Изобретение относится к медицине и найдет применение в урологии при лечении доброкачественной гиперплазии предстательной железы.
Доброкачественная гиперплазия простаты (ДГП) - заболевание, морфологическим субстратом которого является разрастание ткани предстательной железы, вызывающее инфравезикальную обструкцию. ДГП является довольно распространенной патологией, особенно у мужчин среднего и старческого возраста, и проявляется в затрудненном, учащенном мочеиспускании, ночной поллакиурией и т.д.
Основным видом лечения этого заболевания является открытая черезпузырная и позадилонная аденомэктомия, малоинвазивные трансуретральные вмешательства такие, как трансуретральная резекция предстательной железы (ТУРП), электровапоризация простаты (ТУВП), визуальная лазерная абляция простаты (ВЛАП) и др. , различные виды неинвазивного термовоздействия на доброкачественную гиперплазию простаты, медикаментозное лечение и др.
Проведенными исследованиями по патентной и научно-медицинской литературе выявлен ряд способов и устройств для лечения заболеваний предстательной железы. Так, А. С. N 1091396, МПК A 61 N 5/06, Б.И. 36, 1985 г. защищен "Способ лечения хронического неспецифического простатита", предусматривающий воздействие на предстательную железу непрерывным монохроматическим излучением лазера.
А.С. N 1364326, МПК A 61 B 17/36, Б.И. 11, 1988 г. защищен "Способ лечения хронического простатита", предусматривающий проведение очаговой деструкции тканей между предстательной железой и прямой кишкой.
А. С. N1397042, МПК A 61 N 1/18, 1988 г. защищен "Способ профилактики тромбогеморрагических осложнений после аденомэктомии" путем трансректального воздействия на предстательную железу диадинамическим током частотой 50-100 Гц., силой тока 4-25 мА.
А. С. N 1397042, МПК A 61 N 1/20, Б.И. N 19, 1988 г. защищен "Способ лечения простатита", предусматривающий внутриуретральное введение лекарственной смеси и воздействие диадинамическим током.
Патентом Р. Ф. N 2045297, МПК A 61 N 5/06, Б.И. N 28, 1995 г. защищено "Устройство для физиотерапевтического лечения предстательной железы", предусматривающее воздействие ультрасонотерапией.
Патентом РФ N 2046608, МПК A 61 N 1/30, Б.И. N 30, 1995г. защищено "Устройство для лечения хронического простатита" путем воздействия токами низкой частоты.
Патентом США N 5312392, МПК A 61 B 17/36 защищен "Способ лазерной коагуляции предстательной железы". Современные достижения научно-технического прогресса позволили широко применять в урологии, в частности при лечении ДГП, различные малоинвазивные вмешательства, такие как ТУРП, ТУВП и др. Использование этих методик позволяет уменьшить травматичность вмешательства, значительно облегчить течение послеоперационного периода, снизить уровень послеоперационных осложнений.
Из малоинвазивных вмешательств, используемых при лечении ДГП, урологи имеют наибольший опыт использования трансуретральной резекции простаты, история этой операции насчитывает около 50 лет. За этот период ТУРП стала "золотым стандартом" в лечении ДГП и эффективность метода достигает 85-90% (Michele Gallucci, Paolo Puppo, Psquale Fortunato et all, 1996). Однако, несмотря на всеобщее признание метода, остается высоким процент послеоперационных осложнений, который составляет в среднем 18-20%, наиболее частые из них операционные кровотечения, интенсивность которых составляет в среднем 10 мл на 1 г удаленной железы, и при резекции опухоли больших размеров объем кровопотери становится значительным, ТУР - синдром, ретроградная эякуляция, недержание мочи, импотенция.
Техника трансуретральной резекции простаты детально описана во многих медицинских руководствах, выпущенных в России; так, подробное описание методики имеется в монографии А.М. Няньковского "Электрорезекция при опухолях предстательной железы", М., 1972, - вмешательство выполняют в условиях операционной, больного укладывают на спину с разведенными и согнутыми под прямым углом ногами, в мочевой пузырь вводится тубус цистоскопа с введенным в него мандреном, после чего мандрен извлекают и в тубус вводят резектоскоп с оптикой и режущей электропетлей. Для успешной трансуретральной резекции необходима хорошая видимость операционного поля, что достигается путем постоянного притока в мочевой пузырь промывной жидкости, последняя создает прозрачную среду вокруг режущей петли и оптической системы резектоскопа. После введения резектоскопа проводят цистоскопию, выбирают место электрорезекции и заводят за него электропетлю, при этом подлежащая резекции ткань находится между петлей и оптической системой резектоскопа. Нажимая на педаль электрохирургического блока, проводят тракцию петли на себя, срезают ткань интравезикальных отделов предстательной железы от шейки мочевого пузыря до семенного бугорка с использованием эффекта электрорезания и коагуляции. Резецируют среднюю и боковые доли предстательной железы до ее хирургической капсулы, после чего проводят гемостаз электрокоагуляцией и вымывают резецированные фрагменты ткани предстательной железы через резектоскоп.
Одним из методов, создавшим серьезную альтернативу ТУРП, является трансуретральная вапоризация предстательной железы, принципиальным отличием которой от ТУРП является использование вместо резекционной петли специального вапоротрода (Vapor Trode), позволяющего проводить высушивания ткани благодаря особой формы коагулирующей поверхности инструмента, представляющей собой бороздчатый роликовый монополярный электрод, поверхность которого создает условия для высокой плотности тока и высокой температуры в зоне контакта с тканью, что ведет к мгновенному испарению внутриклеточной жидкости, разрыву клеток и образованию коагуляционного струпа.
Подробное описание техники электровапоризации простаты встречается в издании Uro Trends a newsletter on emerging issues in urology. Spring 1996, Vol. 1, N 1, "Transurethral Electrovaporization of the prostate." В мочевой пузырь вводится резектоскоп с вапоротродом, начинают процесс вапоризации с воздействия на среднюю долю предстательной железы, продвигая электрод от шейки мочевого пузыря до семенного бугорка, и заканчивают вапоризацией боковых долей, двигаясь по часовой стрелке в позициях от 1 до 5 часов и затем против часовой стрелки в позициях от 11 до 7 часов, процесс вапоризации продолжают до тех пор, пока не образуется полость в простатическом отделе уретры.
При продвижении вапоротрода по ткани предстательной железы со скоростью 1-4 мм/с и давлении на ткань в 20 г глубина вапоризации составляет 3-4 мм, а зона коагуляции 1-3 мм. При увеличении давления вапоротродом на ткань предстательной железы глубина вапоризации увеличивается незначительно в связи с тем, что образующийся на поверхности струп обладает высоким электросопротивлением и не позволяет добиться необходимого для вапоризации термоэффекта в глубоколежащих тканях. Эта особенность не позволяет проводить вапоризацию ДГП большой массы.
ТУВП по сравнению с ТУРП имеет ряд преимуществ таких, как отсутствие кровопотери, уменьшение опасности развития ТУР-синдрома, при ТУВП уменьшается риск перфорации мочевого пузыря, послеоперационного кровотечения, повреждения наружного сфинктера уретры, то есть данный метод является менее травматичным вмешательством, однако ТУВП по сравнению с ТУРП имеет и ряд недостатков - после ТУВП более выражены явления дизурии в послеоперационном периоде за счет большего термоэлектровоздействия на ткань предстательной железы; метод не показан больным с большими размерами ДГП; ТУВП является менее радикальным вмешательством, продолжительность операции по сравнению с ТУРП возрастает. M.S. Nathan, J.E. Wickham, В. Davies, 1996.
Объединила в себе положительные стороны ТУРП и ТУВП методика "слоеного пирога". Этот способ описан в статье А.А. Камалова и С.В. Разумова "Puff cake" method for treatment of BPH with big volumes", опубликованной в "Журнале эндоурологии" 14-го всемирного конгресса по эндурологии, проходившего в ноябре 1996 года в Мельбурне, Австралии. Способ осуществляется следующим образом: в мочевой пузырь вводится резектоскоп, операция начинается с элетктровапоризации предстательной железы и продолжается до тех пор, пока на поверхности предстательной железы не образуется коагуляционный струп, который затем бескровно срезают петлей, как при трансуретральной резекции (ТУР). Данный способ взят в качестве прототипа настоящего изобретения. Он имеет ряд преимуществ перед отдельно взятыми методиками ТУРП и ТУВП - значительно уменьшается кровопотеря, так как этап ТУР коагуляционного струпа выполняется бескровно, уменьшается продолжительность операции и общее термовоздействие на ткань предстательной железы, что снижает явления дизурии в послеоперационном периоде, создаются условия для проведения операции у больных с значительными размерами ДГП. Однако описываемый способ также имеет недостатки, связанные с тем, что при проведении первого этапа операции - ТУВП трудно визуально оценить глубину и полноту коагуляции тканей после вапоризации предстательной железы, что при проведении этапа ТУР может в местах недостаточно глубокой вапоризации вызвать сильное кровотечение, плохо поддающееся гемостазу, из-за перефокальной гиперемии тканей, вызванной предыдущим электровоздействием. В связи с неоправданно длительным этапом ТУВП (полноту и глубину вапоризации трудно оценить визуально), у больных после вышеописанной методики в послеоперационном периоде так же, как и после обычной ТУВП, могут развиться явления выраженной дизурии.
Это определило цель настоящего изобретения - разработку способа хирургического лечения ДГП, основанного на методах трансуретральной резекции и вапоризации предстательной железы, позволяющего уменьшить травматичность и продолжительность операции, провести операцию бескровно, сократить сроки послеоперационной дизурии. Эта цель достигается путем использования для определения глубины и полноты ТУВП двойного - цистоскопического и ультразвукового контроля, что позволяет переходить к вапоризации следующего участка ткани предстательной железы сразу после появления на сонограмме эхопозитивного участка в зоне электровоздействия, что значительно сокращает время вапоризации. Убедившись в появлении на сонограмме гомогенного и равномерного по глубине эхопозитивного изменения ткани предстательной железы, подлежащей резекции, переходят к ТУР коагуляционного струпа. При этом за счет использования ультразвукового контроля этап электровапоризации проходит быстрее и достигается равномерная глубина коагуляции тканей, вследствие чего ТУР проходит бескровно. При больших размерах ДГП ТУВП и ТУР повторяют до резекции тканей в необходимом объеме.
Способ осуществляется следующим образом: в условиях операционной больного укладывают на спину с разведенными и согнутыми под прямым углом ногами, в мочевой пузырь вводится тубус цистоскопа размером N 22-26 по Шарьеру с введенным в него мандреном, после чего мандрен извлекают и в тубус вводят резектоскоп с оптикой и вапоротродом, а в прямую кишку через анальное отверстие вводят ультразвуковой датчик (частотой 7.5 мГц), на глубину 5-6 см для получения поперечного ультразвукового среза предстательной железы, наполняют пузырь промывным раствором, выбирают зону вапоризации под цистоскопическим и ультразвуковым контролем. На фотографии 1 представлена сонограмма предстательной железы, полученная при ректальной сонографии до проведения вапоризации. Вапоризацию начинают со скоростью продвижения вапоротрода 4 мм/с, вапоризируют среднюю долю предстательной железы, продвигая электрод от шейки мочевого пузыря до семенного бугорка и заканчивая вапоризацией боковых долей, двигаясь по часовой стрелке в позициях от 1 до 5 часов и затем против часовой стрелки в позициях от 11 до 7 часов, переходя от одного участка к другому, сразу после появления на сонограмме участка эхоплотной ткани глубиной 6-7 мм. На фотографии 2 представлена сонограмма после вапоризации средней внутрипузырной доли предстательной железы, на сонограмме виден эхоплотный участок тканей в зоне электровапоризации. После равномерной вапоризации ДГП по всей окружности простатического отдела уретры, о чем свидетельствует появление гомогенного, равномерного по глубине, округлой формы эхопозитивного участка тканей на сонограмме, представленной на фотографии 3, резектоскоп извлекают, вапоротрод заменяют петлей и проводят ТУР образовавшегося струпа, при больших размерах железы ТУВП и ТУР повторяют, заканчивают операцию промыванием мочевого пузыря от резецированных тканей и установкой трехходового катетера в мочевой пузырь.
Иллюстрируют метод следующие примеры.
Пример 1. Больной А. 62 лет, история болезни N 701437 поступил в МЛДЦ "Здоровье" 27.11.96 с диагнозом: доброкачественная гиперплазия простаты. При поступлении предъявлял жалобы на затрудненное, учащенное мочеиспускание вялой струей, ночную поллакиурию до 3 раз, чувство неполного опорожнения мочевого пузыря после мочеиспускания, считает себя больным около 5 лет. Больному проведено комплексное обследование: при ультрасонографии надлобковым и ректальным датчиком выявила преимущественную гиперплазию средней доли простаты, масса простаты 59 г, показатель S 21 баллов, показатель L 6 баллов, объем остаточной мочи 80 мл, средняя объемная скорость мочеиспускания составила 4.8 мл/с. 5.12.96 г. выполнена цистоскопия и сонография ректальным датчиком, сонограмма представлена на фотографии 1. Под цистоскопическим и ультразвуковым контролем провели электровапоризацию средней и латеральных долей до появления на сонограмме гомогенного, равномерного по глубине, эхопозитивного контура по всей окружности простатического отдела уретры, сонограмма после вапоризации представлена на фотографии 3, по завершению вапоризации вапоротрод поменяли на резекционную петлю и выполнили ТУР коагуляционного струпа до неизмененной ткани предстательной железы. При проведении ТУР кровотечение было минимальным, в конце операции был установлен трехходовой уретральный катетер Фолея, установлена промывная система.
Послеоперационный период протекал гладко, уретральный катетер удален на 3-и сутки после операции, явления дизурии были слабо выраженные. Больной обследован через 6 месяцев после операции - показатель S составил 8 баллов, показатель L составил 2 балла, остаточной мочи нет, средняя объемная скорость мочеиспускания составила 12.3 мл/с.
Пример 2. Больной В. 66 лет, история болезни N 701495 поступил в МЛДЦ "Здоровье" 15.12.96 г. с диагнозом: доброкачественная гиперплазия простаты. При поступлении предъявлял жалобы на затрудненное, учащенное мочеиспускание вялой струей, ночную поллакиурию до 2-3 раз, чувство неполного опорожнения мочевого пузыря после мочеиспускания, считает себя больным около двух лет. Больному проведено комплексное обследование: при ультрасонографии надлобковым и ректальным датчиком выявила преимущественную гиперплазию средней доли простаты, масса простаты 48 г, показатель S 14 баллов, показатель L 6 баллов, объем остаточной мочи 65 мл, средняя объемная скорость мочеиспускания составила 5.6 мл/с. 23.12.96 г. выполнена цистоскопия и сонография ректальным датчиком, сонограмма представлена на фотографии 4. Под цистоскопическим и ультразвуковым контролем провели электровапоризацию средней и латеральных долей до появления на сонограмме гомогенного, равномерного по глубине, эхопозитивного контура по всей окружности простатического отдела уретры, сонограмма после вапоризации представлена на фотографии 5, по завершению вапоризации вапоротрод поменяли на резекционную петлю и выполнили ТУР коагуляционного струпа до неизмененной ткани предстательной железы. При проведении ТУР кровотечение было минимальным, в конце операции был установлен трехходовой уретральный катетер Фолея, установлена промывная система.
Послеоперационный период протекал гладко, уретральный катетер удален на 2-е сутки после операции, явления дизурии были слабо выраженные. Больной обследован через 5 месяцев после операции - показатель S составил 6 баллов, показатель L 2 балла, остаточной мочи нет, средняя объемная скорость мочеиспускания составила 14.1 мл/с.
Предлагаемый метод обладает достоинствами и лишен недостатков ТУРП и ТУВП, а также позволяет объективно, в отличии от метода "слоеного пирога" - сочетания методики ТУРП и ТУВП, на основании сонографического исследование определить показания для перехода с вапоризации на трансуретральную резекцию ДГП, избежать кровопотери во время операции, снизить ее продолжительность и травматичность, уменьшить термовоздействие на ткани предстательной железы и явления дизурии в послеоперационном периоде, снизить количество рецидивов заболевания.
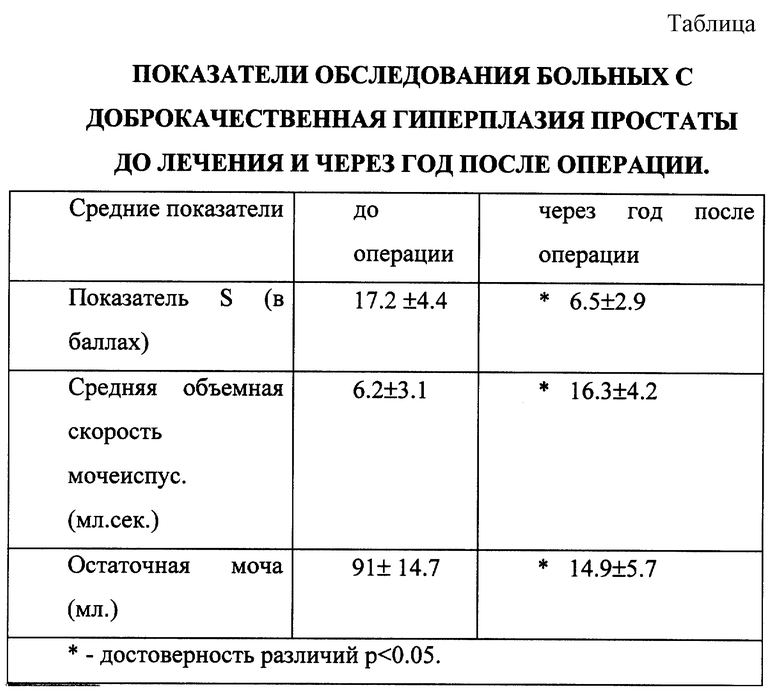
Метод апробирован у 17 больных с ДГПЖ, находившихся на лечении в Лечебно-диагностическом центре "Здоровье" около года. Данные обследования до операции и через год после лечения представлены в таблице.
Как видно из таблицы, результаты лечения больных ДГПЖ с использованием предлагаемого способа можно признать удовлетворительными.




Изобретение относится к медицине, урологии, может быть использовано при лечении доброкачественной гиперплазии предстательной железы. Выполняют комбинированную трансуретральную электровапоризацию и трансуретральную резекцию аденомы предстательной железы. При этом вводят в прямую кишку ультразвуковой датчик на глубину 5 см. Получают поперечный ультразвуковой срез предстательной железы. Выполняют вапоризацию, начиная со средней доли аденомы предстательной железы. Заканчивают вапоризацией боковых долей. Переходят от одного участка к другому до появления на сонограмме по всей вапоризированной поверхности участка глубиной 6 мм. Затем переходят к трансуретральной резекции образовавшегося струпа. Способ позволяет уменьшить травматичность операции. 1 табл., 5 ил.
Способ лечения доброкачественной гиперплазии предстательной железы, предусматривающий комбинированную трансуретральную электровапоризацию и трансуретральную резекцию аденомы предстательной железы, отличающийся тем, что после введения в мочевой пузырь резектоскопа с вапоротродом в прямую кишку вводят ультразвуковой датчик на глубину 5 см и получают поперечный ультразвуковой срез предстательной железы, наполняют пузырь промывным раствором, выбирают зону вапоризации под цистоскопическим и ультразвуковым контролем, начинают вапоризацию со средней доли аденомы предстательной железы, продвигают электрод от шейки мочевого пузыря до семенного бугорка и заканчивают вапоризацией боковых долей, переходя от одного участка к другому до появления на сонограмме по всей вапоризированной поверхности участка эхоплотной ткани глубиной 6 мм, до появления округлого гомогенного, равномерного по глубине эхопозитивного контура на сонограмме, переходят к трансуретральной резекции образовавшегося струпа.
| Способ чреспузырной аденомэктомии | 1985 |
|
SU1333313A1 |
| Способ аденомэктомии | 1976 |
|
SU632349A1 |
Авторы
Даты
2001-04-20—Публикация
1997-07-29—Подача