Изобретение относится к новым производным полициклических гетероциклических соединений, способу их получения.
Трициклическое соединение амонафид [5-амино-2-[2-(диметиламино)этил]-1H-бенз[de] изохинолин-1,3-(2H)-дион] является наиболее известным конденсированным полициклическим гетероциклическим противоопухолевым соединением, имеющим в его молекуле циклическую имидо-часть 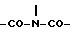 Однако сообщалось, что амонафид обнаруживал сильную токсичность в отношении костного мозга и низкую эффективность в клинических тестах, проводимых до сих пор [Drugs Fut. , 17, 832 (1992)]. В качестве тетрациклического соединения был описан азонафид [2-[2'- (диметиламино)этил] -1,2-дигидро-3H-дибенз(deh)изохинолин - 1,3-дион] , полученный превращением аминонафталиновой части амонафида в антрацен для усиления посредством этого противоопухолевой активности в преклинических тестах (WO9200281).
Однако сообщалось, что амонафид обнаруживал сильную токсичность в отношении костного мозга и низкую эффективность в клинических тестах, проводимых до сих пор [Drugs Fut. , 17, 832 (1992)]. В качестве тетрациклического соединения был описан азонафид [2-[2'- (диметиламино)этил] -1,2-дигидро-3H-дибенз(deh)изохинолин - 1,3-дион] , полученный превращением аминонафталиновой части амонафида в антрацен для усиления посредством этого противоопухолевой активности в преклинических тестах (WO9200281).
В качестве конденсированных, тетрациклических гетероциклических противоопухолевых веществ, имеющих в молекуле структуру урацила, в циклическую имидо-часть которых был введен атом азота, были известны 2-[2-(диметиламино)этил] пиримидо[5,6,1-de]акридин- 1,3,7-трион [Farmaco, 47 1035 (1992)] и 2,3-дигидро-2-[2- (диметиламино)этил]-1H,7H-нафтилидино[3,2,1-ij] -хиназолин-1,3,7 (2H)-трион [J. Med. Chem., 37, 593 (1994)]. Однако каждое из этих соединений обнаружило лишь слабую противоопухолевую активность в преклинических тестах. Не было сообщений ни о пентациклических, ни о гексациклических конденсированных гетероциклических противоопухолевых веществах этого типа.
Данное изобретение имеет своей целью обеспечение новых соединений или новых производных конденсированных пентациклических и гексациклических гетероциклических соединений, обладающих низкой токсичностью и высокой противоопухолевой активностью. Целью данного изобретения является также обеспечение способа получения этих соединений и лекарственных композиций, содержащих эти соединения в качестве активного ингредиента.
Описание изобретения
Для достижения вышеуказанных целей авторы изобретения провели интенсивные исследования для разработки высокоэффективных противоопухолевых веществ. В результате им удалось обнаружить, что новые конденсированные пентациклические и гексациклические гетероциклические соединения, имеющие урацильную структуру в их молекуле, обладают высокой противоопухолевой активностью и низкой токсичностью, что является завершением данного изобретения.
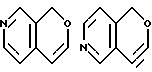
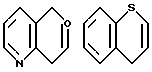
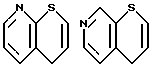
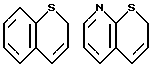
Таким образом, данное изобретение относится к соединению, представленному следующей общей формулой (I), или его фармацевтически приемлемой соли: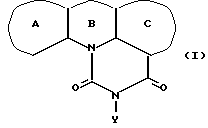
где кольцо A обозначает необязательно замещенное моноциклическое ароматическое кольцо или дициклическое конденсированное кольцо, в котором по меньшей мере одно из колец является ароматическим кольцом; кольцо В обозначает пиррол, 4H-1,4-оксазин, 4H-1,4-тиазин или 4(1H)-пиридон; кольцо C обозначает необязательно замещенное, моноциклическое или дициклическое конденсированное ароматическое кольцо; и Y обозначает группу, представленную формулой-e-f (где e обозначает низший алкилен и f обозначает амидино, гуанидино или амино, необязательно замещенные необязательно гидроксилированным или необязательно низшим алкиламинированным низшим алкилом;
при условии, что исключены случаи, когда кольца A и B оба представляют собой необязательно замещенные моноциклическое ароматическое кольцо.
Далее, данное изобретение относится к лекарственной композиции, содержащей конденсированное полициклическое гетероциклическое соединение в виде описанного выше производного в фармакологически эффективной дозе или его фармакологически приемлемые соли и фармакологически приемлемые носители.
Далее, данное изобретение относится к способу предотвращения или лечения опухолей путем введения пациенту производного конденсированного полициклического гетероциклического соединения, описанного выше, в фармакологически эффективной дозе.
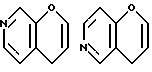
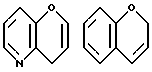
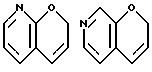
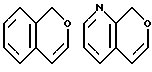
В определении кольца A в приведенной выше формуле (I) термин "моноциклическое ароматическое кольцо" обозначает ароматическое 5- или 6-членное кольцо, необязательно содержащее по меньшей мере один атом кислорода или серы. Термин "дициклическое конденсированное кольцо, где по меньшей мере одно из колец является ароматическим кольцом", означает дициклическое конденсированное кольцо, в котором каждое из колец является 5- - 8-членным кольцом, необязательно содержащим по меньшей мере один атом азота, кислорода или серы, и по меньшей мере одно из колец является ароматическим кольцом. Может быть один - три заместителя на этих кольцах.
Примеры кольца A включают бензол, пиридин, пиразин, пиримидин, пиридазин, фуран, тиофен, пиррол, тиазол и другие дициклические конденсированные структуры, которые могут быть частично гидирированными и окисленными при атоме серы, если он в них содержится. Эти кольца могут быть конденсированны с кольцом В при произвольном допускаемом химически положении.





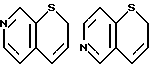
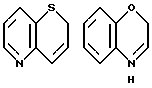
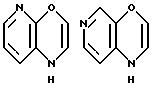
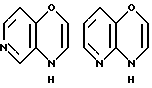

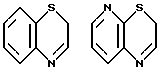
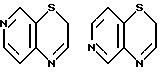
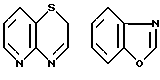
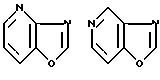
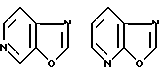
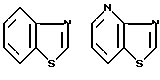

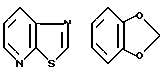


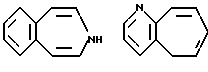
Каждое из приведенных выше колец может иметь 1 - 3 заместителя. В случае двух или более заместителей, эти заместители могут быть одинаковыми или различными. Примеры заместителей включают гидрокси, оксо, циано, галоген, нитро, необязательно гидроксилированный или низший алкиламинированный низший алкил, низший алкокси, низший ацил, необязательно низший - алкилированный карбамоил и необязательно низший - алкилированный, низший - ацилированный, арилсульфонилированный или низший - алкилсульфонилированный амино.
Термин "моноциклическое или дициклическое конденсированное ароматическое кольцо", используемый в определении кольца C, обозначает моноциклический или дициклический ароматический углеводород или ароматический гетероцикл, содержащий один или два атома азота. Может содержать 1 - 3 заместителя на кольце (кольцах).
Примеры кольца C включают бензол, пиридин, пиримидин, нафталин, хинолин, изохинодин, индол и хиназолин. Эти кольца могут быть конденсированы с кольцом B при произвольном химически допускаемом положении.
Каждое из вышеупомянутых колец может иметь 1 - 3 заместителя. В случае двух или более заместителей, эти заместители могут быть одинаковыми или различными. Примеры заместителей включают галоген, гидрокси, низший алкил, низший алкокси, нитро и необязательно низший - алкилированный или низший - ацилированный амино.
Термин "низшая алкильная группа", используемый в определении заместителей колец A и C и в определении Y в приведенной выше общей формуле (I), обозначает линейную или разветвленную C1-6-алкильную группу. Примеры ее включают группы метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил (амил), изопентил, неопентил, трет-пентил, 1-метилбутил, 2-метилбутил, 1,2-диметилпропил, н-гексил, изогексил, 1-метилпентил, 2-метилпентил, 3-метилпентил, 1,1-диметилбутил, 1,2-диметилбутил, 2,2-диметилбутил, 1,3-диметилбутил, 2,3-диметилбутил, 3,3-диметилбутил, 1-этилбутил, 2-этилбутил, 1,1,2-триметилпропил, 1,2,2-триметилпропил, 1-этил-1-метилпропил и 1-этил-2-метил-пропил. Среди этих групп метил, этил, н-пропил и изопропил являются предпочтительными, причем наиболее желательными из всех являются группы метил и этил.
Термин "низший алкилен", используемый в определении e в Y, обозначает остаток, полученный исключением одного атома водорода из низшей алкильной группы, описанной выше. В случае замещения аминогруппы двумя низший - алкильными группами в определении заместителей, необязательно находящихся на кольцах A и C, и f в Y, эти алкильные группы могут быть связаны вместе с образованием 5- или 6-членного кольца.
Группа низший алкокси в определении заместителей, необязательно находящихся на кольцах A и C, обозначает группы, произведенные из вышеупомянутых низший - алкильных групп, такие как метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси и трет-бутокси. Среди этих низший - алкоксигрупп наиболее предпочтительными являются метокси и этоксигруппы. Примерами атома галогена являются фтор, хлор и бром.
Примеры низшей ацильной группы включают группы, имеющие 1-6 атомов углерода, такие как формил, ацетил, пропионил, бутирил, изобутирил и валерил.
Термин "арилсульфонилированный или низший -алкилсульфонилированный амино", используемый в определении заместителя, необязательно находящегося на кольце A, обозначает, например, аминогруппу, необязательно п-толуолсульфонилированную, метилсульфонилированную или этилсульфонилированную.
Производные конденсированных полициклических гетероциклических соединений, представленные выше формулой (I), иногда образуют соли с кислотами. Соли этих соединений (I) также включены в объем данного изобретения. Примеры солей с кислотами включают соли неорганических кислот, такие как гидрохлорид, гидробромид, сульфат и т.д., и соли органических кислот, такие как ацетат, лактат, сукцинат, фумарат, малеат, цитрат, бензоат, метансульфонат, п-толуолсульфонат и т.д.
Не говоря уже о том, что данное изобретение включает в себя также гидраты этих соединений и их оптические изомеры, если они имеются. Хотя соединение данного изобретения обнаруживают сильную противоопухолевую активность, соединения, которые обнаруживают противоопухолевую активность при их метаболизации, например, окисленные, восстановленные, гидролизованные или конъюгированные in vivo, также включены в данное изобретение. Кроме того, данное изобретение включает в себя соединения, способные образовать соединения данного изобретения при их метаболизации, например, при окислении, восстановлении или гидролизе in vivo.
Соединения (I) данного изобретения могут быть получены различными способами. Далее будут описаны типичные примеры таких способов получения.
1) Соединение общей формулы (I) может быть получено взаимодействием соединения, представленного следующей общей формулой (II):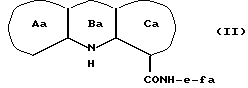
где кольца Aa и Ca соответственно обозначают необязательно защищенные кольца A и C; кольцо Ba обозначает 4H-1,4-оксазин, 4H-1,4-тиазин, 4(1H)-пиридон или пиррол; fa обозначает необязательно защищенный f; и e имеет указанные выше значения, с соединением, представленным следующей общей формулой (III):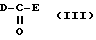
где D и E одинаковы или различны и каждый из них обозначает удаляемую группу.
Эту реакцию обычно выполняют растворением соединения (II) в апротонном растворителе, таком как диметилформамид, тетрагидрофуран или диоксан, добавлением 2-3 эквивалентов гидрида натрия и затем добавлением соединения (III).
Примеры соединения (III) включают фосген, этилхлоркарбонат и N,N'-карбонилдиимидазол. Эту реакцию проводят обычно в диапазоне температур от -50oC до 150oC.
Когда полученный таким образом продукт защищен при амино- или гидроксильной группе и т.д., защитные группы могут быть удалены общепринятым способом, таким как обработка кислотой или щелочью или каталитическим восстановлением, с получением в результате целевого соединения (I).
2) Соединение (I) может быть получено взаимодействием соединения, представленного общей формулой (IV):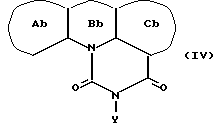
где кольцо Ab обозначает дициклическое конденсированное кольцо, где по меньшей мере одно из колец является ароматическим кольцом и которое имеет низший ацил или оксогруппу, необязательно вместе с необязательно защищенным заместителем (заместителями); кольцо Bb обозначает пиррол, 4H-1,4-оксазин или 4H-1,4-тиазин; кольцо Cb обозначает моноциклическое ароматическое кольцо, необязательно имеющее защищенный заместитель (заместители); и Y имеет указанные выше значения, с карбонил-восстанавливающим агентом.
Восстановление может быть осуществлено при помощи способа, обычно используемого для восстановления карбонильных групп. Предпочтительные примеры такого способа включают каталитическое восстановление с применением катализатора, такого как палладий на угле, и восстановление боран/пиридиновым комплексом или борциано-гидридом натрия.
Далее будет описан способ получения исходных соединений (II), используемых в данном изобретении. Исходные соединения (II) включают известные соединения и новые соединения. Новые соединения могут быть получены с применением или комбинированием способов синтеза известных соединений, которые уже были сообщены в литературе.
Способ получения 1 представлен в конце описания
Соединения, представленные общей формулой (IX), могут быть получены с использованием, например, способа Фишера для синтеза индола и способа Борше для синтеза тетрагидрокарбазола [Org. Syn. IV, 884 (1963]. А именно, его можно получить нагреванием циклического кетона, представленного формулой (VII), и о-гидразиноароматической карбоновой кислоты в уксусной кислоте или в нейтральном растворителе, таком как этанол, в присутствии кислотного катализатора, такого как хлористоводородная кислота, серная кислота или хлорид цинка. В случае, когда кольцо Ас в соединении (IX) представляет собой необязательно замещенную дициклическую конденсированную структуру, в которой одно из колец является ароматическим кольцом, оно может быть конденсировано с соединением, представленным общей формулой (VI), с получением в результате целевого соединения (IIa). Соединение (Х) может быть получено частичным или полным дегидрированием неароматического кольца в соединении (IX) дегидрирующим агентом. В качестве дегидрирующего агента можно использовать, например, 2,3-дихлор-5,6-дициано-1,4-бензохинон, хлоранил или палладий на угле. Реакцию обычно проводят при комнатной температуре или при нагревании. Если кольцо Ac является дициклической конденсированной структурой, в которой оба кольца являются неароматическими кольцами, можно также избирательно дегидрировать одно из этих колец путем соответствующего подбора типа и количества реагента, условий реакции и т.д. Целевое соединение (IIa) можно получить конденсацией полученного таким образом соединения (X) с соединением (VI). Конденсацию можно проводить, например, согласно кислотному хлоридному способу, способу с активным сложным эфиром или способу со смешанными ангидридами карбоновых кислот, или с использованием конденсирующих агентов, таких как 1,3-дициклогексилкарбодиимид, N, N'-карбонилдиимидазол или дифенилфосфорилазид.
Способ получения 2 представлен в конце описания.
Соединение, представленное общей формулой (XIII), может быть получено взаимодействием соединения общей формулы (XI) с соединением общей формулы (XII). Предпочтительными примерами уходящих групп K и L в соединении (XII) являются, соответственно, нитрогруппа и галоген. Реакцию можно проводить путем нагревания этих соединений, необязательно в присутствии основания, такого как триэтиламин, ацетат натрия или гидроксид натрия. Целевое соединение (IIb) может быть получено гидролизом сложного эфира соединения (XIII) щелочью до соединения (XIV) с последующей конденсацией этого соединения с образованием соединения (VI) согласно способу, описанному в способе получения (I).
При использовании соединения данного изобретения в качестве лекарственного средства его можно вводить перорально или парентерально. Хотя доза не является специально ограниченной и изменяется в зависимости от тяжести симптома, возраста, пола, веса тела и чувствительности пациента, способа, времени и интервалов введения, свойств, типа и конкретных активных ингредиентов лекарственного препарата и т.д., обычно его можно вводить взрослому пациенту в суточной дозе от 1 до 3000 мг, предпочтительно от 10 до 2000 мг, и еще предпочтительнее от 20 до 1000 мг в виде 1-3 порций в день.
Для приготовления твердого препарата для перорального введения активный агент смешивают с наполнителями и, если необходимо, со связующими веществами, дезинтегрирующими агентами, смачивающими веществами, красителями, корригентами (улучшающими вкус и запах веществами) и т.д. и полученную смесь формуют в таблетки, таблетки с покрытиями, гранулы, мелкоизмельченные частицы, порошки, капсулы и т. д. общепринятыми способами.
В качестве наполнителей можно использовать, например, лактозу, кукурузный крахмал, сахарозу, глюкозу, сорбит, кристаллическую целлюлозу и диоксид кремния. В качестве связующих веществ можно использовать, например, поливиниловый спирт, этилцеллюлозу, метилцеллюлозу, аравийскую камедь, гидроксипропилцеллюлозу и гидроксипропилметилцеллюлозу. В качестве смазывающих средств можно использовать, например, стеарат магния, тальк и диоксид кремния. В качестве красителей можно использовать фармацевтически приемлемые красители. В качестве корригентов можно использовать, например, какао-порошок, ароматические кислоты, эвкалиптовое масло, камфару Борнео и измельченную в порошок кору коричневого дерева, не говоря уже о том, что эти таблетки или гранулы могут быть покрыты, если необходимо, сахаром, желатином и т. д.
Для приготовления инъекционных форм активный ингредиент смешивают, если необходимо, с регулирующими pH агентами, буферами, суспендирующими агентами, солюбилизирующими агентами, стабилизаторами, изотонирующими агентами, консервантами и т.д. и из полученной смеси готовят внутривенные, подкожные или внутримышечные инъекционные растворы общепринятыми способами. Затем эти препараты могут быть лиофилизированы общепринятым образом, если это необходимо.
В качестве суспендирующих агентов можно использовать, например, метилцеллюлозу, Полисорбат 80, гидроксиэтилцеллюлозу, аравийскую камедь, порошкообразный трагакант, карбоксиметилцеллюзу натрия и монолаурат полиоксиэтиленсорбита.
В качестве солюбилизирующих агентов можно использовать, например, отверждаемое полиоксиэтиленом касторовое масло, Полисорбат 80, никотинамид, монолаурат полиоксиэтиленсорбита, макрогол и этиловые эфиры жирных кислот касторового масла.
В качестве стабилизаторов можно использовать, например, сульфит натрия и метасульфит натрия. В качестве консервантов можно использовать, например, метилпарагидроксибензоат, этилпарагидроксибензоат, сорбиновую кислоту, фенол, крезол и хлоркрезол.
Далее будут даны фармакологические экспериментальные примеры для иллюстрации действия соединений данного изобретения.
Экспериментальный пример 1
Противоопухолевый тест in vitro на клетках P388 (лейкозных клетках мышей)
Клетки P388, суспендированные в среде RPMI1640 (производимой Sanko Junyaku), содержащей 10% фетальную телячью сыворотку, пенициллин (100 E/мл), стрептомицин (100 мкг/мл), 5•10-5 М меркаптоэтанол и 1 мМ пируват натрия, пипетировали в 96-луночный с U-дном микропланшет при отношении 1,25•103 клеток (0,1 мл) на лунку и инкубировали в термостате, содержащем 5% диоксид углерода, при 37oC в течение одного дня.
Соединение данного изобретения растворяли в диметилсульфоксиде с получением концентрации 10-2 М и затем разбавляли содержащей 10% фетальную телячью сыворотку культуральной средой RPMI1640 с получением концентрации 10-4 или 10-5 М. Принимая эту концентрацию в качестве максимального уровня, выполняли трехкратное серийное разведение культуральной средой RPMI1640, содержащей 10% фетальную телячью сыворотку. Затем полученные разведения добавляли в инкубационный планшет с P388, описанный выше, при отношении 0,1 мл на лунку с последующим инкубированием в термостате, содержащем 5% диоксид углерода, при 37oC в течение 3 дней.
После завершения инкубирования добавляли 0,05 мл на лунку раствора 3,3 мг/мл МТТ [бромида 3-(4,5-диметилтиазол-2-ил)-2,5- дифенилтетразолия] и инкубирование продолжали еще в течение 2 часов. Микропланшет центрифугировали и супернатант отсасывали из каждой лунки. Затем образовавшийся таким образом формазан растворяли в 0,1 мл диметилсульфоксида и его поглощение, измеренное при 540 нм микропланшет-ридером, брали как показатель числа жизнеспособных клеток. В соответствии со следующей формулой рассчитывали коэффициент ингибирования и определяли дающую 50% ингибирование концентрацию (IC50) тестируемого соединения: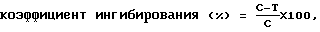
где T обозначает поглощение лунки, содержащей тест-соединение, и C обозначает поглощение лунки, несодержащей тест-соединения.
Таблица 1 суммирует полученные таким образом данные IC50.
Экспериментальный пример 2
Противоопухолевый тест in vivo на M5076 (ретикулоклеточный саркоме мышей)
Клетки M5076 (1•106 клеток на животное) подкожно трансплантировали в боковую часть каждой мыши BDF1 (самки в возрасте 6 - 7 недель). Соединение данного изобретения растворяли в 5%-ном растворе глюкозы. Со следующего дня после трансплантации раствор соединения вводили внутрибрюшинно животным один раз в день в соответствии с каждой схемой введения. С другой стороны, контрольной группе вводили 5%-ный раствор глюкозы. Контрольная группа состояла из 10 животных, тогда как каждая тест-группа состояла из 5 животных.
На 21-й день после трансплантации опухоли извлекали и взвешивали. Коэффициент ингибирования размножения опухоли в каждой тест-группе относительно контрольной группы определяли в соответствии со следующей формулой: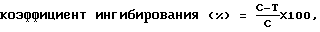
где T обозначает средний вес опухоли тест-группы и C обозначает средний вес опухоли контрольной группы.
Таблица 2 показывает результаты данного эксперимента.
Экспериментальный пример 3
Противоупухолевый тест in vivo на MX-1 (раке молочной железы человека)
Кусочки опухоли MX-1 (приблизительно 1 мм3) подкожно трансплантировали в боковую часть каждой "голой" мыши (BALB/C•nu/nu, самки в возрасте 6 - 7 недель). Соединение данного изобретения растворяли в 5%-ном растворе глюкозы. Когда объем опухоли достигал 50 мм3 (приблизительно на 10-й день после трансплантации), раствор соединения вводили внутрибрюшинно животным один раз в день в соответствии с каждой схемой введения. С другой стороны, контрольной группе вводили 5%-ный раствор глюкозы. Контрольная группа состояла из 10 животных, тогда как каждая тест-группа состояла из 5 животных.
На 22-й день после трансплантации опухоли извлекали и взвешивали. Коэффициент ингибирования размножения опухоли каждой тест-группы относительно контрольной группы определяли в соответствии со следующей формулой: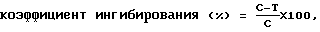
где T обозначает средний вес опухоли тест-группы и C обозначает средний вес опухоли контрольной группы.
Таблица 3 показывает результаты этого эксперимента.
Как ясно показывают эти экспериментальные данные, соединения данного изобретения обладают превосходным противоопухолевым действием и, следовательно, применимы в качестве противоопухолевого средства.
Примеры
Теперь будут представлены Примеры получения, показывающие получение исходных соединений, используемых в данном изобретении, и Примеры, относящиеся к характерным примерам соединений данного изобретения. Однако должно быть понятно, что данное изобретение не ограничивается только этими примерами.
Пример получения 1
5,6-Дигидро-7H-бензо[с]карбазол-8-карбоновая кислота: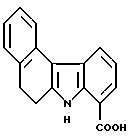
Раствор 5,00 г (34,2 ммоль) β -тетралона в уксусной кислоте (10 мл) добавляли каплями в суспензию 7,05 г (37,4 ммоль) гидрохлорида 2-гидразинобензойной кислоты в уксусной кислоте (40 мл) при 80oC и полученную смесь нагревали с обратным холодильником в течение 3 часов и 45 минут. После возврата к комнатной температуре добавляли воду и образовавшийся таким образом осадок собирали фильтрованием, промывали водой, сушили и перекристаллизовывали из этанола с получением 5,2 г соединения, указанного в названии примера.
1H-ЯМР (ДМСО-d6) δ (м. д.): 2,91 - 3,06 (м, 4H), 7,03 (т, J = 7,6 Гц, 1H), 7,17 (т, J= 7,6 Гц, 1H), 7,20-7,27 (м, 2H), 7,72 (д, J= 7,6 Гц, 1H), 7,76 (д, J=7,6 Гц, 1H), 8,19 (д, J=7,6 Гц, 1H), 11,29 (с, 1H).
Пример получения 2
7H-Бензо [с] карбазол-8-карбоновая кислота: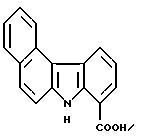
3,29 г (14,3 ммоль) 2,3-дихлор-5,6-дициано-1,4- бензохинона добавляли к суспензии 2,97 г (11,3 ммоль) соединения Примера получения 1 в бензоле (200 мл) при комнатной температуре и полученную смесь перемешивали в течение 50 минут и затем нагревали с обратным холодильником в течение 3 часов и 20 минут. После возврата к комнатной температуре полученный таким образом осадок собирали фильтрованием и перекристаллизовывали из этанола с получением 2,76 г соединения, указанного в названии примера.
1H-ЯМР (ДМСО-d6): δ (м.д.): 7,39 (т, J = 7,3 Гц, 1H), 7,48 (т, J= 7,3 Гц, 1H), 7,70 (т, J=7,3 Гц, 1H), 7,93 (д, J=8,7 Гц, 1H), 8,00-8,07 (м, 3H), 8,79 (д, J=7,3 Гц, 1H), 8,87 (д, J=7,3 Гц, 1H), 11,82 (с, 1H), 13,22 (шир. с, 1H).
Пример получения 3
N-[2-(Диметиламино)этил]-7H-бензо[с]карбазол-8-карбоксамид:
2,52 г (15,5 ммоль) N,N'-карбонилдиимидазола добавляли к раствору 1,89 г (7,25 ммоль) соединения Примера получения 2 в диметилформамиде (60 мл) при комнатной температуре и полученную смесь перемешивали в течение 45 минут. Затем к ней добавляли 5,0 мл (45,5 ммоль) N,N'-диметилэтилендиамина и полученную смесь перемешивали в течение 2 часов и 40 минут. После концентрирования ее экстрагировали добавлением воды и этилацетата. Органический слой собирали, промывали водой, сушили над сульфатом натрия и концентрировали досуха с получением 2,47 г соединения, указанного в названии примера.
1H-ЯМР (ДМСО-d6): δ (м.д.): 2,33 (с, 6H), 2,60 (т, J = 5,7 Гц, 2H), 3,63 (к, J=5,7 Гц, 2H), 7,16 (шир. с, 1H), 7,38 (т, J=7,5 Гц, 1H), 7,46-7,50 (м, 1H), 7,65-7,73 (м, 3H), 7,89 (д, J=9,0 Гц, 1H), 8,01 (д, J=8,2 Гц, 1H), 8,69 (д, J=7,5 Гц, 1H), 8,74 (д, J=8,2 Гц, 1H), 10,94 (шир. с, 1H).
Пример получения 4
3-Ацетил-7H-бензо[с]карбазол-8-карбоновая кислота: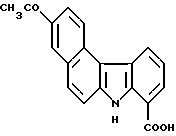
1,17 г (12,4 ммоль) уксусного ангидрида добавляли к суспензии 5,1 г (38 ммоль) хлорида алюминия в дихлорметане (300 мл) при 0oC и полученную смесь перемешивали в течение 20 минут. Затем к ней добавляли 2,16 г (8,28 ммоль) соединения Примера получения 2 и полученную смесь перемешивали при той же температуре в течение 4 часов и 30 минут. Затем реакционную смесь выливали в воду со льдом и экстрагировали смесью хлороформ-этанол. Органический слой собирали и концентрировали. Остаток очищали колоночной хроматографией на силикагеле с получением 1,45 г соединения, указанного в названии примера.
1H-ЯМР (ДМСО-d6): δ (м.д.): 2,72 (с, 3H), 7,44 (т, J = 7,6 Гц, 1H), 8,07 (д, J= 7,6 Гц, 1H), 8,11 (д, J=9,1 Гц, 1H), 8,14 (д, J= 9,1 Гц, 1H), 8,18 (дд, J= 9,8;8 Гц, 1H), 8,79 (д, J=1,9 Гц, 1H), 8,87 (д, J=8,8 Гц, 1H), 8,91 (д, J=7,6 Гц, 1H), 12,01 (с, 1H)
Пример получения 5
3-Ацетил-N-[2-(диметиламино)этил]-7H-бензо[с]карбазол-8-карбоксамид: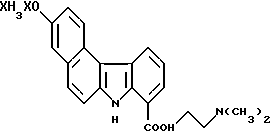
291 мг (1,80 ммоль) N,N'-карбонилдиимидазола добавляли к раствору 247 мг (0,815 ммоль) соединения Примера получения 4 в диметилформамиде (7 мл) при охлаждении льдом. После возврата к комнатной температуре полученную смесь перемешивали в течение приблизительно 2 часов. Затем к ней добавляли 0,45 мл (4,1 ммоль) N, N'-диметилэтилендиамина и реакционную смесь возвращали к комнатной температуре и перемешивали при комнатной температуре в течение приблизительно 12 часов. После экстракции путем добавления воды и хлороформа органический слой собирали, сушили над сульфатом натрия и концентрировали досуха. Затем остаток очищали колоночной хроматографией на силикагеле с получением 140 мг соединения, указанного в названии примера.
1H-ЯМР (ДМСО-d6): δ (м. д.):2,29 (с, 6H), 2,53-2,61 (м, 2H), 2,74 (с, 3H), 3,52 (к, J = 5,9 Гц, 2H), 7,43 (т, J=7,1 Гц, 1H), 7,97 (д, J=7,1 Гц, 1H), 8,10 (д, J=8,7 Гц, 1H), 8,14 (д, J=8,7 Гц, 1H), 8,20 (дд, J=1,8; 8,5 Гц, 1H), 8,72 (т, J=5,9 Гц, 1H), 8,79-8,83 (м, 2H), 8,88 (д, J=8,5 Гц, 1H), 12,17 (с, 1H)
Пример получения 6
3,4,5,8-Тетрагидронафталин-1,6(2H,7H)-дион: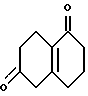
6,8 г (38,2 ммоль) 1,2,3,4,5,8-гексагидро-1-оксо- 6-метоксинафталина растворяли в 50 мл тетрагидрофурана и добавляли к раствору 5 мл 1 н. соляной кислоты. После перемешивания при комнатной температуре в течение 1 часа к раствору добавляли этилацетат. Затем реакционную смесь промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом магния. После концентрирования добавляли небольшое количество смеси н-гексан-этилацетат (1:1) и полученную смесь охлаждали в бане со смесью сухого льда-эфира. Полученный таким образом осадок извлекали фильтрованием и промывали небольшим количеством н-гексана с получением 4,8 г соединения, указанного в названии примера.
1H-ЯМР (ДМСО-d6): δ (м. д. ): 2,01 -2,11 (м, 2H), 2,30-2,37 (м, 2H), 2,45-2,51 (м, 4H), 2,68-2,76 (м, 2H), 3,05 (с, 2H)
Пример получения 7
4-Оксо-1,2,3,4-тетрагидро-7H-бензо[с]карбазол-8-карбоновая кислота: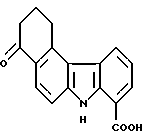
5,4 г (28,6 ммоль) гидрохлорида 2-гидразинобензойной кислоты и 4,7 г (34,3 ммоль) хлорида цинка добавляли к 300 мл ледяной уксусной кислоты. При перемешивании при ~ 85oC добавляли 4,7 г (28,6 ммоль) соединения Примера получения 6 на протяжении ~ 5 минут. Затем полученную смесь перемешивали при той же самой температуре в течение приблизительно 2 часов, возвращали к комнатной температуре и осадок извлекали фильтрованием. После концентрации фильтрата к нему добавляли воду и полученный таким образом осадок извлекали фильтрованием. Эти осадки объединяли, сушили и затем растворяли в ≈ 500 мл диметилформамида. При перемешивании при комнатной температуре добавляли раствор 6,6 г (28,6 ммоль) 2,3-дихлор-5,6-дициано-1,4-бензохинона в тетрагидрофуране (20 мл) и полученную смесь перемешивали в течение приблизительно 30 минут. После концентрирования добавляли приблизительно 50 мл этанола и полученный таким образом осадок извлекали фильтрованием с получением 3,4 г соединения, указанного в названии примера.
1H-ЯМР (ДМСО-d6): δ (м.д.): 2,17-2,29 (м, 2H), 2,63-2,70 (м, 2H), 3,55 (т, J = 6,0 Гц, 2H), 7,36 (т, J=7,6 Гц, 1H), 7,73 (д, J=8,8 Гц, 1H), 8,03 (д, J=8,8 Гц, 1H), 8,06 (дд, J= 0,8; 7,6 Гц, 1H), 8,48 (дд, J= 0,8; 7,6 Гц, 1H), 11,83 (с, 1H), 13,33 (шир. с, 1H)
Пример получения 8
N-[2-(Диметиламино)этил] -4-оксо-1,2,3,4-тетрагидро-7H-бензо[с] карбазол-8-карбоксамид;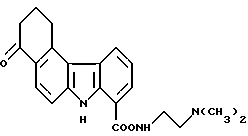
3,4 г (12,2 ммоль) соединения Примера получения 7 добавляли к 120 мл диметилформамида и перемешивали. Затем к смеси добавляли раствор 3,0 г (18,5 ммоль) N, N'-карбонилдиимидазола в диметилформамиде (30 мл). После перемешивания при комнатной температуре в течение 1 часа добавляли 3,2 г (36,3 ммоль) N,N'-диметилэтилендиамина. После перемешивания при той же самой температуре еще в течение 1 часа реакционную смесь концентрировали и добавляли к ней этилацетат. Затем ее промывали последовательно разбавленным водным аммиаком и водным раствором хлорида натрия, сушили над сульфатом магния и концентрировали досуха с получением 4,3 г соединения, указанного в названии примера.
FAB-масс-спектрометрия m/z: 350 ([М+H]+).
1H-ЯМР (CDCl3): δ (м.д.): 2,30-2,40 (м+с, 2H+6H), 2,62 (т, J = 6,0 Гц, 2H), 2,74-2,79 (м, 2H), 3,56-3,66 (м, 4H), 7,21 (шир. с, 1H), 7,32 (т, J=8,0 Гц, 1H), 7,41 (д, J=8,4 Гц, 1H), 7,70 (дд, J= 0,8; 8,0 Гц, 1H), 8,25 (д, J= 8,4 Гц, 1H), 8,33 (дд, J= 0,8; 8,0 Гц, 1H), 10,91 (шир. с, 1H)
Пример получения 9
2,3-Дигидро-3-оксо-1H,6H-циклопента[с]карбазол-7-карбоновая кислота
Соединение, указанное в названии примера получали реакцией 2,3,4,7-тетрагидро-1H-инден-1,5(6H)-диона, который был синтезирован из 2,3,4,7-тетрагидро-5-метокси-1H-инден-1-она согласно способу, описанному в Примере получения 6, таким же образом, как это описано в способе Примера получения 7.
FAB-масс-спектрометрия m/z: 266 ([М+H]+).
1H-ЯМР (ДМСО-d6): δ (м.д.): 2,70-2,82 (м, 2H), 3,52-3,62 (м, 2H), 7,41 (т, J=7,6 Гц, 1H), 7,70 (д, J=8,4 Гц, 1H), 7,81 (д, J=8,4 Гц, 1H), 8,09 (дд, J=0,8;7,6 Гц, 1H), 8,39 (д, J=7,6 Гц, 1H), 11,95 (с, 1H), 13,37 (шир. с, 1H)
Пример получения 10
2,3-Дигидро-N-[2-диметиламино)этил]-3-оксо-1H, 6H-циклопента[с]карбазол-7-карбоксамид: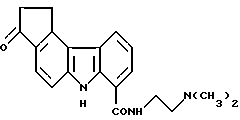
Соединение, указанное в названии примера, получали из соединения Примера получения 9, таким же образом, как это описано в способе Примера получения 8.
FAB-масс-спектрометрия m/z:336 ([М+H]+).
1H-ЯМР (CDCl3):  (м.д.): 2,34 (с, 6H), 2,61 (т, J=6,0 Гц, 2H), 2,85-2,91 (м, 2H), 3,58-3,66 (м, 4H), 7,18 (шир. с, 1H), 7,36 (т, J=7,6 Гц, 1H), 7,49 (д, J=8,4 Гц, 1H), 7,71 (д, J=7,6 Гц, 1H), 7,88 (д, J=8,4 Гц, 1H), 8,22 (д, J=7,6 Гц, 1H), 10,95 (шир. с, 1H)
(м.д.): 2,34 (с, 6H), 2,61 (т, J=6,0 Гц, 2H), 2,85-2,91 (м, 2H), 3,58-3,66 (м, 4H), 7,18 (шир. с, 1H), 7,36 (т, J=7,6 Гц, 1H), 7,49 (д, J=8,4 Гц, 1H), 7,71 (д, J=7,6 Гц, 1H), 7,88 (д, J=8,4 Гц, 1H), 8,22 (д, J=7,6 Гц, 1H), 10,95 (шир. с, 1H)
Пример получения 11
Метил 5,6,7,8-тетрагидро-9H-карбазол-1-карбоксилат: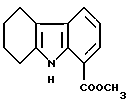
Раствор 28 мл (0,270 моль) циклогексанона в уксусной кислоте (100 мл) добавляли каплями в суспензию 52 г (0,276 моль) гидрохлорида 2-гидразинобензойной кислоты в уксусной кислоте (500 мл) при 100oC и полученную смесь нагревали с обратным холодильником в течение 6 часов. После возврата к комнатной температуре к смеси добавляли 1 л воды и полученный таким образом осадок собирали фильтрованием, промывали водой и сушили с получением 43 г порошка. Затем этот порошок растворяли в 500 мл ацетона. После добавления 37,5 мл (0,602 моль) метилиодида и 41,4 г (0,300 моль) безводного карбоната калия реакционную смесь нагревали с обратным холодильником в течение 2 часов. После возврата к комнатной температуре нерастворимые вещества отфильтровывали. После концентрирования фильтрата добавляли воду и полученный таким образом осадок извлекали фильтрованием с получением 45,7 г соединения, указанного в названии примера.
1H-ЯМР (CDCl3); δ (м.д.): 1,85-1,97 (м, 4H), 2,70-2,74 (м, 2H), 2,76-2,80 (м, 2H), 3,97 (с, 3H), 7,09 (т, J=7,6 Гц, 1H), 7,65-7,68 (м, 1H), 7,79 (дд, 1,1; 7,6 Гц, 1H), 9,39 (шир. с, 1H)
Пример получения 12
Метил 5-оксо-5,6,7,8-тетрагидро-9H-карбазол-1-карбоксилат: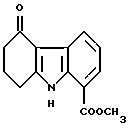
45,7 г (0,199 моль) соединения Примера получения 11 растворяли в смеси тетрагидрофурана (500 мл) с водой (50 мл). В полученный раствор добавляли по каплям раствор 90,8 г (0,400 моль) 2,3-дихлор-5,6-дициано-1,4-бензохинона в тетрагидрофуране (200 мл) в атмосфере азота при охлаждении льдом. После перемешивания при комнатной температуре в течение 3 часов к раствору добавляли 1 л водного раствора карбоната калия с последующей экстракцией этилацетатом. Затем органический слой собирали, промывали водой, сушили над сульфатом магния и концентрировали. Остаток перекристаллизовывали из этанола с получением 39,7 г соединения, указанного в названии примера.
1H-ЯМР (ДМСО-d6); δ (м.д.): 2,10-2,17 (м, 2H), 2,44-2,48 (м, 2H), 3,07 (т, J= 6,2 Гц, 2H), 3,96 (с, 3H), 7,28 (т, J=7,7 Гц, 1H), 7,81 (дд, J=1,3, 7,7 Гц, 1H), 8,25 (дд, J=1,3; 7,7 Гц, 1H), 11,79 (шир. с, 1H)
Пример получения 13
Метил 5-гидрокси-9H-карбазол-1-карбоксилат: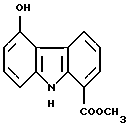
39,1 г (0,161 моль) соединения Примера получения 12 суспендировали в дифениловом эфире (150 мл). После добавления 10 г 10% палладия на угле полученную смесь нагревали с обратным холодильником в атмосфере азота в течение 3 часов. После остывания осажденные кристаллы и палладий на угле извлекали фильтрованием и промывали гексаном. Затем извлеченную смесь растворяли в горячем тетрагидрофуране и палладий на угле отфильтровывали. После концентрирования остаток перекристаллизовывали из этанола с получением 34,7 г соединения, указанного в названии примера.
1H-ЯМР (CDCl3): δ (м. д. ): 4,03 (с, 3H), 5,54 (с, 1H), 6,62 (дд, J= 0,6,7,9 Гц, 1H), 7,10 (дд, J= 0,6; 7,9 Гц, 1H), 7,27 (т, J=7,9 Гц, 1H), 7,30 (т, J= 7,9 Гц, 1H), 8,05 (дд, J=1,2; 7,9 Гц, 1H), 8,46-8,50 (м, 1H), 9,93 (шир. с, 1H)
Пример получения 14
[1-Метоксикарбонил-9H-карбазол-5-ил]оксиуксусная кислота:
34,8 г (0,144 моль) соединения Примера получения 13 растворяли в ацетоне (550 мл). После добавления к раствору 68,5 мл (0,432 моль) бензилбромацетата, 64,8 г (0,432 моль) иодида натрия и 29,8 г (0,216 моль) безводного карбоната калия полученную смесь нагревали с обратным холодильником в течение 60 часов. После выдерживания для охлаждения полученный таким образом остаток отфильтровывали с последующим концентрированием. Затем проводили экстракцию путем добавления этилацетата и воды и органический слой собирали, промывали водой, сушили над сульфатом магния и концентрировали. К полученному остатку добавляли н-гексан для его отверждения. Затем его извлекали фильтрованием и перекристаллизовывали из этанола с получением 40,7 г бензилового эфира соединения заголовка. Этот продукт суспендировали в смеси тетрагидрофурана (600 мл) - метанол (500 мл). Затем к суспензии добавляли 12 г 10% палладия на угле и продукт гидрировали при атмосферном давлении при обычной температуре с получением 29,4 г соединения, указанного в названии примера.
1H-ЯМР (CD3OD): δ (м.д.): 4,02 (с, 3H), 4,90 (с, 2H), 6,67 (дд, J= 0,6; 8,0 Гц, 1H), 7,23 (т, J=7,7 Гц, 1H), 7,26 (дд, J= 0,6; 8,0 Гц, 1H), 7,35 (т, J= 8,0 Гц, 1H), 8,02 (дд, J= 1,1; 7,7 Гц, 1H), 8,63 (дд, J=1,1; 7,7 Гц, 1H), 10,87 (шир. с, 1H)
Пример получения 15
2,3-Дигидро-3-оксо-6H-фуро[3,2-с]карбазол-7-карбоновая кислота: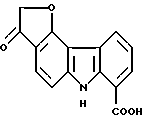
29,4 г (0,098 моль) соединения Примера получения 14 суспендировали в толуоле (500 мл). После добавления 36 мл (0,494 моль) тионилхлорида полученную смесь нагревали с обратным холодильником, пока смесь не становилась гомогенной. После концентрирования ее растворяли путем добавления к ней 500 мл дихлорметана и добавляли порциями 32,1 г (0,240 моль) хлорида аммония с перемешиванием при охлаждении льдом. Затем смесь возвращали к комнатной температуре и перемешивали в течение ночи, затем добавляли к ней смесь воды со льдом при охлаждении льдом. После перемешивания при комнатной температуре раствор концентрировали и добавляли к нему разбавленную соляную кислоту. Осадок извлекали фильтрованием, промывали последовательно водой и этанолом и сушили с получением 26,5 г порошка. Весь порошок растворяли в смеси тетрагидрофуран (350 мл) - метанол (250 мл) и затем добавляли к раствору 750 мл дегазированного раствора гидроксида натрия в атмосфере азота. После гидролиза сложного эфира при 50oC к раствору добавляли 20 мл концентрированной соляной кислоты. Затем его экстрагировали смесью этилацетата с тетрагидрофураном и органический слой собирали, промывали водой, сушили над сульфатом магния и концентрировали. Остаток очищали колоночной хроматографией на силикагеле с получением 11,4 г соединения, указанного в названии примера.
1H-ЯМР (ДМСО-d6): δ (м.д.): 5,00 (с, 2H), 7,41 (т, J=7,7 Гц, 1H), 7,56 (д, J= 8,5 Гц, 1H), 7,63 (д, J=8,5 Гц, 1H), 8,07 (дд, J=1,3; 7,7 Гц, 1H), 8,29-8,32 (м, 1H), 12,10 (шир. с, 1H)
Пример получения 16
N-[2-(Аллилметиламино)этил]-4-оксо-1,2,3,4-тетрагидро-7H- бензо[с]карбазол-8-карбоксамид:
С применением 0,5 г (1,79 ммоль) соединения Примера получения 7 и 0,53 г (7,15 ммоль) N-метилэтилендиамина получали 0,49 г N-[2-(метиламино)этил]-4-оксо-1,2,3,4-тетрагидро-7H-бензо [с] карбазол-8-карбоксамида согласно способу, описанному в Примере получения 8. 0,49 г (1,46 ммоль) этого продукта, 0,25 г (1,74 ммоль) аллилбромида и 0,23г (1,78 ммоль) N,N-диизопропилэтиламина растворяли в тетрагидрофуране (30 мл) и перемешивали при 55oC в течение приблизительно 5 часов. После охлаждения раствор разбавляли этилацетатом, промывали последовательно хлоридом натрия, сушили над сульфатом магния и концентрировали. Остаток очищали препаративной тонкослойной хроматографией с получением 0,24 г соединения, указанного в названии примера.
1H-ЯМР (CDCl3):  (м.д.): 2,28-2,40 (м+с, 2H+3H), 2,70 (т, J=6,0 Гц, 2H), 2,73-2,80 (м, 2H), 3,11-3,17 (м, 2H), 3,56-3,68 (м, 4H), 5,17-5,29 (м, 2H), 5,82-5,97 (м, 1H), 7,24 (шир. с, 1H), 7,33 (т, J=7,6 Гц, 1H), 7,42 (д, J= 8,4 Гц, 1H), 7,67 (дд, J=0,8; 7,6 Гц, 1H), 8,25 (д, J=8,4 Гц, 1H), 8,33 (дд, J= 0,8; 7,6 Гц, 1H), 10,88 (шир. с, 1H)
(м.д.): 2,28-2,40 (м+с, 2H+3H), 2,70 (т, J=6,0 Гц, 2H), 2,73-2,80 (м, 2H), 3,11-3,17 (м, 2H), 3,56-3,68 (м, 4H), 5,17-5,29 (м, 2H), 5,82-5,97 (м, 1H), 7,24 (шир. с, 1H), 7,33 (т, J=7,6 Гц, 1H), 7,42 (д, J= 8,4 Гц, 1H), 7,67 (дд, J=0,8; 7,6 Гц, 1H), 8,25 (д, J=8,4 Гц, 1H), 8,33 (дд, J= 0,8; 7,6 Гц, 1H), 10,88 (шир. с, 1H)
Пример получения 17
5-[1-(Аллилметиламино)этил]-12,13-дигидро-4H-бензо[с]пиримидо [5,6,1-jk] карбазол-4,6,10(5H,11H)-трион:
С применением 0,24 г (0,64 ммоль) соединения Примера получения 16, 0,23 г соединения заголовка получали согласно способу, описанному в Примере 2, за исключением процедуры, относящейся к гидрохлориду.
1H-ЯМР (CDCl3): δ (м. д.): 2,23-2,42 (м+с, 2H+3H), 2,73-2,84 (м, 4H), 3,10-3,15 (м, 2H), 3,53 (т, J=6,4 Гц, 2H), 4,35 (т, J=7,2 Гц, 2H), 5,08-5,22 (м, 2H), 5,74-5,90 (м, 1H), 7,63 (т, J=7,6 Гц, 1H), 8,19 (дд, J=0,8; 7,6 Гц, 1H), 8,32 (дд, J=0,8; 7,6 Гц, 1H), 8,35 (д, J=8,4 Гц, 1H), 8,51 (д, J=8,4 Гц, 1H)
Пример получения 18
Метил-6-метил-9H-карбазол-1-карбоксилат:
Суспензию 2,0 г (10,6 ммоль) гидрохлорида 2-гидразинобензойной кислоты в уксусной кислоте (20 мл) медленно кипятили при перемешивании и добавляли по каплям 1,2 мл (9,8 ммоль) 4-метилциклогексанона. Полученную смесь нагревали с обратным холодильником в течение 8 часов и затем давали ей остыть. После добавления воды полученный таким образом осадок извлекали фильтрованием, промывали водой и сушили с получением 1,96 г 6-метил-5,6,7,8-тетрагидро-9H-карбазол-1-карбоновой кислоты. Этот продукт растворяли в ацетоне (50 мл) и добавляли к раствору 2,1 мл (34 ммоль) метилиодида и 2,35 г (17 ммоль) безводного карбоната калия. Реакционную смесь нагревали с обратным холодильником при перемешивании в течение 2 часов, затем давали ей остыть и экстрагировали водой и этилацетатом. Органический слой собирали, промывали водой, сушили над сульфатом магния и концентрировали досуха. Таким образом были получены 1,49 г метил 6-метил-5,6,7,8-тетра-гидро-9H-карбазол-1-карбоксилата. Этот продукт суспендировали в дифениловом эфире (10 мл) и к суспензии добавляли 890 мг 10% палладия на угле. Полученную смесь нагревали с обратным холодильником при перемешивании в атмосфере азота в течение 1 часа.
После выдерживания для охлаждения продукт растворяли добавлением тетрагидрофурана. Затем катализатор отфильтровывали и фильтрат концентрировали. После добавления н-гексана полученные таким образом кристаллы извлекали фильтрованием с получением 1,26 г соединения, указанного в названии примера.
1H-ЯМР (CDCl3): δ (м.д.): 2,54 (с, 3H), 4,02 (с, 3H), 7,22 (т, J=7,8 Гц, 1H), 7,27-7,31 (м, 1H), 7,41 (д, J=8,2 Гц, 1H), 7,87-7,90 (м, 1H), 8,05 (дд, J=1,1; 7,8 Гц, 1H), 8,21-8,25 (м, 1H), 9,82 (шир. с, 1H)
Пример получения 19
Метил 6-формил-9H-карбазол-1-карбоксилат: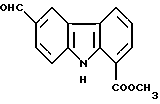
1,8 г (10 ммоль) N-бромсукцинимида и 220 мг (1,3 ммоль) α,α′-азобисизобутиронитрила добавляли к раствору 1,2 г (5 ммоль) соединения Примера получения 18 в четыреххлористом углероде (100 мл) и полученную смесь нагревали с обратным холодильником при перемешивании в течение 1 часа. После остывания смесь концентрировали и остаток очищали колоночной хроматографией на силикагеле с получением 1,13 г соединения, указанного в названии примера.
1H-ЯМР (CDCl3): δ (м.д.): 4,05 (с, 3H), 7,36 (т, J=7,8 Гц, 1H), 7,62 (д, J= 8,4 Гц, 1H), 8,03 (дд, J=1,6; 8,4 Гц, 1H), 8,14 (дд, J=1,2; 7,8 Гц, 1H), 8,32-8,36 (м, 1H), 8,62-8,64 (м, 1H), 10,12 (с, 1H), 10,23 (шир. с, 1H)
Пример получения 20
Метил 1,2-дигидро-1-оксо-7H-пиридо[4,3-с]карбазол-8- карбоксилат:
2,6 г (25 ммоль) малоновой кислоты и 0,3 мл пиперидина добавляли к раствору 2,0 г (7,9 ммоль) соединения Примера получения 19 в пиридине (80 мл) и полученную смесь перемешивали в бане при 80oC в течение 1 часа. Затем к ней добавляли 2,6 г (25 ммоль) малоновой кислоты при нагревании и перемешивании на протяжении 1 часа и полученную смесь нагревали с обратным холодильником еще в течение 1 часа. После остывания реакционную смесь выливали в смесь концентрированной соляной кислоты со льдом и образованный таким образом осадок извлекали фильтрованием, промывали водой и сушили с получением 1,8 г 3-(1-метоксикарбонил-9H-карбазол-6-ил) акриловой кислоты. Полученное соединение растворяли в ацетоне (70 мл) и добавляли к раствору 2 мл триэтиламина. При охлаждении льдом и перемешивании добавляли по каплям 0,64 мл (6,7 ммоль) этилхлорформиата и затем реакционную смесь перемешивали при той же самой температуре в течение 1 часа. Затем в нее добавляли по каплям раствор 870 мг (12 ммоль) азида натрия (90%) в 20 мл воды при охлаждении льдом и перемешивании. Реакционную смесь перемешивали при той же самой температуре в течение 1 часа и затем выливали в лед. Образованный таким образом осадок извлекали фильтрованием. Этот осадок добавляли вместе с 3 мл трибутиламина к дифениловому эфиру (20 мл) и нагревали до 260oC. После остывания добавляли гексан и полученный таким образом осадок извлекали фильтрованием и промывали последовательно н-гексаном и этанолом с получением 1,39г соединения заголовка.
1H-ЯМР (ДМСО-d6): δ (м. д. ): 4,01 (с, 3H), 6,73 (д, J=7,0 Гц, 1H), 7,18-7,24 (м,1H), 7,31 (т, J=7,9 Гц, 1H), 7,77 (д, J=8,5 Гц, 1H), 8,08 (дд, J= 1,3; 7,9 Гц, 1H), 8,22 (д, J=8,5 Гц, 1H), 10,13 (дд, J=1,3; 7,9 Гц, 1H), 11,36-11,42 (м, 1H), 11,93 (шир. с, 1H)
Пример получения 21
Метил 7H-пиридо[4,3-с]карбазол-8-карбоксилат: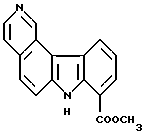
10 мл оксихлорида фосфора добавляли к 1,19 г (4 ммоль) соединения Примера получения 20 и полученную смесь нагревали с обратным холодильником. Спустя 3 часа реакционную смесь выливали в лед и нейтрализовали бикарбонатом натрия. Затем ее экстрагировали дихлорметаном. Органический слой собирали, промывали водой, сушили над сульфатом магния и концентрировали. Остаток очищали колоночной хроматографией на силикагеле с получением 390 мг метил 1-хлор-7H-пиридо[4,3-с]карбазол-8-карбоксилата. Этот продукт растворяли в смеси тетрагидрофуран-метанол и добавляли к раствору 1 мл триэтиламина. Затем проводили гидрирование в присутствии палладия на угле при атмосферном давлении при обычной температуре с получением 300 мг соединения, указанного в названии примера.
1H-ЯМР (ДМСО-d6)):  (м.д.): 4,04 (с, 3H), 7,48 (т, J=7,7 Гц, 1H), 8,00 (д, J=5,4 Гц, 1H), 8,02 (д, J=8,8 Гц, 1H), 8,14 (д, J=7,7 Гц, 1H), 8,28 (д, J= 8,8 Гц, 1H), 8,58 (д, J= 5,4 Гц, 1H), 9,06 (д, J=7,7 Гц, 1H), 10,22 (с, 1H), 12,11 (шир. с, 1H)
(м.д.): 4,04 (с, 3H), 7,48 (т, J=7,7 Гц, 1H), 8,00 (д, J=5,4 Гц, 1H), 8,02 (д, J=8,8 Гц, 1H), 8,14 (д, J=7,7 Гц, 1H), 8,28 (д, J= 8,8 Гц, 1H), 8,58 (д, J= 5,4 Гц, 1H), 9,06 (д, J=7,7 Гц, 1H), 10,22 (с, 1H), 12,11 (шир. с, 1H)
Пример получения 22
10-Hитро-7H-бензо[с]фенотиазин-8-карбоновая кислота: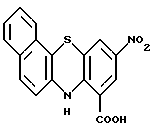
5 мл 2 н. водного раствора гидроксида натрия добавляли к раствору 1,7 г (9,73 ммоль) 2-амино-1-нафталинтиона в этаноле (30 мл) и полученную смесь нагревали с обратным холодильником. К этой смеси добавляли 2,54 г (9,76 ммоль) метил-2-хлор-3,5-динитробензоата и полученную смесь нагревали с обратным холодильником в течение 1 часа. К этой смеси добавляли 10 мл 2 н. водного раствора гидроксида натрия и 40 мл этанола и полученную смесь нагревали с обратным холодильником еще в течение 10 часов. Затем смеси давали остыть до комнатной температуры и концентрировали. После добавления воды к смеси медленно добавляли 1 н. соляную кислоту при перемешивании для доведения величины pH до приблизительно 1. Осадок извлекали фильтрованием и промывали последовательно этанолом и метанолом с получением 1,14 г соединения, указанного в названии примера.
1H-ЯМР (ДМСО-d6): δ (м.д.):7,04 (д, J=8,4 Гц, 1H), 7,40 (т, J=8,4 Гц, 1H), 7,55 (т, J=8,4 Гц, 1H), 7,64 (д, J=8,4 Гц, 1H), 7,68 (д, J=8,4 Гц, 1H), 7,82 (д, J=8,4 Гц, 1H), 7,90 (с, 1H), 7,68 (д, J=8,4 Гц, 1H), 7,82 (д, J=8,4 Гц, 1H), 7,90 (с, 1H), 8,35 (с, 1H), 11,37 (шир. с, 1H)
Пример получения 23
N-[2-(Диметиламино)этил]-10-нитро-7H-бензо[с]фенотиазин -8-карбоксамид: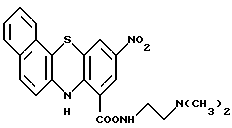
10 мл трихлорида фосфора и 2 мл диметилформамида последовательно добавляли к суспензии 1,82 г (5,39 ммоль) соединения Примера получения 22 в хлороформе (60 мл) при 0oC. Затем смеси давали медленно остыть до комнатной температуры и перемешивали ее в течение ночи. После полной отгонки растворителя из смеси при пониженном давлении к остатку добавляли 30 мл дихлорметана. При перемешивании при 0oC в смесь добавляли по каплям раствор 5 мл N, N-диметилэтилендиамина в дихлорметане (30 мл). Затем реакционной смеси давали медленно остыть до комнатной температуры и перемешивали ее при комнатной температуре в течение 7 часов. Затем к ней добавляли насыщенный водный раствор бикарбоната натрия и полученную смесь перемешивали и фильтровали через целит для удаления из нее нерастворимых веществ. Органический слой извлекали, промывали последовательно водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, концентрировали досуха и перекристаллизовывали из этанола с получением 956 мг соединения, указанного в названии примера.
1H-ЯМР (ДМСО-d6): δ (м.д.):2,20 (с, 6H), 2,45 (т, J=6,0 Гц, 2H), 3,37 (т, J= 6,0 Гц, H), 7,06 (д, J=8,4 Гц, 1H), 7,41 (т, J=8,4 Гц, 1H), 7,56 (т, J= 8,4 Гц, 1H), 7,66 (т, J=8,4 Гц, 1H), 7,69 (д, J=8,4 Гц, 1H), 7,83 (д, J= 8,4 Гц, 1H), 7,93 (шир. с, 1H), 8,39 (д, J=2,9 Гц, 1H), 9,50 (шир. с, 1H)
Пример получения 24
3-(4-Метилбензолсульфонамидо)-7H-бензо[с]карбазол-8-карбоновая кислота: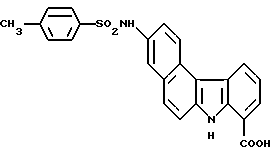
Соединение заголовка получали реакцией 5,6-дигидро-3- (4-метилбензолсульфонамидо)-7H-бензо[с]карбазол-8-карбоновой кислоты, которая была получена нагреванием с обратным холодильником 6-(4-метилбензолсульфонамидо)-2-тетралона и гидрохлорида 2-гидразинобензойной кислоты в ксилоле согласно способу, описанному в Примере получения 2.
1H-ЯМР (ДМСО-d6): δ (м.д.): 2,26 (с, 3H), 7,29 (т, J=8,0 Гц, 2H), 7,35 (дт, J= 2,0; 7,6 Гц, 1H), 7,46 (д, J=8,8 Гц, 1H), 7,66 (д, J=6,8 Гц, 2H), 7,71 (с, 1H), 7,79 (д, J=9,2 Гц, 1H), 7,96 (дд, J= 2,0; 9,2 Гц, 1H), 8,01 (д, J=8,8 Гц, 1H), 8,66 (д, J=8,8 Гц, 1H), 8,79 (д, J=8,0 Гц, 1H), 10,33 (с, 1H), 11,76 (с, 1H)
Пример получения 25
Этил 13H-бенз[6,7]индоло[2,3-с]хинолин-12-карбоксилат: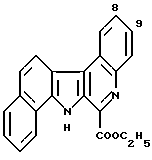
Суспензию 4,24 г (22,5 ммоль) гидрохлорида 1-нафталингидразина в уксусной кислоте (35 мл) медленно кипятили и при перемешивании добавляли в нее по каплям раствор 3,4 г (20,6 ммоль) 2-нитрофенилацетальдегида в уксусной кислоте (15 мл). После завершения добавления по каплям полученную смесь нагревали с обратным холодильником в течение 1 часа. Затем добавляли 20 мл смеси 1 н. соляной кислоты с уксусной кислотой и полученную смесь нагревали с обратным холодильником еще в течение 1 часа. После отгонки растворителя остаток растворяли добавлением к нему этилацетата. Органический слой промывали последовательно водным раствором бикарбоната натрия, водой и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. После отгонки растворителя остаток очищали колоночной хроматографией на силикагеле с получением 1,91 г (выход 32%) 7-(2-нитрофенил)бенз[g]-индола. Затем полученный продукт растворяли в этилацетате (60 мл) и добавляли 200 мг оксида платины (IV). Затем проводили каталитическое восстановление при атмосферном давлении в атмосфере водорода при комнатной температуре с получением 1,7 г (выход 99%) 7-(2-аминофенил)бенз[g]индола.
Затем 20 мл этанола добавляли к 540 мг (2,1 ммоль) 7-(2-аминофенил)бенз[g] индола и 260 мг (2,5 ммоль) этилглиоксилата (полимерного) и полученную смесь нагревали с обратным холодильником в течение 8 часов. После отгонки растворителя остаток очищали колоночной хроматографией на силикагеле с получением 380 мг (выход 53%) соединения, указанного в названии примера.
1H-ЯМР (CDCl3): δ (м. д.): 1,64 (т, J=7,1 Гц, 3H), 4,74 (к, J=7,1 Гц, 2H), 7,63-7,77 (м, 3H), 7,79 (д, J=8,6 Гц, 1H), 7,70-7,85 (м, 1H), 8,06 (дд, J= 1,3; 7,7 Гц, 1H), 8,35 (дд, J=0,7; 8,1 Гц, 1H), 8,45 (дд, J=1,3; 8,4 Гц, 1H), 8,54 (д, J=8,6 Гц, 1H), 8,79 (дд, J=1,1; 8,2 Гц, 1H), 10,98 (шир. с, 1H)
Пример 1
Гидрохлорид 5-[2-(диметиламино)этил] -4H-бензо[с] пиримидо[5,6,1-jk] карбазол-4,6(5H)-диона: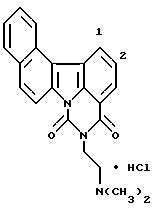
457 мг (10,5 ммоль) гидрида натрия (55% в масле) добавляли к раствору 1,44 г соединения Примера получения 3 в диметилформамиде (50 мл) при комнатной температуре и полученную смесь перемешивали в течение 50 минут. Затем добавляли 1 мл (10,5 ммоль) этилхлорформиата при 0oC и полученную смесь перемешивали при той же температуре в течение 2 часов и затем при комнатной температуре в течение 6 часов. После добавления воды осадок извлекали фильтрованием, промывали водой и сушили. Затем его растворяли в смеси дихлорметан-метанол и нерастворимые вещества отфильтровывали. После концентрирования последовательно добавляли этанол и концентрированную соляную кислоту. Образовавшийся таким образом гидрохлорид извлекали фильтрованием и перекристаллизовывали из этанола с получением 1,24 г соединения, указанного в названии примера.
Точка плавления: 254-255oC (перекристаллизация из этанола).
FAB-масс-спектрометрия m/z: 358 ([М+H]+).
1H-ЯМР (ДМСО-d6): 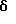 (м.д.):2,90 (д, J=5,5 Гц, 6H), 3,49 (к, J=5,5 Гц, 2H), 4,42 (т, J=5,5 Гц, 2H), 7,67 (т, J=8,0 Гц, 1H), 7,78 (т, J=8,0 Гц, 1H), 7,83 (т, J=8,0 Гц, 1H), 8,14 (д, J=8,0 Гц, 1H), 8,19 (д, J=8,0 Гц, 1H), 8,23 (д, J=8,8 Гц, 1H), 8,62 (д, J=8,0 Гц, 1H), 8,86 (д, J=8,0 Гц, 1H), 9,02 (д, J=8,0 Гц, 1H), 9,70 (шир. с, 1H)
(м.д.):2,90 (д, J=5,5 Гц, 6H), 3,49 (к, J=5,5 Гц, 2H), 4,42 (т, J=5,5 Гц, 2H), 7,67 (т, J=8,0 Гц, 1H), 7,78 (т, J=8,0 Гц, 1H), 7,83 (т, J=8,0 Гц, 1H), 8,14 (д, J=8,0 Гц, 1H), 8,19 (д, J=8,0 Гц, 1H), 8,23 (д, J=8,8 Гц, 1H), 8,62 (д, J=8,0 Гц, 1H), 8,86 (д, J=8,0 Гц, 1H), 9,02 (д, J=8,0 Гц, 1H), 9,70 (шир. с, 1H)
Элементный анализ: как C22H19N3O2•H2O
рассчитано: C 64,15; H 5,38; N 10,20;
найдено: C 64,38; H 5,05; N 10,22.
Пример 2
Гидрохлорид 11-ацетил-5-[2-(диметиламино)этил] -4H-бензо[с] пиримидо[5,6,1-jk]карбазол-4,6(5H)-диона: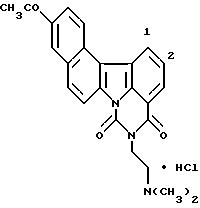
13,2 мг (0,549 ммоль) гидрида натрия добавляли к раствору 105 мг (0,282 ммоль) соединения Примера получения 5 в диметилформамиде (2,5 мл) при 0oC и полученную смесь перемешивали при той же температуре в течение 1 часа и 10 минут и затем при комнатной температуре в течение 1 часа. Затем добавляли 53,6 мкл (0,564 ммоль) этилхлорформиата при 0oC и полученную смесь перемешивали при той же температуре в течение 1 часа 20 минут. После экстракции путем добавления воды и хлороформа органический слой извлекали, сушили над сульфатом натрия и концентрировали. Остаток очищали колоночной хроматографией на силикагеле и превращали в гидрохлорид с использованием 1 н. хлористоводородной кислоты (этанол) с получением 106 мг соединения, указанного в названии примера.
Точка плавления: окрашивается от приблизительно 240oC и разлагается при приблизительно 250-254oC.
FAB-масс-спектрометрия m/z: 400 ([М+H]+).
1H-ЯМР (ДМСО-d6): δ (м.д.):2,78 (с, 3H), 2,92 (с, H), 3,48-3,54 (м, 2H), 4,44 (т, J=5,6 Гц, 2H), 7,80 (т, J=7,5 Гц, 1H), 8,16 (д, J=7,5 Гц, 1H), 8,24 (дд, J= 2,3; 9,4 Гц, 1 H), 8,40 (д, J=8,9 Гц, 1H), 8,68 (д, J=8,9 Гц, 1H), 8,87-8,91 (м, 2H), 9,01 (д, J=7,5 Гц, 1H), 9,88 (шир. с, 1H)
Элементный анализ: как C24H21N3O3•HCl•2H2O
рассчитано: C 63,50; H 5,33; N 9,26,
найдено: C 63,42; H 5,04; N 9,16.
Пример 3 Гидрохлорид
5-[2-(диметиламино)этил] -11-(1-гидроксиэтил)-4H-бензо[с] пиримидо[5,6,1-jk] карбазол-4,6(5H)-диона: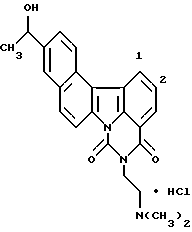
21 мкл (0,168 ммоль) комплекса боран/пиридин (~ 8 М) добавляли к суспензии 84 мг (0,211 ммоль) соединения, полученного преобразованием соединения Примера 2 в его свободное основание, в уксусной кислоте (1,5 мл) и полученную смесь перемешивали при 70oC в течение 3 часов. Затем ее подкисляли добавлением 1 н соляной кислоты при комнатной температуре, перемешивали в течение 1 минуты и нейтрализовали насыщенным водным раствором бикарбоната натрия. Затем ее экстрагировали добавлением к ней смеси дихлорметана с этанолом. Органический слой собирали, промывали водой, сушили над сульфатом натрия и концентрировали. Остаток очищали препаративной тонкослойной хроматографией и превращали в гидрохлорид при помощи 1 н. хлористоводородной кислоты с получением 44 мг соединения, указанного в названии примера.
Точка плавления: ~ 247 - 248oC (разложение) (перекристаллизация из этанола).
FAB-масс-спектрометрия m/z: 402 ([М+ H]+).
1H-ЯМР (ДМСО-d6): δ (м.д.): 1,50 (д, J=5,0 Гц, 3H), 2,92 (с, 6H), 3,49 (т, J=5,7 Гц, 2H), 4,43 (т, J=5,7 Гц, 2H), 4,95-5,05 (м, 1H), 5,45 (д, J=4,2 Гц, 1H), 7,77 (т, J=8,4 Гц, 1H), 7,84 (т, J=8,4 Гц, 1H), 8,08-8,15 (м, 2H), 8,21 (д, J= 8,4 Гц, 1H), 8,59 (дд, J=1,4; 8,4 Гц, 1H), 8,81 (д, J=8,4 Гц, 1H), 8,99 (д, J=7,6 Гц, 1H), 9,90 (шир. с, 1H)
Элементный анализ: как C24H24N3O3Cl
рассчитано: C 65,82; H 5,52; N 9,60;
найдено: С 65,49; H 5,53; N 9,49.
Пример 4
Гидрохлорид 12,13-дигидро-5-[2-(диметиламино) этил]-4H-бензо[с]пиримидо[5,6,1-jk]карбазол-4,6,10(5H,11 H)-триона:
Раствор 4,9 г (14 ммоль) соединения Примера получения 8 в диметилформамиде (70 мл) добавляли по каплям в суспензию 0,9 г (37,5 ммоль) гидрида натрия в диметилформамиде (30 мл) при комнатной температуре и полученную смесь перемешивали при той же температуре в течение 2 часов. Затем добавляли 2,5 г (23 ммоль) этилхлорформиата при охлаждении льдом и перемешивании. Спустя 15 минут добавляли этилацетат и полученную смесь промывали последовательно разбавленным водным аммиаком и водным раствором хлорида натрия и сушили над сульфатом магния. После концентрирования добавляли метанол и кристаллы извлекали фильтрованием. Затем эти кристаллы суспендировали в метаноле и подкисляли добавлением 1 н. хлористоводородной кислоты при перемешивании. После перемешивания при комнатной температуре и концентрирования добавляли этанол и полученный осадок извлекали фильтрованием с получением 4,3 г соединения, указанного в названии примера.
Точка плавления: окрашивается от приблизительно 250oC, постепенно разлагается от приблизительно 260oC и быстро разлагается при приблизительно 273-275oC.
FAB-масс-спектрометрия m/z: 376 ([М+H]+).
1H-ЯМР (ДМСО-d6): 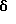 (м.д.): 2,22-2,36 (м, 2H), 2,72-2,80 (м, 2H), 2,92 (с, 6H), 3,44-3,54 (м, 2H), 3,54-3,60 (м, 2H), 4,38-4,46 (м, 2H), 7,75 (т, J= 7,6 Гц, 1H), 8,17 (дд, J=0,8; 7,6 Гц, 1H), 8,25 (д, J=8,8 Гц, 1H), 8,41 (д, J=8,8 Гц, 1H), 8,61 (дд, J=0,8; 7,6 Гц, 1H), 9,52 (шир. с, 1H)
(м.д.): 2,22-2,36 (м, 2H), 2,72-2,80 (м, 2H), 2,92 (с, 6H), 3,44-3,54 (м, 2H), 3,54-3,60 (м, 2H), 4,38-4,46 (м, 2H), 7,75 (т, J= 7,6 Гц, 1H), 8,17 (дд, J=0,8; 7,6 Гц, 1H), 8,25 (д, J=8,8 Гц, 1H), 8,41 (д, J=8,8 Гц, 1H), 8,61 (дд, J=0,8; 7,6 Гц, 1H), 9,52 (шир. с, 1H)
Элементный анализ: как C22H21N3O3•HCl•1H2O
рассчитано: C 61,47; H 5,63; N 9,77;
найдено: C 61,47; H 5,57; N 9,77.
Пример 5
5-[2-(Диметиламино)этил]-10-гидрокси-10,11,12,13-тетрагидро-4H-бензо [с] пиримидо[5,6,1-jk]карбазол-4,6(5H)-дион:
0,5 г (1,2 ммоль) соединения Примера 4 растворяли в смеси воды (50 мл) с метанолом (25 мл) и добавляли 1,2 мл 1 н. хлористоводородной кислоты. Затем проводили гидрирование в присутствии палладия на угле в атмосфере водорода при давлении приблизительно 4,5 кг/см2. После подтверждения завершения реакции тонкослойной хроматографией катализатор отфильтровывали и остаток концентрировали приблизительно до 2/3. После добавления 50 мл воды и 5 мл концентрированного водного аммиака полученную смесь экстрагировали этилацетатом. Органический слой извлекали, промывали водным раствором хлорида натрия, сушили над сульфатом магния и концентрировали. Остаток очищали колоночной хроматографией на силикагеле с получением 0,35 г соединения, указанного в названии примера.
FAB-масс-спектрометрия m/z: 378 ([М+H]+).
1H-ЯМР (CDCl3) δ (м.д.): 1,92-2,30 (м, 4H), 2,37(с, 6H), 2,70 (т, J=6,8 Гц, 2H), 3,06-3,32 (м, 2H), 4,32 (т, J=6,8 Гц, 2H), 4,95 (шир. т, J=4,8 Гц, 1H), 7,52 (т, J=7,6 Гц, 1H), 7,67 (д, J=8,4 Гц, 1H), 8,09 (дд, J=0,8; 7,6 Гц, 1H), 8,15 (дд, J=0,8; 7,6 Гц, 1H), 8,33 (д, J=8,4 Гц, 1H).
Элементный анализ: как C22H23N3O3•1H2O
рассчитано: C 66,82; H 6,37; N 10,63;
найдено: C 67,10; H 6,03; N 10,34.
Пример 6
(+)-5-[2-(Диметиламино)этил]-10-гидрокси-10,11,12,13-тетрагидро-
4H-бензо[с]пиримидо[5,6,1-jk]карбазол-4,6(5H)-дион: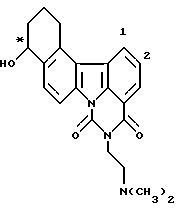
Соединение Примера 5 разделяли на колонке для разделения оптических стереоизомеров [Chiralcel OD, проводимой Daicel; элюируя смесью н-гексан/2-пропанол (7: 3 - 6:4)]. Фракцию, элюирующуюся раньше, концентрировали досуха с получением соединения заголовка.
Точка плавления: ~ 160-162oC
FAB-масс-спектрометрия m/z: 378 ([М+H]+).
1H-ЯМР (CDCl3): δ (м.д.): 1,90-2,30 (м, 4H), 2,43 (с, 6H), 2,77 (т, J= 6,4 Гц, 2H), 3,04-3,31 (м, 2H), 4,34 (т, J=6,8 Гц, 2H), 4,95 (шир. т, J=4,8 Гц, 11-1), 7,51 (т, J=7,6 Гц, 1H), 7,68 (д, J=8,4 Гц, 1H), 8,08 (д, J=7,6 Гц, 1H), 8,13 (д, J=7,6 Гц, 1H), 8,32 (д, J=8,4 Гц, 1H).
Элементный анализ: как C22H23N3O3•0,75H2O
рассчитано: C 67,59; H 6,32; N 10,75;
найдено: C 67,34; H 5,93; N 10,48.
Угол вращения [α]
Пример 7
Гидрохлорид 11,12-дигидро-5-[2-(диметиламино)этил]-4H,10H циклопента[с] пиримидо[5,6,1-jk]карбазол-4,6,10(5H)-триона: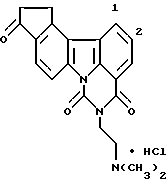
Названное соединение получали из соединения примера получения 10 согласно способу, описанному в Примере 2.
Точка плавления: окрашивается приблизительно от 255oC и постепенно разлагается приблизительно от 265oC.
FAB-масс-спектрометрия m/z: 362 ([М+H]+).
1H-ЯМР (ДМСО-d6): δ (м.д.): 2,83-2,94 (м, 8H), 3,45 (шир. с, 2H), 3,64 (шир. т, J=6,0 Гц, 2H), 4,42 (шир. т, J=6,0 Гц, 2H), 7,79 (т, J=7,6 Гц, 1H), 7,97 (д, J= 8,4 Гц, 1H), 8,19 (дд, J=0,8; 7,6 Гц, 1H), 8,49 (д, J=8,4 Гц, 1H), 8,55 (дд, J=0,8; 7,6 Гц, 1H), 9,44 (шир. с, 1H).
Элементный анализ: как C21H19N3O3•HCl•0,75H2O
рассчитано: C 61,31; H 5,27; N 10,21;
найдено: C 61,17; H 5,04; N 10,16.
Пример 8
Гидрохлорид 8-[2-(диметиламино)этил] -7H-фуро[3,2-с] пиримидо[5,6,1-jk] карбазол-3,7,9(2H,8H)-триона: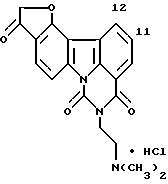
590 мг (2,2 ммоль) соединения Примера получения 15 растворяли в диметилформамиде (20 мл). После добавления 720 мг (4,4 ммоль) N,N'-карбонилдиимидазола полученную смесь перемешивали при комнатной температуре в течение 30 минут. Затем к смеси добавляли 0,97 мл (8,8 ммоль) N,N-диметилэтилендиамина и полученную смесь перемешивали в течение ночи с последующим концентрированием. К остатку добавляли воду и полученную смесь экстрагировали смесью этилацетат-тетрагидрофуран. Органический слой извлекали, промывали последовательно насыщенным водным раствором бикарбоната натрия и водой и сушили над сульфатом магния. После концентрирования остаток очищали колоночной хроматографией на силикагеле с получением 250 мг 2,3-дигидро-N-[2-(диметиламино) этил]-3-оксо-6H-фуро[3,2-с]карбазол-7-карбоксиамида. Этот продукт растворяли в диметилформамиде (10 мл). После добавления 60 мг (1,5 ммоль) гидрида натрия (60% в масле) смесь перемешивали в атмосфере азота в течение 30 минут. После добавления 0,145 мл (1,5ммоль) этилхлорформиата при охлаждении льдом полученную смесь перемешивали в течение 30 минут и затем подкисляли добавлением к ней 1 н. соляной кислоты. После концентрирования добавляли насыщенный водный раствор бикарбоната натрия и полученную смесь экстрагировали смесью этилацетат-тетрагидрофуран. Органический слой извлекали, промывали водой, сушили над сульфатом магния, концентрировали и очищали колоночной хроматографией на силикагеле. Затем продукт суспендировали в этаноле (20 мл). После добавления 1 мл 1 н. соляной кислоты и перемешивания кристаллы извлекали фильтрованием с получением 175 мг соединения, указанного в названии примера.
Точка плавления: окрашивается приблизительно от 240oC и разлагается приблизительно при 270 - 273oC.
FAB-масс-спектрометрия m/z: 364 ([М+H]+).
1H-ЯМР (ДМСО-d6): δ (м. д. ): 2,89 (шир. с, 6H), 3,42-3,50 (м, 2H), 4,39-4,45 (м, 2H), 5,14 (с, 2H), 7,78 (т, J=7,7 Гц, 1H), 7,95 (д, J=8,4 Гц, 1H), 8,17 (дд, J=0,8; 7,7 Гц, 1H), 8,22 (д, J=8,4 Гц, 1H), 8,43 (дд, J=0,8; 7,7 Гц, 1H), 9,62 (шир. с, 1H).
Элементный анализ: как C20H17N3O4•HCl•0,15H2O
рассчитано: C 59,68; H 4,58; N 10,44;
найдено: C 59,64; H 4,49; N 10,33.
Пример 9
2,3-Дигидро-8-[2-(диметиламино)этил]-3-гидрокси-7H-фуро[3,2-с] пиримидо[5,6,1-jk]карбазол-7,9(8H)-дион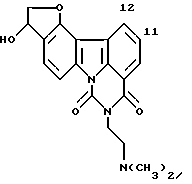
105,5 мг (0,29 ммоль) соединения Примера 8 растворяли в уксусной кислоте (1 мл). Затем добавляли 36 мкл 8 М комплекса боран/пиридин с перемешиванием при комнатной температуре. Полученную смесь перемешивали в течение 4,5 часов. После добавления 30 мкл 8 М комплекса борна/пиридин полученную смесь продолжали перемешивать в течение ночи и концентрировали. Затем ее экстрагировали добавлением воды, насыщенного водного раствора бикарбоната натрия и хлороформа. Органический слой сушили над безводным сульфатом натрия и концентрировали. Остаток очищали колоночной хроматографией на силикагеле. Полученный таким образом продукт перекристаллизовывали из смеси этанол/диизопропиловый эфир с получением 22,6 мг соединения, указанного в названии примера.
1H-ЯМР (ДМСО-d6): δ (м.д.):2,24 (с, 6H), 2,56 (т, J=6,8 Гц,2H), 4,15 (т, J=6,8 Гц, 2H), 4,56 (дд, J=2,8; 10,0 Гц, 1H), 4,84 (дд, J=6,8; 10,0 Гц, 1H), 5,43-5,49 (м, 1H), 5,80 (д, J= 5,6 Гц, 1H), 7,61-7,67 (м, 2H), 7,97 (д, J= 8,4 Гц, 1H), 8,02 (дд, J=0,8: 7,6 Гц, 1H), 8,22 (дд, J=0,8; 7,6 Гц, 1H)
Пример 10
Гидрохлорид 12,13-дигидро-5-[2-(метиламино)этил] -4H-бензо[с] пиримидо[5,6,1-jk] карбазол-4,6,10(5H,11H)-триона: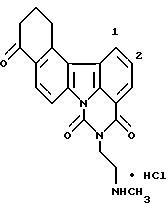
0,23 г (0,57 ммоль) соединения Примера получения 17 и 95 мг (0,1 ммоль) трис (трифенилфосфин) родийхлорида растворяли в 20 мл смеси ацетонитрила с водой (84: 16). Затем полученную смесь нагревали в атмосфере азота для отгонки растворителя, добавляя одновременно смесь ацетонитрила с водой (84:16) для поддержания на постоянном уровне объема смеси. После продолжения этой операции в течение ~ 3 часов исчезновение исходных соединений подтверждали тонкослойной хроматографией. Затем реакционную смесь концентрировали приблизительно до 1/4 и экстрагировали этилацетатом. Органический слой собирали, промывали последовательно разбавленным водным аммиаком и водным раствором хлорида натрия, сушили над сульфатом магния и концентрировали. Остаток очищали препаративной тонкослойной хроматографией и затем превращали в его гидрохлорид согласно способу, описанному в Примере 4 с получением 0,1 г соединения указанного в названии примера.
Точка плавления: окрашивается приблизительно от 250oC, постепенно разлагается приблизительно от 260oC и быстро разлагается при ~ 267 - 269oC.
FAB-масс-спектрометрия m/z: 362 ([М+H]+).
1H-ЯМР (ДМСО-d6•D2O): δ (м.д.): 2,24-2,34 (м, 2H), 2,59 (с, 3H), 2,76 (шир. т, J=6,0 Гц, 2H), 3,31 (шир. т, J=5,2 Гц, 2H), 3,56 (шир. т, J=6,0 Гц, 2H), 4,36 (шир. т, J=5,2 Гц, 2H), 7,75 (т, J=8,0 Гц, 1H), 8,16 (д, J=8,0 Гц, 1H), 8,24 (д, J=8,8 Гц, 1H). 8,39 (д, J=8,8 Гц, 1H), 8,59 (д, J=8,0 Гц, 1H)
Элементный анализ: как C21H19N3O3•HCl•0,2H2O
Рассчитано: C 62,83; H 5,12; N 10,47;
найдено: C 62,78; H 5,09; N 10,36.
Пример 11
Гидрохлорид 12,13-дигидро-5-[2-(1-пирролидинил)этил] -4H-бензo[c] пиpимидo[5,6,1-jk]кapбaзoл-4,6,10(5H,11H)-тpиoнa: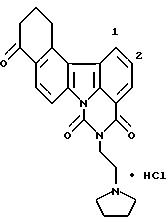
Соединение заголовка получали реакцией соединения Примера получения 7 с 1-(2-аминоэтил) пирролидином согласно способам, описанным в Примере получения 8 и Примере 4.
Точка плавления: окрашивается от приблизительно 235oC и постепенно разлагается от приблизительно 260oC.
FAB-масс-спектрометрия m/z: 402 ([М+H]+).
1H-ЯМР (ДМСО-d6): δ (м.д.) : 1,86 (шир. с, 2H), 2,01 (шир. с, 2H), 2,23- 2,32 (м, 2H), 2,71-2,79 (м, 2H), 3,15 (шир. с, 2H), 3,46-3,74 (шир. т+м, J= 6,0 Гц, 4H+2H), 4,40 (шир. т, J=5,2 Гц, 2H), 7,73 (т, J=8,0 Гц, 1H), 8,15 (д, J=8,0 Гц, 1H), 8,23 (д, J=8,8 Гц, 1H), 8,39 (д, J=8,8 Гц, 1H), 8,57 (д, J=8,0 Гц, 1H), 10,10 (шир. с, 1H).
Элементный анализ: как C24H23N3O3•HCl•1,5H2O
рассчитано: C 62,00; H 5,85; N 9,04;
найдено: C 62,27; H 5,49; N 9,03.
Пример 12
Гидрохлорид 5-[2-(1-пирролидинил)этил] -4H-бензо[с] пиримидо [5,6,1-jk] карбазол-4,6(5H)-диона:
Названное соединение получали реакцией соединения Примера получения 2 с 1-(2-аминоэтил)пирролидином согласно способам, описанным в Примере получения 3 и Примере 1.
FAB-масс-спектрометрия m/z: 384 ([М+H]+).
1H-ЯМР (ДМСО-d6):  (м. д. ): 1,78-1,92 (м, 2H), 1,94-2, 06 (м, 2H), 3,08-3,22 (м, 2H), 3,56 (т, J=5,6 Гц, 2H), 3,60-3,70 (м, 2H), 4,41 (т, J=5,6 Гц, 2H), 7,66 (т, J=7,6 Гц, 1H), 7,75 (т, J=8,0 Гц, 1H), 7,81 (т, J=8,0 Гц, 1H), 8,11 (д, J=7,6 Гц, 1H), 8,18(д, J=8,0 Гц, 1H), 8,21 (д, J=9,2 Гц, 1H), 8,60 (д, J= 9,2 Гц, 1H), 8,83 (д, J=8,0 Гц, 1H), 8,98 (д, J=7,6 Гц, 1H), 10,29 (шир. с, 1H).
(м. д. ): 1,78-1,92 (м, 2H), 1,94-2, 06 (м, 2H), 3,08-3,22 (м, 2H), 3,56 (т, J=5,6 Гц, 2H), 3,60-3,70 (м, 2H), 4,41 (т, J=5,6 Гц, 2H), 7,66 (т, J=7,6 Гц, 1H), 7,75 (т, J=8,0 Гц, 1H), 7,81 (т, J=8,0 Гц, 1H), 8,11 (д, J=7,6 Гц, 1H), 8,18(д, J=8,0 Гц, 1H), 8,21 (д, J=9,2 Гц, 1H), 8,60 (д, J= 9,2 Гц, 1H), 8,83 (д, J=8,0 Гц, 1H), 8,98 (д, J=7,6 Гц, 1H), 10,29 (шир. с, 1H).
Элементный анализ: как C24H21N3O3•HCl•H2O
рассчитано: C 65,83; H 5,52; N 9,60;
найдено: C 66,04; H 5,57; N 9,53.
Пример 13
Гидрохлорид 2-[2-(диметиламино)этил] -5-нитро-1H-бензо[с] пиримидо [5,6,1-kl]фенотиазин-1,3(2H)-диона: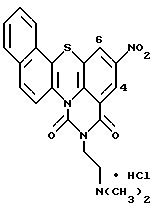
Раствор 200 мг (0,49 ммоль) соединения Примера получения 23 в тетрагидрофуране (15 мл) перемешивали при комнатной температуре и добавляли последовательно 0,5 мл триэтиламина и 200 мкл (2,09 ммоль) этилхлорформиата. После перемешивания при комнатной температуре в течение ночи реакционную смесь концентрировали и экстрагировали добавлением к ней воды, насыщенного водного раствора бикарбоната натрия и дихлорметана. Органический слой промывали последовательно водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния и концентрировали досуха. Остаток перекристаллизовывали из этанола с получением 104 мг свободного основания соединения заголовка. Затем этот продукт суспендировали в метаноле и добавляли концентрированную хлористоводородную кислоту при перемешивании. Затем полученную смесь концентрировали досуха с получением соединения, указанного в названии примера.
1H-ЯМР (ДМСО-d6): δ (м.д.):2,90 (с, 6H), 3,49 (шир. с, 2H). 4,38 (т, J= 5,6 Гц, 2H), 7,66 (т, J=7,6 Гц, 1H), 7,73 (т, J=7,6 Гц, 1H), 7,82 (д, J=9,2 Гц, 1H), 7,96 (т, J=8,8 Гц, 1H), 8,03 (д, J=8,0 Гц, 1H), 8,09 (д, J=8,4 Гц, 1H), 8,49-8,52 (м, 1H), 8,59-8,62 (м, 1H), 9,72 (шир. t, 1H)
Пример 14
Гидрохлорид 2-[2-(диметиламино)этил]-1H-пиримидо[5,6,1-jk]-тиено [3,2-a] карбазол-1,3(2H)-диона: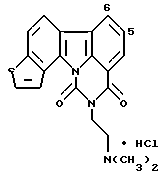
Названное соединение получали с использованием 4-оксо-4,5,6,7-тетрагидро-бензо[b]тиофена и гидрохлорида 2-гидразинобензойной кислоты в качестве исходных соединений и повторением процедур Примеров получения 1,2 и 3 и Примера 2.
1H-ЯМР (ДМСО-d6): δ (м. д. ): 2,92 (шир. с, 6H), 3,44-3,57 (м, 2H), 4,44-4,51 (м, 2H), 7,74 (т, J=7,6 Гц, 1H), 7,98 (д, J=5,6 Гц, 1H), 8,13 (дд, J= 0,8; 7,6 Гц, 1H), 8,26 (д, J=8,4 Гц, 1H), 8,36 (д, J=8,4 Гц, 1H), 8,65 (дд, J=0,8; 7,6 Гц, 1H), 8,84 (д, J=5,6 Гц, 1H), 9,53 (шир. с, 1H)
Пример 15
Гидрохлорид 2,3-дигидро-9-[2-(диметиламино)этил] -4H, 8H-пирано[3,2-с] пиримидо[5,6,1-jk]карбазол-4,8,10(9H)-триона: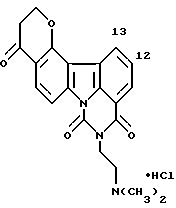
Названное соединение получали согласно процедуре, описанной в Примере 2.
FAB-масс-спектрометрия m/z: 378 ([М+H]+).
1H-ЯМР (ДМСО-d6): δ (м.д.): 2,88 (с, 6H), 2,99 (т, J=6,4 Гц, 2H), 3,46 (шир. с, 2H), 4,40 (шир. т, J=5,6 Гц, 2H), 4,89 (т, J=6,4 Гц, 2H), 7,73 (т, J= 7,6 Гц, 1H), 8,06 (д, J=8,4 Гц, 1H), 8,09 (д, J=8,4 Гц, 1H), 8,12 (д, J= 7,6 Гц, 1H), 8,42 (д, J=7,6 Гц, 1H), 9,68 (шир. с, 1H)
Элементный анализ: как C21H19N3O4•HCl•1,25H2O
рассчитано: C 57,80; H 5,20; N 9,63;
найдено: C 57,99; H 5,07; N 9,69.
Пример 16
Гидрохлорид 9-[2-(диметиламино)этил] -4H, 8H-пирано[3,2-с] пиримидо [5,6,1-jk]карбазол-4,8,10(9H)-триона: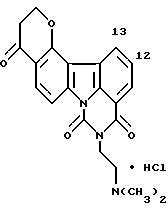
Названное соединение получали с использованием процедур Примера 2.
FAB-масс-спектрометрия m/z: 376 ([М+H]+).
1H-ЯМР (ДМСО-d6): 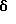 (м.д.): 2,89 (с, 6H), 3,46 (шир. с, 2H), 4,43 (шир. т, J= 5,6 Гц, 2H), 6,55 (д, J=6,0 Гц, 1H), 7,83 (т, J=7,6 Гц, 1H), 8,23 (дд, J=0,8, 7,6 Гц, 1H), 8,34 (д, J=8,8 Гц, 1H), 8,48 (д, J=8,8 Гц, 1H), 8,54 (д, J=6,0 Гц, 1H), 8,65 (дд, J=0,8; 7,6 Гц, 1H), 9,52 (шир. с, 1H)
(м.д.): 2,89 (с, 6H), 3,46 (шир. с, 2H), 4,43 (шир. т, J= 5,6 Гц, 2H), 6,55 (д, J=6,0 Гц, 1H), 7,83 (т, J=7,6 Гц, 1H), 8,23 (дд, J=0,8, 7,6 Гц, 1H), 8,34 (д, J=8,8 Гц, 1H), 8,48 (д, J=8,8 Гц, 1H), 8,54 (д, J=6,0 Гц, 1H), 8,65 (дд, J=0,8; 7,6 Гц, 1H), 9,52 (шир. с, 1H)
Пример 17
Гидрохлорид 9-[2-(диметиламино)этил] -1H-фуро[3,2-а]пиримидо [5,6,1-jk] карбазол-1,3(2H)-диона:
Соединение заголовка получали с использованием 4-оксо-4,5,6,7-тетрагидробензо[b] фурана и гидрохлорида 2-гидразинобензойной кислоты и повторением процедур Примеров получения 1, 2 и 3 и Примера 2.
1H-ЯМР (ДМСО-d6): δ (м.д.):2,91 (шир. с, 6H), 3,40-3,55 (м, 2H), 4,41-4,51 (м, 2H), 7,72 (т, J=7,6 Гц, 1H), 7,83 (д, J=2,0 Гц, 1H), 7,88 (д, J=8,4 Гц, 1H), 8,09 (д, J=7,6 Гц, 1H), 8,20 (д, J=2,0 Гц, 1H), 8,32 (д, J=8,4 Гц, 1H), 8,61 (д, J=7,6 Гц, 1H), 9,46 (шир. с, 1H)
Пример 18
Гидрохлорид 2-[2-(диметиламино)этил] -1H-бензо[a] пиримидо[5,6,1-jk] карбазол-1,3(2H)-диона: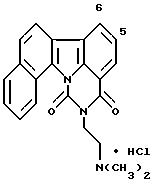
Соединение заголовка получали с использованием в качестве исходных соединений α -тетралона и гидрохлорида 2-гидразинобензойной кислоты и повторением процедур Примеров получения 1, 2 и 3 и Примера 2.
1H-ЯМР (ДМСО-d6): δ (м.д.): 2,89 (с, 6H), 4,49 (шир. с, 2H), 4,49 (т, J= 5,5 Гц, 2H), 7,64-7,71 (м, 2H), 7,74 (т, J=8,0 Гц, 1H), 8,11-8,18 (м, 3H), 8,44 (д, J= 8,3 Гц, 1H), 8,66 (д, J=8,0 Гц, 1H), 9,59 (шир. с, 1H), 9,76 (д, J=8,3 Гц, 1H)
Элементный анализ: как C22H19N3O2•HCl•0,2H2O
рассчитано: C 66,48; H 5,17; N 10,57;
найдено: C 66,47; H 5,20; N 10,51
Пример 19
Гидрохлорид 5-[3-(диметиламино)пропил] -4H-бензо[с] пиримидо[5,6,1-jk] карбазол-4,6(5H)-диона:
Соединение заголовка получали реакцией соединения Примера получения 2 с N, N-диметил-1,3-пропандиамином согласно процедуре, описанной в Примере получения 3 и Примере 1.
FAB-масс-спектрометрия m/z: 372 ([М+H]+).
1H-ЯМР (ДМСО-d6): δ (м.д.): 2,03-2,13 (м, 2H), 2, 74 (с, 6H), 3,19 (т, J= 8,0 Гц, 2H), 4,12 (т, J=6,0 Гц, 2H), 7,65 (т, J=7,2 Гц, 1H), 7,75 (т, J= 8,0 Гц, 1H), 7,81 (т, J=7,6 Гц, 1H), 8,10 (д, J=7,6 Гц, 1H), 8,16 (д, J=8,0 Гц, 1H), 8,19 (д, J=9,6 Гц, 1H), 8,58 (д, J=9,6 Гц, 1H), 8,80 (т, J=8,4 Гц, 1H), 8,94 (д, J=8,0 Гц, 1H), 9,69 (шир. с, 1H)
Элементный анализ: как C23H21N3O2•HCl•0,3H2O
рассчитано: C 66,84; H 5,51; N 10,17;
найдено: C 66,75; H 5,45; N 10,03.
Пример 20
Гидрохлорид 2-[2-(диметиламино)этил] -1H, 11H-индено[1',2': 4,5] пирроло[3,2,1-ij]хиназолин-1,3(2H)-диона: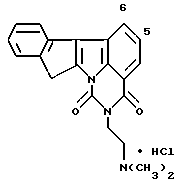
Соединение заголовка получали с использованием 2 - инданона и гидрохлорида 2-гидразинобензойной кислоты и повторением процедур Примеров получения 1 и 3 и Примера 2.
1H-ЯМР (ДМСО-d6): 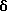 (м.д.):3,02 (с,6H), 3,53 (т, J=5,8 Гц, 2H), 4,10 (с, 2H), 4,50 (т, J=5,8 Гц, 2H), 7,28 (дт, J=1,2; 7,6 Гц, 1H), 7,41 (дт, J= 1,0; 7,6 Гц, 1H), 7,56-7,59 (м, 1H), 7,62 (т, J=7,7 Гц, 1H), 7,76-7,79 (м, 1H), 8,02 (дд, J=0,8; 7,7 Гц, 1H), 8,25 (дд, J=0,8; 7,7 Гц, 1H)
(м.д.):3,02 (с,6H), 3,53 (т, J=5,8 Гц, 2H), 4,10 (с, 2H), 4,50 (т, J=5,8 Гц, 2H), 7,28 (дт, J=1,2; 7,6 Гц, 1H), 7,41 (дт, J= 1,0; 7,6 Гц, 1H), 7,56-7,59 (м, 1H), 7,62 (т, J=7,7 Гц, 1H), 7,76-7,79 (м, 1H), 8,02 (дд, J=0,8; 7,7 Гц, 1H), 8,25 (дд, J=0,8; 7,7 Гц, 1H)
Пример 21
Гидрохлорид 7-[2-(диметиламино)этил] -6H,14H-бензо[а]пиримидо[5,6,1-de] акридин-6,8,14(7H)-триона: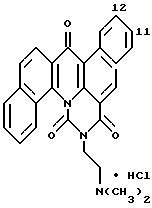
Названное соединение получали согласно процедуре, описанной в Примере 2.
1H-ЯМР (ДМСО-d6): δ (м.д.): 2,91 (шир. с, 6H), 3,50-3,56 (м, 2H), 4,49 (т, J=5,7 Гц, 2H), 7,64-7,69 (м, 1H), 7,77-7,82 (м, 1H), 7,87-7,92 (м, 1H), 7,98-8,03 (м, 1H), 8,37-8,40 (м, 1H), 8,43-8,46 (м, 1H), 8,63 (дд, J=0,5; 8,8 Гц, 1H), 9,26 (с, 1H), 9,81 (дд, J=0,7, 8,6 Гц, 1H), 10,04 (шир. с, 1H)
Пример 22
Гидрохлорид 5-[2-(диметиламино)этил] -11-метокси-4H-бензо- [с] пиримидо[5,6,1-jk]карбазол-4,6(5H)-диона:
Названное соединение получали с использованием 6-метокси- β -тетралона и гидрохлорида 2-гидразинобензойной кислоты и повторением процедур Примеров получения 24 и 3 и Примера 2.
1H-ЯМР (ДМСО-d6): δ (м.д.): 2,93 (д, J=4,6 Гц, 6H), 3,47-3,54 (м, 2H), 3,94 (с, 3H), 4,39-4,45 (м, 2H), 7,46 (дд, J=2,2; 9,0 Гц, 1H), 7,62 (д, J= 2,2 Гц, 1H), 7,78 (т, J=8,4 Гц, 1H), 8,14 (д, J=8,4 Гц, 1H), 8,16 (д, J=9,0 Гц, 1H), 8,59 (д, J=9,0 Гц, 1H), 8,78 (д, J=9,0 Гц, 1H), 9,01 (д, J=8,4 Гц, 1H), 9,16 (шир. с, 1H)
Элементный анализ: как C23H21N3O3•HCl•1,5H2O
рассчитано: C 61,26; H 5,59; N 9,32;
найдено: C 61,08; H 5,46; N 9,40.
Пример 23
Гидрохлорид 5-[2-(диметиламино)этил] -10-метокси-4H-бензо-[с] пиримидо[5,6,1-jk]карбазол-4,6(5H)-диона: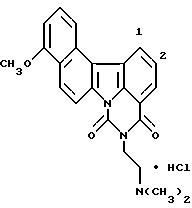
Названное соединение получали с использованием 5-метокси- β -тетралона и гидрохлорида 2-гидразинобензойной кислоты и повторением процедур Примеров получения 1, 2 и 3 и Примера 2.
1H-ЯМР (ДМСО-d6): δ (м.д.): 2,89 (с, 6H), 3,44-3,51 (м, 2H), 4,04 (с, 3H), 4,40 (т, J=6,2 Гц, 2H), 7,12 (д, J=8,2 Гц, 1H), 7,72 (т, J=8,5 Гц, 1H), 7,73 (дт, J= 3,4; 8,2 Гц, 1H), 8,09 (д, J=8,5 Гц, 1H), 8,32 (д, J=8,5 Гц, 1H), 8,41 (д, J=8,5 Гц, 1H), 8,52 (дд, J=1,0; 8,5 Гц, 1H), 8,88 (д, J=8,5 Гц, 1H), 9,93 (шир. с, 1H)
Элементный анализ: как C23H21N3O3•HCl•1,3H2O
рассчитано: C 61,76; H 5,54; N 9,40;
найдено: C 61,89; H 5,32; N 9,45.
Пример 24
Дигидрохлорид 2-[2-(диметиламино)этил]-1H-бензо[b]пиримидо-[1,6,5-lm]-4- азакарбазол-1,3(2H)-диона: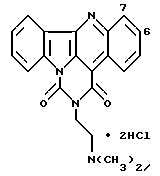
Названное соединение получали согласно способу, описанному в Примере 2.
1H-ЯМР (ДМСО-d6): δ (м.д.): 2,90 (с, 6H), 3,47-3,55 (м, 2H), 4,48 (т, J= 6,3 Гц, 2H), 7,67 (т, J=7,8 Гц, 1H), 7,86-7,95 (м, 3H), 8,36-8,44 (м, 3H), 9,24-9,29 (м, 1H), 10,41 (шир. с, 1H)
Пример 25
Гидрохлорид 1,2-дигидро-9-[2-(диметиламино)этил] -4H, 8H-пирано[3,4-с] пиримидо[5,6,1-jk]карбазол-4,8,10(9H)-триона: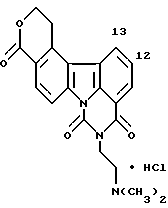
Названное соединение получали согласно способу, описанному в Примере 2.
1H-ЯМР (ДМСО-d6): δ (м.д.): 2,89 (с, 6H), 3,47 (т, J=6,0 Гц, 2H), 3,64 (т, J=6,0 Гц, 2H), 4,38 (т, J=6,0 Гц, 2H), 4,68 (т, J=6,0 Гц, 2H), 7,73 (т, J= 7,6 Гц, 1H), 8,15 (т, J=7,6 Гц, 1H), 8,27 (д, J=8,8 Гц, 1H), 8,44 (д, J= 8,8 Гц, 1H), 8,55 (д, J=7,6 Гц, 1H), 9,82 (шир. с, 1H)
Пример 26
Гидрохлорид 5-[2-(диметиламино)этил] -12-метокси-4H-бензо-[с] пиримидо [5,6,1-jk]карбазол-4,6(5H)-диона: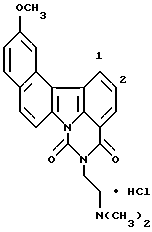
Названное соединение получали с использованием 7-метокси- β -тетралона и гидрохлорида 2-гидразинобензойной кислоты и повторением процедур Примеров 1,2 и 3 и Примера 2.
1H-ЯМР (ДМСО-d6): δ (м.д.):2,85 (шир. с, 6H), 3,35-3,46 (м, 2H), 4,08 (с, 3H), 4,39 (шир. с, 2H), 7,32 (дд, J=2,2; 8,8 Гц, 1H), 7,79 (т, J=7,8 Гц, 1H), 7,99 (д, J=1,7 Гц, 1H), 8,09-8,19 (м, 3H), 8,48 (д, J=8,8 Гц, 1H), 8,97 (д, J=7,8 Гц, 1H), 9,25 (шир. с, 1H)
Пример 27
Гидрохлорид 2-[2-(диметиламино)этил] -5-нитро-1H-бензо-[b] пиримидо [5,6,1-jk]феноксазин-1,3(2H)-диона: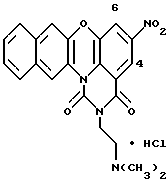
304 мг (1,91 ммоль) 3-амино-2-нафтола, 477 мг (1,81 ммоль) метил 2-хлор-3,5-динитрбензоата и 178 мг (2,17 ммоль) ацетата натрия суспендировали в смеси воды (5 мл) с этанолом (10 мл) и нагревали с обратным холодильником в течение 7 часов. После добавления 3 мл 2 н. водного раствора гидроксида натрия реакционную смесь нагревали с обратным холодильником еще в течение 2,5 часов и затем давали ей остыть до комнатной температуры. После добавления 10 мл 1 н. соляной кислоты полученный таким образом осадок извлекали фильтрованием и промывали последовательно водой, 1 н. соляной кислотой и этанолом с получением 430 мг 3-нитро-12H-бензо[b] феноксазин-1 карбоновой кислоты. Затем этот продукт обрабатывали согласно способам, описанным в Примере получения 23 и Примере 13, с получением соединения, указанного в названии примера.
1H-ЯМР (ДМСО-d6):  (м.д.): 2,89 (с, 6H), 3,45 (т, J=5,2 Гц, 2H), 4,40 (т, J=5,2 Гц, 2H), 7,47 (т, J=8,0 Гц, 1H), 7,52 (т, J=8,0 Гц, 1H), 7,69 (с, 1H), 7,86 (д, J=6,8 Гц, 1H), 7,88 (д, J=8,0 Гц, 1H), 8,19 (д, J=2,4 Гц, 1H), 8,34 (д, J=2,4 Гц, 1H), 9,05 (с, 1H), 9,82 (шир. с, 1H)
(м.д.): 2,89 (с, 6H), 3,45 (т, J=5,2 Гц, 2H), 4,40 (т, J=5,2 Гц, 2H), 7,47 (т, J=8,0 Гц, 1H), 7,52 (т, J=8,0 Гц, 1H), 7,69 (с, 1H), 7,86 (д, J=6,8 Гц, 1H), 7,88 (д, J=8,0 Гц, 1H), 8,19 (д, J=2,4 Гц, 1H), 8,34 (д, J=2,4 Гц, 1H), 9,05 (с, 1H), 9,82 (шир. с, 1H)
Пример 28
Гидрохлорид 2-хлор-5-[2-(диметиламино)этил] -4H-бензо[с] пиримидо [5,6,1-jk]карбазол-4,6(5H)-диона:
Названное соединение получали с использованием в качестве исходных соединений β -тетралона и гидрохлорида 5-хлор-2-гидразинобензойной кислоты и повторением процедур Примеров получения 1,2 и 3 и Примера 2.
1H-ЯМР (ДМСО-d6): δ (м.д.): 2,89 (с, 6H), 3,39-3,53 (м, 2H), 4,38-4,48 (м, 2H), 7,68-7,75 (м, 1H), 7,81-7,89 (м, 1H), 8,13 (д, J=1,6 Гц, 1H), 8,22 (д, J=8,4 Гц, 1H), 8,31 (д, J= 8,8 Гц, 1H), 8,63 (д, J=8,8 Гц, 1H), 8,94 (д, J=8,4 Гц, 1H), 9,14 (д, J=1,6 Гц, 1H), 9,46 (шир. с, 1H)
Элементный анализ: как C22H18N3O2Cl•HCl•1,75H2O
рассчитано: C 57,46; H 4,93; N 9,14;
найдено: C 57,65; H 4,57; N 8,76.
Пример 29
Гидрохлорид 9-[2-(диметиламино)этил]-8H-пиридо[4,3-с]пиримидо [5,6,1-jk] карбазол-1,8,10(2H,9H)-триона:
Названное соединение получали омылением сложного эфира соединения Примера получения 20 и затем повторением процедур Примера получения 3 и Примера 2.
1H-ЯМР (ДМСО-d6): δ (м. д. ): 2,90 (шир. с, 6H), 3,43-3,53 (м, 2H), 4,40-4,46 (м, 2H), 6,80-6,83 (м, 1H), 7,34-7,38 (м, 1H), 7,73 (т, J=7,9 Гц, 1H), 8,01 (д, J=8,9 Гц, 1H), 8,18 (дд, J=0,9, 7,9 Гц, 1H), 8,89 (д, J=8,9 Гц, 1H), 9,52 (шир. с, 1H), 9,91 (дд, J=0,9; 7,9 Гц, 1H), 11,67-11,71 (м, 1H)
Элементный анализ: как C21H18N4O3•HCl•1,3H2O
рассчитано: C 58,08; H 5,01; N 12,90;
найдено: C 57,94; H 4,78; N 12,72.
Пример 30
Гидрохлорид 5-[2-(диметиламино)этил] -4H-хино[4', 3', -4,5] пирроло[3,2,1-ij]хиназолин-4,6(5H)-диона: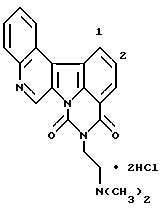
Названное соединение получали согласно способу, описанному в Примере получения 2.
FAB-масс-спектрометрия m/z: 359 ([М+H]+)+]/
1H-ЯМР (ДМСО-d6+D2O): δ (м.д.): 2,94 (с, 6H), 3,54 (шир. т, J=5,6 Гц, 2H), 4,47 (шир. т, J=5,6 Гц, 2H), 7,89 (т, J=7,6 Гц, 1H), 7,91-7,99 (м, 2H), 8,30-8,37 (м, 2H), 8,89-8,95 (м, 1H), 9,16 (д, J=7,6 Гц, 1H), 9,97 (с, 1H)
Элементный анализ: как C21H18N4O2•2HCl•0,5H2O
рассчитано: C 57,28; H 4,81; N 12,72;
найдено: C 57,28; H 4,97; N 12,60.
Пример 31
Гидрохлорид 5-амино-2-[2-(диметиламино)этил] -1H-бензо[b] пиримидо [5,6,1-kl]феноксазин-1,3(2H)-диона:
268 мг (0,641 ммоль) свободного основания соединения Примера 27 растворяли в уксусной кислоте (10 мл) и добавляли 10% палладий на угле. Затем проводили каталитическое восстановление при комнатной температуре в атмосфере азота. После отфильтровывания палладия на угле через целит фильтрат концентрировали. Затем к нему добавляли воду и насыщенный водный раствор бикарбоната натрия и полученную смесь перемешивали при комнатной температуре. Осадок извлекали фильтрованием, промывали водой и суспендировали в метаноле. После добавления концентрированной соляной кислоты полученную смесь перемешивали при комнатной температуре. Таким образом ее превращали в гомогенный раствор и затем образовывался осадок. Этот осадок извлекали фильтрованием с получением 179 мг соединения указанного в названии примера.
1H-ЯМР (ДМСО-d6): δ (м.д.): 2,89 (с, 6H), 3,43 (т, J=5,6 Гц, 2H), 4,34 (т, J= 5,6 Гц, 2H), 6,76 (с, 1H), 6,96 (с, 1H), 7,38-7,48 (м, 2H), 7,59 (с, 1H), 7,79 (д, J= 8,0 Гц, 1H), 7,81 (д, J=8,0 Гц, 1H), 9,15 (с, 1H), 9,65 (шир. с, 1H)
Пример 32
Гидрохлорид 5-[2-(диметиламино)этил] -13-метокси-4H-бензо[с] пиримидо [5,6,1-jk]карбазол-4,6(5H)-диона;
Названное соединение получали с использованием 8-метокси- β -тетралона и гидрохлорида 2-гидразинобензойной кислоты в качестве исходных соединений и повторением процедур Примеров получения 1,2 и 3 и Примера 2.
1H-ЯМР (ДМСО-d6+D2O): δ (м.д.): 2,91 (шир. с, 6H), 3,40-3,53 (м, 2H), 4,23 (с, 3H), 4,40-4,49 (м, 2H), 7,33 (д, J=7,6 Гц, 1H), 7,61 (, J=8,0 Гц, 1H), 7,72-7,79 (м, 2H), 8,15 (д, J=8,0 Гц, 1H), 8,20 (д, J=8,8 Гц, 1H), 8,82 (д, J=8,8 Гц, 1H), 9,09 (д, J=8,0 Гц, 1H), 9,35 (шир. с, 1H)
Элементный анализ: как C23H21N3O3•HCl•0,65H2O
рассчитано: C 63,42; H 5,39; N 9,65;
найдено: C 63,31; H 5,14; N 9,68.
Пример 33
Дигидрохлорид 9-[2-(диметиламино)этил] -8H-пиридо[4,3, -с] пиримидо[5,6,1-jk]карбазол-8,10(9H)-диона;
300 мг (1,1 ммоль) соединения Примера получения 21 растворяли в смеси тетрагидрофуран (10 мл) - метанол (10 мл). После добавления 5 мл 1 н. гидроксида натрия полученную смесь нагревали с обратным холодильником в течение 1 часа. Затем 7H-пиридо[4,3-с] карбазол-8-карбоновую кислоту, выделенную общепринятым способом, растворяли в диметилформамиде (40 мл) и добавляли к раствору 360 мг (2,2 ммоль) N,N'-карбонилдиимидазола. После перемешивания при комнатной температуре в течение 30 минут добавляли 0,48 мл (4,4 ммоль) N, N-диметилэтилендиамина и полученную смесь перемешивали в течение ночи. После концентрирования ее экстрагировали добавлением воды и этилацетата. Органический слой собирали, промывали последовательно насыщенным водным раствором бикарбоната натрия и водой и сушили над безводным сульфатом магния. После концентрирования остаток очищали колоночной хроматографией на силикагеле с получением 250 мг N-[2-(диметиламино)этил]-7H-пиридо[4,3-с]карбазол-8- карбоксамида. Затем этот продукт использовали в реакции и обрабатывали, как описано в Примере 2, с получением 110 мг соединения, указанного в названии примера.
Точка плавления: окрашивается от приблизительно 270oC и разлагается при 279oC.
1H-ЯМР (ДМСО-d6): δ (м.д.): 2,89-2,93 (м, 6H), 3,49-3,54 (м, 2H), 4,46 (т, J=6,0 Гц, 2H), 7,85 (т, J=7,6 Гц, 1H), 8,25 (д, J=7,6 Гц, 1H), 8,40-8,44 (м, 2H), 8,79 (д, J=6,4 Гц, 1H), 9,04 (д, J=9,2 Гц, 1H), 9,23 (д, J=7,6 Гц, 1H), 10,10 (шир. с, 1H), 10,44 (с, 1H)
Элементный анализ: C21H18N4O2•2HCl•2H2O
рассчитано: C 53,97; H 5,18; N 11,99;
найдено: C 54,11; H 4,99; N 11,99
Пример 34 Гидрохлорид
5-[4-(диметиламино)бутил] -4H-бензо[с] пиримидо-[5,6,1-jk] карбазол-4,6 (5H)-диона: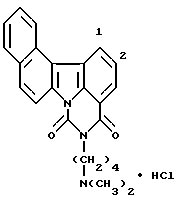
Соединение заголовка получали реакцией соединения Примера получения 2 с N, N-диметил-1,4-бутандиамином согласно способам, описанным в Примере получения 3 и Примере 1.
FAB-масс-спектрометрия m/z: 386 ([М+H]+).
1H-ЯМР (ДМСО-d6): 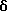 (м.д.): 1,68-1,85 (м, 4H), 2,74 (с, 6H), 3,09 (шир. т, J= 6,4 Гц, 2H), 4,10 (шир. т, J=6,4 Гц, 2H), 7,64-7,70 (м, 1H), 7,75 (т, J=7,6 Гц, 1H), 7,79-7,85 (м, 1H), 8,11 (д, J=7,6 Гц, 1H), 8,16-8,24 (м, 2H), 8,62 (д, J=8,8 Гц, 1H), 8,83 (д, J=8,4 Гц, 1H), 8,97 (д, J=7,6 Гц, 1H), 9,99 (шир. с, 1H)
(м.д.): 1,68-1,85 (м, 4H), 2,74 (с, 6H), 3,09 (шир. т, J= 6,4 Гц, 2H), 4,10 (шир. т, J=6,4 Гц, 2H), 7,64-7,70 (м, 1H), 7,75 (т, J=7,6 Гц, 1H), 7,79-7,85 (м, 1H), 8,11 (д, J=7,6 Гц, 1H), 8,16-8,24 (м, 2H), 8,62 (д, J=8,8 Гц, 1H), 8,83 (д, J=8,4 Гц, 1H), 8,97 (д, J=7,6 Гц, 1H), 9,99 (шир. с, 1H)
Элементный анализ: C24H23N3O2•HCl•0,5H2O
рассчитано: C 66,89; H 5,85; N 9,75;
найдено: C 66,54; H 5,71; N 9,66.
Пример 35
Гидрохлорид 11-циано-5-[2-(диметиламино)этил] -4H-бензо[с] пиримидо[5,6,1-jk]карбазол-4,6(5H)-диона:
Названное соединение получали по способу, описанному в Примере 2.
1H-ЯМР (ДМСО-d6): δ (м.д.): 2,93 (с, 6H), 3,48-3,55 (м, 2H), 4,46 (т, J= 5,6 Гц, 2H), 7,83 (т, J=8,2 Гц, 1H), 8,10 (дд, J=1,3, 8,9 Гц, 1H), 8,21 (д, J= 8,2 Гц, 1H), 8,38 (д, J=8,9 Гц, 1H), 8,79 (д, J=8,9 Гц, 1H), 8,88 (д, J= 1,3 Гц, 1H), 9,04 (д, J=8,9 Гц, 1H), 9,10 (д, J=8,2 Гц, 1H)
Пример 36
Дигидрохлорид 9-[2-(диметиламино)этил] -8H-пиридо[2,3-с] пиримидо [5,6,1-jk]карбазол-8,10(9H)-диона: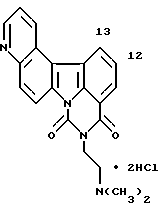
Названное соединение получали, как описано в Примере 2.
1H-ЯМР (ДМСО-d6): δ (м.д.): 2,92 (с, 3H), 2,93 (с, 3H), 3,46-3,58 (м, 2H), 4,41-4,51 (м, 2H), 7,82 (т, J=8,0 Гц, 1H), 7,92 (дд, J=4,8; 8,4 Гц, 1H), 8,21 (д, J=8,0 Гц, 1H), 8,40 (д, J=9,2 Гц, 1H), 8,92 (д, J=9,2 Гц, 1H), 9,10 (д, J=8,0 Гц, 1H), 9,14 (дд, J=0,8; 4,8 Гц, 1H), 9,47 (дд, J=0,8; 8,4 Гц, 1H), 9,86 (шир. с, 1H)
Элементный анализ: C21H18N4O2•2HCl•0,75H2O
рассчитано: C 56,70; H 4,87; N 12,59;
найдено: C 56,78; H 4,82; N 12,36.
Пример 37
Гидрохлорид 5-[2-(диметиламино)этил] -2-нитро-4H-бензо[с] пиримидо [5,6,1-jk]карбазол-4,6(5H)-диона: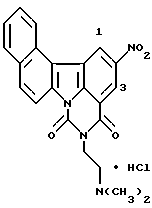
Названное соединение получали с использованием β-тетралона и 5-нитро-2-гидразинобензойной кислоты в качестве исходных продуктов и повторением процедур Примеров получения 1,2 и 3 и Примера 2.
1H-ЯМР (ДМСО-d6): δ (м.д.): 2,89 (с, 6H), 3,44-3,52 (м, 2H), 4,45 (т, J= 5,2 Гц, 2H), 7,73 (т, J=8,1 Гц, 1H), 7,90 (т, J=8,1 Гц, 1H), 8,23 (д, J=8,1 Гц, 1H), 8,35 (д, J=9,2 Гц, 1H), 8,63 (д, J =9,2 Гц, 1H), 8,80 (д, J=1,8 Гц, 1H), 8,94 (д, J=8,1 Гц, 1H), 9,64 (д, J=1,8 Гц, 1H), 9,75 (шир. с, 1H)
Пример 38
Гидрохлорид 5-[2-(диметиламино) этил] -2-метил-4H-бензо[с] пиримидо [5,6,1-jk]карбазол-4,6(5H)-диона: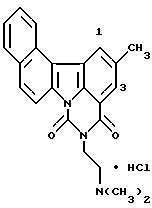
Названное соединение получали с использованием β -тетралона и гидрохлорида 2-гидразино-5-метилбензойной кислоты и повторением процедур Примеров получения 1,2 и 3 и Примера 2.
1H-ЯМР (ДМСО-d6): 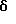 (м.д.): 2,71 (с, 3H), 2,90 (шир. с, 6H), 3,38-3,55 (м, 2H), 4,39-4,46 (м, 2H), 7,66-7,72 (м, 1H), 7,81-7,88 (м, 1H), 7,97-8,00 (м, 1H), 8,18-8,23 (м, 1H), 8,22-8,27 (м, 1H), 8,63 (д, J=9,2 Гц, 1H), 8,88-8,95 (м, 2H)
(м.д.): 2,71 (с, 3H), 2,90 (шир. с, 6H), 3,38-3,55 (м, 2H), 4,39-4,46 (м, 2H), 7,66-7,72 (м, 1H), 7,81-7,88 (м, 1H), 7,97-8,00 (м, 1H), 8,18-8,23 (м, 1H), 8,22-8,27 (м, 1H), 8,63 (д, J=9,2 Гц, 1H), 8,88-8,95 (м, 2H)
Элементный анализ: C23H21N3O2•HCl•1,5H2O
рассчитано: C 63,52; H 5,79; N 9,66;
найдено: C 63,63; H 5,48; N 9,70.
Пример 39
Гидрохлорид 1,2-дигидро-9-[2-(диметиламино)этил] -8H-пиридо [3,4-с]пиримидо[5,6,1-jk]карбазол-4,8,10(3H,9H)-триона: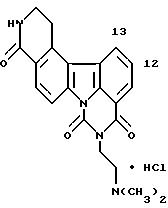
Названное соединение получали, как описано в Примере 2.
1H-ЯМР (ДМСО-d6): δ (м. д. ): 2,88 (шир. с, 6H), 3,37-3,52 (м, 2H), 3,50-3,64 (м, 4H), 4,36-4,44 (м, 2H), 7,73 (т, J=7,6 Гц, 1H), 8,11 (шир. с, 1H), 8,15 (дд, J=0,8; 7,6 Гц, 1H), 8,22 (д, J=8,4 Гц, 1H), 8,40 (д, J=8,4 Гц, 1H), 8,57 (дд, J=0,8; 7,6 Гц, 1H)
Элементный анализ: C21H20N4O3•HCl•H2O
рассчитано: C 58,54; H 5,38; N 13,00;
найдено: C 58,50; H 5,49; N 12,77.
Пример 40
Гидрохлорид 8-[2-(диметиламино) этил] -7H-1,3-диоксоло[4,5-с] пиримидо [5,6,1-jk]карбазол-7,9(8H)-диона: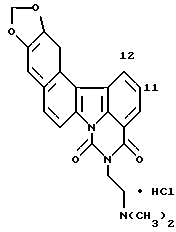
Названное соединение получали, как описано в Примере 2.
1H-ЯМР (ДМСО-d6): δ (м. д. ): 2,90 (шир. с, 6H), 3,42-3,49 (м, 2H), 4,36-4,42 (м, 2H), 6,35 (с, 2H), 7,29 (д, J=8,4 Гц, 1H), 7,68 (т, J=7,7 Гц, 1H), 7,89 (д, J=8,4 Гц, 1H), 8,10 (дд, J=0,8; 7,7 Гц, 1H), 8,27 (дд, J=0,8; 7,7 Гц, 1H), 9,35 (шир. c, 1H)
Пример 41
Гидрохлорид 11-бром-5-[2-(диметиламино)этил] -4H-бензо[с] пиримидо [5,6,1-jk]карбазол-4,6(5H)-диона: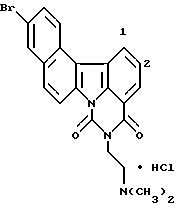
Названное соединение получали с использованием 6-бром- β -тетралона и гидрохлорида 2-гидразинобензойной кислоты и повторением процедур Примеров получения 1, 2 и 3 и Примера 2.
FAB-масс-спектрометрия m/z: 436 ([М+H]+), 438 ([М+2+H]+).
1H-ЯМР (ДМСО-d6):  (м.д.): 2,90 (с, 6H), 3,48 (шир. с, 2H), 4,42 (т, J= 5,6 Гц, 2H), 7,77 (т, J=7,6 Гц, 1H), 7,89 (дд, J = 2,0; 8,8 Гц, 1H), 8,14 (д, J=7,2 Гц, 1H), 8,20 (д, J=8,8 Гц, 1H), 8,47 (д, J=2,0 Гц, 1H), 8,63 (д, J=8,8 Гц, 1H), 8,79 (д, J=9,2 Гц, 1H), 8,97 (д, J=8,0 Гц, 1H), 9,74 (шир. с, 1H)
(м.д.): 2,90 (с, 6H), 3,48 (шир. с, 2H), 4,42 (т, J= 5,6 Гц, 2H), 7,77 (т, J=7,6 Гц, 1H), 7,89 (дд, J = 2,0; 8,8 Гц, 1H), 8,14 (д, J=7,2 Гц, 1H), 8,20 (д, J=8,8 Гц, 1H), 8,47 (д, J=2,0 Гц, 1H), 8,63 (д, J=8,8 Гц, 1H), 8,79 (д, J=9,2 Гц, 1H), 8,97 (д, J=8,0 Гц, 1H), 9,74 (шир. с, 1H)
Элементный анализ: C22H18N3O2Br•HCl•0,6H2O
рассчитано: C 54,64; H 4,21; N 8,69;
найдено: C 54,36; H 3,94; N 8,56.
Пример 42
Гидрохлорид 2-[2-(диметиламино)этил] -1H-бензо[b] пиримидо[5,6,1-jk] карбазол-1,3(2H)-диона:.
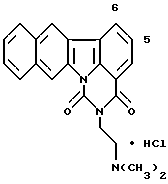
Названное соединение получали, как описано в Примере 2.
FAB-масс-спектрометрия m/z: 358 ([M+H]+).
1H-ЯМР (ДМСО-d6): δ (м. д. ): 2,90 (шир. с, 6H), 3,39-3,53 (м, 2H), 4,37-4,48 (м, 2H), 7,60-7,70 (м, 2H), 7,73 (т, J=7,6 Гц, 1H), 8,13 (дд, J= 0,8; 7,6 Гц, 1H), 8,16-8,20 (м, 1H), 8,21-8,26 (м, 1H), 8,66 (дд, J=0,8; 7,6 Гц, 1H), 8,86 (с, 1H), 8,93 (с, 1H)
Элементный анализ: C22H19N3O2•HCl
рассчитано: C 67,09; H 5,12; N 10,67;
найдено: C 66,94; H 5,22; N 10,65.
Пример 43
Гидрохлорид 5-[2-(диметиламино)этил]-10,11,12,13-тетрагидро-4H-бензо[b] пиримидо[5,6,1-jk]карбазол-4,6(5H)-диона:
Названное соединение получали из соединения Примера 4, как описано в Примере 5.
FAB-масс-спектрометрия m/z: 362 ([М+H]+).
1H-ЯМР (ДМСО-d6): δ (м.д.): 1,79-2,01 (м, 4H), 2,89 (с, 6H), 2,90 (шир. т, J=6,0 Гц, 2H), 3,24 (шир. т, J=6,0 Гц, 2H), 3,46 (шир. т, J=5,6 Гц, 2H), 4,39 (шир. т, J=6,0 Гц, 2H), 7,38 (д, J=8,8 Гц, 1H), 7,65 (т, J=8,0 Гц, 1H), 8,06 (д, J= 8,0 Гц, 1H), 8,13 (д, J=8,8 Гц, 1H), 8,41 (дд, J=0,8; 8,0 Гц, 1H), 9,74 (шир. с, 1H)
Элементный анализ: C22H23N3O2•HCl•0,75H2O
рассчитано: C 64,23; H 6,25; N 10,21;
найдено: C 64,35; H 6,20; N 10,15.
Пример 44
Гидрохлорид 12,13-дигидро-11,11-диметил-5-[2-(диметиламино)этил] -4H-бензо [с]пиримидо[5,6,1-jk]карбазол-4,6,10 (5H,11H)-триона: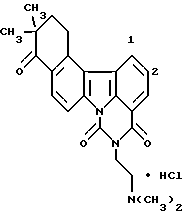
Названное соединение получали, как описано в Примере 2.
1H-ЯМР (ДМСО-d6): δ (м.д.): 1,20 (с, 6H), 2,13 (т, J=6,1 Гц, 2H), 2,88 (с, 6H), 3,43 (шир. с, 2H), 3,52 (т, J=6,1 Гц, 2H), 4,38 (т, J=5,7 Гц, 2H), 7,71 (т, J=7,4 Гц, 1H), 8,11 (д, J=7,4 Гц, 1H), 8,20 (д, J=8,8 Гц, 1H), 8,35 (д, J=8,8 Гц, 1H), 8,54 (д, J=7,4 Гц, 1H), 10,08 (шир. с, 1H)
Элементный анализ: C24H25N3O3•HCl•H2O
рассчитано: C 62,94; H 6,16; N 9,18;
найдено: C 63,06; H 6,27; N 9,14.
Пример 45
Гидрохлорид 5-[2-(диметиламино)этил] -2-метокси-4H-бензо[с пиримидо [5,6,1-jk]карбазол-4,6 (5H)-диона: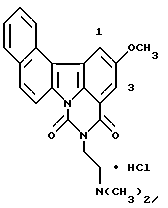
Названное соединение получали с использованием β тетралона и гидрохлорида 2-гидразино-5-метоксибензойной кислоты и повторением процедур Примеров получения 1,2 и 3 и Примера 2.
1H-ЯМР (ДМСО-d6): δ (м.д.): 2,89 (шир. с, 6H), 3,40-3,52 (м, 2H), 4,03 (с, 3H), 4,40 (т, J=6,0 Гц, 2H), 7,60 (д, J=2,4 Гц, 1H), 7,63-7,70 (м, 1H), 7,76-7,85 (м, 1H), 8,17 (дд, J=0,4; 8,4 Гц, 1H), 8,21 (д, J=8,8 Гц, 1H), 8,49 (д, J= 2,4 Гц, 1H), 8,57 (д, J=8,8 Гц, 1H), 8,84 (дд, J=0,4; 8,4 Гц, 1H), 9,57 (шир. с, 1H)
Элементный анализ: C23H21N3O3•HCl•H2O
рассчитано: C 62,51; H 5,47; N 9,51;
найдено: C 62,44; H 5,22; N 9,48.
Пример 46
Гидрохлорид 5-[2-(диметиламино)этил] -11-гидрокси-4H-бензо[с] пиримидо[5,6,1-jk]карбазол-4,6 (5H)-диона: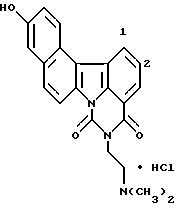
Соединение Примера 22 нагревали с обратным холодильником в 47% бромистоводородной кислоте. Затем реакционную смесь каталитически восстанавливали при комнатной температуре с использованием палладия на угле в качестве катализатора. Полученный продукт превращали в гидрохлорид общепринятым способом с получением соединения, указанного в названии примера.
1H-ЯМР (ДМСО-d6): δ (м.д.): 2,92 (д, J=5,5 Гц, 6H), 3,48 (к, J=5,5 Гц, 2H), 4,41 (т, J=5,5 Гц, 2H), 7,36-7,42 (м, 2H), 7,73 (т, J=8,1 Гц, 1H), 8,00 (д, J=9,4 Гц, 1H), 8,11 (д, J=8,1 Гц, 1H), 8,49 (д, J=8,1 Гц, 1H), 8,71 (д, J=9,4 Гц, 1H), 8,94 (д, J=8,1 Гц, 1H), 9,60 (шир. с, 1H), 10,01 (шир. с, 1H)
Пример 47
Дигидрохлорид 2-амино-5-[2-(диметиламино) этил] -4H-бензо[с] пиримидо [5,6,1-jk]карбазол-4,6 (5H)-диона:
Соединение Примера 37 гидрировали в присутствии катализатора палладия на угле при обычной температуре при атмосферном давлении с получением соединения, указанного в названии примера.
1H-ЯМР (ДМСО-d6): δ (м.д.): 2,89 (д, J=4,1 Гц, 6H), 3,44-3,51, (м, 2H), 4,40 (т, J=5,8 Гц, 2H), 7,67 (т, J=8,2 Гц, 1H), 7,77 (с, 1H), 7,84 (т, J=8,2 Гц, 1H), 8,19 (д, J=8,2 Гц, 1H), 8,22 (д, J=9,3 Гц, 1H), 8,57 (д, J=9,3 Гц, 1H), 8,61 (д, J=8,2 Гц, 1H), 8,63 (с, 1H), 9,94 (шир. с, 1H)
Пример 48
Гидрохлорид 5-[2-(диметиламино)этил]-11-(4-метилбензолсульфонамидо)-4H- бензо[с]пиримидо[5,6,1-jk]карбазол-4,6 (5H)-диона: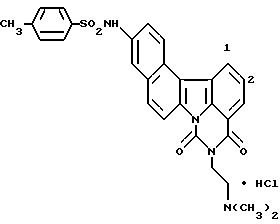
Соединение Примера получения 24 обрабатывали, как описано в Примере получения 3, с получением N-[2-(диметиламино)этил]-3- (4-метилбензолсульфонамидо)-7H-бензо[с]карбазол-8- карбоксамида. Затем этот продукт реагировал с гидридом натрия и этилхлорформиатом в диметилформамиде при охлаждении льдом с образованием 5-[2-(диметиламино)этил]-11-(N-этоксикарбонил-4 -метилбензолсульфонамидо)-4H-бензо[с] пиримидо[5,6,1-jk] карбазол-4,6(5H)-диона. Затем этот продукт обрабатывали 1 н. водным раствором гидроксида натрия в смеси метанол-тетрагидрофуран (1:1) и затем превращали в гидрохлорид общепринятым способом с последующей перекристаллизацией из этанола с получением соединения, указанного в названии примера.
1H-ЯМР (ДМСО-d6):  (м.д.): 2,28 (с, 3H), 2,90 (с, 6H), 3,48 (шир. с, 2H), 4,41 (т, J=5,6 Гц, 2H), 7,33 (д, J=9,2 Гц, 2H), 7,60 (д, J=8,8 Гц, 1H), 7,70-7,78 (м, 3H), 7,82 (с, 1H), 8,09 (д, J=9,2 Гц, 1H), 8,12 (д, J=8,0 Гц, 1H), 8,54 (д, J=8,4 Гц, 1H), 8,76 (д, J =8,4 Гц, 1 H), 8,94 (д, J=8,4 Гц, 1H), 9,56 (шир. с, 1H), 10,68 (с, 1H)
(м.д.): 2,28 (с, 3H), 2,90 (с, 6H), 3,48 (шир. с, 2H), 4,41 (т, J=5,6 Гц, 2H), 7,33 (д, J=9,2 Гц, 2H), 7,60 (д, J=8,8 Гц, 1H), 7,70-7,78 (м, 3H), 7,82 (с, 1H), 8,09 (д, J=9,2 Гц, 1H), 8,12 (д, J=8,0 Гц, 1H), 8,54 (д, J=8,4 Гц, 1H), 8,76 (д, J =8,4 Гц, 1 H), 8,94 (д, J=8,4 Гц, 1H), 9,56 (шир. с, 1H), 10,68 (с, 1H)
Пример 49
Дигидрохлорид 11-амино-5-[2-(диметиламино) этил] -4H-бензо[с] пиримидо[5,6,1-jk]карбазол-4,6(5H)-диона: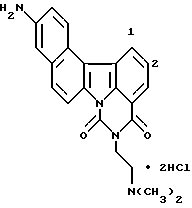
341 мг (0,648 ммоль) свободного основания соединения Примера 48 и 419 мг (4,45 ммоль) фенола нагревали с обратным холодильником в 47% бромистоводородной кислоте (15 мл) в течение 9 часов и 30 минут и затем давали остыть до комнатной температуры. Затем реакционную смесь подщелачивали добавлением к ней насыщенного водного раствора бикарбоната натрия. Затем полученную смесь экстрагировали добавлением к ней этилацетата и тетрагидрофурана. Органический слой промывали последовательно водой и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Органический слой концентрировали и полученный остаток перекристаллизовывали из этанола с получением 141 мг свободного основания соединения заголовка. Затем это свободное основание превращали в гидрохлорид общепринятым способом с получением соединения, указанного в названии примера.
(Свободное основание) 1H-ЯМР (ДМСО-d6): δ (м.д.): 2,22 (с, 6H), 2,55 (т, J=6,8 Гц, 2H), 4,14 (т, J=6,8 Гц, 2H), 5,50-5,53 (м, 2H), 7,06 (д, J=2,0 Гц, 1H), 7,22 (дд, J=2,4; 9,2 Гц, 1H), 7,67 (т, J=8,0 Гц, 1H), 7,79 (д, J=9,2 Гц, 1H), 8,03 (д, J= 8,0 Гц, 1H), 8,38 (д, J=8,8 Гц, 1H), 8,52 (д, J=9,2 Гц, 1H), 8,84 (д, J=7,6 Гц, 1H)
Пример 50
Гидрохлорид 11-ацетамидо-5-[2-(диметиламино) этил] -4H-бензо[с]пиримидо[5,6,1-jk]карбазол-4,6(5H)-диона: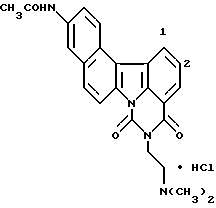
4 мл триэтиламина и 2 мл уксусного ангидрида последовательно добавляли к суспензии 141 мг (0,379 ммоль) свободного основания соединения Примера 49 в дихлорметане (20 мл) с перемешиванием при комнатной температуре и перемешивание продолжали в течение 16 часов. После концентрирования к остатку добавляли 30 мл метанола. Затем полученную смесь подщелачивали добавлением к ней водного раствора бикарбоната натрия. Осадок извлекали фильтрованием и промывали водой. Полученное таким образом твердое вещество суспендировали в этаноле и добавляли концентрированную соляную кислоту с перемешиванием при комнатной температуре. После дополнительного добавления метанола и дихлорметана перемешивание продолжали. После концентрирования добавляли этанол и полученную смесь нагревали с обратным холодильником и затем давали ей остыть до комнатной температуры. Осадок извлекали фильтрованием с получением 148 мг соединения, указанного в названии примера.
FAB-масс-спектрометрия m/z: 415([М+H]+).
1H-ЯМР (ДМСО-d6): δ (м.д.): 2,13 (с, 3H), 2,90 (с, 3H), 2,91 (с, 3H), 3,44-3,52 (м, 2H), 4,42 (т, J=5,6 Гц, 2H), 7,76 (т, J=8,0 Гц, 1H), 7,89 (дд, J=1,6; 9,2 Гц, 1H), 8,06-8,14 (м, 2H), 8,52 (д, J=1,6Гц, 1H), 8,54 (д, J=9,2 Гц, 1H), 8,79 (д, J=8,8 Гц, 1H), 8,98 (д, J=8,0 Гц, 1H), 9,60 (шир. с, 1H), 10,35 (с, 1H)
Элементный анализ: C24H22N4O3•HCl•0,6H2O
рассчитано: C 62,43; H 5,28; N 12,13;
найдено: C 62,54; H 5,03; N 11,82.
Пример 51
Дигидрохлорид 5-[2-[N-[2-(диметиламино)этил]-N-метиламино]этил]-4H-бензо [с]пиримидо[5,6,1-jk]карбазол-4,6(5H)-диона: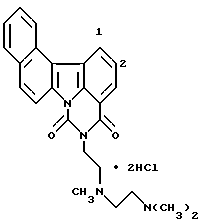
Названное соединение получали, как описано в Примере 2.
(Свободное основание) 1H-ЯМР (CDCl3):  (м.д.): 2,20 (с, 6H), 2,42 (т, J=7,2 Гц, 2H), 2,45 (с, 3H), 2,63 (т, J=7,2 Гц, 2H), 2,81 (т, J=7,2 Гц, 2H), 4,35 (т, J=7,2 Гц, 2H), 7,59 (т, J=7,8 Гц, 1H), 7,64 (т, J=7,8 Гц, 1H), 7,74 (т, J=7,8 Гц, 1H), 8,01 (д, J=9,2 Гц, 1H), 8,03 (д, J=7,8 Гц, 1H), 8,14 (д, J=7,8 Гц, 1H), 8,56-8,61 (м, 2H), 8,66 (д, J=9,2 Гц, 1H),
(м.д.): 2,20 (с, 6H), 2,42 (т, J=7,2 Гц, 2H), 2,45 (с, 3H), 2,63 (т, J=7,2 Гц, 2H), 2,81 (т, J=7,2 Гц, 2H), 4,35 (т, J=7,2 Гц, 2H), 7,59 (т, J=7,8 Гц, 1H), 7,64 (т, J=7,8 Гц, 1H), 7,74 (т, J=7,8 Гц, 1H), 8,01 (д, J=9,2 Гц, 1H), 8,03 (д, J=7,8 Гц, 1H), 8,14 (д, J=7,8 Гц, 1H), 8,56-8,61 (м, 2H), 8,66 (д, J=9,2 Гц, 1H),
Элементный анализ: C25H26N4O2•2HCl•0,8H2O
рассчитано: C 59,83; H 5,78; N 11,17;
найдено: C 59,83; H 6,02; N 11,16.
Пример 52
Гидрохлорид 5-[2-[N-(2-гидроксиэтил)-N-метиламино] этил] -4H-бензо[с] пиримидо[5,6,1-jk]карбазол-4,6(5H)-диона: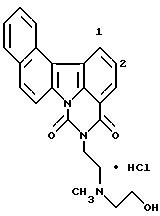
Названное соединение получали, как описано в Примере 2.
1H-ЯМР (ДМСО-d6): δ (м.д.) : 2,93 (с, 3H), 3,14-3,80 (м, 2H), 3,71-3,80 (м, 2H), 4,40-4,49 (м, 2H), 5,33-5,39 (м, 1H), 7,64-7,70 (м, 1H), 7,73-7,86 (м, 2H), 8,10-8,26 (м, 3H), 8,59-8,65 (м, 1H), 8,83-8,89 (м, 1H), 9,00-9,04 (м, 1H), 9,60(шир. с, 1H)
Элементный анализ: C23H21N3O3•HCl•1,1H2O
рассчитано: C 62,26; H 5,25; N 9,47;
найдено: C 62,08; H 5,55; N 9,47.
Пример 53
Гидрохлорид 5-[2-(диметиламино)этил] -2-гидрокси-4H-бензо[с] пиримидо [5,6,1-jk]карбазол-4,6(5H)-диона: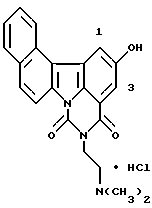
Названное соединение получали обработкой соединения Примера 45, как описано в Примере 46.
1H-ЯМР (ДМСО-d6): δ (м. д. ): 2,89 (шир. с, 6H), 3,39-3,54 (м, 2H), 4,32-4,46 (м, 2H), 7,53-7,56 (м, 1H), 7,65-7,71 (м, 1H), 7,81-7,87(м, 1H), 8,19 (д, J=8,0 Гц, 1H), 8,23 (д, J=8,8 Гц, 1H), 8,35-8,39 (м, 1H), 8,60 (д, J=8,8 Гц, 1H), 8,73 (д, J=8,0 Гц, 1H), 9,29-9,39(шир. 1H), 10,25 (с, 1H)
Элементный анализ: C22H19N3O3•HCl•H2O
рассчитано: C 61,76; H 5,18; N 9,82;
найдено: C 6,92; H 4,90; N 9,84.
Пример 54
Гидрохлорид 2-[2-(диметиламино)этил] -9-метокси-1H-бензо[а] пиримидо[5,6,1-jk]карбазол-1,3(2H)-диона: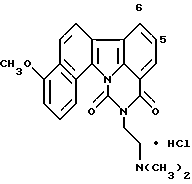
Названное соединение получали с использованием метокси-1- тетралона и гидрохлорида 2-гидразинобензойной кислоты и повторением процедуры Примера 18.
1H-ЯМР (ДМСО-d6):  (м.д.): 2,92 (с, 6H), 3,46-3,55 (м, 2H), 4,02 (с, 3H), 4,42-4,46 (м, 2H), 7,16 (д, J=7,1 Гц, 1H), 7,60 (т, J=7,1 Гц, 1H), 7,73 (т, J=7,1 Гц, 1H), 8,12 (д, J=7,1 Гц, 1H), 8,34-8,44 (м, 2H), 8,63 (д, J=7,1 Гц, 1H), 9,28 (д, J=9,2 Гц, 1H), 9,78 (шир. с, 1H)
(м.д.): 2,92 (с, 6H), 3,46-3,55 (м, 2H), 4,02 (с, 3H), 4,42-4,46 (м, 2H), 7,16 (д, J=7,1 Гц, 1H), 7,60 (т, J=7,1 Гц, 1H), 7,73 (т, J=7,1 Гц, 1H), 8,12 (д, J=7,1 Гц, 1H), 8,34-8,44 (м, 2H), 8,63 (д, J=7,1 Гц, 1H), 9,28 (д, J=9,2 Гц, 1H), 9,78 (шир. с, 1H)
Пример 55
Дигидрохлорид 9-[2-(1-пирролидинил)этил] -8H-пиридо[2,3-с] пиримидо[5,6,1-jk]карбазол-8,10 (9H)-диона: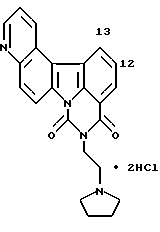
Названное соединение получали, как описано в Примере 36.
1H-ЯМР (ДМСО-d6+D2O): δ (м.д.): 1,84-1,94 (м, 2H), 2,01-2,13 (м, 2H), 3,13-3,25 (м, 2H), 3,57-3,64 (м, 2H), 3,65-3,74 (м, 2H), 4,43-4,49 (м, 2H), 7,85 (т, J= 7,6 Гц, 1H), 7,94 (дд, J=4,4, 8,4 Гц, 1H), 8,23 (д, J=7,6 Гц, 1H), 8,37 (д, J=9,2 Гц, 1H), 8,92 (д, J=9,2 Гц, 1H), 9,05 (д, J=7,6 Гц, 1H), 9,12 (дд, J=1,6; 4,4 Гц, 1H), 9,40-9,45 (м, 1H)
Пример 56
Дигидрохлорид 9-[2-(диметиламино)этил]-13-фтор-8H-пиридо[2,3-с]пиримидо [5,6,1-jk]карбазол-8,10(9H)-диона: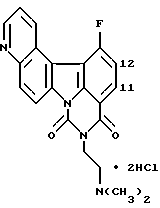
Названное соединение получали, как описано в Примере 36.
1H-ЯМР (ДМСО-d6): δ (м.д.): 2,92 (с, 3H), 2,93 (с, 3H), 3,47-3,55 (м, 2H), 4,41-4,47 (м, 2H), 7,69 (дд, J=8,4; 12,0 Гц, 1H), 7,93 (дд, J=4,4; 8,4 Гц, 1H), 8,29 (дд, J=4,4; 8,4 Гц, 1H), 8,45 (д, J=9,2 Гц, 1H), 8,97 (д, J= 9,2 Гц, 1H), 9,10-9,15 (м, 1H), 9,25- 9,31 (м, 1H)
Пример 57
Дигидрохлорид 9-[2-(диметиламино)этил]-3-метил-8H-пиридо[2,3-с]пиримидо [5,6,1-jk]карбазол-8,10(9H)-диона: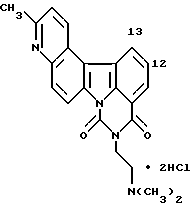
Названное соединение получали, как описано в Примере 36.
1H-ЯМР (ДМСО-d6): δ (м.д.): 2,93 (с, 3H), 2,95 (с, 6H), 3,51-3,57 (м, 2H), 4,44-4,50 (м, 2H), 7,86 (т, J=8,0 Гц, 1H), 7,98 (д, J=8,8 Гц, 1H), 8,25 (д, J=8,0 Гц, 1H), 8,39 (д, J=9,2 Гц, 1H), 8,98 (д, J=9,2 Гц, 1H), 9,09 (д, J=8,0 Гц, 1H), 9,55 (д, J=8,8 Гц, 1H)
Пример 58
7-[2-(Диметиламино)этил] -6H-бензо[c, i] пиримидо[1,6,5-lm] -  -карболин-6,8(7H)-дион:
-карболин-6,8(7H)-дион: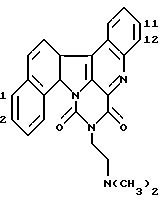
1,06 г (3,1 ммоль) соединения Примера получения 25 растворяли в смеси метанола (20 мл) с тетрагидрофураном (20 мл). После добавления к раствору 1 н. водного раствора гидроксида натрия (10 мл) полученную смесь нагревали с обратным холодильником в течение 1 часа и затем ей давали остыть. Затем к ней добавляли 1 н. водный раствор соляной кислоты (10 мл) и растворитель отгоняли. К остатку добавляли N,N-диметилформамид (50 мл). Далее добавляли 770 мг (4 ммоль) гидрохлорида 1-этил-3-(3-диметиламинопропил) карбодиимида, 540 мг (4 ммоль) 1-гидроксибензотриазола и 0,4 мл (3,7 ммоль) N,N-диметилэтилендиамина и полученную смесь перемешивали при комнатной температуре в течение ночи. Затем к ней добавляли водный раствор бикарбоната натрия и смесь экстрагировали этилацетатом. Органический слой промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния и затем концентрировали. Полученный таким образом остаток промывали этанолом и извлекали фильтрованием с получением 660 мг промежуточного продукта (выход 55%).
100 мг (0,26 ммоль) этого промежуточного продукта растворяли в N,N-диметилформамиде (20 мл) и добавляли к раствору 22 мг (0,55 ммоль) гидрида натрия (60% в масле) под током газообразного водорода. После перемешивания полученной смеси в течение 1 часа к ней добавляли 0,046 мл (0,6 ммоль) метилхлорформиата при комнатной температуре. Затем смесь сразу подкисляли 1 н. соляной кислотой и затем слабо подщелачивали насыщенным водным раствором бикарбоната натрия с последующей экстракцией этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния и затем концентрировали досуха. Остаток очищали колоночной хроматографией на силикагеле с получением 25 мг соединения, указанного в названии примера (выход 24%).
FAB-масс-спектрометрия m/z: 409 ([М+H]+).
1H-ЯМР (CDCl3): δ (м.д.): 2,39 (с, 6H), 2,80 (т, J=6,7 Гц, 2H), 4,51 (т, J=6,7 Гц, 2H), 7,66-7,78 (м, 2H), 7,85-7,93 (м, 2H), 8,01-8,07 (м, 2H), 8,51 (д, J= 8,6 Гц, 1H), 8,57-8,63 (м, 1H), 8,73-8,79 (м, 1H), 9,74 (дд, J=0,7; 8,6 Гц, 1H).
| название | год | авторы | номер документа |
|---|---|---|---|
| АЗОТСОДЕРЖАЩИЕ АРОМАТИЧЕСКИЕ ПРОИЗВОДНЫЕ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ИХ СОДЕРЖАЩАЯ, СПОСОБ ЛЕЧЕНИЯ И ПРИМЕНЕНИЕ | 2003 |
|
RU2310651C2 |
| НОВЫЕ ПИРИДИНОВОЕ ПРОИЗВОДНОЕ И ПИРИМИДИНОВОЕ ПРОИЗВОДНОЕ (1) | 2005 |
|
RU2330021C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ ГЕТЕРОЦИКЛОМ ПРОИЗВОДНЫХ ПИРИДИНА | 2008 |
|
RU2474581C2 |
| ПРОИЗВОДНЫЕ СУЛЬФОНАМИДА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ | 1994 |
|
RU2128648C1 |
| ГЕТЕРОЦИКЛО-ЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ АМИНОВ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ИНГИБИРОВАНИЯ ХОЛИНЭСТЕРАЗЫ, СПОСОБ ПОЛУЧЕНИЯ СОЕДИНЕНИЙ | 1992 |
|
RU2119920C1 |
| НОВОЕ ПРОИЗВОДНОЕ ПИРИДИНА И ПРОИЗВОДНОЕ ПИРИМИДИНА (3) | 2006 |
|
RU2362771C1 |
| 1,2,3,4-ТЕТРАГИДРОХИНОКСАЛИНДИОНОВЫЕ ПРОИЗВОДНЫЕ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1995 |
|
RU2149873C1 |
| КОНДЕНСИРОВАННЫЕ ПРОИЗВОДНЫЕ ПИРИДАЗИНА И ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ, СОДЕРЖАЩИЕ ДАННЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ АКТИВНОГО ИНГРЕДИЕНТА | 2003 |
|
RU2292337C2 |
| МАКРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ИХ ОСНОВЕ И ИХ ПРИМЕНЕНИЕ | 2003 |
|
RU2347784C2 |
| НОВОЕ ТРИЦИКЛИЧЕСКОЕ ПРОИЗВОДНОЕ ИЛИ ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, СПОСОБ ИХ ПОЛУЧЕНИЯ И СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2009 |
|
RU2470934C1 |
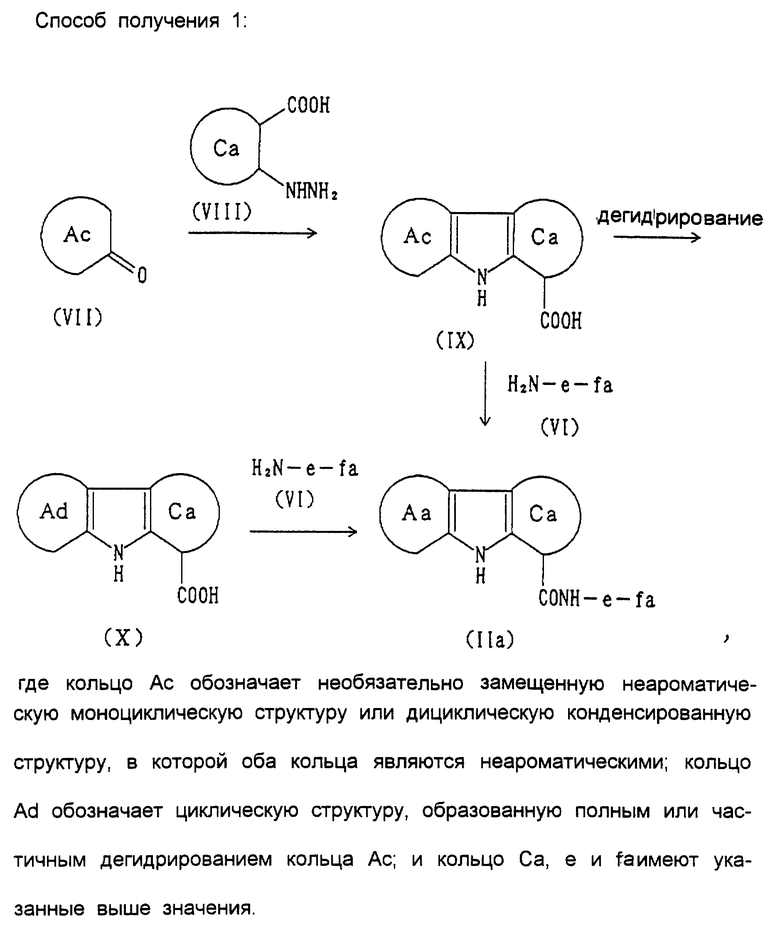
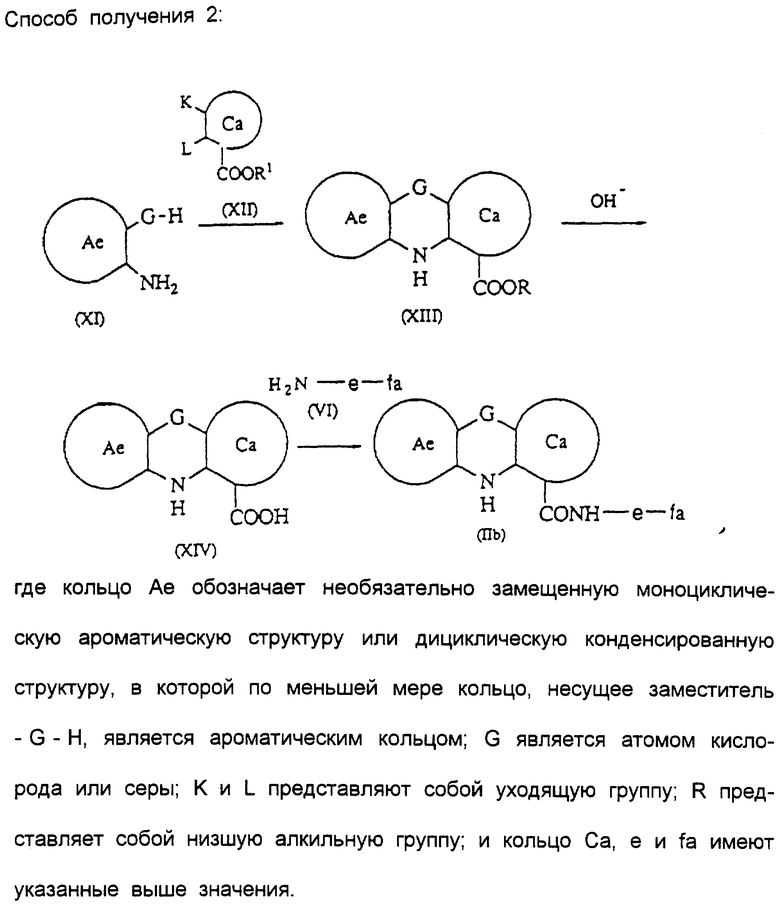
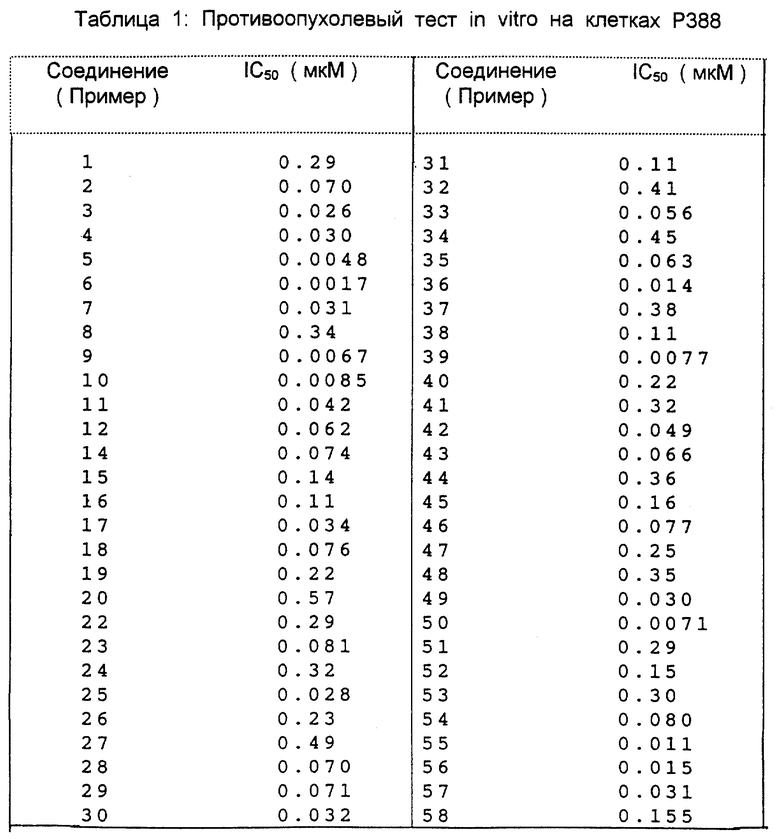
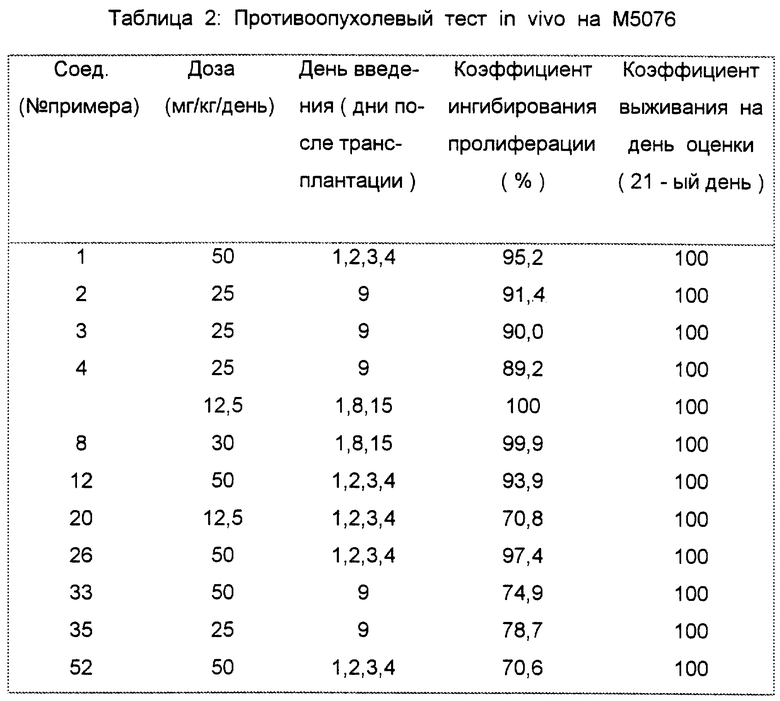
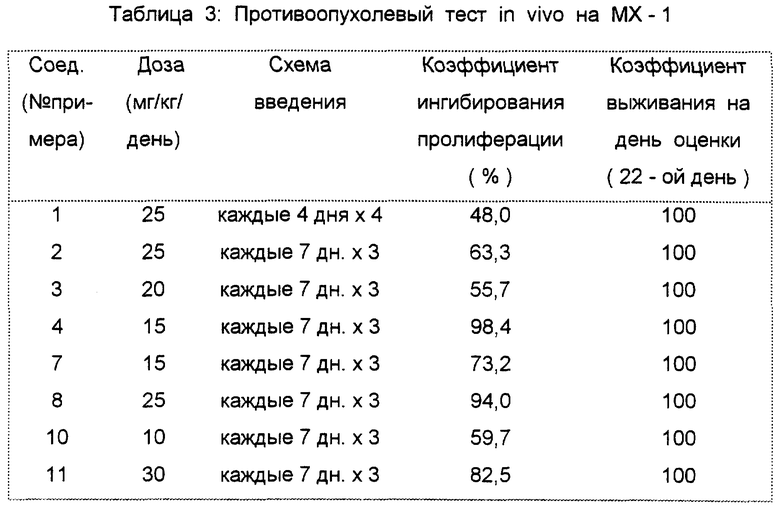
Изобретение относится к новым конденсированным полициклическим гетероциклическим соединениям формулы I и способу их получения. Соединения формулы I обладают низкой токсичностью и высокой противоопухолевой активностью и могут быть использованы в фармацевтической промышленности. Соединения соответствуют общей структурной формуле I, в которой кольцо А обозначает бензол, необязательно замещенный оксо, или дициклическое конденсированное кольцо, где по меньшей мере одно из колец является ароматическим кольцом и выбрано из группы, включающей: 1) нафталин, необязательно гидрированный в одном кольце и/или необязательно замещенный галогеном, гидрокси, низшим алкилом, необязательно содержащим гидрокси группу, низшим алкокси, нитро, амино, низшим ацилом, оксо, циано, бензолсульфонамидо, замещенным низшим алкилом, и низшим ациламино; 2) инден, необязательно гидрированный в одном кольце и/или необязательно замешенный оксо; 3) бензофуран, необязательно гидрированный в одном кольце, и/или необязательно замещенный гидрокси или оксо в гетероциклическом кольце; 4) изобензопиран, необязательно гидрированный и/или необязательно замещенный оксо; 5) бензотиофен, необязательно замешенный; оксо; 6) бензопиран, необязательно гидрированный и/или необязательно замещенный оксо; 7) бензодиоксол; и 8) хинолин и изохинолин, необязательно гидрированные в гетероциклическом кольце и/или необязательно замещенные оксо или низшим алкилом; кольцо В обозначает пиррол, 4Н-1,4-оксазин, 4Н-1,4-тиазин или 4(1Н)-пиридон, кольцо С обозначает моноциклическое или дициклическое ароматическое кольцо, выбранное из: 1) фенила, необязательно замещенного галогеном, гидрокси, низшим алкокси, низшим алкилом, нитро или амино; 2) нафтила и 3) хинолила, Y обозначает группу, представленную формулой -e-f, где е обозначает низший алкилен и f обозначает низший алкиламино, ди-низший алкиламино, пирролидинил, N-(диметиламино)этил-N-метиламино и N-(гидроксиэтил)-N-метиламино; или их фармакологически приемлемые соли. Соединения формулы I или их фармакологически приемлемые соли получают взаимодействием соединения формулы II, где кольца Аа и Са имеют значения, указанные для А и С, в которых заместители могут быть защищены, кольцо Ва означает 4Н-1,4-тиазин, 4Н-1,4-оксазин, 4(1Н)-пиридон, fa имеет значения f, указанное выше, е имеет значения, указанные выше, с соединением формулы III, где D и одинаковы или различны и представляют удаляемую защитную группу или группы, если они имеются из полученного таким образом продукта.
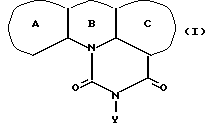
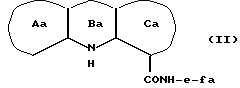
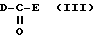
2 с. и 7 з.п.ф-лы, 3 табл.

где кольцо А обозначает бензол, необязательно замещенный оксо, или дициклическое конденсированное кольцо, в котором, по меньшей мере, одно из колец является ароматическим кольцом и выбрано из группы, включающей: 1) нафталин, необязательно гидрированный в одном кольце и/или необязательно замещенный галогеном, гидрокси, низшим алкилом, необязательно содержащим гидроксигруппу, низшим алкокси, нитро, амино, низшим ацилом, оксо, циано, бензолсульфонамидо, замещенным низшим алкилом, и низшим ациламино; 2) инден, необязательно гидрированный в одном кольце и/или необязательно замещенный оксо; 3) бензофуран, необязательно гидрированный в одном кольце и/или необязательно замещенный гидрокси или оксо в гетероциклическом кольце; 4) изобензопиран, необязательно гидрированный и/или необязательно замещенный оксо; 5) бензотиофен, необязательно замещенный оксо; б) бензопиран, необязательно гидрированный и/или необязательно замещенный оксо; 7) бензодиоксол; и 8) хинолин и изохинолин, необязательно гидрированные в гетероциклическом кольце и/или необязательно замещенные оксо или низшим алкилом;
кольцо В обозначает пиррол, 4Н-1,4-оксазин, 4Н-1,4-тиазин или 4(1Н)-пиридон;
кольцо С обозначает моноциклическое или дициклическое ароматическое кольцо, выбранное из: 1) фенила, необязательно замещенного галогеном, гидрокси, низшим алкокси, низшим алкилом, нитро или амино; 2) нафтила и 3) хинолила;
Y обозначает группу, представленную формулой -е-f, где е обозначает низший алкилен и f обозначает низший алкиламино, ди-низший алкиламино, пирролидинил, N-(диметиламино)этил-N-метиламино и N-(гидроксиэтил)-N-метиламино;
или их фармакологически приемлемые соли.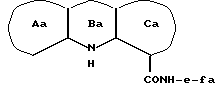
где кольца Аа и Са имеют значения, указанные в п.1 для колец А и С, соответственно, в которых соответствующие заместители необязательно защищены;
кольцо Ва обозначает 4Н-1,4-оксазин, 4Н-1,4-тиазин, 4(1Н)-пиридон;
fа имеет значения f, указанные в п.1;
е имеет значение, указанное в п.1,
с соединением общей формулы III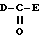
где D и Е одинаковы или различны, и каждый представляет собой удаляемую группу,
с удалением защитной группы или групп, если они имеются, из полученного таким образом продукта.
| Автоматический огнетушитель | 0 |
|
SU92A1 |
| Вихревой осветлитель | 1980 |
|
SU912289A2 |
| US 3962438 A, 08.06.1976 | |||
| ANTONINI IPPOLITO ET ALL | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Печь для сжигания твердых и жидких нечистот | 1920 |
|
SU17A1 |
Авторы
Даты
2001-05-27—Публикация
1996-05-31—Подача