Настоящее изобретение относится к новому производному сульфонамида или сульфонового эфира, способу получения производного и лекарственной композиции, содержащей его в качестве активного ингредиента.
Химико-терапевтические средства, которые используются при лечении раковых заболеваний, включают циклофосфамиды в качестве алкилирующих агентов; метотрексат и фторурацил в качестве антиметаболитов; адриамицин, митомицин и блеомицин в качестве антибиотиков; винкристин и этопозид в качестве лекарств, выделяемых из растений; циспластин в качестве металлокомплекса. Однако эти средства обладают недостаточной противоопухолевой активностью и, таким образом, сохраняется острая потребность в разработке нового антиопухолевого средства.
Далее, в качестве ароматических сульфамидных антиопухолевых средств заявлены производные 2-сульфаниламидохиноксалина (Патент США 4931433) и производные N-(2-анилино-3-пиридинил)бензолсульфонамида (Европейский патент A472053). Не сообщается об использовании в качестве антиопухолевых средств ароматических сульфоновых эфиров.
Целью настоящего изобретения является новое производное сульфонамида или сульфонового эфира, которое обладает превосходной антиопухолевой активностью и отличается по своей базовой структуре от антиопухолевых средств, известных из области техники. Целью настоящего изобретения является также способ получения производного и лекарственная композиция, содержащая его в качестве активного ингредиента.
Для достижения поставленной цели изобретатели провели интенсивные исследования для разработки наилучшего антиопухолевого средства. В результате исследований ими было показано, что новое гетеробициклическое производное сульфонамида и сульфонового эфира обладает превосходной антиопухолевой активностью и низкой токсичностью. Настоящее изобретение является следствием этого открытия.
Таким образом, настоящее изобретение относится к производному сульфонамида или сульфонового эфира, представленному общей формулой (I), или его фармакологически приемлемой соли
где A обозначает моноциклическое или бициклическое ароматическое кольцо, которое может иметь заместители, B обозначает шестичленное ненасыщенное углеводородное кольцо или шестичленный ненасыщенный гетероцикл, содержащий в качестве гетероатома один атом азота, при этом каждое из этих колец может иметь заместители, C обозначает пятичленный гетероцикл, содержащий один или два атома азота, который может иметь заместители, W обозначает простую связь или группу, представленную формулой -CH=CH-,
X обозначает группу, представленную формулой -N(R1)-, или атом кислорода,
Y обозначает атом углерода или атом азота,
Z обозначает группу, представленную формулой -N(R2)-, или атом азота,
R1 и R2 могут быть одинаковыми или отличаться друг от друга и каждый обозначают атом водорода или низший алкил; при условии, что исключаются случаи (1), когда A обозначает 4-метилбензол, W обозначает простую связь, X является группой, представленной формулой -NH-, B обозначает метоксибензол и C обозначает незамещенный имидазол и (2) когда A обозначает 4-(ацетамидо)фенил или 4-аминофенил, W обозначает простую связь, X является группой, представленной формулой -NH-, B обозначает незамещенный фенил и C обозначает незамещенный пиразол.
Далее в настоящем изобретении заявляется использование вышеуказанного соединения в качестве лекарства.
А именно, настоящее изобретение относится и также к лекарственной композиции, включающей фармакологически эффективное количество производного сульфонамида или сульфонового эфира или его фармакологически приемлемой соли, как указано в п. 1 формулы изобретения, и фармакологически приемлемый носитель; способу лечения опухоли, который заключается в назначении пациенту фармакологически эффективной дозы производного сульфонамида, или сульфонового эфира, или его фармакологически приемлемой соли, как указано в п. 1 формулы изобретения; и использованию производного сульфонамида, или сульфонового эфира, или его фармакологически приемлемой соли для получения антиопухолевого средства, как указано в п. 1 формулы изобретения.
В указанной ранее общей формуле (I) А обозначает "моноциклическое или бициклическое ароматическое кольцо, которое может иметь заместители", и относится к ароматическому углеводородному кольцу или ароматическому гетероциклу, содержащему по крайней мере один атом азота, кислорода и серы, при этом каждое кольцо может включать от одного до трех заместителей. Подобное ароматическое кольцо, указанное для A, включает пиррол, пиразол, имидазол, тиофен, фуран, тиазол, оксазол, бензол, пиридин, пиримидин, пиразин, пиридазин, нафталин, хинолин, изохинолин, фталазин, нафтиридин, хиноксалин, хиназолин, циннолин, индол, изоиндол, индолизин, индазол, бензофуран, бензотиофен, бензоксазол, бензимидазол, бензопиразол и бензотиазол. Оно может содержать от одного до трех заместителей, и если присутствуют два или три заместителя, они могут быть одинаковыми или отличаться друг от друга. Примеры таких заместителей включают аминогруппу, которая может быть замещена низшим алкилом или низшим циклоалкилом, низший алкил, низшую алкоксигруппу, гидроксигруппу, нитрогруппу, меркаптогруппу, цианогруппу, низшую алкилтиогруппу, атом галогена, группы, представленные формулой -a-b [где a обозначает простую связь, -(CH2)k-, -O- (CH2)k-, -S-(CH2)k- или N(R3)-(CH2)k (где k -целое число от 1 до 5, а R3 обозначает атом водорода или низший алкил); а b обозначает группу, представленную формулой -CH2-d (где d обозначает аминогруппу, которая может быть замещена низшим алкилом, атом галогена, гидроксигруппу, низшую алкилтиогруппу, цианогруппу, или низшую алкоксигруппу, )], группы, представленные формулой -a-e-f [где a определено ранее; e обозначает -S(O)- или -S(O)2-; а f обозначает аминогруппу, которая может быть замещена низшим алкилом или низшим алкоксилом, низший алкил, трифторметил, -(CH2)m-b или -N(R4)-(CH2)m-b (где b определено ранее; R4 обозначает атом водорода или низший алкил; и m обозначает целое число от 1 до 5)]; группы, представленные формулой -a-g-h [где a определено ранее; g обозначает -C(O)- или -C(S)-; и h обозначает аминогруппу, которая может быть замещена низшим алкилом, гидроксильную группу, низший алкил, низший алкоксил, -(CH2)n-b или -N(R5)-(CH2)n-b (где b определено ранее; R5 обозначает атом водорода или низший алкил; и n обозначает целое число от 1 до 5)]; группы, представленные формулой -a-N(R6)-g-i [где a и g определены ранее, R6 обозначает атом водорода или низший алкил; и i обозначает атом водорода или низший алкоксил или имеет значение, указанное для f] ; группы, представленные формулой -a-N(R7)-e-f [где значения a, e и f определены ранее; а R7 обозначает атом водорода или низший алкил); и группы, представленные формулой -(CH2)p-j-(CH2)q-b (где j обозначает атом кислорода или серы; b определено ранее; и p и q могут совпадать или отличаться друг от друга и обозначают целое число от 1 до 5).
Если заместитель является аминогруппой, замещенной двумя алкильными группами, обе алкильные группы могут быть объединены и образовывать пяти- шестичленное кольцо. Далее, если A обозначает азотсодержащий гетероцикл, имеющий гидроксигруппу или меркаптогруппу, то указанная группа вследствие резонанса моет присутствовать в виде оксо- или тиоксогруппы.
B представляет собой "шестичленное ненасыщенное углеводородное кольцо или шестичленный ненасыщенный гетероцикл, содержащий в качестве гетероатома один атом азота, и может иметь заместители" и относится к бензолу или пиридину, которые могут быть частично гидрированы и могут иметь в кольце один или два заместителя, если заместителей, то они могут быть одинаковыми или отличаться друг от друга.
C обозначает "пятичленный гетероцикл, содержащий один или два атома азота, который может иметь заместители", относится к пирролу, пиразолу или имидазолу, которые могут быть частично гидрированы и могут иметь в кольце один или два заместителя, при этом если заместителей два, то они могут быть одинаковыми или отличаться друг от друга.
Примеры заместителей для B или C включают атом галогена, цианогруппу, низший алкил, низший алкоксил, гидроксил, оксогруппу, группы, представленные формулой -C(O)-r (где r обозначает атом водорода, аминогруппу, которая может быть замещена низшим алкилом, низший алкил, низший алкоксил или гидроксил), аминогруппу, замещенную низшим алкилом, трифторметильную группу.
Низший алкил, упомянутый ранее в связи с R1 и R2 и заместителями для A, B и С в общей формуле (I), является линейной или разветвленной алкильной группой, имеющей от 1 до 6 атомов углерода, примеры которые включают метил, этил, н-пропил, изо-пропил, н-бутил, изо-бутил, втор-бутил, трет-бутил, н-пентил (амил), изо-пентил, неопентил, трет-пентил, 1-метилбутил, 2-метилбутил, 1,2-диметилпропил, н-гексил, изо-гексил, 1-метилпентил, 2-метилпентил, 3-метилпентил, 1,1-диметилбутил, 1,2-диметилбутил, 2,2-диметилбутил, 1,3-диметилбутил, 2,3-диметилбутил, 3,3-диметилбутил, 1-этилбутил-2-этилбутил, 1,1,2-триметилпропил, 1,2,2-триметилпропил, 1-этил-1-метилпропил и 1-этил-2-метилпропил, из них метил, этил, н-пропил, изопропил, н-бутил и изо-бутил являются предпочтительными, при этом метил, этил, н-пропил и изо-пропил являются наиболее предпочтительными.
Низший циклоалкил, упомянутый в связи с заместителем для A, включает циклопропил, циклопентил и циклогексил. Низший алкоксил, упомянутый в связи с заместителями для A, B и C, может быть группой, полученной из вышеупомянутой низшей алкильной группы, примеры которой включают метоксигруппу, этоксигруппу, н-пропоксигруппу, изо-пропоксигруппу, н-бутоксигруппу, изо-бутоксигруппу и трет-бутоксигруппу, из которых предпочтительными являются метоксигруппа и этоксигруппа. Далее галоген, упомянутый ранее, включает фтор, хлор и бром.
Производное сульфонамида или сульфонового эфира, представленное общей формулой (I), может образовывать соль с кислотой или основанием. Настоящее изобретение включает также соли соединений (I). Примеры солей с кислотами включают соли с неорганическими кислотами, такими как соляная кислота, бромистоводородная кислота и серная кислота, и органическими кислотами, такими как масляная кислота, молочная кислота, янтарная кислота, фумаровая кислота, малеиновая кислота, лимонная кислота, бензойная кислота, метансульфокислота и п-толуолсульфокислота, в то время как примеры солей с основаниями включают соли с неорганическими основаниями, такими как натрием, калием или кальцием, и органическими основаниями, такими как триэтиламин, аргинин и лизин.
Нет нужды говорить о том, что настоящее изобретение включает гидраты и оптические изомеры указанных соединений, если они существуют. Хотя соединения по настоящему изобретению проявляют высокую антиопухолевую активность, настоящее изобретение включает соединения, которые подвергаются метаболизму в условиях in vivo, такому как окисление, восстановление, гидролиз или сопряжение, и проявляют антиопухолевую активность. Далее, настоящее изобретение включает также соединения, которые подвергаются в условиях in vivo метаболизму, такому как окисление, восстановление или гидролиз, и образуют соединения по настоящему изобретению.
Хотя соединение (I) по настоящему изобретению может быть получено различными способами, далее в качестве примера будет описан ряд способов получения соединения (I).
1) Соединение (I) может быть получено взаимодействием сульфокислоты, представленной общей формулой (II)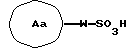
где Aa обозначает моноциклическое или бициклическое ароматическое кольцо, которое может иметь защищенный или незащищенный заместитель; а значение W указано ранее), или ее реакционноспособного производного с соединением, представленным общей формулой III
где Ba обозначает шестичленное ненасыщенное углеводородное кольцо или шестичленный гетероцикл, содержащий в качестве гетероатома один атом азота, при этом каждое из указанных колец может иметь защищенный или незащищенный заместитель; Ca обозначает пятичленный гетероцикл, содержащий один или два атома азота, которые могут иметь защищенный или незащищенный заместитель; а значения X, Y и Z указаны ранее.
Реакционноспособное производное сульфоновой кислоты (II) может быть любым обычным производным, примерами которого являются сульфонилхлорид, сульфоновый ангидрид и N-сульфонилимидазолид, из которых сульфонилхлорид является наиболее предпочтительным. Хотя растворитель, который должен использоваться в указанной выше реакции, специально не ограничивается, предпочтительным является растворитель, в котором растворимы исходные соединения и который слабо взаимодействует с соединениями. Примером такого растворителя является пиридин, тетрагидрофуран, диоксан, бензол, этиловый эфир, дихлорметан, диметилформамид и смеси двух или более указанных растворителей. Если в процессе реакции выделяется кислота, как в случае использования галогенангидрида сульфоновой кислоты, предпочтительно, чтобы реакция проводилась в присутствии подходящего раскислителя. С этой точки зрения наиболее предпочтительным является использование растворителя, обладающего основными свойствами, такого как пиридин. Когда используется нейтральный растворитель, может быть добавлено вещество, обладающее основными свойствами, такое как карбонат щелочного металла или органический третичный амин. Конечно, растворитель, который может использоваться в реакции, не ограничивается указанными ранее. Хотя реакция обычно протекает при комнатной температуре, ее в случае необходимости можно проводить при охлаждении или нагревании. Время реакции составляет обычно от 10 минут до 20 час и может быть выбрано в соответствии с типами исходных соединений и температурой реакции.
Если получаемый продукт содержит защищенную аминогруппу или гидроксильную группу, то в случае необходимости продукт может быть превращен в производное сульфонамида или сульфонового эфира (I), содержащее свободную гидроксильную группу или аминогруппу, с помощью обычного метода удаления защиты, такого как обработка кислотой или щелочью или каталитическое восстановление.
2) Соединение (I) можно получить взаимодействием соединения, представленного общей формулой (IV)
где значения Aa, Ba, W, X и Z указаны ранее,
с галоидирующим агентом. Примером галоидирующего агента является N-хлорсукцинимид, N-бромсукцинимид, 1,3-дибром-5,5-диметилгидантоин, N-бромацетамид, хлор или бром. Хотя растворитель, который должен использоваться в указанной реакции, специально не ограничивается, примеры растворителя включают хлоралканы, такие как дихлорметан, хлороформ и четыреххлористый углерод; хлорированные ароматические соединения, такие как хлорбензол и дихлорбензол, и водорастворимые растворители, такие как диметилформамид, диоксан, пиридин и ацетонитрил. Температура реакции обычно составляет в интервале от минут 50oC до 100oC, хотя она изменяется в зависимости от типа галоидирующего агента и субстрата.
Если получаемый продукт содержит защищенную аминогруппу или гидроксильную группу, то в случае необходимости продукт может быть превращен в производное сульфонамида или сульфонового эфира (I), содержащее свободную гидроксильную группу или аминогруппу, с помощью обычного метода удаления защиты, такого как обработка кислотой или щелочью или каталитическое восстановление.
3) Соединение (I) можно получить взаимодействием соединения, представленного общей формулой (V)
где значения Aa, Ba, W, X и Z указаны ранее;
E обозначает заместитель, который может быть превращен в цианогруппу путем дегидратации,
с дегидратирующим агентом. Пример такого заместителя, который может превращаться в цианогруппу путем дегидратации, включает (гидроксиимино)метил и карбамоил.
Иначе из исходного альдегида или карбоновой кислоты может быть получен оксид или амид кислоты, который может реагировать с дегидратирующим агентом без выделения. Дегидратирующим агентом может быть любое средство, обычно используемое при синтезе нитрилов, примером которого является уксусный ангидрид, тионилхлорид, оксихлорид фосфора, диоксид селена и 1,3-дициклогексилкарбодиимид. Хотя растворитель, который должен использоваться в указанной реакции, специально не ограничивается, предпочтительным является растворитель, в котором растворимы исходные соединения и который слабо взаимодействует с ними, и примером такого растворителя является пиридин, этиловый эфир, бензол, диметилформамид, четыреххлористый углерод, ацетонитрил, тетрагидрофуран и смеси двух или более указанных растворителей. Температура реакции обычно лежит в интервале от минут 50oC до 150oC, хотя она изменяется в зависимости от типа дегидратирующего агента и субстрата.
Если получаемый продукт содержит защищенную аминогруппу или гидроксильную группу, то в случае необходимости продукт может быть превращен в производное сульфонамида или сульфонового эфира (I), содержащее свободную гидроксильную группу или аминогруппу, с помощью обычного метода удаления защиты, такого как обработка кислотой или щелочью или каталитическое восстановление.
4) Соединение (I) может быть получено взаимодействием соединения, представленного общей формулой (VI)
где Ab обозначает моноциклическое или бициклическое ароматическое кольцо, содержащее заместитель, который может быть превращен в аминогруппу путем восстановления и может содержать защищенный или незащищенный заместитель; значения Ba, Ca, W, X Y и Z указаны ранее,
с восстановительным агентом. Заместитель, способный превратиться в аминогруппу путем восстановления, включает нитрогруппу, нитрозогруппу, гидроксиламиногруппу и азогруппу.
Хотя восстановление можно проводить любыми способами, пригодными для восстановления нитрогруппы, оно преимущественно осуществляется каталитическим восстановлением с использованием в качестве катализатора палладия на угле или оксида платины или восстановлением с использованием кислоты вместе с цинком, железом или оловом. Каталитическое восстановление обычно проводят в органическом растворителе, таком как метанол, тетрагидрофуран или диметилформамид при нормальном или повышенном давлении.
Если получаемый продукт содержит защищенную аминогруппу или гидроксильную группу, то в случае необходимости продукт может быть превращен в производное сульфонамида или сульфонового эфира (I), содержащее свободную гидроксильную группу или аминогруппу, с помощью обычного метода удаления защиты, такого как обработка кислотой или щелочью или каталитическое восстановление.
5) Соединение (I) может быть получено взаимодействием соединения, представленного общей формулой (VII)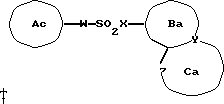
где Ac обозначает моноциклическое или бициклическое ароматическое кольцо, содержащее уходящую группу в кольце или заместитель, которое может иметь защищенный или незащищенный заместитель;
значения Ba, Ca, W, X Y и Z указаны ранее,
с нуклеофилом. Уходящая группа включает атом галогена, метансульфонилоксигруппу и п-толуолсульфонилоксигруппу. Нуклеофил включает амины, спирты и тиолы. Спирт или тиол может использоваться в виде соли с щелочным металлом или т.п. Хотя растворитель, который должен использоваться в указанной реакции, специально не ограничивается, предпочтительным является растворитель, в котором растворимы исходные соединения и который слабо взаимодействует с ними. Примеры таких растворителей включают тетрагидрофуран, диоксан, диметилформамид и воду. Температура реакции обычно лежит в интервале от минут 50oC до 150oC, хотя она изменяется в зависимости от типа дегидратирующего агента и субстрата.
Если получаемый продукт содержит защищенную аминогруппу или гидроксильную группу, то в случае необходимости продукт может быть превращен в производное сульфонамида или сульфонового эфира (I), содержащее свободную гидроксильную группу или аминогруппу, с помощью обычного метода удаления защиты, такого как обработка кислотой или щелочью или каталитическое восстановление.
Далее описывается получение исходного соединения (II) и его реакционноспособного производного, а также соединения (III).
Исходное соединение (II) и его реакционноспособное производное включают как известные соединения, так и новые соединения. Каждое из этих новых соединений может быть получено одним из известных способов, применяемых для получения известных соединений, или путем комбинации двух или большего количества указанных способов. Например, способы, приведенные в публикациях Chem. Ber., Bd. 90, 841 (1957); J. Med. Chem., Vol. 6, 307 (1963); J. Chem. Soc. (c), 1968, 1265; Chem. Lett., 1992, 1483; J. Am. Chem. Soc., Vol. 59, 1837 (1937); J. Med. Chem., Vol. 23, 1376 (1980); J. Am. Chem. Soc., Vol. 70, 375 (1948) и J. Am. Chem. Soc., Vol. 78, 2171 (1956) могут использоваться для получения новых сульфонилхлоридов.
Исходное соединение (III) включает как известные, так и новые соединения. Исходное соединение (III), где H-X- обозначает аминогруппу (H2N-), может быть получено восстановлением соответствующего нитросоединения с помощью обычного метода восстановления нитрогруппы. Указанное восстановление преимущественно осуществляют каталитически в присутствии палладия на угле в качестве катализатора или с использованием порошкообразного цинка и соляной кислоты. Каталитическое восстановление можно обычно проводить в органическом растворителе, таком как метанол, тетрагидрофуран или диметилформамид, при нормальном или повышенном давлении.
Исходное соединение (III), где H-X- обозначает гидроксил (HO-), может быть получено диазотированием указанного выше аминопроизводного или гидролизом полученного диазосоединения.
Если исходное соединение является новым соединением, то его моно получить одним из известных способов, применяемых для получения известных соединений, или путем комбинации двух или большего количества указанных способов. Например, новое исходное соединение может быть получено с помощью способа, приведенного в публикациях Can. J. Chem., Vol. 42, 1235 (1964); Chem. Abst., Vol. 59, 8855 (1963) или Tetrahedron Lett., Vol. 30, 2129 (1989) по следующим схемам реакций:
Схема реакций 1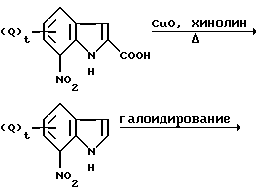

где Qs совпадают или отличаются друг от друга и каждый обозначает заместитель; G обозначает атом галогена, а t обозначает целое число от 0 до 2.
Схема реакции 2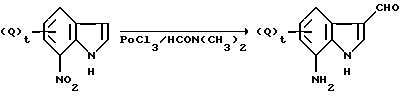

где значения Q и t указаны ранее.
Схема реакции 3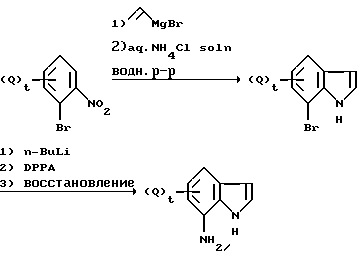
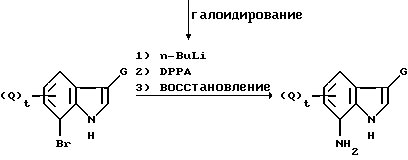
где значения Q, G и t указаны ранее, а DPPA обозначает дифенилфосфорилазид.
Схема реакции 4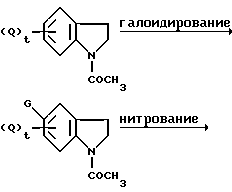

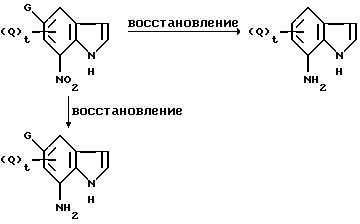
где значения Q, G и t указаны ранее, а DDQ обозначает 2,3-дихлор-5,6-дициано-1,4-бензохинон.
Если соединение по настоящему изобретению используют в качестве лекарства, его вводят перорально или парентерально. Хотя доза указанного соединения изменяется в зависимости от определенных симптомов; от возраста, пола, веса и чувствительности пациента; метода, времени и интервалов между введениями свойств, степени дисперсности и типа фармацевтической композиции; типа активного ингредиента и т.д., и хотя она специально не ограничивается, доза взрослого человека в день составляет от 10 до 6000 мг, предпочтительно приблизительно от 50 до 4000 мг, еще более предпочтительно от 100 до 3000 мг, и обычно вводится в 1 до 3 раз в день
Твердую композицию для перорального введения получают добавлением наполнителя и, в случае необходимости, связующего, разрыхлителя, смазывающего вещества, красителя и/или модификатора активного ингредиента и формуют обычным способом из полученной смеси таблетки, таблетки с покрытием, гранулы, мелкие гранулы, порошки или капсулы.
Примеры наполнителя включают лактозу, кукурузный крахмал, сахарозу, глюкозу, сорбит, кристаллическую целлюлозу и диоксид кремния; примеры связующего включают поливиниловый спирт, этилцеллюлозу, метилцеллюлозу, камедь, гидроксипропилцеллюлозу и гидроксипропилметилцеллюлозу; примеры смазывающих веществ включают стеарат магния, тальк и оксид кремния; примеры красителя включают те, которые разрешены в качестве фармацевтических добавок; и примеры модификаторов включают порошок какао, ментол, ароматизирующий порошок, мятное масло, борнеол и порошок коры коричневого дерева. Конечно, таблетка и гранулы могут в случае необходимости быть покрыты сахаром, желатином и т.п.
Инъекцию готовят добавлением к необходимому активному ингредиенту регулятора pH буфера, суспендирующего средства, солюбилизатора, стабилизатора, изотонического средства и/или консерванта и получают обычным способом инъекцию для внутривенного, подкожного или внутримышечного введения. В случае необходимости полученную суспензию можно высушить обычным методом сублимационной сушки.
Примеры суспендирующего агента включают метилцеллюлозу, Polysorbat 80, гидроксиметилцеллюлозу, камедь, порошок трагаканта, натриевую соль карбоксиметилцеллюлозы и полиоксиэтилен сорбитан монолаурат.
Примерами солюбилизатора являются отвержденное полиоксиэтиленом касторовое масло, Polysorbat 80, никотинамид, полиоксиэтилен сорбитан монолаурат макроголь и этиловый эфир жирной кислоты касторового масла.
Примеры стабилизатора включают сульфат натрия и метабисульфат натрия; примеры консерванта включают метиловый эфир п-гидроксибензойной кислоты, этиловый эфир п-гидроксибензойной кислоты, сорбиновую кислоту, фенол, крезол, и хлоркрезол.
Для иллюстрации воздействия соединения по настоящему изобретению далее приводятся Примеры проведения фармакологических экспериментов, при этом в качестве контрольного соединения для оценки воздействия используют известные гетеробициклический сульфонамид 2-сульфаниламино-5-хлорхиноксалин (CQS : открытая заявка Японии 62-426).
Экспериментальный пример 1
Антиопухолевый тест в условиях in vitro по отношению к клеткам 38 толстой кишки (раковые клетки толстой кишки мыши)
2,5 • 103 (0,1 мл) клеток 38 толстой кишки, суспендированные в среде RPM11640 (продукт компании "Sanko Juinyaku"), содержащей 10% сыворотки плода коровы, пенициллин (100 единиц/мл), стрептомицин (100 мкг/мл), меркаптоэтанол (5 • 10-5 М) и натриевую соль пированоградной кислоты (1 мМ), вносят в каждую ячейку планшета, содержащего 96 ячеек, и культивируют при 37oC в течение одного дня в инкубаторе, содержащем 5% диоксида углерода.
Испытуемое соединение по настоящему изобретению растворяют в диметилсульфоксиде с концентрацией 20 мг/мл и полученный раствор разбавляют средой 10%-ная сыворотка плода коровы/RPM11640 до концентрации 200 мкг/мл. Полученный раствор разбавляют средой 10%-ная сыворотка плода коровы/ RPM1640 и получают серии разбавленных в 3 раза растворов с максимальной концентрацией 200 мкг/мл. Полученные разбавленные растворы помещают в ячейки указанного выше планшета в количестве по 0,1 мл. Полученные пластины культивируют при 37oC в течение трех дней в инкубаторе, содержащем 5% диоксида углерода.
Затем в каждую ячейку добавляют раствор МТТ [3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолийбромида] (с концентрацией 3,3 мг/мл) в количестве 0,05 мл. Полученные смеси инкубируют в термостате еще в течение 2 час. Надосадочную жидкость удаляют откачиванием. Полученный формазан растворяют в 0,1 мл диметилсульфоксида. Определение поглощения на длине волны 540 нм проводят с помощью анализатора микропроб и используют величину поглощения в качестве показателя числа жизнеспособных клеток. Относительную величину ингибирования для испытуемого соединения рассчитывают в соответствии со следующей формулой для определения величины IC50 испытуемого соединения, где IC50 обозначает концентрацию, при которой подавляется 50% клеток 38 толстой кишки мыши.
Относительное ингибирование (%) = C - T / C • 100
T - поглощение ячейки, содержащей испытуемое соединение;
C - поглощение ячейки, не содержащей испытуемое соединение.
Полученные указанным образом величины IC50 представлены в табл. 1 - 1 и 1 - 2.
Экспериментальный пример 2
Антиопухолевый тест в условиях in vivo по отношению к клеткам 38 толстой кишки (раковые клетки толстой кишки мыши)
Приблизительно 75 мг клеток толстой кишки 38 подкожно трансплантируют в бок каждой мыши BDFI (в возрасте 7 недель, женские особи). Испытуемое соединение по настоящему изобретению суспендируют в физиологическом солевом растворе, содержащем 3,5% диметилсульфоксида и 6,5% Tween 80, и полученную суспензию вводят мышам внутрибрюшинно с предварительно определенной дозой один раз в день в течение 8 дней, начиная со следующего дня после трансплантации. С другой стороны, мышам контрольной группы вводят внутрибрюшинно лишь физиологический солевой раствор, содержащий 3,5% диметилсульфоксида и 6,5% Tween 80. Контрольную группу составляют десять мышей, а каждая испытуемая группа включает по шесть мышей.
На 21 день после трансплантации у каждой мыши полностью удаляют опухоль и определяют ее вес. Степень ингибирования роста опухоли определяют по следующей формуле:
Степень ингибирования роста (%) = C - T / C • 100
T - средний вес опухоли испытуемой группы;
C - средний вес опухоли контрольной группы.
Результаты представлены в табл. 2.
Экспериментальный пример 3
Антиопухолевый тест в условиях in vivo по отношению к клеткам HCT116 (раковые клетки толстой кишки человека)
Клетки HCT116 (5-8 • 106) имплантируют подкожно в бок лишенных волосяного покрова мышей (BALB/c. nu/nu, женские особи в возрасте от 7 до 8 недель). Испытуемое соединение по настоящему изобретению суспендируют в физиологическом солевом растворе, содержащем 3,5% диметилсульфоксида и 6,5% Tween 80, и полученную суспензию вводят внутрибрюшинно мышам, прошедшим указанную обработку, с определенной дозой один раз в день в течение 4 дней, начиная со следующего дня после того, как объем опухоли увеличится приблизительно на 100 куб. мм, что составляет приблизительно 7 дней после трансплантации. С другой стороны, мышам контрольной группы вводят внутрибрюшинно лишь физиологический солевой раствор, содержащий 3,5% диметилсульфоксида и 6,5% Tween 80. Контрольную группу составляет десять мышей, а каждая испытуемая группа включает по пять мышей. На 21 день после начала введения у каждой мыши полностью удаляют опухоль и определяют ее вес. Степень ингибирования роста опухоли определяют по следующей формуле:
Степень ингибирования роста (%) = C - T / C • 100
T - средний вес опухоли испытуемой группы;
C - средний вес опухоли контрольной группы.
Результаты представлены в табл. 3.
Как видно из результатов приведенных выше экспериментальных примеров, соединения по настоящему изобретению обладают превосходной антиопухолевой активностью и полезны в качестве антиопухолевого средства.
Примеры
Далее приводятся Препаративные примеры, касающиеся получения исходных соединений, используемых для получения соединений по настоящему изобретению, и Примеры, касающиеся отдельных соединений по настоящему изобретению, хотя настоящее изобретение не огранивается указанными примерами.
Препаративный пример 1
7-Бром-1H-индол
1,0 М раствор (100 мл) винилмагнийбромида (100 ммоль) в тетрагидрофуране добавляют к 250 мл раствора 5,05 г (25 ммоль) 2-бромнитробензола в тетрагидрофуране при температуре минус 40oC в атмосфере азота. Полученную смесь перемешивают в указанных условиях в течение 40 минут и выливают в 500 мл насыщенного водного раствора хлорида аммония. Экстрагируют этиловым эфиром. Органическую фазу сушат над сульфатом магния и упаривают. Остаток очищают колоночной хроматографией на силикагеле и получают 2,89 г целевого продукта.
Спектр ПМР (ДМСО-d6) δ (м.д.): 6,56 (1H, дублет дублетов, J = 2,9, 1,8 Гц), 6,94 (1H, триплет, J = 7,8 Гц), 7,30 (1H, дублет, J = 7,8 Гц), 7,40 (1H, триплет, J = 2,9 Гц), 7,56 (1H, дублет, J = 7,8 Гц).
Препаративный пример 2
7-Амино-1H-индол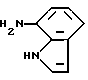
2,5 М раствор (16,5 мл) н-бутиллития (41,3 ммоль) в гексане добавляют по каплям к 50 мл раствора 2,70 г (13,8 ммоль) соединения, полученного в Препаративном примере 1, в тетрагидрофуране при температуре минут 70oC в атмосфере азота. Полученную смесь перемешивают при температуре минут 70oC в течение 15 минут и при температуре от минут 20 до минут 10oC в течение 30 минут. Полученную смесь снова охлаждают до температуры минус 70oC и добавляют по каплям 3,9 мл (18 ммоль) дифенилфосфорилазида. Полученную смесь перемешивают при температуре минус 70oC в течение часа и при температуре минус 40oC в течение часа. К полученной смеси при температуре минус 40oC добавляют 22,3 мл 3,4 М раствора бис(2-метоксиэтокси)алюмогидрида натрия (75,8 ммоль) в толуоле. Полученную смесь перемешивают при температуре от минус 30 до минус 20oC в течение 30 минут и при комнатной температуре в течение 30 минут и добавляют фосфатный буфер с pH 7,0. Полученную смесь отфильтровывают для удаления нерастворимых соединений и фильтрат экстрагируют этиловым эфиром. Органическую фазу отделяют, последовательно промывают насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором соли, сушат над сульфатом магния и упаривают. Остаток очищают колоночной хроматографией на силикагеле и получают 1,29 г целевого продукта.
Спектр ПМР (ДМСО-d6) δ/ (м.д.): 5,01 (2H, уширенный синглет), 6,25 - 6,33 (2H, мультиплет), 6,70 (1H, дублет дублетов, J = 7,9, 7,3 Гц), 6,78 (1H, дублет дублетов, J = 7,9, 0,7 Гц), 7,23 (1H, триплет, J = 2,7 Гц), 10,48 - 10,72 (1H, широкий мультиплет).
Каждое из следующий исходных соединений получают из производного 2-бромнитробензола аналогично методикам, приведенным в Препаративных примерах 1 и 2.
7-Амино-4-метокси-1H-индол
7-Амино-4-бром-1H-индол
Препаративный пример 3
7-бром-3-хлор-4-метил-1H-индол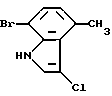
N-Хлорсукцинимид (4,0 г, 30,0 ммоль) добавляют к 250 мл ацетонитрильного раствора 5,8 г (27,6 ммоль) 7-бром-4-метил-1H-индола, полученного из 2-бром-5-метилнитробензола аналогично методике, приведенной в Препаративном примере 1. Полученную смесь оставляют на ночь перемешиваться при комнатной температуре и добавляют 50 мл 1N водного раствора едкого натра. Полученную смесь экстрагируют этилацетатом. Органическую фазу промывают водой, сушат над сульфатом магния и упаривают. Полученный остаток очищают колоночной хроматографией на силикагеле и получают 6,7 г целевого продукта.
Спектр ПМР (хлороформ-d) δ (м.д.): 2,74 (3H, синглет), 6,75 - 7,26 (3H, мультиплет, 8,23 (1H, уширенный синглет).
Препаративный пример 4
7-Амино-3-хлор-4-метил-1H-индол
Целевое соединение (2,6 г) получают по методике, аналогичной приведенной в Препаративном примере 2, из 6,37 г (26,1 ммоль) соединения, полученного в Препаративном примере 3.
Спектр ПМР (хлороформ-d) δ (м.д.); 2,70 (3H, синглет), 6,39 - 7,14 (3H, мультиплет), 8,15 (1H, уширенный синглет).
Препаративный пример 5
4-Сульфамоилбензолсульфохлорид
4-Аминобензолсульфонамид (6,4 г, 37,2 ммоль) добавляют к смеси, состоящей из 12,5 мл воды и 6,3 мл концентрированной соляной кислоты. Полученную смесь перемешивают, а затем по каплям добавляют насыщенный водный раствор 2,56 г (27,1 ммоль) нитрита натрия при температуре не выше 0oC. Образовавшуюся реакционную смесь добавляют при охлаждении в бане со льдом и перемешивании к раствору уксусной кислоты, насыщенному диоксидом серы (получают, насыщая 35 мл уксусной кислоты диоксидом серы и добавляя к полученному раствору 1,5 г хлористой меди). Через 10 минут полученную смесь выливают в ледяную воду, при этом образуется осадок. Этот осадок отделяют фильтрованием, промывают водой и растворяют в тетрагидрофуране. Полученный раствор сушат над сульфатом магния и упаривают досуха, получая 3,5 г целевого соединения.
Препаративный пример 6
4-(Сульфамоилметил)бензолсульфохлорид
4-Нитрофенилметансульфонамида (5,0 г, 23,1 ммоль) суспендируют в 90%-ной уксусной кислоте и гидрируют в присутствии палладия на угле при комнатной температуре и нормальном давлении. Полученную реакционную смесь отфильтровывают для удаления катализатора и фильтрат упаривают досуха, получая 4,3 г 4-аминофенилметансульфонамида. Этот продукт добавляют к смеси, состоящей из 40 мл воды и 4,1 мл концентрированной соляной кислоты. Полученную смесь перемешивают, а затем по каплям добавляют насыщенный водный раствор 1,63 г (23,6 ммоль) нитрита натрия при температуре не выше 0oC. Образовавшуюся реакционную смесь добавляют при охлаждении в бане со льдом и перемешивании к раствору уксусной кислоты, насыщенному диоксидом серы (получают, насыщая 30 мл уксусной кислоты диоксидом серы и добавляя к полученному раствору 0,97 г хлористой меди). Полученную смесь перемешивают при комнатной температуре в течение 40 минут и выливают в ледяную воду. Образовавшуюся смесь насыщают солью и экстрагируют этилацетатом. Органический слой сушат над сульфатом магния и упаривают досуха, получая 1,7 г целевого соединения.
Спектр ПМР (ДМСО-d6) δ (м.д.): 4,26 (2H, синглет), 7,32 (2H, дублет, J = 8,4 Гц), 7,59 (2H, дублет, J = 8,4 Гц).
Каждое из следующих соединений получают аналогично методикам, приведенным в Препаративных примерах 5 или 6.
4-(N-Метилсульфамоил)бензолсульфохлорид
4-(N-Этилсульфамоил)бензолсульфохлорид
4-(N-Метоксисульфамоил)бензолсульфохлорид
4-[(Метансульфонамидо)метил]бензолсульфохлорид
4-(N-Метилметансульфонамидо)бензолсульфохлорид
4-(1-Пирролидинсульфонил)бензолсульфохлорид
4-(1-Пирролидинилкарбонил)бензолсульфохлорид
3-Цианобензолсульфохлорид
4-(N-Метилсульфонил)бензолсульфохлорид
4-[(N-Метилметансульфонамидо)метил]бензолсульфохлорид.
Препаративный пример 7
3-Циано-7-нитро-1H-индол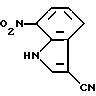
3-Формил-7-нитро-1H-индола (10,15 г, 53,4 ммоль) растворяют в 150 мл диметилформамида, а затем добавляют 3,93 г (56,0 ммоль) гидрохлорида гидроксиламина и 4,5 мл (55,6 ммоль) пиридина. Полученную смесь перемешивают при нагревании при температуре от 80 до 70oC в течение 2 часов, а затем добавляют 6,3 г (56,8 ммоль) диоксида селена и приблизительно 5 г сульфата магния. Полученную смесь нагревают при температуре от 70 до 80oC в течение 2,5 час и отфильтровывают для удаления нерастворимых остатков. Фильтрат упаривают. К концентрату добавляют воду и выпавшие кристаллы отделяют фильтрованием, последовательно промывают водой и этиловым эфиром и растворяют в смеси тетрагидрофуран/ацетон. Полученную смесь отфильтровывают для удаления нерастворимых соединений и добавляют этилацетат. Выпавшие кристаллы отделяют фильтрованием и получают 8,61 г целевого соединения.
Спектр ПМР (ДМСО-d6) δ (м.д.): 7,48 (1H, триплет, J = 8,1 Гц), 8,17 (1H, дублет, J = 8,1 Гц), 8,27 (1H, J = 8,1 Гц), 8,47 (1H, синглет), 12,70 - 13,00 (1H, шир.).
Препаративный пример 8
7-Амино-3-циано-1H-индол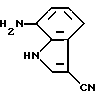
Соединение (2,80 г, 15,0 ммоль), полученное в Препаративном примере 7, суспендируют в 100 мл метанола и гидрируют в присутствии палладия на угле при комнатной температуре и нормальном давлении. После удаления катализатора фильтрованием фильтрат упаривают досуха и получают 2,31 г целевого продукта.
Спектр ПМР (ДМСО-d6) δ (м.д.): 5,32, 5,34 (2H, синглет + синглет), 6,47 (1H, дублет, J = 7,5 Гц), 6,81 (1H, дублет, J = 7,9 Гц), 6,94 (1H, дублет дублетов, J = 7,9, 7,5 Гц), 8,13 (1H, синглет), 11,55 - 11,90 (1H, шир.).
Препаративный пример 9
7-Амино-3,4-дихлор-1H-индол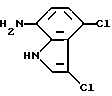
7-Бром-4-хлор-1H-индол, полученный из 2-бром-5-хлорнитробензола по методике, аналогичной приведенной в Препаративном примере 1, хлорируют в соответствии с методикой, приведенной в Препаративном примере 3. Полученный продукт превращают в целевое соединение, замещая атом брома на аминогруппу по методике, приведенной в Препаративном примере 2.
Спектр ПМР (ДМСО-d6) δ (м.д.): 5,26 (2H, синглет), 6,29 (1H, дублет, J = 87,1 Гц), 6,74 (1H, дублет, J = 8,1 Гц), 7,45 - 7,51 (1H, мультиплет), 11,08 - 11,27 (1H, мультиплет).
Аналогично получают 7-амино-4-трет-бутилдиметилсилилокси-3-хлор-1H-индол.
Препаративный пример 10
7-Амино-3-хлор-1H-индол
7-Нитро-1H-индол (1,076 г, 6,64 ммоль) растворяют в 30 мл ацетонитрила, а затем добавляют 920 мг (6,89 ммоль) N-хлорсукцинимида. Полученную смесь перемешивают при комнатной температуре в течение 36 час. Добавляют насыщенный водный раствор бикарбоната натрия, при этом образуется осадок. Его отделяют фильтрованием и промывают водой, получая 1,2 г порошка 3-хлор-7-нитро-1H-индола. Это порошок (863 мг, 4,39 ммоль) суспендируют в 10 мл этанола и добавляют 4,95 г (21,9 ммоль) дигидрата хлористого олова и 100 мкл концентрированной соляной кислоты. Полученную смесь кипятят с обратным холодильником в течение 30 минут и добавляют насыщенный водный раствор бикарбоната натрия. Отфильтровывают для удаления нерастворимых веществ, фильтрат экстрагируют этилацетатом. Органические вытяжки сушат над сульфатом магния и упаривают. Остаток очищают колоночной хроматографией на силикагеле и получают 490 мг целевого продукта.
Целевой продукт получают также гидрированием 3-хлор-7-нитро-1H-индола в присутствии платины на угле в качестве катализатора при комнатной температуре и нормальном давлении.
Спектр ПМР (ДМСО-d6) δ (м.д.): 5,14 (2H, синглет), 6,36 (1H, дублет дублетов, J = 7,5, 1,0 Гц), 6,68 (1H, дублет дублетов, J = 7,9, 0,73 Гц), 6,81 (1H, дублет дублетов, J = 7,9, 7,5 Гц), 7,39 (1H, дублет, J = 2,7 Гц), 10,85 (1H, уширенный синглет).
Препаративный пример 11
4-(2-Сульфамоилэтил)бензолсульфохлорид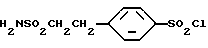
2-Фенилэтансульфонамид (1,3 г, 7,3 ммоль) в течение 20 минут добавляют при охлаждении на бане со льдом к 2,4 г (36,5 ммоль) хлорсульфоновой кислоты. Полученную смесь перемешивают при комнатной температуре в течение 90 минут и выливают в ледяную воду, экстрагируют этилацетатом, органическую фазу отделяют, последовательно промывают насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором соли, сушат над сульфатом магния и растворитель отгоняют в вакууме, получая 1,6 г целевого соединения.
Спектр ПМР (ДМСО-d6) δ (м.д.): 2,97 - 3,02 (2H, мультиплет), 3,21 - 3,26 (2H, мультиплет), 7,21 (2H, дублет, J = 8,4 Гц), 7,53 (2H, дублет, J = 8,4 Гц).
Аналогично получают каждое из следующих соединений:
4-[2-(Метилсульфонил)этил]бензолсульфохлорид
4-[2-(N-Метилметансульфонамидо)этил]бензолсульфохлорид
4-(N-Метилацетамидо)бензолсульфохлорид
Препаративный пример 12
5-Бром-7-нитро-1H-индол
1-Ацетил-5-бром-7-нитроиндол (5,05 г, 17,7 ммоль) добавляют к смеси 6 мл этанола и 40 мл 6 N раствора соляной кислоты. Полученную смесь кипятят с обратным холодильником в течение 3 часов, нейтрализуют бикарбонатом натрия и экстрагируют этилацетатом. Органические вытяжки промывают водой, сушат над сульфатом магния и упаривают. Остаток очищают колоночной хроматографией на силикагеле и получают 4,13 г 5-бром-7-нитроиндола. Это соединение (301 мг, 1,24 ммоль) растворяют в 10 мл толуола, а затем добавляют 580 мг (2,55 ммоль) 2,3-дихлор-5,6-дициано-1,4-бензохинона. Полученную смесь при перемешивании кипятят с обратным холодильником в течение 3,5 час и отфильтровывают. Фильтрат упаривают и полученный остаток очищают колоночной хроматографией на силикагеле, получая 252 мг целевого соединения.
Препаративный пример 13
5-Бром-3-формил-7-нитро-1H-индл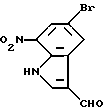
К 1,0 г (14 ммоль) диметилформамида при 0oC в атмосфере азота добавляют оксихлорид фосфора (210 мг, 1,4 ммоль). Полученную смесь перемешивают в течение 30 минут, а затем добавляют при 0oC 240 мг (1,0 ммоль) соединения, полученного в Препаративном примере 12. Перемешивают при 0oC в течение 20 минут и в течение 30 минут при температуре 100oC, охлаждают в бане со льдом и выливают в ледяную воду. Полученную смесь перемешивают в течение 30 минут, поддерживая pH в интервале от 7 до 8 добавлением 1 N водного раствора едкого натра. Полученный осадок отделяют фильтрованием и очищают колоночной хроматографией на силикагеле, получая 239 мг целевого соединения.
Спектр ПМР (ДМСО-d6) δ (м.д.): 8,31 (1H, дублет, J = 1,8 Гц), 8,55 (1H, синглет), 8,65 (1H, дублет, J = 1,8 Гц), 10,05 (1H, синглет), 12,89 (1H, уширенный синглет).
Препаративный пример 14
7-Амино-5-бром-3-циано-1H-индол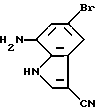
5-Бром-3-циано-7-нитро-1H-индол (214 мг, 0,8 ммоль), синтезированный из соединения, полученного в Препаративном примере 13, в соответствии с методикой, приведенной в Препаративном примере 7, растворяют в смеси 10 мл метанола и 10 мл тетрагидрофурана и гидрируют в присутствии оксида платины под давлением водорода 3,0 кг/кв. см. Катализатор отфильтровывают и фильтрат упаривают досуха, получая 189 мг целевого соединения.
Спектр ПМР (ДМСО-d6) δ (м.д.): 5,68 - 5,71 (2H, мультиплет), 6,60 (1H, дублет, J = 2,0 Гц), 6,91 (1H, дублет, J = 2,0 Гц), 8,16 (1H, синглет).
Препаративный пример 15
3-Ацетил-7-амино-1H-индол
1,0 М раствор (11 мл) диметилалюминийхлорида (11 ммоль) в гексане добавляют при 0oC в атмосфере азота к 50 мл раствора 1,2 г (7,5 ммоль) 7-нитро-1H-индола в дихлорметане, а затем при 0oC добавляют 2,1 мл (29,5 ммоль) хлористого ацетила. Полученную смесь перемешивают при комнатной температуре в течение 4 час, а затем добавляют насыщенный водный раствор хлорида аммония. Выделившийся осадок отфильтровывают и тщательно промывают горячим этанолом. Промывочный раствор и фильтрат объединяют и упаривают. К остатку добавляют воду и полученную смесь экстрагируют этилацетатом. Органическую фазу отделяют, промывают насыщенным водным раствором соли, сушат над сульфатом магния и растворитель отгоняют в вакууме. Остаток очищают колоночной хроматографией на силикагеле, получая 3-ацетил-7-нитро-1H-индол. Полученный продукт растворяют в 100 мл метанола и гидрируют в присутствии палладия на угле при комнатной температуре и нормальном давлении. После удаления катализатора фильтрованием фильтрат упаривают досуха и получают 790 мг целевого соединения.
Пример 1
N-(1H-Индол-7-ил)-4-нитробензолсульфонамид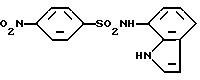
Соединение (1,50 г, 11,3 ммоль), полученное в Препаративном примере 2, растворяют в 40 мл пиридина. К полученному раствору при комнатной температуре и при перемешивании добавляют 2,57 г (11,6 ммоль) 4-нитробензолсульфохлорида. Полученную смесь оставляют на ночь перемешиваться при комнатной температуре и растворитель отгоняют в вакууме. К остатку добавляют этилацетат и 0,2 N раствор соляной кислоты. Органический слой отделяют, промывают водой, сушат над сульфатом магния и растворитель отгоняют в вакууме. Остаток очищают колоночной хроматографией на силикагеле, получая 3,50 г целевого соединения.
Спектр ПМР (ДМСО-d6) δ (м.д.), 6,42 (1H, дублет дублетов, J = 2,8, 2,0 Гц), 6,66 (1H, дублет, J = 7,6 Гц), 6,83 (1H, дублет дублетов, J = 8,0, 7,6 Гц), 7,31 (1H, дублет дублетов, J = 3,2, 2,8 Гц), 7,36 (1H, дублет, J = 8,0 Гц), 7,94 - 8,02 (2H, мультиплет), 8,30 - 8,38 (2H, мультиплет), 10,23 (1H, синглет), 10,74 - 10,87 (1H, мультиплет).
Пример 2
N-(3-хлор-1H-индол-7-ил)-4-нитробензолсульфонамид
Соединение (8,98 г, 28,3 ммоль), полученное в Примере 1, растворяют в смеси 280 мл дихлорметана и 7 мл диметилформамида и при перемешивании в атмосфере азота добавляют 4,16 г (31,2 ммоль) N-хлорсукцинимида. Полученную смесь перемешивают при комнатной температуре в течение 1,5 часов и добавляют 50 мл воды. Упаривают смесь до объема приблизительно 80 мл и добавляют этилацетат и 0,2 N водного раствора соляной кислоты. Органическую фазу отделяют, последовательно промывают насыщенным водным раствором бикарбоната натрия и водным раствором соли, сушат над сульфатом магния и растворитель отгоняют в вакууме. Полученный остаток очищают колоночной хроматографией на силикагеле, получая 7,98 г целевого соединения.
Т. пл.: 199,5 - 200,5oC (перекристаллизовывают из хлороформа)
Спектр ПМР (ДМСО-d6) δ (м.д.): 6,72 (1H, дублет, J = 7,6 Гц), 6,96 (1H, дублет дублетов, J = 8,0, 7,6 Гц), 7,31 (1H, дублет, J = 8,0 Гц), 7,47 - 7,53 (1H, мультиплет), 7,92 - 8,02 (2H, мультиплет), 8,30 - 8,41 (2H, мультиплет), 10,33 (1H, синглет), 11,07 - 11,22 (1H, мультиплет).
Пример 3
4-Амино-N-(3-хлор-1H-индол-7-ил)бензоилсульфонамид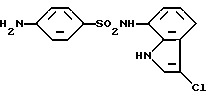
Соединение (7,98 г, 2,7 ммоль), полученное в Примере 2, растворяют в 220 мл метанола. Полученный раствор кипятят при перемешивании с обратным холодильником. Тремя порциями с интервалами 10 минут добавляют к полученному раствору 10 мл концентрированной соляной кислоты и 7,40 г цинковой пыли и кипятят в течение 10 минут, охлаждают, нейтрализуют большим избытком бикарбоната натрия и отфильтровывают для удаления нерастворимых соединений. Фильтрат упаривают и полученный остаток растворяют в этилацетате. Полученный раствор последовательно промывают насыщенным водным раствором бикарбоната натрия, 2 N раствором карбоната натрия и насыщенным водным раствором соли, сушат над сульфатом магния и растворитель отгоняют в вакууме, получая 7,21 г целевого соединения.
Т. пл. 174,5 - 176oC (перекристаллизовывают из смеси этанол/н-гексан)
Спектр ПМР (ДМСО-d6) δ (м.д.): 5,97 (2H, уширенный синглет), 6,48 (2H, дублет, J = 8,8 Гц), 6,88 (1H, дублет, J = 7,6 Гц), 6,95 (1H, дублет дублетов, J = 8,0, 7,6 Гц), 7,19 (1H, дублет, J = 8,0 Гц), 7,36 (1H, дублет, J = 8,8 Гц), 7,46 (1H, дублет, J = 2,4 Гц), 9,56 (1H, синглет), 10,86 - 10,98 (1H, мультиплет).
Пример 4
N-(3-Хлор-1H-индол-7-ил)-4-(метансульфонамидо)бензолсульфонамид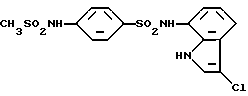
Соединение (68 мг, 0,211 ммоль), полученное в Примере 3, растворяют в 1 мл пиридина и добавляют 15 мкл (0,194 ммоль) метансульфохлорида. Полученную смесь оставляют на ночь перемешиваться при комнатной температуре и добавляют водный раствор бикарбоната натрия. Полученную смесь экстрагируют этилацетатом. Органическую фазу отделяют, последовательно промывают разбавленной соляной кислотой и водой, сушат над сульфатом магния и упаривают. Полученный остаток очищают методом тонкослойной хроматографии на силикагеле и получают 76 мг целевого соединения.
Т. пл. : 213,5 - 214oC (с разложением) (перекристаллизовывают из смеси этанол/н-гексан)
Спектр ПМР (ДMCO-d6) δ (м.д.): 3,08 (3H, синглет), 6,83 (1H, дублет, J = 7,5 Гц), 6,96 (1H, дублет дублетов, J = 7,9, 7,7 Гц), 7,23 (2H, дублет, J = 8,8 Гц), 7,24 (1H, дублет, J = 7,5 Гц), 7,47 (1H, дублет, J = 2,7 Гц), 7,68 (2H, дублет, J = 8,8 Гц), 9,92 (1H, уширенный синглет), 10,38 (1H, уширенный синглет), 10,99 (1H, уширенный синглет).
Пример 5
4-Бромметил-N-(1H-индол-7-ил)бензолсульфонамид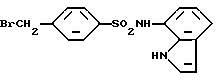
4-Бромметилбензолсульфохлорид вводят во взаимодействие с соединением, полученным в Препаративном примере 2, при комнатной температуре в присутствии эквимолярного количества пиридина в тетрагидрофуране и полученную реакционную смесь обрабатывают так же, как в Примере 1, получая целевое соединение.
Спектр ПМР (ДMCO-d6) δ/ (м.д.): 4,70 (2H, синглет), 6,40 (1H, дублет дублетов, J = 3,1, 1,1 Гц), 6,71 (1H, два дублета дублетов, J = 7,6, 3,2, 0,92 Гц), 6,81 (1H, два дублета дублетов, J = 8,1, 7,4, 0,92 Гц), 7,29 - 7,32 (2H, мультиплет), 7,57 (2H, дублет, J = 8,2 гц), 7,73 (2H, дублет, J = 8,4 Гц), 9,96 (1H, уширенный синглет), 10,75 (1H, уширенный синглет).
Пример 6
N-(1,3-Дигидро-2H-индол-2-он-7-ил)-4-метилбензолсульфонамид
Целевое соединение получают аналогично методике, приведенной в Примере 1.
Т. пл. : постепенно начинает разлагаться приблизительно при температуре 246oC и быстро разлагается при температуре 267 - 269oC (перекристаллизовывают из диоксана).
Пример 7
3-Хлор-N-(3-хлор-1H-индол-7-ил)бензолсульфонамид
3-Хлор-N-(1H-индол-7-ил)бензолсульфонамид (2,18 г, 7,11 ммоль), полученный аналогично методике, приведенной в Примере 1, хлорируют аналогично методике, приведенной в Примере 2, и выделяют 1,86 г целевого соединения.
Т. пл. : 180 - 181oC (перекристаллизовывают из смеси дихлорметан/ди-изо-пропиловый эфир)
Спектр ПМР (ДMCO-d6) δ (м.д.): 6,73 (1H, дублет, J = 7,6 Гц), 6,97 (1H, дублет дублетов, J = 8,0, 7,6 Гц), 7,30 (1H, дублет, J = 8,0 Гц), 7,45 - 7,51 (1H, мультиплет), 7,51 - 7,76 (4H, мультиплет), 10,09 (1H, синглет), 11,02 - 11,18 (1H, мультиплет).
Пример 8
4-Амино-N-(3,4-дихлор-1H-индол-7-ил)бензолсульфонамид
Аналогично методике, приведенной в Примере 3, целевое соединение (2,03 г) получают из 2,43 г (6,29 ммоль) N-(3,4-дихлор-1H-индол- 7-ил)-4-нитробензолсульфонамида, синтезированного аналогично методике, приведенной в Примере 1.
Т. пл. : 205 - 206,5oC (с разложением) (перекристаллизовывают из смеси этанол/н-гексан)
Спектр ПМР (ДMCO-d6) δ (м.д.): 6,00 (2H, синглет), 6,50 (2H, дублет, J = 8,4 Гц), 6,77 (1H, дублет, J = 8,0 Гц), 6,94 (1H, дублет, J = 8,0 Гц), 7,35 (2H, дублет, J = 8,4 Гц), 7,51 - 7,58 (1H, мультиплет), 9,57 (1H, синглет), 11,20 - 11,38 (1H- мультиплет).
Пример 9
4-[N-(1H-индол-7-ил)сульфамоил/бензойная кислота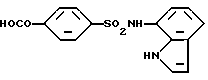
Целевое соединение получают аналогично методике, приведенной в Примере 1.
Спектр ПМР (ДMCO-d6) δ (м.д.): 6,40 (2H, дублет дублетов, J = 2,9, 1,9 Гц), 6,67 (1H, дублет, J = 7,5 Гц), 6,82 (1H, дублет дублетов, J = 7,9, 7,5 Гц), 7,31 (1H, дублет дублетов, J = 2,9, 2,7 Гц), 7,99 - 8,07 (2H, мультиплет), 10,07 (1H, синглет), 10,73 - 10,83 (1H, мультиплет), 13,30 - 13,58 (1H, шир.).
Пример 10
N-(3-Хлор-1H-индол-7-ил)-4-цианобензолсульфонамид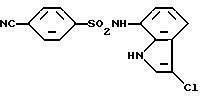
Аналогично методике, приведенной в Примере 2, 2,76 г целевого соединения получают из 100 мг 4-циано-N-(1H-индол-7-ил)бензолсульфонамида, синтезированного аналогично методике, приведенной в Примере 1.
Т. пл.: 210 - 211oC (перекристаллизовывают из смеси этилацетат/н-гексан)
Спектр ПМР (ДMCO-d6) δ (м.д.): 6,71 (1H, дублет дублетов, J = 7,6, 0,8 Гц), 6,96 (1H, дублет дублетов, J = 8,0, 7,6 Гц), 7,30 (2H, дублет, J = 8,0 Гц), 7,48 (1H, дублет дублетов, J = 2,4, 0,8 Гц), 7,82 - 7,90 (2H, мультиплет), 7,97 - 8,05 (2H, мультиплет), 10,25 (1H, синглет), 11,04 - 11,15 (1H, мультиплет).
Пример 11
3-Хлор-N-(3-хлор-4-метокси-1H-индол-7-ил)бензолсульфонамид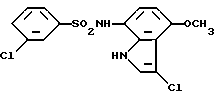
Аналогично методике, приведенной в Примере 2, получают 52 мг целевого соединения из 100 мг 4-хлор-N-(4-метокси-1H-индол-7-ил) бензолсульфонамида, синтезированного аналогично методике, приведенной в Примере 1.
Спектр ПМР (ДMCO-d) δ (м.д.): 3,79 (3H, синглет), 6,37 (1H, дублет, J = 8,4 Гц), 6,45 (1H, дублет, J = 8,4 Гц), 7,24 - 7,31 (1H, мультиплет), 7,48 - 7,77 (4H, мультиплет), 9,76 (1H, синглет), 11,06 - 11,17 (1H, мультиплет).
Пример 12
3-Хлор-N-(3-хлор-4-гидрокси-1H-индол-7-ил)бензолсульфонамид
N-(4-трет-бутилдиметилсилилокси-3-хлор-1H-индол-7-ил)-3- хлор-бензолсульфонамид (220 мг, 0,47 ммоль), полученный аналогично методике, приведенной в Примере 1, добавляют к 2 мл смеси 40%-ного раствора плавиковой кислоты и ацетонитрила в соотношении 1:10. Полученную смесь оставляют на ночь перемешиваться при комнатной температуре, а затем разбавляют водой, экстрагируют этилацетатом. Органическую фазу отделяют, сушат над сульфатом магния и упаривают. Остаток очищают колоночной хроматографией на силикагеле и получают 141 мг целевого соединения.
Спектр ПМР (ДMCO-d6) δ (м.д.): 6,15 (1H, дублет дублетов, J = 8,2, 1,5 Гц), 6,26 (1H, дублет, J = 8,2 Гц), 7,12 (1H, синглет), 7,47 - 7,64 (4H, мультиплет), 9,54 (1H, синглет), 10,85 (1H, синглет).
Пример 13
N-(1H-Индазол-7-ил)-4-метоксибензолсульфонамид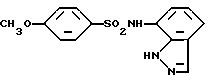
Целевое соединение получают по методике, аналогичной приведенной в Примере 1.
Т. пл.: 155 - 156oC (перекристаллизовывают из смеси этилацетат/н-гексан)
Спектр ПМР (ДMCO-d6) δ/ (м.д.): 3,77 (3H, синглет), 6,91 - 6,99 (2H, мультиплет), 6,98 - 7,07 (2H, мультиплет), 7,45 - 7,63 (1H, мультиплет, 7,64 - 7,94 (2H, мультиплет), 8,01 - 8,07 (1H, мультиплет), 9,97 (1H, синглет), 12,61 - 12,72 (1H, мультиплет).
Пример 14
6-Хлор-N-(3-хлор-1H-индол-7-ил)-3-пиридинсульфонамид
6-Хлор-3-пиридинсульфохлорид вводят во взаимодействие с соединением, полученным в Препаративном примере 2, аналогично методике, приведенной в Примере 1, с образованием 6-хлор-N-(1H-индол-7-ил)-3-пиридинсульфонамида и полученный продукт хлорируют в соответствии с методикой, приведенной в Примере 2, и выделяют целевое соединение.
Спектр ПМР (ДМСО-d6) δ (м.д.): 6,73 (1H, дублет, J = 7,7 Гц), 6,97 (1H, дублет дублетов, J = 7,9, 7,7 Гц), 7,30 (1H, дублет, J = 7,9 Гц), 7,46 (1H, дублет, J = 2,6 Гц), 7,67 (1H, дублет, J = 8,4 Гц), 8,03 (1H, дублет дублетов, J = 8,4, 2,6 Гц), 8,62 (1H, дублет, J = 2,6 Гц), 10,18-10,34 (1H, шир..), 11,06-11,17 (1H, мультиплет).
Пример 15
N-(3-Хлор-1H-индол-7-ил)-4-(метилтиометил)бензолсульфонамид
Соединение (1,97 г, 5,37 ммоль), полученное в Примере 5, растворяют в 10 мл тетрагидрофурана, добавляют при комнатной температуре 10 мл 15%-ного водного раствора метилтиолята натрия (39,4 ммоль) и каталитическое количество метилтриоктиламмонийхлорида. Полученную смесь оставляют перемешиваться на ночь, добавляют 20 мл воды, экстрагируют этилацетатом. Органическую фазу отделяют, промывают водой, сушат над сульфатом магния и упаривают. Остаток очищают колоночной хроматографией на силикагеле и получают 1,51 г N-(1H-индол-7-ил)-4-(метилтиометил)бензолсульфонамида. Полученный продукт хлорируют аналогично методике, приведенной в примере 2, и получают 839 мг целевого соединения.
Спектр ПМР (ДМСО-d6) δ (м.д.): 1,87 (3H, синглет), 3,70 (2H, синглет), 6,77 (1H, дублет дублетов, J = 7,6, 2,1 Гц), 6,94 (1H, дублет дублетов, J = 7,9, 7,7 Гц), 7,24 (1H, дублет, J = 7,9 Гц), 7,42 (2H, дублет, J = 8,2 Гц), 7,47 (1H, дублет, J = 2,6 Гц), 7,67 (2H, дублет, J = 8,4 Гц), 9,96 (1H, уширенный синглет), 11,01 (1H, уширенный синглет).
Пример 16
3-Хлор-N-(3-формил-1H-индол-7-ил)бензолсульфонамид
Добавляют по каплям при перемешивании оксихлорид фосфора (1,3 мл, 13,9 ммоль) к 14,5 мл диметилформамида в атмосфере азота при температуре 10oC. Полученную смесь перемешивают при температуре приблизительно 5oC в течение 30 минут. В три приема к полученной смеси добавляют 2,50 г (8,15 ммоль) 3-хлор-N-(1H-индол-7-ил)бензолсульфонамида, полученного по методике, аналогичной приведенной в Примере 1. Перемешивают смесь при температуре приблизительно 5oC еще в течение 30 минут и добавляют 200 мл холодной воды. Доводят pH смеси до величины приблизительно 14 с помощью 1N водного раствора едкого натра, а затем до величины приблизительно 2 с помощью 1N раствора соляной кислоты. Экстрагируют полученную смесь этилацетатом. Органическую фазу отделяют, промывают насыщенным водным раствором соли, сушат над сульфатом магния и упаривают. Остаток очищают колоночной хроматографией на силикагеле и получают 1,45 г целевого соединения.
Спектр ПМР (ДМСО-d6) δ (м.д.): 6,70 (1H, дублет дублетов, J = 7,6, 0,8 Гц), 7,06 (1H, дублет дублетов, J = 8,0, 7,6 Гц), 7,51-7,75 (4H, мультиплет), 7,93 (1H, дублет, J = 8,0 Гц), 8,22-8,28 (1H, мультиплет), 9,93 (1H, синглет), 11,17 (1H, синглет), 11,86-11,98 (1H, мультиплет).
Пример 17
3-Хлор-N-(3-циано-1H-индол-7-ил)бензолсульфонамид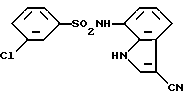
Гидрохлорид гидроксиламина (274 мг, 3,94 ммоль) и пиридин (0,32 мл, 3,96 ммоль) добавляют к раствору (18 мл) 1,20 г (3,58 ммоль) соединения, полученного по Примеру 16, в диметилформамиде при температуре 70-80oC и при перемешивании. Полученную смесь перемешивают в указанных условиях в течение 2,5 час, а затем добавляют 437 мг (3,94 ммоль) диоксида селена и приблизительно 100 мг порошка сульфата магния. Перемешивают еще в течение 3 час и растворитель отгоняют в вакууме. К остатку добавляют этилацетат и отфильтровывают. Фильтрат последовательно промывают 0,1N раствором соляной кислоты и насыщенным раствором соли, сушат над сульфатом магния и растворитель отгоняют в вакууме. Остаток очищают колоночной хроматографией на силикагеле и получают 678 мг целевого соединения.
Т. пл.: 204,5-205oC (перекристаллизовывают из смеси этилацетат/н-гексан)
Спектр ПМР (ДМСО-d6) δ (м.д.): 6,71 (1H, дублет, J = 7,6 Гц), 7,08 (1H, дублет дублетов, J = 8,0, 7,6 Гц), 7,47 (1H, дублет, J = 8,0 Гц), 7,50-7,76 (4H, мультиплет), 8,17-8,25 (1H, мультиплет), 10,21 (1H, синглет), 11,92-12,09 (1H, мультиплет).
Пример 18
6-Хлор-N-(3-циано-1H-индол-7-ил)-3-пиридинсульфонамид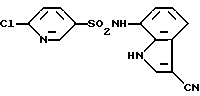
Целевое соединение получают аналогично методике, приведенной в примере 1.
Спектр ПМР (ДМСО-d6) δ (м.д.): 6,77 (1H, дублет, J = 7,9 Гц), 7,12 (1H, триплет, J = 7,9 Гц), 7,50 (1H, дублет, J = 7,9 Гц), 7,72 (1H, дублет, J = 8,4 Гц), 8,06 (1H, дублет дублетов, J = 8,4, 2,6 Гц), 8,23 (1H, дублет, J = 2,6 Гц), 8,65 (1H, дублет, J = 2,6 Гц), 10,34-10,48 (1H, ушир.), 11,98-12,12 (1H, мультиплет).
Пример 19
N-(3-Хлор-1H-индол-7-ил)-4-сульфамоилбензолсульфонамид
Соединение (767 мг, 3,0 ммоль), полученное в препаративном примере 5, вводят во взаимодействие с соединением (264 мг, 2,0 ммоль, полученным в Препаративном примере 2, аналогично методике, приведенной в Примере 1, и полученную смесь обрабатывают в соответствии с Примером 1. Получают 445 мг N-(1H-индол-7-ил)-4-сульфамоилбензолсульфонамида. Полученный продукт хлорируют в соответствии с методикой, приведенной в Примере 2, и получают 349 мг целевого соединения.
Т. пл. : начинает чернеть при температуре приблизительно 220oC и постепенно разлагается при температуре приблизительно 240oC (перекристаллизовывают из смеси этанол/н-гексан).
Спектр ПМР (ДМСО-d6) δ (м.д.): 6,75 (1H, дублет, J = 7,6 Гц), 6,96 (1H, дублет дублетов, J = 8,0, 7,6 Гц), 7,29 (1H, дублет, J = 7,6 Гц), 7,50 (1H, дублет, J = 2,8 Гц), 7,58 (2H, синглет), 7,90-7,98 (4H, мультиплет), 10,23 (1H, синглет), 11,07-11,17 (1H, мультиплет).
Пример 20
3-Хлор-N-(8-имидазо[1,2-a]пиридинил)бензолсульфонамида гидрохлорид
2,3-Диаминопиридин (1,97 г, 18 ммоль) растворяют в смеси тетрагидрофуран/вода и добавляют раствор 1,90 г (9,0 ммоль) 3-хлорбензолсульфохлорида в тетрагидрофуране. Полученную смесь оставляют перемешиваться на ночь при комнатной температуре и разбавляют водой и дихлорметаном. Органическую фазу отделяют, переносят в отдельный сосуд и трут палочкой по стенкам сосуда, чтобы вызывать кристаллизацию. Образовавшиеся кристаллы отделяют фильтрованием и получают 1,41 г N-(2-амино-3-пиридинил)-3-хлорбензолсульфонамида. 530 мг (1,87 ммоль) полученных кристаллов растворяют в метаноле и добавляют 40%-ный водный раствор хлорацетальдегида (367 мг, 1,87 ммоль). Полученную смесь кипятят с обратным холодильником в течение 4 час и упаривают досуха. К остатку добавляют небольшое количество метанола и отфильтровывают, получая 373 мг целевого продукта в виде кристаллов.
Т. пл. : начинает постепенно разлагаться при температуре приблизительно 210oC (перекристаллизовывают из этанола).
Пример 21
N-(3,4-дихлор-1H-индол-7-ил)-4-сульфамоилбензолсульфонамид
Аналогично методике, приведенной в Примере 1, 429 мг (1,68 ммоль) соединения, полученного в препаративном Примере 5, вводят во взаимодействие с 250 мг (1,24 ммоль) соединения, полученного в Препаративном примере 9, и реакционную смесь обрабатывают, получая 200 мг целевого соединения.
Т. пл. : начинает разлагаться при температуре приблизительно 282oC (перекристаллизовывают из смеси этанол-этиловый эфир).
Спектр ПМР (ДМСО-d6) δ/ (м.д.): 6,62 (1H, дублет, J = 8,1 Гц), 6,95 (1H, дублет, J = 8,1 Гц), 7,53-7,62 (3H, мультиплет), 7,87-7,99 (4H, мультиплет), 10,17-10,33 (1H, ушир.), 11,44-11,56 (1H, мультиплет).
Пример 22
N-(3-Хлор-1H-индол-7-ил)-4-(метилтио)бензолсульфонамид
Целевое соединение получают аналогично методикам, приведенным в примерах 1 и 2.
Спектр ПМР (ДМСО-d6) δ (м. д.): 2,48 (3H, синглет), 6,82 (1H, дублет дублетов, J = 7,9, 1,5 Гц), 6,96 (1H, дублет дублетов, J = 8,1, 7,5 Гц), 7,25 (1H, дублет дублетов, J = 7,9, 0,92 Гц), 7,33 (2H, дублет, J = 8,8 Гц), 7,49 (1H, дублет, J = 2,7 Гц), 7,62 (2H, дублет, J = 8,6 Гц), 9,96 (1H, уширенный синглет), 11,02 (1H, уширенный синглет).
Пример 23
N-(3-Хлор-1H-индол-7-ил)-4-(метилсульфонил)бензолсульфонамид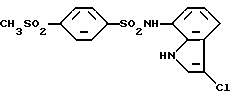
Соединение (54,2 мг, 0,154 ммоль), полученное в Примере 22, растворяют в смеси 2 мл метанола и 1,2 мл воды, а затем добавляют 30 мг тетрагидрата молибдата аммония и 0,6 мл 30%-ного водного раствора перекиси водорода. Полученную смесь оставляют перемешиваться на ночь, разбавляют водой и экстрагируют этилацетатом. Органическую фазу отделяют, промывают водой, сушат над сульфатом магния и упаривают. Остаток очищают колоночной хроматографией на силикагеле и получают 29,4 мг целевого соединения.
Т. пл.: начинает обесцвечиваться при температуре приблизительно 250oC и разлагается при температуре 264 - 266oC (перекристаллизовывают из смеси этанол/н-гексан).
Спектр ПМР (ДМСО-d6) δ (м.д.): 3,28 (3H, синглет), 6,75 (1H, дублет, J = 7,7 Гц), 6,97 (1H, дублет дублетов, J = 7,9, 7,7 Гц), 7,30 (1H, дублет, J = 8,1 Гц), 7,50 (1H, дублет, J = 2,7 Гц), 7,97 (2H, дублет, J = 8,2 Гц), 8,09 (2H, дублет, J = 8,4 Гц), 10,29 (1H, уширенный синглет), 11,12 (1H, уширенный синглет).
Пример 24
N-(3-Хлор-1H-индол-7-ил)-4-(метилсульфинил)бензолсульфонамид
Соединение (19,9 мг, 0,056 ммоль), полученное по Примеру 22, растворяют в 2 мл дихлорметана и при перемешивании и охлаждении в бане со льдом добавляют 10 мг (0,058 ммоль) м-хлорнадбензойной кислоты. Через час к полученной реакционной смеси добавляют насыщенный раствор бикарбоната натрия и экстрагируют этилацетатом. Органическую фазу отделяют, промывают водой, сушат над сульфатом магния и упаривают. Остаток очищают методом тонкослойной хроматографии на силикагеле и получают 14,4 мг целевого соединения.
Спектр ПМР (ДМСО-d6) δ (м.д.): 2,76 (3H, синглет), 6,78 (1H, дублет дублетов, J = 7,5, 1,1 Гц), 6,96 (1H, дублет триплетов, J = 0,55, J = 7,8 Гц), 7,28 (1H, дублет дублетов, J = 7,6, 0,82 Гц), 7,48 (1H, дублет, J = 2,7 Гц), 7,82 (2H, дублет, J = 8,6 Гц), 7,89 (2H, дублет, J = 8,8 Гц), 10,15 (1H, уширенный синглет), 11,06 (1H, уширенный синглет).
Пример 25
3-Хлор-N-(3-хлор-1H-пирроло[3,2-c]пиридин-7-ил)бензолсульфонамид
Целевое соединение получают аналогично методикам, приведенным в Примерах 1 и 2.
Спектр ПМР (ДМСО-d6) δ (м.д.): 7,41 - 7,65 (2H, мультиплет), 7,65 - 7,77 (2H, мультиплет), 7,74 - 7,86 (2H, мультиплет), 8,40 - 8,62 (1H, широкий мультиплет), 12,38 - 12,58 (1H, ушир.), 13,56 - 13,74 (1H, ушир.).
Пример 26
4-Ацетамидо-N-(3-хлор-4-метил-1H-индол-7-ил)бензолсульфонамид
Целевое соединение получают аналогично методике, приведенной в Примере 1.
Т. пл. : начинает постепенно разлагаться при температуре приблизительно 225oC (перекристаллизовывают из смеси этанол/н-гексан).
Спектр ПМР (ДМСО-d6) δ (м.д.): 2,03 (3H, синглет), 2,56 (3H, синглет), 6,54 - 6,60 (2H, мультиплет), 7,33 (1H, дублет, J = 2,6 Гц), 7,60 (2H, дублет, J = 9,0 Гц), 7,64 (2H, дублет, J = 9,0 Гц), 9,63 (1H, уширенный синглет), 10,24 (1H, уширенный синглет), 10,92 (1H, уширенный синглет).
Пример 27
4-Амино-N-(3-хлор-4-метил-1H-индол-7-ил)бензолсульфонамид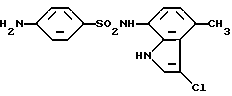
Соединение (3,75 г, 9,9 ммоль), полученное в Примере 26, растворяют в 25 мл 2N водного раствора едкого натра. Полученный раствор перемешивают при температуре 100oC в течение 2 час и охлаждают до комнатной температуры. Доводят pH полученного раствора до 6 с помощью уксусной кислоты, при этом выпадает осадок. Осадок выделяют фильтрованием и очищают колоночной хроматографией на силикагеле, получая 1,1 г целевого соединения.
Т. пл. : начинает постепенно разлагаться при температуре приблизительно 230oC (перекристаллизовывают из смеси этанол/н-гексан).
Спектр ПМР (ДМСО-d6) δ (м.д.): 2,56 (3H, синглет), 5,93 (2H, уширенный синглет), 6,46 (2H, дублет, J = 8,8 Гц), 6,59 (1H, дублет, J = 7,8 Гц), 6,64 (1H, дублет, J = 7,8 Гц), 7,31 (2H, дублет, J = 8,8 Гц), 7,36 (1H, дублет, J = 2,9 Гц), 9,34 (1H, уширенный синглет), 10,88 (1H, уширенный синглет).
Пример 28
4-Циано-N-(3-циано-1H-индол-7-ил)бензолсульфонамид
Целевое соединение получают аналогично методике, приведенной в Примере 1.
Т. пл. : 250,5 - 252oC (перекристаллизовывают из смеси этилацетат/н-гексан)
Спектр ПМР (ДМСО-d6) δ (м.д.): 6,67 (1H, дублет, J = 7,7 Гц), 7,05 (1H, триплет, J = 7,9 Гц), 7,44 (1H, дублет, J = 7,7 Гц), 7,78 - 7,87 (2H, мультиплет), 7,97 - 8,05 (2H, мультиплет), 8,16 - 8,23 (1H, мультиплет), 10,28 - 10,43 (1H, ушир.), 11,92 - 12,09 (1H, мультиплет).
Пример 29
4-Карбамоил-N-(3-хлор-1H-индол-7-ил)бензолсульфонамид
Водный раствор перекиси водорода (30%, 2,4 мл) и 6N водный раствор (360 мкл) едкого натра порциями в три приема добавляют к раствору 1,0 г (3,01 ммольь) соединения, полученного по Примеру 10, в 4,8 мл этанола (температура реакции приблизительно 50oC). Полученную смесь перемешивают при 50oC еще в течение 30 минут, подкисляют разбавленной соляной кислотой и экстрагируют этилацетатом. Органическую фазу отделяют, промывают водой, сушат над сульфатом магния и упаривают. Остаток очищают колоночной хроматографией на силикагеле, получая 600 мг целевого соединения.
Т. пл. : начинает обесцвечиваться и разлагаться при температуре приблизительно 248oC и быстро разлагается при температуре 252,5 - 253,5oC (перекристаллизовывают из смеси этилацетат/н-гексан).
Спектр ПМР (ДМСО-d6) δ/ (м.д.): 6,76 (1H, дублет, J = 7,5 Гц), 6,95 (1H, дублет дублетов, J = 8,1, 7,5 Гц), 7,27 (1H, дублет, J = 8,1 Гц), 7,49 (2H, дублет, J = 2,6 Гц), 7,59 (1H, уширенный синглет), 7,76 - 7,83 (2H, мультиплет), 7,91 - 7,98 (2H, мультиплет), 8,12 (1H, уширенный синглет), 10,10 (1H, синглет), 11,01 - 11,12 (1H, мультиплет).
Пример 30
N-(4-Бром-1H-индол-7-ил)-4-нитробензолсульфонамид
Целевое соединение получают аналогично методике, приведенной в примере 1.
Спектр ПМР (ДМСО-d6) δ (м.д.): 6,35-6,41 (1H, мультиплет), 6,56 (1H, дублет, J = 8,4 Гц), 7,06 (1H, дублет дублетов, J = 8,4, 0,8 Гц), 7,41-7,48 (1H, мультиплет), 7,92-8,02 (2H, мультиплет), 8,30-8,41 (2H, мультиплет), 10,34 (1H, синглет), 11,18-11,32 (1H, мультиплет).
Пример 31
N-(3-Хлор-4-циано-1H-индол-7-ил)-4-нитробензолсульфонамид
Соединение (200 мг, 0,505 ммоль), полученный в Примере 30, растворяют в 0,8 мл N-метилпирролидина и добавляют 83 мг (0,91 ммоль) цианида меди. Полученную смесь перемешивают при температуре 180-190oC в течение 3 час и добавляют 40 мл ледяной воды. Отфильтровывают для удаления нерастворимых соединений. Нерастворимые соединения промывают водой и экстрагируют горячим этанолом и горячим хлороформом. Органические вытяжки упаривают и очищают методом тонкослойной хроматографии на силикагеле, получая 65 мг N-(4-циано-1H-индол-7-ил)-4- нитробензолсульфонамида. Полученный продукт хлорируют аналогично методике, приведенной в примере 2, и получают 42 мг целевого продукта.
Спектр ПМР (ДМСО-d6) δ (м.д.): 6,98 (1H, дублет, J = 8,0 Гц), 7,51 (1H, дублет, J = 8,0 Гц), 7,79 (1H, дублет, J = 2,8 Гц), 7,99-8,08 (2H, мультиплет), 8,31-8,40 (2H, мультиплет), 10,75-10,95 (1H, шир.), 11,62-11,73 (1H, мультиплет).
Пример 32
4-Амино-N-(3-хлор-4-циано-1H-индол-7-ил)бензолсульфонамид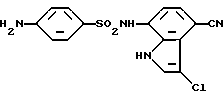
Целевое соединение синтезируют из соединения, полученного по примеру 31, аналогично методике, приведенной в примере 3.
Т. пл. : начинает постепенно разлагаться при температуре приблизительно 232oC и быстро разлагается при температуре 249,5-255oC (перекристаллизовывают из н-гексана).
Спектр ПМР (ДМСО-d6) δ (м.д.): 6,09 (2H, синглет), 6,52 (2H, дублет, J = 8,8 Гц), 7,10 (1H, дублет, J = 8,4 Гц), 7,2-7,9 (1H, мультиплет), 10,20 (1H, синглет), 11,40-11,59 (1H, мультиплет).
Пример 33
6-Амино-N-(3-хлор-1H-индол-7-ил)-3-пиридинсульфонамид
Соединение (2,48 г, 7,25 ммоль), полученное по Примеру 14, и иодид лития (679 мг, 5,07 ммоль) добавляют к 25 мл этанола, а затем добавляют 10 мл жидкого аммиака. Полученную смесь нагревают в запаянной ампуле при температуре 120oC в течение 26 час, а затем упаривают. Остаток растворяют в этилацетате. Полученный раствор последовательно промывают насыщенным водным раствором бикарбоната натрия и водой, сушат над сульфатом магния и упаривают. Остаток очищают колоночной хроматографией на силикагеле и получают 982 мг целевого соединения.
Т. пл.: 206-207oC (перекристаллизовывают из смеси этилацетат/н-гексан)
Спектр ПМР (ДМСО-d6) δ (м.д.): 6,37 (1H, дублет, J = 8,8 Гц), 6,83-6,94 (1H, мультиплет), 6,88 (2H, уширенный синглет), 6,99 (1H, дублет дублетов, J = 7,9, 7,7 Гц), 7,25 (1H, дублет дублетов, J = 7,9, 0,7 Гц), 7,48 (1H, дублет, J = 2,7 Гц), 7,56 (1H, дублет дублетов, J = 8,8, 2,4 Гц), 8,14 (1H, дублет, J = 2,4 Гц), 9,70 (1H, синглет), 10,92-11,03 (1H, мультиплет).
Пример 34
N-(3-Хлор-1H-индол-7-ил)-4-(метилсульфинилметил)бензолсульфонамид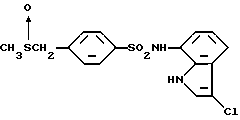
Соединение, полученное в Примере 15, окисляют по методике, аналогичной приведенной в Примере 24, и получают целевое соединение.
Спектр ПМР (ДМСО-d6) δ (м.д.): 2,41 (3H, синглет), 3,98 (1H, дублет, J = 12,6 Гц), 4,18 (1H, дублет, J = 12,8 Гц), 6,77 (1H, дублет, J = 7,5 Гц), 6,94 (1H, дублет дублетов, J = 7,9, 7,7 Гц), 7,25 (1H, дублет, J = 7,9 Гц), 7,43 (2H, дублет, J = 8,1 Гц), 7,47 (1H, дублет, J = 2,8 Гц), 7,73 (2H, дублет, J = 8,1 Гц), 10,01 (1H, уширенный синглет), 11,03 (1H, уширенный синглет).
Пример 35
N-(3-Хлор-1H-индол-7-ил)-4-(2-сульфамоилэтил)бензолсульфонамид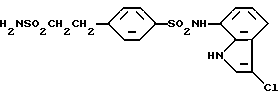
Аналогично методике, приведенной в Примере 1, 865 мг (3,05 ммоль) соединения, полученного в Препаративном примере 11, вводят во взаимодействие с 376 мг (2,84 ммоль) соединения, полученного в Препаративном примере 2, и разрабатывают реакционную смесь. Получают 957 мг N-(1H-индол-7-ил)-4-(2-сульфамоилэтил)бензолсульфонамида. Полученный продукт хлорируют в соответствии с методикой, приведенной в Примере 2, и получают 980 мг целевого соединения.
Т. пл.: 217-219oC (с разложением) (перекристаллизовывают из смеси этанол/н-гексан)
Спектр ПМР (ДМСО-d6) δ (м.д.): 3,01-3,06 (2H, мультиплет), 3,23-3,28 (2H, мультиплет), 6,81 (1H, дублет дублетов, J = 7,5, 0,37 Гц), 6,88 (2H, уширенный синглет), 6,95 (1H, дублет дублетов, J = 8,1, 7,5 Гц), 7,24 (1H, дублет дублетов, J = 7,8, 0,37 Гц), 7,42 (2H, дублет, J = 8,4 Гц), 7,49 (1H, дублет, J = 2,6 Гц), 7,68 (2H, дублет, J = 8,2 Гц), 9,99 (1H, уширенный синглет), 11,02 (1H, уширенный синглет).
Пример 36
N-(3-Хлор-1H-индол-7-ил)-4-[2-(метилсульфонил)этил]бензолсульфонамид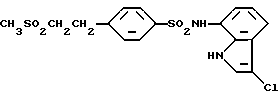
Целевое соединение получают по методикам, аналогичным приведенным в Примерах 1 и 2.
Т. пл.: начинает обесцвечиваться при температуре приблизительно 180oC и разлагается при температуре 201-203oC (перекристаллизовывают из смеси этанол/н-гексан)
Спектр ПМР (ДМСО-d6) δ (м. д. ): 2,92 (3H, синглет), 3,01-3,07 (2H, мультиплет), 3,40-3,46 (2H, мультиплет), 6,81 (1H, дублет, J = 7,9 Гц), 6,94 (1H, дублет дублетов, J = 7,9, 7,7 Гц), 7,24 (1H, дублет, J = 7,7 Гц), 7,45 (2H, дублет, J = 8,2 Гц), 7,49 (1H, дублет, J = 2,7 Гц), 7,68 (2H, дублет, J = 8,2 Гц), 9,99 (1H, уширенный синглет), 11,03 (1H, уширенный синглет).
Пример 37
6-Амино-N-(3-циано-1H-индол-7-ил)-3-пиридинсульфонамид
Целевое соединение синтезируют аминированием соединения, полученного в Примере 18, аналогично методике, приведенной в Примере 33.
Т. пл.: 300oC или выше (перекристаллизовывают из смеси этанол/н-гексан)
Спектр ПМР (ДМСО-d6) δ/ (м.д.): 6,39 (1H, дублет, J = 9,0 Гц), 6,88 (1H, дублет, J = 7,7 Гц), 6,89 (2H, синглет), 7,11 (1H, дублет дублетов, J = 7,9, 7,7 Гц), 7,41 (1H, дублет дублетов, J = 7,9, 0,7 Гц), 7,55 (1H, дублет дублетов, J = 9,0, 2,6 Гц), 8,12 (1H, дублет, J = 2,6 Гц), 8,19 (1H, синглет), 9,72-9,90 (1H, уширенный синглет), 11,78-11,92 (1H, уширенный синглет).
Пример 38
4-Ацетамид-3-хлор-N-(3-хлор-1H-индол-7-ил)бензолсульфонамид
Целевое соединение получают по методикам, аналогичным приведенным в Примерах 1 и 2.
Спектр ПМР (ДМСО-d6) δ (м.д.): 2,14 (3H, синглет), 6,77 (1H, дублет, J = 7,7 Гц), 6,98 (1H, дублет дублетов, J = 7,9 , 7,7 Гц), 7,29 (1H, дублет, J= 7,9 Гц), 7,50 (1H, дублет, J = 2,7 Гц), 7,64 (1H, дублет дублетов, J = 8,6, 2,2 Гц), 7,75 (1H, дублет, J = 2,2 Гц), 8.04 (1H, дублет, J = 8,6 Гц), 9,69 (1H, уширенный синглет), 10,04 (1H, уширенный синглет), 11,11 (1H, уширенный синглет).
Пример 39
N-(3-Циано-1H-индол-7-ил)-8-хинолинсульфонамид
Целевое соединения получают аналогично методике, приведенной в Примере 1.
Спектр ПМР (ДМСО-d6) δ (м.д.): 6,68 (1H, дублет, J = 7,3 Гц), 6,89 (1H, дублет дуплетов, J = 7,9, 7,7 Гц), 7,25 (1H, дублет, J = 8,1 Гц), 7,69 - 7,74 (2H, мультиплет), 8,21 (1H, дублет, J = 2,9 Гц), 8,30 (1H, дублет дублетов, J = 8,2 1,3 Гц), 8,35 (1H, дублет дуплетов, J = 7,4, 1,4 Гц), 8,54 (1H, дублет дублетов, J = 8,3, 1,7 Гц), 9,15 (1H, дублет дублетов, J = 4,3, 1,7 Гц), 10,04 (1H, уширенный синглет), 12,14 (1H, уширенный синглет).
Пример 40
5-Хлор-N-(3-циано-1H-индол-7-ил)-2-тиофенилсульфонамид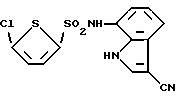
Целевое соединение получают аналогично методике, приведенной в Примере 1.
Спектр ПМР (ДМСО-d6) δ (м.д.): 6,88 (1H, два дублета дублетов, J = 7,7, 2,2, 0,73 Гц), 7,16 (1H, дублет дублетов, J = 7,9, 7,7 Гц), 7,20 (1H, дублет, J = 4,0 Гц), 7,36 (1H, дублет, J = 4,2 Гц), 7,51 (1H, дублет, J = 8,1 Гц), 8,23 (1H, дублет, J = 3,1 Гц), 10,42 (1H, уширенный синглет), 12,01 (1H, уширенный синглет).
Пример 41
N-(3-Хлор-1H-индол-7-ил)-4-(метоксикарбониламино)бензолсульфонамид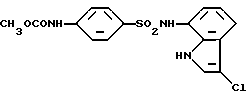
Метиловый эфир хлормуравьиной кислоты (170 мг, 1,8 ммоль) добавляют к 1 мл раствора в пиридине 38 мг (0,18 ммоль) соединения, полученного в Примере 3. Полученную смесь оставляют на ночь перемешиваться при комнатной температуре и упаривают. Остаток очищают колоночной хроматографией на силикагеле, получая 20 мг целевого соединения.
Спектр ПМР (ДМСО-d6) δ (м.д.): 3,65 (3H, синглет), 6,80 (1H, дублет, J = 7,7 Гц), 6,93 (1H, триплет, J = 7,9 Гц), 7,21 (1H, дублет дублетов, J = 7,7 Гц, 0,37 Гц), 7,45 (1H, дублет, J = 2,7 Гц), 7,51 (1H, дублет, J = 9,0 Гц), 7,63 (2H, дублет, J = 8,8 Гц), 9,85 (1H, уширенный синглет), 10,07 (1H, уширенный синглет), 10,97 (1H, уширенный синглет).
Пример 42
4-Ацетил-N-(3-циано-1H-индол-7-ил)бензолсульфонамид
Целевое соединение получают аналогично методике, приведенной в Примере 1.
Спектр ПМР (ДМСО-d6) δ (м.д.): 2,60 (3H, синглет), 6,74 (1H, дублет, J = 7,7 Гц), 7,05 (1H, дублет дублетов, J = 7,9, 7,7 Гц), 7,42 (1H, дублет, J = 7,9 Гц), 7,81 - 7,88 (2H, мультиплет), 8,03 - 8,10 (2H, мультиплет), 8,21 (1H, синглет), 10,18 - 10,50 (1H, ушир.) 11,92 - 12,07 (1H, мультиплет).
Пример 43
N-(3-Хлор-1H-индол-7-ил)-4-(N-метоксисульфамоил)бензолсульфонамид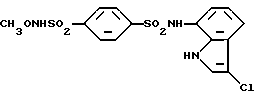
Целевое соединение получают аналогично методикам, приведенным в Примерах 1 и 2.
Спектр ПМР (ДМСО-d6) δ (м.д.): 3,65 (3H, синглет), 6,73 (1H, дублет, J = 7,6 Гц), 6,96 (1H, дублет дублетов, J = 8,0, 7,6 Гц), 7,30 (2H, дублет, J = 8,0 Гц), 7,50 (1H, дублет, J = 2,4 Гц), 7,98 (4H, синглет), 10,29 (1H, уширенный синглет), 10,76 (1H, уширенный синглет), 11,12 (1H уширенный синглет)
Пример 44
N-(3-Циано-1H-индол-7-ил)-бета-стиролсульфонамид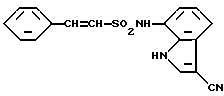
Целевое соединение получают аналогично методике, приведенной в Примере 1.
Спектр ПМР (ДМСО-d6) δ (м.д.): 7,14 - 7,20 (2H, мультиплет), 7,32 (2H, синглет), 7,35 - 7,47 (2H, мультиплет), 7,60 - 7,68 (2H, мультиплет), 8,23 (1H, синглет), 9,70 - 10,03 (1H, ушир), 11,85 - 12,12 (1H, ушир).
Пример 45
3-Хлор-N-(3-Циано-1H-индол-7-ил)-2-метилбензолсульфонамид
Целевое соединение получают аналогично методике, приведенной в Примере 1.
Спектр ПМР (ДМСО-d6) δ/ (м.д.): 2,61 (3H, синглет), 6,69 (1H, дублет, J = 7,7 Гц), 7,04 (1H, триплет, J = 7,9 Гц), 7,36 (1H, дублет дублетов, J = 8,1, 7,9 Гц), 7,42 (1H, дублет, J = 7,9 Гц), 7,73 (1H, дублет дублетов, J = 8,1, 1,1 Гц), 7,77 (1H, дублет дублетов, J = 8,0 , 0,82 Гц), 8,25 (1H, дублет, J = 3,1 Гц), 10,37 (1H, синглет), 11,99 (1H, уширенный синглет).
Пример 46
N-(3-Хлор-1H-индол-7-ил)-6-изо-пропиламино-3-пиридинсульфонамид
Соединение (400 мг, 117 ммоль), полученное по Примеру 14, и изоупропиламин (0,80 мл, 9,39 ммоль) растворяют в 5 мл диоксана. Полученную смесь нагревают в запаянной трубке при температуре 100oC в течение 7,5 час и упаривают. Остаток растворяют в этилацетате. Полученный раствор последовательно промывают разбавленным раствором лимонной кислоты, насыщенным раствором бикарбоната натрия и водой, сушат над сульфатом магния и упаривают. Остаток очищают методом тонкослойной хроматографии на силикагеле и получают 235 мг целевого соединения.
Т. пл. : начинают обесцвечиваться при температуре приблизительно 210oC и разлагается при температуре 213 - 215oC (перекристаллизовывают из смеси этилацетат/н-гексан).
Спектр ПМР (ДМСО-d6) δ (м.д.): 1,09 (6H, дублет, J = 6,6 Гц), 3,90 - 4,08 (1H, мультиплет), 6,39 (1H, дублет, J = 9,0 Гц), 6,90 - 7,05 (2H, мультиплет), 7,24 (1H, дублет, J = 7,9 Гц), 7,33 (1H, дублет, J = 7,7 Гц), 7,48 (1H, дублет, J = 2,6 Гц), 7,54 (1H, дублет дублетов, J = 9,0, 2,6 Гц), 8,22 (1H, дублет, J = 2,6 Гц), 9,65 - 9,84 (1H, шир.), 10,88 - 11,04 (1H, мультиплет).
Пример 47
N-(3-Хлор-1H-индол-7-ил)-6-[[2-(диметиламино)этил] амино] - 3-пиридинсульфонамид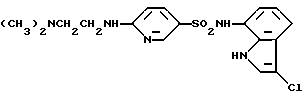
Целевое соединение синтезируют из соединения, полученного по Примеру 14, и N,N-диметилэтилендиамина аналогично методике, приведенной в Примере 46.
Спектр ПМР (ДМСО-d6) δ (м.д.): 2,14 (6H, синглет, 2,35 (2H, триплет, J = 6,6 Гц), 3,24 - 3,44 (2H, мультиплет), 6,48 (1H, дублет, J = 9,0 Гц), 6,92 (1H, дублет, J = 7,7 Гц), 6,99 (1H, дублет дублетов, J = 7,9, 7,7 Гц), 7,22 (1H, дублет, J = 7,9 Гц), 7,27 - 7,39 (1H, мультиплет), 7,47 (1H, дублет, J = 2,4 Гц), 7,54 (1H, дублет дублетов, J = 9,0, 2,6 Гц), 8,21 (1H, дублет, J = 2,6 Гц), 10,91 - 11,03 (1H, мультиплет).
Пример 48
N-(3-Циано-1H-индол-7-ил)-2-фурансульфонамид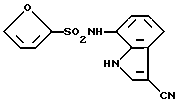
Целевое соединение получают аналогично методике, приведенной в Примере 1.
Спектр ПМР (ДМСО-d6) δ (м.д.): 6,62 (1H, два дублета дублетов, J = 3,7, 1,8, 0,37 Гц), 6,78 (1H, дублет, J = 7,5 Гц), 7,04 (1H, дублет, J = 3,5 Гц), 7,12 (1H, триплет, J = 7,9 Гц), 7,49 (1H, дублет J = 8,1 Гц), 7,99 - 8,00 (1H, мультиплет), 8,23 (1H, дублет, J = 3,1 Гц), 10,49 (1H, уширенный синглет), 12,04 (уширенный синглет).
Пример 49
N-(3-Хлор-1H-индол-7-ил)-4-[(диметиламиносульфонил)амино] бензолсульфонамид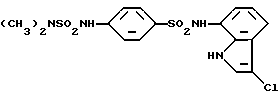
Целевое соединение синтезируют из соединения, полученного по Примеру 3, и диметилсульфамоилхлорида аналогично методике, приведенной в Примере 1.
Спектр ПМР (ДМСО-d6) δ (м. д.): 2,66 (6H, синглет), 5,81 (1H, дублет дублетов, J = 7,7, 0,92 Гц), 6,95 (1H, дублет дублетов, J = 7,9, 7,7 Гц), 7,20 (2H, дублет, J = 8,8 Гц), 7,23 (1H, дублет, J = 8,1 Гц), 7,47 (1H, дублет, J = 2,7 Гц), 7,64 (2H, дублет, J = 8,8 Гц), 10,98 (1H, уширенный синглет).
Пример 50
N-(3-Метил-1H-индол-7-ил)-4-(метилсульфонил)бензолсульфонамид
К 25 мл суспензии 300 мг (1,58 ммоль) 3-формил-7-нитро-1H-индола в 2-изо-пропаноле добавляют боргидрид натрия (580 мг, 15,3 ммоль) и 10%-ный палладий на угле (150 мг). Полученную смесь кипятят с обратным холодильником в течение 6 часов и разбавляют водой. Отфильтровывают для удаления катализатора и фильтрат экстрагируют этилацетатом. Органическую фазу отделяют, промывают насыщенным водным раствором соли, сушат над сульфатом магния и растворитель отгоняют в вакууме. Остаток растворяют в 5 мл пиридина и вводят в реакцию с 170 мг (0,67 ммоль) 4-(метилсульфонил)бензолсульфонилхлорида аналогично методике, приведенной в Примере 1. Полученную смесь обрабатывают аналогично Примеру 1 и получают 149 мг целевого соединения.
Спектр ПМР (ДМСО-d6) δ (м.д.): 2,18 (3H, синглет), 3,24 (3H, синглет), 6,69 (1H, дублет, J = 7,7 Гц), 6,81 (1H, триплет, J = 7,7 Гц), 7,06 (1H, уширенный синглет), 7,25 (2H, дублет, J = 7,8 Гц), 7,95 (2H, дублет, J = 8,8 Гц), 8,04 (2H, дублет, J = 8,2 Гц), 10,14 (1H, уширенный синглет), 10,40 (1H, уширенный синглет).
Пример 51
3-Циано-N-(3-циано-1H-индол-7-ил)бензолсульфонамид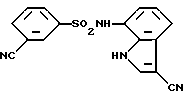
Целевое соединение получают аналогично методике, приведенной в Примере 1.
Спектр ПМР (ДМСО-d6) δ (м.д.): 6,71 (1H, дублет, J = 7,2 Гц), 7,09 (1H, дублет дублетов, J = 8,0, 7,6 Гц), 7,49 (1H, дублет, J = 8,0 Гц), 7,74 (1H, дублет дублетов, J = 8,0, 7,6 Гц), 7,94 (1H, дублет, J = 8,0 Гц), 8,11 - 8,14 (2H, мультиплет), 8,23 (1H, дублет, J = 2,8 Гц), 10,30 (1H, уширенный синглет), 12,05 (1H, уширенный синглет).
Пример 52
N-(3-Хлор-1H-индол-7-ил)-4-(N-метилметансульфонамидо) бензолсульфонамид
Целевое соединение получают аналогично методикам, приведенным в Примерах 1 и 2.
Т. пл. : 199 - 201oC (с разложением) (перекристаллизовывают из смеси этанол/н-гексан)
Спектр ПМР (ДМСО-d6) δ (м.д.): 2,98 (3H, синглет); 3,24 (3H, синглет), 6,83 (1H, дублет дублетов, J = 7,7, 0,37 Гц), 6,96 (1H, дублет дублетов, J = 7,9, 7,7 Гц), 7,26 (2H, дублет дублетов, J = 7,9, 0,55 Гц), 7,48 (1H, дублет, J = 2,7 Гц), 7,50 - 7,54 (2H, мультиплет), 7,27 - 7,76 (2H, мультиплет), 10,04 (1H, уширенный синглет), 11,02 (1H уширенный синглет).
Пример 53
N-(3-Хлор-1H-индол-7-ил)-4-[(метансульфонамидо)метил] бензолсульфонамид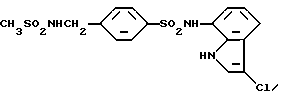
Целевое соединение получают аналогично методикам, приведенным в Примерах 1 и 2.
Т. пл.: начинает обесцвечиваться при температуре приблизительно 180oC и разлагается при температуре 189 - 191oC (перекристаллизовывают из смеси этанол/н-гексан)
Спектр ПМР (ДМСО-d6) δ (м.д.): 2,81 (3H, синглет), 4,19 (2H, дублет, J = 6,0 Гц), 6,79 (1H, дублет, J = 7,7 Гц), 6,94 (1H, дублет дублетов, J = 7,9, 7,7 Гц), 7,24 (2H, дублет, J = 7,9 Гц), 7,47 (2H, дублет, J = 8,8 Гц), 7,47 - 7,49 (1H, мультиплет), 7,64 (1H, триплет, J = 6,4 Гц), 7,72 (2H, дублет, J = 8,4 Гц), 10,00 (1H, синглет), 11,03 (1H, уширенный синглет).
Пример 54
N-(3-Хлор-1H-индол-7-иол)-4-(1-пирролидинилсульфонил) бензолсульфонамид
Целевое соединение синтезируют из 4-(1-пирролидинилсульфонил)бензолсульфохлорида и соединения, полученного в Препаративном примере 10, по методике, аналогичной приведенной в Примере 1.
Спектр ПМР (ДМСО-d6) δ (м.д.): 1,55 - 1,59 (4H, мультиплет), 3,07 - 3,11 (4H, мультиплет), 6,71 (1H, дублет, J = 7,6 Гц), 6,95 (1H, два дублета дублетов, J = 8,2, 7,4, 1,2 Гц), 7,30 (1H, дублет, J = 8,0), 7,46 (1H, дублет, J = 2,4 Гц), 7,89 (2H, дублет, J = 8,8 Гц), 7,92 (2H, дублет, J = 8,4 Гц), 10,18 (1H, уширенный синглет), 11,03 (1H, уширенный синглет)
Пример 55
N-(3-Циано-1H-индол-7-ил)-1-метил-4-имидазолсульфонамид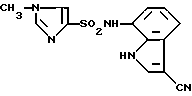
Целевое соединение получают аналогично методике, приведенной в Примере 1.
Спектр ПМР (ДМСО-d6) δ (м.д.): 3,61 (3H, синглет), 7,00 (1H, дублет, дублетов, J = 7,7, 0,92 Гц), 7,07 (1H, дублет дублетов, J = 7,9, 7,7 Гц), 7,35 (1H, дублет, J = 7,9 Гц), 7,75 - 7,76 (2H, мультиплет), 8,19 (1H, дублет, J = 3,1 Гц), 10,03 (1H, уширенный синглет), 11,92 (1H, уширенный синглет).
Пример 56
N-(3-Хлор-1H-индол-7-ил)-6-[(2-гидроксиэтил)амино]-3- пиридинсульфонамид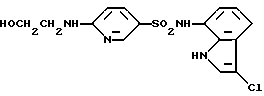
Целевое соединение синтезируют из 2-аминоэтанола и соединения, полученного в Примере 14, по методике, аналогичной приведенной в Примере 49.
Спектр ПМР (ДМСО-d6) δ (м.д.): 3,24-3,40 (2H, мультиплет), 3,42 - 3,52 (2H, мультиплет), 4,66-4,77 (1H, мультиплет), 6,48 (1H, дублет, J = 9,3), 6,92 (1H, дублет, J = 7,7 Гц), 7,00 (1H, триплет, J = 7,7 Гц), 7,24 (1H, дублет, J = 7,7 Гц), 7,40-7,62 (2H, мультиплет), 7,48 (1H, дублет, J = 2,2 Гц), 8,22 (1H, дублет, J = 2,6 Гц), 9,63-9,90 (1H, шир.), 10,90 - 11,07 (1H, мультиплет).
Пример 57
N-(3-Хлор-1H-индол-7-ил)-6-меркапто-3-пиридинсульфонамид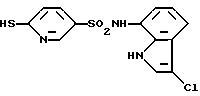
Соединение (340 мг, 0,99 ммоль), полученное в Примере 14, и тиомочевину (151 мг, 1,98 ммоль) растворяют в 5 мл этанола. Полученную смесь кипятят с обратным холодильником в течение 2 час и упаривают. К остатку добавляют воду (1,6 мл) и карбонат натрия (57 мг). Полученную смесь перемешивают при комнатной температуре в течение 10 минут, а затем добавляют 85 мг едкого натра. Перемешивают еще в течение 10 минут и нерастворимые соединения отфильтровывают. Фильтрат подкисляют соляной кислотой, при этом образуется осадок. Его отделяют фильтрованием, промывают водой и растворяют в тетрагидрофуране. Полученный раствор сушат над сульфатом магния и упаривают. Остаток очищают методом тонкослойной хроматографии на силикагеле и получают 121 мг целевого соединения.
Спектр ПМР (ДМСО-d6) δ (м.д.): 6,84 (1H, дублет, J = 7,6 Гц), 7,03 (1H, триплет, J = 7,6 Гц), 7,28 (1H, дублет, J = 9,2 Гц), 7,31 (1H, дублет, J = 7,6 Гц), 7,44 (1H, дублет дублетов, J = 9,2, 2,4 Гц), 7,48 (1H, дублет, J = 2,6 Гц), 7,68 (1H, дублет, J = 2,4 Гц), 9,58 - 9,80 (1H, шир.), 10,08 - 11,19 (1H, мультиплет).
Пример 58
7-(4-Хлорбензолсульфонамидо)-1H-индол-2-карбоновая кислота
Целевое соединение получают аналогично методике, приведенной в Примере 1.
Спектр ПМР (ДМСО-d6) δ (м.д.): 6,65 (1H, дублет, J = 7,6, 0,92 Гц), 6,87 (1H, дублет дублетов, J = 8,0, 7,6 Гц), 7,00 (1H, синглет), 7,26 (1H, дублет, J = 8,0 Гц), 7,56-7,65 (2H, мультиплет), 7,68-7,77 (2H, мультиплет), 9,62-10,00 (1H, шир.), 11,40 - 11,74 (1H, шир.).
Пример 59
N-(3-Хлор-1H-индол-7-ил)-6-циклопропиламино-3-пиридинсульфонамид
Целевое соединение получают аналогично методике, приведенной в Примере 46.
Т. пл.: начинает обесцвечиваться при температуре приблизительно 228oC и разлагается при температуре 233,5 - 235oC (перекристаллизовывают из смеси этилацетат/н-гексан)
Спектр ПМР (ДМСО-d6) δ (м.д.): 0,36-0,46 (2H, мультиплет), 0,63 - 0,75 (2H, мультиплет), 2,44-2,64 (1H, мультиплет), 6,45-6,64 (1H, мультиплет), 6,93 (1H, дублет, J = 7,7 Гц), 7,00 (1H, дублет дублетов, J = 7,9, 7,7 Гц), 7,24 (1H, дублет, J = 7,9 Гц), 7,49 (1H, дублет, J = 2,7 Гц), 7,57-7,73 (2H, мультиплет), 8,25 (1H, дублет, J = 2,6 Гц), 9,68-9,90 (1H, шир.), 10,92 - 11,04 (1H, мультиплет).
Пример 60
N-(3-Циано-1H-индол-7-ил)-5-метил-3-пиридинсульфонамид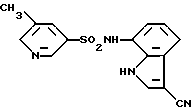
Целевое соединение получают аналогично методике, приведенной в Примере 1.
Т. пл. : начинает постепенно разлагаться при температуре приблизительно 288oC (перекристаллзовывают из смеси этанол/н-гексан)
Спектр ПМР (ДМСО-d6) δ/ (м.д.): 2,33 (3H, синглет), 6,75 (1H, дублет, J = 7,7 Гц), 7,09 (1H, дублет дублетов, J = 7,9, 7,7 Гц), 7,48 (1H, дублет, J = 7,9 Гц), 7,78 - 7,91 (1H, мультиплет), 8,22 (1H, дублет, J = 3,1 Гц), 8,58 - 8,67 (2H, мультиплет), 10,28 (1H, уширенный синглет), 11,95 - 12,08 (1H, мультиплет).
Пример 61
N-(3-Хлор-1H-индол-7-ил)-4-(N-метилсульфамоил)бензолсульфонамид
Целевое соединение получают аналогично методикам, приведенным в Примерах 1 и 2.
Спектр ПМР (ДМСО-d6) δ (м.д.): 2,39 (3H, дублет, J = 5,2 Гц), 6,71 (1H, дублет дублетов, J = 7,8, 2,0 Гц), 6,96 (1H, дублет дублетов, J = 8,0, 7,6 Гц), 7,30 (2H, дублет, J = 8,0 Гц), 7,48 (1H, дублет, J = 2,8 Гц), 7,68 (1H, квартет, J = 4,9 Гц), 7,87 - 7,93 (4H, мультиплет), 10,20 (1H, уширенный синглет), 11,08 (1H, уширенный синглет).
Пример 62
N-(3-Хлор-1H-индол-7-ил)-4-[2-(метансульфонамидо)этил] бензолсульфонамид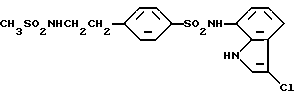
Целевое соединение получают аналогично методикам, приведенным в Примерах 1 и 2.
Спектр ПМР (ДМСО-d6) δ (м.д.): 2,73-2,81 (5H, мультиплет), 3,13-3,19 (2H, мультиплет), 6,82 (1H, дублет, J = 7,7 Гц), 6,95 (1H, дублет дублетов, J = 8,1, 7,7 Гц), 7,09 (1H, триплет, J = 5,9 Гц), 7,24 (1H, дублет, J = 8,1 Гц), 7,39 (2H, дублет, J = 8,2 Гц), 7,48 (1H, дублет, J = 2,7 Гц), 7,68 (2H, дублет, J = 8,4 Гц), 9,97 (1H, уширенный синглет), 11,02 (1H, уширенный синглет).
Пример 63
N-(3-Хлор-1H-индол-7-ил)-4-(сульфамоилметил)бензолсульфонамид
Аналогично методике, приведенной в Примере 1, 389 мг (1,44 ммоль) соединения, полученного в Препаративном примере 6, вводят во взаимодействие с 159 мг (1,2 ммоль) соединения, полученного в Препаративном примере 2, и разрабатывают реакционную смесь. Получают 233 мг N-(1H-индол-7-ил)-4-(сульфамоилметил)бензолсульфонамида. Полученный продукт хлорируют аналогично методике, приведенной в Примере 2, и получают 160 мг целевого соединения.
Т. пл. : 237-238,5oC (с разложением) (перекристаллизовывают из смеси этанол/н-гексан)
Спектр ПМР (ДМСО-d6) δ (м. д.): 4,33 (2H, синглет), 6,84 (1H, дублет дублетов, J = 7,7, 0,73 Гц), 6,93 (2H, синглет), 6,92-6,97 (1H, мультиплет), 7,24 (2H, дублет дублетов, J = 7,9, 0,37 Гц), 7,48 (1H, дублет, J = 2,7 Гц), 7,48-7,52 (2H, мультиплет), 7,75-7,79 (2H, мультиплет), 10,08 (1H, уширенный синглет), 11,04 (1H, уширенный синглет).
Пример 64
N-(3-Хлор-1H-индол-7-ил)-4-тиокарбамоилбензолсульфонамид
Соединение (400 мг, 1,21 ммоль), полученное в Примере 10, растворяют в 10 мл диметилформамида и добавляют 0,5 мл триэтиламина. Через полученную смесь при нагревании на бане с температурой 60-70oC в течение 45 минут барботируют сероводород. Реакционную смесь упаривают и остаток растворяют в этилацетате. Полученный раствор последовательно промывают разбавленной соляной кислотой, насыщенным водным раствором бикарбоната натрия и водой, сушат над сульфатом магния и растворитель отгоняют в вакууме. Полученный остаток очищают колоночной хроматографией на силикагеле, получая 355 мг целевого соединения.
Т. пл. : 223-225,5oC (с разложением) (перекристаллизовывают из смеси этанол/н-гексан)
Спектр ПМР (ДМСО-d6) δ (м.д.): 6,81 (1H, дублет, J = 7,7 Гц) 6,96 (1H, дублет дублетов, J = 7,9, 7,7 Гц), 7,27 (1H, дублет, J = 7,9 Гц), 7,50 (1H, дублет, J = 2,7 Гц), 7,73-7,80 (2H, мультиплет), 7,86-7,93 (2H, мультиплет), 9,58-9,73 (1H, широкий мультиплет), 10,02-10,18 (1H, широкий мультиплет), 10,15 (1H, сиглет), 11,03-11,12 (1H, мультиплет).
Пример 64
5-Бром-N-(3-циано-1H-индол-7-ил)-2-пиридинсульфонамид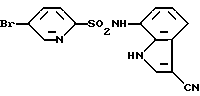
Целевое соединение получают аналогично методике, приведенной в Примере 1.
Т. пл. : 245,5-246,5oC (с разложением) (перекристаллизовывают из смеси этилацетат/н-гексан)
Спектр ПМР (ДМСО-d6) δ (м.д.): 6,82 (1H, дублет, J = 7,7 Гц), 7,07 (1H, дублет дублетов, J = 7,9, 7,7 Гц), 7,44 (1H, дублет, J = 7,9 Гц), 7,80 (1H, дублет, J = 8,2 Гц), 8,23 (1H, дублет, J = 2,2 Гц), 8,29 (2H, дублет дублетов, J = 8,2, 2,2 гц), 8,92 (1H, дублет, J = 2,2 Гц), 10,42-10,67 (1H, шир.), 11,93-12,08 (1H, мультиплет).
Пример 66
N-(3-циано-1H-индол-7-ил)-2-нафталинсульфонамид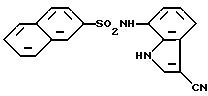
Целевое соединение получают аналогично методике, приведенной в Пример 1.
Спектр ПМР (ДМСО-d6) δ (м.д.): 6,74 (1H, дублет дублетов, J = 7,6, 2,8 Гц), 7,00 (1H, дублет дублетов, J = 7,9, 7,7 Гц), 7,39 (1H, дублет дублетов, J = 8,0, 0,46 Гц), 7,61-7,72 (2H, мультиплет), 7,80 (1H, дублет дублетов, J = 8,6, 1,8 Гц), 8,01 (1H, дублет, J = 8,1 Гц), 8,08 (1H, синглет), 8,10 (1H, синглет), 8,21 (1H, дублет, J = 2,9 Гц), 8,34 (1H, дублет, J = 1,6 гц), 10,23 (1H, уширенный синглет), 12,01 (1H, уширенный синглет).
Пример 67
N-(3-Ацетил-1H-индол-7-ил)-3-хлорбензолсульфонамид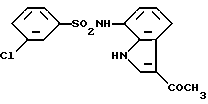
Целевое соединение получают аналогично методике, приведенной в Примере 1.
Спектр ПМР (ДМСО-d6) δ (м.д.): 2,44 (3H, синглет), 6,65 (1H, дублет, J = 7,5 Гц), 7,01 (1H, дублет дублетов, J = 7,9, 7,7 Гц), 7,53-7,63 (2H, мультиплет), 7,69-7,73 (2H, мультиплет), 8,01 (1H, дублет дублетотв, J = 8,1, 0,73 Гц), 8,26 (1H, дублет, J = 2,9 Гц), 10,10 (1H, синглет), 11,75 (1H, уширенный синглет).
Пример 68
4-Амино-N-(5-бром-3-циано-1H-индол-7-ил)бензолсульфонамид
N-(5-Бром-3-циано-1H-индол-7-ил)-4-нитробензолсульфонамид синтезируют из 4-нитробензолсульфонилхлорида и соединения, полученного в Препаративном примере 14, аналогично методике, приведенной в Примере 1, и гидрируют в присутствии оксида платины при комнатной температуре и нормальном давлении, получая целевое соединение.
Спектр ПМР (ДМСО-d6) δ (м.д.): 6,07 (2H, уширенный синглет), 6,52 (2H, дублет, J = 8,4 Гц), 6,97-6,99 (1H, мультиплет), 7,36 (2H, дублет дублетов, J = 8,7, 1,6 Гц), 7,51 (1H, уширенный синглет), 8,25 (1H, синглет), 9,93 (1H, дублет, J = 5,5 Гц), 11,97 (1H, уширенный синглет).
Пример 69
N-(3-Хлор-1H-индол-7-ил)-4-(N-этилсульфамоил)бензолсульфонамид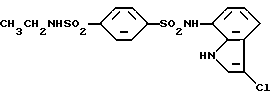
Целевое соединение получают аналогично методикам, приведенным в Примерах 1 и 2.
Т.пл.: 213-215oC (перекристаллизовывают из смеси этанол/н-гексан)
Спектр ПМР (ДМСО-d6) δ (м.д.): 0,90 (3H, триплет, J = 7,2 Гц), 2,76 (2H, два квартета, Jd = 5,8 Гц, Jq = 7,2 Гц), 6,70 (1H, дублет, J = 7,4 Гц), 6,95 (1H, дублет дублетов, J = 8,0, 7,6 Гц), 7,29 (1H, дублет, J = 8,0 Гц), 7,47 (1H, дублет, J = 2,8 Гц), 7,78 (1H, триплет, J = 5,6 гц), 7,90 (4H, синглет), 10,18 (1H, уширенный синглет), 11,06 (1H, уширенный синглет).
Пример 70
N-(3-Хлор-1H-индол-7-ил)-4-(этансульфонамидо)бензолсульфонамид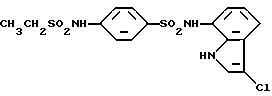
Целевое соединение получают аналогично методике, приведенной в Пример 4.
Т. пл. 214-215oC (с разложение) (перекристаллизовывают из смеси этанол/н-гексан)
Спектр ПМР (ДМСО-d6) δ (м.д.): 1,14 (3H, триплет, J = 7,3 Гц), 3,16 (2H, квартет, J = 7,3 Гц), 6,82 (1H, дублет, J = 7,5 Гц), 6,96 (1H, дублет, J = 7,9, 7,7 Гц), 7,23 (2H, дублет, J = 8,8 Гц), 7,24 (1H, дублет, J = 7,5 Гц), 7,47 (1H, дублет, J = 2,6 Гц), 7,66 (1H, дублет, J = 8,8 Гц), 9,90 (1H, уширенный синглет), 10,37 (1H, уширенный синглет), 10,96 (1H, уширенный синглет).
Пример 71
N-(3-Хлор-1H-индол-7-ил)-6-[(2-цианоэтил)амино]-3-пиридинсульфонамид
Целевое соединение получают аналогично методике, приведенной в Пример 46.
Спектр ПМР (ДМСО-d6) δ (м.д.): 2,72 (2H, триплет, J = 6,4 Гц), 3,46-3,55 (1H, мультиплет), 6,53 (1H, дублет, J = 9,0 Гц), 6,90 (1H, дублет, J = 9,0 Гц), 6,90 (1H, дублет, J = 7,7 Гц), 6,99 (1H, дублет дублетов, J = 7,9, 7,7 Гц), 7,25 (1H, дублет, J = 7,9 Гц), 7,48 (1H, дублет, J = 2,6 Гц), 7,61 (1H, дублет дублетов, J = 9,0, 2,4 Гц), 7,78 - 7,87 (1H, мультиплет), 8,25 (1H, дублет, J = 2,4 Гц), 9,70 - 9,95 (1H, шир.), 10,92 - 11,04 (1H, мультиплет).
Пример 72
N-(3-Хлор-1H-индол-7-ил)-4-(N-метилкарбамоил)бензолсульфонамид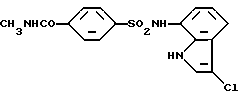
Соединение (533 мг, 1,68 ммоль), полученное по Примеру 9, растворяют в смеси 5 мл диметилформамида и 2,5 мл диметилсульфоксида, а затем добавляют 171 мг (2,53 ммоль) гидрохлорида метиламина и 705 мкл (5,06 ммоль) триэтиламина. К этой смеси добавляют 436 мкл (2,02 ммоль) дифенилфосфорилазида. Полученную смесь оставляют перемешиваться на ночь и упаривают. Остаток экстрагируют этилацетатом. Раствор в этилацетате последовательно промывают разбавленной соляной кислотой, насыщенным водным раствором бикарбоната натрия и водой, сушат над сульфатом магния и упаривают. Остаток очищают колоночной хроматографией на силикагеле, получая 465 мг N-(1H-индол-7-ил)-4-(N-метилкарбамоил)бензолсульфонамида. Это продукт хлорируют аналогично методике, приведенной в Пример 2, и получают 413 мг целевого соединения.
Т. пл. 252-253oC (с разложением) (перекристаллизовывают из смеси этанол/н-гексан)
Спектр ПМР (ДМСО-d6) δ (м.д.): 2,76 (3H, дублет, J = 4,6 Гц), 6,74 (1H, дублет, J = 7,7 Гц), 6,94 (1H, дублет дублетов, J = 7,9, 7,7 Гц), 7,27 (2H, дублет, J = 7,9 Гц), 7,49 (1H, дублет, J = 2,7 Гц), 7,76-7,83 (2H, мультиплет), 7,87 - 7,94 (2H, мультиплет), 8,61 (1H, квартет, J = 4,6 Гц), 10,10 (1H, синглет), 11,03-11,13 (1H, мультиплет).
Пример 73
N-(3-Хлор-1H-индол-7-ил)-4-(метилсульфонилметил)бензолсульфонамид
Соединение (510 мг), полученное в Пример 34, окисляют 30%-ной перекисью водорода по методике, аналогичной приведенной в Пример 23, и получают 307 мг целевого соединения.
Т. пл. : начинает обесцвечиваться при температуре приблизительно 225oC и постепенно разлагается при температуре приблизительно 235oC (перекристаллизовывают из смеси этанол/н-гексан).
Спектр ПМР (ДМСО-d6) δ (м.д.): 2,88 (3H, синглет), 4,57 (2H, синглет), 6,77 (1H, дублет, J = 7,6 Гц), 6,94 (1H, дублет дублетов, J = 7,9, 7,7 Гц), 7,25 (1H, дублет, J = 8,0 Гц), 7,47 (1H, дублет, J = 2,7 Гц), 7,51-7,56 (2H, мультиплет), 7,73-7,78 (2H, мультиплет), 10,05 (1H, уширенный синглет), 11,04 (1H, уширенный синглет).
Пример 74
N-(3-Хлор-1H-индол-7-ил)-4-(N,N-диметилсульфамоил)бензолсульфонамид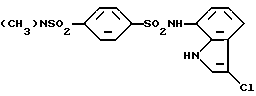
Целевое соединение получают аналогично методикам, приведенным в Примера 1 и 2.
Спектр ПМР (ДМСО-d6) δ (м. д. ) 2,57 (6H, синглет), 6,71 (1H, дублет дублетов, J = 7,4, 0,6 Гц), 6,97 (1H, дублет дублетов, J = 8,0, 7,6 Гц), 7,31 (1H, дублет, J = 8,0 Гц), 7,47 (1H, дублет, J = 2,8 Гц), 7,86 (2H, дублет, J = 8,4 Гц), 7,91 (2H, дублет, J = 8,4 Гц), 10,19 (1H, уширенный синглет), 11,04 (1H, уширенный синглет).
Пример 75
N-(3-Хлор-1H-индол-7-ил)-4-(1-пирролидинилкарбонил)бензолсульфонамид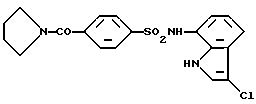
Целевое соединение получают аналогично методике, приведенной в Примере 1.
Спектр ПМР (ДМСО-d6) δ (м.д.): 1,79 (2H, дублет триплетов, Jd = 12,8, Jt = 6,4 Гц), 1,85 (2H, дублет триплетов, Jd = 13,6, Jt = 6,8 Гц), 3,22 (2H, триплет, J = 6,4 Гц), 3,44 (2H, триплет, J = 6,8 Гц), 6,78 (1H, дублет, J = 7,2 Гц), 6,96 (1H, дублет дублетов, J = 8,0, 7,2 Гц), 7,28 (1H, дублет, J = 8,0 Гц), 7,47 (1H, дублет, J = 2,4 Гц), 7,60 (2H, дублет, J = 8,0 Гц), 7,74 (2H, дублет, J = 8,4 Гц), 10,06 (1H, уширенный синглет), 11,01 (1H, уширенный синглет).
Пример 76
3-Хлор-N-(3-хлор-1H-индол-7-ил)-N-метилбензолсульфонамид
Соединение (120 мг, 0,352 ммоль), полученное в Примеру 7, растворяют в 10 мл диметилформамида и добавляют 19,2 мг (0,479 ммоль) гидрида натрия (60%). Полученную смесь перемешивают при комнатной температуре в течение 30 минут и добавляют 30 мкл (0,482 ммоль) иодистого метила. Перемешивают еще в течение 2 часов, к полученной смеси приливают воду и экстрагируют этилацетатом. Органическую фазу отделяют, промывают водой, сушат над сульфатом магния и упаривают. Остаток очищают методом тонкослойной хроматографии на силикагеле и получают 87 мг целевого соединения.
Спектр ПМР (ДМСО-d6) δ (м.д.): 3,26 (3H, синглет), 6,51 (1H, дублет дублетов, J = 7,6, 0,64 Гц), 7,00 (1H, дублет дублетов, J = 7,9, 7,7 Гц), 7,47 (1H, дублет, J = 8,1 Гц), 7,53 (2H, дублет, J = 2,7 Гц), 7,54 - 7,59 (2H, мультиплет), 7,65 (1H, триплет, J = 7,9 Гц), 7,84 (1H, два дублета дублетов, J = 8,1, 2,1, 1,1 Гц), 11,62 (1H, уширенный синглет).
Пример 77
N-(3,4-дихлор-1H-индол-7-ил)-4-(сульфамоилметил)бензолсульфонамид
Целевое соединение получают аналогично методике, приведенной в Примере 1.
Т. пл. : начинает медленно разлагаться при температуре приблизительно 297oC (перекристаллизовывают из смеси этанол/н-гексан)
Спектр ПМР (ДМСО-d6) δ (м.д.): 4,34 (2H, синглет), 6,72 (1H, дублет, J = 8,1 Гц), 6,93 (2H, синглет), 6,94 (1H, дублет, J = 8,1 Гц), 7,51 (1H, дублет, J = 8,1 Гц), 7,57 (1H, дублет дублетов, J = 2,7, 0,55 Гц), 7,75 (2H, дублет, J = 8,2 Гц), 10,10 (1H, уширенный синглет), 11,44 (1H, уширенный синглет).
Пример 78
N-(3-Циано-1H-индол-7-ил)-4-[2- (метилсульфонил)этил]бензолсульфонамид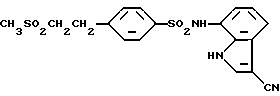
Целевое соединение получают аналогично методике, приведенной в Примере 1.
Спектр ПМР (ДМСО-d6) δ (м. д.): 2,94 (3H, синглет), 3,03 - 3,08 (2H, мультиплет), 3,42 - 3,47 (2H, мультиплет), 6,77 (1H, дублет дублетов, J = 7,7 0,37 Гц), 7,05 (1H, триплет, J = 7,9 Гц), 7,41 (1H, дублет, J = 8,1 Гц), 7,46 (2H, дублет, J = 8,2 Гц), 7,66 (2H, дублет, J = 8,2 Гц), 8,20 (1H, синглет), 10,09 (1H, уширенный синглет), 11,92 (1H, уширенный синглет).
Пример 79
N-(3-Хлор-1H-индол-7-ил)-4-(N-метилацетамидо)бензолсульфонамид
Целевое соединение получают аналогично методике, приведенной в Примерах 1 и 2.
Спектр ПМР (ДМСО-d6) δ (м.д.): 1,84 (3H, уширенный синглет), 3,16 (3H, синглет), 6,81 (1H, дублет, J = 7,7 Гц), 6,96 (1H, дублет дублетов, J = 8,0, 7,6 Гц), 7,27 (1H, дублет, J = 7,9 Гц), 7,45-7,49 (2H, мультиплет), 7,47 (1H, дублет, J = 2,7 Гц), 7,70-7,75 (2H, мультиплет), 10,02 (1H, уширенный синглет), 11,01 (1H, уширенный синглет).
Пример 80
N-(3-Хлор-1H-индол-7-ил)-6-гидрокси-3-пиридинсульфонамид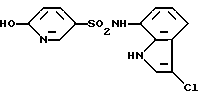
Водный раствор (1 мл), содержащий 32 мг (0,46 ммоль) нитрита натрия, по каплям при охлаждении в бане со льдом добавляют к раствору, полученному при растворении 100 мг (0,31 ммоль) соединения, синтезированного по Примеру 33, в 2 мл ледяной уксусной кислоты. Полученную смесь перемешивают в течение часа. Доводят pH смеси приблизительно до 8 добавлением водного раствора бикарбоната натрия. Полученную смесь перемешивают в течение 10 минут и экстрагируют этилацетатом. Органическую фазу отделяют, промывают водой, сушат над сульфатом магния и упаривают. Остаток очищают методом тонкослойной хроматографии на силикагеле и получают 54 мг целевого соединения.
Т. пл. : 244 - 245oC (с разложением) (перекристаллизовывают из смеси этилацетат/н-гексан)
Спектр ПМР (ДМСО-d6) δ (м.д.): 6,39 (1H, дублет, J = 9,5 Гц), 6,88 (1H, дублет, J = 7,7 Гц), 7,04 (1H, дублет дублетов, J = 7,9, 7,7 Гц), 7,32 (1H, дублет, J = 7,9 Гц), 7,50 (1H, дублет, J = 2,7 Гц), 7,55 (1H, дублет дублетов, J = 9,5, 3,1 Гц), 7,64 (1H, дублет, J = 3,1 Гц), 9,76 - 9,94 (1H, шир.), 11,01 - 11,13 (1H, мультиплет), 11,98 - 12,15 (1H, шир.).
Пример 81
N-(3-Хлор-1H-индол-7-ил)-4-[2-(N-метилметансульфонамидо)этил] бензолсульфонамид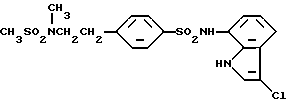
Целевое соединение получают аналогично методикам, приведенным в Примерах 1 и 2.
Спектр ПМР (ДМСО-d6) δ (м.д.): 2,69 (3H, синглет), 2,76 (3H, синглет), 2,86 (2H, триплет, J = 7,5 Гц), 3,26 (2H, триплет, J = 7,5 Гц), 6,78 (1H, дублет дублетов, J = 7,4, 0,55 Гц), 6,94 (1H, триплет, J = 7,7 Гц), 7,24 (1H, дублет дублетов, J = 7,7, 0,37 Гц), 7,39 (1H, дублет, J = 8,2 Гц), 7,48 (1H, дублет, J = 2,6 Гц), 7,66 (2H, дублет, J = 8,2 Гц), 7,94 (1H, уширенный синглет), 11,02 (1H, уширенный синглет).
Пример 82
N-(3-Хлор-1H-индол-7-ил)-4-(трифторметансульфонамидо) бензолсульфонамид
Трифторметансульфоновый ангидрид (128 мкл, 0,75 ммоль) добавляют при 0oC к раствору в пиридине (5 мл) соединения (62 мг, 0,19 ммоль), полученного в Примере 3. Образовавшуюся смесь оставляют на ночь перемешиваться в указанных условиях, упаривают в вакууме и добавляют фосфатный буфер с pH 7. Полученную смесь экстрагируют этилацетатом. Органическую фазу отделяют, промывают насыщенным водным раствором соли, сушат над сульфатом магния и растворитель отгоняют в вакууме. Остаток очищают колоночной хроматографией на силикагеле, получая 20 мг целевого соединения.
Спектр ПМР (ДМСО-d6) δ (м.д.): 6,79 (1H, дублет, J = 7,7 Гц), 6,94 (1H, дублет дублетов, J = 7,9, 7,7 Гц), 7,16 (2H, дублет, J = 8,6 Гц), 7,23 (1H, дублет, J = 7,9 Гц), 7,46 (1H, дублет, J = 2,7 Гц), 7,58 (2H, дублет, J = 8,1 Гц), 9,84 (1H, уширенный синглет), 10,98 (1H, уширенный синглет).
Пример 83
N-(3-Хлор-1H-индол-7-ил)-4-[(N-метилметансульфонамидо)метил] бензолсульфонамид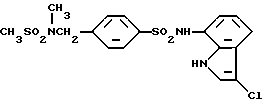
Целевое соединение получают аналогично методикам, приведенным в Примерах 1 и 2.
Т.пл.: 200,5 - 202oC (перекристаллизовывают из этанола)
Спектр ПМР (ДМСО-d6) δ/ (м.д.): 2,63 (3H, синглет), 2,94 (3H, синглет), 6,80 (1H, дублет, J = 7,3 Гц), 6,95 (1H, дублет дублетов, J = 8,1, 7,5 Гц), 7,25 (1H, дублет, J = 7,9 Гц), 7,45 (2H, дублет, J = 8,2 Гц), 7,47 (1H, дублет, J = 2,7 Гц), 7,74 (2H, дублет, J = 8,2 Гц), 10,00 (1H, синглет), 11,00 (1H, уширенный синглет).
Пример 84
3-Хлор-N-(3-хлор-1H-индол-пирроло[2,3-с]пиридин-7-ил) бензолсульфонамид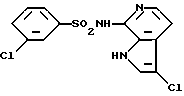
7-Бром-1H-пирроло[2,3-с] пиридина (600 мг, 3,05 ммоль), полученного из 2-бром-3-нитропиридина аналогично методике, приведенной в Препаративном примере 1, порошок меди (194 мг) и хлористую медь (603 мг) добавляют к 84 мл концентрированного водного раствора аммиака. Полученную смесь нагревают при температуре 120oC в закрытой трубке в течение 15 час и разбавляют, получая 170 мг 7-амино-1H-пирроло[2,3-с] пиридина. Полученный продукт обрабатывают аналогично методикам, приведенным в Примерах 1 и 2, и получают 57 мг целевого соединения.
Спектр ПМР (ДМСО-d6) δ (м.д.): 6,93 (1H, дублет, J = 6,6 Гц), 7,45 (2H, дублет дублетов, J = 6,6, 5,8 Гц), 7,53 (1H, дублет дублетов, J = 8,0, 7,6 Гц), 7,61 (1H, дублет, J = 7,6 Гц), 7,73 (1H, дублет, J = 2,8 Гц), 7,85 (1H, дублет, J = 8,0 Гц), 7,96 (1H, дублет, J = 1,2 Гц), 11,90 - 12,10 (1H, мультиплет), 12,72 (1H, уширенный синглет).
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ 7-АМИНО-1Н-ИНДОЛА | 1994 |
|
RU2121997C1 |
| ПРОИЗВОДНЫЕ ПЕПТИДОВ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ИНГИБИРОВАНИЯ ДЕЙСТВИЯ ТАХИКИНИНА | 1993 |
|
RU2119922C1 |
| ПРОИЗВОДНЫЕ КОНДЕНСИРОВАННЫХ ПОЛИЦИКЛИЧЕСКИХ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1996 |
|
RU2167877C2 |
| ПРОИЗВОДНЫЕ БЕНЗОДИАЗЕПИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1993 |
|
RU2139282C1 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ | 1993 |
|
RU2128172C1 |
| ГЕТЕРОЦИКЛО-ЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ АМИНОВ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ИНГИБИРОВАНИЯ ХОЛИНЭСТЕРАЗЫ, СПОСОБ ПОЛУЧЕНИЯ СОЕДИНЕНИЙ | 1992 |
|
RU2119920C1 |
| АЗОТСОДЕРЖАЩИЕ АРОМАТИЧЕСКИЕ ПРОИЗВОДНЫЕ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ИХ СОДЕРЖАЩАЯ, СПОСОБ ЛЕЧЕНИЯ И ПРИМЕНЕНИЕ | 2003 |
|
RU2310651C2 |
| ПРОИЗВОДНЫЕ ПЕПТИДОВ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ПРЕДУПРЕЖДЕНИЯ И УСТРАНЕНИЯ ТРОМБОЗОВ | 1992 |
|
RU2103276C1 |
| ИНГИБИТОР ЭКСПРЕССИИ ИНТЕГРИНА | 2001 |
|
RU2240826C2 |
| ПРОИЗВОДНЫЕ ИНДОЛА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1991 |
|
RU2045518C1 |
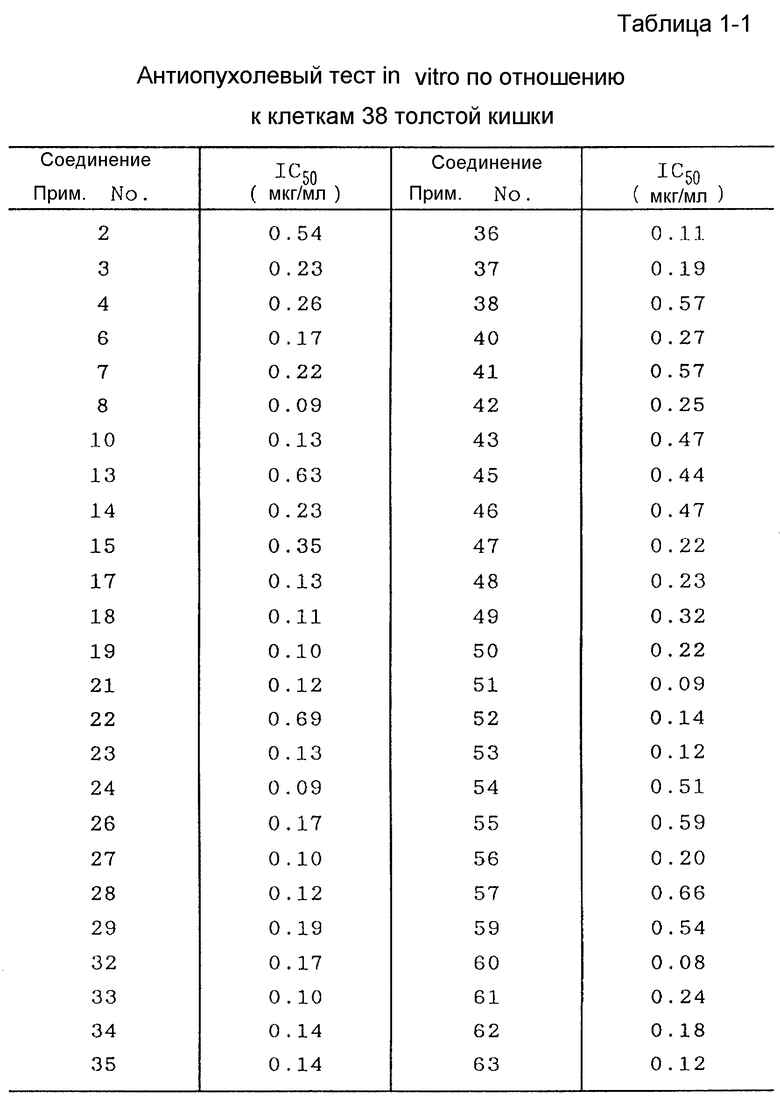

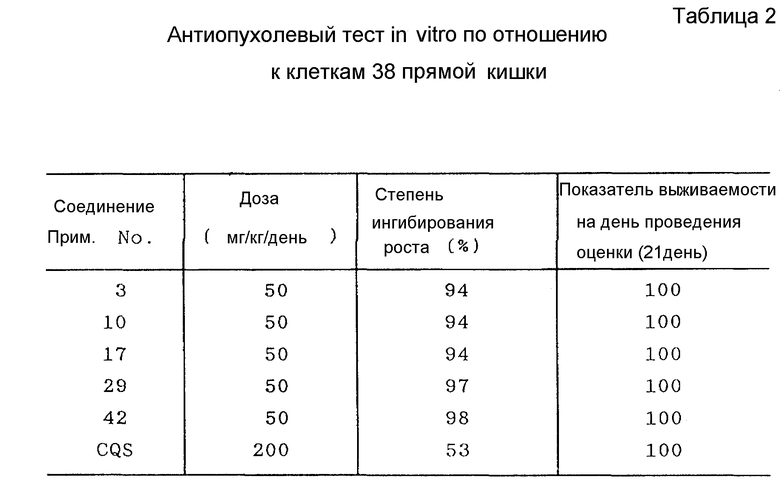

Описываются новые соединения, проявляющие противоопухолевую активность, общей формулы I
A-W-SO2N(R')-B,
где W представляет собой простую связь, группу -СН=СН-,
R' - водород или низший алкил;
А - замещенное или незамещенное ароматическое моно- или бициклическое кольцо, замещенное или незамещенное азот-, кислород - или серусодержащее ненасыщенное пяти- или шестичленное гетероциклическое кольцо, конденсированное или нет с ароматическим шестичленным кольцом, которое может иметь заместители:
В - заместитель формулы II, III, IV, V, VI,
где каждое из конденсированных колец может иметь заместители, при условии, что когда А представляет собой 4- (ацетамидо)фенил или 4-аминофенил;
W представляет собой простую связь;
B не является заместителем формулы УП
или его фармацевтически приемлемые соли. Описывается способ производного сульфонамида общей формулы I, причем В имеет в качестве заместителя цианогруппу, заключающийся в том, что соединение общей формулы I, где значения W, R', A указаны выше и В в пиррольном кольце содержит заместитель, способный превращаться в цианогруппу при дегидратации, подвергают взаимодействию с гидратирующим агентом и, в случае необходимости, удаляют защитные группы полученного продукта. Описывается также противоопухолевое средство, фармацевтическая композиция, а также способ лечения опухоли, с использованием вышеуказанных соединений формулы I. 9 с. и 6 з.п. ф-лы, 4 табл.
A - W - SO2N(R1) - B,
где W представляет собой простую связь, группу -CH = CH-;
R1 представляет собой водород или низший алкил;
A представляет собой замещенное или незамещенное ароматическое моно- или бициклическое кольцо; замещенное или незамещенное азот-, кислород- или серусодержащее ненасыщенное пяти или шестичленное гетероциклическое кольцо, конденсированное или нет с ароматическим шестичленным кольцом, которое может иметь заместители;
B представляет собой
где каждое из конденсированных колец может иметь заместители, при условии, что когда A представляет собой 4-(ацетамидо)фенил или 4-аминофенил, W представляет собой простую связь, B не является
или его фармацевтически приемлемые соли.
4. Производное сульфонамида или его фармацевтически приемлемые соли по п.1, где B представляет собой
5. Производное сульфонамида или его фармацевтически приемлемые соли по п. 1, где А представляет собой фенил или пиридил, W представляет собой простую связь, R1 представляет собой водород, B представляет собой
6. Производное сульфонамида или его фармацевтически приемлемые соли по п.1, которое выбирают из
1) 4-амино-N-(3-хлор-1H-индол-7-ил)бензолсульфонамида,
2) N-(3-хлор-1H-индол-7-ил)-4-(метансульфонамидо)-бензолсульфонамида,
3) N-(3-хлор-1H-индол-7-ил)-4-цианобензолсульфонамида,
4) 6-хлор-N-(3-хлор-1H-индол-7-ил)-3-пиридинсульфонамида,
5) 3-хлор-N-(3-циано-1H-индол-7-ил)бензолсульфонамида,
6) N-(3-хлор-1H-индол-7-ил)-4-сульфамоилбензолсульфонамида,
7) N-(3,4-дихлор-1H-индол-7-ил)-4-сульфамоилбензолсульфонамида,
8) N-(3-хлор-1H-индол-7-ил)-4-(метилсульфонил)бензолсульфонамида,
9) 4-циано-N-(3-циано-1H-индол-7-ил)бензолсульфонамида,
10) 4-карбамоил-N-(3-хлор-1H-индол-7-ил)бензолсульфонамида,
11) 6-амино-N-(3-хлор-1H-индол-7-ил)-3-пиридинсульфонамида,
12) N-(3-хлор-1H-индол-7-ил)-4-(2-сульфамоилэтил)бензолсульфонамида,
13) N-(3-хлор-1H-индол-7-ил)-4-[2-(метилсульфонил)этил] -бензолсульфонамида,
14) 6-амино-N-(3-циано-1H-индол-7-ил)-3-пиридинсульфонамида,
15) N-(3-хлор-1H-индол-7-ил)-6-изо-пропиламино-3-пиридинсульфонамида,
16) N-(3-хлор-1H-индол-7-ил)-6-[[2-(диметиламино)этил] -амино] -3-пиридинсульфонамида,
17) 3-циано-N-(3-циано-1H-индол-7-ил)бензолсульфонамида,
18) N-(3-хлор-1H-индол-7-ил)-4-(N-метилметансульфонамидо)-бензолсульфонамида,
19) N-(3-хлор-1H-индол-7-ил)-4-[(метансульфонамидо)метил] -бензолсульфонамида,
20) N-(3-хлор-1H-индол-7-ил)-6-циклопропиламино-3-пиридинсульфонамида,
21) N-(3-циан-1H-индол-7-ил)-5-метил-3-пиридинсульфонамида,
22) N-(3-хлор-1H-индол-7-ил)-4-(метилсульфамоил)бензолсульфонамида,
23) N-(3-хлор-1H-индол-7-ил)-4-[2-(метансульфонамидо)-этил]бензолсульфонамида,
24) N-(3-хлор-1H-индол-7-ил)-4-(сульфамоилметил)бензолсульфонамида,
25) N-(3-хлор-1H-индол-7-ил)-4-тиокарбамоилбензолсульфонамида,
26) 5-бром-N-(3-циано-1H-индол-7-ил)-2-пиридинсульфонамида,
27) N-(3-хлор-1H-индол-7-ил)-4-(N-этилсульфамоил)бензолсульфонамида,
28) N-(3-хлор-1H-индол-7-ил)-4-(этансульфонамидо)бензолсульфонамида,
29) N-(3-хлор-1H-индол-7-ил)-4-(N-метилкарбамоил)бензолсульфонамида,
30) N-(3-хлор-1H-индол-7-ил)-4-(метилсульфонилметил)бензолсульфонамида,
31) N-(3,4-дихлор-1H-индол-7-ил)-4-(сульфамотлметил)бензолсульфонамида,
32) N-(3-хлор-1H-индол-7-ил)-4-(N-метилацетамидо)бензолсульфонамида,
33) N-(3-хлор-1H-индол-7-ил)-6-гидрокси-3-пиридинсульфонамида,
34) N-(3-хлор-1H-индол-7-ил)-4-[2-(N-метилметансульфонамидо)этил]бензолсульфонамида,
35) 4-карбамоилметил-N-(3-хлор-1H-индол-7-ил)бензолсульфонамида,
36) N-(3-хлор-1H-индол-7-ил)-4-[(N-метилметансульфонамидо)-метил]бензолсульфонамида,
37) N-(3-хлор-1H-индол-7-ил)-4-гидроксибензолсульфонамида,
38) N-(3-хлор-1H-индол-7-ил)-5-сульфамоил-2-пиридинсульфонамида,
39) 6-ацетамидо-N-(3-хлор-1H-индол-7-ил)-3-пиридинсульфонамида,
40) N-(3-хлор-1H-индол-7-ил)-1-метил-4-имидазолсульфонамида,
41) N-(3-хлор-1H-индол-7-ил)-6-формамидо-3-пиридинсульфонамида, и
42) N-(3-хлор-1H-индол-7-ил)-5-сульфамоилметил-2-пиридинсульфонамида.
A - W - SO3H,
где A обозначает кольцо, значение которого определено в п.1, и которое может иметь защитную группу, значение W указано в п.1, подвергают взаимодействию с соединением общей формулы III
H - N(R') - B,
где B обозначает гетероцикл, значение которого определено в п.1, и который может иметь защитную группу, и, в случае необходимости, удаляют защитную группу полученного продукта.
причем A и B могут иметь заместители и защитные группы, подвергают взаимодействию с галоидирующим агентом с последующим удалением, в случае необходимости, защитных групп.
Ac - W - SO2N(R') - B,
где Ac обозначает кольцо, значение которого определено в п.1 для кольца A и которое может содержать в кольце уходящую группу, представляющую собой атом галогена, метилсульфонилоксигруппу или n-толуолсульфонилоксигруппу, или заместитель и иметь защиту, значения B определены в п.8, а значения W, R' указаны в п.1, с нуклеофилом, представляющим собой амин, спирт или тиол, которые могут быть использованы в виде их солей с щелочными металлами, и, в случае необходимости, удаление защиты у полученного продукта, если продукт имеет защитную группу.
| US 4610981 A, 1986 | |||
| Способ получения производных аминопропанола или их солей | 1976 |
|
SU679135A3 |
| US 4639463 A, 1987 | |||
| Способ получения карбамата | 1969 |
|
SU452093A3 |
| US 4942263 A, 1990 | |||
| US 4931433 A, 1987 | |||
| US 4849563 A, 1989 | |||
| Механизм перемещения ноги шагающего движителя | 1973 |
|
SU472053A1 |
| М.Д.Машковский | |||
| Лекарственные средства | |||
| - М.: Медицина, 1978, ч.II, с.388. | |||
Авторы
Даты
1999-04-10—Публикация
1994-09-08—Подача