Изобретение относится к производным пиридазиндиона. Используемый в лечении неврологических заболеваний, главным образом, у млекопитающих, таких как человек. Более конкретно, соединения используются при лечении припадков и/или других нейродегенеративных нарушений, таких как гипогликемия, корковый паралич, преходящее нарушение коркового мозгового кровообращения, перинатальная асфиксия, эпилепсия, психоз, хорея Хантингтона (Huntington), боковой амиотрофический склероз, болезнь Альцгеймера, болезнь Паркинсона, оливо- понтоцеребеллярная атрофия, вызванная вирусом, нейродегенерация, такая как приобретенный синдром иммунного дефицита и связанного с ним слабоумия, гипоксия, вызванная утоплением, травмой спинного мозга или головного мозга, и хроническая болезнь, для предупреждения лекарственных алкогольных синдромов отмены, и подавления толерантности и зависимости от наркотических анальгетиков. В частности, изобретение относится к новым производным пиридазиндиона, используемым при восстановлении неврологической дегенерации, такой, которая может быть вызвана ударом, и возникающей в результате ассоциативной функциональной недостаточности. Лечение с использованием соединения по изобретению может быть лечебной или терапевтической при введении соединения после проявления ишемии для смягчения эффектов этого заболевания. Обработка может также быть профилактической или перспективной при введении соединения в предвидении возможности проявления ишемии, например, пациенту, который склонен к ишемии. Известно, что случаи ишемии могут стать пусковым механизмом очень сильного увеличения внеклеточных концентраций возбуждающих аминокислот глутамата и аспартата, которые могут, в свою очередь, вызвать длительное нейронное возбуждение, приводящее к массированному притоку кальция из внеклеточных участков к внутриклеточным участкам в невральных клетках головного мозга. Тем самым может быть создана кальциевая перегрузка, которая приводит к каскаду событий, ведущих к катаболизму клеток и в конечном счете выражающихся в смерти клеток. Предполагается, что N-метил-Dаспартат (NMDA) рецепторный комплекс играет существенную роль в потоке событий, приводящих к некрозу клеток, следующему за проявлением ишемии. Предложенные в данном изобретении соединения могут быть полезны при целом ряде нейродегенеративных нарушений, поскольку они действуют как антагонисты возбуждающих аминокислот. Они могут это делать косвенно, путем аллостерической модуляции места связывания глутамата, в частности, действуя как антагонисты стрихнин-нечувствительного глицин рецептора на NMDA рецепторном комплексе. Они могут также делать это непосредственно, путем связывания самого глутамат участка NMDA рецепторного комплекса.
Согласно изобретению предложено соединение и его фармацевтические композиции, пригодные для лечения неврологических заболеваний, включающие соединение формулы I или его фармацевтивтически приемлемую соль (формула вынесена, вместе с другими формулами, обозначенными римскими цифрами, на страницы, следующие за примерами) и их таутомеры,
где Z выбран из O, S или NH (или, когда В-кольцо N- таутомеризовано или B-кольцо восстановлено, Z группа может быть выбрана из H, OH, SH или NH2 с образованием соединения I').
Кольцо выбрано A из ортоконденсированного ароматического или гетероароматического пяти- или шестичленного кольца, выбранного из фенила, пиридила, фурила, пирролила или тиенила, либо незамещенного, либо полизамещенного по кольцевому углеродному атому радикалом R4, где R4 независимо выбран из группы, содержащей галоген, (1-4C)алкил, NO2, CN, (C1-3)перфторалкил, OH, OCF3, (2-4C)алкенил, (2-4C)алкинил, O(1-4C)алкил, NR'R'', SO2NR'R'' или S(O)mR'; гетероциклическую группу, NR'COR'', COR'', NR'CO2R'', CO2R', CONR'R'';
R' выбран из H или -(CH2)nL, где L обозначает M или W;
M обозначает фенил или его бензопроизводные и является либо незамещенным, либо замещенным 1,2,3 или 4 группами, выбранными из -O-(1-4C)алкила, -O-(2-4C)алкенила, -O-(2-4C)алкинила, -O-(CO-C6алкил)фенил, -OH, -галогена, -N2O, -CN, -CF3, -(1-4C)алкилCF3, NH(CO)R', -(1-4C)алкил, -NR'R'', -CO2R', -CONR'R'', S(O)mR', SO2NR'R'', (C1-C6)алкилокси-, (C1-C6)алкилокси, гидрокси(C1-C6)алкилокси-, окси(1-6C)алкилокси, которые могут образовывать циклическое кольцо, присоединенное к фенильному кольцу в орто положении, арилокси(1-4C) алкилокси(1-4C)алкила, (C1-C6)алкилокси-(C1-C6)алкилокси(C1-C6)алкилокси-, гидрокси(C1-C6)алкилокси(C1-C6)алкилокси-, -O(C1-C6алкил)NR'R'', NR'(C1-C6)алкилNR'R'', (С1-С6алкил)NR'R", -O-(1-4C)перфторалкил, -(1-4С)перфторалкил, -NR'(C1-C6алкилокси), -NR'(C1-C6алкилгидрокси), -(C1-4алкил)окси(C1-4алкил), -O(C1-4алкил)COOR', -(CH)nNR'R''COOR', где n= 1-4, -(C1-4алкил)NR'R'', -(C1-4алкил)OR', -NR'(CH2)nCOOR', -S(O)m(C1-4алкил)окси(C1-4алкил), S(O)m(C1-4алкил)окси(C1-4алкил)окси(C1-4алкил)окси(C1-4алкил), -NR'(C1-4алкил), -NR'(C1-4алкил)окси(C1-4алкил)окси(C1-4алкил); гетероцикл, в котором гетероцикл выбран из пяти- и/или шести и/или семичленного гетероциклического кольца, содержащего 1,2 или 3 гетероатома, выбранных из O, N или -S, или их арил или гетероарил бензопроизводных, где N гетероцикла необязательно замещен R' и атом углерода или атом азота гетероцикла может быть замещен, R или R', или атом углерода может быть дизамещенным с образованием C5-C7 спиро-группы, или атом углерода или атом серы может быть замещен O с образованием карбонильной группы или сульфонил группу S(O)m при условии, что гетероциклический азот не может быть связан с азотом трициклической кольцевой системы формулы I;
гетероарил, где гетероарил выбран из незамещенных или замещенных ароматических радикалов и их бензопроизводных, включающих пиридил, тиенил, фуранил, или из групп, содержащих два гетероатома, выбранных из N, O или S, таких как пиразол, имидазол, изоксазол, оксазол, тиазол или изотиазол (и их окисленные производные, выбранные из S(O)m, где m = 0-2), пиридазин, пиримидин, пиразин, или из групп, содержащих три гетероатома, выбранных из N, O или S, таких как триазол или оксадиазол или триазин, или из групп, содержащих четыре гетероатома, таких как тетразол, где N гетероарильной группы необязательно замещен R и замещенные ароматические заместители включают обычные ароматические заместители, выбранные из гидрокси, алкокси, галогена или циано, и гетероарильная группа присоединена к -(CH2)n через атом углерода или гетероатом гетероарильной группы;
W выбран из OH, OR', CF3OCOR', S(O)mR', S(O)mNR'R'', галоген, NR'R'', при условии, что NR'R'' не равен NH2, COR', NR'COR'', OCONR', NR'CO2R'', (C3-6)циклоалкила, NRCONR'R'', CO2R' или CONRR' при условии что n > 0 и:
n = 0-6;
R2 выбран из H или -(CH2)nL, где L обозначает M или W, и
M представляет:
фенил или его бензопроизводные и является либо незамещенным, либо замещенным 1,2 или 3, выбранными из -O-(1-4C)алкила, -OH, - галогена, -NO2, -CN, -CF3, -NH(CO)R', -(1-4C)алкила, -NR'R'', -CO2R', -CONR'R'', -S(O)mR', -SO2NR'R'', (C1-C6)алкилокси(C1-C6) алкилокси-, гидрокси(C1-C6)алкилокси-, (C1-C6)алкилокси(C1-C6) алкилокси (C1-C6) алкилокси-, гидрокси (C1-C6) алкилокси (C1-C6) алкилокси-, -O(C1-C6алкил)NR'R'', -NR'(C1-C6алкил)NR'R'', -(C1- C6алкил)NR'R'', -OCF3, -NR'(C1-C6алкилокси), -NR'(C1- C6алкилгидрокси);
гетероцикл, где гетероцикл выбран из пяти- и/или шести и/или семичленного гетероциклического кольца, содержащего 1,2 или 3 гетероатома, выбранных из O, N или S, или его арильных или гетероарильных бензопроизводных, где N гетероцикла необязательно замещен радикалом R' и атом углерода или азота гетероцикла может быть замещен R или R', или атом углерода может быть дизамещен с образованием C5-C7 спиро-группы, или атом углерода или атом серы могут быть замещены O с образованием карбонильной группы или сульфонильной группы (S(O)m);
гетероарил, где гетероарил выбран из незамещенных или замещенных ароматических радикалов и их бензопроизводных, включающих пиридил, тиенил, фуранил, или из групп, содержащих два гетероатома, выбранных из N, O или S, таких как пиразол, имидазол, изоксазол, оксазол, тиазол, изотиазол или из групп, содержащих три гетероатома, выбранных из N, O или S, таких как триазол или оксадиазол, или из групп, содержащих четыре гетероатома, таких как тетразол, где N гетероарильной группы необязательно замещен радикалом R и замещенные ароматические заместители включают обычные ароматические заместители, выбранные из гидрокси, алкокси, галогена или циано, и гетероарильная группа присоединена к -(CH2)n посредством атома углерода или гетероатома гетероарильной группы;
W выбран из OH, OR', OCOR', S(O)mR', галоген, S(O)mNR'R'', NR'R'', при условии, что NR'R'' не равен NH2, COR', NR'COR'', OCONR', NR'CO2R'', (C3-6)циклоалкила, NRCONR'R'', CO2R' или CONRR',
при условии что n > 0, и:
n = 0 - 4;
R выбирают из H или (1-4C)алкила;
R' и R'', независимо, выбраны из H, (1-4C)алкила, где алкил включает алкенил(C2-C4) и алкинил(C2-C4); (3-6C)циклоалкила, фенил (O-4C)алкила, гетероцикло(O-4C)алкила или гетероарил (O-4C)алкила, где фенил или гетероцикл или гетероарил - такой, как определено выше, и любой из вышеприведенных радикалов необязательно замещен по одному или более углеродных атомов галогеном, H, (1-4C)алкилом, (3-6C)циклоалкилом, фенилом, NO2, CN, CF3, OH, O-(1-4C)алкилом, NR'R'', S(O)mR' или SO2NR'R'', где NR'R'' может, необязательно, образовывать N-алкил(C1-3)оксиалкил(C2-3) кольцо с N;
m = 0-2;
при условии, что R1 и R2 не равны оба H и в фармацевтической композиции к соединению формулы I или I' добавлен фармацевтически приемлемый растворитель или носитель. Согласно изобретению предлагается соединение и фармацевтические композиции на его основе, подходящие для лечения неврологических заболеваний, включающие соединение формулы I или его фармацевтивтически приемлемую соль (формула вынесена, вместе с другими формулами, обозначенными римскими цифрами, на страницы, следующие за экспериментальными примерами) и их таутомеры, где
Z выбран из O, S или NH (или, когда В-кольцо N- таутомеризовано или В-кольцо восстановлено, Z группа может быть выбрана из H, OH, SH или NH2 с образованием соединения I').
Кольцо А выбрано из ортоконденсированного ароматического или гетероароматического пяти- или шестичленного кольца, выбранного из фенила, пиридила, фурила, пирролила или тиенила, либо незамещенного, либо полизамещенного у кольцевого углеродного атома радикалом R4, где R4 независимо выбран из группы, содержащей галоген, (1-4C)алкил, NO2, CN, (C1-3)перфторалкил, OH, OCF3, (2-4C)алкенил, (2-4C)алкинил, -O-(1-4C)алкил, NR'R'', SO2NR'R'' или S(O)mR';
R' выбирают из H или -(CH2)nL, где L представляет M или W;
M обозначает
фенил или его бензопроизводные и является либо незамещенным, либо замещенным 1,2 или 3 группами, выбранными из -O-(1-4C)алкила, -O-(2-4C)алкенила, -O-(2-4C)алкинила, -OH, галогена, -NO2, -CN, - CF3, -(1-4C)алкилCF3, -NH(CO)R', -(1-4C)алкила, -NR'R'', -CO2R', -CONR'R'', -S(O)mR', -SO2NR'R'', (C1-C6) алкилокси (C1-C6) алкилокси-, гидрокси (C1-C6) алкилокси-, арилокси (1-4C) алкилокси (1-4C) алкила, (C1-C6) алкилокси- (C1-C6) алкилокси (C1-C6) алкилокси-, гидрокси (C1-C6) алкилокси (C1-C6) алкилокси-, -O-(C1- C6алкил)NR'R'', -NR'(C1-C6алкил)NR'R'', -(C1-C6алкил)NR'R", -O-(1-4C)перфторалкила, -(1-4C)перфторалкила, -NR'(C1- C6алкилокси), -NR'(C1-C6алкилгидрокси);
гетероцикл, где гетероцикл выбран из пяти- и/или шести и/или семичленного гетероциклического кольца, содержащего 1,2 или 3 гетероатома, выбранных из O, N или S, где N на гетероцикле, необязательно, замещен радикалом R' и атом углерода или атом азота на гетероцикле может быть замещен радикалом R или R', или атом углерода может быть замещен O с образованием карбонильной группы;
гетероарил, где гетероарил выбран из незамещенных или замещенных ароматических радикалов и их бензопроизводных, включающих пиридил, тиенил, фуранил, или из групп, содержащих два гетероатома, выбранных из N, O или S, таких как пиразол, имидазол, изоксазол, оксазол, тиазол, изотиазол или из групп, содержащих три гетероатома, выбранных из N, O или S, таких как триазол или оксадиазол, где N гетероарильной группы, необязательно, замещен радикалом R, а замещенные ароматические заместители включают обычные ароматические заместители, выбранные из гидрокси, алкокси, галогена или циано, и гетероарильная группа присоединена к -(CH2)n посредством атома углерода или гетероатома гетероарильной группы;
W выбран из OH, OR', OCOR', S(O)mR', NR'R'', при условии, что NR'R'' не равен NH2, NR'COR'', OCONR', NR'CO2R'', NRCONR'R'', CO2R' или CONRR', при условии, что n > 0, и:
n = 0 - 4;
R2 выбран из H или -(CH2)nL, где L обозначает M или W, и
M обозначает
фенил или его бензопроизводные и является либо незамещенным, либо замещенным 1,2 или 3 группами, выбранными из -O-(1-4C)алкила, -OH, -галогена, -NO2, -CN, -CF3, NH(CO)R', -(1-4C)алкила, - NR'R'', -CO2R', -CONR'R'', -S(O)mR', -SO2NR'R'', (C1-C6)алкилокси(C1-C6)алкилокси-, гидрокси (C1-C6)алкилокси-, (C1-C6) алкилокси- (C1-C6) алкилокси (C1-C6) алкилокси-, гидрокси (C1-C6)алкилокси(C1-C6)алкилокси-, -O-(C1-C6алкил) NR'R'', -NR'(C1- C6алкил)NR'R'', -(C1-C6алкил)NR'R'', -OCF3, -NR'(C1- C6алкилокси), -NR' (C1-C6алкилгидрокси); гетероцикл, где гетероцикл выбран из пяти- и/или шести и/или семичленного гетероциклического кольца, содержащего 1,2 или 3 гетероатома, выбранных из O, N или S, где N гетероцикла, необязательно, замещен радикалом R' и атом углерода или атом азота на гетероцикле может быть замещен радикалом R или R';
гетероарил, где гетероарил выбран из незамещенных или замещенных ароматических радикалов и их бензопроизводных, включающих пиридил, тиенил, фуранил, или из групп, содержащих два гетероатома, выбранных из N, O или S, таких как пиразол, имидазол, дитиол, оксатиол, изоксазол, оксазол, тиазол, изотиазол или из групп, содержащих три гетероатома, выбранных из N, O или S, таких как триазол, оксадиазол, диоксазол или оксатиазол, где N на гетероарильной группе, необязательно, замещен R, и замещенные ароматические заместители включают обычные ароматические заместители, выбранные из гидрокси, алкокси, галогена или циано, и гетероарильная группа присоединена к -(CH2)n посредством углеродного атома гетероарильной группы;
W выбран из OH, OR', OCOR', S(O)mR', NR'R'', при условии что NR'R'' не равен NH2, NR'COR'', OCONR', NR'CO2R'', NRCONR'R'', CO2R' или CONRR', при условии что n > 0, и:
n = 1-4;
R выбран из H или (1-4C) алкила;
R' и R'', независимо, выбраны из H, (1-4C)алкила, где алкил включает алкенил или алкинил; фенил(O-4C)алкила, гетероцикло(O- 4C)алкила или гетероарил(O-4C)алкила, где фенил или гетероцикл или гетероарил - такие, как определено выше, и необязательно замещен по одному или более углеродным атомам галогеном, H, (1-4C)алкилом, NO2, CN, CF3, OH, -O-(1-4C)алкилом, NR'R'', S(O)mR' или SO2NR'R'';
m = 0-2; и в фармацевтической композиции к соединению формулы I или I' прибавлен фармацевтически приемлемый растворитель или носитель.
Данное изобретение относится также к соединениям, которые используются в качестве промежуточных соединений при получении глицин рецепторных антагонистов, как определено выше, где W обозначает галоидные радикалы, такие как Cl, Br или I, где n > 0. Дополнительно, соединения, полученные новым способом получения пиридазинхинолинов, указанным здесь, с R1, выбранным из арила или гетероарила, как определено выше, является ключевыми промежуточными продуктами для получения указанных соединений. Эти ключевые промежуточные соединения представляют N-2-арил (или гетероарил) гидразиды 3-карбоалкокси-4-гидрокси-хинолин-2-карбоциклической кислоты, которые используются для получения вышеуказанных арильных или гетероарильных радикалов, где арил или гетероарил - такой, как определено выше. Другие промежуточные ключевые продукты включают промежуточные производные 3-карбоновой кислоты-4-гидроксихинолин-2-пирролидинамида, которые используются для взаимодействия с ВОС-замещенными арил, гетероарил или замещенными алкил гидразинами с получением после связывания с помощью дициклогексилдиимида или диизопропилдиимида в полярном растворителе, таком как ТГФ, метанол, диэтиловый эфир, диоксан, CH2Cl2, CH3CN или ДМФ и кислота (например, CH3SO3H), другого ключевого промежуточного продукта - 2-пирролидинокарбамид-3-карбоновой кислоты-N-1 арил-, гетероарил-, замещенного алкил, арилалкил- или гетероарилалкилгидразида, который после снятия защиты или удаления ВОС или другой объемной N-защитной группы, приводит селективно к N-2-защищенному PQD. Пирролидин может быть замещен эквивалентным количеством амина, который приводит к амиду с ограниченной стерической доступностью и который действует как подходящая уходящая группа.
В ЕРО номер 0516297 A1 описаны некоторые пиридазиндионы. Кроме того, соединения (1) тиено [2',3':5,6]пиридо[2,3-d]пиридазин-5,8,9 (4H,6H,7H)-трион и (2) тиено [3',2':5,6]-пиридо [2,3-d]пиридазин- 4,5,8(6H,7H,9H)-трион известны, например из J. Heterocyclic Chem., 28, 205, (1991).
Другие производные пиридазиндиона известны, например, из Beilstein's Handbuch der Organischen Chemic; Goodard et al., Bull.Soc.Chim.Fr., 1588, (1972); и Reid et al., Chem.Bet., 85, 204, (1952). С другой стороны, соединения по настоящему изобретению относятся к новым 2- или 3-замещенным пиридазиндионам или их таутомерам, как показано формулой I или I'.
Отдельные группы этой широко определенной группы соединений включают соединения, имеющие конкретные формулы II или III, где, в случае формулы II:
Z выбран из O, S или NH;
Кольцо А выбрано из ортозамещенного ароматического или гетероароматического пяти- или шестичленного кольца, выбранного из фенила, пиридила, пирролила или тиенила, либо незамещенного, либо замещенного по одному или более углеродным атомам кольца группой R4, где R4, независимо, выбран из группы, содержащей водород, галоген, (1-4C)алкил, NO2, CN, (C1-3)перфторалкил, OH, OCF3, (2-4C)алкенил, (2-4C)алкинил, O(1-4C)алкил, NR'R'', SO2NR'R'' или S(O)mR';
R1 обозначает -(CH2)mL, где L выбран из:
OH, -O(C1-C4алкил), -O(C1-C4алкил)арила, (C1-C4алкил)COOR', OCOR', S(O)mR', NR'R'', при условии что NR'R'' не равен NH2, NR'COR'', OCONR', NR'CO2R'', NRCONR'R'', CO2R' или CONRR', при условии что n > 0;
арила или его бензопроизводных, либо незамещенных, либо моно-, ди- или тризамещенных ароматическими заместителями, включющим -галоген, -(C1-C6)алкил, -(C2-C6)алкенил или алкинил, -окси(CO-6алкил) фенил, -OH, (C1-C6)алкокси, OCF3, CF3, NO2, ON, NH2, S(O)mR', NH(C1-4алкил), гетероарил или N(C1-C4алкил)2;
гетероцикла, где гетероцикл выбран из пяти- и/или шести и/или семичленного гетероцикла, содержащего 1, 2 или 3 гетероатома, выбранных из O, N или S, где N гетероцикла, необязательно, замещен радикалом R' и атом углерода или атом азота на гетероцикле может быть замещен R или R' или атом углерода может быть дизамещен с образованием C5-C7 спиро-группы, или атом углерода или атом серы может быть замещен O с образованием карбонильной группы или сульфонильной группы (S(O)m); где гетероциклические группы могут быть выбраны из, например, 2-пирролидинона, пиперазина, оксазолидона, 2,5-оксазолидиндиона, 2,4-имидазолидиндиона, 2,4-тиазолидиндиона или сукцинимида; его арил или бензо, или гетероарилбензо производных (3,4-пиридиндикарбоксимид, -1-фталимидо, ангидрид N- карбоксиантраниловой кислоты (isatoic anhydride), ортобензойный сульфимид), либо незамещенных, либо моно-, ди-или тризамещенных алкильными или ароматическими заместителями, включающими -галоген, -C1-C6алкил, -OH, C1-C6алкокси, фенил, OCF3, CF3, NO2, CN, NH2, S(O)mR', NH(C1-4алкил) или N(C1-C4алкил)2;
гетероарила, где гетероарил выбран из незамещенных или замещенных ароматических радикалов и их бензопроизводных, включающих пиридил, тиенил, фуранил, или из групп, содержащих два гетероатома, выбранных из N, O или S, таких как пиразол, имидазол, изоксазол, оксазол, тиазол, изотиазол или из групп, содержащих три гетероатома, выбранных из N, O или S, таких как триазол или оксадиазол, или из групп, содержащих 4 гетероатома, таких как тетразол, где N гетероарильной группе необязательно замещен R, и замещенные ароматические заместители включают обычные ароматические заместители, выбранные из гидрокси, алкокси, галогена или циано, и гетероарильная группа присоединена к -(CH2)n через атом углерода или гетероатом гетероарильной группы;
n = 0-3;
и их фармацевтически приемлемые соли. Настоящее изобретение относится также к фармацевтическим композициям соединения формулы II, указанного выше, с фармацевтически приемлемой добавкой. Кроме того, изобретение относится к важным промежуточным продуктам, которые используются в синтезах соединения формулы II, где L в приведенной выше формуле выбран из галогена (Br, Cl, F или I) и n > 0. Этот промежуточный продукт используется при получении некоторых глицин рецепторных антагонистов формулы II. В случае соединения формулы III,
Z выбран из:
O, S или NH;
кольцо А выбрано из ортоконденсированного ароматического или гетероароматического пяти- или шестичленного кольца, выбранного из фенила, пиридила, пирролила или тиенила, либо незамещенного, либо полизамещенного по углероду кольца группой R4, где R4, независимо, выбран из группы, содержащей водород, галоген, (1-4C)алкил, NO2, CN, (C1-3)перфторалкил, OH, OCF3, (2-4C)алкенил, (2-4C)алкинил, O(1-4C)алкил, NR'R'', SO2NR'R'' или S(O)mR';
R2 обозначает -(CH2)nL, где
L выбран из:
-OH, -O(C1-C4алкил), -O(C1-C4алкил)арила, (C1-C4алкил)COOR'; их арил или бензопроизводных, либо незамещенных, либо моно-, ди- или тризамещенных ароматическими заместителями, включающими галоген, -C1-C6алкил, S(O)mR', -OH, C1-C6алкокси; CF3, OCF3, NO2, CN, NH2, NH(C1-C4алкил) или N(C1-C4алкил)2, при условии что n > 0;
гетероцикла, где гетероцикл выбран из пяти- и/или шести и/или семичленного гетероциклического кольца, содержащего 1, 2 или 3 гетероатома, выбранных из O, N или S, где N гетероцикла, необязательно, замещен R' и атом углерода или атом азота гетероцикла может быть замещен R или R';
гетероарила, где гетероарил выбран из незамещенных или замещенных ароматических радикалов и их бензопроизводных, включающих пиридил, тиенил, фуранил, или из групп, содержащих два гетероатома, выбранных из N, O или S, таких как пиразол, имидазол, изоксазол, оксазол, тиазол, изотиазол или из групп, содержащих три гетероатома, выбранных из N, O или S, таких как триазол или оксадиазол, или из групп, содержащих четыре гетероатома, таких как тетразол, где N гетероарильной группы необязательно замещен R, и замещенные ароматические заместители включают обычные ароматические заместители, выбранные из гидрокси, алкокси, галогена или циано, и гетероарильная группа присоединена к -(CH2)n через атом углерода гетероарильной группы;
n = 0-3;
и их фармацевтически приемлемых солей. Настоящее изобретение относится также к фармацевтическим композициям соединения формулы III, указанного выше, с фармацевтически приемлемой добавкой. Кроме того, изобретение относится к важным промежуточным продуктам, которые используются в синтезах соединения формулы III, где L в приведенной выше формуле выбран из галогена (Br, Cl, F или I). Этот промежуточный продукт используется при получении некоторых глицин рецепторных антагонистов формулы III.
Более конкретно подгруппы включают соединения, имеющие конкретные формулы II или III, где Z выбран из кислорода;
кольцо А выбрано из фенила или замещенного фенила, где фенильный цикл моно-, ди- или тризамещен галогеном, нитро или простым C1-C4алкилом, включающим метил, этил или пропил;
R1, в случае формулы II, выбран из -(CH2)nL, где L выбирают из:
-OH, -O(C1-C4алкил), -O(C1-C4алкил)арила, (C1-C4алкил)CO2R', OCOR', S(O)mR', NR'R'', при условии, что NR'R'' не равен NH2, NR'COR'', OCONR', NR'CO2R'', NRCONR'R'', CO2R' или CONRR', при - O условии что n > 0;
их арил или бензопроизводных, либо незамещенных, либо моно-, ди- или тризамещенных ароматическими заместителями, включающими - галоген, -C1-C6алкил, -OH, C1-C6алкокси, -окси(C1-C4)алкилфенил, - C2-4алкенил, CF3, OCF3, NO2, CN, NH2,
-C(O)NR'R'', гетероарил, S(O)mR', NH(C1-C4алкил) или N(C1- C4алкил)2;
сукцинимида; оксазолидона; пиперазина; или их замещенных призводных, где заместители выбраны из (C1-C4алкила), фенила включая замещенный фенил, где фенильные заместители являются обычными ароматическими заместителями, 2-пирролидинона и его замещенных производных (например, (C1-6)алкил, гидрокси); 2,5- оксазолидиндиона или его замещенных производных (например, алкил, диалкил, фенил, дифенил, спиро(C4-6)алкил), 2,4-тиазолидиндиона, 2,4-имидазолидиндиона или их замещенных производных (например, алкил, диалкил, фенил, дифенил), или их бензо или их гетероарил бензопроизводных, выбранных из фталимидо, ортобензойного сульфимида, ангидрида N-карбоксиантраниловой кислоты или 3,4- пиридиндикарбоксимида;
гетероарила, где группы выбраны из тиофена, пиррола, фурана, пиразола, имидазола, триазола, тетразола или пиридина; n = 0-3;
и их фармацевтически приемлемых солей, включая их холиновые соли. R2, в случае формулы III и с Z и кольцом А, указанными выше, выбран из -(CH2)nL, где
L выбран из:
-OH, (n>0), (C1-C4алкил)карбокси, их арил или бензопроизводные, либо незамещенные, либо моно-, ди- или тризамещенные обычными ароматическими заместителями, включающими -галоген, -C1-C6алкил, OCF3, CF3, гидрокси, C1-C6алкокси; NO2, CN, NH2, NH(C1- 4алкил), S(O)mR' или N(C1-C4алкил)2;
Более конкретно, в случае формулы III, R2 выбран из -(CH2)n, где n равно 0 и L выбран из 4-S(O)mR'фенила, где m равен 0-2, 2-метилфенила, 2-метил-4- хлорфенила, 3-нитрофенила, 3-хлор-4-метилфенила, 4- трифторметилфенила, 3,4-диметоксифенила или 2,4-дихлорфенила.
Предпочтительно, настоящее изобретение относится к соединениям формулы II или их фармацевтически приемлемым солям, где
кольцо А выбрано из ортоконденсированного фенила, 7- хлорфенила, 7,9-дихлорфенила, 7-хлор-9-метилфенила, 7-метил-9- хлорфенила, 7, 9-диметилфенила, 7-хлор-8-нитрофенила, 7, 9-дихлор- 8-нитро-фенила, 7-хлор-9-этилфенила, где цифровые обозначения относятся к положению на конечной пиридазинхинолиновой кольцевой системе;
Z выбран из кислорода;
R1 выбран из -(CH2)nL, где
L выбран из: -OH, -O(C1-C4алкил), -O(C1-C4алкил)арила, (C1- C4алкил)CO2R', OCOR', S(O)mR', NR'R'', при условии, что NR'R'' не равно NH2, NR'COR'', OCONR', NR'CO2R'', NRCONR'R'', CO2R' или CONRR', при условии что n > 0;
арила или его бензопроизводных, либо незамещенных, либо моно-, ди- или тризамещенных ароматическими заместителями, включающими -галоген, -C1-C6алкил, -OH, C1-C6алкокси, OCF3, NO2, CN, CF3, NH2, S(O)mR', NH(C1-C4алкил) или N(C1-C4алкил)2;
сукцинимида, пиперазина или его замещенных призводных, где заместители выбраны из (C1-4алкила), фенила, включая замещенный фенил, где фенильные заместители это обычные ароматические заместители: 2,5-оксазолидиндиона или его замещенных производных, выбранных из C1-C6алкила, фенила или замещенного фенила, C3-C6спироалкила; пирролидона и его замещенных производных, выбранных из C1-C6алкила, гидрокси, фенила; 2,4- имидазолидиндиона или его замещенных производных, выбранных из C1- C6алкила, фенила или замещенного фенила; 2,4-тиазолидиндиона или его замещенных производных, выбранных из C1-C6алкила или фенила; или бензо или гетероарил бензо гетероциклических производных, выбранных из -1-фталимида, ортобензойного сульфимида, ангидрида N- карбоксиантраниловой кислоты или 3,4-дикарбоксимида;
гетероарила, выбранного из тиофена, имидазола, триазола, тетразола, фурана или пиридина; и n = 0-2. Преимущественно, для соединений формулы II, n = 0, и L выбран из: фенила, 4- метоксифенила, 4-гидроксифенила, 4-хлорфенила, 4-метилфенила, 4-изопропилфенила, нафтила, 4-фторфенила, 4-бромфенила, 2- метоксифенила, 2-гидроксифенила, 3-метоксифенила, 3- гидроксифенила, 4-трифторметоксифенила, 3-хлор-4-метоксифенила, 5- метокси-3-пиридила, 4-S(O)mR'фенила, где m = 0-2, и R' обозначает метил; 3-хлорфенила, 3-хлор-4-гидроксифенила, 2-метил- 4-хлорфенила, 3-метилфенила, 2-метилфенила, 3-фторфенила, 2,4-дифторфенила, 3,5-трифторметилфенила, 3-нитрофенила, 2- фторфенила, 2,4-диметилфенила, 3-хлор-4-метилфенила, 4- трифторметилфенила, 4-иодфенила, 3,4-диметилфенила, 3,4- диметоксифенила, 2-метил-4-метоксифенила, 2-метокси-4-бромфенила, 2-метил-4-гидроксифенила, 4-этилфенила, 2,3-диметилфенила, 3,4- дигидроксифенила, 2,4-диметоксифенила, 2,4-дихлорфенила, 4- нитрофенил-2,5-диметоксифенила, 2,5-диметилфенила, 4- оксибензилфенила, 2,5-дигидроксифенила, 4-винилфенила, 2,5- дифторфенила, 2-метил-4-фторфенила, 3,5-диметоксифенила, 4- карбоксифенила, 4-формамидофенила, 4-(N,N-диэтилформамидо) фенила, 4-цианофенила или 4-тетразолфенила. Преимущественно, настоящее изобретение относится также к соединениям формулы II, где n = 1, и L выбран из какого-либо из указанных выше значений для n, равном нулю, и более конкретно, к соединениям, выбранным из 1-фторфенила, 4-цианофенила, 4-трифторметилфенила, 4-метилфенила, пентафторфенила или 3,5-дитрифторметилфенила, или к соединениям формулы II, где n = 3, и L выбран из какой-либо группы, указанной для n = 0 или 1, а более конкретно, к соединениям, выбранным из фенила или фенила, замещенного обычным ароматическим заместителем.
Из описанных здесь замещенных алкил(C1-6)арилов, содержащих фенильные заместители, увеличивающие липофильность с повышением активности красных ядер, являются особенно полезными. Например, повышенную активность имеют фторированные, алкилфторированные, алкил(C1-4) или моногалогенированные бензильные производные. (C1-C6)алкильные группы, замещенные концевой CF3 группой особенно полезны ввиду их неожиданной способности к растворимости, а также полезны в связи с их липофильностью.
Пиридилбром соль, присоединенная к N-2-этильному радикалу в PQD кольце, и где азот пиридила непосредственно присоединен к концевому углероду этила, не обладает свойствами глицинового антагониста. Пиридильные кольца, присоединенные посредством атома углерода пиридильного кольца к (CH2)n группе соединения формулы II, обладают значительной глицин рецепторной антагонистической активностью.
Настоящее изобретение предпочтительно также относится к соединениям формулы II, где n = 2, и гетероциклическая часть, как описано здесь, присоединена к 2-этиловому углероду и выбрана из 1-фталимидо, 4- фенилпиперазина, сукцинимида, 3,3-диметил-2,5-оксазолидиндиона, 1- метилпирролидина, 3-метил-3-фенил-2,5-оксазолидиндиона, 3-N-метил- 2,5-имидазолидиндиона, 4,4-диметил-2,5-имидазолидиндиона, 4,4- дифенил-2,5-имидазолидиндиона, 2,4-тиазолидиндиона, 3,4- пиридиндикарбоксимида, сульфимида оротобензойной кислоты (сахарин), 4-цикло-гексилспиро-2,5-оксазолидиндиона, ангидрида N- карбокси-антраниловой кислоты, бензо[е][1.3] оксазин-2,4-диона, 4- фенил-2,5-оксазолидиндиона или 3-гидрокси-3-метил-2-пирролидинона.
Предпочтительные соединения, для которых n равно единице и L обозначает гетероцикл, включают группы, выбранные из тетрагидрофурана, пиперидина, N-метилпиперидина, тетрагидро- фурана, 1,3-диоксана, бензо-1,4-диоксана или сульфимида ортобензойной кислоты. Настоящее изобретение также, предпочтительно, относится к соединения формулы II, где R1 равно (CH2)nL и где n = 1, и L обозначает гетероарил, выбранный из тиофена, или пиридила, или фурана, или их замещенных производных, где заместители выбраны из обычных ароматических заместителей (например, гидрокси, галоген, C1-C6алкил, фенил или гетероарил), или из групп, выбранных из имидазола, тиазола, тиадиазола, пиридопиридина, пиримидина, пиразина, пиридазина, бензотиофена, фурана, бензофурана, индола или триазола, или из замещенных производных. Предпочтительные группы, когда n = 2 и где гетероарильная группа присоединена к 2-этиловому углероду, включают члены, выбранные из имидазола, триазола, тетразола или пиридина.
Настоящее изобретение относится также, преимущественно, к соединению формулы II, где n = 2, и L равно W, где W выбран из группы, содержащей: гидрокси, ацетокси, бензоиламидо, 2-гидрокси-2-метилпропамидо, 4-метоксианилин, 1- формамидоцикло-гексанол, 2-гидроксибензамидо, дифенилгидроксиацетамидо, -S-CH3, -S(O)2-CH3, -S-4-метоксифенил, S-циклопентил, -S(O)2-этил, -S-этил, -S-бутил, -S(O)2-бутил или - S-пропил. Кроме того, эти группы могут быть выбраны из Oph, галогена, -CH2-COOR' или -CH2CONR'R'', OCH3, OCH2CH2OCH3, - OCH2CH2OCH2CH3, -O-2-метоксифенила, -S(O)2Ph, -S(O)2NR'R'', - CF(CF3)2, -CF2CF3, -CF2CF2CF3, -OC2H5OC2H5, -CH2NR'R'' или -CH2CH2COCH3. Настоящее изобретение относится также к фармацевтическим композициям, содержащим предпочтительное соединение формулы II, указанное выше, и фармацевтически приемлемый носитель.
Необходимо учесть, что описанные здесь формулы могут быть представлены в виде различных таутомерных и связанных с расположением изомерных форм, как обсуждается далее. Настоящее изобретение включает, если не указано особо, такие альтернативные формы, а также включает их соли, особенно фармацевтически приемлемые соли присоединения.
Многие из описанных здесь соединений могут существовать и быть представлены в виде различных точных таутомерных форм (например, соединения соответствующие соединению формулы I). Указывается, что таутомерные формы этих соединений могут также существовать, когда Z обозначает гидрокси, тиогидрокси, амино или алкиламино, как показано в формуле I'.
Специалисту в данной области будет должно быть понятно, что некоторые соединения формулы I содержат асимметрически замещенный атом углерода, и, следовательно, могут существовать и быть выделены в оптически-активных и рацемических формах. Кроме того, будет ясно, что некоторые соединения формулы I, например, соединения, содержащие двойную связь, могут существовать и быть выделены в виде раздельных стереоизомерных форм ('E' и 'Z') относительно этой группы. Некоторые соединения могут проявлять полиморфизм. Необходимо учесть, что настоящее изобретение включает любую рацемическую, оптически активную полиморфную и стереоизомерную форму, или их смеси, обладающую свойствами, используемыми при лечении нейродегенеративных заболеваний, при этом хорошо известно в данной области, как получить оптически-активные формы (например, путем разделения рацемической формы или путем синтеза из оптически-активных исходных материалов) и индивидуальные 'E' и 'Z' стереоизомеры (например, хроматографическим разделением из смеси), и как определить нейрозащитные свойства путем описанных здесь ниже стандартных испытаний.
Далее, изобретение относится к способу лечения неврологических заболеваний, включающему введение млекопитающему, при необходимости такого лечения, эффективного количества соединения согласно изобретению, как определено выше, или его фармацевтически приемлемой соли, или композиции, как определено выше. Изобретение также включает способ антагонизации NMDA рецептора у млекопитающих, включающий введение фармацевтически эффективного количества соединения или его соли, как заявлено в формуле изобретения, или фармацевтической композиции, как изложено здесь, нуждающемуся в лечении пациенту. Предпочтительной областью терапевтического применения является профилактика и/или лечение припадка. Фармацевтически эффективное количество соединения, как заявлено в формуле изобретения и раскрыто в настоящем изобретении, может вводиться сразу после ишемического приступа для предотвращения разрушения и/или отмирания клеток. Настоящее изобретение относится также к способу профилактики и/или лечения нарушения, вызванного возбуждающими аминокислотами, такими как L-глутамат. Изобретение также относится к способу предупреждения избыточного притока ионов кальция в центральных нейронов. Изобретение относится к способу предупреждения ишемического нейронного повреждения после транзиторной глобальной ишемии и к способу уменьшения размера инфаркта после локального ишемического инсульта путем обработки пациента, при необходимости его лечения, фармацевтически эффективным количеством соединения формулы I или I', где Z, кольцо А и R1 и R2 - такие, как здесь указано. Кроме того, что они используются при лечении больных с внезапным острым приступом, соединения и композиции изобретения могут быть чрезвычайно успешными при профилактике нейрологической заболеваемости в процессе восстановления сердечной деятельности или назначаться в качестве церебральных профилактических средств в процессе хирургического вмешательства с высокой степенью риска.
В данном описании термины "алкил" и "алкокси" включают как разветвленные, так и линейные радикалы, но следует учесть, что ссылки на индивидуальные радикалы, такие как "пропил" или "пропокси" включают только линейные ("нормальные") радикалы, изомеры с разветвленной цепью, такие как "изопропил" или "изопрокси" указываются особо.
Термин "галоген" включает фтор, хлор, бром и иод, если не оговорено иного.
Термин "гетероарил" включает гетероароматические группы или их бензопроизводные, которые конкретно или обобщенно описаны или раскрыты в данном описании.
Конкретные значения (1-4C)алкила включают метил, этил, пропил, изопропил, бутил, изобутил, втор- бутил и трет-бутил.
Конкретные значения (2-4C)алкила, содержащие двойную или тройную связь, включают винил, 2-пропенил (т.е. аллил), 2-пропинил, (т.е. пропаргил), 2-бутенил и 3-бутенил.
Конкретные значения (1-4C) алкокси включают метокси, этокси, пропокси, изопропокси, бутокси, изобутокси и трет-бутокси.
Конкретные значения (1-6C)алкила включают метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил и трет-бутил, пентил, изопентил, неопентил, гексил, изогексил.
Конкретные значения (2-6C)алкила, содержащего двойную или тройную связь, включают винил, 2-пропенил (т. е. аллил), 2- пропинил, (т.е. пропаргил), бут-2-енил, 2-пентенил, 3-пентил, 4- пентенил, 4-пентинил, 5-гексенил, 5-гексинил.
Конкретные значения фенила, замещенного 0-4 заместителями, могут включать, но не ограничиваются для фенила; 2-, 3- и 4-галогенфенил; 2-, 3- и 4- аминофенил; 2-, 3- и 4-гидроксифенил; 2-, 3- и 4-цианофенил; 2-, 3- и 4-нитрофенил; 2-, 3- и 4-метилфенил; 2-, 3- и 4-этилфенил; 2- , 3- и 4-пропилфенил; 2,3 или 4-изопропилфенил; 2-, 3- и 4- метоксифенил; 2-, 3- и 4-этоксифенил; 2-, 3- и 4-пропоксифенил и 3,5-дигалогенфенил, 3-галоген-4-гидроксифенил и 3,5-дигалоген-4-гидроксифенил и фенил, замещенный по 1, 2 или 3 углеродным атомам радикалом метоксиэтокси, метоксиэтилоксиэтилокси, N, N-диметилэтилокси и N,N-димeтилэтилaминил; 3,4-диметокси; 3,4- дигидрокси; 3,5-дигидрокси; 3,5-диметокси; 3,5-дигидрокси или 2,3,4-SMe или SH и, кроме того, включает группы, выбранные из 4- (SO2CH3) фенила, 2-метил-4-хлорфенила, 2,4-дигалогенфенила, 4-(тетразол) фенила, 3,5-трифторметилфенила, 2,4-диметилфенила, 3-галоген-4-метилфенила, 4-трифторметилфенила, 3,4-диметилфенила, 2-метил-4-метокси-фенила, 2-метокси-4-галогенфенила, 2-метил-4-гидроксифенила, 2,3-диметилфенила, 2,4-диметоксифенила, 2,5-диметоксифенила, 2,5-диметилфенила, 4-(бензилокси) фенила, 4-(этокси) фенила, 2,5-дигидроксифенила, 4-винилфенила, 2,5-дигалогенфенила, 2-метил-4-фторфенила или 2,3 или 4 (CONR'R'') фенила.
Конкретные значения фенил (1-4C)алкила, замещенного 0-4 заместителями, могут включать бензил, фенилэтил, фенилпропил, фенилбутил; 2-, 3-, 4- и 5-галогенбензил; 2-, 3- и 4-CF3- бензил, 2-, 3- и 4-аминобензил; 2-, 3-, 4-цианобензил, 2-, 3- и 4- нитробензил, 2-, 3- и 4-метилбензил; 2-, 3- и 4-этилбензил, 2-, 3- и 4-пропилбензил; 2-, 3- и 4-гидроксибензил; 2-, 3- и 4- метоксибензил; 2-, 3- и 4-этоксибензил; 2-, 3- и 4-пропокси- бензил, и 3,5-дигалогенбензил, 3-галоген-4-гидроксибензил, 3,5- диCF3бензил и 3,5-дигалоген-4-гидроксибензил или 2,3,4,5,6- пентагалогенбензил; и фенил (1-4 C)алкил, замещенный радикалом метоксиэтилокси, метоксиэтилоксиэтилокси, N, N-димeтилэтилoкcи и N, N-диметилэтиламинил; 3,4-диметокси; 3,4-дигидрокси; 3,5- диметокси; 3,5-дигидрокси или 2,3,4-SMe или 2,3,4-SH. Конкретные значения от 4- до 7-членных колец, содержащих азот, могут включать пиперидино, пирролидинил и азетидинил.
Конкретные значения гетероциклических радикалов с 2 гетероатомами включают пиперазинил, морфолинил, оксазолинил или тиазинил. Конкретные значения гетероциклов или их замещенных производных включают 2-пирролидинон, сукцинимид, оксазолидон, 2,5-оксазолидиндион, 2,4-тиазолидиндион, 2,4-имидазолидиндион и различные бензопроизводные, включающие фталимидо, ангидрид изатовой кислоты, бензо[е][1,3]оксазин-2,4-дион, 3,4-пиридин-дикарбоксимид или сульфимид ортобензойной кислоты.
Более частные значения галогена включают хлор и бром.
Более частные значения (1-3C)перфторалкила включают трифторметил и пентафторэтил.
Более частные значения от 4- до 7-членных колец, содержащих азот, включают пиперидино, пиперазинил и пирролидинил.
Более частные значения (1-3C)алкила, замещенного трифторметильной группой, включают трифторметил и 2-трифтор- метилэтил.
Более частные значения гетероарила включают тетразол, фуран, тиофен, диазол, имидазол, триазол, пиридин, пиримидин, пиридазин или пиразин.
Более частные значения m = 0-2.
Более частные значения n = 0-2.
Более частные значения фенила, замещенного 0-3 заместителями, могут включать фенил; 2- и 4-галогенфенил; 2- и 4-аминофенил; 2-, 3- и 4-гидроксифенил; 2-, 3- и 4-метокси-фенил; 2,4-дигалогенфенил; 3,5-дигалогенфенил; 2,6-дигалоген-4-гидроксифенил, 2 -галоген- 4 -метилфенил; 2-метокси-4-метилфенил; 2-метил-4-метоксифенил; 3-гидрокси-4-метилфенил; 2-гидрокси-4-метилфенил; 2-метил-4-метоксифенил, 2,4-диметилфенил, 3,4-диметоксифенил; 2-метил-4-метоксифенил, 3,4-дигидроксифенил или 2,4-диметилфенил; и включают значения радикалов, особо подтвержденные в примерах.
Более частные значения фенил (1-4C)алкила, замещенного 0-3 заместителями, могут включать бензил, фенилэтил, 2- и 4-гало-генбензил; 2- и 4-цианобензил, 2- и 4- нитробензил, 2- и 4-метоксибензил; 2,4-дигалогенбензил, 3,5-дигалогенбензил и 2,6-дигалоген-4-гидроксибензил. Соответствующие фенетиловые изомеры также могут быть включены.
Предпочтительные значения R1 включают гидроксиэтил, ацетоксиэтил, фталимидоэтил, бромэтил (как промежуточный продукт при получении глицин рецепторных антагонистов), фенил, SO2Мефенил, метоксифенил, гидроксифенил, бензил, (фенилпиперазино) этил, фенетил, хлорфенил, метилфенил или (C1-C4алкил) фенил.
Более частные значения R1 включают 2- гидрокси-этил, 2-ацетоксиэтил, 2-фталимидоэтил, фенил, 4-метокси- фенил, 4-гидроксифенил, бензил, 2-(4-фенилпиперазино) этил, 2- фенетил, 4-хлорфенил, 4-метилфенил или 4-изопропилфенил.
Конечно, предпочтительные значения для Z, кольца A, R1 и R2 и других, указанных в формулах I, I', II, III и т.д. включают значения или группы, которые, в частности, представлены в примерах и/или на схемах.
Наиболее предпочтительные значения Z включают O или OH.
Предпочтительные значения R4 включают водород, фтор, хлор, бром, иод, амино, метил, этил, пропил, аллил, пропаргил, трифторметил, пентафторэтил, трифторметилэтил, нитро, метокси, этокси, пропокси и циано.
Более предпочтительные значения R4 включают водород, фтор, хлор, бром, иод, метил, этил, трифторметил, нитро, метокси, амино и циано.
Предпочтительные соединения, имеющие формулу I (или II) включают:
(а) 7-Хлор-1-гидрокси-2-(2-гидроксиэтил)-3,4,5,10-тетрагидропиридазино[4,5-b]хинолин-4,10-дион;
(b) 2-(2-Ацетоксиэтил)-7-хлор-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
(с) 7-Хлор-4-гидрокси-2- (2-фталимидоэтил) -1,2,5,10- тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
(d) (7-Хлор-4-гидрокси-2-фенил-1,2,5,10-тетрагидропиридазино [4,5-b]хинолин-1,10-дион;
(е) 7-Xлop-4-гидpoкcи-2-(4-метоксифенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
(f) 7-Хлор-4-гидрокси-2-(4-гидроксифенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
(g) 4-Гидрокси-8-нитро-2-(фенил)-1,2,5,10-тетрагидропиридазино[4,5-b] хинолин-1,10-дион;
(h) 2-Бензил-7-хлор-4-гидрокси-1,2,5,10-тетрагидропиридазино [4,5-b]хинолин-1,10-дион;
(i) 7-Хлор-4-гидрокси-2-[2-(4-фенилпиперазино)этил] -1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
(j) (7-Хлор-4-гидрокси-2-(2-фенетил)-1,2,5,10- тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
(k) 7-Хлор-4-гидрокси-2-(4-хлорфенил)-1,2,5,10-тетрагидропиридазино [4,5-b]хинолин-1,10-дион;
(e) 7-Хлор-4-гидрокси-2-(4-метилфенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
(m) 7-Хлор-4-гидрокси-2-(4-изопропилфенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
(n) 7,9-Дихлор-1-гидрокси-2-фенил-1,2,5,10-тетрагидропиридазино[4,5-b] хинолин-1,10-дион;
(о) 7-Хлор-4-гидрокси-2-(1-нафтиламино)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
(p) 7-Хлор-2-(4-фторфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
(q) 2-(4-Бромфенил)-7-хлор-4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
(r) 7-Хлор-4-гидрокси-2-(2-метоксифенил)-1,2,5,10- тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
(s) 7-Хлор-4-гидрокси-2-(2-гидроксифенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
(t) 7-Хлор-4-гидрокси-2-(3-гидроксифенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
(u) 7-Хлор-4-гидрокси-2-(3-метоксифенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
(v) 7-Хлор-4-гидрокси-2-(4-трифторметоксифенил)-1,2,5,10- тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
(w) 7-Хлор-2-(3-хлор-4-метоксифенил)-4-гидрокси-1,2,5,10- тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
(x) 7-Хлор-2-(2-метоксипирид-5-ил)-4-гидрокси-1,2,5,10- тетрагидропиридазино[4,5-b] хинолин-1,10-дион, и кроме того, включают специфические и более предпочтительные соединения, выбранные из:
(1) 7-Хлор-4-гидрокси-2-(4-метокси-2-метилфенил)-1,2,5,10- тетрагидропиридазино[4,5-b]хинолин-1,10-дион или его N-метил- глюкаминовая соль;
(2) 7-Хлор-2-(4-хлор-2-метилфенил)-4-гидрокси-1,2,5,10- тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
(3) 7-Хлор-2-(2,4-диметилфенил)-4-гидрокси-1,2,5,10- тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
(4) 7-Хлор-2-(3,4-дигидроксифенил)-4-гидрокси-1,2,5,10- тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
(5) 7-Хлор-2-(3,4-диметоксифенил)-4-гидрокси-1,2,5,10- тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
(6) 7-Хлор-4-гидрокси-2-(2-метилтиоэтил)-1,2,5,10- тетрагидропиридазино[4,5-b]хинолин-1,10-дион;
(7) 7,9-Дихлор-2-(2,4-диметилфенил)-4-гидрокси-1,2,5,10- тетрагидропиридазино[4,5-b]хинолин-1,10-дион, а также включают соединения
(8) 7-Хлор-4-гидрокси-2-(2-метил-2-гидроксипропионамидоэтил)- 1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион или
(9) 7-Хлор-4-гидрокси-2-(фуран-2-илметил)-1,2,5,10- тетрагидропиридазино[4,5-b]хинолин-1,10-дион или их фармацевтически приемлемые соли. Предпочтительным является внутривенный путь введения.
Пиридазиндионы формулы I или I' (или II, или III) могут быть получены способами, включающими способы, известные в химической технике для получения структурно аналогичных соединений. Cоединения, в которых Z обозначает H, могут быть получены путем хлорирования гидрокси группы диалкил-4-OH-хинолин-2,3-дикарбоксилата (исходное вещество) с использованием оксихлорида фосфора. Этот хлорированный продукт затем восстанавливают, используя тетракистрифенилфосфин Pd(O) и формиат натрия для получения диметилхинолин-2,3-дикарбоксилата, который затем подвергают оставшимся химическим стадиям (например, добавляя гидразин и т.д.). Способы получения пиридазиндиона формулы I, как указано выше, приведены в качестве дополнительных признаков изобретения и иллюстрируются следующими далее методиками, в которых значения основных радикалов соответствуют приведенным выше, если не оговорено иного.
(а) для получения соединения формулы I, путем обработки соответствующего сложного диэфира формулы IV (где R13 обозначает (C1-C3)алкил), арил или гетероарилзамещенным гидразином, где арил выбран из фенила или его бензопроизводного (например, нафтил), либо незамещенного, либо замещенного 1, 2 или 3 группами, выбранными из -O-(1-4C)алкила, - OH, галогена, -NO2, -CN, -CF3, -NH(CO)R', -(1-4C)алкила, -NR'R'', -CO2R', -CONR'R'', -S(O)mR', -SO2NR'R'', -(C1-C6)алкилокси(C1- C6)алкилокси-, гидрокси (C1-C6) алкилокси-, (C1-C6) алкилокси (C1- C6) алкилокси (C1-C6)алкилокси-, гидрокси (C1-C6) алкилокси (C1- C6) алкилокси-, O (C1-C6алкил) NR'R'', -NR' (C1-C6алкил) NR'R'', - (C1-C6алкил) NR'R'', OCF3, -NR' (C1-C6алкил), -NR'(C1-C6алкилгидрокси); и гетероарил выбран из незамещенных или замещенных ароматических радикалов и их бензопроизводных, включающих пиридил, тиенил, фуранил или из групп, содержащих два гетероатома, выбранных из N, O или S, таких как пиразол, имидазол, изоксазол, оксазол, тиазол, изотиазол или из групп, содержащих три гетероатома, выбранных из N, O или S, таких как триазол, оксадиазол, где N на гетероарильной группе необязательно замещен радикалом R, и замещенные ароматические заместители включают обычные ароматические заместители, выбранные из гидрокси, алкокси, галогена или циано, и гетероарильная группа присоединена к -(CH2)n посредством атома углерода на гетероарильной группе; что дает соединение формулы V (пирроло[3,4-b] хинолин) при кипячении вышеуказанных реагентов в (1) этаноле или другом подходящем растворителе в течение 12 ч с последующим нагреванием до температуры кипения в уксусной кислоте (АсOH). Соединение формулы V обрабатывают затем метансульфононовой кислотой (MeSO3H) в кипящем метаноле или другом подходящем растворителе в течение восемнадцати часов с образованием соединения формулы I, где R1 или R2 обозначает арил, как это указано выше (Схема 1);
(b) для получения соединения формулы I, путем обработки соответствующего сложного диэфира формулы IV (где R13 обозначает (C1-C3)алкил), (C1-C6)алкиларил или (C1-C6)алкилгетеро- арилзамещенным гидразином, где арил или гетероарил - такие, как определено выше в (а), в (1) этаноле при кипячении и (2) в уксусной кислоте при кипячении с образованием соединения формулы I, где R1 и R2 выбраны из (C1-C6)алкиларила, где арил и гетероарил имеют вышеуказанные значения. Изомеры положения, полученные по данному способу, легко могут быть разделены фракционированным подкислением растворов меглумин/холина (Схема 2);
(с) для получения соединения формулы I путем обработки соединения формулы IV (где R13 обозначает (C1-C3)алкил), (C1-C6)алкилзамещенным гидразином, в котором алкильная группа дополнительно замещена заместителями, выбранными из OH, OR', SR' или NR'R'' в этаноле, при температуре кипения с последующей обработкой кипящей уксусной кислотой с образованием соединения формулы VI или VI', где R1 и R2 обозначают замещенные алкильные радикалы, как указано выше. Полученные соединения (где Y обозначает OH, SH или NHR) могут затем быть преобразованы с образованием соединений, где W представляет - NR'COR'', OCONR', NR'CO2R'', NRCONR'R'', CO2R' или CONRR', или как указано здесь далее (Схема 3). Изомерную смесь обрабатывают водным меглумином или водной смесью меглумин/холина с образованием раствора, который далее подкисляют уксусной кислотой до pH 6-7. Твердый осадок затем отфильтровывают для отделения изомера по 3-положению, а фильтрат затем дополнительно обрабатывают уксусной кислотой до pH около 5,5 с получением твердого продукта, который является изомером по 2-положению (VI').
(d) для получения соединения формулы I, как указано выше в (с), где замещенная алкильная группа содержит гетероциклические радикалы, путем (1) обработки соответствующего соединения формулы VI или VI' (где W обозначает (-OH)), галогенводородной кислотой (HBr) с образованием соответствующих галогенированных продуктов и (2) обработки этого соединения нуклеофильными реагентами с получением соединения формулы I, где R1 и R2 обозначают -(CH2)nгетероцикл, где гетероцикл включает пяти- и/или шести и/или семичленный гетероцикл, содержащий 1, 2 или 3 гетероатома, выбранных из O, N или S, где N гетероцикла необязательно замещен радикалом R', и атом углерода или азота гетероцикла может быть замещен радикалом R или R', или с получением соединения формулы I с R', равным -(CH2)nNu, где Nu также равен ArNH-, R'NH-, ArO-, ArS- или другому обычному нуклеофилу, который может взаимодействовать с алкилбромидом (Схема 4). Описанное здесь галогенированное промежуточное соединение также используют для получения карбоновой кислоты и/или ее сложных производных путем взаимодействия бромпроизводного с цианидом натрия и затем гидролизом или этерификацией полученного цианопроизводного.
(е) для получения соединения формулы I описанным здесь новым способом, выполняемым согласно общей методике, описанной в схеме 5, и конкретно проиллюстрированной в примерах 35-81. 3-Карбоалкокси-4- гидроксихинолин-2-карбоновая кислота (полученная из соответствующего сложного диалкилэфира (IV') взаимодействует с тионилхлоридом с образованием соответствующего 3-карбоалкокси-2- хлорангидрида, который взаимодействует либо с арилгидразином, где арил - такой как определено выше (в соответствующих условиях, как показано в примерах), или с гетероарилгидразином, где гетероарил является таким, как определено выше (при соответствующих условиях, приведенных в примерах). Растворители, используемые для получения гидразида, включают любой безводный органический растворитель, выбранный из, например, ТГФ, толуола, CH2Cl2, CH3Cl, гексана или любого инертного органического растворителя.
Настоящее изобретение относится к новому способу получения 2-замещенных пиридазино-хинолинов формулы I (или II), где R1 обозначает арил или гетероарил, который включает стадии (i) образования промежуточного 3-карбоалкокси-2-хлор-ангидрида из соответствующего сложного диалкилового эфира формулы IV' и (ii) взаимодействие указанного хлорангидрида со стадии (i) либо с арилгидразином, где арил - такой, как определено выше, в условиях, описанных в примерах, либо с гетероарилгидразином, где гетероарил является таким, как определено выше, в условиях, описанных в примерах, с получением соединения формулы II, где R1 обозначает арил или гетероарил. В этом способе получается также некоторое количество 3-изомера. Вышеприведенный новый способ необязательно протекает через новое ключевое промежуточное соединение, выбранное из N-2-арил (или гетероарил) гидразида 3- карбоалкокси-4-гидроксихинолин-2-карбоновой кислоты. Реакция циклизации из ацилгидразида в PQD трициклическую кольцевую структуру оптимально осуществляется в метансульфоновой кислоте и метаноле. Однако могут применяться алкилсульфоновые кислоты низкого молекулярного веса (C1-C4) и спирты низкого молекулярного веса (C2-C6 алкил) с необязательными сорастворителями, выбранными из, но не ограниченными ими, ТГФ или диоксана или эквивалентных растворителей, которые растворяют реагенты. Кроме того, при некоторых обстоятельствах (например, с заместителями, богатыми электронами на ароматическом кольце) альтернативные кислоты, например, разбавл. HCl в H2O, могут также использоваться для достижения циклизации. Кроме того, могут быть также использованы другие органические растворители, такие как диэтиловый эфир, диоксан, CH2Cl2, CH3CN, ДМФ или эквивалентный растворитель для осуществления сочетания или циклизации. Этот промежуточный продукт, преимущественно, используют при получении соединений формулы II, где R1 обозначает арил. Гидразид может, в зависимости от арил или гетероарилзаместителей, переходить непосредственно в 2-замещенный PQD или через промежуточное пятичленное пиррольное производное, которое дает затем как 2-, так и 3- замещенные PQD. Электронодонорные группы на ариловом кольце способствуют селективному образованию 2-замещенного PQD. Стерические эффекты также могут влиять на степень селективности.
(f) для получения соединения формулы I новым описанным здесь способом, выполненным согласно общей методике, описанной в Схеме 6, и конкретно проиллюстрированным в не ограничивающих примерах 42а и 43а и в примерах 82-103 и примерах 138-142. 2- Пирролидонкарбамидхинолин-3-карбоновая кислота, полученная гидролизом соответствующего 3-метилового эфира, который получают взаимодействием соответствующей 3-карбометоксихинолин-2-карбоновой кислоты с дициклогексилкарбодиимидом или другим подходящими диимидным связывающим реагентом, таким как диизопропилкарбодиимид и пирролидин, взаимодействует с N-трет-бутоксикарбонил-N'- 2(CH2)nM (n=0-4) гидразином [(полученным взаимодействием либо (а) трет-бутилкарбазата и желаемого C1-C4алкиларила или замещенного алкиларила или алкоксиалкил производного, где концевой алкильный углерод имеет подходящую уходящую группу, выбранную из галогена (X) или трифлата, в растворителе, таком как ДМФ, CH2Cl2 или CH3CN или их эквивалента, и основания, такого как Net3 или, для n=0 (например, прямое н-арильное замещение), других групп, которые могут легко взаимодействовать с трет-бутилкарбазатом с образованием исходного дизамещенного гидразина трет-бутил-O-(CO) N-N-R1, включающего любой алкиларил, арилоксиалкил, алкилоксиалкил, алкилоксиалкилокси или алкилгетероарил, указанный здесь, где алкильная группа имеет подходящую уходящую группу, либо (b) подходящего арила или замещенного арилгидразина с ди-трет- бутилдикарбонатом в органическом растворителе (например, ТГФ или ему эквивалентный), либо (с) (для n=1-4) подходящего арила или замещенного арилальдегида или замещенного алкилальдегида с трет-бутилкарбазатом в кипящем гексане или эквивалентном органическом растворителе, с образованием соответствующего имина, который затем восстанавливают восстанавливающим агентом (например, BH3 ТГФ или LiAlH4)] с образованием ключевого промежуточного гидразида, который циклизуют в CH3SO3H/ТГФ или эквивалентном растворителе с целью селективного образования 2-замещенного арила или алкиларила PQD или замещенного алкила PQD. Этот способ может быть обычно использован для селективного получения соединения формулы II. Трет-бутилкарбазат коммерчески доступен, a R1-замещенный гидразин трет-бутилкарбоната легко получить.
(g) N-2-арил- и гетероарилзамещенные изомеры могут легко и селективно быть получены, как показано на схеме 7, путем обработки арил- или гетероарилгидразина бензальдегидом с последующим восстановлением гидразидимина с образованием N-арил-N-бензилзамещенного гидразина. Это соединение подвергают затем взаимодействию с 3-карбокси-эфир- 2-хлорангидрид хинолином с образованием ключевого гидразидного промежуточного продукта, например, N-2-арил(или гетероарил)-N-1- бензил-гидразид 3-карбоалкокси-4-гидроксихинолин-2-карбоновой кислоты, который обрабатывают последовательно холингидроксидом при нагревании (80-180oC) и метансульфокислотой или эквивалентной кислотой в присутствии или отсутствии растворителя для селективного образования N-2-арил PQD.
Следует отметить, что обычно, когда используют несимметричные гидразины, например, где R1 и R2 являются различными группами, или когда используют монозамещенный гидразин, должна получаться смесь продуктов (2-замещенные и 3-замещенные, если не применять описанный здесь новый способ. Такие смеси разделяют стандартными (например, хроматографией и перекристаллизацией) методиками, известными в данной области и используемыми для этих целей. Соединение формулы I, где L обозначает гетероциклический радикал, такой как 4-(C1-C6) замещенный пиперазин или 4-арилзамещенный пиперазин или фталимидо или другой коммерчески доступный нуклеофильный гетероцикл, может быть получено взаимодействием гетероциклических нуклеофильных соединений с 2- или 3-галоген(C1-C6алкил)пиридазино[4,5- b]хинолинами формулы I, последний из которых получают из соответствующих гидрокси соединений, как описано выше в (d). Как будет показано в приведенных далее примерах, соединения в рамках данного изобретения получают применением разнообразных химических синтетических стадий или методик. Ключевые промежуточные продукты показаны на схемах или описаны в тексте. Примеры 1-34 исходят, обычно, из соединений формулы IV' и дают, не селективным способом, через промежуточный продукт V'' (за исключением примеров, где замещение или взаимодействие с N-2-гидроксиалкил производным) желаемые или предпочтительные N-2-арил- или замещенный арилпроизводные (например, R1-арил или замещенный арил, и n=0). Этим способом получают также N-2-бензил- или фенетилпроизводные и их замещенные варианты. Изомеры, полученные этим способом, легко разделимы. Другие ключевые промежуточные соединения в начальных примерах включают N-2-гидроксиалкил PQD, который затем взаимодействует с (низший алкил)-(C1-4)-кислотами с образованием соответствующего сложного эфира. Углеродная цепь, связанная с N-2-азотом, может содержать 1-6 углеродных атомов с гидрокси группой на конце. N-2 арил производные получают также в примерах 35 и т.д., где ключевым промежуточным соединением является хинолин-2-хлорангидрид, который взаимодействует с арил гидразином, образуя, в некоторых случаях селективно, N-2-арил PQD. Конечно, N-метил-глюкамин или другие соли (например, холина, натрия и т.д.) легко получить из соответствующего предшественника. Промежуточным продуктом, получаемым из хлорангидрида, является N-2 арил (или замещенный арил) гидразид 3-карбоалкокси-4- гидроксихинолин-2-карбоновой кислоты, который при благоприятных условиях образует N-2-арилзамещенный PQD. Усовершенствованная методика, использующая 1 экв. исходного арилгидразина, описана в примерах. Обычно используют для циклизации промежуточного гидразида метансульфокислоту в метаноле или ТГФ. Конечно, любые метоксифенилпроизводные могут быть гидролизованы HBr или другой кислотой (например, CH3SO3H), образуя соответствующие гидроксипроизводные.
N-2-гидроксиалкил PQD производные используются для получения соответствующих N-2-галогеналкил PQD производных, которые используются в качестве промежуточных соединений для получения, например, N-2-алкил(C1-C4)тиоалкил(C1-C4) глицин рецепторных антагонистов. Соответствующий тиолят анион повергают взаимодействию в ДМФ с N-2-галогеналкил PQD. Конечно, амины, анилины или другие гетероциклические или гетероарильные нуклеофилы могут взаимодействовать с N-2-алкил-(C1-C4) галоген PQD, образуя соответствующий нуклеофильный замещенный PQD. В этом способе используют ДМФ или эквивалентный органический растворитель.
Приведенный в качестве примера, но не ограничивающий, ключевой способ селективного получения N-2-арила, гетероарила, замещенного алкила или других производных, полученных из любых N- 2-промежуточных соединений, включает получение сначала 2- пирролидинамидозамещенного хинолина, который образуется из соответствующего 2-карбокси-3-карбоалкоксихинолина. Это соединение или аналогичные соединения (например, с группами, эквивалентными пирролидинамидо) гидролизуют до образования соответствующего 2- пирролидинамидо-3-карбоксихинолина, который затем подвергают сочетанию с выбранным R1-N-N-C(O)O-трет-бутил гидразином, используя выбранный диимид (например, ДСС или эквивалентный), с получением ключевого гидразидного промежуточного соединения, например, 2-пирролидинамидо-3-карбоновой кислоты-NR'- N(ВОС)гидразида, который, в условиях циклизации, образует N-2 замещенный PQD без образования в каких-либо количествах N-3 замещенного PQD. Используемые в этом способе гидразины легко получают из коммерчески доступных продуктов, как описано здесь, где либо трет-бутилкарбазат, либо ди-трет-бутилдикарбонат используются для ВОС при одном из N гидразина, в зависимости от того, является ли R' арилом, или алкиларилом, или замещенным алкилом, или гетероарилом, или алкилгетероарилом. Например, бензил или замещенные бензилпроизводные, описанные здесь, легко и удобно получены из соответствующей 2-пирролидинамидо-3-карбоновой кислоты и N-бензил-N1-трет-бутилкарбоксигидразина, который в настоящее время получают из соответствующего арилалкилгалогенида и трет- бутилкарбазата. Трет-бутилкарбазат легко вступает в обменную реакцию с галогеном или спиртом, таким как трифлат, образуя желаемый гидразин.
Другой промежуточный и глицин рецепторный антагонист включает N-2-арил PQD, замещенный циано заместителем или заместителями. Эта группа (CN) может быть затем преобразована с получением карбоновых кислот, карбонилгалогенидов, сложных эфиров, амидов или тетразолов. Как указано ранее, для получения различных гетероциклических соединений или их бензо- или гетероарилбензопрозводных, являющихся глицин рецепторными антагонистами, используют анионное замещение (нуклеофильное замещение). N-2 галоген(C1-4)алкил PQD взаимодействует с выбранным нуклеофилом (гетероциклический или гетероарильный, где гетероарил включает, например, соединения, показанные в примерах и описанные здесь) с образованием соответствующего N-2-нуклеофил-(C1-4)алкил PQD.
Некоторые N-2-гетероциклические PQD могут быть затем гидролизованы с образованием амидоспиртов, входящих в объем настоящего изобретения. Например, оксизолидиндионы легко гидролизуются до соответствующих амидоспиртов, как показано в примере 112 и таблице 5. На страницах с формулами показаны некоторые из ключевых перечисленных здесь промежуточных соединений. Основные промежуточные соединения включают соединения формул XIV-XX.
Настоящее изобретение относится к способу получения соединения формулы II, включающему:
(а) обработку соединения формулы V или XIV кислотой, выбранной из низших алкил(C1-C4)сульфоновой кислоты, в подходящем органическом растворителе, или
(b) обработку соединения формулы IV' алкиларил- или алкилгетероарилгидразином в среде полярного растворителя и слабой кислоты; или
(с) обработку соединения формулы IV', где Y выбран из -OH, -SH или NHR, где R обозначает (C1-C4)алкил, реагентом, выбранным из (i)R2NC(O)Cl; или (ii) RC(O)X или (iii) ROC(O)Cl; или (iv) HBr/NaCN/H2O или ROH; или (v) RNCO, или R'R'NC(O)Cl, или из другой электрофильной группы, перечисленной здесь, с образованием, в частности, соединения формулы XXI; или
(d) обработку соединения формулы XV, где X обозначает галоген, нуклеофильным реагентом, выбранным из гетероцикла или его бензо-, или гетероарилбензопроизводных; или
(е) обработку соединения формулы XXII замещенным гидразином с образованием соединения формулы XVII в органическом растворителе в подходящих условиях; или
(f) обработку соединения формулы XVIII связывающим реагентом, выбранным из диимида и дизамещенным гидразином формулы R'- NHNHC(O)O-трет-бутил в органическом растворителе в присутствии соответствующей кислоты, или
(g) последующую обработку соединения формулы II, как указано в п.2, где соединение содержит фенильное кольцо замещенное метоксигруппой или группами, кислотой с получением фенильного заместителя или заместителей, или дальнейшую обработку соединения формулы II, где соединение не находится в форме соли, фармацевтически приемлемым основанием с получением фармацевтически приемлемой соли, или дальнейшую обработку соединения формулы II, где соединение содержит фенильное кольцо замещенное цианогруппой или группами, (i) основанием с получением карбокислотного заместителя или заместителей, или (ii) кислотой с получением амидного заместителя, или (iii) азидом с получением тетразольного заместителя, где карбокислотный заместитель может быть затем обработан галогенирующим агентом и замещенным амином формулы HNR'R'' с получением замещенного амидного заместителя, или карбокислотный радикал может быть далее обработан спиртом (C1-C6) в присутствии кислоты с получением сложноэфирного заместителя (C1-C6), или
(h) последующую обработку соединения формулы II, где соединение содержит оксозолидиндион, основанием в водном растворе с получением амидоспиртового заместителя качестве W, концевого для (CH2)n углеродной цепи при n = 1-4; или
(i) последующую обработку соединения формулы II, где соединение содержит сульфидную группу, окислительным агентом в подходящих условиях для образования S(O)1 или S(O)2 группы.
Если они не доступны коммерчески, необходимые исходные продукты для описанных выше превращений могут быть получены способами, которые выбраны из стандартных органических химических методик, способов, аналогичных синтезам известных, структурно подобных соединений, или способов, аналогичных описанным выше, или способов, описанных в примерах.
Некоторые сложные диэфиры формулы IV для использования в реакциях с замещенным гидразином с целью получения соединения формулы I, могут быть получены обработкой соединений формулы VII подходящим основанием, таким как алкоголят щелочного металла (например, трет-бутоксид калия) в подходящем растворителе, таком как трет-бутанол, для осуществления замыкания цикла и, тем самым, получения желаемого сложного диэфира. В указанном соединении формулы VII, значение Y соответствует следующим, с получением соответствующего значения для Z, как указано:
а. CHO, если желаемое значение Z - водород;
b. COOR15 где R15 обозначает (C1-C3)алкил, если желаемое значение Z - гидрокси (таутомерно эквивалентный оксо); Указывается, что могут использоваться алкилсложные эфиры, но они не дают какого-либо синтетического преимущества).
с. CSOR15 или CSSR15, если для Z желательно значение тиогидрокси (SH); и
d. CN, если желаемое значение Z - амино.
Не требуется выделение соединения формулы VII для получения соответствующего соединения формулы IV'. Лучше получить сложный диэфир формулы IV' в одном реакторе, без выделения соединения формулы VII из реакционной смеси.
Сложный диэтиловый эфир формулы IV', где Z обозначает гидрокси (или оксо), может быть также получен обработкой ангидрида N-карбоксиантраниловой кислоты формулы Х непосредственно натриевой или калиевой солью (C1-C3)алкилового (например, диэтилового) эфира 2-оксоянтарной кислоты в подходящем растворителе, таком как диметилформамид.
Сложный диэфир формулы IV', где Z обозначает тиогидрокси может быть получен обработкой соответствующего сложного диэфира формулы IV, где R3 обозначает гидрокси, реактивом Лавессона (Lawesson's), 2,4-бис(4-метоксифенил)-1,3-дитиа-2,4-дифосфетан- 2,4-дисульфидом в подходящем растворителе, таком как толуол или диметоксиэтан при 50-110oC.
Замещенный имид формулы V, где В-кольцевой N теряет H, и Z обозначает, например, NH2, может быть получен обработкой сложного диэфира формулы IV', где значению Z соответствует галоген группа, такая как хлор или бром, аммиаком с образованием фталимида, который взаимодействует затем с арилгидразином, образуя V', который затем реагирует обычным образом (Схема 1), образуя конечный пиридазинохинолин.
Соединение формулы VII, где Y обозначает CN, CHO, COOR15, CSOR15 или CSSR15, где R15 обозначает C1-C10 алкил, алкенил или алкинил группу, может быть получено обработкой соответствующего VIII диалкилацетилендикарбоксилатом, таким как диметил- ацетилендикарбоксилат, в подходящем растворителе, таком как (C1-C4) спирт. В качестве растворителя предпочтителен трет-бутанол.
Орто-амин формулы VIII' может быть получен этерификацией соответствующей кислоты формулы VIII' обычными способами. В свою очередь, кислота формулы VIII' может быть получена снятием защиты у соответствующего производного формулы VIII'', где аминогруппа была защищена обычной защитной группой Pr (такой как трет- бутоксикарбонил, t-BOC). Соединение формулы VIII'', в свою очередь, может быть получено последовательным взаимодействием амина формулы IX сначала с двумя эквивалентами литийорганического соединения (например, трет-бутиллития) с образованием дилитиевого производного, которое может быть карбоксилировано путем взаимодействия с двуокисью углерода. Амин формулы IX может быть получен защитой соответствующего (незащищенного) амина обычными способами.
Орто-амин формулы VIII, где Y обозначает COOR15, также может быть получен способом, который отличается от только что описанного выше, тем, что стадию этерификации осуществляют, используя основание (например, гидрида натрия) и затем алкилирующий агент R15X с защищенной кислотой формулы VIII'', а не кислотой формулы VIII'.
Орто-амин формулы VIII', где Y обозначает COOR15, также может быть получен соответствующего ангидрида N-карбоксиантраниловой кислоты формулы Х основанием (таким как гидрооксись щелочного металла) в спиртовом растворителе формулы R15OH.
Ангидрид N-карбоксиантраниловой кислоты формулы Х может быть получен обработкой изатина формулы XI триоксидом хрома в присутствии уксусного ангидрида, или надоксикарбоновой кислотой, такой как магниевая соль мононадоксифталиевой кислоты, и в подходящем растворителе, таком как уксусная кислота.
Изатин формулы XI может быть получен циклизацией гидроксииминацетамида формулы XII в концентрированной серной кислоте при 60-80oC.
Гидроксииминоацетамид формулы XII может быть получен обработкой амина формулы XIII с хлоральгидратом в присутствии сульфата натрия и гидрохлорида гидроксиламина и в подходящем растворителе, таком как вода. N-трет-бутоксикарбонилгидразины, используемые по настоящему изобретению, могут быть получены согласно способу, приведенному далее в примере 82C. Например, N-трет-бутоксикарбонил-N'-пентафторбензилгидразин; N-трет- бутоксикарбонил-N'-2-цианобензилгидразин; N-трет-бутоксикарбнил-N'-3-хлорбензилгидразин; N-трет-бутоксикарбонил-N'-3, 5- дитри-фторметилбензилгидразин; N-трет-бутоксикарбонил-N'-3- фенилпропилгидразин; N-трет-бутоксикарбонил-N'-4-метилбензил-гидразин; N-трет-бутоксикарбонил-N'-4-трифторметилбензил- гидразин; N-трет-бутоксикарбонил-N'-4-цианобензилгидразин и N- трет-бутоксикарбонил-N'-2,4-диметилфенилгидразин. Кроме того, настоящее изобретение относится также к этим новым гидразинпроизводным и к способу их получения и применения в качестве промежуточных продуктов для соединения с ключевой промежуточной 2-пирролидинокарбамидхинолин-3-карбоновой кислотой с целью образования соединения формулы II с помощью нового и оригинального способа, как описано здесь, в результате которого селективно образуется N-2-замещенный PQD. Промежуточные гидразины, используемые для получения N-2-арил или N-2-замещенных арил PQD, могут также быть получены согласно не ограничивающему примеру 42а. N'-трет-бутоксикарбонил-N'-арил или замещенные арилпроизводные получают с помощью этого нового способа, дающего возможность селективного получения N-2-замещенных PQD. Этот способ может быть предпочтительным для арилзамещенных производных, перечисленных здесь и в формуле изобретения.
Следует отметить, что многие из исходных веществ для описанных выше способов синтеза являются коммерчески доступными и/или широко известны в научной литературе.
Примерами подходящих фармацевтически приемлемых солей служат соли, образованные основаниями, которые дают физиологически приемлемый катион, такой как щелочной металл (особенно литий, натрий и калий), щелочноземельный металл (особенно кальций и магний), соли алюминия или аммония, а также соли, полученные с подходящими органическими основаниями, такими как холингидроксид, триэтиламин, морфолин, пиперидин, этилендиамин, лизин, этаноламин, диэтаноламин, триэтаноламин, N-метил-D-глюкамин (меглумин), аргинин и трис(гидрокси- метил)аминометан. Предпочтительны натриевые и калиевые соли холина и меглумина. Натриевые и калиевые соли холина особенно предпочтительны.
При внутривенном терапевтическом применении, после приступа, пиридазиндион формулы I обычно вводят в виде подходящей фармацевтической композиции, которая содержит соединение по изобретению, указанное выше, вместе с фармацевтически приемлемым растворителем или носителем, при этом композицию подбирают с учетом конкретного выбранного пути введения. Такие композиции составляют следующий объект изобретения. Они могут быть получены обычными способами с использованием обычных добавок и связующих веществ и могут быть в виде различных дозированных форм. Например, они могут быть в форме таблеток, капсул, растворов или суспензий для перорального введения; в форме суппозитариев для ректального введения; в форме стерильных растворов или суспензий для введения путем внутривенной или внутримышечной инъекции или вливания; и в форме порошков вместе с фармацевтически приемлемыми инертными твердыми разбавителями, такими как лактоза, для введения путем вдувания.
Доза вводимого соединения согласно изобретению обязательно должна варьироваться в соответствии с правилами хорошо известными в данной области, учитывающими способ введения, степень пост ишемического поражения, вес и возраст пациента. Обычно, соединение согласно изобретению вводится теплокровным животным (таким как человек) в количестве, требуемом для достижения эффективной дозы, обычно дозы в интервале приблизительно 0,01 - 100,0 мг/кг веса тела. Например, если соединение вводится внутривенно, его количество составляет приблизительно 0,5 - 100,0 мг/кг веса тела.
Специалисту в данной области техники понятно, что соединение согласно изобретению может вводиться совместно с другими терапевтическими или профилактическими средствами и/или медикаментами, которые не являются с ними медицински несовместимыми.
Действие соединений согласно изобретению как антагонистов к глицин рецептору NMDA рецепторного комплекса могут быть продемонстрированы одним или более стандартными исследованиями, такими как исследование на связывание [3H] -глицина (испытание А) и исследованиями in vivo, такими как ишемия, индуцируемая каротидной окклюзией на модели песчанки (испытание В). В дополнение к этим испытаниям, соединения данного изобретения проверяют испытанием на красных ядрах клеток (испытание C) и испытанием на средней церебральной артерии крыс (испытание D). Эти испытания подтверждают, что соединения по изобретению являются NMDA рецепторными антагонистами in vitro и in vivo. Некоторые соединения по изобретению являются сильно действующими NMDA рецепторными антагонистами. Некоторые из перечисленных соединений (то есть, 3-(2-ацетоксиэтил), 3-(п- метоксифенил) или 3-(п-гидроксифенил)-7-хлор-4-гидрокси-1,2,5,10- тетрагидропиридазино[4,5-b] хинолин-1,10-дионы) имеют значение IC50 в [3H]Gly испытании выше 100 мк/моль и, таким образом, менее активны, чем их более сильно действующие аналоги. В частности, соединения по настоящему изобретению с R1, обозначающим алкил, арил или гетероцикл, как определено здесь, и R2, равным H, являются сильно действующими рецепторными (глицин) антагонистами.
Испытание А
В исследовании на связывание [3H]- глицина нейрональные синаптические мембраны получают из взрослых (около 250 г) самцов крыс Sprague Dawley. Свежеиссеченные образцы коры головного мозга и гипокампа гомогенизируются в 0,32 М сукрозы (110 мг/мл). Синаптосомы выделяют центрифугированием (1000 об/мин, 10 мин), супернатант осаждают (20000 об/мин, 20 мин) и вновь суспендируют в дважды дистиллированной воде. Суспензию центрифугируют 20 мин при 8000 об/мин. Полученный супернатант и лейкоцитную пленку дважды промывают (48000 об/мин, 10 мин вновь суспендируют в дважды деионизованной воде). Полученный осадок быстро замораживают (баня из сухого льда/этанола) под слоем дважды деионизованной воды и хранят при -70oC.
В день эксперимента оттаянные синаптические мембраны гомогенизирзуют в тканевом гомогенизаторе Brinkmann Polytron (tm. Brinkmann Instruments, Westbury, N. Y. ) в 50 ммоль трис(гидроксиметил)аминометанцитрате, pH 7,1. Мембраны инкубируют с 0,04% Sufact-AMPS Х100 (tm. Pierce, Rockford, IL) в буфере в течение 20 мин при 37oC и промывают шесть раз путем центрифугирования (48000 об/мин, 10 мин) и вновь суспендируют в буфере. Конечный осадок гомогенизируют при 200 мг вес влажного/мл буфера для исследования на связывание.
Для [3H] -глицин связывания N-метил-D-аспартат рецептору, 20 наномоль [3H] -глицина (40-60 Ci/ммоль, New England Naclear, Boston, MA) инкубируют с мембранами, суспендированными в 50 ммоль трис(гидроксиметил)аминометанцитрате, pH 7,1, в течение 30 мин при 4oC. Глицин, 1 ммоль, используют для определения неспецифического связывания. Связанный [3H]- глицин определяют от свободного, используя харвестер клеток Brandel (Biomedical Research and Development Laboratories, Gaithersburg, MD) для вакуумной фильтрации через фильтры из стекловолокна (Whatman GF/B from Brandel, Gaithersburg, MD), предварительно пропитанные 0,025% полиэтиленимином. Образцы, оставшиеся на фильтре из стекловолокна промывают 3 раза в общей сложности 2,5 мл холодного буфера. Радиоактивность измеряют жидкостным сцинтилляционным счетчиком. Значение IC50 получают из регрессии по наименьшим квадратам logit-log (длинные логарифмы) обработки данных. Характерные IC50 значения для соединений по изобретению составляют обычно менее 50 мкмоль и иллюстрируются соединением примера 1 (IC50=40 мкМ), примера 2 (IC50=0,50 мкмоль, примера 10 (IC50=0,12 мкмоль).
Другие приведенные здесь примеры описывают глицин антагонисты.
Испытание В
При испытании in vivo, использующим ишемическую модель песчанки, взрослые особи песчанок Mongolian (50-70 г) анестезируют 2-3% галотаном (halothane). Билатеральные общие каротидные артерии шеи раскрывают и накладывают микроаневрические зажимы. Спустя 10 мин (если иного не указано) зажимы удаляют, восстанавливают кровоток через каротидные артерии и кожу сшивают. Исследуемые соединения вводят внутрибрюшинно как до, так и после окклюзии, например, за 45 минут до и через 5 минут после окклюзии каротидных артерий. Животных, которым симулирована операция, обрабатывают аналогичным способом, за исключением того, что артерии не пережимаются. Наблюдения за общим поведением, связанным с моторной активностью, проводятся в течение 2 часов первого (24 часа) дня после окклюзии. Через 4 дня животных забивают (обезглавливание), извлекают головной мозг, фиксируют, разрезают и окрашивают гематоксилин/эозином и крезилвиолетом.
Секции головного мозга оценивают на нейрональные поражения гиппокампуса, используя следующую оценочную шкалу:
0 = непораженные, нормальные
1 = слабое поражение (до 25%) - ограниченные CAI/подлежащая ткань пределами
2 = умеренные поражения (до 50%) - очевидные поражения, ограниченные менее, чем половиной CAI области
3 = заметные поражения (до 75%) - включающие более чем половину CAI области
4 = поражения, выходящие за CAI область
Срезы (7 мкм) каждого мозга, подвергаются оценке. Может быть отмечено случайное, асимметрическое поражение, и за рейтинговое значение принимается среднее показание двух сторон. Регистрируют среднюю рейтинговую величину поражений мозга, и показатели нарушений для обработанных лекарственными средствами групп сравнивают с группой, обработанной растворителем, используя тест Wilcoxon-Rank Sum.
Обычные значения, полученные в этих испытаниях для соединений согласно изобретению, иллюстрируются следующими результатами: 35% нейрозащита (относительно контроля с имитированной операцией) для соединения примера 4, и свыше 80% нейрозащита для соединения примера 10, когда каждое соединение вводится внутрибрюшинно (ip) при уровне 10 мг/кг веса тела в соответствии с вышеприведенным режимом.
Испытание C
Испытание красных ядер клеток
Цель этого испытания состоит в определении воздействия введенных внутривенно глицин антагонистов на индуцированную возбуждающую реакцию клеток, содержащих красные ядра. HА-966 (рацемическая) и CGP 37849 являются стандартными агентами, проявляющими активность в этом испытании (ID50 7,9 и 1,7 мг/кг, внутрибрюшинно соответственно).
Методика испытания красных ядер клеток приведена далее. Крыс анестезируют хлоральгидратом (400 мг/кг, внутрибрюшинно) и вводят катетер в бедренную вену для внутрибрюшинного введения лекарственного средства. Пятицилиндровые микропипетки размещают стереотаксикально в красных ядрах клеток. Обычно, от трех до четырех из пяти цилиндров заполняются следующим образом: цилиндр для регистрации -2М цитратом калия, цилиндр общепринятого сопоставления 4М NaCl, цилиндр для лекарственных средств - 25 мМ NMDA, а другой цилиндр для лекарственных средств - 2,5 мМ кискалевой (quisqualic) кислоты (QA используют только в исследованиях селективности). NMDA применяют ионофоретически при постоянном токе, который регулируется в зависимости от чувствительности каждой индивидуальной клетки, содержащей красное ядро. NMDA двигается по кругу вперед и назад (обычно 30-60 сек вперед и 60-120 сек назад) и степень возбуждения клетки во время каждого периода регистрируется. Как только нулевая степень возбуждения установлена, начинают внутривенно вводить испытуемое соединение. Воздействие лекарственного средства на NMDA-индуцированную возбуждающую реакцию клетки, содержащей красное ядро, может быть оценено как качественно, так и количественно из регистрируемых и необработанных накопленных данных. Соединения по изобретению проявляют значительную антагонистическую реакцию.
Испытание D
Испытание на средней церебральной артерии крыс.
В этом испытании используют самцов крыс SHR, весящих 280-320 г. Способ использованный для непрерывной окклюзии средней церебральной артерии (МCА) описан Brint и др. (1988). Вкратце: локальную ишемию вызывают путем окклюзии сначала левой общей каротидной артерии и затем левой средней церебральной артерии, расположенной точно над носовым отверстием. После окклюзии, лекарственные средства вводят внутривенно через шейный катетер. Спустя двадцать четыре часа после МCА/общей каротидной артерии окклюзии, животных забивают и быстро извлекают головной мозг. Коронарные срезы ткани 1 мм толщиной делают, используя вибратом, и окрашивают 2,3,5-трифенил-2H-тетразолхлоридным красителем (ТТC). После окрашивания некротическую ткань легко отделяют от интактного мозга и участок инфарктной коры головного мозга исследуют на анализаторе изображения. Размер инфаркта для каждого участка определяют количественно на анализаторе изображения и общий инфарктный объем рассчитывают с помощью программы, суммирующей объем всего интервала. CM. S. Brint et al., J. Cerebral Blood Flow 8: 474-485 (1988). Статистический анализ различия между объемом ишемического поражения в контроле с растворителем и обработанных лекарственными средствами животных выполняется на основе т-теста Стьюдента. Все данные представлены как среднее ±S.E значение для n животных. Соединения по изобретению уменьшают ишемические поражения.
Далее изобретение иллюстрируется следующими не ограничивающими примерами. В примерах, если не оговорено иного:
(i) температура дана в градусах Цельсия (oC); операцию выполняют при комнатной температуре или при температуре окружающей среды, т.е. при температуре в интервале 18-25oC;
(ii) упаривание растворителя выполняют, используя роторный испаритель при пониженном давлении (600-4000 Па: 4,5-30 мм рт. ст.) с температурой бани до 60oC;
(iii) флэш-хроматографию выполняют на Merck Kieselgel (Art 9385) и колоночную хроматографию на Merck Kieselgel 60 (Art 7734); [эти материалы получают от фирмы Е. Merck Darmstacdt, W. Germany]; тонкослойную хроматографию (TCX - TLC) выполняют на Analtech 0,25 мм силикагелевых ВДЖХ пластинах (Art 21521), получаемых от фирмы Analtech Newark, DE, USA;
(iv) обычно, за ходом реакции следят методами TCX и ВДЖХ и реакционное время дается только для иллюстрации;
(v) точки плавления приведены в точке, и (разл.) означает разложение; приведенные точки плавления - это температуры, полученные для продуктов, полученных как описано; полиморфизм может выражаться в выделении веществ с различными температурами плавления при одном и том же способе получения;
(vi) все конечные продукты, в основном, очищены TCX и ВДЖХ и дают удовлетворительный ядерный магниторезонансный спектр (ЯМР) (300 МГц ПМР в D-ДМCO, если не оговорено иного) и микроаналитические данные;
(vii) выходы приведены только для иллюстрации;
(viii) пониженное давление выражено в виде абсолютного давления в паскалях (Pa); другие давления выражены в виде монометрических давлений в барах;
(ix) химические символы имеют их обычные значения; использованы также следующие обозначения: об. (объем), вес (вес), т.пл. (точка плавления), л [литр (ы)], мл (миллилитры), мМ (миллимоли), г [грамм(ы)], мг [миллиграмм(ы)], мин (минуты), ч (часы); и
(х) соотношения растворителей даны в объем: объем (v/v) терминах.
Что касается N-2 арил соединений в рамках данного изобретения, орто-заместители на фенильном кольце оказывают существенное воздействие на растворимость (водную) глицин рецепторных антагонистов. В частности, орто-метилзаместители повышают растворимость и активность in vivo. Кроме того, путь, представленный на Схеме 7 (см. ниже), относится к эффективному способу получения N-2 гетероарилов в рамках настоящего изобретения. Кроме того, заявленное изобретение относится к способу отщепления N-бензильных групп с помощью метансульфокислоты.
В приведенных далее спектрах ЯМР приняты следующие обозначения:
s - синглет,
m - мультиплет
d - дублет,
br - уширенный сигнал,
t - триплет.
dd - двойной дублет
Пример 1. 7-хлор-1-гидрокси-3-(2-гидроксиэтил)- 3,4,5,10-тетрагидро-пиридазино[4,5-b]хинолин-4,10-дион;
К перемешиваемой смеси диметил 7-хлор-1-гидрокси-хинолин-2,3- дикарбоксилата (50,0 г, 0,169 М), в этаноле (750 мл) добавляют 2- гидроксиэтилгидразин (286 т, 3,38 м) 90% чистоты вещество). Полученную темно-коричневую смесь нагревают при температуре кипения с обратным холодильником в течение 18 часов и затем оставляют охлаждаться до комнатной температуры без перемешивания. Смесь фильтруют и собранный твердый продукт промывают один раз этанолом и затем нагревают при температуре кипения в течение с обратным холодильником 3 ч в ледяной уксусной кислоте (1,0 л). Полученной смеси дают охладиться до комнатной температуры и затем фильтруют, отделяя желтый твердый продукт. Этот продукт сушат в течение ночи в вакууме, получая (41,83 г) смеси изомерных 2- и 3-(2-гидроксиэтил) соединений в виде желтого твердого продукта. Эту смесь разделяют на две фракции 20,23 г и 21,6 г. Меньшую фракцию (20,23 г) растворяют при энергичном перемешивании в воде (2700 мл), содержащей N-метилглюкамин (54,0 г). Этот раствор осторожно подкисляют ледяной уксусной кислотой до достижения pH точно 7,0 и образовавшийся во время подкисления осадок отделяют фильтрацией. Собранные твердые продукты промывают один раз водой, сушат и сохраняют. Фильтрат и промывную воду также объединяют и сохраняют. Большую из двух первоначальных фракций аналогичным образом растворяют в воде (2880 мл), содержащей N- метилглюкамин (57,6 г) и аналогично подкисляют ледяной уксусной кислотой до pH 7 получая вторую порцию твердых продуктов. Фильтрат и соответствующую промывную воду, полученные при этом подкислении, также объединяют и сохраняют. Две порции собранных твердых продуктов объединяют и получают указанное в заголовке 3-(2- гидроксиэтил) соединение в виде светло-желтого твердого продукта (19,27 г, 37,0%). Перекристаллизация части этого продукта из уксусной кислоты дает аналитический образец указанного в заголовке соединения в виде светло-желтых кристаллов. Т.пл. 377- 378oC; МC (CI): 308 (М+H).
Анализ для C13H10ClN3O4:
Рассчитано: C, 50.75; H, 3.28; N, 13.66
Найдено: C, 50.65; H, 3.39; N, 13.78
ЯМР: 13.19 (s, 1H, способный к обмену), 12.32 (s, 1H, способный к обмену), 8.22 (d, J=9.0 Гц, 1H), 8.15 (d, J=1.8 Гц, 1H), 7.56 (dd, J=9.0, 1.8 Гц, 1H), 4.83 (br s, 1H, способный к обмену), 4.10 (t, J=5.7 Гц, 2H), 3.75 (t, J=5.7 Гц, 2H).
Исходный диметил 7-хлор-4-гидроксихинолин-2,3-дикарбоксилат получают следующим образом:
а. Диметил 7-хлор-4-гидроксихинолин-2,3-дикарбоксилат.
Перемешиваемую смесь метил 2-амино-4-хлорбензоата (2,50 г, 13,5 мМ) и диметил ацетилендикарбоксилата (2,05 г,14,4 мМ) в трет-бутаноле (22 мл) нагревают при температуре кипения с обратным холодильником в течение 7 ч в атмосфере азота. После добавления дополнительного количества диметил ацетилендикарбоксилата (1,16 г, 8,13 мМ) и дополнительного нагревания при температуре кипения с обратным холодильником в течение 2,5 ч, реакционной смеси дают охладиться до комнатной температуры и добавляют за одну порцию трет-бутилата калия (1,56 г,13,9 мМ). Образовавшийся осадок и полученную смесь нагревают при температуре кипения с обратным холодильником в течение 1,5 ч. Реакционную смесь охлаждают до комнатной температуры и фильтруют для отделения твердых продуктов, которые промывают трет-бутанолом и диэтиловым эфиром. Твердые продукты растворяют в воде и подкисляют 1 н. серной кислотой до образования осадка. Полученную смесь экстрагируют метиленхлоридом и объединенные экстракты промывают раствором соли и воды, сушат (MgSO4), фильтруют и концентрируют, получая зеленый твердый продукт. Перекристаллизация этого твердого вещества из метанола дает диметил 7-хлор-4-гидроксихинолин-2,3-дикарбоксилат (1,15 г, 28,94) в виде не совсем белого твердого продукта, Т. пл. 232-233oC; МC (CI): 296 (М+H).
Анализ для C13H10ClNO5:
Рассчитано: C, 52.81; H, 3.41; N, 4.74
Найдено: C, 52.75; H, 3.47; N, 4.69.
Пример 2. 7-хлор-4-гидрокси-2-(2-гидроксиэтил)-1,2,5,10- тетрагидро-пиридазино[4,5-b]хинолин-1,10-дион.
Все фильтраты и промывные воды, оставшиеся от Примера 1, объединяют и затем подкисляют ледяной уксусной кислотой до pH 5. Образовавшийся осадок собирают, промывают водой и сушат, получая указанное в заголовке соединение в виде бледно-желтого твердого продукта (12,27 г, 23,5%). Перекристаллизация части этого вещества из уксусной кислоты дает аналитический образец указанного соединения в виде не совсем белого кристаллического вещества. Т.пл. 335-336oC; МC (CI): 308 (М+H).
Анализ для C13H10ClN3O4:
Рассчитано: C, 50.75; H, 3.28; N, 13.66
Найдено: C, 50.54; H, 3.39; N, 13.65
ЯМР: 12.53 (br s, 1H, способн. к обмену), 11.87 (br s, 1H, способн. к обмену), 8.17 (d, J=8.7 Гц, 1H), 8.04 (s, 1H), 7.45 (d, J=8.7, Гц, 1H), 4.82 (br s, 1H, способн. к обмену), 3.99 (t, J=6.1 Гц, 2H), 3.70 (t, J=6.1 Гц, 2H).
Пример 3. 2-(2-Ацектоксиэтил)-7-хлор-4-гидрокси-1,2,5,10- тетрагидропиридазино[4,5-b]хинолин-1,10-дион.
Оранжевую суспензию 7-хлор-4-гидрокси-2-(2-гидроксиэтил)-1,2, 5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-диона (0,250 г, 0,81 мМ) в 30% растворе бромистоводородной кислоты в ледяной уксусной кислоте (5 мл) осторожно нагревают при температуре кипения с обратным холодильником в течение 16 ч в атмосфере азота. Смесь охлаждают до комнатной температуры и разбавляют водой (20 мл) до образования осадка. Собранные твердые продукты промывают водой и метанолом и затем сушат, получая указанное в заголовке соединение (0,242 г, 86%) в виде рыжевато-коричневого твердого вещества. Т.пл. 307-309oC; МC (CI): 350 (М+H).
Анализ для C15H12ClN3O5• 0,2CH3CO2H:
Рассчитано: C, 51.10; H, 3.57; N, 11.60
Найдено: C, 50.81; H, 3.45; N, 11.86.
ЯМР: 12.64 (br s, 1H, способн. к обмену), 11.91 (br s, 1H, способн. к обмену), 8.14 (d, J=8.64 Гц, 1H), 8.02 (d, J=1.74 Гц, 1H), 7.43 (dd, J=1.74, 8.64 Гц), 4.32 (t, J=5.54 Гц, 2H), 4.13 (t, J=5.54 Гц), 1.98 (s, 3H).
Пример 4. 7-хлор-4-гидрокси-2-(2-фталимидоэтил)-1,2,5,10- тетрагидропиридазино[4,5-b]хинолин-1,10-дион.
2-(2-Бромэтил)-7-хлор-4-гидрокси-1,2,5,10-тетрагидропиридазино [4,5-b] хинолин-1,10-дион (5,00 г, 13,50 мМ) и фталимид калия (10,50 г, 56,70 мМ) перемешивают и кипятят с обратным холодильником в ДМФ (100 мл) в течение 22 ч. Охлажденную желтую суспензию выливают в разбавленную соляную кислоту (1 н. , 1,0 л) при хорошем перемешивании. Образуется белый осадок, который собирают. Этот твердый продукт ресуспендируют в водном метаноле (50%, 1,0 л) и перемешивают/воздействуют ультразвуком, получая хорошую суспензию. Фильтрация и повторное суспендирование в метаноле (0,25 л) дают свободно текущую белую суспензию после обработки ультразвуком и непродолжительного нагревания при температуре кипения с обратным холодильником. Твердые продукты окончательно собирают и промывают метанолом, получая указанное в заголовке соединение (4,65 г, 79%) в виде белого порошка, Т.пл. 349-352oC; МC (CI): 437 (М+H).
Анализ для C231H13ClN4O5• 0,35H2O•0,1CH3OH:
Рассчитано: C, 56.78; H, 3.18; N, 12.55
Найдено: C, 56.40; H, 2.76; N, 12.59.
ЯМР: 12.54 (br s, 1H, способн. к обмену), 11.88 (br s, 1H, способн. к обмену), 8.11 (d, J=8.67 Гц, 1H), 8.00 (br s, 1H), 7.83 (s, 4H), 7.42 (d, J= 8.67 Гц, 1H), 4.13 (br m, 2H), 3. 93 (br m, 2H).
Исходный 2-(2-бромэтил)-7-хлор-4-гидрокси-1,2,5,10-тетра- гидроксипиридазино[4,5-b]хинолин-1,10-дион готовят как описано ниже:
а. 2-(2-Бромэтил)-7-хлор-4-гидрокси-1,2,5,10-тетрагидропиридазино [4,5-b]хинолин-1,10-дион
7-Хлор-4-гидрокси-2-(2-гидроксиэтил)-1,2,5,10-тетрагидро-пиридазино [4,5-b] хинолин-1,10-дион (8,00 г, 26,00 мМ) перемешивают в смеси: водная бромистоводородная кислота (50%, 80 мл), 30% бромистоводородная кислота в ледяной уксусной кислоте (160 мл) и метансульфокислота (8 мл), получая красный раствор. Этот раствор нагревают при температуре кипения с обратным холодильником в течение 20 ч, за это время образуется осадок. Желтую суспензию охлаждают до комнатной температуры и перемешивают 2 ч. Твердый продукт собирают и промывают смесью ацетонитрил/диэтиловый эфир и диэтиловым эфиром и сушат порошок на воздухе. МC (CI): 370 (М+H).
ЯМР: 13.00 (br s, 1H, способн. к обмену), 8.23-8.18 (m, 2H), 7.60 (dd, J=2.04, 5.73 Гц), 5.20(t, J=9.37Гц, 2H), 4.56(t, J=9.37 Гц 2H).
Пример 5. Холиновая соль 7-Хлор-1-гидрокси-3-фенил-3,4,5,10- тетрагидропиридазино[4,5-b]хинолин-4,10-диона.
6-Хлор-2-анилин-2,3,4,9-тетрагидро-1H-пирроло-[3,4-b] хино-лин- 1,3,9-трион (1,70 г, 5,0 мМ) перемешивают в метаноле (0,85 л) и добавляют метансульфокислоту (85 мл). Желтую суспензию нагревают при температуре кипения с обратным холодильником 16 часов и охлаждают до комнатной температуры. Полученную смесь фильтруют (фильтрат сохраняют для использования в Примере 6) и собранные твердые продукты промывают метанолом и сушат, получая 7-хлор-4-гидрокси-3-фенил-1,2,5,10-тетрагидропиридазино [4,5-b]хинолин-4,10-дион (0,48 г, 28%) в виде желтого порошка. Этот порошок перемешивают в метаноле и добавляют гидроокись холина (45 вес..% в метаноле, 0,5 мл), получая раствор янтарного цвета. Этот раствор концентрируют и остаток разбавляют толуолом и концентрируют. Остаток растворяют в толуоле и концентрируют два дополнительных раза и полученный твердый остаток растирают со смесью этанол/толуол (20%, 25 мл), получая кристаллический твердый продукт. Твердый продукт собирают, получая указанное в заголовке соединение (0,49 г, 78%) в виде желтого порошка, Т.пл. 253-257oC; МC (CI): 340 (М+H).
Анализ для C17H10ClN3О3• C5H14NO•0,30H2O:
Рассчитано: C, 58.90; H, 5.31; N, 12.50
Найдено: C, 58.88; H, 5.18; N, 12.41.
ЯМР: 15.00 (s, 1H, способн. к обмену), 8.22 (d, J=8.79 Гц, 1H), 7.85 (d, J= 2.01 Гц, 1H), 7.61(d, J=7.53 Гц, 2H), 7.45(t, J=7.53 Гц, 2H), 7.38-7.28 (m, 2H), 5.31 (s, 1H, способн. к обмену), 3.83 (brm, 2H), 3.39(brm, 2H), 3.10(s, 9H).
Исходный 6-хлор-2-анилин-2,3,4,9-тетрагидро-1H-пирроло-[3,4-b] хинолин-1,3,9-трион получают следующим способом:
а. 6-хлор-2-анилин-2,3,4,9-тетрагидро-1H-пирроло[3,4-b]хинолин- 1,3,9-трион.
К перемешиваемой суспензии диметил 7-хлор-4-гидрокси-хинолин-2,3-дикарбоксилата (2,50 г, 8,45 мМ) в этаноле (35 мл) добавляют фенилгидразин (5,82 мл, 59,20 мМ), получая коричневый раствор. Этот раствор нагревают при температуре кипения с обратным холодильником в течение 16 ч, за это время образуется осадок. Суспензию фильтруют горячей и собранные твердые продукты промывают этанолом, получая фенилгидразиновую соль указанного в заголовке соединения в виде белого порошка (2,10 г). Этот продукт перемешивают и нагревают при температуре кипения с обратным холодильником в ледяной уксусной кислоте (50 мл) в течение 2 ч. Полученную желтую суспензию охлаждают до комнатной температуры и фильтруют, получая указанное в заголовке соединение (1,70 г, 59%) в виде желтого твердого продукта, Т.пл. 397oC; МC (CI): 340 (М+H).
Анализ для C17H10ClN3О3:
Рассчитано: C, 60.10; H, 2.97; N, 12.40
Найдено: C, 59.96; H, 2.79; N, 12.45.
ЯМР: 13.80 (br s, 1H, способн. к обмену), 8.54(s, 1H, способн. к обмену), 8.23 (d, J=8.70 Гц, 1H), 7.89 (d, J=1.89 Гц, 1H), 7.58(dd, J=1.89, 8.70 Гц, 1H), 7.18(t, J=8.01 Гц, 2H), 6.82(m, 3H).
Пример 6. 7-Хлор-4-гидрокси-2-фенил-1,2,5,10-тетрагидрокси- пиридазино[4,5-b]хинолин-1,10-дион.
Фильтрат, сохраненный из Примера 5, разбавляют водой (0,80 л) и полученную рыжевато-коричневую суспензию перемешивают 1 ч. Твердые продукты собирают и промывают водным метанолом (50%), получая указанное в заголовке соединение (1,20 г, 71%) в виде не совсем белого порошка, Т.пл. 347-349oC; МC (CI): 340 (М+H).
Анализ для C17H10ClN3О3• 0,10H2O:
Рассчитано: C, 59.80; H, 3.01; N, 12.30
Найдено: C, 59.64; H, 2.76; N, 12.27.
ЯМР: 12.8 (br s, 1H, способы, к обмену), 12.1 (br s, 1H, способы, к обмену), 8.16 (d, J=8.67 Гц, 1H), 8.06 (d, J=1.80 Гц, 1H), 7.56-7.33(m, 6H).
Пример 7. 7-Хлор-1-гидрокси-3-(4-метоксифенил)-3,4,5,10- тетрагидропиридазино[4,5-b]хинолин-4,10-дион.
6-Хлор-2-(4-метоксианилин)-2,3,4,9-тетрагидро-1H-пирроло [3,4-b] хинолин-1,3,9-трион (2,72 г, 7,40 мМ) перемешивают в метаноле (200 мл) и добавляют метансульфокислоту (50 мл). Рыжевато-коричневую суспензию нагревают при температуре кипения с обратным холодильником в течение 16 ч, во время чего она становится желтой. Эту желтую суспензию охлаждают до комнатной температуры и фильтруют (фильтрат сохраняют для использования в Примере 8). Собранные твердые продукты промывают метанолом, получая указанное в заголовке соединение в виде желтого порошка (1,19 г, 44%), Т.пл. 371-373oC; МC (CI): 370 (М+H).
Анализ для C18H12ClN3O4:
Рассчитано: C, 58.50; H, 3.27; N, 11.36
Найдено: C, 58.30; H, 3.41; N, 10.92.
ЯМР: 13.33 (br s, 1H, способн. к обмену), 12.47 (s, 1H, способн. к обмену), 8.30 (d, J=8.73 Гц, 1H), 8.23 (br s, 1H), 7.61 (m, 3H), 7.08 (d, J=8.90 Гц, 2H), 3.83(s, 3H).
Исходный 6-Хлор-2-(4-метоксианилин)-2,3,4,9-тетрагидро-1H-пирроло [3,4-b]хинолин-1,3,9-трион получают следующим способом:
a. 6-Хлор-2-(4-метоксианилин)-2,3,4,9-тетрагидро-1H- пирроло-[3,4-b] хинолин-1,3,9-трион.
К перемешиваемой суспензии диметил 7-хлор-4-гидрокси- хинолин-2,3-дикарбоксилата (0,500 г, 1,69 мМ) в этаноле (17 мл) добавляют 4-метоксифенил гидразин гидрохлорид (2,07 г, 11,83 мМ). Добавляют триэтиламин (1,88 мл, 13,52 мМ) и смесь нагревают при температуре кипения с обратным холодильником в течение 40 ч. Полученную суспензию фильтруют горячей, собранные твердые продукты промывают этанолом, получая соль 4-метоксифенил гидразина с названным в заголовке соединением (0,700 г) в виде светлого рыжевато-коричневого твердого продукта. Этот продукт нагревают при температуре кипения с обратным холодильником в ледяной уксусной кислоте (20 мл) в течение 2 ч, получая коричневую суспензию. Суспензию охлаждают до комнатной температуры. Твердые продукты собирают и промывают ледяной уксусной кислотой, метанолом и диэтиловым эфиром, получая указанное в заголовке соединение (0,331 г, 53%) в виде рыжевато-коричневого порошка, Т.пл. 365oC (разл.); МC (CI): 370 (М+H).
Анализ для C18H12ClN3O4:
Рассчитано: C, 58.50; H, 3.27; N, 11.36
Найдено: C, 58.29; H, 3.41; N, 11.14.
ЯМР: 13.79 (br s, 1H, способн. к обмену), 8.22 (br d, J=8.70 Гц, 2H, 1H способн. к обмену), 7.88 (d, J=1.79 Гц, 1H), 7.57 (dd, J=1.79, 8.70 Гц, 1H), 6.78 (s, 4H), 3.67(s, 3H).
Пример 8. 7-Хлор-4-гидрокси-2-(4-метоксифенил)-1,2,5,10- тетрагидропиридазино[4,5-b] хинолин-1, 10-дион.
Сохраненный фильтрат от Примера 7 разбавляют водой (250 мл), получая желтую суспензию. Собирают твердые продукты и промывают водным метанолом (50%), получая указанное в заголовке соединение (1,22 г, 45%) в виде желтоватого порошка, Т.пл. 351-353oC; МC (CI): 370 (М+H).
Анализ для C18H12ClN3O4:
Рассчитано: C, 58.50; H, 3.27; N, 11.36
Найдено: C, 58.51; H, 3.44; N, 11.03.
ЯМР: 12.74 (s, 1H, способн. к обмену), 12.01 (s, 1H, способн. к обмену), 8.15 (d, J=8.70 Гц, 1H), 8.05 (br s, 1H), 7.44 (мультиплет, 3H), 7.02 (br d, J=6.96 Гц, 2H), 3.80(s, 3H).
Пример 9. 7-Хлор-1-гидрокси-3-(4-гидроксифенил)-3,4,5,10- тетрагидропиридазино[4,5-b]хинолин-4,10-дион.
7-Хлор-1-гидрокси-3-(4-метоксифенил)-3,4,5,10-тетрагидропиридазино [4,5-b] хинолин-4,10-дион (0,800 г, 2,16 мМ) перемешивают в метансульфокислоте (16 мл), получая янтарно-желтый раствор. Этот раствор нагревают при 160oC 6 ч и охлаждают до комнатной температуры. Добавление диэтилового эфира (250 мл) дает рыжевато- коричневый осадок, который перемешивают 1 ч. Твердый продукт собирают и промывают смесью метанол/диэтиловый эфир, получая указанное в заголовке соединение (0,661 г, 77%) в виде рыжевато-коричневого порошка, Т.пл. 393-395oC; МC (CI): 356 (М+H).
Анализ для C17H10ClN3O4•0,2 CH3SO3H•1,3H2O:
Рассчитано: C, 51.86; H, 3.39; N, 10.55;
Найдено: C, 51.76; H, 3.02; N, 10.37.
ЯМР: 13.30 (s, 1H, способн. к обмену), 12.5 (v br s, 1H, способн. к обмену), 10.8 (br s, 1H, способн. к обмену), 8.29 (d, J=8.76 Гц, 1H), 8.23 (br s, 1H), 7.61 (br d, J=8.76 Гц, 1H), 7.45 (d, J=0.81 Гц, 2H), 6.88 (d, J=8.81 Гц, 2H), 2.32(s, 0,5H).
Пример 10. 7-Хлор-4-гидрокси-2-(4-гидроксифенил)-1,2,5,10- тетрагидропиридазино[4,5-b]хинолин-1,10-дион.
7-Хлор-4-гидрокси-2-(4-метоксифенил)-1,2,5,10-тетрагидро- пиридазино[4,5-b]хинолин-1,10-дион (0,800 г, 2,16 мМ) перемешивают в метансульфокислоте (16 мл), получая раствор янтарного цвета. Этот раствор нагревают при 150oC 6 ч и охлаждают до комнатной температуры. Добавление диэтилового раствора (250 мл) и метанола (50 мл) дает рыжевато-коричневый осадок. Твердый продукт собирают и промывают, получая указанное в заголовке соединение (0,530 г, 51%) в виде рыжевато-коричневого порошка, Т.пл. 316-318oC; МC (CI): 356 (М+H).
Анализ для C17H10ClN3O4• CH3SO3H•1,3H2O:
Рассчитано: C,45.49; H, 3.52; N, 8.84;
Найдено: C, 45.45; H, 3.24; N, 8.64.
ЯМР: 12.80 (v br s, 1H, способн. к обмену), 8.15 (d, J=8.68 Гц, 1H), 8.04 (d, J=1.84 Гц, 1H), 7.44 (dd, J=1.84, 8.68 Гц, 1H), 7.28 (d, J=8.74 Гц, 2H), 6.81 (d, J=8.74 Гц, 2H), 2.35(s, 3H).
Пример 11. 4-Гидрокси-8-нитро-2-фенил-1,2,5,10-тетра- гидропиридазино[4,5-b]хинолин-1,10-дион.
2-Анилино-7-нитро-2,3,4,9-тетрагидро-1H-пирроло[3,4-b] хинолин-1,3,9-трион (0,830 г, 2,37 мМ) растворяют при перемешивании в метансульфокислоте (42 мл), получая темно- оранжевый раствор. Добавляют метанол (420 мл) и полученный желтый раствор нагревают при температуре кипения с обратным холодильником 2 ч, получая желтую суспензию. Нагрев убирают и суспензию перемешивают при комнатной температуре 3 часа. Твердые продукты отделяют фильтрацией и фильтрат оставляют стоять на 20 часов. За это время в фильтрате образуется дополнительное количество твердых продуктов и суспензию повторно фильтруют. Этот фильтрат концентрируют затем приблизительно до 250 мл и разбавляют водой (400 мл), получая желтый осадок. Эти твердые продукты собирают и промывают водным метанолом (50%) и затем диэтиловым эфиром, получая указанное в заголовке соединение (0,590 г, 71%) в виде желтого порошка, Т.пл. 382-385oC; МC (CI): 351 (М+H).
Анализ для C17H10N4O5•0,1 C4H10O•1,1H2O:
Рассчитано: C, 55.40; H, 3.52; N, 14.80;
Найдено: C, 55.42; H, 3.46; N, 14.60.
ЯМР: 12.91 (br s, 1H, способн. к обмену), 12.44 (br s, 1H, способн. к обмену), 8.86 (s, 1H), 8.53 (d, J=9.18 Гц, 1H), 8.15 (d, J=9.18 Гц, 1H), 7.57-7.35 (m, 5H).
Исходный 2-анилин-7-нитро-2,3,4,9-тетрагидро-1H-пирроло[3,4-b] хинолин-1,3,9-трион получают следующим способом:
а. 2-Анилин-7-нитро-2,3,4,9-тетрагидро-1H-пирроло[3,4-b] хинолин- 1,3,9-трион.
К перемешиваемой суспензии диэтил 6-нитро-4-гидрокси- хинолин-2,3-дикарбоксилата (1,670 г, 5,00 мМ) в этаноле (30 мл) добавляют фенилгидразин (3,44 мл, 35,00 мМ), получая темно-красный раствор. Раствор нагревают при температуре кипения с обратным холодильником 1 час и концентрируют приблизительно до 15 мл. Дальнейшее нагревание дает густую суспензию, которую разбавляют этанолом (5 мл) и нагревают при температуре кипения с обратным холодильником дополнительно 16 ч. Смесь охлаждают до комнатной температуры и фильтруют, получая фенил гидразиновую соль указанного в заголовке соединения в виде рыжевато-коричневого твердого вещества. Этот продукт нагревают при температуре кипения с обратным холодильником в ледяной уксусной кислоте (25 мл) в течение 2 ч и охлаждают до комнатной температуры. Фильтрация дает указанное в заголовке соединение (1,01 г, 58%) в виде рыжевато-коричневого порошка, Т.пл. 368oC (разл.); МC (CI): 351 (М+H).
Анализ для C17H10N4o5:
Рассчитано: C, 58.30; H, 2.88; N, 16.00;
Найдено: C, 58.21; H, 3.07; N, 16.15.
ЯМР: 8.91(d, J=2.76 Гц, 1H), 8.60 (dd, J=2.76, 9.18 Гц, 1H), 8.06(d, J= 9.18 Гц, 1H), 7.18 (t, J=7.23 Гц, 2H), 6.82 (m, ЗH).
Пример 12. 2-Бензил-7-хлор-4-гидрокси-1,2,5,10-тетрагидро- пиридазино[4,5-b]хинолин-1,10-дион.
К перемешиваемой суспензии диметил 7-хлор-4-гидроксихинолин-2,3- дикарбоксилита (5,00 г, 16,90 мМ) и бензилгидразин дигидрохлорида (46,15 г, 236,50 мМ) в этаноле (100 мл) добавляют триэтиламин (75,8 мл, 541,0 мМ). Смесь нагревают, получая коричневый раствор, который нагревают при температуре кипения с обратным холодильником 40 ч, за это время образуется осадок. Суспензию охлаждают до комнатной температуры и фильтруют, получая бензилгидразиновую соль указанного в заголовке соединения в виде содержащего примесь желтого твердого вещества. Многократная кристаллизация из этанольного хлористого водорода и метанола дает указанное в заголовке соединение (0,370 г, 6%) в виде белого порошка, Т.пл. 347-350oC; МC (CI): 354 (М+H).
Анализ для C18H12ClN3O3:
Рассчитано: C, 61.10; H, 3.42; N, 11.90;
Найдено: C, 60.68; H, 3.61; N, 11.80.
ЯМР: 12.65 (br s, 1H, способн. к обмену), 11.93 (br s, 1H, способн. к обмену), 8.15(d, J= 8.67 Гц, 1H), 8.02(d, J=1.83, 1H), 7.43 (d, J=8.55 Гц, 1H), 7.36-7.23(m, 5H), 5.11 (s, 2H).
Пример 13. 7-Хлор-4-гидрокси-2-[2-(4-фенилпиперазино)- этил]-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион.
2(2-Бромэтил)-7-хлор-4-гидрокси-1,2,5,10-тетрагидро- пиридазино[4,5-b] хинолин-1,10-дион (0,500 г, 1,35 мМ) перемешивают в диметилформамиде (10 мл) и добавляют N- фенилпиперазин (10 мл, 10,6 г, 65,5 мМ). Полученную желтую суспензию нагревают до 110oC, получая прозрачный желтый раствор. Раствор нагревают 6 часов, за это время образуется осадок. Суспензию охлаждают до комнатной температуры и перемешивают пять дней. Полученную желтую суспензию растворяют в водном метаноле (500 мл, 50%). pH этого раствора осторожно доводят до pH 6 с помощью 1 н. хлористоводородной кислоты (≈20 мл), что дает желтый осадок. Эту суспензию перемешивают 1 ч и фильтруют, получая указанное в заголовке соединение, загрязненное N-фенилпиперазином (0,753 г). Этот продукт перекристаллизуют из этанола (200 мл), получая указанное в заголовке соединение (0,428 г, 70%) в виде желтого порошка, Т.пл. 361-364oC; МC (CI): 452 (М+H).
Анализ для C23H22ClN5O5:
Рассчитано: C, 61.10; H, 4.91; N, 15.50;
Найдено: C, 60.72; H, 5.06; N, 15.30.
ЯМР: 7.95(d, J=8.67 Гц, 1H), 7.64 (br s, 1H), 7.26-7.18 (m, 3H), 6.95(d, J=8.07 Гц, 2H), 6.78(t, J=7.32, 1H), 4.15 (br s, 2H), 3.55-2.85 (brm, 10H).
Пример 14. Холиновая соль 7-Хлор-1-гидрокси-3-(2-фенетил)-3, 4,5,10-тетрагидропиридазино[4,5-b]хинолин-4,10-диона.
К еремешиваемому раствору гидроокиси натрия (9,46 г, 236,6 мМ) в этаноле (100 мл) при 45oC добавляют сульфатную соль 2- фенетилгидразина (27,6 г 118,3 мМ) наряду с дополнительным количеством этанола (50 мл). Полученную густую белую суспензию перемешивают 2 ч. Твердый продукт удаляют фильтрацией и промывают этанолом (50 мл). Прозрачный объединенный фильтрат концентрируют до ~ 70 мл и добавляют диметил 7-хлор-4- гидроксихинолин-2,3-дикарбоксилат (2,50 г, 8,45 мМ), что дает коричневый раствор. Раствор нагревают при температуре кипения с обратным холодильником 16 ч, за это время образуется желтый осадок. Cуспензию фильтруют горячей и промывают этанолом (50 мл), получая 2-фенетилгидразиновую соль 7-хлор-1-гидрокси-3-(2- фенетил)-3,4,5,10-тетрагидропиридазино[4,5-b] хинолин-4, 10-дион в виде желтого порошка (2,90 г). Этот продукт нагревают при температуре кипения с обратным холодильником в ледяной уксусной кислоте (50 мл) в течение 2 ч и, после охлаждения до комнатной температуры, полученную суспензию фильтруют, получая смесь 7-хлор-1-гидрокси-3-(2-фенетил)-3,4,5,10- тетрагидропиридазино[4,5-b] хинолин-4,10-диона и соответствующего 2-замещенного фенетил изомера в виде желтого твердого продукта (2,20 г, 68%). Смесь перемешивают в метаноле (250 мл) и растворе метил-D-глюкамина (15,0 г метил-D-глюкамина в 250 мл воды). Затем добавляют раствор холин гидроксида (9,0 мл, 50 вес.% в воде), получая раствор насыщенного янтарного цвета. Этот раствор осторожно подкисляют до pH 9 ледяной уксусной кислотой, после чего образуется желтый осадок. После перемешивания этой желтой суспензии в течение 1 ч, твердые продукты собирают и промывают последовательно водным метанолом (50%), смесью метанол/эфир и диэтиловым эфиром, получая указанное в заголовке соединение (свободная кислота, 1,13 г, 54%) в виде желтого порошка. Фильтрат и промывные воды собирают и сохраняют для использования в Примере 15.
Выделенный ранее 7-хлор-1-гидрокси-3-(2-фенетил)-3,4,5,10- тетрагидропиридазино[4,5-b]хинолин-4,10-дион (1,00 г, 2,72 мМ), выделенный ранее, перемешивают в метаноле (50 мл) и добавляют раствор гидроокиси холина (1,0 мл, 45 вес. % в метаноле). Полученную суспензию перемешивают и обрабатывают ультразвуком в течение 1 ч, что дает раствор янтарного цвета. Этот раствор трижды подвергают азеотропной перегонке из смеси метанол/толуол (10%, 50 мл), получая оранжевый твердый продукт. Растирание с толуолом (50 мл), содержащим этанол (3 мл), дает свободно текущую суспензию, которую перемешивают 16 ч. Твердый продукт собирают и промывают толуолом и диэтиловым эфиром, получая рыжевато-коричневый порошок (1,19 г). Этот порошок сушат при глубоком вакууме (50 мТ) при 100oC в течение 72 ч, что дает указанное в заголовке соединение (1,00 г, 78%) в виде порошка золотистого цвета, Т.пл. 227-229oC; МC (CI): 368 (М+H).
Анализ для C19H13ClN3О3• C5H14NO•0,2H2O:
Рассчитано: C, 60.70; H, 5.82; N, 11.81;
Найдено: C, 60.41; H, 5.74; N, 11.68.
ЯМР: 14.86 (s, 1H, способн. к обмену), 8.17(d, J=8.82 Гц, 1H), 7.80 (s, 1H), 7.33-7.19 (m, 6H), 5.37(br s, 1H, способн. к обмену), 4.13 (t, J=7.29, 2H), 3.84 (br s, 2H), 3.37(m, 2H), 3.10 (s, 9H), 3.00(t, J=7.29 Гц, 2H).
Пример 15. 7-Хлор-4-гидрокси-2-(2-фенетил)-1,2,5,10- тетрагидропиридазино[4,5-b]хинолин-1,10-дион.
Фильтрат и промывные воды, сохраненные из Примера 14, подкисляют ледяной уксусной кислотой, что дает осадок. Твердые продукты собирают и промывают последовательно метанолом, водой, метанолом и диэтиловым эфиром, получая указанное в заголовке соединение (0,81 г, 39%) в виде светло-желтого порошка, Т.пл. 327-330oC; МC (CI): 368 (М+H).
Анализ для C19H14ClN3О3• 0,1H2O:
Рассчитано: C, 61.70; H, 3.87 N, 11.36;
Найдено: C, 61.60; H, 3.99; N, 10.98.
ЯМР: 12.60 (v s, 1H, способн. к разлож.), 11.95 (v s, 1H, способн. к разлож. ), 8.15(d, J=8.63 Гц, 1H), 8.01(d, J=1.35 Гц, 1H), 7.43(d, J=8.63 Гц, 1H), 7.33-7.22 (m, 5H), 4.11 (t, J=7.46, 2H), 2.99(t, J=7.46 Гц, 2H).
Пример 16. 7-Хлор-1-гидрокси-3-(4-хлорфенил)-3,4,5,10- тетрагидропиридазино[4,5-b] хинолин-4,10-дион.
Перемешиваемую суспензию 6-хлор-2-(4-хлоранилин)-2,3,4,9- тетрагидро-1H-пирроло[3,4-b] хинолин-1,3,9-триона (0,670 г, 1,79 мМ) в метаноле (60 мл) и метансульфокислоте (15 мл) нагревают при температуре кипения с обратным холодильником 3 ч и охлаждают до комнатной температуры. Смесь фильтруют (фильтрат сохраняют для использования в Примере 17) и собранные желтые твердые продукты промывают метанолом и диэтиловым эфиром, что дает указанное в заголовке соединение (0,156 г, 23%) в виде желтого порошка, Т.пл. >400oC; МC (CI): 374 (М+H).
Анализ для C17H9Cl2N3O3:
Рассчитано: C, 54.60; H, 2.42 N, 11.23;
Найдено: C, 54.29; H, 2.19; N, 11.20.
ЯМР: 13.40 (s, 1H, способн. к обмену), 12.54 (s, 1H, способн. к обмену), 8.30(d, J=8.79 Гц, 1H), 8.23(d, J=1.89 Гц, 1H), 7.75(d, J=6.90 Гц, 2H), 7.63 (m, 3H). Исходный 6-хлор-2-(4-хлоранилин) -2,3,4,9-тетрагидро-1H-пирроло[3,4-b]хинолин-1,3,9-трион получают как описано ниже:
а. 6-хлор-2-(4-хлоранилин)-2,3,4,9-тетрагидро-1H-пирроло[3,4-b] хинолин-1,3,8-трион
К перемешиваемой суспензии диметил 7-хлор-4-гидрокси- хинолин-2,3-дикарбоксилата (2,50 г, 8,45 мМ) и 4-хлорфенил- гидразина (10,60 г, 59,20 мМ) в этаноле (50 мл) добавляют триэтиламин (9,43 мл), получая коричневый раствор. Этот раствор нагревают при температуре кипения с обратным холодильником 24 часа и затем охлаждают до комнатной температуры. Разбавление водой (25 мл) дает коричневый осадок. Эту суспензию перемешивают 16 ч и фильтруют, для отделения твердых продуктов, которые отбрасываются. После хранения фильтрата в течение семи дней образуется другой осадок. Этот твердый продукт собирают и промывают метанолом (50%) и диэтиловым эфиром, получая соль 4- хлофенилгидразина, указанного в заголовке соединения, в виде коричневого порошка (1,20 г). Этот продукт нагревают при температуре кипения с обратным холодильником в ледяной уксусной кислоте (25 мл) в течение 3 ч и охлаждают до комнатной температуры. Полученную оранжевую суспензию фильтруют и твердые продукты промывают ледяной уксусной кислотой и диэтиловым эфиром, получая указанное в заголовке соединение (0,810 г, 25%) в виде светло-оранжевого порошка, Т.пл. 399-401oC; МС (CI): 374 (М+H).
Анализ для C17H9Cl2N3O3:
Рассчитано: C, 54.60; H, 2.42 N, 11.23;
Найдено: C, 54.29; H, 2.61; N, 11.12.
ЯМР: 13.80 (v br s, 1H, способн. к обмену), 8.67 (s, 1H, способн. к обмену), 8.22(d, J=8.67 Гц, 1H), 7.88(d, J=1.73 Гц, 1H), 7.57(d, J=1.73, 8.67 Гц, 1H), 7.21(d, J=8.79, 2H), 6.87(d, J=8.79 Гц, 2H).
Пример 17. 7-Хлор-4-гидрокси-2-(4-хлорфенил)-1,2,5,10- тетрагидропиридазино[4,5-b]хинолин-1,10-дион.
Фильтрат, сохраненный из Примера 16, разбавляют водой (75 мл), получая белую суспензию, которую перемешивают 16 ч. Эту суспензию фильтруют и собранные твердые продукты промывают последовательно водой, водным метанолом, метанол/диэтиловым эфиром и диэтиловым эфиром, получая указанное в заголовке соединение (0,420 г, 63%) в виде белого твердого порошка, Т.пл. 359-360oC; МС (CI): 374 (М+H).
Анализ для C17H9Cl2N3O3• 0,5H2O•0,2CH3SO3H:
Рассчитано: C, 51.30; H, 2.71; N,10.40;
Найдено: C, 51.44; H, 2.64; N, 0.60.
ЯМР: 12.91 (br s, 1H, способн. к обмену), 12.07 (br s, 1H, способн. к обмену), 8.16(d, J=8.64 Гц, 1H), 8.06(d, J=1.62 Гц, 1H), 7.63-7.46(m, 5H).
Пример 18. 7-Хлор-1-гидрокси-3-(4-метилфенил)-3,4,5,10- тетрагидропиридазино[4,5-b]хинолин-4,10-дион.
Перемешиваемую суспензию 6-хлор-2-(4-метиланилин)-2,3,4,9-тетрагидро-1H- пирроло[3,4-b] хинолин-1,3,9-триона (1, 60 г, 4,53 мМ) в растворе метанола (128 мл) и метансульфокислоты (32 мл) нагревают при температуре кипения с обратным холодильником 4 ч и охлаждают до комнатной температуры. Полученную желтую суспензию перемешивают при комнатной температуре пять дней и затем фильтруют (фильтрат сохраняют для использования в Примере 19). Собранные твердые продукты промывают метанолом и затем диэтиловым эфиром, получая указанное в заголовке соединение (0,594 г, 37%) в виде желтого порошка, Т.пл. >400oC; МС (CI): 354 (М+H).
Анализ для C18H12ClN3O3• 0,4H2O:
Рассчитано: C, 59.89; H, 3.57; N, 11.64;
Найдено: C, 59.47; H, 3.14; N, 11.57.
ЯМР: 13.34(s, 1H, способн. к обмену), 12.48 (s, 1H, способн. к обмену), 8.30(d, J=8.75 Гц, 1H), 8.22 (br s, 1H), 7.62(d, J=8.75 Гц, 1H), 7.55(d, J= 8.01 Гц, 2H), 7.33(d, J=8.01 Гц, 2H), 2.38 (s, 3H).
Исходный 6-хлор-2-(4-метиланилин)-2,3,4,9-тетрагидро-1H- пирроло[3,4-b] хинолин-1,3,9-трион получают следующим способом:
а. 6-Хлор-2-(4-метиланилин)-2,3,4,9-тетрагидро-1H-пирроло[3,4-b] хинолин-1,3,9-трион.
К перемешиваемой суспензии диметил 7-хлор- 4-гидрохинолин-2,3-дикарбоксилата (3,90 г, 13,3 мМ) и 4- метилфенилгидразин гидрохлорида (14,8 г, 93,2 мМ) в этаноле (140 мл) добавляют триэтиламин (14,8 мл,106,4 мМ). Полученный коричневый раствор нагревают при температуре кипения с обратным холодильником 16 ч, за это время выпадает осадок. Полученную суспензию охлаждают до комнатной температуры и фильтруют, получая соль 4-метилфенилгидразина указанного в заголовке соединения в виде серого порошка (2,30 г). Этот продукт нагревают при температуре кипения с обратным холодильником в ледяной уксусной кислоте (45 мл) в течение 2 ч и охлаждают до комнатной температуры. Полученную коричневую суспензию фильтруют, получая указанное в заголовке соединение (1,60 г, 34%) в виде рыжевато-коричневого порошка, Т.пл. 380-382oC; МС (CI): 354 (М+H).
Анализ для C18H12ClN3O3• 0,2H2O:
Рассчитано: C, 60.49; H, 3.50; N, 11.76;
Найдено: C, 60.66; H, 3.26; N, 11.76.
ЯМР: 13.81. (v br s, 1H, способн. к обмену), 8.39(s, 1H, способн. к обмену), 8.22(d, J= 8.58 Гц, 1H), 7.89(d, J=1.97 Гц, 1H), 7.58(dd, J=1.97, 8.58 Гц, 1H), 6.98(d, J=8.28 Гц, 2H), 6.73(d, J=8.28 Гц, 2H), 2.19 (s, 3H).
Пример 19. 7-Хлор-4-гидрокси-2-(4-метилфенил)-1,2,5,10- тетрагидропиридазино[4,5-b]хинолин-1,10-дион.
Фильтрат, сохраненный в Примере 18, разбавляют водой (160 мл), получая рыжевато-коричневую суспензию, которую перемешивают 3 ч. Суспензию фильтруют и собранные твердые продукты промывают последовательно водой, метанол/эфиром и диэтиловым эфиром, получая указанное в заголовке соединение (0,855 г, 53%) в виде рыжевато-коричневого порошка, Т.пл. 368-370oC; МС (CI): 354 (М+H).
Анализ для C18H12ClN3O3• 0,2H2O:
Рассчитано: C, 60.50; H, 3.50; N, 11.76;
Найдено: C, 60.52; H, 3.23; N, 11.79.
ЯМР: 12.75 (br s, 1H, способн. к обмену), 12.00 (br s, 1H, способн. к обмену), 8.15(d, J= 8.61 Гц, 1H), 8.04(d, J=1.50 Гц, 1H), 7.43(m, 3H), 7.26(d, J=8.25 Гц, 2H), 2.36 (s, 3H).
Пример 20. 7-Хлор-1-гидрокси-3-(4-изопропилфенил)-3,4,5,10- тетрагидропиридазино[4,5-b]хинолин-4,10-дион.
Перемешиваемую суспензию 6-хлор-2-(4-изопропиланилин)-2,3,4,9-тетрагидро-1H-пирроло[3,4-b] хинолин-1,3,9-триона (1,13 г, 2,98 мМ) в растворе метанола (90 мл) и метансульфокислоты (23 мл) нагревают при температуре кипения с обратным холодильником 7 ч и охлаждают до комнатной температуры. Смесь фильтруют (фильтрат сохраняют для использования в Примере 21), собранные желтые твердые продукты промывают метанолом и диэтиловым эфиром, получая указанное в заголовке соединение (0,401 г, 35%) в виде желтого порошка, Т. пл. 393-394oC; МС (CI): 382 (М+H).
Анализ для C20H16ClN3O3• 0,2H2O:
Рассчитано: C, 62.33; H, 4.29; N,10.90;
Найдено: C, 62.16; H, 3.98; N,10.82.
ЯМР: 13.33 (s, 1H, способн. к обмену), 12.48 (s, 1H, способн. к обмену), 8.28(d, J=8.76 Гц, 1H), 8.22(d, J=1.77 Гц, 1H), 7.63-7.58(m, 3H), 7.40(d, J= 8.49 Гц, 2H), 2.98(септет, J=6.96 Гц, 1H), 1.25(d, J=6.96 Гц, 6H).
Исходный 6-хлор-2-(4-изопропиланилин)-2,3,4,9-тетрагидро-1H-пирроло [3,4-b]хинолин-1,3,9-трион получают следующим способом:
а. 6-Хлор-2-(4-изопропиланилин)-2,3,4,9-тетрагидро-1H-пирроло [3,4-b] хинолин-1,3,9-трион.
К перемешиваемой суспензии диметил 7-хлор-4-гидрохинолин-2,3- дикарбоксилата (2,01 г, 6,80 мМ) и 4-изопропилфенилгидразин гидрохлорида (8,90 г, 47,6 мМ) в этаноле (72 мл) добавляют триэтиламин (7,6 мл, 54,5 мМ), получая коричневый раствор. Этот раствор нагревают при температуре кипения с обратным холодильником 16 ч, охлаждают до комнатной температуры и затем медленно добавляют к смеси хлористоводородной кислоты (12 н.,100 мл) при энергичном перемешивании, в результате чего образуется розовая суспензия. Суспензию фильтруют и собранные твердые продукты промывают охлажденным раствором, приготовленным смешением метанола (100 мл), соляной кислоты (100 мл, 12 н.) и льда, получая соль 4-изопропилфенилгидразина указанного в заголовке соединения в виде порошка пурпурного цвета (1,80 г). Этот продукт нагревают при температуре кипения с обратным холодильником в ледяной уксусной кислоте (15 мл) 3 ч, получая рыжевато-коричневую суспензию. Суспензию охлаждают до комнатной температуры и фильтруют. Собранные твердые продукты промывают ледяной уксусной кислотой (10 мл) и диэтиловым эфиром, получая указанное в заголовке соединение (1,125 г, 43%) в виде рыжевато- коричневого порошка, Т.пл. 367-369oC; МС (CI): 382 (М+H).
Анализ для C20H16ClN3O3• 0,1H2O:
Рассчитано: C, 62.60; H, 4.26; N,10.95;
Найдено: C, 62.60; H, 4.35; N,10.73.
ЯМР: 13.82 (v br s, 1H, способн. к обмену), 8.41 (s, 1H, способн. к обмену), 8.23(d, J= 8.64 Гц, 1H), 7.89(d, J=1.98 Гц, 1H), 7.61(dd, J=1.98, 8.64 Гц, 1H), 7.04(d, J=8.42 Гц, 2H), 6.74(d, J=8.42 Гц, 2H), 2.78(септет, J=6.87 Гц, 1H), 1.15(d, J=6.87 Гц, 6H).
Пример 21. 7-Хлор-4-гидрокси-2-(4-изопропилфенил)-1,2,5, 10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион.
Фильтрат, сохраненный в Примере 20, разбавляют водой (115 мл), получая светло-желтую суспензию, которую перемешивают 5 ч при комнатной температуре. Суспензию фильтруют и собранные твердые продукты промывают последовательно водой, водным метанолом (50%), метанол/диэтиловым эфиром и диэтиловым эфиром, что дает указанное в заголовке соединение (0,418 г, 37%) в виде рыжевато-коричневого порошка, Т.пл. 323-326oC; МС (CI): 382 (М+H).
Анализ для C20H16ClN3O3• 0,5H2O•0,1CH3SO3H:
Рассчитано: C, 60.29; H, 4.38; N,10.49;
Найдено: C, 60.13; H, 4.10; N,10.40.
ЯМР: 12.73 (br s, 1H, способн. к обмену), 12.00 (br s, 1H, способн. к обмену), 8.15(d, J= 8.70 Гц, 1H), 8.05(d, J=1.74 Гц, 1H), 7.45(m, 3H), 7.33(d, J=8.40 Гц, 2H), 2.95(септет, J=6.90 Гц, 1H), 1.24(d, J=6.90 Гц, 6H).
Пример 22. 7,9-Дихлор-1-гидрокси-2-фенил-1,2,5,10- тетрагидропиридазино[4,5-b]хинолин-1,10-дион.
6,8-Дихлор-2-анилин-2,3,4,9-тетрагидро-1H-пирроло[3,4-b] хинолин- 1,3,9-трион (0,60 г, 1,60 мМ) перемешивают в метаноле (200 мл) и метансульфокислоту (20 мл) добавляют при охлаждении, поддерживая температуру ниже 20oC. Полученный оранжевый раствор перемешивают в течение ночи при комнатной температуре. Образовавшийся за ночь осадок и оранжевую суспензию нагревают при температуре кипения в течение с обратным холодильником 1 ч. Суспензию охлаждают до комнатной температуры и оставляют стоять в течение ночи без перемешивания. Суспензию фильтруют и фильтрат медленно разбавляют водой (200 мл), получая желтую суспензию. Эту суспензию перемешивают 2 ч и твердый продукт собирают и промывают водой, водным метанолом, 50% метанол/диэтиловым эфиром и диэтиловым эфиром, получая указанное в заголовке соединение (0,368 г, 61%) в виде светлого рыжевато- коричневого порошка, Т.пл. 361-36oC; МС (CI): 374 (М+H).
Анализ для C17H9Cl2N3O3• 0,30H2O:
Рассчитано: C, 53.80; H, 2.55 N, 11.07;
Найдено: C, 53.71; H, 2.64; N,10.97.
1H ЯМР: 12.84 (s, 1H, способн. к обмену), 11.96 (s, 1H, способн. к обмену), 8.04(d, J=2.02 Гц, 1H), 7.55-7.45(m, 5H), 7.36(t, J=6.84 Гц, 1H).
Исходный 6, 8-Дихлор-2-анилин-2,3,4,9-тетрагидро-1H-пирроло [3,4-b]хинолин-1,3,9-трион получают нижеописанным способом:
а. 6,8-Дихлор-2-анилин-2,3,4,9-тетрагидро-1H-пирроло[3,4- b] хинолин-1,3,9-трион. К перемешиваемой суспензии диметил 5,7- дихлор-4-гидроксихинолин-2,3-дикарбоксилата (3,00 г, 9,09 мМ) в этаноле (42 мл) добавляют фенилгидразин (6,26 мл, 63,6 мМ). Полученный зеленый раствор нагревают при температуре кипения с обратным холодильником 16 ч, за это время образуется небольшое количество красного осадка. Эту суспензию охлаждают до комнатной температуры при перемешивании, вызывая дополнительное осаждение продукта и образование густой рыжевато-коричневой суспензии. Твердые продукты собирают и промывают этанолом (этанольные промывные воды сохраняют). Собранный твердый продукт перекристаллизовывают из этанола (1,20 л), получая фенил гидразиновую соль указанного в заголовке соединения (1,17 г) в виде рыжевато-коричневого порошка. Этот продукт перемешивают и нагревают при температуре кипения с обратным холодильником в ледяной уксусной кислоте (15 мл) в течение 2,5 ч и затем охлаждают до комнатной температуры при перемешивании. Полученную оранжевую суспензию фильтруют, получая указанное в заголовке соединение (0,629 г, 19%) в виде оранжевого порошка, который слегка загрязнен. Аналитический образец указанного в заголовке соединения получают из оставленных ранее этанольных промывных вод фильтрацией осадка, образовавшегося после того, как эти промывные воды стояли в течение нескольких часов. Перекристаллизация этого собранного рыжевато-коричневого порошка (0,126 г) из ледяной уксусной кислоты (2 мл) дает чистое указанное в заголовке соединение (0,083 г) в виде оранжевого порошка, Т.пл. 364-367oC; МС (CI): 374 (М+H).
Анализ для C17H9Cl2N3O3• 0,30H2O•0,10CH3CО2H:
Рассчитано: C, 53.60; H, 2.61; N,10.90;
Найдено: C, 53.49; H, 2.77; N,10.82.
1H ЯМР: 8.53 (s, 1H, способн. к обмену), 7.85(d, J=1.94 Гц, 1H), 7.65(d, J=1.94 Гц, 1H), 7.18(t, J=7.84 Гц, 2H), 6.82(d, J=7.84 Гц, 3H).
Пример 23. 7-Хлор-1-гидрокси-3-(1-нафтил)-3,4,5,10- тетрагидропиридазино[4,5-b]хинолин-4,10-дион.
6-Хлор-2-(1-нафтиламино)-2,3,4,9-тетрагидро-1H- пирроло[3,4-b]хинолин-1,3,9-трион (1,30 г, 3,34 мМ) перемешивают в метаноле (0,65 л) и добавляют метансульфокислоту (65 мл). Коричневую суспензию нагревают при температуре кипения с обратным холодильником 16 ч, за это время твердые продукты растворяются, образуя коричневый раствор. Этот раствор охлаждают до комнатной температуры. Добавление льда (10 мл) дает рыжевато-коричневую суспензию, которую перемешивают 1,5 ч. Суспензию фильтруют (фильтрат сохраняют для использования в Примере 24) и собранные твердые продукты промывают метанолом и диэтиловым эфиром, получая указанное в заголовке соединение (0,560 г, 43%) в виде слабо-желтого порошка, Т.пл. 374-376oC; МС (CI): 390 (М+H).
Анализ для C21H12ClN3O3• 0,2H2O:
Рассчитано: C, 64.10; H, 3.18; N,10.68;
Найдено: C, 63.91; H, 3.42; N,10.61.
1H ЯМР: 13.40 (s, 1H, способн. к обмену), 12.58 (s, 1H, способн. к обмену), 8.35(d, J= 8.70 Гц, 1H), 8.25(d, J=1.76 Гц, 1H), 8.12-8.07 (m, 2H), 7.74-7.53 (m, 6H).
Исходный 6-хлор-2-(1-нафтиламино)-2,3,4,9-тетрагидро-1H-пирроло [3,4-b] хинолин-1,3,9-трион получают как описано ниже:
а. 6-Хлор-2-(1-нафтиламино)-2,3,4,9-тетрагидро-1H- пирроло[3,4-b]хинолин-1,3,9-трион.
К перемешиваемой суспензии диметил-7-хлор-4-гидро-ксихинолин-2,3-дикарбоксилата (2,00 г, 6,80 мМ) и 1-нафтил гидразин гидрохлорида (9,26 г, 47,6 мМ) в этаноле (72 мл) добавляют триэтиламин (7,60 мл), получая коричневый раствор. После нагревания при температуре кипения с обратным холодильником в течение 4 дней, раствор охлаждают до комнатной температуры и разбавляют этилацетатом (0,30 л), получая рыжевато-коричневую суспензию. Эту суспензию фильтруют, удаляя твердые продукты, которые отбрасывают. Затем фильтрат выливают в этилацетат (500 мл), который промывают хлористоводородной кислотой (3 х 500 мл, 1 н.). Промытый раствор разбавляют диэтиловым эфиром (250 мл), получая рыжевато-коричневую суспензию. Твердые продукты собирают, получая 1-нафтил гидразиновую соль указанного в заголовке соединения в виде рыжевато-коричневого порошка (2,09 г). Этот продукт нагревают при температуре кипения с обратным холодильником в ледяной уксусной кислоте (50 мл) в течение 2 часов, охлаждают до комнатной температуры и фильтруют. Собранные твердые продукты промывают ледяной уксусной кислотой и диэтиловым эфиром, получая указанное в заголовке соединение (1,44 г, 54%)) в виде рыжевато-коричневого порошка, Т.пл. 368oC (разложение); МС (CI): 390 (М+H).
Анализ для C21H12ClN3O3• 0,30CH3CO2H:
Рассчитано: C, 63.60; H, 3.26 N,10.30;
Найдено: C, 63.90; H, 3.43; N, 9.97.
1H ЯМР: 9.06 (s, 1H, способн. к обмену), 8.27-8.22 (m, 2H), 7.92-7.88 (m, 2H), 7.63-7.52 (m, 3H), 7.41(d, J=8.17 Гц, 1H), 7.27(t, J=7.86 Гц, 1H), 6.80(d, J=7.86 Гц, 1H).
Пример 24. 7-Хлор-4-гидрокси-2-(1-нафтил)-1,2,5,10- тетрагидропиридазино[4,5-b]хинолин-1,10-дион.
Фильтрат, сохраненный от Примера 23, разбавляют водой (0,75 л) и затем частично концентрируют на роторном испарителе, получая коричневую суспензию. Твердые продукты из суспензии собирают и промывают водой, метанол/диэтиловым эфиром и диэтиловым эфиром, получая коричневый порошок (0,535 г). Этот продукт нагревают при температуре кипения с обратным холодильником в метаноле (23 мл) и фильтруют горячим для удаления не растворившихся твердых продуктов, которые отбрасывают. Фильтрат концентрируют досуха и растворяют с этилацетатом (20 мл). Полученную суспензию фильтруют и собранные твердые продукты промывают этилацетатом и диэтиловым эфиром, получая указанное в заголовке соединение (0,240 г, 18%) в виде серого порошка, Т.пл. 335-337oC; МС (CI): 390 (М+H).
Анализ для C21H12ClN3O3• 0,60 H2O•0,40 CH3SO3H• 0,20C4H10O•0,15C4H8O2: Рассчитано: C, 58.60; H, 3.88 N, 9.00;
Найдено: C, 58.37; H, 3.53; N, 9.14.
1H ЯМР: 12.80 (br s, 1H, способн. к обмену), 12.1 (br s, 1H, способн. к обмену), 8.15-8.03 (br m, 4H), 7.67-7.50 (br m, 6H).
Пример 25. 7-Хлор-3-(4-фторфенил)-1-гидрокси-3,4,5,10- тетрагидропиридазино[4,5-b]хинолин-4,10-дион.
Перемешиваемую суспензию 6-хлор-2-(4-фторанилин)-2,3,4,9- тетрагидро-1H-пирроло[3,4-b] хинолин-1,3,9-триона (1,40 г, 3,90 мМ) в растворе метанола (0,73 л) и метансульфокислоты (73 мл) нагревают при температуре кипения с обратным холодильником 16 ч и охлаждают до комнатной температуры. Полученную оранжевую суспензию фильтруют (фильтрат сохраняют для использования в Примере 26) и собранные твердые продукты промывают метанолом и диэтиловым эфиром, получая указанное в заголовке соединение (0,374 г, 27%) в виде светло-оранжевого порошка, Т.пл. >400oC; МС (CI): 358 (М+H).
Анализ для C17H9ClN3O3• H2O:
Рассчитано: C, 54.30; H, 2.95; N, 11.20;
Найдено: C, 54.08; H, 2.62; N,10.98.
1H ЯМР: 13.38 (s, 1H, способн. к обмену), 12.51 (s, 1H, способн. к обмену), 8.30(d, J= 8.75 Гц, 1H), 8.22(d, J=1.78 Гц, 1H), 7.76-7.71 (m, 2H), 7.63(dd, J=1.78, 8.75 Гц, 1H), 7.40-7.35 (m, 2H).
Исходный 6-хлор-2-(4-фторанилин)-2,3,4,9-тетрагидро-1H-пирроло [3,4-b] хинолин-1,3,9-трион получают как описано ниже:
а. 6-Хлор-2-(4-фторанилин)-2,3,4,9-тетрагидро-1H-пирроло [3,4-b]хинолин-1,3,9-трион.
К перемешиваемой суспензии диметил-7-хлор-4-гидроксихинолин- 2,3-дикарбоксилата (2,59 г, 8,79 мМ) и 4-фторфенил гидразин гидрохлорида (10,00 г, 61,5 мМ) в этаноле (48 мл) добавляют триэтиламин (9,8 мл, 70,3 мМ). Полученный коричневый раствор нагревают при температуре кипения с обратным холодильником 48 ч, охлаждают до комнатной температуры и разбавляют этилацетатом (150 мл), получая белый кристаллический осадок, который удаляют фильтрацией и отбрасывают. Фильтрат промывают соляной кислотой (3 х 500 мл, 1 н.), что вызывает осаждение в этилацетатном слое. Осадок собирают и промывают последовательно этилацетат-диэтиловым эфиром и диэтиловым эфиром, получая 4-фторфенил гидразиновую соль указанного в заголовке соединения (2,14 г). Этот продукт нагревают при температуре кипения с обратным холодильником в ледяной уксусной кислоте (20 мл) в течение 2 ч. После охлаждения уксуснокислого раствора до комнатной температуры, образовавшийся осадок и твердые продукты собирают, получая указанное в заголовке соединение (1,48 г, 47%)) в виде желтого порошка, Т.пл. 390-392oC; МС (CI): 358 (М+H).
Анализ для C17H9ClFN3O3• 0,40 H2O:
Рассчитано: C, 55.95; H, 2.71 N, 11.51;
Найдено: C, 56.01; H, 2.67; N, 11.54.
1H ЯМР: 13.78 (br s, 1H, способн. к обмену), 8.52 (s, 1H, способн. к обмену), 8.22(d, J=8.71 Гц, 1H), 7.89 (d, J=2.01 Гц, 1H), 7.58(dd, J=2.01, 8.71 Гц, 1H), 7.05-6.98(m, 2H), 6.89-6.85 (m, 2H).
Пример 26. 7-Хлор-2-(4-фторфенил)-4-гидрокси-1,2,5, 10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион.
Фильтрат, сохраненный от Примера 25, разбавляют водой (0,800 л), получая светло-зеленую суспензию, которую перемешивают 3 ч. Суспензию фильтруют и собранные твердые продукты промывают водой, метанол/диэтиловым эфиром и диэтиловым эфиром, получая указанное в заголовке соединение (0,910 г, 65%) в виде серого порошка, Т.пл. 353-356oC; МС (CI): 358 (М+H).
Анализ для C17H9ClFN3O3• 2,00 H2O•0,06 CH3SO3H:
Рассчитано: C, 51.30; H, 3.34; N,10.52;
Найдено: C, 51.58; H, 3.00; N,10.47.
1H ЯМР: 11.95 (br s, 1H, способн. к обмену), 12.50 (br s, 1H, способн. к обмену), 8.15 (br d, J=8.26 Гц, 1H), 8.07 (br s, 1H), 7.58(br s,2H), 7.43 (br d, J=8.26 Гц, 1H), 7.29-7.24(br m, 2H).
Пример 27. 3-(4-Бромфенил)-7-хлор-1-гидрокси-3,4,5,10- тетрагидропиридазино[4,5-b]хинолин-4,10-дион.
Перемешиваемую суспензию 2-(4-броманилин)-6-хлор-2,3,4,9-тетрагидро-1H- пирроло[3,4-b] хинолин-1,3,9-триона (1,00 г, 2,39 мМ) в растворе метанола (500 мл) и метансульфокислоты (50 мл) нагревают при температуре кипения с обратным холодильником 16 ч и охлаждают до комнатной температуры. Полученную желтую суспензию фильтруют (фильтрат сохраняют для использования в Примере 28). Собранные твердые продукты промывают метанолом и затем диэтиловым эфиром, получая указанное в заголовке соединение (0,222 г, 22%) в виде желтого порошка, Т.пл. >400oC; МС (CI): 420 (М+H).
Анализ для C17H9BrClN3O3• 0,30 H2O:
Рассчитано: C, 48.15; H, 2.28; N, 9.91;
Найдено: C, 48.15; H, 2.36; N, 9.88.
1H ЯМР: 13.36 (s, 1H, способн. к обмену), 12.51 (s, 1H, способн. к обмену), 8.25 (d, J=8.73 Гц, 1H), 8.19 (d, J=1.55 Гц, 1H), 7.75-7,67(m, 4H), 7.60 (dd, J=1.55, 8.73 Гц, 1H).
Исходный 2-(4-броманилин)-6-хлор-2,3,4,9-тетрагидро-1H- пирроло[3,4-b] хинолин-1,3,9-трион получают приведенным ниже способом:
а. 2-(4-Броманилин)-6-хлор-2,3,4,9-тетрагидро-1H- пирроло[3,4-b] хинолин-1,3,9-трион.
К перемешиваемой суспензии диметил 7-хлор-4-гидроксихинолин- 2,3-дикарбоксилата (1,90 г, 6,40 мМ) и 4-бромфенил гидразин гидрохлорида (10,00 г, 44,7 мМ) в этаноле (35 мл) добавляют триэтиламин (7,1 мл, 51,1 мМ). Полученный коричневый раствор нагревают при температуре кипения с обратным холодильником 22 ч, за это время образуется рыжевато-коричневый осадок. Эту смесь охлаждают до комнатной температуры и фильтруют, получая 4- бромфенил гидразиновую соль указанного в заголовке соединения в виде белого порошка (1,69 г). Этот продукт нагревают при температуре кипения с обратным холодильником в ледяной уксусной кислоте (20 мл) в течение 3 ч и охлаждают до комнатной температуры. Полученную рыжевато-коричневую суспензию фильтруют и твердые продукты промывают ледяной уксусной кислотой и затем диэтиловым эфиром, получая указанное в заголовке соединение (1,15 г, 43%) в виде рыжевато-коричневого порошка, Т.пл. 393-394oC; МС (CI): 420 (М+H).
Анализ для C17H9BrClN3O3• 0,30 H2O:
Рассчитано: C, 48.77; H, 2.17 N,10.04;
Найдено: C, 48.52; H, 2.26; N,10.00.
1H ЯМР: 13.84 (br s, 1H, способн. к обмену), 8.71 (s, 1H, способн. к обмену), 8.23 (d, J=8.63 Гц, 1H), 7.89 (d, J=1.98 Гц, 1H), 7.58(dd, J=1.98, 8.63 Гц, 1H), 7.32 (d, J=8.70 Гц, 2H), 6.84(d, J=8.70 Гц, 2H).
Пример 28. 2-(4-Бромфенил)-7-хлор-4-гидрокси-1,2,5,10- тетрагидропиридазино[4,5-b]хинолин-1,10-дион.
Фильтрат, сохраненный от Примера 27, разбавляют водой (550 мл), получая рыжевато-коричневую суспензию, которую перемешивают 2 ч. Суспензию фильтруют и промывают последовательно водой, метанол/диэтиловым эфиром и диэтиловым эфиром, получая указанное в заголовке соединение (0,716 г, 72%) в виде рыжевато-коричневого порошка, Т.пл. 359-361oC; МС (CI): 420 (М+H).
Анализ для C17H9BrClN3O3• 1,30 H2O:
Рассчитано: C, 46.20; H, 2.64; N, 9.51;
Найдено: C, 46.26; H, 2.66; N, 9.37.
1H ЯМР: 12.60 (br s, 1H, способн. к обмену), 11.95 (br s, 1H, способн. к обмену), 8.16 (d, J=8.61 Гц, 1H), 8.06 (d, J=1.67 Гц, 1H), 7.64(d, J=8.78 Гц, 2H), 7.55 (d, J=8.78 Гц, 2H), 7.43 (d, J=8.61 Гц, 1H).
Пример 29. 7-Хлор-1-гидрокси-3-(2-метоксифенил)-3,4,5, 10-тетрагидропиридазино[4,5-b]хинолин-4,10-дион.
Перемешиваемую суспензию 6-хлор-2-(2-метоксианилин)-2,3,4,9- тетрагидро-1H-пирроло[3,4-b] хинолин-1,3,9-триона (1, 78 г, 4,81 мМ) в растворе метанола (285 мл) и метансульфокислоты (89 мл) нагревают при температуре кипения с обратным холодильником 8 ч, за это время образуется рыжевато-коричневый осадок. Полученную суспензию охлаждают до комнатной температуры и перемешивают 16 ч. Суспензию фильтруют (фильтрат сохраняют для использования в Примере 30), собранные твердые продукты промывают метанолом и диэтиловым эфиром, получая указанное в заголовке соединение (0,889 г, 50%) в виде желтого порошка, Т.пл. 356-359oC; МС (CI): 370 (М+H).
Анализ для C18H12ClN3O4• 1,20 CH3ОH:
Рассчитано: C, 56.50; H, 4.15; N,10.30;
Найдено: C, 56.50; H, 4.15; N,10.55.
1H ЯМР: 13.34 (s, 1H, способн. к обмену), 12.45 (s, 1H, способн. к обмену), 8.30 (d, J=8.61 Гц, 1H), 8.21 (s, 1H), 7.63 (d, J=8.61 Гц, 1H), 7.48 (t, J= 8.10 Гц, 1H), 7.40 (d, J=7.46 Гц, 1H), 7.23 (d, J=8.10 Гц, 1H), 7.10 (t, J=7.46 Гц, 1H), 3.77 (s, 3H).
Исходный 6-хлор-2-(2-метоксианилин)-2,3,4,9-тетрагидро-1H- пирроло[3,4-b]хинолин-1,3,9-трион готовят следующим способом:
а. 6-Хлор-2-(2-метоксианилин)-2,3,4,9-тетрагидро-1H-пирроло[3, 4-b]хинолин-1,3,9-трион.
К перемешиваемой суспензии диметил-7-хлор-4-гидрокси- хинолин-2,3-дикарбоксилата (0,218 г, 0,74 мМ) и 2-метоксифенил гидразин гидрохлорида (0,900 г, 5,20 мМ) в этаноле (4 мл) добавляют триэтиламин (0,83 мл, 51,9 мМ). Полученный коричневый раствор нагревают при температуре кипения с обратным холодильником 22 ч. Раствор охлаждают до комнатной температуры и в результате осаждения образуется суспензия рыжевато-коричневого цвета, которую перемешивают 16 ч. Суспензию фильтруют и собранный твердый продукт отбрасывают. Фильтрат разбавляют этилацетатом (50 мл) и промывают хлористоводородной кислотой (3 х 50 мл, 1 н.) и раствором соли (50 мл). Концентрация промытого раствора в токе газообразного азота дает рыжевато- коричневый порошок (0,527 г). Этот продукт нагревают при температуре кипения с обратным холодильником в ледяной уксусной кислоте (5 мл) 2 ч, получая густую рыжевато-коричневую суспензию. Эту суспензию охлаждают до комнатной температуры и перемешивают 16 ч. Суспензию фильтруют и собранные твердые продукты промывают ледяной уксусной кислотой и затем диэтиловым эфиром, получая рыжевато-коричневый порошок (0,378 г). Этот продукт перемешивают в растворе воды (5 мл) и метанола (1 мл), получая рыжевато-коричневую суспензию, которую перемешивают 16 ч. Суспензию фильтруют и собранные твердые продукты промывают последовательно водой, метанолом и затем диэтиловым эфиром указанное в заголовке соединение (0,126 г, 46%) в виде рыжевато-коричневого порошка, Т.пл. 390oC (разл.); МС (CI): 370 (М+H).
Анализ для C18H12ClN3O4• 0,20 H2O:
Рассчитано: C, 57.90; H, 3.35; N, 11.25;
Найдено: C, 57.92; H, 3.48; N,10.93.
1H ЯМР: 13.80 (br s, 1H, способн. к обмену), 8.23 (d, J=8.67 Гц, 1H), 7.89 (d, J=1.98 Гц, 1H), 7.79(s, 1H, способн. к обмену), 7.58 (dd, J=1.98, 8.67 Гц, 1H), 6.97 (d, J=7.62 Гц, 1H), 6.80-6.73 (m, 3H), 3.86 (s, 3H).
Пример 30. 7-Хлор-4-гидрокси-2-(2-метоксифенил)-1,2,5, 10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион.
Фильтрат, сохраненный от Примера 30, разбавляют водой (600 мл), получая рыжевато-коричневую суспензию, которую перемешивают при 0oC в течение 1 ч фильтруют, удаляя твердые продукты. Фильтрат частично концентрируют в токе газообразного азота, получая белую суспензию. Эту суспензию фильтруют и названные твердые продукты промывают водой, получая указанное в заголовке соединение (0,347 г, 19%) в виде белого порошка, Т.пл. 347-349oC; МС (CI): 370 (М+H).
Анализ для C18H12ClN3O4• 1,30 H2O•0,10CH3SO3H:
Рассчитано: C, 54.00; H, 3.75; N,10.43;
Найдено: C, 54.07; H, 3.33; N,10.41.
1H ЯМР: 12.68 (br s, 1H, способн. к обмену), 12.00 (br s, 1H, способн. к обмену), 8.16 (d, J=8.61 Гц, 1H), 8.07 (s, 1H), 7.48- 7.40 (m, 2H), 7.32 (d, J= 7.59 Гц, 1H), 7.16 (d, J=8.31, Гц, 1H), 7.05 (t, J=7.59 Гц, 1H), 3.75 (s, 3H).
Пример 31. 7-Хлор-4-гидрокси-2-(2-гидроксифенил)- 1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион.
Раствор 7-хлор-4-гидрокси-2-(2-метоксифенил)-1,2,5,10- тетрагидропиридазино[4,5-b] хинолин-1,10-диона (0,288 г, 0,78 мМ) в метансульфокислоте (5 мл) нагревают при 140oC 7 ч и охлаждают до комнатной температуры. Коричневый раствор разбавляют водой (5 мл), что вызывает экзотермический разогрев до 80oC и выпадение осадка с образованием коричневой суспензии.
Эту суспензию разбавляют затем водой (10 мл) и фильтруют. Собранные твердые продукты промывают водой (25 мл) и диэтиловым эфиром, что дает коричневый твердый продукт (0,23 г). Этот продукт суспендируют в воде (13 мл) и добавляют раствор гидроокиси холина (45 вес.% в метаноле, 0,5 мл), получая коричневый раствор. Этот раствор нагревают до 50oC в течение 2 ч и охлаждают до комнатной температуры. Добавляют соляную кислоту (5 мл, 1 н.), получая серую суспензию. Эту суспензию фильтруют и собранные твердые продукты промывают водой и затем диэтиловым эфиром, получая указанное в заголовке соединение (0,225 г, 81%) в виде серого порошка, Т.пл. >400oC; МС (CI): 356 (М+H).
Анализ для C17H10ClN3O4• 0,80 H2O•0,10C4H10O:
Рассчитано: C, 55.35; H, 3.36 N, 11.13;
Найдено: C, 55.53; H, 3.00; N,10.89.
1H ЯМР: 12.68 (s, 1H, способн. к обмену), 12.01 (s, 1H, спосбн. к обмену), 9.53(5, 1H, способн. к обмену), 8.16 (d, J=8.18 Гц, 1H), 8.06 (s, 1H), 7.46 (d, J=8.18, Гц, 1H), 7.23 (m, 2H), 6.95 (d, J=7.80 Гц, 1H), 6.87 (t, J=7.17 Гц, 1H).
Пример 32. 7-Хлор-4-гидрокси-3-(3-метоксифенил)-3,4,5, 10-тетрагидропиридазино[4,5-b]хинолин-4,10-дион
Перемешиваемую суспензию 6-хлор-2-(3-метоксианилин)-2,3,4,9-тетрагидро-1H- пирроло[3,4-b]хинолин-1,3,9-триона (1, 85 г, 5,00 мМ) в растворе метанола (0,93 л) и метансульфокислоты (93 мл) нагревают при температуре кипения с обратным холодильником 16 ч, получая рыжевато-коричневую суспензию. Эту суспензию охлаждают до комнатной температуры и перемешивают 24 ч. Суспензию фильтруют (фильтрат сохраняют для использования в Примере 33), собранные твердые продукты промывают метанолом и затем диэтиловым эфиром, что дает указанное в заголовке соединение (0,385 г, 21%) в виде рыжевато-коричневого порошка, Т.пл. 393-395oC; МС (CI): 370 (М+H).
Анализ для C18H12ClN3O4• 0,50 H2O•0,05 CH3ОH:
Рассчитано: C, 57.00; H, 3.50; N, 11.05;
Найдено: C, 56.73; H, 3.11; N,10.98.
1H ЯМР: 13.35 (s, 1H, способн. к обмену), 12.47 (s, 1H, способн. к обмену), 8.28 (d, J= 8.75 Гц, 1H), 8.20 (d, J=1.83 Гц, 1H), 7.60 (dd, J=1.83, 8.75 Гц, 1H), 7.47-7.42 (t, J=8.06 Гц, 1H), 7.28-7.26 (m, 2H), 7,01 (dd, J= 1.38, 8.06 Гц, 1H), 3.81 (s, 3H).
Исходный 6-хлор-2-(3-метоксианилин)-2,3,4,9-тетрагидро-1H-пирроло [3,4-b]хинолин-1,3,9-трион получают следующим способом:
а. 6-Хлор-2-(3-метоксианилин)-2,3,4,9-тетрагидро-1H- пирроло[3,4-b]хинолин-1,3,9-трион.
К перемешиваемой суспензии диметил-7-хлор-4-гидро-ксихинолин-2,3-дикарбоксилата (4,61 г, 15,6 мМ) и 3-метоксифенил гидразин гидрохлорида (19,10 г, 109 мМ) в этаноле (84 мл) добавляют триэтиламин (17,4 мл, 125 мМ). Полученный коричневый раствор нагревают при температуре кипения с обратным холодильником 40 ч и охлаждают до комнатной температуры. Добавляют этилацетат (430 мл) для получения рыжевато- коричневой суспензии. Эту суспензию фильтруют для удаления твердых продуктов, которые отбрасывают. Фильтрат промывают хлористоводородной кислотой (3 х 750 мл, 1 н.), что вызывает осаждение этилацетатного слоя. Этот этилацетатный раствор фильтруют, получая рыжевато-коричневый твердый продукт (0,940 г). Фильтрат сохраняют. Объединенные хлористоводородные промывные воды повторно экстрагируют этилацетатом и эти экстракты объединяют с оставленным ранее этилацетатным фильтратом. Этот раствор концентрируют, получая твердый продукт, который растирают с диэтиловый эфир/этилацетатом, получая рыжевато-коричневую суспензию. Эту суспензию фильтруют, что дает вторую порцию рыжевато-коричневого твердого вещества (1,60 г). Фильтрат концентрируют до твердого продукта с диэтиловый эфир/этилацетатом, получая суспензию. Эту суспензию фильтруют, получая третий сбор рыжевато-коричневого твердого продукта (0,70 г). Твердые продукты сохраненные после вышеописанных фильтраций объединяют (3,24 г) и нагревают при температуре кипения с обратным холодильником в ледяной уксусной кислоте (32 мл) в течение 3 ч. Полученную суспензию охлаждают до комнатной температуры и перемешивают 16 ч. Эту суспензию фильтруют и собранные твердые продукты промывают ледяной уксусной кислотой и затем диэтиловым эфиром, получая указанное в заголовке соединение (1,93 г, 33%) в виде рыжевато-коричневого порошка, Т.пл. 369oC (разл.); МС (CI): 370 (М+H).
Анализ для C18H12ClN3O4• 0,50 H2O:
Рассчитано: C, 57.10; H, 3.46; N, 11.10
Найдено: C, 57.21; H, 3.53; N,10.86.
1H ЯМР: 13.75 (br s, 1H, способн. к обмену), 8.51(br s, 1H, способн. к обмену), 8.23(d, J=8.69 Гц, 1H), 7.89(d, J=1.87 Гц, 1H), 5.58 (dd, J=1.87, 8.69 Гц, 1H), 7.08 (t, J=7.96 Гц, 1H), 6.42-6.39 (m, 3H), 3.69 (s, 3H).
Пример 33. 7-Хлор-4-гидрокси-2-(3-метоксифенил)-1,2,5,10- тетрагидропиридазино[4,5-b]хинолин-1,10-дион.
Фильтрат, неиспользованный и сохраненный от Примера 32, разбавляют водой/льдом (1,0 л), получая коричневую суспензию, которую перемешивают 16 ч. Суспензию фильтруют и собранные твердые продукты промывают водой и затем диэтиловым эфиром, получая указанное в заголовке соединение (1,04 г, 56%) в виде рыжевато- коричневого порошка, Т.пл. 312-315oC; МС (CI): 370 (М+H).
Анализ для C18H12ClN3O4• 0,20 H2O•0,10 CH3SO3H:
Рассчитано: C, 56.80; H, 3.37; N,10.97.
Найдено: C, 56.90; H, 3.55; N,10.93.
1H ЯМР: 8.17 (d, J=8.64 Гц, 1H), 8.06 (d, J=1.71 Гц, 1H), 7.43 (dd, J= 1.71, 8.64 Гц, 1H); 7.36 (t, J=8.49 Гц, 1H), 7.15-7.12 (m, 2H), 6,93 (d, J= 8.49 Гц, 1H), 3.79 (s, 3H).
Пример 34. 7-Хлор-4-гидрокси-2-(3-гидроксифенил)-1,2,5, 10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион.
Раствор 7-Хлор-4-гидрокси-2-(3-метоксифенил)-1,2,5,10- тетрагидропиридазино[4,5-b] хинолин-1,10-диона (0,600 г, 1,62 мМ) в метансульфокислоте (12 мл) нагревают при 130-140oC 3,5 ч и охлаждают до комнатной температуры. Коричневый раствор разбавляют водой (36 мл), что вызывает экзотермическое выделение тепла и выделение осадка, образующего коричневую суспензию. Эту суспензию фильтруют и полученные твердые вещества промывают водой (50 мл) и диэтиловым эфиром, получая коричневый твердый продукт (0,447 г). Этот продукт суспендируют в воде (26 мл) и добавляют раствор гидроокиси холина (45 вес. % в метаноле, 1,5 мл), получая коричневый раствор. Этот раствор нагревают до 50oC 3 ч и охлаждают до комнатной температуры. Добавляют хлористоводородную кислоту (10 мл, 1 н.) и получают коричневую суспензию, которую фильтруют. Собранные твердые продукты промывают водой и затем диэтиловым эфиром, получая коричневый порошок (0,302 г). Этот коричневый порошок суспендируют в метаноле и полученную суспензию концентрируют до остающегося коричневого твердого продукта. Твердый продукт суспендируют в метаноле и концентрируют два дополнительных раза, получая указанное в заголовке соединение (0,260 г, 45%) в виде коричневого порошка, Т.пл. 333oC (разл.); МС (CI): 356 (М+H).
Анализ для C17H10ClN3O4• 1,0 H2O•1,40 HCL:
Рассчитано: C, 48.1; H, 3.18; N, 9.89
Найдено: C, 48.5; H, 3.16; N, 9.45.
1H ЯМР: 9.6(br s, 1H, способн. к обмену), 8.15(br s, 1H), 8.06(br s, 1H), 7.46(br s, 1H), 7.23(br s, 1H), 6.95(br s, 1H), 6.75(br s, 1H).
Пример 35. 7-Хлор-4-гидрокси-2-(4-трифторметоксифенил)-1, 2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион.
К перемешиваемой суспензии 3-карбометокси-7-хлор-4-гидро- ксихинолин-2-карбоновой кислоты N-2-(4-трифторметоксифенил)- гидразида (600 мг, 1,3 мМ) в метаноле (85 мл) при температуре окружающей среды добавляют метансульфокислоту (3 мл). Реакционную смесь нагревают при температуре кипения с обратным холодильником 68 ч, за это время образуется небольшое количество осадка. Твердый продукт удаляют фильтрацией. Добавляют воду (150 мл) к фильтрату, получая светлую суспензию, которую отделяют вакуумной фильтрацией и сушат над пятиокисью фосфора, получая указанное в заголовке соединение (467 мг, 84%) в виде твердого вещества персикового цвета, Т.пл. 320-322oC; МС (CI): 424 (М+H).
Анализ для C18H9N3O4F3Cl• 0,8 H2O:
Рассчитано: C, 49.34; H, 2.44; N, 9.59
Найдено: C, 49.01; H, 2.10; N, 9.55.
1H ЯМР: 12.07(br s, 1H, способн. к обмену), 8.16(d, J=8.64 Гц,-1H), 8.06(5, 1H), 7.71 (d, 2H, J=8.82), 7.45-7.50 (m, ЗH).
Исходный 3-карбометокси-7-хлор-4-гидроксихинолин-2-карбоновой кислоты N-2-(4-трифторметоксифенил)гидразид получают следующим способом:
а. 3-Карбометокси-7-хлор-4-гидроксихинолин-2-карбоновая кислота
К перемешиваемой суспензии диметил-7-хлор-4-гидрокси- хинолин-2,3-дикарбоксилата (1,0 г, 3,38 мМ) в воде (20 мл) добавляют водный раствор гидроокси натрия (0,27 мл, 6,75 мМ). В процессе добавления суспензия растворяется. Реакционную смесь нагревают при 60oC 1 ч. По окончании этого времени реакционную смесь охлаждают до комнатной температуры и подкисляют концентрированной соляной кислотой. Продукт экстрагируют затем диэтиловым эфиром и диэтилацетатом. Органические экстракты сушат над сульфатом магния, фильтруют и концентрируют в вакууме, получая указанное в заголовке соединение в виде неочищенного твердого продукта (900 мг). Этот продукт чистят перекристаллизацией, используя систему смешанного растворителя этилацетат/гексан, что дает указанное в заголовке соединение (571 мг, 60%) в виде белого твердого вещества, Т.пл. 296oC (разл.); МС (CI)=238(М+H).
Анализ для C12H8NO5Cl• 0,45 CH3CО2CH2CH3•0,10 H2O:
Рассчитано: C, 51.30, H, 3.68; N, 4.34
Найдено: C, 51.28; H, 3.62; N, 3.97.
1H ЯМР: 8.22 (d, J=8.7 Гц, 1H), 7.92 (d, J=1.8 Гц, 1H), 7.28 (dd, J=8.7, 1.8, Гц, 1H), 3.90 (s, 3H).
b. 3-Карбометокси-7-хлор-4-гидроксихинолин-2-карбоновой кислоты N-2-(4-трифторметоксифенил) гидразид.
Свободное основание 4-(трифторметокси)фенилгидразина получают из хлористоводородной соли путем обработки суспендированной соли (400 мг, 1,75 мМ) в этилацетате (50 мл) 2 н. гидроокисью натрия (50 мл). Органический слой отделяют, сушат над сульфатом магния и концентрируют в вакууме, получая свободное основание 4- (трифторметокси)фенилгидразина (325 мг, 1,69 мМ). Этот продукт помещают в безводный тетрагидрофуран (5 мл) и охлаждают до 0oC в атмосфере азота. Одновременно, 3-карбометокси- 7-хлор-4-гидроксихинолин-2-карбонил хлорид получают из 3-карбометокси-7-хлор-4-гидроксихинолин-2-карбоновой кислоты (121 мг, 0,43 мМ) нагреванием при 60oC в тионилхлориде (4 мл). Через 3 часа неочищенный хлорангидрид выделяют отгонкой избытка тионил хлорида. Сырой 3-карбометокси-7-хлор-4-гидроксихинолин-2- карбонил хлорид (130 мг, 0,43 мМ) помещают затем в безводный тетрагидрофуран (3 мл) при температуре окружающей среды и добавляют через стеклянную трубку к раствору 4-(трифторметокси) фенил гидразина. Через 30 мин реакционную смесь выливают в 1,0 н. хлористоводородную кислоту, вызывающую осаждение. Твердый продукт выделяют, получая указанное в заголовке соединение (185 мг, 95%) в виде не совсем белого твердого вещества, Т.пл. 346-350oC; МС 456 (М+H).
1H ЯМР 12.67(3, 1H, способн. к обмену),10.79(5, 1H, способн. к обмену), 8.37(br s, 1H, способн. к обмену), 8.13 (d, J=8.61 Гц, 1H), 7.83(d, J=1.76 Гц, 1H), 7.48(dd, J=8.61, 1.76 Гц, 1H), 7.21(d, J=8.50 Гц, 2H,), 6.94(d, J= 8.50 Гц, 2H), 3.70(s, ЗH).
Пример 36. 7-Хлор-3-(3-хлор-4-метоксифенил)-1-гидрокси-3,4, 5,10-тетрагидропиридазино[4,5-b]хинолин-4,10-дион;
Перемешиваемый раствор 3-карбометокси-7-хлор-4-гидроксихинолин-2- карбоновой кислоты N-2-(3-хлор-4-метоксифенил) гидразида (2,25 г, 5,16 мМ) в метаноле (1,13 л) и метансульфокислоте (113 мл) нагревают при температуре кипения с обратным холодильником в течение 1 ч, за это время образуется коричневый осадок. Эту суспензию охлаждают до комнатной температуры, перемешивают 16 ч и фильтруют (фильтрат сохраняют для использования в Примере 37). Собранные твердые продукты промывают метанолом и затем диэтиловым эфиром, получая указанное в заголовке соединение (0,153 г, 7%) в виде желтого порошка, Т.пл. 395-396oC; МС (CI): 404 (М+H).
Анализ для C18H11Cl2N3O4• 1,20 H2О:
Рассчитано: C, 50.70; H, 3.17; N, 9.87
Найдено: C, 50.33; H, 2.87; N, 9.61.
1H ЯМР: 13.36(3, 1H,способн.к обмену), 12.50(s,1H, способн. к обмену), 8.28(d, J= 8.78 Гц, 1H), 8.22(d, J=1.74 Гц, 1H), 7.77(d, J=2.42, Гц, 1H), 7.67(dd, J= 2.42, 8.91 Гц, 1H,), 7.62(dd, J=1.74, 8.78Гц, 1H,), 7.30(d, J= 8.91 Гц, 1H), 3.94(s, 3H).
Исходный 3- карбометокси-7-хлор-4-гидроксихинолин-2-карбо-новой кислоты N-2-(3-хлор-4-метоксифенил)гидразид получают приведенным ниже способом:
а. 3-Хлор-4-метоксифенилгидразин
Раствор 3-хлор-п-анизидин гидрохлорида (10 г, 52 мМ) в соляной кислоте (48 мл, 12 н) охлаждают до -10oC. К реакционной смеси медленно добавляют раствор нитрита натрия (3,56 г, 52 мМ) в воде (19,5 мл), так чтобы температура не превышала -5oC. Затем реакционную смесь перемешивают 1 ч при 0oC. Полученный раствор соли диазония добавляют затем к охлажденному (0oC, ледяная баня) раствору дигидрата хлорида олова. (44 г, 193 мМ) в соляной кислоте (29 мл, 12 н.) при такой скорости, чтобы температура не превышала 5oC. Образуется пурпурного цвета пенистая суспензия, и после добавления воды (20 мл), смесь перемешивают 3 ч при 0oC. Пурпурный твердый продукт отфильтровывают, промывают этилацетатом и затем добавляют водный раствор бикарбоната натрия. Образовавшуюся смесь растворяют в этилацетате и всю смесь фильтруют для отделения нерастворимых солей олова. Собранные соли олова промывают водой и этил-ацетатом. Этилацетатный слой от начальной фильтрации и этил-ацетат из промывных вод для солей олова объединяют, сушат над сульфатом магния и концентрируют до получения указанного в заголовке соединения (4,49 г, 51%) в виде коричневого твердого продукта МС(CI): 172 (М-1) 1H ЯМР 6.94-6.90 (m, 2H), 6.71 (dd, J=2.70, 9.00 Гц, 1H,), 3.73 (s, 3H).
b. 3-карбометокси-7-хлор-4-гидроксихинолин-2-карбоновой кислоты N-2-(3-хлор-4-метоксифенил) гидразид.
К раствору 3-хлор-4-метоксифенил гидразина (4.26 г, 24.7 мМ) в 35b) в тетрагидрофуране (200 мл) добавляют раствор 3-карбометокси-7-хлор-4-гидроксихинолин-2-карбонил хлорида (3,54 г, 11,8 мМ, как получено в примере 35b) в тетрагидрофуране (100 мл) при 0oC. Полученную желтую суспензию перемешивают при 0oC 30 мин и разбавляют водой (200 мл), получая желтый раствор. Этот раствор разбавляют затем соляной кислотой (600 мл, 1 н.), получая суспензию рыжевато-коричневого цвета, которую перемешивают 1 ч. Суспензию фильтруют (фильтрат сохраняют) и собранные твердые продукты промывают водой и затем диэтиловым эфиром, получая указанное в заголовке соединение (2,30 г 45%) в виде порошка рыжевато-коричневого цвета, МС(CI): 436 (М+H), которое использовали в ранее описанном синтезе для 7-хлор-3- (3-хлор-4-метоксифенил)-1-гидрокси-3,4,5,10-тетрагидропири-дазино [4,5-b]хинолин-4,10-диона.
1H ЯМР: 12.69 (s, 1H, способн. к обмену),10.72 (s, 1H, способн. к обмену), 8.14 (d, J=8.50 Гц, 1H), 8.00(br s, 1H, способн. к обмену), 7.76 (s, 1H), 7.48(d, J=8.50 Гц, 1H), 7.05 (d, J=8.80 Гц, 1H), 6.98 (d, J=2.28, Гц, 1H), 6.85 (dd, J=2.28, 8.80 Гц, 1H,), 3.78(s, 3H), 3.70(s, 3H).
После выдерживания в течение пяти дней наблюдается дальнейшее образование осадка в вышеупомянутом сохраненном кислотном фильтрате. Твердые продукты собирают, получая вещество (1,80 г), содержащее смесь указанного в заголовке соединения (60%). 7-хлор-2-(3-хлор-4-метоксифенил)-1-гидрокси-1,2,5,10- тетрагидропиридазино[4,5-b]хинолин-1,10-диона (35%) и 7-хлор- 3-(3-хлор-4-метоксифенил)-1-гидрокси-3,4,5,10-тетрагидропиридазино[4,5-b]хинолин-4,10-диона (5%).
Пример 37. 7-Хлор-2-(3-хлор-4-метоксифенил)-4-гидрокси-1, 2, 5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион.
Фильтрат, сохраненный от Примера 36, концентрируют приблизительно до 500 мл и разбавляют водой/льдом (1,1 л), получая светло-зеленую суспензию, которую перемешивают 3 ч. Суспензию фильтруют и собранные твердые продукты ресуспендируют в воде (500 мл) и перемешивают 16 ч. Эту суспензию фильтруют собранные твердые продукты последовательно промывают водой, ацетонитрил/диэтиловым эфиром и затем диэтиловым эфиром, получая указанное в заголовке соединение (1,42 г, 68%) в виде зеленого порошка, Т.пл. 348-351oC; МС (CI): 404 (М+H).
Анализ для C18H11Cl2N3O4• 1,20 H2О•0,50 CH3SO3H:
Рассчитано: C, 46.89; H, 3.27; N, 8.87
Найдено: C, 46.54; H, 2.96; N, 8.91.
1H ЯМР: 12.82(br s, 1H, способн. к обмену), 12.05(br s, 1H, способн. к обмену), 8.16(d, J=9.01 Гц, 1H), 8.06(d, J=1.56 Гц, 1H), 7.64(dd, J=2.37 Гц, 1H), 7.52(dd, J=2.37, 8.89 Гц, 1H), 7.45(dd, J=1.56, 9.01 Гц, 1H), 7,23(d, 8.89 Гц, 1H), 3.91(s, ЗH).
Пример 38. 7-Хлор-2-(2-метоксипирид-5-ил)-4-гидрокси-1,2, 5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион.
К охлажденному (ледяная баня) перемешиваемому раствору 5-гидразино- 2-метоксипиридина (0,839 г, 6,03 мМ) в безводном ТГФ (40 мл) добавляют по каплям раствор 3-карбометокси-7-хлор-4-гидрокси хинолин-2-карбонилхлорида (1,67 г, 5,59 мМ) в ТГФ (40 мл). После перемешивания при 0oC в течение 3 ч реакционной смеси дают охладиться до комнатной температуры и перемешивают дополнительно 17 ч. Реакционную смесь разбавляют водой/этилацетатом (30 мл/40 мл) и pH полученной смеси доводят до 4, добавляя 2 н. гидроокись натрия. Полученную смесь фильтруют и собранные органические продукты растирают затем в теплом метаноле (10 мл) и фильтруют, выделяя указанное в заголовке соединение (0,17 г, 5,7%) в виде коричневого твердого продукта, Т.пл. 235-237oC (разл.); МС (CI): 371 (М+H).
Анализ для C17H11ClN4O4• 1,45 H2О:
Рассчитано: C, 51.45; H, 3.53; N, 14.12
Найдено: C, 51.26; H, 2.95; N, 14.18.
1H ЯМР: 12.88 (br s, 1H, способн. к обмену), 12.09 (br s, 1H, способн. к обмену), 8.34 (d, J= 2.24 Гц, 1H), 8.16 (d, J=7.65 Гц, 1H), 8.05 (s, 1H), 7.85 (dd, J= 8.7, 2.24 Гц, 1H), 7.46 (d, J=7.6, Гц, 1H), 6.93(d, J=8.7 Гц, 1H), 3.88 (s, 3H).
Исходные 3-карбометокси-7-хлор-4-гидроксихинолин-2-карбонил хлорид и 5-гидразин-2-метоксипиридин получают следующим способом
а. 3-Карбометокси-7-хлор-4-гидроксихинолин-2-карбонил хлорид.
После нагревания с обратным холодильником смеси 3-карбометокси-7-хлор-4-гидроксихинолин-2-карбоновой кислоты (1,56 г, 5,6 мМ) и тионил хлорида (5 мл, 68,5 мМ) в метиленхлориде (12 мл) в течение 2 ч, полученный мутный раствор концентрируют, оставляя твердые продукты, которые снова обрабатывают ТГФ и концентрируют, после чего остается неочищенное указанное в заголовке соединение (1,67 г,100%) в виде твердого вещества кремового цвета.
b. 5-Гидразин-2-метоксипиридин
К перемешиваемому охлажденному раствору (-10oC) 5-амино-2-метоксипиридина (5,01 г, 40,4 MM) в концентрированной соляной кислоте (50 мл) добавляют по каплям раствор нитрита натрия (2,9 г, 42 мМ) в воде (10 мл). После перемешивания при -10oC в течение 10 мин реакционную смесь добавляют порциями к охлажденному (-20oC) перемешиваемому раствору дигидрата хлорида двухвалентного олова (22,9 г, 101 мМ) в концентрированной соляной кислоте (15 мл). Полученную густую смесь разбавляют водой (10 мл) и концентрированной соляной кислотой (15 мл) и продолжают перемешивание при -10oC дополнительно 1 ч. Затем смесь фильтруют и собранные твердые продукты промывают диэтиловым эфиром (три порции по 40 мл) и сушат в вакууме до получения неочищенной соли гидрохлорида (7,03 г, 125%) указанного в заголовке соединения в виде твердого вещества розового цвета. Часть (3,97 г, 22 мМ) этого вещества суспендируют в этилацетат/диэтиловом эфире (75 мл/25мл) и добавляют 2 н. гидроокись натрия к образовавшейся перемешиваемой суспензии до достижения pH 6,5. После перемешивания в течение 15 мин, органическую фазу отделяют и водную фазу экстрагируют дважды 50 мл порциями этилацетат/диэтиловым эфиром (1:1). Органические фазы объединяют, сушат (MgSO4), фильтруют и концентрируют до получения указанного в заголовке соединения (0,839 г, 27%) в виде сырого твердого продукта, который используют без дальнейшей очистки.
Пример 39. 7-Хлор-4-гидрокси-2-(4-метокси-2-метилфенил)- 1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион.
К перемешиваемой суспензии 7-хлор-3-метоксикарбонил-4-оксо-1,4- дигидро-хинолин-2-карбоновой кислоты N-2-(4-метокси-2- метилфенил)гидразида (3,0 мг, 7,2 мМ) и твердых продуктов (0,6 г, 1,6 мМ смеси, состоящей из 7-хлор-4-гидрокси-2-(4-метокси-2- метилфенил)-1,2,5,10-тетрагидропиридазино[4,5-b] хинолин-1, 10-диона и 6-хлор-2-(4-метокси-2-метиланилин)-2,3,4,9- тетрагидро-1H-пиррол[3,4-b] хинолин-1,3,9-триона), собранных из концентрированного фильтрата, описанного в Примере 1а), ниже, в метаноле (500 мл) добавляют метансульфоновую кислоту (50 мл) и полученную перемешиваемую суспензию нагревают при температуре кипения с обратным холодильником 7 ч. Образовавшийся раствор перемешивают при комнатной температуре в течение ночи и затем разбавляют 600 мл лед/вода, получая рыжевато-коричневую суспензию. После перемешивания в течение 2 ч, суспензию фильтруют, получая твердый продукт (2,8 г,100%). Перекристаллизация этого вещества из кипящего метанола (500 мл) дает указанное в заголовке соединение в виде белого порошка (1,7 г, 61%), Т. пл. 354-356oC.
Анализ для C19H14ClN3O4• 1,5 H2О•0,2 CH3ОH•0,2 (C2H5)2O:
Рассчитано: C, 55.60; H, 4.62; N, 9.73
Найдено: C, 55.25; H, 4.35; N, 9.60.
1H ЯМР (ДMCO-d6): 12.74(br s, 1H, способн. к обмену), 12.00(br s, 1H, способн. к обмену), 8.16(d, J=8.8 Гц, 1H), 8.06 (s, 1H), 7.46(d, J=8.8 Гц, 1H), 7.21(d, J= 8.6 Гц, 1H), 6.91 (s, 1H), 6.85(d, J=8.6 Гц, 1H), 3.79 (s, 3H), 2.08 (s, 3H).
Исходный 7-хлор-3-метоксикарбонил-4-оксо-1,4-дигидро-хинолин-2- карбоновой кислоты N-2-(4-метокси-2-метилфенил)-гидразид получают следующим способом:
а. 7-Хлор-3-метоксикарбонил-4-оксо-1,4-дигидро-хинолин-2- карбоновой кислоты N-2-(4-метокси-2-метилфенил)гидразид.
4-Метокси-2-метилфенилгидразин гидрохлорид (4,7 г, 25 мМ) распределяют между диэтиловым эфиром (300 мл) и 2 н. гидроокисью натрия (50 мл). Эфирный слой отделяют и водный слой экстрагируют дополнительным количеством диэтилового эфира (300 мл). Объединенный эфирный экстракт сушат (MgSO4), фильтруют и концентрируют до остаточного свободного гидразина в виде желтого порошка. Этот гидразин растворяют в безводном тетрагидрофуране (180 мл). После охлаждения полученного янтарно-желтого раствора до 0oC раствор 7-хлор-3-метоксикарбонил-4-оксо-1,4- дигидрохинолин-2-карбонил хлорида (3,0.г, 10,0 мМ) в ТГФ (90 мл) добавляют по каплям за 15 мин. По завершении добавления, полученную желтую суспензию перемешивают при 0oC в течение 30 мин и затем 2 ч при комнатной температуре. Реакцию прерывают, добавляя ~200 г воды/льда и затем 500 мл охлажденной соляной кислоты. Полученную желтую суспензию перемешивают 1 ч и желтые твердые продукты собирают фильтрацией, промывают водой, затем диэтиловым эфиром и сушат на воздухе до получения указанного в заголовке соединения в виде белого твердого порошка (3,3 г, 79%). Фильтрат частично концентрируют для удаления основной части ТГФ и полученную суспензию фильтруют, что дает дополнительно ~0,6 г твердого вещества, содержащего (ВДЖХ анализ) 35% 7-хлор-4-гидрокси-2-(4-метокси-2-метилфенил)-1,2,5,10-тетрагидропиридазино[4,5-b] хинолин-1,10-диона и 65% 6-хлор-2-(4-метокси-2-метиланилин)-2,3,4,9-тетрагидро-1H-пирроло[3,4-b] хинолин-1,3,9-триона.
7-Хлор-3-метоксикарбонил-4-оксо-1,4-дигидрохинолин-2-карбонил хлорид, используемый в Примере 39а, получают следующим способом:
b. 7-хлор-3-метоксикарбонил-4-оксо-1,4-дигидрохинолин-2- карбонил хлорид.
К перемешиваемой суспензии 7-хлор-3-метоксикарбонил-4-оксо-1,4- дигидрохинолин-2-карбоновой кислоты (полученной из сложного эфира) (35,0 г, 0,124 М) в свободном от спирта хлороформе (850 мл) в атмосфере азота добавляют за одну порцию тионилхлорид (60,3 г, 37 мл, 0,507 М). Полученную смесь нагревают при температуре кипения с обратным холодильником до превращения в раствор (1,5 ч). После охлаждения до комнатной температуры раствор концентрируют, используя роторный испаритель (температура бани = 25oC), до получения рыжевато-коричневого твердого вещества. Этот продукт сушат в вакууме при комнатной температуре в течение двух дней, что дает названный в заголовке хлорангидрид (34,7 г, 93,2%) в виде рыжевато-коричневого твердого вещества.
2-Метил-4-метоксифенилгидразин гидрохлорид, использованный в Примере 39а, получают следующим способом:
с) 2-Метил-4-метоксифенилгидразин гидрохлорид.
Раствор нитрата натрия (5,60 г, 81,2 мМ) в воде (56 мл) добавляют в течение 20 мин к механически перемешиваемой суспензии 2-метил-4-метоксианилина (10,42 мл, 81,0 мМ) в смеси 12 н. HCl (60 мл) и воды (64 мл), выдерживаемой при -5oC. Темный раствор охлаждают до -15oC за 15 мин и добавляют в течение 30 мин раствор SnC12•2H2O (53,3 г, 236,2 мМ) в 12 н. HCl (36 мл), поддерживая температуру между -15 и -10oC. Розовую суспензию перемешивают 30 мин при -15oC и добавляют по каплям этанол (25 мл). Суспензию перемешивают при -15oC 3 ч и фильтруют в N2 (газ). Фильтрация выполняется при -10oC (воронка с двойными стенками) и занимает 2 ч. Слежавшийся осадок отсасывают досуха и промывают 50% этанол/диэтиловым эфиром (200 мл) и
диэтиловым эфиром (500 мл). Твердый продукт сушат в токе N2 (газ) 20 ч, получая хлористоводородную соль указанного в заголовке соединения (8,60 г, 56%) в виде серого порошка, Т.пл.=107 (разл.); МС (CI): 152 (М+H).
Анализ для C8H12N3O•HCl• H2О:
Рассчитано: C, 46.49; H, 7.32; N, 13.55
Найдено: C, 46.46; H, 6.92; N, 13.00. 300 Гц
1H ЯМР (ДМСО-d6):10.01 (s, ЗH, способн. к обмену), 7.48 (br s, 1H, способн. к обмену), 6.94 (d, J=8.8 Гц, 1H), 6.77-6.74 (m, 2H), 3.70 (s, 3H), 2.19 (s, 3H).
Пример 39(2). Альтернативный синтез 7-хлор-3-метоксикарбонил-4-оксо-1,4-дигидрохинолин-2-карбоновой кислоты N-2-(4-мето- кси-2-метилфенил)гидразида приведен ниже.
4-Метокси-2-метилфенилгидразин гидрохлорид (11,38 г, 60,32 мМ) суспендируют в сухом тетрагидрофуране (264 мл) в атмосфере аргона и обрабатывают 2,6-лутидином (14,06 мл 120,6 мМ). Эту реакционную смесь охлаждают на ледяной бане и добавляют раствор 7-хлор-3-метоксикарбонил-4-оксо-1,4-дигидрохинолин-2-карбонил хлорида (18,14 г, 60,32 мМ) в ТГФ (328 мл) со скоростью, позволяющей поддерживать температуру реакционной смеси при 2-5oC. После завершения добавления, реакционную смесь перемешивают 25 мин при 0-2oC и затем добавляют при перемешивании к охлаждаемой льдом 1,0 н. HCl (1300 мл). Перемешивание продолжают несколько часов, пока смесь не превратится в свободно текущую суспензию. Твердые продукты отделяют фильтрацией, промывают водой и сушат на воздухе, получая указанное в заголовке соединение (17,57 г, 70%) в виде рыжевато-коричневого твердого продукта, который циклизуют до указанного в заголовке соединения (39), используя стандартные условия. Примечание: 2,6-ди-трет-бутилпиридин может быть использован вместо 2,6-лутидина(2,6-диметилпиридина) в приведенной выше методике.
Пример 40. N-Метил-глюкаминовая соль 7-хлор-4-гидрокси-2-(4- метокси-2-метилфенил)-1,2,5,10-тетрагидропиридазино[4,5-b] хинолин-1,10-диона.
7-Хлор-4-гидрокси-2-(4-метокси-2-метилфенил) -1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион (0,45 г, 1,17 мМ) перемешивают в метаноле (20 мл) и добавляют N-метил-D-глюкамин (0,23 г, 1,17 мМ) до получения прозрачного желтого раствора. Этот раствор концентрируют и остаток растворяют в воде (20 мл), получая желтый раствор. Этот раствор фильтруют через Gelman 0,45 um Acrodisc и концентрируют, получая желтый остаток. Остаток растворяют с 2-пропанолом (20 мл), получая желтую суспензию. Твердые продукты собирают и промывают 2-пропанолом, получая указанное в заголовке соединение (0,20 г, 29%) в виде желтого порошка, Т.пл. 177oC (разл.).
Анализ для C19H14ClN3O4• C7H18NO5•1,5 H2O:
Рассчитано: C, 51.53; H, 5.65; N, 9.24
Найдено: C, 51.17; H, 5.28; N, 8.88
300 Гц 1H ЯМР (ДМСО-d6): 8.14 (s, 1H), 8.10 (d, J=8.6 Гц, 1H), 7.33 (d, J= 8.6 Гц, 1H), 7.06(d, J=8.0 Гц, 1H), 6.76 (br m, 2H), 3.84 (m, 1H), 3.76 (s, 3H), 3.65-3.56 (m, 2H), 3.48-3.38 (m, 3H), 2.95-2.87 (m, 2H), 2.51-2.46 (m, 3H), 2.02 (s, 3H).
Пример 41. 7-Хлор-3-(4-хлор-2-метилфенил)-4-гидрокси-3,4, 5,10-тетрагидропиридазино[4,5-b]хинолин-4,10-дион.
7-Хлор-3-метоксикарбонил-4-оксо-1,4-дигидрохинолин-2-карбоновой кислоты N-2-(4-хлор-2-метилфенил)гидразид (2,00 г, 4,76 мМ) суспендируют в метаноле (1,0 л) и добавляют быстрыми каплями при хорошем перемешивании метансульфокислоту (100 мл). Полученную желтую суспензию нагревают с обратным холодильником четыре дня, получая оранжевый раствор. Метанол (500 мл) отгоняют и концентрированный раствор охлаждают до комнатной температуры, получая желтую суспензию. Эту суспензию фильтруют (фильтрат сохраняют для использования в Примере 42). Собранные твердые продукты промывают метанолом и диэтиловым эфиром, получая указанное в заголовке соединение (0,72 г, 39%) в виде желтого порошка, Т.пл. 336-339oC; МС(CI): 388 (М+H).
Анализ для C18H11Cl2N3O3• 1,15 H2О:
Рассчитано: C, 52.87; H, 3.27; N,10.28
Найдено: C, 52.51; H, 2.87; N,10.12
300 МГц 1H ЯМР (ДМСО-d6): 13.40 (s, 1H, способн. к обмену), 12.55 (s, 1H, способн. к обмену), 8.30 (d, J=8.8 Гц, 1H), 8.20 (s, 1H), 7.62 (d, J=8.8 Гц, 1H), 7.53(s, 1H), 7.43(s, 2H), 2.16 (s, 3H).
Пример 42. 7-Хлор-2-(4-хлор-2-метилфенил)-4-гидрокси-1,2,5,10- тетрагидропиридазино[4,5-b]хинолин-1,10-дион.
Фильтрат, сохраненный от Примера 41, разбавляют водой (1,0 л) и полученную суспензию перемешивают 2 ч. Твердые продукты собирают, промывают водой и затем диэтиловым эфиром, получая указанное в заголовке соединение (0,54 г, 29%) в виде не совсем белого порошка, Т.пл. 355-357oC; МС(CI): 388 (М+H).
Анализ для C18H11Cl2N3O3• 0,20 H2О:
Рассчитано: C, 55.18; H, 2.93; N,10.72
Найдено: C, 55.00; H, 2.62; N,10.66
300 МГц 1H ЯМР (ДМСО-d6): 12.84 (br s, 1H, способн. к обмену), 12.07 (br s, 1H, способн. к обмену), 8.16 (d, J=8.6 Гц, 1H), 8.07 (s, 1H), 7.47-7.33 (m, 4H), 2.12 (s, 3H).
Пример 42a. Альтернативно, указанное в заголовке соединение получают следующим способом, приведенным в общем виде в Схеме 6, и в условиях, аналогичных описанным в Примере 82, где к перемешиваемой суспензии 2-пирролидинокарбамид-7-хлор-4-гидрокси хинолин 3-карбоновой кислоты в ТГФ добавляют DCC. Сразу же к описанной выше суспензии добавляют ТГФ раствор N-трет-бутокси карбонил-N'-4-хлор-2-метилфенил гидразина. Реакционную смесь перемешивают при комнатной температуре 4 ч. По завершении сочетания (после проверки подходящим хроматографическим способом, например, ТCХ или ВДЖХ) мочевину, являющуюся побочным продуктом, удаляют вакуумной фильтрацией. Частичная очистка с применением флэш-хроматографии и использованием 5% метанол/CH2Cl2 дает заданный гидразид. К гидразиду, суспендированному в ТГФ добавляют
метансульфокислоту. Реакционную смесь перемешивают при комнатной температуре 24 ч и затем выливают в ледяную воду. Полученный осадок отделяют, сушат и растирают/обрабатывают ультразвуком с метанолом и выделяют, получая указанное в заголовке соединение.
Исходный 2-пирролидинокарбамид-7-хлор-4- гидроксихинолин-3-карбоновую кислоту и родственные исходные продукты получают по методикам, описанным в Примере 82а и b (ниже).
Исходный N-трет-бутоксикарбонил-N'-4-хлор-2-метилфенил гидразин получают следующим способом:
К суспензии 4-хлор-2-метилфенилгидразина (992 мг, 6,33 мM) и карбоната калия (1,44 г, 10, 4 мM) в насыщенном водном растворе добавляют раствор ди-третбутил бикарбоната (1,52 г, 6,96 мM) в ТГФ (24 мл). Через 2,5 ч смесь распределяют между диэтиловым эфиром и водным слоем. Органические экстракты объединяют и промывают водой и раствором соли, сушат (MgSO4), фильтруют и концентрируют в вакууме. Сырой продукт чистят флэш колоночной хроматографией с 25% диэтиловый эфир-гексаны в качестве элюента, получая указанное в заголовке соединение (1,56 г, 96%) в виде рыжевато-коричневого твердого вещества, МС(CI): 256 (М).
300 Гц 1H ЯМР (ДМСО-d6): 8.81 (br s, 1H), 7.17 (br s, 1H), 7.00-7.08 (m, 2H), 6.55-6.62 (m, 1H), 2.09(s, 1H), 1.41 (s, 9H).
Пример 43. 7-Хлор-2-(2,4-диметилфенил)-4-гидрокси-1, 2, 5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион.
7-Хлор-3-метоксикарбонил-4-оксо-1,4-дигидрохинолин-2- карбоновой кислоты N-2-(2,4-диметилфенил)гидразид (3,80 г, 9,50 мМ) суспендируют в метаноле (330 мл) и добавляют быстрыми каплями при хорошем перемешивании метансульфокислоту (83 мл). Полученную оранжевую суспензию нагревают при температуре кипения с обратным холодильником 20 ч, получая янтарного цвета раствор. Этот раствор охлаждают до комнатной температуры и добавляют по каплям воду (75 мл), получая желтую суспензию, которую перемешивают 2 ч. Твердые продукты отфильтровывают и фильтрат разбавляют водой (300 мл), получая желтую суспензию, которую перемешивают 20 ч. Твердые продукты собирают и промывают водой, метанол/диэтиловым эфиром, затем диэтиловым эфиром, получая неочищенное указанное в заголовке соединение (1,80 г). Перекристаллизация из метанола дает указанное соединение (0,58 г, 17%) в виде рыжевато-коричневого порошка, Т.пл.=349-351oC; МС(CI): 368 (М+H).
Анализ для C19H14Cl2N3O3• H2О•0,5 СH3ОH:
Рассчитано: C, 56.25; H, 4.34; N,10.06
Найдено: C, 56.01; H, 4.36; N, 9.90
300 МГц 1H ЯМР (ДМСО-d6): 12.72 (br s, 1H, способн. к обмену), 12.02 (br s, 1H, способн. к обмену), 8.16 (d, J=8.7 Гц, 1H), 8.06 (s, 1H), 7.46 (d, J= 8.7 Гц, 1H), 7.18(m, 3H), 2.33(s, 3H), 2.07 (s, 3H).
Исходный гидразид получают из соответствующего хлорангидрида, который получают из соответствующего сложного диэфира.
Пример 43а. Альтернативно, исходное соединение получают по общей методике, описанной в 42а, исключая использование соответствующего N-трет-бутокси карбонил-N'-2,4-метилфенилгидразина, который получают как описано в 42а, кроме 2,4-диметилфенил-гидразина, взаимодействием с ди-трет-бутилдикарбонатом.
Пример 44. 7-Хлор-2-(3,4-дигидроксифенил)-4-гидрокси- 1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион.
7-Хлор-4-гидрокси-2-(3,4-дигидроксифенил)-1,2,5,10- тетрагидропиридазино[4,5-b] хинолин-1,10-дион (1,00 г, 2,50 мМ) нагревают при температуре кипения с обратным холодильником в 484) HBr (40 мл) 6 ч, получая оранжевую суспензию. Нагрев убирают и суспензию фильтруют, пока она еще теплая. Собранные твердые продукты промывают водой и затем диэтиловым эфиром, получая неочищенный продукт (0,94 г) в виде желтого порошка. Этот продукт перекристаллизовывают из кипящего метанола (600 мл), получая указанное в заголовке соединение (0,63 г, 68%) в виде желтого порошка, Т.пл.=269-272oC; МС(CI): 372 (М+H).
Анализ для C17H10ClN3O5• 0,5H2О•0,75 CH3ОH:
Рассчитано: C, 52.67; H, 3.49; N,10.38
Найдено: C, 52.66; H, 3.64; N,10.14
300 МГц 1H ЯМР (ДМСО-d6): 12.67(br s, 1H, способн. к обмену), 11.97(br s, 1H, способн. к обмену), 9,19(br s, 1H, способн. к обмену), 9.10(br s, 1H, способн. к обмену), 8.15 (d, J=8.3 Гц, 1H), 8.04 (s, 1H), 7.44 (d, J=8.3 Гц, 1H), 6.89-6.73(m, 3H).
Исходный 7-Хлор-4-гидрокси-2-(3,4-диметоксифенил)-1, 2, 5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион получают как описано в Примере 45.
Пример 45. 7-Хлор-4-гидрокси-2-(3,4-диметоксифенил)-1, 2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион.
7-Хлор-3-метоксикарбонил-4-оксо-1,4-дигидрохинолин-2-карбонил хлорид (7,00 г, 23,3 мМ) растворяют в тетрагидрофуране (210 мл) и добавляют по каплям за 20 мин к охлажденному (0oC) раствору 3,4-диметоксифенилгидразина (9,80 г, 58,3 мМ) в тетрагидрофуране (420 мл) при перемешивании. Полученную коричневую суспензию перемешивают при 0oC 30 мин и 2 ч при комнатной температуре. Кашицу лед/вода (450 мл) добавляют к реакционной смеси и впоследствии 1 н. HCl (1,2 л) и коричневую суспензию перемешивают 1 ч. Твердые продукты отделяют фильтрацией и промывают водой и затем диэтиловым эфиром до получения 7-хлор-3- метоксикарбонил-4-оксо-1,4-дигидроксихинолин-2-карбоновой кислоты N-2-(2,4-диметоксифенил) гидразида (15 г, влаж.). Объединенный фильтрат и промывные воды частично концентрируют, удаляя ТГФ, в результате чего образуется осадок. Этот осадок собирают и промывают водой, затем диэтиловым эфиром, получая сырой продукт - указанное в заголовке соединение (2,00 г). Перекристаллизация этого сырого продукта из кипящего метанола (500 мл) дает указанное в заголовке соединение (0,98 г, 10%) в виде рыжевато-коричневого порошка, Т.пл.=334-336oC; МС(CI): 400 (М+H).
Анализ для C19H14ClN3O5• CH3ОH:
Рассчитано: C, 55.63; H, 4.20; N, 9.73
Найдено: C, 55.27; H, 4.31; N, 9.56
300 МГц 1H ЯМР (ДМСО-d6): 12.75 (s, 1H, способн. к обмену), 12.01 (s, 1H, способн. к обмену), 8.16 (d, J=8.6 Гц, 1H), 8.05 (s, 1H), 7.45 (d, J=8.6 Гц, 1H), 7.13(s, 1H), 7.03 (s, 2H), 3.80(s, 3H), 3.76 (s, 3H).
Пример 46. 7-Хлор-4-гидрокси-2-(2-метилтиоэтил)-1,2,5,10- тетрагидропиридазино[4,5-b]хинолин-1,10-дион.
К суспензии тиометоксида натрия (230 мг, 3,2 мМ) в диметилформамиде (20 мл), добавляют за один прием 2-(2-бромэтил)-7-хлор-4-гидрокси-1,2,5, 10-тетрагидропиридазино[4,5-b] хинолин-1,10-дион (0,4 г, 1,08 мМ, полученный в Примере 4а заявки N 37811) в виде сухого порошка. Смесь нагревают до слабого кипения около трех часов. В это время нагрев удаляют и реакционную смесь выливают в охлажденную льдом 1,2 н. HCl (100 мл) и перемешивают около 1 ч. Полученный осадок отделяют вакуумной фильтрацией и промывают водой и диэтиловым эфиром, затем сушат в вакууме при 50oC, получая 330 мг (91%) указанного в заголовке соединения в виде не совсем белого порошка, Т.пл.=275-277oC; МС(CI): 338 (М+H).
Анализ для C14H12ClN3O3S:
Рассчитано: C, 49.78; H, 3.58 N, 12.44
Найдено: C, 49.73; H, 3.73; N, 12.30
ЯМР: 2.11(s, 3H), 2.79(t, 2H, J= 7.13 Гц), 4.09(t, 2H, J=7.08 Гц), 7.42(dd, 1H, J=8.59, 1.6 Гц), 8.57(d, 1H, J=1.77 Гц), 8.13 (d, 1H J=8.64 Гц, ), 11.8 (br s, 1H), 12.64(br s, 1H).
Пример 47. 7,9-Дихлор-2-(2, 4-диметилфенил)-4-гидрокси-1, 2, 5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион.
К перемешиваемой суспензии 5,7-дихлор-3-метоксикарбонил-4-оксо-1,4-дигидрохинолин-2-карбоновой кислоты N-2-(2,4-диметилфенил) гидразида (3,60 г, 8,31 мМ) в метаноле (151 мл) медленно добавляют метансульфокислоту (7,2 мл) и полученную смесь нагревают до температуры кипения. После 2 ч нагревания при температуре кипения с обратным холодильником, реакционной смеси дают охладиться до комнатной температуры и затем фильтруют, для отделения осажденных твердых продуктов. Фильтрат разбавляют водой (150 мл), в результате чего выпадает белый осадок. Эту смесь перемешивают в течение ночи при комнатной температуре и твердые продукты собирают фильтрацией, затем промывают водой и диэтиловым эфиром и сушат на воздухе, получая указанное в заголовке соединение в виде белого порошка (2,78 г, 84%), Т.пл. 335-336oC; МС(CI): 402 (М+H).
Анализ для C19H13Cl2N3O3• 0,2 H2О:
Рассчитано: C, 56.25; H, 3.37; N,10.09
Найдено: C, 56.23; H, 3.33; N,10.35
ЯМР: 12.73 (br s, 1H, способн. к обмену), 11.92 (br s, 1H, способн. к обмену), 8.03(s, 1H), 7.51 (s, 1H), 7.17-7.08 (m, 3H), 2.32 (s, 1H), 2.06 (s, 1H).
Исходный 5,7-дихлор-3-метоксикарбонил-4-оксо-1,4-дигидро- ксихинолин-2-карбоновой кислоты N-2-(2,4-диметилфенил) гидразид получают следующим способом:
а) 3-Карбометокси-5,7-дихлор-4-гидроксихинолин-2-карбоновая кислота.
К перемешиваемой суспензии диметил 5,7-дихлор-4- гидроксихинолин-2,3-дикарбоксилата (4,0 г, 12,2 мМ) в воде (72 мл) добавляют водный раствор гидроокиси натрия (0,97 г, 24,2 мМ в 22 мл воды). Твердые продукты сразу же растворяются и полученный раствор нагревают при 55oC 30 мин. Реакционную смесь затем медленно охлаждают до 20oC и подкисляют добавлением 6 н. соляной кислоты (4 мл), поддерживая при этом температуру ниже 20oC. Образуется осадок, и после перемешивания суспензии в течение 2 ч, смесь фильтруют, собранные твердые продукты промывают последовательно водой, этанол/метанолом и диэтиловым эфиром. Сушка на воздухе дает указанное соединение (2,82 г, 74%) в виде рыжевато-коричневого твердого продукта. Аналитический образец указанного в заголовке соединения получают перекристаллизацией небольшой порции выделенного твердого вещества из этилацетата до получения рыжевато-коричневого твердого продукта, Т.пл. 339-340oC;
Анализ для C12H7Cl2N3O5N:
Рассчитано: C, 45.6; H, 2.23; N, 4.43
Найдено: C, 45.78; H, 2.43; N, 4.52
1H ЯМР (MeOD): 7.82 (d, J=2.0 Гц, 1H), 7.44(d, J=2.0 Гц 1H), 3.86 (s, 3H).
b) 3-Карбометокси-5,7-дихлор-4-гидроксихинолин-2-карбонил хлорид.
Тионилхлорид (1,50 г, 12,6 мМ) добавляют к перемешиваемой суспензии 3-карбометокси-5,7-дихлор-4-гидроксихинолин-2-карбоновой кислоты (1,0 г, 3,17 мМ) в свободном от этанола хлороформе (25 мл). Полученную суспензию нагревают при температуре кипения с обратным холодильником 5 часов, в результате чего образуется раствор. Реакционной смеси дают охладиться до комнатной температуры и затем концентрируют, получая в остатке названный в заголовке хлорангидрид (0,88 г, 83%) в виде рыжевато- коричневого твердого продукта. Этот продукт используют как есть для получения гидразида кислоты.
с) 5,7-Дихлор-3-метоксикарбонил-4-оксо-1,4-дигидро-хинолин- 2-карбоновой кислоты N-2-(2,4-диметилфенил)гидразид.
3-Карбометокси-5,7-дихлор-4-гидроксихинолин-2-карбонил хлорид (3,65 г, 11,0 мМ) растворяют в тетрагидрофуране (274 мл) и добавляют по каплям к охлажденному (0oC) раствору 2,4-диметилфенилгидразина (3,13 г, 23,0 мМ) в тетрагидрофуран (172 мл) при перемешивании. Медленно образуется коричнево-красная суспензия и полученную смесь перемешивают при 0oC 30 мин. Реакцию прерывают добавлением охлажденной воды (223 мл) и последующим добавлением 1 н. HC1 (669 мл). Полученную смесь перемешивают 1 ч, затем фильтруют для отделения осадившихся твердых веществ. Собранные твердые продукты промывают водой и затем диэтиловым эфиром, получая, после сушки на воздухе, указанное в заголовке соединение (3,60 г, 76%) в виде белого порошка, МС(CI): 434 (М+H).
1H ЯМР (ДМСО-d6): 12.55 (br s, 1H, способн. к обмену),10.67 (br s, 1H, способн. к обмену), 7.76 (d, J=1.6 Гц, 1H), 7.54(d, J=1.6 Гц, 1H), 7.19(br s, способн. к обмену 1H), 6.91-6.76 (m, 3H), 3.69 (s, 2H), 2.19 (s, 6H).
Пример 48. 7-Хлор-4-гидрокси-2-(4-метокси-2-метилфенил)- 1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион натриевая соль.
К перемешиваемой суспензии 7-хлор-4-гидрокси-2-(4- метокси-2-метилфенил)-1,2,5,10-тетрагидропиридазино[4,5-b] хинолин-1,10-диона (2,00 г, 5,22 мМ) в 0,1 н. гидроксиде натрия (52,2 мл, 5,22 мМ) добавляют воду (100 мл) и метанол (3 мл). После непродолжительной обработки ультразвуком твердые продукты растворяются и полученный раствор фильтруют через Gelman Glass Acrodisc фильтр (0,45 ультрам) и концентрируют досуха. Остаток растирают с изопропанолом (100 мл) и фильтруют, отделяя твердые продукты. Твердые вещества промывают несколько раз изопропанолом и затем сушат в вакууме при 100oC в течение ночи, получая указанное в заголовке соединение (1,64 г, 78%) в виде желтого порошка, Т.пл. 356 (разл.).
Анализ для C19H13ClN3O4• 1,0 Na • 0,02 (CH3)2CHОH•1,8 H2О:.
Рассчитано: C, 52.10; H, 3.84; N, 9.56
Найдено: C, 52.10; H, 3.71; N, 9.40
1H ЯМР (ДМСО-d6): 8.15-8.17 (m, 2H), 7.31 (dd, J=8.7, 2.0 Гц, 1H), 7.11(d, J=8.4 Гц, 1H), 6.83-6.76 (m, 2H), 3.76 (s, 3H), 2.07 (s, 3H).
Пример 49. Холиновая соль 7-хлор-4-гидрокси-2-(4-метокси-2- метилфенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1, 10-диона.
К перемешиваемой суспензии 7-хлор-4-гидрокси-2-(4- метокси-2-метилфенил)-1,2,5,10-тетрагидропиридазино[4,5-b] хинолин-1,10- диона (400 мг, 1,03 мМ) в метаноле (4 мл) добавляют холин гидрохлорид (45% по весу в метаноле, 295,6 ультра-л, 1,03 мМ). После непродолжительной обработки ультразвуком, все твердые продукты растворяются и полученный раствор пропускают через Gelman Glass Acrodisc фильтр (0,45 ультра-м) наряду с дополнительным, количеством метанола (8 мл). Фильтрат концентрируют досуха и оставшееся масло перемешивают с изопропанолом (15 мл) и этанолом (8 мл), что вызывает кристаллизацию. Твердые продукты собирают и сушат в вакууме при 100oC в течение ночи, получая указанное в заголовке соединение (411 г, 81%) в виде желтого твердого продукта, Т.пл. 229-230oC.
Анализ для C19H13ClN3O4• C5H14NO•1,1 H2O:
Рассчитано: C, 56.88; H, 5.81; N, 11.06
Найдено: C, 56.91; H, 5.47, N,10.98
1H ЯМР (ДМСО-d6): 8.09-8.12 (m, 2H), 7.31 (dd, J=8.6, 2.1 Гц,.1H), 7.07(d, J= 8.5 Гц, 1H), 6.75-6.82 (m, 2H), 3.80-3.85 (m, 2H), 3.77 (s, 3H), 3.37-3.40 (m, 2H), 3.09 (s, 9H), 2.04 (2, 3H).
Пример 50. Холиновая соль 2-(4-бензилоксифенил)-7-хлор-4- гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-диона
К перемешиваемой суспензии 7-хлор-3-метоксикарбонил-4-оксо- 1, 4-дигидрохинолин-2-карбоновой кислоты N-2-(4-бензилокси- фенил)гидразида (1,19 г, 2,50 мМ) в метаноле (50 мл) добавляют метансульфокислоту (2,4 мл) и полученную смесь нагревают при температуре кипения в течение с обратным холодильником 1 ч. После охлаждения до комнатной температуры, реакционную смесь фильтруют и собранные твердые продукты промывают диэтиловым эфиром и сушат на воздухе, получая 900 мг продукта, который сохраняют для дальнейшей очистки. Фильтрат разбавляют равным объемом воды и, после перемешивания в течение 30 мин, полученную суспензию фильтруют, собранные твердые продукты промывают водой и диэтиловым эфиром и сушат на воздухе, получая указанное в заголовке соединение (151,8 мг) в форме свободной кислоты. Твердые продукты (900 мг), которые были первоначально собраны и сохранены, перекристаллизуют путем растворения в горячей смеси метанола (3,8 л) и метансульфокислоты (63 мл) и затем дают охладиться до комнатной температуры. Полученную суспензию фильтруют для удаления осадка и фильтрат разбавляют равным объемом воды и перемешивают в течение ночи. Образовавшийся в результате осадок собирают, промывают водой диэтиловым эфиром и затем сушат на воздухе, получая указанное в заголовке соединение (422,2 мг) в форме свободной кислоты (общий объединенный выход указанного в заголовке соединения в виде свободной кислоты: 574 мг, 52%); МС(CI): 446 (М+H).
300 МГц 1H ЯМР (ДМСО-d6): 12.71 (br s, 1H, способн. к обмену), 11.98 (br s, 1H, способн. к обмену), 8.14 (d, J=8.6 Гц, 1H), 8.03 (s, 1H), 7.47-7.32 (m, 9H), 7.07(d, J=8.9 Гц, 1H), 5.14 (s, 2H).
К перемешиваемой суспензии 2-(4-бензилоксифенил)-7-хлор-4- гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b] хинолин-1,10- диона (515 мг, 1,16 мМ) в метаноле (77 мл) добавляют гидроокись холина (45% по весу в метаноле, 0,36 мл, 1,28 мМ). Полученную смесь фильтруют для отделения небольшого количества мелких твердых частиц и фильтрат концентрируют, получая в остатке масло. Этот остаток разбавляют смесью толуол/этанол (70 мл/20 мл) и концентрируют. Остаток разбавляют окончательно порцией толуола (70 мл) и концентрируют, получая холиновую соль указанного в заголовке соединения (640 мг, 99%) в виде желто-зеленого твердого продукта, Т.пл. 304-306oC; МС (FAB); 446 (М+1). 444 (М-1).
Анализ для C24H16ClN3O4• 0,5 H2O•1,0 OC5H14NO:
Рассчитано: C, 61.95; H, 5.43 N, 9.89
Найдено: C, 62.31; H, 5.59, N,10.02
300 МГц 1H ЯМР (ДМСО-d6): 8.11-8.09 (m, 2H), 7.48-7.28(m, 8H), 7.00 (d, J=8.88, Гц, 2H), 5.13 (s, 2H), 3.83 (br s, 2H), 3.39 (br s, 2H), 3.09 (br s, 9H).
а) 7-Хлор-3-метоксикарбонил-4-оксо-1,4-дигидрохинолин-2- карбоновой кислоты N-2-(4-бензилоксифенил)гидразид.
7-Хлор-3-метоксикарбонил-4-оксо-1,4-дигидрохинолин-2-карбоновой кислоты N-2-(4-бензилоксифенил)гидразид, использованный в Примере 50, получают согласно способу, использованному в Примере 41, за тем исключением, что используют 4-бензилоксифенилгидразин вместо 4-хлор-2-метилфенилгидразина.
Пример 51. 7-Хлор-2-(2,4-дихлорфенил)-4-гидрокси- 1,2, 5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион.
К перемешиваемой суспензии 7-хлор-3-метоксикарбонил-4-оксо-1,4- дигидрохинолин-2-карбоновой кислоты N-2-(2,4- дихлорфенил)гидразида (3,00 г, 6,81 мМ) в метаноле (1500 мл) добавляют метансульфокислоту (150 мл). Полученную суспензию нагревают при температуре кипения с обратным холодильником 9 дней и образовавшийся раствор затем охлаждают до температуры окружающей среды и концентрируют до половины первоначального объема, используя роторный испаритель. Полученную суспензию перемешивают при комнатной температуре 30 мин и фильтруют для отделения твердых продуктов. Фильтрат разбавляют равным объемом воды, после чего образуется осадок. Эту смесь перемешивают при температуре окружающей среды в течение ночи и затем фильтруют. Собранные твердые продукты промывают диэтиловым эфиром и затем суспендируют в метаноле (500 мл) и обрабатывают ультразвуком в течение 5 мин. Полученную смесь фильтруют для отделения твердых продуктов и фильтрат концентрируют. Остаток суспендируют в диэтиловом эфире и фильтруют. Собранные твердые продукты промывают водой и диэтиловым эфиром и затем сушат на воздухе, получая указанное в заголовке соединение (198,5 г, 7%) в виде желтого твердого продукта, Т.пл. 360-361oC; МС (CI); 408 (М+1).
Анализ для C17H8ClN3O3• 0,2 H2O•0,10 CH3SO3H:
Рассчитано: C, 49.02; H, 2.35; N, 9.75
Найдено: C, 48.69; H, 2.10; N, 9.96
300 МГц 1H ЯМР (ДМСО-d6): 12.99 (br s, 1H, способн. к обмену), 12.12 (br s, 1H, способн. к обмену), 8.15 (d, J=8.67 Гц, 1H), 8.07 (d, J=1.23 Гц, 1H), 7.85 (d, J=1.02 Гц, 1H),7.60 (s, 2H), 7.47(dd, J=1.61, 8.63 Гц 1H).
а) 7-Хлор-3-метоксикарбонил-4-оксо-1,4-дигидрохинолин-2- карбоновой кислоты N-2-(2,4-дихлорфенил)гидразида
7-Хлор-3-метоксикарбонил-4-оксо-1,4-дигидрохинолин-2- карбоновой кислоты N-2-(2,4-дихлорфенил)гидразид, использованный в Примере 51, получают по способу, использованному в Примере 41а), за тем исключением, что 2,4-дихлорфенилгидразин используют вместо 4-хлор-2-метилфенилгидразина.
Пример 52. 7-Хлор-2-(2,4-дихлорфенил)-1-гидрокси-3,4,5,10- тетрагидропиридазино[4,5-b]хинолин-4,10-дион
К перемешиваемой суспензии 7-хлор-3-метоксикарбонил-4-оксо-1,4- дигидрохинолин-2-карбоновой кислоты N-2-(2, 4-дихлорфенил) гидразида (1,28 г, 2,92 мМ) в метаноле (645 мл) добавляют метансульфокислоту (65 мл). Полученную суспензию нагревают при температуре кипения с обратным холодильником 10 дней и образовавшийся раствор охлаждают до температуры окружающей среды, в результате чего выпадает осадок. Смесь фильтруют, отделяя твердые продукты, и фильтрат разбавляют водой (300 мл) до образования другого осадка. Этот осадок собирают и сушат, получая указанное в заголовке соединение (266,5 мг, 22%) в виде желтого твердого вещества, Т.пл. 342-343oC; МС (CI); 408 (М+1).
Анализ для C17H8ClN3O3• 0,10 CH3SO3H•0,2 H2O:
Рассчитано: C, 48.73; H, 2.16; N, 9.95
Найдено: C, 48.69; H, 2.10; N, 9.96
300 МГц 1H ЯМР (ДМСО-d6): 13.50 (br s, 1H, способн. к обмену), 8.29 (d, J= 8.76 Гц, 1H), 8.19 (d, J=1.26 Гц, 1H), 7.92 (d, J=1.71 Гц, 1H), 7.70-7.61 (m, 3H).
а) 7-Хлор-3-метоксикарбонил-4-оксо-1,4-дигидрохинолин-2- карбоновой кислоты N-2-(2,4-дихлорфенил)гидразид.
7-Хлор-3-метоксикарбонил-4-оксо-1,4-дигидрохинолин-2-карбоновой кислоты N-2-(2,4-дихлорфенил)гидразид, использованный в Примере 52, получают по способу, использованному в Примере 51.
Пример 53. 7-Хлор-4-гидрокси-2-[2-(4-метоксианилин) этил] -1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион.
2-(2-Бромэтил)-7-хлор-4-гидрокси-1,2,5,10-тетрагидропиридазино [4,5-b] хинолин-1,10-дион (1,00 г, 2,7 мМ), полученный в Примере 4а и п-анизидин (1,33 г,10,8 мМ) перемешивают и нагревают при температуре кипения с обратным холодильником в ДМФ (20 мл) в течение 1,5 ч, получая коричневый раствор. Раствор охлаждают до комнатной температуры и добавляют диэтиловый эфир (80 мл), получая темную суспензию. Суспензию перемешивают два часа и фильтруют. Собранные твердые продукты промывают диэтиловым эфиром (150 мл), получая указанное в заголовке соединение в виде рыжевато-коричневого порошка (1,17 г, 60%) Т.пл. 239-241oC; МС (CI): 413.
Анализ для C20H17ClN4O4•HBr• 3,0 C3H7NО•0,5 H2O:
Рассчитано: C, 48.24; H, 5.58; N, 13.58
Найдено: C, 47.80; H, 5.20; N, 13.93
300 МГц 1H ЯМР (ДМСО-d6): 8.14 (d, J=8.7 Гц, 1H), 8.09 (d, J=1.9 Гц, 1H), 7.35 (d, J= 8.7 Гц, 1H), 6.75 (d, J=8.9, Гц, 2H), 6.58 (d, J-8.9 Гц, 2H), 3.96 (t, J=6.8 Гц, 2H), 3.62 (s, 3H), 3.27 (t, J=6.8 Гц, 2H).
Пример 54. 7-Хлор-2-(3-хлор-4-гидроксифенил)-4-гидрокси-1, 2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион.
7-Хлор-2-(3-хлор-4-метоксифенил)-4-гидрокси-1,2,5,10- тетрагилропиридазино[4,5-b]хинолин-1,10-дион (получен ранее в Примере 37, 1,00 г, 2,47 мМ) перемешивают в метансульфокислоте (20 мл), получая черный раствор. Этот раствор нагревают при 145oC 6 ч и охлаждают до комнатной температуры. Добавляя воду (60 мл) до получения рыжевато-коричневой суспензии, которую перемешивают 3 ч и фильтруют. Собранные твердые продукты промывают водой и диэтиловым эфиром, получая указанное в заголовке соединение в виде порошка золотистого цвета (0,98 г, 76%), Т.пл. 350-353oC; МС (CI): 390.
Анализ для C17H9Cl2N3O4• H2O • 1,2 CH3SO3H
Рассчитано: C, 41.76; H, 3.04; N, 8.02
Найдено: C, 41.74; H, 2.76; N, 7.68
300 МГц 1H ЯМР (ДМСО-d6): 8.15 (d, J=8.5, Гц, 1H), 8.05 (d, J=1.9 Гц, 1H), 7.53 (d, J=2.2 Гц, 1H), 7.45 (d, J=8.5 Гц, 1H), 7.33 (dd, J=2.2, 8.7 Гц, 1H), 7.03 (d, J=8.7 Гц, 2H).
Пример 55. 7-Хлор-4-гидрокси-2-(4-гидрокси-2-метилфенил)- 1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион.
7-Хлор-4-гидрокси-2-(4-метокси-2-метилфенил)-1,2,5,10- тетрагидропиридазино[4,5-b] хинолин-1,10-дион (1,00 г, 2,61 мМ) перемешивают в метансульфокислоте (10 мл), получая коричневый раствор. Этот раствор нагревают при 150oC 3 ч и охлаждают до комнатной температуры. Охлажденный раствор добавляют по каплям к воде (50 мл) при перемешивании, получая серую суспензию, которую перемешивают 20 ч и фильтруют. Собранные твердые продукты промывают водой и затем суспендируют в воде (50 мл). К этой суспензии добавляют раствор гидроокиси холина (2 мл, 45 вес.% в метаноле), который растворяя твердые продукты дает коричневый раствор. Этот раствор нагревают при температуре кипения с обратным холодильником 1 ч, вносят дополнительное количество раствора гидроокиси холина (2 мл) и раствор нагревают при температуре кипения с обратным холодильником 3 ч. Раствор охлаждают до комнатной температуры и подкисляют до pH 1 1 н. HCl, получая коричневую суспензию. Суспензию фильтруют и собранные твердые продукты промывают водой, получая коричневое твердое вещество. Несколько перекристаллизацией из горячего метанола дают указанное в заголовке соединение в виде совсем белого порошка (0,35 г, 36%), Т.пл. 287oC (разл.); МС (CI): 370.
Анализ для C18H12ClN3O4• H2O • 0,7 CH3ОH:
Рассчитано: C, 54.75; H, 4.13; N,10.24
Найдено: C, 54.75; H, 3.87; N,10.18
300 МГц 1H ЯМР (ДМСО-d6): 12.60 (br s, 1H, способн. к обмену), 12.00 (br s, 1H, способн. к обмену), 9.55 (br s, 1H, способн. к обмену), 8.16 (d, J= 8.6, Гц, 1H), 8.06 (s, 1H), 7.45 (d, J=8.6 Гц, 1H), 7.07 (d, J=8.4 Гц, 1H), 6.70(s, 1H), 6.66 (d, J=8.4 Гц, 1H), 2,00 (s, 3H).
Пример 56. 7-Хлор-2-(4-хлор-2-метилфенил)-4-гидрокси-1, 2, 5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион.
Представлен альтернативный синтез этого соединения, описанного ранее в Примере 42. 3-Бензил-7-хлор-2-(4-хлор-2-метилфенил)- 1,2,3,4,5,10-гексагидропиридазино[4,5-b] хинолин-1, 4,10- трион, 0,61 г, 1,28 мМ) перемешивают в метансульфокислоте (12 мл), получая вязкий раствор янтарного цвета. Этот раствор нагревают при 45oC 6,5 ч, получая суспензию цвета зеленого порошка, которую охлаждают до комнатной температуры. Добавляют лед (50 мл) при перемешивании, получая светло-зеленую суспензию, которую фильтруют. Собранные твердые продукты промывают водой и диэтиловым эфиром, получая серый порошок (0,49 г). Часть этого порошка (0,36 г) перемешивают в метаноле и добавляют раствор гидроокиси холина (2 мл, 1М). Большинство твердых продуктов растворяется и смесь фильтруют, удаляя нерастворимые вещества. Профильтрованный раствор подкисляют до pH 1 с помощью 1 н. HCl, получая рыжевато-коричневую суспензию. Метанол (2 мл) удаляют в токе газообразного N2 и суспензию фильтруют. Собранные твердые продукты промывают водой и диэтиловым эфиром, получая указанное в заголовке соединение в виде не совсем белого порошка (0,30 г, 82%), идентифицированного как вещество, полученное ранее в Примере 42. Исходный 3-бензил-7-хлор-2-(4-хлор-2-метилфенил)- 1,2,3,4,5,10-гексагидропиридазино[4,5-b]хинолин-1, 4,10-трион получают следующим способом:
а) 2-Бензилиден-1-(4-хлор-2-метилфенил) гидразин.
К перемешиваемой суспензии 4-хлор-2-метилфенилгидразин гидрохлорида (1,00 г, 5,18 мМ) в этаноле (15 мл) добавляют бензальдегид (0,66 г, 6,22 мМ) и ацетат натрия (0,51 г, 6,2 мМ). После перемешивания полученной смеси в течение 3 ч при комнатной температуре, добавляют дополнительное количество бензальдегида (0,11 г, 1,3 мМ) и перемешивание продолжают 30 мин. Реакционную смесь выливают в воду и образующуюся смесь экстрагируют диэтиловым эфиром. Объединенные эфирные экстракты сушат (MgSO4), фильтруют и концентрируют до остаточного желтого масла (1,71 г), содержащего указанное в заголовке соединение, смешанное с диэтил ацеталем бензальдегида. Ацеталь отгоняют нагреванием (70oC) смеси в глубоком вакууме. Остаток представляет чистое указанное в заголовке соединение (1,23 г, 97%) в виде оранжевого твердого вещества, которое используют как оно есть в следующей стадии
300 МГц 1H ЯМР (CDCl3): 7.79 (s, 1H), 7.68 (s, 1H), 7.65(s, 1H), 7.49 (d, J=6.3 Гц, 1H), 7.42-7.26 (m, 4H), 7.16 (dd, J=2.5, 6.0 Гц, 1H), 7.06 (d, J=2.5 Гц, 1H), 2.21(s, 3H).
b) 1-Бензил-2-(4-хлор-2-метилфенил)гидразин.
К перемешиваемому раствору 2-бензилиден-1-(4-хлор-2- метилфенил) гидразина (2,40 г, 9,81 мМ) в безводном тетрагидрофуране (43 мл) добавляют по каплям раствор борана в тетрагидрофуране (4,6 мл, 1М раствора, 4,6 мМ). Выделение газа наблюдается в процессе добавления и после него. По завершении добавления реакционную смесь перемешивают 20 мин при комнатной температуре и затем тщательно насыщают газообразным хлористым водородом при комнатной температуре. Постепенно, по мере добавления газообразного HCl к реакционной смеси образуется белый осадок. После добавления HCl реакционную смесь перемешивают в течение 20 мин и затем реакцию прерывают осторожным добавлением по каплям последовательно воды (150 мл) и 10% соляной кислоты (5 мл). Полученный раствор концентрируют для удаления основного количества тетрагидрофурана. Среду в оставшейся смеси делают щелочной, добавляя твердый карбонат калия, и затем экстрагируют диэтиловым эфиром. Объединенные экстракты сушат (MgSO4), фильтруют и концентрируют до остаточного бледно-желтого масла (2,38 г). Этот продукт подвергают флэш-хроматографии на силикагеле, используя в качестве элюента гексан/диэтиловый эфир (3:1). Фракции, содержащие заданный продукт, объединяют и концентрируют до остаточного указанного в заголовке соединения в виде желтого масла (1,30 г, 53,7%); МС (CI): 247(М+H).
300 МГц 1H ЯМР (CDCl3): 7.22-7.41(m, 6H), 7.14(d, J=2.4 Гц, 1H), 7.01 (d, J=2.4 Гц), 4.90 (br s, 1H, способн. к обмену), 3.95 (s, 2H), 3.77 (br s, 1H, способн. к обмену), 1.98(s, ЗH).
с) 7-Хлор-3-метоксикарбонил-4-оксо-1,4-дигидрохинолин-2- карбоновой кислоты N-1-бензил-N-2-(4-хлор-2-метилфенил) гидразид
7-Хлор-3-метоксикарбонил-4-оксо-1,4-дигидрохинолин-2- карбонил хлорид (0,58 г, 1,93 мМ) растворяют в тетрагидрофуране (50 мл) и добавляют по каплям за 15 мин к раствору 1-бензил-2- (4-хлор-2-метилфенил) гидразина (1,00 г, 4,05 мМ) в тетрагидрофуране (100 мл) при 0oC. Полученный раствор янтарного цвета перемешивают 45 минут при 0oC и разбавляют водой (75 мл), поддерживая 0oC охлаждением. Полученный раствор разбавляют затем при 0oC 1 н. HCl (180 мл) до образования белой суспензии. Суспензию перемешивают при 0oC 1 ч и фильтруют. Собранные твердые продукты промывают 1 н. HCl, водой и диэтиловым эфиром, получая после сушки на воздухе, указанное в заголовке соединение в виде белого порошка (0,83 г, 84%), Т.пл. 172-175oC.
Анализ для C26H21Cl2N3O4• 0,6 H2O•0,4 C4H10O:
Рассчитано: C, 60.18; H, 4.79; N, 7.63
Найдено: C, 60.21; H, 4.44; N, 7.70
300 МГц 1H ЯМР (ДМСО-d6): 12.44 (s, 1H, способн. к обмену), 8.04 (d, J= 8.6 Гц, 1H), 7.52 (d, J=1.4 Гц, 1H), 7.43-7.31 (m, 6H), 7.11-6.85 (m, 3H), 4.85 (br s, 2H), 3.69 (s, 3H), 1.76(s, 3H).
d) 3-Бензил-7-хлор-2-(4-хлор-2-метилфенил)-1,2,3,4,5,10- гексагидропиридазино[4,5-b]хинолин-1,4,10-трион.
7-Хлор-3-метоксикарбонил-4-оксо-1,4-дигидрохинолин-2- карбоновой кислоты N-1-бензил-N-2-(4-хлор-2-метилфенил) гидразид (0,92 г, 1,80 мМ) перемешивают в метаноле (37 мл) и добавляют раствор гидрооксисихолина (1,03 мл, 45 вес% в метаноле), получая бледно-коричневый раствор. Этот раствор нагревают при температуре кипения с обратным холодильником в течение 12 ч до комнатной температуры. Метанол удаляют в токе газообразного азота, получая остаток янтарного цвета. Добавляют раствор гидроокиси холина (1, мл, 45 вес.% в метаноле) и полученный густой раствор перемешивают 1 час. Добавляют метанол (40 мл) и раствор охлаждают до -15oC. Добавляют по каплям 1 н. HCl (10 мл) при -15oC и перемешивании, получая белую суспензию. Метанол (15 мл) удаляют в токе газообразного N2 и суспензию фильтруют. Собранные твердые продукты промывают водой и диэтиловым эфиром, получая указанное в заголовке соединение в виде не совсем белого порошка (0,76 г, 89%), Т.пл. 279-281oC; МС (CI): 478.
Анализ для C25H17Cl2N3O2• H2O • 0,3 CH3ОH:
Рассчитано: C, 60.06; H, 4.02; N, 8.31
Найдено: C, 60.14; H, 3.90; N, 8.34
300 МГц 1H ЯМР (ДМСО-d6): 12.68 (s, 1H, способн. к обмену), 8.19 (d, J= 1.97 Гц, 1H), 8.16 (d, J=8.6 Гц, 1H), 7.50 (dd, J=1.9, 8.6 Гц, 1H), 7.35-7.24 (m, 6H), 6.94-6.91 (m, 2H), 5.28(d, J=16.3 Гц, 1H), 4.60 (d, J=16.3 Гц, 1H), 1.69 (s, 3H).
Пример 57. Натриевая соль 7,9-дихлор-2-(2,4-диметилфенил)- 4-гидрокси-1,2,5,10-тетрагидропиридазино[4,5-b] хинолин-1,10- диона. Натриевая соль соединения, полученного в Примере 47.
7,9-Дихлор-2-(2, 4-диметилфенил)-4-гидрокси-1,2,5,10-тетра- гидропиридазино[4,5-b] хинолин-1,10-дион (получен, как описано в Примере 47, 375 мг, 0,925 мМ) растворяют в воде (20 мл), содержащей 0,1 н. гидроокись натрия (9,25 мл, 0,925 мМ) и метанол (4 мл) при вращении и обработке ультразвуком. Полученный раствор фильтруют через Gelman Glass Acrodisc фильтр (0,45 мкм) и фильтрат концентрируют досуха. Остаток растирают с изопропанолом (10 мл) и полученную смесь фильтруют. Собранные твердые продукты промывают изопропанолом (5 мл) и затем сушат в глубоком вакууме при 100oC в течение ночи, получая указанное в заголовке соединение в виде желтого твердого продукта (310,4 мг, 79%), Т.пл. 369-370oC.
Анализ для C19H12Cl2N3O3• 1,0 Na • 1,70 H2O • 0,02 (CH3)2CHОH:
Рассчитано: C, 50.32; H, 3.12; N, 9.08
Найдено: C, 50.20; H, 3.44; N, 9.21
1H ЯМР (ДМСО-d6): 8.01 (d, J=2.2 Гц, 1H), 7.28(d, J=2.0 Гц, 1H), 7.01-7.08 (m, 3H), 2.30 (s, 3H), 2.04 (s, 3H).
Примеры 58-81 представлены в Таблице 1.
Пример 82. 7-Хлор-4-гидрокси-2-(2-фторбензил)-1,2,5,10- тетрагидропиридазино[4,5-b]хинолин-1,10-дион.
К перемешиваемой суспензии 2-пирролидинокарбамил-7-хлор-4- гидроксихинолин-3-карбоновой кислоты (1,068 г, 3, мМ) в тетра- гидрофуране (60 мл) при температуре окружающей среды добавляют дициклогексилкарбодиимид (0,795 г, 3,85 мМ). Тетрагидро-фурановый раствор (20 мл) N-трет-бутоксикарбонил-N'-2-фторбензилгидразина (1,10 г, 4,59 мМ, получен как описано в 82с) добавляют непосредственно в вышеприведенную суспензию. Реакционную смесь перемешивают при комнатной температуре четыре часа. По окончании сочетания, мочевину в качестве побочного продукта удаляют вакуумной фильтрацией. Частичная очистка флэш колоночной хроматографией, использующей 5% метанола в метиленхлориде дает заданный гидразид (1,67 г, 3,0 мМ, 92%). К гидразиду, суспендированному в тетрагидрофуране, (80 мл) добавляют метансульфокислоту (9,0 мл, 139 мМ). Реакционную смесь перемешивают при комнатной температуре 24 часа и затем выливают в ледяную воду (600 мл). Полученный осадок выделяют, сушат и растирают/обрабатывают ультразвуком с метанолом (20 мл) и выделяют, получая после сушки в вакууме при 50oC 0,733 г (65,9%) указанного в заголовке соединения в виде не совсем белого твердого продукта, Т.пл. >300oC; МС (CI): 372 (М+H).
Анализ для C18H11N3O3Cl:
Рассчитано: C, 58.16; H, 2.98 N; 11.30
Найдено: C, 57.81; H, 3.20; N, 11.08
300 МГц 1H ЯМР (ДМСО-d6): 12.68 (s, 1H, способн. к обмену), 11.96 (s, 1H, способн. к обмену), 8.15 (d, J=8.7 Гц, 1H), 8.03 (s,1H), 7.43(d, 1H, J= 8.6 H2), 7.15-7.32 (m, 4H), 5.17 (s, 2H).
а) Исходную 2-пирролидинокарбамид-7-хлор-4-гидроксихинолин- 3-карбоновую кислоту получают следующим способом:
К суспензии 3-карбометокси-2-пирролидинокарбамид-7-хлор-4-гидроксихинолина (2,52 г, 7,5 мМ) в деионизованной воде (40 мл) добавляют по каплям раствор (20 мл) водной гидроокиси калия (882 мг, 15,75 мМ). По завершении добавления, реакционную смесь нагревают до 60oC. Через 3 ч реакционную смесь фильтруют для удаления небольшого количества нерастворимого вещества. Фильтрат затем подкисляют до pH 1, что дает белый осадок. Твердый продукт выделяют вакуумной фильтрацией, промывают водой и сушат при 30oC в вакууме в течение 16 ч. Это дает указанное в заголовке соединение (1,5 г, 64%) в виде белого твердого вещества, Т.пл.= 225-8oC; МС (CI): 321 (М+H).
300 МГц 1H ЯМР (ДМСО-d6): 8.28 (d, J=8.8 Гц, 1H), 7.77 (s,1H), 7.64(d, 1H, J=8.7), 3.52-3.57 (m, 2H), 3.17-3.19 (m, 2H), 1.83-1.98 (m, 4H).
b) Исходный 3-карбометокси-2-пирролидинокарбамид-7-хлор-4- гидроксихинолин получают следующим способом:
К суспензии 3-карбометокси-7-хлор-4-гидроксихинолин-2- карбоновой кислоты (2,25 г, 8,0 мМ) в тетрагидрофуране (20 мл) при температуре окружающей среды в атмосфере N2 добавляют дициклогексилкарбодиимид (1,65 г, 8,0 мМ) и пирролидин (0,596 г, 8,4 мМ). Реакционную смесь перемешивают при комнатной температуре 15 ч, после этого времени мочевину как побочный продукт, удаляют вакуумной фильтрацией. Заданный продукт чистят флэш-хроматографией на колонке, используя 5% метанол в хлороформе для получения указанного в заголовке соединения (2,52 г, 94,3%) в виде рыжевато-коричневого твердого вещества, Т.пл. 215oC; МС (CI): 335 (М+H).
300 МГц 1H ЯМР (ДМСО-d6): 8.12 (d, J=8.7 Гц, 1H), 7.60 (d, 1H J=1.8 Гц), 7.47(dd, 1H, J= 8.8, 2.0 Гц), 3.69(s,3H), 3.40-3.49 (m, 2H), 3.27-3.33 (m, 2H), 1.80-1.96 (m, 4H).
Исходный N-трет-бутоксикарбонил-N'-2-фторбензилгидразин получают следующим способом:
с) К смеси трет-бутилкарбазата (17,84 г, 135 мМ) и 2- фторбензилбромида (3,2 мл, 26,5 мМ) в диметилформамиде (30 мл) нагретой до 50oC добавляют триэтиламин (7,4 мл, 53,1 мМ). После перемешивания при 50oC в течение 30 мин реакционную смесь разбавляют водой и экстрагируют метиленхлоридом. Объединенные органические экстракты промывают водой, раствором соли, сушат над MgSO4 и концентрируют в вакууме. Сырой продукт чистят флэш колоночной хроматографией, используя 1:1 диэтиловый эфир:гексан в качестве элюента. Это дает указанное в заголовке соединение (5,13 г, 80%) в виде белого твердого вещества, МС (CI): 241 (М+H).
300 МГц 1H ЯМР (ДМСО-d6): 8.27 (br s, 1H), 7.40-7.50 (m, 1H), 7.25- 7.36 (m, 1H), 7.09-7.20 (m, 2H), 4.48(br s, 1H), 3.87-3.94(m, 2H), 1,37 (s, 9H).
Пример 83. 7-Хлор-1-гидрокси-3-(3-нитрофенил)-3,4,5,10- тетрагидропиридазино[4,5-b]хинолин-4,10-дион.
Указанное в заголовке соединение получают в основном как описано ранее в Примере 14, используя соответствующие подходящие исходные соединения для получения указанного в заголовке соединения и бутанол вместо этанола. Кроме того, продукт выделяют предварительно перед обработкой в метаноле метансульфокислотой.
Анализ для C17H9N4O5Cl:
Рассчитано: C, 53.07; H, 2.36; N, 11.02
Найдено: C, 53.55; H, 2.54; N,10.94
ЯМР (ДМСО-d6): 7.63 (d, J=8.9 Гц, 1H), 7.80-7.91 (m, 1H), 8.18-8.36 (m, 4H), 8.64 (s, 1H), 12.71 (br s, 1H), 13.36(br s, 1H).
MC(CI): 385(M+H).
Т.пл.(oC): >250
Пример 84. 7-Хлор-2-(3-фторфенил)-4-гидрокси-1,2,5,10- тетрагидропиридазино[4,5-b]хинолин-1,10-дион.
Указанное в заголовке соединение получают в основном как описано ранее в Примере 15, используя соответствующие подходящие исходные соединения для получения перечисленных соединений.
Анализ для C17H9N3O3ClF:
Рассчитано: C, 53.57; H, 3.07; N, 14.56
Найдено: C, 53.55; H, 2.94; N, 14.44
ЯМР (ДМСО-d6): 7.18-7.32 (m, 1H), 7.46-7.60 (m, 4H), 8.06 (s, 1H), 8.17 (d, J=8.7 Гц, 1H), 12.09 (br s, 1H), 12.92(br s, 1H).
ЯМР (ДМСО-d6): 7.18-7.32 (m, 1H), 7.46-7.60 (m, 4H), 8.06 (s, 1H), 8.17 (d, J=8.7 Гц, 1H), 12.09 (br s, 1H), 12.92(br s, 1H).
MC(CI): 358(M+H).
Т.пл.(oC): >250
Примеры 85-94. получают, в основном, как описано ранее в Примере 35, используя подходящие соответствующие исходные соединения. Физические характеристики и выходы из предшествующего ацилгидразида представлены в Таблице 2.
Примеры 95-103 получены, в основном, как описано ранее -в Примере 80, использованием соответствующих подходящих исходные соединений из 2-пирролидино хинолин предшественников, с физическими характеристиками и выходами представленными в Таблице 3.
Пример 104. 7-Хлор-4-гидрокси-2-(2, 5-дигидроксифенил)-1, 2, 5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион.
Суспензия 7-хлор-4-гидрокси-2-(2,5-диметоксифенил)-1,2,5,10- тетрагидропиридазино[4,5-b] хинолин-1,10-дион (0,5618 г, 1,4 мМ) оставляют кипеть в 50 мл 48% бромистоводородной кислоты. После приблизительно 45 мин суспензия превращается в оранжевый раствор. После 2 часов нагревания при температуре кипения, ВДЖХ анализ показывает, что реакция завершилась. После охлаждения раствор дает осадок, который удаляют фильтрацией и промывают водой до отсутствия кислотной реакции промывных вод. отделения твердых частиц. Подкисление конц. HCl дает рыжевато-коричневый осадок, который удаляют фильтрацией. Мокрый твердый продукт растворяют в метаноле и растворитель упаривают, получая заданный продукт (0,230 г, 44,3%) в виде рыжевато- коричневого твердого вещества.
Анализ для C17H11N3O5Cl• 0,7 HBr:
Рассчитано: C, 47.55; H, 2.75; N, 9.78
Найдено: C, 47.85; H, 3.85; N, 9.70
Химическая ионизация: m+1: 372
300 МГц протон ЯМР (ДМСО-d6/ТФА-d): 12.65 (br s, 1H, способн. к обмену), 8.2 (d, 1H, J=9.0 Гц), 8.12 (s, 1H), 7.47(d, J=9.0 Гц), 6.80 (d, 1H, J=6.0 Гц), 6.74(d, 1H), 6.70 (s, 1H).
Пример 105. 7-Хлор-4-гидрокси-2-(4-карбоксифенил)-1,2,5, 10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион.
Суспензия 7-хлор-4-гидрокси-2-(4-цианофенил)-1,2,5,10- тетрагидропиридазино[4,5-b] хинолин-1,10-диона (0,400 г, 1,04 мМ) в 50 мл 1 н. KОH нагревают при температуре кипения с обратным холодильником 5 ч, течение реакции контролируют ВДЖХ. Исходная суспензия медленно превращается в желтый раствор. Как показывает ВДЖХ, полное превращение в новое вещество завершается за 5 ч. Раствор охлаждают до 0oC и подкисляют конц. HCl. При подкислении сразу же образуется осадок, который удаляют фильтрацией с отстаиванием. Желтый спекшийся осадок промывают водой и затем суспендируют в 1:1 растворе этанол: метанол и растворитель удаляют в вакууме при 50oC. Процедуру повторяют до тех пор, пока желтый порошок не превратится в свободном пересыпающийся твердый продукт (0,400 г,100%), соответствующий заданному соединению.
Анализ для C18H10N3O5Cl•2,7 HCl:
Рассчитано: C, 44.38; H, 2.87 N, 9.15
Найдено: C, 44.83; H, 2.65, N, 8.71
Химическая ионизация: m+1: 384
300 МГц протон ЯМР (ДМСО-d6/ТФА-d): 13.04 (br s, 1H, способн. к обмену), 12.20 (br s, 1H, способн. к обмену), 8.1 (d, 1H, J=9.0 Гц), 8.08 (s, 1H), 8.03(d, 2H, J=9.0 Гц), 7.70 (d, 2H, J=9.0 Гц), 7.465(d, 1H).
Пример 106. 7-Хлор-4-гидрокси-2-(4-гидроксифенил)-1,2,5, 10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион.
К 50 мл раствора 5:1 48% HBr:метансульфокислота добавляют 7-хлор-4- гидрокси-2-(4-метоксифенил)-1,2,5,10-тетрагидро-пиридазино [4,5-b] хинолин-1,10-дион (1,0328 г, 27,9 мМ). Полученную суспензию нагревают при 110oC 3,5 ч. ВДЖХ показывает полное превращение в новое соединение. Суспензию охлаждают до комнатной температуры и фильтруют через воронку Бюхнера. Желтый твердый продукт промывают 2х100 мл порциями дистиллированной воды и затем 200 мл 1:1 раствора ТГФ:диэтиловый эфир. Затем продукт промывают гексаном до тех пор, пока твердое вещество не станет свободно пересыпающимся. Перед проведением анализа это вещество сушат 72 ч на воздухе. Для этой реакции процентный выход не зарегистрирован.
Анализ для C17H9N3O4Cl2• 2,3 HBr:
Рассчитано: C, 35.43; H, 1.97; N, 7.29
Найдено: C, 35.40; H, 1.95; N, 6.85
Химическая ионизация: m+1: 390
300 МГц протон ЯМР (ДМСО-d6/ТФА-d): 8.08 (s, 1H), 7.49 (s, 1H), 7.30(d, 2N, J=8.73 Гц), 6.8(d, 2H, J=8.73).
Пример 107. 7-Хлор-4-гидрокси-2-(4-карбоксамидофенил)-1,2, 5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион.
В 50 мл круглодонную колбу помещают 7-хлор-4-гидрокси-2-(4-цианофенил)- 1,2,5,10-тетрагидропиридазино[4,5-b] хинолин-1,10-дион (0,2040 г, 0,558 мМ). Это вещество растворяют в 6 мл H2SO4 и нагревают до 50oC. Теплый раствор выливают затем в 10,0 г ледяной крошки, в результате чего образуется желтый твердый продукт. Твердый продукт удаляют из водного раствора фильтрацией с отсосом и промывают 60 мл дистиллированной воды и затем 30 мл 1 н. NаHCО3. Полученную желтую пасту суспендируют в 1:1 этанол:метанол и растворитель удаляют в вакууме до тех пор, пока твердый продукт не станет свободно пересыпаться. Дополнительная промывка 60 мл метанола и затем 200 мл ТГФ дает желтый твердый продукт, который свободно пересыпается. После дополнительной сушки на воздухе получают заданный продукт (0,187 г, 87,7%) в виде твердого желтого вещества.
Анализ для C18H11N4O4Cl• 1,3 H2SO4:
Рассчитано: C, 42.37; H, 2.68; N,10.98
Найдено: C, 42.75; H, 3.10; N,10.61
FAB: m+1 277.2, 257.1, 299.1, 383.1
300 МГц протон ЯМР (ДМСО-d6/ТФА-d): 8.23 (s, 1H), 8.10 (s, 1H), 8.05(d, 2H, J=8.49Fu), 7.70 (d, 2H, J=8.49), 7.465 (d, J=8.49).
Пример 108. 7-Хлор-4-гидрокси-2-(4-тетразолфенил)-1, 2, 5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион.
К 10 мл NMP добавляют 7-хлор-4-гидрокси-2-(4-цианофенил)-1,2,5,10- тетрагидропиридазино[4,5-b]хинолин-1,10-дион (0,5 г, 1,37 мМ) и впоследствии триэтиламин (0,206 г, 1,57 мМ) и азид натрия (0,534 г, 8,22 мМ). Эту суспензию энергично перемешивают и нагревают при 170oC 6 ч. К этому времени ВДЖХ анализ показывает, что реакция завершилась. Раствору дают охладиться, при этом начинает образовываться осадок. К охлажденной суспензии добавляют диэтиловый эфир до прекращения дальнейшего образования осадка. Твердый продукт удаляют фильтрацией с отсосом и промывают диэтиловым эфиром, превращение твердого вещества в свободно пересыпающийся рыжевато-коричневый порошок. Порошок суспендируют потом в 100 мл 1 н. HCl для удаления избытка азида натрия и триэтиламин гидрохлорида. Твердый продукт удаляют фильтрацией и промывают 1: 1 метанол:диэтиловый эфир раствором до превращения рыжевато-коричневого твердого продукта в свободно пересыпающийся порошок. После дополнительной сушки на воздухе зарегистрирован заданный продукт (0,552 г, 99,1%).
Анализ для C18H11N4O4Cl• 2,4 H2O:
Рассчитано: C, 47.93; H, 3.30; N, 21.73
Найдено: C, 47.36; H, 3.32; N,10.57
FAB: m+1 277.2, 257.1
300 МГц протон ЯМР (ДМСО-d6/ТФА-d): 12.10 (br s, 1H, способн. к обмену), 8.19-8.12 (m, 4H), 8.065 (s, 1H), 7.85(d, 3H, J=9.00 Гц).
Пример 109. 7-Хлор-4-гидрокси-2-(4-N, N-диметилкарбоксами-до фенил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин-1,10- дион.
В 20 мл безводного ТГФ суспендируют 7-хлор-4-гидрокси-2-(4- карбоксифенил)-1,2,5,10-тетрагидропиридазино[4,5-b] хинолин- 1,10-дион (0,3436 г, 0,897 мМ) в атмосфере азота. К этой суспензии добавляют SOCl2 (0,13 мл, 1,79 мМ). Смесь нагревают затем при температуре кипения с обратным холодильником около 60 мин и добавляют 1 мл ДМФ. По окончании добавления ДМФ суспензия сразу же превращается в светло-желтый раствор, который через 5 мин опять превращается, в конечном счете, в желтую суспензию. ТГФ удаляют при пониженном давлении и добавляют 10 мл ДМФ при комнатной температуре. Полученный темно-оранжевый раствор охлаждают до -10oC. К этому раствору добавляют диэтиламин (0,27 мл, 2,69 мМ). Сразу же после добавления диэтиламина образуется темно-красный осадок. Эту суспензию поддерживают охлажденной во время медленного добавления 50 мл 1 н. HCl наряду с 50 мл насыщенного NaCl, приводящих к образованию желтого осадка. Осадок отделяют фильтрацией и промывают 200 мл воды и впоследствии 100 мл диэтилового эфира. Дополнительная промывка 4:1 диэтиловый эфир: метанол приводит к свободно пересыпающемуся твердому веществу. После дополнительной сушки на воздухе получают заданный продукт (0,1485 г, 38,1%) в виде желтого твердого вещества.
Анализ для C22H19N4O4Cl•1,7 HCl:
Рассчитано: C, 52.75; H, 4.16; N, 11.18
Найдено: C, 52.63; H, 4.45; N,10.85
Химическая ионизация: m+1: 439
300 МГц протон ЯМР (ДМСО-d6/ТФА-d): 12.90 (br s, 1H, способн. к обмену), 12.08 (br s, 1H, способн. к обмену), 8.21 (s, 1H, J=9.00 Гц), 8.11(s, 1H), 87.67 (d, 2H, J=9.00 Гц), 7.48-7.46 (m, 3H, J=6.15), 3.47-3.25 (br m, 4H), 1.15 (br s, 6H).
Пример 110. 7-Хлор-4-гидрокси-2-(4-карбоксиметилфенил)-1, 2, 5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион.
К 50 мл абсолютного метанола добавляют 7-хлор-4-гидрокси-2-(4- карбоксифенил)-1,2,5,10-тетрагидропиридазино[4,5-b] хинолин-1,10-дион (0,30 г, 0,785 мМ). К этой белой суспензии добавляют две капли концентрированной H2SO4 и суспензию оставляют нагреваться при температуре кипения с обратным холодильником, контролируя реакцию ВДЖХ в течение 26 ч. Суспензии дают охладиться до комнатной температуры, после чего суспензию разбавляют диэтиловым эфиром (100 мл), вызывая дополнительное осаждение. Осадок удаляют фильтрацией с отсосом и промывают 50 мл 7:1 диэтиловый эфир:метанолом. После сушки на воздухе получают заданный продукт (0,327 г,100%) в виде белого твердого вещества.
Анализ для C19H12N3O5Cl•1,5 HCl:
Рассчитано: C, 50.43; H, 3.01; N, 9.21
Найдено: C, 50.91; H, 3.60; N, 9.36
Химическая ионизация: m+1: 398
300 МГц протон ЯМР (ДМСО-d6/ТФА-d): 8.15(d, 1H, J=9.00), 8.05 (d, 3H), 7.75 (d, 2H, J=9.00 Гц), 7.47 (d, 1H, J=9.00), 3.87 (s, 3H).
Пример 111. 7-Хлор-4-гидрокси-2-(4, 4-диметил-2, 5-диоксо- оксазолидин-лил-этил)-1,2,5,10-тетрагидропиридазино[4,5-b] хино-лин-1,10-дион.
Гидрид натрия, 60% в минеральном масле (150 мг, 3,75 мМ) промывают сухим гексаном и суспендируют в диметилформамиде (20 мл). 4,4-Диметил-оксазолин-2,5-дион (580 мг, 4,5 мМ) добавляют порцией за 15 мин при комнатной температуре. Полученную смесь перемешивают 15-20 мин при комнатной температуре. По окончании этого времени исходный 7-Хлор-4- гидрокси-2-(2-бромэтил)-1,2,5,10-тетрагидропиридазино[4,5-b] хинолин-1,10-дион добавляют и реакционную смесь быстро нагревают до 150oC. После приблизительно трех часов при этой температуре, нагрев убирают и реакционную смесь выливают в охлажденную льдом 1 н. HCl (100 мл). Эту смесь перемешивают приблизительно 5-10 мин и фильтруют с отсосом. Полученный на фильтре осадок промывают водой и диэтиловым эфиром, затем сушат в вакууме, получая заданный продукт в виде белого твердого вещества (280 мг, 67%).
Пример 112. 7-Хлор-4-гидрокси-2-(2-метил-2-гидроксипро- пионамидо этил)-1,2,5,10-тетрагидропиридазино[4,5-b]хинолин- 1,10-дион (9740-178-1).
Исходный 7-хлор-4-гидрокси-2-(4,4-диметил-2,5-диоксо- оксазолидинлилэтил)-1,2,5,10-тетрагидропиридазино[4,5-b] хинолин- 1,10-дион (400 мг, 0,95 мМ) суспендируют в воде (30 мл) при комнатной температуре. К суспензии добавляют 1 н. NaOH (2,0 мл). Образуется прозрачный раствор, который нагревают при 50oC 2 ч. По прошествии этого времени добавляют 1,2н HCl (5 мл). Смесь перемешивают еще 30 мин при 50oC, затем охлаждают до комнатной температуры. Белый осадок выделяют фильтрацией и сушат, получая указанное в заголовке соединение в виде белого твердого вещества (330 мг, 89%).
Пример 113. 7-Хлор-4-гидрокси-2-(2-метилтиоэтил)-1,2,5, 10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион.
К суспензии NаSCH3 (230 мг, 3,2 мМ) в диметилформамиде (20 мл) добавляют за одну порцию 7-Хлор-4-гидрокси-2-(2-бромэтил)-1,2,5, 10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион в виде сухого порошка. Эту смесь нагревают до слабого кипения с обратным холодильником приблизительно в течение 3 ч. Затем нагрев удаляют и реакционную смесь выливают в охлажденную льдом HCl (100 мл) и перемешивают около 1 ч. Полученный осадок отделяют вакуумной фильтрацией и промывают водой и диэтиловым эфиром, затем сушат в вакууме при 50oC, получая 330 мг (91%) не совсем белого порошка. Т.пл.=275-277oC; МС: 338(М+1).
ЯМР: 2.11 (s, ЗH), 2.79 (t, 2H, J=7,13), 4.09 (t, 2H, J=7,08), 7.42 (dd, 1H, J=8.59, J2=1.6), 8.57 (d, 1H, J=1.77), 8.13 (d, 1H, J=8.64), 11.8 (br s, 1H), 12.64 (br s, 1H).
Пример 114. 7-Хлор-4-гидрокси-2-(2-метилсульфонилэтил)-1, 2, 5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион.
К раствору 7-хлор-4-гидрокси-2-(2-метилтиоэтил)-1,2,5,10- тетрагидропиридазино[4,5-b]хинолин-1,10-диона (0,11 г, 0,33 мМ) в метаноле (5 мл) перемешиваемому при комнатной температуре, добавляют оксон, моноперсульфат соединение (250 мг, 1,0 мМ), растворенное в воде (1 мл). Полученную смесь перемешивают при комнатной температуре 17 ч. Добавляют воду (10 мл) и реакционную смесь фильтруют. Сырой продукт снова перемешивают с водой до полного удаления оксиданта. Фильтрация и вакуумная сушка дают аналитически чистый продукт в виде белого твердого вещества. Выделено 95 мг, 75%.
Пример 115. 7-Хлор-4-гидрокси-2-(тиофен-2-илметил)-1,2, 5,10-тетрагидропиридазино[4,5-b]хинолин-1,10-дион.
К раствору 2-(тиофен-2-илметил)-трет-бутилкарбазата (1,0 г, 4,4 мМ) и 2- пирроламидо-3-карбокси-7-хлорхинолин-4-она (1,2 г, 3,6 мМ) в тетрагидрофуране (75 мл), перемешиваемому при комнатной температуре, добавляют диизопропилкарбодиимид (0,84 мл, 5,4 мМ). Эту смесь перемешивают при комнатной температуре 2,5 ч, затем фильтруют с отсосом во второй реакционный сосуд. К фильтрату (перемешиваемому при комнатной температуре) добавляют метансульфокислоту (12 мл, 185 мМ). Полученный раствор перемешивают при комнатной температуре 17 ч. ТCХ анализ к этому времени показывает завершение реакции. Реакционную смесь выливают в ледяную воду (200 мл). Эту суспензию перемешивают около 15 мин и фильтруют Спекшийся осадок после фильтрования промывают водой и диэтиловым эфиром, затем сушат в вакууме, получая аналитически чистое указанное соединение (1,1 г, 84%).
Физические характеристики для примеров 111-144 представлены в таблицах 4-8 перед формулой изобретения.
Алкил(C1-C6)амино соединения легко реагируют с бензоилхлоридами, образуя алкилбензамид PQDs. Например, получен R1 в виде 2-этилбензамид производного, активный в качестве глицин рецепторного антагониста.
Пример 145. Приведенные далее иллюстрированные фармацевтические дозированные формы, содержащие соединения формулы I или его фармацевтически приемлемую соль, даны для примера применения в терапевтических и профилактических целях любого из предыдущих примеров соединения (далее обозначенного здесь "соединение X"):
(а) Таблетка, мг%:
Соединение Х - 50,0
Маннитол, Фармакопея CША - 223,75
Натрий кроскармелоза - 6,0
Маисовый крахмал - 15,0
Гидроксипропилметилцеллюлоза (HРМС)
Фармакопея CША - 2,25
Магний стеарат - 3,0
(b) Капсула, мг:
Соединение Х - 10,0
Маннитол, Фармакопея CША - 488,5
Натрий кроскармелоза - 15,0
Магний стеарат - 1,5
Приведенные выше составы могут быть получены обычными способами, хорошо известными в фармацевтической технике. Таблетки могут быть покрыты энтеросолюбильной оболочкой общепринятыми способами, например, оболочка из целлюлозы ацетатфталата.
Пример 146. Приведен состав, подходящий для парентерального применения, полученный с применением соединения примера 2:
Парентеральный состав, мг/мл%
Соединение - 10,0
Меглумин - 19,5
Декстроза, безводная - 39,5
Стерильная вода для инъекций, мл - до 1
Раствор готовят, используя обычные приемы, хорошо известные в области фармацевтики. Обычно составы для этого класса соединений и их солей, не являющихся ацилированными соединениями, могут быть получены растворением активного соединения в водном растворе меглумина (N-метилглюкамина), содержащем эквимолярное количество или, если растворение затруднено, молярный избыток меглумина относительно соединения. При изготовлении составов предпочтительны соли холина. Добавки, такие как декстроза, могут быть добавлены для поддержания осмоляльности состава. Вода для инъекции добавляется для приведения раствора к конечному объему. Или же иначе, амино основания, такие как трометамин или L-аргинин, могут быть использованы для растворения активного соединения.
Пример 147. Состав готовят как в примере 49, за исключением, что соль холина соединения Х используют вместо соединения примера 2.
Пример 148. Готовят состав, включающий 5%-ный водный раствор декстрозы, содержащий 10 мг/мл соли холина соединения X.
Приведенные выше примеры не являются ограничивающими, таким образом, соединения формул I или I' (или II, или III) и содержащие из фармацевтические композиции могут быть использованы для лечения или профилактики приступов или связанных с ними заболеваний.
Приведенные далее схемы и формулы даны для пояснения, как получить соединения изобретения. Соединения, приведенные в примерах 5, 7, 9, 16, 18 и 20, оказались неактивными в in vitro глицин рецепторном испытании и, в частности, исключены из соединений формулы I или III.

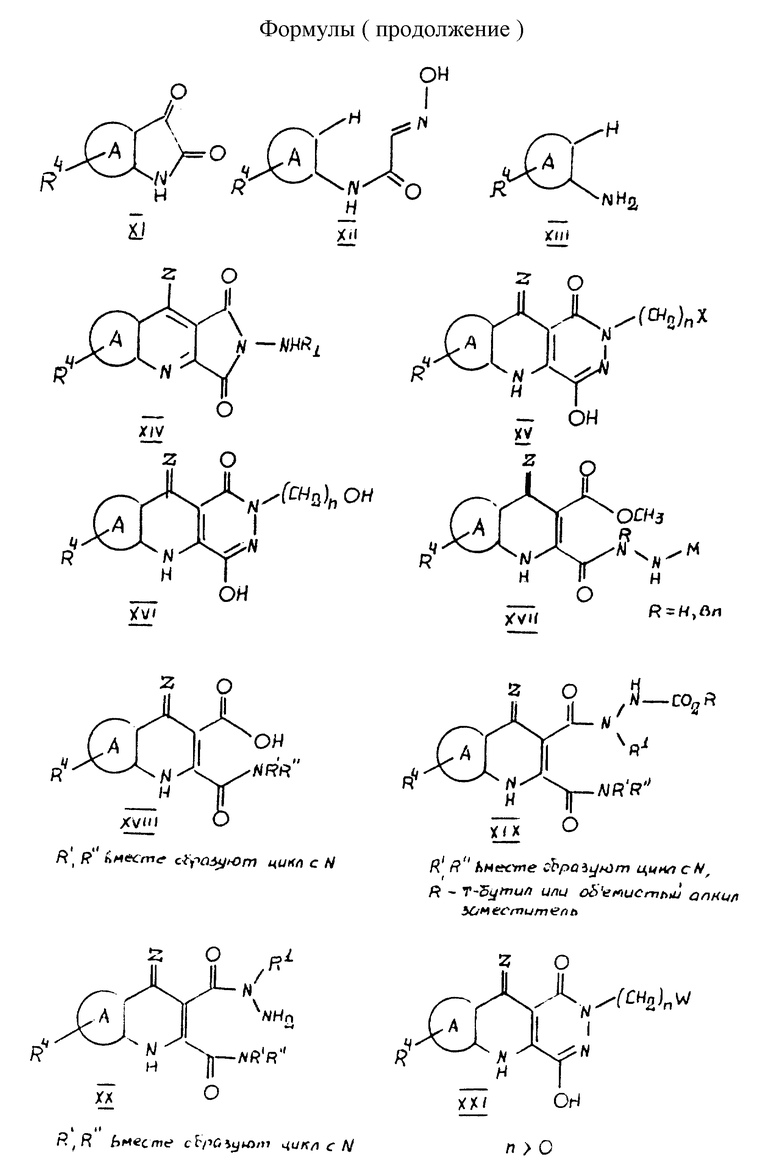
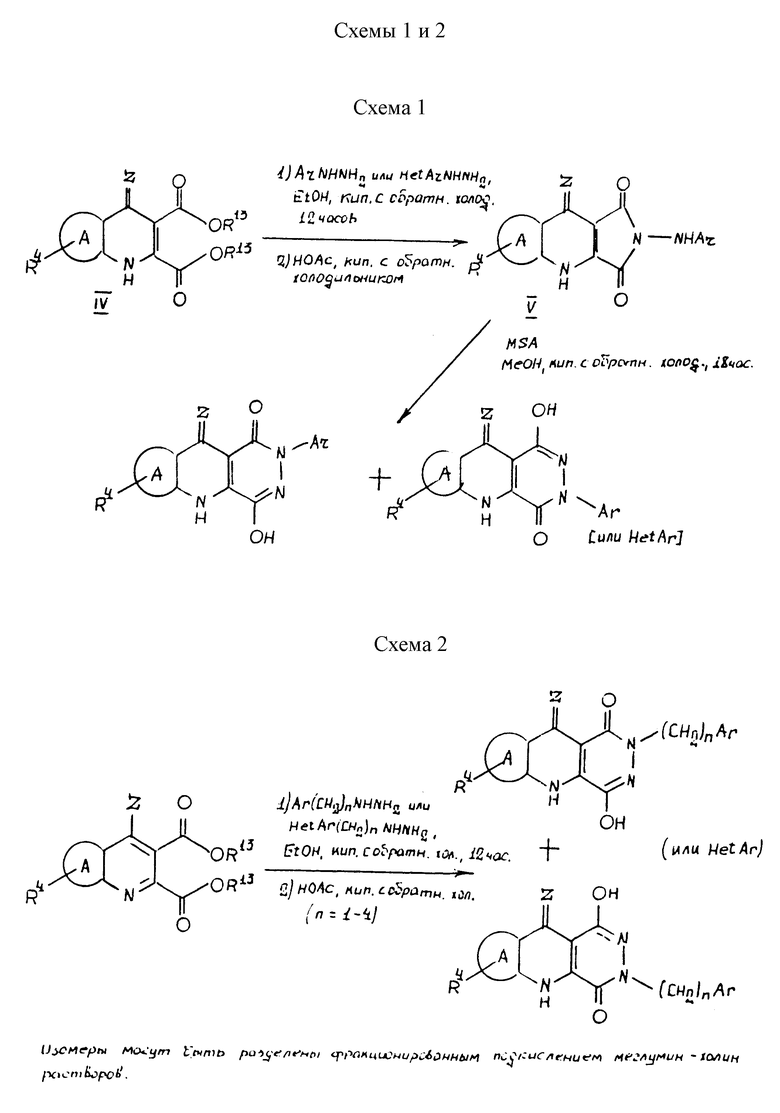

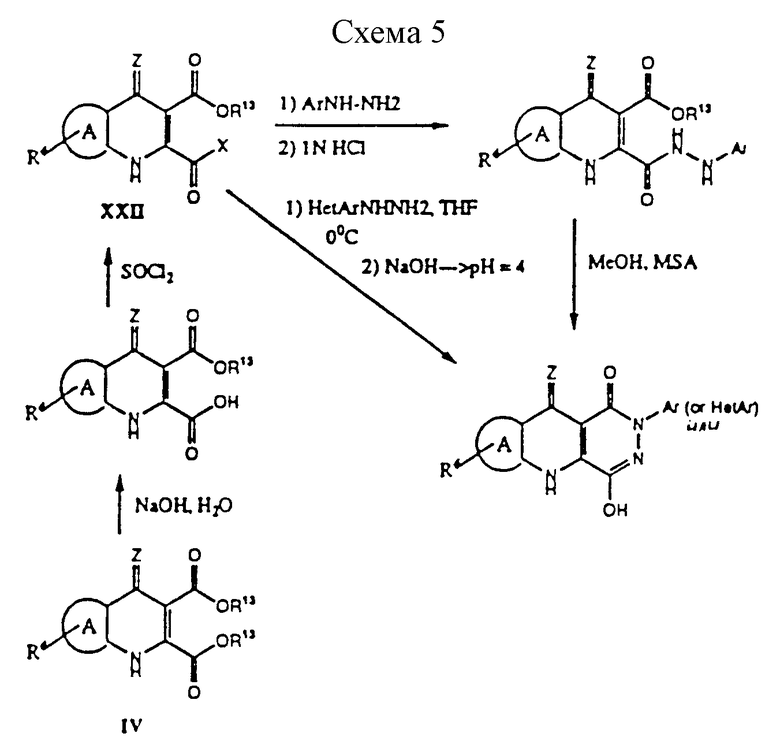
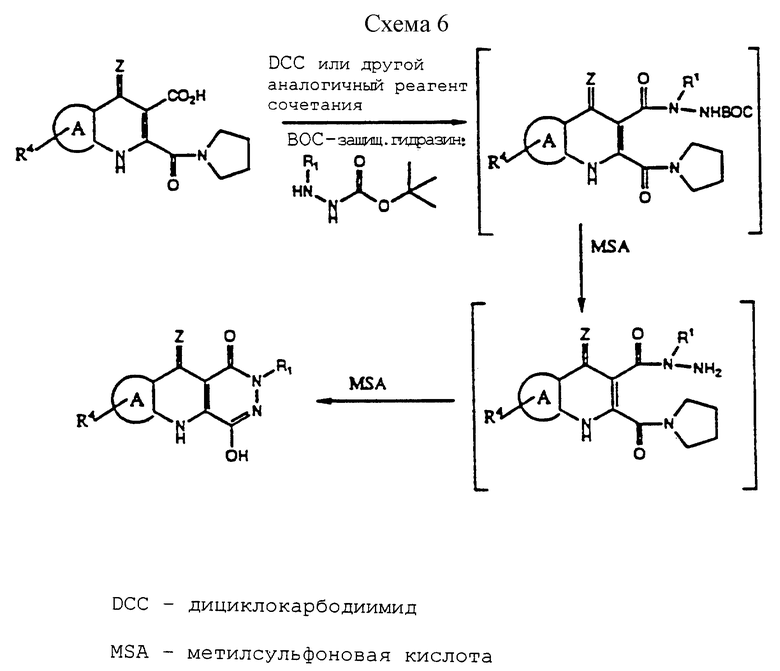
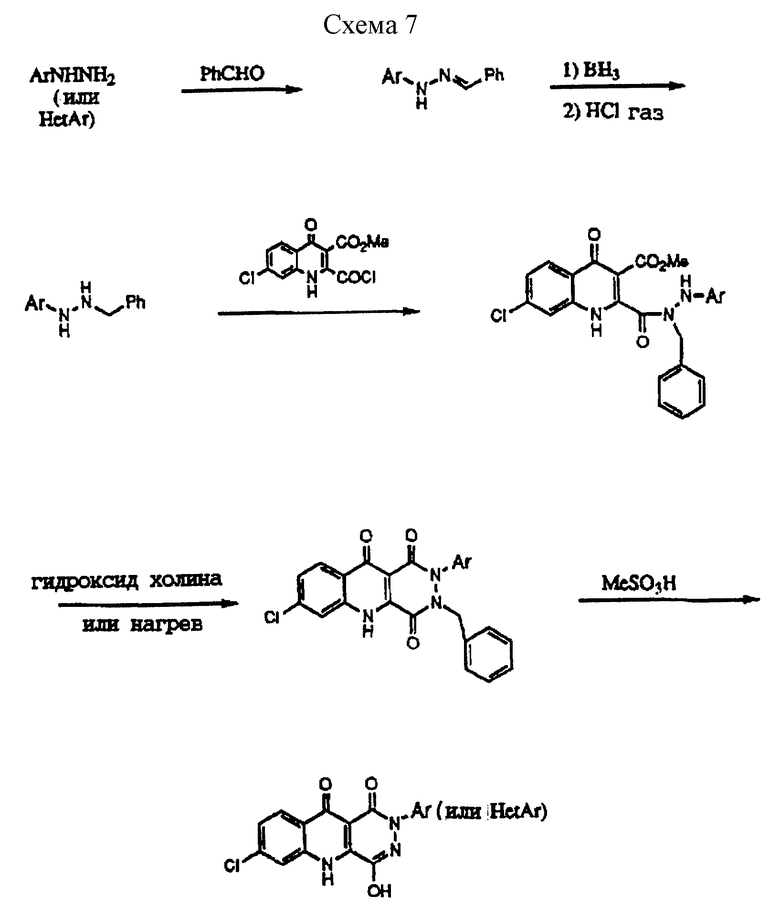
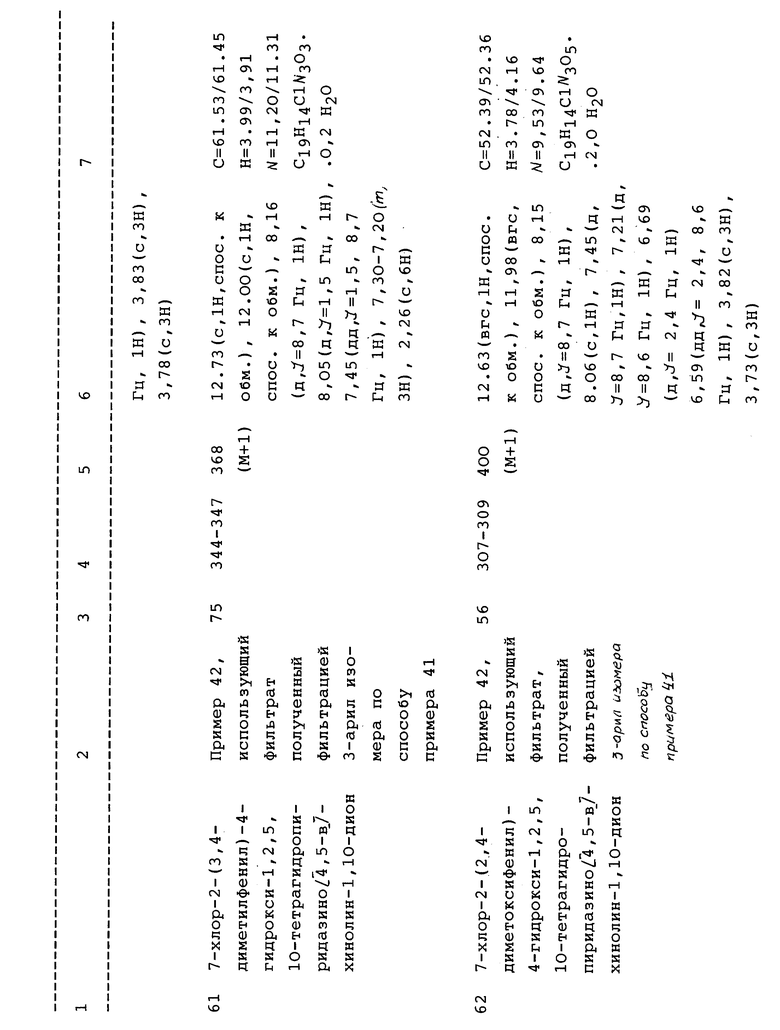
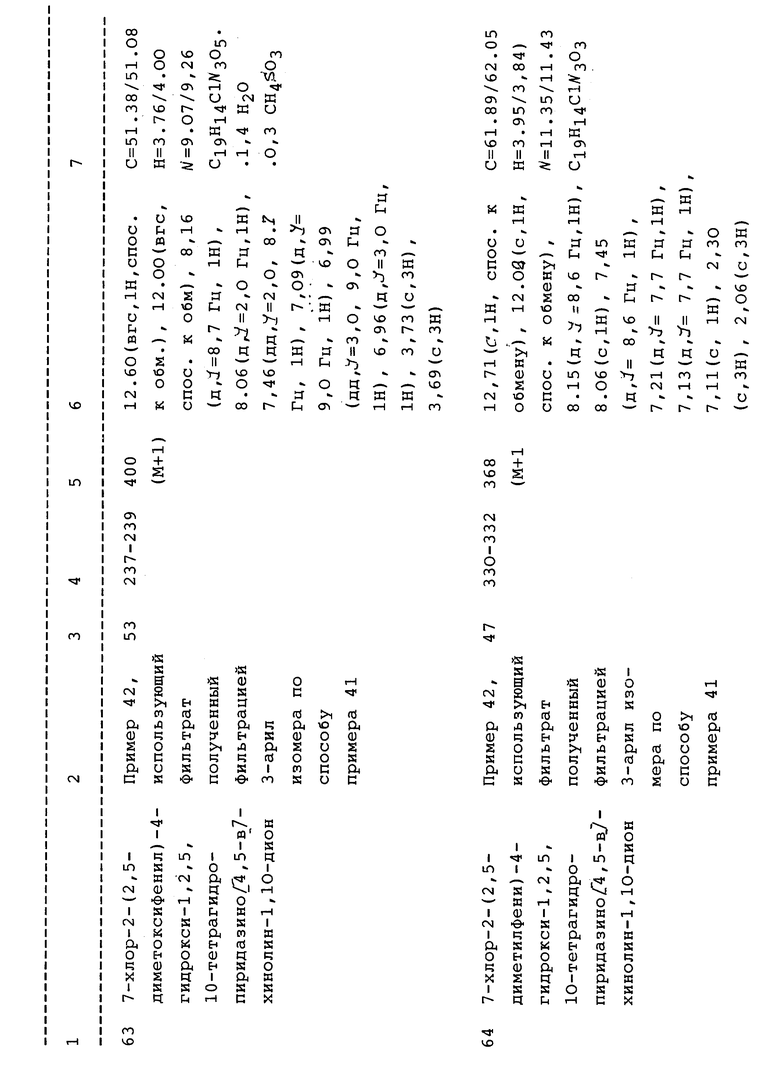
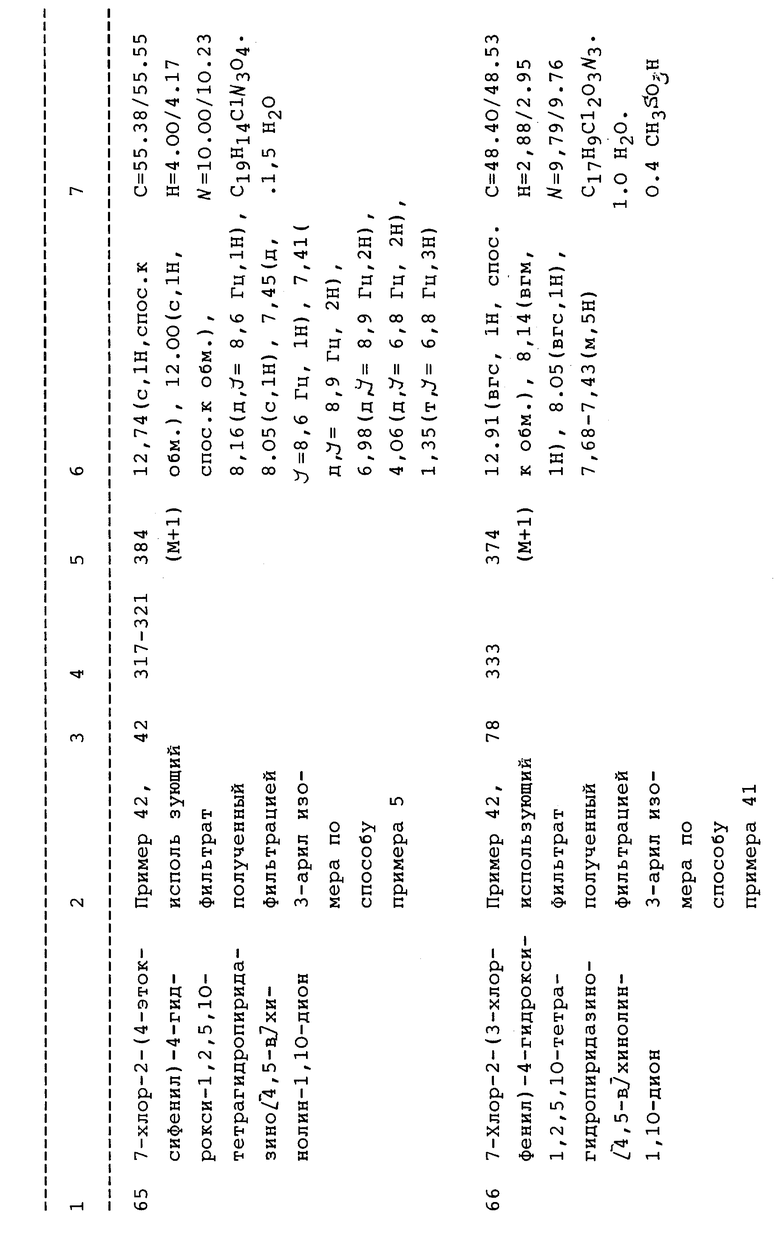
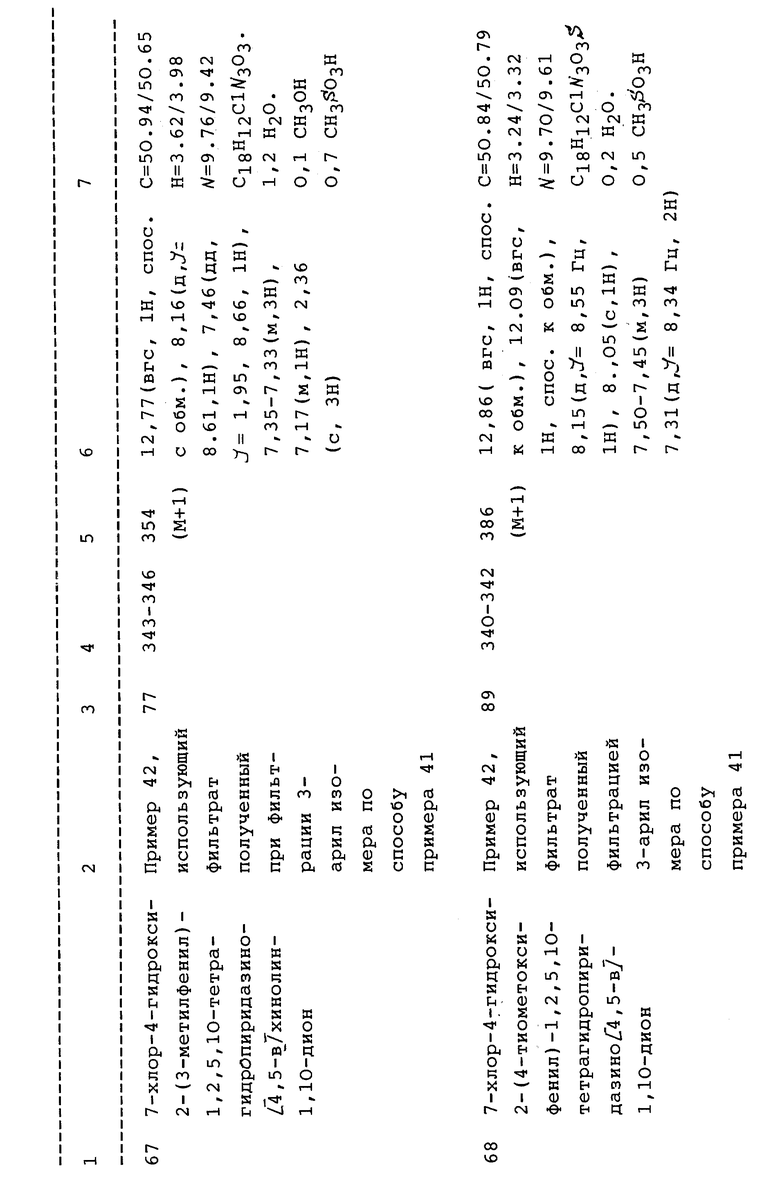

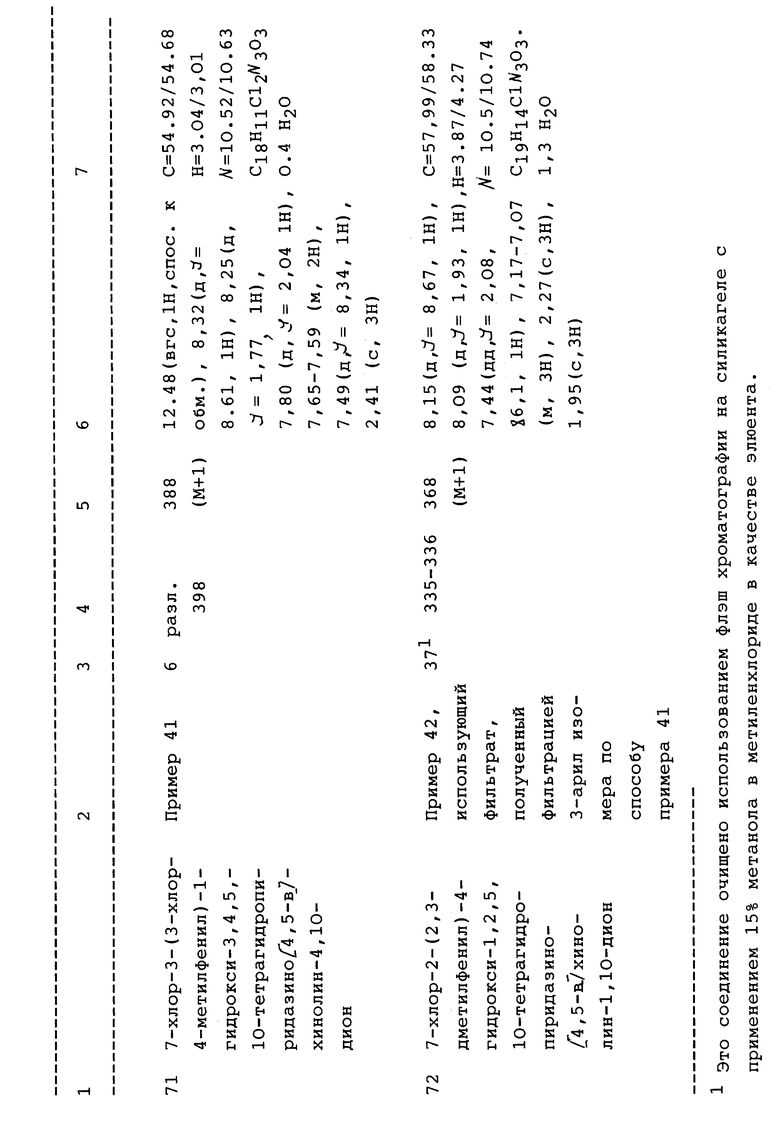
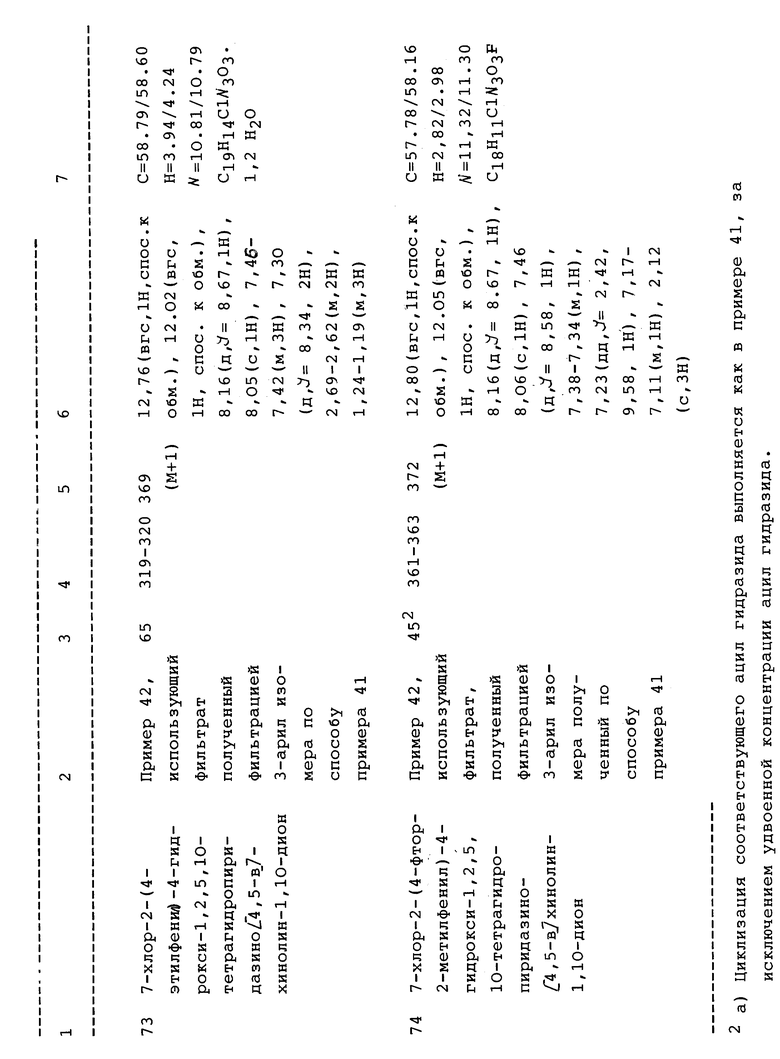


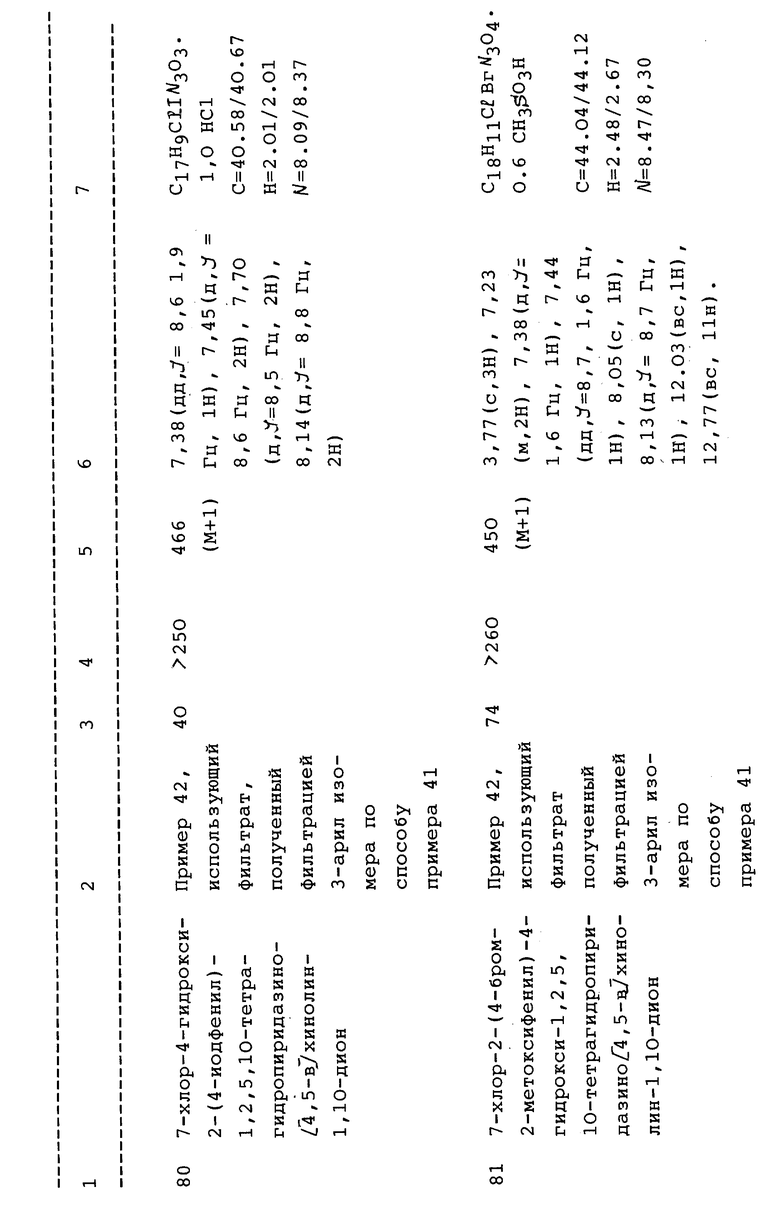

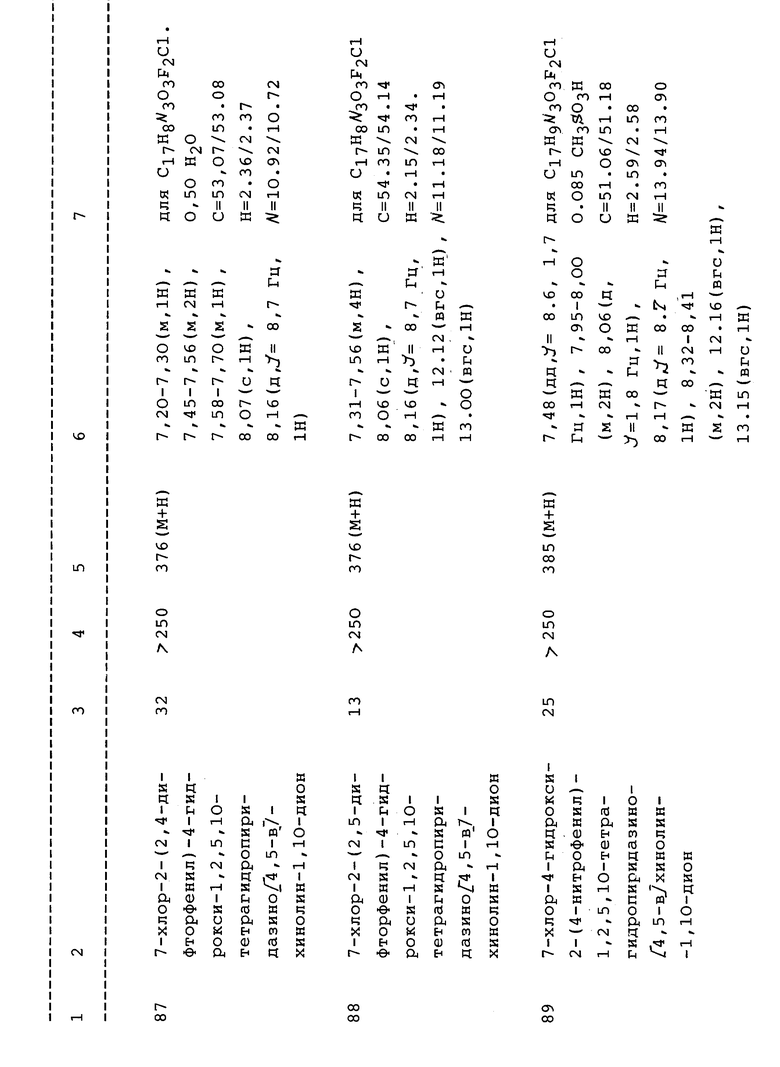
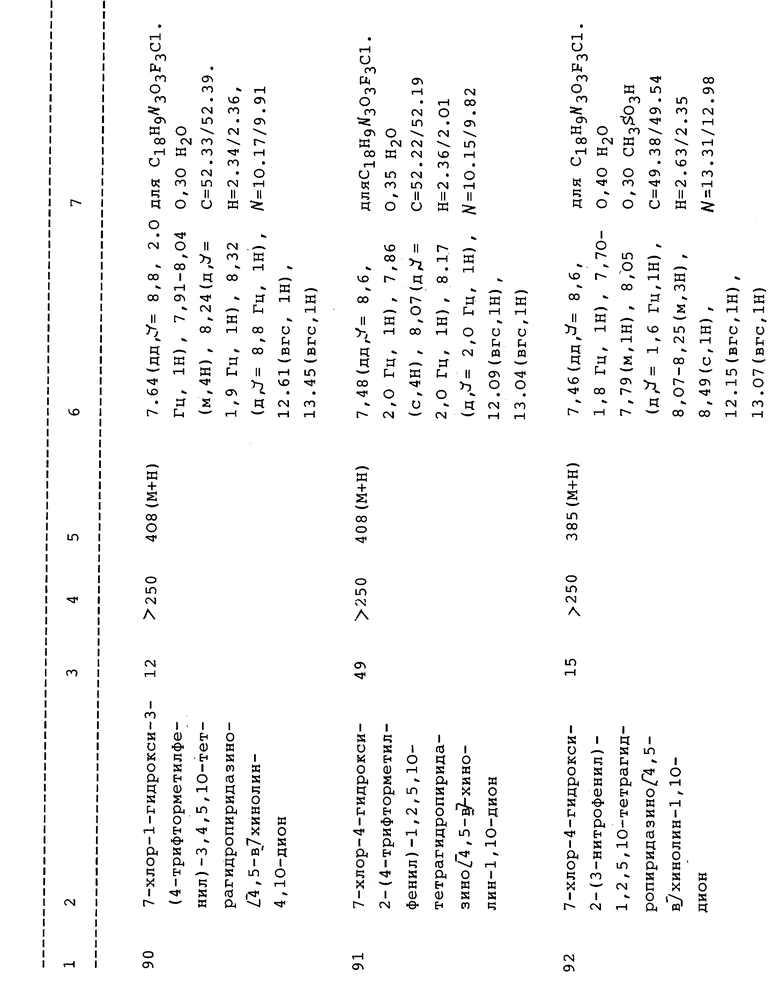

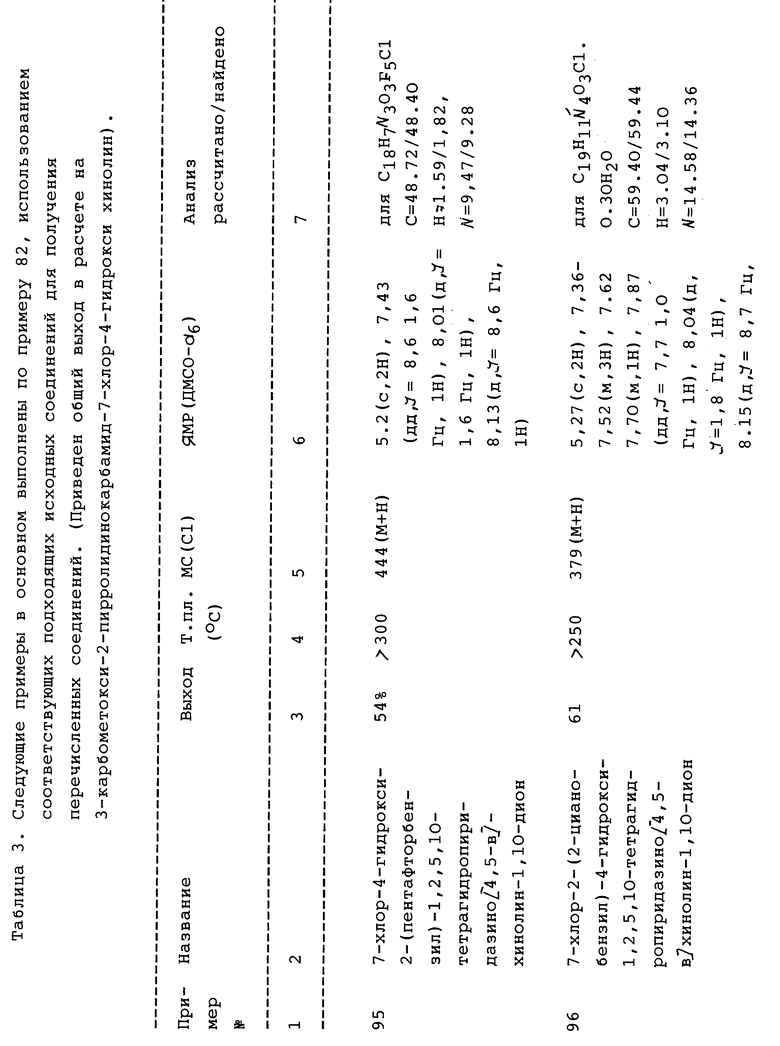

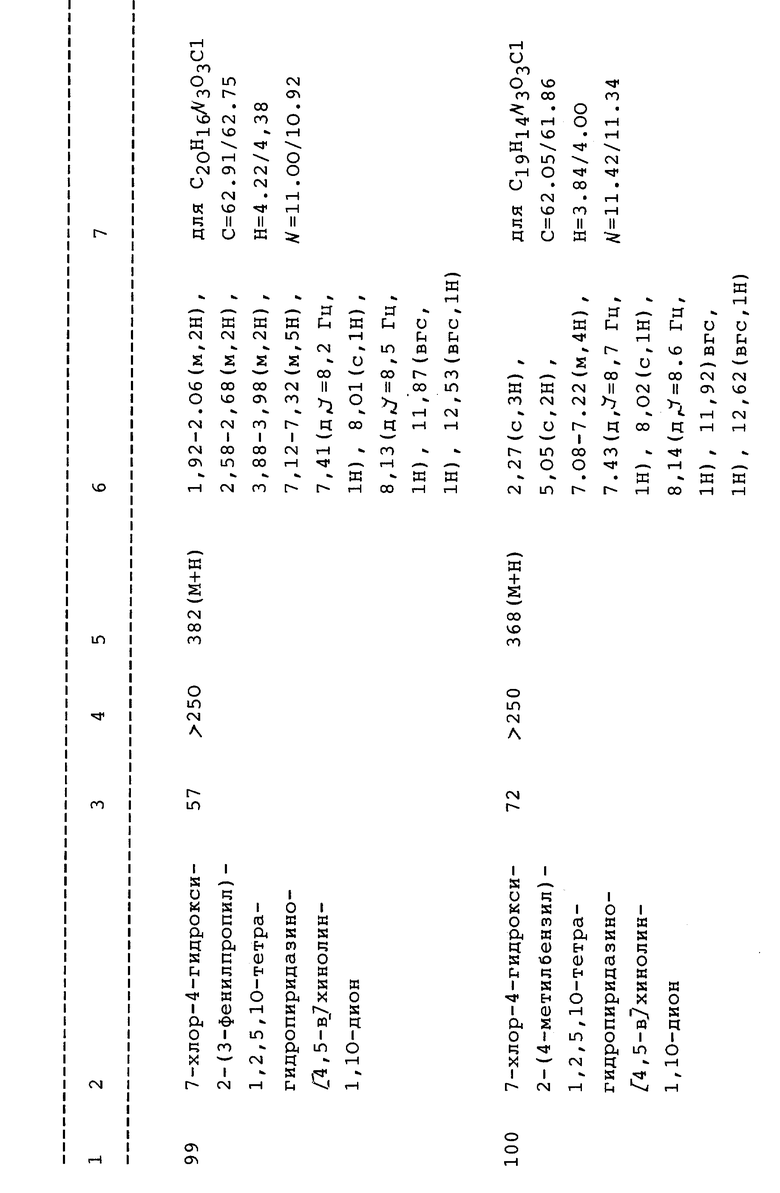



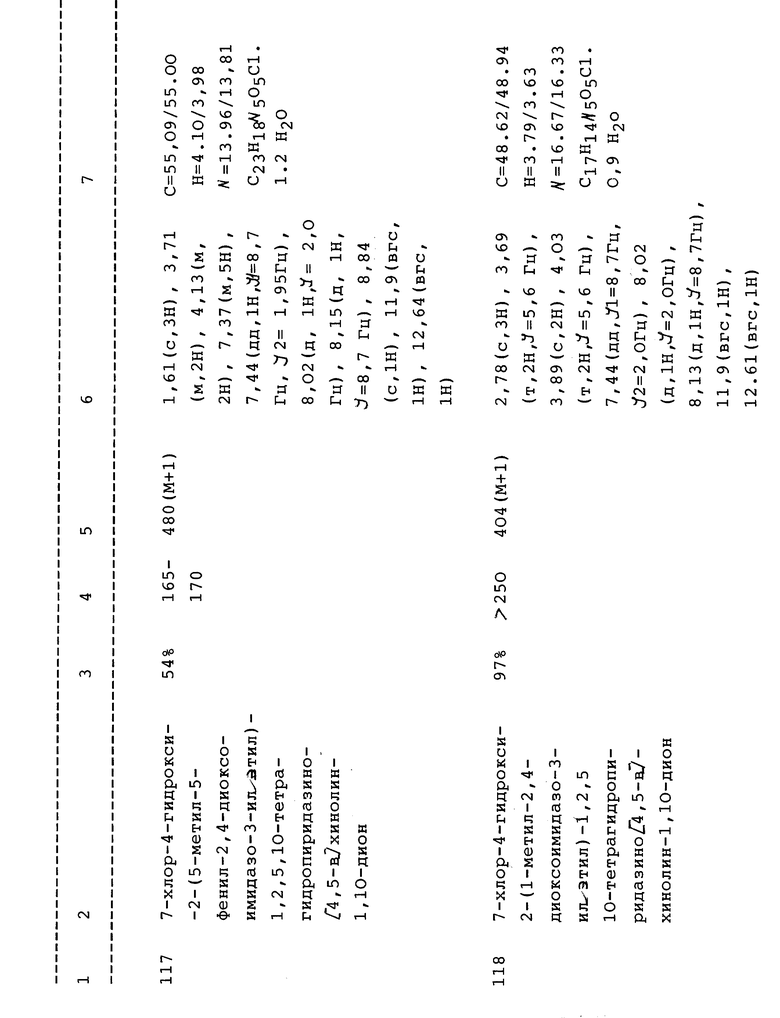
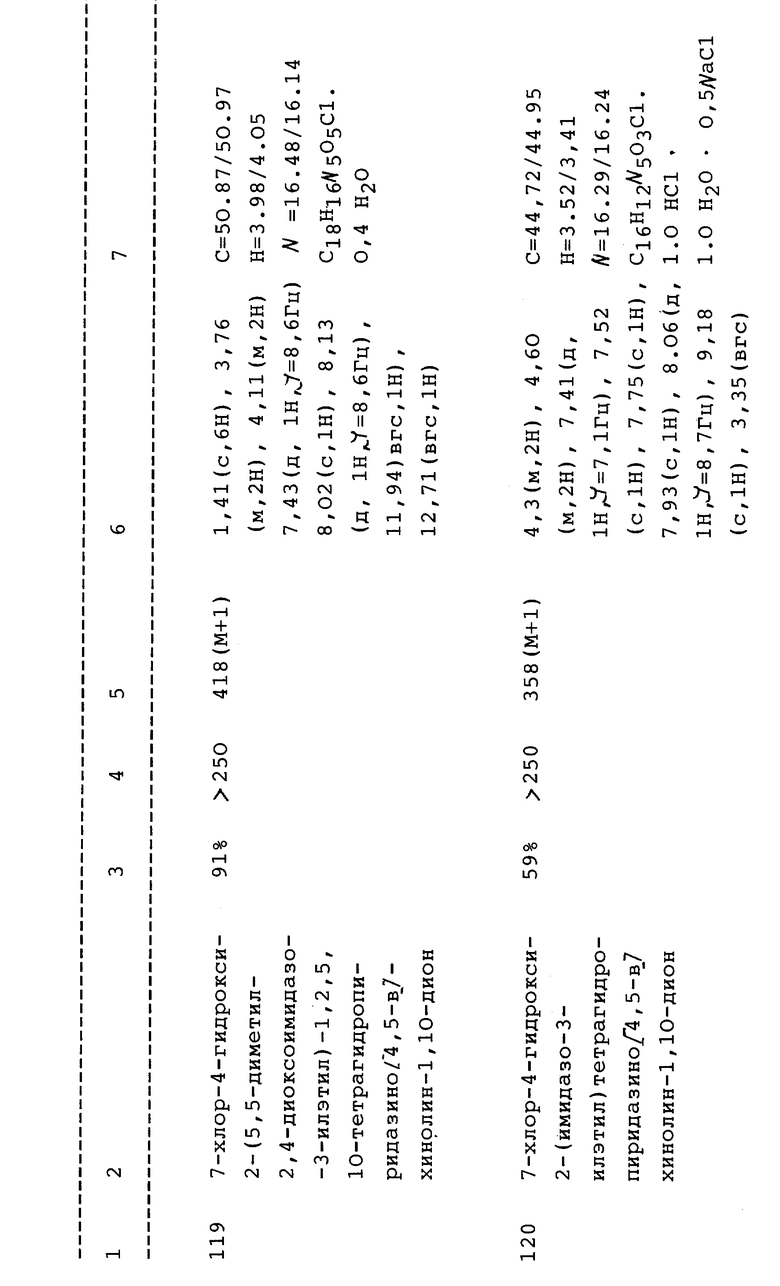
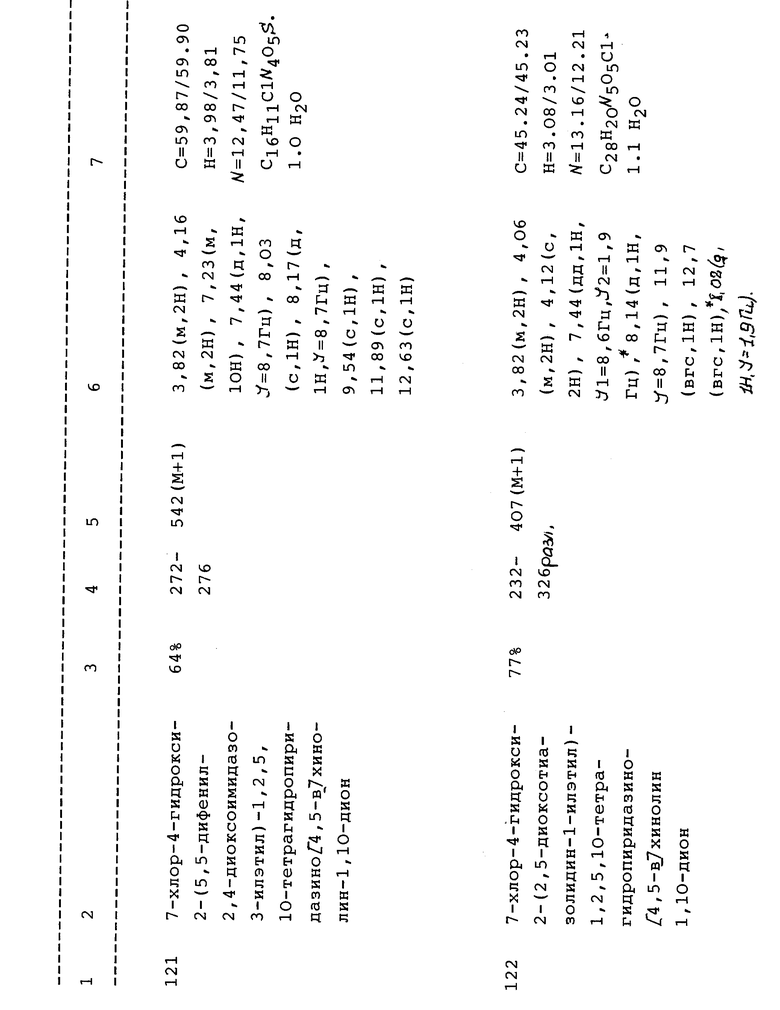
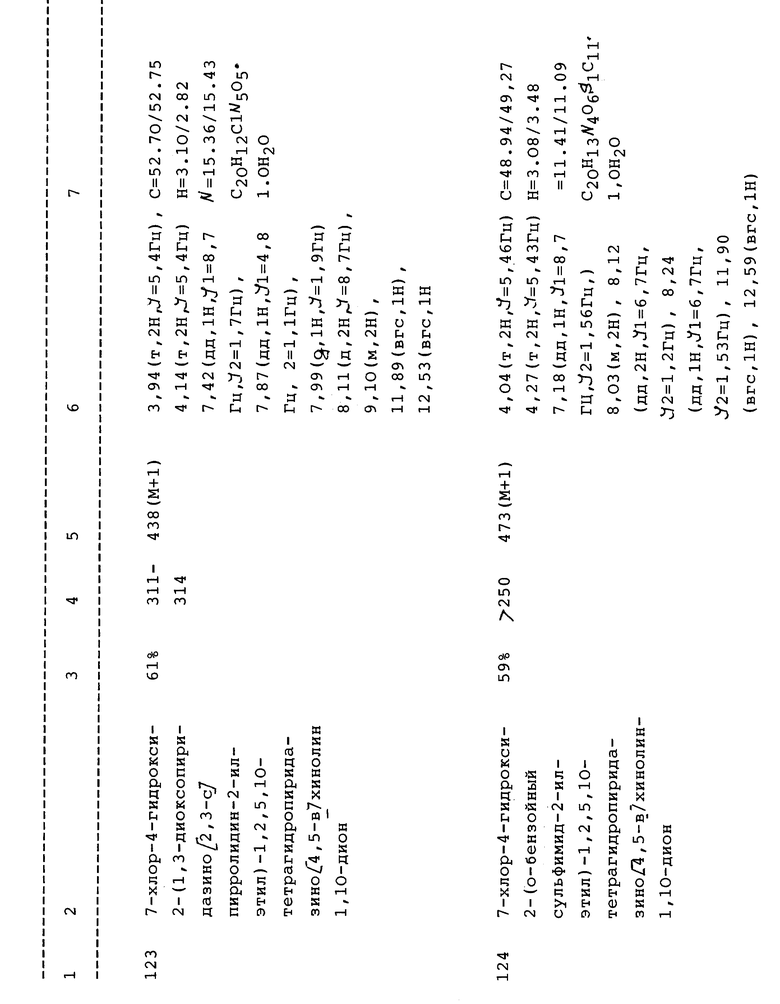
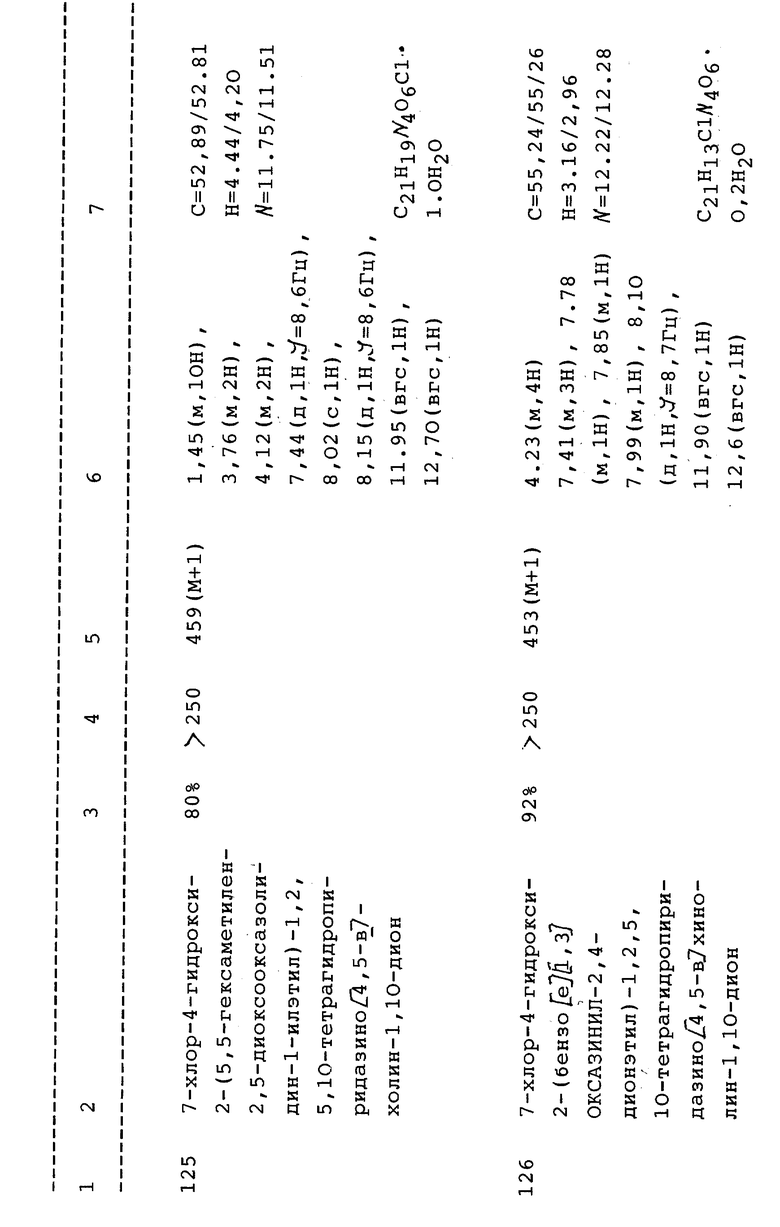

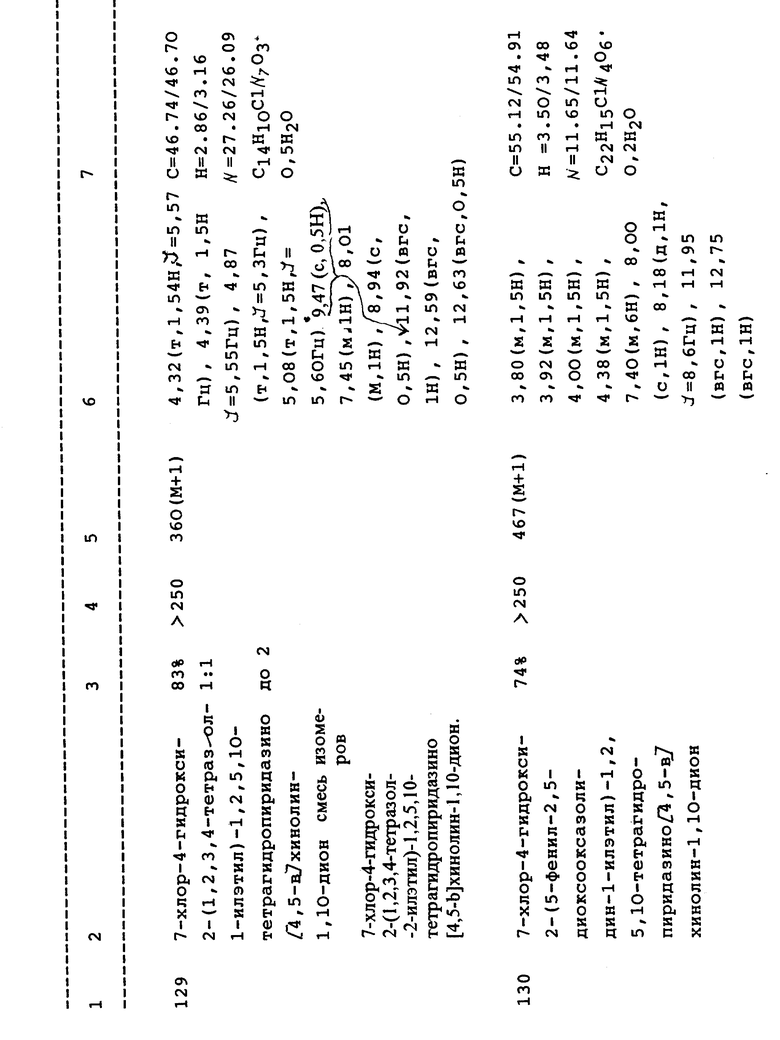
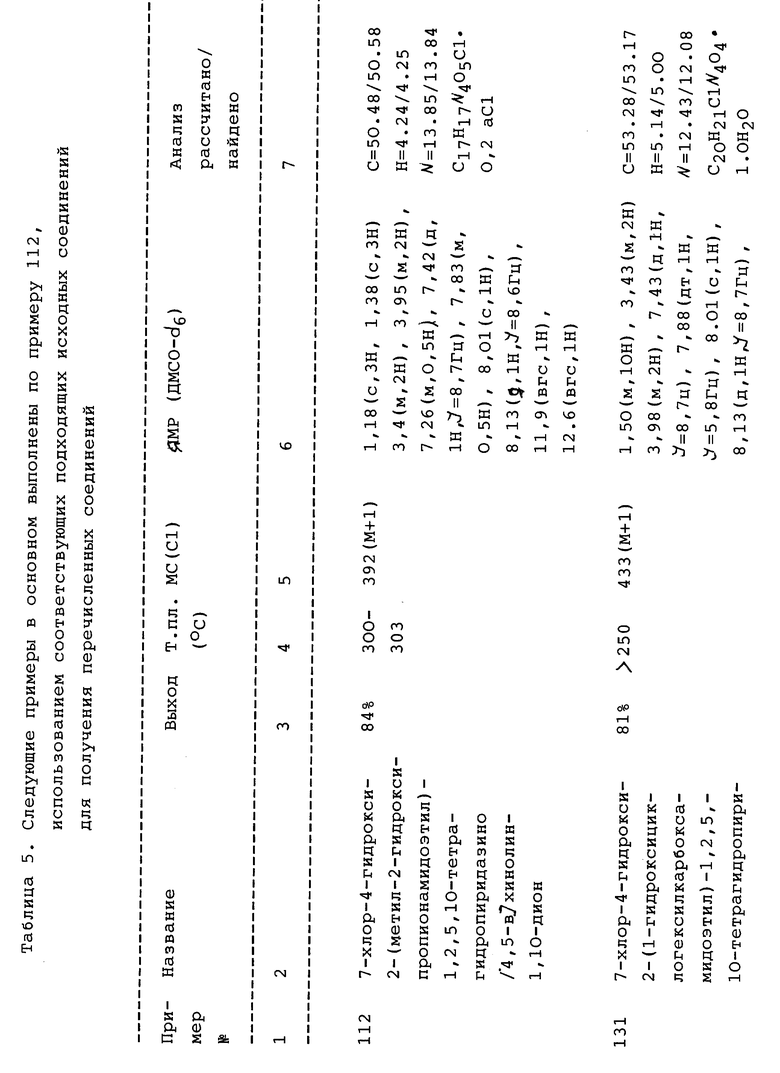
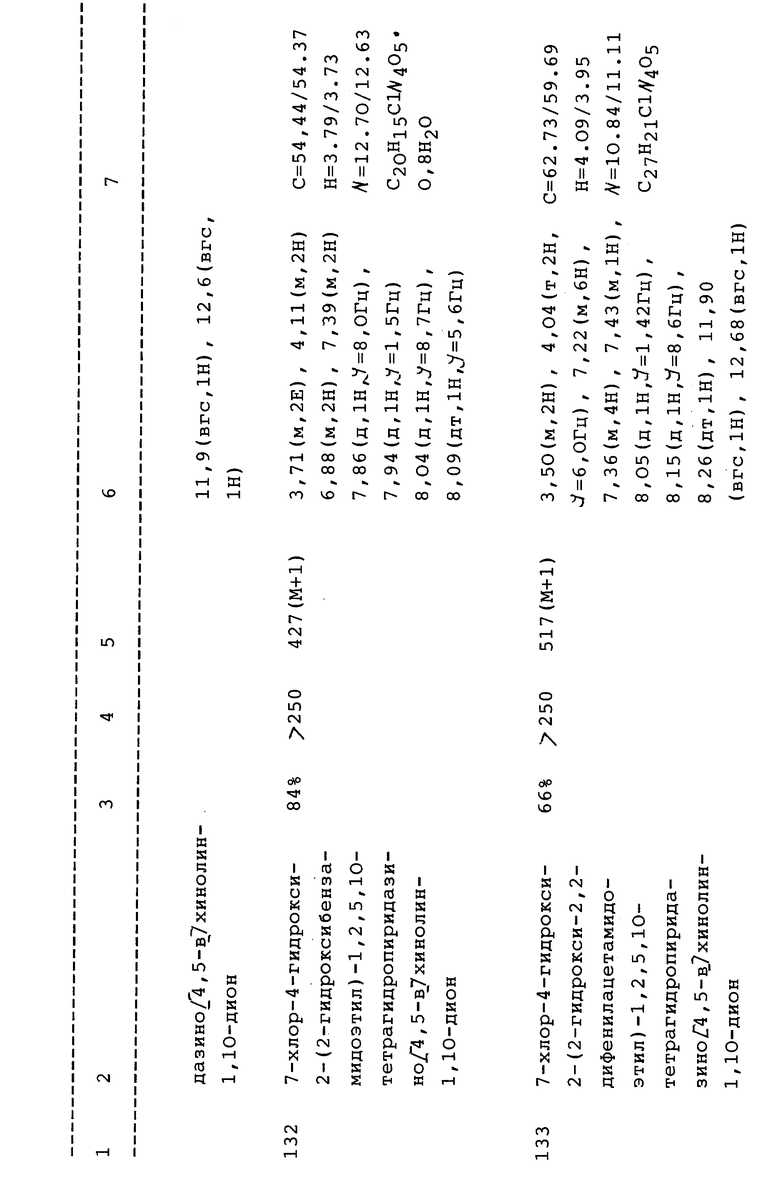

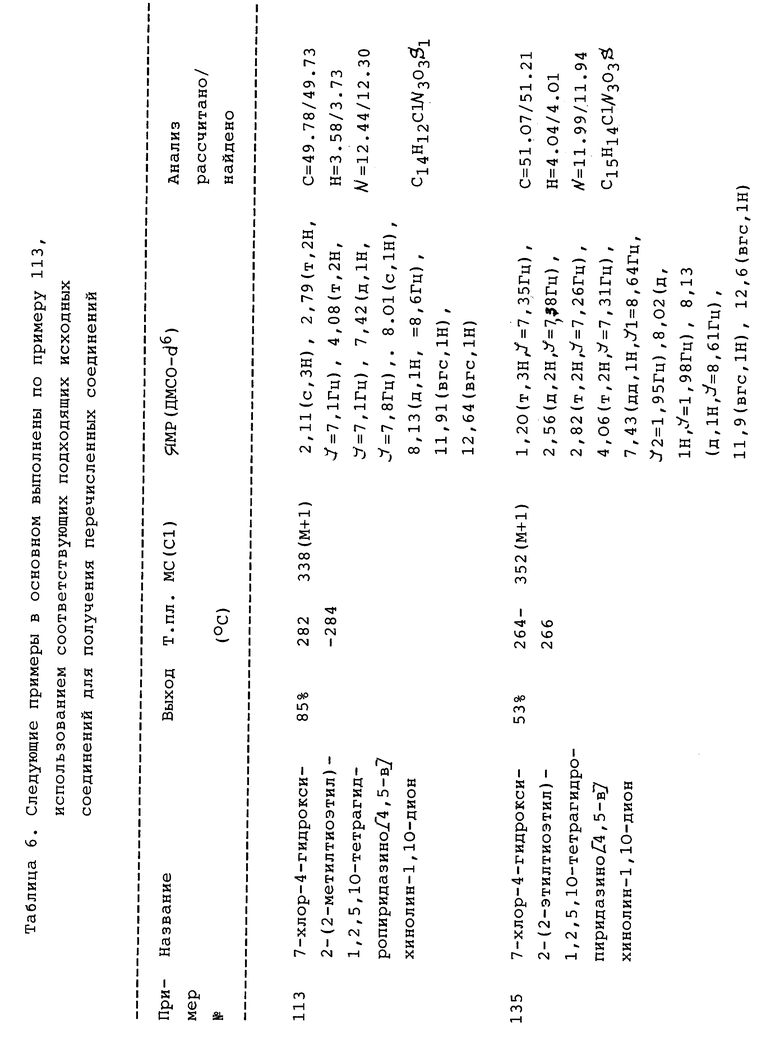
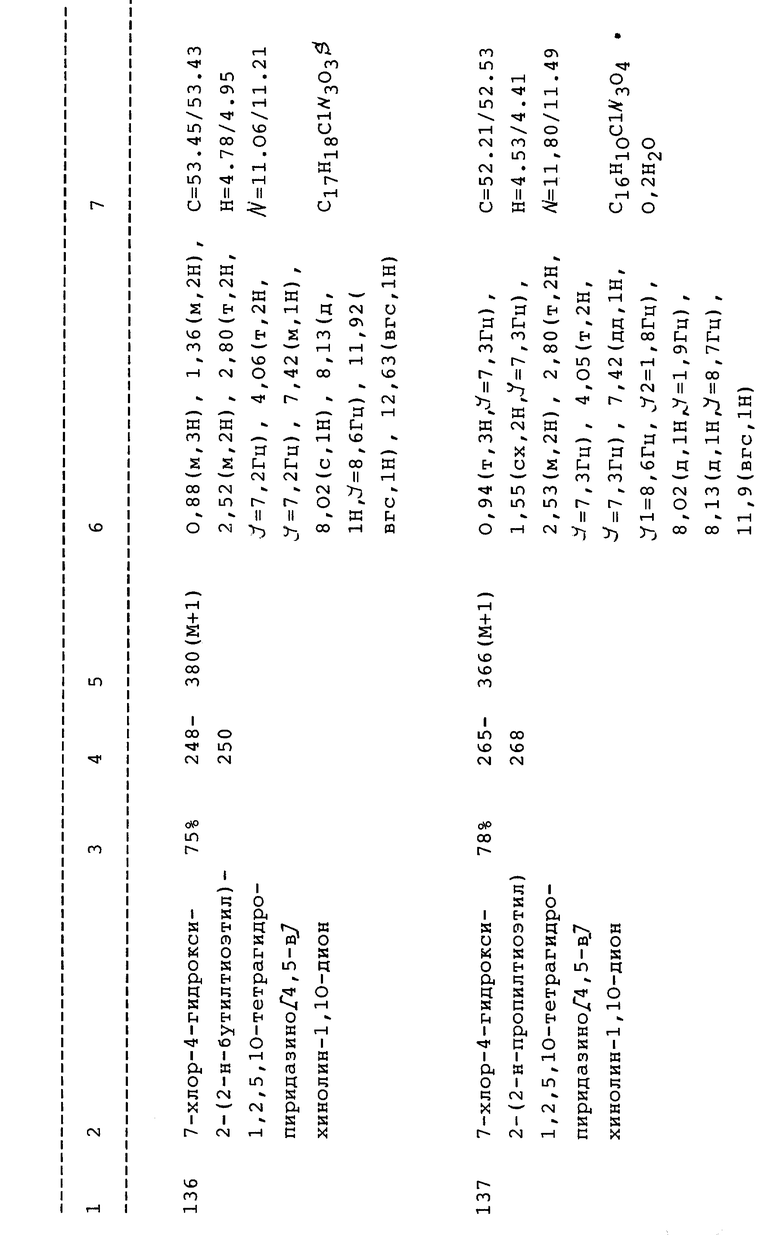


Изобретение относится к соединениям, фармацевтическим композициям и способам применения соединений формулы (II) в лечении или профилактике некоторых заболеваний или состояний. В формуле (II) Z обозначает О; кольцо А - ортоконденсированный фенил как незамещенный, так и замещенный у одного или нескольких кольцевых атомов углерода радикалом R4, где R4 независимо выбран из группы, включающей галоген, NO2; R1 -(CH2)nL, где n=0, L обозначает М; М - фенил или его бензпроизводное и является как незамещенным, так и замещенным 1 или 2 группами, выбранными из O(С1-С4)алкила, ОН, галогена, NO2, (С1-С3)перфторалкила, тетразолила, (С1-С4)алкила, СО2R', CON'R", -SOmR', -OCF3, m = 0-2, или М - пиридил, замещенный O-(С1-С4)алкилом; R' и R" независимо выбраны из Н, (С1-С4)алкила, и его фармацевтически приемлемые соли и таутомеры. В изобретении описаны также соединения формул XIX и XX как промежуточные соединения для получения соединений формулы II. Заместители у соединений XIX и XX имеют указанные значения. Соединения (II) полезны при лечении и/или профилактике неврологических заболеваний, связанных с возбуждающими аминокислотами. 9 с. и 11 з.п. ф-лы, 8 табл.
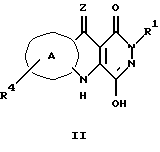
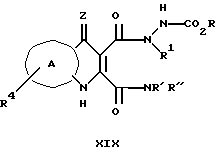

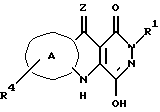
где Z обозначает О;
кольцо А - ортоконденсированный фенил как незамещенный, так и замещенный у одного или нескольких кольцевых атомов углерода радикалом R4, где R4 независимо выбран из группы, включающей галоген, NO2;
R1 представляет собой -(CH2)nL, где n = О, L обозначает М; М представляет собой фенил или его бензпроизводное и является как незамещенным, так и замещенным 1 или 2 группами, выбранными из O(C1-C4)алкила, ОН, галогена, NO2, (C1-C3)перфторалкила, тетразолила, (C1-C4)алкила, CO2R', CONR'R'', -SOmR', -ОСF3, m = 0-2, или М представляет собой пиридил, замещенный О-(C1-C4)алкилом, R' и R'' независимо выбраны из Н, (C1-C4)алкила,
и его фармацевтически приемлемые соли и таутомеры.
7-хлор-4-гидрокси-2-(4-метокси-2-метилфенил)-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион;
7-хлор-2-(4-хлор-2-метилфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион;
7-хлор-2-(2,4-диметилфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион;
7-хлор-2-(3,4-дигидроксифенил)-4-гидрокси-1,2,5,10-тетрагидропиридаэин[4,5-b]хинолин-1,10-дион;
7-хлор-2-(3,4-диметоксифенил)-4-гидрокси-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион; и
7,9-дихлор-2-(2,4-диметилфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион или их фармацевтически приемлемые соли.
7-хлор-4-гидрокси-2-(4-метокси-2-метилфенил)-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион, соль N-метилглюкамина;
7-хлор-4-гидрокси-2-(4-метокси-2-метилфенил)-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион, натриевая соль
и 7-хлор-4-гидрокси-2-(4-метокси-2-метилфенил)-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион, холиновая соль.
7-хлор-4-гидрокси-2-фенил-1,2,5,10-тетрагидропиридазин[4,5-b] хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(4-метоксифенил)-1,2,5,10-тетрагидропиридазин[4,5-b] хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(4-гидроксифенил)-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион;
4-гидрокси-8-нитро-2-фенил-1,2,5,10-тетрагидропиридазин[4,5-b] хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(4-хлорфенил)-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(4-метилфенил)-1,2,5,10-тетрагидропиридазин[4,5-b] хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(4-изопропилфенил)-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион;
7,9-дихлор-4-гидрокси-2-фенил-1,2,5,10-тетрагидропиридазин[4,5-b] хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(1-нафтил)-1,2,5,10-тетрагидропиридазин[4,5-b] хинолин-1,10-дион;
7-хлор-2-(4-фторфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион;
2-(4-бромфенил)-7-хлор-4-гидрокси-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(2-метоксифенил)-1,2,5,10-тетрагидропиридазин[4,5-b] хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(2-гидроксифенил)-1,2,5,10-тетрагидропиридазин[4,5-b] хинолин-1,10-дион; 7-хлор-4-гидрокси-2-(3-метоксифенил)-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(3-гидроксифенил)-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(4-трифторметоксифенил)-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион;
7-хлор-2-(3-хлор-4-метоксифенил)-4-гидрокси-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион и
7-хлор-4-гидрокси-2-(2-метоксипирид-5-ил)-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион
или их фармацевтически приемлемые соли.
7-хлор-2-(2,4-дихлорфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион;
7-хлор-2-(3-хлор-4-гидроксифенил)-4-гидрокси-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(4-гидрокси-2-метилфенил)-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион;
7-хлор-2-(4-хлор-2-метилфенил)-4гидрокси-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион;
7,9-дихлор-2-(2,4-диметилфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(2-метилфенил)-1,2,5,10-тетрагидропиридазин[4,5-b] хинолин-1,10-дион;
7-хлор-2-(3,4-диметилфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион;
7-хлор-2-(2,4-диметоксифенил)-4-гидрокси-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион;
7-хлор-2-(2,5-диметоксифенил)-4-гидрокси-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион;
7-хлор-2-(2,5-диметилфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион;
7-хлор-2-(3-хлорфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазин[4,5-b] хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(3-метилфенил)-1,2,5,10-тетрагидропиридазин[4,5-b] хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(4-тиометоксифенил)-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион;
7-хлор-2-(3-хлор-4-метилфенил)-4-гидрокси-1,2,5,10-тетраидропиридазин[4,5-b]хинолин-1,10-дион;
7-хлор-2-(2,3-диметилфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион;
7-хлор-2-(4-этилфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазин[4,5-b] хинолин-1,10-дион;
7-хлор-2-(4-фтор-2-метилфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион;
7-хлор-2-(3,5-диметоксифенил)-4-гидрокси-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(4-йодфенил)-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион;
7-хлор-2-(4-бром-2-метоксифенил)-4-гидрокси-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион;
7-хлор-2-(3-фторфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазин[4,5-b] хинолин-1,10-дион;
7-хлор-2-(2-фторфенил)-4-гидрокси-1,2,5,10- тетрагидропиридазин[4,5-b] хинолин-1,10-дион;
7-хлор-2-(3,5-дитрифторметилфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион;
7-хлор-2-(2,4-дифторфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион;
7-хлор-2-(2,5-дифторфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(4-нитрофенил)-1,2,5,10-тетрагидропиридазин[4,5-b] хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(4-трифторметилфенил)-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(3-нитрофенил)-1,2,5,10-тетрагидропиридазин[4,5-b] хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(4-сульфонилметилфенил)-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(2,5-дигидроксифенил)-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(4-карбоксифенил)-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(4-гидроксифенил)-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(4-карбоксамидофенил)-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(4-тетразолфенил)-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион и
7-хлор-4-гидрокси-2-(4, N, N-диэтилкарбоксамидофенил)-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион
или фармацевтически приемлемые соли.
7-хлор-2-(4-этоксифенил)-4-гидрокси-1,2,5,10-тетрагидропиридазин[4,5-b] хинолин-1,10-дион;
7-хлор-4-гидрокси-2-(2-изопропилфенил)-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион и
7-хлор-4-гидрокси-2-(4-карбоксиметилфенил)-1,2,5,10-тетрагидропиридазин[4,5-Ь]хинолин-1,10-дион
или его фармацевтически приемлемые соли.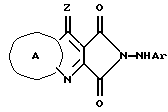
где Z и А указаны в п. 1;
Аr имеет те же значения, что и М, кроме вышеуказанного ограничения,
подвергают взаимодействию с C1-C4алкилсульфоновой кислоты в кипящем метаноле.
7-хлор-4-гидрокси-2-(4-метокси-2-метилфенил)-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион или соль N-метилглюкамина;
7-хлор-2-(4-хлор-2-метилфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион;
7-хлор-2-(2,4-диметилфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион;
7-хлор-2-(3,4-дигидроксифенил)-4-гидрокси-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион;
7-хлор-2-(3,4-диметоксифенил)-4-гидрокси-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион;
7,9-дихлор-2-(2,4-диметилфенил)-4-гидрокси-1,2,5,10-тетрагидропиридазин[4,5-b]хинолин-1,10-дион
или их фармацевтически приемлемые соли.
или формулы ХХ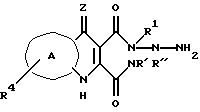
где Z обозначает О;
кольцо А - ортоконденсированный фенил как незамещенный, так и замещенный у одного или нескольких кольцевых атомов углерода радикалом R4, где R4 независимо выбран из группы, включающей галоген, NO2;
R1 представляет собой -(CH2)nL, где n = О, L обозначает M, M представляет собой фенил или его бензпроизводное и является как незамещенным, так и замещенным 1 или 2 группами, выбранными из, ОН, галогена, NO2, (C1-C3)перфторалкила, тетразолила, (C1-C4)алкила, CO2R', CONR'R'', -SOmR', -ОСF3, m = 0-2, или М представляет собой пиридил, замещенный O-(C1-C4)алкилом, R' и R'' независимо выбраны из Н, (C1-C4)алкила.
Приоритет по пунктам:
22.10.1993 по пп.1, 2-4, 9, 12, 13, 15-20;
25.08.1994 по пп.5 - 8, 10 - 11 и 14.
| EP 516297 A1,02.12.1992 | |||
| СПОСОБ ПРОИЗВОДСТВА ЖЕЛЕЙНОГО МАРМЕЛАДА | 2002 |
|
RU2219798C1 |
| Машковский М.Д | |||
| Лекарственные средства | |||
| - М.: Медицина, 1978 т.1, с.392-395. | |||
Авторы
Даты
2001-06-10—Публикация
1994-10-20—Подача