Изобретение относится к офтальмологии, а именно к офтальмоонкологии, и предназначено для лечения больных с внутриглазной, эпибульбарной и конъюнктивальной меланомой.
На протяжении четырех веков больных с внутриглазными меланомами значительных размеров (проминенцией более 7 мм) лечили с помощью энуклеации (удаление глазного яблока с опухолью). Такого рода лечение позволяло больному избавиться от опухолевого узла вместе с глазом, однако не предотвращало от возникновения метастазов. Энуклеация относится к категории ликвидационных и приводит к инвалидизации больного.
За последние 20 лет в связи с достижениями в области локальных методов лечения опухолей появились сведения о возможности двухэтапной брахитерапии. Способ заключается в том, что опухоль дважды подвергалась брахитерапии с интервалом до 1,5 года (чаще 12 месяцев). Второй этап был возможен при условии: 1) если размеры первичного опухолевого узла после регрессии, обусловленной первым этапом локального облучения, были меньше, чем до лечения; 2) сохранности склеры, которая под воздействием большой дозы облучения может подвергнуться лучевой склеромаляции; 3) радиочувствительности опухоли; 4) отсутствия метастазов к моменту второй брахитерапии. Данный способ принят за ближайший аналог.
Идея двухэтапной брахитерапии безусловно хороша, поскольку она позволяет расширить показания к органосохранному лечению. Но и она не лишена недостатков.
1. Двухэтапная брахитерапия невозможна при локализации опухоли в области цилиарного тела, поскольку большая доза облучения вызывает лучевой иридоциклит с гипертензией, выраженный болевым синдромом, не купирующийся медикаментозной терапией.
2. Продолжительность реабилитации больного при двухэтапной брахитерапии составляет не менее двух лет, поскольку длительность лучевой реакции и регрессия опухоли могли длиться от 3 месяцев до 1,5 года, и, следовательно, врач мог планировать второй этап не ранее 1 года в среднем.
Столь длительная регрессия опухолей значительных размеров, склонных к метастазированию "играет", образно говоря, против больного, поскольку у части больных (25% случаев) после первого этапа происходит метастазирование. Как известно, пациенты с проминенцией опухоли более 5 мм и диаметром более 15 мм относятся к категории лиц повышенного риска возникновения метастазов.
3. Возможно развитие склеромаляции, поскольку доза, необходимая для достижения регрессии опухолевого узла больших размеров, должна быть предельно высока, а склера является первой тканью на пути у радиоактивных частиц, и соответственнo доза, полученная ею, на порядок выше, чем на верхушку опухоли [Методические рекомендации МНИИ глазных болезней имени Гельмгольца. - Бета-терапия опухолей органа зрения. - М., 1988].
4. Опухоли значительных размеров чаще оказываются радиорезистентными (в 30% случаев), не подвергаются регрессии или демонстрируют только частичную регрессию узла. Таким образом, только небольшая часть больных проходит второй этап органосохранного лечения. Большинство, к сожалению, вынуждены перейти к отсроченной энуклеации.
К настоящему моменту известен способ лазерной термотерапии, позволяющий осуществить локальную деструкцию опухолевого узла путем нагревания его до 42-25o. Однако этот способ имеет ограниченные показания. Он невозможен при проминенции более 5 мм или диаметре более 15 мм2, при иридоцилиарной или цилиохориоидальной локализации [IRIS MEDICAL Reference Catalog. Summaries of Studies on Infrared Diode Laser Applications in ophthalmology. - CA. USA. - 1998. - P. 69-87].
Возможно локальное удаление опухоли. Однако при этом должны быть соответствующая локализапия и размеры, позволяющие ее проведение. Операция такого плана требует адекватной подготовки врача и неординарных хирургических навыков. Должно быть соответствующее специальное дорогостоящее оборудование (эндолазер последних поколений с витреотехникой и световодами). Кроме того, ее проведение сопровождается повышенным риском метастазирования или обсеменения здоровых тканей [Basic and Clinical Science Course of American Academy of Ophthalmology. - 1996-1997. - Section 4.- Ophthalmic Pathology and Intraocular Tumor. - P. 235-237].
Эффективного медикаментозного лечения (например, полихимиотерапия или биотерапия) при увеальной меланоме к настоящему моменту нет.
В связи с достижениями в области генной инженерии, генной терапии и иммунологии появились сведения о роли некоторых иммунорегуляторных пептидов и ответственных за их продукцию генов в возникновении онкологических заболеваний. Так, дисбаланс в продукции и рецепции ИЛ-2 ассоциируется с развитием лимфопролиферативных процессов.
Наше внимание привлек фактор некроза опухоли (ФНО). ФНО относится к семейству цитокинов. Он способен вызывать деструкцию опухолей различного генеза.
ФНО убивает опухоль двумя различными механизмами. Во-первых, связь ФНО с высокоаффинными рецепторами на поверхности опухолевых клеток прямо токсична для них. Токсичность заключается в продукции свободных радикалов, разрушении цитоскелетных белков в клетке и возникающих при этом промежуточных эффектах. Нормальные клетки отвечают на ФНО синтезом супероксид-дисмутазы - энзима, который участвует в инактивации свободных радикалов. Опухолевые клетки в силу особенностей своего метаболизма не могут этого сделать. Это объясняет избирательный киллинг опухолевых клеток ФНО. Не установлено, почему развивается геморрагический некроз после введения ФНО только в больших опухолях и нет никакого эффекта при интратуморальном лечении маленьких опухолей. Доказано, что высокий рецептурный уровень определяет эффект ФНО.
Во-вторых, ФНО вызывает некроз опухоли, мобилизуя эффекторный ответ хозяина in vivo. Фактически даже опухоли у мышей, не имеющие рецепторы к ФНО, при обработке цитокином гибнут. Причем ФНО селективно уничтожает васкуляризированные опухоли более активно, чем аваскулярные импланты. Гистоморфологический ответ к ФНО выглядит как локализованная реакция Шварцмана в ответ на тромбоз сосудов с последующим геморрагически-ишемическим некрозом опухоли. Опухолевые сосуды первыми вовлекаются в триггерный механизм - шварцмановскую реакцию. Некоторые выделяемые опухолью ангиогенные факторы при этом потенциируют ответ на ФНО. Например, сосудистый эндотелиальный фактор роста.
Предлагаемый нами способ лечения увеальной меланомы базируется на экспериментальных данных о роли фактора некроза опухоли альфа (ФНО) в механизмах противораковой защиты, а также его специфических функций.
Согласно экспериментальным данным, полученным как in vitro, так и in vivo, ФНО, обладая цитотоксическими и цитостатическими свойствами, повышает активность естественных киллеров (ЕКК), осуществляющих неспецифический киллинг опухолевых клеток-мишеней.
ФНО, усиливая экспрессию HLA-LR-антигенов на поверхности макрофагов, способствует быстрому распознаванию ими опухолевых антигенов и элиминации клеток, их несущих [Vassalli P. The pathophysiology of tumor necrosis factors. Annu. Immunol 1992, vol. 10, p. 411-425].
Под влиянием ФНО периферические лимфоциты дифференцируются в лимфокин-активированные киллеры - клетки, обладающие максимальным потенциалом и киллинговыми способностями. Кроме того, ФНО индуцирует продукцию Т-хелперами лимфокинов, повышающих экспрессию молекул МНС I класса на опухолевых клетках, что в свою очередь усиливает чувствительность клеток-мишеней к специфическому лизису цитотоксическими лимфоцитами.
На всех субпопуляциях лимфоцитов имеются рецепторы к ФНО. Благодаря этому лимфоциты могут воспринимать ФНО как сигнал к пролиферации и осуществлению специфических функций.
В норме продукция ФНО находится на низком уровне, который обеспечивает прямую и обратную связь в цитокиновой сети, поддержание нормальной регуляции иммунного гомеостаза. Однако режим быстро меняется, если в организме появляется клетка, несущая чужеродную информацию. Противоопухолевая активность ФНО реализуется в процессе цитолиза, который условно можно разделить на 4 стадии.
I стадия - распознавание клетки-мишени и приближение к ней. Для этой стадии важна экспрессия молекул на мембране клетки-мишени, которые распознаются клеткой-эффектором как чужеродные. В случаях опухолевых клеток меланомы в окружающее пространство поступают иммунорегуляторные молекулы - цитокины, в том числе и ФНО. Они ориентируют клетку-киллер относительно поиска клетки-мишени. ФНО облегчает процесс распознавания, усиливая экспрессию антигенов гистосовместимости, без чего невозможен процесс цитолиза. I стадия заканчивается (условно!) приближением к мишени.
II стадия начинается процессом связывания с мишенью или прикрепления к ней. Процесс возможен только в том случае, если мембрана мишени несет чужеродную информацию: отличия в антигенах, отличия в экспрессии маркирующих молекул, в ферментах и др.
III стадия начинается тотчас по прикреплении, которое продолжается от 2 до 10 мин. Клетка-эффектор (естественный киллер, лимфокин-активированный киллер, цитотоксический Т-лимфоцит) начинает секретировать белки-предшественники, формирующие в дальнейшем поры. Сформировавшийся белковый конъюгат погружается в мембрану, нарушая ее структуру, и по полому цилиндру внутрь клетки-мишени перетекают цитолизины. В случае опухоли эту роль выполняет ФНО - литический агент естественных киллеров и лимфокин-активированных киллеров,
IV стадия заключительная - литический процесс. Разрушенные фрагменты цитоскелета и цитоплазмы вытекают из перфорированной мембраны, наступает лизис клетки. А клетка-эффектор, отсоединившись от мишени, снова вступает в процесс киллинга, повторяя первый и последний этапы.
За последнее время появились публикации, свидетельствующие о важной роли этого цитокина в механизмах регрессии опухолевого меланомного имплантата, помещенного в переднюю камеру глаза экспериментального животного (Ferguson T.A. et al. The immune response and the eye: a role for TNT in anterior chamber-associated immune deviation. Investigative Ophthahmology & Visual Science, April 1994, vol. 35, N 5, p. 2643-2651; Filer R.S. et al. "Zytokine in Uveamelanimen" Klin Monatsbl Augenheild 1993, vol. 202, p. 174-179; II. Knisely-TL et al. Emergence of a dominant cytotoxic T lymphocyte antitumor effecte from tumorinfiltrating cells in the anterior chamber of the eye. Cahcer-Immunol-Immunother., 1990, 30(6): 323-30).
Предварительные исследования, проведенные нами у 155 пациентов с увеальной меланомой, показали, что абсолютное большинство из них имеет системный и местный дефицит фактора некроза-альфа (ФНО-α). Дефицит ФНО-α нарастает по мере прогрессирования неопластического процесса. Продукция цитокина прекращается незадолго до развития метастазов [Слепова О.С. и др. Фактор некроза опухоли-альфа при увеальной меланоме. - Офтальмологический журнал. - 1998. - N 5. - C. 357-360].
Полученные нами данные позволили предположить, что введение экзогенного рекомбинантного цитокина ФНО-α улучшит течение заболевания или вызовет частичную деструкцию опухолевого узла. Однако для развития деструкции опухоли необходимым условием является наличие рецепторов на поверхности опухолевых клеток.
Известно, что ФНО-альфа имеет два рецептора р55 и р75. Рецептор ФНО р55 является прототипом подгруппы рецепторов, которые способны посылать сигнал программированной клеточной смерти, причем этот сигнал совпадает с таковым для специализированного "рецептора смерти"- Fas (АПО-1). Таким образом, говоря иными словами, введение ФНО-альфа в опухоль, экспрессирующую рецептор ФНО р55, сопровождается запуском каскада реакций, приводящих клетку к гибели, а опухоль к полной деструкции.
Наши предварительные исследования, проведенные на крио-срезах опухоли увеальной меланомы, показали, что не все, но некоторые опухолевые клетки увеальной меланомы имеют рецепторы к ФНО-альфа (АПО-1) [Андреева Л.Д., Лихванцева В. Г. Иммуногистохимический анализ апоптоза, интерлейкина-2 и ядерного антигена пролиферации при увеальной меланоме. - B сб. Опухоли и опухолеподобные заболевания органа зрения. М., 1998. - C. 10-12]. Известно, что рецептор АПО-1 точно связывается с цитокином. Следовательно, введение рекомбинантного цитокина должно сопровождаться активацией программы смерти [Доклад на Европейской школе по онкологии ассоциации по лечению рака и лейкозов. - M. , 1999 г. Недоспасов С.А. Физиологические функции фактора некроза опухолей и лимфотоксина. - Cб. тезисов, с. 1-8].
Таким образом, исходя из известных биологических свойств ФНО-α, а также полученных нами данных о дефиците его продукции и имеющихся рецепторах на опухолевых клетках у наиболее тяжелого контингента больных с увеальной меланомой, этот цитокин получил явные преимущества перед другими в качестве кандидата для включения его в схему противоопухолевой терапии. Возникал вопрос о том, как решить проблему гематоофтальмологического барьера и доставки рекомбинантного ФНО-α к рецепторам на опухолевых клетках в количестве, необходимом для развития реакции. Это возможно либо при струйном введении мегадоз рекомбинантного ФНО-α в организм больного увеальной меланомой, либо при интратуморальном введении.
Учитывая имеющиеся сведения о возможных осложнениях, развивающихся в ответ на мегадозы экзогенного ФНО-α, и ускорение процессов метастазирования. второй способ, на наш взгляд, являлся предпочтительнее.
Для решения поставленной нами задачи мы взяли отечественный препарат Альнорин (фирма ВЕКТОР, г. Бердск), представляющий собой человеческий рекомбинантный фактор некроза опухоли -α (ФНО-α). Альнорин - полипептид из 153 аминокислотных остатков, выделенных пз трансформированных клеток Е. Coli, идентичен природному ФНО-α c 5 по 157 аминокислоту. В предклинических исследованиях были показаны основные биологические эффекты, свойственные прежде изученным препаратам ФНО. Сообщалось, что специфическая активность Альнорина 2•107 Е/мг белка.
В различных странах ФНО выпускается для клинического изучения (фармацевтические компании Asahi, Knoll, Genentech, Dainippon, Waldey Inst. Cetus). Специфическая активность ФНО, выпускаемого различными фармацевтическими компаниями, отличалась, но это не оказало влияния на выбор клинической дозы препаратов после I фазы исследования, проведенной на базе РОНЦ РАМН имени Н.Н. Блохина.
Так, специфическая активность препарата фирмы Genentech 2-4•106 Е/мг белка, a Asahi - 2•106 Е/мг (10-кратное различие). В клинических исследованиях при 5-дневном внутривенном введении МПД (мкг/м2/день) составила 200 (Genentech) и 272 (Asahi). Таким образом, отсутствуют существенные дозовые различия при достижении МПД у людей. Сходные МПД установлены и для препаратов отечественного ФНО.
ФНО вводили внутривенно (струйно или 24-часовой постоянной инфузией однократно, или в течение 3-5 дней), внутримышечно (Genentech) с 5-дневным режимом или 3 раза в неделю, длительно и разовой дозой 150 мкг/м2 или 25-75 мкг/м2 ежедневно в течение 8 недель. Кроме местных реакций такой способ введения сопровождается лейкопенией, тромбоцитопенией, гипотонией, гепатотоксичностью (проявления лимитирующей токсичности). Возможно введение ФНО внутрибрюшинно - 1 раз в неделю. Этот способ введения дает сходную характеристику токсичности c внутривенным.
Доказано преимуществен местного введения ФНО перед системным за счет уменьшения вводимой дозы, соответственно меньшей токсичности и достижения большей терапевтической дозы в очаге поражения. Так, внутрипузырное введение высоких доз ФНО (500 мкг/м2 2 раза в неделю, 4 недели), не вызывает побочных эффектов, но сопровождается деструкцией раковой опухоли [Лициницер М.Р. и др. Клиническое изучение рекомбинантного фактора некроза опухоли. - Сб. Новые противоопухолевые препараты в лечении рака. - М, 1999. - C. 1-5]. Внутрипузырное введение 16 больным с поверхностным раком мочевого пузыря в 9 случаях завершилось частичным эффектом и в 2-х полным.
Регионарное введение ФНО путем перфузии конечности у больных с метастазами меланомы и неоперабельной саркомой мягких тканей удавалось провести с относительно высокими дозами. Достигнуто 90% регрессии и полной морфологической ремиссии в 26% случаях при введении ФНО путем перфузии конечности в условиях умеренной гипертермии. При метастазах такое лечение эффективно в 100% случаев (полная ремиссия 70-90%).
Исходя из известного факта наличия гематоофтальмологического барьера, препятствующего достижению терапевтической дозы, необходимой для деструкции опухолей глаза вообще и меланомы в частности, мы предположили, что оптимальным является интратуморальный способ введения препарата.
Результаты, достигнутые при внутриопухолевом введении ФНО в саркому Капоши были хорошими. При этом в ходе клинических испытаний, проводимых в отделении химиотерапии и комбинированных методов лечения злокачественных опухолей РОНЦ на I фазе клинического изучения ФНО, (Альнорин) вводили интратуморально в возрастающей дозировке (15000 ⇒ 30000 ⇒75000 ЕД и т.д.). Эскалация дозы Альнорина проведена по модифицированной шкале Фиббоначи. Интервал между курсами 1 неделя. Лечение проводили до признаков прогрессирования или регрессии опухолевого узла. Всего у 13 больных провели 38 курсов. Достигнута разовая доза 130000 ЕД. Отмечена удовлетворительная переносимость. Побочные реакции - озноб и незначительное повышение температуры тела.
Способ подбора терапевтической дозы по шкале Фиббоначи является стандартным для таких случаев. Но, к сожалению, при внутриглазных меланомах он невозможен, поскольку каждое введение препарата сопровождается оперативным вмешательством под наркозом. Кроме того, риск метастазирования растет пропорционально кратности введения препарата.
В эксперименте интраокулярное введение ФНО мышам с опухолями глаза сопровождалось частичным ее некрозом, без токсического воздействия на окружающие ткани [Ferguson Т.A. et al. The immune response and the eye: a role for TNF in anterior chamber-associated immune deviation. Investigative Ophthalmology & Visual Science, April 1994, vol. 35, N 5, p. 2643-2651). Противоопухолевая активность ФНО у мышей и человека имеет различные дозы. У мышей геморрагический некроз опухоли вызывается в концентрации 5 мкг/кг, а у человека - 1000 мкг/м2. Достичь того же впечатляющего противоопухолевого эффекта у людей, что и в эксперименте у мышей, не удается, поскольку лимитирующая токсическая доза не позволяет достичь такой концентрации у людей.
Данные о возможности применения рекомбинантного ФНО-альфа у больных увеальной меланомой каким-либо из описанных способов в доступной литературе отсутствуют.
При расчете предполагаемой терапевтической дозы ФНО, введенной интратуморально однократно, мы предприняли принципиально новый подход.
Исходя из представлений о том, что размеры опухоли глаза, при которых возникает вторичная гипертензия (и, следовательно, имеются противопоказания к органосохранному лечению), как правило, превышают 1400 мм2 (площадь поверхности около 500 мм2, опухоль занимает половину глаза), а также учитывая имеющиеся данные о том, что для полной деструкции опухоли у человека необходима доза 1000 мг/м2 или 100 мкг/мм2 ФНО, мы предлагаем производить перерасчет с учетом максимально допустимых размеров опухолей, при которых еще можно рекомендовать наш способ лечения [Определение объема внутриглазного новообразования по результатам акустического сканирования с использованием компьютерной техники. - Пособие для врачей. - МНИИ глазных болезней имени Гельмгольца. - М., 1998]. По данным фирмы-производителя, специфическая активность Альнорина 2•107 Е/мг (20000 Е/мкг). Таким образом, доза, необходимая для деструкции опухоли с площадью поверхности 500 мм2, составляет 100000 Е Альнорина.
Указанную дозу нельзя вводить в большом объеме растворителя или физиологического раствора, поскольку тогда, учитывая плотность увеальной или конъюнктивальной меланомы, препарат будет вытекать обратно или вызовет большую механическую травму с повышением риска метастазирования, травматизацией окружающих тканей глаза и обсеменением их структур, что идет вразрез с правилами абластики. Мы предлагаем вводить эту дозу в 0,1 мл3 физиологического раствора посередине основания опухоли, определяемого трансиллюминационным способом и отмаркированного 0,5%-ным водным раствором бриллиантовой зелени на глубину не более половины высоты меланомы, определяемой ультрасонографическим методом.
Итак, 100000 ЕД Альнорина (ФНО-альфа), растворенного в 0,1 мл3 физиологического раствора, вводят на операционном столе в строму меланомы инъекционной иглой на шприце через отверстие в глубоких слоях склеры после предварительной отсепаровки лоскута на 3/4 толщины склеры. После введения препарата отверстие ушивают узловым швом. Лоскут откладывается на ложе и фиксируется двумя узловыми швами. Накладывается шов на конъюнктиву.
Вводя такую дозу, мы предполагаем a priori, что меланомные клетки экспрессируют на поверхности рецептор к ФНО-α в достаточном количестве, и биологическое действие препарата в виде деструкции опухоли проявится после рецептор-лигандного взаимодействия. Однако известно, что каждая опухоль индивидуальна и неповторима, более того, она меняет свой экспрессионный профиль на протяжении своего развития. Поэтому весьма вероятно предположить, что она разрушится неполностью. В таком случае необходима комбинация с другими способами лечения, например, брахитерапией или термотерапией и т.д.
Для того чтобы убедиться в правомочности своих предположений, первоначально мы ввели заведомо меньшую дозу - 10000 Е Альнорина в опухоль с высотой 10 мм и диаметром 17 мм. Инъекция сопровождалaсь возникновением полости в строме меланомы, зафиксированной на УЗИ, проведенном на 5-е сутки адаптационного периода. Затем больной был взят на операционный стол для энуклеации. Операция по удалению глаза произведена по стандартной методике под общим наркозом с криофиксацией глазного яблока. Удаленный глаз отправлен на гистологию. Гистологическое исследование обнаружило дефект в строме опухоли в виде кисты, занимающей до 1/4 от объема опухоли. Киста была окружена зоной некрозов опухолевых клеток и мощным валом лимфоцитов. Фотография представлена на чертеже.
Далее мы пролечили 8 пациентов по описанной методике, но вводимая доза составляла 100000 Е Альнорина в 0,1 мл3 физраствора. В 2-х случаях достигли полной (100%) регрессии опухолевого узла; у 2-х пациентов опухоль уменьшилась наполовину; в 3-х (37,5%) случаях наступила 30%-ная регрессия. В одном случае опухоль оказалась резистентной (полное отсутствие рецепторов?). Сроки наблюдения составили от 6 до 9 месяцев. Инструментальные методы исследования до и после такого лечения свидетельствуют об отсутствии метастазов за указанные сроки наблюдения.
Задачей предлагаемого изобретения является разработка способа лечения эпибульбарных, внутриглазных и конъюнктивальных меланом глаза, позволяющего уменьшить размеры опухолевого узла путем его частичной или полной деструкции у каждого конкретного больного.
Техническим результатом является уменьшение размера опухоли вплоть до полной регрессии.
Технический результат достигается за счет интратуморального введения экзогенного рекомбинантного ФНО-альфа как фактора противоопухолевой защиты, осуществляющего деструкцию опухоли в определенном количестве и объеме.
Способ осуществляется следующим образом.
1. Больному дают наркоз.
2. На операционном столе после отсепаровки конъюнктивального лоскута в месте локализации опухоли больному производят маркировку границ меланомы с помощью трансиллюминационного метода.
3. Над основанием опухоли из верхних 2/3 толщины склеры выкраивают лоскут треугольной формы произвольных размеров.
4. Под лоскутом производят коагуляционный вал в виде круга в глубоких слоях склеры посередине него.
5. Посередине круга производят сквозной разрез склеры лезвием.
5. Через этот разрез с помощью обычной иглы для инъекций на шприце вводят рекомбинантный ФНО-альфа в дозе 100000 Е, растворенной в 0,1 мл3 физиологического раствора.
6. Отверстие в склере ушивают узловым швом.
7. Фиксируют склеральный лоскут в ложе и пришивают его на место узловыми швами.
Пример 1. Пациент К., 34 лет, профессиональный художник. Поступил с диагнозом: цилиохориоидальная меланома в стадии T3N0M0. От предложенной энуклеации отказался. Размеры опухоли: проминенция 9 мм и диаметр 16 мм. Безальтернативным методом лечения таких меланом является энуклеация, поскольку локализация опухоли не позволяет провести двухэтапную брахитерапию. Из имеющегося в отделе опыта известно, что в таких случаях развивается постлучевой иридоциклит с гипертензией, который практически не управляется медикаментозно. От энуклеации больной отказывается. Взят на операционный стол. По описанной методике после маркировки границ опухоли интратуморально введен рекомбинантный ФНО.
На контрольном УЗИ-исследовании через 3 месяца опухолевый узел представлял собой неоднородную массу с полостью в строме до 1/2 ее размеров. Вторым этапом проведена брахитерапия. Больной отпущен под наблюдение окулиста по месту жительства.
На повторной явке размеры узла регрессировали до 1.2 мм. Учитывая небольшие сроки наблюдения и продолжающуюся лучевую реакцию, пациент оставлен под наблюдением. Обследование печени и легких не выявило очаговых изменений метастатического характера.
Пример 2. Больная 35 лет. Поступила с диагнозом: меланома правого глаза в стадии T3N0M0. Гиперметропия, гиперметропический астигматизм, сходящееся монолатеральное косоглазие, амблиопия высокой степени левого глаза.
Локализация опухоли в области цилиарного тела и размеры опухоли не позволяют провести какой-либо из существующих органосохранных методов лечения. От предложенной энуклеациии отказывается.
С согласия больной проведена попытка биодеструкции опухоли с помощью Альнорина, введенного по описанной методике. Спустя 5 месяцев на УЗИ мы не обнаружили узла опухоли, вместо нее фиксировался плотный рубец до 1 мм толщиной.
Проведенные нами клинические наблюдения позволяют высказать предположение о том, что в будущем возможно использование такого метода лечения внутриглазных опухолей значительных размеров в комбинации с брахитерапией или лазерной деструкцией, проводимой вторым этапом в сроки до 1 месяца после интратуморального введения Альнорина.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРОГНОЗИРОВАНИЯ КЛИНИЧЕСКОГО ТЕЧЕНИЯ УВЕАЛЬНОЙ МЕЛАНОМЫ | 1998 |
|
RU2146823C1 |
| СПОСОБ ЛЕЧЕНИЯ УВЕАЛЬНОЙ МЕЛАНОМЫ | 2000 |
|
RU2175242C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ КЛИНИЧЕСКОГО ТЕЧЕНИЯ УВЕАЛЬНОЙ МЕЛАНОМЫ | 1999 |
|
RU2149404C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ КЛИНИЧЕСКОГО ТЕЧЕНИЯ УВЕАЛЬНОЙ МЕЛАНОМЫ | 1999 |
|
RU2157998C1 |
| СПОСОБ ВЫЯВЛЕНИЯ СКРЫТОГО МЕТАСТАЗИРОВАНИЯ ПРИ УВЕАЛЬНОЙ МЕЛАНОМЕ | 1998 |
|
RU2147373C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ КЛИНИЧЕСКОГО ТЕЧЕНИЯ УВЕАЛЬНОЙ МЕЛАНОМЫ | 2001 |
|
RU2197731C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ КЛИНИЧЕСКОГО ТЕЧЕНИЯ УВЕАЛЬНОЙ МЕЛАНОМЫ | 2001 |
|
RU2193200C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ КЛИНИЧЕСКОГО ТЕЧЕНИЯ УВЕАЛЬНОЙ МЕЛАНОМЫ | 2001 |
|
RU2192812C1 |
| СПОСОБ ОРГАНОСОХРАНЯЮЩЕГО ЛЕЧЕНИЯ УВЕАЛЬНОЙ МЕЛАНОМЫ | 2017 |
|
RU2655831C1 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ЛЕЙОМИОМЫ ОТ МЕЛАНОМЫ РАДУЖКИ | 2001 |
|
RU2199124C1 |
Изобретение относится к офтальмологии, в частности к офтальмоонкологии, и предназначено для лечения внутриглазной и конъюнктивальной меланомы. Способ представляет собой интратуморальное введение рекомбинантного ФНО - α. При неполном разрушении опухоли дополнительно проводят брахитерапию. Способ позволяет уменьшить размеры опухоли вплоть до полной регрессии и сохранить глаз как орган. 1 з.п. ф-лы, 1 ил.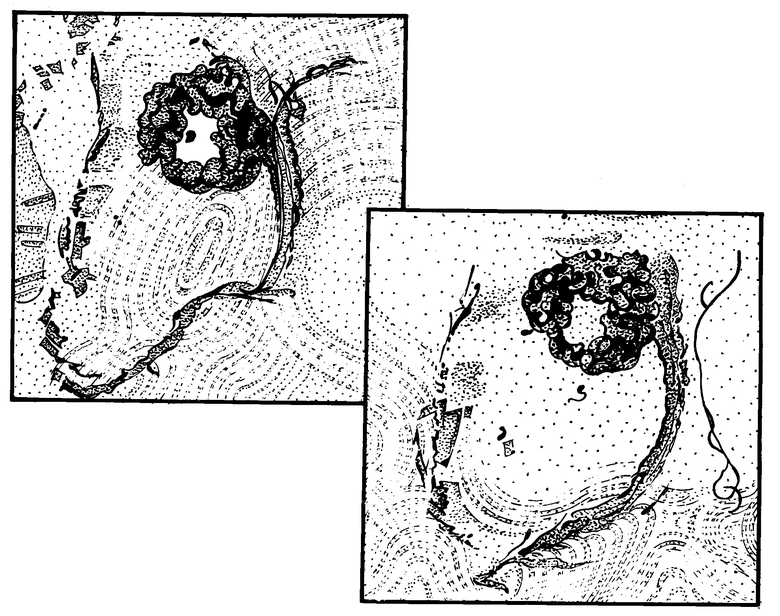
2. Способ по п.1, отличающийся тем, что дополнительно проводят брахитерапию.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| ПРОТИВООПУХОЛЕВОЕ СРЕДСТВО | 1998 |
|
RU2136278C1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| СПОСОБ ПОЛУЧЕНИЯ ФАКТОРА НЕКРОЗА ОПУХОЛИ, ЧЕЛОВЕЧЕСКИЙ ФАКТОР НЕКРОЗА ОПУХОЛИ | 1985 |
|
RU2076151C1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| СПОСОБ ДВУХПЛОСКОСТНОЙ ЗАТОЧКИ СВЕРЛ | 0 |
|
SU248516A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| БРОВКИНА А.Ф., ЗАРУБЕЙ Г.Ф | |||
| Об эффективности брахитерапии при увеальных меланомах | |||
| Офтальмологический журнал | |||
| Способ изготовления фанеры-переклейки | 1921 |
|
SU1993A1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
| BOREL-RINKES IH isolated hepatic perfusion in the pig with TNF-alpha with and without melphalan | |||
| Br-J-Cancer | |||
| Электрическое сопротивление для нагревательных приборов и нагревательный элемент для этих приборов | 1922 |
|
SU1997A1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| МОРОЗОВА Е.Л | |||
| Испытание антионкогенного действия рекомбинантного фактора некроза опухоли при экспериментальных онкологических заболеваниях лабораторных животных | |||
| Сб | |||
| научных трудов НИИ эпидемиологии и микробиологии | |||
| - М., 1990. | |||
Авторы
Даты
2001-06-20—Публикация
2000-02-22—Подача