Настоящее заявка является частичным продолжением заявки на патент США (Newman et al.) рег. N 07/856281, поданной 23 марта 1992 г., которая, в свою очередь, является частичным продолжением заявки на патент США рег. N 07/735064, поданной 25 июля 1991; и обе указанные заявки целиком, включая рисунки, входят в настоящее описание посредством ссылки. Настоящее изобретение относится к рекомбинантным антителам, используемым для терапевтического лечения людей, а также к способам продуцирования указанных антител.
Предшествующий уровень техники
Мышиные моноклональные антитела используются в диагностике заболеваний человека и в биологических исследованиях, направленных на решение важных научных задач. Указанные антитела также используются в клинических анализах при лечении острых и хронических заболеваний человека, включая лейкозы, лимфомы, твердые опухоли (например, опухоли прямой кишки, молочной железы, печени), СПИД и другие аутоиммунные заболевания.
Были продуцированы химерные антитела мыши/человека и показано, что эти антитела обладают связывающими свойствами родительского мышиного антитела, а их эффекторные функции ассоциируются с констатнтной областью антитела человека. См. , например, патент США (Cabilly и др. ) 4816567; патент США (Shoemaker и др.) 4978745; патент США (Beavers и др.) 4975369 и патент США (Boss и др.) 4816397, из которых все вводятся в настоящее описание посредством ссылки. Обычно, указанные химерные антитела конструируют путем получения геномной библиотеки из ДНК, экстрагированной из уже имеющихся мышиных гибридом. Nishimura et al. , 47 Cancer Researeh 999, 1987. Затем библиотеку скринируют на гены вариабельных областей из тяжелой и легкой цепей, обнаруживающих правильные картины реаранжировки фрагмента антитела. Затем клонированные гены вариабельных областей лигируют в вектор экспрессии, содержащий клонированные кассеты соответствующего гена константной области тяжелой или легкой цепи человека. После этого, химерные гены экспрессируют в подходящей клеточной линии, обычно в линии клеток мышиной миеломы.
Описанные химерные антитела были использованы для лечения людей. Однако в ряде случаев у человека-реципиента продуцировались антитела к этим химерным антителам. Такое продуцирование антитела против химерного антитела оказывало неблагоприятное воздействие на проведение терапии с использованием химерного антитела.
Erlich и др. (34 Clinical Chemistry 1681, 1988), Erlich и др. (7 Hybridoma 385, 1988), Erlich и др. (6 Hibridoma 151, 1987) и Erlich и др. (1 Human Antibody Gybridomas 23, 1990) (не принимаемые за прототипы к настоящему изобретению) указывают, что человеческое моноклональное антитело дало бы лучший эффект в in vivo-терапии человека, чем мышиные моноклональные тела. В своих работах они также исходили из постулата, что антитела приматов, не относящихся к человеку, например моноклональные антитела шимпанзе, являются толерантными для человека, поскольку антитела шимпанзе и человека являются структурно схожими. Так как человеческие антитела являются неиммуногенными для макаки-резус (т.е. они не индуцируют антительный ответ), то было высказано предложение, что антитела приматов будут неиммуногенными для человека. В вышеупомянутых работах также указывается, что испытание на продуцирование антител у человека проводить необязательно в том случае, если антитело примата имеет структуру константной области, аналогичную структуре этой области Ig человека, или, по крайней мере, это антитело имеет структуру, которая отличается от структуры иммуноглобулина человека не более, чем различные антитела человека отличается между собой. Таким образом, было высказано предложение, что антитела шимпанзе могут быть использованы в терапии человека.
Краткое описание изобретения
Настоящее изобретение относится к способам амплификации и клонирования генов, кодирующих антигенсвязывающие участки вариабельной области иммуноглобулина обезьян Старого Света (называемых далее "обезьянами", например павианов или макак); лигирования этих генов с клонированными генами, кодирующими константную область иммуноглобулинов человека, шимпанзе или других обезьян (или, если это необходимо, с генами, кодирующими остов молекулы иммуноглобулина человека, шимпанзе или другой обезьяны); и экспрессии этих генов, кодирующих рекомбинантные антитела человека/обезьяны либо полностью обезьяньи рекомбинантные антитела. Кроме того, настоящее изобретение относится к использованию указанных рекомбинантных антител (этот термин означает антитела, продуцированные в результате гибридизации ДНК двух различных генов антител, которые могут происходить даже от двух одинаковых видов, например, от обезьян, таких как макака-резус и собаковидная обезьяна, и которые будут кодировать обезьяно-обезьянье рекомбинантное антитело) в качестве иммунотерапевтических средств для лечения людей. В основу настоящего изобретения было положено обнаружение того факта, что в отличие от шимпанзе, такие эволюционно далекие от человека виды обезьян, как бабуин или макака (включая собаковидную обезьяну и макаку-резус), не только достаточно отличаются от человека (настолько, что у этих обезьян продуцируются антитела против антигенов человека, даже против относительно консервативных антигенов человека, например C 4 и C 54), но и имеют достаточное сходство с человеком, такое что при введении человеку антител этих обезьян или рекомбинантных антител, происходящих от этих обезьян, у него не продуцируется иммунный ответ против этих антител.
В отличие от некоторых антител, используемых ранее в лечении людей, антитела настоящего изобретения не имеют ряда недостатков, присущих указанным используемым ранее антителам, например, таких как (1) иммуногенность и индуцирование иммунного ответа с образованием антител против антител человека (HAA) после их повторного введения, необходимого для лечения хронических заболеваний; (2) относительно короткое время полужизни по сравнению с человеческими антителами; (3) отсутствие эффекторных функций в отношении клеток человека или комплемента. Благодаря отсутствию вышеуказанных недостатков, антитела настоящего изобретения могут быть с успехом использованы для терапевтического лечения заболеваний у человека. Например, в случае хронических заболеваний человека, включая аутоиммунные заболевания или любые другие заболевания, требующие продолжительного введения антител, одним из главных препятствий для успешного проведения повторной иммунотерапии является иммунный ответ организма-хозяина на терапевтическое антитело. HAA-ответы того или другого пациента часто бывают непредсказуемы. Указанные HAA-ответы преимущественно, хотя и не исключительно, направлены против константной области молекулы антитела и часто сводят на нет или снижают эффективность любой последующей терапии с использованием этого антитела или другого антитела того же изотипа.
В принципе, проблемы, связанные с HAA-ответом, могут быть решены путем использования моноклональных антител человека. Однако такой подход имеет ряд этических, клинических и иммунологических ограничений, связанных с иммунонизацией индивидуума нужными антигенами (например, термин "антигены человека" включает в себя антигенные или иммуногенные части любых белков, полипептидов или их эквивалентов, присутствующие в организме человека) в целях продуцирования антител. Авторы настоящего изобретения подошли к решению этой проблемы путем продуцирования антител с соответствующей специфичностью и нужной эффекторной функцией и использования их для получения рекомбинантных антител. Эти рекомбинантные антитела включают в себя соответствующую часть вариабельной области антитела, происходящего от иммунизированной обезьяны, и константную область антитела, происходящего от человека или шимпанзе. Таким образом, может быть сохранена специфичность и высокая степень аффинности моноклональных антител и легко подобрана константная область, происходящая от антитела человека или шимпанзе и обладающая нужными эффективными функциями.
Кроме того, в основу настоящего изобретения был положен метод амплификации генов иммуноглобулина обезьян, осуществляемый, например, посредством полимеразно-цепной реакции (PCR) с использованием РНК, экстрагированной из лимфоцитов обезьяны, и синтетических олигонуклеотидных праймеров, специфичных для семейств генов, кодирующих вариабельную область тяжелой и легкой цепи. Амплифицированные гены или их соответствующие части (например, области, кодирующие гипервариабельный участок (CDR), см. Winter, заявки на патент Великобритании N GB 2188638A, которая вводится в настоящее описание посредством ссылки) клонируют в вектор экспрессии, содержащий ген константной области человека или шимпанзе, в целях продуцирования рекомбинантного антитела обезьяны/человека; либо в вектор экспрессии, содержащий ген константной области обезьяны, в целях продуцирования рекомбинантного антитела нужного изотипа, полностью происходящего от обезьяны. Эти антитела представляют собой иммунотерапевтические агенты, способные к локализации и/или убиванию соответствующих клеток-мишеней (например, опухолевых клеток) после их in vivo-введения.
Таким образом, в первом своем варианте настоящее изобретение относится к способу клонирования гена, кодирующего антигенраспознающий участок вариабельной области антитела обезьяны. Этот способ предусматривает получение нуклеиновой кислоты, например РНК, от обезьяны; проведение синтеза ДНК, комплементарной РНК, (кДНК) (с использованием обратной транскриптазы); получение праймера, комплементарного кДНК-последовательности, кодирующей 5'-лидерную последовательность гена антитела; взаимодействие указанной кДНК и праймера с образованием гибридного комплекса; амплификацию кДНК в целях продуцирования нуклеиновой кислоты, кодирующей ген вариабельного участка антитела обезьяны.
Под термином "антигенраспознавающий участок" подразумевается один или несколько участков вариабельной области антитела обезьяны, которые являются ответственными за связывание и/или распознавание антигена-мишени (или эпитопа, или идиотипа) данного антитела. Например, этот участок включает в себя гипервариабельные участки (CDR, см. ниже), или всю вариабельную область, или любую комбинацию из этих двух областей, включая любые изменения в кодирующих областях, которые могут быть индуцированы в целях получения более человекообразной области (вместо обезьянообразной области) без изменения способности к специфическому связыванию этого антитела. Если используется лишь часть от всей вариабельной области, то остальные участки (например, так называемые "каркасные участки") могут происходить от другого антитела, предпочтительно от антитела человека или шимпанзе (см. ниже и в вышеуказанных работах, вводимых в настоящее описание посредством ссылки).
Используемые в настоящем описании термины "вариабельная область", "лидерная последовательность", "константная область" и "каркас" употребляются в их общепринятом смысле (см., например, ниже или в вышеуказанных работах, вводимых в настоящее описание посредством ссылки).
В предпочтительном варианте осуществления настоящего изобретения лидерная последовательность происходит от человека, шимпанзе или обезьяны и имеет приблизительно 60 оснований (примеры см. на фиг. 1).
Автор настоящей заявки обнаружил, что лидерная последовательности вариабельной области антитела обезьяны, шимпанзе и человека имеют достаточное сходство, такое, что праймеры, сконструированные для одной из них, могут быть использованы для амплификации другой. В этом методе осуществляют амплификацию РНК для продуцирования некоторого количества нуклеиновой кислоты, достаточного для введения этой нуклеиновой кислоты в вектор для последующего клонирования.
Во втором своем варианте настоящее изобретение относится к способу продуцирования антитела против антигена человека, которое не является иммуногенным для человека. Этот способ предусматривает продукцирование в организме обезьяны антитела против антигена человека и выделение нуклеиновой кислоты обезьяны, кодирующей антигенраспознающий участок вариабельной области антитела обезьяны. Затем получают нуклеиновую кислоту человека, кодирующую константную область антитела человека, и полученную нуклеиновую кислоту человека лигируют с нуклеиновой кислотой обезьяны, в результате чего образуется рекомбинантная нуклеиновая кислота. После этого, полученную рекомбинантную нуклеиновую кислоту экспрессируют для получения нужного антитела. Альтернативно для получения рекомбинантного антитела может быть использована нуклеиновая кислота, кодирующая константную область шимпанзе или обезьяны. Имеется очень небольшое различие, если оно вообще имеется, между константными областями аминокислотных последовательностей человека и шимпанзе (то есть они являются гомологичными), а те различия, которые имеются между указанными константными областями человека и шимпанзе, могут быть легко изменены с помощью стандартной техники, в том случае, если для продуцирования рекомбинантного антитела используют нуклеиновую кислоту, кодирующую константную область антитела обезьяны. Основная отличительная особенность настоящего изобретения заключается в том, что продуцируемое антитело является менее иммуногенным, чем константная область обезьяны, поэтому при введении рекомбинантного антитела человеку в его организме не индуцируется значительного иммунного ответа. Далее, указанные области антитела будут называться гомологичными областями. Таким образом, сконструированное рекомбинантное антитело по своей аминокислотной последовательности является функционально аналогичным антителу человека, то есть оно имеет константную область, гомологичную константной области антитела человека или шимпанзе. В целом, это антитело является аналогичным антителу человека, что необходимо для снижения возможности продуцирования нежелательного иммунологического ответа к этому антителу, а также содержит антигенсвязывающий участок, происходящий от антитела обезьяны.
Термин "неиммуногенное" антитело означает, что это антитело не вызывает иммунного ответа с образованием антител, достаточного для снижения эффективности продолжительного введения антитела большинству людей, осуществляемого в период времени, достаточный для достижения терапевтического эффекта (например, по сравнению с мышиным или мышь-человеческим химерным антителом). Предпочтительно, если этого иммунного ответа вообще не будет продуцироваться.
В предпочтительных вариантах осуществления настоящего изобретения рассматриваемый способ предусматривает иммортализацию клеток обезьяны, которые являются ответственными за продуцирование антител обезьяны, например, путем синтеза гибридомы, вирусной трансформации с использованием Herpes papio, лишь B-клеточного клонирования (такая иммортализация называется также "временной иммортализацией"); и продуцирование библиотеки рекомбинантных иммуноглобулинов. В другом предпочтительном варианте настоящего изобретения этот способ предусматривает отбор B-клеток из лейкоцитов периферической крови, селезенки, костного мозга или лимфатических узлов обезьяны; отбор клона, который продуцирует соответствующее антитело; "спасение" генов иммуноглобулина, кодирующих данное антитело из иммортализованной клеточной линии; и повторную экспрессию генов в линии клеток-продуцентов (т.е. в линии клеток, способствующих продуцированию антитела, достаточному для его использования в целях терапии человека).
В третьем своем варианте настоящее изобретение относится к моноклональному антителу или его Fab-, (Fab)2-фрагментам, димеру легкой или тяжелой цепи или к любому минимальному рекомбинантному фрагменту, такому как FV или SCA (одноцепочечному антителу), либо другому его фрагменту с иммуноглобулиновой активностью (например, CDR-область) против антигена человека, продуцируемого иммортализованной B-клеткой обезьяны. Данные фрагменты используются в качестве иммуносупрессорных агентов. Альтернативно антитело настоящего изобретения может присоединять к себе эффекторную или репортерную молекулу. Например, антитело настоящего изобретения может иметь макроцикл для образования хелатного комплекса с тяжелымт атомом металла или с токсином, таким как рицин; причем антитело присоединяет указанную молекулу посредством ковалетной мостиковой связи. Кроме того, Fc-фрагмент или CH3-домен полной молекулы антитела может быть заменен молекулой фермента или токсина, а часть цепи иммуноглобулина может быть связана с полипептидным эффектором или молекулой-репортером. С помощью стандартной процедуры могут быть также сконструированы биспецифические антитела.
В другом своем варианте настоящее изобретение относится к фармацевтическим композициям, которые содержат антитела настоящего изобретения, используемые в терапевтических или профилактических целях. Такие антитела могут быть также получены в виде иммунотоксинов, то есть молекул, состоящих из двух компонентов и предназначенных, в частности, для убивания определенных клеток in vitro или in vivo. Одним из компонентов указанных антител является цитотоксичный агент, который, при его присоединении или абсорбции, оказывает убивающее действие на клетку. Второй компонент, известный как "транспортный механизм", обеспечивает доставку указанного токсического агента к клетке конкретного типа, например, такой как клетка карциномы. Эти два компонента, обычно, химически связаны друг с другом посредством любой из известных химических или генетических связей. Например, если цитотоксическим агентом является белок, а вторым компонентом является цельный иммуноглобулин, то они могут быть связаны между собой с помощью гетеробифункционального перекрестно-сшивающего агента, такого как карбодиимид, глутаральдегид, и т.п. Способы продуцирования различных иммунотоксинов хорошо известны специалистам.
В другом, близком к предыдущему, варианте настоящее изобретение относится к нуклеиновой кислоте, кодирующей рекомбинантное антитело человека/обезьяны. В предпочтительных вариантах осуществления настоящего изобретения нуклеиновая кислота кодирует константную область человека или шимпанзе и антигенсвязывающий участок вариабельной области обезьяны; и эту нуклеиновую кислоту очищают, т. е. отделяют от биологических компонентов, которые связаны с ней в природных условиях, либо, что более предпочтительно, эту нуклеиновую кислоту получают в виде гомогенного раствора.
В еще одном своем варианте настоящее изобретение относится к CDR-привитому антителу, содержащему, по крайней мере, 1 из гипервариабельных участков (CDR, complementarity determining region), то есть аминокислотных остатков (с использованием стандартной системы мечения аминокислот kabat) 31-35 (CDR1), 50-65 (CDR2) и 95-102 (CDR3) указанной тяжелой цепи, и аминокислотных остатков 24-34 (CDR1), 50-56 (CDR2) и 89-97 (CDR3) указанной легкой цепи вариабельной области обезьяны, и каркас вариабельной области иммуноглобулина, происходящего от другого вида. Антитело со встроенным CDR способно связываться с тем же самым антигеном, что и исходное антитело обезьяны. Константная область этого антитела происходит от иммуноглобулина человека или шимпанзе. Методология осуществления рассматриваемого варианта настоящего изобретения, в общих чертах, описана Jones и др. (321 Nature 522, 1986). Указанные CDR-вставки могут быть изменены, если это необходимо для обеспечения большего человекообразия данного антитела в целях снижения вероятности индуцирования нежелательной иммунной реакции против этого антитела.
В предпочтительных вариантах осуществления настоящего изобретения рассматриваемый способ предусматривает иммортализацию или селекцию клеток от макаки, ответственных за продуцирование антител макак, и выделение генов иммуноглобулина из этих клеток; клонирование и секвенирование генов, ответственных за продуцирование антител; отбор каркасной последовательности вариабельной области человека (предпочтительно, с наибольшей гомологией по отношению к каркасной последовательности вариабельной области макаки); замещение CDR-последовательностей человека CDR-последовательностями макаки; а также для сохранения аффинности антитела по отношению к его антигену могут быть осуществлены небольшие модификации в каркасной области человека.
Под термином "небольшие модификации" подразумевается, что в указанной каркасной области могут быть, в целом, заменены другими аминокислотами менее чем около 6 аминокислот, обычно такие замещения или модификации осуществляют только, если эти аминокислоты участвуют в конформационных взаимодействиях, которые поддерживают каркас в соответствующей форме так, чтобы нужный антиген распознавался антителом. Эти модификации будут, в основном, относится к аминокислотам, присутствующим в антителе макаки, и отличающимся от аминокислот антитела человека. Например, аминокислотная последовательность антитела человека, расположенная как раз перед CDR3 тяжелой цепи, 92-94 представляет собой, в основном, цистеин-аланин-аргинин (известно, что в меньшинстве антител, аргинин бывает заменен серином или треонином); а в некоторых антителах последовательности мартышек, эта последовательность представляет собой цистеин-аланин-серин; таким образом, в этом примере может быть предпочтительным использовать в положении 94 серин (см. фиг. 9D).
В еще одном своем варианте, настоящее изобретение относится к способу лечения человека, имеющего конкретный антиген, например антиген, ассоциируемый с каким-либо заболеванием. Этот способ предусматривает введение терапевтически эффективного количества рекомбинантного антитела, специфичного для данного антигена; причем указанное антитело содержит константную область человека или шимпанзе и антигенраспознающий участок вариабельной области обезьяны; либо константную область первой обезьяны и антигенсвязывающий участок вариабельной области второй, отличающейся от первой обезьяны.
В предпочтительных вариантах осуществления настоящего изобретения антигеном является опухолевый антиген; антиген, вызывающий аутоиммунный ответ; рецептор, экспрессируемый на клетке-хозяине; или антиген, выбранный из антигенов человека CD58, VLA4 (интегрин α 4 β 1), CD2, LFA3, ELAM, LAM, CD25, CD4, CD19, CD20, рецептор T-клеток человека, CD3, CD8, CD23, CD41, CD44, CD45, CD71, TNFα, TNFβ, антиген Tn, IL-1, IL-8, C5a, факторы адгезии, например VCAM, CD54, CD28, CD11a, CD11c, CD18 и CD11b, продукт онкогенного вируса neu, MDR-1 (P-гликопротеин), TGFα и его рецептор и PDGF; а рекомбинантное антитело обладает супрессорным действием (убивающим или элиминирующим) на нежелательные клетки (например, анти-CD4) путем активации комплемента или клеток-киллеров, либо указанное антитело является цитотоксическим агентом или способствует связыванию Fc-рецептора фагоцитом. Альтернативно это антитело блокирует или стимулирует функции рецептора либо нейтрализует активные растворимые продукты, такие как один или более интерлейкинов, TNF и C5a.
В других своих вариантах настоящее изобретение относится к фармацевтическим комбинациям, содержащим вышеуказанные антитела или их фрагменты. Композиции или продукты настоящего изобретения могут быть получены в виде растворов, подходящих для парентерального, назального, или перорального введения. Соответствующие препараты, содержащие антитело, могут быть использованы в сочетании с соответствующими препаратами других агентов для повышения клинической эффективности.
Другие особенности и преимущества настоящего изобретения будут очевидны из нижеприведенного описания предпочтительных вариантов осуществления настоящего изобретения и из нижеприведенной формулы изобретения.
Описание предпочтительного осуществления настоящего изобретения
Ниже приводится краткое описание чертежей:
фиг. 1 - схематическое изображение 20 кодонов в девяти различных лидерных последовательностях тяжелой цепи Ig человека и десяти лидерных последовательностей тяжелой цепи Ig обезьяны;
фиг. 2 - схематическое изображение структуры различных цепей Ig, где показаны относительные положения лидерной, вариабельной и константной областей, а также положения рестриктирующих сайтов и праймеров, используемых для амплификации;
фиг. 3 - схематическое изображение вектора-кластера тяжелой цепи для экспрессии человеческого или химерного антител;
фиг. 4 - схематическое изображение вектора-кластера легкой цепи для экспрессии человеческого или химерного антител;
фиг. 5 и 6 - схематические изображения векторов, предназначенных для экспрессии иммуноглобулина из кДНК, кодирующей каппа- и лямбда-легкие цепи соответственно. В этих векторах, гены иммуноглобулина выстроены в тандемной конфигурации с помощью неомицин-фосфотрансферазы в качестве селектируемого маркера;
фиг. 7-1, 7-2 и 8 - изображение нуклеиновокислотной последовательности различных праймеров лидерных последовательностей, используемых в настоящем изобретении (эти праймеры на фиг. 8 соответствуют праймерам, представленным ниже, см. SEQ ID N 1-12);
фиг. 9A-9H - сравнение областей, происходящих от человека и обезьяны, в VH1, VH2, VH3, VH4 и VH5-последовательностях VKI и VKII и Yλ III соответственно;
фиг. 10 - сравнение VH3-последовательностей человека и обезьяны и с VH2-последовательностью человека;
фиг. 11 - графическое изображение связывания антитела настоящего изобретения с CD4-антигеном человека;
фиг. 12 - графическое изображение ингибирования связывания IF3 с антителом, показанным на фиг. 10;
фиг. 13-14 - части нуклеотидных последовательностей областей VH и VL против CD4 соответственно;
фиг. 15 - график, иллюстрирующий анти-CD54-активность;
фиг. 16 - гистограмма, иллюстрирующая сравнительную экспрессию плазмид.
Антитела обезьян
К обезьянам Старого Света относятся бабуин и макаки (включая макаку-резус и павиана). В данной заявке подробно описано использование в настоящем изобретении генов различных обезьян. Приведенные ниже примеры служат лишь иллюстрацией настоящего изобретения и не ограничивают его объема, а поэтому оно может быть с таким же успехом применено и к другим видам обезьян Старого Света.
На фиг. 2 в схематическом виде показана основная структура генов, кодирующих тяжелую, каппа-легкую и лямбда-легкую цепи иммуноглобулина. Каждая их этих цепей имеет инициирующий ATG-кодон, после которого следует лидерная последовательность приблизительно из 60 оснований, затем область, кодирующая вариабельную область иммуноглобулина, и, наконец, область, кодирующая константную область этого иммуноглобулина. Примеры различных лидерных последовательностей или сигнальных пептидов тяжелых цепей показаны на фиг. 1. Эти последовательности и их эквивалент у обезьян могут быть определены с помощью стандартной техники, хорошо известной специалистам и описанной ниже.
Последовательности, показанные в нижней части фиг. 1, представляют собой лидерные последовательности человека. Авторами настоящей заявки было обнаружено, что конструирование праймеров, комплементарных этим лидерным последовательностям, позволяет осуществить амплификацию генов Ig обезьян. Аналогично праймеры, гомологичные лидерным последовательностям обезьян (см., например, верхнюю часть фиг. 1), могут быть использованы для амплификации генов иммуноглобулина обезьяны, а также для амплификации генов иммуноглобулина человека.
При использовании указанных праймеров в стандартных процедурах амплификации гены, кодирующие различные иммуноглобулины обезьян, могут быть легко выделены, в результате чего могут быть определены последовательности, кодирующие вариабельные области антител. Примеры таких процедур описаны ниже. Результаты анализов представлены на фиг. 9A-9H и фиг. 10. Неожиданно было обнаружено, что несмотря на способность к продуцированию у обезьян антител к относительно консервативным антигенам человека, вариабельные последовательности каркасных участков продуцированных таким образом антител будут неотличимы от соответствующих последовательностей антител человека. То есть, степени вариабельности последовательности иммуноглобулина, наблюдаемой у обезьян и у человека, аналогичны, а поэтому без анализа самого источника невозможно определить, какое из антител принадлежит человеку, а какое обезьяне.
Так, например, на фиг. 10 дано сравнение аминокислотной последовательности VH3-области человека и обезьяны. Антитела человека обнаруживают область гомологии между собой на 83-98%, а антитела обезьяны на 90-95% гомологичны VH3-области человека. В противоположность этому VH2-область человека гомологична VH3-области человека на 60%. На этом чертеже так же, как и на других чертежах, присутствие одинаковых аминокислот в любом положении показано пунктирной линией, тогда как присутствие различных аминокислот показано стандартным буквенным обозначением. Положения, которым не могут быть приписаны аминокислоты "консенсуса" (обобщающего типичного элемента структуры), обозначены X. Аналогично гомология для VH1, VH2, VH3, VH4 и VH5, и для VKI и VKIII и V λ III показана на фиг. 9A-9H соответственно. И снова, наблюдалась значительная гомология между последовательностями иммуноглобулина обезьян и человека в каждой вариабельной области, включая последовательности J-участков иммуноглобулина. Такая высокая гомология аналогична той, что наблюдается между антителами человека.
Методика определения этих последовательностей описана в нижеприведенных примерах. При этом, следует отметить, что настоящее изобретение не ограничивается этими примерами, и эквивалентные результаты, а также моноклональные и химреные антитела могут быть получены с использованием аналогичных процедур, хорошо известных специалистам. См., например, выше патенты США 4816567, 4978745, 4975369 и 4816397. Например, после клонирования гена, кодирующего вариабельную область обезьяны, этот ген может быть легко лигирован с геном, кодирующим константную область обезьяны или человека, после чего эти слитые гены экспрессируют в клетке-продуценте для получения нужного антитела. Эти процедуры описаны в представленных ниже примерах.
В нижеприведенных примерах первая стадия описываемого метода включает в себя выделение полной РНК из клеток периферической крови или клеток селезенки обезьяны. B-клетки от иммунизированных обезьян могут быть получены из периферической крови или лимфоузлов и непосредственно использованы, либо они могут быть, предпочтительно, размножены. Указанное размножение может включать в себя трансформацию вирусом Herpes papio, гибридизацию с гетерологической клеткой, миеломы, и последующую селекцию или клонирование отдельных B-клеток при ограниченном разделении в присутствии стимулированных T-клетках человека.
Затем, полную РНК конвертируют в одноцепочечную (оц) кДНК с помощью обратной транскриптазы и с использованием неспецифических (олиго-dT или неупорядоченных гексамеров) или специфических (константные области C λ или CK или CH1 иммуноглобулина) олигонуклеитидных праймеров. Одноцепочечную кДНК, продуцированную с помощью этой реакции, амплифицируют с использованием полимеразно-цепной реакции, в которой оц кДНК вместе с дезоксинуклеотидтрифосфатами, ДНК-полимеразной (например, термостабильной полимеразной) и специфическими праймерами используют для амплификации генов вариабельной области тяжелой или легкой цепи иммуноглобулина. Используемые праймеры представляют собой одноцепочечные синтетические олигонуклеотиды из 20-40 оснований, содержащие вырожденные основания, которые связаны с 5'-лидерными последовательностями иммуноглобулина. Для амплификации семейств вариабельных областей тяжелой цепи антитела обезьяны, исходя из их схожести с генными семействами вариабельных областей тяжелой цепи антитела человека, были сконструировали 6 различных 5'-праймеров для лидерных последовательностей (см. фиг. 7-1), вводящих рестрикционный сайт (например, Sall). Причем, с каждым из этих шести 5'-праймеров для лидерных последовательностей был использован 3'-праймер, являющийся специфическим для константной области домена соответствующего изотипа (например, IgG, IgM, IgA или IgE) и также вводящий рестриктирующий сайт (например, Nhel). Аналогично для легких каппа- и лямбда-цепей обезьяны были использованы другие пары праймеров для амплификации соответствующей вариабельной области легкой цепи (фиг. 7-2).
Другие серии праймеров могут быть использованы для введения других уникальных рестрикционных сайтов для непосредственного клонирования PCR-амплифицированной ДНК в соответствующий экспрессирующий вектор, имеющий тот же самый рестрикционный сайт. Как показано на фиг. 7-1, может быть также использован набор праймеров, связывающихся с 3'-концом лидерной последовательности тяжелой цепи антитела и вводящих Ml и l-сайт, либо набор праймеров, связывающихся с первыми 23 основаниями каркасной последовательности и вводящих Xhol-сайт. Гены вариабельной области легкой и тяжелой цепи иммуноглобулина обезьяны могут быть клонированы в "челночный" вектор непосредственно после PCR-амплификации, что позволяет проводить дальнейшие молекулярные манипуляции, если они необходимы; либо эти гены могут быть клонированы непосредственно в экспрессирующий вектор, который содержит гены константной области тяжелой или легкой цепи иммуноглобулина человека. Молекулярная конфигурация генов иммуноглобулина в экспрессирующем векторе может быть геномной, где присутствуют промотор/энхансер иммуноглобулина и другие регуляторные области, а также последовательности донора/акцептора сплайсированного фрагмента в экзон/интронном стыке. Альтернативно химерные гены иммуноглобулина могут быть вставлены в кДНК-конфигурации, используют гетерологические вирусные промоторные/энхансерные последовательности.
Пример 1. Последовательность антител обезьян
На фиг. 7 и 8 показаны праймеры с рестрикционными или без рестрикционных сайтов соответственно, используемые в PCR-амплификации генов иммуноглобулина от кДНК обезьяны и/или человека. Подробно эти процедуры описаны ниже. РНК выделяли из клеток селезенки, периферической крови и лимфатических узлов обезьян при помощи метода с использованием гуанидинизотиоцианата. Фракцию полной РНК выделяли указанным методом, а затем использовали в качестве матрицы для последующей реакции амплификации. Аликвоту РНК инкубировали в присутствии 200 единиц обратной транкриптазы вируса Малони мышиного лейкоза неспецифических (олиго dT или неупорядоченных гексамеров) или специфических (CH1-область иммуноглобулина IoG или константная область CK каппа-цепи) олигонуклеотидных праймеров (50-100 пикомолей) в целях генерации некодирующей смысловой одной цепи кДНК. Затем, однонитевую кДНК, продуцированную таким образом, амплифицировали с помощью полимеразно-цепной реакции (PCR). Аликвоту одноцепочечной кДНК инкубировали вместе с дезоксинуклеотидтрифосфатами (20 мкМ), термостабильной ДНК-полимеразой (2-5 единиц) и происходящими от человека синтетическими олтгонуклеитидными праймерами (50 пикомолей) в целях амплификации генов вариабельной области либо тяжелой, либо легкой цепи иммуноглобулина.
Используя пары праймеров, показанных на фиг. 8, также амплифицировали несколько характерных последовательностей ряда генных семейств вариабельной области тяжелой и легкой цепи иммуноглобулина павиана. Эти амплифицированные последовательности клонировали в EcoRV-сайт плазмидного вектора p-Bluescript (pBS, поставляемый от Stratagene, CA) и использовали для секвенирования ДНК. Секвенирование ДНК осуществляли с использованием плазмиды, содержащей вставку в виде двухцепочечной ДНК-матрицы, и с помощью стандартного метода обрыва цепи.
Типичные последовательности иммуноглобулина павиана показаны на фиг. 9A-9H. Показанные на фиг. 9A-9H последовательности представляют собой аминокислотные последовательности "консенсуса" для генов вариабельной области иммуноглобулина человека, представляющих собой каждое из генных семейств мажорной вариабельной области. Показано процентное содержание гомологии между каждой последовательностью обезьяны и последовательностями "консенсуса" человека за исключением константных доменных областей и CDR-областей. Уровень гомологии между последовательностями данного семейства человека и обезьяны является таким же высоким, как и между последовательностями того же семейства двух людей. Поэтому невозможно на основании лишь одного сравнения последовательностей отличить последовательности вариабельной области имммуноглобулина, происходящие от обезьяны, от последовательностей, происходящих от человека.
Выделение РНК
Антигенспецифические B-клетки обезьяны были получены несколькими способами, а именно: путем слияния клеток лимфатических узлов иммунизированной обезьяны с гибридной клеточной линией K5H6/B5 гетеромиеломы человека/мыши с последующим скринингом линий гибридомы; путем вирусной трансформации B-клеток или путем in vitro-клонирования одиночной B-клетки. В последнем случае, рост одиночной B-клетки обезьяны поддержали in vitro путем совместного культивирования c T-клетками человека, которые были стимулированы антителом. Одну B-клетку помещали в каждую лунку 96-луночного планшета для культивирования тканей вместе с около 150000 T-клетками человека, обработанными анти-CD3-стимулированным митомицином C. После двухнедельной инкубации одиночную B-клетку размножали, по крайней мере, до 200 дифференцированных плазматических клеток. Культуральную насадочную жидкость из этих лунок анализировали на присутствие иммуноглобулина с помощью ELISA-анализа, используя иммобилизованное козье антитело против иммуноглобулина обезьяны.
Клетки либо из антигенспецифических, трансформированных вирусом клеток, либо из гидридом культивировали в количестве, достаточном для экстракции РНК. Клетки, полученные в лунках путем клонирования одиночной B-клетки и являющиеся положительными на иммуноглобулин, удаляли, дважды промывали холодным фосфатно-солевым буфером (pH 7,5) и центрифугировали (1000 х g, 10 мин). Промытые клетки суспендировали в 100 мкл раствора для лизиса (4 М гуанидинизоцианата; 25 мМ цитрата натрия, pH 7,0; 0,5% натрийсакрозин; 0,1 2-меркаптоэтанола). Затем добавляли 10 мкл 2 М ацетата натрия, pH 4,0, и размешивали. Белок удаляли путем добавления 100 мкл воды, насыщенной фенолом, с последующим смешиванием и добавлением 20 мкл хлороформа/изоамилового спирта (49:1). После интенсивного перемешивания и инкубации на льду в течение 15 минут образцы центрифугировали при 10000 х g в течение 20 минут. Затем водную фазу переносили в новую пробирку, смешивали с равным объемом изопропанола и инкубировали в течение 1 часа при -20oC. Образовавшийся осадок собирали путем центрифугирования при 10000 х g в течение 15 минут, затем промывали 70% этанолом, снова центрифугировали, а осадок осушали в Speedivac (Savant). Осушенную РНК снова растворяли (во второй раз) в 100 мкл буфере для лизиса. Затем добавляли равный объем изопропанола и инкубировали при -20oC в течение одного часа. Осадок собирали путем центрифугирования при 10000 х g в течение 15 минут и промывали 70% этанолом. Осадок после центрифугирования осушали в Speedivac (Savant) и хранили при -20oC в 70% этаноле вплоть до его использования.
Синтез одноцепочечной кДНК
Полную РНК, экстрагированную из клеток, взятых из одной лунки, растворяли в 32 мкл дважды дистиллированной воды, к которой добавляли 1 мкл (50-100 пМ) праймера (либо неупорядоченных гексамеров, олиго-dT, либо 3'-иммуноглобулинспецифических праймеров) и 10 мкл (5 х) буфера для обратной транскриптазы (0,25 Трис-HCl, pH 8,3, 0,375М KCl, 15 мМ MgCl2 50 мМ дитиотреитола). Полученую смесь нагревали 5 минут при 65oC, после чего ее помещали на лед на 2 минуты. После нагревания добавляли 1 мкл РНКазина (Promega), 5 мкл 5 мМ дезоксинуклеотидтрифосфатов и 1 мкл (200 ед.) обратной транскриптазы вируса Молони мышиного лейкоза (BRL), и полученную смесь инкубировали 1,5 часа при 37oC. После завершения обратно-транскриптазной реакции смесь одноцепочечной кДНК-РНК экстрагировали фенолом/хлороформом и пропускали через вращающуюся колонку с 1 мл G-25-Сафадекса. Материал, пропущенный через эту колонку, использовали в качестве оц кДНК-матрицы для PCR-амплификации.
Амплификация оц кДНК
3-10 мкл оц кДНК смешивали с 10 мкл (10 х) PCR-буфера (500 мМ KCl, 10 мМ Трис-HCl, pH 8,3, 15 мМ MgCl2), 1,6 мкл, 1,25 мМ дезоксинуклеотидтрифосфатов, 50 пМ специфического 5'-праймера для амплификации генов иммуноглобулина, 50 пМ специфического 3'-праймера для амплификации генов иммуноглобулина и 2-5 ед. термостабильной ДНК-полимеразы (Synthetic Genetics). Реакционный объем доводили до 100 мкл путем добавления воды и покрывали сверху 100 микролитрами минерального масла. Реакционную смесь инкубировали в следующем режиме:
при 94oC в течение 1 минуты;
при 48oC в течение 2 минут;
при 72oC в течение 2 минут.
Этот цикл повторяли 30-35 раз. Амплифицированные продукты анализировали в помощью электрофореза на агарозном геле, используя 1,2%-ный агарозный гель и молекулярно-массовые стандарты. Амплифицированные гены вариабельной области иммуноглобулина вводили приблизительно между маркерами 350-500 п.о. PCR-амплифицированные продукты затем использовали для клонирования в соответствующий плазмидный вектор.
Пример 2. Клонирование генов антител обезьян
Поскольку последовательности генов вариабельной области иммуноглобулина обезьян невозможно отличить (на уровне кДНК) от членов эквивалентного генного семейства человека, то иммунные ответы на химерные антитела обезьян/человека, если они имеют место, будут, к сожалению, отличаться от ответов, индуцированных против антител человека.
PCR-техника может быть использована для введения специфических сайтов рестриктирующих ферментов, включая (но не ограничиваясь ими) SaII, BgII, KPnI и NheI, в последовательности вариабельной области иммуноглобулина обезьян, где для PCR-амплификации используют праймеры (см. фиг. 6). Уже имеющиеся клонированные гены амплифицировали из их специфического вектора, используя указанные праймеры для введения специфического рестриктирующего сайта, который затем использовали для клонирования гена в экспрессирующий вектор. Альтернативно эти праймеры использовали для амплификации непосредственно из клеточной РНК.
Были сконструированы два типа экспрессирующих векторов. Первый вектор (см. фиг. 3 и 4) позволял вставить клонированные кДНК вариабельных областей иммуноглобулина обезьян в кластерный вектор, используя уникальные рестрикционные сайты; причем в этом кластерном векторе элементы гена иммуноглобулина располагались в геномной конфигурации. Этот тип вектора включает в себя промотор иммуноглобулина; два экзона, составляющие лидерную последовательность иммуноглобулина; два сайта клонирования Spel и Nhel, затем, "вниз по течению", последовательности донора сплайсированного фрагмента, энхансерная область иммуноглобулина, ген константной области (тяжелой или легкой цепи) иммуноглобулина человека, а затем сигналы полиаденилирования. Эти векторы, кроме того, включают в себя бактериальную область начала репликации, ген бета-лактамазы для бактериальной селекции и ген неомицинфосфотрансферазы для G418-селекции или ген ксантин-гуанин-фосфорибозилтрансферазы (gpt) для селекции в клетках млекопитающих с использованием микофеноловой кислоты. В векторах экспрессии тяжелой и легкой цепи используются гены неомицинфосфотрансферазы (Neo) и ксанти-гуанин-фосфорибозилтрансферазы (Gpt) соответственно в качестве селектируемого маркера.
Во втором типе экспрессирующей системы (см. фиг. 5 и 6) используются гены иммуноглобулина в кДНК-конфигурации. То есть между 5'-лидерной последовательностью и 3'-последовательностями константной области не имеется инронов или участков сплайсинга. Этот тип вектора использует гетерологические вирусные промоторные энхансерные последовательности, стимулирующие расположенные тандемом гены тяжелой и легкой цепи иммуноглобулина, последовательности полиаденилирования и селектируемый маркер клеток млекопитающих (Neo). Ген Neo может быть модифицирован для ослабления его трансляции, например, путем изменения расположенного выше кодона и соседнего старт-сигнала гена от ACC до TCT. Кроме того, для проведения последующей амплификации гена с использованием метотрексата присутствует ген гидрофолатредуктазы (dhfr). Гены вариабельной области иммуноглобулина обезьяны, клонированные в экспрессирующие векторы с кДНК-конфигурацией, амплифицировали либо из уже присутствующих в челночном" векторе (PBS) клонированных последовательностей, либо непосредственно из РНК с использованием праймеров, содержащих либо рестрикционные сайты SaII или MIuI и NheI для тяжелой цепи, либо BgIII и KpnI или BsiwI для легких каппа- или лямбда-цепей. Однако не исключается использование и других подходящих уникальных рестрикционных сайтов.
Химерные гены тяжелой и легкой цепи иммуноглобулина вводили отдельно или последовательно (для конструкций с геномной конфигурацией), или в тот же самый вектор (для конструкций с кДНК-конфигурацией) путем электропорации в линию клеток-продуцентов. Метод электропорации использовали для введения лианеризованных конструкций ДНК либо в клетки яичника китайского хомячка (CHO), либо в клетки мышиной миеломы с последующим клонированием потомства одной клетки с трансфектантом в 96-луночном планшете для культивирования тканей. Условия электропорации с использованием прибора для электропорации BTX-100 (BTX, San Deigo) и одноразовой пластиковой 1 мл-кюветы давали оптимальное число трансфектантов от данного количества ДНК вектора. CHO-клетки, которые были адаптированы для культивирования в суспензии в бессывоторочной среде (SFM) (CHO-S SFMII минус гипоксантин и тимидин, Gibco), использовали в конструкциях, содержащих вирусных регуляторные элементы.
Субклонирование генов вариабельной области Ig
Продукты PCR-реакции экстрагировали смесью фенола и хлороформа и пропускали через вращающуюся колонку (1 мл, Сефадекс G-25). Если ДНК-фрагмент клонировали в плазмиду по тупым концам, то ко всей PCR-реакционной смеси добавляли 1 мкл 1M MgCl2, 0,5 мл, 1,25 мМ дезоксинуклеотидтрифосфатов и 1 мМ ДНК-полимеразы Кленова (5 ед.), и полученную смесь инкубировали 15 минут при 37oC для заполнения любых 5 "липких" концов. Перед клонированием в плазмиду по "тупым концам" 5'-концы фосфорилировали следующим образом: ко всей реакционной смеси добавляли 5 мкл 10 мМ ATP, 1 мкл полинуклеотид-киназы T4 (10 ед. ), и полученную смесь инкубировали 30 минут при 37oC. Амплифицированные фрагменты, которые содержали внутренние рестрикционные сайты, сначала разрезали соответствующим рестрикционным ферментом и использовали непосредственно для лигирования без фосфорилирования. В обоих случаях клонированный фрагмент экстрагировали фенолом/хлороформом, а затем лигировали в соответствующий вектор.
Для реакции лигирования 10% фосфорилированного или разрезанного рестрикционным ферментом PCR-амплифицированного фрагмента смешивали с около 2 нг соответствующего вектора (полный объем 8 мкл), предварительно переваренного рестриктирующим(и) ферментом (ферментами). Для клонирования по "тупым" концам использовали pBluescript, переваренный ферментом EcoRV. Для клонирования по "липким" концам использовали вектор TCAE 5,2, или 6,0, или pGenex-H, или pGenexL, разрезанные соответствующими рестрикционными ферментами. К смеси добавляли 1 мкл буфера для лигирования (10 х) (500 мМ Трис-HCl, pH 7,6, 100 мМ MgCl2; 10 мМ ATP; 10 мМ дитиотреитола) и 1 мкл ДНК-лигазы T4 (1 ед.) и проводили реакцию при 14oC в течение ночи. Лигированный материал использовали для трансформации компетентных клеток HB101 E.coli, проводимой стандартным методом с использованием хлорида кальция. Трансформированные бактерии отбирали путем культивирования на чашках с агаром LB, содержащем ампициллин. Отдельные колонии отбирали, культивировали в течение ночи в LB-среде, содержащей ампициллин, и плазмидную ДНК экстрагировали посредством стандартного щелочного лизиса. После рестрикционного анализа, проводимого для того, чтобы определить, которые из клонов содержали иммуноглобулиновые вставки, получали ДНК для секвенирования.
Секвенирование клонированных генов
Клонированные гены вариабельной области иммуноглобулина секвенировали с использованием стандартного метода обрыва цепи. Двухцепочечную плазмидную ДНК, содержащую клонированную вставку, использовали в качестве секвенирующей матрицы. Перед секвенированием двухцепочечную ДНК химически денатурировали. ДНК секвенировали с использованием ДНК полимеразы T7 SEQUENASE (United States Biochemical Corporation, Cleveland, OH), радиоактивно меченного альфа дезоксиАТР и следующих праймеров для секвенирования: (5'-CAGAGTGGGTACGTCCTCA 3') и (5' GCCCCCAGAGGTGCTCTTGG 3'), для вариабельной области тяжелой цепи иммуноглобулина G в направлениях 5'--->3' и 3'--->5' соответственно; и (5'CAGAGCTGGGTACGTGAACC 3'), и (5'GGCTTGAAGCTCCTCAGAGG 3') для вариабельной области легкой λ -цепи иммуноглобулина в направлениях 5'--->3' и 3'--->5' соответственно. Реакционные продукты разделяли на 6% в полиакриламидном геле и проводили считывание данных.
Результаты секвенирования ряда генов вариабельной области тяжелой и легкой цепи иммуноглобулина обезьяны систематизированы на фиг. 9A-9H. Клонирование и секвенирование генов иммуноглобулина павиана ранее не описывалось в литературе. Поэтому, невозможно также определить степень гомологии между генами V-области иммуноглобулинов человека и павиана. Была описана гомология между единичным геном вариабельной области λ - цепи шимпанзе и его человеческого двойника, которая обнаружила лишь 2% различия в их каркасных областях.
Трансфекция и селекция
После секвенирования клонированных генов вариабельной области тяжелой и легкой цепи они были субклонированы в соответствующие векторы экспрессии. Эти векторы могут быть сконструированы так, чтобы они содержали регуляторные элементы иммуноглобулина в геномной конфигурации (как показано на фиг. 3 и 4) или вирусные регуляторные элементы в кДНК-конфигурации (фиг. 5 и 6). Соответствующие рестрикционные сайты (SpeI NheI) могут быть встроены в праймеры для PCR-амплификации во время начальной стадии амплификации, или наоборот, праймеры для амплификации, содержащие рестрикционные сайты, могут быть использованы для амплификации генов иммуноглобулина из "челночных" векторов, в которых они были клонированы. Альтернативно гены вариабельной области иммуноглобулина могут быть клонированы непосредственно в экспрессирующие векторы после PCR-амплификации из РНК для того, чтобы избежать субклонирования.
Электропорация
Электропорацию использовали либо для котрансфекции геномных конструкций тяжелой и легкой цепи, либо для последовательной трансфекции геномных конструкций легкой и тяжелой цепи в клетки Sp2/0. При последовательной трансфекции проводили электропорацию химерной конструкции легкой цепи с последующей селекцией в микофеноловой кислоте. Скрининг культуральных супернатантов от клонов, культивированных в 96-луночных планшетах, на продуцирование легкой цепи с использованием антисыворотки против константной области легкой цепи человека и с помощью ELISA-анализа позволяет проводить селекцию наиболее высокоэкспрессирующихся клонов легкой цепи. Последующая электропорация трансфектантов легкой цепи с вектором, содержащим химерную конструкцию тяжелой цепи обезьяны/человека, позволяет проводить селекцию трансфектом, экспрессирующих химерное антитело нужной специфичности и изотипа.
Конструкцию легкой цепи pGENEX-L (фиг. 3 и 4) трансфецировали в клеточную линию мышиной миеломы Sp2/0 путем электропорации, как описано ниже. Клетки Sp2/0 при концентрации 1•107/мл в буфере для трансфекции (272 мМ сахарозы, 7 мМ фосфата натрия, pH 7,4, 1 мМ MgCl2) смешивали с 50 мкг pGENEX-L, содержащих соответствующий клонированный ген легкой цепи, который был предварительно линеаризован путем переваривания рестриктирующим ферментом PvuI. Клетки помещали в одноразовую пластиковую спектрофотометрическую кювету (1 мл), и в эту кювету вставляли плоские электроды на расстоянии 3,5 мм друг от друга. Используя аппарат для трансфекции BTX-100 (BTX, Inc), через клетки пропускали ток в течение 500 микросекунд так, чтобы примерно 50% клеток погибало. Эту величину определяли до трансфекции клеток путем подачи импульса при отсутствии ДНК с возрастающим напряжением и последующего измерения числа клеток, выживших через 24 часа. Затем строили график зависимости выживания клеток от напряжения; и напряжение, при котором наблюдалась гибель 50% клеток, использовали для всех последующих экспериментов по электропорации. Используя прибор BTX-100, установили, что импульс с амплитудой 200, подаваемый в течение 500 микросекунд, дает оптимальное значение. После пропускания тока клетки оставляли на 15 минут на льду, а затем переносили в 96-луночные планшеты для культивирования тканей с модифицированной по способу Дульбекко средой Игла (DMEM), содержащей 5%-ную околоплодную сыворотку теленка и 10% Sp2/0 кондиционированную среду. Клетки высевали в концентрации, при которой рост клеток наблюдается примерно в 1 из 3 лунок после селекции с использованием соответствующего лекарственного средства. Этот параметр определяли для каждого эксперимента по электропорации путем посева различного числа электропорированных клеток на лунку (1000-10000) и последующей селекции на клетки, включенные в плазмиду. Через 2-3 недели после засева на селективную среду подсчитывали число лунок на каждом планшете, где обнаруживался рост клеток. Так, например, для использования в дальнейших экспериментах было определено число клеток, которое давала 1 из 3 положительных лунок при данной концентрации конкретной плазмиды.
Сразу после электропорации клетки помещали в среду, не содержащую лекарственного средства. Через два дня после электропорации добавляли свежую среду, содержащую либо G418, либо микофеноловую кислоту, для клеток, обладающих неомицинфосфотрансферазной или гуаназилфосфотрансферазной активностью соответственно. Клетки подкармливали каждые два дня в течение первой недели, а затем два раза в каждую последующую неделю. Необходимую для использования концентрацию лекарственного средства определяли путем инкубирования клеток в присутствии возрастающих концентраций лекарственного средства с контролированием жизнеспособности клеток. Используемая концентрация лекарственного средства в два раза превышала концентрацию, дающую 100%-ную гибель клеток. Для Sp2/0 потребовалось приблизительно 1 мкг микофеноловой кислоты на мл, а для G418 - приблизительно 800 мкг/мл.
Клетки подвергали электропорации в течение нескольких дней: причем либо были совместно электропорированы геномные векторы с тяжелой и легкой цепью (pGenex-H и pGenex-L), либо электропорирован отдельно вектор с легкой цепью. В последнем случае, клоны были скринированы на высокий уровень экспрессии легкой цепи химерного иммуноглобулина с использованием ELISA-техники. Затем эти клоны культивировали и электропорировали с вектором, содержащим тяжелую цепь. Если были использованы кДНК-конструкции с тандемными генами, то экспрессирующий вектор (TCAE5.2 или TCAE6) сначала линеаризировали путем переваривания рестриктирующим ферментом NotI. Одной электропорации было достаточно для достижения интеграции обоих генов тяжелой и легкой цепи. Через 2-3 недели супернатанты из лунок, которые продолжали культивировать в присутствии соответствующего лекарственного средства, анализировали на секрецию легкой цепи химерного иммуноглобулина или всего иммуноглобулина с использованием ELISA-техники. Гены иммуноглобулина в кДНК-конфигурации электропорировали либо в Sp2/0-клетки, как описано выше, либо в клетки яичника китайского хомячка (CHO), адаптированные для культивирования в суспензии в бессывороточной среде. CHO-клетки электропорировали с использованием аппарата для электропорации BTX 600 и в условиях, способствующих достижению максимального числа G418-резистентных колоний. Такими условиями были следующие параметры: 210 В, 400 мкФ, 13 Ом. После электропорации клетки подсчитывали, промывали в буфере для трансфекции, ресуспендировали в том же самом буфере и помещали на 15 минут на лед. Клетки доводили до уровня 1•107 живых клеток/мл, после чего 400 мкл клеточной суспензии переносили в стерильную одноразовую кювету (0,4 мл, BTX Inc.). 25 мкг ДНК-вектора TCAE 5.2 или TCAE 6, линеаризованного рестриктирующим ферментом NotI и содержащего клонированные гены вариабельной области иммуноглобулина макаки, ресуспендировали в TE-буфере (10 мМ Трис, 1 мМ ЭДТК, pH 8,0) при 1 мкг/мл и добавляли суспензию. Электропорацию осуществляли путем разрядки аппарата с автоматической подачей заряда с помощью пусковой кнопки. Кювету помещали на лед на 15 минут, причем клетки разводили в 120 мл бессывороточной среде и помещали в шесть 96-луночных планшетов (200 мкл на лунку содержали приблизительно 6,667 электропорированных или 3,333 живых клеток на лунку). Для этих клеток были установлены независимые параметры электропорации, а селекцию проводили с использованием G418 при 400 мкг/мл.
Скрининг на продуцирование антител
Присутствие антител человека, обезьяны или химерных антител, секретированных трансфектантами, анализировали с помощью ELISA-техники, как описано ниже. 96-луночные планшеты с плоским дном (Dynatech) покрывали козьим античеловеческим иммуноглобулином IgG или каппа-цепью при 200 нг/лунку в буфере для покрытия (карбонат натрия 0,8 мг/мл, бикарбонат натрия 1,55 мг/мл, pH 9,6) и инкубировали, по крайней мере, 16 часов при 4oC. Затем буфер для покрытия удаляли, а лунки блокировали 120 микролитрами буфера для блокирования (1% альбумин бычьей сыворотки в фосфатносолевом буфере, содержащем 0,2% азида натрия) и инкубировали в течение 1 часа при 37oC. К лункам, содержащим блокирующий буфер, добавляли до 125 мкл супернатанта клеточной культуры и инкубировали 2 часа при 37oC. Затем планшеты промывали 5 раз PBS. После этого добавляли 100 мкл меченных пероксидазой хрена античеловеческих иммуноглобулинов (IgG) козы (или каппа-цепи), разделенных 1:1000 - 1:5000 в буфере для разведения (1% альбумин бычьей сыворотки, 0,05% Твин-20; 0,03% азида натрия в PBS). Планшеты инкуюировали 1 час при 37oC, а затем промывали 5 раз PBS. Химерное водорода и субстрата 3,3', 5,5'-тетраметилбензидина (1:1, об/об) на лунку. Цветную реакцию завершали через 2-5 минут добавлением 100 мкл 2М серной кислоты на лунку.
Каждый специалист может провести эксперимент по методике, эквивалентной описанной выше. Примером такой технологии является иммортализация выбранных B-клеток путем образования гибридом (как описано выше) с клеточной линией K5H6/B5, описанной Carroll и др., 164 J.Experimental Medicine, 1566, 1986, или с эквивалентной клеточной линией, такой как SPAZ4 (поставляемой Sanoloz, см. , Ehrlich и др., 34 Clin. Chem, 1681, 1988). Аналогичные клеточные линии могут быть легко сконструированы с помощью стандартной техники. Альтернативно гены иммуноглобулина могут быть клонированы: (а) из клеток, иммортализированных с помощью трансформации вирусом Herpes papio, как описано Markova и др. , 30 Vopr Virusol 549, 1985, или эквивалентным вирусом; (b) путем клонирования одиночной B-клетки с получением временной иммортализации, как описано Amaroso и Lipske 145 J.Immunology 3155, 1990; или (c) путем использования бактериофаговых библиотек рекомбинантных ДНК, кодирующих иммуноглобулин, как описано Huse и др., 246 Science 1275, 1989; и McCafferty и др., 348 Nature 552, 1990. Скрининг на клоны, содержащие соответствующее антитело, может быть осуществлен способами, описанными выше, или эквивалентными способами, хорошо известными каждому специалисту, и из иммортализованной клеточной линии может быть "спасен" нужный ген иммуноглобулина. Кроме того, антитело, продуцированное с помощью выделенных B-клеток обезьян, может быть использовано непосредственно для лечения человека без каких-либо манипуляций с образованием химерного антитела.
Константная область, происходящая от иммуноглобулина человека, может быть получена стандартными способами с использованием любого нужного изотипа, и вариабельную область антитела обезьяны лигируют с указанной константной областью человека. Полученные химерные антитела особенно предпочтительно использовать для иммунотерапии человека против специфических рецепторов клеточной поверхности, таких как CD4, ICAM, CD19, CD20, CD8, CD11a, CD11b, CD28, CD18, CD45, CD71 и TCR.
Пример 3. Клонирование и экспрессия генов химерного антитела обезьяны/человека со специфичностью к CD4
Ниже приводится конкретный пример использования методов и антител настоящего изобретения.
Генерирование линий иммортализованных B-клеток обезьяны
Взрослого павиана (White Sands New Mexico, Primate Centre) иммунизировали внутримышечно в нескольких местах 150-300 микрограммами растворимого (pCD4) или клеточными мембранами (1•108 клеток) от CD4-положительной клеточной линии SUpTI с использованием стандартного адъюванта. Иммунизацию повторяли каждые 2-3 недели, всего 6 раз. Затем павиану вводили бустер-инъекцию 100 мкг pCD4 в паховую область бедра, а неделю спустя дренированный лимфоузел из того же самого бедра удаляли. Из этого лимфоузла удаляли лимфоциты путем приготовления тонких срезов ткани и промывания их стерильной средой DMEM. Суспензию клеток пропускали через газовую найлоновую ткань, а затем собирали путем центрифугирования при 1000 х g в течение 10 минут.
Приблизительно 1•108 лимфоцитов суспендировали в Трис-аммонийхлоридном буфере (16 мМ, pH 7,5) и нагревали до 37oC в течение 5 минут для лизиса эритроцитов. Лимфоциты собирали путем центрифугирования и ресуспендировали в L-лейцинметиловом сложном эфире (LME), после чего инкубировали 45 минут при 37oC. LME-обработанные клетки фильтровали через найлоновое сито и центрифугировали. Затем добавляли 1 мл околоплодной сыворотки теленка, клетки суспендировали и дважды промывали в бессывороточной среде RPMI. После этого клетки подсчитывали и смешивали в одной 50 миллилитровой конической центрифужной пробирке вместе с равным количеством клеток K6H6/B5 гетеромиеломы, которые предварительно промывали два раза в бессыворотчной среде. Клетки слегка суспендировали в 1 мл 50% ПЭГ (полиэтиленгликоля), который медленно в течение 1 минуты добавляли, слегка размешивая. Затем клетки ресуспендировали путем добавления 20 мл бессыворотной среды в течение 5 минут, слегка помешивая для выделения из ПЭГ. После двухкратного промывания бессывороточной средой клетки ресуспендировали при концентрации 5•105/0,1 мл в RPMI-среде, содержащей 20% околоплодной сыворотки теленка и гентамицин, и помещали в 96-луночные планшеты для микротитрования при 0,1 мл на лунку. К каждой лунке добавляли равный объем HAT-среды (0,1 мл) и перед скринингом гибриды культивировали в течение 14-17 дней.
Скрининг клеточных гибридов для продуцирования антител против CD4
Анализ для определения специфичности против CD4 осуществляли следующим образом: ELISA-планшеты покрывали рекомбинантным pCD4 при концентрации 100 нг на лунку и блокировали 1% альбумином бычьей сыворотки в PBS. Из каждой лунки удаляли 50 мкл-аликвоты гибридомного суспернатанта, и планшеты с покрытыми pCD4 инкубировали в течение 60 минут. Связывание оценивали путем инкубирования с 125I-меченными козьими античеловеческими или козьими антиобезьяньими Ig в течение 60 минут. После четырехкратного промывания дистиллированной водой лунки анализировали путем подсчета на гамма-счетчике. Положительные лунки снова анализировали для получения дубликатов, и гибридомные клетки из этих лунок субклонировали три раза, сначала при концентрации 5 клеток на лунку, а затем два раза при концентрации 1 клетки на лунку. На этой стадии анти-pCD4-положительные лунки скринировали на способность к связыванию с CD4 клеточной поверхности. Этот скрининг осуществляли путем ингибирования связывания мышиного анти-CD4 моноклонального антитела, обозначаемого IF3, с CD4-положительной клеточной линией SupTI. Короче говоря, скрининг проводили путем совместного инкубирования различных количеств анти-CD4-антитела обезьяны и 10 нг 125I-меченного IF3 с клетками SupTI (3•105 клеток на лунку) в 96-луночном планшете. После 1-часового инкубирования при комнатной температуре (около 20-25oC) клетки удаляли путем вакуумной фильтрации с использованием стекловолоконных фильтров. После экстенсивного промывания PBS фильтры подсчитывали на гамма-счетчике для определения степени ингибирования супернатантами от гибридом обезьяны связывания IF3 с клетками SupTI.
В качестве кандидатов выбирали клоны, которые обнаруживали сильное ингибирующее действие против IF3. Выбранный клон изотипировали с использованием реагентов для изотипирования, происходящих от человека, в результате чего был выбран IgG2, имеющий легкую лямбда-цепь. Эту клеточную линию культивировали до получения количеств, достаточно больших для клонирования генов его иммуноглобулина.
Клонирование генов вариабельной области тяжелой и легкой цепи иммуноглобулина из иммортализованных B-клеток обезьяны
Полную РНК выделяли из 1•107 иммортализованных B-клеток обезьяны при помощи метода с использованием гуанидинизотиоцианата. Одну десятую от полной РНК использовали для построения одноцепочечной кДНК с помощью олигонуклеотидного праймера oligo-dT и обратной транскриптазы, как описано выше. Одну десятую от количества оц кДНК использовали для индуцирования PCR-реакцией. В каждой из шести PCR-реакций использовался один из шести олигонуклеотидных праймеров, специфичных к 5' VH-семейству и содержащих SaII-рестрикционный сайт вместе с олигонуклеотидом константной области IgG3', содержащим NheI-сайт (оба показаны на фиг. 7-1). Аналогично в пяти PCR-реакциях использовался один из пяти 5'-олигонуклеотидных праймеров для лидерной последовательности лямбда-цепи, содержащих BoIII-сайт и 3'-праймер лямбда-константной области, содержащий AvrII-сайт. Условия реакции были такими, как описано выше. Каждая PCR-реакция была дублирована три раза. Продукты каждой реакции амплификации тяжелой и легкой цепи пропускали на 1,2% агарозном геле. При электрофорезе на агарозном геле праймер VH4 тяжелой цепи (SEQ ID N 13: 5' ACTAAGTTCGACATGAAACACCTGTGGTTCTT 3') и праймер лямбда-цепи (SEQ ID N 14: (5' ATCACAGATCTCTCACCATGACCTGCTCCCCTCTCCTCC 3') обнаруживали яркие полосы. Продукты этих реакций были использованы для клонирования в вектор TCAE 6, который содержал последовательности константных областей IgGI человека и лямбда-цепи иммуноглобулина человека.
Клонирование генов двух вариабельных областей в вектор экспрессии TCAE 6 осуществляли последовательно. Сначала PCR-продукт тяжелой цепи и вектор TCAE 6 переваривали рестриктирующими ферментами SalI и NheI, экстрагировали фенолом/хлороформом и пропускали через роторную колонку с Сефадексом G-25. PCR-продукты лигировали в разрезанный вектор в течение ночи при 14oC в присутствии ДНК-лигазы T4. Приблизительно 500 нг полной ДНК лигировали (в объеме 10 мкл) со вставкой/вектором в молярном отношении 10:1. Лигированный материал использовали для трансформации XL-I Blue-компетентных клеток (Stratagene), и трансформированные клетки засевали на чашки с LB-агаром, содержащим 50 мкг/мл ампициллина. Колонии ампициллинрезистентных бактерий собирали и культивировали как 5 мл - мини-культуры. Из каждой их этих культур экстрагировали плазмидную ДНК методом щелочного лизиса, разрезали рестриктирующими ферментами SalI и NheI, и продукты подвергали электрофорезу на 1,2% агарозном геле. Плазмиды со вставками приблизительно в 450 п.о. использовали в качестве матриц для полследующего клонирования вариабельных областей легкой цепи. Продукты PCR-реакций легкой цепи, а также плазмиду, содержащую вставку тяжелой цепи, разрезали рестриктирующими ферментами BglII и AvrII и лигировали вместе. Плазмидные мини-культуры скринировали путем разрезания BglII и AvrII-ферментами. Перевары, дающие вставку приблизительно в 400-450 п.о., считали положительными. Плазмиды, содержащие обе SalI/NheI и BglII/AvrII-вставки, культивировали в больших количествах для секвенирования ДНК.
Экспрессирующие векторы тандемных химерных антител (TCAE 5,2 и TCAE 6) получали из вектора CLDN, который, в свою очередь, происходит от вектора RLDN10b (253 Science 77-79, 1991). А вектор RLDN10b происходит от экспрессирующего вектора TND (7 DNA 651-661, 1988).
RLDN10b отличают от вектора TND следующим образом. Транскрипционную кассету дигидрофолат-редуктазы (DHFR) промотор, кДНК и область полиаденилирования помещали между кассетой тканевого активатора плазминогена (экспрессирующая кассета t-PA) и кассетой неомицинфосфотрансферазы (NEO) так, чтобы три кассеты располагались тандемом и в одной и той же транскрипционно-активной ориентации. Кроме того, промотор гена DHFR в CLDN заменяли главным промотором мышиного бета-глобина (3 Mol. Cell. Biol., 1246-54, 1983), а t-PA-кДНК заменяли полилинкером. Все три эукариотические транскрипционные кассеты (Expression, DHFR, NEO) могут быть выделены из бактериальной плазмидной ДНК (производное pUC9) путем переваривания рестриктирующей эндонуклезой Notl.
CLDN отличается от RLDN10b тем, что в нем LTR Рауса перед полилинкером были заменены энхансером промотора предраннего гена цитомегаловируса человека (41 CeII, 521, 1985).
Экспрессирующие векторы TCAE 5,2 и TCAE 6 отличается от CLDN тем, что:
1) они содержат четыре транскрипционные кассеты (вместо трех), расположенные последовательно:
a) константную область легкой цепи иммуноглобулина человека, полученную посредством амплификации кДНК с помощью полимерзано-цепной реакции. В TCAE 5,2 имеется константная область легкой каппа-цепи иммуноглобулина человека (аминокислоты) 108-214 по нумерации Kabat, аллотип Km3), а в TCAE 6 имеется константная область легкой лямбда-цепи иммуноглобулина человека (аминокислоты 108-215 по нумерации Kabat, генотип Oz минус, Mcg минус, аллотип Ke минус);
b) константную область тяжелой цепи иммуноглобулина; в обеих конструкциях тяжелая цепь иммуноглобулина человека является константной областью гамма 1 (аминокислоты 114-478 по нумерации Kabat, аллотип Gmla, Gmlz), которую получали посредством амплификации кДНК с помощью полимеразно-цепной реакции;
c) DHFR; содержит свой собственный эукариотический промотор и область полиаденилирования;
d) NEO; также содержат свой собственный промотор и область полиаленилирования;
3) кассеты легкой и тяжелой цепи иммуноглобулина человека содержат синтетические сигнальные последовательности для секреции цепей иммуноглобулина;
4) кассеты легкой и тяжелой цепи иммуноглобулина человека содержат специфические ДНК-линкеры, которые позволяют осуществить инсерцию вариабельных областей легкой и тяжелой цепи иммуноглобулина, сохраняющих транскрипционную рамку считывания и не меняющих аминокислот, обычно присутствующих в цепях иммуноглобулина. Введение описанных изменений привело к конструированию векторов TCAE 5.2 и TCAE 6. Клонирование генов вариабельной области тяжелой и легкой цепи иммуноглобулина из клеточной линии гетерогибридомы E9.1 против CD4 в TCAE 6 привело к получению конструкции, которая была депонирована в ATCC. Эта конструкция содержит вариабельную область тяжелой цепи иммуноглобулина обезьяны и вариабельную область легкой цепи иммуноглобулина обезьяны (эти последовательности показаны на фиг. 13 и 14 соответственно), которые были клонированы из клеточной линии E9.1 гибридомы против CD4. Константная область тяжелой цепи происходит от изотипа гамма-1 и аллотипа Gmla, Gmlz человека. Константная область легкой лямбда-цепи также происходит от человека, от генотипа Oz минус, mcg минус и аллотипа Ke минус. Гены иммуноглобулина клонировали в экспрессирующий вектор млекопитающего TCAE 6 (показанный на фиг. 6), который после электропорации в клеточную линию CHO продуцировал анти-CD4 химерное антитело обезьяны/человека. Описанную ДНК-конструкцию использовали для трансформации бактериального штамма XL-1 Blue, селектированного в антибиотике ампициллина и депонированного в виде суспензии бактериальных клеток в стерильной LB-среде, содержащей 15% глицерина.
Другой подходящей системой экспрессии является система, в которой ген, кодирующий селективный маркер, модифицировали для повышения выхода рекомбинантных систем, кодирующих нужную последовательность. Например, повреждение области инициации трансляции доминантного селектируемого маркера дает колонии, менее резистентные к лекарственному средству по сравнению с неповрежденным вектором, однако, в этом случае отдельная колония экспрессирует более высокие уровни генного продукта, чем неповрежденный вектор. Например, инициация трансляции является первой стадией синтеза белка. Участок инициации трансляции гена неомицинфосфотрансферазы G418-резистентный ген изменяли от последовательности "консенсуса" Kozak (последовательность - ccAccATGG) до обедненной последовательности Kozak (последовательность - ccTccATGC). Повреждение области инициации трансляции G418-резистентного гена приводит к: 1) значительному (5-кратному) снижению числа G418-резистентных колоний, полученных от эквивалентного количества плазмидной ДНК, трансфецированной на 1 клетку; и 2) значительному увеличению количества продуктов
сцепленных генов, экспрессируемых в каждом клоне. В клонах, содержащих "консенсус" Kozak, 73% скринированных колоний продуцировали менее чем 25 нг/мл, причем только 3% из них продуцировали более чем 100 нг/мл. Для клонов с измененной обедненной последовательностью Kozak, 8% скринированных колоний продуцировали менеечем 25 нг/мл, тогда как 63% колоний продуцировали более чем 100 нг/мл. В частности, как показано на фиг. 16 (где TCAE 5,2 имеет "консенсус" Kozak, а TCAE 12 имеет обедненную последовательность Kozak, а TCAE 12 имеет обедненную последовательность Kozak), 258 колоний были получены в результате 2 электропораций 25 мкг ДНК, содержащей ген неомицинфосфотрансферазы с сайтом инициации трансляции (неизмененным) "консенсуса". 201 их этих колоний (78%) не экспрессировали какой-либо обнаружимый генный продукт (т.е. < 25 нг/мл химерного иммуноглобулина), и только 8 колоний (3%) экспрессировали более чем 100 нг/мл. 98 колоний получали в результате 6 электропораций 25 мкг ДНК, содержащей ген неомицинфосфотрансферазы с измененным сайтом инициации трансляции. 63% этих колоний экспрессировали более чем 100 нг/мл, и лишь 8% этих колоний экспрессировали менее чем 25 нг/мл.
ДНК-секвенирование
Плазмидную ДНК получали из 100 мл культур. Ее дополнительно очищали путем осаждения (1 объем) смесью 2,5 М хлорида натрия и 20% полиэтиленгликоля (6 объемов) в течение 15 минут на льду. После центрифугирования при 10000 х g в течение 20 минут осадок промывали 70% этанолом, снова центрифугировали и осушали в Speedivac (Savant). Осадок ДНК ресуспендировали в деионизованной воде при концентрации 150-250 мкг/мл. Секвенирование проводили на 5 мкг двухцепочечной ДНК методом Сэнгера. В этих целях были использованы праймеры для секвенирования, которые были гомологичны последовательностям, расположенным в экспрессирующем векторе "вверх по течению" и "вниз по течению" либо от вставок легкой цепи, либо от вставки тяжелой цепи. Вставки секвенировали как в направлении 5'--->3', так и в направлении 3'--->5'. Два клона анти-CD4 легкой цепи и два клона анти-CD4 тяжелой цепи, каждый из которых был генерирован в результате PCR-реакций, секвенировали параллельно для того, чтобы определить были ли введены какие-либо изменения в нуклеотидах во время PCR-реакции. Было обнаружено, что выбранные два клона тяжелой цепи и два клона легкой цепи идентичны между собой по всей длине, что свидетельствует о том, что в процессе амплификации никаких погрешностей внесено не было. Последовательность тяжелой и легкой анти-CD4-цепей показаны на фиг. 13 и 14 и в списке последовательностей: последовательности NN 15 и 16.
Экспрессия химерного антитела обезьяны/человека против CD4
Экспрессирующие векторы TCAE 5.2 и TCAE 6 могут быть использованы не только для стабильной интегрированной экспрессии в клеточных линиях Sp2/0 и CHO, но и могут, так как они имеют SV40-начало, быть также использованы для временной экспрессии в клеточной линии COS. Экспрессию в клетках COS осуществляли следующим образом: COS-клетки высевали за 1 день до трансфекции так, чтобы на следующий день они имели 50-70% сплошности. Затем культуральную среду удаляли и клетки промывали два раза буфером для трансфекции (TB-140 мМ NaCl, 25 мМ Трис, 5 мМ KCl, 0,5 мМ Na2HPO4, 1 мМ MgCl2, 1 мМ CaCl2). 30 мкг очищенной хлоридом цезия плазмиды TCAE 6, содержащей тяжелую и легкую цепи химерного анти-CD4 иммуноглобулина обезьяны/человека, смешивали с 3 мл DEAE-декстрана на чашку (1 мг/мл в TB). ДНК инкубировали с клетками в течение 1 часа при 37oC. Затем ДНК-раствор удаляли и заменяли 3 миллилитрами 20% глицерина на 1,5-2,5 минут, после чего клетки дважды промывали TB. Клетки инкубировали в 5 мл свежей среды, содержащей 100 мкМ хлорохина, в течение 3-5 часов при 37oC, после чего их промывали два раза средой и инкубировали с нормальной DMEM в течение 72 часов. Супернатант (100 мкл) от трансфецированных COS-клеток анализировали при различных разведениях на наличие антитела способа на основе ELISA. Козья лямбда IgG против человека использовали для покрытия 96-луночных планшет для анализа, а меченные пероксидазой козьи IgG против человека использовали в качестве идентифицирующих антител в стандартных условиях ELISA. Было установлено, что COS-клетки продуцируют от 10 до 40 нг/мл химерных антител обезьяны/человека. Большие количества супернатанта 10-кратно концентрировали и использовали в прямом РИА на связывание с CD4-положительными клетками SUpTI. Родительское полное антитело обезьяны и неревалентный иммуноглобулин человека использовали в качестве позитивного и негативного контролей соответственно (фиг. 11). Кроме того, антитело обезьяны против CD4 и химерное антитело обезьяны/человека против CD4 использовали для ингибирования связывания высокоаффинного мышиного антитела против CD4 (IF3) (см. 12). Было обнаружено, что рекомбинантное антитело обезьяны/человека (ATCC N) не только связывается с CD4-положительными клетками, но и способно ингибировать связывание IF3 с CD4-положительными клетками приблизительно в тех же концентрациях, что и полное антитело обезьяны или само IF3.
В нижеприведенных примерах раскрываются способы и антитела настоящего изобретения.
Пример 4. Продуцирование антител обезьяны против антигенов лимфоцитов человека
Взрослого павиана (white Send New Mexico Primate Centre) иммунизировали внутримышечно, в нескольких местах, целыми CD54-положительными лимфоцитами (5•108) человека. Поочередно использовали клетки: клетки SB (лимфоидная линия B человека) и активированные периферические лимфоциты человека, активированные путем предварительной инкубации со смесью митогена фитолакки (2,5 мг/мл), форбола моноацетата (40 нМ) и фитогемагглютинина (4 мг на лунку) в сочетании со стандартным адъювантом. Иммунизацию повторяли каждые 2-3 недели в течение 8 месяцев. Сыворотки от иммунизованных животных скринировали в различные периоды времени путем ингибирования связывания мышиного антитела (84H10), которое, как известно, связывается с ICAM-1. Насыщенное количество 84H10 подвергали связыванию с клетками яичника китайского хомячка (CHO), предварительно трансфецированных экспрессирующим вектором, содержащим кДНК CD54 человека, и отобранных на высокую экспрессию CD54 клеточной поверхности вместе с возрастающими разведениями сыворотки обезьяны. Ингибирование связывания показано на фиг. 15.
Другие мышиные моноклональные антитела, которые распознают другие антигены лимфоцитов человека, тестировали путем ингибирования с использованием сывороток обезьян, полученных аналогичными методами иммунизации.
Использование
Антитела, продуцированные вышеописанным способом или эквивалентными способами, могут быть очищены при помощи комбинации аффинной и эксклюзионной хроматографии для использования в целях характеризации в функциональных биологических анализах. Эти анализы предусматривают определение специфичности и аффинности связывания, а также эффекторные функции, ассоциированные с экспрессированным изотипом, например ADCC, или фиксации комплемента. Указанные антитела могут быть использованы как пассивные или активные терапевтические агенты при лечении ряда заболеваний человека, включая B-клеточную лимфому, инфекционные заболевания, такие как СПИД, аутоиммунные и воспалительные заболевания, и трансплантацию. Эти антитела могут быть использованы в их нативной форме либо как часть комплекса "антитело/хелат", "антитело/лекарственное средство", или "антитело/токсин". Кроме того, целые антитела или их фрагменты (Fab2, Fab, Fv) могут быть использованы в качестве визуализирующих реагентов либо в качестве потенциальных вакцин или иммуногенов в активной иммунотерапии в целях генерации антиидиотипической реакции.
Количество используемого антитела, необходимое для получения терапевтического эффекта, может быть определено стандартной техникой, хорошо известной специалистам. Обычно антитела используют в фармацевтически приемлемом буфере и вводят любым подходящим способом. Вследствие достаточной эффективности заявленных антител и их хорошей переносимости человеком, они могут быть введены пациенту повторно в целях лечения различных заболеваний и состояний.
Рекомбинантные антитела (или их фрагменты) против CD4, полученные в соответствии с настоящим изобретением, могут быть также использованы для индуцирования иммуносупрессии, то есть для индуцирования супрессии иммунной системы человека или животного. Поэтому настоящее изобретение относится к способу индуцирования в профилактических или терапевтических целях иммуносупрессии у человека или животного, нуждающихся в этом, путем введения указанному человеку или животному эффективного нетоксичного количества антитела настоящего изобретения.
Способность соединений настоящего изобретения к индуцированию иммуносупрессии может быть продемонстрирована в используемых для этой цели стандартных тестах, например в смешанном тесте на реакцию лимфоцитов, или в тесте, где ингибирование пролиферации T-клеток измеряют путем поглощения тимидина.
Тот факт, что антитела настоящего изобретения способны к индуцированию иммуносупрессии, означает, что эти антитела могут быть использованы для лечения или предупреждения резистентности или отторжения трансплантированных органов или тканей (например, почки, сердца, легких, костного мозга, кожи, роговицы и т.п.; для лечения или предупреждения аутоиммунных, воспалительных, пролиферативных и гиперпролиферативных заболеваний, и кожных симптомов иммунологически восприимчивых заболеваний, например, таких как ревматоидный артрит, красная волчанка, системная волчанка, хронический тироидит, рассеянный склероз, миастения, диабеты типа I, увеит, невротический синдром, псориаз, атопический дерматит, контактный дерматит и дерматиты типа экземы, красный плоский лишай (лишай Вильсона), пузырчатка, буллезная пузырчатка, врожденный буллезный эпидермолиз, крапивница, ангионевротический шок, васкулиты, эритемы, кожный эозинофильный лейкоцитоз, гнездная элопеция и т.п.); для лечения обратимых обструкций дыхательных путей, кишечных воспалительных заболеваний и аллергических заболеваний (например, таких как заболевания брюшной полости, проктит, эозинофильный гастроэнтерит, мастоцитоз, болезнь Крона и язвенный колит), а также пищевых аллергий (например, мигрень, ринит и экзема).
С помощью рутинного экспериментирования любой специалист может определить эффективное нетоксичное количество антитела, необходимое для индуцирования иммуносупрессии. Однако, в основном, такое эффективное количество может варьироваться в диапазоне от около 0,05 до 100 миллиграммов на килограмм веса в день.
Антитела (или их фрагменты) настоящего изобретения могут быть также использованы для лечения опухолей у млекопитающих. Более конкретно, эти антитела могут быть использованы для уменьшения размеров опухоли, ингибирования роста опухоли и/или продления жизни животного, страдающего опухолевым заболеванием. Настоящее изобретение также относится к способу лечения опухолей у человека или животных путем введения человеку или животному эффективного и нетоксичного количества антитела настоящего изобретения. С помощью рутинного экспериментирования любой специалист может определить эффективное нетоксичное количество антитела, необходимое для лечения канцерогенных опухолей. Однако, в основном, такое эффективное количество может варьироваться в диапазоне от около 0,05 до 100 миллиграммов на килограмм веса тела в день.
Антитела настоящего изобретения могут быть введены человеку или животному в соответствии с вышеупомянутыми методами лечения в количествах, достаточных для получения определенного терапевтического или профилактического эффекта. Антитела настоящего изобретения могут быть введены человеку или животному в виде стандартной унифицированной лекарственной формы, полученной путем смешивания антитела настоящего изобретения со стандартным фармацевтически приемлемым носителем или разбавителем в соответствии со стандартной техникой изготовления фармацевтических препаратов. Следует отметить при этом, что форма и природа фармацевтически приемлемого носителя или разбавителя будет зависеть от количества активного ингредиента, с которым он должен быть смешан, от способа введения лекарственного средства и от других хорошо известных параметров.
Антитела (или его фрагменты) настоящего изобретения могут быть введены перорально, парентерально, путем ингаляции или путем местного применения. Используемый в настоящем описании термин "парентеральное введение" означает внутривенное, внутримышечное, подкожное, ректальное, вагинальное или интраперитонеальное введение. Особенно предпочтительными формами парентерального введения является подкожное и внутримышечное введение.
Для профилактическое или терапевтического индуцирования иммуносупрессии, или для терапевтического лечения канцерогенных опухолей суточная доза для парентерального или перорального введения составляет, в основном, от около 0,05 до 100, а предпочтительно около 0,5-10 миллиграммов на килограмм веса тела в день.
Антитело настоящего изобретения может быть также введено путем ингаляции. Под термином "ингаляция" подразумевается интраназальное или пероральное введение путем ингаляции. Подходящие лекарственные формы для такого введения, такие как аэрозольные композиции или ингаляторы с дозируемым количеством активного ингредиента, могут быть получены стандартными способами. Предпочтительная доза используемого соединения настоящего изобретения, в основном, составляет от около 10 до 100 миллиграммов.
Антитело настоящего изобретения может быть также использовано для местного применения. Под термином "местное введение" подразумевается несистемное введение, а в частности, нанесение антитела (или его фрагмента) настоящего изобретения на внешнюю поверхность эпидермиса или на щечные карманы, и закапывание такого препарата антитела в уши, глаза и нос, при котором не происходит попадания значительного количества этого антитела в кровоток. Термин "системное введение" означает пероральное, внутривенное, внутримышечное и внутрибрюшинное введение. Разумеется, что количество антитела, необходимое для получения желаемого терапевтического или профилактического эффекта, будет зависеть от выбранного антитела, природы и тяжести заболевания, подвергаемого лечению, и от самого пациента, и в конечном счете это количество может быть установлено лечащим врачом. Подходящая доза для местного применения антитела настоящего изобретения может, в основном, составлять от около 1 до 100 миллиграммов на килограмм веса тела в день.
Композиции
Хотя антитело настоящего изобретения или его фрагменты могут быть введены отдельно, однако, предпочтительно вводить эти антитела в виде фармацевтической композиции. Для местного применения активный ингредиент может составлять от 0,001% до 10% мас., например от 1% до 2% мас. по массе всей композиции, и хотя он может составлять от 10% мас., однако, предпочтительно, чтобы его количество не превышало 5% мас., а более предпочтительно, чтобы это количество составляло от 0,1% до 1% по массе композиции.
Композиции настоящего изобретения для местного применения включают в себя активный ингредиент в сочетании с одним или несколькими приемлемыми носителями и необязательно другой (другие) терапевтический(кие) ингредиент(ы). Этот носитель или носители должны быть "приемлемыми" в отношении их совместимости с другими ингредиентами композиции и не оказывать неблагоприятного воздействия на реципиента.
Композиции, подходящие для местного применения, представляют собой жидкие или полужидкие препараты, которые могут проникать через кожу в места организма, требующие лечения, и примерами которых могут служить линименты, лосьоны, кремы, мази или пасты, а также капли, подходящие для закапывания в глаза, уши или нос.
В соответствии с настоящим изобретением препараты в виде капель могут содержать стерильные водные или масляные растворы или суспензии, которые могут быть получены путем растворения активного ингредиента в соответствующем водном растворе бактерицидного, и/или фунгицидного агента, и/или любого другого подходящего консерванта, и предпочтительно включающего поверхностно-активного вещества. Полученный раствор может быть затем очищен путем фильтрации и перенесен в соответствующую емкость, которую затем герметично закрывают и стерилизуют путем автоклавирования или выдерживания в течение получаса при температуре 90-100oC. Альтернативно этот раствор может быть стерилизован путем фильтрации и перенесен в соответствующие емкости с помощью стандартной техники асептики. Примерами бактериальных и фунгицидных агентов, подходящих для введения в препараты в виде капель, являются нитрат или ацетат фенилртути (0,002%), бензалконийхлорид (0,01%) и ацетат хлоргексидина (0,01%). Подходящими растворителями для получения масляного раствора являются глицерин, разбавленный спирт и пропиленгликоль.
Лосьоны настоящего изобретения представляют собой препараты, подходящие для нанесения на кожу или глаза. Глазные лосьоны могут включать в себя стерильный водный раствор, необязательно содержащий бактерицид, и могут быть изготовлены способами, аналогичными способам изготовления капель. Лосьоны или линименты для нанесения на кожу могут также содержать агент, ускоряющий осушку или охлаждение кожи, например, такой как спирт или ацетон, и/или увлажняющий агент, такой как глицерин или масло, например касторовое или арахисовое масло.
Согласно настоящему изобретению кремы, мази или пасты представляют собой полутвердые препараты активного соединения, предназначенные для наружного применения. Они могут быть приготовлены путем смешивания активного ингредиента в тонкоизмельченной или порошковой форме отдельно или в растворе или суспензии в водной или безводной жидкости, с жирной или нежирной основой, используя соответствующее устройство. Эта основа может содержать углеводороды, такие как твердый, мягкий или жидкий парафин; глицерин; пчелиный воск; металлосодержащие мыла; слизи; масла натурального происхождения, такие как миндальное, кукурузное, арахисовое, касторовое или оливковое масло; ланолин или его производные, или жирные кислоты, такие как стеариновая или олеиновая кислота, в сочетании со спиртом, таким как пропиленгликоль или полигликоли. Эта композиция может содержать любое подходящее поверхностно-активное вещество, такое как катионогенное или неионогенное ПАВ, например сложные сорбитанэфиры или их полиоксиэтиленовые производные. В такую композицию могут быть включены суспендирующие агенты, такие как натуральные камеди, производные целлюлозы, или неорганические материалы, такие как кремноземы, а также другие ингредиенты, такие как ланолин.
При этом, следует отметить, что количество и интервал приема индивидуальных доз антитела (или его фрагментов) настоящего изобретения зависят от природы и тяжести заболевания, подвергаемого лечению, формы, способа и места введения лекарственного средства, а также от каждого конкретного реципиента и могут быть определены традиционными способами. Следует также отметить, что оптимальный курс лечения, то есть число доз антитела настоящего изобретения или его фрагментов, принимаемых в день, и число дней приема этих доз могут быть определены специалистом с помощью стандартных тестов, обычно используемых для установления режима лечения.
Однако, следуя вышеприведенному описанию, каждый специалист может без излишнего и трудоемкого экспериментирования в полной мере использовать настоящее изобретение. Для более наглядной иллюстрации настоящего изобретения ниже приводятся примеры, которые, однако, не должны рассматриваться как некое ограничение объема настоящего изобретения.
Композиция в виде капсулы.
Композиции настоящего изобретения в виде капсул получали путем наполнения жесткой желатиновой капсулы, состоящей из двух частей, 50 миллиграммами антитела настоящего изобретения или его фрагментом в виде порошка, 100 миллиграммами лактозы, 32 миллиграммами талька и 8 миллиграммами стеарата магния.
Инъецируемая парентеральная композиция
Фармацевтическую композицию настоящего изобретения в форме, подходящей для введения путем инъекции, получали путем размешивания 1,5% мас. антитела настоящего изобретения или его фрагмента в 10% по объему пропиленгликоля и воде. Полученный раствор стерилизовали путем фильтрации.
Композиции в виде мази
Антитело настоящего изобретения или его фрагмент - 1,0 г
Медицинское парафиновое масло - До 100,0 г
Антитело настоящего изобретения или его фрагмент диспергировали в небольшом объеме носителя, в результате чего получали в высокой степени гомогенный продукт. Затем этой дисперсией заполняли гибкие металлические тюбики.
Композиция в виде крема для наружного применения
Антитело настоящего изобретения или его фрагмент - 1,0 г
Polawax GP 200 - 20,0 г
Безводный ланолин - 2,0 г
Белый воск - 2,5 г
Метилгидроксибензоат - 0,1 г
Дистиллированная вода - 100,0 г
Polawax, пчелиный воск и ланолин нагревали вместе при 60oC. Затем добавляли метилгидроксибензоат, и полученную смесь гомогенизировали с помощью высокоскоростного смешивания. После этого температуру снижали до 50oC. К смеси добавляли антитело настоящего изобретения или его фрагмент и диспергировали это антитело в смеси, после чего полученную композицию оставляли для охлаждения, медленно размешивая при этом.
Композиция в виде лосьона для местного применения
Антитело настоящего изобретения или его фрагмент - 1,0 г
Сорбитанмонолаурат - 0,6 г
Полисорбат 20 - 0,6 г
Цетостеариловый спирт - 1,2 г
Глицерин - 0,6 г
Метилгидроксибензоат - 0,2 г
Очищенная вода B.P. - До 100,00 мл B.P. - Британская фармакопея
Метилгидроксибензоат и глицерин растворяли в 70 мл воды при 75oC. Сорбитанмонолаурат, полисорбат 20 и цетостеариловый спирт расплавляли вместе при 75oC и добавляли к водному раствору. Полученную эмульсию гомогенизировали, оставляли охлаждаться, продолжая размешивать, и добавляли антитело настоящего изобретения или его фрагмент в виде суспензии в оставшейся воде. После этого, всю полученную суспензию продолжали размешивать до тех пор, пока она не будет однородной.
Композиция в виде глазных капель
Антитело настоящего изобретения или его фрагмент - 0,5 г
Метилгидроксибензоат - 0,01 г
Пропилгидроксибензоат - 0,04 г
Очищенная вода B.P. - 100,0 г
Метил- и пропилгидроксибензоаты растворяли в 70 мл очищенной воды при 75oC, и полученный раствор оставляли для охлаждения. Затем добавляли антитело настоящего изобретения или его фрагмент, и раствор стерилизовали путем фильтрации через мембранный фильтр (размер пор 0,022 мкм), после чего этот раствор заливали в соответствующие стерильные емкости, используя технику асептики.
Композиции для введения путем ингаляции
Приготавливали смесь 10 мг антитела настоящего изобретения или его фрагмента и 0,2-0,5% замасливающего агента, такого как полисорбат 85 или олеиновая кислота, и эту смесь диспергировали в пропелленте, таком как фреон, а предпочтительно в комбинации с 1,2-дихлоротетрафторэтаном и дифторохлорометаном, после чего смесь вводили в соответствующий аэрозольный контейнер, имеющий емкость 15-20 мл, и адаптированный либо для интраназального, либо для перорального введения путем ингаляции.
Композиция для введения путем ингаляции
Для введения в аэрозольный контейнер емкостью 15-20 мл 10 мг антитела настоящего изобретения или его фрагмента растворяли в этаноле (6-8 мл), добавляли 0,1-0,2% замасливающего агента, такого как полисорбат 85 или олеиновая кислота, и диспергировали в пропелленте, таком как фреон, предпочтительно в комбинации 1,2-дихлоротетрафторэтаном и дифторохлорометаном, после чего эту смесь вводили в соответствующий аэрозольный контейнер либо для интраназального, либо для перорального введения путем ингаляции.
Антитела и фармацевтические композиции настоящего изобретения особенно предпочтительно использовать для парентерального введения, то есть подкожного, внутримышечного или внутривенного введения. Композиции для парентерального введения могут быть изготовлены в виде раствора антитела настоящего изобретения или его фрагмента, либо коктейля этого антитела, растворенного в приемлемом носителе, предпочтительно в водном носителе. Для этой цели могут быть использованы водные носители, такие как вода, забуференная вода, 0,4%-ный солевой раствор, 0,3%-ный глицин и т.п. Указанные растворы являются стерильными и, в основном, не содержат макрочастиц. Эти растворы стерилизуют с использованием стандартной техники стерилизации. Композиции настоящего изобретения могут содержать фармацевтически приемлемые добавки, необходимые для приближения указанных композиций к физиологическим условиям, например агенты, корректирующие pH, буферные агенты и т.п. Концентрация антитела настоящего изобретения или его фрагмента в указанной композиции может широко варьироваться, например, примерно, от менее чем 0,5%, а в основном, около или, по крайней мере, около 1%, и вплоть до 15 или 20% мас., и может быть, в первую очередь, определена исходя из объема жидкости, ее вязкости и т.п., а также исходя из выбранного способа введения.
Так, например, фармацевтическая композиция для внутримышечного введения может содержать 1 мл стерильной забуферной воды и 50 мл антитела настоящего изобретения или его фрагмента. Аналогично фармацевтическая композиция для внутривенного вливания может содержать 250 мл стерильного раствора Рингера и 150 мг антитела настоящего изобретения или его фрагмента. Практические методы получения парентеральных композиций хорошо известны специалистам и более подробно описаны, например, в Remington's Pharmaceutical Science, 15-е изд. Mack Publishing Company, Easton, Pennsylvania (водится в настоящее описание посредством ссылки).
Антитела (или их фрагменты) настоящего изобретения могут быть лиофилизованы для хранения с последующим его разведением в соответствующем носителе непосредственно перед использованием. Было показано, что эта техника является эффективной при использовании стандартных иммуноглобулинов, и поэтому могут быть использованы стандартные способы лиофилизации и восстановления композиций настоящего изобретения.
В зависимости от желаемого результата фармацевтические композиции настоящего изобретения могут быть введены в профилактических и/или терапевтических целях. При терапевтическом введении композиции водят пациенту, уже страдающему определенным заболеванием, в количестве, достаточном для лечения заболевания или, по крайней мере, для задержки его развития, либо развития возможных осложнений. При профилактическом применении композиции, содержащие антитела настоящего изобретения, или коктейль, содержащий указанные антитела, вводят пациенту, еще не страдающему данным заболеванием, в целях усиления резистентности этого пациента к данному заболеванию.
Однократное или многократные введения фармацевтических композиций могут быть осуществлены с использованием доз и режима их введения в соответствии с назначением врача. В любом случае, фармацевтическая композиция настоящего изобретения обеспечивает определенное количество модифицированных антител или его фрагментов настоящего изобретения, достаточное для эффективного лечения пациента.
Следует отметить, что антитела настоящего изобретения могут быть использованы для конструирования и синтеза либо пептидных, либо непептидных соединений (псевдопептидных), которые, в свою очередь, могут быть использованы в той же самой терапии, что и исходное антитело. См., например, Saragovi и др., Science 253, 782-795 (1991).
Депозит
Штамм был депонирован в ATCC с номером допуска N. Дата депонирования: 9 июля 1992 г.
Заявители и их правоприемники признают свою обязанность заменять те культуры, которые должны погибнуть до конца срока выдачи патента, в течение 5 лет после последнего запроса на культуру, либо в течение 30 лет, независимо от каких-либо сроков; заявители также признают свою обязанность известить депозитарий о выдаче указанного патента, с момента которой этот депозит должен быть окончательно доступен для пользования. До сего времени указанный депозит является доступным лишь Комиссару по патентам, согласно условиям ст. 37 Свода федеральных правил, часть 1-14, и разделу 35 Кодекса законов США.
Другие варианты осуществления настоящего изобретения приводятся в формуле изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| РЕКОМБИНАНТНЫЕ АНТИТЕЛА ПРОТИВ CD4 ДЛЯ ТЕРАПИИ ЧЕЛОВЕКА | 1996 |
|
RU2232773C2 |
| СПОСОБ ЛЕЧЕНИЯ, АНТИТЕЛА, ГИБРИДОМА | 1993 |
|
RU2139731C1 |
| АНТИТЕЛО ПРОТИВ PD-L1 | 2017 |
|
RU2744862C2 |
| РЕКОМБИНАНТНЫЕ АНТИТЕЛА И КОМПОЗИЦИИ, А ТАКЖЕ СПОСОБЫ ИХ СОЗДАНИЯ И ИСПОЛЬЗОВАНИЯ | 2002 |
|
RU2292353C2 |
| УСИЛЕНИЕ ИММУННЫХ ОТВЕТОВ, ОПОСРЕДОВАННЫХ БЕЛКАМИ, СЛИТЫМИ ИЗ АНТИТЕЛА И ЦИТОКИНА, ПОСРЕДСТВОМ СОВМЕСТНОГО ВВЕДЕНИЯ ИНГИБИТОРА АНГИОГЕНЕЗА | 1999 |
|
RU2229305C2 |
| АНТИТЕЛО ПРОТИВ PD-L1 | 2017 |
|
RU2744911C2 |
| СПОСОБ КЛОНИРОВАНИЯ КОГНАТНЫХ АНТИТЕЛ | 2008 |
|
RU2459868C2 |
| ЛЕЧЕНИЕ В-КЛЕТОЧНЫХ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ С ИСПОЛЬЗОВАНИЕМ АНТИТЕЛ ПРОТИВ CD40L В КОМБИНАЦИИ С АНТИТЕЛАМИ ПРОТИВ CD20 И/ИЛИ ХИМИОТЕРАПИЕЙ И ЛУЧЕВОЙ ТЕРАПИЕЙ | 2000 |
|
RU2305561C2 |
| РЕКОМБИНАНТНЫЕ IL4-АНТИТЕЛА, ИСПОЛЬЗУЕМЫЕ ДЛЯ ЛЕЧЕНИЯ НАРУШЕНИЙ, СВЯЗАННЫХ С ДЕЙСТВИЕМ IL4 | 1994 |
|
RU2162711C2 |
| Способ получения димерной формы мутантного иммуноглобулина IgA2m1-изотипа в клетках млекопитающих | 2023 |
|
RU2822889C1 |






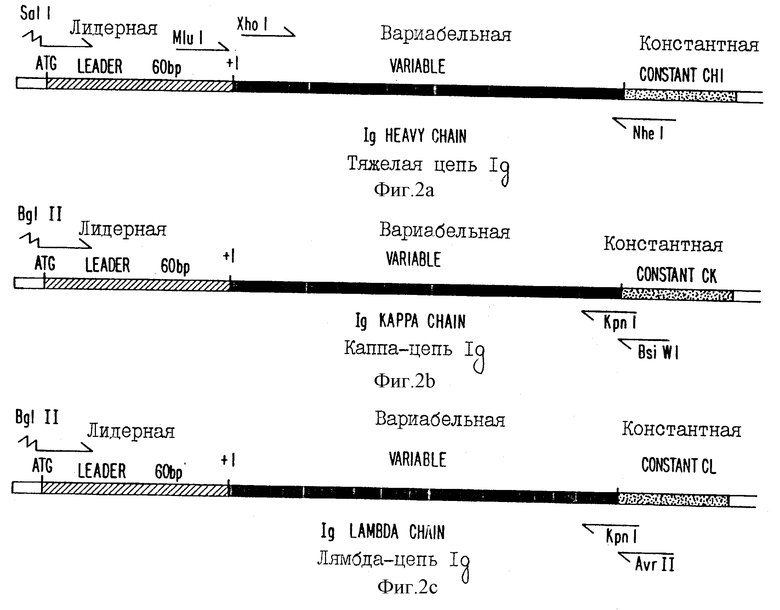
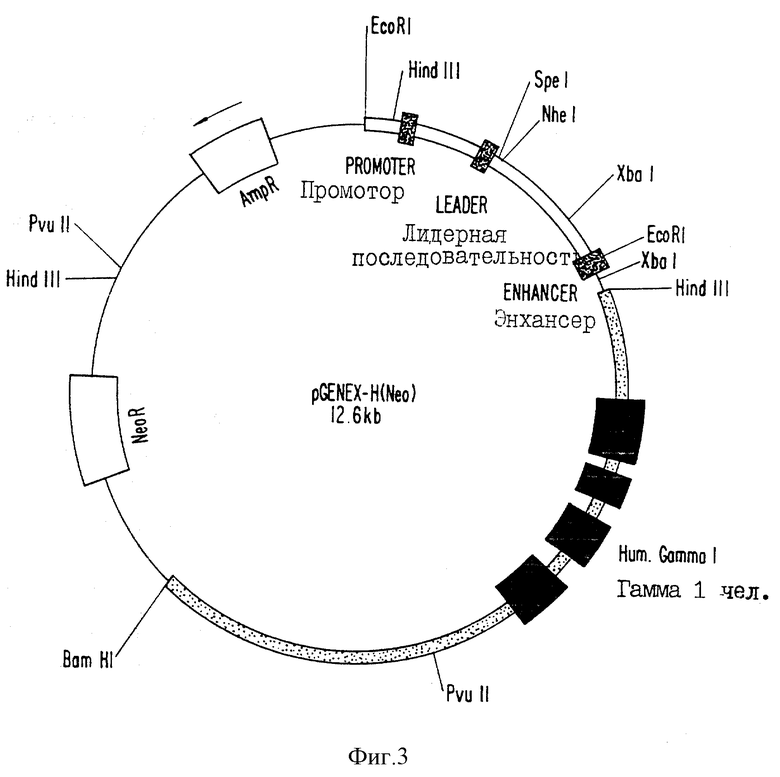
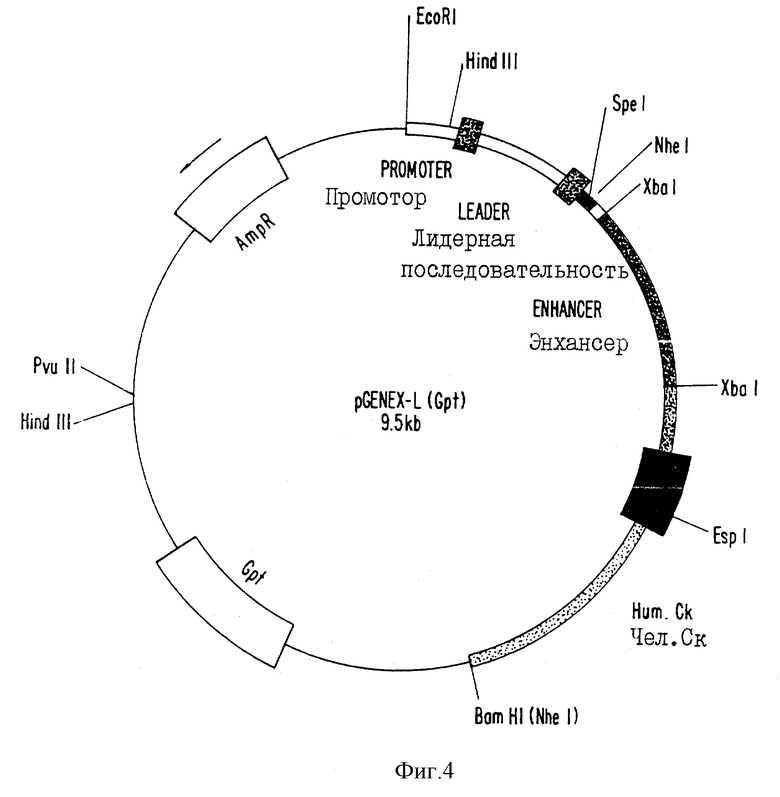
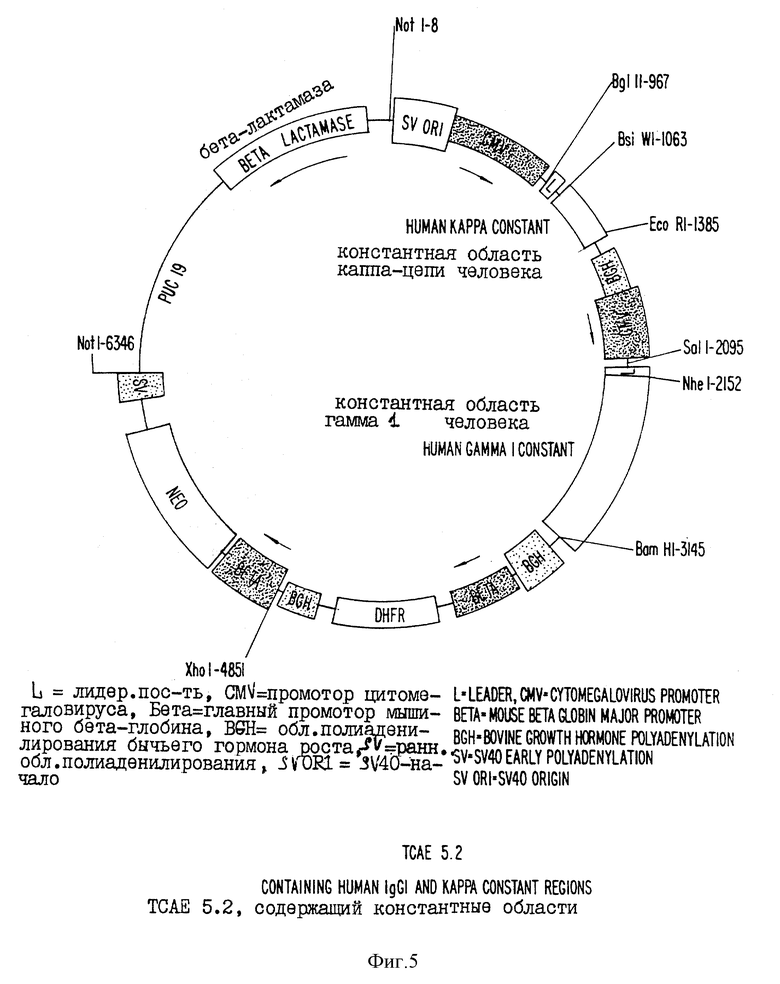
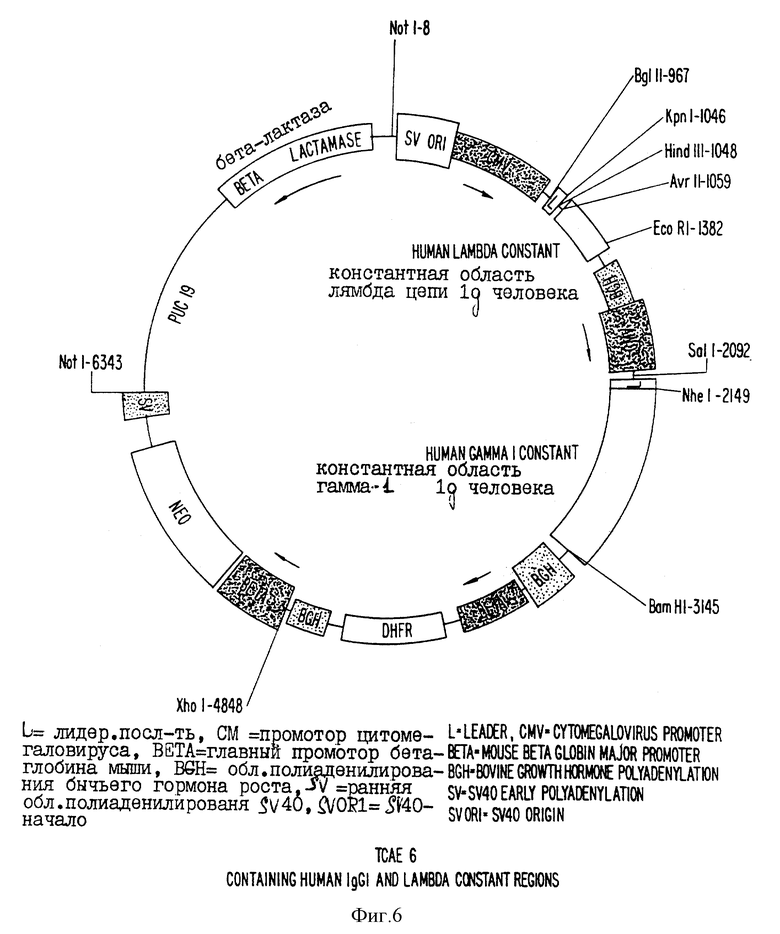






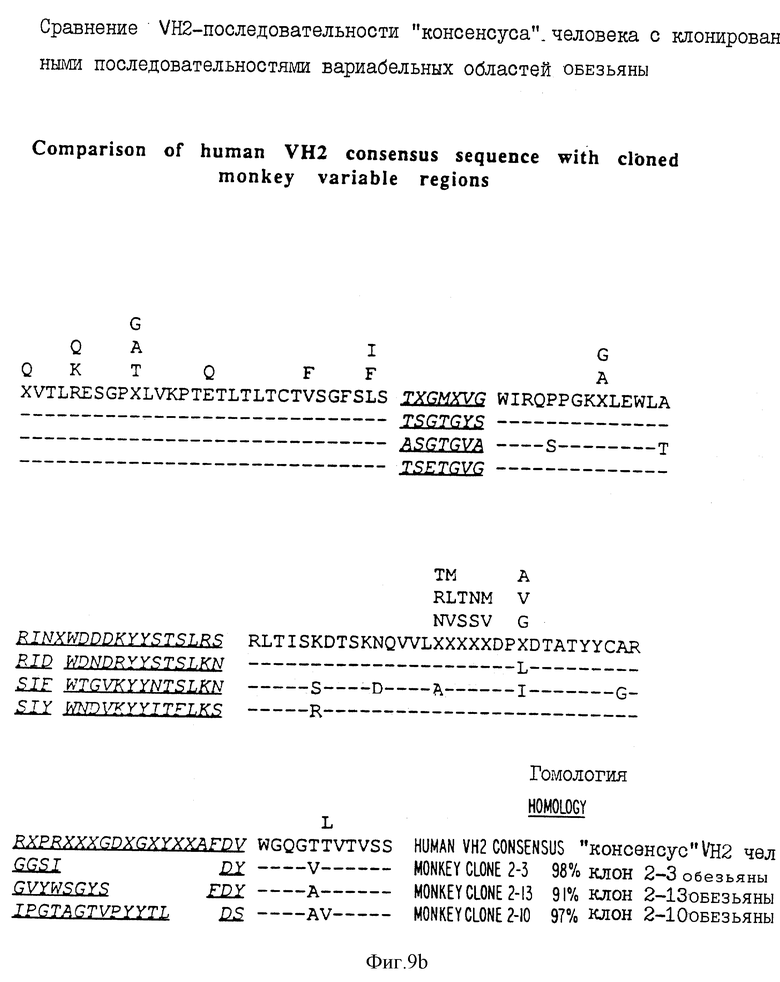
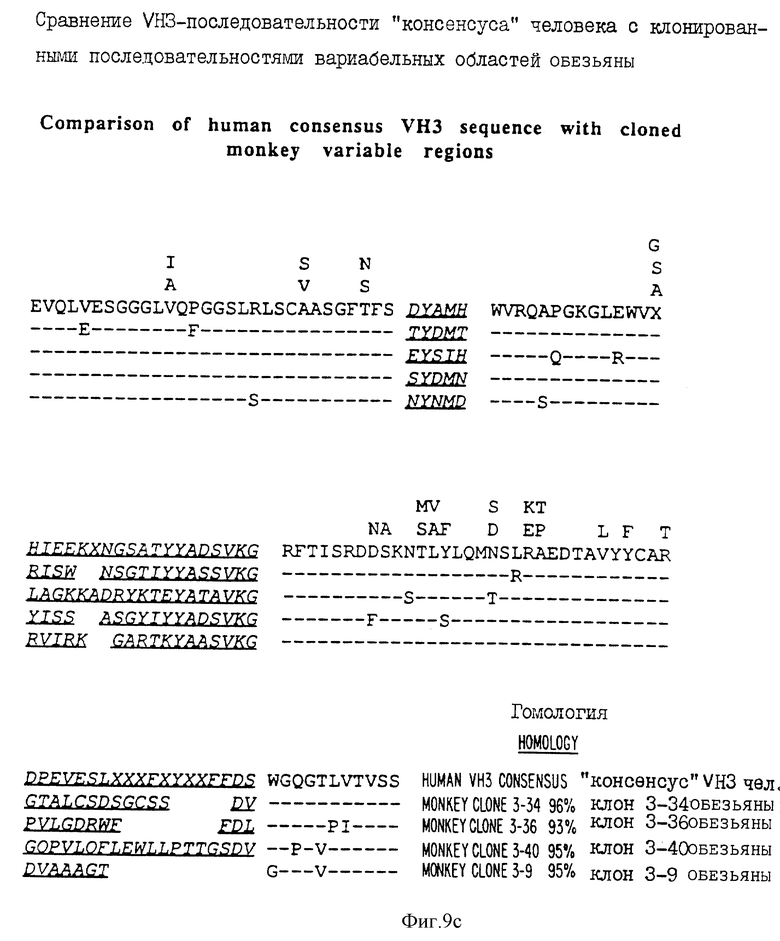






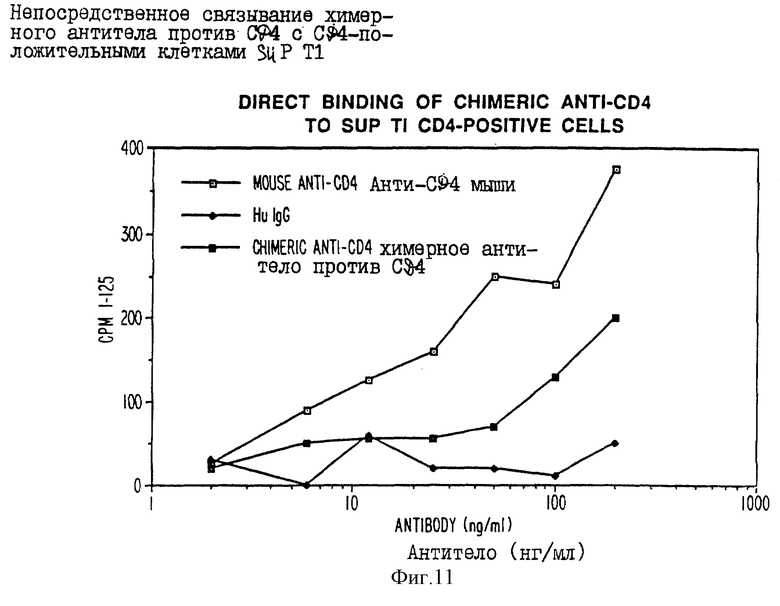
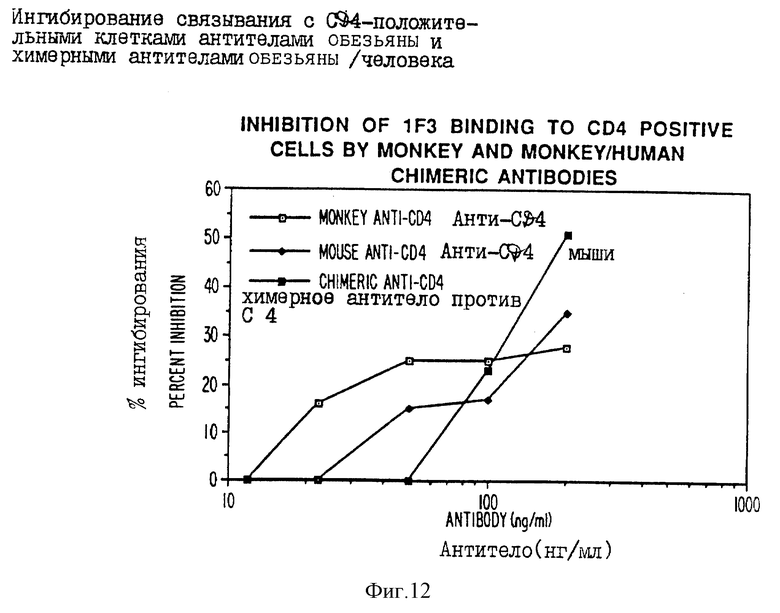


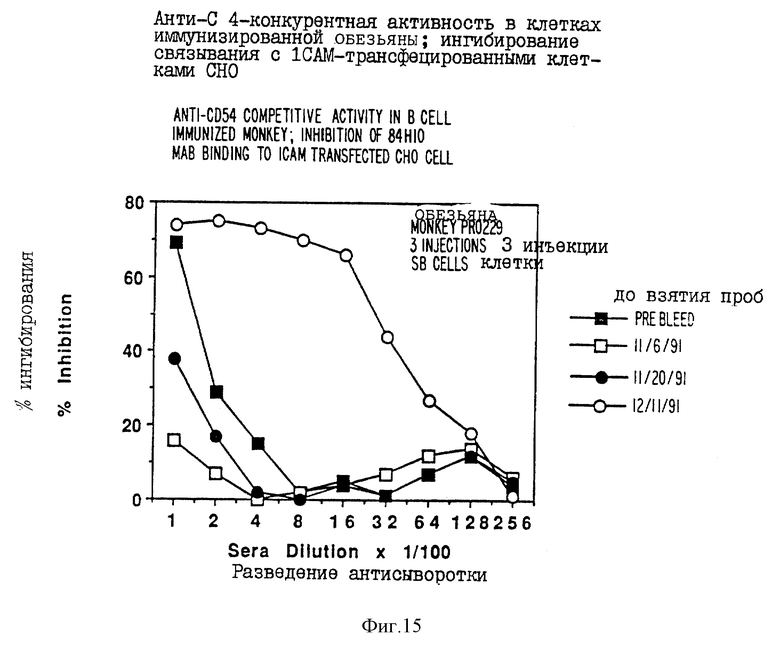
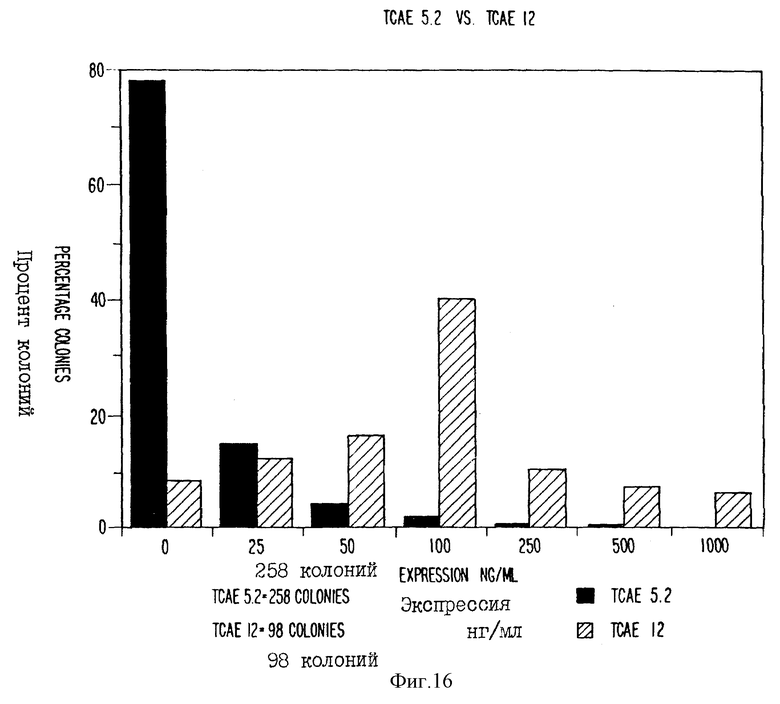
Изобретение относится к рекомбинантному антителу, содержащему область антитела обезьяны Старого Света и область антитела человека. Рекомбинантное антитело состоит из вариабельных областей тяжелой и легкой цепей иммуноглобулина обезьяны Старого Света и константных областей человека. Антитело обладает специфичностью к CD4. Рекомбинантное антитело входит в состав фармацевтической композиции, которая может быть использована для лечения псориаза. 3 с. и 3 з.п. ф-лы, 28 ил.
Авторы
Даты
2001-07-10—Публикация
1992-07-24—Подача