Данная заявка является частичным продолжением US Serial № 08/476237, которая является частичным продолжением US Serial № 08/397072, поданной 25 января 1995, которая является продолжением US Serial № 07/912292, поданной 10 июля 1992, которая является частичным продолжением Newman et al., United States patent application Serial № 07/856281, поданной 23 марта 1992, которая является частичным продолжением US patent application Serial № 07/735064, поданной 25 июля 1991, причем все их содержимое, в том числе рисунки, включено этим перечислением в качестве ссылки. Данное изобретение относится к рекомбинантным антителам, специфическим в отношении CD4, которые применимы для терапии человека, и к способам получения таких антител.
CD4 представляет собой поверхностный гликопротеин, первично экспрессируемый на клетках линии дифференцировки Т-лимфоцитов, в том числе на большинстве тимоцитов и субпопуляции периферических Т-клеток. Низкие уровни CD4 экспрессируются также некоторыми нелимфоидными клетками, хотя функциональное значение такого дивергентного клеточного распределения неизвестно. На зрелых Т-клетках CD4 выполняет функцию двойного распознавания через взаимодействие с молекулами МНС (ГКГ) Класса II, экспрессируемыми в антигенпредставляющих клетках. CD4+ Т-клетки составляют первично хелперную субпопуляцию, которая регулирует функции Т- и В-клеток во время Т-зависимых ответных реакций на вирусные, бактериальные, грибковые и паразитарные инфекции.
Во время патогенеза аутоиммунных заболеваний, в частности, когда толерантность к аутоантигенам разрушается, CD4+ Т-клетки способствуют воспалительным реакциям, которые приводят к разрушению суставов и тканей. Эти процессы облегчаются рекрутингом воспалительных клеток гемопоэтической линии дифференцировки, образованием антител, воспалительных цитокинов и медиаторов и активацией клеток-киллеров.
Ревматоидный артрит (РА), воспалительное заболевание синовиальной оболочки, является одним из проявлений аутоиммунного феномена, который приводит к эрозии, деформации и деструкции суставов. Подобно большинству аутоиммунных заболеваний, этиология РА не выяснена хорошо. Однако известно, что РА характеризуется повышенными уровнями активированных CD4+ Т-лимфоцитов в пораженных суставах. В настоящее время не существует способа лечения для РА. Первоочередная терапия для РА предназначена для обеспечения ослабления симптомов РА и улучшения способности функционирования на протяжении короткого времени. Иммуносупрессоры и стероиды второй и третьей очереди, такие как азатиоприн, метотрексат и преднизолон, направленные на лежащее в основе заболевание, вводят в более тяжелых случаях, и они либо слабоэффективны, либо проявляют неприемлемую токсичность для хронической терапии. Кроме того, они не защищают от деструкции суставов.
Кроме РА, CD4+ клетки считали также причастными к другим хроническим состояниям, в том числе, к псориазу, инсулин-зависимому сахарному диабету, системной красной волчанке и воспалительным заболеваниям кишечника. Кроме того, возможно, что экспрессия CD4 может принимать участие в других аутоиммунных заболеваниях.
При условии, что Т-клетки участвуют в развитии и поддержании аутоиммунных заболеваний, иммуносупрессия стала важной стратегией лечения. Доступные иммуносупрессивные лекарственные средства, такие как циклоспорин А, успешно использовали для лечения отторжения трансплантата. Однако их токсичные побочные эффекты делают их неприемлемыми для хронической терапии аутоиммунных заболеваний.
Истощение всей популяции Т-клеток, в том числе, CD4+ субпопуляции, в клинических ситуациях выполняли способами, включающими дренаж грудного (лимфатического) протока, тотальное облучение лимфоидов и лимфоферез, приводящими к клиническому улучшению у некоторых пациентов. Однако стратегии настоящего времени сосредоточены на более избирательных агентах, которые ингибируют нежелательные иммунные ответы, не индуцируя токсичности для твердых органов или других основных побочных эффектов. Одним из путей, при помощи которого это может быть потенциально достигнуто, является избирательное удаление или инактивация опосредующих заболевание Т-клеток моноклональными антителами (mAb). mAb к CD4 представляют собой одну из таких стратегий. В животных моделях аутоиммунитета и трансплантации mAb против CD4 задерживают или обращают прогрессирование заболевания при профилактическом или терапевтическом введении. Кроме того, первоначальные результаты из некоторых клинических испытаний с mАb против CD4 в случае РА, псориаза, воспалительного заболевания кишечника и системного васкулита дали некоторое предварительное доказательство потенциальной терапевтической эффективности.
По существу, цель терапии с использованием mAb против CD4 состоит в остановке аутодеструктивной активности CD4+ клеток, в частности, во время острых фаз аутоиммунного нарушения. Конечной терапевтической задачей является создание состояния иммунологической неотвечаемости (анергии) или долгосрочной толерантности к поражающим антигенам (или специфическим тканям), которые поддерживают лежащее в основе заболевание, без ослабления нормальных защитных сил хозяина против условно-патогенных инфекций. Кроме PA, mAb против CD4 выгодны также для лечения других аутоиммунных заболеваний, например, инсулин-зависимого сахарного диабета, системной красной волчанки, псориаза, воспалительного заболевания кишечника и рассеянного склероза.
Вследствие потенциальной важности mAb против CD4 в качестве иммунотерапевтических средств многочисленные компании и исследовательские группы сообщили о mAb против CD4 как о потенциальных терапевтических агентах. Например, Centocor сообщил о mAb против CD4, названном Centara, который представляет собой химерное мышиное mAb против CD4. Далее, Johnson and Johnson/Ortho сообщил об ОКТ-4а, mAb против CD4, которое представляет собой "очеловеченное" мышиное mAb. Далее Burroughs Wellcome сообщил об mAb против CD4, которое представляет собой "очеловеченное" крысиное mAb к CD4. Кроме того, как Sandoz, так и MedImmune (в сотрудничестве с Merck) разработали mAb "мышь-человек" против CD4, специфическое в отношении CD4. Далее, Becton Dickinson, Immunotech и Boehringer Mannheim независимо получили mAb против CD4.
Кроме mAb против CD4, были описаны различные иммуномодуляторы и лекарственные средства, потенциально применимые для лечения РА. Такие иммуномодуляторы и лекарственные средства включают, например, ингибиторы клеточной адгезии, ингибиторы рецепторов цитокинов, иммунотоксины и антагонисты рецепторов Т-клеток. Конкретные примеры включают гамма-интерферон, anti-ICAM-1 (мышиное mAb против CD54, которое ингибирует направленную миграцию лимфоцитов и адгезию), Campath-lH (крысиное-"очеловеченное" mAb против Cdw52), рецептор IL-1, сА2 (химерное mAb против TNF-α), CDP571 (mAb против TNF), anti-IL-2R ("очеловеченное"-мышиное mAb против CD25), SDZ СНН 380 (mAb "мышь-человек" против CD7), DAB486 IL-2 (IL-2-слитый токсин, неспецифический для CD4- и CD8 клеток), Antril (IL-1RA), anti-TCR (mAb и белки, которые нацелены на популяции рецепторов Т-клеток) и XomaZyme-CDS (конъюгат мышиное mAb против CDS-токсин).
Также другие иммуномодуляторы и иммуносупрессоры, имеющие потенциальное применение для лечения аутоиммунных заболеваний, включают Рапамицин (пероральное иммуносупрессивное средство), Терафектин, Лефлуномид (иммуносупрессивное пролекарство), Тенидап (модулятор цитокина/СО-ингибитор), IMM-125 и RS-61443 (пероральное иммуносупрессивное средство).
Как отмечалось, были сообщения о многочисленных моноклональных антителах к CD4, имеющих потенциальные терапевтические применения. В большинстве случаев эти антитела содержат мышиные mAb, химерные или мышиные-"очеловеченные" (мышь-человек) mAb против CD4.
Мышиные моноклональные антитела имеют потенциальную применимость в диагностике заболевания человека, а также в клинических испытаниях в качестве терапевтических средств для лечения как острых, так и хронических заболеваний человека, в том числе, лейкозов, лимфом, твердых опухолей (например, опухолей ободочной кишки, молочной железы, печени), СПИДа и аутоиммунных заболеваний. Однако мышиные антитела являются невыгодными, поскольку они часто приводят к иммунному гуморальному ответу в хозяине, т.е. образованию антител против мышиных моноклональных антител.
Были также сообщения о химерных мышь/человек антителах. Эти антитела имеют характеристики связывания исходного мышиного антитела и эффекторные функции, связанные с константной областью иммуноглобулина человека. См., например, Cabilly et al., US Patent № 4816567; Shoemaker et al., US Patent № 4978775; Beavers et al., US Patent № 4975369 и Boss et al., US Patent № 4816397 (все включены здесь в качестве ссылки). Как правило, эти химерные антитела конструируют при получении геномной генной библиотеки из ДНК, экстрагированной из предсуществующих мышиных гибридом (Nishman et al., 47 Cancer Research, 999 (1987)). Затем библиотеку подвергают скринингу на гены вариабельных областей как из тяжелых, так и из легких цепей, обнаруживающих правильный характер перегруппировки фрагментов антител. Клонированные гены вариабельных областей затем лигируют в экспрессирующий вектор, содержащий клонированные кассеты подходящего гена константной области тяжелой или легкой цепи человека. Затем химерные гены экспрессируют в выбранной клеточной линии, обычно в линии мышиных миеломных клеток.
Однако, хотя такие химерные антитела были использованы в терапии человека, они также создают некоторые проблемы. Подобно тому, как это имеет место в случае мышиных моноклональных антител, индивидуумы-реципиенты могут продуцировать антитела против химерного антитела. Это неблагоприятно для эффективности продолжающейся терапии с использованием химерного антитела.
В качестве усовершенствования общепринятых химерных антител некоторые исследователи описали способы получения человеческих моноклональных антител, которые не должны создавать подобных проблем. См., например, Erlich et al., 34 Clinical Chemistry, 1681 (1988); Erlich et al., 7 Hybridoma, 385 (1988); Erlich et al., 6 Hybridoma, 151 (1987) и Erlich et al., 1 Human Antibody Hybridomas, 23 (1990). Эти ссылки также выдвигают гипотезу, что антитела приматов (кроме человека), например моноклональные антитела шимпанзе, должны хорошо переноситься человеком вследствие их структурного сходства с антителами человека. Однако образование антител в людях имеет очевидные этические неудобства.
Поскольку антитела человека неиммуногенны в макаке Резусе (т.е. не вызывают образования антител), Erlich et al. также предсказывают, что антитела приматов должны быть неиммуногенными в человеке. Erlich et al. (Id.) указывают, что испытание антител в людях является необязательным, если антитело примата имеет константную область, идентичную с константной областью иммуноглобулина человека, или, по меньшей мере, структура не больше отличается от иммуноглобулина человека, чем различные антитела человека отличаются друг от друга. Таким образом, они предполагают, что антитела шимпанзе могут быть использованы в терапии человека.
В качестве усовершенствования известных химерных антител, которые часто являются антигенными в организме человека, родственные заявки US Serial № 08/476237, поданная 7 июня 1995, US Serial № 08/347072, поданная 25 января 1995, и US Serial № 07/912212, поданная 10 июля 1992, 07/856281, поданная 23 марта 1992, и 07/735064, поданная 25 июля 1991, все включенные здесь в качестве ссылки, описывают приготовление моноклональных антител низших узконосых обезьян и химерных антител, произведенных из них, полученных рекомбинантными способами, которые содержат вариабельную область антитела узконосой обезьяны (например, павиана или макака), слитую с клонированной константной областью иммуноглобулина человека, шимпанзе или другой обезьяны или каркасными областями других обезьян. Эти заявки описывают, в частности, приготовление таких антител низшей узконосой обезьяны и произведенных из них химерных антител против человеческих антигенов, а также использование таких химерных рекомбинантных антител в качестве иммунотерапевтических средств для лечения заболевания человека.
Эти заявки основываются на неожиданном открытии, что эволюционно отдаленные обезьяны (например, павиан или макак), (в том числе cynomolgus и резус)), в противоположность шимпанзе, не только достаточно отличаются от человека, чтобы антитела против человеческих антигенов образовались в этих обезьянах даже против относительно консервативных человеческих антигенов, например, CD4 и CD54, но и достаточно сходны с человеком, чтобы иметь антитела, которые структурно одинаковы с антителами человека, так что не происходит образования антител в хозяине против антител этих обезьян или против произведенных из них рекомбинантных химерных антител при введении их в человека.
Эти заявки описывают, что в противоположность некоторым прежним антителам, используемым для терапии человека, в том числе известным химерным антителам, такие химерные антитела не имеют некоторых недостатков, например, таких как 1) иммуногенность и индукция образования в человеке антител против этих антител (НАА) при повторяемом введении, необходимом для лечения хронических состояний, 2) относительно короткий период полувыведения по сравнению с антителами человека и 3) отсутствие эффекторных функций в отношении клеток или комплемента человека.
Отсутствие этих недостатков является существенным преимуществом для терапии человека. Например, в случае хронических заболеваний человека, в том числе аутоиммунных заболеваний, или любого заболевания, при котором требуется продолжительное введение антитела, одним из главных препятствий для повторяющейся терапии с применением антител является реакция хозяина на терапевтические антитела. НАА-реакции часто непредсказуемы и отличаются от одного пациента к другому. Также, такие ответные реакции преимущественно, хотя и не исключительно, направлены против константной области молекулы антитела, и, если они имеют место, они часто устраняют или снижают эффективность терапии этим антителом или другим антителом того же изотипа. Рекомбинантные химерные антитела, описанные в упомянутых выше заявках, элиминируют эту проблему и делают возможным генерирование антител подходящей специфичности и желаемой эффекторной функции и их использование в получении рекомбинантных антител.
Эти рекомбинантные антитела, как правило, содержат подходящую часть вариабельной области антитела, полученного из иммунизированной обезьяны, которая необходима для связывания антигена, и константную область антитела из человека или шимпанзе. Таким образом, это позволяет сохранить специфичности и высокие аффинности моноклональных антител обезьяны и желательные эффекторные функции путем подходящего выбора константной области антитела человека или шимпанзе.
Некоторые из этих родственных заявок приводят, в частности, примеры химерного антитела обезьяна/человек, специфического для CD4, называемого СЕ9.1, которое содержит вариабельный домен тяжелой и легкой цепей моноклонального антитела против CD4, образованного в собакоподобной обезьяне (cynomolgus), и константной области легкой цепи лямбда иммуноглобулина человека и константной области тяжелой цепи гамма 1 иммуноглобулина человека. Это антитело обладает некоторой активностью истощения Т-клеток, но эта активность является более низкой в сравнении с предшествующими моноклональными антителами против CD4. Однако желательно получить антитела, которые обладают более низкой истощающей Т-клетки активностью или лишены этой активности, поскольку это потенциально усилило бы их терапевтический потенциал.
Эти заявки описывают также предпочтительные векторные системы для получения таких химерных антител, в частности, ТСАЕ 5.2 и ТСАЕ 6, которые содержат:
1. Четыре транскрипционные кассеты в тандемном порядке:
а) константную область легкой цепи иммуноглобулина человека. В ТСАЕ 5.2 это константная область легкой цепи каппа иммуноглобулина человека (согласно нумерации Kabat аминокислоты 108-214, аллотип Km 3) и в ТСАЕ 6 константная область легкой цепи лямбда иммуноглобулина человека (согласно нумерации Kabat аминокислоты 108-215, генотип Oz минус, аллотип Мcg минус, Ке минус);
b) константную область тяжелой цепи иммуноглобулина человека; в обеих конструкциях тяжелой цепью иммуноглобулина человека является константная область гамма (согласно нумерации Kabat аминокислоты 114-478, аллотип Gmla, Gm 12);
c) DHFR, содержащий его собственный эукариотический промотор и район полиаденилирования; и
d) NEO, также содержащий его собственный эукариотический промотор и район полиаденилирования.
2. Кассеты легкой и тяжелой цепей иммуноглобулина человека содержат синтетические сигнальные последовательности для секреции цепей иммуноглобулина.
3. Кассеты легкой и тяжелой цепей иммуноглобулина человека содержат специфические ДНК-связи, которые позволяют встраивание вариабельных областей легкой и тяжелой цепей иммуноглобулина, которые сохраняют трансляционную рамку считывания и не изменяют аминокислоты, в норме обнаруживаемые в цепях иммуноглобулина.
Однако, несмотря на все описанное ранее, в данной области все еще существует потребность в усовершенствованных антителах, которые являются специфическими в отношении CD4, обладают низкой антигенностью в человеке и которые могут использоваться терапевтически, например, для лечения аутоиммунных заболеваний, таких как ревматоидный артрит. В частности, существует потребность в получении антител против CD4, которые проявляют улучшенные свойства, например, более длительный период полувыведения, и/или которые по существу лишены истощающей активности.
Для выполнения этой задачи, целью данного изобретения является обеспечение новых моноклональных и химерных антител, специфических в отношении CD4, имеющих улучшенные свойства, например, более продолжительный период полувыведения, низкую иммуногенность в человеке и/или пониженную истощающую Т-клетки активность или ее отсутствие. Более конкретно, целью данного изобретения является получение химерных антител против CD4, которые содержат антиген-узнающую часть иммуноглобулина низшей узконосой обезьяны, специфическую в отношении CD4, и последовательности константной области иммуноглобулина человека или обезьяны, в частности, константную область легких каппа- или лямбда-цепей человека, и последовательности константной области тяжелой гамма-1- или гамма-4- или мутированной гамма-4-цепи с измененными эффекторными функциями и повышенной стабильностью по сравнению с гамма-4-изотипом.
Более конкретной целью данного изобретения является обеспечение моноклональных и химерных антител, содержащих специфическую вариабельную последовательность тяжелой цепи антитела против CD4 обезьяны, показанную на фиг.1, и вариабельную последовательность легкой цепи антитела против CD4 обезьяны, показанную на фиг.2, слитые с последовательностями константного домена обезьяны или человека, предпочтительно последовательностью константного домена легкой каппа- или лямбда-цепи человека или последовательностью константного домена тяжелой гамма-1- или гамма-4-цепи или мутированной гамма-4-цепи с измененными эффекторными функциями и улучшенной стабильностью по сравнению с гамма-4-изотипом.
Другой целью данного изобретения является обеспечение последовательностей ДНК, которые обеспечивают экспрессию таких усовершенствованных химерных антител против CD4, и векторов и клеток-хозяев, которые могут быть использованы для экспрессии таких химерных антител против CD4. Предпочтительно, такие векторы должны включать в себя экспрессирующие векторы, на которые ссылаются в заявках, включенных здесь в качестве ссылок, а предпочтительными клетками-хозяевами являются клетки СНО. Еще одной целью данного изобретения является обеспечение фармацевтических композиций для применения в лечении или профилактике связанных с CD4 расстройств, в частности, аутоиммунных заболеваний, которые содержат профилактически или терапевтически эффективное количество рассматриваемых усовершенствованных химерных антител против CD4 в сочетании с фармацевтически приемлемым носителем.
Еще одной целью данного изобретения является обеспечение способов лечения или профилактики связанных с CD4 нарушений, в частности, аутоиммунных заболеваний и других состояний, в которых желательна иммуносупрессия, посредством введения терапевтически или профилактически эффективного количества рассматриваемых новых химерных антител против CD4 в сочетании с фармацевтически приемлемым носителем.
Фиг.1 изображает аминокислотную последовательность и последовательность ДНК вариабельного домена легкой цепи СЕ9.1.
Фиг.2 изображает аминокислотную последовательность и последовательность ДНК вариабельного домена тяжелой цепи СЕ9.1.
Фиг.3 изображает аминокислотную последовательность и последовательность ДНК вариабельного и константного доменов лямбда-цепи, содержащихся в СЕ9.1.
Фиг.4 изображает аминокислотную последовательность и последовательность ДНК, кодирующую вариабельную и константную последовательность тяжелой цепи гамма-4.
Фиг.5 изображает аминокислотную последовательность и последовательность ДНК, кодирующую тяжелую цепь гамма-4-человека, содержащую Е-мутацию.
Фиг.6 изображает аминокислотную последовательность и последовательность ДНК, кодирующую тяжелую цепь гамма-4-человека, содержащую Р- и Е-мутацию.
Фиг.7-1, 7-2 и 8 показывают нуклеотидную последовательность различных лидерных последовательностей, используемых в данном изобретении.
Фиг.9 показывает диаграмму рассеяния связывания СЕ9.1 со свежими PMNC человека, где верхний правый квадрант Панели А показывает лимфоциты, вдвойне окрашенные СЕ9.1 и ОКТЗ, верхний правый квадрант Панели В показывает популяцию, вдвойне окрашенную СЕ9.1 и ОКТ4, верхний правый квадрант Панели С показывает отсутствие клеток, вдвойне окрашенных CD4 и СЕ9.1, и контроль Панели D показывает клетки, окрашенные нормальным и человеческим IgG.
Фиг.10а,10b и 10с показывают характеристики связывания рецептора Fc CE9.1, где измерения показывают агглютинацию CD4+ проточно-цитометрической гистограммы связывания фибробластов с: а) индуцированными γIFN свежими моноцитами, где в негативном контроле использовали F(ab')2-фрагменты CE9.1, b) свежими моноцитами с индукцией γIFN или без нее и с) в присутствии sCD4 или в отсутствие антитела.
Фиг.11 показывает ингибирование реакции смешанных лимфоцитов человека СЕ9.1, где а) свежие PBL человека использовали в качестве респондеров, а обработанные митомицином С клетки из неродственного донора использовали для тестирования ингибирующих свойств диапазона концентрацией СЕ 9.1 и ингибирование измеряли количеством включения тимидина при образовании IL-1 и b) MLR с применением клеток-респондеров шимпанзе и неродственных шимпанзе стимуляторов, где Leu3a, мышиные антитела против CD4 человека, использовали в качестве контроля.
Фиг.12 показывает антитела-зависимые клеточные цитотоксические свойства СЕ9.1, где лизис клеток-мишеней SupT-18 в присутствии γ-интерферона стимулировал эффекторные клетки и где 4D9 представляет собой мышиное моноклональное антитело IgG2a против CD4.
Фиг.13 показывает гистограмму проточной цитометрии связывания Clq с клетками SupTl-18 в присутствии и в отсутствие СЕ9.1, где зарегистрированы 10000 событий и результаты выражены в виде гистограммы, PRO945 представляет собой поликлональные антитела из обезьяны с высоким титром антител сыворотки против CD4 и негативным контролем был Clq+anti-Clq в отсутствие СЕ9.1.
Фиг.14 показывает тест комплемент-зависимой цитотоксичности СЕ9.1, где лизис клеток SupT-18 проводят в присутствии СЕ9.1 и кроличьего комплемента, где 4D9 представляет собой контроль в виде мышиных антител против CD4 подкласса IgG2a, которые способны фиксировать комплемент, и где PRO965 представляет собой поликлональную смесь антител из сыворотки обезьяны cynomolgus с высоким титром антител против CD4.
Фиг.15 показывает фармакологическое исследование с высокими дозами в шести шимпанзе, где также показаны уровни CD4, CD8 в периферической крови, экспрессируемых на протяжении периода 150-300 дней, и кривые CD4-CD8, показывающие число CD4-модулированных клеток; верхняя панель: Группа 1 - наблюдаемые числа шимпанзе. Стрелки указывают дозы СЕ9.1. (2) группа солевого контроля, Средняя Панель: Группа 2 - шимпанзе (2), получающие 10 мг/кг СЕ9.1. Дозирование повторяли при возврате чисел CD4 в пределы 30% фона. Нижняя Панель: Группа 3 - шимпанзе (2), получающие 10 мг/кг СЕ9.1. Дозирование повторяли при возвращении чисел CD4 в пределы 70% фона.
Фиг.16 изображает праймеры ПЦР, пригодные для получения константного района γ4 человека.
Фиг.17 изображает последовательность тяжелой цепи СЕ9. 1γ4РЕ.
Фиг.18 изображает невосстанавливающий электрофорез в ДСН-полиакриламидном геле СЕ9.1, CE9γ4(G4), CE9γ4E(G4E) и СЕ9γРЕ(G4PE). Половина молекулы имеет молекулярную массу приблизительно 80 кД.
Фиг.19 содержит данные для фаз ассоциации и диссоциации кривых прогрессирования SPR.
Фиг.20 показывает действие конструкций mAb против CD4 в первичных MLR.
Фиг.21 показывает адгезию индуцированной γIFN линии моноцитов ТНР-1 с CD4+ фибробластными трансфектантами.
Фиг.22 изображает FcR- и CD4--мeдииpyeмyю адгезию СЕ9.1, СЕ9γ4, СЕ9γ4Е и СЕ9γ4γК.
Фиг.23 показывает результаты CDC и ADCC с СЕ9γ4РЕ, СЕ9.1 и мышиными фиксирующими mAb с HuCD4.
Фиг.24 показывает концентрации в плазме после болюсной инъекции 1 мг/кг СЕ9γ4Е и СЕ9γ4РЕ в крысах Sprague-Dawley.
Фиг.25 изображает действие обработки mAb на образование специфических для овальбумина антител в HuСD4-трансгенных мышах.
Данное изобретение обеспечивает новые моноклональные химерные антитела, специфические в отношении CD4, которые содержат антигенсвязывающую часть вариабельной области моноклонального антитела против CD4 низшей узконосой обезьяны, слитую с желаемыми последовательностями константного домена обезьяны или человека, предпочтительно константным доменом тяжелой цепи гамма 1 человека, гамма 4 человека или мутированной тяжелой цепи гамма 4 человека, и с последовательностью константного домена легкой каппа- или лямбда-цепи человека. Эти антитела проявляют улучшенные свойства относительно обычных моноклональных антител против CD4, например, высокую аффинность в отношении человеческого CD4 и низкую иммуногенность или отсутствие иммуногенности в человеке. Варианты гамма 4 обнаруживают пониженную эффекторную функцию или отсутствие эффекторной функции, например, активности связывания Fc рецептора или фиксации комплемента, и низкую активность истощения Т-клеток или ее отсутствие.
Способы получения моноклональных антител, специфических для CD4, узконосой обезьяны и клоны, которые продуцируют моноклональные антитела, специфические для CD4, узконосой обезьяны могут быть найдены в вышеупомянутых родственных патентных заявках, включенных здесь в качестве ссылки.
В общем виде, такой способ предусматривает иммунизацию узконосой обезьяны против человеческого антигена CD4 при таких условиях, что узконосая обезьяна образует антитела против CD4, иммортализацию клеток этой обезьяны, ответственных за продуцирование антител против CD4, например, посредством гибридомного слияния, вирусной трансформации Herpes papio, клонирование отдельной В-клетки (также называемое "временной иммортализацией") и получение библиотеки рекомбинантных иммуноглобулинов. В предпочтительных вариантах этот способ включает выбор В-клетки из обезьяны либо из лейкоцита периферической крови, селезенки, костного мозга, либо из лимфатического узла; выбор основы, которая продуцирует подходящее антитело; "спасение" генов иммуноглобулинов, кодирующих это антитело, из иммортализованной клеточной линии; и экспрессию этих генов в линии клеток-продуцентов (т.е. клеточной линии, которая позволяет получить достаточное количество антител для использования для терапии человека). Как определено в вышеупомянутых заявках, низшие узконосые обезьяны включают павианов и макаков (в том числе макака Резуса и собакоподобную обезьяну cynomolgys).
Как обсуждалось supra, в предпочтительном варианте рассматриваемые химерные антитела будут содержать вариабельную тяжелую и вариабельную легкую последовательности антитела против CD4 узконосой обезьяны, показанные на фиг.1 и 2, слитые с последовательностями константного домена антитела человека. Подходящие способы для получения этих специфических последовательностей вариабельных доменов тяжелой и легкой цепей детально описаны в US application Serial № 08/476237, поданной 7 июня 1990 и 08/397072, поданной 25 января 1995, а также в 07/912292, поданной 10 июля 1992, включенных здесь в качестве ссылки в их полном виде. Кроме того, эти заявки описывают полную нуклеотидную и аминокислотную последовательность этих последовательностей.
Эти последовательности вариабельного домена тяжелой и легкой цепей могут быть слиты с любыми желательными последовательностями константного домена человека. Конкретный выбор будет влиять на эффекторную функцию полученного химерного антитела против CD4. Предпочтительно, константный домен тяжелой цепи будет содержать константный домен гамма 1, гамма 4 или мутированный гамма 4, называемый здесь гамма 4Е, или мутированный гамма 4, называемый гамма 4РЕ. Выбор гамма 4 является предпочтительным, поскольку было обнаружено, что гамма 4 приводит к химерным антителам, не имеющим или почти не имеющим истощающей Т-клетки активности (80-100% относительно гамма 1). Считают, что это связано с тем, что константный домен гамма 4 не способен связывать комплемент. Константный район может быть также мутированным для усиления свойств получаемого химерного антитела, например, стабильности, и/или для элиминации истощающей активности. В частности, модификации Р и Е домена гамма 4, описанные infra, являются модификациями гамма 4 в шарнирной области, которые придают активность повышенной стабильности и исключают истощающую активность. Кроме того, ожидается, что другие модификации должны также обеспечивать химерные антитела, имеющие усиленные свойства.
Константным доменом легкой цепи человека, содержащимся в рассматриваемых химерных антителах против CD4, предпочтительно является константный домен легкой каппа- или лямбда-цепи человека, более предпочтительно константный район легкой лямбда-цепи человека. Аминокислотные и ДНК-последовательности, кодирующие константные домены гамма 1, гамма 4, каппа- и лямбда-цепей человека, известны в данной области. Также, аминокислотные и последовательности нуклеиновых кислот для константного домена гамма 4 и Е и РЕ мутантов и лямбда могут быть найдены на фиг.4-6 и 3, соответственно.
Приведенные в качестве примеров варианты данного изобретения включают специфическое химерное моноклональное антитело против CD4, называемое СЕ9.1, которое содержит антигенсвязывающие домены, полученные из иммунизированного sCD4 человека макака cynomolgus (показанные на фиг.1 и 2), в сочетании с константными доменами человеческого IgG, и моноклональные химерные антитела, произведенные из него, например, СЕ9γ4, СЕ9γ4λК и СЕ9γ4Е, СЕ9γ4РЕ, которые имеют те же самые антиген-связывающие домены СЕ9.1, но были сконструированы генетически с каркасом Fc-связывающего домена IgG4 человека. Моноклональное антитело СЕ9γ4Е содержит мутацию лейцин-глутаминовая кислота (L236E) вблизи шарнирного района антитела (Е-модификация). Моноклональное антитело СЕ9γ4РЕ содержит ту же самую мутацию лейцин-глутаминовая кислота плюс мутацию серин-пролин (S229P) (Е- и Р-модификация). Антитело СЕ9γ4λК отличается от СЕ9γ4 заменой его константного домена легкой цепи с подтипа К на подтип λ человека.
Эти переключения и мутации константного домена были произведены, поскольку известно, что биологические ответы антител IgG зависят от состава их карбокси-концевых доменов, т.е. их изотипа. Таким образом, путем изменения изотипа антитела конструированием белков потенциально возможно модифицировать биологический ответ антитела IgG и, более конкретно, рассматриваемых химерных моноклональных антител против CD4.
Желательным результатом этой стратегии конструирования было достижение того, чтобы переключение изотипа Fc-части антитела не уменьшало аффинность связывания связывающих антиген CD4 Fab районов. Однако изначально это неизвестно. Возможно, что изменение константного района или его модификации могли бы иметь неблагоприятное влияние на связывание CD4. Поэтому, полученные антитела тестировали для определения влияния модификации на свойства антител, в частности, на связывание антигена CD4. Для измерения возможных влияний переключения изотипа константного домена на связывание антигена можно использовать известные способы анализа. В частности, исследование взаимодействия между CD4 и СЕ9.1, СЕ9γ4, СЕ9γ4λК, СЕ9γ4Е, СЕ9γ4РЕ выполняли анализом Скетчарда и поверхностным плазмонным резонансом (SPR). Результаты этих анализов показали, что связывание CD4 с каждым из тестируемых антител было равноценным. При помощи SPR было найдено, что все константы равновесной диссоциации при 25°С для связывания CD4 с антителами равны приблизительно 1,0 нМ. Кроме того, эти измерения показывают, что:
1) связывание CD4 с антителами происходит согласно двухсайтной независимой и идентичной модели связывания и
2) функциональные свойства связывания антигенсвязывающих доменов не зависят от структурных модификаций Fc-части антитела, в том числе изотипов гамма 1, гамма 4 или мутированного гамма 4. Таким образом, данное изобретение обеспечивает доказательство того, что переключение изотипа между IgGl и IgG4 может быть ценной стратегией для конструирования антител без потери антигенсвязывающей аффинности и, более конкретно, антител к CD4.
Как описано infra, было также обнаружено, что замена константного домена гамма 1 доменом гамма 4 существенно уменьшала связывание Fc-рецептора, фиксацию комплемента и активность истощения Т-клеток, и что модификации Е и Р, соответственно, дополнительно элиминируют связывание Fc-рецептора и истощающую Т-клетки активность и обеспечивают повышенную стабильность антител. Таким образом, резонно предположить, что другие химерные антитела, получаемые в соответствии с данным изобретением (сконструированные таким образом, чтобы они содержали константный домен гамма 4 человека или его мутированные формы), могут быть выбраны с измененной Fc-эффекторной функцией, которые почти не имеют истощающей Т-клетки активности или полностью лишены ее, и/или которые проявляют повышенную стабильность. Способы определения истощающей Т-клетки активности, Fc-эффекторной функции и стабильности антител известны в данной области.
Таким образом, данное изобретение обеспечивает специфические рекомбинантные антитела, которые являются химерными антителами "примат/человек", направленными против человеческого антигена CD4 человека, которые проявляют улучшенные свойства, например, низкую истощающую Т-клетки активность и повышенную стабильность. Обладая этими свойствами, эти рекомбинантные антитела имеют особую ценность в качестве иммуномодуляторов и особенно ценны для лечения аутоиммунных заболеваний, таких как ревматоидный артрит, псориаз, системная красная волчанка (SLE), а также в случае неаутоиммунных показаний, таких как реакция "трансплантат против хозяина" (РПТХ), отторжение трансплантата, астма и ВИЧ. Рассматриваемые антитела применимы также в качестве вспомогательных средств в генной терапии. В частности, рассматриваемые антитела могут быть введены до, одновременно или после введения вектора (содержащего терапевтическую ДНК) для предотвращения или уменьшения гуморального ответа хозяина на этот вектор. Эти заболевания являются примерами связанных с CD4 состояний.
Как описано более подробно в Примерах, рекомбинантное антитело СЕ9.1 получают прививкой (присоединением) антиген-связывающих вариабельных Fv-доменов из макака cynomolgus к константным доменам человека, например, к константным доменам IgGl. Более конкретно, антитело СЕ9.1 содержит домен гамма 1 и константный домен лямбда человека. СЕ9γ4, СЕ9γ4λК, СЕ9γ4Е и СЕ9γ4РЕ содержат константный домен гамма 4 или его мутированную форму и константный домен лямбда или каппа. Полученные рекомбинантные последовательности антитела являются неотличимыми от последовательностей иммуноглобулина человека. В результате эти антитела, а также другие антитела против CD4, получаемые подобными способами, при введении in vivo человеку должны проявлять пониженную иммуногенность или вообще не иметь иммуногенности и иметь более медленный сывороточный клиренс (выведение из сыворотки) по сравнению с подобными мышиными моноклональными или химерными "мышь-человек" антителами, направленными на CD4.
Антитело СЕ9.1 связывается с доменом 1 CD4 человека, но не макака, районом, который участвует во взаимодействии с молекулами МНС Class II (ГКГ Класса II) на антигенпредставляющих клетках. Кроме того, анализы показали, что другие приведенные в качестве примеров антитела содержат такие же антигенсвязывающие характеристики, что и СЕ9.1.
Сильнодействующую иммуномодуляторную активность наблюдали с антителом СЕ9.1 как in vitro, так и in vivo. При условии обладания такими свойствами, т.е. пониженной иммуногенностью, более низким сывороточным клиренсом и сильной иммуномодуляцией, по сравнению с другими известными mAb против CD4 человека, полученными из мышей или грызунов, это антитело, а также другие описанные здесь антитела должны быть особенно пригодными для долгосрочной терапии заболеваний, при которых желательна иммуносупрессия, например, аутоиммунных нарушений и хронических воспалительных заболеваний, таких как ревматоидный артрит. Однако ожидается, что эти антитела должны быть применимы для лечения многих других патологических состояний, в том числе, например, тироидита Хашимото, первичной микседемы, базедовой болезни/болезни Грейвса, пернициозной анемии, аутоиммунного атрофического гастрита, аутоиммунного кардита, болезни Аддисона, преждевременной менопаузы, сахарного диабета типа I, синдрома Гудпасчера, тяжелой псевдопаралитической миастении, рассеянного склероза, мужского бесплодия, обыкновенной пузырчатки, пемфигоида, симпатической офтальмии, факогенного увеита, аутоиммунной гемолитической анемии, идиопатической тромбоцитопенической пурпуры, идиопатической лейкопении, первичного билиарного цирроза, активного хронического гепатита (Аg НВ-негативного), криптогенного цирроза, синдрома воспалительного заболевания кишечника, синдрома Шегрена, псориаза, ревматоидного артрита, дерматомиозита, склеродермы, смешанной соединительнотканной болезни, дискоидной красной волчанки, системного васкулита и системной красной волчанки (SLE).
Как обсуждалось выше, ревматоидный артрит (РА) представляет собой воспалительное заболевание синовиальной оболочки, которое включает в себя один симптом аутоиммунного феномена, который приводит к эрозии, деформации и деструкции суставов. Как это бывает в случае большинства аутоиммунных заболеваний, этиология РА хорошо не определена, но характеризуется повышенными уровнями активированных CD4+ T-лимфоцитов в пораженных суставах. В настоящее время не существует лечения для РА и терапия для лечения этого изнурительного заболевания предназначена только для ослабления симптомов и улучшения функциональных способностей на протяжении короткого периода времени. Кроме того, иммуносупрессоры второй и третьей очереди и стероиды, такие как азатиоприн, метотрексат и преднизолон, направленные на лежащее в основе заболевание, даются только в более тяжелых случаях и обычно малоэффективны или проявляют неприемлемую токсичность при использовании для хронической терапии. В противоположность этому, ожидается, что рассматриваемое антитело будет пригодно для продолжительного и хронического введения, при условии, что оно проявляет пониженную иммуногенность, более продолжительный период полувыведения и сильнодействующую иммуномодуляторную активность по сравнению с другими известными mAb против CD4 человека, полученными из мышей или грызунов.
По существу, приводимые в качестве примеров рекомбинантные моноклональные антитела против CD4, описанные в данной заявке, или другие антитела, полученные в соответствии с данным изобретением и описанные в вышеупомянутой заявке (включенной здесь в качестве ссылки), будут, по-видимому, медиировать терапевтическую активность путем задержки или изменения деструктивной активности CD4+ клеток, в частности, во время острых фаз аутоиммунных нарушений, таких как ревматоидный артрит. Таким образом, введение антител согласно данному изобретению будет приводить к состоянию иммунологической неотвечаемости (анергии) или долгосрочной толерантности в отношении поражающих антигенов (или специфических тканей), которое действует на лежащее в основе заболевание без ослабления нормальных защитных сил хозяина против условно-патогенных инфекций. Кроме РА, моноклональные антитела против CD4 должны быть выгодными в лечении вышеназванных заболеваний и приносить успех в случае конкретного применения для лечения инсулин-зависимого сахарного диабета, системной красной волчанки, цирроза, воспалительного заболевания кишечника, множественного склероза, а также других аутоиммунных заболеваний. Они могут также быть полезны в лечении неаутоиммунных заболеваний, таких как лейкоз, лимфома, реакция трансплантат против хозяина, отторжение трансплантата, астма и ВИЧ.
Рекомбинантные моноклональные антитела против CD4, полученные в соответствии с данным изобретением, должны медиировать желаемый терапевтический эффект in vivo через один или более из следующих механизмов:
i) ингибирование взаимодействия CD4 с молекулами МНС класса 2;
ii) отрицательная модуляция CD4 клеточной поверхности;
iii) вызывание анергии и/или апоптоза;
iv) истощение (элиминация) CD4+ клеток или
v) индукция толерантности к аутоантигенам.
Хотя временное истощение CD4+ клеток приводит к иммуносупрессии и, возможно, нормализации в ином случае гиперактивной иммунной системы, основной механизм, посредством которого антитела против CD4 проявляют их действие in vivo, необязательно должен зависеть от истощения Т-клеток. Считают, что скорее связывание антитела с молекулой CD4 препятствует активации хелперных Т-клеток антигенами, связанными с Т-клеточным рецептором, что приводит к антиген-специфической Т-клеточной анергии или толерантности. Например, антитело СЕ9.1, которое содержит домен гамма 1 человека, проявляет иммуносупрессивную активность. Однако оно лишь частично элиминирует CD4 клетки в шимпанзе. Кроме того, результаты, полученные на человеке, указывают на то, что это антитело приводит к существенно меньшему истощению клеток по сравнению с другими моноклональными антителами в клинических испытаниях.
Также в экспериментальных моделях in vivo аллотрансплантатспецифическая толерантность была индуцирована неистощающими антителами против CD4, введенными в момент трансплантации. Сохранение состояния толерантности не требует истощения антител против CD4, но, однако, является, по-видимому, зависимым от присутствия антигена. На основании этих открытий ожидается, что рассматриваемые рекомбинантные антитела или другие антитела, полученные в соответствии с данным изобретением, должны быть пригодными для лечения аутоиммунных заболеваний. Кратковременные режимы лечения антителами против CD4 будут мешать ответным реакциям Т-хелперных клеток против аутоантигенов, приводя к длительным клиническим улучшениям в отсутствие общей иммуносупрессии.
На основании информации, содержащейся в рассматриваемой заявке, и с использованием известных способов специалист в данной области может легко установить безопасную, переносимую и эффективную схему лечения приведенными в качестве примеров рекомбинантными антителами против CD4, описанными здесь, а также другими антителами, полученными в основном в соответствии с данным изобретением.
Как отмечалось, СЕ9.1 представляет собой моноклональное химерное "макак-человек" антитело против CD4, которое экспрессируется в клетках яичников Китайского хомячка (СНО) и обнаруживает 91-92% гомологию с каркасными областями иммуноглобулина человека. Таким образом, эта молекула должна показывать пониженный иммуногенный ответ или его полное отсутствие у человека и должна проявлять более длительный полупериод существования в сыворотке по сравнению с мышиными моноклональными или химерными "мышь-человек" антителами. Это антитело проявляет также ограниченную перекрестную реактивность с тканями человека. Например, не наблюдали доказательства связывания этого антитела с нелимфоидными тканями при испытании. Как и ожидалось, это антитело связывается с некоторыми, но не со всеми лимфоидными клетками из периферической крови и других органов. Было также обнаружено, что это антитело реагирует с CD4+ Т-клетками шимпанзе, но не реагирует с CD4+ Т-клетками из макака резуса, cynomolgus или свинохвостых макаков, павианов, крыс, мышей или кроликов. Таким образом, если судить по этой реактивности, шимпанзе представляют собой релевантный вид для подтверждения фармакологических эффектов in vivo этого антитела, т.е. его способности функционировать в качестве эффективного иммуносупрессора.
Антитело СЕ9.1 обнаруживает обратимую истощающую Т-клетки активность в шимпанзе. Кроме того, оно, по-видимому, является улучшенным относительно мышиных и мышиных/химерных моноклональных антител против CD4, благодаря его ожидаемому более длительному полупериоду существования в сыворотке человека и пониженным потенциальным неблагоприятным иммуногенным эффектам. Кроме того, при условии присутствия последовательностей константного домена человека, ожидается, что рассматриваемое антитело при введении человеку будет сохранять нормальные эффекторные функции человеческих антител. Действительно, эффекторные функции антитела СЕ9.1, а также других описанных антител оценивали в нескольких различных анализах. Было найдено, что антитело СЕ9.1 проявляет ингибирующую активность в реакции смешанной культуры лимфоцитов (СКЛ), проявляет слабое связывание Clq, но не обнаруживает опосредованной комплементом клеточной цитотоксичности. Было также обнаружено, что оно проявляет активность антитело-зависимой клеточной цитотоксичности (ADCC) и связывает FcR. Кроме того, антитело СЕ9.1 оценивали In vivo в шимпанзе и при этом было обнаружено, что введение его приводит к частичному истощению CD4+ клеток и модулированию рецептора CD4.
Антитело СЕ9.1 вводили шимпанзе в различных дозах. Более конкретно, действие доз 0,1, 0,3, 1,5 и 10 мг/кг исследовали на шимпанзе, получавшем дозы с 7-14-дневными интервалами. Не наблюдали клинического доказательства токсичности. Дозы мг/кг или более высокие дозы вызывали 80-95% уменьшение CD4+ клеток в кровотоке спустя 24 часа после введения дозы. Значимого снижения количества CD4+ клеток не наблюдали спустя 7 дней после введения дозы 1 мг/кг. После дозы 5 мг/кг числа циркулирующих в кровотоке CD4+ клеток восстанавливались до приблизительно 40% от линии фона после 7 дней и приблизительно 60% от линии фона после 14 дней. После дозы 10 мг/кг числа циркулирующих CD4+ клеток не восстанавливались спустя 7 дней после обработки и восстанавливались только до 40% от линии фона спустя 42 дня после введения дозы. При этом не наблюдали никаких изменений в других клинических показателях патологии.
Антитело СЕ9.1 испытывали также на человеке. Например, активность антитела СЕ9.1 оценивали также в испытаниях фазы 1 с разовой усиливающей дозой на пациентах с ревматоидным артритом. Эти результаты были очень многообещающими. Конкретно, приблизительно половина пациентов, которым вводили дозу, обнаружили по меньшей мере 30%-ное улучшение в их болезненных суставах (в баллах), причем показатели профиля неблагоприятных эффектов были чрезвычайно мягкими. Кроме того, как обсуждалось supra, хотя первоначально предполагали, что СЕ9.1 должно быть истощающим, на самом деле это антитело проявляло только частичное и временное истощение при разовом введении. Частичная неистощающая природа этого антитела может быть благоприятной, поскольку в ряде исследований на животных сообщалось, что истощение CD4+ Т-клеток, по-видимому, не является необходимым для эффективности моноклональных антител против CD4 (см. Carteron et.al.. Induction of Immune Tolerance During Administration of Monoclonal Antibody to L3 T4 Does not Depend on L3 T4+ Cells, Underlying Journal of Immunology, 140:713-716 (1988); Carteron et al, F(ab')2 Anti-CD4 and Intact Anti-CD4 Monoclonal Antibodies Inhibit the Accumulation of CD4+ T-Cells, CD8+ Т Cells and ВТ Т Cells and В Cells in the Kidneys of Lupus-Prone NZB/NZW Mice, Clinical Immunology Immunopathology, 56:373-383 (1990)). Таким образом, это антитело может функционировать подобно классическому антагонисту рецептора i) путем взаимодействия CD4 с его противорецептором МНС II или ii) путем вызывания модуляции CD4 из клеточной поверхности. При этих условиях ответы CD4+ Т-клеток, которые требуют участия рецептора CD4, были бы ослаблены или ингибированы. Тот факт, что обсуждаемое антитело СЕ9.1, по-видимому, проявляет низкую истощающую клетки активность в случае человека, является благоприятным, поскольку это может улучшить безопасность, может устранить необходимость частого мониторинга числа CD4+ клеток и может также улучшить эффективность.
Антитело СЕ9.1 было сконструировано для уменьшения количеств CD4+ клеток in vivo через Fc-рецептор и механизмы связывания комплемента. Исследования на шимпанзе показывают, что СЕ9.1 вызывает частичное истощение CD4+ клеток, и первоначальные результаты показывают, что истощение клеток у человека сильно уменьшено в сравнении с другими известными mAb против CD4. Однако желательно также получать антитела, которые лишены истощающей активности.
Применимость "неистощающих" mAb против CD4 должна улучшаться, поскольку:
i) истощение CD4+ клеток не требуется для эффективности mAb против CD4;
ii) отсутствие истощения CD4+ клеток должно увеличивать их безопасность;
iii) более высокая безопасность позволяет использовать тАЬ раньше в процессе заболевания;
iv) отсутствие истощения CD4+ клеток должно улучшать эффективность и
v) отсутствие истощения CD4+ клеток будет устранять или уменьшать необходимость частого мониторинга числа CD4+ клеток, что увеличивает материальную выгоду и уменьшает стоимость всего лечения.
Это подтверждается тем фактом, что в ряде моделей животных было показано, что истощение CD4+ Т-клеток не требовалось для эффективности mAb против CD4. Таким образом, неистощающиеся mAb против CD4 должны функционировать подобно классическому антагонисту рецептора путем:
i) ингибирования взаимодействия CD4 с его противорецептором МНС II,
ii) индуцирования модуляции CD4 из клеточной поверхности или
iii) индуцирования Т-клеточной анергии и/или апоптоза.
В результате этого ответы CD4+ Т-клеток, которые требуют участия рецептора CD4, будут изменены или ингибированы.
Как правило, Т-клеточные ответы, запускаемые сильными или высокоаффинными антигенами, по-видимому, не зависят от CD4-корецепторных функций и, следовательно, не должны эффективно ингибироваться mAb против CD4. Напротив, Т-клеточные ответы на слабые антигены (такие как аутоантигены) требуют CD4-кopeцeптopнoй функции и, следовательно, должны ингибироваться mАb против CD4. Обычно сильно аутореактивные Т-клетки (Т-клетки с высокой аффинностью TCR в отношении аутоантигенов) удаляются в тимусе "клональным истощением" и, следовательно, никогда не появляются на периферии. В противоположность этому, Т-клетки, которые запускают аутоиммунный ответ, считаются слабо аутореактивными клетками, которые избежали нормальных механизмов периферической толерантности. Такие клетки зависят от участия корецепторов, таких как CD4, для полного развития ответной реакции. Таким образом, ингибирование корецепторов будет лишать эти Т-клетки решающих функций передачи сигнала, что будет приводить к частичной активации или анергии. Также, как отмечено выше, желательно, кроме того, получение химерных антител, специфических в отношении CD4, обладающих большей стабильностью (большим полупериодом существования in vivo).
С этой целью были синтезированы различные химерные антитела, которые содержат константный домен гамма 4 человека. Этот домен был выбран потому, что он, по-видимому, не связывает комплемент человека или FCγ1-рецепторы. Следовательно, была высказана гипотеза, что химерные антитела, содержащие этот константный домен, будут лишены или почти лишены истощающей Т-клетки активности. Были сконструированы также несколько химерных антител, которые содержат модификации константного домена гамма 4. В частности, некоторые из них содержат "Е"-модификацию, описанную Duncan et al., Nature, 332:563-564 (1988) и Winter et al., Wo 88/07089 (1988), причем эта модификация, как было описано, уменьшала связывание комплемента и FCγl-рецептора. Эта модификация содержит замену лейцин-глутаминовая кислота в положении 236 (248 согласно нумерации Kabat) для уменьшения остаточного связывания Fc-рецептора. Некоторые химерные антитела содержат также "P"-модификацию, описанную Angal et al., Mol. Iminunol., 30:105-8 (1993). Эта модификация, которая содержит замену серин-пролин в положении 229 (241 согласно нумерации Kabat), усиливает стабильность (полупериод существования в сыворотке) путем стабилизации дисульфидных связей между тяжелыми цепями и, как было сообщено, увеличивает улучшенное тканевое распределение по сравнению с химерным IgG4, не имеющим этой модификации.
Более конкретно, целью разработки СЕ9γ4 были отмена фиксации комплемента и уменьшение FcR-связывающих активностей. Это антитело отличается от СЕ9.1 тем, что оно содержит константный домен гамма 4 иммуноглобулина человека (а не гамма 1). Однако, хотя это было желательно, результат не имел рутинного или предсказуемого характера. В самом деле, данные заявители нашли, что химерные антитела, содержащие немодифицированное антитело γ9, имели такое же связывание Fc-рецептора, что и антитело γ2. В противоположность этому, целью конструирования СЕ9γ4λК было увеличение продуктивности конструкции γ4. Это антитело отличается от СЕ9.1 тем, что оно содержит легкую каппа-цепь иммуноглобулина человека, а не лямбда-цепь. Оценка СЕ9γ4 in vitro при помощи анализа связывания Fc-рецептора, который измеряет связывание антитела со стимулированными моноцитами и линиями моноцитарных клеток, показал, что СЕ9γ4 все еще обладал значительной активностью связывания Fc-рецептора. Кроме того, в этой системе анализа связывание СЕ9γ4 было неотличимо от СЕ9.1 (гамма 1). Поэтому целью приготовления СЕ9γЕ была полная отмена всего остаточного связывания FcR, превышающая это свойство химерных антител, содержащих немодифицированную гамма 4-цепь. СЕ9γЕ содержит константный домен гамма 4, модифицированный в одном сайте (Е-модификацию). Наконец, целью приготовления СЕ9γ4РЕ было увеличение стабильности по сравнению с химерными антителами, содержащими немодифицированную γ4-цепь или мутацию в одном сайте (Е-модификацию). Это антитело содержит константный домен гамма 4, модифицированный в двух сайтах (Р- и Е-модификацию).
Как обсуждалось выше, константный домен γ4 человека был выбран как изотип для отмены эффекторных функций, т.е. реактивности с Fcγ-рецепторами или Clq, и отсутствия истощения CD4+ клеток in vivo. Эти четыре кандидата были выбраны и экспрессированы в клетках СНО.
Два из этих моноклональных антител-кандидатов были отобраны для более интенсивного исследования, т.е., СЕ9γ4Е и СЕ9γ4РЕ. Как отмечалось, оба они содержат замену глутаминовой кислоты в районе СН2, введенную для элиминации остаточного FcR-связывания, связанного с константным районом γ4. Кроме того, СЕ9γ4РЕ содержит замену пролина в шарнирном районе, предназначенную для усиления стабильности взаимодействия дисульфидных связей тяжелой цепи.
Было обнаружено, что эти антитела не отличаются по их аффинности в отношении CD4, молекулярной массе, стабильности к денатурации нагреванием, супрессии СКЛ, отсутствию связывания с FcR и отсутствию активности в ADCC и CDC. Таким образом, оба эти антитела показывают in vitro критерий высокой аффинности mAb против CD4 при отсутствии эффекторных функций FcR и комплемента.
Свойства СЕ9.1 и СЕ9γ4РЕ сравниваются в таблице 1. Пониженное связывание Fc-рецептора отмечается в том случае, если химерные антитела связываются с Fc-рецептором менее, чем 1 γ1-содержащие химерные антитела, с понижением приблизительно на 30-80% в сравнении с ними и, наиболее предпочтительно, с полной отменой связывания. Однако, как видно из представленных результатов с немодифицированным гамма 4 химерным антителом, желаемый результат не имел предсказуемого характера.
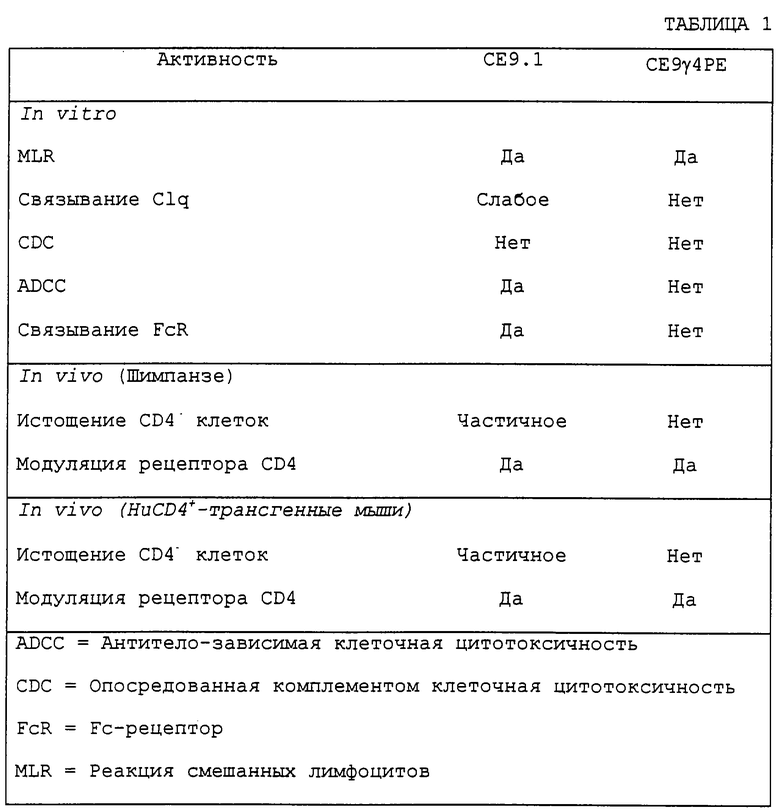
Таким образом, эти результаты подтверждают, что в соответствии с данным изобретением могут быть получены химерные антитела, которые связывают CD4 человека, которые лишены определенных эффекторных функций благодаря выбору специфических последовательностей константного домена.
При использовании приведенных в качестве примеров химерных антител против CD4 или других химерных антител, полученных в соответствии с данным изобретением, в качестве иммуносупрессоров или модуляторов CD4 для лечения аутоиммунных нарушений, в том числе, например, ревматоидного артрита, такие антитела могут вводиться индивидуально или в сочетании с другими соединениями, пригодными для лечения конкретного патологического состояния. Например, рассматриваемое антитело может вводиться в сочетании с другими белками, например, такими как растворимые рецепторные белки моноклонального антитела к TNF-α, моноклональные антитела к рецептору IL-2, моноклональные антитела и рецепторные слитые белки, которые являются антагонистами взаимодействия CD40/gp39 и CTLA 4-Ig в моноклональных антителах, которые являются антагонистами взаимодействия B7/CD28. Также, в случае лечения ревматоидного артрита рассматриваемое антитело может вводиться в сочетании с другими терапевтическими средствами, например, Рапамицином, Лефлуномидом, Тенидапом, RS-61443 (Mycophenolate Mofetil), Суренилом (Гиалуронатом натрия), анти-TCR (Vβl7)-пептидной вакциной, Anerva Х (вакциной против МНС) и иммуноабсорбентами экстракорпореального протеина А или их сочетаниями. Кроме того, обсуждаемое антитело может вводиться в сочетании с другими антителами, полученными в соответствии с данным изобретением или известными в данной области как специфические в отношении CD4. Это может приводить к синергическим эффектам, например, если эти антитела связываются с разными эпитопами белка CD4.
Для дополнительного описания данного изобретения представлены следующие примеры.
ПРИМЕР 1
КЛОНИРОВАНИЕ И ЭКСПРЕССИЯ ХИМЕРНОГО "ОБЕЗЬЯНА/ЧЕЛОВЕК" АНТИТЕЛА, СПЕЦИФИЧЕСКОГО В ОТНОШЕНИИ CD4
Далее приведен характерный пример способов и антител данного изобретения.
Получение иммортализованных линий В-клеток обезьяны
Взрослую обезьяну cynomolgus (White Sands New Mexico Primate Center) иммунизировали внутримышечно в многочисленных местах 150-300 мкг растворимого CD4 (sCD4) или клеточными мембранами (1×108 клеток) из CD4+-клeтoчнoй линии SupT1 с использованием стандартного адъюванта. Иммунизацию повторяли каждые 2-3 недели, всего шесть раз. Бустерную инъекцию обезьяны выполняли с использованием 100 мкг sCD4 в паховый участок одного бедра и спустя одну неделю дренирующий лимфатический узел из того же бедра извлекали хирургическим путем. Лимфоциты извлекали из лимфатического узла разрезанием ткани и промыванием стерильной средой ДМЕМ. Суспензию клеток пропускали через найлоновую марлю и собирали центрифугированием при 1000×g в течение 10 минут.
Приблизительно 1×108 лимфоцитов суспендировали в буфере Трис-хлорид аммония (16 мМ, рН 7,5) и нагревали до 37°С в течение 5 минут для лизиса эритроцитов. Лимфоциты собирали центрифугированием и ресуспендировали в L-лейцин-метиловом эфире (ЛМЭ) и инкубировали при 37°С в течение 45 минут. Обработанные ЛМЭ клетки фильтровали через найлоновую марлю и центрифугировали. Добавляли 1 мл фетальной телячьей сыворотки, клетки суспендировали и промывали дважды в бессывороточной среде RPMI. Клетки считали и смешивали в одной конической центрифужной пробирке вместе с равным количеством гетеромиеломных клеток К6Н6/В5, предварительно промытых дважды в бессывороточной среде. Клетки осторожно суспендировали в 1 мл 50% ПЭГ (полиэтиленгликоле), добавляемом медленно с осторожным перемешиванием на протяжении периода 1 мин. Затем клетки ресуспендировали добавлением 20 мл бессывороточной среды на протяжении 5-минутного периода с мягким перемешиванием для разведения ПЭГ. После промывания дважды бессывороточной средой клетки ресуспендировали при концентрации 5×105/0,1 мл в среде RPMI, содержащей 20% фетальную телячью сыворотку и гентамицин, и помещали в 96-луночные микропланшеты для культуры ткани при 0,1 мл на лунку. В каждую лунку добавляли равный объем ГАТ-среды (0,1 мл) и гибридам давали расти в течение 14-17 дней перед скринингом.
Скрининг слитых клеточных гибридов для получения антител против CD4
Анализ для определения специфичности против CD4 был следующим: планшеты ELISA покрывали рекомбинантным sCD4 при концентрации 100 нг на лунку и блокировали 1% бычьим сывороточным альбумином в ЗФР. Аликвоты 50 мкл гибридомного супернатанта извлекали из каждой лунки и давали инкубироваться с покрытыми sCD4 планшетами в течение 60 минут. Связывание обнаруживали инкубированием с 125I-мечеными козьими антителами против человеческого Ig или козьими антителами против обезьяньего Ig в течение 60 минут. После промывания 4 раза дистиллированной водой лунки просчитывали в гамма-счетчике. Позитивные лунки повторно анализировали в двух повторностях и гибридомные клетки из этих лунок субклонировали три раза, сначала при 5 клетках на лунку, затем дважды с 1 клеткой на лунку. На этой стадии позитивные антитела против sCD4 подвергали скринингу на способность связывания с CD4 поверхности клеток. Это выполняли путем ингибирования связывания мышиных моноклональных антител против CD4, названных 1F3, с CD4-позитивной клеточной линией SupTl. Вкратце, это выполняли коинкубированием различных количеств обезьяньих антител против CD4 и 10 мкг 125I-меченых антител 1F3 с 3×105 клеток SupTl на лунку в 96-луночном планшете. После инкубирования в течение 1 часа при комнатной температуре (~20-25°С) клетки удаляли при помощи вакуума на фильтры из стекловолокна. После интенсивного промывания ЗФР фильтры считали в гамма-счетчике для определения ингибирования связывания 1F3 с клетками SupTl супернатантами гибридом обезьяны.
Выбирали клон-кандидат, который продуцировал антитела, которые показали сильное ингибирование против 1F3. Этот клон изотипировали при помощи реагентов для изотипирования человека и обнаружили, что он представляет собой IgG2, имеющий легкую лямбда-цепь. Эту клеточную линию выращивали до больших количеств клеток для клонирования ее генов иммуноглобулина.
Клонирование генов вариабельных доменов тяжелой и легкой цепей из обезьяньих иммортализованных В-клеток
Тотальную РНК выделяли из 1×107 иммортализованных клеток обезьяны с применением гуанидиний-изоцианатного способа. Одну десятую тотальной РНК использовали для получения одноцепочечной кДНК с применением олиго-dТ-олигонуклеотидного праймера и обратной транскриптазы. Одну десятую количества одноцепочечной кДНК использовали для проведения реакций ПЦР. Каждая из шести реакций ПЦР включала в себя один из шести 5' специфических для Vн-семейства олигонуклеотидных праймеров, содержащих сайт рестрикции SalI, вместе с 3' олигонуклеотидом константного района IgG, содержащим сайт NheI, оба показаны на фиг.7-1. Подобным образом, проводили пять реакций ПЦР, использующих один из пяти 5' олигонуклеотидных праймеров лидерной последовательности лямбда, содержащих сайт BglII, и 3' олигонуклеотидный праймер константного района лямбда, содержащий сайт AvrII. Условия реакции соответствовали описанным выше. Каждую из ПЦР-реакций проводили в трех повторностях. Продукты каждой из реакций амплификации тяжелой цепи и легкой цепи разделяли на 1,2% агарозных гелях. Праймер VH4 тяжелой цепи (5'-ACTAAGTCGACATGAAACACCTGTGGTTCTT-3') и лямбда-праймер (5'-ATCACAGATCTCTCACCATGACCTGCTCCCCTCTCCTCC-3') дали сильновыраженные полосы при электрофорезе на агарозных гелях. Продукты этих реакций использовали для клонирования в вектор ТСАЕ6, который содержит последовательности IgG1 человека и константного домена лямбда-цепи человека.
Клонирование генов двух вариабельных областей в эксперессирующий вектор ТСАЕ6 выполняли последовательно. Сначала продукт ПЦР тяжелой цепи и вектор ТСАЕ6 расщепляли рестриктазами SalI и NheI, продукты экстрагировали смесью фенол/хлороформ и пропускали через spin-колонку Сефадекса G-25.
ПЦР-продукт лигировали с разрезанным вектором в течение ночи при 14°С в присутствии ДНК-лигазы Т4. Приблизительно 500 нг общей ДНК лигировали в объеме 10 мкл с отношением вставка/вектор 10:1. Лигированный материал использовали для трансформации компетентных клеток XL-1 Blue (Stratagene) и трансформированные клетки высевали на чашки с агаром, содержащие 50 мкг/мл ампициллина. Колонии ампициллин-резистентных бактерий выскребали и выращивали в виде миникультур по 5 мл. Плазмидную ДНК экстрагировали из каждой из этих культур стандартным способом щелочного лизиса, разрезали рестриктазами SalI и NheI и продукты разделяли на 1,2% агарозном геле. Плазмиды со вставками приблизительно 450 п.н. использовали в качестве матриц для последующего клонирования вариабельных областей легкой цепи. Продукты ПЦР-реакции легкой цепи, а также плазмиду, содержащую вставку тяжелой цепи, разрезали рестриктазами BglII и AvrII и лигировали вместе. Миникультуры плазмид подвергали скринингу разрезанием BglII и AvrII. Продукты расщепления, дающие вставку приблизительно 400-450 п.н., оценивали как позитивные. Плазмиды, содержащие вставки как SalI/NheI, так и BglII/AvrII, выращивали в больших количествах для секвенирования ДНК.
Тандемные экспрессирующие векторы ТСАЕ5.2 и ТСАЕ6, экспрессирующие химерное антитело, были получены из вектора CLDN, который сам является производным вектора RLDN10b (253 Science, 77-79 (1991)). RLDN10b, в свою очередь, является производным экспрессирующего вектора TND (7 DNA, 651-661 (1988)).
RLDN10b отличается от вектора TND следующими особенностями. Транскрипционную кассету дигидрофолатредуктазы (DHFR) (промотор, кДНК и район полиаденилирования) помещали между кассетой тканевого активатора плазминогена (экспрессионной кассетой ТАЛ) и кассетой фосфотрансферазы неомицина (NEO) таким образом, что все три кассеты находятся в тандеме и в одной и той же ориентации транскрипции. Кроме того, промотор гена DHFR в CLDN заменяли основным промотором мышиного бета-глобина (3 Mol. Cell Biol., 1246-54 (1983)) и кДНК ТАЛ заменяли полилинкером. Все три эукариотические транскрипционные кассеты (Экспрессионная, DHFR, NEO) можно отделить от бактериальной плазмидной ДНК (производного pUC9) расщеплением рестриктазой NotI.
CLDN отличается от RLDN10b, поскольку LTR Rous, находящийся перед полилинкером, был заменен энхансером промотора предраннего гена цитомегаловируса человека (41 Cell, 521 (1985)).
Экспрессирующие векторы ТСАЕ 5.2 и ТСАЕ 6 отличаются от CDLN тем, что:
1) Они содержат четыре транскрипционные кассеты (вместо трех) в тандемном порядке:
(a) Константную область легкой цепи иммуноглобулина человека, полученную амплификацией кДНК при помощи полимеразной цепной реакции. В ТСАЕ 5.2 это константная область легкой цепи каппа иммуноглобулина человека (согласно нумерации Kabat, аминокислоты 108-214, аллотип Кm3), а в ТСАЕ 6 это константная область легкой цепи лямбда иммуноглобулина человека (согласно нумерации Kabat, аминокислоты 108-215, генотип Oz минус, Мcg минус, аллотип Ке минус).
(b) Константную область тяжелой цепи иммуноглобулина человека; в обеих конструкциях тяжелая цепь иммуноглобулина человека была константной областью гамма 1 (согласно нумерации Kabat, аминокислоты 114-478, аллотип Gmla, Gmlz), полученной амплификацией кДНК при помощи полимеразной цепной реакции.
(c) DHFR; содержащую ее собственный эукариотический промотор и район полиаденилирования.
(d) NEO; также содержащую ее собственный эукариотический промотор и район полиаденилирования.
2) Кассеты легкой и тяжелой цепей иммуноглобулина человека содержат синтетические сигнальные последовательности для секреции цепей иммуноглобулина.
3) Кассеты легкой и тяжелой цепей иммуноглобулина человека содержат специфические ДНК-линкеры, которые позволяют встраивать вариабельные области легкой и тяжелой цепей иммуноглобулина, которые сохраняют трасляционную рамку считывания и не изменяют аминокислоты, обычно обнаруживаемые в цепях иммуноглобулина. Описанное включение этих замен привело к конструированию векторов ТСАЕ 5.2 и ТСАЕ 6. Клонирование генов вариабельных областей легкой и тяжелой цепей иммуноглобулина из анти-СD4 гетерогибридомной клеточной линии Е9.1 в ТСАЕ 6 привело к конструкции, которая была депонирована в АТСС. Эта конструкция, которая была депонирована и которая кодирует антитело СЕ9.1, содержит вариабельную область тяжелой цепи иммуноглобулина обезьяны cynomolgus и вариабельную область легкой цепи иммуноглобулина обезьяны cynomolgus, последовательности которых показаны на фиг.1 и 2, соответственно, клонированные из анти-СD4 гибридомной клеточной линии Е9.1. Константная область тяжелой цепи происходит из человека, имеет изотип гамма 1 и аллотип Gmla, Gmlz. Константная область легкой лямбда-цепи также происходит из человека, генотип Oz минус, mcg минус и аллотип Ке минус. Гены иммуноглобулина клонируют в экспрессирующий вектор млекопитающего ТСАЕ 6, описанный в упомянутых выше заявках, включенных в качестве ссылки, который при электропорации в клеточную линию млекопитающего СНО продуцировал химерное "обезьяна/человек" антитело против CD4. Конструкцию ДНК, описанную здесь, использовали для трансформации бактериального штамма XL-1 Blue, отбирали в антибиотике ампициллине и хранили в виде суспензии бактериальных клеток в стерильной среде LB, содержащей 15% глицерин.
Секвенирование ДНК
Плазмидную ДНК получали из 100 мл-культур. Ее дополнительно очищали осаждением (1 объема) смесью 2,5 М хлорида натрия и 20% полиэтиленгликоля (6 объемов) на льду в течение 15 минут. После центрифугирования при 10000×g в течение 20 минут осадок промывали 70% этанолом, повторно центрифугировали и сушили в Speedivac (Savant). Осадок ДНК ресуспендировали в деионизованной воде при концентрации 150-240 мкг/мл. Секвенирование проводили на 5 мкг двухцепочечной ДНК с применением способа Сэнгера. Использовали секвенирующие праймеры, которые были гомологичны последовательностям в экспрессирующем векторе против хода транскрипции и по ходу транскрипции от вставок легкой цепи или тяжелой цепи. Вставки секвенировали в направлениях как 5'-3', так и 3'-5'. Два клона легкой цепи иммуноглобулина против CD4 и два клона тяжелой цепи против CD4, каждый из которых был получен из отдельной ПЦР-реакции, секвенировали параллельно для определения, введены ли какие-либо нуклеотидные изменения во время ПЦР-реакции. Было обнаружено, что как выбранные клоны тяжелой цепи, так и клоны легкой цепи являются идентичными по всей их длине, что подтверждало, что во время процесса амплификации не были введены ошибки. Последовательности тяжелой и легкой цепей иммуноглобулина против CD4 показаны на фиг.1 и 2.
Экспрессия химерного "обезьяна/человек" антитела против CD4
Эксперессирующие векторы ТСАЕ 5.2 и ТСАЕ 6 могут использоваться не только для стабильной интегрированной экспрессии в линии клеток Sр2/0 и СНО, но, поскольку они включают в себя начало репликации SV40, могут также экспрессироваться временно в линии клеток COS. Экспрессию клеток COS выполняли следующим образом: клетки COS высевали за один день перед трансфекцией, так чтобы они имели конфлюентность 50-70% на следующий день. Культуральную среду удаляли и клетки промывали дважды буфером для трансфекции (ТБ-140 мМ NaCl, 25 мМ Трис, 5 мМ КСl, 0,5 мМ Na2HPO4, 1 мМ MgCl2, 1 мМ CaCl2). 30 мкг очищенной хлоридом цезия плазмиды ТСАЕ 6, содержащей тяжелую и легкую цепи иммуноглобулина химерного "обезьяна/человек" антитела против CD4, смешивали с 3 мл ДЭАЭ-декстрана на чашку (1 мг/мл в ТБ). Эту ДНК инкубировали с клетками в течение 1 часа при 37°С. Раствор ДНК удаляли и заменяли 3 мл 20% глицерина на 1,5-2,5 минут, после чего клетки дважды промывали ТБ. Клетки инкубировали в 5 мл свежей среды, содержащей 100 мкМ хлорохина, в течение 3-5 часов при 37°С, после чего их промывали дважды средой и инкубировали с нормальной ДМЕМ в течение 72 часов. Супернатант (100 мкл) от трансфицированных клеток COS анализировали при различных разведениях на присутствие антитела при помощи способа на основе ELISA. Козьи антитела против лямбда-цепи человека использовали для покрытия 96-луночных планшетов для ELISA, а также меченые пероксидазой козьи антитела против IgG человека, при стандартных условиях. Было обнаружено, что клетки COS продуцируют между 10 и 40 нг/мл химерного "обезьяна-человек" антитела. Большие объемы супернатанта концентрировали в 10 раз и использовали в радио-иммуноанализе (РИА) прямого связывания с CD4-позитивными клетками SupT1. Исходное целое антитело обезьяны и не относящийся к делу иммуноглобулин человека использовали в качестве позитивного и негативного контролей, соответственно. Кроме того, антитело обезьяны против CD4 и химерное "обезьяна/человек" антитело против CD4 использовали для ингибирования связывания высокоаффинного мышиного антитела против CD4 (1F3). Эти результаты показали, что рекомбинантное "обезьяна/человек" антитело (АТСС № 69030) не только связывается с CD4+ клетками, но и способно ингибировать связывание 1F3 с CD4+ клетками в приблизительно одинаковых концентрациях с концентрациями целого обезьяньего антитела или самого 1F3.
ПРИМЕР 2
Этот пример относится к функциональной характеристике in vitro CE9.1, в том числе к его действиям на пролиферацию Т-клеток и образование IL-2 в MLR, к его способности связывания Fc-рецептора и связывания комплемента и к его способности опосредовать ответы ADCC и CDC. Кроме того, анализировали действие in vivo на медиирование рецептора CD4 и популяцию лимфоидов в периферической крови. Проводили нижеследующие анализы. Представленные далее материалы и способ использовали в этом примере [Anderson et al, "In vitro and in vivo characterization of a primatized mAb to Human CD4: mAb causes CD4 receptor modulation but not CD4 Т cell depletion in chimpanzees"].
Материалы и способы
Молекулярное конструирование и экспрессия ПРИМАТИЗИРОВАННОГОТМ антитела против CD4
Гены вариабельной области иммуноглобулина амплифицировали при помощи ПЦР и клонировали из гетерогибридомы, полученной из обезьян, иммунизированных sCD4, как описано ранее [Newman, R.A., et al, "Primatization of recombinant antibodies for immunotherapy of human disease: a macaque/human chimeric antibody against human CD4", Biotechnology, 10:1455 (1992)]. Гены вариабельных областей тяжелой и легкой цепей вводили в кассетный экспрессирующий вектор, ТСАЕ 6, в виде тандема и экспрессировали в виде IgG1λ, после стабильной интеграции в DHFR-клетки СНО [Newman, supra]. Три цикла амплификации в увеличивающихся количествах метотрексата позволяли получить клеточные линии, которые экспрессировали уровни антител более 750 мкг/мл на протяжении 8 дней. Получали продукционную клеточную линию, которую выращивали в суспензионной культуре и прогрессивно размножали перед инокуляцией реактора с полыми волокнами [Evans et al., "Large-scale production of murine monoclonal antibodies using hollow fiber bioreactors", BioTechniques 6(8):762 (1988)].
inAb CE9.1 очищали пропусканием супернатанта культуры из реактора через колонку Prosep A (300 мл, Bioprocessing Inc.), предварительно уравновешенную забуференным фосфатом солевым раствором, рН 7,2, при скорости 125 мл/мин. Колонку промывали ЗФР до установления линии фона и связанное антитело элюировали 5 колоночными объемами смеси 0,2 М уксусная кислота/0,1 М глициновый буфер, рН 4,0. Извлечение было около 90%. Элюат доводили до рН 5,5 и пропускали через колонку Q-Sepharose (Pharmacia). СЕ9.1 связывался с этой колонкой, которую затем промывали 25 мМ Трис-HCl, рН 8,5. Антитело элюировали 50 мМ Трис-HCl, рН 6,5, содержащим 100 мМ NaCl, и концентрировали дефильтрацией (Millipore Pellicon) против изотонического солевого раствора для инъекций USP. Наконец, СЕ9.1 фильтровали через 0,04 мкм Nylon66 NDP-фильтр (Pall Filtration).
Специфичность связывания: связывание СЕ 9.1 с CD4+ клеткой SupT-18
96-луночные микротитрационные планшеты с U-дном (Corning) предварительно блокировали в течение 1 часа на льду с ЗФР, содержащим 0,2% бычий сывороточный альбумин и 0,1% азид натрия. Клетки SupT-18 (1×105), предварительно промытые тем же самым буфером, инкубировали в течение 30 минут на льду с различными концентрациями СЕ9.1 (2,4 пг/мл - 10 мкг/мл). Клетки промывали дважды и инкубировали в течение 30 минут на льду с антителом второго слоя (FITC-мечеными козьими антителами против мышиного Ig). Клетки промывали дважды, ресуспендировали в фиксирующем буфере (2% формальдегид в ЗФР) и анализировали с применением проточного цитометра FACScan (Becton Dickinson).
Специфичность связывания: анализ при помощи протекания связывания СЕ9.1 с лейкоцитами периферической крови человека
Мононуклеарные клетки выделяли из периферической крови человека при помощи стандартного способа центрифугирования с Ficoll/Hypaque [Boyum, A., "Separation of blood leukocytes, granulocytes and Lymphocytes", Tissue Antigens 4:269 (1974)]. Межфазный слой, содержащий мононуклеарные клетки периферической крови (PMNC), удаляли, промывали сбалансированным солевым раствором Хенка (HBSS) и считали. 5×106 клеток инкубировали с 20 мкл СЕ9.1 (25 мкг/мл) в течение 30 минут при 4°С. Затем клетки промывали HBSS и инкубировали с 20 мкл козьих антител против IgG человека-FITC (Fisher Scientific). После инкубирования на льду в течение дополнительных 30 минут клетки анализировали на приборе Becton Dickinson FACScan с автокомпенсацией и предварительной калибровкой гранулами Calibrite. Популяции жизнеспособных лимфоцитов идентифицировали при помощи прибора для определения рассеяния света (forward vs. right angle light scatter) и общую популяцию лимфоцитов выделяли путем отделения всех других результатов. Последующие измерения флуоресценции отражали только результаты отделенных лимфоцитов. mAb использовали для определения количества двойным способом окрашенных клеток и последующие исследования на крови шимпанзе включали антитела против CD3 человека (Leu-4-FITC; Becton Dickinson); конъюгированные с флюоресцеином антитела против CDS человека (Leu-2a-FITC; Becton Dickinson); конъюгированные с фикоэритрином антитела против CD8 человека (Leu-2a-PE; Becton Dickinson); конъюгированные с фикоэритрином антитела против CD20 человека (Leu-16-PE; Becton Dickinson); конъюгированные с флюоресцеином козьи антитела против F(ab')2 человеческого IgG (Cappel) и конъюгированные с фикоэритрином мышиные антитела против CD4 (ОКТ4; Ortho Pharmaceuticals).
Перекрестная реактивность с тканями человека
СЕ9.1 оценивали на перекрестную реактивность на тканях здорового человека. Биотинилированные СЕ9.1 тестировали на замороженных в криостате срезах из 32 различных тканей при помощи иммунопероксидазного способа с использованием конъюгата авидина-биотина [Wilchek, M. et al, "The avidin-biotin complex in bioanalytical applications" Anal. Blochem., 171:1 (1983)]. Клетки SupT1 (CD4+) использовали в качестве позитивного контроля и клетки SB (CD4-) в качестве негативной контрольной клеточной линии. Постороннее биотинилированное химерное "мышь/человек" антитело (IgG1) использовали в качестве негативного контроля антитела.
Для большинства тканей испытывали три различных образца и реактивность с СЕ9.1 оценивали по шкале от 0 до 3+. В некоторых тканях отдельно оценивали различные структуры. Например, в печени независимо оценивали гепатоциты, желчные протоки и клетки Купфера.
Видоспецифичность
Периферическую кровь из нескольких обычных лабораторных приматов и неприматов подвергали скринингу с СЕ9.1 для идентификации возможной перекрестной реактивности CD4+ Т-клеток. Группа включала в себя шимпанзе, павианов, резусов, cynomolgus и свинохвостых макаков, крыс, мышей, кроликов и собак. Клетки крови выделяли из 1-5 мл цельной крови центрифугированием (1500 об/мин, в течение 5 минут) при 4°С и промывали ресуспендированием в равных объемах ЗФР. Процесс повторяли еще раз и клетки ресуспендировали в равном объеме фетальной телячьей сыворотки. 200 мкл суспензии клеток из каждого вида помещали в коническую центрифужную пробирку на 15 мл с 20 мкл СЕ9.1 (25 мг/мл). Антитело и клетки смешивали, помещали на лед на 30 минут и затем промывали тщательно HBSS. Затем добавляли 20 мкл козьих антител против человеческого IgG-FITC (Fisher Scientific) и пробы смешивали. После инкубирования на льду в течение дополнительных 30 минут пробы удаляли из льда и добавляли 10 мл буфера для лизиса (0,01 М бикарбонат калия, рН 7,4, содержащий 0,16 М хлорида аммония и 0,1 М ЭДТА-Na), предварительно нагретого до 37°С. Пробы инкубировали при комнатной температуре в течение 15 минут с последующим центрифугированием при 1500 об/мин, в течение 5 минут. Осадки меченых клеток фиксировали ресуспендированием в фиксирующем буфере (0,5 М хлорид натрия, содержащий 1,0% формальдегид; отфильтрованный через фильтр 0,22 мкм). Пробы анализировали на приборе FACScan Becton Dickinson, как описано выше.
Функциональный анализ in vitro: однокомпонентная и трехкомпонентная реакция смешанных лимфоцитов
Т-клетки человека или шимпанзе (1,3×105) культивировали с СЕ9.1 или без них в плоскодонных микролунках в течение семи дней с обработанными митомицином РВМС (6,0×104), полученными из постороннего донора, человека или шимпанзе, соответственно. 1 мкКи/лунку тритированного тимидина добавляли к культуре во время последних 18 часов культивирования. Микротитрационные планшеты центрифугировали, осадки клеток промывали HBSS и затем считали в жидкостном сцинтилляционном счетчике. Каждую пробу анализировали в трех повторностях.
MLR (СКЛ) проводили с использованием трех отдельных посторонних (не относящихся к делу) доноров в качестве смесей стимуляторов и респондеров. Этот протокол был взят для максимизации шансов хорошего ответа в HLA-неохарактеризованных случайных пробах крови лейкоцитарной пленки Красного креста. В этом протоколе ни одну из проб крови донора не обрабатывали митомицином С и не облучали.
Анализ адгезии клеток ТНР-1 для измерения активности связывания Fc-рецептора антителами СЕ 9.1
Этот анализ зависит от мостикового конъюгирования двух клеточных линий, одной, экспрессирующей CD4, и другой экспрессирующей Fc-рецепторы, посредством антител против CD4. Используемым экспрессирующим CD4 партнером была линия прикрепленных мышиных фибробластных клеток DAP, которую трансфицировали CD4 человека (DAP/CD4). Несущими Fc-рецептор клетками были ТНР-1. Клетки DAP/CD4 помещали в 96-луночные плоскодонные планшеты (100 мкл на лунку; 25000 клеток на лунку) и давали им прикрепляться в течение ночи. Клетки ТНР-1 ресуспендировали в 50 мл среды RPMI (1×106 клеток/мл) и индуцировали в течение 24 часов при 37°С добавлением 50 Е/мл γIFN.
γIFN-индуцированные клетки ТНР-1 нагружали calcine-ацетометоксиэфиром (САМ, Molecular Probes) следующим образом: клетки промывали наполняющим буфером (ЗФР Dulbecco с кальцием и магнием и 0,1% бычьим сывороточным альбумином) и ресуспендировали при концентрации 5×106 клеток/мл в 10 мл того же буфера. САМ (1 мг/мл в ДМСО) разбавляли (1:50) наполняющим буфером и добавляли к суспензиям клеток ТНР-1 1:1 (об/об). После инкубирования в течение 20 минут при комнатной температуре 25 мл свежего наполняющего буфера добавляли к каждым 4 мл смеси клетки/САМ и инкубировали дополнительно в течение 40 минут при комнатной температуре. Затем клетки промывали дважды наполняющим буфером и ресуспендировали при 8×106 клеток на мл. Серийные разведения СЕ9.1 в ЗФР (без кальция, магния или БСА) добавляли в лунки, содержащие CD4+ клетки DAP, и инкубировали в течение 5 минут при комнатной температуре. Затем добавляли 50 мкл нагруженной САМ суспензии клеток ТНР-1 и планшеты инкубировали при комнатной температуре в течение 1 часа в темноте. Контрольные лунки без клеток DAP также подвергали анализу. После инкубирования лунки промывали 3 раза ЗФР. После конечного промывания добавляли 100 мкл ЗФР на лунку и затем 10 мкл 20% Тритона Х-100. После помещения на шейкер на 10-15 минут планшеты прочитывали в Fluoroscan (MTX Lab systems Inc).
Анализ связывания активированных моноцитов для измерения активности связывания Fc-рецептора антителами СЕ 9.1
Анализ связывания Fc-рецептора выполняли, как описано для клеток ТНР-1 выше, за исключением следующих отличий. Моноциты получали из свежей периферической крови человека стандартным разделением с применением Ficoll/Hypaque и градиента Percoll. Моноциты стимулировали γIFN, как описано выше, но в течение 48 часов. Планшеты покрывали стимулированными моноцитами в течение 24 часов и, в этом анализе, линию CD4+ клеток SupT-18 нагружали САМ, как описано выше. Затем клетки SupT-18 добавляли в планшеты, покрытые стимулированными моноцитами, как описано выше. Основное отличие в этом анализе заключается в том, что к несущим FcR клеткам на планшете добавляли нагруженную САМ линию CD4+ клеток. В описанном выше анализе с использованием клеток ТНР-1 порядок добавления был обратным.
Связывание FcγRII-трансфицированных мышиных фибробластов
Мышиную линию фибробластных клеток (CDW32-L), которая была трансфицирована человеческим FCRH, получали из АТСС. Прямое связывание СЕ9.1 определяли инкубированием антитела в присутствии и в отсутствие sCD4. Связывание СЕ9.1 детектировали инкубированием с козьими антителами против человеческого Ig, конъюгированными с пероксидазой хрена (Southern Biotech). Fab-фрагменты СЕ 9.1 получали ферментативным расщеплением и использовали в качестве негативных контролей. Величины поглощения, полученные от СЕ9.1 (и Fab-фрагментов), прединкубированных с клетками в присутствии sCD4, вычитали из величин поглощений, полученных для этих антител в отсутствие sCD4.
Анализ ADCC (лизис клеток SupT1)
Собирали свежие гепаринизированные пробы крови человека и PMNC выделяли стандартными способами центрифугирования на Ficoll/Hypaque. Эритроциты в лейкоцитарной пленке (светлом слое кровяного сгустка) лизировали буфером с хлоридом аммония и клетки промывали дважды в сбалансированном солевом растворе Хенка. Лимфоциты периферической крови (ЛПК) стимулировали 10 единицами IL-2 на мл среды RPMI/10% фетальная телячья сыворотка FCS (ФТС) в течение 24 часов при 37°С, 5% СO2. После 24 часов ЛПК ресуспендировали в RPMI/5% FCS.
Клетки SupT1-18 (1×106) метили инкубированием с 100 мкКи 51Сr в течение 1 часа при 37°С, 5% СO2. Клетки промывали дважды RPMI/5% FCS и 1×104 клеток добавляли в каждую лунку. Три серии антитела СЕ9.1 серийно разводили 1:2 RPMI/5% FCS и аликвоты добавляли в трех повторностях к содержащим клетки SupTl-18 лункам на 30 минут при 37°С, 5% СO2. 100 мкл 1% Тритона Х-100 и 100 мкл среды использовали в качестве максимального контроля и контроля спонтанного высвобождения, соответственно. В лунки добавляли стимулированные IL-2 ЛПК (8×105 клеток). Планшеты центрифугировали в течение 3 минут при 900 об/мин и инкубировали в течение 16 часов при 37°С, 5% CO2. Супернатант из каждой лунки собирали и количество радиоактивности считали в гамма-счетчике. Анализ проводили в трех повторностях. Процент лизиса клеток определяли при помощи следующей формулы:
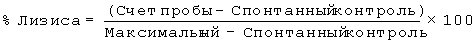
Анализ связывания Clq
Анализ Clq проводили с использованием линии CD4+ клеток SupTl-18 в суспензии 4×106 клеток на мл. СЕ 9.1 и контрольные аффинно очищенные антитела против CD4 обезьяны (50 мкл) при эквивалентных концентрациях 20 мкг/мл добавляли к 2×105 CD4+ клеткам-мишеням. Клеточную суспензию и антитела инкубировали в течение 1 часа на льду и затем промывали дважды 1% БСА в ЗФР. 50 мкл человеческого Clq (10 мкг/мл) добавляли в каждую пробирку и инкубировали в течение 1 часа на льду. Каждую пробирку промывали дважды, затем инкубировали (1 час, на льду, в темноте) с разведением 1:15 кроличьих антител против человеческого Clq-FITC (50 мкл). Клетки промывали опять дважды и фиксировали в 0,5 мл смеси 1% формальдегид/ЗФР. Клетки анализировали на проточном цитометре Becton Dickinson FACScan с использованием программного обеспечения Consort 30 для сбора и анализа данных.
Анализ опосредованной комплементом цитотоксичности
Клетки SupTl-18 (1×106) метили инкубированием со 100 мкКи 51Сr в течение 1 часа при 37°С, 5% СО2. Клетки промывали дважды RPMI/5% FCS и в каждую лунку добавляли 1×104 клеток. СЕ 9.1 и контрольные антитела против CD4 серийно разводили 1:2 RPMI/5% FCS и аликвоты 50 мкл добавляли в трех повторностях к содержащим SupTl-18 лункам. 100 мкл 1% Тритона Х-100 или 100 мкл среды добавляли к лункам для измерения максимального и спонтанного высвобождения 51Сr, соответственно. После 90 минут инкубирования при 37°С, 5% СO2 разведение 1:5 комплемента кролика (Cappel) добавляли в лунки. Планшеты инкубировали еще 90 минут при 37°С, 5% СO2 и затем центрифугировали в течение 3 минут при 900 об/мин. Супернатант из каждой лунки собирали и количество радиоактивности считали на гамма-счетчике. Процент лизиса клеток определяли при помощи следующей формулы:
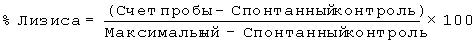
Исследования in vivo в шимпанзе
Шесть шимпанзе делили на три группы из 2 животных каждая: группа I (солевой раствор-контроль); группа II (10,0 мг/кг антитела СЕ9.1) и группа III (10,0 мг/кг антитела СЕ9.1). Животных группы II повторно обрабатывали 10 мг/кг СЕ9.1 после 30 дней, вследствие чего число их CD4+ Т-клеток возвращалось до 30% от линии фона. Животных группы III повторно обрабатывали 10,0 мг/кг после 30 дней, вследствие чего число их CD4+ Т-клеток возвращалось до 70% линии фона. Если эти величины не достигались спустя 30 дней, животных подвергали скринингу на величины CD3+, CD4+ и CD8+ Т-клеток с двухнедельными интервалами до тех пор, пока величины CD4+ Т-клеток не достигали соответствующей величины-мишени для конкретной группы. В этот момент животные опять получали 10 мг/кг антитела СЕ9.1 внутривенно до (максимально) трех доз.
Определения фона (базисной линии) числа общих лейкоцитов, величин лимфоцитов и гранулоцитов и субпопуляций CD3+, CD4+ и CD8+ лимфоцитов выполняли в 6-й день, в день 0 непосредственно перед введением дозы и снова при 24 часах и 14 днях после введения дозы. Три цикла обработки, каждый с дозами 10 мг/кг, проводили с шимпанзе в этом исследовании.
РЕЗУЛЬТАТЫ
Специфичность связывания mAb СЕ 9.1
Измерения афинности при помощи SPR на связывание СЕ9.1 с растворимым CD4 показывают Кd, 1,0 нМ (Brigham-Burke et al. North American BIAsymposium 1995 (in press)). С линиями CD4-клеток не обнаруживали связывания и исследования по ингибированию показали, что связывание с CD4+ клетками можно было полностью устранить растворимым CD4 стехиометрическим образом.
Для определения специфичности реактивности СЕ9.1, связывание со свежевыделенными РВМС человека определяли проточной цитометрией с двойным окрашиванием. Фиг.9 показывает, что 2/3 CD4+ клеток связывают СЕ9.1. В лимфоидной субпопуляции все клетки, которые связывают ОКТ4, были также позитивными в отношении СЕ9.1, тогда как CD8+ клетки все были негативными. Некоторые CD3-клетки также обнаруживали реактивность с СЕ9.1, хотя природа этой реактивности не была определена.
Иммуногистохимический анализ проводили для определения тканевой реактивности СЕ9.1, с использованием 32 различных тканей лимфоидного и нелимфоидного происхождения здорового человека. Нелимфоидные ткани включали ткани основных органов, мозга, сердца, скелетных мышц, кожи, печени, почки, железистые и репродуктивные ткани. Такой анализ не показал перекрестной реактивности с какой-либо тканью, не являющейся тканью лимфоидного происхождения, такой как лимфатические узлы, селезенка, миндалины и периферическая кровь (данные не показаны). Окрашивание, ограниченное лимфоидными агрегатами, наблюдали также в толстой кишке, легких, пищеводе и коже.
Ингибирование MLR(CKЛ) человека антителами СЕ9.1
Действие СЕ9.1 на Т-клеточные ответы (такие как образование IL-2 или пролиферативные ответы) оценивали при помощи реакции смешанной культуры лимфоцитов человека (MLR=CKЛ). Антитело СЕ9.1 ингибировало как пролиферацию, так и образование IL-1 с IC50 10-30 нг/мл и приблизительно 80% ингибированием при 60 нг/мл (фиг.10).
Активность связывания Fc-рецептора антителами СЕ9.1
Были разработаны анализы межклеточной адгезии на основе CD4 и Fc-рецептора для определения реактивности СЕ9.1 с Fc-рецепторами на моноцитах. В одном типе анализа моноциты выделяли из свежих РВМС (мононуклеарных клеток периферической крови) центрифугированием в градиенте перколла, высевали в микротитрационные планшеты и стимулировали γIFN в течение 48 часов. После 48 часов нагруженные красителем CD4+ клетки SupT1 добавляли к активированным прикрепленным моноцитам в присутствии или в отсутствие СЕ9.1. Во втором типе этого адгезионного анализа линию моноцитарных неприкрепленных клеток, ТНР-1, стимулировали γIFN. Спустя 24 часа активированные клетки ТНР-1 нагружали маркерным красителем и добавляли, в присутствии или в отсутствие СЕ9.1, к прикрепленным CD4+ фибробластным трансфектантам, которые высевали предварительно (на 24 часа ранее) в микротитрационные планшеты. В обоих случаях, межклеточная адгезия зависит от связывания mAb с CD4 на одной клетке и Fc-рецепторами на другой клетке.
Данные, представленные на фиг.10a, 10b и 10с, полученные на γIFN-активированных свежих моноцитах и CD4+ Т-клетках SupT1, показывают, что СЕ9.1 медиирует межклеточную адгезию зависимым от дозы образом, с приблизительной ED50 20 нг/мл. Адгезия была полностью ингибирована sCD4 и не медиировалась F(ab')-фрагментом СЕ9.1. Моноциты, не активированные γIFN, не могли связывать СЕ9.1 (фиг.10b). Сходные результаты получали также с тестом на основе ТНР-1 и CD4+ фибробластов (данные не приведены). Также наблюдали прямое связывание СЕ9.1 с мышиной фибробластной линией, трансфицированной рецепторами FCγRII человека (данные не приведены).
Антитело-зависимая клеточно-опосредованная цитотоксичность
Было показано, что радиоактивно меченые клетки SupT1, используемые в качестве мишеней в анализе ADCC, специфически лизировались эффекторными клетками в присутствии СЕ9.1. Максимальная цитотоксичность достигалась при ~ 6 мкг/мл с тотальным специфическим лизисом приблизительно 50% (фиг.12). В качестве позитивного контроля использовали мышиные антитела против CD4 изотипа IgG2a (4D9). Эти антитела вели себя подобно СЕ9.1, давая тот же самый уровень общего лизиса клеток. Таким образом, СЕ9.1 был очень эффективным в связывании Fc-рецепторов на эффекторных клетках и в медиировании убивания линий CD4+ клеток-мишеней.
Связывание комплемента антителом СЕ9.1
Связывание Clq измеряли проточной цитометрией, как описано выше (Материалы и способы). Как показано на фиг.13, несмотря на то, что СЕ9.1 содержало константную область тяжелой цепи человека подтипа гамма 1, оно показало только минимальное связывание Clq (фиг.13). Аффинно очищенные сывороточные антитела против CD4 обезьяны были эффективны в медиировании связывания Clq, что позволяет предположить, что отсутствие связывания Clq антителом СЕ9.1 является свойством, специфическим для этого антитела. Отсутствие связывания Clq антителом СЕ9.1 отражается в неспособности связывать комплемент (фиг.14). Аффинно очищенные антитела против CD4 из сыворотки обезьяны и мышиный моноклональный IgG2a давали значительный лизис в одном и том же диапазоне концентраций.
Видовая перекрестная реактивность СЕ9.1
Проточно-цитометрический анализ лимфоцитов из различных видов обнаружил, что только клетки шимпанзе и человека сильно связывали СЕ9.1. Павиан был единственным другим видом, показавшим слабую реактивность с СЕ9.1 (в 10 раз более низкую, чем в случае человека). Лимфоциты человека и шимпанзе реагировали одинаково хорошо с этими mAb (таблица 2). Это отражалось в сравнимом ингибировании пролиферации Т-клеток и образовании IL-2 в MLR (СКЛ) антителом СЕ9.1 (данные не показаны).
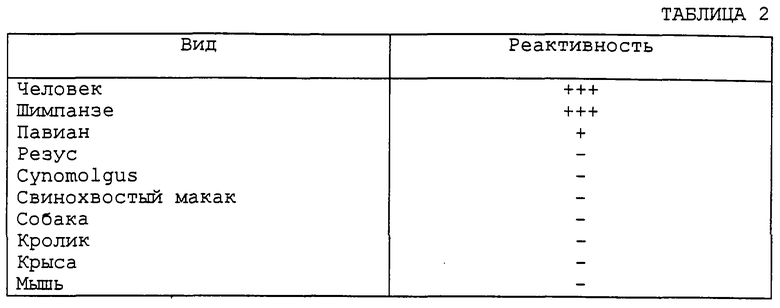
Исследования in vivo на 6 шимпанзе
На основании отсутствия истощения CD4-клеток в исследовании с усиливающей дозой на одном шимпанзе, дозу 10 мг/мл давали 4 шимпанзе (кроме того, 2 животных в контрольной группе получали солевой раствор). Как описано в Материалах и способах, группам с двумя дозами давали 10 мг/кг в день 0 исследования. Фиг.15 суммирует действия на количество CD4 и CD8 в этих животных. Можно видеть, что имелось уменьшение клеток, экспрессирующих рецептор CD4, непосредственно после введения антитела. Уменьшение количеств CD4 наблюдали только сразу после каждой вводимой дозы. Подобного изменения в количествах CD4 не наблюдали в контрольной группе, получавшей солевой раствор. Количества CD8 оставались неизмененными в ходе обработки, хотя наблюдали вариабельность в течение дня (фиг.15, левая панель, белые кружки). При исследовании популяции CD3+-CD8+ наблюдали менее существенные снижения в количествах CD4. Эти результаты предполагают появление CD3+ CD8- Т-клеток, которые могут быть результатом модуляции антигена CD4. Точный механизм модуляции неясен на этой стадии, но он может включать в себя интернализацию или выделение молекул CD4 в результате сшивания Fc-рецепторами, экспрессируемыми на других лимфоидных или моноцитарных клетках. Сравнение количеств клеток на фиг.15 показывает, что некоторое истощение CD4+ клеток может иметь место, хотя основной эффект обусловлен модуляцией рецепторов CD4. В большинстве случаев модуляторное действие, по-видимому, продолжается приблизительно 7-10 дней сразу после введения антитела, после чего экспрессия CD4 возвращается до уровней, чуть ниже фоновых.
Общие количества CD4 остаются пониженными относительно временной точки линии фона на 10-50%, но после прекращения обработки возвращаются в нормальный диапазон. Этих шимпанзе наблюдали в течение периода до 150 дней (группы 1 и 2) или 300 дней (группа 3). Количества CD4 животных группы 2 возвращались к нормальным уровням при 80 днях после конечной обработки, тогда как животные группы 3 возвращались к уровням в пределах 20% от фона за то же самое время.
ПРИМЕР 3
Этот пример описывает генетическую конструкцию экспрессирующего ДНК-вектора, используемого в клетках млекопитающих, для получения антитела СЕ9γ4РЕ, которое представляет собой "макак/человек" химерное антитело против CD4, содержащее изотип γ4 человека, включающий в себя Р- и Е-изменения.
Конструирование экспрессирующего ДНК-вектора
Ген тяжелой цепи гамма 4 человека выделяли при помощи ПЦР из клеточной линии TPIT10.4 (полученной от S. Morrison, UCLA) с применением праймеров 5' IDEC primer № 479 и 3' IDEC primer № 462 (см. фиг.16), которые содержали сайты Nhe I и ВаmН I, соответственно. Весь клонированный фрагмент гамма 4 человека секвенировали и обнаружили, что он идентичен описанному в Kabat et al. (NIH Publication Fifth Edition № 91-3242, US Dept. of Health and Human Services (1991)) (см. фиг.17). Фрагмент Nhe I/BamH I клонировали в экспрессирующий вектор Anex 2. Полные гены легкой и тяжелой цепей иммуноглобулина из этой плазмиды перемещали в другую экспрессирующую плазмиду на фрагменте Вg1 II - Sac I. Эта плазмида была названа anti-CD4 (G4, L, Oz-) в NEOSPLA3F.
ПЦР-мутагенез использовали для замены аминокислот №229 и 236 в константной области гамма 4. ПЦР проводили с применением 5' праймера GE212 (Midland) и 3' IDEC праймера №698, содержащих сайты рестрикции Nhe I и BspH I, соответственно (см. фиг.16), и этот фрагмент клонировали в плазмиду anti-CD4 (G4, L, Oz-) в состоящем из 3 частей лигировании, и эта плазмида была названа anti-CD4 (G4(PE),L Oz-) в NEOSPLA3F.
ПРИМЕР 4
ЭКСПРЕССИЯ В КЛЕТКАХ ЯИЧНИКА КИТАЙСКОГО ХОМЯЧКА
Интегрирование плазмиды и отбор на продуцирующие антитела клоны
Клетки СНО (DG44) (Uriaub et al., Som. Cell Mol. Genet., 16:555-566 (1986)) выращивали в среде CHO-S-SEM II, содержащей (GIBCO/BRL, СНО-среда), 50 мкМ Гипоксантин и 8 мкМ Тимидин (GIBCO/BRL, СНО-среда). Эта среда названа СНО-средой плюс НТ.
Проводили 5 электропораций с 4×106 клетками и 4 мкг плазмидной ДНК [Anti-CD4 (γ4 (РЕ), Lambda, OZ-) в NEOSPLA3F] с применением устройства для электропорации ВТХ 600 (ВТХ, San Diego, CA) в одноразовых кюветах на 0,4 мл. Перед электропорацией плазмиду рестриктировали Рас I, которая отделяет гены, экспрессируемые в клетках млекопитающих, от части плазмиды, используемой для выращивания этой плазмиды в бактериях. Использовали следующие условия для электропорации: 230 В, 400 мкФ, 13 Ом. Каждую электропорацию высевали в отдельный 96-луночный планшет (приблизительно 40000 клеток на лунку). В планшеты подавали СНО-среду + НТ, содержащую G418 (Geneticin, GIBCO), при 400 мкг/мл активного соединения, два дня после электропорации и после этого по мере необходимости до возникновения колоний. Супернатант от конфлюентных колоний анализировали на присутствие химерного иммуноглобулина с применением ELISA для антител человека. 28 G418-резистентных колоний появилось на пяти планшетах (из 480 лунок). G418-резистентная колония, экспрессируюшая большую часть антител, клон 5С1, был конфлюентным через 30 дней после электропорации. Блоттинг по Саузерну показал, что клон 5С1 является интергрантом единственной копии (данные не показаны). В 4-дневной культуре, при посеве 105 клеток/мл в центрифугу на 125 мл, этот клон удваивался каждые 28 часов и имел скорость образования антител 0,5 пг на клетку в день (0,9 мг/л).
Амплификация
Клон 5С1 размножали и высевали при различных концентрациях от 106 клеток/планшет до 3×104 клеток/планшет в 96-луночных планшетах, содержащих СНО-среду + 5 нМ Метотрексат (МТХб Sigma (+) Amethopterin). Спустя 20 дней клон 5С1-5В9 становился конфлюентным на планшете с концентрацией при посеве 3×105 клеток/планшет (49 из 96 лунок росли на этом планшете). Этот клон размножали. В 4-дневной культуре, посеянной при 105 клеток/мл в Т150, этот клон удваивался каждые 35,5 часов и имел темп образования антител 15,3 пг/клетку/день (18 мг/л). Клон 5С1-5В9 размножали и высевали при различных концентрациях от 100 клеток/планшет до 3×104 клеток/планшет в 96-луночные планшеты, содержащие СНО-среду + 50 нМ Метотрексат. Спустя 6 дней клон 5С1-5В9 50С1 становился приблизительно на 60% конфлюентным на планшете 105 клеток/планшет (50 из 96 лунок росло на этом планшете). Этот клон размножали.
Банки клеток для запасов Фазы I исходного посевного материала СЕ9γ4РЕ (PSS)
50 нМ МТХ PSS клон 5С1-5В9-50С1 замораживали. Клетки культивировали в центрифужном контейнере на 500 мл, содержащем СНО-среду + 50 нМ МТХ. В момент замораживания культура достигала плотности 1,1×106 клеток/мл с 96%-ной жизнеспособностью и временем удвоения 29,3 часа. Образование антител, определяемое при помощи сэндвич-ELISA, было приблизительно 27 пг/клетку/день. Клетки центрифугировали для удаления среды и помещали во флаконы при плотности 2,0×107 клеток/мл в смеси 95% JRH Biosciences фетальной телячьей сыворотки и 5% Sigma этой обычной смеси. 1 мл замороженной среды с клетками замораживали в одном флаконе. Флаконы замораживали при -70°С и на следующий день помещали в резервуар с жидким азотом.
Один из флаконов с 50 нМ МТХ PSS оттаивали и высевали в центрифужный контейнер на 100 мл, содержащий СНО-среду + 50 нМ МТХ. Спустя три дня его содержимое распределяли в 2 центрифужных контейнера на 125 мл при 2×105 клеток/мл; один контейнер, содержащий СНО-среду + 50 нМ МТХ, и другой, содержащий только СНО-среду.
Спустя три дня 15 мл этих клеток и среды из контейнера, содержащего только среду, замораживали и посылали в Tectagen for Points to Consider Mycoplasma для тестирования микоплазмы. Производственные циклы как с МТХ, так и без него продолжались в течение 8 недель. Результаты из Tectagen показали, что Anti-CD4 (gamma 4 (РЕ), Lambda, OZ-) NEOSPLA3F в СНО; исходный запас клона 5С1-5В9-50С1 (PSS) не содержал микоплазмы. Десять флаконов 50 нМ NM PSS переносили для хранения в жидкий азот.
Основной банк клеток (МСВ)
Два флакона 50 нМ МТХ PSS клона 5С1-5В9-50С1 оттаивали и высевали в центрифужную бутыль на 100 мл, содержащую СНО-среду + 50 нМ МТХ. Эту культуру размножали в течение 6 дней в прогрессивно увеличивающихся центрифужных бутылях до достижения объема 2000 мл с плотностью 9,5×05 и жизнеспособностью 98%. Клетки центрифугировали для отделения от среды и ресуспендировали при плотности 2,0×107 клеток/мл в смеси 95% JRH Biosciences Fetal Bovine Serum и 5% Sigma Hybrimax DMSO. Клеточную суспензию в среде для замораживания помещали в виде аликвот по 10 мл в каждый из 80 криофлаконов, МСВ G4PE50-M-A. Флаконы замораживали при -70°С. Спустя 24 часа этот банк клеток переносили для хранения в жидкий азот.
ПРИМЕР 5
Стабильность mAb против CD4
Физическую и химическую стабильность растворов СЕ9γ4РЕ и СЕ9γ4Е наблюдали на протяжении 3 месяцев при 5°С, 40°С и при диффузном свете при помощи электрофореза в ДСН-ПААГ (при восстанавливающих и невосстанавливающих условиях), изоэлектрофокусирования (ИЭФ), ВЖХ с обращенной фазой, гель-фильтрационной хроматографии (ГФХ) и ELISA. Первоначальное тестирование при помощи ВЖХ-ОФ и невосстанавливающего электрофореза в ДСН-ПААГ позволяло предположить, что СЕ9γ4Е состоит из двух основных видов, невосстановленной целой молекулы и нековалентно связанной молекулы, которая при условиях анализа расщепляется на две равные единицы, названные "полумономерами" ("halfmer"). Интересно, что не наблюдали больших различий в биоаналитических профилях этих двух mAb при применении гель-фильтрации, изоэлектрофокусирования, электрофореза в ДСН-ПААГ (восстановленного) и ELISA. Количество "полумономеров" в СЕ9γ4РЕ было менее 1% согласно ВЖХ-ОФ или электрофорезу в ДСН-ПААГ (невосстановленном). Фиг.18 показывает анализ при помощи электрофореза в ДСН-ПААГ мономера и "полумономера" в растворах СЕ9γ4РЕ и СЕ9γ4Е. Количество "полумономера" в СЕ9γ4Е оставалось постоянным по отношению к первоначальному тестированию на протяжении трех месяцев при любых испытанных условиях. Содержание "полумономера" в СЕ9γ4РЕ оставалось менее 2% при всех испытанных временных точках. Не наблюдали больших различий в стабильности между СЕ9γ4Е и СЕ9γ4РЕ при 5 и 40°С. Раствор СЕ9γ4Е, хранимый под диффузным светом, был слегка менее стабильным, чем СЕ9γ4РЕ. Эти данные предполагают, что "полумономер" в СЕ9γ4Е не оказывает значительного влияния на общую стабильность целой молекулы. Не наблюдали больших различий в физической стабильности растворов СЕ9γ4Е и СЕ9γ4РЕ.
Аффинность и стехиометрия mAb против CD4 согласно поверхностному плазмонному резонансу (SPR)
Стехиометрия связывания растворимого CD4 с иммобилизованными mAb может быть определена экспериментами по насыщающему связыванию на BIAcore (Pharmacia). Данные для фаз ассоциации и диссоциации прогрессирования SPR (фиг.19) анализировали непосредственно с использованием интегрированной формы уравнений скоростей, как описано в O'Shannessey et al., Anal. Biochem., 212:467-468 (1993). Суммарные данные по связыванию, выраженные в виде моль СD4/моль mAb, представлены в таблице 3. Из этих данных можно видеть, что во всех случаях стехиометрия связывания больше 1,5:1. При условии, что BIAcore является системой твердофазного взаимодействия и что протокол иммобилизации является случайным, эти результаты предполагают, что оба антигенсвязывающих сайта каждого mAb являются функциональными. Таким образом, стехиометрия связывания CD4 была одинакова для всех mAb и близка к теоретической величине 2,0. Кроме того, измерения аффинности (сродства) показывают, что аффинность является одинаковой для всех комплексов mAb, a именно ~1,0 нМ.
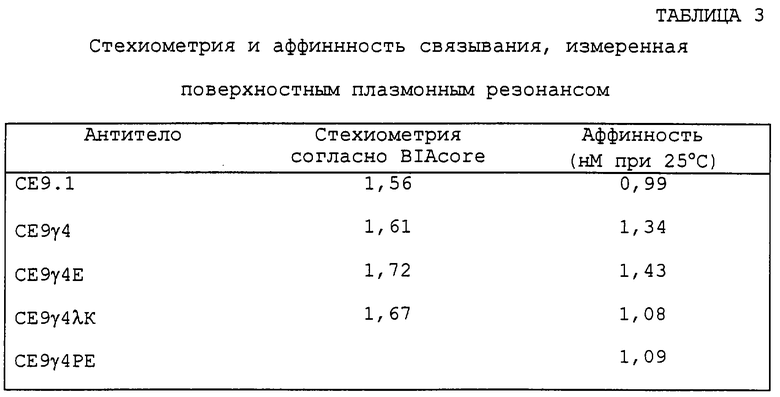
ПРИМЕР 6
БИОЛОГИЧЕСКАЯ ОЦЕНКА СЕ9γ4РЕ in vitro
Резюме
СЕ9.1, СЕ9γ4РЕ и другие производные гамма 4 сравнивали по активности, опосредованной Fab-фрагментом (при помощи MLR) и Fc-доменом (по связыванию Fc-рецептора, ADCC и CDC). Fab-зависимая активность (MLR) не различалась среди mAb, но они отличались по их способности связывания Fc-рецептора. Немодифицированное гамма 4-производное СЕ9γ4 обнаружило удивительно сильное связывание с Fc-рецепторами, но Е-мутация в СЕ9γ4Е и СЕ9γ4РЕ удаляла это связывание, а также активность в ADCC.
Влияние mАb на реакции смешанных лимфоцитов (MLR)
Тест трехкомпонентной смешанной культуры лимфоцитов (MLR) выполняли для определения влияния mAb-конструкций на индуцируемую аллоантигеном пролиферацию Т-клеток и образование IL-2. Реакции смешанных лимфоцитов (MLR) зависят от присутствия CD4+ Т-клеток, а большая доля этой реакции зависит от участия рецептора CD4 через его взаимодействие с молекулами МНС класса II на антигенпрезентирующих клетках. Реакция смешанных лимфоцитов представляет собой корреляцию in vitro аспектов отторжения трансплантата in vivo. Что касается других фармакологических агентов, MLR ингибируются также такими иммуносупрессивными агентами, как циклоспорин А.
Все mАb были равноценны в их способности ингибировать MLR согласно как пролиферативным ответам Т-клеток, так и образованию IL-2 (фиг.20 и таблица 4). Таким образом, присоединение V-доменов СЕ9.1 на структуры λ4 человека и "Р и Е" замены в шарнирной области и СН2-области не влияло на способность mAb ингибировать СD4-зависимые Т-клеточные ответы in vitro.
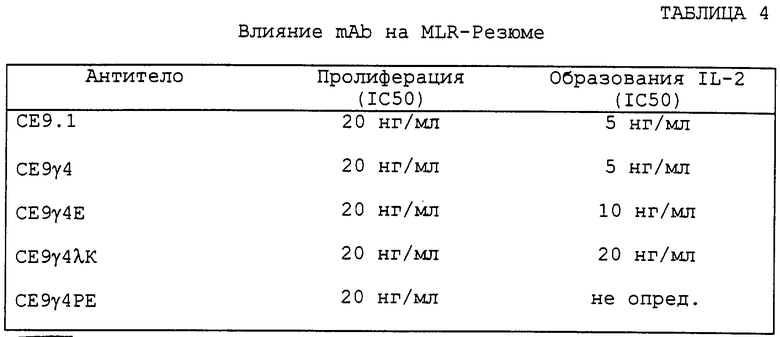
Заключение
Все mAb эквивалентны в ингибировании MLR.
Свойства связывания Fc-рецептора моноклональными антителами
Подтверждение теста определения связывания Fc-рецептора
СЕ9γ4РЕ был сконструирован таким образом, что он не имеет FcR-связывающей активности. Для измерения этой активности был разработан тест, основанный на опосредованном FcR и CD4 присоединении клеток мостиковыми связями посредством mAb. Этот тест измеряет функции связывания CD4 и FcR mAb одновременно, как корреляцию in vitro истощения СD4-клеток, опосредованного FcR и mAb, in vivo.
Фиг.21 демонстрирует, что СЕ9.1 облегчает адгезию экспрессирующих FcR моноцитарных клеток (γIFN-индуцированные клетки ТНР-1) к CD4+ фибробластам (трансфицированной CD4 линии фибробластных клеток) в адгезионном тесте. Связывание зависит от Fc-доменов mAb CE9.1, так как укороченный F(ab')2 не мог облегчать связывание. Связывание также требует сайта узнавания антигена СЕ9.1, поскольку его занятость sCD4 ингибирует межклеточное присоединение.
Определение активностей связывания Fc-рецептора mАb
Моноклональные антитела СЕ9.1 (IgG1), СЕ9γ4 (IgG4), СЕ9γ4λК (гибрид IgG4λK), СЕ9γ4Е (IgG4, Е-мутант) и СЕ9γ4РЕ (IgG4, РЕ-мутант) оценивали на их способность одновременного связывания CD4 и FcR клеточной поверхности.
Как и ожидали, СЕ9.1 обладает хорошей активностью связывания в этом тесте. Неожиданно IgG4-конструкции СЕ9γ4 и СЕ9γ4λК сохраняли достаточную аффинность в отношении FcR, так что они не отличались от СЕ9.1 в этом тесте. Активность в этом тесте была утрачена только при введении "Е"-замены с СЕ9γ4Е и СЕ9γ4РЕ (см. фиг.22).
Свойства связывания Clq in vitro антителом СЕ9γ4РЕ
Система комплемента, содержащая различные функциональные компоненты, обладает способностью взаимодействовать с некоторыми типами антител таким образом, что это взаимодействие приводит к лизису и деструкции клеток. Антитела IgG1 в норме обладают способностью связывать Clq и истощать клетки-мишени, несущие поверхностные антигены, для которых они являются специфическими. Другие изотипы антител человека, такие как IgG4, обнаруживают пониженную способность связывать Clq и, следовательно, не способны истощать клетки-мишени. Конструирование СЕ9γ4РЕ в гамма 4-конструкции теоретически должно предотвращать связывание комплемента и позволять антителу связываться с CD4-клетками-мишенями, с устранением потенциальных деструктивных побочных действий.
Сравнение CDC-эффекторных свойств СЕ9γ4РЕ и СЕ9.1 проводили при помощи классического способа опосредованного комплементом цитолиза меченых хромом CD4+ клеток SupT1 в присутствии комплемента кролика. В этих исследованиях в качестве позитивного контроля использовали мышиные связывающие комплемент mAb к HuСD4, 4D9 (IgG2a). Как CE9.1, так и СЕ9γ4РЕ были неэффективными в связывании комплемента кролика (фиг.23). Ранее отмечалось, что СЕ9.1 слабо связывает Clq и, следовательно, не способен связывать комплемент человека. Эти результаты показывают, что обе эти конструкции не способны усиливать лизис клеток через эффекторные механизмы комплемента.
In vitro АDСС-эффекторные свойства СЕ9γ4РЕ
Клетки с цитотоксическим потенциалом, которые могут связывать mAb через FcR, могут медиировать ADCC, направленную на покрытые антителами клетки-мишени. Т-хелперные клетки человека, экспрессирующие молекулу CD4, узнаются mAb CE9.1, которое запускает цитолитическую атаку несущими FcR клетками-киллерами, гранулоцитами и/или макрофагами. Целью конструирования СЕ9γ4РЕ было устранение способности mAb связываться с FcR, что исключало бы способность хелперных клеток медиировать истощение СD4-клеток-мишеней, при сохранении иммуносупрессорных свойств mAb.
Сравнение ADCC-эффекторных свойств СЕ9γ4РЕ и CE9.1 проводили с применением классического способа клеточно-опосредованного цитолиза меченых хромом CD4+ клеток SupT1. В качестве позитивного контроля выбирали мышиные mAb против CD4, 4D9 (IgG2a, К). Эффекторными клетками были лейкоциты периферической крови человека, получаемые из лейкоцитарной пленки. Фиг.12 показывает способности mАb 4D9 и СЕ9.1 медиировать специфический лизис CD4+ клеток. При одинаковых условиях СЕ9γ4РЕ имело очень небольшое действие.
Эти результаты показывают, что СЕ9γ4РЕ не способен медиировать клеточный лизис через FcR-механизм или через механизм с участием комплемента.
ПРИМЕР 7
СРАВНИТЕЛЬНЫЙ АНАЛИЗ СЕ9γ4Е И СЕ9γ4РЕ
Сравнительные фармакокинетики двух основных mAb гамма 4, СЕ9γ4Е и СЕ9γ4РЕ исследовали в самцах крыс Sprague-Dawley. СЕ9γ4Е и СЕ9γ4РЕ вводили в виде болюсной iv-дозы при 1 мг/кг (четыре животных на группу) и пробы крови брали в течение 4 недель после введения дозы. Концентрации СЕ9γ4Е и СЕ9γ4РЕ в плазме определяли при помощи sCD4/антитело против IgG человека-сэндвич-ELISA, для подтверждения не только присутствия IgG человека в кровотоке, но также способности связывать рекомбинантный растворимый CD4 человека.
После внутривенной болюсной инъекции 1 мг/кг mAb против CD4, концентрации в плазме СЕ9γ4Е уменьшались трехфазным образом, а концентрации в плазме СЕ9γ4РЕ уменьшались двухфазным образом (фиг.24). Для сравнительных целей и вследствие недостаточного количества точек данных для адекватного описания конечной фазы для СЕ9γ4Е, все временные профили концентрации в плазме анализировали при помощи двухфазной модели. Наблюдали небольшую вариабельность между животными. Преобладающая вторая фаза t1/2 была равна приблизительно 4 дням для СЕ9γ4Е и 9 дням для СЕ9γ4РЕ и составляли 67 и 93%, соответственно, общей площади под временной кривой концентрации плазмы. Видимое выведение из плазмы для СЕ9γ4РЕ было низким (6,4 мл/час/кг) и составляло примерно половину клиренса СЕ9γ4Е (1,0 мл/час/кг). Таким образом, фармакокинетические характеристики РЕ-мутанта γ4-mAb, СЕ9γ4РЕ сходны с характеристиками других "очеловеченных" γ1-mAb у крыс.
Длительные полупериоды существования в кровотоке функционально интактного СЕ9γ4РЕ в крысах также предполагает, что СЕ9γ4РЕ, по-видимому, будет эффективен на протяжении удлиненного периода времени при введении людям.
Эти результаты подтверждают, что РЕ-мутант СЕ9γ4РЕ имеет вдвое более низкий коэффициент выведения из плазмы и более продолжительный полупериод существования в организме, чем мутант СЕ9γЕ, у крыс (см. табл.5).
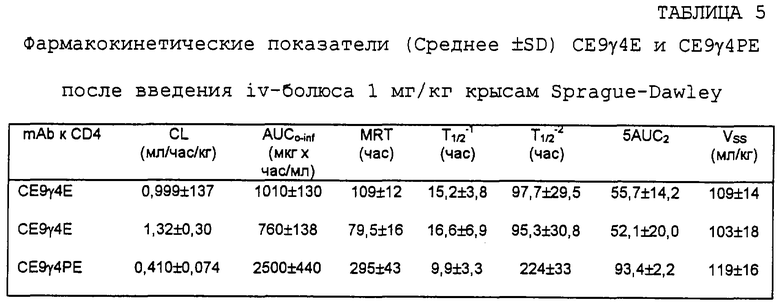
Аббревиатуры фармакокинетических показателей: CL = общий коэффициент очищения плазмы; АUCo-inf = общая площадь под кривой зависимости концентрации в плазме от времени; МRТ=среднее время пребывания в плазме; T
На основании этих результатов СЕ9γ4РЕ должен быть пригодным для терапевтического использования, например, посредством внутривенного введения. Также могут быть пригодны другие способы введения.
ПРИМЕР 8
ФАРМАКОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ in vivo НА HuCD4+-TPAHCГEHHЫX МЫШАХ
Описание HuCD4-трансгенных мышей
Введение
Высокая степень видоспецифичности СЕ9.1 и СЕ9γ4РЕ осложняет оценку эффективности in vivo. Для СЕ9.1 фармакологический ответ мог бы легко подвергаться мониторингу, в шимпанзе, через зависимое от дозы истощение CD4+ клеток. Ожидаемое отсутствие этой активности у СЕ9γ4РЕ побудило нас использовать другие средства для оценки эффективности. В частности, эффективность исследуется в HuCD4-трансгенных мышах. Исследование в этой системе описаны ниже.
HuCD4+ трансгенные мыши
В HuCD4 трансгенных мышах, полученных в UCSF (Killeen et al., EMBO J.,12:1547-53 (1003)), эндогенный ген MuCD4 разрушали гомологичной рекомбинацией и минитрансген CD4 человека вводили под контролем промотора MuCD4. В этих мышах, которые теперь были скрещены до гомозиготности, HuCD4 заменяет MuCD4.
HuCD4 восстанавливает позитивный и негативный отбор в тимусе, приводя к образованию только позитивных периферических CD4+ или CD8+ Т-клеток при уровнях, близких к обнаруживаемым в нормальных мышах. Кроме того, по сравнению с получившим генный нокаут MuCD4-родителем, зрелые MuСD4-Т-клетки демонстрируют свойства, близкие к их нормальным мышиным копиям: (1) in vivo, уровни сывороточного IgG восстанавливаются до нормальных уровней и (2) эти животные обнаруживают подходящие МНС-зависимые ответы в in vitro NMR.
Генетический фон этих мышей несколько сложен вследствие необходимости использования различных штаммов эмбриональных стволовых клеток и мышей в первоначальном генном нокауте и в трансгенных экспериментах. Мыши первоначального генного нокаута/трансгенные мыши затем скрещивались до гомозиготности в локусе МНС и используемые мыши в SB представляют собой H-2dd-гаплотип.
Результаты показали, что в этих HuСD4-мышах получен хороший ответ на чужеродный антиген, овальбумин, и первоначальные исследования продемонстрировали активность in vivo для СЕ9γ4РЕ.
Предварительная оценка СЕ9γ4РЕ в HuCD4-трансгенных мышах
Получали 12 HuСD4-трансгенных мышей (H-2dd) и использовали их для сравнения СЕ9γ4РЕ с IF3 (мышиными антителами против CD4) и GK 1.5. Мышей дозировали в дни -2, -1 и 0 внутрибрюшинно 1 мг антитела и иммунизировали овальбумином (OVA) через три часа после последней дозы. Мышей умервщляли спустя 2 недели и сыворотку и клетки оценивали на функциональную активность. Образование OVA-специфических антител показано на фиг.25. Как ожидалось, mAb к мышиному CD4 (GK 1.5) не влияли на гуморальный ответ, тогда как оба моноклональных антитела против HuСD4 ингибировали гуморальный ответ, причем СЕ9γ4РЕ был более активным из двух mAb.
Все группы мышей отвечали образованием антител на Con A и LS, однако, было некоторое различие в ответе на овальбумин и в реакции смешанных лимфоцитов (MLR). Это может быть обусловлено тем, что эта серия животных содержала как самцов, так и самок мышей и мыши были разного возраста.
Мышей MuCD4 -/- (СD4-нокаут) HuCD4 +/+ (трансгенных мышей) обрабатывали СЕ9.1, СЕ9γ4РЕ или солевым раствором. Исследование проводили на протяжении периода 28 дней, причем пробы брали в дни 1, 3, 7, 14 и 28. Трехцветный проточный цитометрический анализ спленоцитов из этих мышей использовали для прослеживания судьбы CD4+ и CD8+ Т-клеток. Для определения уровней Т-клеток использовали следующие антитела: CD3-PE, OKT4-FITC, CD8-TC. Для прослеживания судьбы Т- и В-клеток в этих мышах использовали следующие антитела: CD3-PE, CD2-FITC, CD45-TC. Для прослеживания судьбы СЕ9.1 или СЕ9γ4РЕ покрытых клеток, использовали следующий набор mAb: OKT4-PE, Leu3a-FITC, CD3-TC.
Результаты показали, что в обработанных СЕ9.1 и СЕ9γ4РЕ трансгенных мышах (HuCD4 +/+) все CD4+ клетки были покрыты антителом в день 1. Покрытие сохранялось в течение нескольких дней и уже не детектировалось в день 28. Общее число CD4+ клеток в получавших СЕ9.1 мышах значительно уменьшалось, даже в день 28. В противоположность этому обработанные СЕ9γ4РЕ мыши не обнаружили уменьшения в общем числе CD4+ клеток. Оба антитела обнаружили доказательство модуляции рецептора CD4. Хотя имелось соответственное увеличение процента CD8+ клеток в обработанных СЕ9.1 мышах, не было доказательства, что на эти абсолютные числа значимо влияла эта обработка. Также не было влияния на количества CD8+ клеток в обработанных СЕ9γ4РЕ мышах. Во всех экспериментах с любым антителом число В-клеток оставалось постоянным.
Исследования in vivo на шимпанзе
Шесть шимпанзе испытывали на истощение CD4+ Т-клеток и/или модуляцию рецептора CD4 из клеточной поверхности после инфузий увеличивающихся доз антитела СЕ9γ4РЕ до 15 мг/кг. Пробы периферической крови брали из каждого шимпанзе за три недели и за две недели до начала исследования для установления фоновых уровней для CD4+ Т-клеток. Кроме CD4+ клеток, проточной цитометрией измеряли также уровни CD3+ и CD84 клеток. В качестве контроля использовали mAb OKT4, которое связывается с отличающейся частью молекулы CD4 и не конкурирует за связывание с СЕ9γ4РЕ. Вычитанием количеств CD8+ из общих количеств CD3+ можно рассчитать теоретическую величину для количества CD4+ Т-клеток. Сравнением этой величины с числом CD4+ клеток, измеренным при помощи OKT4, модуляцию рецептора CD4 можно отличить от истощения CD4+ клеток.
В начале этого исследования каждый шимпанзе получал iv-инфузию солевого раствора. Пробы крови брали сразу же после инфузий и спустя 3 и 14 дней. СЕ9γ4РЕ (0,05 мг/кг) инфузировали в каждого шимпанзе и пробы крови брали спустя 3 и 14 дней. CD4+ клетки подвергали мониторингу и, если они были в нормальных пределах, давали следующую дозу СЕ9γ4РЕ. В целом, каждый шимпанзе имел следующую схему введения: солевой раствор, 0,05 мг/кг СЕ9γ4РЕ, 1,5 мг/кг СЕ9γ4РЕ, солевой раствор, 15 мг/кг СЕ9γ4РЕ.
После инфузий солевого раствора или СЕ9γ4РЕ при 0,05 мг/кг не наблюдали влияния на уровни CD4. При 1,5 мг/кг наблюдали CD4+ покрытые клетки и временную и частичную модуляцию рецепторов CD4 из клеточной поверхности, хотя не наблюдали истощения CD4+ клеток. При 15 мг/кг СЕ9γ4РЕ не наблюдали истощения CD4+ клеток ни в одном животном, хотя во всех животных наблюдали значимую модуляцию. Модулирующее действие было временным и возвращалось к линии фона за 14-21 дней. Ни в одном из животных не наблюдали неблагоприятного действия. СЕ9γ4РЕ можно было детектировать на клеточной поверхности до 2 дней после введения и в сыворотке.
СЕ9γ4РЕ сконструирован как неистощающее антитело и ни в одном из животных не наблюдали истощения клеток, даже при относительно высокой дозе 15 мг/кг. СЕ9γ4РЕ был стабилен в сыворотках шимпанзе и оставался в кровотоке в течение периода до 21 дня.
Применение
Антитела, получаемые, как описано выше, или равноценными способами, могут быть очищены сочетанием аффинной и гель-фильтрационной хроматографии для характеристики в функциональных биологических тестах. Эти тесты включают определение специфичности и аффинности связывания, а также эффекторной фукции, ассоциированной с экспрессируемым изотипом, например, ADCC, или фиксации комплемента. Такие антитела можно использовать в качестве пассивных или активных терапевтических агентов против ряда заболеваний человека, которые включают в себя экспрессию CD4 и Т-клетки, в том числе В-клеточной лимфомы, инфекционных заболеваний, в том числе СПИДа, аутоиммунных и воспалительных заболеваний, и трансплантации. Эти антитела можно использовать либо в их нативной форме, либо в виде части комплекса антитело/хелат, антитело/лекарственное средство или антитело/токсин. Дополнительно, целые антитела или фрагменты антител (Fab2, Fab, Fv) можно использовать в качестве реагентов для томографии или в качестве потенциальных вакцин или иммуногенов в активной иммунотерапии для генерирования антиидиотипических реакций.
Количество антитела, используемого для получения терапевтического действия, может быть определено стандартными способами, хорошо известными специалистам с обычной квалификацией в данной области. Антитела могут быть получены, как правило, стандартным способом в фармацевтически приемлемом буфере и могут вводиться любым желаемым способом. Вследствие эффективности заявляемых в настоящее время антител и их переносимости человеком можно вводить эти антитела несколько раз для борьбы с различными заболеваниями или патологическими состояниями у человека.
Рекомбинантные антитела против CD4 (или их фрагменты) данного изобретения применимы также для индукции иммуномодуляции, например, для индукции супрессии иммунной системы человека или животного. Таким образом, данное изобретение относится к способу профилактической или терапевтической индукции иммуномодуляции у человека или животного, нуждающихся в ней, путем введения эффективного нетоксичного количества антитела данного изобретения этому человеку или животному.
Способность соединений данного изобретения индуцировать иммуномодуляцию может быть показана в стандартных тестах для этой цели, например, в реакции смешанной культуры лимфоцитов или в тесте измерения ингибирования пролиферации Т-клеток, измеряемого по поглощению тимидина.
Факт, что антитела данного изобретения применимы в индуцировании иммуносупрессии, означает, что они применимы в лечении или предотвращении резистентности к трансплантированным органам или тканям или отторжения трансплантированных органов или тканей (например, почки, сердца, легкого, костного мозга, кожи, роговицы и т.д.); лечении или предотвращении аутоиммунных, воспалительных, пролиферативных и гиперпролиферативыых заболеваний и кожных проявлений иммунологически опосредованных заболеваний (например, ревматоидного артрита, красной волчанки, системной красной волчанки, тиреоидита Хашимото, множественного склероза, тяжелой псевдоастенической миастении, диабета типа 1, увеита, нефротического синдрома, псориаза, атопического дерматита, контактного дерматита и других экзематозных дерматитов, себорейных экзем, плоского лишая, пузырчатки, буллезного пемфигоида, врожденного буллезного эпидермолиза, крапивницы, болезни Квинке, васкулитов, эритемы, эозинофильных лейкоцитозов, гнездной алопеции, и т.д.); лечении обратимой обструкции дыхательных путей, воспалений кишечника и аллергий (например, болезни Coeliac, проктита, эозинофильного гастроэнтерита, мастоцитоза, болезни Крона и язвенного колита) и пищевых аллергий (например, мигрени, ринита и экземы). Рассматриваемые антитела имеют также потенциальную применимость для лечения неаутоиммунных состояний, в которых желательна иммуномодуляция, например, реакции "трансплантат против хозяина", отторжения трансплантата, астмы, ВИЧ, лейкоза, лимфомы, среди прочих.
Специалист в данной области способен, рутинным экспериментированием, определить, какое эффективное, нетоксичное количество антитела следует вводить для цели индуцирования иммуносупрессии. Как правило, однако, эффективная доза находится в пределах от приблизительно 0,05 до 100 мг/кг веса тела в день.
Антитела (или их фрагменты) данного изобретения должны быть также применимы для лечения опухолей в млекопитающем. Более конкретно, они должны быть применимы для уменьшения размера опухоли, ингибирования роста опухоли и/или пролонгирования времени выживания несущих опухоли животных. Поэтому, данное изобретение относится также к способу лечения опухолей в человеке или животном путем введения этому человеку или животному эффективного, нетоксичного количества антитела. Специалист в данной области будет способен, рутинным экспериментированием, определить, каким является эффективное, нетоксичное количество антитела для цели лечения канцерогенных опухолей. Как правило, однако, ожидается, что эффективная доза находится в пределах 0,05-100 мг/кг веса тела в день.
Антитела данного изобретения могут вводиться человеку или другому животному в соответствии с вышеупомянутыми способами лечения в количествах, достаточных для получения указанного эффекта в терапевтической или профилактической степени. Такие антитела данного изобретения могут вводиться человеку или животному в форме стандартных доз путем объединения антитела данного изобретения с общепринятым фармацевтически приемлемым носителем или разбавителем в соответствии с известными способами. Специалисту в данной области понятно, что форма и природа фармацевтически приемлемого носителя или разбавителя диктуется количеством активного ингредиента, с которым носитель должен быть объединен, способом введения и другими хорошо известными переменными.
Способ введения антитела (или его фрагмента) данного изобретения может быть пероральным, парентеральным, ингаляционным или местным. Термин "парентеральный" включает внутривенное, внутримышечное, подкожное, ректальное, вагинальное или внутрибрюшинное введение. Как правило, подкожная и внутримышечная формы парентерального введения являются предпочтительными.
Суточные схемы парентеральных или пероральных доз для применения соединений данного изобретения для профилактической или терапевтической индукции иммуносупрессии или для терапевтического лечения канцерогенных опухолей находятся, как правило, в пределах 0,05-100, но более предпочтительно ~0,5-10 мг/кг веса тела в день.
Антитело данного изобретения может также вводиться при помощи ингаляции. Под "ингаляцией" понимают введение путем интраназальной и пероральной ингаляции. Подходящие дозированные формы для такого введения, такие как аэрозольный препарат или ингалятор с отмеренными дозами, могут быть приготовлены стандартными способами. Предпочтительная доза соединения данного изобретения находится при этом в пределах ~10-100 мг.
Антитело данного изобретения может также вводиться местно. Под местным введением понимают несистемное введение и оно включает в себя нанесение антитела (или его фрагмента) данного изобретения наружно на эпидермис (кожу), в щечный карман и закапывание антитела в ухо, глаз и нос, причем такое введение не поступает в значительных количествах в кровоток. Под системным введением понимают пероральное, внутривенное, внутрибрюшинное и внутримышечное введение. Количество антитела, необходимое для терапевтического или профилактического эффекта, будет, конечно, изменяться в зависимости от выбранного антитела, характера и тяжести подлежащего лечению состояния и животного, подлежащего лечению, и, в конце концов, определяется лечащим врачом. Подходящая местная доза антитела данного изобретения, как правило, находится в пределах ~1-100 мг/кг веса тела в сутки.
Препараты
Хотя антитело или фрагмент антитела может вводиться индивидуально, предпочтительно предоставление его в виде фармацевтического препарата. Активный ингредиент может составлять, для местного применения, от 0,001% до 10% (масса/масса), например, от 1 до 2 мас.% препарата, хотя он может составлять даже 10 мас.%, но предпочтительно не превышает 5 мас.% и более предпочтительно от 0,1 до 1 мас.% препарата.
Препараты для местного применения данного изобретения содержат активный ингредиент вместе с одним или несколькими приемлемыми носителями и, необязательно, любыми другими терапевтическими ингредиентами. Носитель (носители) должен быть "приемлемым", в том смысле, что он должен быть совместим с другими ингредиентами препарата и безвредным для реципиента этого препарата.
Препараты, пригодные для местного введения, включают жидкие или полужидкие препараты, пригодные для проникновения через кожу к месту, где требуется лечение, такие как линименты, лосьоны, кремы, мази или пасты, а также капли, пригодные для введения в глаз, ухо или нос.
Капли, согласно данному изобретению, могут содержать стерильные водные или маслянистые растворы или суспензии и могут быть приготовлены растворением активного ингредиента в подходящем водном растворе бактерицидного и/или фунгицидного агента и/или другого подходящего консерванта и, предпочтительно, включают в себя поверхностно-активное вещество. Затем полученный раствор может быть осветлен фильтрованием, перенесен в подходящий контейнер, который затем герметично закрывают и стерилизуют автоклавированием или выдерживанием при 90-100°С в течение получаса. Альтернативно, раствор можно стерилизовать фильтрованием и переносить в контейнер асептическим способом. Примерами бактерицидных и фунгицидных агентов, пригодных для включения в капли, являются фенилмеркурнитрат или ацетат (0,002%), бензалконийхлорид (0,01%) и хлоргексидинацетат (0,01%). Подходящие растворители для приготовления маслянистого раствора включают глицерин, разбавленный спирт и пропиленгликоль.
Лосьоны, согласно данному изобретению, включают лосьоны, пригодные для нанесения на кожу или глаз. Глазной лосьон может содержать бактерицид и может быть приготовлен способами, сходными с описанными для приготовления капель. Лосьоны и линименты для нанесения на кожу могут также включать в себя агент для ускорения высыхания или для охлаждения кожи, такой как спирт или ацетон, и/или увлажнитель, такой как глицерин, или масло, такое как касторовое масло или арахисовое масло.
Кремы, мази или пасты, согласно данному изобретению, являются полутвердыми препаратами активного ингредиента для наружного нанесения. Они могут быть приготовлены смешиванием активного ингредиента в мелкоизмельченной или порошкообразной форме, одного или в растворе или суспензии, при помощи соответствующего оборудования, с жировой или нежировой основой. Основа может содержать углеводороды, такие как твердый, полутвердый или жидкий парафин, глицерин, пчелиный воск, металлическое мыло (мыло с минеральными солями); растительную слизь; масло природного происхождения, такое как миндальное, кукурузное, арахисовое, касторовое или оливковое масло; ланолин или его производные или жирную кислоту, такую как стеариновая или олеиновая кислота, вместе со спиртом, таким как пропиленгликоль или макроголы. Такой препарат может содержать любой подходящий поверхностно-активный компонент, такой как анионогенный, катионогенный или неионогенный поверхностно-активный агент, например, сложные эфиры сорбитана или его полиоксиэтиленовые производные. В препарат могут быть также включены суспендирующие агенты, такие как природные камеди, производные целлюлозы, или неорганические вещества, такие как кремнийсодержащие диоксиды кремния, и другие ингредиенты, такие как ланолин.
Специалисту в данной области должно быть понятно, что оптимальное количество и распределение отдельных доз антитела или его фрагмента данного изобретения будет определяться характером и степенью тяжести состояния, подлежащего лечению, формой, способом и местом введения и конкретным животным и что такие оптимумы могут быть определены стандартными способами. Специалисту в данной области должно быть также понятно, что оптимальная схема лечения, т.е. число доз антитела или его фрагмента данного изобретения, даваемое в сутки, в течение определенного числа дней, может быть определена специалистами в данной области при помощи стандартного проведения тестов определения схемы лечения.
Без дальнейшего развития объяснений, считается, что специалист в данной области может, используя предшествующее описание, применять данное изобретение в его самой полной степени. Следующие далее материалы представлены, таким образом, лишь в качестве иллюстративных примеров, а не в качестве ограничения каким-либо образом данного изобретения.
Композиция для капсул
Фармацевтическую композицию данного изобретения в форме капсулы готовят заполнением стандартной состоящей из двух частей твердой желатиновой капсулы 50 мг антитела или его фрагмента данного изобретения в форме порошка, 100 мг лактозы, 32 мг талька и 8 мг стеарата магния.
Инъецируемая парентеральная композиция
Фармацевтическую композицию данного изобретения в форме, пригодной для введения посредством инъекции, готовят смешиванием 1,5 мас.% антитела или его фрагмента данного изобретения в 10 об.% пропиленгликоле и воде. Раствор стерилизуют фильтрованием.
Композиции для мази
Антитело или его фрагмент данного изобретения 1,0 г
Белый полутвердый парафин До 100,0 г
Антитело или его фрагмент данного изобретения диспергируют в небольшом объеме носителя с получением гладкого, гомогенного продукта. Затем этой дисперсией заполняют легкосжимаемые тубы из металла.
Композиции кремов для местного нанесения
Антитело или его фрагмент данного изобретения 1,0 г
Polawax GP 200 20,0 г
Ланолин безводный 2,0 г
Белый пчелиный воск 2,5 г
Метилгидроксибензоат 0,1 г
Дистиллированная вода До 100,0 г
Полавоск, пчелиный воск и ланолин нагревают вместе при 60°С. Добавляют раствор метилгидроксибензоата и гомогенизируют перемешиванием при высокой скорости. Затем температуре дают снизиться до 50°С. Затем добавляют антитело или его фрагмент данного изобретения, диспергируют в смеси и композиции дают остыть при перемешивании при медленной скорости.
Композиция лосьона для местного применения
Антитело или его фрагмент данного изобретения 1,0 г
Монолаурат сорбитана 0,6 г
Полисорбат 20 0,6 г
Цетостеариловый спирт 1,2 г
Глицерин 6,0 г
Метилгидроксибензоат 0,2 г
Очищенная вода В.Р. До 100,00 мл
(В.Р. = Фармакопея Великобритании).
Метилгидроксибензоат и глицерин растворяют в 70 мл воды при 75°С. Монолаурат сорбитана, полисорбат 20 и цетостеариловый спирт расплавляют вместе при 74°С и добавляют к водной суспензии. Полученную эмульсию гомогенизируют, дают ей остыть при непрерывном перемешивании и антитело или его фрагмент данного изобретения добавляют в виде суспензии в оставшейся воде. Всю суспензию перемешивают до гомогенности.
Композиция для глазных капель
Антитело или его фрагмент данного изобретения 0,5 г
Метилгидроксибензоат 0,01 г
Пропилгидроксибензоат 0,04 г
Очищенная вода В.Р. До 100,00 мл
Метил- и пропилгидроксибензоаты растворяют в 70 мл очищенной воды при 75°С и полученному раствору дают остыть. Затем добавляют антитело или его фрагмент данного изобретения и раствор стерилизуют фильтрованием через мембранный фильтр (размер пор 0,022 мкм) и упаковывают асептически в подходящие стерильные контейнеры.
Композиция для введения ингаляцией
Для аэрозольного контейнера с емкостью 15-20 мл: смешайте 10 мг антитела или его фрагмента данного изобретения с 0,2-0,5% увлажнителя, такого как полисорбат 85 или олеиновая кислота, и диспергируйте эту смесь в пропелленте, таком как фреон, предпочтительно в комбинации с (1,2-дихлортетрафторэтаном) и дифторхлорметаном, и поместите в подходящий контейнер для аэрозоля, приспособленный для введения интраназальной или пероральной ингаляцией.
Композиция для введения ингаляцией для аэрозольного контейнера с емкостью 15-20 мл: растворите 10 мг антитела или его фрагмента данного изобретения в этаноле (6-8 мл), добавьте 0,1-0,2% увлажнителя, такого как полисорбат 85 или олеиновая кислота, и диспергируйте в пропелленте, таком как фреон, предпочтительно в комбинации с (1,2-дихлортетрафторэтаном) и дифторхлорметаном, и поместите в подходящий контейнер для аэрозоля, приспособленный для введения интраназальной или пероральной ингаляцией.
Антитела и фармацевтические композиции данного изобретения применимы, в частности, для парентерального введения, т.е. подкожного, внутримышечного или внутривенного введения. Композиция для парентерального введения обычно содержит раствор антитела или его фрагмента данного изобретения или их коктейль (смесь), растворенный в приемлемом носителе, предпочтительно в водном носителе. Можно применять различные водные носители, например, воду, забуференную воду, 0,4% солевой раствор, 0,3% глицин и т.п. Эти растворы являются стерильными и по существу не содержат состоящего из частиц материала. Эти растворы можно стерилизовать стандартными, хорошо известными способами стерилизации. Композиции могут содержать приемлемые вспомогательные вещества, требующиеся для приближения к физиологическим условиям, такие как корректирующие рН и буферящие агенты и т.д. Концентрация антитела или его фрагмента данного изобретения в таком фармацевтическом препарате может значительно варьировать, т.е. от менее ~0,5%, обычно при или по меньшей мере ~1%, до 15 или 20% по весу, и она выбирается первично на основе объемов жидкости, вязкости и т.д., в соответствии с выбранным конкретным способом введения.
Так, может быть приготовлена фармацевтическая композиция данного изобретения для внутримышечной инъекции, содержащая 1 мл стерильной забуференной воды и 50 мг антитела или его фрагмента данного изобретения. Подобным образом может быть приготовлена фармацевтическая композиция данного изобретения для внутривенной инфузии, содержащая 250 мл стерильного раствора Рингера и 150 мг антитела или его фрагмента данного изобретения. Современные способы приготовления вводимых парентерально композиций хорошо известны или будут очевидными для специалистов в данной области и описаны более детально, например, в Remington's Pharmaceutical Science, 15th ed., Mack Publishing Company, Easton, Pennsylvania, включ. здесь в качестве ссылки.
Антитела (или их фрагменты) данного изобретения могут быть лиофилизированы для хранения и реконституированы (воссозданы) в подходящем носителе перед использованием. Было показано, что этот способ является эффективным в случае обычных иммуноглобулинов и могут применяться известные в данной области способы лиофилизации и реконституирования.
В зависимости от предполагаемого результата, фармацевтическая композиция данного изобретения может вводиться для профилактического и/или терапевтического воздействия. В случае терапевтического применения композиции вводят пациенту, уже страдающему от заболевания, в количестве, достаточном для излечивания или по меньшей мере для частичной задержки заболевания и его осложнений. В случае профилактических применений композиции, содержащие антитела данного изобретения или их смесь, вводят пациенту, не находящемуся уже в состоянии болезни, для усиления резистентности пациента.
Разовые или многократные введения фармацевтических композиций могут проводиться с уровнями доз и схемой, выбираемыми лечащим врачом. В любом случае, фармацевтическая композиция данного изобретения должна обеспечивать количество измененных антител (или их фрагментов) данного изобретения, достаточное для эффективного лечения пациента.
Следует отметить, что антитела данного изобретения могут быть использованы для конструирования и синтеза пептидных или непептидных соединений (миметиков), которые могли бы применяться в такой же терапии, что и рассматриваемое антитело. См., например, Saragovi et al., Science, 253:792-795 (1991).
Депозит
Штамм XL1 Blue, Anti-CD4 в ТСАЕ6, который экспрессирует антитело СЕ9.1, был депонирован в АТСС под номером 69030. Этот депозит был сделан 9 июля 1992 года.
Заявителям и их правопреемникам известно, что они обязаны заменить эти культуры в случае их гибели до конца срока патента, выданного на них, спустя 5 лет после последнего запроса на культуру или спустя 30 лет, какой бы срок ни был более длительным, и они обязаны известить банк о выдаче такого патента, после чего депозит будет окончательно доступен для общественности. До этого момента депозит будет доступен Комиссару по патентам под названием 37 C.F.R. Section 1-14 35 U.S.C. Section 112.
Другие варианты находятся в прилагаемой формуле изобретения.
Список последовательностей см. в конце текста.
| название | год | авторы | номер документа |
|---|---|---|---|
| РЕКОМБИНАНТНОЕ АНТИТЕЛО, СПЕЦИФИЧНОЕ К CD4, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ПСОРИАЗА | 1992 |
|
RU2170256C2 |
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА ПРОТИВ IL-21 ЧЕЛОВЕКА | 2008 |
|
RU2504552C2 |
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА К РЕЦЕПТОРУ 2 ФАКТОРА РОСТА ФИБРОБЛАСТОВ | 2009 |
|
RU2546254C9 |
| АНТИТЕЛА, ОБЛАДАЮЩИЕ СПЕЦИФИЧНОСТЬЮ К BTN2, И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2794996C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА К Toll-ПОДОБНЫМ РЕЦЕПТОРАМ 2 И ИХ ПРИМЕНЕНИЯ | 2010 |
|
RU2563344C2 |
| АНТИТЕЛА ПРОТИВ ИНТЕРФЕРОНА-АЛЬФА | 2002 |
|
RU2314317C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ ДЛЯ ЛЕЧЕНИЯ АУТОИММУННЫХ ЗАБОЛЕВАНИЙ С ИСПОЛЬЗОВАНИЕМ КОМБИНАЦИИ ЭЛИМИНИРУЮЩЕГО В-КЛЕТКИ/ИММУНОРЕГУЛЯТОРНОГО АНТИТЕЛ | 2001 |
|
RU2285541C2 |
| АНТИТЕЛА ПРОТИВ МИЕЛИН-АССОЦИИРОВАННОГО ГЛИКОПРОТЕИНА (MAG) | 2003 |
|
RU2303461C9 |
| ИНТЕРЛЕЙКИН-13-СВЯЗЫВАЮЩИЕ БЕЛКИ | 2012 |
|
RU2605327C2 |
| АНТИТЕЛА ПРОТИВ IL2 | 2006 |
|
RU2425054C2 |




















































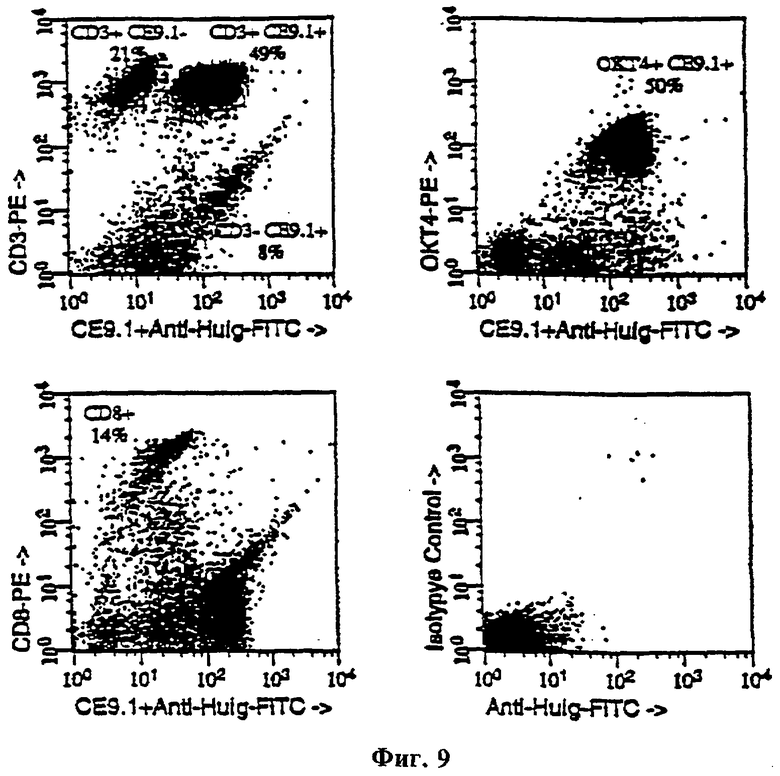
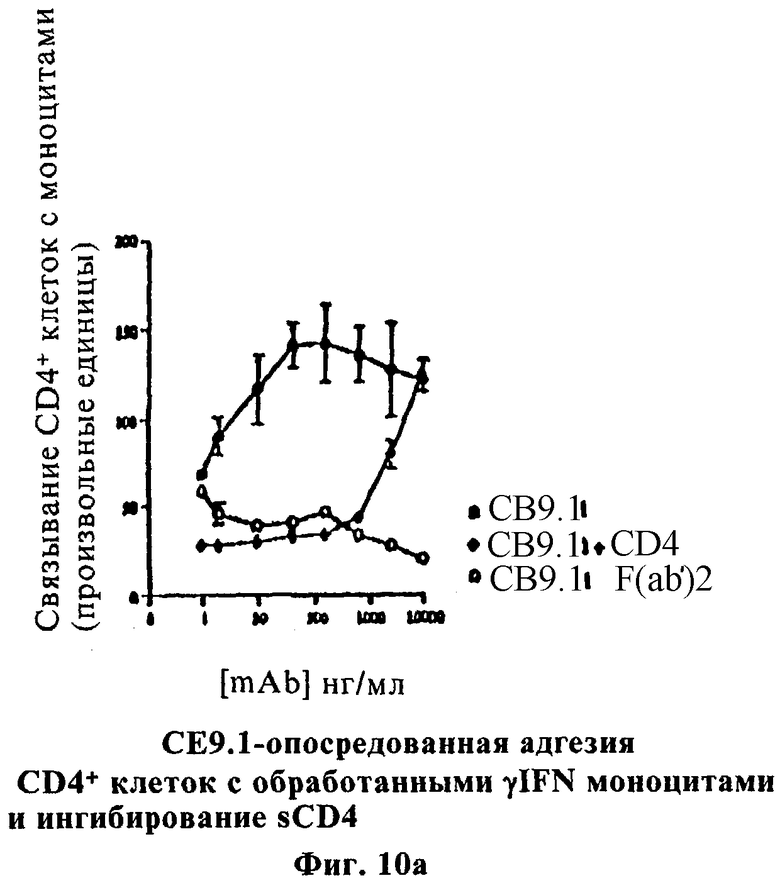
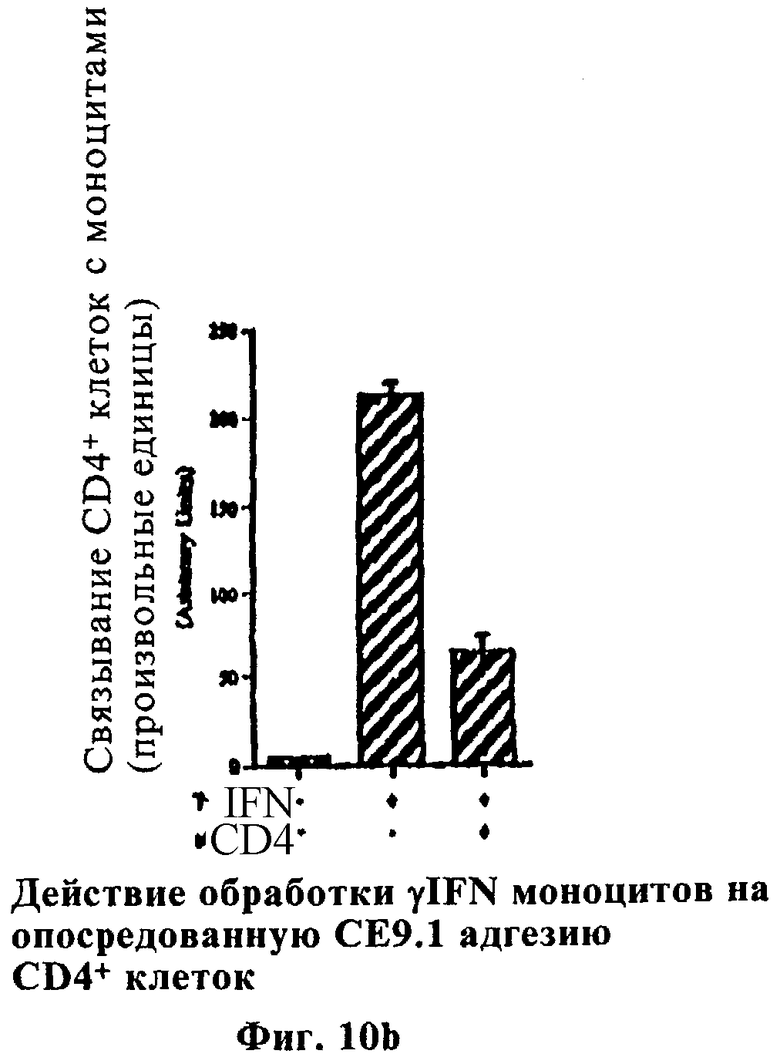
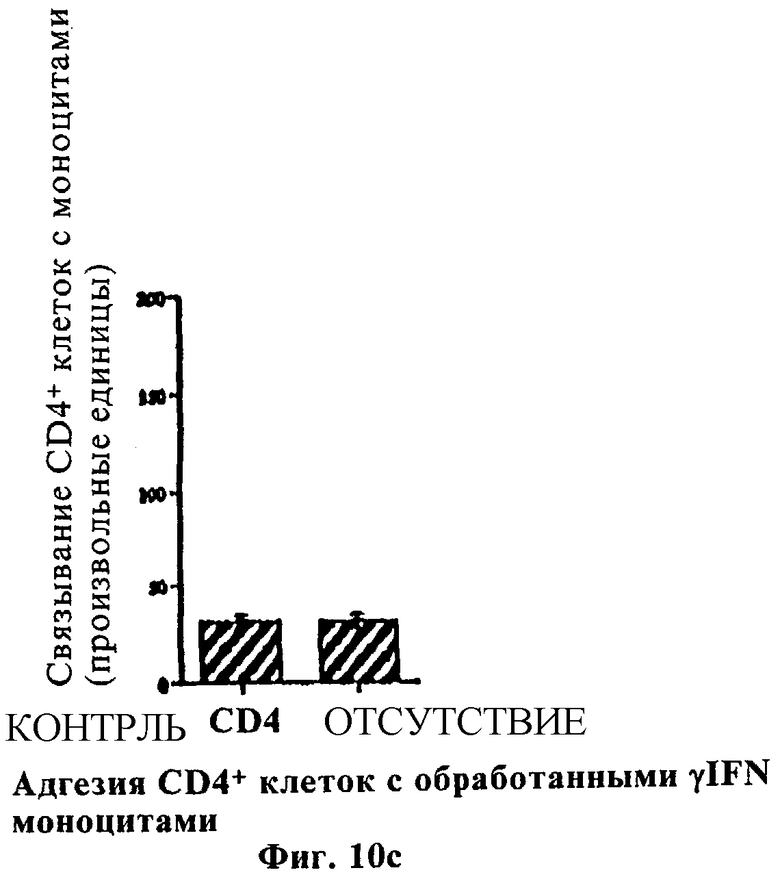
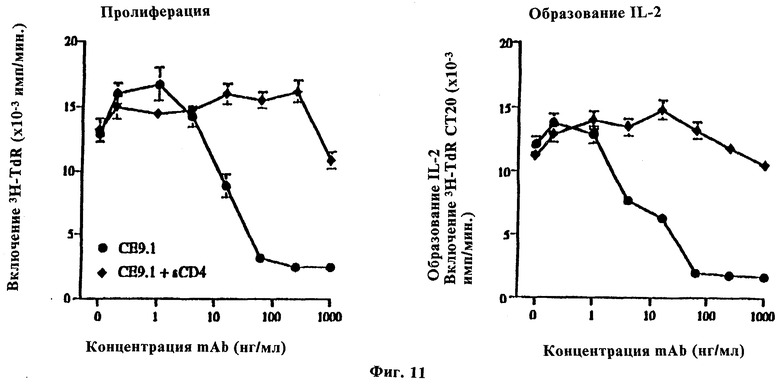
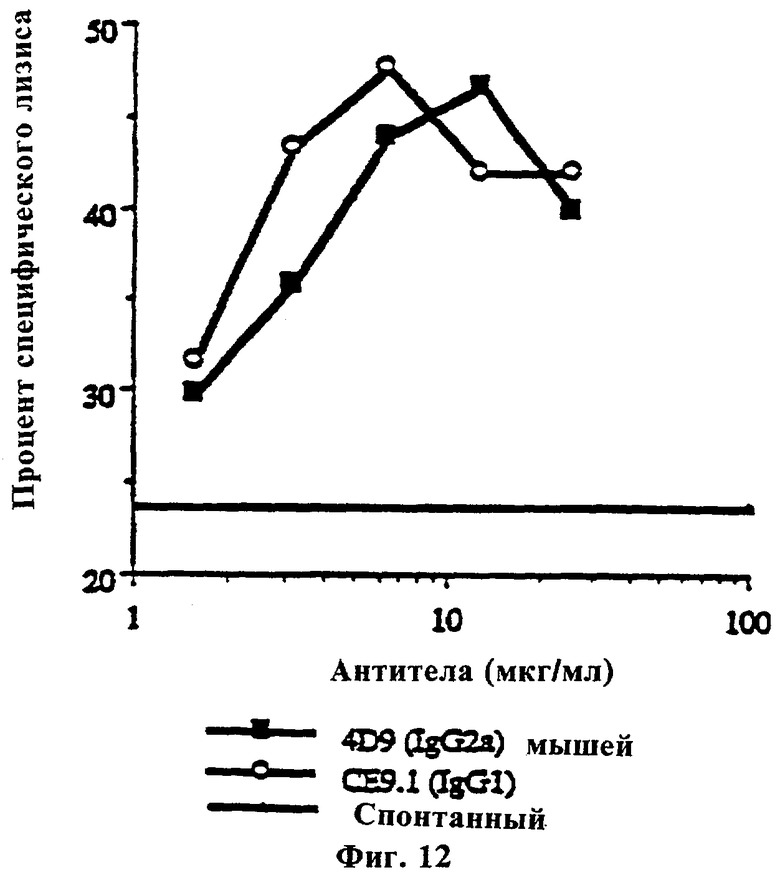
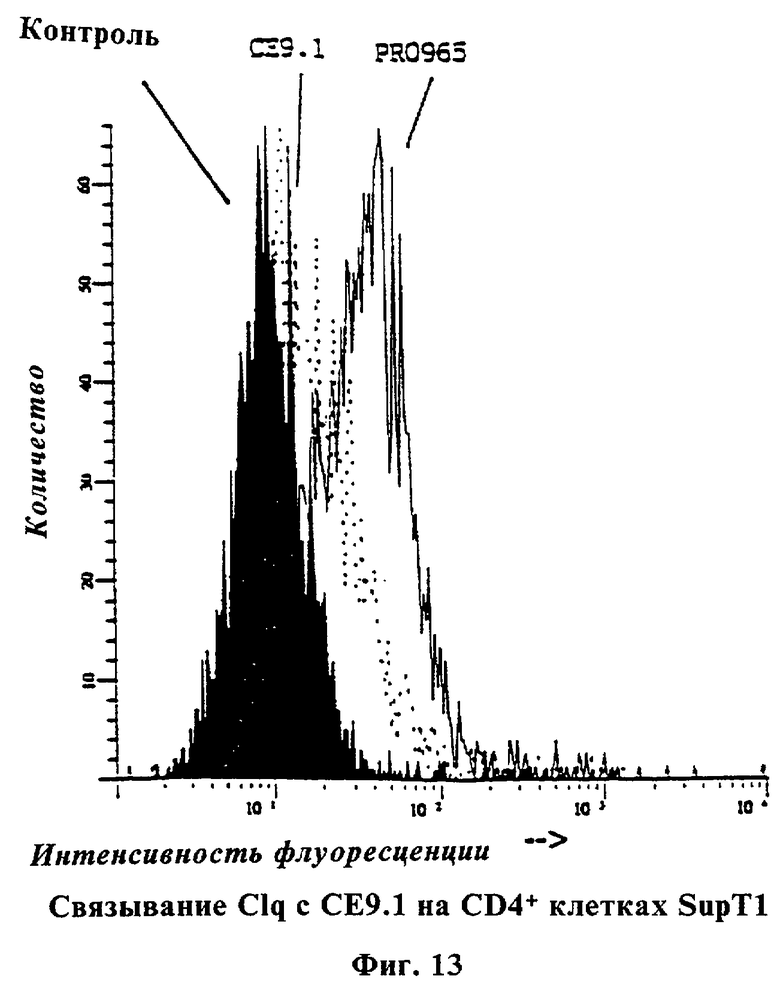
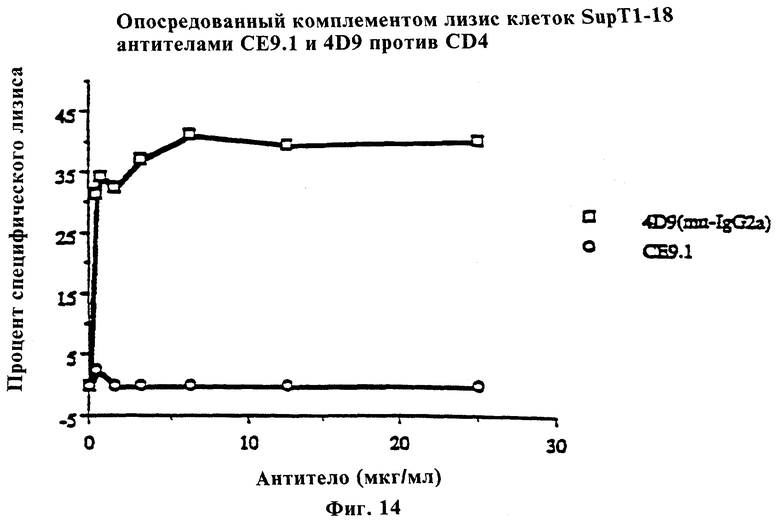
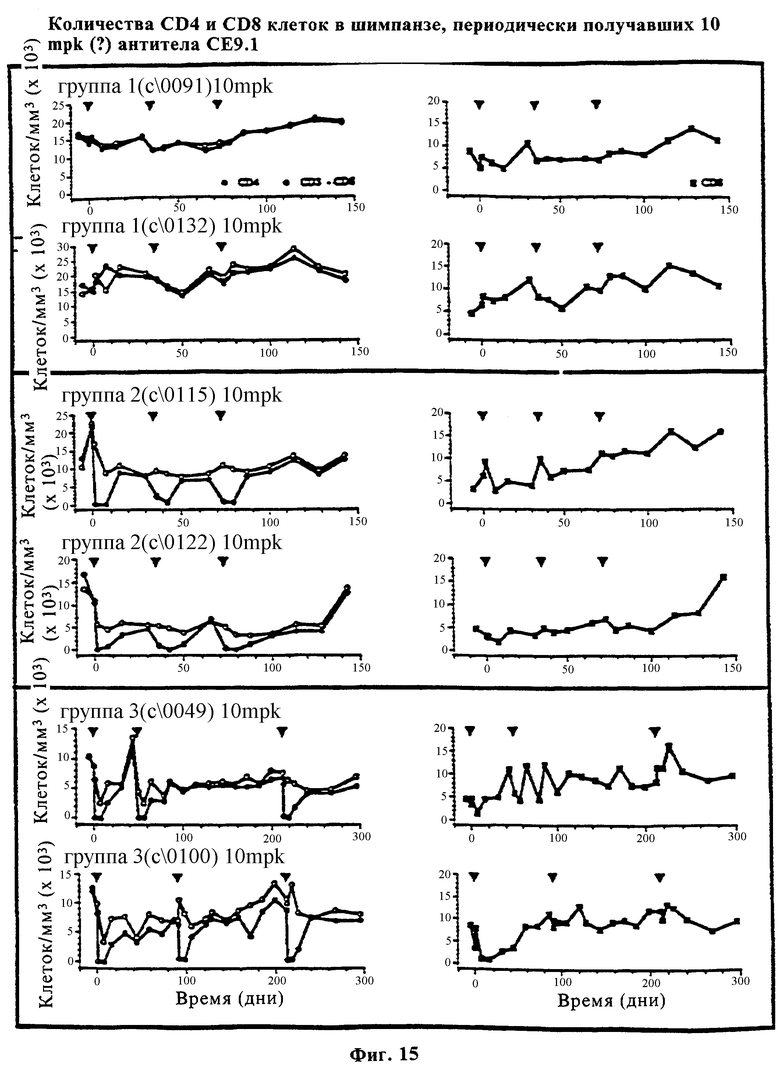



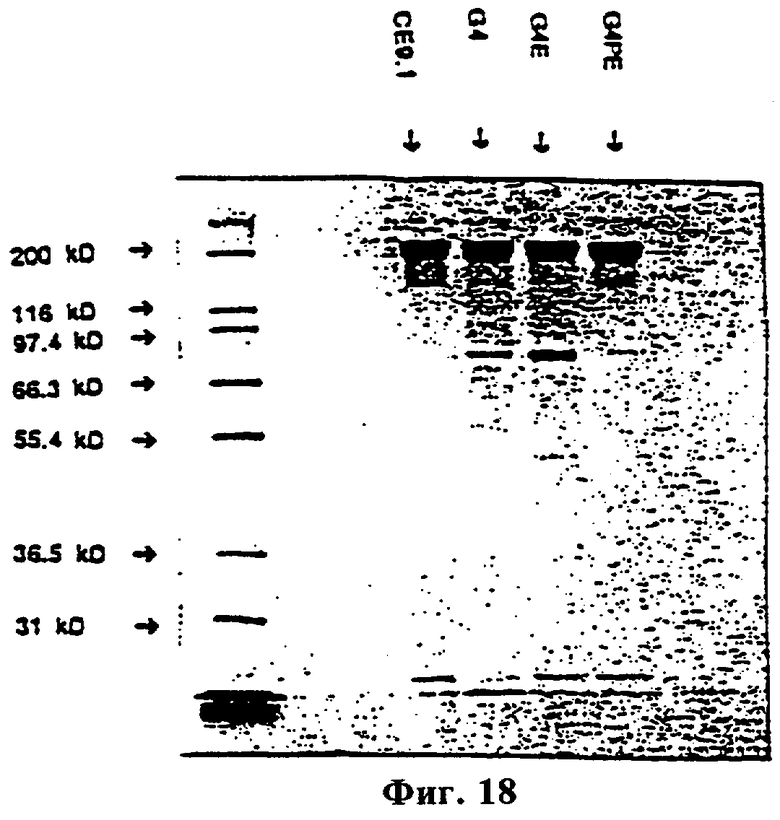
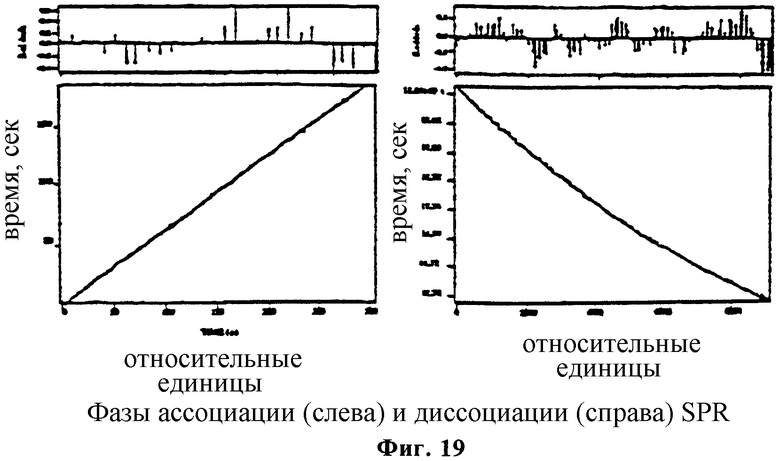
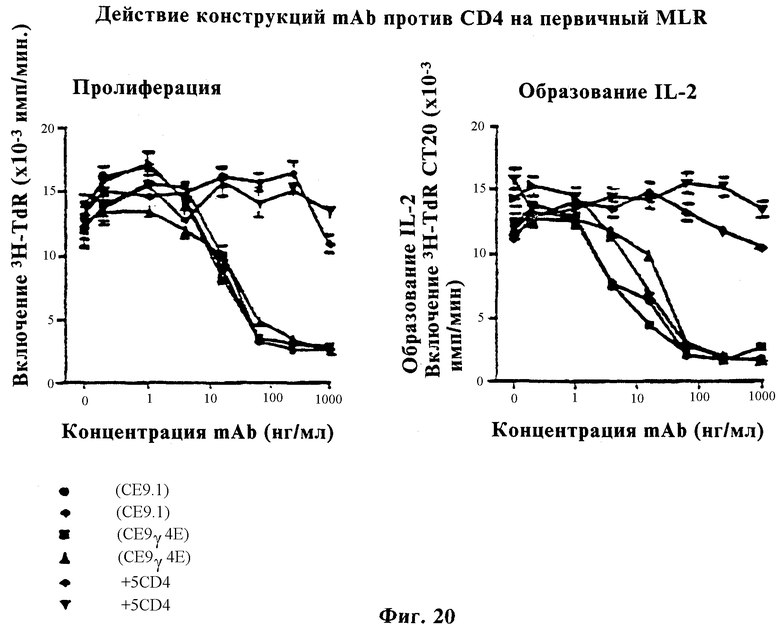
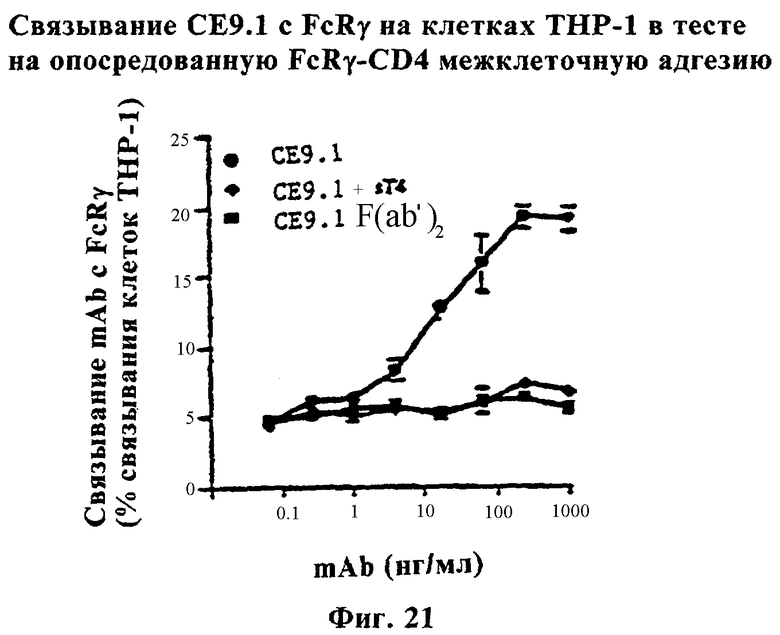
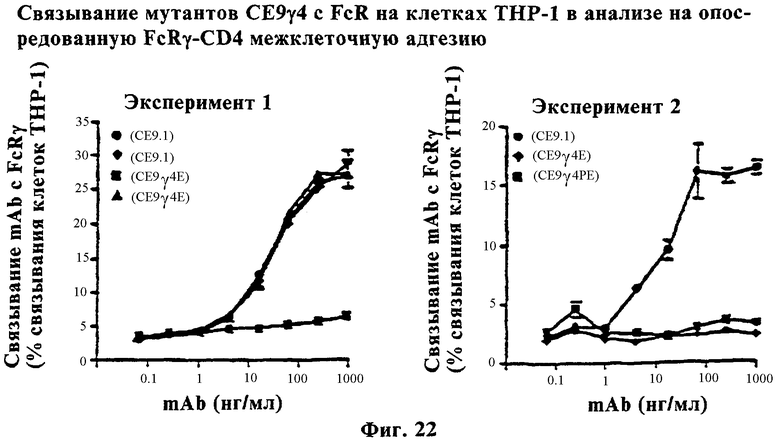
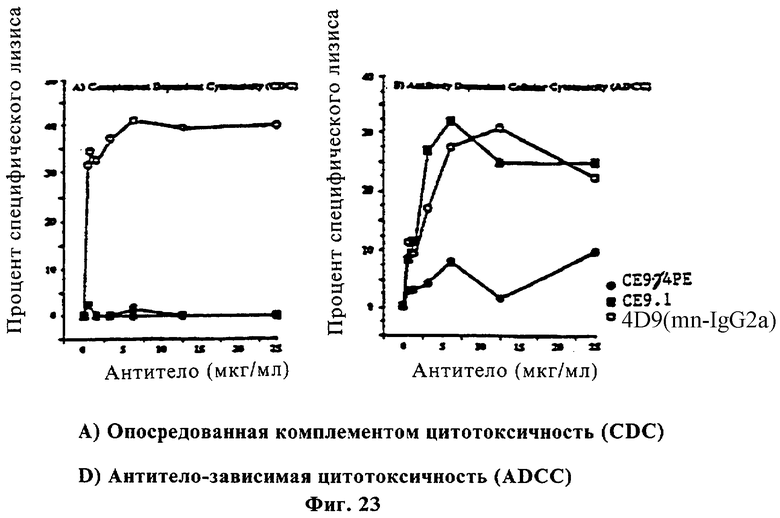
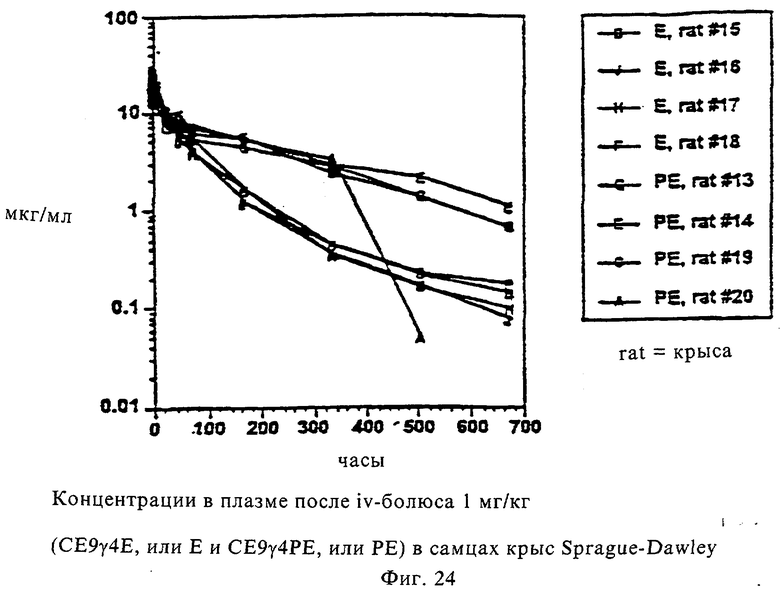
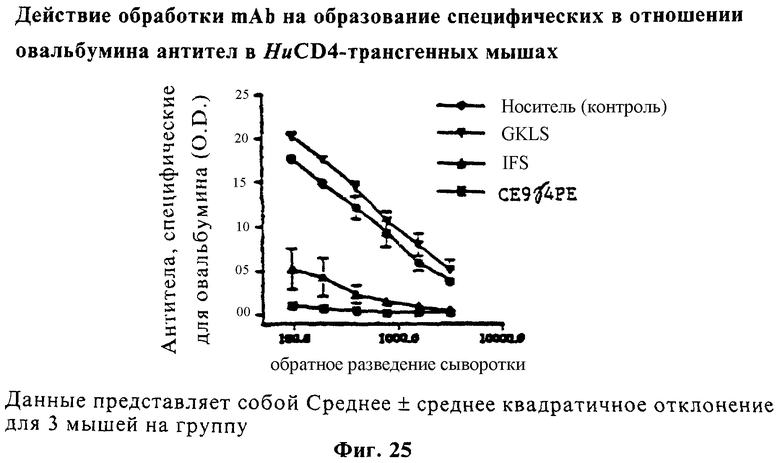
Изобретение относится к биотехнологии и медицине и представляет собой химерные антитела, специфические в отношении антигена CD4 человека, ДНК, кодирующие их, а также применение их в качестве терапевтических средств. Эти химерные антитела содержат последовательности вариабельного домена иммуноглобулина низшей узконосой обезьяны и последовательности константного домена иммуноглобулина человека. За счет того, что данные антитела обладают желательными терапевтическими свойствами, в том числе низкой антигенностью, пониженной (или отсутствующей) активностью истощения Т-клеток, хорошей аффинностью (сродством) в отношении CD4 человека и повышенной стабильностью (полупериодом существования в организме in vivo), данное изобретение позволяет выработать более эффективный способ лечения или предотвращения связанного с CD4 состояния. 13 н. и 17 з.п. ф-лы, 25 ил., 5 табл.
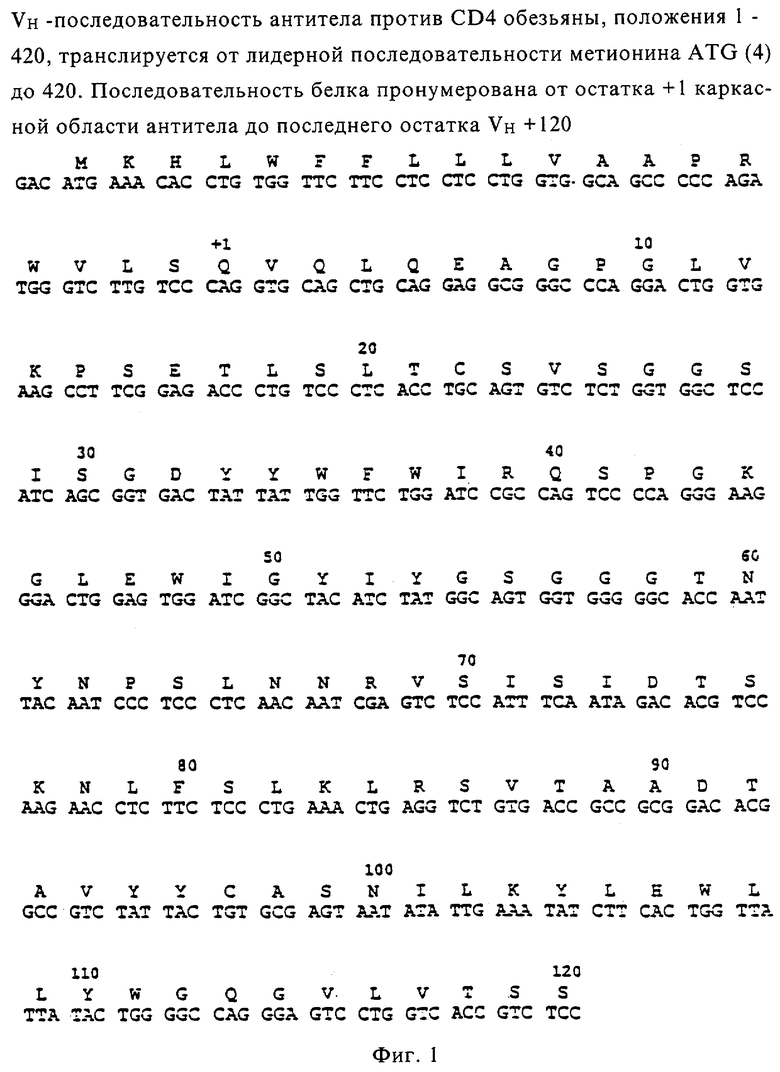
| US 5120642 A1, 09.06.1992 | |||
| СПОСОБ ПОЛУЧЕНИЯ ВАКЦИНЫ ПРОТИВ СПИДА | 1988 |
|
RU2014845C1 |
| УСТРОЙСТВО ДЛЯ МОДЕЛИРОВАНИЯ ГЕНЕРАТОРА ПОИСКА | 0 |
|
SU409242A1 |
Авторы
Даты
2004-07-20—Публикация
1996-09-05—Подача