Область техники
Изобретение относится к области биотехнологии, в частности, предложена рекомбинантная плазмидная ДНК, позволяющая осуществлять транскрипцию и трансляцию кодирующей последовательности генов тяжелой и легкой цепей иммуноглобулина А и J-цепи для последующего получения клеток эукариот, экспрессирующих антитела мутантного изотипа A2m1 в виде димера с J-цепью, которые могут быть использованы при производстве терапевтических средств (препаратов и вакцин), в том числе против вируса SARS-CoV-2 (2019-nCoV).
Уровень техники
В литературе описано несколько способов получения рекомбинантных иммуноглобулинов А в животных клетках и создания культур - продуцентов антител на основе клеток грызунов и приматов, например, на основе линии клеток СНО (клетки яичника китайского хомячка).
Известна плазмида pEF-dhfr2a-NEO-IGA-chi-H, содержащая кодирующую последовательность вариабельного домена тяжелой цепи мышиного антитела HA-9 против вируса птичьего гриппа H5N1, кодирующую последовательность константных доменов IgA2 антител человека из pGEM-T-Easy-IGHA с интронами, ген устойчивости к неомицину NeoR и ген дигидрофолатредуктазы dhfr, промоторы CMV и фактора элонгации 1 человека (EF1)-α, искусственный интрон перед и поздний сайт полиаденилирования SV40 poly (A) после гена цепи антитела. Известна плазмида pEF-dhfr2a-NEO-IGA-Kappa, содержащая кодирующую последовательность вариабельного домена легкой цепи мышиного антитела HA-9 против вируса птичьего гриппа H5N1, кодирующую последовательность константного домена каппа легкой цепи антител человека из pGEM-T-Easy-CK, устойчивости к неомицину NeoR и ген дигидрофолатредуктазы dhfr, промоторы CMV и фактора элонгации 1 человека (EF1)-α, искусственный интрон перед и поздний сайт полиаденилирования SV40 poly (A) после гена цепи антитела. Обе плазмиды обеспечивают продукцию химерного антитела IgA2 HA-9 против вируса птичьего гриппа H5N1 при котрансфекции в клетки CHO/dhfr- в суспензионной культуре в бессывороточной среде. Известна плазмида pcDNA4/His A-IgJ, содержащая ген J-цепи антител IgJ. Известна плазмида pcDNA4/HisA-SC, содержащая ген секреторного компонента (состоит из первых 585 аминокислот полимерного рецептора иммуноглобулинов pIgR человека). Обе плазмиды обеспечивают продукцию секреторного варианта химерного антитела IgA2 HA-9 против вируса птичьего гриппа H5N1 при котрансфекции в клетки CHO/dhfr-, продуцироющие мономерный вариант в суспензионной культуре в бессывороточной среде с выходом 25 мг/л супернатанта [Li C, An X, Butt AM, Zhang B, Zhang Z, Wang X, Huang Y, Zhang W, Zhang B, Mi Z, Tong Y. Construction of a chimeric secretory IgA and its neutralization activity against avian influenza virus H5N1. J Immunol Res. 2014;2014:394127. doi: 10.1155/2014/394127. Epub 2014 Feb 13. PMID: 24741594; PMCID: PMC3987799.].
Известна плазмида, полученная на основе pFUSE2ss-CLIg-hK (InvivoGen), содержащая гибридный промотор hEF1-HTLV, сигнальную последовательность интерлейкина-2 человека, кодирующую последовательность вариабельного домена легкой цепи антитела 9F4 против вирусов гриппа H5N1, ген константного каппа-домена легкой цепи антитела человека, сигнал полиаденилирования SV40 pAn, ген устойчивости к бластицидину под контролем гибридного промотора CMV enh / hFerL и сайта полиаденилирования бета-глобина человека βGlo pAn в качестве селективного маркера. Известна плазмида, полученная на основе pFUSEss-CHIg-hA1 (InvivoGen), содержащая гибридный промотор hEF1-HTLV, сигнальную последовательность интерлейкина-2 человека, кодирующую последовательность вариабельного домена тяжелой цепи антитела 9F4 против вирусов гриппа H5N1, кодирующую последовательность константных доменов тяжелой цепи антитела человека IgA1, сигнал полиаденилирования SV40 pAn, ген устойчивости к зеоцину под контролем гибридного промотора CMV enh / hFerL и сайта полиаденилирования бета-глобина человека βGlo pAn в качестве селективного маркера. При транзиентной котрансфекции клеток 293FT обе плазмиды обеспечивали продукцию химерного антитела против вирусов гриппа H5N1 xi-IgA1-9F4 [Tze-Minn Mak, Brendon J. Hanson, Yee-Joo Tan. Chimerization and characterization of a monoclonal antibody with potent neutralizing activity across multiple influenza A H5N1 clades. // Antiviral Res. 2014 Jul;107:76-83. doi: 10.1016/j.antiviral.2014.04.011].
Известна плазмида pYR-GCEVH, содержащая тяжелую цепь антитела HCAb к раку кишечника человека, и плазмида pYR-GCEVL, содержащая легкую цепь антитела к раку кишечника человека. Плазмида pYR-GCEVL включает в себя ген устойчивости к неомицину/генетицину под управлением раннего промотора вируса SV40 с удаленным энхансером. Транскрипция гена легкой цепи находится под контролем CMV на 5' конце и терминатора бычьего гормона роста (BGHT), на 3' конце находится сайт полиаденилирования. Плазмида pYR-GCEVH включает в себя ген dhfr под управлением раннего промотора вируса SV40. Транскрипция гена легкой цепи находится под контролем CMV на 5' конце и терминатора бычьего гормона роста (BGHT), на 3' конце находится сайт полиаденилирования. Культура клеток dhfr (−) CHO (ATCC, США), дефицитных по дигидрофолатредуктазе (ДГФР), была ко-трансфецирована с использованием равных количеств плазмид pYR-GCEVH, pYR-GCEVL. После проведения нескольких раундов селекции была получена культура, клоны которой имели продукцию химерных антител против рака кишечника человека от 30 до 100 и более мкг/мл кондиционированной среды [Xiong H, Ran Y, Xing J, Yang X, Li Y, Chen Z. Expression vectors for human-mouse chimeric antibodies. J Biochem Mol Biol. 2005 Jul 31;38(4):414-9. doi: 10.5483/bmbrep.2005.38.4.414. PMID: 16053708.].
Известна плазмида, созданная на основе pEE14.4, содержащая промотор и энхансер гена hCMV-MIE, включая 5'-нетранслируемую последовательность и первый интрон, лидерный пептид HAVT20, вариабельный домен легкой цепи антитела 225 против рецептора эпидермального фактора роста человека EGF-R, константный домен легкой каппа-цепи человека, сайт полиаденилирования и, в качестве селективного маркера на безглутаминовой среде, ген глутамин-синтетазы под контролем слабого позднего промотора вируса SV40. Известна плазмида, созданная на основе pEE14.4, содержащая промотор и энхансер гена hCMV-MIE, включая 5'-нетранслируемую последовательность и первый интрон, лидерный пептид HAVT20, вариабельный домен тяжелой цепи антитела 225 против EGF-R, ген констанных доменов тяжелой α1-цепи человека (или α2-цепи в варианте для IgA2(m1)), сайт полиаденилирования и ген глутамин-синтетазы под контролем слабого позднего промотора вируса SV40 в качестве селективного маркера на безглутаминовой среде. Полученные с помощью ко-трансфекции в клетках CHO-K1 стабильные клеточные линии обеспечивали продукцию мономерных IgA1 и IgA2 в суспензионной культуре в бессывороточной среде с выходом 2,2 пикограмм/клетку/день [Beyer T, Lohse S, Berger S, Peipp M, Valerius T, Dechant M. Serum-free production and purification of chimeric IgA antibodies. J Immunol Methods. 2009 Jul 31;346(1-2):26-37. doi: 10.1016/j.jim.2009.05.002. Epub 2009 May 7. PMID: 19427867.].
Известна плазмида, полученная на основе вектора pIR-ESpuro3 (Clontech, Mountain View, CA), содержащая ранний промотор и энхансер цитомегаловируса человека РCMV IE, ген J-цепи человека с гексагистидиновой последовательностью на N-конце (кодирующая последовательность 6 гистидинов взята из вектора pcDNA6His (Invitrogen)), синтетический интрон IVS, внутренный сайт посадки рибосом вируса энцефаломиокардита IRES, ген пуромицин-N-ацетил-трансферазы Puror и ранний сигнал полиаденилирования вируса SV40. Котрансфекция этой плазмидой клонов, хорошо продуцирующих антитела 225-IgA против EGF-R, обеспечивает продукцию димеров 225-IgA, связанных с J-цепью, в суспензионной культуре в бессывороточной среде в клетках (CHO)-K1 с выходом 200.8 (673.3) и 295.2 (6139.5) мг/мл для мономерной и димерной форм 225-IgA1 [Lohse S, Derer S, Beyer T, Klausz K, Peipp M, Leusen JH, van de Winkel JG, Dechant M, Valerius T. Recombinant dimeric IgA antibodies against the epidermal growth factor receptor mediate effective tumor cell killing. J Immunol. 2011 Mar 15;186(6):3770-8. doi: 10.4049/jimmunol.1003082. Epub 2011 Feb 11. PMID: 21317397.]. Для стабилизации антител авторами в константных доменах тяжелой цепи антитела IgA2m1 произведены замены N166G, P221R, C311S, N337T, I338L, T339S и делеция Δ471,472. Замена P221R позволит установить и стабилизировать дисульфидную связь между цистеинами тяжелой (C241) и легкой (C214) цепей IgA2m1 и, соответственно, должна увеличить термическую и долгосрочную стабильность антитела. Замена С311S — для предотвращения образования дополнительных дисульфидных связей. Δ471,472 — делеция двух аминокислот, участвующих в димеризации, для повышения продукции мономерной формы. Мутации C311S и Δ471,472 должны уменьшить образования агрегатов. Замены N166G и N337T — для уменьшения уровня N-гликозилирования, что улучшит гомогенность как клеточной культуры, так и получаемого белкового препарата. Замены N337T, I338L, T339S основываются на последовательности IgA1 в соответствующих положениях и способствуют сохранению стабильности структуры белка. [Lohse S, Meyer S, Meulenbroek LA, Jansen JH, Nederend M, Kretschmer A, Klausz K, Möginger U, Derer S, Rösner T, Kellner C, Schewe D, Sondermann P, Tiwari S, Kolarich D, Peipp M, Leusen JH, Valerius T. An Anti-EGFR IgA That Displays Improved Pharmacokinetics and Myeloid Effector Cell Engagement In Vivo. Cancer Res. 2016 Jan 15;76(2):403-17. doi: 10.1158/0008-5472.CAN-15-1232. Epub 2015 Dec 3. PMID: 26634925.]. Это антитело является прототипом по мутагенезу константных доменов IgA2m1.
Известны плазмиды pOptiVEC-L и pcDNA3.3-L, содержащие в своём составе ген легкой цепи антитела против ФНО-альфа человека [Radko BV, Boitchenko VE, Nedospasov SA, Korobko VG. Characterization of the genes encoding variable light and heavy chains of the high-affinity monoclonal antibody against human tumor necrosis factor. Russ J Immunol. 2002 Dec;7(4):371-4. PMID: 12687250.] под контролем промотора CMV, а также OptiVEC-H, pcDNA3.3-H, содержащие в своём составе ген легкой цепи антитела против ФНО-альфа человека под контролем промотора CMV. Плазмиды pcDNA3.3-L и pcDNA3.3-H содержат в своём составе также ген устойчивости к селективному антибиотику G418, а плазмиды pOptiVEC-L и pOptiVEC-H содержат в своём составе также миниген ДГФР мыши. После трансфекции экспрессирующими векторами pOptiVEC-L и pcDNA3.3-H клеток линии CHO DG44 и селекции в среде без нуклеотидов получен клон клеток, секретирующий химерные антитела против ФНО-альфа человека в среду культивирования с выходом 2 мкг на мл кондиционированной среды. Путем проведения нескольких раундов амплификации в присутствии возрастающих концентраций метотрексата и селективного антибиотика G418 была получена линия-продуцент, стабильно секретирующая химерные антитела против ФНО-альфа человека с выходом до 24,5 мкг/мл. [Балабашин Д.С., Зайцева-Зотова Д.С., Топорова В.А., Панина А.А., Марквичева Е.А., Свирщевская Е.В., Алиев Т.К. Способы увеличения продукции рекомбинантных антител в клеточных линиях CHO DG44 // Современные проблемы науки и образования. – 2011. – № 5.].
Недостатком данного продуцента, в котором используются 2 различные плазмиды, имеющие в своём составе гены тяжелой и легкой цепей антитела является то, что интегрированные в них гены цепей антител против ФНО-альфа человека находятся в клетке под контролем одинаковых промоторов и терминаторов. Также различные генетические маркеры, позволяющие за счет селективного давления увеличивать продукцию cis-ориентированных генов в клетках-продуцентах, имеют различную активность, что может влиять на количество экспрессируемого белкового продукта каждой из плазмид. Данное обстоятельство может изменять соотношение легкой и тяжелой цепей, и приводить к токсичности белкового продукта для клеток-продуцентов. При использовании метода селекции клеточной линии-продуцента с помощью метотрексата увеличение уровня экспрессии будет происходить только для той цепи антитела, которая находится в непосредственной близости от селективного маркера, гена ДГФР.
Известно нейтрализующее моноклональное антитело P4A1 против вируса SARS-CoV-2 (2019-nCoV), идентифицированое у выздоравливающих пациентов с COVID-19, взаимодействующее непосредственно с рецептор-связывающим мотивом рецептор-связывающего домена (RBD) шиповидного белка Spike и покрывает его большую часть, что показано анализом сложной структуры с высоким разрешением. P4A1 демонстрирует связывающую и нейтрализующую активность против дикого типа и мутантных белков Spike или псевдовирусов. P4A1 связывается с субъединицей S1 с наномолярной IC50, но не связывается с субъединицей S2, блокируя при этом связывание субъединицы S1 с клетками, экспрессирующими ACE2, со значениями IC50 в наномолярном диапазоне концентраций. P4A1 нейтрализовал живую инфекцию SARS-CoV-2 клеток Vero E6 со значением 50% нейтрализующей дозы (ND50) 5,212 нМ. Сконструированное для снижения потенциального риска антителозависимого усиления инфекции и увеличения периода его полужизни антитело P4A1 изотипа IgG4 (названное как P4A1-2A) обладает оптимизированным профилем фармакокинетики и безопасности и приводит к полной элиминации вируса в модели COVID-19 на макаках-резусах после однократной инъекции, что свидетельствует о его потенциале против заболеваний, связанных с SARS-CoV-2 [Guo, Y., Huang, L., Zhang, G. et al. A SARS-CoV-2 neutralizing antibody with extensive Spike binding coverage and modified for optimal therapeutic outcomes. Nat Commun 12, 2623 (2021). https://doi.org/10.1038/s41467-021-22926-2]. кДНК вариабельных доменов этого антитела были клонированы в экспрессионные векторы IgG4 и Igk и экспрессированы путем транзиентной трансфекции суспензионной культуры клеток CHO.K1 (ATCC, No. CCL 61). Эти антитела и их фрагменты потенциально могут быть использованы для диагностики и терапии коронавирусной инфекции [Патент WO/2021/257695 A61K 38/00 2006.1, опубл. 23.12.2021 г.]. Последовательности вариабельных доменов данного антитела использованы в качестве примера.
Известна плазмида pBiPr-ABTNF [Патент RU2555533С2, C12N 15/13 (2006.01), опубл. 27.11.2014, прототип по конструированию], кодирующая химерное антитело против фактора некроза опухолей-альфа человека (ФНО-альфа) изотипа IgG1, созданная на основе плазмиды pOptiVECTM-TOPO®. Трансфецированная этой плазмидой линия эукариотических клеток осуществляет продукцию антитела против ФНО-альфа на уровне 90 мг/л. Наличие в плазмиде pBiPr-ABTNF активного гена ДГФР, находящегося под контролем IRES, позволяет проводить селекцию и амплификацию чужеродных последовательностей, интегрированных в геном клетки СНО DG44 (dhfr-/- вариант линии клеток СНО-K1), в среде, содержащей метотрексат. Сочетание процессов трансфекции, селекции и амплификации позволяет получить линию клеток продуцентов CHO-S11, содержащую в своем геноме интегрированные копии генов химерного антитела против ФНО-альфа человека и стабильно секретирующую рекомбинантные антитела в культуральную жидкость. Наличие генов тяжелой и легкой цепей антитела в составе одной плазмиды позволяет осуществлять одновременную амплификацию генов легкой и тяжелой цепей рекомбинантного антитела, встроенных в геном клеток СНО, при воздействии метотрексатом. Недостатком плазмиды является то, что эта плазмида позволяет получать антитела только изотипа G1 и только против фактора некроза опухолей-альфа человека.
Известна плазмида pBiPr-ABIgA1FI6-ht [Патент RU2656142C1, C12N 15/13 (2006.01), опубл. 31.05.2018, прототип по конструированию], кодирующая человеческое антитело к гемагглютинину вируса гриппа А человека изотипа IgA1, созданная на основе плазмиды pOptiVECTM-TOPO®. Трансфецированная этой плазмидой линия эукариотических клеток осуществляет продукцию человеческого антитела к гемагглютинину вируса гриппа А человека на уровне 3,6 мг/л. Наличие в плазмиде активного гена ДГФР, находящегося под контролем IRES, позволяет проводить селекцию и амплификацию чужеродных последовательностей, интегрированных в геном клетки СНО DG44 (dhfr-/- вариант линии клеток СНО-K1), в среде, содержащей метотрексат. Сочетание процессов трансфекции, селекции и амплификации позволяет получить линию клеток продуцентов CHO, содержащую в своем геноме интегрированные копии генов человеческого антитела к гемагглютинину вируса гриппа А человека изотипа IgA1 и стабильно секретирующую рекомбинантные антитела в культуральную жидкость. Наличие генов тяжелой и легкой цепей антитела в составе одной плазмиды позволяет осуществлять одновременную амплификацию генов легкой и тяжелой цепей рекомбинантного антитела, встроенных в геном клеток СНО, при воздействии метотрексатом. Недостатком плазмиды является то, что эта плазмида позволяет получать антитела только изотипа IgA1 и только против гемагглютинина вируса гриппа А.
Известна рекомбинантная плазмидная ДНК pBiPr-ABIgA2m1P4A1-Intht, кодирующая нейтрализующее моноклональное антитело P4A1 [Патент WO/2021/257695 A61K 38/00 2006.1, опубл. 23.12.2021 г.] к вирусу SARS-CoV-2 изотипа IgA2m1, содержащая интронированный ген тяжелой цепи антитела изотипа IgA2m1, находящийся под контролем промотора hEF1-HTLV и сигнала полиаденилирования бычьего гормона роста BGH polyA, ген легкой цепи антитела, находящийся под контролем промотора CMV, сигнал полиаденилирования тимидинкиназы вируса герпеса цепей антитела, а также селективный маркер, обеспечивающий отбор трансфецированных эукариотических клеток, при этом промоторы hEF1-HTLV и CMV размещены в последовательности, обеспечивающей однонаправленную транскрипцию. Также описана линия эукариотических клеток CHO DG44/pBiPr-ABIgA2m1P4A1-Intht - продуцент нейтрализующего моноклонального антитела P4A1 к вирусу SARS-CoV-2 изотипа IgA2m1. Также представлен способ получения нейтрализующего моноклонального антитела P4A1 к вирусу SARS-CoV-2 изотипа IgA2m1, включающий: культивирование в питательной среде указанных линий клеток, выделение полученного целевого антитела P4A1 к вирусу SARS-CoV-2 изотипа IgA2m1 из культуральной жидкости. В результате трансфекции клеток СНО DG44 сконструированной рекомбинантной плазмидой pBiPr-ABIgA2m1P4A1-Intht, последующего культивирования на ростовой среде и отбора колоний, устойчивых к метотрексату, получены культуры клеток, стабильно продуцирующие в культуральную жидкость нейтрализующие моноклональные антитела P4A1 к вирусу SARS-CoV-2 изотипа IgA2m1 с выходом 16.6 мкг в мл кондиционированной среды [Патент RU2801178C1 C12N15/13 2006.01, опубл. 03. 08.2023 г.]. Эта плазмида является прототипом по клонированию.
Субъединицы иммуноглобулинов в высоких полимерных формах (IgA, IgM) соединяются между собой дисульфидными связями через полипептид, называемый J-цепью. С ее участием происходит стабилизация сульфгидрильных групп Fc-фрагмента в процессе синтеза иммуноглобулинов. Димеризация антител изотипа IgA2m1 с помощью J-цепи увеличивает также время полужизни антител и расширяет возможности их терапевтического применения. Возникшая необходимость получения димерных антител изотипа IgA2m1 приводит к созданию сходной бипромоторно-бицистронной рекомбинантной плазмиды, обеспечивающей получение антител изотипа IgA2m1 в виде димера с J-цепью. В качестве вариабельных доменов тяжелой и легкой цепей используются вариабельные домены атитела P4A1 [Патент WO/2021/257695 A61K 38/00 2006.1, опубл. 23.12.2021 г.] как имеющие потенциальное терапевтическое значение. Ген J-цепи находится в виде бицистрона с геном легкой цепи под контролем промотора CMV и последовательности IRES. Кроме того, в ходе создания плазмиды получаются варианты как с однонаправленной, так и с разнонаправленной транскрипцией генов тяжелой и легкой цепей антитела, что приводит к необходимости как разработки способов дифференцирования клонов по взаимному направлению транскрипции генов. Также для увеличения стабильности IgA2m1 и повышения уровня его продукции в гене константных доменов тяжелой цепи антитела изотипа IgA2m1 проведен мутагенез, что приводит к созданию бипромоторно-быцистронной рекомбинантной плазмиды, обеспечивающей получение димерных антител изотипа IgA2m1 с J-цепью и содержащей интронированный вариант гена IgA2m1. В дальнейшем эти данные могут позволить оптимизировать работу по получению рекомбинантных плазмид и клеточных культур, экспрессирующих другие антитела изотипа IgA2m1.
Раскрытие изобретения
Задачей настоящего изобретения, является создание рекомбинантной плазмиды для получения димерной формы нейтрализующего моноклонального антитела P4A1 против вируса SARS-CoV-2 (2019-nCoV) мутантного изотипа IgA2m1 с J-цепью.
Сконструированная рекомбинантная плазмидная ДНК p3.4-P4A1IgA2m1mut2-J12His-Intht содержит:
- фрагмент плазмиды pcDNA™3.4-TOPO®, включающий промотор/энхансер ранних генов цитомегаловируса человека (CMV), посттранскрипционный регуляторный элемент WPRE вируса гепатита сурка (WHV), сигнал полиаденилирования тимидинкиназы вируса герпеса TK pA, сайт начала репликации в E. coli из плазмиды pUC, ген β-лактамазы, а также единичный сайт узнавания рестриктазы MluI в начале промотора CMV, а также введенные единичные сайты узнавания рестриктаз NheI и XhoI после промотора CMV для клонирования ДНК легкой цепи антитела;
- фрагмент ДНК, включающий фланкированную сайтами рестрикции NheI и XhoI кДНК легкой цепи типа каппа нейтрализующего моноклонального антитела P4A1 против вируса SARS-CoV-2 (2019-nCoV) [Патент WO/2021/257695 A61K 38/00 2006.1, опубл. 23.12.2021 г.] под контролем промотора/энхансера ранних генов цитомегаловируса человека (CMV);
- фрагмент плазмиды pOptiVEC™-TOPO®, включающий внутренний сайт связывания рибосом (IRES) вируса энцефаломиокардита (EMCV), фланкированный сайтами узнавания рестриктаз XhoI и BglII;
- фрагмент ДНК, включающий фланкированную сайтами рестрикции BglII и XhoI кДНК J-цепи человека под контролем внутреннего сайта связывания рибосом (IRES) вируса энцефаломиокардита (EMCV);
- MluI/MluI - фрагмент ДНК, содержащий ДНК тяжелой цепи нейтрализующего моноклонального антитела P4A1 против вируса SARS-CoV-2 (2019-nCoV) [Патент WO/2021/257695 A61K 38/00 2006.1, опубл. 23.12.2021 г.] мутантного изотипа IgA2m1 в интронированном варианте под контролем гибридного промотора hEF1-HTLV и сигнала полиаденилирования бычьего гормона роста BGH polyA. Фрагмент ориентирован так, что транскрипция с промоторов hEF1-HTLV и CMV идет однонаправлено.
Также настоящее изобретение представляет упомянутую выше рекомбинантную плазмидную ДНК p3.4-P4A1IgA2m1mut2-J12His-Intht, характеризующуюся тем, что в ней содержится фрагмент ДНК, кодирующий тяжелую цепь нейтрализующего моноклонального антитела P4A1 против вируса SARS-CoV-2 (2019-nCoV) изотипа IgA2m1 с аминокислотной последовательностью SEQ ID NO:1 (сигнальный пептид составляет первые 19 аминокислотных остатков).
Также настоящее изобретение представляет упомянутую выше рекомбинантную плазмидную ДНК p3.4-P4A1IgA2m1mut2-J12His-Intht, характеризующуюся тем, что фрагмент ДНК, кодирующий тяжелую цепь нейтрализующего моноклонального антитела P4A1 против вируса SARS-CoV-2 (2019-nCoV) изотипа IgA2m1 в интронированном варианте, имеет нуклеотидную последовательность SEQ ID NO:2.
Также настоящее изобретение представляет упомянутую выше рекомбинантную плазмидную ДНК, характеризующуюся тем, что в ней содержится фрагмент ДНК, кодирующий легкую цепь нейтрализующего моноклонального антитела P4A1 против вируса SARS-CoV-2 (2019-nCoV) с аминокислотной последовательностью SEQ ID NO:3 (сигнальный пептид составляет первые 20 аминокислотных остатков).
Также настоящее изобретение представляет упомянутую выше рекомбинантную плазмидную ДНК, характеризующуюся тем, что фрагмент ДНК, кодирующий легкую цепь нейтрализующего моноклонального антитела P4A1 против вируса SARS-CoV-2 (2019-nCoV), имеет нуклеотидную последовательность SEQ ID NO:4.
Также настоящее изобретение представляет упомянутую выше рекомбинантную плазмидную ДНК, характеризующуюся тем, что в ней содержится фрагмент ДНК, кодирующий J-цепь человека с аминокислотной последовательностью SEQ ID NO:5 (сигнальный пептид составляет первые 22 аминокислотных остатков).
Также настоящее изобретение представляет упомянутую выше рекомбинантную плазмидную ДНК, характеризующуюся тем, что фрагмент ДНК, кодирующий J-цепь человека, имеет нуклеотидную последовательность SEQ ID NO:6.
Также настоящее изобретение представляет упомянутую выше рекомбинантную плазмидную ДНК, характеризующуюся тем, что указанный промотор/энхансер ранних генов цитомегаловируса человека (CMV) имеет нуклеотидную последовательность SEQ ID NO:7.
Также настоящее изобретение представляет упомянутую выше рекомбинантную плазмидную ДНК, характеризующуюся тем, что указанный гибридный промотор hEF1-HTLV имеет нуклеотидную последовательность SEQ ID NO:8.
Также настоящее изобретение представляет упомянутую выше рекомбинантную плазмидную ДНК, характеризующуюся тем, что указанный сигнал полиаденилирования бычьего гормона роста BGH polyA имеет нуклеотидную последовательность SEQ ID NO:9.
Также настоящее изобретение представляет упомянутую выше рекомбинантную плазмидную ДНК, характеризующуюся тем, что указанный внутренний сайт связывания рибосом (IRES) вируса энцефаломиокардита (EMCV) имеет нуклеотидную последовательность SEQ ID NO:10.
Поставленная задача также решается способом получения культуры клеток яичника китайского хомячка СНО - продуцента димерной формы мутантного иммуноглобулина А изотипа IgA2m1 нейтрализующего моноклонального антитела P4A1 против вируса SARS-CoV-2 (2019-nCoV) путем трансфекции клеток упомянутой выше рекомбинантной плазмидной ДНК p3.4-P4A1IgA2m1mut2-J12His-Intht.
Поставленная задача также решается способом получения димера нейтрализующего моноклонального антитела P4A1 против вируса SARS-CoV-2 (2019-nCoV) изотипа IgA2m1, включающим:
-культивирование в питательной среде упомянутых выше клеток,
-выделение полученного целевого белка из культуральной жидкости.
Технический результат заключается в одновременной экспрессии генов тяжелой и легкой цепей антитела и гена J-цепи в результате трансфекции одной плазмидой и достигается за счет однонаправленной транскрипции генов тяжелой (в интронированном мутантном варианте) и легкой цепей антитела нейтрализующего моноклонального антитела P4A1 против вируса SARS-CoV-2 (2019-nCoV) изотипа IgA2m1 и гена J-цепи клетками-продуцентами СНО при использовании полученной рекомбинантной плазмидной ДНК p3.4-P4A1IgA2m1mut2-J12His-Intht с выходом до 4,7 мг/л культуральной среды.
Преимущество предлагаемого изобретения заключается в том, что все три гена (тяжелая и легкая цепи и J-цепь) входят в состав одной плазмиды p3.4-P4A1IgA2m1mut2-J12His-Intht и не требуют подбора соотношения плазмид, несущих отдельные гены. Кроме того, культуры, трансфецированные плазмидой p3.4-P4A1IgA2m1mut2-J12His-Intht, не требуют прохождения процедуры селекции с использованием метотрексата, что позволяет расширить список используемых линий клеток и применить транзиентную экспрессию в клетках CHO, которая не зависит от места встраивания плазмиды в геном клеток. Культуры клеток CHO, трансфецированные плазмидой p3.4-P4A1IgA2m1mut2-J12His-Intht, синтезируют димерные рекомбинантные нейтрализующие антитела P4A1 против вируса SARS-CoV-2 (2019-nCoV) мутантного изотипа IgA2m1 с выходом до 4,7 мг/л культуральной среды.
Продукция антител может быть осуществлена в эукариотических клетках. Примером эукариотической клетки, пригодной для продукции полноразмерного антитела, согласно настоящему изобретению являются, но не ограничиваются ими, клетки яичников Cricetulus griseus (CHO). Фраза “клетки яичников Cricetulus griseus” означает, что указанные эукариотические клетки классифицируют как клетки яичников C. griseus (CHO) в соответствии с классификацией, известной специалисту в данной области биотехнологии. Примерами клеток яичников Cricetulus griseus (CHO), применимых в рамках настоящего изобретения, являются, но не ограничиваются ими, клетки яичников Cricetulus griseus (CHO) клетки CHO DG44 (Invitrogen).
Предложенная рекомбинантная плазмида p3.4-P4A1IgA2m1mut2-J12His-Intht и способ получения культивируемых клеток CHO, основанный на использовании рекомбинантной плазмиды p3.4-P4A1IgA2m1mut2-J12His-Intht, впервые получены авторами данного изобретения, в научной и патентной литературе не описаны. Кроме того, нуклеотидная последовательность вариабельных доменов тяжелой и легкой цепей антитела P4A1 получена отличным от прототипа способом. Также большая часть использованных праймеров впервые разработана для получения данной плазмиды и ранее не встречались в литературе. Наличие интронов и мутагенез в кодирующей последовательности гена тяжелой цепи антитела позволяет повысить уровень продукции антител и сократить время культивирования.
Краткое описание чертежей
На Фиг. 1 показана схематическая структура промежуточной плазмиды pcDNA3.4-P4A1L-MluI. PCMV – промотор/энхансер ранних генов цитомегаловируса человека, VL и CL – вариабельная и константная области гена легкой цепи нейтрализующего моноклонального антитела P4A1 против вируса SARS-CoV-2 (2019-nCoV), соответственно, WPRE – посттранскрипционный регуляторный элемент WPRE вируса гепатита сурка (WHV), TK pA - сигнал полиаденилирования тимидинкиназы вируса герпеса, MluI, NheI, XhoI – сайты узнавания соответствующих рестриктаз.
На Фиг. 2 показана электрофореграмма разделения фрагментов ПЦР с помощью гель-электрофореза в 1% агарозном геле. Дорожки: 1, 2 — фрагмент I (163 bp); 3, 4 — II (142 bp); 5, 6 — III (459 bp); 7, 8 — IV (103 bp); 9, 10 — V (643 bp). M — 100+ bp маркер (Евроген, Россия).
На Фиг. 3 показана электрофореграмма разделения продуктов SOE-ПЦР при помощи 1% гель-электрофореза. На дорожках 6-10 слабо заметная полоса (около 1500 bp) нужного фрагмента. M — 1kb маркер (Евроген, РФ).
На Фиг. 4 показана схематическая структура промежуточной плазмиды pcDNA3.4-P4A1L-IRES-J12His-MluI. PCMV – промотор/энхансер ранних генов цитомегаловируса человека, VL и CL – вариабельная и константная области гена легкой цепи нейтрализующего моноклонального антитела P4A1 против вируса SARS-CoV-2 (2019-nCoV), соответственно, EMCV IRES - внутренний сайт связывания рибосом (IRES) вируса энцефаломиокардита, J-12His – ген J-цепи человека с 12 гистидинами на С-конце, WPRE – посттранскрипционный регуляторный элемент WPRE вируса гепатита сурка (WHV), TK pA - сигнал полиаденилирования тимидинкиназы вируса герпеса, MluI, NheI, XhoI, BglII – сайты узнавания соответствующих рестриктаз.
На Фиг. 5 показана структура полученной промежуточной плазмиды pSK-EF1-P4A1HA2m1mut2-Int-BGH. PhEF1-HTLV – гибридный промотор из плазмиды pMG, состоящий из промотора фактора элонгации EF-1a и 5’-нетранслируемой области вируса Т-клеточной лейкемии человека HTLV, BGH pA – сигнал полиаденилирования BGH из плазмиды pBudCE4.1, VH и CH – вариабельная и константная (интронированный вариант) области гена тяжелой цепи нейтрализующего моноклонального антитела P4A1 против вируса SARS-CoV-2 (2019-nCoV) изотипа IgA2m1, соответственно, MluI, SacI, NheI, XhoI – сайты узнавания соответствующих эндонуклеаз рестрикции.
На Фиг. 6 показана структура полученных плазмид p3.4-P4A1IgA2m1mut2-J12His-Intht и p3.4-P4A1IgA2m1-J12His-Intht. PhEF1-HTLV – гибридный промотор из плазмиды pMG, состоящий из промотора фактора элонгации EF-1a и 5’-нетранслируемой области вируса Т-клеточной лейкемии человека HTLV, BGH pA – сигнал полиаденилирования BGH из плазмиды pBudCE4.1, VH и CH – вариабельная и константная (интронированный вариант) области гена тяжелой цепи нейтрализующего моноклонального антитела P4A1 против вируса SARS-CoV-2 (2019-nCoV) изотипа IgA2m1, соответственно, MluI, SacI, NheI, XhoI – сайты узнавания соответствующих эндонуклеаз рестрикции, PCMV – промотор/энхансер ранних генов цитомегаловируса человека, VL и CL – вариабельная и константная области гена легкой цепи нейтрализующего моноклонального антитела P4A1 против вируса SARS-CoV-2 (2019-nCoV), соответственно, EMCV IRES - внутренний сайт связывания рибосом (IRES) вируса энцефаломиокардита, J-12His – ген J-цепи человека с 12 гистидинами на С-конце, WPRE – посттранскрипционный регуляторный элемент WPRE вируса гепатита сурка (WHV), TK pA - сигнал полиаденилирования тимидинкиназы вируса герпеса, MluI, SacI, NheI, XhoI, BglII – сайты узнавания соответствующих эндонуклеаз рестрикции.
Осуществление изобретения
В частном варианте воплощения настоящего изобретения указанная плазмида p3.4-P4A1IgA2m1mut2-J12His-Intht может представлять собой плазмиду, кодирующую полипептиды со свойствами тяжелой и легкой цепей нейтрализующего моноклонального антитела P4A1 против вируса SARS-CoV-2 (2019-nCoV) изотипа IgA2m1 и J-цепи с молекулярной массой 3,84 Md (10,719 т.п.о.), и, например, состоять из:
фрагмента плазмиды pcDNA™3.4-TOPO® длиной 6,011 т.п.о., включающего промотор/энхансер ранних генов цитомегаловируса человека (CMV), обеспечивающий высокий уровень экспрессии целевых белков в клетках млекопитающих, посттранскрипционный регуляторный элемент WPRE вируса гепатита сурка (WHV), сигнал полиаденилирования тимидинкиназы вируса герпеса TK pA для правильной терминации и процессинга рекомбинантных транскриптов, сайт начала репликации в E. coli из плазмиды pUC, ген β-лактамазы, а также следующие модификации – единичные сайты узнавания рестриктаз NheI и XhoI после промотора CMV для клонирования кДНК легкой цепи антитела;
фрагмента XhoI-BglII плазмиды pOptiVEC™-TOPO® длиной 0,636 т.п.о., включающего внутренний сайт связывания рибосом (IRES) вируса энцефаломиокардита (EMCV) для кэп-независимой трансляции гена J-цепи;
фрагмента BglII-XhoI 0,663 т.п.о., включающего кодирующую последовательность гена J-цепи человека;
NheI/XhoI - фрагмента ДНК длиной 0,708 т.п.о., включающего фланкированную сайтами рестрикции NheI и XhoI кДНК легкой каппа цепи нейтрализующего моноклонального антитела P4A1 против вируса SARS-CoV-2 (2019-nCoV);
MluI/MluI - фрагмента ДНК длиной 2,664 т.п.о., включающего гибридный промотор hEF1-HTLV из плазмиды pMG, интронированный мутантный вариант гена тяжелой цепи нейтрализующего моноклонального антитела P4A1 против вируса SARS-CoV-2 (2019-nCoV) изотипа IgA2m1 и сигнал полиаденилирования гена фактора роста быка BGH polyA из плазмиды pBudCE4.1. Фрагмент ориентирован так, что транскрипция с промоторов hEF1-HTLV и CMV идет однонаправлено.
Способом согласно настоящему изобретению является способ получения полноразмерного нейтрализующего моноклонального антитела P4A1 против вируса SARS-CoV-2 (2019-nCoV) изотипа IgA2m1 в виде димера с J-цепью, включающий выращивание транcформированных клеток эукариот в питательной среде и выделение полученных антител из культуральной жидкости. В настоящем изобретении выращивание, накопление и очистка антител из культуральной жидкости может быть осуществлена методом, сходным с традиционными методами ферментации, когда некий белок производится с использованием трансформированных клеток.
Выращивание клеток эукариот осуществляют в атмосфере 8% СО2 в CO2-инкубаторе при 37°C и 96% влажности в режиме культивирования с перемешиванием в синтетических средах, таких как среда OptiCHO (Invitrogen, USA), в течение 3-6 суток.
После выращивания твердые компоненты, такие как клетки, могут быть удалены из культуральной жидкости методом центрифугирования или фильтрации с использованием мембраны, а затем антитела могут быть выделены и очищены методом осаждения с солями, с использованием сульфата натрия или сульфата аммония, аффинной хроматографии, ионообменной хроматографии и т.п.
Предложенная рекомбинантная плазмида p3.4-P4A1IgA2m1mut2-J12His-Intht и способ получения культивируемых клеток CHO, основанный на использовании рекомбинантной плазмиды p3.4-P4A1IgA2m1mut2-J12His-Intht, впервые получены авторами данного изобретения, в научной и патентной литературе не описаны. Кроме того, нуклеотидная последовательность вариабельных доменов тяжелой и легкой цепей антитела P4A1 получена отличным от прототипа способом и отличается от опубликованной в прототипе по сайтам узнавания рестриктаз. Также большая часть использованных праймеров впервые разработана для получения данной плазмиды и ранее не встречались в литературе.
Ниже следуют примеры осуществления предлагаемого изобретения.
Пример 1. Конструирование рекомбинантной плазмидной ДНК p3.4-P4A1IgA2m1mut2-J12His-Intht и p3.4-P4A1IgA2m1-J12His-Intht.
Пример 1a. Конструирование промежуточной рекомбинантной плазмидной ДНК pcDNA3.4-P4A1L-MluI.
Кодирующая последовательность легкой цепи антитела P4A1 [Guo, Y., Huang, L., Zhang, G. et al. A SARS-CoV-2 neutralizing antibody with extensive Spike binding coverage and modified for optimal therapeutic outcomes. Nat Commun 12, 2623 (2021). https://doi.org/10.1038/s41467-021-22926-2] составлена, исходя из аминокислотной и нуклеотидной последовательности легкой цепи антитела P4A1 [Патент WO/2021/257695 A61K 38/00 2006.1, опубл. 23.12.2021 г.] и сайтов узнавания рестриктаз. Для получения кодирующей последовательности используются олигонуклеотидные праймеры (структура праймеров приведена в Таблице 1). Данные олигонуклеотидные праймеры (кроме CMV forward, pcDNA3.4 reverse и EMCV IRES reverse M) разработаны для получения составленной последовательности и ранее в литературе не встречались.
Таблица 1
Праймеры для получения кодирующей последовательности вариабельных доменов легкой и тяжелой цепей антитела P4A1. В скобках указана длина олигонуклеотидов, сайты узнавания рестриктаз подчеркнуты.
Праймеры CMV forward, pcDNA3.4 reverse и EMCV IRES reverse M (№№ 5 - 7) являются коммерческими, остальные синтезированы для этой работы и ранее в литературе не встречались.
Кодирующую последовательность легкой цепи получают методом ПЦР на матрице плазмиды с составленной последовательностью с полимеразой Pfu со специфическими олигонуклеотидными праймерами P4A1-LNheIF и LkapXhoIR1, при этом на 5’-конец гена вводят сайт узнавания рестриктазы NheI, а на 3’-конец - сайт XhoI. Реакцию проводят в следующем температурном режиме: денатурация - 94°С, 30 сек; отжиг - 50°С, 40 сек; элонгация - 72°С, 2 мин; 30 циклов. Фрагменты очищают с помощью электpофоpеза в 1 % легкоплавкой агаpозе и выделения фрагментов из геля. После обработки ПЦР-фрагмента соответствующими рестриктазами кодирующую последовательность легкой цепи антитела клонируют по сайтам узнавания рестриктаз NheI и XhoI в плазмиду pcDNA3.4 Poly40 (модификация вектора pcDNA3.4 (Invitrogen) со встроенным полилинкером). Данная плазмида имеет среднеранний цитомегаловирусный промотор-энхансер CMV для обеспечения биосинтеза целевого белка.
Отбирают плазмидные ДНК, содержащие нужный набор рестрикционных фрагментов. Определяют нуклеотидную последовательность отобранных клонов промежуточной рекомбинантной плазмидной ДНК pcDNA3.4-P4A1L-MluI, содержащей ген легкой цепи антитела P4A1 под контролем промотора CMV, регуляторного элемента WPRE и сайта полиаденилирования тимидинкиназы вируса простого герпеса TKpA, секвенированием по двум цепям по методу Сэнгера. Структура полученной промежуточной плазмиды pcDNA3.4-P4A1L-MluI приведена в Фиг. 1.
Пример 1б. Конструирование промежуточной рекомбинантной плазмиды pAL-2T-J-12His.
Наиболее эффективным способом получения кодирующей последовательности J-цепи мультимеризации IgA и IgM является амплификация экзонов соответствующего гена с использованием хромосомной ДНК в качестве матрицы. Ген находится в области 4q13.3 хромосомы 4 человека и содержит четыре экзона. Анализ последовательностей на наличие сайтов узнавания рестриктаз показывает, что последовательность J-цепи не содержит сайты узнавания рестриктаз BglII и XhoI, что можно использовать для клонирования. Сайт BglII вносится на 5’-конец кодирующей последовательности J-цепи с помощью ПЦР с праймером IGCJF6. На 3’-конец с помощью синтетического олигонуклеотидного праймера hJ-12HisR вносятся последовательность, кондирующая 12 гистидинов, и сайт узнавания рестриктазы XhoI. Структура олигонуклеотидных праймеров, использованных для амплификации экзонов, приведена в Таблице 2. Все приведенные в Таблице 2 праймеры разработаны для получения данной последовательности и ранее не встречались в литературе. Ожидаемые при амплификации размеры ДНК-фрагментов приведены в Таблице 3.
Объединение полученных экзонов проводят с помощью метода SOE-PCR. Сплайсинг экзонов in vitro проводят в 2 этапа. На первом этапе проводят амплификацию экзонов по отдельности. Фрагменты, содержащие экзоны гена J-цепи, получают с помощью ПЦР на матрице хромосомной ДНК человека из двух образцов. ПЦР с полимеразой Pfu проводят в следующем температурном режиме: денатурация - 94°С, 30 сек; отжиг - 50°С, 40 сек; элонгация - 72°С, 2 мин; 30 циклов. Результатом всех проведенных ПЦР-амплификаций является получение ДНК-фрагментов требуемой длины. ДНК-фрагменты требуемой длины очищают с помощью электpофоpеза в 1 % легкоплавкой агаpозе и выделяют из геля.
На втором этапе выделенные ПЦР-фрагменты, полученные на первом этапе, смешивают и амплифицируют с использованием концевых олигонуклеотидных праймеров IGCJF6 и hJ-12HisR, фланкирующих кодирующую последовательность J-цепи человека. Реакцию с помощью полимеразы Taq проводят в следующем температурном режиме: денатурация - 95°С, 30 сек; отжиг - 50°С, 40 сек; элонгация - 72°С, 2 мин; 30 циклов. В итоге получают ДНК-фрагмент длиной 0,676 т.п.о., кодирующий J-цепь человека с 12 гистидинами на С-конце.
Фрагменты очищают с помощью электpофоpеза в 1 % легкоплавкой агаpозе, выделяют из геля и клонируют в вектор pAL2-T. Вектоp лигиpуют с фpагментом с помощью ДНК-лигазы фага Т4 пpи 12°С в течение ночи. Лигазной смесью тpансфоpмиpуют компетентные клетки E.coli штамма XL-1 Blue. Для первичного анализа используют бело-голубую селекцию. Колонии анализируют с помощью ПЦР с праймерами M13/pUC-46F и M13/pUC-46R, внешними к вставке. Структура олигонуклеотидных праймеров приведена в Таблице 4. Плазмидную ДНК отобранных по наличию фрагмента длиной 0,945 т.п.о. клонов выделяют из ночных культур и анализируют с помощью ПЦР с праймерами IGCJF6 и hJ-12HisR. Кроме того, плазмидную ДНК клонов дополнительно анализируют с помощью рестрикции с рестриктазами BglII и XhoI.
Отобранные положительные клоны секвенируют по Сэнгеру в области вставки по двум цепям. Проведенный гомологичный анализ нуклеотидных последовательностей с целью обнаружения в последовательностях отдельных клонов артефактных мутаций, вызванных протеканием ПЦР, позволяет идентифицировать плазмидные ДНК, в которых последовательность ДНК полностью соответствует завленной в базе данных Genbank последовательности экзонов J-цепи человека.
Таким образом, из хромосомной ДНК человека получают и клонируют ДНК кодирующей последовательности J-цепи человека.
Таблица 2.
Праймеры для амплификации экзонов гена J-цепи. В скобках указана длина олигонуклеотидов
CAGGATAGCAGGCATCTG-3’
Все приведенные праймеры разработаны для получения данной последовательности и ранее не встречались в литературе.
Таблица 3.
Размер ДНК-фрагментов при ПЦР амплификации экзонов J-цепи.
Таблица 4.
Праймеры для секвенирования последовательностей в плазмидах, полученных на основе pAL-2T и pSK+. В скобках указана длина олигонуклеотидов.
Пример 1в. Конструирование промежуточной рекомбинантной плазмиды pAL-2T-IgA2m1-Int.
Наиболее эффективным способом получения кодирующей последовательности константного домена тяжелой цепи изотипа IgA2m1 является амплификация соответствующего гена с использованием хромосомной ДНК в качестве матрицы. Ген находится в кластере генов иммуноглобулинов в области 14q32.33 хромосомы 14 человека и содержит три экзона. Анализ последовательностей на наличие сайтов узнавания рестриктаз показывает, что последовательность IgA2m1 не содержит сайт узнавания рестриктазы SacI, что можно использовать для подстыковки гена к кодирующей последовательности вариабельного домена тяжелой цепи антитела P4A1. Сайт SacI и последовательность CG для восстановления рамки считывания вносятся на 5’-конец кодирующей последовательности IgA2m1 с помощью ПЦР. Структура олигонуклеотидных праймеров, использованных для амплификации, приведена в Таблице 5. Все приведенные в таблице праймеры разработаны для получения данной последовательности и ранее не встречались в литературе.
Фрагменты, содержащие интронированный вариант гена IgA2m1, получают одновременно с удалением сайта XhoI во втором экзоне с помощью ПЦР c полимеразой Taq на матрице хромосомной ДНК человека из двух образцов с праймерами IgAF1SacI и IgAXhoR (первая половина гена) и IgAXhoF и IgA-RXhoN (вторая половина гена). Реакцию проводят в следующем температурном режиме: денатурация - 95°С, 30 сек; отжиг - 50°С, 40 сек; элонгация - 72°С, 2 мин; 30 циклов.
Результатом всех проведенных ПЦР-амплификаций является получение ДНК-фрагментов требуемой длины. Фрагменты выделяют из геля и клонируют в вектор pAL2-T (Евроген, Россия). Вектоp лигиpуют с фpагментами с помощью ДНК-лигазы фага Т4 пpи 12°С в течение ночи. Лигазной смесью тpансфоpмиpуют компетентные клетки E.coli штамма XL-1 Blue. Для первичного анализа используют бело-голубую селекцию. Плазмидную ДНК клонов, отобранных по наличию в продуктах ПЦР фрагментов соответствующих длин, выделяют из ночных культур и дополнительно анализируют с помощью ПЦР с теми же парами праймеров. Отобранные по наличию фрагментов соответствующих длин клоны секвенируют по методу Сэнгера. Полученные нуклеотидные последовательности сравнивают с литературными данными с помощью выравнивания. Плазмидные ДНК клонов, чья нуклеотидная последовательность соответствует гену IgA2m1 и не содержит мутации, вызванные протеканием ПЦР, отбирают для последующей работы.
Объединение полученных фрагментов проводят с помощью метода SOE-PCR одновременно с удалением сайта XhoI во втором экзоне. Наличие данного сайта препятствует клонированию ДНК константных доменов в экспрессионный вектор.
На первом этапе проводят амплификацию половин гена по отдельности, используя в качестве матриц ДНК клонов, не содержащих артефактных нуклеотидных замен по отношению к последовательности константных доменов из баз данных. ПЦР с полимеразой Pfu проводят в следующем температурном режиме: денатурация - 94°С, 30 сек; отжиг - 50°С, 40 сек; элонгация - 72°С, 2 мин; 30 циклов. ДНК-фрагменты требуемой длины выделяют из геля.
На втором этапе выделенные ПЦР-фрагменты, полученные на первом этапе, смешивают и амплифицируют с использованием концевых олигонуклеотидных праймеров IgAF1SacI и IgA-RXhoN, фланкирующих интронированный вариант гена изотипа IgA2m1. Реакцию с помощью полимеразы Taq проводят в следующем температурном режиме: денатурация - 95°С, 30 сек; отжиг - 50°С, 40 сек; элонгация - 72°С, 2 мин; 30 циклов. В итоге получают ДНК-фрагмент длиной 1,578 т.п.о., кодирующий полноразмерный константный домен IgA2m1.
Фрагмент выделяют из геля и клонируют в вектор pAL2-T. Вектоp лигиpуют с фpагментом с помощью ДНК-лигазы фага Т4 пpи 12 °С в течение ночи. Лигазной смесью тpансфоpмиpуют компетентные клетки E.coli штамма XL-1 Blue. Для первичного анализа используют бело-голубую селекцию. Колонии анализируют с помощью ПЦР с праймерами M13/pUC-46F и M13/pUC-46R, внешними к вставке. Структура олигонуклеотидных праймеров приведена в Таблице 4. Плазмидную ДНК отобранных по наличию фрагмента длиной 1,847 т.п.о. клонов выделяют из ночных культур и анализируют с помощью ПЦР с праймерами IgAF1SacI и IgA-RXhoN. Кроме того, плазмидную ДНК клонов дополнительно анализируют с помощью рестрикции с рестриктазами SacI и XhoI.
Отобранные положительные клоны секвенируют по Сэнгеру в области вставки по двум цепям. Проведенный гомологичный анализ нуклеотидных последовательностей с целью обнаружения в последовательностях отдельных клонов артефактных мутаций, вызванных протеканием ПЦР, позволяет идентифицировать плазмидные ДНК, в которых последовательность константного домена полностью соответствует завленной в базе данных Genbank.
Таким образом, из хромосомной ДНК человека получают и клонируют содержащий интронированный вариант гена константного домена иммуноглобулина изотипа IgA2m1.
Таблица 5.
Праймеры для амплификации кодирующей последовательности константных доменов тяжелой цепи изотипа IgA2m1 иммуноглобулина А. В скобках указана длина олигонуклеотидов
Все приведенные праймеры разработаны для получения данной последовательности и ранее не встречались в литературе.
Пример 1г. Мутагенез кодирующей последовательности IgA2m1 и конструирование промежуточной плазмиды pAL-2T-IgA2m1-Int_mut2
Для увеличения выхода антитела P4A1 изотипа IgA2m1 и повышения стабильности целевого белка проводят мутагенез кодирующей последовательности константных доменов его тяжелой цепи. Исходя из литературных данных [Lohse S. et al. Recombinant dimeric IgA antibodies against the epidermal growth factor receptor mediate effective tumor cell killing // Journal of Immunology (Baltimore, Md.: 1950). 2011. № 6 (186). C. 3770-3778] выбирают следующие замены: N166G, P221R, C311S, N337T, I338L, T339S. Замена P221R позволяет установить и стабилизировать дисульфидную связь между цистеинами тяжелой (C241) и легкой (C214) цепей IgA2m1 и, соответственно, увеличивает термическую и долгосрочную стабильность антитела. Замена С311S — для предотвращения образования дополнительных дисульфидных связейи и уменьшения образование агрегатов. Замены N166G и N337T — для уменьшения уровня N-гликозилирования, что улучшает гомогенность как клеточной культуры, так и получаемого белкового препарата. Замены N337T, I338L, T339S основываются на последовательности IgA1 в соответствующих положениях и способствуют сохранению стабильности структуры белка.
Внесение мутаций в константные домены проводят путём сайт-направленного мутагенеза кодирующей последовательности с помощью SOE-ПЦР. В качестве исходной последовательности используют плазмиду pAL-2T-IgA2m1-Int, содержащую ген константной области тяжелой цепи IgA2m1 с интронами без собственного сигнала pA.
Внесение мутаций проводят путём сайт-направленного мутагенеза с помощью SOE-ПЦР. Для внесения мутаций используют праймеры: N166G-F, N166G-R, P221R-F3, P221R-R3, C311S-F, C311S-R, TLS-F2, TLS-R1 и IgAF1SacI, IgARXhoN. Структура олигонуклеотидных праймеров приведена в Таблице 6. Одноименные прямой и обратный праймеры имеют комплементарные участки на 5`-конце в области мутации для возможности последующего объединения фрагментов методом SOE-ПЦР. Праймеры IgAF1SacI, IgARXhoN имеют используемые для дальнейшего клонирования сайты рестрикции SacI и XhoI, соответственно.
ПЦР проводят в два этапа. На первом этапе на исходной матрице плазмиды pAL-2T-IgA2m1-Int, содержащей ген константной области тяжелой цепи IgA2m1 с интронами без собственного сигнала pA, методом ПЦР с полимеразой Pfu, используя соответствующие пары праймеров, получают 5 фрагментов. Ожидаемые при амплификации размеры ДНК-фрагментов приведены в Таблице 7. ПЦР с полимеразой Pfu проводят в следующем температурном режиме: денатурация - 94°С, 30 сек; отжиг - 50°С, 40 сек; элонгация - 72°С, 2 мин; 30 циклов. Электрофореграмма очистки полученных фрагментов представлена на Фиг. 2. ДНК-фрагменты требуемой длины выделяют из геля.
На втором этапе выделенные ПЦР-фрагменты, полученные на первом этапе, смешивают и амплифицируют с использованием концевых олигонуклеотидных праймеров IgAF1SacI и IgA-RXhoN, фланкирующих интронированный вариант гена изотипа IgA2m1. Реакцию с помощью полимеразы Taq проводят в следующем температурном режиме: денатурация - 95°С, 30 сек; отжиг - 50°С, 40 сек; элонгация - 72°С, 2 мин; 30 циклов. В итоге получают ДНК-фрагмент длиной 1,578 т.п.о., кодирующий полноразмерный константный домен IgA2m1 с внесенными мутациями. Электрофореграмма очистки полученных фрагментов представлена на Фиг. 3.
Фрагмент длиной 1,578 т.п.о. выделяют из геля и клонируют в вектор pAL2-T. Вектоp лигиpуют с фpагментом с помощью ДНК-лигазы фага Т4 пpи 12 °С в течение ночи. Лигазной смесью тpансфоpмиpуют компетентные клетки E.coli штамма XL-1 Blue. Для первичного анализа используют бело-голубую селекцию. Колонии анализируют с помощью ПЦР с праймерами M13/pUC-46F и M13/pUC-46R, внешними к вставке. Структура олигонуклеотидных праймеров приведена в Таблице 4. Плазмидную ДНК отобранных по наличию фрагмента длиной 1,847 т.п.о. клонов выделяют из ночных культур и анализируют с помощью ПЦР с праймерами IgAF1SacI и IgA-RXhoN. Кроме того, плазмидную ДНК клонов дополнительно анализируют с помощью рестрикции с рестриктазами SacI и XhoI.
Отобранные положительные клоны секвенируют по Сэнгеру в области вставки по двум цепям. Проведенный гомологичный анализ нуклеотидных последовательностей с целью обнаружения в последовательностях отдельных клонов артефактных мутаций, вызванных протеканием ПЦР, позволяет идентифицировать плазмидные ДНК, в которых последовательность константного домена полностью соответствует завленной в базе данных Genbank с внесенными искомыми заменами.
Таким образом, получают плазмиду pAL-2T-IgA2m1-Int_mut2, содержащую интронированный вариант гена константного домена иммуноглобулина изотипа IgA2m1 с искомыми заменами N166G, P221R, C311S, N337T, I338L, T339S.
Таблица 6.
Праймеры для мутагенеза кодирующей последовательности константных доменов тяжелой цепи изотипа IgA2m1 иммуноглобулина А. В скобках указана длина олигонуклеотидов.
Все приведенные праймеры разработаны для получения данной последовательности и ранее не встречались в литературе.
Таблица 7.
Размер ДНК-фрагментов при первом этапе SOE-ПЦР для мутагенеза кодирующей последовательности константных доменов тяжелой цепи изотипа IgA2m1 иммуноглобулина А.
Пример 1д. Конструирование промежуточной рекомбинантной плазмидной ДНК pcDNA3.4-P4A1L-IRES-J12His-MluI.
Для получения фрагмента, содержащего внутренний сайт связывания рибосом (IRES) вируса энцефаломиокардита (EMCV) для кэп-независимой трансляции гена J-цепи, плазмиду pOpti-F10L-MluI [Балабашин Д.С., Зайцева-Зотова Д.С., Топорова В.А., Панина А.А., Марквичева Е.А., Свирщевская Е.В., Алиев Т.К. Способы увеличения продукции рекомбинантных антител в клеточных линиях СНО DG44 // Современные проблемы науки и образования. - 2011. - №5.] [Алиев Т.К., Балабашин Д.С., Долгих Д.А., Кирпичников М.П., Панина А.А., Топорова В.А. Рекомбинантная плазмидная ДНК, кодирующая химерное антитело против фактора некроза опухоли-альфа человека, линия экуариотических клеток - продуцент химерного антитела и способ получения химерного антитела. Патент №2555533 http://www.findpatent.ru/patent/255/2555533.html © FindPatent.ru - патентный поиск, 2012-2016] обрабатывают рестриктазами XhoI и BglII, продукты реакции разделяют с помощью электpофоpеза в 1 % легкоплавкой агаpозе. Фрагмент IRES XhoI-BglII 0,636 т.п.о. выделяют из геля.
Для получения кодирующей последовательности J-цепи с двенадцатью гистидинами на С-конце плазмиду pAL-2T-J-12His обрабатывают рестриктазами BglII и XhoI. Продукты реакции разделяют с помощью электpофоpеза в 1 % легкоплавкой агаpозе, фрагмент BglII-XhoI 0,663 т.п.о. выделяют из геля.
Плазмиду pcDNA3.4-P4A1L-MluI обрабатывают рестриктазой XhoI совместно со щелочной фосфатазой для предотвращения замыкания вектора на себя в процессе лигирования. Продукты реакции разделяют с помощью электpофоpеза в 1 % легкоплавкой агаpозе. Вектор выделяют из геля.
Вектор лигируют с фрагментами IRES XhoI-BglII 0,636 т.п.о. и BglII-XhoI 0,663 т.п.о. с помощью ДНК-лигазы фага Т4 пpи 12 °С в течение ночи. Лигазной смесью тpансфоpмиpуют компетентные клетки E.coli штамма XL-1 Blue. Колонии анализируют с помощью ПЦР с праймерами IRES-F и hJ-12HisR, фланкирующими обе вставки. Структура олигонуклеотидных праймеров приведена в Таблице 8. Реакцию с помощью полимеразы Taq проводят в следующем температурном режиме: денатурация - 95°С, 30 сек; отжиг - 50°С, 40 сек; элонгация - 72°С, 2 мин; 30 циклов. Продукты реакции разделяют с помощью электpофоpеза в 1 % легкоплавкой агаpозе. Плазмидную ДНК отобранных по наличию фрагмента длиной 1,312 т.п.о. клонов выделяют из ночных культур и анализируют с помощью ПЦР с праймерами LkcF и IRES-R. Кроме того, плазмидную ДНК клонов дополнительно анализируют с помощью рестрикции с рестриктазой XhoI.
Отобранные положительные клоны секвенируют по Сэнгеру в области вставки по двум цепям. Проведенный гомологичный анализ нуклеотидных последовательностей с целью обнаружения в последовательностях отдельных клонов артефактных мутаций позволяет идентифицировать плазмидные ДНК, в которых последовательность вставки домена полностью соответствует искомой.
Таким образом, получают плазмиду pcDNA3.4-P4A1L-IRES-J12His-MluI, содержащую ген легкой цепи антитела P4A1 под контролем промотора CMV, следующий за ним внутренний сайт связывания рибосом (IRES) вируса энцефаломиокардита (EMCV) для кэп-независимой трансляции гена J-цепи, ген J-цепи и следующий за ним регуляторный элемент WPRE и сайт полиаденилирования тимидинкиназы вируса простого герпеса TKpA. В начале промотора CMV находится сайт узнавания рестриктазы MluI, выбранный для дальнейшего клонирования. Структура полученной промежуточной плазмиды pcDNA3.4-P4A1L-IRES-J12His-MluI приведена в Фиг. 4.
Таблица 8.
Праймеры для анализа клонов плазмиды pcDNA3.4-P4A1L-IRES-J12His-MluI. В скобках указана длина олигонуклеотидов.
Все приведенные праймеры разработаны для получения данной последовательности и ранее не встречались в литературе.
Пример 1е. Конструирование промежуточных плазмид pSK-EF1-P4A1HA2m1-Int-BGH и pSK-EF1-P4A1HA2m1mut2-Int-BGH.
Кодирующая последовательность тяжелой цепи антитела P4A1 [Guo, Y., Huang, L., Zhang, G. et al. A SARS-CoV-2 neutralizing antibody with extensive Spike binding coverage and modified for optimal therapeutic outcomes. Nat Commun 12, 2623 (2021). https://doi.org/10.1038/s41467-021-22926-2] составлена, исходя из аминокислотной и нуклеотидной последовательности тяжелой цепи антитела P4A1 [Патент WO/2021/257695 A61K 38/00 2006.1, опубл. 23.12.2021 г.] и сайтов узнавания рестриктаз. Для получения кодирующей последовательности используются олигонуклеотидные праймеры (структура праймеров приведена в Таблице 1) [Патент RU2801178C1 C12N15/13 2006.01, опубл. 03. 08.2023 г.].
Кодирующую последовательность тяжелой цепи получают методом ПЦР на матрице плазмиды с составленной последовательностью с полимеразой Pfu со специфическими олигонуклеотидными праймерами P4A1-HNheIF и P4A1-HSacIR, при этом на 5’-конец гена вводят сайт узнавания рестриктазы NheI, а на 3’-конец – сайты SacI и Bsp120I. Реакцию проводят в следующем температурном режиме: денатурация - 94°С, 30 сек; отжиг - 50°С, 40 сек; элонгация - 72°С, 1 мин; 30 циклов. Фрагмент очищают с помощью электpофоpеза в 1 % легкоплавкой агаpозе и выделения фрагмента из геля. После обработки ПЦР-фрагмента рестриктазами NheI и SacI фрагмент ДНК, содержащий кодирующую последовательность вариабельного домена тяжелой цепи антитела снова очищают с помощью электpофоpеза в 1 % легкоплавкой агаpозе и выделения фрагмента из геля.
Также полученные промежуточные плазмиды pAL-2T-IgA2m1-Int_mut2 и pAL-2T-IgA2m1-Int обрабатывают рестриктазами SacI и XhoI. Продукты реакции разделяют в 1% агарозном геле. Фрагменты IgA2m1-Int_mut2 / SacI-XhoI и IgA2m1-Int / SacI-XhoI длиной 1,402 т.п.о., содержащие мутантный и природный интронированные варианты кодирующей последовательности константной области изотипа IgA2m1, вырезают и выделяют из геля для последующих лигирований.
Для подстыковки кодирующих последовательностей вариабельной области тяжелой цепи антитела P4A1 и константной области IgA2m1 ПЦР-фрагмент NheI-SacI и фрагменты SacI-XhoI из плазмид pAL-2T-IgA2m1-Int_mut2 и pAL-2T-IgA2m1-Int клонируют в предобработанную рестриктазами NheI и XhoI плазмиду pSK+/hEF1-HTLV-BGH [Патент RU2555533С2, C12N 15/13 (2006.01), опубл. 27.11.2014]. Вектоp лигиpуют с фpагментами с помощью ДНК-лигазы фага Т4 пpи 12 °С в течение ночи. Лигазными смесями тpансфоpмиpуют компетентные клетки E.coli штамма XL-1 Blue. Колонии анализируют с помощью ПЦР с праймерами P4A1-HNheIF и P4A1-HSacIR. Плазмидную ДНК отобранных по наличию и длине фрагмента клонов выделяют из ночных культур и анализируют с помощью ПЦР с праймерами IgAF1SacI и IgA-RXhoIN. Кроме того, плазмидную ДНК клонов дополнительно анализируют с помощью рестрикции с рестриктазой SacI. Отбирают плазмидные ДНК, содержащие нужный набор рестрикционных фрагментов. Определяют нуклеотидную последовательность отобранных клонов промежуточных рекомбинантных плазмидных ДНК pSK-EF1-P4A1HA2m1-Int-BGH и pSK-EF1-P4A1HA2m1mut2-BGH секвенированием по двум цепям по методу Сэнгера. Структура полученной промежуточной плазмиды pSK-EF1-P4A1HA2m1mut2-Int-BGH приведена в Фиг. 5. Структура промежуточной плазмиды pSK-EF1-P4A1HA2m1-Int-BGH аналогична.
Пример 1ж. Конструирование рекомбинантных плазмид p3.4-P4A1IgA2m1mut2-J12His-Intht и p3.4-P4A1IgA2m1-J12His-Intht.
Рекомбинантную плазмидную ДНК pcDNA3.4-P4A1L-IRES-J12His-MluI обрабатывают рестриктазой MluI и дефосфорилируют с помощью фосфатазы CIAP, из полученного гидролизата выделяют линеаризованную плазмидную ДНК длиной 8,056 т.п.о. после электрофоретического разделения в 0,8%-ном агарозном геле.
Промежуточную рекомбинантную плазмидную ДНК pSK-EF1-P4A1HA2m1-Int-BGH обрабатывают рестриктазой MluI, из полученного гидролизата выделяют фрагмент ДНК длиной 2,664 т.п.о. после электрофоретического разделения в 0,8%-ном агарозном геле.
Промежуточную рекомбинантную плазмидную ДНК pSK-EF1-P4A1HA2m1mut2-Int-BGH обрабатывают рестриктазой MluI, из полученного гидролизата выделяют фрагмент ДНК длиной 2,664 т.п.о. после электрофоретического разделения в 0,8%-ном агарозном геле.
Векторную часть плазмидной ДНК pcDNA3.4-P4A1L-IRES-J12His-MluI/MluI длиной 8,056 т.п.о. и MluI/MluI - фрагменты ДНК длиной 2,664 т.п.о., включающий в себя гибридный промотор hEF1-HTLV из плазмиды pMG, интронированный природный или мутантный вариант гена тяжелой цепи антитела P4A1 изотипа IgA2m1 и сигнал полиаденилирования гена фактора роста быка BGH из плазмиды pBudCE4.1, сшивают при помощи лигазной реакции и клонируют.
Вектоp лигиpуют с фpагментами с помощью ДНК-лигазы фага Т4 пpи 12 °С в течение ночи. Лигазной смесью тpансфоpмиpуют компетентные клетки E.coli штамма XL-1 Blue. Колонии анализируют с помощью ПЦР с полимеразой Taq с праймерами P4A1-HNheIF и P4A1-HSacIR. Реакцию проводят в следующем температурном режиме: денатурация - 95°С, 30 сек; отжиг - 50°С, 40 сек; элонгация - 72°С, 1 мин; 30 циклов. Продукты реакции разделяют в 1% агарозном геле. Плазмидную ДНК отобранных по наличию и длине фрагмента клонов выделяют из ночных культур и анализируют с помощью рестрикции по наличию двух сайтов узнавания рестриктазы MluI (наличие в продуктах реакции фрагментов ДНК длиной 2,664 т.п.о.).
Кроме того, плазмидную ДНК клонов дополнительно анализируют с помощью рестрикции с рестриктазами NheI и XhoI (появление второго сайта узнавания рестриктаз свидетельствует о наличии вставки).
Пример 1з. Определение взаимной ориентации генов тяжелой и легкой цепей в полученных рекомбинантных плазмидах p3.4-P4A1IgA2m1mut2-J12His-Intht и p3.4-P4A1IgA2m1-J12His-Intht.
Встраивание фрагментов MluI-MluI в плазмиду pcDNA3.4-P4A1L-IRES-J12His-MluI возможно в двух ориентациях: «голова-хвост» (ht), когда транскрипция генов тяжелой и легкой цепей антитела осуществляется в одном направлении, и «голова-голова» (hh), когда транскрипция разнонаправленная. Ориентацию встроенных MluI-MluI-фрагментов, включающих в себя гибридный промотор hEF1-HTLV из плазмиды pMG, интронированный природный или мутантный вариант гена тяжелой цепи антитела P4A1 изотипа IgA2m1 и сигнал полиаденилирования гена фактора роста быка BGH pA из плазмиды pBudCE4.1, определяют с помощью метода ПЦР с полимеразой Taq с олигонуклеотидными праймерами CMVrev1, BGHF и HTLV-R (праймеры в смесь добавляют в эквимолярном соотношении, состав праймеров приведен в Таблице 9). Реакцию проводят в следующем температурном режиме: денатурация - 95°°С, 30 сек; отжиг - 50°С, 40 сек; элонгация - 72°С, 1 мин; 30 циклов. Продукты реакции разделяют в 1% агарозном геле. Длины получаемых фрагментов приведены в Таблице 10.
Дополнительно плазмидную ДНК клонов анализируют с помощью обработки рестриктазами NheI и XhoI (появление второго сайта узнавания рестриктаз свидетельствует о наличии вставки). Продукты реакции разделяют в 1% агарозном геле.
Окончательно структуру рекомбинантных плазмидных ДНК p3.4-P4A1IgA2m1mut2-J12His-Inthh, p3.4-P4A1IgA2m1-J12His-Inthh, p3.4-P4A1IgA2m1mut2-J12His-Intht и p3.4-P4A1IgA2m1-J12His-Intht подтверждают определением нуклеотидной последовательности секвенированием по методу Сэнгера. Структура плазмиды p3.4-P4A1IgA2m1mut2-J12His-Intht приведена в Фиг. 6. Структура плазмиды p3.4-P4A1IgA2m1-J12His-Intht аналогична.
Таблица 9.
Структура олигонуклеотидных праймеров, использованных для определения взаимной ориентации генов тяжелой и легкой цепей и секвенирования в плазмидах p3.4-P4A1IgA2m1mut2-J12His-Inthh, p3.4-P4A1IgA2m1-J12His-Inthh, p3.4-P4A1IgA2m1mut2-J12His-Intht и p3.4-P4A1IgA2m1-J12His-Intht. В скобках указана длина олигонуклеотидов.
Все приведенные праймеры разработаны для получения данной последовательности и ранее не встречались в литературе.
Таблица 10.
Длины фрагментов (п.о.), получаемых при определении взаимной ориентации генов тяжелой и легкой цепей в плазмидах p3.4-P4A1IgA2m1mut2-J12His-Inthh, p3.4-P4A1IgA2m1-J12His-Inthh, p3.4-P4A1IgA2m1mut2-J12His-Intht и p3.4-P4A1IgA2m1-J12His-Intht.
BGHF
HTLV-R
Пример 2. Получение клеток CHO – продуцентов димеров IgA2m1 нейтрализующего антитела P4A1 против вируса SARS-CoV-2 (2019-nCoV) с применением плазмид p3.4-P4A1IgA2m1mut2-J12His-Intht и p3.4-P4A1IgA2m1-J12His-Intht.
Продукцию димеров IgA2m1 нейтрализующего антитела P4A1 против вируса SARS-CoV-2 (2019-nCoV) с применением плазмид p3.4-P4A1IgA2m1mut2-J12His-Intht и p3.4-P4A1IgA2m1-J12His-Intht осуществляют путем транзиентной экспрессии. Продукцию белков осуществляют в суспензионной культуре клеток СНО. Для получения продуцента рекомбинантных антител человека проводят трансфекцию клеток яичника китайского хомячка CHO плазмидами p3.4-P4A1IgA2m1mut2-J12His-Intht и p3.4-P4A1IgA2m1-J12His-Intht. За сутки до трансфекции клетки сеют в 100 мл колбы Эрлеемейера, содержащие 30 мл среды OptiCHO (Invitrogen, США) до стартовой клеточной плотности 4*106 кл/мл. Клетки культивируют в CO2-инкубаторе при 37°C, 96% влажности и 8% CO2. Трансфекцию проводят через 20-24 ч с использованием трансфекционного реагента Lipofectamine 2000 (Invitrogen, США) cогласно инструкции производителя. Плазмидную ДНК добавляют к клеткам в виде ДНК-липосомного преципитата. На одну трансфекцию используют 25 мкг плазмидной ДНК. Культивирование осуществляют в течение 10-14 сут при 37 °С в атмосфере, содержащей 8% СО2, на орбитальном шейкере при 120 об/мин до снижения уровня жизнеспособности культуры до уровня 106 кл/мл (10-14 сут).
Измерение концентрации клеток и их жизнеспособности проводят с использованием 0.04% раствора трипанового синего в камере Горяева.
По завершению культивирования клетки осаждают центрифугированием при 1000 об/мин в течение 10 мин, супернатант переносят в чистые пробирки и центрифугируют при 4000 об/мин в течение 30 мин. К cупернатану добавляют PMSF и NaN3 до концентраций 25-50 мкг/мл и 50-100 мкг/мл, соответственно, переносят в чистые пробирки и хранят при +4 °С до выделения целевого белка.
Продуктивность измеряют с помощью иммуноферментного анализа по стандартной методике.
Природный вариант достигает уровня 3.6 мг/мл за 3 суток, мутантный - 4.7 мг/мл, что говорит о положительном влиянии выбранных мутаций на продукцию антитела.
Пример 3. Получение, выделение и очистка белкового продукта с помощью клеток CHO, продуцирующих димер человеческих антител P4A1 мутантного изотипа IgA2m1 с J-цепью.
Получение белкового продукта производят в колбах Эрленмейера различного объема без рассекателей в ростовой среде CD OptiCHO как описывается в Примере 2. Культивирование для получения белкового продукта производят не менее 14 дней.
После окончания культивирования для получения продукта димера человеческих антител P4A1 мутантного изотипа IgA2m1 с J-цепью полученную кондиционированную среду от культур трансфецированных клеток центрифугируют при 4000 об/мин в течение 30 мин. Супернатант смешивают в соотношении 4:1 с Буфером для нанесения (50 мМ фосфат калия, 400 мМ KCl, pH=7.2) и наносят на подготовленную Буфером для нанесения Ni-сефарозную колонку HisTrap HP (GE Healthcare Bio-Sciences AB, Швеция). При элюции используют Буфер для элюции (фосфатно-солевой буфер, 137 мМ NaCl, 2,7 мМ KCl, 10 мМ Na2HPO4, 1,76 мМ KH2PO4, pH 7,4 с добавлением 500 мМ имидазола). Образец наносят при комнатной температуре с помощью перистальтического насоса. После нанесения образца колонку промывают 3 раза по 10 мл Буфером для нанесения. Смывание антител с колонки производят с помощью 8 фракций по 1 мл Буфера для элюции. Полученные образцы выделенных антител диализуют против ФСБ (фосфатно-солевой буфер, 137 мМ NaCl, 2,7 мМ KCl, 10 мМ Na2HPO4, 1,76 мМ KH2PO4, pH 7,4) и хранят при температуре +4 ºC.
Оценку гомогенности и степени очистки препарата проводят с использованием электрофоретического метода. Электрофорез проводят в 10%-ном полиакриламидном геле. В качестве контроля используют неокрашенный белковый маркер молекулярных весов (Fermentas, Великобритания). Перед внесением к 15 мкл образца антител добавляют 5 мкл Буфера для нанесения с 2-меркаптоэтанолом (2-МЭ) (200 мМ Трис-HCl, pH 6,8, 400 мМ 2-МЭ, 4% натрия додецилсульфат, 0,01 % бромофеноловый синий, 40 %-ный глицерин). Образцы для внесения на гель инкубируют при температуре 37 ºC в течение 10 мин. Антитела наносят в Буфере для нанесения, как содержащем 2-МЭ, так и в отсутствии него.
Полученные образцы продукта димера антител P4A1 мутантного изотипа IgA2m1 с J-цепью характеризуются следующими показателями:
- гомогенность препарата не менее 98% (по данным гель-электрофореза в 10%-ном полиакриламидном геле с денситометрией);
- молекулярная масса – 308000 Да (по данным гель-электрофореза с белковыми маркерами молекулярных весов);
- молекулярная масса легкой цепи антитела – 24000 Да, молекулярная масса тяжелой цепи антитела – 50000 Да, молекулярная масса J-цепи – 17300 Да (по данным гель-электрофореза с белковыми маркерами молекулярных весов).
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<?xml version="1.0" encoding="UTF-8"?>
<!DOCTYPE ST26SequenceListing PUBLIC "-//WIPO//DTD Sequence Listing
1.3//EN" "ST26SequenceListing_V1_3.dtd">
<ST26SequenceListing dtdVersion="V1_3" fileName="Способ получения
димерной формы мутантного иммуноглобулина IgA2m1-изотипа в клетках
млекопитающих.xml" softwareName="WIPO Sequence"
softwareVersion="2.2.0" productionDate="2024-04-04">
<ApplicationIdentification>
<IPOfficeCode>RU</IPOfficeCode>
<ApplicationNumberText>2023135525</ApplicationNumberText>
<FilingDate>2023-12-27</FilingDate>
</ApplicationIdentification>
<ApplicantFileReference>2023135525</ApplicantFileReference>
<ApplicantName languageCode="ru">Государственный Научный Центр
Федеральное государственное бюджетное учреждение науки Институт
биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова
Российской академии наук</ApplicantName>
<ApplicantNameLatin>Shemyakin-Ovchinnikov Institute of Bioorganic
Chemistry of the Russian Academy of Sciences</ApplicantNameLatin>
<InventionTitle languageCode="ru">Способ получения димерной формы
мутантного иммуноглобулина IgA2m1-изотипа в клетках млекопитающих
</InventionTitle>
<SequenceTotalQuantity>10</SequenceTotalQuantity>
<SequenceData sequenceIDNumber="1">
<INSDSeq>
<INSDSeq_length>477</INSDSeq_length>
<INSDSeq_moltype>AA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..477</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>protein</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q2">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>synthetic construct</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>MGWSCIILFLVATATGVHSEVQLVESGGGLIQPGGSLRLSCAASGFIVS
SNYMSWVRQAPGKGLEWVSIIYSGGSTFYADSVKGRFTISRDNSKNTLYLQMNSLRVEDTAVYYCARDLQ
ELGSLDYWGQGTLVTVSSASPTSPKVFPLSLDSTPQDGNVVVACLVQGFFPQEPLSVTWSESGQGVTARN
FPPSQDASGDLYTTSSQLTLPATQCPDGKSVTCHVKHYTNPSQDVTVPCRVPPPPPCCHPRLSLHRPALE
DLLLGSEANLTCTLTGLRDASGATFTWTPSSGKSAVQGPPERDLCGCYSVSSVLPGSAQPWNHGETFTCT
AAHPELKTPLTATLSKSGNTFRPEVHLLPPPSEELALNELVTLTCLARGFSPKDVLVRWLQGSQELPREK
YLTWASRQEPSQGTTTFAVTSILRVAAEDWKKGDTFSCMVGHEALPLAFTQKTIDRLAGKPTHVNVSVVM
AEVDGTCY</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="2">
<INSDSeq>
<INSDSeq_length>670</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..670</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>unassigned DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q4">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>tgctgcccaccccgagttgaagaccccactaaccgccaccctctcaaaa
tccggtgggtccagaccctgctcggggccctgctcagtgctctggtttgcaaagcatattcccggcctgc
ctcctccctcccaatcctgggctccagtgctcatgccaagtacagagggaaactgaggcaggctgagggg
ccaggacacagcccagggtgcccaccagagcagaggggctctctcatcccctgcccagccccctgacctg
gctctctaccctccaggaaacacattccggcccgaggtccacctgctgccgccgccgtcggaggagctgg
ccctgaacgagctggtgacgctgacgtgcctggcacgtggcttcagccccaaggatgtgctggttcgctg
gctgcaggggtcacaggagctgccccgcgagaagtacctgacttgggcatcccggcaggagcccagccag
ggcaccaccaccttcgctgtgaccagcatactgcgcgtggcagccgaggactggaagaagggggacacct
tctcctgcatggtgggccacgaggccctgccgctggccttcacacagaagaccatcgaccgcttggcggg
taaacccacccatgtcaatgtgtctgttgtcatggcggaggtggacggcacctgctactga</INSDSeq
_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="3">
<INSDSeq>
<INSDSeq_length>234</INSDSeq_length>
<INSDSeq_moltype>AA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..234</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>protein</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q6">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>synthetic construct</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>METDTLLLWVLLLWVPGSTGDIQMTQSPSSVSASVGDRVTITCRASQGI
SSWLAWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQEANSFPYTFG
QGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSK
DSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="4">
<INSDSeq>
<INSDSeq_length>708</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..708</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>unassigned DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q8">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>atggagacagacacactcctgctatgggtactgctgctctgggttccag
gctccaccggcgatatccagatgacacagtctcctagtagcgtgtccgcttctgttggggaccgggtcac
cattacatgtcgggctagtcagggtatctcttcttggctggcctggtatcagcaaaaacccggcaaggcg
ccgaagctgctgatctacgctgctagctccttacaatctggggtcccttctaggttcagcggcagcggca
gcggcaccgacttcacactcaccatttcttccctgcaacccgaggacttcgccacatactattgccaaga
agcgaattctttcccttacacatttggacaagggactaagctggaaatcaaacgcaccgtggccgctcca
agcgtattcatctttccacctagcgatgagcagctgaagtccggaacagcttctgtggtctgcctgctga
ataacttctaccctagggaggccaaggtccagtggaaggtggacaacgcccttcaatctggaaactcgca
agaatctgtaactgaacaagactctaaagacagtacctactccctgtctagcacactgaccctgtccaag
gccgactacgagaagcataaagtctacgcttgtgaagtgacgcatcaaggcctctctagccctgttacca
aaagctttaaccgaggagaatgctaatag</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="5">
<INSDSeq>
<INSDSeq_length>171</INSDSeq_length>
<INSDSeq_moltype>AA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..171</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>protein</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q10">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>synthetic construct</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>MKNHLLFWGVLAVFIKAVHVKAQEDERIVLVDNKCKCARITSRIIRSSE
DPNEDIVERNIRIIVPLNNRENISDPTSPLRTRFVYHLSDLCKKCDPTEVELDNQIVTATQSNICDEDSA
TETCYTYDRNKCYTAVVPLVYGGETKMVETALTPDACYPDHHHHHHHHHHHH</INSDSeq_sequence
>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="6">
<INSDSeq>
<INSDSeq_length>516</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..516</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>unassigned DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q12">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>atgaagaaccatttgcttttctggggagtcctggcggtttttattaagg
ctgttcatgtgaaagcccaagaagatgaaaggattgttcttgttgacaacaaatgtaagtgtgcccggat
tacttccaggatcatccgttcttccgaagatcctaatgaggacattgtggagagaaacatccgaattatt
gttcctctgaacaacagggagaatatctctgatcccacctcaccattgagaaccagatttgtgtaccatt
tgtctgacctctgtaaaaaatgtgatcctacagaagtggagctggataatcagatagttactgctaccca
gagcaatatctgtgatgaagacagtgctacagagacctgctacacttatgacagaaacaagtgctacaca
gctgtggtcccactcgtatatggtggtgagaccaaaatggtggaaacagccttaaccccagatgcctgct
atcctgaccatcaccatcaccatcaccatcaccatcaccatcactaa</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="7">
<INSDSeq>
<INSDSeq_length>680</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..680</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>unassigned DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q14">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>gttgacattgattattgactagttattaatagtaatcaattacggggtc
attagttcatagcccatatatggagttccgcgttacataacttacggtaaatggcccgcctggctgaccg
cccaacgacccccgcccattgacgtcaataatgacgtatgttcccatagtaacgccaatagggactttcc
attgacgtcaatgggtggagtatttacggtaaactgcccacttggcagtacatcaagtgtatcatatgcc
aagtacgccccctattgacgtcaatgacggtaaatggcccgcctggcattatgcccagtacatgacctta
tgggactttcctacttggcagtacatctacgtattagtcatcgctattaccatggtgatgcggttttggc
agtacatcaatgggcgtggatagcggtttgactcacggggatttccaagtctccaccccattgacgtcaa
tgggagtttgttttggcaccaaaatcaacgggactttccaaaatgtcgtaacaactccgccccattgacg
caaatgggcggtaggcgtgtacggtgggaggtctatataagcagagctcgtttagtgaaccgtcagatcg
cctggagacgccatccacgctgttttgacctccatagaagacaccgggaccgatccagcctccggactct
a</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="8">
<INSDSeq>
<INSDSeq_length>532</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..532</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>unassigned DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q16">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>gctccggtgcccgtcagtgggcagagcgcacatcgcccacagtccccga
gaagttggggggaggggtcggcaattgaaccggtgcctagagaaggtggcgcggggtaaactgggaaagt
gatgtcgtgtactggctccgcctttttcccgagggtgggggagaaccgtatataagtgcagtagtcgccg
tgaacgttctttttcgcaacgggtttgccgccagaacacagctgaagcttcgaggggctcgcatctctcc
ttcacgcgcccgccgccctacctgaggccgccatccacgccggttgagtcgcgttctgccgcctcccgcc
tgtggtgcctcctgaactgcgtccgccgtctaggtaagtttaaagctcaggtcgagaccgggcctttgtc
cggcgctcccttggagcctacctagactcagccggctctccacgctttgcctgaccctgcttgctcaact
ctacgtctttgtttcgttttctgttctgcgccgttacagatccaagctgtgaccggcgcctac</INSDS
eq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="9">
<INSDSeq>
<INSDSeq_length>224</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..224</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>unassigned DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q18">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>ctgtgccttctagttgccagccatctgttgtttgcccctcccccgtgcc
ttccttgaccctggaaggtgccactcccactgtcctttcctaataaaatgaggaaattgcatcgcattgt
ctgagtaggtgtcattctattctggggggtggggtggggcaggacagcaagggggaggattgggaagaca
atagcaggcatgctggggatgcggtgggctctatg</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="10">
<INSDSeq>
<INSDSeq_length>588</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..588</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>unassigned DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q20">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>gccgcccctctccctcccccccccctaacgttactggccgaagccgctt
ggaataaggccggtgtgcgtttgtctatatgttattttccaccatattgccgtcttttggcaatgtgagg
gcccggaaacctggccctgtcttcttgacgagcattcctaggggtctttcccctctcgccaaaggaatgc
aaggtctgttgaatgtcgtgaaggaagcagttcctctggaagcttcttgaagacaaacaacgtctgtagc
gaccctttgcaggcagcggaaccccccacctggcgacaggtgcctctgcggccaaaagccacgtgtataa
gatacacctgcaaaggcggcacaaccccagtgccacgttgtgagttggatagttgtggaaagagtcaaat
ggctctcctcaagcgtattcaacaaggggctgaaggatgcccagaaggtaccccattgtatgggatctga
tctggggcctcggtacacatgctttacatgtgtttagtcgaggttaaaaaaacgtctaggccccccgaac
cacggggacgtggttttcctttgaaaaacacgatgataatatggccaca</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
</ST26SequenceListing>
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения димерной формы иммуноглобулина IgA1-изотипа в клетках млекопитающих | 2023 |
|
RU2822890C1 |
| СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО ИММУНОГЛОБУЛИНА IGA2m1-ИЗОТИПА В КЛЕТКАХ МЛЕКОПИТАЮЩИХ | 2022 |
|
RU2801178C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pBiPr-ABIgA2m1F16-ht ДЛЯ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО ИММУНОГЛОБУЛИНА А ИЗОТИПА IGA2m1 | 2016 |
|
RU2671477C2 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pBiPr-ABIgA1FI6-Intht ДЛЯ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО ИММУНОГЛОБУЛИНА А ИЗОТИПА IgA1 | 2016 |
|
RU2664184C2 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pBiPr-ABIgA1FI6-ht ДЛЯ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО ИММУНОГЛОБУЛИНА А ИЗОТИПА IGA1 | 2016 |
|
RU2656142C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК, КОДИРУЮЩАЯ ХИМЕРНОЕ АНТИТЕЛО ПРОТИВ ФАКТОРА НЕКРОЗА ОПУХОЛИ-АЛЬФА ЧЕЛОВЕКА, ЛИНИЯ ЭУКАРИОТИЧЕСКИХ КЛЕТОК-ПРОДУЦЕНТ ХИМЕРНОГО АНТИТЕЛА И СПОСОБ ПОЛУЧЕНИЯ ХИМЕРНОГО АНТИТЕЛА | 2013 |
|
RU2555533C9 |
| Универсальный интеграционный вектор SB7G_HIGH и рекомбинантная плазмида SB7G_HIGH_DEV_57, обеспечивающая синтез и секрецию рекомбинантного человеческого антитела к рецептор-связывающему домену (RBD) коронавируса SARS-CoV-2 в клетках млекопитающих и полученная с использованием универсального вектора SB7G_HIGH, и рекомбинантное моноклональное антитело DEV_K57, обладающее вируснейтрализующей активностью в отношении SARS-CoV-2 | 2023 |
|
RU2829359C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pOptiVEC-MBP-Fc, КОДИРУЮЩАЯ КОНСТАНТНЫЙ ФРАГМЕНТ ИММУНОГЛОБУЛИНА ЧЕЛОВЕКА, СЛИТНОГО С ФРАГМЕНТОМ ОСНОВНОГО БЕЛКА МИЕЛИНА, ЛИНИИ ЭУКАРИОТИЧЕСКИХ КЛЕТОК - ПРОДУЦЕНТОВ УКАЗАННОГО БЕЛКА И СПОСОБ ПОЛУЧЕНИЯ БЕЛКА MBP-Fc ДЛЯ ТЕРАПИИ РАССЕЯННОГО СКЛЕРОЗА | 2016 |
|
RU2679055C2 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pСL1, КОДИРУЮЩАЯ ПОЛИПЕПТИД СО СВОЙСТВАМИ ЛЕГКОЙ ЦЕПИ АНТИТЕЛА ЧЕЛОВЕКА ПРОТИВ ВИРУСА ЭБОЛА, РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК рСН1, КОДИРУЮЩАЯ ПОЛИПЕПТИД СО СВОЙСТВАМИ ТЯЖЕЛОЙ ЦЕПИ УКАЗАННОГО АНТИТЕЛА, И ИХ ПРИМЕНЕНИЕ | 2004 |
|
RU2285043C2 |
| СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО АНТИГЕНА MBP_RBD_6His ВИРУСА SARS-CoV-2 с C-КОНЦЕВОЙ АФФИННОЙ МЕТКОЙ 6xHIS-tag, ПРЕДНАЗНАЧЕННОГО ДЛЯ ИСПОЛЬЗОВАНИЯЧ В КАЧЕСТВЕ КОМПОНЕНТА НАБОРА РЕАГЕНТОВ ДЛЯ СЕРОДИАГНОСТИКИ COVID-19 | 2023 |
|
RU2813324C1 |
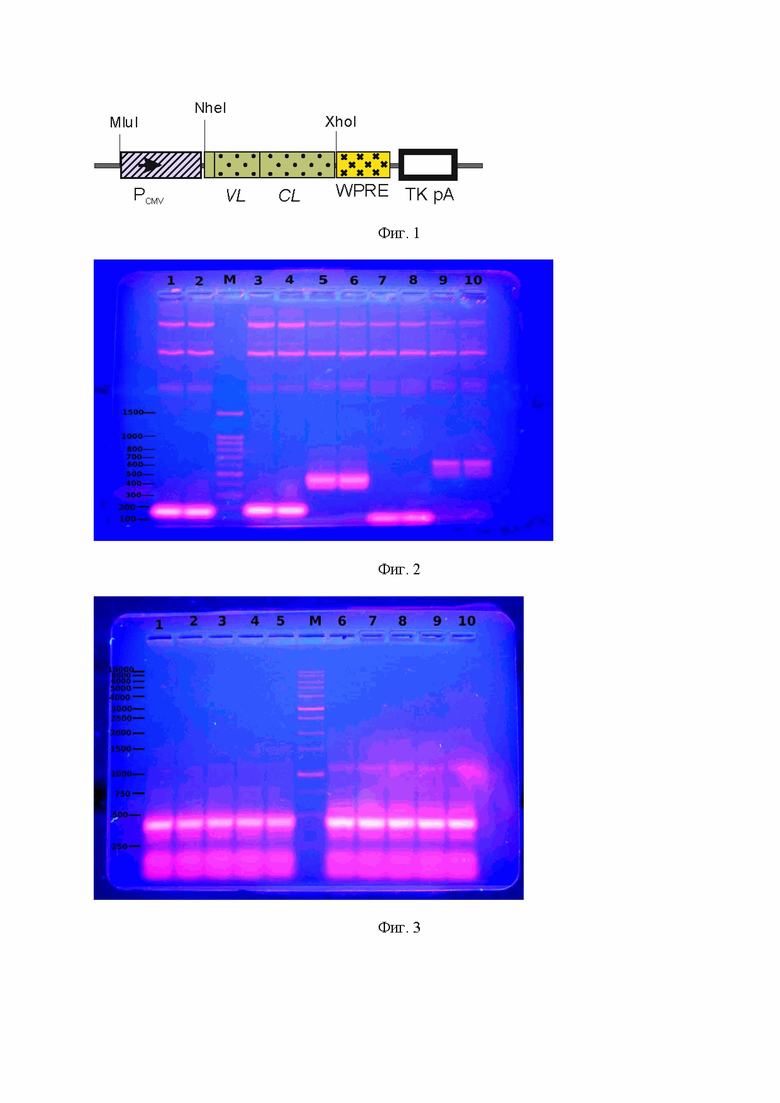

Изобретения относятся к области биотехнологии. Предложена рекомбинантная плазмидная ДНК p3.4-P4A1IgA2m1mut2-J12His-Intht, кодирующая нейтрализующее моноклональное антитело P4A1 к вирусу SARS-CoV-2 мутантного изотипа IgA2m1 и J-цепь человека. Плазмида содержит интронированный ген тяжелой цепи антитела, находящийся под контролем промотора hEF1-HTLV и сигнала полиаденилирования бычьего гормона роста BGH polyA, ген легкой цепи антитела и ген J-цепи человека, находящиеся под контролем промотора CMV и внутреннего сайта связывания рибосом (IRES) вируса энцефаломиокардита (EMCV), посттранскрипционный регуляторный элемент WPRE вируса гепатита сурка (WHV) и сигнал полиаденилирования тимидинкиназы вируса герпеса. Промоторы hEF1-HTLV и CMV размещены в последовательности, обеспечивающей однонаправленную транскрипцию. Также предложен способ получения димера нейтрализующего моноклонального антитела P4A1 против вируса SARS-CoV-2 мутантного изотипа IgA2m1 с J-цепью, включающий культивирование клеток СНО, трансфецированных рекомбинантной плазмидной ДНК p3.4-P4A1IgA2m1mut2-J12His-Intht. Изобретения обеспечивают одновременную экспрессию генов тяжелой и легкой цепей антитела и гена J-цепи в результате трансфекции одной плазмидой и выход димера нейтрализующего моноклонального антитела 4,7 мг/мл культуральной среды. 2 н. и 1 з.п. ф-лы, 6 ил., 10 табл., 3 пр.
1. Рекомбинантная плазмидная ДНК p3.4-P4A1IgA2m1mut2-J12His-Intht, кодирующая нейтрализующее моноклональное антитело P4A1 против вируса SARS-CoV-2 мутантного изотипа IgA2m1, содержащая мутантный интронированный ген тяжелой цепи антитела с нуклеотидной последовательностью SEQ ID NO: 2, кодирующей аминокислотную последовательность SEQ ID NO: 1, находящийся под контролем промотора hEF1-HTLV с нуклеотидной последовательностью SEQ ID NO: 8 и сигнала полиаденилирования бычьего гормона роста BGH polyA с нуклеотидной последовательностью SEQ ID NO: 9, ген легкой цепи антитела с нуклеотидной последовательностью SEQ ID NO: 4, кодирующей аминокислотную последовательность SEQ ID NO: 3, и ген J-цепи человека с нуклеотидной последовательностью SEQ ID NO: 6, кодирующей аминокислотную последовательность SEQ ID NO: 5, находящиеся под контролем промотора CMV с нуклеотидной последовательностью SEQ ID NO: 7 и внутреннего сайта связывания рибосом IRES вируса энцефаломиокардита EMCV с нуклеотидной последовательностью SEQ ID NO: 10, посттранскрипционный регуляторный элемент WPRE вируса гепатита сурка WHV и сигнал полиаденилирования тимидинкиназы вируса герпеса, при этом промоторы hEF1-HTLV и CMV размещены в последовательности, обеспечивающей однонаправленную транскрипцию.
2. Рекомбинантная плазмидная ДНК по п.1, характеризующаяся тем, что она выполнена на базе плазмиды pcDNA™3.4-TOPO®, включающей также посттранскрипционный регуляторный элемент WPRE вируса гепатита сурка WHV и сигнал полиаденилирования тимидинкиназы вируса герпеса, сайт начала репликации в E. coli из плазмиды pUC, ген β-лактамазы, а также следующие модификации – единичные сайты узнавания рестриктаз NheI и XhoI после промотора CMV для клонирования ДНК легкой цепи антитела.
3. Способ получения димера нейтрализующего моноклонального антитела P4A1 против вируса SARS-CoV-2 мутантного изотипа IgA2m1 с J-цепью, включающий:
- культивирование в питательной среде линии клеток яичника китайского хомячка СНО,
- трансфекцию линии клеток рекомбинантной плазмидной ДНК p3.4-P4A1IgA2m1mut2-J12His-Intht по п.1 или 2,
- выделение полученного целевого димерного антитела P4A1 против вируса SARS-CoV-2 мутантного изотипа IgA2m1 с J-цепью из культуральной жидкости.
| GUO, Y | |||
| et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Способ регенерирования сульфо-кислот, употребленных при гидролизе жиров | 1924 |
|
SU2021A1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pBiPr-ABIgA1FI6-ht ДЛЯ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО ИММУНОГЛОБУЛИНА А ИЗОТИПА IGA1 | 2016 |
|
RU2656142C1 |
| Способ регенерирования сульфо-кислот, употребленных при гидролизе жиров | 1924 |
|
SU2021A1 |
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА ПРОТИВ РЕЦЕПТОР-СВЯЗЫВАЮЩЕГО ДОМЕНА SPIKE-БЕЛКА ВИРУСА SARS-COV-2 И ИХ АНТИГЕНСВЯЗЫВАЮЩИЕ ФРАГМЕНТЫ, КОДИРУЮЩИЕ ИХ НУКЛЕИНОВЫЕ КИСЛОТЫ, А ТАКЖЕ СПОСОБЫ ПРИМЕНЕНИЯ | 2021 |
|
RU2800649C2 |
| СПОСОБ ИСПОЛЬЗОВАНИЯ РЕКОМБИНАНТНЫХ БЕЛКОВ SARS-COV-2 В СОСТАВЕ ТЕСТ-СИСТЕМЫ ДЛЯ ИММУНОФЕРМЕНТНОГО АНАЛИЗА С ОПРЕДЕЛЕНИЕМ УРОВНЕЙ АНТИТЕЛ КЛАССОВ IgM, IgG, IgA В СЫВОРОТКЕ/ПЛАЗМЕ КРОВИ БОЛЬНЫХ COVID-19 | 2020 |
|
RU2730897C1 |
Авторы
Даты
2024-07-15—Публикация
2023-12-27—Подача