Изобретение относится к способам обработки и очистке танталосодержащих руд и соединений. В частности настоящее изобретение относится к способам получения соединений тантала высокой чистоты из стандартной технической пятиокиси тантала.
Высокочистые металлический тантал и его пятиокись приобретают все более важное значение в электронной промышленности для получения усовершенствованных электронных материалов, используемых при изготовлении таких приборов, как поверхностные акустические волновые фильтры, пироэлектрические датчики инфракрасного излучения и оптоэлектрические приборы. Кроме того, пятиокись тантала высокой чистоты требуется для получения танталовых рентгеновских люминофоров, необходимых при изготовлении экранов для рентгеновских усилителей. Чистота металлического тантала и его пятиокиси, используемых в производстве указанных материалов, должна превышать 99,99% и предпочтительно составлять 99,9999%.
Существуют три основных способа очистки танталосодержащих материалов: дистилляция (или хлорирование), жидкостная экстракция и ионный обмен. При дистилляционном способе смесь из загрязненного танталосодержащего материала и углерода взаимодействует с газообразным хлором при температуре 600-800oC. Хотя дистилляция представляет собой хорошо изученный и действующий промышленный процесс очистки танталосодержащих материалов, здесь сталкиваются с проблемой разделения тантала и ниобия ввиду близких точек кипения у хлорида тантала (239oC) и хлорида ниобия (249oC). Так как ниобий является повсеместной примесью танталосодержащих материалов, методы экстрагирования с помощью растворителя и ионный обмен являются предпочтительными по сравнению с дистилляцией в тех случаях, когда желательно получение тантала и его пятиокиси высокой чистоты.
При жидкостной экстракции загрязненный танталосодержащий материал растворяют в среде фтористо-водородной кислоты и приводят в контакт с органическим растворителем. Соединения тантала селективно экстрагируют в органическую фазу, подвергают далее обратной экстракции в водный раствор и осаждают в виде гидроокиси тантала путем гидролиза с помощью водного аммиака. Осажденную гидроокись можно перевести в пятиокись тантала кальцинированием на воздухе. Однако для получения желаемого продукта высокой чистоты необходим многоступенчатый циклический процесс "экстракция-обратная экстракция". Примеры использования жидкостной экстракции приведены в патентах США NN 3117833, 3712939 и 4673554.
В методах с использованием ионного обмена загрязненный танталосодержащий материал растворяют в среде фтористо-водородной кислоты и затем пропускают через анионно-обменную колонку, которая селективно удерживает металлический тантал. Примеси остаются в растворе и удаляются со сточными водами. Удерживаемые соединения тантала затем элюируют из колонны и осаждают в виде гидроокиси тантала описанным выше способом. Пример такого метода описан в патенте США N 4446115. Однако из-за довольно низкой обменной способности анионно-обменной смолы этот способ является дорогостоящим для применения в промышленном масштабе.
Хотя имеющийся уровень техники сосредоточивается на очистке танталосодержащей руды и скрапа, существуют большие запасы технической пятиокиси тантала, которые могли бы обеспечить сравнительно недорогое сырье для получения металлического тантала и его окиси высокой чистоты. Однако стандартная техническая пятиокись тантала содержит целый ряд различных примесей (например, Al, Si, F, Cl, Na, Cr, Fe, Co, Ni, Cu, Ti, Zr, Mo, Nb и W) в количестве от 0,05 до 1% (500-10000 (ppm). Такие высокие примеси были бы неприемлемы для применения в электронной промышленности и для производства люминофоров. Следовательно, перед использованием необходимо произвести очистку технической пятиокиси тантала.
К сожалению, пятиокись тантала чрезвычайно трудно растворяется даже во фтористо-водородной кислоте (HF), особенно кристаллическая фаза B - Ta2O5. Непосредственное растворение в HF требует непомерно длительного времени и расхода кислоты, определяемого стехиометрией реакции. Следовательно, прямое растворение пятиокиси тантала для использования в стандартных методах очистки, таких как жидкостная экстракция и ионный обмен, промышленно неосуществимо.
Химическую реакцию растворения Ta2O5 во фтористо-водородной кислоте можно записать следующим образом
Ta2O5 + 14HF (водн.) ---> 2Н2TaF7(водн.) + 5H2O
Кинетика реакции растворения Ta2O5 в среде HF была изучена И.И.Барамом (И.И.Барам, Журн. прикладной химии, т. 38, с. 2181-88, 1965). Согласно полученным результатам только около 5,3 г чистой Ta2O5, которая была подвергнута кальцинированию при 800oC в течение 3 часов, растворилась в 1 л 14,6 М раствора HF в течение 4 часов при 70oC. Поскольку сообщалось, что реакция растворения является реакцией первого порядка по отношению к содержанию HF, можно было вычислить, что приблизительно 10,8 г Ta2O5 растворилось бы в 1 л 29 М раствора HF в течение 4 часов при 70oC, а молярное соотношение HF:Ta2O5 составило бы приблизительно 1200:1. Таким образом, очевидно, что при указанных выше условиях требуется значительно больше HF для растворения Ta2O5, чем продиктовано стехиометрией. Присутствие такого большого избытка фтористо-водородной кислоты не только экономически нежелательно, то также, по всей вероятности, и опасно.
Хотя увеличение температуры будет увеличивать скорость растворения, количество требуемой для этого HF все же во много раз превышает стехиометрическое. Например, за 3 дня при температуре 100oC в 190 мл приблизительно 25 М раствора HF можно растворить около 15 г Ta2O5 при молярном соотношении HF: Ta2O5, равном 140:1, или 10-кратное стехиометрическое количество. Однако при использовании для растворения более высоких температур увеличивается также потребление энергии и концентрация опасных паров фтористо-водородной кислоты.
Поэтому значительным усовершенствованием в данной области техники явился бы такой способ растворения Ta2O5 в среде HF с образованием танталосодержащего раствора, который можно было непосредственно использовать в стандартных методах очистки методами жидкостной хроматографии и ионного обмена. Кроме того, значительное усовершенствование состояло бы в достижении такого способа растворения Ta2O5 в среде HF, который требовал бы гораздо меньшего расхода HF по сравнению с тем, который необходим для прямого растворения Ta2O5 в среде HF в тех же условиях.
Цель настоящего изобретения состоит в том, чтобы устранить недостатки известного уровня техники.
Другая цель настоящего изобретения состоит в том, чтобы обеспечить экономичный и безопасный метод растворения и очистки пятиокиси тантала.
Еще одна цель настоящего изобретения состоит в том, чтобы обеспечить способ растворения и очистки пятиокиси тантала без применения методик жидкостной экстракции или ионного обмена.
Согласно одному аспекту изобретения обеспечивается способ растворения и очистки пятиокиси тантала, включающий взаимодействие пятиокиси тантала и калийсодержащего соединения с образованием танталата калия, растворение танталата калия в среде фтористо-водородной кислоты с получением раствора, содержащего тантал и примеси, и отделение соединения тантала от примесей.
Согласно другому аспекту изобретения обеспечивается способ растворения и очистки пятиокиси тантала, включающий взаимодействие стехиометрического количества загрязненной пятиокиси тантала и карбоната калия с образованием танталата калия, необязательное получение суспензии танталата калия в серной кислоте, растворение танталата калия в среде фтористо-водородной кислоты с получением раствора, содержащего тантал и примеси, осаждение фтортанталата калия с помощью водорастворимого соединения калия, фильтрование раствора с получением мокрого осадка, суспендирование мокрого осадка в воде, необязательно добавление эффективного количества хелатирующего агента, осаждение (NH4)2Ta2O5•H2O путем добавления гидроокиси аммония и кальцинирование (NH4)2Ta2O5•H2O для получения пятиокиси тантала с низким содержанием ниобия и переходных металлов.
Краткое описание чертежа
Чертеж представляет собой технологическую схему, которая иллюстрирует способ, предложенный в настоящем изобретении.
Позиции на технологической схеме
1 - стадия растворения;
2 - объединение стехиометрических количеств Ta2О5 и K2CO3;
3 - нагревание при температуре 550-1300oC в течение 3-20 часов для образования KTaO3;
4 - промывка и сушка при 100oC;
5 - образование суспензии в серной кислоте (необязательная стадия);
6 - растворение в HF (кислая среда);
7 - добавление KCl для образования осадка K2TaF7;
8 - отделение осадка от жидкости и промывка;
9 - суспендирование осадка в воде;
10 - добавление гидроокиси аммония с получением белого осадка;
11 - фильтрование, промывка и сушка с получением (NH4)2Ta2O6•H2O;
12 - кальцинирование при температуре 900-1000oC;
13 - "электронный" сорт Ta2O5;
14 - жидкостная экстракция или ионный обмен;
15 - очищенная Ta2O5;
16 - промывка и сушка при температуре 110oC;
17 - "конденсаторный" сорт K2TaF7,
18 - добавка ЭДТА как хелатирующего агента.
Для лучшего понимания настоящего изобретения в сочетании с другими и дополнительными его аспектами, преимуществами и практическими возможностями авторы ссылаются на следующее ниже описание и прилагаемую к нему формулу изобретения. Примеры служат для иллюстрации поставленной цели и не должны каким-либо образом ограничивать изобретение конкретным примером его осуществления.
Для очистки технической пятиокиси тантала с помощью стандартных методов жидкостной экстракции или ионного обмена необходимо сначала растворить загрязненную пятиокись тантала в среде фтористо-водородной кислоты. Во избежание трудностей, с которыми сталкиваются при непосредственном растворении Ta2O5 в среде HF, загрязненную пятиокись тантала сначала переводят в танталат калия KTaO3 путем взаимодействия Ta2O5 со стехиометрическим количеством калийсодержащего соединения, предпочтительно карбоната калия K2CO3, при температуре 550o-1300oC в течение 3-20 часов. Могут быть использованы и другие источники калия, например KCl, K2O, K2C2O4 и др. Предпочтительная реакция протекает по следующей схеме:
Ta2O5 + K2CO3 ---> 2KTaO3 + CO2 (газ)1
Предпочтительная температура и время реакции составляют, соответственно, 750-850oC и 5-10 часов.
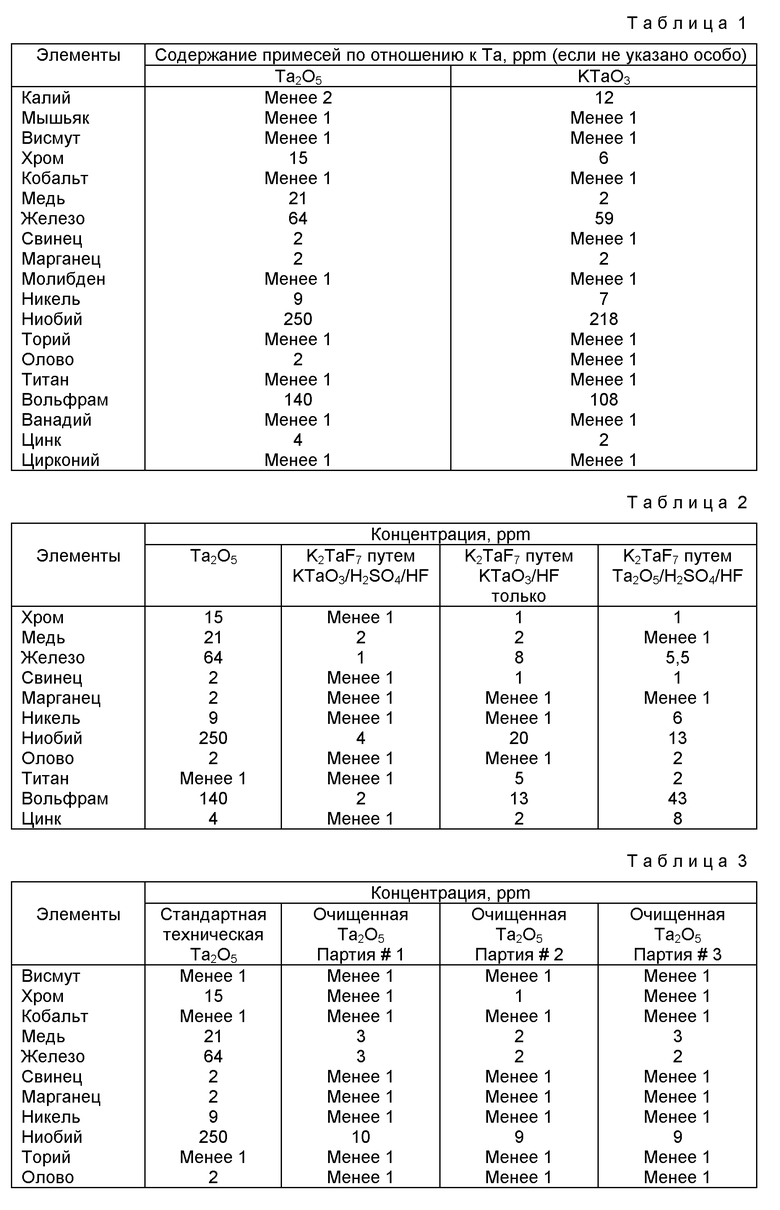
Конверсия стандартной технической Ta2O5 в KTaO3 дает очень эффективный метод растворения пятиокиси тантала в среде HF, так как KTaO3 растворяется в HF почти мгновенно. Более того, в процессе получения KTaO3 улучшается чистота технической пятиокиси тантала по отношению к W, Mo, Cr и Nb. Отмеченное увеличение чистоты иллюстрируется таблицей 1. Кроме того, KTaO3 в форме перовскита можно получить исключительно при температуре 700oC исходя из стехиометрических количеств K2CO3 и Ta2O5, без образования любого из метаболитов KTaO3 имеющего пирохлорную кубическую структуру.
После образования KTaO3 последний охлаждают, промывают водой и сушат при 110oC. KTaO3 интенсивно реагирует с HF и способен почти мгновенно раствориться в ней при комнатной температуре. Однако для более эффективного протекания процесса перед растворением в HF сначала готовят суспензию KTaO3 в серной кислоте.
Пример 1.
10 мл концентрированной (49-51%) фтористо-водородной кислоты добавляют к 5 г KTaO3, полученной из технического Ta2O5. Идет мгновенная и бурная экзотермическая реакция и почти весь твердый материал растворяется. Полученный раствор разбавляют до 200 мл водой и осаждают с помощью 7,4 М раствора гидроокиси аммония. Осадок анализируют методом масс-спектрометрии в тлеющем разряде (ТР-МС), с помощью которого определяют наличие 3 вес.% калия, остающегося в осадке, указывая тем самым на то, что более 97% KTaO3 растворилось в HF. Таким образом, раствор пятиокиси тантала с концентрацией 16-21 г/л Ta легко можно получить в среде приблизительно 1,5 М (или 2%) HF.
Примеры 2-3.
Из 25 г KTaO3, полученной из технического Ta2O5, готовят суспензию в 25 мл концентрированной H2SO4, а затем добавляют 24 мл концентрированной (29 М) фтористо-водородной кислоты (HF). В результате сильной экзотермической реакции образуется бесцветная паста, которую полностью растворяют в разбавленной HF (приблизительно 1,5 М), получая прозрачный раствор, содержащий около 17 г/л Ta.
Для сравнения в аналогичных условиях готовят суспензию из 25 г технической пятиокиси тантала и 25 мл концентрированной H2SO4, а затем добавляют 25 мл концентрированной HF. Никакой видимой реакции между твердой фазой и кислотой не наблюдается. Твердую фазу отделяют от HF, промывают водой, сушат и взвешивают. Как было установлено, только 1,2 г из исходного количества Ta2O5, равного 25 г, растворяется в HF.
Таким образом, в аналогичных условиях 20,6 г технической пятиокиси тантала (эквивалентной 25 г KTaO3) можно легко растворить в HF, трансформируя сначала Ta2O5 в KTaO3 в то время как только 1,2 г Ta2O5 можно перевести в раствор прямым растворением.
Пример 4.
125 г KTaO3, полученной из технической Ta2O5, растворяют менее чем за 10 минут в 5,5 л разбавленной смеси HF/H2SO4, содержащей 225 мл концентрированной HF и 200 мл концентрированной H2SO4. Следовательно, относительно легко получить раствор, содержащий 15 г/л Ta, используя разбавленную смесь из HF и H2SO4 (1% HF и 1,3 н • H2SO4).
Танталаты других щелочных металлов не обнаруживают такой же полезной способности к растворению, как KTaO3. Например, сравнительные испытания растворяющей способности KTaO3, NaTaO3 и LiTaO3 показывают, что в аналогичных условиях только 25% NaTaO3 и LiTaO3 растворились бы в HF по сравнению с почти 100%-ым количеством KTaO3.
Полагают, что реакция растворения KTaO3 протекает по следующей схеме
2KTaO3 + 14HF(водн.) --- > H2TaF7 (водн.) + 2KOH(водн.) + 4H2O
Некоторые из ионов калия реагируют с водной H2TaF7 в танталосодержащем растворе с образованием осадка фтортанталата калия K2TaF7. Однако осажденный K2TaF7 можно легко растворить в разбавленной HF или H2SO4. Таким образом, конверсия технической пятиокиси тантала в KTaO3 с последующим растворением в HF дает танталосодержащий раствор, подходящий для использования в стандартных методах очистки путем жидкостной экстракции или ионного обмена.
Кроме того, высокочистый "конденсаторный" K2TaF7 можно получить прямым осаждением из танталосодержащего раствора путем добавления водорастворимого калиевого соединения, например KCl. Реакция протекает по следующей схеме
H2TaF7 (водн.) + 2KCl ---> K2TaF7(тв.)1 + 2HCl
В предпочтительном варианте количество водорастворимого соединения калия, используемого в реакции, в два раза превышает стехиометрическое. Другие приемлемые водорастворимые соединения калия, которые можно использовать для получения осадка K2TaF7, включают K2CО3, KOH, KF, K2C2O4 и K2O.
Пример 5.
Фтортанталат калия высокой чистоты получают путем образования смеси из 132 г технической Ta2O5 с 45 г K2CO3. Смесь нагревают в тигле из двуокиси алюминия при температуре 750oC в течение 5-10 часов для образования KTaO3. После промывки KTaO3 водой и сушки при температуре 100oC 125 г сухого KTaO3 суспендируют в пластмассовом стакане в 125 мл концентрированной H2SO4, куда затем добавляют 225 мл концентрированной фтористо-водородной кислоты. В результате протекающей экзотермической реакции происходит превращение всего количества KTaO3 в K2TaF7/H2TaF7. Доводят водой объем полученной смеси до 4 л. Раствор отделяют от осадка фтортанталата калия и добавляют 100 хлористого калия для завершения процесса осаждения K2TaF7, который затем также отделяют от раствора. Оба осадка смешивают между собой и промывают двумя порциями (по 1 л) 0,5% HF (можно использовать также и воду). Промытую смесь сушат при 100oC и анализируют методами рентгеноструктурного анализа и масс-спектрометрии в тлеющем разряде (ТР-МС). Данные рентгеноструктурного анализа подтверждают, что полученные осадки представляют собой K2TaF7. Таблица 2 иллюстрирует зависимость чистоты осажденного K2TaF7 от чистоты технической двуокиси тантала. Полученные результаты показывают, что примеси ниобия и переходных металлов, присутствующие в технической двуокиси тантала, значительно снижаются, приводя к получению K2TaF7 высокой чистоты, который пригоден для использования в производстве танталовых конденсаторов.
Из таблицы 2 видно, что чистота у фтортанталата калия, полученного растворением KTaO3 (KTaO3/H2SO4/HF) гораздо выше, чем у фтортанталата калия, полученного прямым растворением Ta2O5 (Ta2O5/H2SO4/HF). Добавление в HF серной кислоты до растворения KTaO3 ускоряет удаление примесей ниобия и переходных металлов во время селективной кристаллизации K2TaF7. Как видно из таблицы 2, более чистую K2TaF7 получают при добавлении H2SO4 к KTaO3 перед растворением в HF (KTaO3/H2SO4/HF) по сравнению с прямым растворением танталата калия в HF(KTaO3/HF).
Фтортанталат калия (K2TaF7), полученный настоящим способом, не только представляет собой чистый продукт, а также может быть непосредственно переведен в гидратированный аммоний-танталоксид (танталово-кислый аммоний) без предварительного растворения в HF. Ввиду того, что фтортанталат калия (K2TaF7) моментально образуется из пересыщенного (по отношению к K2TaF7) раствора, он имеет более высокую удельную поверхность по сравнению с K2TaF7, полученным путем медленной кристаллизации. K2TaF7, полученный способом, заявленным в настоящем изобретении, имеет среднюю площадь поверхности около 0,62 м2/г, в то время как у промышленных образцов K2TaF7 она составляет (0,12±0,5) м2/г. Благодаря такой высокой удельной поверхности осажденный K2TaF7 можно непосредственно превратить в гидратированный танталово-кислый аммоний с помощью гидрата окиси аммония. Такой способ является значительным усовершенствованием по сравнению с существующей технологией, которая требует полного растворения K2TaF7 в HF перед конверсией в гидратированный аммонийтанталоксид благодаря взаимодействию с гидроокисью аммония.
Схема иллюстрирует различные пути, по которым можно получить очищенные танталосодержащие соединения после стадии растворения пятиокиси тантала. Центральный путь представляет собой предпочтительный, экономически выгодный мокрый химический способ получения высокочистой пятиокиси тантала. Этот способ не требует больших объемов органических растворителей, используемых в методах жидкостной экстракции, или сравнительно дорогостоящих смол и оборудования, необходимых для ионного обмена.
В предпочтительном способе для осаждения K2TaF7 из танталосодержащего раствора, полученного на стадии растворения, используют KCl. Осадок K2TaF7 отделяют от жидкости фильтрацией и промывают водой. Мокрый осадок затем суспендируют в воде и необязательно добавляют хелатирующий агент, такой как этилендиаминтетрауксусная кислота (ЭДТА), чтобы отделить переходные металлы, такие как железо и медь. После смешивания проводят прямую конверсию K2TaF7 в гидратированный аммонийтанталоксид (танталово-кислый аммоний) формулы (NH4)2Ta2O6 • H2O путем гидролиза суспензии с помощью раствора 14,5 М гидроокиси аммония, которую добавляют при непрерывном перемешивании суспензии. Через 2-3 часа образовавшийся осадок (NH4)2Ta2O6 • H2O фильтруют, промывают водой до достижения нейтрального значения pH и сушат при температуре 110oC. (NH4)2Ta2O6 • H2О можно затем перевести в пятиокись тантала путем кальцинирования при температуре 900-1000oC.
Очищенную пятиокись тантала получают путем образования смеси из 132 г технической Ta2O5, содержащей около 0,06% (600 ppm) примеси ниобия и других переходных металлов, и 45 г карбоната калия. Смесь нагревают в тигле из двуокиси алюминия при температуре 750-850oC в течение 5-10 часов для образования танталата калия KTаO3, который промывают водой и сушат при температуре 110oC. В пластмассовой емкости на 4 л готовят суспензию из 125 г танталата калия и 125 мл концентрированной серной кислоты, к которой затем добавляют 225 мл концентрированной HF. В результате протекающей экзотермической реакции происходит превращение всего количества танталата калия KTaO3 в K2TaF7/H2TaF7. Объем полученной смеси доводят водой до 4 л. Осадок фтортанталата калия образуется путем добавления к раствору 100 г KCl. После выпадения кристаллов фтортанталата калия верхний слой декантируют, оставляя около 1 г шлама. Добавляют 1 л воды, осадок K2TaF7 отфильтровывают, промывают водой (1,5 л) и повторно суспендируют в 6 л воды. Суспензию хорошо встряхивают и добавляют 1 г ЭДТА. Образование белого осадка происходит благодаря добавлению 800 мл 14,5-15 М раствора гидроокиси аммония при непрерывном перемешивании суспензии. Маточный раствор с белым осадком оставляют на время от 2 часов до 3 суток. Затем осадок фильтруют, промывают до нейтрального pH и сушат при 110oC, получая гидратированный танталово-кислый аммоний. Очищенную пятиокись тантала получают кальцинированием гидратированного аммонийтанталпентоксида при температуре 900o-1000oC в лодочке из двуокиси алюминия. Пробы с каждой стадии анализируют методами рентгеноструктурного анализа (PCA), масс-спектрометрии в тлеющем разряде (ТР-МС) и инфракрасной спектроскопии (ИКС).
Чистота пятиокиси тантала, полученной предпочтительным мокрым способом, иллюстрируется в таблицах 3 и 4. В таблице 3 чистоту технической пятиокиси тантала, используемой в качестве сырьевого продукта, сравнивают с чистотой полученной очищенной пятиокиси тантала для трех отдельных партий продукта. Чистота пятиокиси тантала, получаемой из двух различных источников технического продукта, приведена в таблице 4.
Таким образом, пятиокись тантала "электронной" чистоты получают без использования методов очистки с помощью жидкостной экстракции или ионного обмена. Хотя было описано и отмочено, что все рассмотренное здесь представляет собой предпочтительные варианты осуществления изобретения, для специалистов в данной области техники будет очевидно, что различные изменения могут быть сделаны без отступления от объема изобретения, который определяется прилагаемой ниже формулой.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ РАСТВОРЕНИЯ ПЯТИОКИСИ ТАНТАЛА | 2024 |
|
RU2829387C1 |
| Способ получения фтортанталата калия из танталсодержащих растворов | 2016 |
|
RU2623522C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФТОРТАНТАЛАТА КАЛИЯ | 1992 |
|
RU2031967C1 |
| Способ получения высокочистого оксида тантала из танталсодержащих растворов | 2015 |
|
RU2611869C1 |
| Способ получения сложного литиевого танталата лантана и кальция | 2019 |
|
RU2704990C1 |
| СПОСОБ ПОЛУЧЕНИЯ ОКИСЛОВ ТУГОПЛАВКИХ МЕТАЛЛОВ ИЗ ЛОПАРИТОВОГО КОНЦЕНТРАТА | 1999 |
|
RU2147621C1 |
| СПОСОБ ПОЛУЧЕНИЯ ОКИСЛОВ ТУГОПЛАВКИХ МЕТАЛЛОВ ИЗ ЛОПАРИТОВОГО КОНЦЕНТРАТА | 1999 |
|
RU2149912C1 |
| СПОСОБ РАЗЛОЖЕНИЯ ОТХОДОВ ПРОИЗВОДСТВА МОНОКРИСТАЛЛОВ СОЕДИНЕНИЙ ТУГОПЛАВКИХ МЕТАЛЛОВ С ЛИТИЕМ | 2002 |
|
RU2221746C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПЯТИОКИСЕЙ ТАНТАЛА И НИОБИЯ | 1996 |
|
RU2160709C2 |
| СПОСОБ ПОЛУЧЕНИЯ ОКИСЛОВ ТУГОПЛАВКИХ МЕТАЛЛОВ ИЗ ЛОПАРИТОВОГО КОНЦЕНТРАТА | 2000 |
|
RU2160787C1 |

Предложен способ растворения и очистки пятиокиси тантала. Загрязненная пятиокись тантала реагирует с калийсодержащим соединением с образованием танталата калия. Танталат калия суспендируют в серной кислоте и растворяют в среде фтористо-водородной кислоты. Полученный раствор пригоден для очистки стандартными методами ионного обмена или жидкостной экстракции. Кроме того, осадок фтортанталата калия можно получить путем добавления к раствору хлористого калия. Осадок фтортанталата далее переводят в пятиокись тантала путем суспендирования осадка в водном растворе, содержащем хелатирующий агент. Добавляют гидроокись аммония с получением аммонийтанталоксида, который затем превращают в пятиокись тантала кальцинированием при высокой температуре. Результат изобретения: создание способа растворения и очистки технической пятиокиси тантала, который был бы экономичен и безопасен. 2 c. и 15 з.п. ф-лы, 4 табл., 1 ил.
| JP 12007338 A, 11.01.2000 | |||
| ЗЕЛИКМАН А.Н | |||
| и др | |||
| НИОБИЙ И ТАНТАЛ | |||
| - М.: МЕТАЛЛУРГИЯ, 1990, с.45-49, 98 | |||
| Способ получения танталатов,ниобатов и ванадатов щелочных и/или щелочноземельных металлов | 1981 |
|
SU994414A1 |
| Устройство автоматического регулирования громкости | 1982 |
|
SU1104654A1 |
| DE 3919187 Al, 14.12.1989 | |||
| JP 04002618 A, 07.01.1992. | |||
Авторы
Даты
2001-07-27—Публикация
1996-11-29—Подача