Изобретение относится к медицине и медицинской промышленности и касается получения вещества из бурсы Фабрициуса птиц, обладающего иммуностимулирущей активностью.
Известны различные способы получения иммуностимуляторов, которые можно рассматривать в качестве аналогов предлагаемого способа. К ним, в первую очередь, можно отнести способы получения иммуностимулирующих веществ из центральных органов иммунитета: костного мозга (АС СССР N 1077089, 1994; АС СССР N 1836954, 1993; AC СССР N 1822784, 1993; АС СССР N 1005790, 1982; патент РФ N 2041716, 1995; патент РФ N 2120799, 1998) и тимуса (АС СССР N 975017, 1982; AC СССР N 1255136, 1986; АС СССР N 1443237, 1985; патент СССР N 1442064, 1988; АС РФ N 1112606, 1996; АС РФ N 1506668, 1996), а также из селезенки (АС СССР N 1158201, 1985; патент РФ N 2033796, 1995). Но наиболее близкими к предлагаемому решению являются способы получения иммуностимулирующих веществ из бурсы Фабрициуса - центрального органа гуморального иммунитета птиц, аналог которого у млекопитающих отсутствует.
Известен способ получения пептидного экстракта из бурсы, названного "бурсопоэтином" [1]. Способ включает забор бурсы Фабрициуса у цыплят в возрасте 8-10 недель, замораживание сырья, гомогенизацию в гомогенизаторе в среде RPMI-1630 с добавлением 15 мМ HEPES, 5% эмбриональной телячьей сыворотки, 14-18 ед/мл ДНК, 5 ед/мл гепарина, 100 ед/мл пенициллина и 100 мкг/мл стрептомицина с последующим центрифугированием. Супернатант собирают и для хранения замораживают при -70oC. Получаемое вещество обладает способностью стимулировать В-лимфоциты и их предшественники, и в значительно меньшей степени влиять на Т-клетки. Однако такой ограниченный спектр иммуностимулирующей активности не позволяет широко применять данное вещество в качестве иммуностимулятора. Кроме того, целевой продукт нестабилен при хранении, что делает трудным стандартизацию препарата.
Известен также способ получения вещества, стимулирующего иммунитет, путем экстракции физиологическим раствором из ткани сумки Фабрициуса [2]. Необходимо отметить, что конечный продукт указанного способа также представляет собой грубый, неочищенный экстракт, что придает ему дополнительные аллергогенные и токсические свойства и требует высокой концентрации вещества для проявления иммуностимулирующей активности.
Известен способ получения вещества, обладающего иммуностимулирующей активностью, из ткани сумки Фабрициуса птиц [3], который по технической сущности и достигаемому эффекту является наиболее близким к предлагаемому решению и выбран в качестве прототипа.
Согласно известному способу сумки Фабрициуса птиц замораживают при -40oC, гомогенизируют и загружают в реактор с охлаждением и мешалкой в 3%-ный раствор уксусной кислоты (1 часть сырья к 5 частям раствора уксусной кислоты) и добавляют хлорид цинка из расчета 1 г на 1 л 3%-ной уксусной кислоты (pH 3,5-4,0). Экстракцию проводят в течение 48-72 ч при 4-10oC. Экстракт отфильтровывают, центрифугируют (5000 об/мин в течение 20 мин) и приливают в охлажденный ацетон в соотношении 1:5 (1 часть экстракта к 5 частям ацетона). Формирование осадка продолжается 24 ч при (-5)-(-8)oC. Осадок отфильтровывают под вакуумом и отмывают чистым ацетоном. Раствор препарата стерилизуют фильтрацией, разливают в стерильные флаконы и лиофилизируют. Полученное вещество обладает иммуностимулирующей активностью - нормализует иммунный статус у бурсэктомированных и тимэктомированных животных, усиливает экспрессию lg-рецепторов на В-лимфоцитах, увеличивает количество Еа-РОК в культуре лимфоцитов.
Однако данный способ позволяет получить вещество, обладающее низкой иммуностимулирующей активностью. Так, вещество, полученное по способу-прототипу, проявляет свою активность лишь в концентрации 100 мкг/мл in vitro и 1 мг/кг веса тела in vivo. Кроме того, молекулярная масса данного вещества колеблется от 2000 до 12000 Д, что указывает на присутствие большого количества примесных соединений, не обладающих специфической активностью. Присутствие значительного количества балластных неактивных компонентов и обуславливает необходимость столь высокой дозировки, а также наличие побочных эффектов препарата.
Заявляемое изобретение направлено на повышение иммуностимулирующей активности вещества. Решение поставленной задачи достигается тем, что сырье замораживают трехкратно при -40oC, чередуя заморозку с оттаиванием, экстракцию проводят 1 н. раствором уксусной кислоты с добавлением ингибитора протеаз фенилметилсульфонилфторида 0,1 мМ в течение 30-60 минут, а целевой продукт подвергают гель-фильтрации на Tyoperal HW-40 и отбирают фракции с молекулярной массой от 300 до 3000 Д.
Способ осуществляется следующим образом.
Используемые в качестве сырья сумки Фабрициуса птиц получают на птицефабрике при разделке цыплят-бройлеров, причем забор сырья вписывается в технологическую цепочку забоя. Полученное сырье подвергают трехкратному замораживанию при температуре -40oC, чередующимся с оттаиванием. Затем сырье гомогенизируют в гомогенизаторе. Гомогенат заливают 1 н. раствором уксусной кислоты в объемном соотношении 1:5 (1 часть сырья и 5 частей раствора), добавляют фенилметилсульфонилфторид в концентрации 0,1 мМ. Экстракцию проводят на холоду при температуре +4 - +8oC в течение 30-60 минут при постоянном перемешивании. Экстракт фильтруют через бязевую ткань, центрифугируют при 5000 об/мин в течение 20 минут. К фильтрату добавляют охлажденный ацетон в соотношении 1: 5 (1 часть супернатанта и 5 частей ацетона). Формирование осадка продолжается в течение 24 часов при температуре (-5)-(-8)oC. Осадок фильтруют под вакуумом, отмывают чистым ацетоном и высушивают на воронке Бюхнера. Порошок растворяют в 0,1 н. уксусной кислоте и центрифугируют при 8000 об/мин в течение 20 минут. Супернатант подвергают гель-фильтрации на Tyoperal HW-40 и отбирают фракции с молекулярной массой от 300 до 3000 Д. Собранные фракции объединяют, разливают в стерильные флаконы и лиофилизируют. Полученное вещество обладает высокой иммуностимулирующей активностью.
Способ иллюстрируется следующими примерами.
ПРИМЕР 1. Берут 100 г свежезамороженных сумок Фабрициуса птиц, гомогенизирут в гомогенизаторе с добавлением 1 н. раствора уксусной кислоты. Далее гомогенат заливают 5 объемами 1 н. раствора уксусной кислоты и добавляют фенилметилсульфонилфторид 0,1 мМ. Экстракцию проводят в течение 30 минут при температуре +4oC при постоянном перемешивании. Затем экстракт фильтруют через бязевую ткань, центрифугируют при 5000 об/мин в течение 20 минут. К полученному экстракту добавляют охлажденный до -6oC ацетон в соотношении 1:5 (1 часть экстракта и 5 частей ацетона), осадок формируют в течение 24 часов при температуре -6oC. Полученный осадок отфильтровывают под вакуумом, тщательно промывают чистым ацетоном и высушивают. Порошок растворяют в 10 объемах 0,1 н. уксусной кислоты, перемешивая в течение 30 минут. Нерастворившийся осадок отделяют центрифугированием при 8000 об/мин при +4oC в течение 20 минут. Супернатант наносят на колонку с Tyoperal HW-40. Гель-фильтрацию проводят при +4oC, используя в качестве элюента 0,1 н. раствор уксусной кислоты, отбирают фракции с молекулярной массой от 300 до 3000 Д. Собранные фракции объединяют, разливают во флаконы по 3 мл и лиофильно высушивают. Полученное вещество обладает широким спектром иммуностимулирующей активности, так, например, in vitro в концентрации 10 мкг/мл увеличивает количество CD3+ клеток с 37,9 ±1,5 до 71,1±1,7%, a CD22+ клеток с 5,4±0,4 до 9,1±0,6%.
ПРИМЕР 2. 300 г сумок Фабрициуса птиц подвергают трехкратной заморозке при 40oC, затем измельчают в гомогенизаторе с добавлением 1 н. раствора уксусной кислоты. Гомогенат заливают 5 объемами 1 н. уксусной кислоты с добавлением фенилметилсульфонилфторида 0,1 мМ. Экстракцию проводят в течение 60 минут при температуре +6oC при постоянном перемешивании. Затем экстракт фильтруют через бязевую ткань, центрифугируют при 5000 об/мин в течение 20 минут. К полученному экстракту добавляют охлажденный до -8oC ацетон в соотношении 1:6 (1 часть экстракта и 6 частей ацетона), осадок формируют в течение 24 часов при температуре -8oC. Полученный осадок отфильтровывают под вакуумом, тщательно промывают трехкратным объемом чистого ацетона и высушивают. Порошок растворяют в 10 объемах 0,1 н. уксусной кислоты при перемешивании в течение 1 часа и центрифугируют при 8000 об/мин в течение 20 минут. Супернатант подвергают гель-фильтрации на Tyoperal HW-40 на холоду, элюцию проводят 0,1 н. уксусной кислоты, собирают фракции с молекулярной массой от 300 до 3000 Д. Собранные фракции объединяют, разливают во флаконы по 3 мл и лиофилизируют. Полученное вещество обладает высокой иммуностимулирующей активностью, в частности у эмбрионально бурсэктомированных цыплят в дозе 100 мкг/кг массы тела увеличивает титр гемагглютининов и гемолизинов с 2,1±0,4 до 5,9±0,5 и с 1,3±0,2 до 4,0±0,4 log2 соответственно, а количество АОК в селезенке с 10,5±1,3 до 22,5±1,5•103.
Полученное вещество представляет собой комплекс пептидов с молекулярной массой 300 - 3000 Д. Пептидная природа вещества, полученного по предлагаемому способу, подтверждается следующими данными:
1) Дает цветную реакцию с биуретовым реактивом;
2) Молекулярная масса компонентов, определенная с помощью гель-хроматографии, составляет от 300 до 3000 Д;
3) При аминокислотном анализе щелочного гидролизата вещества определяется 17 аминокислот в определенном соотношении (Glu - 13,86; Pro - 13,26; Gly - 8,52; Asp - 8,01; Lys - 7,41; Ala - 6,81; Arg - 6,64; Leu - 5,87; Thr - 5,66; Ser - 5,03; Val - 4,40; Ile - 3,63; His - 3,10; Phe - 2,90; Met - 2,14; Tyr - 2,14; Cys - 0,62);
4) Основной спектр (пик) поглощения в ультрафиолетовом свете колеблется в пределах 220-230 нм (спектрофотометрически).
Вышеуказанное позволяет достаточно точно провести идентификацию полученного вещества.
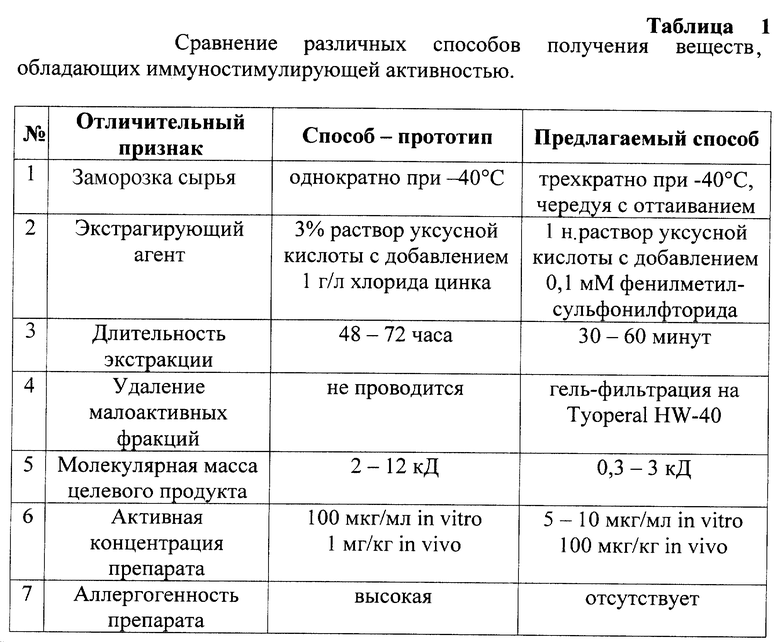
При сопоставительном анализе заявляемого способа и способа-прототипа выявлены следующие сходные признаки:
1) Оба способа предназначены для получения вещества, обладающего иммуностимулирующей активностью;
2) В качестве исходного сырья используют сумки Фабрициуса птиц;
3) Сырье предварительно замораживают и гомогенизируют;
4) Гомогенат подвергают экстракции уксусной кислотой;
5) Экстракт фильтруют и центрифугируют;
6) Осаждение целевого продукта производят охлажденным ацетоном в течение 24 часов при (-5)-(-8)oC;
7) Осадок отфильтровывают под вакуумом;
8) Полученное вещество лиофильно высушивают.
Однако известный способ-прототип и предлагаемый способ имеют следующие отличия:
1) В прототипе сырье замораживают однократно при -40oC, а в предлагаемом способе сырье трижды подвергают замораживанию при -40oC с последующим оттаиванием.
2) В прототипе экстракцию проводят в 3%-ном растворе уксусной кислоты при pH 3,0-3,5 с добавлением хлористого цинка в концентрации 1 г/л, а в предлагаемом способе экстракцию осуществляют 1 н. раствором уксусной кислоты с добавлением ингибитора фенилметилсульфонилфторида в концентрации 0,1 мМ;
3) В способе-прототипе время экстракции составляет 48-72 часа, а в предлагаемом способе экстракцию осуществляют в течение 30-60 минут;
4) В предлагаемом способе с целью дополнительной очистки целевого продукта осадок подвергают гель-фильтрации и собирают фракции с ММ от 300 до 3000 Д;
5) В способе - прототипе целевой продукт представлен щелочными полипептидами с молекулярной массой от 2 до 12 кД, а в предлагаемом способе выделяют пептиды с ММ от 300 до 3000 Д.
Экстракция 1 н. раствором уксусной кислоты в присутствии ингибитора протеаз фенилметилсульфонилфторида, значительное сокращение времени экстракции обеспечивают более щадящие условия выделения пептидов по сравнению со способом-прототипом. При этом практически отсутствует протеолиз нативных высокоактивных иммуностимулирующих пептидов, что ведет к повышению иммуностимулирующей активности целевого продукта. Трехкратный цикл замораживания-оттаивания в предлагаемом способе способствует разрушению клеток и субклеточных структур и более полному выходу из них биологически активных веществ.
В табл. 1 приведено сравнение различных способов получения веществ, обладающих иммостимулирующей активностью.
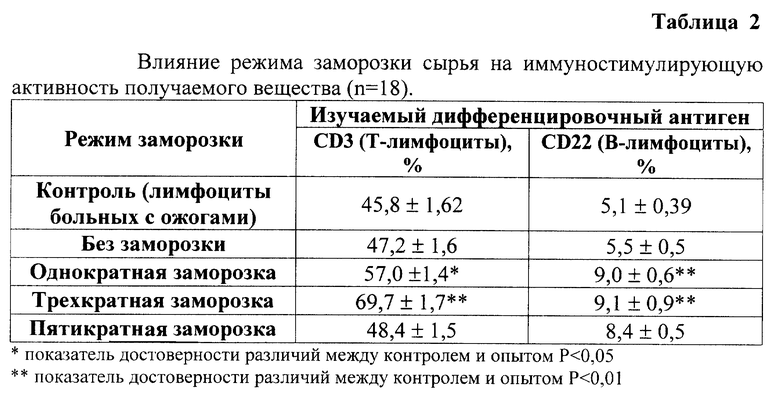
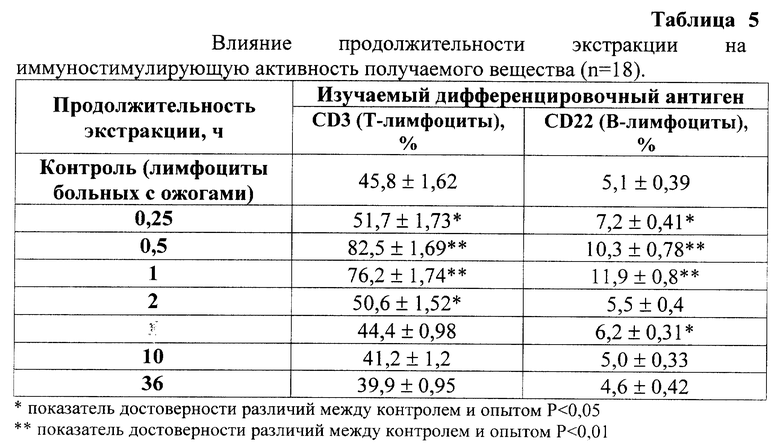
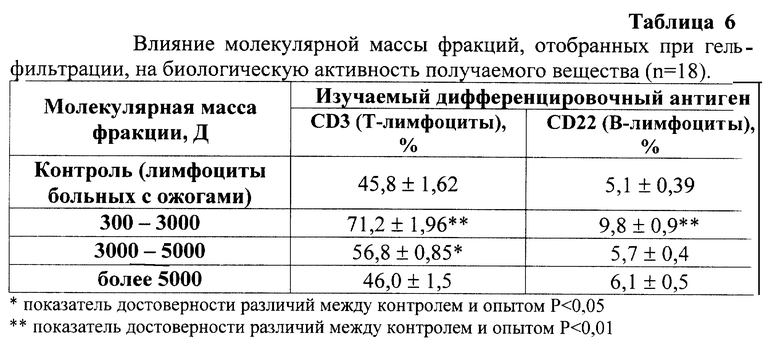
Наиболее оптимальные условия предлагаемого способа были подобраны экспериментально. Доказательство правильности выбранных параметров заморозки, экстракции и гель-фильтрации приведены в табл. 2-6. В качестве скрининг-теста оценки иммуностимулирующей активности использовали оценку влияния полученного вещества на экспрессию дифференцировочных антигенов CD3 (Т-лимфоциты) и CD22 (В-лимфоциты) на лимфоцитах больных с вторичными иммунодефицитами методом непрямой иммунофлюоресценции [4]. В качестве модели иммунодефицита использовали лимфоциты больных с ожоговой болезнью. Концентрация пептидов в опыте составляла 10 мкг/мл.
Наиболее оптимальным является режим трехкратной заморозки, поскольку он позволяет получить вещество с максимальной иммуностимулирующей активностью.
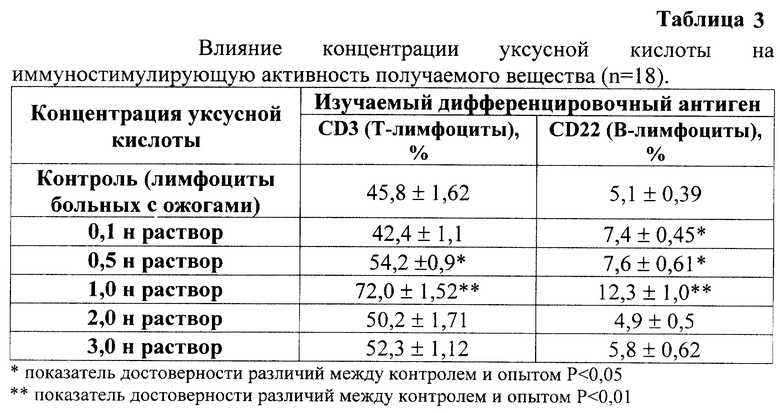
Из табл. 3 видно, что для получения вещества, обладающего иммуностимулирующей активностью, необходимо проводить экстракцию 1 н. раствором уксусной кислоты. Более высокая или более низкая концентрация уксусной кислоты приводят к снижению специфической активности целевого продукта.
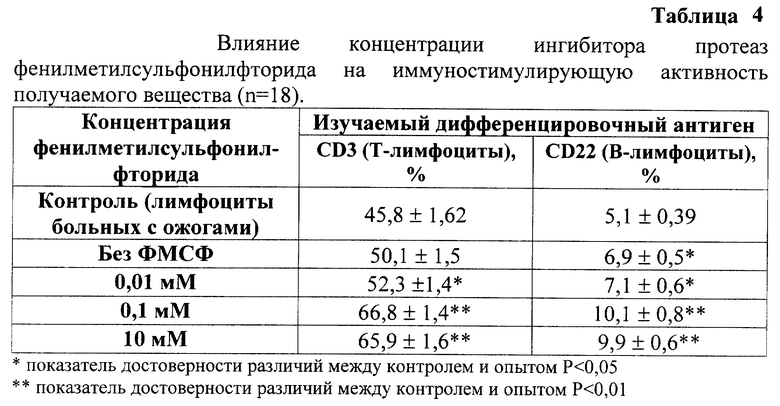
Таким образом, оптимальной концентрацией в экстрагирующем растворе ингибитора протеаз фенилметилсульфонилфторида является 0,1 мМ. Увеличение концентрации фенилметилсульфонилфторида не приводит к возрастанию иммуностимулирующей активности.
Из табл. 5 видно, что оптимальное время экстракции составляет 3 - 60 минут. Уменьшение или увеличение времени экстракции приводит снижению биологической активности целевого продукта.
Из табл. 6 видно, что максимальной специфической активностью обладает фракция с молекулярной массой от 300 до 3000 Д.
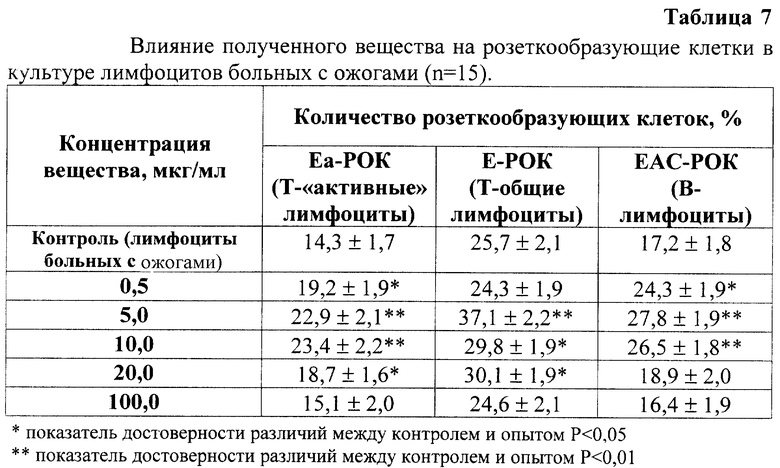
Биологическую активность полученного вещества in vitro, как и в способе - прототипе, изучали методом неиммунного розеткообразования с эритроцитами барана Е-РОК, Еа-РОК (Kerman В.Н. et al., 1976) и ЕАС-РОК (Bianco С. et al., 1983) [5]. Исследования проведены на модели лимфоцитов периферической крови больных с ожогами IIIб - IV степени 15 - 30% поверхности тела, сопровождающихся вторичным иммунодефицитом [6, 7]. Лимфоциты больных с ожоговой болезнью инкубировали с полученными пептидами в концентрации от 0,5 до 100 мкг/мл в течение 2 часов при температуре 37oC в полной питательной среде. Контролем служили лимфоциты, инкубированные с добавлением аналогичного объема физиологического раствора.
Полученное вещество увеличивает количество розеткообразующих клеток в концентрации 5 - 10 мкг/мл, в то время как, вещество способа-прототипа обладает аналогичной активностью лишь в концентрации 100 мкг/мл. Более того, вещество способа-прототипа увеличивает количество только Еа-РОК, не влияя на другие клетки, что свидетельствует о расширении спектра иммуностимулирующей активности вещества, полученного по предлагаемому способу.
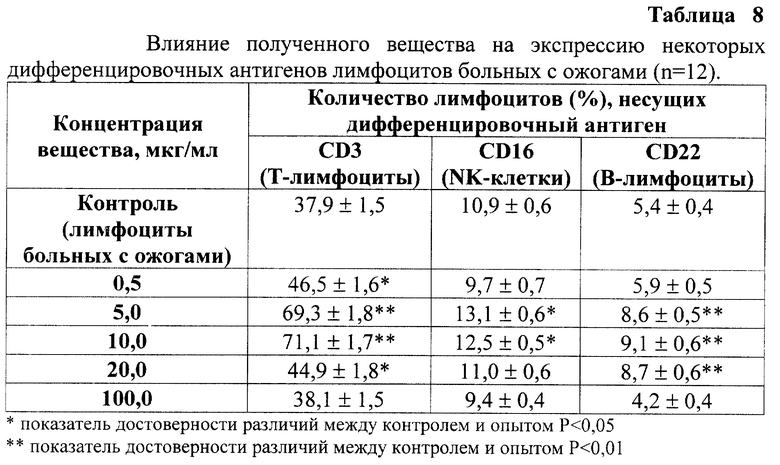
Кроме того, иммуностимулирующую активность полученного вещества изучали методом непрямой мембранной иммунофлуоресценции с моноклональными антителами к дифференцировочным антигенам основных популяций лимфоцитов: CD3 (Т-лимфоциты), CD16 (NK-клетки) и CD22 (В-лимфоциты).
Полученное вещество способно стимулировать экспрессию дифференцировочных антигенов, что также является проявлением его иммуностимулирующей активности.
Иммуностимулирующую активность вещества in vivo оценивали, как и в прототипе, на модели эмбриональной буреэктомии. Цыплятам на 19 сутки инкубации in vivo удаляли сумку Фабрициуса. Через 1,5 месяца, когда у бурсэктомированных цыплят наблюдалось максимальное развитие иммунодефицита, им вводили полученное вещество в течение недели по 100 мкг/кг массы тела. Контролем служили птицы, получавшие физиологический раствор в аналогичном объеме. Затем цыплят иммунизировали эритроцитами барана и через 5 суток определяли состояние иммунитета. Полученные данные приведены в таблице 9.
Введение вещества, полученного по заявляемому способу, восстанавливает иммунный ответ, птицы быстрее набирают в весе, увеличивается вес селезенки. Аналогичный эффект оказывает и вещество способа-прототипа, однако лишь в дозе 1 мг/кг массы тела.
Таким образом, по предлагаемому способу получают вещество, обладающее высокой иммуностимулирующей активностью. По сравнению со способом-прототипом предлагаемый способ позволяет достигнуть повышения активности целевого продукта, что выражается в снижении активной концентрации препарата. Так вещество, полученное по предлагаемому способу, обладает иммуностимулирующей активностью в концентрации от 2 до 10 мкг/мл в опытах in vitro и 100 мкг/кг in vivo, в то время как по способу-прототипу - 100 мкг/мл и 1 мг/кг соответственно. Изобретение обеспечивает повышение иммуностимулирующей активности в 10 раз, что позволяет снизить терапевтическую дозу препарата и уменьшить риск побочных эффектов. Кроме того, по сравнению со способом-прототипом отмечается расширение спектра иммуностимулирующей активности вещества.
Вещество, обладающее иммуностимулирующей активностью, может найти применение в медицине для профилактики и лечения широкого круга иммунодефицитных состояний различной этиологии.
Источники информации
1. Brand A., Gilmour D.G., Goldstein G. Lymphocyte- differentiating hormone of bursa of Fabricius //Science.- 1976.- Vol. 193.- P. 319-321.
2. Арион В.Я. и др. Получение и свойства пептидов бурсы Фабрициуса цыплят // Тезисы 1 Всесоюзного иммунол. съезда.- 1989.- Том 1.- С. 12.
3. Степанов А.В. Механизмы корригирующего действия полипептидов из лимфоидной ткани при иммунодефицитных состояниях и воспалении. Дисс. док. мед. наук, Иркутск, 1994, 331 с.
4. Лимфоциты: Методы: Пер. с англ. / Под ред. Дж. Клауса. - М.: Мир, 1990, 395 с.
5. Иммунологические методы / Под ред. Г. Фримеля, Пер. с нем. А.П.Тарасова. - М.: Медицина, 1987, 472 с.
6. Колкер И. И., Вишневская С.М., Панова Ю.М. и др. Содержание Т- и В- лимфоцитов у больных с термическими ожогами//Клинич. медицина. - 1985. - N 7. - С. 87-93.
7. Белоцкий С.М., Борисова Т.Г., Снастина Т.И. и др. Характеристика фагоцитов, Т- и В-лимфоцитов у обожженных // Иммунология.-1983.- N 6.- С. 51-54. Ты
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ВЕЩЕСТВА, СТИМУЛИРУЮЩЕГО АНТИГЕННЕЗАВИСИМУЮ ДИФФЕРЕНЦИРОВКУ В-ЛИМФОЦИТОВ | 1999 |
|
RU2155068C1 |
| СРЕДСТВО, СТИМУЛИРУЮЩЕЕ АНТИГЕННЕЗАВИСИМУЮ ДИФФЕРЕНЦИРОВКУ B-ЛИМФОЦИТОВ | 2000 |
|
RU2166956C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ ИММУНОСТИМУЛИРУЮЩЕЙ АКТИВНОСТЬЮ | 2000 |
|
RU2177803C1 |
| СПОСОБ ПОЛУЧЕНИЯ ВЕЩЕСТВА, СТИМУЛИРУЮЩЕГО АНТИГЕННЕЗАВИСИМУЮ ДИФФЕРЕНЦИРОВКУ В-ЛИМФОЦИТОВ | 2012 |
|
RU2521230C1 |
| Способ переработки фабрициевой бурсы птиц | 2021 |
|
RU2782347C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОМПЛЕКСА БИОЛОГИЧЕСКИ АКТИВНЫХ ПЕПТИДОВ, ОБЛАДАЮЩИХ ИММУНОСТИМУЛИРУЮЩЕЙ АКТИВНОСТЬЮ | 2017 |
|
RU2669691C1 |
| Способ получения стимулятора из селезенки млекопитающих | 1983 |
|
SU1158201A1 |
| СПОСОБ ПОЛУЧЕНИЯ ПЕПТИДОВ, ОБЛАДАЮЩИХ АНТИПРОТЕАЗНЫМ, ИММУНОСТИМУЛИРУЮЩИМ И ГИПОТЕНЗИВНЫМ ДЕЙСТВИЕМ | 1992 |
|
RU2036648C1 |
| Способ получения иммуностимулятора | 1983 |
|
SU1187824A1 |
| СРЕДСТВО, СТИМУЛИРУЮЩЕЕ ПРОЛИФЕРАЦИЮ ФИБРОБЛАСТОВ | 2002 |
|
RU2211046C1 |

Изобретение относится к медицине и медицинской промышленности и касается получения вещества из бурсы Фабрициуса птиц, обладающего иммуностимулирующей активностью. Сущность изобретения состоит в том, что сырье подвергают трехкратному замораживанию при температуре -40oС, чередующемуся с оттаиванием, затем гомогенизируют, гомогенат заливают 1 н. раствором уксусной кислоты, добавляют фенилметилсульфонилфторид в концентрации 0,1 мМ, экстракцию проводят в течение 30-60 мин, экстракт фильтруют, центрифугируют, к фильтрату добавляют охлажденный ацетон для формирования осадка, осадок фильтруют, отмывают чистым ацетоном и высушивают, полученный порошок растворяют в 0,1 н. уксусной кислоте и центрифугируют, супернатант подвергают гель-фильтрации на Tyoperal HW-40 и отбирают фракции с молекулярной массой от 300 до 3000 Д. Изобретение обеспечивает повышение иммуностимулирующей активности в 10 раз, что позволяет снизить терапевтическую дозу препарата и уменьшить риск побочных эффектов. 9 табл.
Способ получения вещества, обладающего иммуностимулирующей активностью, из сумки Фабрициуса птиц, включающий гомогенизацию предварительно замороженного сырья с последующей экстракцией, фильтрацией, осаждением ацетоном и лиофилизацией, отличающийся тем, что сырье замораживают трехкратно при -40oС, чередуя с оттаиванием, экстракцию проводят 1н раствором уксусной кислоты с добавлением ингибитора протеаз фенилметилсульфонилфторида 0,1 мМ в течение 30-60 мин, а целевой продукт подвергают гель-фильтрации на Туореral HW-40 и отбирают фракции с молекулярной массой от 300 до 3000 Д.
| СТЕПАНОВ А.В | |||
| Механизмы корригирующего действия полипептидов из лимфоидной ткани при иммунодефицитных состояниях и воспалении | |||
| Дисс | |||
| докт | |||
| мед | |||
| наук, Чита, 1994 | |||
| SU 1438044 А1, 10.04.1999 | |||
| СПОСОБ ПОЛУЧЕНИЯ ВЕЩЕСТВА, СТИМУЛИРУЮЩЕГО АНТИГЕННЕЗАВИСИМУЮ ДИФФЕРЕНЦИРОВКУ В-ЛИМФОЦИТОВ | 1999 |
|
RU2155068C1 |
| СПОСОБ ПОЛУЧЕНИЯ НУКЛЕОПРОТЕИДНЫХ КОМПЛЕКСОВ ИЗ ЭМБРИОНОВ ПТИЦ, ОБЛАДАЮЩИХ ИММУНОТРОПНОЙ И РАДИОПРОТЕКТИВНОЙ АКТИВНОСТЬЮ | 1995 |
|
RU2110267C1 |
| КУЗНИК Б.И | |||
| и др | |||
| Иммуногенез, гемостаз и неспецифическая резистентность организма | |||
| - М.: Медицина, 1989, с.264. | |||
Авторы
Даты
2001-12-27—Публикация
2000-09-19—Подача