Изобретение относится к химико-фармацевтической промышленности и касается выделения биологически активных веществ из органов животных. Выделенный целевой продукт представляет комплекс биологически активных пептидов проявляющих иммуностимулирующую активность.
Биологически активные пептиды проявляющие иммуностимулирующее действие широко и успешно используется в медицине в качестве лекарственных препаратов для усиления неспецифической резистентности организма и в терапии иммунодефицитных состояний различного генеза у взрослых и детей.
Изобретение может использоваться при получении пептидных препаратов из ткани вилочковой (зобной) железы в промышленных масштабах.
Известно несколько способов получения биологически активного пептидов из ткани вилочковой железы копытных сельскохозяйственных животных. Все они предусматривают операции измельчения ткани, кислотную экстракцию, отделение осадка и выделение из него целевого продукта (см., например (Патент РФ №1522485, кл. А61К 35/30, 1994 г., Авторское свидетельство СССР №1112606, кл. А61К 37/24, 1982). Способы различаются условиями проведения технологических операций и веществами применяемые на данных стадиях. Известные способы не позволяют получать биологически активные пептиды из ткани вилочковой железы в достаточном количестве и высокого качества, а так же являются слишком сложными и длительными.
Наиболее близким решением к предлагаемому изобретению являются способ получения пептидов обладающих иммуностимулирующей активностью по авторскому свидетельству СССР №1112606. В соответствии с патентом исходное количество тимуса (вилочковой железы) молодняка крупного рогатого скота подвергают измельчению на волчке с диаметром отверстий решетки 2 мм. Проводят экстракцию 3%-ным раствором уксусной кислоты, содержащей хлористый цинк в концентрации 1,0 г/л при массовом соотношении измельченной массы и раствора уксусной кислоты 1:5 - 1:6. Экстракцию проводят в течение 48-72 ч с перемешиванием по 1 часу 3 раза в день. После окончания экстракции субстрат центрифугируют в течение 20 мин со скоростью 3000 об/мин. Осветленный экстракт обрабатывают охлажденным ацетоном при температуре -3 - -5°С и массовом соотношении экстракта и ацетона 1:5. Смесь перемешивают и оставляют на 20-24 часа для формирования осадка при температуре -3 - -5°С. Полученный осадок высушивают, измельчают и растворяют в дистиллированной воде при 20°С из расчета 20 г порошка в 1 л воды (2%) при рН 6,0-7,0. Водную экстракцию проводят 1-3 ч при непрерывном перемешивании и при комнатной температуре. Удаляют балластные вещества путем фильтрации. В отфильтрованный прозрачный слегка желтоватый раствор добавляют уксусной кислоты до рН 4,0. В раствор добавляют гликокол (на 1 г порошка 3 г гликокола), стерильно фильтруют через пластины EKS, разливают во флаконы и лиофилизируют.
В результате многочисленных экспериментов были выявлены следующие недостатки данного способа получения - низкий выход и качество целевого продукта
Таким образом, приведенные выше способ-прототип позволяет получать целевой продукт, содержащий пептиды обладающие иммуностимулирующей активностью, пригодные для производства фармацевтических препаратов, однако в технологическом отношении является менее предпочтительным.
Задача настоящего изобретения состоит в способе получения целевого продукта, содержащий пептиды обладающие иммуностимулирующей активностью, обеспечивающий высокий процента выход и качества продукта, что делает его наиболее предпочтительными при использовании в промышленных масштабах.
Техническим результатом настоящего изобретения является: увеличение выхода, активности и качества целевого продукта, оптимизация технологического процесса.
Для достижения указанного технического результата предложен способ который включает в себя следующие стадии:
Вилочковую железу убойных животных обрабатывают с удалением жировой ткани, сгустков крови и замораживают, замороженную ткань измельчают, гомогенизируют и проводят экстракцию 3% раствором уксусной кислоты, содержащей хлористый цинк в концентрации 1,2 г/л при массовом соотношении гомогената и раствора уксусной кислоты 1:5. Значение рН раствора должно быть рН 3.5. Для экстракции гомогенат выдерживают при температуре не выше +20°С при постоянном перемешивании в течение 48 часов. По окончании экстракции гомогенат сепарируют, отделяют твердую и жидкую фазы. К надосадочной жидкости добавляют охлажденный ацетон (температура не выше +5°С) в соотношении 1:5. Смесь перемешивают в течение 4 часов при температур +5°С. Образовавшийся осадок отделяют на центрифуге и несколько раз промывают охлажденным ацетоном. Полученный влажный осадок сушат в вакуум-сушильном шкафу. Получают ацетоновый порошок. Ацетоновый порошок растворяют в воде для инъекций и устанавливают рН 7,0. Добавляют фермент - сериновую эндопротеазу, выдерживают при постоянном перемешивании до +65°С в течение 3 часов. Для инактивации фермента температуру реакционной массы увеличивается до +90°С и выдерживают в течение 30 минут. Затем охлаждают до комнатной температуры, сепарируют или фильтруют. Далее проводят стерилизующую фильтрацию путем пропускания раствора через мембрану с диаметром пор 0,22 мм. Раствор разливают в емкости, замораживают и лиофилизируют. Целевой продукт представляет лиофилизированный порошок белого или белого с желтоватым оттенком цвета и содержит комплекс биологически активных пептидов.
Для производства используют вилочковую железу телят и молодняка крупного рогатого скота. Замороженную вилочковую железу используют не позднее чем через 8-10 месяцев.
Использование повышенной концентрации хлористого цинка (1,2 г/л) способствует более полному извлечению активных фракций из гомогенизированной ткани вилочковой железы. Применение протеолитического фермента сериновой эндопротеазы, обладающей широкой субстрат - специфичностью, при высокой ионной силе, способствует более полному высвобождению и накоплению биологически активных пептидов из ацетонового порошка. Конечная концентрация фермента при ферментативном гидролизе составляет 0,3%. Проведенными нами исследованиями, по кинетики высвобождения пептидов из ацетонового порошка при ферментативном гидролизе, установлено, что максимальное количество пептидов накапливается в гидролизате в течение 3 часов. В течение данного времени интенсивно протекает протеолиз и происходит максимальное накопление продуктов промежуточного гидролиза белково-пептидных субстратов. Применение ограниченного ферментативного гидролиза способствует полному удалению высокомолекулярных белковых примесей из целевого продукта, которые могут вызывать негативные последствия, такие как аллергические реакции и прионные заболевания. В данном случае ферментативный гидролиз можно рассматривать, как альтернативный вариант методу ультрафильтрации с целью удаления белковых веществ проявляющие побочные свойства. Отсутствие белковых примесей в целевом продукте подтверждено методами ВЭЖХ и электрофореза по Леммли (Остерман Л.А. Хроматография белков и нуклемновых кислот Остерман Л. А. Методы исследования белков и нуклеиновых кислот М.: Наука, 1985. 536 с, Электрофорез и ультрацентрифугирование (практическое пособие). М.: Наука, 1981. 288 с.).
Согласно литературным данным при ограниченном протеолизе белков происходит высвобождение низкомолекулярных пептидов, которые обладают выраженными биологически активными свойствами. Например, при протеолизе казеина (белок содержащийся в молоке) высвобождаются пептиды, которые обладают анальгетическими свойствами - казоморфины, при протеолизе иммуноглобулинов, в частности иммуноглобулинов G, образуются иммуномодулируюшие пептиды - тафцин, ригин, пептиды коллагена и фибронектина участвующие в тканевом и клеточном гомеостазе (Структурные основы действия пептидных и белковых иммунорегуляторовлод ред. Чипенса Г.И. Рига: Зинатне, 1990. 324 с, Jinsmaa Y, Yoshikawa М, 1999; «Enzymatic release of neocasomorphin and beta-casomorphhinfrom bovine beta-casein»; Peptides 20:957-962.,).
Использование ацетона на одной из стадий технологического процесса позволяет не только удалить липиды, пигменты и полисахариды, но и значительно сократить содержание уксусной кислоты и цинка хлористого в готовом продукте. Необходимо подчеркнуть, что из ацетонового порошка в основном извлекаются водорастворимые полипептиды и белки, что особенно важно при учете их фармакокинетики и биодоступности.
Сопоставимый анализ предлагаемого способа показал, что определяющим отличием заявляемого технического решения от прототипа является то, что биологически активные водорастворимые пептиды выделяют на стадии экстракции из ацетонового порошка при ферментативном гидролизе, при этом значительно повышается выход и качество целевого продукта (таблица 1).

Изобретение иллюстрируется примером конкретного выполнения способа: Предварительно размороженное сырье в количестве 20 кг подвергают измельчению с помощью волчка с диаметром отверстий решетки 3 мм. Далее проводят экстракцию 3% раствором кислоты уксусной при рН 3,5, содержащий цинк хлористый в концентрации 1,2 г/л при массовом соотношении измельченной массы и экстракционного раствора 1:5. В начале процесса экстракции смесь гомогенизируют погружным диспергатором при частоте вращения ротора 3000 об/мин в течение 20 минут и далее экстракцию проводят при постоянном перемешивании в течении 48 часов при температуре не более +20°С. По окончании процесса экстракции проводят отделение жидкой и твердой части экстракционной смеси при помощи сепаратора. Режим сепарации 2000-3000 об/мин.
Отфильтрованный раствор экстракта охлаждается при перемешивании в течение 24 часов, после чего начинается процесс осаждения. К охлажденному экстракту добавляют в соотношении 1:5 охлажденный ацетон при температура не выше +5°С. Далее смесь перемешивают и выдерживают в течение 4 часов для формирования осадка. Осадок отделяется от жидкой фазы при помощи центрифуги. Твердая фаза несколько раз (2-3 раза) промывается охлажденным ацетоном до тех пор, пока осадок не приобретет светлосерый или белый цвет. Полученный влажный осадок ацетонового порошка направляют в вакуумно-сушильный шкаф для сушки при температуре не выше +20°С. Время высушивания составляет 2,5-3,0 часа. Получают ацетоновый порошок в количестве 1,26 кг. Водно-ацетоновая смесь направляют на регенерацию ацетона.
К ацетоновому порошку добавляют расчетное количество воды для инъекций при рН 7,0. Затем вносят сериновую эндопротеазу (0,3% от общего объема раствора полупродукта). После внесения фермента раствор полупродукта нагревают при постоянном перемешивании до +65°С. Нагрев осуществляют в течение 3 часов. Затем температуру реакционной массы увеличивают до +90°С и выдерживается в течение 30 минут для инактивации фермента.
После окончания ферментативного гидролиза реакционную смесь охлаждают до комнатной температуры и подают на сепаратор для удаления твердой фазы. Режим сепарирования при 2000-3000 об/мин. Полученный фильтрат собирают и передают на стадию стерилизующей фильтрации.
Процессы стадии стерилизующей фильтрации осуществляют в помещении класса чистоты В. Полученный стерильный раствор разливают в предварительно подготовленные стерильные поддоны и передают на стадию лиофильной сушки.
Процессы стадии осуществляются в помещении класса чистоты В с локальной зоной А в зоне загрузки/выгрузки сушки. Процесс производства осуществляют на лиофильной сушке в автоматическом режиме.
Высушенный готовый продукт представляет собой хорошо сформированный порошок белого или желтовато-белого цвета, потери в массе при высушивании не должны превышать 10%. Выход готового продукта составляет 0,380 кг сухого порошка. Высушенный готовый продукт упаковывается в первичную упаковку и передается в помещение для хранения, где маркируется и временно хранится в холодильнике.
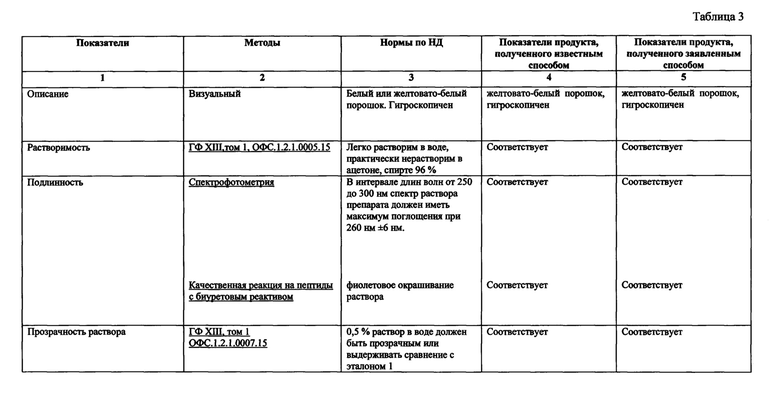
Далее проводят контроль параметров полученного продукта (таблица 2 и таблица 3): Полученный заявляемым способом целевой продукт был проверен на биологическую активность. Биологическую активность оценивают по иммунологической активности выделенных лимфоцитов крови с использованием метода розеткообразования (РО). Тест розеткообразования основан на различиях рецепторной структуры лейкоцитов (лимфоцитов, гранулоцитов, моноцитов), которые при взаимодействии с эритроцитами могут спонтанно присоединять последние к своей поверхности. При этом образуются фигуры, напоминающие розетки, в центре которых находится лейкоцит, а вокруг него располагаются не менее 3-5 эритроцитов. В формировании розеток участвуют антигены самих эритроцитов, которые образуют спонтанные и иммунные розетки: спонтанные розетки - между лимфоцитами животных и эритроцитами кролика.
Испытание проводят в реакции «активного» розеткообразования (РОК) обработанных трипсином тимоцитов морской свинки с эритроцитами кролика. Время проведения опыта на одном животном от момента его умерщвления и извлечения тимуса до подсчета процентного содержания розеткообразующих клеток (РОК) не должно превышать 2 часа.
В опыт берут последовательно 5 морских свинок с массой тела 150-250 г. От каждого животного, умервщленного в камере для эфтаназии, отбирали тимус. Одну долю тимуса помещают в 5 мл среды 199, затем в стеклянный гомогенизатор, тщательно гомогенизируют. Затем гомогенат фильтруют через 4 слоя марли, предварительно смоченной средой 199, в центрифужную пробирку. Пробирку с суспензией клеток центрифугируют при 1500 об/мин (400 g) в течение 10 мин. Надосадочную жидкость удаляют и к осадку прибавляют 1 мл среды 199, суспензируют. В сухую центрифужную пробирку вносят 0,33 мл 3% раствора кислоты уксусной и 0,02 мл взвеси тимоцитов, тщательно перемешивают. В камере Горяева подсчитывают количество клеток в 100 больших квадратах, полученное число умножают на 5*104 и получают количество клеток в 1 мл. Если количество клеток в 1 мл окажется менее 100*106. животное исключают из опыта и заменяют другим. Полученную суспензию клеток разбавляют средой 199 до концентрации 20*106 клеток/мл. Одновременно готовят концентрацию суспензии 2*106 клеток/мл (норма).
В сухую центрифужную пробирку вносят в соотношении 6:1 суспензию тимоцитов в концентрации 20*106 клеток/мл и 0,5% раствор трипсина в среде 199, приготовленный непосредственно перед использованием. После прибавления раствора трипсина образовавшийся сгусток удаляют отсасыванием пипеткой. Суспензию клеток центрифугируют при 1500 об/мин (400 g) в течение 10 мин. Надосадочную жидкость аккуратно сливают, прибавляют 3 мл среды 199, тщательно ресуспендируют. Затем отмывают тимоциты от трипсина в этом же режиме. К осадку прибавляют 1 мл среды, тщательно ресуспендируют. Затем готовят рабочую суспензию с концентрацией 2*106 клеток/мл (контроль), как указано ранее. Определение биологической активности субстанции экстракта вилочковой железы с использованием тимоцитов от одной морской свинки проводят следующим образом. В первую центрифужную пробирку вносят 0,1 мл контрольной суспензии тимоцитов в концентрации 2*106 клеток/мл (норма). Во вторую (контроль) и третью (опыт) центрифужные пробирки вносят по 0,1 мл рабочей суспензии тимоцитов, обработанных трипсином, в той же концентрации. В третью пробирку прибавляют 0,02 мл испытуемого раствора. Затем во все пробирки прибавляют по 0,1 мл % суспензии свежих отмытых раствором натрия хлорида изотонического 0,9% эритроцитов кролика, разведенных в среде 199. Взвесь клеток перемешивают и центрифугируют в течение 5 минут при 800-1000 об/мин (200g). Клетки ресуспендируют и в камере Горячева подсчитывают процентное содержание РОК в каждой из трех пробирок. За РОК принимают тимоцит, присоединивший 3 и более эритроцитов. В случае определения числа РОК в субстанции в норме (без обработки трипсином) менее 40% или процентного содержания РОК в опыте менее чем в контроле, животное исключают из опыта и заменяют другим. Определяют средние арифметические показатели процентного содержания РОК у 5 животных. Субстанцию считают биологически активной, если при снижении среднеарифметического числа РОК при воздействии трипсина по сравнению с нормой, она восстанавливает количество РОК не менее чем на 40% по сравнению с контролем.
Выявлено, что продукт полученный заявленным способом обладает выраженной биологической активностью - процент восстановления РОК (розеткообразующих клеток) достоверно превышали 40% относительно контрольных значений (таблица 2).

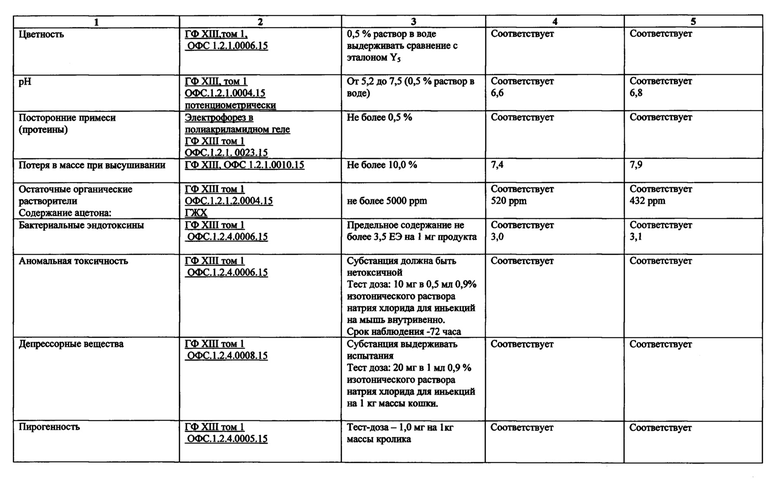
Проведенные испытания представлены в таблице 3.
Представленные в таблице 3 данные демонстрируют, что полученный заявленным способом целевой продукт имеет аналогичные качественные и количественные характеристики, а по некоторым параметрам заявленный продукт превосходит известный.
Таким образом, целевой продукт, полученный предлагаемым способом, соответствует всем параметрам фармацевтического продукта - субстанции.

| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ КОМПЛЕКСА БИОЛОГИЧЕСКИ АКТИВНЫХ ПЕПТИДОВ, ВОССТАНАВЛИВАЮЩИХ ФУНКЦИЮ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ | 2017 |
|
RU2669693C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОМПЛЕКСА БИОЛОГИЧЕСКИ АКТИВНЫХ ПЕПТИДОВ ОБЛАДАЮЩИХ НЕЙРОТРОПНОЙ АКТИВНОСТЬЮ | 2017 |
|
RU2669692C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГЕПАРИНА | 2015 |
|
RU2612813C1 |
| СПОСОБ ПОЛУЧЕНИЯ ВЕЩЕСТВА, ОБЛАДАЮЩЕГО ИММУНОСТИМУЛИРУЮЩЕЙ АКТИВНОСТЬЮ | 2000 |
|
RU2177325C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОМОДУЛЯТОРА | 2003 |
|
RU2257904C2 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ ИММУНОСТИМУЛИРУЮЩЕЙ АКТИВНОСТЬЮ | 2000 |
|
RU2177803C1 |
| "Способ получения комплекса липидов "фосфотим" из животного сырья" | 1991 |
|
SU1836092A3 |
| МЕМБРАННЫЙ СПОСОБ ПОЛУЧЕНИЯ ЛЕКАРСТВЕННОГО СРЕДСТВА НА ОСНОВЕ ПЕПТИДОВ ТИМУСА ТЕЛЯТ | 2016 |
|
RU2648468C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПЕПТИДОВ, ОБЛАДАЮЩИХ АНТИПРОТЕАЗНЫМ, ИММУНОСТИМУЛИРУЮЩИМ И ГИПОТЕНЗИВНЫМ ДЕЙСТВИЕМ | 1992 |
|
RU2036648C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ ИММУНОМОДУЛИРУЮЩЕЙ АКТИВНОСТЬЮ | 1994 |
|
RU2080120C1 |
Изобретение относится к фармацевтической промышленности, а именно к способу получения комплекса биологически активных пептидов. Способ получения комплекса биологически активных пептидов, обладающего иммуностимулирующей активностью, из вилочковой железы крупного рогатого скота, включающий измельчение и гомогенизацию ткани, экстракцию гомогената раствором кислоты уксусной, содержащей цинк хлористый и раствор уксусной кислоты, обработку надосадочной жидкости ацетоном, промывку образовавшегося осадка ацетоном, высушивание осадка, экстракцию пептидов из высушенного порошка водой для инъекций и добавление фермента - сериновой эндопротеазы, далее экстракт выдерживают при нагревании и постоянном перемешивании, инактивируют фермент, охлаждают, сепарируют или фильтруют и лиофилизируют, при определенных условиях. Вышеописанный способ позволяет увеличить выход и качество целевого продукта. 3 табл.
Способ получения комплекса биологически активных пептидов, обладающих иммуностимулирующей активностью, из вилочковой железы крупного рогатого скота, включающий операции измельчения и гомогенизации ткани, экстракции гомогената раствором 3% кислоты уксусной, содержащей цинк хлористый при массовом соотношении гомогената и раствора уксусной кислоты 1:5, обработки надосадочной жидкости ацетоном, промывки образовавшегося осадка ацетоном, высушивания осадка, экстракции пептидов из высушенного порошка водой для инъекций, отличающийся тем, что на стадии экстракции гомогената ткани вилочковой железы используется концентрация цинка хлористого 1,2 г/л, на стадии экстракции пептидов из высушенного порошка добавляют фермент - сериновую эндопротеазу до конечной концентрации 0,3%, выдерживают при температуре +65°С при постоянном перемешивании в течение 3 часов, инактивируют фермент при температуре +90°С в течение 30 минут, охлаждают до комнатной температуры, сепарируют или фильтруют и лиофилизируют.
| SU 1112606 A1, 20.08.1996 | |||
| СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА ДЛЯ ЛЕЧЕНИЯ КООРДИНАТОРНЫХ НАРУШЕНИЙ ИЗ МОЗЖЕЧКОВО-СТВОЛОВОГО ОТДЕЛА ГОЛОВНОГО МОЗГА | 1994 |
|
RU2090194C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГИДРОЛИЗАТА МОЗГОВОЙ ТКАНИ "ЦЕРЕБРОЛИЗАТ" | 1992 |
|
RU2049472C1 |
| Выделение регуляторных пептидов из тимусамина - нуклеопротеинового комплекса тимуса/А.Ю | |||
| Соловьев, Д.В | |||
| Жилинский, И.А | |||
| Чернова, Б.Я | |||
| Басин, Л.К | |||
| Шатаева, В.Х | |||
| Хавинсон // Сорбционные и хроматографические процессы | |||
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
Авторы
Даты
2018-10-15—Публикация
2017-08-14—Подача