Изобретение относится в качестве новых и полезных промышленных продуктов к биароматическим соединениям, в которых ароматические ядра соединяются с помощью пропиниленового или аллениленового двухвалентного радикала. Изобретение также относится к использованию этих новых соединений в фармацевтических композициях, предназначенных для использования в медицине для человека или ветеринарной медицине, или альтернативно в косметических композициях.
Соединения согласно изобретению обладают заметной активностью в областях клеточной дифференциации и пролиферации, и они находят применения более конкретно в локальном и систематическом лечении дерматологических состояний, связанных с нарушением кератинизации, дерматологических состояний (и им подобных) с воспалительным компонентом и/или иммуноаллергическим компонентом, и дермальной или эпидермальной пролиферацией, либо доброкачественной, либо со злокачественным развитием. Эти соединения, кроме того, могут быть использованы при лечении дегенеративных заболеваний соединительной ткани для борьбы со старением кожи, либо фотоиндуцированным, либо хронологическим (протекающим во времени), и при лечении нарушений, связанных с рубцеванием. Кроме того, они находят применение в области офтальмологии, в частности, при лечении корнеопатий.
Возможным также является использование соединений согласно изобретению в косметических композициях для гигиены тела и волос.
В заявке ЕР-661258 уже раскрыты биароматические соединения, ароматические ядра которых соединяются с помощью пропиниленового двухвалентного радикала, в качестве веществ, которые являются активными в фармацевтических или косметических композициях.
Соединения согласно заявке ЕР-661258 соответствуют следующей общей формуле:
в которой Ar представляет двухвалентный ароматический радикал, необязательно замещенный радикалом R5, или гетероароматический двухвалентный радикал, необязательно замещенный радикалом R6, когда гетероатом является азотом,
R1 представляет Н, -СН3, -CH2OR6, -OR6, -COR7 или -S(O)tR9, в котором t равняется 0, 1 или 2,
R2 и R3 представляют Н, C1-C20 алкил, -OR6 или -SR6,
или R2 и R3, взятые вместе, образуют 5- или 6-членное кольцо, необязательно замещенное метильными группами и/или необязательно разделенное атомом кислорода или серы,
R4 и R6 представляют Н, галоид, или низший алкил, или -OR6,
R6 представляет Н, низший алкил или -COR9,
R7 представляет Н, низший алкил -N(R)R1 или -OR8,
R8 представляют Н, С1-С20 алкил, который может быть линейным или разветвленным, алкенил, моно- или полигидроксиалкил, необязательно замещенный арил или аралкил, или сахар, или аминокислоту, или пептидный остаток,
R9 представляет низший алкил,
R и R' представляют Н, низший алкил, моно- или полигидроксиалкил, необязательно замещенный арил или сахар, аминокислоту или пептидный остаток или R и R', взятые вместе, образуют гетероцикл,
Х представляет двухвалентный радикал, который справа налево или наоборот имеет формулу:
в которой R10 представляет Н, низший алкил или -OR6,
R11 представляет -OR6,
или R10 и R11, взятые вместе, образуют оксо (= O) радикал,
и соли указанных соединений приведенной выше формулы, где R1 представляет функциональную группу карбоновой кислоты, и оптические и геометрические изомеры этих указанных соединений.
Соединения согласно настоящему изобретению по сравнению с соединениями заявки ЕР-661258 отличаются в основном в том, что -X-Ar-R1 заместитель находится в орто-положении по отношению к R2 радикалу, или к 5- или 6-членному кольцу, когда R2 и R3 берутся вместе, тогда как в заявке ЕР-661258, -X-Ar-R1 заместитель находится в мета-положении.
Это является таким из-за того, что удивительно и неожиданно было найдено, что эта модификация в структуре позволяет возможно значительно увеличивать ее фармацевтические и косметическое свойства и, кроме того, снижать его некоторые побочные эффекты.
Предметом настоящего изобретения поэтому являются новые соединения, которые могут быть представлены следующей общей формулой:
в которой Ar представляет радикал, выбранный из следующих формул от (а) до (с):


в которых Z является атомом кислорода или серы,
R1 представляет -СН3, -CH2-O-R6, -OR6 или -COR7,
R2 представляет -OR8, -SR8 или полиэфирный радикал, если в последнем случае R4 представляет линейный или разветвленный С1-С20 алкил и находится в орто- или мета-положении по отношению к Х-Ar связи,
R3 представляет низший алкил, или
R2 и R3, взятые вместе, образуют 5- или 6-членное кольцо, необязательно замещенное, по крайней мере, одним метилом и/или необязательно разделенное атомом кислорода или серы,
R4 представляют Н, галоид, линейный или разветвленный C1-C20 алкил, -OR8, полиэфирный радикал или арил,
R5 представляют Н, галоид, линейный или разветвленный C1-C20 алкил или -OR8 радикал,
R6 представляет Н, низший алкил или -COR9 радикал,
R7 представляет Н, низший алкил -N(r')r" или -ОR10,
R8 представляют Н, низший алкил или -COR9,
R9 представляет низший алкил,
R10 представляют Н, C1-C20 алкил, который может быть линейным или разветвленным, алкенил, моно- или полигидроксиалкил, необязательно замещенный арил или аралкил или остаток сахара,
r' и r" представляют Н, низший алкил, моно- или полигидроксиалкил, необязательно замещенный арил, или аминокислоту, или остаток сахара, или взятые вместе с атомом азота образуют гетероцикл,
Х представляет двухвалентный радикал, который справа налево или наоборот имеет формулу:
в которой R11 представляет Н или -OR6, R6, имеющий то же самое значение, что и выше,
R12 представляет Н или низший алкил, или
R11 и R12, взятые вместе, образуют оксо (= O) радикал,
и соли соединений формулы (I), когда R1 представляет функциональную группу карбоновой кислоты, и оптические и геометрические изомеры указанных соединений формулы (I).
Если соединения согласно изобретению обеспечиваются в форме соли, то она предпочтительно является солью щелочного или щелочноземельного металла или альтернативно цинка или органического амина.
Согласно настоящему изобретению низший алкил следует понимать как C1-C6 радикал, предпочтительно метильный, этильный, изопропильный, бутильный, трет-бутильный и гексильный радикалы.
С1-С20 алкил, который может быть линейным или разветвленным, понимается как представляющий, в частности, метильный, этильный, пропильный, изопропильный, гексильный, гептильный, 2-этилгексильный, октильный, нонильный, додецильный, гексадецильный и октадецильный радикалы.
Моногидроксиалкил понимается как представляющий радикал, предпочтительно содержащий 2 или 3 атома углерода, в частности 2-гидроксиэтильный, 2-гидроксипропильный или 3-гидроксипропильный радикал.
Полигидроксиалкил понимается как представляющий радикал, предпочтительно содержащий от 3 до 6 атомов углерода и от 2 до 5 гидроксильных групп, такой как 2,3-дигидроксипропильный, 2,3,4-тригидроксибутильный или 2,3,4,5-тетрагидроксипентильный радикалы или пентпэритритольный остаток.
Полиэфирный радикал понимается как представляющий радикал, содержащий от 1 до 6 атомов углерода и от 1 до 3 атомов кислорода или серы, такой как радикалы метоксиметильного эфира, метоксиэтоксиметильного эфира или метилтиометильного эфира.
Арил понимается как представляющий пиридильный радикал, тиофенильный радикал или фенильный радикал, необязательно замещенный, по крайней мере, одним атомом галоида, одной гидроксильной, одной нитрофункциональной группой, одним низшим алкилом, одним CF3 радикалом, одним аминорадикалом, необязательно защищенным ацетильной функциональной группой или необязательно замещенным одним или двумя низшими алкилом(лами), одним алкоксирадикалом или одним полиэфирным радикалом. Арил предпочтительно понимается как представляющий фенильный радикал, необязательно замещенный, по крайней мере, одним атомом галоида, одной гидроксильной, одной нитро функциональной группой, одним низшим алкилом, одним CF3 радикалом, одним аминорадикалом, необязательно защищенным ацетильной функциональной группой или необязательно замещенным одним или двумя низшими алкилом(лами), одним алкоксирадикалом или одним полиэфирным радикалом, где последний имеет значение, как оно определено выше.
Если заместитель представляет алкоксирадикал, последний предпочтительно является C1-C12 алкоксирадикалом, таким как, в частности, метокси, этокси, пропилокси, изопропилокси, гексилокси, гептилокси, октилокси и нонилоксирадикалы.
Аралкил предпочтительно понимается как представляющий бензильный радикал или фенетильный радикал, необязательно замещенный, по крайней мере, одним атомом галоида, одной гидроксильной или одной нитро функциональной группой.
Алкенил понимается как представляющий предпочтительно радикал, содержащий от 2 до 5 атомов углерода и содержащий одну или большее количество этиленовых ненасыщенных связей, такой как, более конкретно, аллильный радикал.
Остаток сахара понимается как представляющий остаток, образующийся, в частности, из глюкозы, галактозы, маннозы или глюкуроновой кислоты.
Остаток аминокислоты понимается как представляющий, в частности, остаток, образующийся из лизина глицина или аспартиновой кислоты, и пептидный остаток понимается как представляющий более конкретно дипептидный или трипептидный остаток, образующийся из комбинации аминокислот.
Гетероцикл предпочтительно понимается как представляющий пиперидиновый радикал, морфолиновый радикал, пирролидиновый радикал или пиперазиновый радикал, необязательно замещенный в 4-положении низшим C1-C6 алкилом или моно- или полигидроксиалкилом, как определено выше.
Если R4 и R5 представляет галоид, последний является предпочтительно атомом фтора, хлора или брома.
Согласно предпочтительному варианту, соединения согласно изобретению соответствуют следующей общей формуле: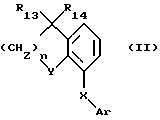
в которой Ar представляет радикал следующей формулы (а) или (b)

R1 представляет -COR7,
R5 и R7 имеют значения, как они определены выше для формулы (I),
Х представляет двухвалентный радикал, который справа налево или наоборот имеет формулу:
R11 и R12 представляют Н,
R13 и R14, которые являются одинаковыми или разными, представляют Н или СН3,
Y представляет атом кислорода или серы или метиленовый, этиленовый или изопропилиденовый двухвалентный радикал, и
n равно 1 или 2.
В частности, среди соединений, соответствующих приведенной выше формуле (I) и (II), согласно настоящему изобретению могут быть упомянуты следующие соединения:
-Метил 2-гидрокси-4-[3-(4,4-диметилхроман-8-ил)проп-1-инил] бензоат,
-2-Гидрокси-4-[3-(4,4-диметилхроман-8-ил)проп-1-инил] бензойная кислота,
- Метил 2-гидрокси-4-[3-гидрокси-3-(4,4-диметилхроман-8-ил)проп-1-инил] бензоат,
-2-Гидрокси-4-[3-гидрокси-3-(4,4-диметилхроман-8-ил)проп-1-инил] бензойная кислота,
Метил 2-гидрокси-4-[3-(4,4-диметилтиохроман-8-ил)проп-1-инил] бензоат,
-2-Гидрокси-4-[3-(4,4-диметилтиохроман-8-ил)проп-1-инил] бензойная кислота,
Этил 4-[3-гидрокси-3-(5,5,8,8-тетраметил-3-фенил-5,6,7,8-тетрагидронафт-1-ил)проп-1-инил] бензоат,
-4-[3-Гидрокси-3-(5,5,8,8-тетраметил-3-фенил-5,6,7,8-тетрагидронафт-1-ил)проп-1-инил] бензойная кислота,
-4-[3-(5,5,8,8-Тетраметил-3-фенил-5,6,7,8-тетрагидронафт-1-ил)проп-1-инил] бензойная кислота,
-Этил 4-[3-(4,4-диметилтиохроман-5-ил)-3-гидроксипроп-1-инил] бензоат,
-4-[3-(4,4-Диметилтиохроман-5-ил)-3-гидроксипроп-1-инил] бензойная кислота,
-4-[3-(4,4-Диметилтиохроман-5-ил)проп-1-инил] бензойная кислота,
Этил 4-[3-(3,5-ди-трет-бутил-2-(метоксиметокси)-фенил)-3-гидроксипроп-1-инил] бензоат,
-4-[3-(3,5-Ди-трет-бутил-2-(метоксиметокси)фенил)-3-гидроксипроп-1-инил] бензойная кислота,
-Этил 4-[3-(3,5-ди-трет-бутил-2-гидроксифенил)-3-гидроксипроп-1-инил] бензоат,
-Этил 4-[3-(3,5-ди-трет-бутил-2-гидроксифенил)проп-1-инил] бензоат,
Этил 4-[3-(3,5-ди-трет-бутил-2-метоксифенил)-3-гидроксипроп-1-инил] бензоат,
-4-[3-(3,5-Ди-трет-бутил-2-метоксифенил)-3-гидроксипроп-1-инил] бензойная кислота,
-4-[3-(3,5-Ди-трет-бутил-2-метоксифенил)проп-1-инил] бензойная кислота,
- Этил 4-[3-(5-трет-бутил-4-(метоксиметокси)бифенил-3-ил)-3-гидроксипроп-1-инил] бензоат,
-4-[3-(5-трет-Бутил-4-(метоксиметокси)бифенил-3-ил)-3-гидроксипроп-1-инил] бензойная кислота,
- Этил 4-[3-(5-трет-бутил-4-(метоксибифенил-3-ил)-3-гидроксипроп-1-инил] бензоат,
-4-[3-(5-трет-Бутил-4-метоксибифенил-3-ил)-3-гидроксипроп-1-инил] бензойная кислота,
- Этил 4-[3-(3,5-ди-трет-бутил-2-метоксифенил)-3-метоксипроп-1-инил] бензоат,
-4-[3-(3,5-Ди-трет-бутил-2-метоксифенил)-3-метоксипроп-1-инил] бензойная кислота,
-Метил 4-[3-(4,4-диметилтиохроман-8-ил)проп-1-инил] -бензоат,
-Этил 6-[3-(4,4-диметилтиохроман-8-ил)проп-1-инил] -никотинат,
-4-[3-(4,4-Диметилтиохроман-8-ил)проп-1-инил] бензальдегид,
-4-[3-(4,4-Диметилтиохроман-8-ил)проп-1-инил] фенол,
- Этил 4-[3-(5-трет-бутил-4-гидроксибифенил-3-ил)-3-гидроксипроп-1-инил] бензоат,
-4-[3-(5-трет-Бутил-4-метоксибифенил-3-ил)проп-1-инил] бензойная кислота,
-4-[3-(4,4-Диметилтиохроман-8-ил)проп-1-инил] -бензойная кислота,
-4-[3-{ 5,6,7,8-Тетрагидро-5,5,8,8-тетраметил-1-нафтил)проп-1-инил] бензойная кислота,
-2-Гидрокси-4-[3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-1-нафтил)проп-1 -инил] бензойная кислота,
- Метил 2-гидрокси-4-[3-гидрокси-3-(4,4-диметилхроман-8-ил)проп-1-инил] бензоат,
-2-Гидрокси-4-[3-гидрокси-3-(4,4-диметилхроман-8-ил)проп-1-инил] бензойная кислота,
-2-Гидрокси-4-[3-(4,4-диметилтиохроман-8-ил)проп-1-инил] бензойная кислота,
-4-[3-(4,4-Диметилтиохроман-8-ил)проп-1-инил] бензамид,
-N-Этил-4-[3-(4,4-диметилтиохроман-8-ил)проп-1-инил] бензамид,
-N-(4-Гидроксифенил)-4-[3-(4,4-диметилтиохроман-8-ил)проп-1-инил] бензамид,
-Морфолид-4-[3-(4,4-диметилтиохроман-8-ил)проп-1-инил] бензойной кислоты,
-4-[3-(4,4-Диметилтиохроман-8-ил)проп-2-инил] бензойная кислота,
-4-[3-(5,5,8,8-Тетраметил-5, б, 7,8-тетрагидронафт-1-ил)проп-2-инил] бензойная кислота,
-4-[3-(4,4-Диметил-6-фенилтиохроман-8-ил)проп-1-инил] бензойная кислота,
-4-[3-(4,4-Диметил-6-фенилхроман-8-ил)проп-1-инил] бензойная кислота,
-4-[3-(4,4-Диметил-6-фенилтиохроман-8-ил)проп-2-инил] бензойная кислота,
-4-[3-(4,4-Диметил-6-(п-толил)тиохроман-8-ил)проп-1-инил] бензойная кислота,
-4-[3-(5,5,8,8-Тетраметил-5,6,7,8-тетрагидронафт-1-ил)проп-2-инил] бензойная кислота,
-4-[3-(5,5,8,8-Тетраметил-3-(п-толил)-5,6,7,8-тетрагидронафт-1-ил)проп-2-инил] бензойная кислота,
-4-(3-[3-(4-Метоксифенил)-5,5,8,8-тетраметил-5,6,7,8-тетрагидронафт-1-ил)проп-1 -инил] бензойная кислота,
-2-Гидрокси-4-[3-(5,5,8,8-тетраметил-3-(п-толил)-5,6,7,8-тетрагидронафт-1-ил)проп-1-инил] бензойная кислота и
-3-Гидрокси-4-[3-(5,5,8,8-тетраметил-3-фенил-5,6,7,8-тетрагидронафт-1-ил)проп-1-инил] бензойная кислота.
Другим предметом настоящего изобретения являются способы приготовления соединений формулы (I), приведеной выше, согласно схеме реакции 1 (см. в конце описания).
Соединения формулы (I) могут быть приготовлены из галоидзамещенного производного (1), предпочтительно бромированного или иодированного производного, путем превращения в магниевое производной, с последующей реакцией с метоксиалленом в присутствии CuBr и получением пропаргилового производного (2). Последнее впоследствии сочетается с галоидзамещенным производным (3), предпочтительно иодированным или бромированным производным, в присутствии палладиевого катализатора, например бис(трифенилфосфин)палладий (II) хлорида, в растворителе, таком как триэтиламин.
Соединения формулы (I) могут быть также приготовлены путем последовательности реакций, включающих реакцию литий триметилсилилацетилида с альдегидным соединением (4), и снятием защиты тетрабутиламмонийфторидом в ТГФ с получением пропаргилового спирта (6). Сочетанием последнего с галоидзамещенным производным (3), предпочтительно иодированным или бромированным производным, в присутствии палладиевого катализатора, например бис(трифенилфосфин)палладий (II) хлорида, в растворителе, таком как триэтиламин, получается гидроксилированное соединение формулы (I') согласно изобретению. Последнее соединение за счет восстановления функциональной спиртовой группы в карбид в присутствии триметилсилилиодида в растворителе, таком как гексан, или за счет гидридного переноса из силана, такого как триэтилсилан, в присутствии BF3. Et2O в хлорированном растворителе, таком как метиленхлорид, дает соединение формулы (I).
Соединения формулы (I) могут быть также приготовлены путем последовательности реакций, включающих реакцию бензоил хлорида формулы (8) с ацетиленовым производным формулы (9) в присутствии кислоты Льюиса (например, AlCl3) в хлорированном растворителе, таком как дихлорметан. Ацетиленовый кетон (10), полученный таким образом, восстанавливается в гидроксилированное соединение (I') согласно изобретению действием гидрида щелочного металла, такого как боргидрид натрия, в спиртовом растворителе (например, метаноле). Восстановление функциональной спиртовой группы соединения (I') в карбид проводится, как описано выше, и дает соединение формулы (I).
Алленовые соединения формулы (I") могут быть приготовлены путем нагревания соединений формулы (I) в присутствии основания (NaOH, Et3N, DBU) в растворителе, таком как гептан или ТГФ.
Исходные соединения для синтеза предпочтительных соединений формулы (II) могут быть получены согласно различным схемам реакции в зависимости от значения радикала Y.
Если Y представляет атом серы, R13 и R14 представляют -СН3 и n= 2, то есть 4,4-диметилтиохроманильные производные, последние могут быть получены из 2-бромтиофенола за счет реакции сочетания с 4-бром-2-метил-2-бутеном в присутствии карбоната калия или гидрида натрия в ДМФА и затем подвергнуты циклизации либо в присутствии п-толуолсульфоновой кислоты, либо в присутствии хлористого алюминия или полифосфорной кислоты, согласно схеме реакции 2 (см. в конце описания).
Когда Y представляет атом кислорода, R13 и R14 представляют -СН3 и n= 2, то есть 4,4-диметилтиохроманильные производные, последние могут быть получены из фенола за счет реакции с 3-метил-3-бутен-1-ил дифенилфосфатом в присутствии хлористого олова, затем литирования в присутствии дибутиллития и тетраметилэтилендиамина и реакции с дииодметаном (K. McWilliams, J. Org. Chem. , 1966, 61, 7408-14), согласно схеме реакции 3 (см. в конце описания).
Когда Y представляет изопропилиденовый радикал, R13 и R14 представляют -СН3 и n= 2, то есть тетрагидротетраметилнафтильные производные, последние могут быть получены из 3-бромфенола за счет реакции с 2,5-дихлор-2,5-диметилгексаном в присутствии хлорида алюминия, палладия на угле и муравьиной кислоты или водорода и образования трифлатного производного, и затем гидроформилирования (H. Kotsuki, Synthesis, 1996, 470-2) согласно схеме реакции 4 (см. в конце описания).
Когда Y представляет метиленовый радикал, R13 и R14 представляют -СН3 и n= 2, то есть тетрагидродиметилнафтильные производные, последние могут быть получены из 2-броманизола за счет реакции сочетания с цинковым производным 1-бром-4-метилпент-3-ена в присутствии палладиевого катализатора, например PdCl2/(dppf) (R. L. Danheiser, J. Org. Chem. , 1995, 60, 8341-8350), затем циклизации в присутствии кислоты Льюиса, например хлористого алюминия, затем диметилирования BBr3, образования трифлата и гидроформилирования, как описано выше.
Эта последовательность реакций может быть представлена схемой реакции 5 (см. в конце описания).
Когда R1 представляет -СООН, соединения готовятся при условии, когда группа R1 защищается защищающей группой алкильного, аллильного или трет-бутильного типа.
Превращение свободной формы может проводиться:
- в случае алкильной защищающей группы с помощью гидроокиси натрия или гидроокиси лития в спиртовом растворителе, таком как метанол, или в ТГФ;
- в случае аллильной защищающей группы с помощью катализатора, такого как определенные комплексы переходных металлов, в присутствии вторичного амина, такого как морфолин;
- в случае защищающей группы трет-бутильного типа с помощью триметилсилилиодида.
Когда R1 является -ОН, соединения могут быть получены из соответствующей кислоты за счет восстановления в присутствии литий алюминий гидрида.
Когда R1 является -CON(r')r", соединения могут быть получены путем превращения соответствующей кислоты в хлорид кислоты, например тионилхлоридом, и затем реакцией с аммиаком или соответствующим амином.
Другой предмет настоящего изобретения представляют соединения формулы (I), как они определены выше, в качестве лекарственного средства.
Эти соединения проявляют активность в тесте на дифференциацию клеток мышиной эмбриональной терактокарциномы (F9) (Cancer Research, 43, р. 5268, 1983) и/или в тесте на ингибирование орнитин декарбоксилазы после индуцирования ТРА у мыши (Cancer Research, 38. р, 793-801, 1978). Эти тесты показывают активность соединений в областях клеточной дифференциации и пролиферации соответственно.
В тесте на дифференциацию клеток (F9) становится возможным оценить агонистическую активность, подобную антогонистической активности на рецепторах ретиноевой кислоты. Это происходит потому, что антогонист является неактивным, если он присутствует один в этом тесте, но частично или полностью ингибирует влияние, продуцированное с помощью агонистического ретиноида, на морфологию и на секрецию плазминогенного активатора. Поэтому эти соединения также ингибируют активность в тесте, который заключается в идентификации RAR-антагонистических молекул, как описано во фрацузской патентной заявке No. 95-07302, поданной 19 июня 1995 г. компанией заявителя. Этот тест включает следующие стадии: (i) достаточное количество RAR-агонистической молекулы применяется локально к части кожи млекопитающего, (ii) молекула, способная к ингибированию RAR-антагонистической активности, вводится систематически или локально тому же млекопитающему или в ту же часть кожи млекопитающего до, в процессе или после стадий (i) и (iii) оценивается отклик части кожи обработанного таким образом млекопитающего. Таким образом, отклик на локальное применение к уху млекопитающего RAR-агонистической молекулы, который соответствует увеличению толщины этого уха, может быть ингибирован за счет систематического или локального введения RAR-антагонистической молекулы.
Соединения согласно изобретению являются особенно пригодными для следующих областей лечения:
1) для лечения дерматологических состояний, связанных с нарушением кератинизации, включающим дифференциацию и пролиферацию, в частности для лечения обыкновенных угрей, комедониевых или полиморфных угрей, розовых угрей, узелковокистозных угрей, шаровидных угрей, старческих угрей и вторичных угрей, таких как солнечные, лекарственные или профессиональные угри,
2) для лечения других типов нарушений кератинизации, в частности ихтиозов, ихтиозоформных состояний, болезни Darier's, кератодермии ладонно-подошвенной, лейкоплакии и лейкоплакиформных состояний или кожного лихена, или лихена, относящегося к слизистой оболочке (орального),
3) для лечения других дерматологических состояний, связанных с нарушением кератинизации с воспалительным и/или иммуноаллергенным компонентом, и, в частности, всех форм псориаза, либо кожных, относящихся к слизистой оболочке, либо ногтевых, и даже псориатического ревматизма, или альтернативно кожной атопии, такой как экзема, или респираторной атопии, или альтернативно десневой гипертрофии; соединения могут быть также использованы для определенных воспалительных состояний, которые не показывают нарушения кератинизации,
4) для лечения всех дермальных или эпидермальных пролифераций, являются ли они доброкачественными или злокачественными и обладают ли они или не обладают вирусной природой, таких как простые бородавки, плоские бородавки и эпидермодиспласийные бородавкообразные образования, цветущие или оральные папиломатозы, и пролиферации, которые могут быть индуцированы ультрафиолетовым облучением, в частности, в случае базальных клеток и эпителиомы шиповатых клеток,
5) для лечения других дерматологических нарушений, таких как буллезные дерматозы и коллагеновые заболевания,
6) для лечения определенных офтальмологических нарушений, в частности корнеопатий,
7) для восстановления или для борьбы со старением кожи, либо фотоиндуцированным, либо хронологическим, или для снижения актиничных кератозов и пигментаций, или любой патологии, связанной с хронологическим или актиничным старением,
8) для предупреждения или лечения стигм эпидермальной и/или дермальной атрофии, индуцированной локальными или систематическими кортикостероидами, или любых других форм кожной атрофии,
9) для предупреждения или лечения нарушений, связанных с заживлением ран, или для предупреждения или для восстановления ссадин,
10) для борьбы с нарушениями сальных функций, таких как гиперсеборея угрей или простая себорея,
11) для лечения или предупреждения раковых или предраковых состояний,
12) для лечения воспалительных состояний, таких как артриты,
13) для лечения любого состояния вирусного происхождения на кожном уровне или общем уровне,
14) для предупреждения или лечения облысения,
15) для лечения дерматологических или общих состояний с иммунологическим компонентом,
16) для лечения состояний сердечно-сосудистой системы, таких как атеросклерозы.
В терапевтических областях, упомянутых выше, соединения согласно изобретению могут преимущественно применяться в комбинации с другими соединениями с активностью ретиноидного типа, с витаминами D или другими производными, с кортикостероидами, с агентами для разрушения свободных радикалов, с α-гидрокси, или α-кетокислотами, или их производными, или альтернативно с блокаторами ионных каналов. Витамины D или их производные понимаются как имеющие значение, например, производных витамина D2 или D3 и, в частности, 1,25-дигидровитамина D3. Под агентами для разрушения свободных радикалов понимаются, например, α-токоферол, супероксид дисмутазы или SOD, убихинол или определенные металлхелатирующие агенты. α-Гидрокси, или α-кетокислоты, или их производные понимаются как имеющие значение, например, молочной кислоты, яблочной кислоты, лимонной кислоты, гликолевой кислоты, миндальной кислоты, винной кислоты, глицериновой кислоты или аскорбиновой кислоты или их солей, амидов или эфиров. Наконец, под блокаторами ионных каналов понимаются, например, миноксидил (2,4-диамино-6-пиперидинопиримидин-3-оксид) и его производные.
Другим предметом настоящего изобретения являются фармацевтические композиции, включающие, по крайней мере, одно соединение формулы (I), как оно определено выше, один из его оптических или геометрических изомеров или одну из его солей.
Фармацевтические композиции предназначаются особенно для лечения вышеупомянутых состояний и характеризуются тем, что они включают в фармацевтически приемлемый носитель, который является совместимым с выбранным способом введения, по крайней мере, одно соединение формулы (I), один из его оптических или геометрических изомеров, или одну из его солей.
Введение соединений согласно изобретению может быть проведено энтерально, парентерально, локально или через глазное введение.
Для энтерального введения композиции могут быть обеспечены в виде таблеток, твердых желатиновых капсул, драже, сиропов, суспензий, растворов, порошков, гранул, эмульсий или полимерных или липидных визикул, или наносфер, или микросфер, которые делают возможным контролированное высвобождение. Для парентерального введения композиции могут обеспечиваться в виде растворов или суспензий для инфузии или инъекции.
Соединения согласно изобретению обычно вводят с суточной дозой приблизительно от 0,01 мг/кг до 100 мг/кг веса тела, и это при норме от 1 до 3 введений.
Для локального введения фармацевтические композиции на основании соединений согласно изобретению более конкретно предназначаются для лечения кожи и слизистых мембран и могут поэтому обеспечиваться в виде мазей, кремов, молочка, лечебных мазей, порошков, импрегнированных прокладок, растворов, гелей, спреев, лосьонов или суспензий. Они могут также обеспечиваться в виде полимерных или липидных визикул, или наносфер, или микросфер, или полимерных пластырей, или гидрогелей, которые делают возможным контролированное высвобождение активного вещества. Эти композиции для локального введения могут, кроме того, обеспечиваться либо в безводной форме, либо в виде водных растворов согласно клиническим требованиям.
Для глазного введения они главным образом используются для промываний глаз.
Эти композиции для локального или глазного использования содержат, по крайней мере, одно соединение формулы (I), как оно определено выше, или один из его оптических или геометрических изомеров, или одну из его солей при концентрации предпочтительно между 0,001 вес. % и 5 вес. % по отношению к общему весу композиции.
Соединения формулы (I) согласно изобретению также находят применение в косметической области, в частности для гигиены тела и волос, и особенно для лечения кожи со склонностью к появлению угрей, для восстановления роста волос и для борьбы с потерей волос, для борьбы с проявлением сальности кожи или волос, для защиты против вредного влияния солнечного света или при лечении физиологически сухой кожи и для предотвращения и/или для борьбы с фотоиндуцированным или хронологическим старением.
В косметической области соединения согласно изобретению могут, кроме того, преимущественно использоваться в комбинации с другими соединениями с активностью ретиноидного типа, с витаминами D или их производными с кортикостероидами, с агентами для разрушения свободных радикалов, с α-гидрокси или α-кетокислотами или их производными, или альтернативно с блокаторами ионных каналов, все последние соединения являются такими, как они определены выше.
Другим предметом настоящего изобретения является, таким образом, косметическая композиция, которая характеризуется тем, что она включает в косметически приемлемом носителе, по крайней мере, одно соединение формулы (I), как оно определено выше, или один из его оптических или геометрических изомеров, или одну из его солей, что делает возможным, чтобы указанная косметическая композиция обеспечивалась конкретно в форме крема, молочка, лосьона, геля, полимерных или липидных визикул, или наносфер, или микросфер, мыла или шампуня.
Концентрации соединения формулы (I) в косметических композициях согласно изобретению находятся преимущественно между 0,001 вес. % и 3 вес. % по отношению к общему весу композиции.
Фармацевтические и косметические композиции согласно изобретению могут дополнительно содержать инертные или даже фармакологически или косметически активные добавки или комбинации этих добавок и особенно: смачивающие агенты; депигментирующие агенты, такие как гидрохинон, азелаиновая кислота, кофейная кислота или коевая кислота; мягчители; гидратирующие агенты, такие как глицерин, ПЭГ 400, тиаморфолин и его производные или мочевина; антисеборейные или противоугревые агенты, такие как S-карбоксиметилцистеин, S-бензилцистамин, их соли или их производные, или перекись бензоила; антибиотики, такие как эритромицин и его эфиры, неомицин, клиндамицин и его эфиры, или тетрациклины; противогрибковые агенты, такие как кетоконазол или 4,5-полиметилен-3-изотиазолидоны; агенты, ускоряющие восстановление роста волос, такие как миноксидил (2,4-диамино-6-пиперидинопиримидин-3-оксид) и его производные, диазоксиды (7-хлор-3-метил-1,2,4-бензотиадизин 1,1-диоксид) и фенитоин (5,5-дифенилимидазолидин-2,4-дион); нестероидные противовоспалительные агенты; каротеноиды и особенно β-каротин; антипсориатические агенты, такие как антралин и его производные; и, наконец, эйкоза-5,8,11,14-тетраиноевые и эйкоза-5,8,11-трииноевые кислоты, их эфиры и амиды.
Композиции согласно изобретению могут также содержать усилители запаха, консервирующие агенты, такие как сложные эфиры пара-гидроксибензойной кислоты, стабилизирующие агенты, агенты, регулирующие влажность, агенты, регулирующие рН, агенты, модифицирующие осмотическое давление, эмульгирующие агенты, УФ-А и УФ-В, экранирующие агенты и антиоксиданты, такие как α-токоферол, бутилированный гидроксианизол или бутилированный гидрокситолуол.
Ряд примеров приготовления активных соединений формулы (I) согласно изобретению, а также различных фармацевтических и косметических композиций на основе этих соединений будут даны в качестве иллюстрации и без какого либо ограничения.
ПРИМЕР 1
Метил 2-гидрокси-4-[3-(4,4-диметилхроман-8-ил)проп-1-инил] бензоат (а) 4,4-диметил-8-иодхроман
2,00 г (12,3 ммолей) 4,4-диметилхромана и 30 мл этилового эфира вводят в трехгорлую колбу в атмосфере аргона. Добавляют по каплям 2,4 мл (15,9 ммолей) тетраметилэтилендиамина (TMEDA) (ТЭМД), смесь охлаждают до -78oС и добавляют по каплям 5,9 мл (14,8 ммолей) н-бутиллития (2,5 М в гексане). Позволяют температуре возвратиться до -20oС в течение двух часов и затем до комнатной температуры и смесь перемешивают в течение 12 часов. В другую трехгорлую колбу вводят в атмосфере аргона 1,3 мл (16,0 ммолей) дииодметана и 15 мл этилового эфира. Проводят охлаждение до 0oС и вводят предыдущий раствор, заранее охлажденный до -78oС, затем реакционной смеси позволяют дойти до комнатной температуры и перемешивают в течение 12 часов. Реакционную смесь выливают в воду и экстрагируют этиловым эфиром и органическую фазу разделяют отстаиванием, сушат над сульфатом магния и упаривают. Полученный остаток чистят с помощью хроматографии на колонке с силикагелем элюированием гептаном. После выпаривания растворителей собирают 1,30 г (37%) ожидаемого соединения в виде бледно-желтого масла.
1H ЯМР (CDCl3) δ 1,32 (с, 6Н), 1,84 (т, 2Н, J= 5,4 Гц), 4,28 (т, 2Н, J= 5,4 Гц), 6,62 (т, 1Н, J= 7,7 Гц), 7,24 (дд, 1Н, J= 7,8/1,5 Гц), 7,56 (дд, 1Н, J= 7,7/1,5 Гц) (здесь и далее s-синглет, с; t-триплет, т; d-дублет, д; dd-двойной дублет, дд; td-тройной дублет, тд; m-мульплет, м).
(b)метоксиаллен
210 мл (2,5 моля) пропаргилметилового эфира и 12,00 г (110,0 ммолей) трет-бутоксида натрия вводят в трехгорлую колбу в атмосфере аргона. Реакционную смесь нагревают при кипячении с обратным холодильником в течение трех часов и отгоняют при атмосферном давлении. Фракцию, отгоняющуюся при 51oС, собирают для того, чтобы получить 153,50 г (88%) ожидаемого соединения в виде бесцветного масла.
1H ЯМР (CDCl3) δ 3,41 (с, 3Н), 5,48 (д, 2Н, J= 5,9 Гц), 6,77 (т, 1Н, J= 5,9 Гц).
(c) 3-(4,4-диметилхроман-8-ил)-проп-1-ин
280 мг (11,5 ммолей) магния, активированного одной каплей диброэтана, вводят в трехгорлую колбу в атмосфере аргона. Добавляют по каплям раствор 3,00 г (10,4 ммолей) 4,4-диметил-8-иодхромана в 15 мл этилового эфира, так чтобы поддерживать рефлюкс растворителя, и реакционную смесь перемешивают при 35oС в течение 15 минут. Впоследствии ее охлаждают до -5oС, добавляют 40 мг (0,2 ммолей) Cul и к раствору по каплям добавляют 1,24 г (17,7 ммолей) метоксиаллена в 5 мл этилового эфира. Смесь перемешивают в течение 1 часа при -5oС, позволяют дойти до комнатной температуры и перемешивают в течение двух часов. Реакционную смесь выливают в насыщенный водный раствор хлористого аммония и экстрагируют этилацетатом и органическую фазу разделяют отстаиванием, сушат над сульфатом магния и упаривают. Полученный остаток чистят с помощью хроматографии на колонке с силикагелем элюированием гептаном. После выпаривания растворителей собирают 1,30 г (65%) ожидаемого соединения в виде желтого масла.
1H ЯМР (CDCl3) δ 1.33 (с, 6Н), 1.83 (т, 2Н, J= 5.4 Гц), 2.15 (т, 1Н, J= 2.7 Гц), 3.52 (д, 2Н, J= 2.7 Гц), 4.21 (т, 2Н, . J= 5.4 Гц), 6.87 (т, 1Н, J= 7.6Гц), 7.18 (дд, 1Н, J= 7.9/1.5 Гц), 7.33 (дд, 1Н, J= 7.4/1.5 Гц).
(d) метил 2-гидрокси-4-[3-(4,4-диметилхроман-8-ил)-проп-1-инил] бензоат
1,18 г (5,9 ммолей) 3-(4,4-диметилхроман-8-ил)-1-пропина, 1,60 г (5,9 ммолей) метил 2-гидрокси-4-иодбензоата и 60 мл триэтиламина вводят в трехгорлую колбу в атмосфере аргона. Реакционную смесь дегазируют продуванием азотом, вводят 332 мг (0,46 ммолей) бис(трифенилфосфин)палладий хлорида (II) и 134 мг иодида меди и смесь перемешивают при комнатной температуре в течение восьми часов. Реакционную смесь упаривают досуха, остаток собирают этилацетатом и соляной кислотой (1N) и органическую фазу разделяют отстаиванием, сушат над сульфатом магния и упаривают. Остаток чистят с помощью хроматографии на колонке с силикагелем элюированием гептаном. После выпаривания растворителей получают масло, которое медленно кристаллизуется, и перекристаллизовывают его из гептана. Собирают 1,00 г (50%) метил 2-гидрокси-4-[3-(4,4-диметилхроман-8-ил)-проп-1-инил] бензоата в виде белого твердого вещества с температурой плавления 92-93oС.
1H ЯМР (CDCl3) δ 1.34 (с, 6Н), 1.84 (т, 2Н, J= 5.4 Гц), 3.75 (с, 2Н), 3.94 (с, 3Н), 4.23 (т, 2Н, J= 5.4 Гц), 6.89 (т, 1Н, J= 7.6 Гц), 6.95 (дд, 1Н, J= 8.2/1.5 Гц), 7.06 (д, 1H, J= 1.4 Гц), 7.20 (д, 1Н, J= 6.3 Гц), 7.35 (д, 1H, J= 7.4 Гц), 7.75 (д, 1Н, J= 8.2 Гц), 10.73 (с, 1Н).
ПРИМЕР 2
2-Гидрокси-4-[3-(4,4-диметилхроман-8-ил)проп-1-инил] бензойная кислота
860 мг (2,5 ммоля) метилового эфира, полученного в Примере 1(d), 1,00 г (25,0 ммолей) гидроокиси лития и 50 мл ТГФ вводят в круглодонную колбу. Реакционную смесь нагревают при кипячении с обратным холодильником в течение 18 часов и упаривают досуха. Остаток собирают водой, подкисляют до рН 1 и экстрагируют этиловым эфиром и органическую фазу разделяют отстаиванием, сушат над сульфатом магния и упаривают. Остаток растирают в гептане и отфильтровывают и собирают 560 мг (70%) 2-гидрокси-4-[3-(4,4-диметилхроман-8-ил)проп-1-инил] бензойной кислоты в виде твердого белого вещества с температурой плавления 182-183oС.
1H ЯМР (d6-ДМСО) δ 1.29 (с, 6Н), 1.79 (т, 2Н, J= 5.2 Гц), 3.72 (с, 2Н), 4.20 (т, 2Н, J= 5.3 Гц), 6.67 10 (т, 1Н, J= 7.6 Гц), 6.76 - 6.79 (м, 2Н), 7.05 (д, 2Н, J= 7.6 Гц), 7.55 (д, 1Н, J= 8.6 Гц).
ПРИМЕР 3
Метил 2-гидрокси-4-[3-гидрокси-3-(4,4-диметилхроман-8-ил)проп-1-нил] бензоат.
(a) 4,4-диметилхроман-8-карбальдегид
14,40 г (50,0 ммолей) 4,4-диметил-8-иодхромана и 50 мл ТГФ вводят в трехгорлую колбу в потоке азота. 22 мл (55,0 ммолей) н-бутиллития (2,5 М в гексане) вводят по каплям при -78oС, реакционную смесь перемешивают в течение 30 минут, затем добавляют 4,2 мл (55,0 ммолей) ДМФА и смеси позволяют дойти до комнатной температуры. Реакционную смесь выливают в насыщенный водный раствор хлористого аммония и экстрагируют этиловым эфиром и органическую фазу разделяют отстаиванием, сушат над сульфатом магния и упаривают. Собирают 10,40 г (100%) ожидаемого соединения в виде желтого масла.
1H ЯМР (СDСl3) δ 1.36 (с, 6Н), 1.86 (т, 2Н, J= 5.2 Гц), 4.29 (т, 2Н, J= 5.6 Гц), 6.91 (т, 1 Н, J= 8.4 Гц), 7.50 (дд, 1 Н, J= 7.7/1.7 Гц), 7.64 (дд, 1 Н, J= 7.9/1,7Гц), 10.42 (с, 1Н).
(b) α-этинил-4,4-диметилхроман-8-метанол
7,6 мл (54,0 ммолей) триметилсилилацетилена и 50 мл ТГФ вводят в трехгорлую колбу. Раствор 22 мл (54,0 ммолей) н-бутиллития (2,5 М в гексане) добавляют по каплям при -78oС под азотом и смеси позволяют дойти до комнатной температуры. Реакционную смесь вводят по каплям в холодный (-78oС) раствор, состоящий из 9,30 г (49,0 ммолей) 4,4-диметилхроман-8-карбальдегида и 50 мл ТГФ. Реакционной смеси позволяют дойти до комнатной температуры, выливают в насыщенный водный раствор хлористого аммония и экстрагируют этиловым эфиром и органическую фазу разделяют отстаиванием, сушат над сульфатом магния и упаривают. Получают 14,00 г (100%) ожидаемого соединения в виде желтого масла. 3,00 г (10,0 ммолей) этого масла смешивают с 50 мл ТГФ и добавляют по каплям 11,5 мл (12,6 ммолей) раствора тетрабутиламмоний фторида (1,1 М в ТГФ). Реакционную смесь перемешивают при комнатной температуре в течение одного часа, выливают в воду и экстрагируют этиловым эфиром, и органическую фазу разделяют отстаиванием, сушат над сульфатом магния и упаривают. Собирают 2,30 г (100%) ожидаемого соединения в виде бесцветного масла.
1H ЯМР (CDCl3) δ 1,33 (с, 6Н), 1.81-1.88 (м, 2Н), 2.59 (д, 1H, J= 2.2 Гц), 4.11 (д, 1Н, J= 6.1 Гц), 4.25 (т, 2Н, J= 4.7 Гц), 5.68 (дд, 1Н, J= 6.1/25 2.0 Гц), 6.90 (т, 1Н, J= 7.7 Гц), 7.25 (д, 1Н, J= 7.8 Гц), 7.41 (д, 1Н, J= 7.7 Гц).
(с) метил 2-гидрокси-4-[3-гидрокси-3-(4,4-диметилхроман-8-ил)проп-1-инил] бензоат.
3,00 г (13,9 ммолей) α-этинил-4,4-диметилхроман-8-метанола, 3,90 г (13,9 ммолей) метил 2-гидрокси-4-иодбензоата и 100 мл триэтиламина вводят в трехгорлую колбу. Реакционную смесь дегазируют продуванием азотом в течение 30 минут и затем последовательно добавляют 780 мг (1,1 ммоля) бис(трифенилфосфин)палладий хлорида (II) и 320 мг (1,7 ммолей) иодида меди. Реакционную смесь перемешивают при комнатной температуре в течение 4 часов и упаривают досуха, а полученный остаток собирают водой и этиловым эфиром. Органическую фазу разделяют отстаиванием, сушат над сульфатом магния и упаривают. Полученный остаток чистят с помощью хроматографии на колонке с силикагелем элюированием смесью, состоящей из 50% этилацетата и 50% гептана. Собирают 2,85 г (56%) метил 2-гидрокси-4-[3-гидрокси-3-(4,4-диметилхроман-8-ил)-проп-1-инил] бензоата в виде белого твердого вещества с температурой плавления 122-123oС.
1H ЯМР (CDCl3) δ 1.36 (с, 6Н), 1.87-1.90 (м, 2Н), 3.18 (д, 1Н, J= 6.4 Гц), 3.95 (с, 3Н), 4.31 (т, 2Н, J= 5.3 Гц), 5.86 (д, 1Н, J= 6.4 Гц), 6.89-7.00 (м, 2Н), 7.09 (с, 1Н), 7.29 (д, 1Н, J= 7-9 Гц), 7.40 (д, 1Н, J= 7.4 Гц), 7.77 (д, 1Н, J= 8.2 Гц).
ПРИМЕР 4
2-Гидрокси-4-[3-гидрокси-3-(4,4-диметилхроман-8-ил)проп-1-инил] бензойная кислота.
2,80 г (7,60 ммолей) соединения, полученного в Примере 3 (с), 3,20 г (76,5 ммолей) гидроокиси лития и 100 мл ТГФ вводят в круглодонную колбу. Реакционную смесь нагревают при кипячении с обратным холодильником в течение 18 часов и упаривают досуха. Остаток собирают водой, подкисляют до рН 1 и экстрагируют этиловым эфиром, и органическую фазу разделяют отстаиванием, сушат над сульфатом магния и упаривают. Остаток растирают в гептане и отфильтровывают и собирают 660 мг (25%) 2-гидрокси-4-[3-гидрокси-3-(4,4-диметилхроман-8-ил)проп-1-инил] бензойной кислоты в виде белого твердого вещества с температурой плавления 225-227oС.
1H ЯМР (CDCl3 + 2 капли d6-ДМСО) δ 1.34 (с, 6Н), 1.87 (т, 2Н, J= 6.0 Гц), 3,50 (с, 1Н), 4.28 (т, 2Н, J= 5.7 Гц), 5.90 (с, 1Н), 6.88-6.96 (м, 2Н), 7.02 (с, 35 1Н), 7.27 (д, 1Н, J= 7.8 Гц), 7.46 (д, 1Н, J= 7.4 Гц), 7.79 (д, 1Н, J - 8.1 Гц), 11.23 (бр с, 1Н).
ПРИМЕР 5
Метил 2-гидрокси-4-[3-(4,4-диметилтиохроман-8-ил)проп-1-инил] бензоат
(a) 2-бром-1-(3-метилбут-2-енилтио)бензол
19,30 г (102,0 ммолей) 2-бромтиофенола, 160 мл ДМФА и 15,50 г (112,0 ммолей) карбоната калия вводят в трехгорлую колбу. 13 мл (112,0 ммолей) 1-бром-3-метил-2-бутена добавляют и реакционную смесь перемешивают при комнатной температуре в течение двух часов. Смесь выливают в воду и экстрагируют этилацетатом и органическую фазу разделяют отстаиванием, сушат над сульфатом магния и упаривают. Собирают 26,00 г (99%) ожидаемого соединения в виде оранжевого масла.
1H ЯМР (CDCl3) δ 1.65 (с, 3Н), 1.73 (с, 3Н), 3.56 (д, 2Н, J= 7.7 Гц), 5.32 (тд, 1Н, J= 7.7/1.4 Гц), 6.96-7.06 (м, 1Н), 7.22-7.26 (м, 2Н), 7.52 (д, 1Н, J= 7.7 Гц).
(b) 4,4-диметил-8-бромтиотиохроман
26,00 г (102,0 ммолей) 2-бром-1-(3-метилбут-2-енилтио)бензола, 180 мл толуола и 23,20 г (122,0 ммолей) пара-толуолсульфоновой кислоты вводят в трехгорлую колбу. Реакционную смесь нагревают при кипячении с обратным холодильником в течение четырех часов и упаривают досуха. Остаток собирают водным раствором гидрокарбоната натрия и экстрагируют этилацетатом и органическую фазу разделяют отстаиванием, сушат над сульфатом магния и упаривают. Полученный остаток чистят с помощью хроматографии на колонке с силикагелем, элюируемой гептаном. Собирают 20,00 г (76%) ожидаемого соединения в виде оранжевого масла.
1H ЯМР (CDCl3) δ 1.33 (с, 6Н), 1.94 (т, 2Н, J= 6.0 Гц), 3,04 (т, 2Н, J= 6.1 Гц), 6.89 (т, 1Н, J= 7.9 Гц), 7.34 (д, 2Н, J= 7.9 Гц).
(c) 3-(4,4-диметилтиохроман-8-ил)проп-1-ин
Таким же образом, как и в Примере 1(с), из 3,00 г (11,7 ммолей) 4,4-диметил-8-бромтиохромана получают 710 мг (28%) ожидаемого соединения в виде светло-желтого масла.
1H ЯМР (CDCl3) δ 1.34 (с, 6Н), 1.95 (т, 2Н, J= 6.1 Гц), 2.23 (т, 1Н, J= 2.7 Гц), 3.04 (т, 2Н, J= 6.2 Гц), 3.53 (д, 2Н, J= 2.6 Гц), 7.05 (т, 1Н, J= 7.7 Гц), 7.32 (д, 1Н, J= 7.8 Гц), 7.38 (д, 1Н, J= 7.7 Гц).
(d) метил 2-гидрокси-4-[3-(4,4-диметилтиохроман-8-ил)проп-1-инил] бензоат
670 мг (3,1 ммолей) 3-(4,4-диметилтиохроман-8-ил)проп-1-ина, 860 мг (3,1 ммолей) метил 2-гидрокси-4-иодбензоата и 33 мл триэтиламина вводят в трехгорлую колбу под аргоном. Реакционную смесь дегазируют продуванием азотом, вводят 174 мг (0,25 ммоля) бис(трифенилфосфин)палладий хлорида (II) и 71 мг иодида меди и реакционную смесь перемешивают при комнатной температуре в течение восьми часов. Реакционную смесь упаривают досуха, остаток собирают этилацетатом и соляной кислотой (1 N) и органическую фазу разделяют отстаиванием, сушат над сульфатом магния и упаривают. Остаток чистят с помощью хроматографии на колонке с силикагелем элюированием смесью, состоящей из 99% гептана и 1% этилацетата. После упаривания растворителей собирают 1,50 г (75%) метил 2-гидрокси-4-[3-(4,4-диметилтиохроман-8-ил)проп-1-инил] бензоата в виде желтого масла.
1H ЯМР (CDCl3) δ 1.35 (с, 6Н), 1.97 (т, 2Н, J= 6.0 Гц), 3.06 (т, 2Н, J= 6.1 Гц), 3.76 (с, 2Н), 3.94 (с, 3Н), 6.96 (дд, 1Н, J= 8.2/1.5 Гц), 7.04-7.10 (м, 2Н), 7.33 (д, 1Н, J= 6.9 Гц), 7.41 (д, 1Н, J= 7.4 Гц), 7.75 (д, 1H, J= 8.2 Гц).
ПРИМЕР 6
2-Гидрокси-4-[3-(4,4-диметилтиохроман-8-ил)проп-1-инил] бензойная кислота
Таким же образом, как и в Примере 2, из 1,40 г (3,8 ммолей) соединения, полученного в Примере 5(d), получают 960 мг (70%) 2-гидрокси-4-[3-(4,4-диметилтиохроман-8-ил)проп-1-инил] бензойной кислоты в виде белого твердого вещества с температурой плавления 190-191oС.
1H ЯМР (d6-ДМСО) δ 1.29 (с, 6Н), 1.69 (т, 2Н, J= 5.9 Гц), 3.04 (т, 2Н, J= 6.0 Гц), 3.75 (с, 2Н), 6.96-6.99 (м, 2Н), 7.06 (т, 1Н, J= 7.7 Гц), 7.32 (д, 1Н, J= 7.3 Гц), 7.38 (д, 1Н, J= 7.8 Гц), 7.76 (д, 1Н, J= 8.4 Гц).
ПРИМЕР 7
Этил 4-[3-гидрокси-3-(5,5,8,8-тетраметил-3-фенил-5,6,7,8-тетрагидронафт-1-ил)проп-1-инил] бензоат
(а) 3-бром-5,5,8,8-тетраметил-5,6,7,8-тетрагидронафт-1-ол
13,40 г (100,0 ммолей) хлористого алюминия и 100 мл дихлорметана вводят в трехгорлую колбу в атмосфере аргона. По каплям добавляют раствор, состоящий из 34,60 г (199,0 ммолей) 3-бромфенола, 89,00 г (486,0 ммолей) 2,5-дихлор-2,5-диметилгексана и 300 мл дихлорметана. Реакционную смесь перемешивают в течение шестнадцати часов при комнатной температуре. Реакционную смесь выливают в воду и экстрагируют дихлорметаном, экстракт промывают водой и органическую фазу разделяют отстаиванием, сушат над сульфатом магния и упаривают. Остаток чистят с помощью хроматографии на колонке с силикагелем элюированием смесью, состоящей из 80% гептана и 20% дихлорметана. После упаривания растворителей собирают 30,00 г (53%) ожидаемого соединения в виде белых кристаллов с температурой плавления 93oС.
1Н ЯМР (CDCl3) δ 1.25 (с, 6Н), 1.38 (с, 6Н), 1.57-1.69 (м, 4Н), 4.78 (с, 1Н), 6.64 (д, 1Н, J= 2.0 Гц), 7.04 (д, 1Н, J= 2.0 Гц).
(b) 5,5,8,8-тетраметил-3-фенил -5,6,7,8-тетрагидронафт-1-ол
12,93 г (106,0 ммолей) фенилборной кислоты, 20,00 г (70,7 ммолей) соединения, полученного в Примере 7(а), 400 мл ДМЭ и 70 мл водного раствора карбоната калия (2М) вводят в трехгорлую колбу. Реакционную смесь дегазируют продуванием аргона, добавляют 4,08 г (3,5 ммолей) тетракистрифенилфосфин палладия (0) и реакционную смесь нагревают до 90oС в течение восьми часов. Реакционную смесь выливают в воду и экстрагируют этилацетатом и органическую фазу разделяют отстаиванием, сушат над сульфатом магния и упаривают. Получаемый остаток чистят с помощью хроматографии на колонке с силикагелем элюированием гептаном. После выпаривания растворителей собирают 13,44 г (68%) ожидаемого соединения в виде белого порошка с температурой плавления 121oС.
1H ЯМР (CDCl3) δ 1.33 (с, 6Н), 1.46 (с, 6Н), 1.65-1.73 (м, 4Н), 4.77 (с, 1Н), 6,69 (д, 1Н, J= 1.8 Гц), 7.16 (д, 1Н, J= 1.8 Гц), 7.24-7.52 (м, 3Н), 7.53 (д, 2Н, J= 8.5 Гц).
(c) 5,5,8,8-тетраметил-3-фенил-5,6,7,8-тетрагидронафт-1-ил трифторметансульфонат
13,44 г (47,9 ммолей) соединения, полученного в Примере 7(b), 100 мл дихлорметана и 9,95 г (81,5 ммолей) N, N-диметил-4-аминопиридина вводят в трехгорлую колбу под аргоном. Смесь охлаждают до 0oС и добавляют по каплям 12,1 мл (71,9 ммолей) трифликового ангидрида. Температуре позволяют подняться до комнатной температуры в течение шестнадцати часов и реакционную смесь упаривают досуха. Добавляют этилацетат и смесь подкисляют до рН 3 соляной кислотой (1 N). Продукт экстрагируют этилацетатом, органическую фазу промывают водой и затем с использованием насыщенного водного раствора хлористого натрия, сушат над сульфатом магния и фильтруют, а растворители упаривают. Получают 19,29 г (97%) ожидаемого соединения в виде белого порошка с температурой плавления 110oС.
1H ЯМР (CDCl3) δ 1.35 (с, 6Н), 1.45 (с, 6Н), 1.71 (с, 4Н), 7.35-7.55 (м, 7Н).
(d) метил 5,5,8,8-тетраметил-3-фенил-5,6,7,8-тетрагидронафталин-1-карбоксилат
16,12 г (39,1 ммолей) трифлата, полученного в Примере 7(с), 1,61 г (3,9 ммолей) 1,3-бис(дифенилфосфин)пропана (DPPP), 440 мг (1,9 ммолей) ацетата палладия, 130 мл ДМФА, 10,9 мл (78,2 ммолей) триэтиламина и 17,1 мл (390,8 ммолей) метанола вводят в гидрирующее устройство. Реакционную смесь подвергают давлению диоксида углерода 4 бара и нагревают при перемешивании при 70oС в течение семи часов. Смесь охлаждают и упаривают насколько возможно, остаток собирают насыщенным водным раствором хлористого натрия и экстрагируют этилацетатом, и органическую фазу промывают с использованием разбавленного раствора соляной кислоты и затем водой, сушат над сульфатом магния и упаривают. Получаемый остаток очищают с помощью хроматографии на колонке с силикагелем, элюируемой гептаном. После выпаривания растворителей собирают 7,60 г (60%) ожидаемого соединения в виде белого порошка с температурой плавления 118oС.
1H ЯМР (CDCl3) δ 1.35 (с, 6Н), 1.40 (с, 6Н), 1.65-1.69 (м, 2Н), 1.76-1.80 (м, 2Н), 3.91 (с, 3Н), 7.30 (д, 1Н, J= 2.0 Гц), 7.34-7.46 (м, 3Н), 7.59 (д, 2Н, 35 J= 7.0 Гц), 7.61 (д, 1Н, J= 2.0 Гц).
(e) (5,5,8,8-тетраметил-3-фенил-5,6,7,8-тетрагидронафт-1-ил)-метанол
80 мл этилового эфира и 2,68 г (70,7 ммолей) литий алюминий гидрида вводят в однолитровую трехгорлую колбу. Реакционную смесь охлаждают до 0oС и затем вводят по каплям 7,60 г (23,5 ммолей) соединения, полученного в Примере 7(d), в растворе 80 мл этилового эфира. Реакционную смесь перемешивают в течение шестнадцати часов при комнатной температуре, затем по каплям добавляют насыщенный раствор хлористого натрия, смесь фильтруют через Celite и добавляют воду и этиловый эфир. Продукт экстрагируют этиловым эфиром, органическую фазу промывают водой до нейтрального рН, сушат над сульфатом магния и фильтруют, а растворители выпаривают. 6,82 г (98%) ожидаемого соединения собирают в виде белых кристаллов с температурой плавления 80-82oС.
1H ЯМР (CDCl3) δ 1.36 (с, 6Н), 1.45 (с, 6Н), 1.61 (т, 1Н, J= 5.8 Гц), 1.71 (с, 4Н), 4.95 (д, 2Н, J= 5.7 Гц), 7.30-7.36 (м, 1Н), 7.43 (т, 2Н, J= 7.7 Гц), 7.53 (д, 1Н, J= 2.1 Гц), 7.58-7.61 (м, 3Н).
(f) 5,5,8,8-тетраметил-3-фенил-5,6,7,8-тетрагидронафталин-1-карбальдегид
6,56 г (22,2 ммолей) соединения, полученного в Примере 7(е), 38,73 г (445,6 ммолей) окиси марганца и 500 мл дихлорметана смешивают в однолитровой круглодонной колбе. Реакционную смесь перемешивают в течение двадцати часов при комнатной температуре и затем отфильтровывают окись марганца и промывают дихлорметаном. После выпаривания растворителей собирают 4,44 г (68%) ожидаемого соединения в виде желтого порошка с температурой плавления 113oС.
1H ЯМР (CDCl3) δ 1.37 (с, 6Н), 1.57 (с, 6Н), 1.75 (с, 4Н), 7.33-7.48 (м, 3Н), 7.58-7.62 (м, 2Н), 7.77 (д, 1Н, J= 2.2 Гц), 7.95 (д, 1Н, J= 2.2 Гц).
(g) 1-(5,5,8,8-тетраметил-3-фенил-5,6,7,8-тетрагидронафт-1-ил)-3-(триметилсиланил)проп-2-ин-1-ол
2,43 мл (17,2 ммолей) триметилсилилацетилена и 25 мл ТГФ вводят в трехгорлую колбу. Добавляют по каплям раствор, состоящий из 6,89 мл (17,2 ммолей) н-бутиллития (2,5 М в гексане), при -78oС в атмосфере азота и реакционной смеси позволяют вернуться до комнатной температуры. Этот раствор вводят по каплям в холодный (-78oС) раствор, состоящий из 4,20 г (14,4 ммолей) соединения, полученного в Примере 7(f), и 25 мл ТГФ. Реакционной смеси позволяют вернуться до комнатной температуры, выливают в водный раствор хлористого аммония и экстрагируют этиловым эфиром и органическую фазу отделяют путем отстаивания, сушат над сульфатом магния и выпаривают. Собирают 5,60 г (100%) ожидаемого соединения в виде белого порошка с температурой плавления 145oС.
1H ЯМР (CDCl3) δ 1.34 (с, 3Н), 1.36 (с, 3Н), 1.48 (с, 3Н), 1.51 (с, 3Н), 1.66-1.76 (с, 4Н), 2.19 (бр с, 1Н), 6.13 (с, 1Н), 7.30-7.36 (м, 1Н), 7.41-7.47 (м, 2Н), 7.55 (д, 1Н, J= 2.0 Гц), 7.60 (д, 2Н, J= 7.1 Гц), 7.90 (д, 1Н, J= 2.1 Гц).
(h) 1-(5,5,8,8-тетраметил-3-фенил-5,6,7,8-тетрагидронафт-1-ил)проп-2-ин-1-ол
5,60 г (14,3 ммолей) соединения, полученного в Примере 7(g), смешивают с 30 мл ТГФ в трехгорлой колбе объемом 500 мл и добавляют по каплям 15,8 мл (17,4 ммолей) раствора тетрабутиламмоний фторида (1,1 М в ТГФ). Реакционную смесь перемешивают при комнатной температуре в течение одного часа, выливают в воду и экстрагируют этиловым эфиром и органическую фазу отделяют отстаиванием, сушат над сульфатом магния и выпаривают. Собирают 4,07 г (89%) ожидаемого соединения в виде желтого масла.
1Н ЯМР (CDCl3) δ 1.34 (с, 3Н), 1.35 (с, 3Н), 1.48 (с, 3Н), 1.52 (с, 3Н), 1.66-1.75 (м, 4Н), 2.30 (бр с, 1Н), 2.59 (д, 1Н, J= 2.1 Гц), 6.16 (д, 1Н, J= 2.0 Гц), 7.31-7.37 (м, 1Н), 7.41-7.47 (м, 2Н), 7.55 (д, 1Н, J= 2.1 Гц), 7.60 (д, 2Н, J= 7.1 Гц), 7.88 (д, 1Н, J= 2.1 Гц).
(i) этил 4-[3-гидрокси-3-(5,5,8,8-тетраметил-3-фенил-5,6,7,8-тетрагидронафт-1-ил)проп-1-инил] бензоат
Способом, аналогичным Примеру 3 (с), реакцией 4,07 г (12,8 ммолей) соединения, полученного в Примере 7(h), с 3,53 г (12,8 ммолями) этил 4-иодобензоата получают 4,57 г (77%) этил 4-[3-гидрокси-3-(5,5,8,8-тетраметил-3-фенил-5,6,7,8-тетрагидронафт-1-ил-проп-1-инил] бензоата в виде оранжевого порошка с температурой плавления 121oС.
1H ЯМР (CDCl3) δ 1.35 (с, 3Н), 1.35 (т, 3Н, J= 7.1 Гц), 1.37 (с, 3Н), 1.53 (с, 3Н), 1.56 (с, 3Н), 1.67-1.80 (м, 4Н), 2.45 (д, 1Н, J= 4.9 Гц), 4.35 (г, 2Н, J= 7.1 Гц), 6.40 (д, 1Н, J= 4.9 Гц), 7.30-7.36 (м, 1Н), 7.41-7.49 (м, 4Н), 7.57 (д, 1Н, J= 2.0 Гц), 7.61 (д, 2Н, J= 7.1 Гц), 7.95 (д, 1Н, J= 2.0 Гц), 7.96 (д, 2Н, J= 6.0 Гц).
ПРИМЕР 8
4-[3-Гидрокси-3-(5,5,8,8-тетраметил-3-фенил-5,6,7,8-тетрагидронафт-1-ил)проп-1-инил] бензойная кислота
Способом, аналогичным Примеру 2, из 3,60 г (7,7 ммолей) соединения, полученного в Примере 7(i), получают 3,32 г (98%) 4-[3-гидрокси-3-(5,5,8,8-тетраметил-3-фенил-5,6,7,8-тетрагидронафт-1)ил)проп-1-инил] бензойной кислоты в виде оранжево-бежевого порошка с температурой плавления 250oС.
1H ЯМР (d6-ДМСО) δ 1.12 (с, 3Н), 1.13 (с, 3Н), 1.26 (с, 3Н), 1.27 (с, 3Н), 1.43-1.55 (м, 4Н), 5.97 (бр с, 1Н), 7.13-7.19 (с, 1Н), 7.25-7.33 (с, 4Н), 7.36 (д, 1Н, J= 1.9 Гц), 7.45 (д, 2Н, J= 7.3 Гц), 7.68 (д, 1Н, J= 2.0 Гц), 7.70 (д, 2Н, J= 8.4 Гц), 12.92 (бр с, 1Н),
ПРИМЕР 9
4-[3-(5,5,8,8-Тетраметил-3-фенил-5,6,7,8-тетрагидронафт-1-ил)проп-1-инил] бензойная кислота
2,00 г (4,6 ммолей) соединения, полученного в Примере 8, 1,45 мл (9,1 ммолей) триэтилсилана, 30 мл дихлорметана и 3,5 мл трифторуксусной кислоты вводят в однолитровую круглодонную колбу в атмосфере азота. Реакционную смесь перемешивают в течение двух часов при комнатной температуре и гидролизуют, используя раствор 1N HCl, и продукт экстрагируют этиловым эфиром. Органическую фазу промывают водой и сушат над сульфатом магния и растворитель выпаривают досуха. Полученный остаток чистят с помощью хроматографии на колонке с силикагелем, элюированием смесью, состоящей из 50% этилацетата и 50% гептана. После выпаривания растворителей собирают 370 мг (19%) 4-[3-(5,5,8,8-тетраметил-3-фенил-5,6,7,8-тетрагидронафт-1-ил)проп-1-инил] бензойной кислоты в виде белого порошка с температурой плавления 228oС.
1H ЯМР (d6-ДМСО) δ 1.22 (с, 6Н), 1.35 (с, 6Н), 4.00 (с, 2Н), 7.24-7.27 (м, 2Н), 7.33-7.41 (м, 4Н), 7.46 (с, 1Н), 7.53 (д, 2Н, J= 7.3 Гц), 7.78 (д, 2Н, J= 8.2 Гц).
ПРИМЕР 10
Этил 4-[3-(4,4-диметилтиохроман-5-ил)-3-гидроксипроп-1-инил] бензоат
(а) 1 -метокси-3-(3-метилбут-2-енилсульфанил)бензол
50,45 г (360,0 ммолей) 3-метокситиофенола, 360 мл ацетона и 14,40 г (360,0 ммолей) таблеток гидроокиси натрия вводят в однолитровую круглодонную колбу в атмосфере азота и смесь кипятят с обратным холодильником в течение трех часов. Добавляют по каплям раствор, состоящий из 53,65 г (360,0 ммолей) 2-метил-4-бром-2-бутена и 60 мл ацетона. Рефлюкс поддерживают в течение шестнадцати часов и реакционную смесь выпаривают досуха. Добавляют воду, экстракцию проводят этилацетатом, органическую фазу промывают водой и затем насыщенным раствором хлористого натрия, сушат над сульфатом магния и фильтруют, а растворители выпаривают. Полученный остаток перегоняют при пониженном давлении (5•10-2 бар/113oС) с получением 67,81 г (90%) ожидаемого соединения в виде бледно-желтого масла.
1Н ЯМР (CDCl3) δ 1.62 (с, 3Н), 1.72 (с, 3Н), 3.55 (д, 2Н, J= 7.7 Гц), 3.79 (с, 3Н), 5.31 (тт, 1Н, J= 7.7/1.3 Гц), 6.71 (дт, 1Н, J= 8.3/1.8 Гц), 6.87-6.92 (м, 2Н), 7.18 (т, 1Н, J= 7.9 Гц).
(b) 5-метокси-4,4-диметилтиохроман
62,00 г (298,0 ммолей) соединения, полученного в Примере 10(а), 85,00 г (446,0 ммолей) пара-толуолсульфоновой кислоты и 500 мл толуола вводят в круглодонную колбу. Смесь нагревают при кипячении с обратным холодильником в течение двух часов, охлаждают, затем добавляют воду и этилацетат и экстракцию проводят этилацетатом. Органическую фазу отделяют отстаиванием, промывают водой и затем насыщенным раствором хлористого натрия, сушат над сульфатом магния и растворители выпаривают. Получают 65,19 г желтого масла, которое перегоняют при пониженном давлении (5•10-2 бар/120-122oС) с получением 17,40 г (28%) ожидаемого соединения в виде бесцветного масла.
1H ЯМР (CDCl3) δ 1.41 (с, 3Н), 2.00-2.05 (м, 2Н), 2.86-2.90 (м, 2Н), 3.80 (с, 3Н), 6.58 (д, 1Н, J= 18.1 Гц), 6.72 (дд, 1Н, J= 7.9/1.2 Гц), 6.98 (т, 1Н, J= 8.0 Гц).
(c) 4,4-диметилтиохроман-5-ол
17,40 г (83,5 ммолей) соединения, полученного в Примере 10(b), 28,10 г (333,0 ммолей) этантиолата натрия и 100 мл ДМФА вводят в круглодонную колбу. Смесь нагревают при температуре 150oС в течение двух часов и затем перемешивают в течение шестнадцати часов при комнатной температуре, выливают в смесь 1N HCl/этилового эфира и экстрагируют этиловым эфиром. Органическую фазу отделяют отстаиванием, сушат над сульфатом магния и выпаривают. Полученный остаток чистят с помощью хроматографии на колонке с силикагелем элюированием смесью, состоящей из 20% этилацетата и 80% гептана. Собирают 14,07 г (87%) ожидаемого соединения в виде светло-желтого твердого вещества с температурой плавления 48oС.
1H ЯМР (CDCl3) δ 1.45 (с, 3Н), 2.01-2.07 (м, 2Н), 2.86-2.91 (м, 2Н), 5.00 (с, 1Н), 6.34 (дд, 1Н, J= 7.8/1.3 Гц), 6.69 (дд, 1Н, J= 7.9/1.2 Гц), 6.84 (д, 1Н, J= 7.8 Гц).
(d) 4,4-диметилтиохроман-5-ил трифторметансульфонат
13,63 г (70,1 ммолей) 4,4-диметилтиохроман-5-ола, полученного в Примере 10(с), 11,14 г (91,2 ммолей) N, N-диметиламинопиридина и 100 мл дихлорметана вводят в круглодонную колбу объемом 500 мл в атмосфере азота. Смесь охлаждают до 0oС и добавляют по каплям 14,16 мл (84,2 ммолей) трифликового ангидрида. Реакционную смесь перемешивают в течение 30 минут при комнатной температуре и затем добавляют раствор 1N НСl и дихлорметана. Продукт экстрагируют дихлорметаном и органическую фазу промывают водой до нейтрального рН, сушат над сульфатом магния и фильтруют. Полученный остаток чистят с помощью хроматографии на колонке с силикагелем элюированием смесью, состоящей из 90% гептана и 10% этилацетата. После выпаривания растворителей собирают 16,32 г (71%) ожидаемого соединения в виде желтого масла.
1H ЯМР (CDCl3) δ 1.46 (с, 3Н), 2.01-2.06 (м, 2Н), 2.93-2.98 (м, 2Н), 7,00-7.12 (м, 3Н).
(e) метил 4,4-диметилтиохроман-5-карбоксилат
Способом, аналогичным Примеру 7(d), из 14,23 г (43,6 ммолей) соединения, полученного в Примере 10(d), получают 8,81 г (85%) ожидаемого соединения в виде желтого масла.
1H ЯМР (CDCl3) δ 1.39 (с, 3Н), 1.91 (т, 2Н, J= 6.1 Гц), 3.05 (т, 2Н, J= 6.1 Гц), 3.89 (с, 3Н), 6.96 (дд, 1Н, J= 7.4/1.8 Гц), 7.03 (т, 1Н, J= 7.4 Гц), 7.16 (дд, 1H, J= 7.5/1.8 Гц).
(f) 4,4-диметилтиохроман-5-метанол
8,81 г (3,3 ммолей) эфира, полученного в Примере 10(е), и 300 мл толуола смешивают в круглодонной колбе объемом 500 мл. После охлаждения до -78oС приливают по каплям раствор диизобутилалюминий гидрида (1М в толуоле), одновременно поддерживая эту же температуру -78oС. Реакционную смесь перемешивают в течение одного часа при этой температуре, затем добавляют водную пасту сульфата магния, смесь перемешивают и экстрагируют этиловым эфиром. Органическую фазу сушат над сульфатом магния и фильтруют, и растворители выпаривают. Полученный остаток чистят с помощью хроматографии на колонке с силикагелем элюированием смесью, состоящей из 70% гептана и 30% этилацетата. После выпаривания растворителей собирают 4,37 г (56%) ожидаемого соединения в виде светло-желтого порошка с температурой плавления 53oС.
1H ЯМР (CDCl3) δ 1.45 (с, 6Н), 2.04 (т, 2Н, J= 6.4 Гц), 2.95 (т, 2Н, J= 6.4 Гц), 4.87 (д, 2Н, J= 5.8 Гц), 7.01-7.08 (м, 2Н), 7.17-7.22 (м, 1Н).
(g) 4,4-диметилтиохроман-5-карбальдегид
4,37 г (21,0 ммолей) спирта, полученного в Примере 10(f), 36,47 г (419,5 ммолей) окиси марганца и 300 мл дихлорметана смешивают в круглодонной колбе объемом 500 мл. Реакционную смесь перемешивают в течение двадцати часов при комнатной температуре, затем отфильтровывают окись марганца через Celite и дихлорметан выпаривают. После выпаривания растворителей собирают 3,25 г (75%) ожидаемого соединения в виде желтого масла.
1H ЯМР (CDCl3) δ 1.54 (с, 6Н), 2.03 (т, 2Н, J= 5.9 Гц), 3.01 (т, 2Н, J= 6.0 Гц), 7.15 (д. 1Н, J= 7.6 Гц), 7.25-7.29 (м, 1Н), 7.49 (дд, 1Н), J= 7.4/1.4 Гц, 10,73 (с, 1Н).
(h) 1-(4,4-диметилтиохроман-5-ил)-3-(триметилсиланил)проп-2-ин-1 -ол
Способом, аналогичным Примеру 7(g), из 3,25 г (15,7 ммолей) соединения, полученного в Примере 10(g), получают 4,79 г (100%) 1-(4,4-диметилтиохроман-5-ил)-3-(триметилсиланил)проп-2-ин-1-ола в виде желтого масла.
1H ЯМР (CDCl3) δ 0.16 (с, 9Н), 1.48 (с, 3Н), 1.50 (с, 3Н), 2.04-2.09 (м, 2Н), 2.14 (д, 1Н, J= 5.2 Гц), 2.87-2.93 (м, 2Н), 6.04 (д, 1Н, J= 5.1 Гц), 7.05-7.13 (м, 2Н), 7.50-7.54 (г, 1Н, J= 3.1 Гц).
(i) 1-(4,4-диметилтиохроман-5-ил)проп-2-ин-1-ол
Способом, аналогичным Примеру 7(h), из 4,79 г (15,7 ммолей) соединения, полученного в Примере 10(h), получают 3,34 г (89%) 1-(4,4-диметилтиохроман-5-ил)проп-2-ин-1-ола в виде бежевых кристаллов с температурой плавления 88oС.
1H ЯМР (CDCl3) δ 1.49 (с, 3Н), 1.51 (с, 3Н), 2.04-2.10 (м, 2Н), 2.26 (д, 1Н, J= 5.1 Гц), 2.59 (д, 1Н, J= 2.2 Гц), 2.88-2.94 (м, 2Н), 6.07 (бр с, 1Н), 7.07-7.14 (м, 2Н), 7.52-7.55 (г, 1Н, J= 3.0 Гц).
(j) этил 4-[3-(4,4-диметилтиохроман-5-ил)-3-гидроксипроп-1-инил] бензоат
Способом, аналогичным Примеру 3(с), реакцией 3,34 г (14,4 ммолей) соединения, полученного в Примере 10(i), с 3,97 г (14,4 ммолями) этил 4-иодобензоата получают 4,66 г (85%) этил 4-[3-(4,4-диметилтиохроман-5-ил)-3-гидроксипроп-1-инил] бензоата в виде оранжевого порошка с температурой плавления 108oС.
1H ЯМР (CDCl3) δ 1.39 (т, 3Н, J= 7.1 Гц), 1.54 (с, 3Н), 1.56 (с, 3Н), 2.08-2.13 (м, 2Н), 2.28 (д, 1Н, J= 5.3 Гц), 2.90-2.96 (м, 2Н), 4.37 (г, 2Н, J= 7.1 Гц), 6.31 (д, 1H, J = 5.3 Гц), 7.09-7.17 (м, 2Н), 7.48 (д, 2Н, J= 8.3 Гц), 7.60 (дд, 1Н, J= 6.4/2.8 Гц), 7.98 (д, 2Н, J= 8.4 Гц).
ПРИМЕР 11
4-[3-(4,4-Диметилтиохроман-5-ил)-3-гидроксипроп-1-инил] бензойная кислота
Способом, аналогичным Примеру 2, из 4,66 г (12,3 ммолей) соединения, полученного в Примере 10(j), получают 3,41 г (78%) 4-[3-(4,4-диметилтиохроман-5-ил)-3-гидроксипроп-1-инил] бензойной кислоты в виде коричневого твердого вещества с температурой плавления 198oС.
1H ЯМР (CDCl3) δ 1.54 (с, 3Н), 1.56 (с, 3Н), 2.08-2.12 (м, 2Н), 2.90-2.94 (м, 2Н), 6.29 (с, 1Н), 7.10-7,16 (м, 2Н), 7.48 (д, 2Н, J= 8.2 Гц), 7.61 (дд, 1Н, J= 6.7/2.3 Гц), 7.99 (д, 2Н, J= 8.3 Гц).
ПРИМЕР 12
4-[3-(4,4-Диметилтиохроман-5-ил)проп-1-инил] бензойная кислота
Способом, аналогичным Примеру 9, из 2,06 г (5,82 ммолей) соединения, полученного в Примере 11, получают 1,00 г (51%) 4-[3-(4,4-диметилтиохроман-5-ил)проп-1-инил] бензойной кислоты в виде бежевых кристаллов с температурой плавления 207oС.
1H ЯМР (d6-ДМСО) δ 1.51 (с, 6Н), 2.05-2.10 (м, 2Н), 2.92-2.97 (м, 2Н), 4.01 (с, 2Н), 7.01-7.03 (м, 2Н), 7.25-7.31 (м, 1Н), 7.45 (д, 2Н, J= 8.3 Гц), 7.97 (д, 2Н, J= 8.3 Гц).
ПРИМЕР 13
Этил 4-[3-(3,5-ди-трет-бутил-2-(метоксиметокси)-фенил)-3-гидроксипроп-1-инил] бензоат
(а) 1-бром-3,5-ди-трет-бутил-2-(метоксиметокси)-бензол
40,00 г (140,2 ммолей) 2,4-ди-трет-бутил-6-бромфенола и 400 мл ДМФА вводят в однолитровую трехгорлую колбу. Полученный раствор охлаждают до 5-10oС, добавляют 4,70 г гидрида натрия и смесь перемешивают при 10oС в течение 30 минут. Затем по каплям добавляют 11,7 мл (154,0 ммолей) хлорметильного метилового эфира и реакционную смесь перемешивают в течение 1 часа при комнатной температуре. Реакционную смесь выливают в смесь 1 N HCl/этилового эфир и экстрагируют этиловым эфиром и органическую фазу отделяют отстаиванием, сушат над сульфатом магния и выпаривают. Собирают 46,00 г (100%) ожидаемого соединения в виде оранжевого масла.
1H ЯМР (CDCl3) δ 1.28 (с, 9Н), 1.43 (с, 9Н), 3.69 (с, 3Н), 5.21 (с, 2Н), 7.30 (д, 1Н, J= 2.4 Гц), 7.39 (д, 1Н, J= 2.4 Гц).
(b) 3,5-ди-трет-бутил-2-(метоксиметокси)бензальдегид
46,00 г (140,0 ммолей) соединения, полученного в Примере 13(а), и 500 мл ТГФ вводят в трехгорлую колбу в атмосфере азота. Добавляют по каплям 61,5 мл (154,00 ммолей) раствора н-бутиллития (2,5 М в гексане) при -78oС и смесь перемешивают в течение 30 минут при этой же температуре. Затем добавляют по каплям 13 мл (168,0 ммолей) ДМФА и смеси позволяют вернуться до комнатной температуре. Реакционную смесь подкисляют соляной кислотой (1N) и экстрагируют этиловым эфиром и органическую фазу отделяют отстаиванием, сушат над сульфатом магния и выпаривают. Собирают 46,00 г (100%) ожидаемого соединения в виде оранжевого масла.
1H ЯМР (CDCl3) δ 1.32 (с, 9Н), 1.44 (с, 9Н), 3.64 (с, 3Н), 5.02 (с, 2Н), 7.64 (д, 1Н, J= 2.6 Гц), 7.72 (д, 1Н, J= 2.6 Гц), 10.22 (с, 1Н).
(c) 1-(3,5-ди-трет-бутил-2-(метоксиметокси)фенил)-3-(триметилсиланил)проп-2-ин-1-ол
18,60 г (190,0 ммолей) триметилсилилацетилена и 190 мл ТГФ вводят в трехгорлую колбу в атмосфере азота и полученный таким образом раствор охлаждают до -78oС. Добавляют по каплям 76,0 мл (190,0 ммолей) раствора н-бутиллития (2,5 М в гексане) при -70oС, реакционную смесь перемешивают в течение 30 минут при этой же температуре и смесь доводят до температуры -20oС. Этот раствор выливают по каплям в холодный (-70oС) раствор, состоящий из 44,00 г (158,0 ммолей) соединения, полученного в Примере 13(b), в растворе 550 мл безводного ТГФ. Температуру реакционной смеси доводят до комнатной температуры в течение двух часов, реакционную смесь затем подкисляют соляной кислотой (1N) и экстрагируют этиловым эфиром и органическую фазу отделяют отстаиванием, сушат над сульфатом магния и выпаривают. Собирают 59,00 г (100%) ожидаемого соединения в виде оранжевого масла.
1H ЯМР (CDCl3) δ 1.12 (с, 9Н), 1.18 (с, 9Н), 3.49 (с, 3Н), 3.81 (д, 1Н, J= 5.4 Гц), 4.68 (д, 1Н, J= 6.3 Гц), 4.88 (д, 1H, J= 6.3 Гц), 5.55 (д, 1Н. J= 5,3 Гц), 7.16 (д, 1Н, J= 2.5 Гц), 7.56 (д, 1Н, J= 2.5 Гц).
(d) 1-(3,5-ди-трет-бутил-2-(метоксиметокси)фенил)проп-2-ин-1-ол
58,00 г (154,0 ммолей) соединения, полученного в Примере 13(с), и 300 мл ТГФ вводят в трехгорлую колбу в атмосфере азота и приливают по каплям раствор тетрабутиламмоний фторида (1М в ТГФ). Реакционную смесь перемешивают в течение двух часов при комнатной температуре, затем подкисляют соляной кислотой (1N) и экстрагируют этиловым эфиром и органическую фазу отделяют отстаиванием, сушат над сульфатом магния и выпаривают. Собирают 6 [лакуна] г (13%) ожидаемого соединения в виде оранжевого масла и собирают 12.00 г (30%) 1-(3,5-ди-трет-бутил-2-гидроксифенил)проп-2-ин-1-ола в виде оранжевого масла.
1H ЯМР ожидаемого соединения (CDCl3) δ 1.32 (с, 9Н), 1.39 (с, 9Н), 2.61 (д, 1Н, J= 2.2 Гц), 3.70 (с, 3Н), 3.90 (д, 1Н, J= 5.5 Гц), 4.90 (д, 1Н, J= 6.3 Гц), 5.08 (д, 1Н, J= 6.2 Гц), 5.79 (дд, 1Н, J= 5.4/2.3 Гц), 7.37 (д, 1Н, J= 2.5 Гц), 7.70 (д, 1H, J= 2.5 Гц).
1H ЯМР 1-(3,5-ди-трет-бутил-2-гидроксифенил)проп-2-ин-1-ола (CDCl3) δ 1.30 (с, 9Н), 1.43 (с, 9Н), 2.72 (бр с, 1Н), 2.80 (д, 1Н, J= 2.3 Гц), 4.94 - 5.05 (м, 1Н), 5.66 (бр с, 1Н), 7.27 (д, 1Н, J= 2.3 Гц), 7.32 (д, 1Н, J= 2.4 Гц).
(e) этил 4-[3-(3,5-ди-трет-бутил-2-(метоксиметокси)-фенил)-3-гидроксипроп-1-инил] бензоат
6,00 г (19,7 ммолей) соединения, полученного в Примере 13 (d), 5,40 г (19,7 ммолей) этил 4-иодобензоата и 40 мл триэтиламина последовательно вводят в круглодонную колбу. Реакционную смесь дегазируют азотом в течение 20 минут и затем добавляют 375 мг Cul и 700 мг бис(трифенилфосфин)палладий (II) хлорида. Реакционную смесь перемешивают при комнатной температуре в течение пяти часов, выливают в воду, подкисляют 1N соляной кислотой и экстрагируют этиловым эфиром и органическую фазу отделяют отстаиванием, сушат над сульфатом магния и выпаривают. Полученный остаток чистят с помощью хроматографии на колонке с силикагелем, элюированием смесью, состоящей из 10% этилацетата и 90% гептана. После выпаривания растворителей собирают 6,00 г (69%) этил 4-[3-(3,5-ди-трет-бутил-2-(метоксиметокси)-фенил)-3-гидроксипроп-1-инил] бензоата в виде оранжевого порошка с температурой плавления 89-91oС.
1h ЯМР (CDCl3) δ 1.34 (с, 9Н), 1.39 (т, 3Н, J= 7.1 Гц), 1.41 (с, 9Н), 3.73 (с, 3Н), 4.09 (д, 1Н, J= 5.5 Гц), 4.37 (д, 2Н, J= 7.1 Гц), 4.93 (д, 1Н, J= 6.3 Гц), 5.12 (д, 1Н, J= 6.3 Гц), 6.00 (д, 1Н, J= 5.5 Гц), 7.40 (д, 1Н, J= 2.5. Гц), 7.53 (д, 2Н, J= 8.4 Гц), 7,79 (д, 1Н, J= 2.5. Гц), 7.99 (д, 2Н, J= 8.4 Гц).
ПРИМЕР 14
4-[3-(3,5-Ди-трет-бутил-2-(метоксиметокси)фенил)-3-гидроксипроп-1-инил] бензойная кислота
Способом, аналогичным Примеру 2, из 1,50 г (3,3 ммолей) соединения, полученного в Примере 13(е), получают 1,20 г (85%) 4-[3-(3,5-ди-трет-бутил-2-(метоксиметокси)фенил)-3-гидроксипроп-1-инил] бензойной кислоты в виде бежевого порошка с температурой плавления 197oС.
1H ЯМР (CDCl3) δ 1.33 (с, 9Н), 1.41 (с, 9Н), 3.73 (с, 3Н), 4.35 (бр с, 1Н), 4.97 (д, 1Н, J= 6.1 Гц), 5.12 (д, 1Н, J= 6.1 Гц), 6.00 (с, 1Н), 7.38 (д, 1Н, J= 2.5 Гц), 7.51 (д, 2Н, J= 8.4 Гц), 7.78 (д, 1Н, J= 2.5 Гц), 8.00 (д, 2Н, J= 8.4 Гц).
ПРИМЕР 15
Этил 4-[3-(3,5-ди-трет-бутил-2-гидроксифенил)-3-гидроксипроп-1-инил] бензоат
Способом, аналогичным Примеру 13(е), реакцией 10,00 г (38,4 ммолей) 1-(3,5-ди-трет-бутил-2-гидроксифенил)проп-2-ин-1-ола, полученного в Примере 13(d), с 10,60 г (38,4 ммолями) этил 4-иодобензоата, получают 5,00 г (32%) этил 4-[3-(3,5-ди-трет-бутил-2-гидроксифенил)-3-гидроксипроп-1-инил] бензоата в виде не совсем белого твердого вещества с температурой плавления 142-144oС.
1H ЯМР (CDCl3) δ 1.31 (с, 9Н), 1.39 (т, 3Н, J= 7.1 Гц), 1.44 (с, 9Н), 2.80 (д, 1Н, J= 6.2 Гц), 4.37 (г, 2Н, J= 7.1 Гц), 5.90 (д, 1Н, J= 6.2 Гц), 7.34 (с, 2Н), 7.37 (с, 1Н), 7.53 (д, 2Н, J= 8.4 Гц), 8.02 (д, 2Н, J= 8.4 Гц).
ПРИМЕР 16
Этил 4-[3-(3,5-ди-трет-бутил-2-гидроксифенил)проп-1-инил] бензоат
Способом, аналогичным Примеру 9, из 3.00 г (7,3 ммолей) соединения, полученного в Примере 15, получают 1,30 г (45%) этил 4-[3-(3,5-ди-трет-бутил-2-гидроксифенил)проп-1-инил] бензоата в виде белого порошка с температурой плавления 113-115oС.
1H ЯМР (CDCl3) δ 1.31 (с, 9Н), 1.39 (т, 3Н, J= 7.1 Гц), 1.44 (с, 9Н), 3.80 (с, 2Н), 4.37 (г, 2Н, J= 7.1 Гц), 6.77 (бр с. 1Н), 7.13 (д, 1Н, J= 2.3 Гц), 7.27 (д, 1Н, J= 2.3 Гц), 7.48 (д, 2Н, J= 8.3 Гц), 7.98 (д, 2Н, J = 8.4 Гц).
ПРИМЕР 17
Этил 4-[3-(3,5-ди-трет-бутил-2-метоксифенил)-3-гидроксипроп-1-инил] бензоат
(a) 1-бром-3,5-ди-трет-бутил-2-метоксибензол
Способом, аналогичным Примеру 13(а), из 25,00 г (87,6 ммолей) 2,4-ди-трет-бутил-6-бромфенола и из 13.70 г (96,4 ммолей) метилиодида получают 27,00 г (100%) 1-бром-3,5-ди-трет-бутил-2-метоксибензола в виде оранжевого масла.
1H ЯМР (CDCl3) δ 1.29 (с, 9Н), 1.39 (с, 9Н), 3.91 (с, 3Н), 7.27 (д, 1Н, J= 2.4 Гц), 7.40 (д, 1H, J= 2.4 Гц).
(b) 3,5-ди-трет-бутил-2-метоксибензальдегид
Способом, аналогичным Примеру 13(b), из 25,00 г (83,5 ммолей) соединения, полученного в Примере 17(а), получают 21,00 г (100%) ожидаемого соединения в виде оранжевого масла.
1H ЯМР (CDCl3) δ 1.32 (с, 9Н), 1.43 (с, 9Н), 3.93 (с, 3Н), 7,61 (д, 1Н, J= 2.6 Гц), 7.71 (д, 1Н, J= 2.5 Гц), 10.34 (с, 1Н).
(c) 1-(3,5-ди-трет-бутил-2-метоксифенил)-3-(триметилсиланил)проп-2-ин-1-ол
Способом, аналогичным Примеру 13(с), из 21,00 г (85,0 ммолей) соединения, полученного в Примере 17(b), получают 30,00 г (100%) ожидаемого соединения в виде бежевого порошка с температурой плавления 104-106oС.
1H ЯМР (CDCl3) δ 1.13 (с, 9Н), 1.20 (с, 9Н), 2.39 (д, 1Н, J= 4.7 Гц), 3.69 (с, 3Н), 5.59 (д, 1Н, J= 4.0 Гц), 7.15 (д, 1Н, J= 2.5 Гц), 7.43 (д, 1Н, J= 2.5 Гц).
(d) 1-(3,5-ди-трет-бутил-2-метоксифенил)проп-2-ин-1-ол
Способом, аналогичным Примеру 13(d), из 23,00 г (66,0 ммолей) соединения, полученного в Примере 17(с), получают 25,00 г (100%) ожидаемого соединения в виде оранжевого масла.
1H ЯМР (CDCl3) δ 1.32 (с, 9Н), 1.40 (с, 9Н), 2.63 (д, 1Н, J= 2,2 Гц), 3.88 (с, 3Н), 5.81 (д, 1Н, J= 2.2 Гц), 7.35 (д, 1Н, J= 2.5 Гц), 7.58 (д, 1Н, J= 2.5 Гц).
(e) этил 4-[3-(3,5-ди-трет-бутил-2-метоксифенил)-3-гидроксипроп-1-инил] бензоат
Способом, аналогичным Примеру 13(е), реакцией 23,30 г (85,0 ммолей) соединения, полученного в Примере 17(d), с 23,50 г (85,0 ммолями) этил 4-иодбензоата получают 20,00 г (55%) этил 4-[3-(3,5-ди-трет-бутил-2-метоксифенил)-3-гидроксипроп-1-инил] бензоата в виде серого порошка с температурой плавления 101-103oС.
1H ЯМР (CDCl3) δ 1.34 (с, 9Н), 1.39 (т, 3Н, J= 5.2 Гц), 1.42 (с, 9Н), 2.74 (д, 1Н, J= 5.4 Гц), 3.93 (с, 3Н), 4.37 (г, 2Н, J= 7.1 Гц), 6.04 (д, 1Н, J= 5.4 Гц), 7.37 (д, 1Н, J= 2.5 Гц), 7.50 (д, 2Н, J= 8.4 Гц), 7.65 (д, 1Н, J= 2.5 Гц), 7.99 (д, 2Н, J = 8.4 Гц).
ПРИМЕР 18
4-[3-(3,5-Ди-трет-бутил-2-метоксифенил)-3-гидроксипроп-1-инил] бензойная кислота
Способом, аналогичным Примеру 2, из 5,00 г (11,8 ммолей) соединения, полученного в Примере 17(е), получают 4,50 г (96%) 4-[3-(3,5-ди-трет-бутил-2-метоксифенил)-3-гидроксипроп-1-инил] бензойной кислоты в виде светло-желтого твердого вещества с температурой плавления 208-209oС.
1H ЯМР (CDCl3) δ 1.29 (с, 9Н), 1.37 (с, 9Н), 3.83 (с, 3Н), 5.80 (д, 1Н, J= 5.0 Гц), 6.19 (д, 1Н, J= 5,6 Гц), 7.27 (д, 1Н, J= 2.5 Гц), 7.53 (д, 2Н, J= 8.3 Гц), 7.62 (д, 1Н, J= 2.4 Гц), 7.93 (д, 2Н, J= 8.3 Гц), 13.14 (бр с, 1Н).
ПРИМЕР 19
4-[3-(3,5-Ди-трет-бутил-2-метоксифенил)проп-1-инил] бензойная кислота
Способом, аналогичным Примеру 9, из 1,50 г (3,8 ммолей) соединения, полученного в Примере 18, получают 1,40 г (97%) 4-[3-(3,5-ди-трет-бутил-2-метоксифенил)проп-1-инил] бензойной кислоты в виде белого порошка с температурой плавления 237-239oС.
1H ЯМР (CDCl3) δ 1.33 (с, 9Н), 1.41 (с, 9Н), 3.83 (с, 3Н), 3.87 (с, 2Н), 7.27 (д, 1Н, J= 2.2 Гц), 7.46 (д, 1Н, J= 2.2. Гц), 7.47 (Д, 2Н, J= 8.2 Гц), 7,99 (д, 2Н, J= 8.2 Гц).
ПРИМЕР 20
Этил 4-[3-(5-трет-бутил-4-(метоксиметокси)бифенил-3-ил)-3-гидроксипроп-1-инил] бензоат
(a) 2-трет-бутил-4-бромфенол
80,00 г (426,0 ммолей) 4-бромфенола и 8,00 г Dowex 50WX8 смолы сульфоновой кислоты смешивают в трехгорлой колбе объемом 250 мл. Смесь нагревают до 80oС и пропускают через нее поток изобутилена в течение 30 часов. Реакционную смесь охлаждают и остаток очищают путем пропускания через колонку с силикагелем, которую элюируют смесью, состоящей из 95% дихлорметана и 5% гептана. Собирают 88 г (90%) ожидаемого соединения в виде желтого масла.
1H ЯМР (CDCl3) δ 1.38 (с, 9Н), 4.79 (с, 1Н), 6.55 (д, 1Н, J= 8.4 Гц), 7.16 (дд, 1Н, J= 8.4/2.4 Гц), 7.35 (д, 1Н, J= 2.4 Гц).
(b) 3-(трет-бутил)бифенил-4-ол
Способом, аналогичным Примеру 7(b), реакцией 40,00 г (175,0 ммолей) соединения, полученного в Примере 20(а), с 34,60 г (283,0 ммолями) фенилборной кислоты получают 27,00 г (68%) ожидаемого соединения в виде коричневого масла.
1H ЯМР (CDCl3) δ 1.46 (С, 9Н), 4.99 (с, 1Н), 6.74 (д, 1Н, J= 8.1 Гц), 7.28 (д, 1Н, J= 2.3 Гц), 7.31 (д, 1Н, J= 2.4 Гц), 7.41 (т, 2Н, J= 7.2 Гц), 7.50 (д, 1Н, J= 2.2 Гц), 7.53 (с, 1Н), 7.56 (д, 1Н, J= 1.4 Гц).
(c) 5-бром-3-(трет-бутил)бифенил-4-ол
27,00 г (120,0 ммолей) соединения, полученного в Примере 20(b), и 120 мл дихлорметана вводят в круглодонную колбу. Смесь охлаждают до 0oС, добавляют по каплям 6,4 мл (131,0 ммолей) брома и смесь перемешивают в течение десяти минут при 0oС. Добавляют насыщенный раствор тиосульфата натрия, проводят экстракцию дихлорметаном и органическую фазу отделяют отстаиванием, промывают водой до нейтрального рН, сушат над сульфатом магния и выпаривают. Собирают 32,00 г (88%) ожидаемого продукта в виде желтого масла.
1H ЯМР (CDCl3) δ 1.45 (с, 9Н), 5.83 (с, 1Н), 7.28-7.34 (м, 1Н), 7.40 (д, 2Н, J= 7.6 Гц), 7.44 (д, 1Н, J= 1.9 Гц), 7.49-7.53 (д, 2Н, J= 8.6 Гц), 7.57 (д, 1Н, J= 2.2 Гц).
(d) 5-бром-3-трет-бутил-4-(метоксиметокси)бифенил
Способом, аналогичным Примеру 13(а), реакцией 7,30 г (24,0 ммолей) соединения, полученного в Примере 20(с), с 2 мл (26,4 ммолями) хлорметильного метилового эфира получают 8,00 г (100%) ожидаемого соединения в виде оранжевого масла.
1H ЯМР (CDCl3) δ 1.48 (с, 9Н), 3.71 (с, 3Н), 5.16 (с, 2Н), 7.34-7.46 (м, 3Н), 7.51-7.54 (м, 3Н), 7.64 (д, 1Н, J= 2.0 Гц).
(e) 5-трет-бутил-4-(метоксиметокси)бифенил-3-карбальдегид
Способом, аналогичным Примеру 3(а), из 7,80 г (23,0 ммолей) соединения, полученного в Примере 20(d), получают 4,31 г (63%) ожидаемого соединения в виде желтого твердого вещества с температурой плавления 92-94oС.
1H ЯМР (CDCl3) δ 1.49 (с, 9Н), 3.66 (с, 3Н), 5.09 (с, 2Н), 7.38 (д, 1Н, J= 8.5 Гц), 7.44 (т, 2Н, J= 7.0 Гц), 7.58 (д, 2Н, J= 8.5 Гц), 7.82 (д, 1Н, J= 2.5 Гц), 7.94 (д, 1Н, J= 2.4 Гц), 10.27 (с, 1Н).
(f) 1-(5-трет-бутил-4-(метоксиметокси)бифенил-3-ил)-3-(триметилсиланил)проп-2-ин-1-ол
Способом, аналогичным Примеру 7(g), из 4,30 г (14,4 ммолей) соединения, полученного в Примере 20(е), получают 4,00 г (70%) ожидаемого соединения в виде желтого твердого вещества с температурой плавления 90-91oС.
1H ЯМР (CDCl3) δ 0.21 (с, 9Н), 1.45 (с, 9Н), 3.74 (с, 3Н), 3.87 (д, 1Н, J= 5.5 Гц), 4.96 (д, 1Н, J= 6.2 Гц), 5.15 (д, 1Н, J= 6.2 Гц), 5.84 (д, 1Н, J= 5.5 Гц), 7.36 (д, 1Н, J= 7.1 Гц), 7.46 (т, 2Н, J= 7.0 Гц), 7.59-7.62 (м, 3Н), 7.96 (д, 1Н, J= 2.4 Гц).
(g) 1-(5-трет-бутил-4-(метоксиметокси)бифенил-3-ил)проп-2-ин-1-ол
Способом, аналогичным Примеру 7(h), из 4,00 г (10,1 ммолей) соединения, полученного в Примере 20(f), получают 3,27 г (100%) ожидаемого соединения в виде оранжевого масла.
1H ЯМР (CDCl3) δ 1.37 (с, 9Н), 2.55 (д, 1Н, J= 2.3 Гц), 3.66 (с, 3Н), 4.89 (д, 1Н, J= 6.3 Гц), 5.07 (д, 1Н, J= 6.2 Гц), 5.79 (д, 1Н, J= 2.1 Гц), 7.24-7.46 (м, 3Н), 7.50-7.54 (м, 3Н), 7.85 (д, 1Н, J= 2.3 Гц).
(h) этил 4-[3-(5-трет-бутил-4-(метоксиметокси)бифенил-3-ил)-3-гидроксипроп-1-инил] бензоат
Способом, аналогичным Примеру 3(с), реакцией 3,20 г (9,9 ммолей) соединения, полученного в Примере 20(g), с 3,00 г (10,8 ммолями) этил 4-иодбензоата получают 3,00 г (65%) этил 4-[3-(5-терт-бутил-4-(метоксиметокси)бифенил-3-ил)-3-гидроксипроп-1-инил] бензоата в виде коричневого масла.
1H ЯМР (CDCl3) δ 1.39 (т, 3Н, J= 7.1 Гц), 1.46 (с, 9Н), 3.76 (с, 3Н), 3.99 (д, 1Н, J= 5.5 Гц), 4.37 (г, 2Н, J= 7.2 Гц), 4.99 (д, 1Н, J= 6.3 Гц), 5.17 (д, 1Н, J= 6,3 Гц), 7.35 (д, 1Н, J= 7.1 Гц), 7.44 (т, 1Н, J= 7.5 Гц), 7.53 (д, 2Н, J= 8.3 Гц). 7.57-7.61 (м, 4Н), 7.96 (с, 1Н), 7.98 (д, 2Н, J= 8.1 Гц).
ПРИМЕР 21
4-[3-(5-трет-Бутил-4-(метоксиметокси)бифенил-3-ил)-3-гидроксипроп-1-инил] бензойная кислота
Способом, аналогичным Примеру 2, из 1,50 г (3,2 ммолей) соединения, полученного в Примере 20(h), получают 970 мг (70%) 4-[3-(5-трет-бутил-4-(метоксиметокси)бифенил-3-ил)-3-гидроксипроп-1 -инил] бензойной кислоты в виде бежевого порошка с температурой плавления 162-164oС.
1H ЯМР (d6-ДМСО) δ 1.44 (с, 9Н), 3.63 (с, 3Н), 5.11 (д, 1Н, J= 5.2 Гц), 5.18 (д, 1Н, J= 5.2 Гц), 5.94 (д, 1Н, J= 6.2 Гц), 6.30 (д, 1Н, J= 6.3 Гц), 7.37 (д, 1Н, J= 7.3 Гц), 7.46 (д, 2Н, J= 7.6 Гц), 7.52-7.55 (м, 3Н), 7.62 (д, 2Н. J= 7.5 Гц), 7.85 (д, 1Н, J= 2.0 Гц), 7.91 (д, 2Н, J= 8.1 Гц), 13,14 (с, 1Н).
ПРИМЕР 22
Этил 4-[3-(5-трет-бутил-4-(метоксибифенил-3-ил)-3-гидроксипроп-1-инил] бензоат
(a) 5-бром-3-трет-бутил-4-метоксибифенил
Способом, аналогичным Примеру 13(а), реакцией 4,00 г (13,0 ммолей) соединения, полученного в Примере 20(с), с 890 мкл (14,3 ммолями) йодистого метила получают 4,09 г (98%) ожидаемого соединения в виде желтого масла.
1H ЯМР (CDCl3) δ 1.44 (с, 9Н), 3.97 (с, 3Н), 7.34-7.54 (м, 5Н), 7.47 (д, 1Н, J= 2.1 Гц), 7.65 (д, 1Н, J= 2.0 Гц).
(b) 5-трет-бутил-4-метоксибифенил-3-карбальдегид
Способом, аналогичным Примеру 3(а), из 3,80 г (12,0 ммолей) соединения, полученного в Примере 22(а), получают 2,29 г (71%) ожидаемого соединения в виде желтого твердого вещества с температурой плавления 45oС.
1H ЯМР (CDCl3) δ 1.47 (с, 9Н), 3.99 (с, 3Н), 7.32-7.59 (м, 5Н), 7.79 (д, 1Н, J= 2.1 Гц), 7.93 (д, 1Н, J= 2.2 Гц), 10.40 (с, 1Н).
(c) 1-(5-трет-бутил-4-метоксибифенил-3-ил)-3-триметилсиланил)проп-2-ин-1 -ол
Способом, аналогичным Примеру 7(g), из 2,29 г (8,5 ммолей) соединения, полученного в Примере 22(b), получают 2,00 г (64%) ожидаемого соединения в виде желтого твердого вещества с температурой плавления 94-96oС.
1H ЯМР (CDCl3) δ 0.21 (с, 9Н), 1.46 (с, 3Н), 2.56 (д, 1Н, J= 5.3 Гц), 3.96 (с, 3Н), 5.86 (д, 1Н, J= 5.2 Гц), 7.37 (д, 1Н, J= 7.1 Гц), 7.46 (т, 2Н, J= 7.0 Гц), 7.56 (д, 1Н, J= 2.4 Гц), 7.60 (д, 2Н, J= 7.6 Гц), 7.83 (д, 1Н, J= 2.3 Гц).
(d) 1-(5-трет-бутил-4-метоксибифенил-3-ил)проп-2-ин-1 -ол
Способом, аналогичным Примеру 7(h), из 2,00 г (5,5 ммолей) соединения, полученного в Примере 22(с), получают 1,52 г (95%) ожидаемого соединения в виде желтого масла.
1H ЯМР (CDCl3) δ 1.38 (с, 9Н), 2.57 (д, 1Н, J= 2.3 Гц), 3.87 (с, 3Н), 5.79 (бр с, 1Н), 7.24-7.40 (м, 6Н), 7.74 (д, 1Н, J= 2.3 Гц).
(e) этил 4-[3-(5-трет-бутил-4-метоксибифенил-3-ил)-3-гидроксипроп-1-инил] бензоат
Способом, аналогичным Примеру 3(с), реакцией 1,50 г (5,1 ммолей) соединения, полученного в Примере 22(d), с 1,55 г (5,6 ммолями) этил 4-иодбензоата, получают 1,88 г (83%) этил 4-[3-(5-трет-бутил-4-метоксибифенил-3-ил)-3-гидроксипроп-1-инил] бензоата в виде красноватого масла.
1H ЯМР (CDCl3) δ 1.39 (т, 3Н, J= 7.2 Гц), 1.46 (с, 9Н), 2.67 (д, 1Н, J= 5.3 Гц), 3.99 (с, 3Н), 4.37 (г, 2Н, J= 7.1 Гц), 6.10 (д, 1Н, J= 5.2 Гц), 7.34-7.60 (м, 8Н), 7.85 (д, 1Н, J= 2.3 Гц), 7.98 (д, 2Н, J= 8.4 Гц).
ПРИМЕР 23
4-[3-(5-трет-Бутил-4-метоксибифенил-3-ил)-3-гидроксипроп-1-инил] бензойная кислота
Способом, аналогичным Примеру 2, из 1,88 г (4,2 ммолей) соединения, полученного в Примере 22(е), получают 1,25 г (72%) 4-[3-(5-трет-бутил-4-метоксибифенил-3-ил)-3-гидроксипроп-1-инил] бензойной кислоты в виде бежевого порошка с температурой плавления 165-167oС.
1H ЯМР (d6-ДМСО) δ 1.42 (с, 9Н), 3.90 (с, 3Н), 5.88 (бр с, 1Н), 6.32 (бр с, 1Н), 7.37 (д, 1Н, J= 7,2 Гц), 7.45-7.51 (м, 3Н), 7.54 (д, 2Н, J= 8.3 Гц), 7.62 (д, 2Н, J= 7.2 Гц), 7.83 (д, 1Н, J= 2.3 Гц), 7.91 (д, 2Н, J= 8.3 Гц).
ПРИМЕР 24
Этил 4-[3-(3,5-ди-трет-бутил-2-метоксифенил)-3-метоксипроп-1-инил] бензоат
(a) 1-(3,5-ди-трет-бутил-2-метоксифенил)-1-метоксипроп-2-ин
Способом, аналогичным Примеру 13(а), реакцией 1,30 г (5,0 ммолей) 1-(3,5-ди-трет-бутил-2-гидроксифенил)проп-2-ин-1-ола, полученного в Примере 13(d), с 340 мкл (5,5 ммолями) йодистого метила получают 600 мг (41%) ожидаемого соединения в виде желтого твердого вещества с температурой плавления 68-70oС.
1H ЯМР (CDCl3) δ 1.32 (С, 9Н), 1.39 (с, 9Н), 2.58 (д, 1Н, J= 2.2 Гц), 3.47 (с, 3Н), 3.82 (с, 3Н), 5.34 (д, 1Н, J= 2.2 Гц), 7.34 (д, 1Н, J= 2.5 Гц), 7.54 (д, 1Н, J= 2.5 Гц).
(b) этил 4-[3-(3,5-ди-трет-бутил-2-метоксифенил)-3-метоксипроп-1-инил] бензоат
Способом, аналогичным Примеру 3(с), реакцией 220 мг (0,8 ммолей) соединения, полученного в Примере 24(а), с 220 мг (0,8 ммолями) этил 4-иодбензоата получают 260 мг (74%) этил 4-[3-(3,5-ди-трет-бутил-2-метоксифенил)-3-метоксипроп-1-инил] бензоата в виде оранжевого масла.
1H ЯМР (CDCl3) δ 1.33 (с, 9Н), 1.38 (т, 3Н, J= 7.1 Гц), 1.41 (с, 9Н), 3.53 (с, 3Н), 3.88 (с, 3Н), 4.37 (г, 2Н. J= 7.1 Гц), 5.57 (с, 1Н), 7.36 (д, 1Н, J= 2.5 Гц), 7.51 (д, 1Н, J= 8.4 Гц), 7.62 (д, 1Н, J= 2.5 Гц), 7.99 (д, 1Н, J= 8.4 Гц).
ПРИМЕР 25
4-[3-(3,5-Ди-трет-бутил-2-метоксифенил)-3-метоксипроп-1-инил] бензойная кислота
Способом, аналогичным Примеру 2, из 260 мг (0,6 ммолей) соединения, полученного в Примере 24(b), получают 180 мг (73%) 4-[3-(3,5-ди-трет-бутил-2-метоксифенил)-3-метоксипроп-1-инил] бензойной кислоты в виде бежевого порошка с температурой плавления 162-164oС.
1H ЯМР (CDCl3) δ 1.33 (с, 9Н), 1.41 (с, 9Н), 3.54 (с, 3Н), 3.88 (с, 3Н), 5,58 (с, 1Н), 7.36 (д, 1Н, J= 2.5 Гц), 7.55 (д, 1Н, J= 8.3 Гц), 7.62 (д, 1Н, J= 2.5 Гц), 8.06 (д. 1Н, J= 8.4 Гц).
ПРИМЕР 26
Метил 4-[3-(4,4-диметилтиохроман-8-ил)проп-1-инил] -бензоат
Способом, аналогичным Примеру 3(с), реакцией 4,00 г (18,5 ммолей) соединения, полученного в Примере 5(с), с 3,88 г (14,8 ммолями) метил 4-иодбензоата получают 1,66 г (25%) метил 4-[3-(4,4-диметилтиохроман-8-ил)проп-1-инил] -бензоата в виде желтого порошка с температурой плавления 92oС.
1H ЯМР (CDCl3)  1.35 (с, 6Н), 1.96 (т, 2Н, J= 6.0 Гц), 3.05 (т, 2Н, J= 6.2 Гц), 3.77 (с, 2Н), 3.91 (с, 3Н), 7.07 (т, 1Н, J= 7.7 Гц), 7.33 (д, 1Н, J= 7.0 Гц), 7.42 (д, 1Н, J= 7.3 Гц), 7.51 (д, 2Н, J= 8.4 Гц), 7.97 (д, 2Н, J= 8.4 Гц).
1.35 (с, 6Н), 1.96 (т, 2Н, J= 6.0 Гц), 3.05 (т, 2Н, J= 6.2 Гц), 3.77 (с, 2Н), 3.91 (с, 3Н), 7.07 (т, 1Н, J= 7.7 Гц), 7.33 (д, 1Н, J= 7.0 Гц), 7.42 (д, 1Н, J= 7.3 Гц), 7.51 (д, 2Н, J= 8.4 Гц), 7.97 (д, 2Н, J= 8.4 Гц).
ПРИМЕР 27
Этил 6-[3-(4,4-диметилтиохроман-8-ил)проп-1-инил] никотинат
Способом, аналогичным Примеру 3(с), реакцией 1,00 г (4,6 ммолей) соединения, полученного в Примере 5(с), с 1,41 г (5,1 ммолями) этил 6-иодпиридин-3-карбоксилата получают 50 мг (3%) этил 6-[3-(4,4-диметилтиохроман-8-ил)проп-1-инил] никотината в виде желтого масла.
1H ЯМР (CDCl3) δ 1.35 (с, 6Н), 1.41 (т, 3Н, J= 7.2 Гц), 1.97 (т, 2Н, J= 6.0 Гц), 3.06 (т, 2Н, J= 6.1 Гц), 3.82 (с, 2Н), 4.41 (г, 2Н, J= 7.1 Гц), 7.06 (т, 1Н, J= 7.7 Гц), 7.34 (д, 1Н, J= 7.9 Гц), 7.42 (д, 1Н, J= 7.4 Гц), 7.51 (д, 1Н, J= 8.2 Гц), 8.23 (дд, 1Н, J= 8.1/2.1 Гц), 9.16 (д, 1Н, J= 1.8 Гц).
ПРИМЕР 28
4-[3-(4,4-Диметилтиохроман-8-ил)проп-1-инил] бензальдегид
Способом, аналогичным Примеру 3(с), реакцией 2,00 г (9,3 ммолей) соединения, полученного в Примере 5(с), с 1,88 г (10,2 ммолями) 4-бромбензальдегида получают 90 мг (5%) 4-[3-(4,4-диметилтиохроман-8-ил)проп-1-инил] бензальдегида в виде желтого порошка с температурой плавления 55-63oС.
1H ЯМР (CDCl3) δ 1.34 (с, 6Н), 1.95 (т, 2Н, J= 6.1 Гц), 3.05 (т, 2Н, J= 6.2 Гц), 7.00 (т, 1Н, J= 8.6 Гц), 7.17 (дд, 1Н, J= 7.5/1.2 Гц), 7.29 (дд, 1Н, J= 7.1/1.3 Гц), 7.58 (д, 2Н, J= 8.2 Гц), 7.80 (д, 2Н, J= 8.2 Гц), 9.94 (с, 1Н).
ПРИМЕР 29
4-[3-(4,4-Диметилтиохроман-8-ил)проп-1-инил] фенол
Способом, аналогичным Примеру 3(с), реакцией 1,00 г (4,6 ммолей) соединения, полученного в Примере 5(с), с 880 мг (5,1 ммолями) 4-бромфенола получают 286 мг (20%) 4-[3-(4,4-диметилтиохроман-8-ил)проп-1-инил] фенола в виде желтого порошка с температурой плавления 95oС.
1H ЯМР (CDCl3) δ 1.33 (с, 6Н), 1.94 (т, 2Н, J= 6.0 Гц), 3.03 (т, 2Н, J= 6.1 Гц), 3.72 (с, 2Н), 6.75 (д, 2Н, J= 8.7 Гц), 7.07 (т, 1Н, J= 7.7 Гц), 7.27-7.34 (м, 3Н), 7.46 (д, 1Н, J= 7.4Гц).
ПРИМЕР 30
Этил 4-[3-(5-трет-бутил-4-гидроксибифенил-3-ил)-3-гидроксипроп-1-инил] бензоат
1,44 г (3,0 ммолей) соединения, полученного в Примере 20(h), и 15 мл этанола вводят в трехгорлую колбу объемом 100 мл в атмосфере азота. По каплям добавляют 830 мкл (15 ммолей) концентрированной серной кислоты. Реакционную смесь перемешивают с течение трех часов при комнатной температуре, добавляют затем воду, экстракцию проводят этиловым эфиром, органическую фазу промывают водой до нейтрального рН, сушат над сульфатом магния и фильтруют, и растворители выпаривают. Собирают 1,25 г (100%) этил 4-[3-(5-трет-бутил-4-(гидроксибифенил-3-ил)-3-гидроксипроп-1-инил] бензоата в виде красноватого масла.
1H ЯМР (CDCl3) δ 1.40 (т, 3Н, J= 7.2 Гц), 1.48 (с, 9Н), 4.38 (г, 2Н, J= 7.2 Гц), 5.69 (с, 1Н), 7.31 (д, 1Н, J= 7.1 Гц), 7.38-7.44 (м, 3Н), 7.52-7.56 (м, 5Н), 7,97 (с, 1Н), 8.00 (д, 2Н, J= 8.4 Гц).
ПРИМЕР 31
4-[3-(5-трет-Бутил-4-метоксибифенил-3-ил)проп-1-инил] бензойная кислота
Способом, аналогичным Примеру 9, из 700 мг (1,7 ммолей) соединения, полученного в Примере 23, получают 508 мг (75%) 4-[3-(5-трет-бутил-4-метоксибифенил-3-ил)проп-1-инил] бензойной кислоты в виде белого порошка с температурой плавления 229-231oС.
1H ЯМР (CDCl3) δ 1.45 (с, 9Н), 3.89 (с, 3Н), 3.94 (с, 2Н), 7.34 (д, 1Н, J= 7.1 Гц), 7.40-7.49 (м, 5Н), 7.56-7.60 (м, 2Н), 7.66 (д, 1Н, J= 2.2 Гц), 7.98 (д, 2Н, J= 8.3 Гц).
Примеры фармацевтических и косметических композиций
Различные фармацевтические и косметические композиции, основанные на активных соединениях согласно изобретению, проиллюстрированы в следующих примерах.
А - ОРАЛЬНЫЙ СПОСОБ ПРИМЕНЕНИЯ
(а) 0,2 г Таблетка
Соединение, приготовленное в Примере 2, - 0,001 г
Крахмал - 0,114 г
Дикальций фосфат - 0,020 г
Двуокись кремния - 0,020 г
Лактоза - 0,030 г
Тальк - 0,010 г
Стеарат магния - 0,005 г
Соединение согласно Примеру 2 может преимущественно заменяться тем же самым количеством одного из соединений согласно Примерам 4, 6, 11, 12, 21, 25 или 31.
(b) Оральная суспензия в 5 мл флаконах
Соединение, приготовленное в Примере 4 - 0,001 г
Глицерин - 0,500 г
70%-й Сорбитол - 0,500 г
Сахаринат натрия - 0,010 г
Метил п-гидроксибензоат - 0,040 г
Отдушка q. s.
Дистиллированная вода q. s. на - 5 мл
Соединение согласно Примеру 4 может преимущественно заменяться тем же самым количеством одного из соединений согласно Примерам 8, 12, 18 и 19.
(c) 0,8 г Таблетка
Соединение Примера 6 - 0,500 г
Предварительно желатинизированный крахмал - 0,100 г
Микрокристаллическая целлюлоза - 0,115 г
Лактоза - 0,075 г
Стеарат магния - 0,010 г
(d) Оральная суспензия в 10 мл флаконах
Соединение Примера 6 - 0,200 г
Глицерин - 1,000 г
70%-й Сорбитол - 1,000 г
Сахаринат натрия - 0,010 г
Метил п-гидроксибензоат - 0,080 г
Отдушка q, s.
Дистиллированная вода q. s. на - 10 мл
Соединение согласно Примеру 6 может преимущественно заменяться тем же самым количеством одного из соединений согласно Примерам 11, 12, 14, 23 или 25.
В - ЛОКАЛЬНЫЙ СПОСОБ ПРИМЕНЕНИЯ
(a) Мазь
Соединение Примера 4 - 0,020 г
Изопропил миристат - 81,700 г
Жидкое пафиновое масло - 9,100 г
Двуокись кремния("Ayrosil 200", продаваемый фирмой Degussa) - 9,180 г
(b) Мазь
Соединение Примера 1 - 0,300 г
Белый вазелин фармацевтической марки - 100 г
В этом примере соединение Примера 1 может преимущественно заменяться тем же самым количеством одного из соединений согласно Примерам 28 и 29.
(c) Неионный крем вода-в-масле
Соединение Примера 2 - 0,100 г
Смесь эмульсивных ланолиновых спиртов, восков и масел ("Anhydrous eucerin", продаваемых фирмой BDF) - 39,900 г
Метил п-гидроксибензоат - 0,075 г
Пропил п-гидроксибензоат - 0,075 г
Стерильная деминерализованная вода q. s. на - 100 г
(d) Лосьон
Соединение Примера 4 - 0,100 г
Полиэтиленглиголь (PEG 400) - 69,900 г
95%-й этанол - 30,000 г
В вышеприведенных примерах (с) и (d) соединение согласно Примеру 4 может преимущественно заменяться тем же самым количеством одного из соединений согласно Примерам 6, 9, 11, 14, 21, 23 и 31.
(e) Гидрофобная мазь
Соединение Примера 2 - 0,300 г
Изопропил миристат - 36,400 г
Силиконовое масло ("Rhodorsil 47V300", продаваемое фирмой Rhone-Poulenc) - 36,400 г
Пчелиный воск - 13,600 г
Силиконовое масло ("Abil 300.000 cst", продаваемое фирмой Goldschmidt) - 100 г
(f) Неионный крем масло-в-воде
Соединение Примера 5 - 1,000 г
Цетиловый спирт - 4,000 г
Моностеарат глицерина - 2,500 г
Стеарат ПЭГ 50 - 2,500 г
Масло семян butyrospermum Parkii - 9,200 г
Пропиленгликоль - 2,000 г
Метил п-гидроксибензоат - 0,075 г
Пропил п-гидроксибензоат - 0,075 г
Стерильная деминерализованная вода q. s. на - 100 г
В этом примере соединение согласно Примеру 5 может преимущественно заменяться тем же самым количеством одного из соединений согласно Примерам 7, 10, 13, 15, 17, 20 или 22.
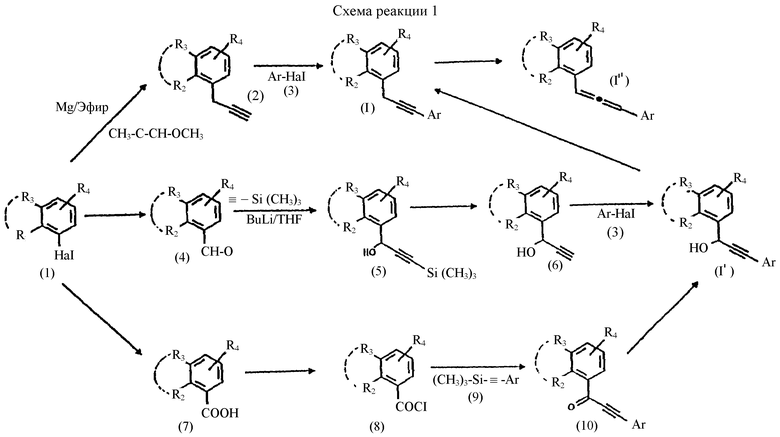



Изобретение относится к новым биароматическим соединениям, соединенным пропиниленовой связью, общей формулы I, где Ar представляет радикал формулы (а) или (b), R1 представляет -OR6 или -COR7, R2 представляет полиэфирный радикал, включающий 1-6 атомов углерода и 1-3 атомов кислорода или серы, и если в последнем случае R4 представляет линейный или разветвленный C1-С20 алкил, то он находится в орто- или мета-положении относительно Х-Ar связи, R3 представляет низший алкил, или R2, или R3, взятые вместе, образуют 6-членное кольцо, необязательно замещенное, по крайней мере, одним метилом и/или необязательно разделенное атомом кислорода или серы, R4 представляет Н, линейный или разветвленный C1-C20 алкил или арил, R5 представляет Н или -OR8, R6 представляет Н, R7 представляет Н, -OR10 или -N(r)r, где (r) r являются Н, низшим алкилом или взятые вместе с атомом азота образуют кольцо морфолино, R8 представляет Н или низший алкил, R10 представляет Н, линейный или разветвленный C1-C20 алкил, Х представляет двухвалентный радикал, который справа налево или наоборот имеет формулу (d), R11 представляет Н или -OR8, R12 представляет Н, и соли соединений формулы (I), когда R1 представляет карбоновую кислоту и оптические и геометрические изомеры указанных соединений формулы (I). Фармацевтическая композиция, обладающая антагонистической активностью в отношении рецепторов ретиноевой кислоты, содержащая соединение формулы I и фармацевтически приемлемый носитель. Косметическая композиция, обладающая антагонистической активностью в отношении рецепторов ретиноевой кислоты, содержащая соединение формулы I и косметически приемлемый носитель. 3 с. и 10 з. п. ф-лы.



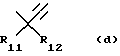
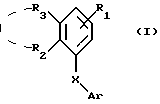
где Ar представляет радикал по формулам (а) или (b)

R1 представляет -OR6 или -COR7;
R2 полиэфирный радикал, включающий от 1 до 6 атомов углерода и от 1 до 3 атомов кислорода или серы, и если в последнем случае R4 представляет линейный или разветвленный C1-C20 алкил, то он находится в орто- или мета-положении относительно Х-Ar связи;
R3 представляет низший алкил,
или R2 и R3, взятые вместе, образуют 6-ти членное кольцо, необязательно замещенное, по крайней мере, одним метилом и/или необязательно разделенное атомом кислорода или серы;
R4 представляет Н, линейный или разветвленный C1-C20 алкил или арил;
R5 представляет Н или -OR8;
R6 представляет Н;
R7 представляет Н, -ОR10, или
где r' и r'' являются Н, низшим алкилом или взятые вместе с атомами азота образуют кольцо морфолино;
R8 представляет Н или низший алкил;
R10 представляет Н или C1-C20 алкил, который может быть линейным или разветвленным;
Х представляет двухвалентный радикал, который справа налево или наоборот имеет формулу
R11 представляет Н или -OR8;
R12 представляет Н,
и соли соединений формулы (I), когда R1 представляет карбоновую кислоту и оптические и геометрические изомеры указанных соединений формулы (I).
в которой Ar представляет радикал следующей формулы (а) или (b)

где R1 представляет -COR7;
R5 и R7 имеют значения, как они определены в п. 1;
Х представляет двухвалентный радикал, который справа налево или наоборот имеет формулу
R11 и R12 представляют Н;
R13 и R14, которые являются одинаковыми или разными, представляют Н, или СН3;
Y представляет атом кислорода или серы или метиленовый, этиленовый или изопропилиденовый двухвалентный радикал;
n = 1 или 2.
метил 2-гидрокси-4-[3-(4,4-диметилхроман-8-ил)проп-1-инил] бензоат,
2-гидрокси-4-[3-(4,4-диметилхроман-8-ил)проп-1-инил] бензойная кислота,
метил 2-гидрокси-4-[3-гидрокси-3-(4,4-диметилхроман-8-ил)проп-1-инил] бензоат,
2-гидрокси-4-[3-гидрокси-3-(4,4-диметилхроман-8-ил)проп-1-инил] бензойная кислота,
метил 2-гидрокси-4-[3-(4,4-диметилтиохроман-8-ил)проп-1-инил] бензоат,
2-гидрокси-4-[3-(4,4-диметилтиохроман-8-ил)проп-1-инил] бензойная кислота,
этил 4-[3-гидрокси-3-(5,5,8,8-тетраметил-3-фенил-5,6,7,8-тетрагидронафт-1-ил)проп-1-инил] бензоат,
4-[3-гидрокси-3-(5,5,8,8-тетраметил-3-фенил-5,6,7,8-тетрагидронафт-1-ил)проп-1-инил] бензойная кислота,
4-[3-(5,5,8,8-тетраметил-3-фенил-5,6,7,8-тетрагидронафт-1-ил)проп-1-инил] бензойная кислота,
этил 4-[3-(4,4-диметилтиохроман-5-ил)-3-гидроксипроп-1-инил] бензоат,
4-[3-(4,4-диметилтиохроман-5-ил)-3-гидроксипроп-1-инил] бензойная кислота,
4-[3-(4,4-диметилтиохроман-5-ил)проп-1-инил] бензойная кислота,
этил 4-[3-(3,5-ди-трет-бутил-2-(метоксиметокси)-фенил)-3-гидроксипроп-1-инил] бензоат,
4-[3-(3,5-ди-трет-бутил-2-(метоксиметокси)фенил)-3-гидроксипроп-1-инил] бензойная кислота,
этил 4-[3-(3,5-ди-трет-бутил-2-гидроксифенил)-3-гидроксипроп-1-инил] бензоат,
этил 4-[3-(3,5-ди-трет-бутил-2-гидроксифенил)проп-1-инил] бензоат,
этил 4-[3-(3,5-ди-трет-бутил-2-метоксифенил)-3-гидроксипроп-1-инил] бензоат,
4-[3-(3,5-ди-трет-бутил-2-метоксифенил)-3-гидроксипроп-1-инил] бензойная кислота,
4-[3-(3,5-ди-трет-бутил-2-метоксифенил)проп-1-инил] бензойная кислота,
этил 4-[3-(5-трет-бутил-4-(метоксиметокси)бифенил-3-ил)-3-гидроксипроп-1-инил] бензоат,
4-[3-(5-трет-бутил-4-(метоксиметокси)бифенил-3-ил)-3-гидроксипроп-1-инил] бензойная кислота,
этил 4-[3-(5-трет-бутил-4-(метоксибифенил-3-ил)-3-гидроксипроп-1-инил] бензоат,
4-[3-(5-трет-бутил-4-метоксибифенил-3-ил)-3-гидроксипроп-1-инил] бензойная кислота,
этил 4-[3-(3,5-ди-трет-бутил-2-метоксифенил)-3-метоксипроп-1-инил] бензоат,
4-[3-(3,5-ди-трет-бутил-2-метоксифенил)-3-метоксипроп-1-инил] бензойная кислота,
метил 4-[3-(4,4-диметилтиохроман-8-ил)проп-1-инил] -бензоат,
этил 6-[3-(4,4-диметилтиохроман-8-ил)проп-1-инил] -никотинат,
4-[3-(4,4-диметилтиохроман-8-ил)проп-1-инил] бензальдегид,
4-[3-(4,4-диметилтиохроман-8-ил)проп-1-инил] фенол,
этил 4-[3-(5-трет-бутил-4-гидроксибифенил-3-ил)-3-гидроксипроп-1-инил] бензоат,
4-[3-(5-трет-бутил-4-метоксибифенил-3-ил)проп-1-инил] бензойная кислота,
4-[3-(4,4-диметилтиохроман-8-ил)проп-1-инил] -бензойная кислота,
4-[3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-1-нафтил)проп-1-инил] бензойная кислота,
2-гидрокси-4-[3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-1-нафтил)проп-1-инил] бензойная кислота,
метил 2-гидрокси-4-[3-гидрокси-3-(4,4-диметилхроман-8-ил)проп-1-инил] бензоат,
2-гидрокси-4-[3-гидрокси-3-(4,4-диметилхроман-8-ил)проп-1-инил] бензойная кислота,
2-гидрокси-4-[3-(4,4-диметилтиохроман-8-ил)проп-1-инил] бензойная кислота,
4-[3-(4,4-диметилтиохроман-8-ил)проп-1-инил] бензамид,
N-этил-4-[3-(4,4-диметилтиохроман-8-ил)проп-1-инил] бензамид,
N-(4-гидроксифенил)-4-[3-(4,4-диметилтиохроман-8-ил)проп-1-инил] бензамид,
морфолид-4-[3-(4,4-диметилтиохроман-8-ил)проп-1-инил] бензойной кислоты,
4-[3-(4,4-диметилтиохроман-8-ил)проп-2-инил] бензойная кислота,
4-[3-(5,5,8,8-тетраметил-5,6,7,8-тетрагидронафт-1-ил)проп-2-инил] бензойная кислота,
4-[3-(4,4-диметил-6-фенилтиохроман-8-ил)проп-1-инил] бензойная кислота,
4-[3-(4,4-диметил-6-фенилхроман-8-ил)проп-1-инил] бензойная кислота,
4-[3-(4,4-диметил-6-фенилтиохроман-8-ил)проп-2-инил] бензойная кислота,
4-[3-(4,4-диметил-6-(п-толил)тиохроман-8-ил)проп-1-инил] бензойная кислота,
4-[3-(5,5,8,8-тетраметил-5,6,7,8-тетрагидронафт-1-ил)проп-2-инил] бензойная кислота,
4-[3-(5,5,8,8-тетраметил-3-(п-толил)-5,6,7,8-тетрагидронафт-1-ил)проп-2-инил] бензойная кислота,
4-(3-[3-(4-метоксифенил)-5,5,8,8-тетраметил-5,6,7,8-тетрагидронафт-1-ил)проп-1-инил] бензойная кислота,
2-гидрокси-4-[3-(5,5,8,8-тетраметил-3-(п-толил)-5,6,7,8-тетрагидронафт-1-ил)проп-1-инил] бензойная кислота и
3-гидрокси-4-[3-(5,5,8,8-тетраметил-3-фенил-5,6,7,8-тетрагидрофант-1-ил)проп-1-инил] бензойная кислота.
| Фотометр | 1977 |
|
SU661258A1 |
| Демодулятор сигнала с угловой модуляцией | 1973 |
|
SU476658A1 |
| EP 0401517 A1, 11.12.1990 | |||
| Домовый номерной фонарь, служащий одновременно для указания названия улицы и номера дома и для освещения прилежащего участка улицы | 1917 |
|
SU93A1 |
| ЭТИНИЛБЕНЗОТИЕНИЛЫ | 1991 |
|
RU2079495C1 |
Авторы
Даты
2002-01-27—Публикация
1998-06-12—Подача