Изобретение относится к новым производным карбамоилметилмочевины, способным конкурировать с гастрином и/или CCK-B и связываться с их рецепторами, и к фармацевтическим композициям, которые их содержат и являются полезными при лечении различных заболеваний, связанных с рецепторами гастрина и/или CCK-B.
Гастрин и холецистокинин (CCK) являются физиологически активными веществами, принадлежащими к группе, которая называется гастриновым подсемейством желудочно-кишечных пептидных гормонов. Хотя рецепторы гастрина обычно находят в различных тканях, включающих весь верхний пищеварительный тракт, поджелудочную железу, печень желчные протоки и аналогичные, они существуют, главным образом, в паристальных клетках фундальных желез и участвуют в медиировании или посредничестве секреции желудочной кислоты. Что касается рецепторов CCK, известно, что имеется два типа рецепторов, т.е. CCK-A-рецептор, найденный в периферических тканях, таких как пищеварительный тракт, и CCK-B-рецептор, найденный в головном мозге. Первый участвует в регулировании подвижности или сократительной способности тракта и секреции поджелудочной железы, тогда как последний - в регулировании центральной нервной деятельности, аппестата и аналогичных. Соответственно ожидалось, что соединения, способные конкурировать с гастрином и/или CCK-B и связываться с их рецепторами, полезны в лечении животных, включая человека, страдающих от желудочно-кишечных заболеваний и заболеваний центральной нервной системы, связанных с рецепторами этих пептидных гормонов. Например, считается, что такие соединения полезны в качестве противоопухолевых агентов; лекарств для лечения панкреатита, заболеваний желчного пузыря или слизистого колита, для облегчения желчных колик и для улучшения аппетита. Кроме того, при исследованиях рецепторов как желудочно-кишечного тракта, так и центральной нервной системы обнаружено, что данные желудочно-кишечные пептидные гормоны важны также в качестве биологически активных веществ ["Brain and Peptides" Taisha, vol. 18, 10, 33-44 (1981); J. Hughus, С. Woodruff, D. Horwell, A. McKnight and D. Hill, "Gastrin", J.H. Walsh ed., Rovan Press, Ltd., Нью Йорк, 1993, стр. 169-186; F. Makovec, Drugs of the Future, 18, 919 (1993); Японская патентная публикация (Кокаи) 63-238069, ЕР 167919; патент США 4820834; ЕР 284256; патент США 5004741].
Например, антагонисты гастрина, специфичные к гастриновым рецепторам, как полагают, являются эффективными в отношении нарушений, связанных с гастрином, таких как пептические язвы желудка и двенадцатиперстной кишки, синдром Золлингер-Эллисона, гиперплазия синусных G клеток, и снижают активность гастрина. Сообщается об использовании антагонистов, специфичных к рецепторам гастрина, при лечении язв желудка и двенадцатиперстной кишки (Taisha, 29/7, 1992, R. Eissele, H. Patberg, H. Koop, W. Krack, W. Lorenz, A.T. McKnight and Arnold, Gastroenterology, 103, 1596 (1992), и др.).
Сообщалось, что антагонисты CCK-B-рецептора полезны для усиления и увеличения продолжительности действия соединений опиоидного (наркотического) типа (например, морфиновых производных, таких как сульфат или гидрохлорид морфина), которые являются антагонистами опиоидных рецепторов [Drugs of the Future, 18, 919 (1993); Proc. Natl. Acad. Sci. США, Vol. 87, стр. 71, 5 сентября 1990 г., Neurobiology].
В качестве соединений, используемых при указанных выше лечениях, описывались некоторые бензодиазепиновые производные типа с замкнутым кольцом [например, L-365260, описанное в японской патентной публикации Кокаи N 63-238069; VMO22, описанное в WO 92/11246; и соединения, описанные в WO 93/14074 и WO 93/14075] или другие соединения с замкнутым кольцом [например, C1-988, описанный авторами Martin J. Drysdale и др., J. Med. Chem. 35: 2573-2581 (1992); RP 72540, описанный в Drugs of the Future, 1993, 18 (10); и LV-288513, описанный в J. Pharmacol. Exp. Ther., 264, 480 (1993)], которые являются антагонистами гастринового рецептора или CCK-B-рецептора. Однако многие из соединений, описанных до настоящего изобретения, не имеют достаточного сродства к каждому рецептору или нет каких-либо конкретных фармакологических данных. Так, не предложено никаких клинически применимых противоязвенных агентов с антагонистическим эффектом по отношению к рецептору гастрина. Поэтому существует необходимость разработки соединения, способного связываться предпочтительно с нужным рецептором пептидного гормона, отличая его от пептидных гормонов иных подтипов, для того чтобы лечение проходило более эффективно.
Исходя из вышеизложенного заявители провели интенсивные исследования по разработке соединений, которые обладают высоким сродством к гастриновым рецепторам и/или CCK-B-рецепторам с высокой селективностью и низким сродством к CCK-A-рецепторам, и нашли, что некоторые производные карбамоилметилмочевины полезны для указанных выше целей, и создали настоящее изобретение.
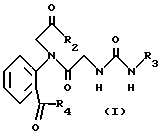
Таким образом, настоящее изобретение относится к соединению формулы I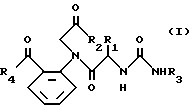
где R1 представляет атом водорода или низший алкил;
R2 представляет низший алкокси, низший алкиламино, низший циклоалкил, необязательно замещенный фенил, при этом фенил может иметь заместитель, выбранный из группы амино, галогена, низшего алкила, галогенированного низшего алкила, или означает пирролидинил.
R3 необязательно замещенный фенил, в котором заместители выбраны из группы: галоген, низший алкил, галогенированный низший алкил, низший алкокси, циано, тетразолил, остаток формулы -R5(CH2)nR6, где 0-3, R5 - означает связь, -O-, -S- или -S(O)-, R6 - группа COOR7, где R7 - водород, низший алкил, низший алкенил;
R4 представляет необязательно замещенный фенил, при этом фенил может иметь 1-3 заместителя, выбранных из группы: амино, низший алкил, галогенированный алкил, галоген, низший алкокси, циано; C3-C7-циклоалкил, который может быть замещен низшим алкилом; C1-C10-алкил с прямой или разветвленной цепью; необязательно замещенная гетероциклическая группа, выбранная из пиперидинила, тиенила или его фармацевтически приемлемая соль.
Хотя все соединения (I), определенные выше, полезны для достижения целей настоящего изобретения, соединения формулы I, где R1 является атомом водорода, R2 представляет низший алкокси или низший алкиламино, особенно трет-бутокси, R3 представляет необязательно замещенный фенил, особенно карбоксифенил, и R4 представляет необязательно замещенный фенил, особенно фенил, являются предпочтительными.
Предпочтительно соединение, которое представляет 2-/(трет-бутоксикарбонилметил)-/3-(м-карбоксифенил)уреидометилкарбонил)/ аминобензофенон. Объектом изобретения является также фармацевтическая композиция, обладающая свойствами антагониста гастринового или CСK-B-рецептора, включающая фармацевтически активный компонент и фармацевтически приемлемый носитель, отличающаяся тем, что в качестве фармацевтически приемлемого компонента она содержит эффективное количество производного карбамоилтиомочевины формулы I или его фармацевтически приемлемую соль. Указанная фармацевтическая композиция является антагонистической по отношению к гастриновому рецептору или CСK-B-рецептору и обладает противоязвенным действием.
Фармацевтическая композиция обладает способностью усиливать или пролонгировать анальгетическое действие, вызываемое лекарствами опиоидного типа.
B настоящем описании термин "антагонист гастринового рецептора или рецептора гастрина" или "антагонист CCK-B-рецептора" относится к соединениям, способным конкурентно ингибировать связывание гастринового рецептора или CCK-B-рецептора с соответствующими природными лигандами, и используется, соответственно, взаимозаменяемо с термином "антагонист гастрина" или "антагонист CCK-B". Поскольку соединение формулы I по настоящему изобретению имеет сильное сродство к гастриновым рецепторам и/или CCK-B-рецепторам и может связываться с ними специфично, конкурируя с их природными лигандами, оно может называться как "антагонист гастринового рецептора" или "антагонист CCK-B-рецептора".
По тем же самым причинам, указанным выше, термины "антагонизм гастриновым рецепторам" и "гастриновый антагонизм", и термины "антагонизм CCK-B-рецептору" и "CCK-B-антагонизм" используются взаимозаменяемо.
Термины, используемые при определении соединения (I), даны ниже.
Термин "алкил" означает C1-C10-углеродную группу с прямой или разветвленной цепью, включающую октил, нонил и децил в дополнение к низшему алкилу, определенному ниже.
Термин "низший алкил" означает C1-C8-углеродную группу с прямой или разветвленной цепью, включающую метил, этил, н-пропил, изо-пропил, н-бутил, втор-бутил, трет-бутил, н-пентил, изо-пентил, неопентил, втор-пентил, трет-пентил, н-гексил, неогексил, изо-гексил, втор-гексил, трет-гексил, гептил и октил, и предпочтительной является C1-C3-углеродная группа.
Термин "низший циклоалкил" означает C3-C7-циклоалкильную группу, включающую циклопропил, циклобутил, циклопентил, циклогексил и циклогептил.
Термин "низший алкокси" означает C1-C8-алкоксигруппу с прямой или разветвленной цепью, включающую метокси, этокси, н-пропокси, изо-пропокси, н-бутокси, втор-бутокси, трет-бутокси, н-пентилокси, изо-пентилокси, неопентилокси, втор-пентилокси, трет-пентилокси, н-гексилокси, неогексилокси, изо-гексилокси, втор-гексилокси и трет-гексилокси. Предпочтительной алкокси группой является C1-C4-алкокси, в частности трет-бутокси.
Термин "низший алкиламино" означает группу, происходящую из аминогруппы в результате замещения водорода низшим и алкилом, включающую метиламино, этиламино, н-пропиламино, изо-пропиламино, н-бутиламино, трет-бутиламино и аналогичные.
В определении радикала R2 термин "необязательно замещенный фенил" обозначает фенил, который может быть замещен 1-3 заместителями, выбранными, например, из амино, галогена, низшего алкила и галоидированного низшего алкила, в орто-, мета- и/или параположении.
Термин "галоген" обозначает бром, хлор, фтор или йод.
В определении R3 термин "необязательно замещенный фенил" обозначает фенил, который может быть замещен заместителем (заместителями), выбранным, например, из галогена, циано, низшего алкокси, низшего алкила, галоидированного низшего алкила, -R5-(CH2)n-R6 [R5 представляет связь -O-, -S- или -S(O)-, R6 представляет группу -COOR7 (R7 представляет водород, низший алкил, низший алкенил), n представляет целое число от 0 до 3], предпочтительно -COOR7 в орто-, мета- и/или параположении.
В определении R4 термин "необязательно замещенный фенил", "необязательно замещенный алкил", "необязательно замещенная гетероциклическая группа" или "необязательно замещенный циклоалкил" обозначает каждую из указанных групп, которая может быть замещена 1-3 заместителями, выбранными, например, из притягивающих электрон или высвобождающих электрон групп, таких как амино, галоген, низший алкил, галоидированный низший алкил и низший алкокси, в орто-, мета- и/или параположении.
Термин "галоидированный алкил" или "галоидированный низший алкил" обозначает алкильную или низшую алкильную группу, определенную выше, которая замещена атомами галогена, предпочтительно 1-3 атомами, включающую -CF3-, -CHF2-, -CH2F-, CH2CCl3-, -CH2CHClCH3- и аналогичные.
Соединение (I) настоящего изобретения может быть получено с использованием любого из способов, известных в технике. Типичные процедуры иллюстрируются ниже, однако они не являются ограничивающими объем.
Способ 1.
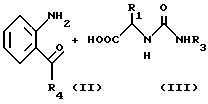

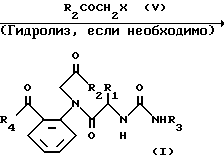
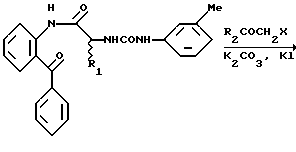
в котором R1, R2, R3 и R4 имеют значения, определенные выше, и X представляет галоген.
Реакция 2-замещенного анилинового производного формулы II и соединения формулы III, которое, если необходимо, является N-защищенным, осуществляется в обычных условиях реакции присоединения. Реакция присоединения или сочетания осуществляется в соответствии с любым общепринятым методом, например, 1) по методу, в котором реакция осуществляется непосредственно при использовании сочетающего агента, такого как дициклогексилкарбодиимид, 1-(3-диметиламинопропил)-3- этилкарбодиимид или аналогичные; 2) по методу, при котором аминокислота (III) подвергается взаимодействию с тионилхлоридом с получением хлорангидрида кислоты, который затем подвергают взаимодействию с кетоном (II); или 3) по методу, при котором аминокислоту (III) подвергают взаимодействию с этилхлоркарбонатом с получением активного сложного эфира, который затем подвергается взаимодействию с кетоном (II). Затем полученный продукт соответствующим образом деблокируется с помощью обычного метода, например с помощью обработки раствором бромистого водорода в уксусной кислоте.
Получающееся в результате амидное соединение (IV) подвергается взаимодействию с галогенидом (V) формулы R2COCH2X в присутствии соответствующего основания, такого как гидроокись щелочного металла (NaOH и др.), или карбоната щелочного металла (K2CO3) в растворителе, таком как диметилформамид. Продукт реакции (I) может превращаться в другое соединение (I), которое также полезно для целей настоящего изобретения, с помощью соответствующего модифицирования заместителя R3. Конечный продукт может очищаться с помощью общепринятых методов очистки, используемых в технике, например экстракции органическим растворителем, таким как этилацетат, сушки, концентрирования, хроматографии, кристаллизации из соответствующего растворителя и аналогичных.
Способ 2.

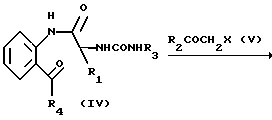
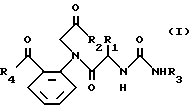
в котором R1, R2, R3, R4 имеют значения, определенные выше.
Аминосоединение (VI), исходный материал для способа 2, получается, например, по способу, согласно которому кетон указанной выше формулы (II) подвергается взаимодействию с N-защищенным аминокислотным производным, содержащим соответствующую боковую, цепь R1, а затем деблокируется.
Реакция сочетания между кетоном (II) и N-защищенным аминокислотным производным и реакция деблокирования или снятия защиты осуществляется в обычных условиях сочетания и деблокирования, упомянутых в способе 1, описанном выше.
Реакцию между аминосоединением (VI) и изоцианатным производным формулы VII осуществляется с помощью смешения их в подходящем растворителе при комнатной температуре. Затем, таким же образом, как в случае способа 1, амид (IV) подвергается взаимодействию с галогенидом (V) с получением соединения формулы I, которое, если необходимо, модифицируется подходящим образом для получения другого соединения (I) настоящего изобретения.
В дополнение к сказанному может применяться способ получения, показанный на следующей схеме реакции.
Способ 3.

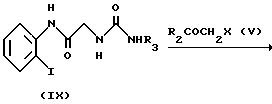
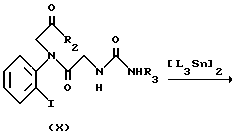
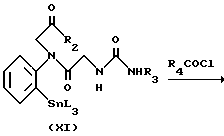
на которой R1, R2, R3, R4 и X имеют значения, определенные выше, и L представляет низший алкил.
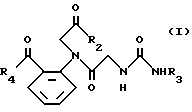
Исходное вещество (VIII) может получаться с помощью сочетания ортоиоданилина и Cbz глицина с получением амидного соединения, а затем деблокирования амидного соединения. Реакция между соединением (VIII) и производным изоцианата (VII) осуществляется при комнатной температуре в присутствии основания, такого как триэтиламин, в подходящем растворителе. Затем, как упоминается в способе 1, амид (IX) подвергается реакции с галогенидом (V), в результате чего синтезируется иодид (X). Иодид X подвергается взаимодействию с гексаалкилдиоловом в присутствии трансбензилхлорбистрифенилфосфинпалладиевого и тетраэтиламмонийхлоридного катализаторов с получением соединения алкилолова (XI). Соединение олова (XI) подвергается взаимодействию с хлорангидридом кислоты в присутствии дихлорбисацетонитрилпалладиевого катализатора с получением соединения (I).
Способ 4.
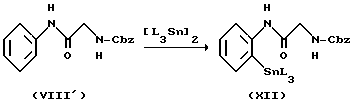
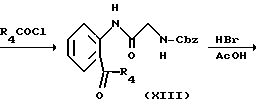

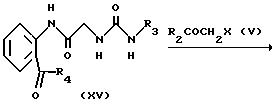
в котором R1, R2, R3, R4, L и X имеют значения, определенные выше, Cbz представляет бензилоксикарбонил.
Как описано в случае способа 3, иодид (VIII') подвергается взаимодействию с гексаалкилдиоловом с получением соединения алкилолова (XII). Затем соединение (XII) подвергается взаимодействию с хлорангидридом кислоты с получением кетона (XIII), и кетон подвергается деблокированию с получением амина (XIII'). Амин (XIII') смешивается с изоцианатом, синтезированным in situ, с получением соединения мочевины (XV), которое затем подвергается взаимодействию с галогеновым соединением (V), как описано в случае способа 1, с получением соединения (I).
Каждый способ, описанный выше, является только частью подходящих способов получения соединения (I) настоящего изобретения. Соединение (I) настоящего изобретения можно также получить с помощью комбинирования соответствующего исходного материала с любым способом, известным в технике. Соединение (I), полученное таким образом, также может охватываться объемом настоящего изобретения.
Соединение (I) настоящего изобретения может образовывать соли с обычной неорганической кислотой или органической кислотой, или неорганическим или органическим основанием. Соли соединения (I) включают соли с щелочными металлами, такими как натрий и калий, или со щелочно-земельными металлами, такими как кальций и магний; соли с органическим основанием, таким как аммоний, триэтиламин, триметиламин, пиридин, пиколин, дициклогексиламин и N,N-дибензилэтилендиамин; соли с органическими кислотами, такими как уксусная кислота, малеиновая, винная кислота, метансульфоновая кислота, бензолсульфоновая кислота, муравьиная, толуолсульфоновая и трифторуксусная кислота; соли с неорганическими кислотами, такими как соляная, бромисто-водородная, серная и фосфорная кислота; и соли с аминокислотами, такими как аргинин, аспарагиновая кислота и глютаминовая кислота. Предпочтительными солями являются обычные неорганические соли.
Функция карбамоилметилмочевинового производного (I) по настоящему изобретению препятствовать секреции кислоты подтверждена экспериментами in vivo (см. Schild Method; эксперимент N 1, ниже). Затем в отношении разнообразных соединений осуществлялись эксперименты in vivo, касающиеся антагонистического действия в отношении гастринового рецептора и антагонистического действия по отношению к CCK-B-рецептору, и эксперименты показали, что карбамоилметилмочевиновое производное (I) оказывает эти два действия ( см. эксперимент N 2, ниже). Из результатов этих экспериментов очевидно, что карбамоилметилмочевиновое производное (I) обладает функцией препятствовать секреции кислоты и является превосходным антагонистом гастринового рецептора и/или антагонистом CCK-B-рецептора, который имеет достаточные функциональные отличия от CCK-A-рецептора.
Таким образом, карбамоилметилмочевиновые производные соединения согласно настоящему изобретению и их соли имеют высокое сродство к гастриновому рецептору и/или CCK-B-рецептору, а также обладают ингибирующим действием in vivo в отношении секреции кислоты, вызываемой стимуляцией пентагастрина. Соответственно, указанные производные и их соли являются полезными в качестве терапевтических медицинских средств, которые не вызывают побочного эффекта, связанного с CCK-A-рецептором, и являются эффективными в отношении заболеваний, которые вызываются расстройством функции, связанной с гастриновым рецептором, в частности таких болезней, как язва желудка, язва двенадцатиперстной кишки, гастрит, рефлюкс-эзофагит и синдром Золлингер-Эллисона. Кроме того, считается, что они оказывают действие по увеличению или поддержанию анальгетического действия, вызываемого опиоидными медицинскими средствами (анальгетический эффект, индуцируемый опиоидом), и, следовательно, можно ожидать, что они являются полезными для объединенного или комбинированного использования с анальгетиками.
Следовательно, настоящее изобретение представляет фармацевтическую композицию, содержащую соединение формулы I вместе с фармацевтически приемлемым носителем, эксципиентом и аналогичными.
Более конкретно, настоящее изобретение представляет фармацевтическую композицию, включающую терапевтически эффективное количество соединения (I) и фармацевтически приемлемый носитель, которая является полезной в качестве терапевтического средства против болезней, которые вызываются нарушением физиологической функции, регулируемой гастриновым рецептором, особенно таких, как язва желудка, язва двенадцатиперстной кишки, гастрит, рефлюкс-эзофагит и синдром Золлингер-Эллисона, не вызывая при этом побочного эффекта, связанного с CCK-A-рецептором.
В дополнение к изложенному настоящее изобретение представляет фармацевтическую композицию, включающую терапевтически эффективное количество соединения (I) и фармацевтически приемлемый носитель, которая является полезной в качестве терапевтического средства или агента, препятствующего состоянию беспокойства или страха, для лечения расстройств центральной нервной системы, вызываемых нарушением физиологической функции, регулируемой CCK-B-рецептором, например болезней, вызванных расстройством аппестата, не вызывая при этом побочного эффекта, связанного с CCK-A-рецептором. Более того считается, что соединение (I) по настоящему изобретению оказывает действие, выражающееся в увеличении или в удлинении анальгетического действия, вызываемого опиоидными средствами, и, следовательно, можно ожидать, что оно полезно в комбинированном использовании с анальгетиками.
Соединение (I) по настоящему изобретению может использоваться одно или в сочетании с другими медицинскими препаратами. Комбинационное лечение может осуществляться путем смешения соединения (I) по настоящему изобретению с одним или более фармакологически приемлемыми активными компонентами с образованием одной фармацевтической композиции или путем последовательного назначения их.
Когда соединение (I) по настоящему изобретению используется для лечения, производное может назначаться для приема орально или парентерально. Когда применяется оральное назначение, соединение по настоящему изобретению может преобразовываться в обычные готовые препаративные формы в виде твердого вещества, такого как таблетки, порошки, гранулы, капсулы и др.; в форме растворов; масляных суспензий; или в виде жидких препаративных форм, таких как сиропы, эликсиры и др. Когда применяется парентеральное назначение, соединение по настоящему изобретению может использоваться в виде масляных инъекционных форм или в виде масляной суспензионной инъекционной формы. При приготовлении этих препаративных форм могут использоваться обычные общепринятые эксципиенты, связующие агенты, смазочные вещества, водные растворы, масляные растворы, эмульгаторы, суспендирующие агенты и аналогичные, а также другие добавки, такие как предохраняющие или консервирующие агенты, стабилизаторы и аналогичные.
Дозированная форма соединения по настоящему изобретению варьирует в зависимости от способа назначения, возраста пациента, его веса и состояния и типа болезни, и в случае орального назначения она может обычно составлять примерно 5-500 мг/день/на взрослого человека, предпочтительно примерно 10-200 мг, более предпочтительно примерно 20-100, в виде 1-2 раздельных доз. В случае парентерального назначения дозированная форма может составлять примерно 1-20 мг/день/человека, более предпочтительно примерно 2-10 мг, в виде 1-2 раздельных доз.
Следующие примеры предоставляются для дальнейшей иллюстрации настоящего изобретения подробно, но они служат только целям иллюстрации и не должны рассматриваться как ограничивающие объем настоящего изобретения.

2a: R1 = H,
b: R1 = Me, (R)
c: R1 = Me, (S)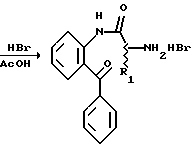
3a: R1 = H,
b: R1 = Me, (R)
c: R1 = Me, (S)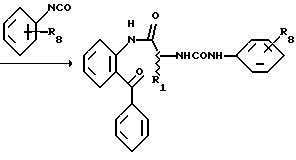
4a: R1 = H,
b: R1 = Me, (R)
c: R1 = Me, (S)
Получение 1. 2-(Бензилоксикарбонилглициламино) бензофенон 2a.
1). Триэтиламин (26 мл) выливают при охлаждении льдом в смесь 2-аминобензофенона (12 г, 60,8 ммоль), N-бензилоксикарбонил (Cbz) глицина (12,73 г, 60,8 ммоль), гидрохлорида 1-(3-диметиламинопропил)- 3-этилкарбодиимида (12,25 г, 63,9 ммоль) и 1-гидроксибензотриазола (1,07 г, 7,9 ммоль) в тетрагидрофуране (250 мл). Смесь перемешивают на протяжении ночи при комнатной температуре. Смесь выливают в воду, а затем полученную в результате смесь экстрагируют этилацетатом. Экстракт перегоняют при пониженном давлении. Остаток перекристаллизовывают из 2-пропанола.
Выход 65%, т.пл. 115-117oC.
ИК νмакс (KBr): 3306, 1693, 1637, 1534, 1521 см-1.
ЯМР (CDCl3) δ: 4,07 (2Н, д, J=5,8 Гц), 5,17 (2H, с), 5,52 (1Н, шир. с), 7,1-7,69 (9Н, м), 8,63 (1Н, д, J=8,6 Гц), 11,36 (1Н, шир. с).
Элементный анализ (C23H20N2O4):
Вычислено: C 71,12; H 5,19; N 7,21.
Найдено: С 71,35; H 5,36; N 7,28.
2). Тионилхлорид (4 мл, 55 ммоль) добавляют по каплям к раствору N-бензилоксикарбонилглицина (12,6 г, 60 ммоль) в гексаметилфосфонилтриамиде (70 мл) и ацетонитриле (20 мл) при перемешивании при -4-5oC, и перемешивание при -5oC продолжают еще в течение 10 минут. К реакционной смеси добавляют 2-аминобензофенон (9,86 г, 50 ммоль) в виде пяти порций, и смесь перемешивают при комнатной температуре в течение 3 часов. Реакционную смесь нейтрализуют насыщенным водным раствором бикарбоната натрия и экстрагируют этилацетатом. Органическую фазу промывают водой, сушат (сульфатом магния), а затем концентрируют при пониженном давлении. Получающийся сырой продукт перекристаллизовывают из гексана, получая целевое соединение 2а (18,89 г, 97,3%).
Получение 2. (-)- и (+)-2-(Бензилоксикарбонилаланиламино)бензофенон 2b, 2c.
Ту же самую процедуру, что и в получении 1, осуществляют с использованием N-бензилоксикарбонил-L-аланина и получают соединение 2b (-)-типа. Выход 74,0%, т.пл. 95oC.
[α]
ИК νмакс (KBr): 3290, 1728, 1697, 1585, 1512 см-1.
ЯМР (CDCl3) δ: 1,52 (3H, д, J=7,0 Гц), 4,45 (1Н, м), 5,14 (2Н, с), 5,45 (1Н, д, J=5,0 Гц), 7,12 (1Н, дт, J=1,8, 8,0 Гц), 7,2-7,7 (13Н, м), 8,65 (1Н, д, J=10,0 Гц).
Элементный анализ (C24H22N2O4):
Вычислено: С 71,63; H 5,51; N 6,96.
Найдено: С 71,64; H 5,49; N 6,99.
Соединение 2c (+)-типа также получают с помощью использования N-бензилоксикарбонил-L-аланина в качестве исходного материала таким же образом, как соединение 2b (-)-типа.
[α]
Получение 3. Гидробромид 2-(глициламино)бензофенона 3a.
Смесь N-бензилоксикарбонильного производного 2а (3,13 г, 8,06 ммоль), полученного в получении 1, и раствор 30%-ной бромисто-водородной кислоты в уксусной кислоте перемешивают в течение 1 часа. Добавляют избыток эфира и полученный в результате осадок отфильтровывают. После промывания эфиром, осадок сушат, получая 2,50 г (92%) гидробромата (соединение 3а).
ЯМР (CDCL3) δ: 3,42 (2Н, шир. с), 4,11 (2Н, шир. с), 6,95 (1Н, т, J=7,8 Гц), 7,3-8,22 (9Н, м), 10,80 (1Н, шир. с).
Получение 4. (-)- и (+)-2-(Аланиламино)бензофенон-гидробромид 3b, 3c.
Соединения 2b и 2c, полученные в получении 2, используют в качестве исходных материалов и обрабатывают, как описано в приведенном выше получении 3, получая целевые соединения 3b и 3c соответственно.
Получение 5. 2-(N'-(м-Толил)уреидометилкарбониламино)бензофенон 4а.
Раствор м-толилизоцианата (0,846 г, 6,35 ммоль) в диметилформамиде (3 мл) добавляют к раствору соли 3а, полученной в получении 3 (1,937 г, 5,78 ммоль) в диметилформамиде (8 мл). Добавляют триэтиламин (32 мл) при 0oC. Смесь перемешивают при 0oC в течение 30 минут и затем при комнатной температуре на протяжении ночи. Добавляют воду, а затем 10%-ную соляную кислоту. Смесь экстрагируют этилацетатом. Экстракт промывают водой и сушат (сульфатом натрия), а затем растворитель отгоняют при пониженном давлении. Остаток перекристаллизовывают из ацетонитрила и получают целевое соединение 4а (1,39 г, выход 62%).
ИК νмакс (KBr): 3310, 1684, 1639, 1590, 1523 см-1.
ЯМР (CDCl3) δ: 2,21 (3H, с), 4,07 (2Н, д, J=5,4 Гц), 5,93 (1Н, т, J=5,7 Гц), 6,83 (1Н, м), 7,07-7,65 (13Н, м), 8,56 (1Н, д, J=8,8 Гц), 11,20 (1Н, с).
Элементный анализ (C23H21N3O3):
Вычислено: С 71,30; H 5,46; N 10,85.
Найдено: С 71,45; H 5,54; N 10,90.
Получение 6. (+)- и (-)-2-(1-(N'-(м-Толил)уреидо)этилкарбамоил)- бензофенон 4b, 4c.
Соединения 3b и 3c, полученные в получении 4, используют в качестве исходных материалов и обрабатывают как описано в получении 5, получая соответственно соответствующие соединения 4b и 4c.
Соединение (4b).
Выход 75,0%, т.пл. 160oC.
[α]
ИК νмакс (нуйол): 3298, 1683, 1651, 1636, 1582, 1552 см-1.
ЯМР (CDCl3) δ: 1,45 (3H, д, J=7,0 Гц), 2,19 (3H, c), 4,61 (1H, кви, J= 7,0 Гц), 5,95 (1H, шир. с), 6,79 (1Н, шир. с), 7,0-7,7 (12Н, м), 8,55 (1Н, д, J=8,6 Гц), 11,32 (1Н, с).
Элементный анализ (C24H23N3O3):
Вычислено: С 71,80; H 5,77; N 10,49.
Найдено: С 71,63; H 5,88; N 10,55.
Соединение (4c).
[α]
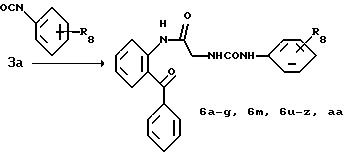
R8=a: -COOCH2Ph, b: -COOCH2CH=CH2, c: -CH2COOCH2CH=CH2, d: -OCH2COOCH2CH= CH2, e: -SCH2COOCH2CH=CH2, 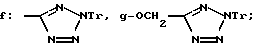 -CH2COOMe, t: -CF3, u: m-Cl, v: m-Br, w: m-CN, x: m-OCH3, y: p-Cl, z: p-Me, aa: H.
-CH2COOMe, t: -CF3, u: m-Cl, v: m-Br, w: m-CN, x: m-OCH3, y: p-Cl, z: p-Me, aa: H.
Получение 7. 2-(N'-(м-(Бензилоксикарбонил)фенил)уреидометилкарбамоил) бензофенон 6a.
Таким же образом, как описано в получении 5, целевое соединение получают при использовании соединения 3a, полученного в получении 3, и соответствующего изоцианата. T.пл. 157-159oC.
ИК νмакс (KBr): 3360, 1720, 1680, 1635, 1584, 1560, 1520 см-1.
ЯМР (DMCO-d6) δ: 3,74 (2H, д, J=5,2 Гц), 5,33 (2Н, с), 6,51 (1Н, шир. с), 7,20-7,70 (16Н, м), 7,88 (1Н, д, J=8,8 Гц), 8,06 (1Н, шир. с), 9,13 (1Н, с), 10,53 (1Н, с).
Элементный анализ (в виде C30H25N3O5):
Вычислено: С 71,00; H 4,97; N 8,28.
Найдено: С 71,15; H 5,06; N 8,30.
Получение 8. 2-(N'-(м-(Пропенилксикарбонил)фенил) уреидометилкарбамоил)бензофенон 6b.
Таким же образом, как в случае получения 7, целевое соединение получают из соединения 3a и соответствующего изоцианата. T.пл. 68-71oC.
ИК νмакс (KBr): 3350, 1718, 1692, 1659, 1595, 1580, 1557, 1520 см-1.
ЯМР (CDCl3) δ: 4,12 (2Н, д, J=5,6 Гц), 4,77 (2Н, д, J=5,6 Гц), 5,20-5,43 (2Н, м), 5,88-6,10 (2Н, м), 7,04-7,18 (3H, м), 7,36-7,70 (10Н, м), 7,90 (1Н, шир. с), 8,54 (1Н, д, J=8,6 Гц).
Элементный анализ (C26H23N3O5):
Вычислено: С 68,26; H 5,07; N 9,19.
Найдено: С 68,30; H 5,19; N 9,16.
Получение 9. 2-(N'-(м-(2-Пропенилксикарбонилметил) фенил)уреидометилкарбамоил)бензофенон 6c.
Таким же образом, как описано в получении 7, целевое соединение получают из соединения 3a и соответствующего изоцианата. T.пл. 125-127oC.
ИК νмакс (KBr): 3330, 1740, 1682, 1639, 1600, 1560, 1520 см-1.
ЯМР (CDCl3) δ: 3,55 (2H, с), 4,08 (2Н, д, J=5,8 Гц), 4,56 (2Н, д, J=5,8 Гц), 5,13-5,32 (2Н, м), 6,91-5,98 (2Н, м), 6,91-6,99 (1Н, м), 7,05-7,32 (6Н, м), 7,38-7,70 (7Н, м), 8,57 (1Н, д, J=8,6 Гц).
Элементный анализ (C27H25N3O5):
Вычислено: С 68,78; H 5,34; N 8,91.
Найдено: С 68,89; H 5,46; N 8,88.
Получение 10. 2-(N'-(м-(2-Пропенилоксикарбонилметилокси)фенил)- уреидометилкарбамоил)бензофенон 6d.
Таким же образом, как описано в получении 7, целевое соединение получают из соединения 3a и соответствующего изоцианата. T.пл. 147-149oC.
ИК νмакс (KBr): 3330, 1748, 1680, 1653, 1638, 1605, 1563, 1530, 1500 см-1.
ЯМР (CDCl3) δ: 4,11 (2H, д, J=5,8 Гц), 4,58 (2Н, с), 5,18-5,37 (2Н, м), 5,70-5,99 (2Н, м), 6,60 (1Н, дд, J=7,6, 2,6 Гц), 6,90 (1Н, д, J=9,0 Гц), 7,05-7,18 (4Н, м), 7,40-7,71 (7Н, м), 8,59 (1H, д, J=10,0 Гц), 11,28 (1Н, с).
Элементный анализ (C27H25N3O6):
Вычислено: С 66,52; H 5,17; N 8,62.
Найдено: С 66,54; H 5,25; N 8,66.
Получение 11. 2-(N'-(м-(2-Пропенилоксикарбонилметилтио)фенил)- уреилометилкарбамоил)бензофенон 6e.
Целевое соединение получают из соединения 3a и соответствующего изоцианата таким же образом, как описано в получении 7.
ИК νмакс (CHCl3): 3350, 1733, 1682, 1640, 1584, 1521 см-1.
ЯМР (CDCl3) δ: 3,60 (2Н, с), 4,09 (2Н, д, J=5,6 Гц), 4,47-4,62 (2Н, м), 5,10-5,31 (2Н, м), 5,70-5,93 (1Н, м), 6,00-6,15 (1Н, шир. с), 6,92-7,20 (4Н, м), 7,32-7,71 (9Н, м), 8,56 (1Н, д, J=8,6 Гц).
Элементный анализ (C27H25N3O5S):
Вычислено: С 63,94; H 5,05; N 8,28; S 6,32.
Найдено: С 63,96; H 5,18; N 8,24; S 6,29.
Получение 12. 2-(N'-(м-(2-(Трифенилметил)тетразол-5-ил)фенил)- уреидометилкарбамоил)бензофенон 6f.
Целевое соединение получают таким же образом, как описано в получении 5, с использованием изоцианата, который получают на месте из 3-амино-(1Н-(трифенилметил)тетразол-5-ил)бензола (567 мг, 3,52 ммоль), полученного из 3-аминобензонитрила в соответствии со способом, описанным в EPO 508769 A1, и соединения 3a. Порошок.
ИК νмакс (KBr): 3375, 1695, 1660, 1640, 1595, 1580, 1560, 1513 см-1.
ЯМР (CDCl3) δ: 4,06 (2Н, д, J=5,8 Гц), 5,91 (1Н, шир. с), 6,95- 7,80 (28Н, м), 7,91 (1Н, с), 8,50 (1Н, д, J=10,0 Гц).
Элементный анализ (C42H33N7O3• 0,5H2O):
Вычислено: С 72,82; H 4,95; N 14,15.
Найдено: С 72,92; H 5,17; N 13,16.
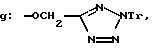
Получение 13. 2-(N'-(м-(2-Трифенилметил)тетразол-5-илметилокси)- фенил)уреидометилкарбониламино)бензофенон 6g.
Целевое соединение получают из соединения 3a и изоинаната, полученного на месте из 3-амино-(1Н-(трифенилметил)тетразолил)- метоксибензола и трифосгена.
ИК νмакс (KBr): 3380, 1690, 1660, 1639, 1600, 1580, 1553, 1520 см-1.
ЯМР (CDCl3) δ: 4,04 (2Н, д, J=5,8 Гц), 5,24 (2Н, с), 5,93 (1Н, т, J=5,8 Гц), 6,61-6,69 (1Н, м), 6,88-7,65 (24Н, м), 8,59 (1Н, д, J=8,8 Гц), 11,28 (1Н, с).
Элементный анализ (C43H35N7O4• 0,5CH3C6H5):
Вычислено: С 73,50; H 5,17; N 12,90.
Найдено: С 73,30; H 5,37; N 12,90.
Получение 14. 2-(N'-(м-(2-Трифторметилфенил)уреидометилкарбониламино) бензофенон 6t.
Целевое соединение получают при использовании соединения 3a, полученного в получении 3, и м-(трифторметил)фенилизоцианата таким же образом, как в получении 5. Выход 74%, т.пл. 177-178oC.
ЯМР (CDCl3) δ: 4,15 (2Н, с), 5,97-6,32 (1Н, шир. с), 7,30-7,73 (13Н, м), 8,53 (1Н, д, J=8,6 Гц), 11,27 (1Н, с).
Получение 15. 2-(N'-(м-Хлорфенил)уреидометилкарбониламино)бензофенон 6u.
Раствор м-хлорфенилизоцианата (756 мг, 4,92 ммоль) в тетрагидрофуране (8 мл) добавляют к раствору соли 3a (1,341 г, 4 ммоль), полученной в получении 3 в тетрагидрофуране (50 мл). При 0oC добавляют триэтиламин (1,67 мкл, 12 ммоль) и смесь перемешивают при 0oC в течение 30 минут, а затем при комнатной температуре на протяжении ночи. Добавляют воду, а затем 10%-ную соляную кислоту и смесь экстрагируют этилацетатом. Экстракт промывают водой, сушат (сульфатом натрия) и перегоняют при пониженном давлении для удаления растворителя. Остаток перекристаллизовывают из смеси дихлорметан/диизопропиловый спирт, получая целевое соединение 6u (1,43 г, выход 73%).
ИК νмакс (KBr): 1691, 1639, 1593, 1556, 1523 см-1.
ЯМР (CDCl3) δ: 4,08 (2Н, с), 6,90-7,33 (5H, м), 7,40-7,73 (8Н, м), 8,54 (1Н, д, J=8,2 Гц), 11,21 (1Н, с).
Получение 16. 2-(N'-(м-Бромфенил)уреидометилкарбониламино)бензофенон 6v.
Раствор соединения 3a (1,341 г, 4 ммоль), полученного в получении 3, в тетрагидрофуране (10 мл) добавляют при охлаждении льдом к раствору м-бромизоцианата, который получают в соответствии с методом, описанным в EP-508796-A1, из раствора м-броманилина (846 мг, 4,92 ммоль), трифосгена (551 мг, 1,72 ммоль) и триэтиламина (960 мкл, 6,9 ммоль) в тетрагидрофуране (50 мл). Дополнительно добавляют триэтиламин (558 мкл, 4 ммоль) и смесь обрабатывают по способу, аналогичному описанному в получении 5, получая соединение 6v (1,45 г, выход 68%).
ИК νмакс (KBr): 1682, 1638, 1590, 1554, 1523 см-1.
ЯМР (CDCl3 + CD3OD) δ: 4,10 (2H, д, J=5,7 Гц), 6,11 (1Н, шир. с), 6,99-7,30 (5Н, м), 7,41-7,70 (8Н, м), 8,54 (1Н, д, J=8,4 Гц), 11,23 (1Н, с).
Получение 17. 2-(N'-(м-Цианофенил)уреидометилкарбониламино)-бензофенон 6w.
Раствор соединения 3a (1,341 г, 4 ммоль), полученного в получении 3, в тетрагидрофуране (10 мл) добавляют при охлаждении льдом к раствору м-бромизоцианата, который получают согласно методу, описанному в EP-508796-A1, из раствора м-цианоанилина (581 мг, 4,92 ммоль), трифосгена (551 мг, 1,72 ммоль) и триэтиламина (960 мкл, 6,9 ммоль) в тетрагидрофуране (50 мл). Дополнительно добавляют триэтиламин (558 мкл, 4 ммоль) и осуществляют обработку по способу, аналогичному описанному в получении 5, получая соединение 6w (1,4 г, выход 88%).
ИК νмакс (KBr): 2230, 1686, 1638, 1603, 1589, 1558, 1522 см-1.
ЯМР (CDCl3 + CD3OD) δ: 4,09 (2Н, д, J=5,7 Гц), 7,09-7,72 (13Н, м), 8,53 (1Н, д, J=8,7 Гц), 11,22 (1Н, с).
Получение 18. 2-(N'-(м-Метоксифенил)уреидометилкарбониламино)- бензофенон 6x.
Раствор м-метоксифенилизоцианата (734 мг, 4,92 ммоль) в тетрагидрофуране (8 мл) добавляют к раствору соли 3a (1,341 г, 4 ммоль), полученной в получении 3, в тетрагидрофуране (50 мл). При 0oC добавляют триэтиламин (558 мкл, 4 ммоль) и смесь перемешивают при 0oC в течение 30 минут, а затем при комнатной температуре на протяжении ночи. Добавляют воду, а затем 10%-ную соляную кислоту и смесь экстрагируют этилацетатом. Экстракт промывают водой, сушат (сульфатом натрия) и перегоняют при пониженном давлении для удаления растворителя. Остаток перекристаллизовывают из дихлорметана/диизопропилового эфира, получая целевое соединение 6x (1,29 г, 80%).
ИК νмакс (KBr): 1693, 1640, 1619, 1606, 1591, 1560, 1515 см-1.
ЯМР (CDCl3) δ: 3,68 (3H, с), 4,08 (2Н, д, J=2,9 Гц), 5,99 (1Н, д, J=5,8 Гц), 6,56 (1Н, дд, J=8,0, 1,8 Гц), 6,79 (1Н, дд, J=7,4, 1,0 Гц), 7,00-7,16 (3H, м), 7,37-7,69 (8Н, м), 8,55 (1Н, д, J=7,8 Гц), 11,27 (1Н, с).
Получение 19. 2-(N'-(п-Хлорфенил)уреидометилкарбониламино)- бензофенон 6y.
Раствор п-хлорфенилизоцианата (756 мг, 4,92 ммоль) в тетрагидрофуране (8 мл) добавляют к раствору соли 3а (1,341 г, 4 ммоль), полученной в получении 3, в тетрагидрофуране (50 мл). При 0oC добавляют триэтиламин (558 мкл, 4 ммоль) и смесь перемешивают при 0oC в течение 30 минут, а затем при комнатной температуре на протяжении ночи. Добавляют воду, а затем 10%-ную соляную кислоту и смесь экстрагируют этилацетатом. Экстракт промывают водой, сушат (сульфатом натрия) и перегоняют при пониженном давлении для удаления растворителя. Остаток перекристаллизовывают из дихлорметана и диизопропилового эфира, получая целевое соединение 6y (1,48 г, 76%).
ИК νмакс (KBr): 1686, 1636, 1591, 1558, 1522 см-1.
ЯМР (CDCl3 + CD3OD) δ: 4,06 (2Н, д, J=5,7 Гц), 6,31 (1Н, т, J=6,0 Гц), 7,11-7,70 (13Н, м), 8,52 (1Н, д, J=7,5 Гц).
Получение 20. 2-(N'-(п-Толил)уреидометилкарбониламино)-бензофенон 6z.
Раствор п-толилизоцианата (655 мг, 4,92 ммоль) в тетрагидрофуране (8 мл) добавляют к раствору соли 3a (1,341 г, 4 ммоль), полученной в получении 3, в тетрагидрофуране (50 мл). При 0oC добавляют триэтиламин (558 мкл, 4 ммоль) и смесь перемешивают при 0oC в течение 30 минут, а затем при комнатной температуре на протяжении ночи. Добавляют воду, а затем 10%-ную соляную кислоту и смесь экстрагируют этилацетатом. Экстракт промывают водой, сушат (сульфатом натрия), а затем растворитель отгоняют при пониженном давлении. Остаток перекристаллизовывают из дихлорметана и диизопропилового эфира, получая целевое соединение 6z (1,311 г, 85%).
ИК νмакс (KBr): 1685, 1639, 1604, 1593, 1555, 1519 см-1.
ЯМР (CDCl3) δ: 2,27 (3H, c), 4,07 (2H, д, J=6,0 Гц), 5,93 (1H, шир. с), 7,0-7,29 (6H, м), 7,43-7,68 (7H, м), 8,65 (1Н, д, J=8,4 Гц), 11,22 (1Н, с).
Получение 21. 2-(N'-Фенилуреидометилкарбониламино)бензофенон 6aa.
Раствор фенилизоцианата (440 мг, 3,69 ммоль) в тетрагидрофуране (8 мл) добавляют к раствору соли 3a (1,005 г, 3 ммоль), полученной в получении 3, в тетрагидрофуране (50 мл). При 0oC добавляют триэтиламин (911 мг, 9 ммоль) и смесь перемешивают при 0oC в течение 30 минут, а затем при комнатной температуре на протяжении ночи. Добавляют воду, а затем 10%-ную соляную кислоту и смесь экстрагируют этилацетатом. Экстракт промывают водой, сушат (сульфатом натрия), а затем растворитель отгоняют при пониженном давлении. Остаток перекристаллизовывают из смеси дихлорметан/диизопропиловый эфир, с получением целевого соединения 6аа (750 мг, 67%).
ИК νмакс (KBr): 1685, 1638, 1595, 1583, 1556, 1523 см-1.
ЯМР (CDCl3 + CD3OD) δ: 4,07 (2H, с), 6,93-7,70 (14Н, м), 8,54 (1Н, т, J= 8,4 Гц), 11,22 (1Н, с).



R8 = a: -CH3, b: -CF3, c: -COOCH2CH=CH2.
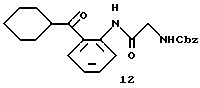
Получение 22. Циклогексил-(2-бензилоксикарбониламинометилкарбамоил) фенил)кетон 12.
Согласно методу, описанному в получении 1, целевое соединение получают при использовании циклогексил-(2-аминофенил)кетона 11, который описан в литературе [M. S. Chambers, S.C. Hobbs, S.R. Fletcher, V.G. Matassa, P.J. Mitchell, A. P. Watt, R. Baker, S.B. Freedman, S. Patel and A.J. Smith, Bioorg.Med.Chem.Lett., 3, 1919 (1993)].
ИК νмакс (KBr): 3324, 1669, 1694, 1641, 1602, 1582, 1517 см-1.
ЯМР (CDCl3) δ: 1,13-1,61 (5Н, м), 1,69-1,94 (5Н, м), 3,31 (1Н, м), 4,09 (1Н, д, J= 5,6 Гц), 5,20 (2Н, с), 5,49 (1Н, м), 7,14 (1Н, т, J=8,2 Гц), 7,20-7,48 (5Н, м), 7,55 (1Н, д, J=8,2 Гц), 7,93 (1Н, д, J=8,0 Гц), 8,72 (1Н, д, 8,6 Гц).
Элементный анализ (C23H26N2O4• 0,2H2O):
Вычислено: С 69,40; H 6,68; N 7,04.
Найдено: С 69,42; H 6,58; N 7,06.
Получение 23. Гидробромид циклогексил-(2-(аминометилкарбамоил)- фенил)кетона 13.
В соответствии с методом, описанным в получении 3, целевое соединение получают при использовании соединения 12, полученного в указанном выше получении. T.пл. 193-196oC.
ИК νмакс (KBr): 3432, 1702, 1645, 1605, 1588, 1533 см-1.
Элементный анализ (C15H21BrN2O2• 0,4H2O):
Вычислено: С 51,70; H 6,31; Br 22,93; N 8,04.
Найдено: С 51,88; H 6,05; Br 22,86; N 8,04.
Получение 24. Циклогексил-(2-(N'-(толил)уреидометилкарбамоил)- фенил)кетон 14а.
В соответствии с методом, описанным в получении 5, целевое соединение получают при использовании бромгидрата циклогексил-(2-(аминометилкарбамоил)фенил)кетона 13 и м-толилизоцианата. T.пл. 192-193oC.
ИК νмакс (KBr): 3328, 1669, 1644, 1594, 1583, 1559, 1518 см-1.
ЯМР (CDCl3 + CD3OD) δ: 1,05-1,52 (5H, м), 1,62-1,89 (5H, м), 2,32 (3H, с), 4,02 (2Н, с), 6,85 (1Н, д, J=6,0 Гц), 7,09-7,31 (4Н, м), 7,55 (1Н, м), 7,95 (1Н, д, J=9,6 Гц), 8,65 (1Н, д, J=8,6 Гц).
Элементный анализ (C23H27N2O3• 0,2H2O):
Вычислено: С 69,57; H 6,95; N 10,58.
Найдено: С 69,37; H 6,85; N 10,53.
Получение 25. Циклогексил-(2-(N'-(м-трифторметилфенил) уреидометилкарбамоил)фенил)кетон 14b.
Целевое соединение получают в соответствии с методом, описанным в получении 5, с использованием гидробромида циклогексил-(2-(аминометилкарбамоил) фенил)кетона 13 и м-(трифторметил)фенилизоцианата. T.пл. 207-209oC.
ИК νмакс (KBr): 3343, 1661, 1605, 1581, 1565, 1524 см-1.
ЯМР (CDCl3 + CD3OD) δ: 1,13 (1Н, м), 1,23-1,48 (4Н, м), 1,65-1,89 (5Н, м), 3,28 (1Н, м), 4,11 (2Н, с), 7,10-7,41 (3H, м), 7,48- 7,68 (2Н, м), 7,71 (1Н, с), 7,90 (1Н, д, J=8,2 Гц), 8,68 (1Н, д, J=8,6 Гц).
Элементный анализ (C23H24F3N3O3):
Вычислено: С 61,74; H 5,41; N 9,39.
Найдено: С 61,70; H 5,45; N 9,40.
Получение 26. Циклогексил-(2-(N'-(м-(аллилоксикарбонил) уреидометилкарбамоил)фенил)кетон 14c.
Целевое соединение получают в соответствии со способом, описанным в получении 5, с использованием бромгидрата циклогексил-(2-(аминометилкарбамоил)фенил)кетона (13) и м-(аллилоксикарбонил)фенилизоцианата. T.пл. 188-190oC.
ИК νмакс (KBr): 3335, 1720, 1660, 1582, 1557, 1524 см-1.
ЯМР (CDCl3) δ: 1,03-1,52 (5Н, м), 1,53-1,91 (5Н, м), 3,23 (1Н, м), 4,17 (2Н, д, J=6,0 Гц), 4,79 (2Н, д, J=5,8 Гц), 5,15-5,48 (2Н, м), 5,82-6,13 (2Н, м), 7,12 (1Н, м), 7,31 (1Н, т, J=13,5 Гц), 7,49 (1Н, м), 7,70 (1Н, м), 7,96 (1Н, м), 8,69 (1Н, д, J=9,4 Гц), 12,18 (1Н, с).
Элементный анализ (C26H29N3O5):
Вычислено: С 67,37; H 6,31; N 9,07.
Найдено: С 67,53; H 6,36; N 9,12.



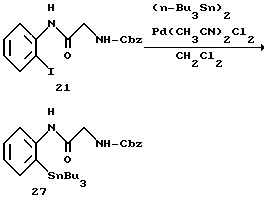
Получение 27. N-(2-Иодфенил)-2-(бензилоксикарбониламино)-ацетамид 21.
Хлорокись фосфора (2,2 мл, 24 ммоль), имидазол (2,7 г, 40 ммоль) и N-бензилоксикарбонилглицин (5,0 г, 24 ммоль) добавляют к диметилацетамиду (32 мл) при охлаждении льдом и перемешивании. После перемешивания в течение 5 минут по каплям добавляют раствор 2-иоданилина (4,4 г, 20 ммоль) в ДМА (10 мл). Реакционную смесь перемешивают при 50oC в течение 3 часов. После того как реакционной смеси дают остыть, к ней добавляют воду и этилацетат и добавляют насыщенный водный раствор бикарбоната натрия для доведения pH до 9 и водную фазу экстрагируют дважды этилацетатом. Органический слой промывают насыщенным солевым раствором, сушат над безводным сульфатом магния, а затем концентрируют. К остатку добавляют изопропиловый эфир (40 мл), и выпавшее в осадок твердое вещество отфильтровывают и получают целевое соединение (7,10 г). Выход 86%.
ЯМР (CDCl3) δ: 4,06(2Н, д, J=5,8 Гц), 5,19 (2Н, с), 5,44 (1Н, шир. с), 6,80-6,9 (1Н, м), 7,20-7,45 (6Н, м), 7,76 (1Н, д, J=8,0 Гц), 8,12 (1Н, шир. с), 8,21 (1Н, д, J=8,0 Гц).
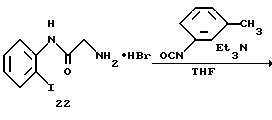
Получение 28. Гидробромид 2-амино-N-(2-иодфенил)ацетамида 22.
Целевое соединение (5,2 г) получают в соответствии со способом, описанным в получении 5, при использовании соединения 21 (6,15 г). Выход 96%.
ЯМР (CDCl3 δ: 3,94 (2H, с), 6,99-7,07 (1Н, м), 7,37-7,45 (1Н, м), 7,55 (1Н, д, J=8,2 Гц), 7,92 (1Н, д, J=8,0 Гц).
Получение 29. N-(2-Иодфенил)-2-(3-м-толилуреидо)ацетамид 23.
Целевое соединение (3,05 г) получают в соответствии со способом, описанным в получении 5, с использованием соединения 2 (2,67 г) и м-толилизоцианата (0,96 мл). Выход 100%.
ЯМР (DMCO-d6) δ: 2,25 (3H, с), 3,95 (2Н, д, J=5,4 Гц), 6,48-6,55 (1Н, м), 6,73 (1Н, д, J=6,8 Гц), 6,93-7,45 (5Н, м), 7,61 (1Н, дд, J=1,4, 8,1 Гц), 7,88 (1Н, дд, J=1,4, 8,0 Гц), 8,79 (1Н, с), 9,45 (1Н, с).
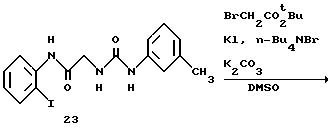
Получение 30. Трет-бутил ((2-иодфенил)-(2-(3-м-толилуреидо) ацетил)амино) ацетат 24.
К раствору N-(2-иодфенил)-2-(3-м-толилуреидо)ацетамида (1,02 г, 2,5 ммоль) в ДМСО (5 мл) добавляют при комнатной температуре иодид калия (83 мг, 0,2 ммоль), тетра-н-бутиламмонийбромид (81 мг, 0,1 ммоль), трет-бутилбромацетат (0,55 мл, 3,75 ммоль) и карбонат калия (1,04 г, 7,5 ммоль) и все перемешивают при комнатной температуре в течение 2,25 часа. К реакционной смеси добавляют воду и этилацетат, и pH доводят до 2 с помощью 2н. соляной кислоты. Водный слой экстрагируют дважды этилацетатом. Органический слой промывают 0,1н. соляной кислотой, водой и насыщенным солевым раствором, сушат над безводным сульфатом магния, а затем концентрируют. К остатку добавляют изопропиловый эфир, и выпавшее в осадок твердое вещество отфильтровывают, получая целевое соединение (1,20 г). Выход 92%.
ЯМР (CDCl3) δ: 1,45 (9Н, с), 2,35 (3H, с), 3,49 (1Н, д, J=17,6 Гц), 3,65 (1Н, дд, J=4,4 Гц, 17,6 Гц), 3,88 (1Н, дд, J=4,4 Гц, 17,7 Гц), 4,92 (1Н, д, J= 17,6 Гц), 5,78-5,82 (1Н, м), 6,59 (1Н, шир. с), 6,87 (1Н, д, J=7,4 Гц), 7,14-7,48 (5Н, м), 7,69 (1Н, д, J=7,8 Гц), 7,95 (1Н, д, J=8,2 Гц).
Получение 31. Трет-бутил ((2-триметилстаннилфенил)-(2-(3- м-толилуреидо)ацетил)амино)ацетат 25.
К раствору трет-бутилового эфира ((2-иодфенил)-(2-(3-м-толилуреидо) ацетил)амино)уксусной кислоты (52 мг, 0,1 ммоль) в толуоле (2 мл) добавляют при комнатной температуре трансбензилхлорбистрифенилфосфинпалладий (3,8 мг, 7 мкмоль), тетраэтиламмонийхлорид (3 мг, 20 мкмоль) и гексаметилдиолово (50 мг, 0,15 ммоль) и перемешивают при 85oC в течение 1 часа и при 100oC в течение 30 минут. К реакционной смеси добавляют охлажденную льдом воду и смесь перемешивают. Водный слой экстрагируют дважды этилацетатом. Органический слой промывают насыщенным солевым раствором, сушат над безводным сульфатом магния, а затем концентрируют. Остаток очищают с помощью колоночной хроматографии на силикагеле и получают целевое соединение (35 мг). Выход 64%.
ЯМР (CDCl3) δ: 0,29 (9Н, с), 1,43 (9Н, с), 2,29 (3H, с), 3,56 (1Н, д, J= 16,8 Гц), 3,80 (2Н, с), 4,79 (1Н, д, J=16,8 Гц), 6,00 (1Н, шир. с), 6,80-7,61 (9Н, м).



a: X=2-F,
b: X=4-CF3,
c: X=4-CN,
Получение 32. N-(2-Трибутилстаннилфенил)-2-(бензилоксикарбониламино) ацетамид 27.
К раствору N-(2-иодфенил)-(бензилоксикарбониламино)-ацетамида (соединения 21) (4,1 г, 0,01 моль) в дихлорметане (80 мл) добавляют при комнатной температуре дихлорбисацетонитрилпалладий (190 мг, 0,25 ммоль) и гексабутилдиолово (6,0 мл, 0,012 моль) и смесь перемешивают при комнатной температуре на протяжении ночи. К реакционной смеси добавляют водный раствор 50%-ного фторида калия и смесь перемешивают в течение 30 минут, и осадок удаляют фильтрованием. После данной процедуры, которую повторяют еще один раз, органический слой промывают насыщенным солевым раствором, сушат над безводным сульфатом магния, а затем концентрируют. Остаток очищают с помощью колоночной хроматографии на силикагеле и получают целевое соединение (4,4 г). Выход 77%.
ЯМР (CDCl3) δ: 0,83-1,65 (27Н, м), 4,03 (2Н, д, J=5,6 Гц), 5,16 (2Н, с), 5,40 (1Н, шир. с), 7,10-7,48 (1Н, м), 7,21 (1Н, д, J=8,0 Гц).
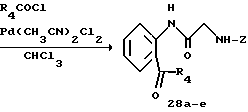
Получение 33. N-(2-(2-Фторбензоил)фенил)-2-(бензилоксикарбониламино) ацетамид 28а.
К раствору 2-фторбензоилхлорида (208 мкл, 1,74 ммоль) в хлороформе (20 мл) добавляют при комнатной температуре дихлорбисацетонитрилпалладий (15 мг, 0,044 ммоль). Затем добавляют раствор N-(2-трибутилстаннилфенил)-2-бензилоксикарбониламино)ацетамида (2 г, 1,74 ммоль) в хлороформе (3 мл) и смесь перемешивают при 50oC в течение 35 минут. Добавляют дихлорбисацетонитрилпалладий (15 мг, 0,044 ммоль) и перемешивание продолжают еще в течение 10 минут. После охлаждения смеси к реакционной смеси добавляют водный раствор 50%-ного фтористого калия и смесь перемешивают в течение 30 минут. Осадок удаляют с помощью фильтрования. После того как данную процедуру повторят еще раз, органические слои промывают насыщенным солевым раствором, сушат над безводным сульфатом магния, а затем концентрируют. Остаток очищают с помощью колоночной хроматографии на силикагеле и получают целевое соединение (570 мг). Выход 80%.
ЯМР (CDCl3) δ: 4,12 (2Н, д, J=6,0 Гц), 5,19 (2Н, с), 5,50 (1Н, шир. с), 7,05-7,66 (7Н, м), 8,74 (1Н, д, J=8,2 Гц).
Получение 34. N-(2-(4-Трифторметилбензоил)фенил)-2- (бензилоксикарбониламино)ацетамид 28b.
В соответствии со способом, используемым для получения соединения 28а, целевое соединение (592 мг) получают с использованием трет-бутил ((2-триметилстаннилфенил)-(2-(3-м-толилуреидо) ацетил)амино) ацетата (1,0 г) и 4-трифторметилбензоилхлорида (364 мг). Выход 74%.
ЯМР (CDCl3) δ: 4,10 (2Н, д, J=6,0 Гц), 5,18 (2Н, с), 5,50 (1Н, шир. с), 7,08-7,67 (8Н, м), 7,76 (4Н, с), 8,68 (1Н, д, J=8,2 Гц).
Получение 35. N-(2-(4-Цианобензоил)фенил)-2- (бензилоксикарбониламино)ацетамид 28c.
В соответствии со способом, используемым для получения соединения 28а, целевое соединение (551 мг) получают с использованием трет-бутил ((2-триметилстаннилфенил)-(2-(3-м-толилуреидо)ацетил)амино) ацетата (1,0 г) и 4-цианобензоилхлорида (289 мг). Выход 76%.
ЯМР (CDCl3) δ: 4,09 (2Н, д, J=6,0 Гц), 5,18 (2Н, с), 5,50 (1Н, шир. с), 7,08-7,69 (8Н, м), 7,74 (2Н, д, J=8,6 Гц), 7,80 (2Н, д, J=8,6 Гц), 8,68 (1Н, д, J=8,2 Гц).
Получение 36. N-(2-(Адамантан-1-карбонил)фенил)-2- (бензилоксикарбониламино)ацетамид 28d.
Целевое соединение (110 мг) получают согласно способу, используемому для получения соединения 28а, при использовании трет-бутил ((2-триметилстаннилфенил)-(2-(3-м-толилуреидо)-ацетил)амино) ацетата (2,5 г) и адамантан-1-карбонилхлорида (866 мг). Выход 6%.
ЯМР (CDCl3) δ: 1,72 (6Н, с), 2,00 (6Н, с), 2,06 (3Н, с), 4,00 (2Н, д, J= 5,8 Гц), 5,20 (2Н, с), 5,44 (1Н, шир. с), 7,09-7,68 (8Н, м), 8,28 (2Н, д, J= 8,7 Гц), 9,57 (1Н, шир. с).
Получение 37. N-(2-(1-Оксо-2-пропилпентил)фенил)-2- (бензилоксикарбониламино)ацетамид 28е.
В соответствии со способом, используемым для получения соединения 28а, целевое соединение (990 мг) получают с использованием трет-бутил ((2-триметилстаннилфенил)-(2-(3-м-толилуреидо)ацетил)амино) ацетата (2,5 г) и 2-н-пропил-н-велероилхлорида (710 мг). Выход 55%.
ЯМР (CDCl3) δ: 0,88 (6Н, т, J=7,0 Гц), 1,16-1,84 (8Н, м), 3,43-3,58 (1Н, м), 4,10 (2Н, д, J=5,4 Гц), 5,19 (2Н, с), 5,44 (1Н, шир.с), 7,10-7,62 (7Н, м), 7,94 (1Н, д, J=8,2 Гц), 8,73 (1Н, д, J=8,2 Гц).
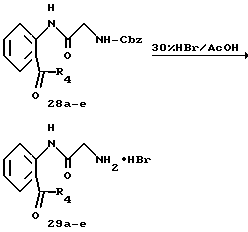
Получение 38. Гидробромид 2-амино-N-(2-(2-фторбензоил)фенил)- ацетамида 29а.
Целевое соединение (432 мг) получают в соответствии со способом, описанным в получении 3, с использованием соединения 28а (530 мг). Выход 94%.
ЯМР (CD3OD) δ: 3,88 (2Н, с), 6,99-7,07 (1Н, м), 7,18-7,70 (7Н, м), 8,20 (1Н, д, J=8,0 Гц).
Получение 39. Гидрохлорид 2-aминo-N-(2-(4-тpифтopмeтилбeнзoил)- фенил)ацетамида 29b.
В соответствии со способом, описанным в получении 3, целевое соединение (450 мг) получают с использованием соединения 28b (550 мг). Выход 93%.
ЯМР (CD3OD) δ: 3,90 (2Н, с), 7,19-7,67 (3H, м), 7,76 (2Н, д, J=8,0 Гц), 7,86 (2Н, д, J=8,0 Гц), 8,19 (1Н, д, J=8,0 Гц).
Получение 40. Гидробромид 2-амино-N-(2-(4-цианобензоил)фенил)- ацетамида 29с.
Целевое соединение (484 мг) получают в соответствии со способом, описанным в получении 3, с использованием соединения 28с (542 мг). Выход 100%.
ЯМР (CD3OD) δ: 3,76 (2Н, с), 7,29-7,88 (3H, м), 7,89 (4Н, с).
Получение 41. Гидробромид 2-амино-N-(2-(адамантан-1-карбонил)-фенил) ацетамида 29d.
Целевое соединение (61 мг) получают в соответствии со способом, описанным в получении 3, с использованием соединения 28d (100 мг). Выход 69%.
ЯМР (CD3OD) δ: 1,75 (6Н, с), 1,97 (6Н, с), 2,02 (3H, с), 3,83 (2Н, с), 7,22-7,58 (4Н, м).
Получение 42. Гидробромид 2-амино-N-(2-(1-оксо-2-пропилпентил)- фенил)ацетамида 29е.
Целевое соединение (522 мг) получают в соответствии со способом, описанным в получении 3, с использованием соединения 28е (770 мг). Выход 78%.
ЯМР (CD3OD) δ: 0,88 (6Н, т, J=7,2 Гц), 1,19-1,83 (8Н, м), 3,58-3,73 (1Н, м), 4,00 (2Н, с), 7,26-7,69 (2Н, м), 8,14 (1Н, дд, J=1,6, 8,2 Гц), 8,56 (1Н, д, J=8,2 Гц).
Получение 43. Аллил 3-(3-(2-(2-фторбензоил)фенилкарбамоилметил)- уреидо)бензоат 30а.
Целевое соединение (391 мг) получают в соответствии со способом, описанным в получении 5, с использованием в качестве исходного материала соединения 29а (432 мг) и изоцианата, который получают из гидрохлорида аллил 3-аминобензоата (261 мг) и трифосгена (145 мг). Выход 67%.
ЯМР (CDCl3) δ: 4,19 (2Н, д, J=5,4 Гц), 4,78 (2Н, д, J=5,4 Гц), 5,21-5,44 (2Н, м), 5,79-6,10 (2Н, м), 7,03-7,94 (12Н, м), 8,69 (1Н, д, J=8,2 Гц).
Получение 44. Аллил 3-(3-(2-(4-трифторметилбензоил)фенил- карбамоилметил)уреидо)бензоат 30b.
Целевое соединение (343 мг) получают в соответствии со способом, описанным в получении 5, с использованием соединения 29b (450 мг) в качестве исходного материала. Выход 65%.
ЯМР (CDCl3) δ: 4,14 (2Н, д, J=5,7 Гц), 4,76 (2Н, д, J=5,4 Гц), 5,22-5,41 (2Н, м), 5,92-6,05 (2Н, м), 7,06-7,76 (11Н, м), 7,90 (1Н, с), 8,57 (1Н, д, J=84 Гц), 11,31 (1Н, с).
Получение 45. Аллил 3-(3-(2-(4-цианобензоил)фенилкарбамоилметил)уреидо) бензоат 30с.
Целевое соединение (438 мг) получают в соответствии со способом, описанным в получении 5, с использованием в качестве исходного материала соединения 29с (472 мг). Выход 69%.
ЯМР (CDCl3) δ: 4,13 (2Н, д, J=5,7 Гц), 4,79 (2Н, д, J=5,4 Гц), 5,22-5,44 (2Н, м), 5,79-6,12 (2Н, м), 7,06-7,80 (11Н, м), 7,89 (1Н, с), 8,58 (1Н, д, J=8,4 Гц).
Получение 46. Аллил 3-(3-(2-(адамантан-1-карбонил) фенилкарбамоилметил)уреидо)бензоат 30d.
Целевое соединение (44 мг) получают в соответствии со способом, описанным в получении 5, с использованием соединения 29d (61 мг) в качестве исходного материала. Выход 55%.
ЯМР (CDCl3) δ: 1,63 (9Н, с), 1,90 (6Н, с), 4,05 (2Н, д, J=5,8 Гц), 4,81 (2Н, д, J=6,0 Гц), 5,23-5,45 (2Н, м), 5,81-6,12 (2Н, м), 7,07-7,98 (12Н, м), 8,21 (1Н, д, J=8,0 Гц).
Получение 47. Аллил 3-(3-(2-(1-оксо-2-пропилпентил)фенилкарбамоилметил) уреидо)бензоат 30e.
Целевое соединение (321 мг) получают в соответствии со способом, описанным в получении 5, с использованием соединения 29е (522 мг) в качестве исходного материала. Выход 43%.
ЯМР (CDCl3) δ: 0,83 (6Н, т, J=7,0 Гц), 1,12-1,78 (8H, м), 3,41-3,56 (1Н, м), 5,22-5,45 (2Н, м), 5,84-6,12 (2Н, м), 7,10-7,98 (12H, м), 8,71 (1Н, д, J=8,4 Гц).
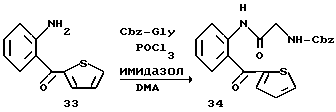
Получение 48. N-(2-(Тиофен-2-карбонил)фенил)-2- (бензилоксикарбониламино)ацетамид 34.
Целевое соединение получают с использованием соединения 33 в соответствии со способом получения соединения 21. T.пл. 115-116,5oC.
ИК νмакс (KBr): 3274, 1716, 1671, 1619, 1601, 1579, 1514 см-1.
ЯМР (CDCl3) δ: 4,04 (2Н, д, J=6,0 Гц), 5,18 (2Н, с), 5,44-5,60 (1Н, м), 7,15-7,50 (7Н, м), 7,56-7,62 (2Н, м), 7,75 (1Н, дд, J=4,8 Гц, 0,9 Гц), 7,84 (1Н, дд, J=7,8, 1,2 Гц), 8,55 (1Н, д, J=8,1 Гц), 10,80 (1Н, с).
Элементный анализ (C21H18N2O4S):
Вычислено: С 63,95; H 4,60; N 7,10; S 8,13.
Найдено: С 63,97; H 4,70; N 7,17; S 8,03.
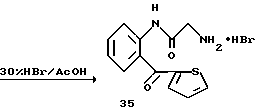
Получение 49. Гидробромид 2-амино-N-(2-(тиофен-2-карбонил)- фенил)ацетамида 35.
Целевое соединение получают с использованием соединения 34 в соответствии со способом, описанным в получении 3.
ЯМР (CDCl3 + CD3OD) δ: 5,31 (2Н, с), 7,08-7,24 (2Н, м), 7,44-7,54 (2Н, м), 7,66 (1Н, д, J=7,8 Гц), 7,74 (1Н, дд, J=5,0 Гц, 1,2 Гц), 8,09 (1Н, дд, J=8,2 Гц, 1,8 Гц), 10,35 (1Н, с).
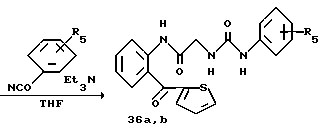
Получение 50. N-(2-(Тиофен-2-карбонил)фенил)-2-(м-толилуреидо)-ацетамид 36а.
Целевое соединение получают в соответствии со способом, описанным в получении 15, с использованием соединения 35. T.пл. 208-210oC.
ИК νмакс (KBr): 3337, 1687, 1638, 1609, 1580, 1563, 1518 см-1.
ЯМР (DMCO-d6) δ: 2,22 (3H, с), 3,79 (2Н, д, J=5,2 Гц), 6,50 (2Н, т, J= 10,8 Гц), 6,72 (1Н, дд, J=2,6 Гц, 0,8 Гц), 7,04-7,32 (5Н, м), 7,52-7,70 (3H, м), 7,94 (1Н, д, J=8,2 Гц), 8,04-8,10 (1Н, м), 8,76 (1Н, с), 10,33 (1Н, с).
Элементный анализ (C21H19N3O3S):
Вычислено: С 64,11; H 4,87; N 10,68; S 8,15.
Найдено: С 64,09; H 4,92; N 10,74; S 8,05.
Получение 51. Аллил 3-(3-(2-(тиофен-2-карбонил)фенилкарбамоилметил) уреидо)бензоат 30b.
В соответствии со способом, описанным в получении 15, целевое соединение получают с использованием соединения 35. T.пл. 140-141oC.
ИК νмакс (KBr): 3284, 1714, 1689, 1648, 1618, 1584, 1560, 1520 см-1.
ЯМР (CDCl3) δ: 4,09 (2Н, д, J=5,6 Гц), 4,77 (2Н, дт, J=5,4 Гц, 1,4 Гц), 5,25 (1Н, дд, J=10,2 Гц 1,2 Гц), 5,37 (1Н, дд, J=17,2 Гц, 1,4 Гц), 5,85-6,10 (2Н, м), 7,05-7,30 (3H, м), 7,50-7,80 (7Н, м), 7,91 (1Н, м), 8,45 (1Н, дд, J=8,2 Гц, 0,8 Гц), 10,71 (1Н, с).
Элементный анализ (C24H21N2O5S):
Вычислено: С 62,19; H 4,57; N 9,07; S 6,92.
Найдено: С 62,13; H 4,74; N 9,00; S 6,81.

a: m-Me,
b: P-COOCH2-CH=CH2.
Получение 52. N-(2-(4-Метоксибензоил)фенил)-2- (бензоилоксикарбониламино)ацетамид 40.
Целевое соединение получают в соответствии со способом получения соединения 21 с использованием соединения 39. T.пл. 97-98oC.
ИК νмакс (KBr): 3342, 1687, 1624, 1583, 1513 см-1.
ЯМР (CDCl3) δ: 3,89 (3H, с), 4,05 (2Н, д, J=6,0 Гц), 5,16 (2Н, с), 5,55-5,58 (1Н, м), 6,93-6,98 (2Н, м), 7,09-7,14 (1Н, м), 7,30-7,42 (5Н, м), 7,52-7,57 (2Н, м), 7,69-7,72 (2Н, м), 8,55 (1Н, д, J=7,5 Гц), 11,06 (1Н, с).
Элементный анализ (C24H22N2O5):
Вычислено: С 68,88; H 5,30; N 6,69.
Найдено: С 68,91; H 5,34; N 6,72.
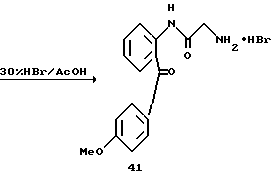
Получение 53. Гидробромид 2-амино-N-(2-(4-метоксибензоил)-фенил) ацетамида 41.
Целевое соединение получают с использованием соединения 42 в соответствии со способом, описанным в получении 3.
ЯМР (D2O) δ: 3,67 (2Н, с), 3,92 (3Н, с), 7,05-7,10 (2Н, м), 7,40-7,78 (6Н, м).
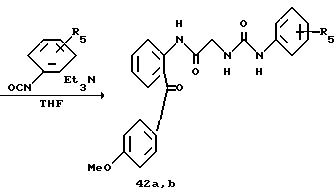
Получение 54. N-(2-(4-метоксибензоил)фенил-2-(3-м-толилуреидо)- ацетамид 42а.
Целевое соединение получают с использованием соединения 41 в соответствии со способом, описанным в получении 15. Аморфный порошок.
ИК νмакс (KBr): 3313, 2925, 2855, 1654, 1597, 1581, 1559 см-1.
ЯМР (CDCl3) δ: 2,18 (3Н, с), 3,84 (3Н, с), 4,02 (2Н, д, J=6,0 Гц), 6,10 (1Н, т, J=6,0 Гц), 6,75-6,90 (3Н, м), 7,03-7,10 (4Н, м), 7,45-7,68 (5Н, м), 8,44 (1Н, д, J=7,2 Гц), 10,94 (1Н, с).
Получение 55. Аллил 3-(3-(2-(4-метоксибензоил)фенилкарбамоилметил) уреидо)бензоат 42b.
Целевое соединение получают с использованием соединения 41 в соответствии со способом, описанным в получении 15. T.пл. 167-169oC.
ИК νмакс (KBr): 3371, 3275, 1713, 1690, 1641, 1591, 1566, 1525 см-1.
ЯМР (CBCl3) δ: 3,86 (3Н, с), 4,07 (2Н, д, J=6,0 Гц), 4,78 (2Н, дт, J=5,7 Гц, 1,2 Гц), 5,24-5,28 (1Н, м), 5,35-5,41 (1Н, м), 5,94-6,07 (1Н, м), 6,43 (1Н, т, J=5,4 Гц), 6,87-6,95 (2Н, м), 7,07-7,12 (1Н, м), 7,23-7,29 (1Н, м), 7,49-7,55 (2Н, м), 7,62-7,67 (3Н, м), 7,75-7,78 (1Н, м), 7,90-7,91 (1Н, м), 8,35 (1Н, с), 8,51 (1Н, д, J=7,5 Гц), 10,95 (1Н, с).
Элементный анализ (C27H25N3O6):
Вычислено: С 66,52; H 5,17; N 8,62.
Найдено: С 66,37; H 5,29; N 8,58.


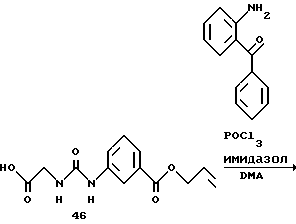
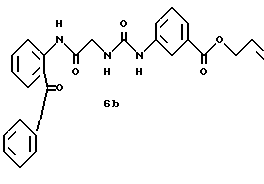
Получение 56. Синтез 2-(бензилоксикарбонилглициламино)бензофенона (соединение 6b) с помощью способа 1.
(1). Аллил 3-(метоксикарбонилметилуреидо)бензоат 45.
Суспензию трифосгена (2,5 г, 8,42 ммоль) и гидрохлорида аллил 3-аминобензоата (4,0 г, 18,7 ммоль) в дихлорметане (80 мл) охлаждают до -20oC и по каплям к ней добавляют триэтиламин (9,64 мл, 69,2 ммоль). Смесь перемешивают в течение 30 минут. К смеси добавляют гидрохлорид глицинметилового эфира (2,82 г, 22,44 ммоль). Затем по каплям добавляют триэтиламин (3,75 мл, 18,7 ммоль) с последующим перемешиванием при -20oC в течение 2,5 часов. К реакционному раствору добавляют охлажденную льдом воду, и после перемешивания водный слой экстрагируют дважды этилацетатом. Органический слой промывают насыщенным солевым раствором, сушат над безводным сульфатом магния и концентрируют с получением целевого соединения (5,27 г). Выход 96%.
ЯМР (CBCl3) δ: 3,76 (3Н, с), 4,08 (2Н, с), 4,80 (2Н, д, J=5,5 Гц), 5,23-5,45 (2Н, м), 5,92-6,12 (2Н, м), 7,28-7,38 (1Н, м), 7,67-7,90 (3Н, м).
(2). (3-Аллилоксикарбонилфенил)уреидоуксусная кислота 46.
К раствору аллил 3-(метоксикарбонилметилуреидо)бензоата (5,27 г, 18,7 ммоль) в ТГФ (27 мл) добавляют 2н. соляную кислоту (37,4 мл) и смесь нагревают с обратным холодильником при перемешивании в течение 2,5 часов. После того как реакционному раствору дают остыть, к нему добавляют воду и водный насыщенный раствор бикарбоната натрия для доведения pH водного слоя до 1 с последующим экстрагированием этилацетатом. Органический слой промывают насыщенным солевым раствором, сушат над безводным сульфатом магния и концентрируют. Остаток кристаллизуют из толуола и получают целевое соединение (3,66 г). Выход 70%.
ЯМР (DMCO-d6) δ: 3,80 (2Н, д, J=5,9 Гц), 4,79 (2Н, д, J=5,4 Гц), 5,24-5,47 (2Н, м), 5,95-6,16 (2Н, м), 6,41 (1Н, т, J=5,9 Гц), 7,39 (1H, т, J=7,8 Гц), 7,50-7,65 (2Н, м), 8,14 (1Н, с), 9,08 (1H, с).
(3). 2-(Аллилоксикарбонилфенилглициламино)бензофенон 6b.
К ДМА (40 мл) добавляют хлорокись фосфора (2,07 мл, 22,64 ммоль) и имидазол (1,54 г, 22,64 ммоль) при перемешивании и охлаждении. По каплям добавляют раствор (3-аллилоксикарбонилфенил)уреидоуксусной кислоты (3,0 г, 10,78 ммоль) в диметилацетамиде (10 мл) и смесь перемешивают в течение 10 минут при охлаждении льдом. Затем по каплям добавляют раствор 2-аминобензофенона (2,34 г, 11,86 ммоль) в ДМА (5 мл). Реакционный раствор перемешивают при 50oC в течение 5,5 часов. После того как реакционному раствору дают остыть, к нему добавляют воду и этилацетат с доведением pH до 9 водным насыщенным раствором бикарбоната натрия, и водный слой экстрагируют этилацетатом. Органический слой промывают насыщенным солевым раствором, сушат над безводным сульфатом магния и концентрируют. Остаток кристаллизуют из толуола и получают целевое соединение (3,63 г). Выход 74%.
Получение 57. Синтез 2-(аллилоксикарбонилфенилглициламино)- бензофенона (соединение 6b) с помощью другого способа II.
(1). В токе азота к суспензии N,N'-карбонилдиимидазола (5,69 г, 1,5 экв. ) в ДМФ (25 мл) добавляют по каплям раствор исходного материала (5,0 г) в ДМФ (20 мл) при 5oC или ниже при охлаждении льдом на протяжении 30 минут. После перемешивания при той же температуре в течение 1 часа и 30 минут добавляют гидрохлорид глицинметилового эфира (3,53 г, 1,2 экв.) и смесь перемешивают при комнатной температуре в течение 2 часов.
Реакционный раствор выливают в смесь 1н. соляной кислоты (50 мл) и этилацетата (50 мл) и затем распределяют на слои. Органический слой промывают дважды водой (25 мл), а водный слой экстрагируют этилацетатом (25 мл). Водные слои объединяют, сушат над безводным сульфатом магния и концентрируют при пониженном давлении, получая 6,55 г (95,8%) кристаллического остатка соединения 45.
(2). В токе азота к суспензии глицина (9,13 г, 1,3 экв.) в ДМФ (40 мл) добавляют по каплям триметилсилилхлорид (16,0 мл, 1,35 экв.) при охлаждении льдом на протяжении 6 минут. Смесь перемешивают при комнатной температуре в течение 1,5 часов, а затем при 40oC в течение 0,5 часа. Затем смесь перемешивают при охлаждении льдом с получением реакционного раствора O-силилглицина.
В токе азота к суспензии N,N'-карбонилдиимидазола (22,77 г, 1,5 экв.) в ДМФ (80 мл) добавляют по каплям раствор исходного материала (20,00 г) в ДМФ (60 мл) при 5oC или ниже при охлаждении льдом на протяжении 10 минут, и смесь промывают ДМФ (10 мл). После перемешивания при той же температуре в течение 1,5 часов добавляют указанный выше реакционный раствор О-силилглицина, что сопровождается перемешиванием при комнатной температуре в течение 2 часов.
Реакционный раствор выливают в этилацетат (300 мл), охлажденную льдом воду (200 мл), н-HCl (200 мл) и хлористый натрий (60 г), а затем разделяют на слои. Органический слой промывают водой (200 мл), насыщенным водным бикарбонатом натрия (200 мл) и смесью водного насыщенного бикарбоната натрия (100 мл) с водой (100 мл). Водные слои подвергают обратной экстракции этилацетатом (200 мл), а затем этилацетатом (100 мл).
Натрийбикарбонатные щелочные слои объединяют и к ним добавляют этилацетат (260 мл). После добавления по каплям при перемешивании концентрированной соляной кислоты (10 мл) смесь распределяют на слои. Органический слой промывают дважды водным 10%-ным солевым раствором. Водный слой подвергают обратной экстракции этилацетатом (130 мл). Органические слои объединяют, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. После добавления толуола (200 мл) смесь дополнительно концентрируют при пониженном давлении, давая раствор суспензии соединения 46. После стояния на протяжении ночи раствор фильтруют и промывают дважды толуолом (20 мл), и получают 21,7 г (83,3%) кристаллов соединения 46. Соединение 46 обрабатывают аналогично описанному в получении 57 и получают соединение 6b.



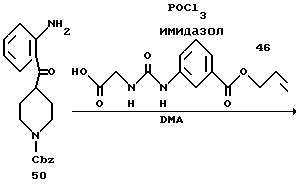
Получение 58. N-трет-Бутоксикарбонил-2-иоданилин 47.
К раствору иоданилина (11,0 г, 0,05 моль) добавляют пиридин (10,1 мг, 0,10 моль) и диметиламинопиридин (610 мг, 5 ммоль) при комнатной температуре. По каплям добавляют ди-трет-бутилкарбонат (26,6 мл, 0,125 моль), и смесь нагревают с обратным холодильником при перемешивании в течение 6 часов. После того как реакционному раствору дают охладиться, его разбавляют этилацетатом и добавляют охлажденную льдом воду. К смеси добавляют 2н. соляную кислоту для доведения pH до 1, и водный слой экстрагируют дважды этилацетатом. Органический слой промывают насыщенным солевым раствором, сушат над безводным сульфатом магния и концентрируют. Остаток растворяют в метаноле (200 мл) и при перемешивании и охлаждении льдом добавляют водный 2н. раствор гидроокиси натрия (50 мл). После перемешивания при комнатной температуре в течение 2 часов метанол отгоняют при пониженном давлении. Реакционный раствор разбавляют дихлорметаном и после добавления охлажденной льдом воды, добавляют 2н. соляную кислоту для доведения pH до 1. Водный слой экстрагируют этилацетатом. Органический слой промывают насыщенным солевым раствором, сушат над безводным сульфатом магния и концентрируют. Остаток очищают, подвергая колоночной хроматографии на силикагеле, и получают целевое соединение (8,54 г). Выход 54%.
ЯМР (CDCl3) δ: 1,42 (9Н, с), 6,71-6,81 (1Н, м), 6,82 (1Н, шир. с), 7,26-7,36 (1Н, м), 7,75 (1Н, дд, J=1,2 Гц, 8,0 Гц), 8,05 (1Н, дд, J=1,6 Гц, 8,2 Гц).
Получение 59. N-трет-Бутоксикарбонил-2-триметилстанниланилин 48.
К раствору N-трет-бутоксикарбонил-2-иоданилина (3,20 г, 0,01 моль) в толуоле (65 мл) добавляют транс-бензилхлорбистрифенилфосфинпалладий (360 мг, 5 мкмоль), хлористый тетра-этиламмоний (330 мг, 20 мкмоль) и гексаметилдиолово (5,1 г, 0,015 ммоль) при комнатной температуре и смесь перемешивают при 95oC в течение 2,5 часов. После того как реакционному раствору дают охладиться, к нему добавляют охлажденную льдом воду и осадок удаляют с помощью фильтрования. Водный слой экстрагируют этилацетатом. Органический слой промывают насыщенным солевым раствором, сушат над безводным сульфатом магния и концентрируют. Остаток очищают, подвергая колоночной хроматографии на силикагеле, и получают целевое соединение (2,46 г). Выход 69%.
ЯМР (CDCl3) δ: 0,34 (9Н, с), 1,51 (9Н, с), 6,28 (1Н, шир. с), 7,07-7,17 (1Н, м), 7,22-7,43 (2Н, м), 7,52 (1Н, д, J=8,6 Гц).
Получение 60. 2-(N-(Бензилоксикарбонил)пиперидин-4-карбонил)-N'- трет-бутоксикарбониланилин 49.
N-(Бензилоксикарбонил)пиперидин-4-карбоновую кислоту (1,10 г, 4,18 ммоль) растворяют в тионилхлориде (1,23 мл) и раствор нагревают с обратным холодильником при перемешивании в течение 20 минут. Избыток тионилхлорида отгоняют при пониженном давлении и остаток растворяют в толуоле. К раствору добавляют дихлорбисацетонитрилпалладий (73 мг, 0,209 ммоль). Затем добавляют N-трет-бутоксикарбонил-2- триметилстанниланилин (1,50 г, 4,18 ммоль) и смесь перемешивают при 55oC в течение 45 минут. После того как реакционному раствору дают охладиться, к нему добавляют охлажденную льдом воду, и после перемешивания водный слой экстрагируют дважды этилацетатом. Органический слой промывают насыщенным солевым раствором, сушат над безводным сульфатом магния и концентрируют. Остаток очищают с помощью колоночной хроматографии на силикагеле и получают целевое соединение (1,49 г). Выход 81%.
ЯМР (CDCl3) δ: 1,53 (9Н, с), 1,63-1,95 (4Н, м), 2,85-3,06 (2Н, м), 3,37-3,58 (1Н, м), 4,16-4,38 (2Н, м), 5,15 (2Н, с), 6,99-7,08 (1Н,
м), 7,36 (5Н, с), 7,48-7,57 (1Н, м), 7,86 (1Н, дд, J=1,2 Гц, 8,2 Гц), 8,51 (1Н, дд, J=1,0 Гц, 8,2 Гц).
Получение 61. 2-(N-(Бензилоксикарбонил)пиперидин-4-карбонил)- анилин 50.
К раствору 2-(N-(бензилоксикарбонил)пиперидин-4-карбонил)- N'-трет-бутоксикарбониланилина (1,30 г, 3,0 ммоль) в метиленхлориде (6,5 мл) добавляют анизол (2,0 мл) при комнатной температуре. Затем по каплям при перемешивании и при охлаждении льдом добавляют трифторуксусную кислоту (13,0 мл) и смесь перемешивают при той же температуре в течение одного часа. Реакционный раствор разбавляют этилацетатом, и после добавления охлажденной льдом воды раствор нейтрализуют водным насыщенным раствором бикарбоната натрия. Водный слой экстрагируют дважды этилацетатом. Органический слой промывают насыщенным солевым раствором, сушат над безводным сульфатом магния и концентрируют. Остаток очищают с помощью колоночной хроматографии на силикагеле и получают целевое соединение (987 г). Выход 99%.
ЯМР (CDCl3) δ: 1,69-1,96 (4Н, м), 2,83-3,08 (2Н, м), 3,35-3,53 (1Н, м), 4,17-4,39 (2Н, м), 5,15 (2Н, с), 6,30 (2Н, шир. с), 6,61-6,70 (2Н, м), 7,23-7,39 (1Н, м), 7,36 (5Н, с), 7,73 (1Н, д, J=8,2 Гц).
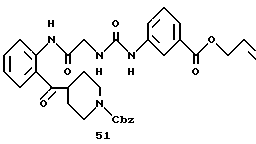
Получение 62. Аллил 3-(3-(2-(N-(бензилоксикарбонил)пиперидин-4- карбонил)фенилкарбамоилметил)уреидо)бензоат 51.
Целевое соединение (780 мг) получают в соответствии со способом получения соединения 6b с использованием 2-(N-(бензилоксикарбонил)пиперидин-4-карбонил)анилина (677 мг) и 2- (бензилоксикарбонилглициламино)бензофенона (соединение 46) (556 г) в качестве исходных материалов. Выход 65%.
ЯМР (DMCO-d6) δ: 1,13-1,39 (2Н, м), 1,54-1,79 (2Н, м), 2,80- 3,06 (2Н, м), 3,52-3,69 (1Н, м), 3,74-3,98 (2Н, м), 3,88 (2Н, д, J=6,0 Гц), 3,76 (2Н, д, J= 5,2 Гц, 5,06 (2Н, с), 5,20-5,43 (2Н, м), 5,90-6,13 (1Н, м), 6,83 (1Н, т, J=6,0 Гц), 7,18-7,68 (10Н, м), 8,05 (1Н, д, J=7,8 Гц), 8,15 (1Н, с), 8,45 (1Н, д, J=7,8 Гц), 9,28 (1Н, с), 11,60 (1Н, с).
4a: R1=H,
b: R1=Me, (R)
c: R1=Me, (S)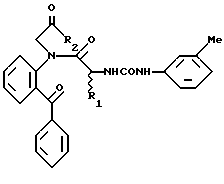
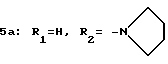
b: R1=H, R2=-OtBu,
e: R1=Me(R), R2=-OtBu,
f: R1=Me(S), R2=-OtBu.
Пример 1. 2-(N-(Пирролидинокарбонилметил)-N-(N'-(м-толил)- уреидометилкарбонил)амино) бензофенон 5а.
Раствор амида 4а (300 мг), полученного в получении 5, бромацетилпирролидина (17,35 мг), карбоната калия (120 мг) и йодистого калия (10 мг) в диметилфорамиде (5 мл) перемешивают на протяжении ночи. После выливания в воду смесь экстрагируют этилацетатом. После того как экстракт промывают водой и сушат (над сульфатом натрия), растворитель отгоняют при пониженном давлении. Остаток перекристаллизовывают из ацетонитрила. Выход 53%. T.пл. 204-205oC.
ИК νмакс (KBr): 3310, 1655, 1637, 1560 см-1.
ЯМР (CDCl3) δ: 1,81 (4Н, м), 2,28 (3Н, с), 3,34 (4Н, м), 3,78 (1Н, д, J= 18,0 Гц), 3,81 (1Н, д, J=16,4 Гц), 3,99 (1Н, д, J=17,2 Гц), 4,82 (1Н, д, J= 16,4 Гц), 5,78 (1Н, шир. с), 6,80-7,79 (13Н, м).
Элементный анализ (C29H30N4O4):
Вычислено: С 69,86; H 6,06; N 11,24.
Найдено: С 69,72; H 6,17; N 11,04.
Пример 2. 2-(N-(трет-Бутоксикарбонилметил)-N-(N'-(м-толил)- уреидометилкарбонил) амино) бензофенон 5b.
Целевое соединение 5b получают в соответствии со способом описания в примере 1 с использованием соединения 4b в качестве исходного материала. Выход 50%, т.пл. 183-184oC.
ИК νмакс (KBr): 3344, 1746, 1658, 1618, 1561 см-1.
ЯМР (CDCl3) δ: 1,39 (9H, м), 2,28 (3Н, с), 3,65 (1Н, д, J=17,8 Гц), 3,77 (1Н, д, J=17,8 Гц), 4,01 (1Н, д, J=17,4 Гц), 4,64 (1Н, д, J=17,4 Гц), 5,90 (1Н, шир. с), 6,81-6,84 (1Н, д, J=6,0 Гц), 6,95-6,81 (13Н, м).
Элементный анализ (C29H31N3O5):
Вычислено: С 69,44; H 6,23; N 8,38.
Найдено: С 69,14; H 6,28; N 8,33.
Пример 3. 2-(N-(Циклопропилкарбонилметил)-N-(N'-(м-толил)- уреидометилкарбонил)амино)бензофенон 5c.
Целевое соединение 5с получают в соответствии с тем же способом, что описан в примере 2, с использованием соединения 4с в качестве исходного материала. Выход 3,3%, т.пл. 114-118oC.
ИК νмакс (KBr): 3391, 1650, 1611, 1596, 1556 см-1.
ЯМР (CDCl3) δ: 1,16 (4H, м), 1,94 (1Н, шир. с), 3,23 (3Н, с), 3,43-4,67 (4Н, м), 6,07 (1Н, шир. с), 6,79 (2Н, д, J=6,4 Гц), 7,04-7,40 (13Н, м), 8,27 (1Н, с).
Пример 4. 2-(N-(м-Аминобензил)-N-(N'-(м-толил)уреидометилкарбонил) амино)бензофенон 5d.
В соответствии с тем же способом, что описан в примере 1, осуществляется N-алкилирование с использованием м-(BOC-A-амино)бензилбромида вместо бромацетилпирролидина. К полученному в результате BOC-соединению, добавляют этилацетатный раствор 4н. хлористого водорода и смесь перемешивают на протяжении ночи. Смешанный раствор подщелачивают водным раствором карбоната натрия экстрагируют этилацетатом. Экстракт промывают водой, сушат (сульфатом натрия), а затем растворитель отгоняют при пониженном давлении. Выход 12%, т.пл. 96-100oC.
ИК νмакс (KBr): 3359, 1662, 1594, 1555 см-1.
ЯМР (CDCl3) δ: 2,22 (3H, c), 3,48 (2H, шир. с), 3,98 (2H, м), 4,27 (2H, д, J=14,4 Гц), 5,07 (1H, д, J=14,4 Гц), 6,32-7,69 (17H, м).
Элементный анализ (C30H28N4O3•0,2H2O):
Вычислено: С 72,62; H 5,77; N 11,29.
Найдено: С 72,49; H 5,88; N 11,49.
Пример 5. 2-(N-(трет-Бутоксикарбонилметил)-N-(2-(N'-(м-толил)- уреидо)этилкарбонил)амино)бензофенон 5е, 5f.
Целевые соединения получаются в соответствии с тем же самым способом, что описан в примере 2, с использованием соединения 4b, 4с в качестве исходного материала.
Соединение 5е.
Выход 31,2%.
[α]
ИК νмакс (нуйол): 3368, 1741, 1665, 1642, 1553 см-1.
ЯМР (CDCl3 + CD3OD) δ: 1,0-1,5 (9H, м), 2,31 и 2,28 (всего 3Н, с), 3,65-3,80 (1Н, м), 4,35-4,75 (2H, м), 6,75-7,90 (13Н, м).
Элементный анализ (C30H33N3O5•0,5H2O):
Вычислено: С 68,88; H 6,53; N 8,01.
Найдено: С 68,67; H 6,52; N 8,22.
Соединение 5f.
[α]
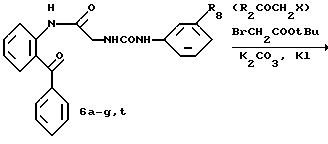
R8=a: -COOCH2Ph,
b: -COOCH2CH=CH2,
c: -CH2COOCH2CH=CH2,
d: -OCH2COOCH2CH=CH2,
e: -SCH2COOCH2CH=CH2,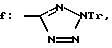
t: -CF3.
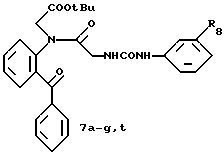
Пример 6. 2-(N-(трет-Бутоксикарбонилметил)-N'-(м-(бензилокси-карбонил) фенил) уреидометилкарбониламино) бензофенон 7а.
В соответствии со способом получения соединения 5b примера 2 соединение 6а, полученное в получении 7, используют для получения целевого соединения. T.пл. 85-88oC.
ИК νмакс (KBr): 3380, 1720, 1661, 1597, 1555 см-1.
ЯМР (DMCO-d6) δ: 1,36 (9H, с), 3,53-3,85 (2H, м), 3,73 (1Н, д, J=16,8 Гц), 4,14 (1Н, д, J=16,8 Гц), 5,33 (2Н, с), 6,38 (1Н, шир. с), 7,30-7,85 (17Н, м), 8,05 (1Н, шир. с), 9,09 (1Н, с).
Элементный анализ (C36H35N3O7):
Вычислено: С 69,55; H 5,67; N 6,76.
Найдено: С 69,41; H 5,74; N 6,79.
Пример 7. 2-(N-(трет-Бутоксикарбонилметил)-N'-(м-(аллилоксикарбонил) фенил)уреидометилкарбониламино)бензофенон 7b.
В соответствии с тем же способом, что описан в примере 2, соединение 6b используют в качестве исходного вещества для получения целевого соединения. T.пл. 105-107oC.
ИК νмакс (KBr): 3385, 1743, 1722, 1662, 1597, 1558 см-1.
ЯМР (CDCl3) δ: 1,39 (9Н, с), 3,65 (1Н, д, J=17,2 Гц), 3,80 (1Н, дд, J= 17,42, 4,6 Гц), 4,63 (1Н, д, J=17,2 Гц), 4,79 (2Н, д, J=5,8 Гц), 5,20-5,46 (2Н, м), 5,82-5,46 (2Н, м), 5,82-6,14 (2Н, м), 7,01 (1Н, с), 7,22-7,86 (12Н, м), 7,96 (1Н, шир. с).
Элементный анализ (C32H33N3O7):
Вычислено: С 67,24; H 5,82; N 7,35.
Найдено: С 66,98; H 5,80; N 7,31.
Пример 8. 2-(N-(трет-Бутоксикарбонилметил)-N'-(м-(2- пропенилоксикарбонилметил)фенил)уреидометилкарбониламино) бензофенон 7с.
Для получения целевого соединения в соответствии с тем же способом, что описан в примере 2, в качестве исходного вещества используют соединение 6с. T.пл. 122-124oC.
ИК νмакс (KBr): 3360, 1740, 1662, 1645, 1610, 1595, 1560 см-1.
ЯМР (CDCl3) δ: 1,40 (9Н, с), 3,59 (2Н, с), 3,64 (1Н, д, J=17,2 Гц), 3,77 (1Н, дд, J=17,0, 5,0 Гц), 4,00 (1Н, дд, J=17,5, 5,0 Гц), 4,53-4,61 (2Н, м), 4,64 (1Н, д, J=17,2 Гц), 5,13-5,32 (2Н, м), 5,72-5,99 (2Н, м), 6,75 (1Н, с), 6,89-6,97 (1Н, м), 7,11-7,30 (4Н, м), 7,2-7,67 (6Н, м), 7,72-7,84 (3Н, м).
Элементный анализ (C33H35N3O7):
Вычислено: С 67,68; H 6,02; N 7,18.
Найдено: С 67,68; H 6,09; N 7,19.
Пример 9. 2-(N-(трет-Бутоксикарбонилметил)-N'-(м- (2-пропенилоксикарбонилметилокси)фенил)уреидометилкарбониламино)бензофенон 7d.
В качестве исходного вещества для получения целевого соединения используют соединение 6d в соответствии с тем же способом, что описан в примере 2. T.пл. 134-136oC.
ИК νмакс (KBr): 3390, 1760, 1739, 1660, 1650, 1610, 1560, 1500 см-1.
ЯМР (CDCl3) δ: 1,40 (9H, с), 3,63 (1Н, д, J=17,4 Гц), 3,76 (1Н, дд, J= 17,4, 3,6 Гц), 4,00 (1Н, дд, J=17,4, 3,6 Гц), 4,62 (2Н, с), 4,64 (1Н, д, J= 17,4 Гц), 4,69 (1Н, д, J=5,6 Гц), 5,19-5,38 (2Н, м), 5,77-6,01 (2Н, м), 6,57 (1Н, дд, J= 7,6, 2,6 Гц), 6,73-6,87 (2Н, м), 7,00-7,18 (2Н, м), 7,37-7,68 (6Н, м), 7,72-7,84 (3Н, м).
Элементный анализ (C33H35N3O8):
Вычислено: С 65,88; H 5,86; N 6,98.
Найдено: С 65,76; H 5,89; N 6,92.
Пример 10. 2-(N-(трет-Бутоксикарбонилметил)-N'-(м- (2-пропенилоксикарбонилметилтио)фенил)уреидометилкарбониламино)бензофенон 7е.
В соответствии с тем же способом, что описан в примере 2, для получения целевого соединения в качестве исходного вещества используют соединение 6е. T.пл. 155-157oC.
ИК νмакс (KBr): 3380, 1740, 1650, 1595, 1550 см-1.
ЯМР (CDCl3) δ: 1,40 (9H, с), 3,63 (1Н, д, J=17,4 Гц), 3,67 (2H, c), 3,78 (1H, дд, J=17,2, 5,6 Гц), 4,01 (1H, дд, J=17,2, 5,6 Гц), 4,55-4,62 (2H, м), 4,73 (1Н, д, J=17,4 Гц), 5,16-5,32 (2Н, м), 5,73-6,00 (2Н, м), 6,86 (1Н, с), 6,96-7,07 (1Н, м), 7,08-7,16 (2Н, м), 7,33 (10Н, м).
Элементный анализ (C33H35N3O7S):
Вычислено: С 64,17; H 5,71; N 6,80; S 5,19.
Найдено: С 64,22; H 5,80; N 6,79; S 5,08.
Пример 11. 2-(N-(тpeт-Бутoкcикapбoнилмeтил) -N'-(м-(2-(тpифeнилметил) тетразол-5-ил)фенил)уреидометилкарбониламино)бензофенон 7f.
В соответствии с тем же способом, что описан в примере 2, для получения целевого соединения в качестве исходного вещества используют соединение 6f. Порошок.
ИК νмакс (KBr): 3380, 1740, 1662, 1595, 1560, 1515 см-1.
ЯМР (CDCl3) δ: 1,40 (9Н, с), 3,63 (1Н, д, J=17,2 Гц), 3,80 (1Н, д, J= 17,2 Гц), 3,99 (1Н, дд, J=17,2, 4,6 Гц), 4,63 (1Н, д, J=17,2 Гц), 5,71 (1Н, шир. с), 6,70 (1Н, с), 7,00-7,90 (28Н, м).
Элементный анализ (C48H43N7O5• 0,5CH3С6H5):
Вычислено: С 73,29; H 5,61; N 11,62.
Найдено: С 72,95; H 5,76; N 11,31.
Пример 12. 2-(N-(трет-Бутоксикарбонилметил)-N'-(м-(2-(трифенилметил) тетразол-5-илметилокси)фенил)уреидометилкарбониламино)-бензофенон 7g.
Для получения целевого соединения в качестве исходного вещества в соответствии с тем же способом, что описан в примере 2, используют соединение 6g.
ИК νмакс (KBr): 3380, 1740, 1662, 1600, 1548 см-1.
ЯМР (CDCl3) δ: 1,39 (9H, с), 3,64 (1Н, д, J=17,4 Гц), 3,76 (1Н, дд, J= 17,8, 8,4 Гц), 3,98 (1Н, дд, J=17,8, 4,6 Гц), 4,64 (1Н, д, J=17,4 Гц), 5,28 (2Н, с), 5,81 (1Н, шир. с), 6,58-6,73 (2Н, м), 6,83-6,91 (1Н, м), 6,99-7,66 (23Н, м), 7,71-7,83 (3Н, м).
Элементный анализ (C49H45N7O6 • 0,3 CH3C6H5):
Вычислено: С 71,74; H 5,58; N 11,46.
Найдено: С 71,58; H 5,65; N 11,38.
Пример 13. 2-(N-(трет-Бутоксикарбонилметил)-N'-(м-трифторметилфенил) уреидометилкарбониламино)бензофенон 7t.
Для получения целевого соединения в соответствии с тем же способом, что описан в примере 2, используют соединение 6t в качестве исходного вещества. Порошок.
ЯМР (CDCl3) δ: 1,36 (9H, с), 3,68 (1Н, д, J=17,2 Гц), 3,79 (1Н, д, J= 17,4 Гц), 4,10 (1Н, д, J=17,4 Гц), 4,61 (1Н, д, J=17,2 Гц), 7,07-7,88 (13Н, м).
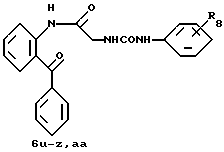

R8=u: m-Cl, v: m-Br, w: m-CN, x: m-OCH3, y: p-Cl, z: p-Me, aa: H
Пример 14. 2-(N-(тpeт-Бутoкcикapбoнилмeтил)-N'-(м-xлopфeнил)- уреидометилкарбониламино)бензофенон 7u.
Раствор амида 6u (977 мг, 2 ммоль), полученного в получении 15, трет-бутилбромацетата (420 мкг, 2,6 ммоль), карбоната калия (359 мг, 2,6 ммоль) и йодистого калия (33 мг, 0,2 ммоль) в диметилформамиде (6 мл) перемешивают на протяжении ночи. После выливания в воду смесь экстрагируют этилацетатом. Экстракт промывают водой и сушат (сульфатом натрия), а затем растворитель отгоняют при пониженном давлении. Остаток перекристаллизовывают из толуола. Выход 58%. T.пл. 160-161oC.
ЯМР (CDCl3) δ: 1,37 (9Н, с), 3,67 (1Н, д, J=17,2 Гц), 3,77 (1Н, дд, J= 17,4, 5,6 Гц), 4,05 (1Н, дд, J=17,4, 5,6 Гц), 4,05 (1Н, дд, J=17,2, 5,6 Гц), 4,60 (1H, д, J=17,2 Гц), 6,12 (1Н, шир. с), 6,89 (1Н, шир. с), 7,06 (1Н, м), 7,25 (2Н, с), 7,41-7,69 (7Н, м), 7,80 (2Н, м).
Элементный анализ (C28H28N3O5Cl):
Вычислено: С 64,43; H 5,41; Cl 6,69; N 8,05.
Найдено: С 64,19; H 5,54; Cl 6,65; N 7,93.
Пример 15. 2-(N-(трет-Бутоксикарбонилметил)-N'-(м-бромфенил)- уреидометилкарбониламино)бензофенон 7v.
В соответствии с тем же способом, что описан в примере 14, в качестве исходного вещества для получения целевого соединения используют соединение 6v, полученное в получении 16.
ИК νмакс (KBr): 1741, 1663, 1593, 1539 см-1.
ЯМР (CDCl3) δ: 1,38 (9Н, с), 3,67 (1Н, д, J=17,2 Гц), 3,78 (1Н, дд, J= 17,2, 4,4 Гц), 4,04 (1Н, дд, J=17,4, 4,4 Гц), 4,61 (1Н, д, J=17,2 Гц), 6,09 (1Н, шир. с), 6,95-7,27 (5Н, м), 7,42-7,70 (6Н, м), 7,76- 7,85 (3Н, м).
Элементный анализ (C28H28N3O5Br):
Вычислено: С 59,37; H 4,98; Br 14,11; N 7,42.
Найдено: С 59,25; H 4,98; Br 13,85; N 7,33.
Пример 16. 2-(N-(трет-Бутоксикарбонилметил)-N'-(м-цианофенил) уреидометилкарбониламино)бензофенон 7w.
Для получения целевого соединения в соответствии с тем же способом, что описан в примере 14, в качестве исходного вещества используют соединение 6w, полученное в примере получения 17.
ИК νмакс (KBr): 2228, 1741, 1664, 1594, 1553 см-1.
ЯМР (CDCl3) δ: 1,36 (9H, с), 3,69 (1Н, д, J=17,2 Гц), 3,73 (1Н, дд, J= 17,2, 6,0 Гц), 4,12 (1Н, дд, J=17,2, 6,0 Гц), 4,60 (1Н, д, J=17,2 Гц), 6,41 (1Н, шир. с), 7,08-7,33 (4Н, м), 7,43-7,91 (10Н, м).
Элементный анализ (C29H28N4O5• 0,4H2O):
Вычислено: С 67,01; H 5,58; N 10,78.
Найдено: С 66,98; H 5,56; N 10,71.
Пример 17. 2-(N-(трет-Бутоксикарбонилметил)-N-(м-метоксифенил) уреидометилкарбониламино)бензофенон 7x.
В соответствии с тем же способом, что описан в примере 14, для получения целевого соединения в качестве исходного вещества используют соединение 6х, полученное в примере получения 18. T.пл. 153-155oC.
ИК νмакс (KBr): 1743, 1663, 1646, 1608, 1556, 1575 см-1.
ЯМР (CDCl3) δ: 1,39 (9H, с), 3,64 (1Н, д, J=17,2 Гц), 3,75 (3Н, с), 3,78 (1Н, дд, J=17,2, 4,0 Гц), 4,03 (1Н, дд, J=17,2, 4,0 Гц), 4,63 (1Н, д, J=17,2 Гц), 6,00 (1Н, шир. с), 6,51-6,58 (1Н, м), 6,68-6,77 (1Н, м), 6,98-7,16 (3Н, м), 7,40-7,67 (6Н, м), 7,40-7,67 (6Н, м).
Элементный анализ (С29H31N3О6):
Вычислено: С 67,30; H 6,04; N 8,12.
Найдено: С 67,30; H 6,10; N 8,16.
Пример 18. 2-(N-(трет-Бутоксикарбонилметил)-N'-(п-хлорфенил)- уреидометилкарбониламино)бензофенон 7y.
В соответствии с тем же способом, что описан в примере 14, в качестве исходного вещества, для получения целевого соединения, используют соединение 6y, полученное в примере получения 19. T.пл. 196-197oC.
ИК νмакс (KBr): 1742, 1660, 1578, 1548 см-1.
ЯМР (CDCl3) δ: 1,37 (9H, с), 3,66 (1Н, д, J=17,2 Гц), 3,77 (1Н, дд, J= 17,4, 4,4 Гц), 4,07 (1Н, дд, J=17,4, 4,4 Гц), 4,61 (1Н, д, J=17,2 Гц), 6,10 (1Н, шир. с), 7,06-7,28 (6Н, м), 7,43-7,83 (8Н, м).
Элементный анализ (C28H28N3O5Cl):
Вычислено: С 64,43; H 5,41; Cl 6,79; N 8,05.
Найдено: 64,41; H 5,49; Cl 6,90; N 8,04.
Пример 19. 2-(N-(трет-Бутоксикарбонилметил)-N'-(п-толил)- уреидометилкарбониламино)бензофенон 7z.
В соответствии с тем же способом, что описан в примере 14, для получения целевого соединения в качестве исходного вещества используют соединение 6z, полученное в примере получения 20. T.пл. 182-183oC/
ИК νмакс (KBr): 1742, 1661, 1598, 1577, 1548 см-1.
ЯМР (CDCl3) δ: 1,43 (9Н, c), 2,28 (3H, с), 3,64 (1Н, д, J=17,2 Гц), 3,74 (1H, дд, J=17,4, 4,0 Гц), 4,01 (1Н, дд, J=17,4, 4,0 Гц), 4,63 (1Н, д, J=17,2 Гц), 5,77 (1Н, шир. с), 7,00-7,22 (4Н, м), 7,42-7,83 (10Н, м).
Элементный анализ (C29H31N3O5):
Вычислено: С 69,44; H 6,23; N 8,38.
Найдено: С 69,68; H 6,33; N 8,34.
Пример 20. 2-(N-(трет-Бутоксикарбонилметил)-N'- фенилуреидометилкарбониламино)бензофенон 7аа.
В соответствии с тем же способом, что описан в примере 14, для получения целевого соединения в качестве исходного вещества используют соединение 6аа, полученное в примере получения 21. T.пл. 166-167oC.
ИК νмакс (KBr): 1743, 1662, 1598, 1553, 1498 см-1.
ЯМР (CDCl3) δ: 1,39 (9Н, с), 3,65 (1Н, д, J=17,4 Гц), 3,79 (1Н, дд, J= 17,6, 4,2 Гц), 4,04 (1Н, дд, J=17,6, 4,2 Гц), 4,64 (1Н, д, J=17,4 Гц), 5,97 (1Н, шир. с), 7,01 (2Н, шир. с), 7,16-7,30 (5Н, м), 7,40- 7,85 (7Н, м).
Элементный анализ (C28H29N3O5):
Вычислено: C 68,98; H 6,00; N 8,62.
Найдено: С 68,94; H 6,03; N 8,62.
Пример 21. Натриевая соль 2-[(трет-Бутоксикарбонилметил)-[3- (м-(карбоксилфенил)уреидометилкарбонил]]аминобензофенона 8ha.
(1). 2-(N'-(м-(2-пропенилоксикарбонил)фенил)уреидометилкарбонил) бензофенон 6b.
К раствору м-(3-пропенилоксикарбонил)фенилизоцианата, который получился из раствора м-(3-пропенилокси) анилина (1,3 г, 6,80 ммоль), трифосгена (665 мг, 2,38 ммоль) и триэтиланилина (996 мкл, 7,14 ммоль) в тетрагидрофуране (50 мол) в соответствии со способом, описанным в EP-508796-A1, добавляют при охлаждении льдом раствор соединения 3a (1,852 г, 5,53 ммоль). Кроме того, добавляют триэтиламин (810 мкг, 5,80 ммоль) и смесь обрабатывают в соответствии со способом, описанным в примере получения 15, для получения целевого соединения (1,678 г, выход 68%). T.пл. 68-71oC.
ИК νмакс (KBr): 3350, 1718, 1692, 1659, 1595, 1580, 1557, 1520 см-1.
ЯМР (CDCl3) δ: 4,12 (2H, д, J=5,6 Гц), 4,77 (2H, д, J=5,6 Гц), 5,20-5,43 (2Н, м), 5,88-6,10 (2Н, м), 7,04-7,18 (3Н, м), 7,36-7,70 (10Н, м), 7,90 (1Н, шир. с), 8,54 (1Н, дд, J=8,6 Гц).
Элементный анализ (C26H23N3O5):
Вычислено: С 68,26; H 5,07; N 9,19.
Найдено: С 68,30; H 5,19; N 9,16.
(2). 2-(N-(трет-Бутоксикарбонилметил)-N'-(м-(2-пропенилоксикарбонил)фенил) уреидометилкарбониламино)бензофенон 7b.
В соответствии с тем же способом, что описан в примере 14, для получения целевого соединения используют в качестве исходного вещества соединение 6b. T.пл. 105-107oC.
ИК νмакс (KBr): 3385, 1743, 1722, 1662, 1597, 1558 см-1.
ЯМР (CDCl3) δ: 1,39 (9Н, с), 3,65 (1Н, д, J=17,2 Гц), 3,80 (1Н, дд, J= 17,2, 4,6 Гц), 4,63 (1Н, д, J=17,2 Гц), 4,79 (1Н, д, J=5,8 Гц), 5,20-5,46 (2Н, м), 5,82-6,14 (2Н, м), 7,01 (1Н, с), 7,22-7,86 (12Н, м), 7,96 (1Н, шир. с).
Элементный анализ (C32H33N3O7):
Вычислено: С 67,24; H 5,82; N 7,35.
Найдено: С 66,98; H 5,80; N 7,31.
(3). 2-[(трет-Бутоксикарбонилметил)-[3-(м-(карбоксифенил) уреидометилкарбонил]]аминобензофенон 8h.
К раствору, указанного выше сложного эфира 7b (820 мг, 1,43 ммоль) добавляют тетракистрифенилфосфинпалладий (41,4 мг, 0,036 ммоль) и трифенилфосфин (19 мг, 0,072 ммоль) в дихлорметане (0,5 мл) добавляют раствор пирролидина (127 мкл, 1,51 ммоль) в дихлорметане (0,5 мл) при перемешивании при 0oC. Спустя пятнадцать минут, реакционный раствор разбавляют этилацетатом и экстрагируют водным 15%-ным раствором бикарбоната натрия. Основной слой доводят до pH 2 с помощью 5%-ной соляной кислоты и экстрагируют этилацетатом. Этилацетатный слой промывают водой, сушат (сульфатом натрия) и затем концентрируют при пониженном давлении с получением целевого порошкообразного соединения 8h (256 мг, 34%).
ИК νмакс (KBr): 3380, 1665, 1595, 1555 см-1.
ЯМР (CDCl3) δ: 3,69 (1Н, д, J=17,2 Гц), 3,83 (1Н, дд, J=17,2, 4,6 Гц), 4,05 (1H, дд, J=17,2, 4,6 Гц), 4,70 (1Н, д, J=17,2 Гц), 7,17-7,27 (1Н, шир. с), 7,30-7,85 (12Н, м), 8,17 (1Н, с), 8,30-8,41 (1Н, м).
(4). Натриевая соль 2-[(трет-бутоксикарбонилметил)-[3-(м-(карбоксифенил) уреидометилкарбонил]]аминобензофенона 8ha.
Раствор соединения 8h (11,266 г, 21,2 ммоль) в метаноле (700 мл) и воде (50 мл) нейтрализуют водным 1н. раствором гидроокиси натрия (21,2 мл), а затем концентрируют при пониженном давлении. К полученному в результате остатку добавляют воду (200 мл) с последующей сушкой вымораживанием с получением целевого соединения 8ha (12,49 г, 100%) в виде бесцветного порошка.
ЯМР (CDCl3) δ: 1,42 (9Н, с), 3,77 (1Н, д, J=17,0 Гц), 3,78 (1Н, д, J= 17,4 Гц), 3,94 (1Н, д, J=17,4 Гц), 4,37 (1Н, д, J=17,0 Гц), 7,16-7,28 (1Н, м), 7,44-7,87 (13Н, м).
Элементный анализ (C29H28N3O7Na•2H2O):
Вычислено: С 59,08; H 5,47; N 7,13; Na 3,90.
Найдено: С 59,19; H 5,48; N 7,42; Na 3,95.
Пример 22. Кальциевая соль 2-[(трет-бутоксикарбонилметил)-[3- (м-(карбоксифенил)уреидометилкарбонил]]аминобензофенона 8hb.
К раствору соединения 8ha (7,496 мг, 12,7 ммоль) в воде (200 мл) добавляют по каплям водный раствор (50 мл) хлорида кальция (1,411 г, 12,7 ммоль) при перемешивании. После 6-часового перемешивания отфильтровывают бесцветный порошок с получением 5,156 г (70,2%) целевого соединения.
ЯМР (CDCl3) δ: 1,41 (9H, с), 3,71 (1Н, д, J=17,2 Гц), 3,79 (1Н, д, J= 17,4 Гц), 3,94 (1Н, д, J=17,4 Гц), 4,36 (1Н, д, J=17,2 Гц), 7,17-7,29 (1Н, м), 7,23-7,90 (13Н, м).
Элементный анализ (C58H56N6O14Ca• 3H2O):
Вычислено: С 60,30; H 5,41; N 7,27; Ca 3,47.
Найдено: С 60,74; H 5,40; N 7,46; Ca 3,44.
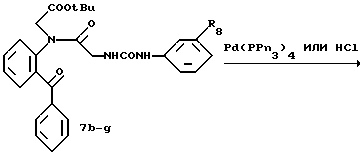

R8=h: -COOH,
i: -CH2COOH,
j: -OCH2COOH,
k: -SCH2COOH,

Пример 23. 2-[(трет-Бутоксикарбонилметил)-[3-(м-(карбоксифенил) - уреидометилкарбонил]]аминобензофенон.
К раствору аллилового эфира 7b (820 мг, 1,43 ммоль), полученному в примере 7, при перемешивании при 0oC добавляют палладиевый тетракистрифенилфосфин (41,4 мг, 0,036 ммоль) и трифенилфосфин (19 мг, 0,072 ммоль) в дихлорметане (0,5 мл), добавляют раствор пирролидина (127 мкл, 1,51 ммоль) в дихлорметане (0,5 мл) при перемешивании при 0oC. Спустя пятнадцать минут, реакционный раствор разбавляют этилацетатом и экстрагируют водным 15%-ным раствором бикарбоната натрия. Щелочной слой доводят до pH 2 с помощью 5%-ной соляной кислоты и экстрагируют этилацетатом. Этилацетатный слой промывают водой, сушат (сульфатом натрия) и затем концентрируют при пониженном давлении с получением целевого порошкообразного соединения 8h (256 мг, 34%).
ИК νмакс (KBr): 3380, 1665, 1595, 1555 см-1.
ЯМР (CDCl3) δ: 3,69 (1Н, д, J=17,2 Гц), 3,83 (1Н, дд, J=17,2, 4,6 Гц), 4,05 (1Н, дд, J=17,2, 4,6 Гц), 4,70 (1Н, д, J=17,2 Гц), 7,17-7,27 (1Н, шир. с), 7,30-7,85 (12Н, м), 8,17 (1Н, с), 8,30-8,41 (1Н, м).
Пример 24. 2-(N-(трет-Бутоксикарбонилметил)-N'-(м- (карбоксифенил)уреидометилкарбониламино)аминобензофенон 8i.
В соответствии с тем же способом, что описан в примере 23, для получения целевого соединения используют аллиловый эфир 7с, полученный в примере 8. T. пл. 96-98oC.
ИК νмакс (KBr): 3380, 1739, 1661, 1595, 1555 см-1.
ЯМР (CDCl3) δ: 1,41 (9H, с), 3,57 (2Н, с), 3,63 (1Н, д, J=17,2 Гц), 3,75 (1Н, дд, J=17,0, 5,0 Гц), 4,02 (1Н, дд, J=17,0, 5,0 Гц), 4,61 (1Н, д, J=17,2 Гц), 6,42 (1Н, шир. с), 6,81-6,97 (2Н, м), 7,12- 7,24 (1Н, м), 7,40-7,70 (7Н, м), 7,71-7,82 (3Н, м).
Элементный анализ (C30H31N3O7•0,4H2O):
Вычислено: С 65,18; H 5,80; N 7,6.
Найдено: С 65,15; H 5,77; N 7,46.
Пример 25. 2-(N-(трет-Бутоксикарбонилметил)-N'-(м- (карбоксиметилокси)фенил)уреидометилкарбониламино)бензофенон 8j.
Аллиловый эфир 7d, полученный в примере 9, используют для получения целевого соединения в соответствии со способом, описанным в примере 23. Порошок.
ИК νмакс (KBr): 3380, 1740, 1662, 1599, 1551 см-1.
ЯМР (CDCl3) δ: 1,41 (9Н, с), 3,67 (1Н, д, J=17,0 Гц), 3,76 (1Н, дд, J= 17,4, 3,6 Гц), 4,06 (1Н, дд, J=17,4, 3,6 Гц), 4,59 (2Н, с), 4,62 (1H, д, J= 17,0 Гц), 6,38-6,53 (2Н, м), 6,71 (1Н, шир.с), 7,04-7,26 (2Н, м), 7,40-7,70 (6Н, м), 7,73-7,82 (3Н, м).
Элементный анализ (C30H31N3O8•0,4H2O):
Вычислено: С 63,35; H 5,64; N 7,39.
Найдено: С 63,34; H 5,70; N 7,29.
Пример 26. 2-(N-(трет-Бутоксикарбонилметил)-N'- (м- (карбоксиметилтио)фенил)уреидометилкарбониламино)бензофенон 8k.
Для получения целевого соединения используют аллиловый эфир 7е, полученный в примере 10, в соответствии со способом, описанным в примере 23.
ИК νмакс (KBr): 3380, 1738, 1661, 1595, 1547 см-1.
ЯМР (CDCl3) δ: 1,38 (9H, с), 3,60 (2Н, с), 3,68 (1Н, д, J=17,4 Гц), 3,80 (1Н, дд, J=17,2, 5,6 Гц), 4,03 (1Н, дд, J=17,2, 5,6 Гц), 4,60 (1Н, д, J=17,4 Гц), 6,28 (1Н, шир. с), 6,97-7,24 (4Н, м), 7,38-7,70 (7Н, м), 7,76-7,88 (3Н, м).
Элементный анализ (C30H31N3O7S•0,5H2O):
Вычислено: С 61,42; H 5,50; N 7,16; S 5,47.
Найдено: С 61,51; H 5,51; N 7,04.
Пример 27. 2-(N-(трет-Бутоксикарбонилметил)-N'-(м-(тетразол-5-ил) фенил)уреидометилкарбониламино)бензофенон 8p.
К раствору тритильного соединения f (570 мг, 0,71 ммоль), полученного в примере 11, в тетрагидрофуране (3 мл) и этаноле (10 мл) добавляют 1н. соляную кислоту (2,9 мл), и смесь перемешивают при комнатной температуре. Спустя три часа в реакционный раствор выливают воду и раствор экстрагируют этилацетатом. После того как органический слой промывают водой и сушат (сульфатом натрия), растворитель отгоняют, и получают целевое соединение (187 мг, 33,7%). T.пл. 163-175oC.
ИК νмакс (KBr): 3380, 1740, 1661, 1595, 1570 см-1.
ЯМР (CDCl3 + CD3OD) δ: 1,34 (9H, с), 3,67 (1Н, д, J=17,4 Гц), 3,85 (1Н, д, J=17,4 Гц), 4,01 (1Н, д, J=17,4 Гц), 7,07-7,92 (13Н, м).
Элементный анализ (C29H29N7O5•H2O):
Вычислено: С 60,72; H 5,45; N 17,09.
Найдено: С 60,86; H 5,40; N 16,72.
Пример 28. 2-(N-(трет-Бутоксикарбонилметил)-N'-(м-(тетразол-5- илметилокси)фенил)уреидометилкарбониламино)бензофенон 8q.
Для получения целевого соединения используют тритильное соединение 7g, полученное в примере 12, в соответствии со способом, описанным в примере 27.
ИК νмакс (KBr): 3400, 1741, 1662, 1600, 1555 см-1.
ЯМР (CDCl3 + CD3OD) δ: 1,39 (9Н, с), 3,64 (1Н, д, J=17,4 Гц), 3,81 (1Н, д, J= 17,4 Гц), 4,58 (1Н, д, J=17,4 Гц), 5,28 (2Н, дд, 20,1, 14,0 Гц), 6,36-6,47 (1Н, м), 6,77-7,03 (3Н, м), 7,44-8,00 (11Н, м).
Элементный анализ (C30H31N7O6•0,4H2O):
Вычислено: С 60,78; H 5,41; N 16,54.
Найдено: С 60,87; H 5,43; N 16,46.
Пример 29. 2-(N-(трет-Бутоксикарбонилметил)-N'-(м- (карбоксиметилсульфинил)фенил)уреидометилкарбониламино)бензофенон 8r.
Соединение 8k обрабатывают м-хлорнадбензойной кислотой обычным методом с получением целевого соединения. Порошок.
ЯМР (CDCl3) δ: 1,43 (9H, c), 3,74 (1H, д, J=17,2 Гц), 3,75-3,98 (4Н, м), 4,37 (1Н, д, J=17,2 Гц), 7,27-7,86 (13Н, м).
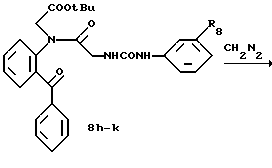

R8=h: -COOH;
i: -CH2COOH;
j: -OCH2COOH;
k: -SCH2COOH;
l: -COOMe;
m: -CH2COOMe;
n: -OCH2COOMe;
o: -SCH2COOMe;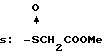
Пример 30. 2-(N-(трет-Бутоксикарбонилметил)-N'-(м-(карбометокси) фенил)уреидометилкарбониламино)бензофенон 9l.
Карбоновую кислоту, полученную в примере 23, обрабатывают раствором избытка диазометана в эфире, получая соединение 9l.
ИК νмакс (KBr): 3390, 1740, 1725, 1660, 1595, 1556 см-1.
ЯМР (CDCl3) δ: 1,38 (9H, с), 3,66 (1Н, д, J=17,0 Гц), 3,80 (1Н, дд, J= 17,6, 5,6 Гц), 4,04 (1Н, дд, J=17,6, 5,6 Гц), 4,63 (1Н, д, J=17,0 Гц), 5,96 (1Н, шир. с), 7,11 (1Н, с), 7,22-7,32 (1Н, м), 7,42-7,69 (8Н, м), 7,75-7,86 (3Н, м), 7,96 (1Н, шир. с).
Элементный анализ (C30H31N3O7•1,3H2O):
Вычислено: С 63,33; H 5,95; N 7,38.
Найдено: С 62,12; H 5,51; N 7,30.
Пример 31. 2-(N-(трет-Бутоксикарбонилметил)-N'-(м- (карбометоксиметил)фенил) уреидометилкарбонил)амино)бензофенон 9m.
Для получения целевого соединения в соответствии со способом, описанным в примере 30, используют карбоновую кислоту 8i, полученную в примере 24. Выход 42%, т.пл. 127-129oC.
ИК νмакс (KBr): 3359, 1740, 1658, 1562, 1494 см-1.
ЯМР (CDCl3) δ: 1,39 (3H, с), 3,55 (2Н, с), 3,65 (1Н, д, J=17,6 Гц), 3,67 (3Н, с), 3,77 (1Н, д, J=18,2 Гц), 4,01 (1Н, д, J=17,6 Гц), 4,64 (1Н, д, J= 17,6 Гц), 5,88 (1Н, шир.с), 6,91 (1Н, м), 7,15-7,81 (13Н, м).
Элементный анализ (C31H33N3O7):
Вычислено: С 66,53; H 5,94; N 7,56.
Найдено: С 66,41; H 6,02; N 7,61.
Пример 32. 2-(N-(трет-Бутоксикарбонилметил)-N'-(м- (карбометоксиметилокси) фенил)уреидометилкарбониламино)бензофенон 9n.
В соответствии со способом, описанным в примере получения соединения 91 примера 30, для получения целевого соединения используют карбоновую кислоту 8j, полученную в примере 25. T.пл. 74-77oC.
ИК νмакс (KBr): 3380, 1741, 1662, 1599, 1550 см-1.
ЯМР (CDCl3) δ: 1,40 (9Н, с), 3,63 (1Н, д, J=17,4 Гц), 3,75 (1Н, дд, J= 17,4, 8,6 Гц), 3,63 (1Н, д, J=17,4 Гц), 4,01 (1Н, дд, J=17,4, 8,6 Гц), 4,60 (2Н, с), 4,63 (1Н, д, J=17,4) 5,82 (1Н, шир. с), 6,57 (1Н, дд, J=7,6, 2,6 Гц), 6,72-6,88 (2Н, м), 7,00-7,18 (2Н, м), 7,37-7,68 (6Н, м), 7,72-7,85 (32Н, м).
Элементный анализ (C31H33N3O8):
Вычислено: С 64,69; H 5,78; N 7,30.
Найдено: С 64,54; H 5,85; N 7,21.
Пример 33. 2-(N-(трет-Бутоксикарбонилметил)-N'-(м- (карбометоксиметилтио)фенил)уреидометилкарбониламино) бензофенон 9o.
В соответствии со способом, описанным в получении соединения 9l примера 30, для получения целевого соединения используют карбоновую кислоту 8k, полученную в примере 26. T.пл. 131-133oC.
ИК νмакс (KBr): 3375, 1741, 1665, 1653, 1598, 1550 см-1.
ЯМР (CDCl3) δ: 1,40 (9H, с), 3,66 (1Н, д, J=17,4 Гц), 3,67 (2Н, с), 3,72 (3Н, с), 3,82 (1Н, дд, J=17,2, 5,6 Гц), 4,05 (1Н, дд, J=17,2, 5,6 Гц), 4,64 (1Н, д, J=17,4 Гц), 5,99 (1Н, шир. с), 6,91-7,20 (4Н, м), 7,32-7,73 (7Н, м), 7,75-7,87 (3Н, м).
Элементный анализ (C31H33N3O7S):
Вычислено: С 62,93; H 5,62; N 7,10; S 5,42.
Найдено: С 62,84; H 5,68; N 7,07; S 5,26.
Пример 34. 2-(N-(трет-Бутоксикарбонилметил)-N'-(м- (карбометоксиметилсульфинил)фенил)уреидометилкарбониламино)бензофенон 9s.
В соответствии с тем же способом, что описан в получении соединения 9l примера 30, для получения целевого соединения используют карбоновую кислоту 8r. Порошок.
ЯМР (CDCl3) δ: 1,41 (9Н, с), 3,70 (3Н, с), 3,73 (1Н, д, J=17,2 Гц), 3,74-4,00 (4Н, м), 4,37 (1Н, д, J=17,2 Гц), 7,09-7,87 (13Н, м).
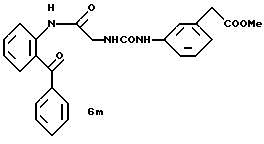
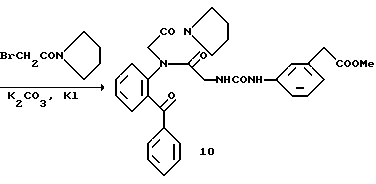
Пример 35. 2-(N-(Пирролидинокарбонилметил)-N'-(м- (карбометокси) фенил)уреидометилкарбониламино)бензофенон 10.
Целевое соединение получают в соответствии с тем же способом, что описан в примере 1, с использованием соединения 6m, полученного в соответствии со способом, используемым для получения соединения 6с в примере получения 9. Выход 30,4%, т.пл. 189-194oC.
ИК νмакс (KBr): 3378, 3332, 1740, 1653, 1595, 1561 см-1.
ЯМР (CDCl3) δ: 1,84 (4Н, с), 3,34 (4Н, м), 3,56 (2Н, с), 3,66 (3Н, с), 3,82 (1Н, д, J=16,8 Гц), 3,86 (2Н, кв, J=17,2 Гц), 4,82 (1Н, д, J=16,8 Гц), 5,84 (1Н, шир. с), 6,90-6,98 (1Н, м), 7,17-7,95 (13Н, м).
Элементный анализ (C31H32N4O6):
Вычислено: С 66,89; H 5,79; N 10,07.
Найдено: С 66,66; H 5,83; N 10,05.
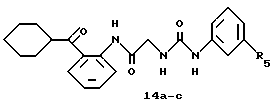

R8=a: -CH3, b: -CF3, c: -COOCH2CH=CH2, d: -COOH, e: -COOCH3.
Пример 36. Циклогексил-(2-(N-(трет-бутоксикарбонилметил)-N-(N'-(м-толил) уреидометилкарбонил)амино)кетон 15а.
В соответствии с тем же способом, что описан в примере 14, соединение 14а, полученное в примере получения 24, используют для получения целевого соединения 15а. T.пл. 128-130oC.
ИК νмакс (KBr): 3383, 1741, 1673, 1647, 1612, 1595, 1557, 1522 см-1.
ЯМР (CDCl3) δ: 1,10-1,53 (5Н, м), 1,47 (9Н, с), 1,62-1,97 (5Н, м), 2,27 (2Н, с), 3,60 (1Н, д, J=17,2 Гц), 3,64 (1Н, д, J=17,2 Гц), 3,81 (1Н, д, J= 17,2 Гц), 4,61 (1Н, д, J=17,2 Гц), 6,78 (1Н, м), 7,06-7,20 (4Н, м), 7,54-7,73 (4Н, м), 7,91 (1Н, м).
Элементный анализ (C29H37N3O5):
Вычислено: С 68,62; H 7,35; N 8,28.
Найдено: С 68,42; H 7,34; N 8,32.
Пример 37. Циклогексил-(2-(N-(трет-бутоксикарбонилметил) -N-(N'-(м-трифторметилфенил) уреидометилкарбонил)амино)фенил)кетон 15b.
В соответствии с тем же способом, что описан в примере 14, для получения целевого соединения 15b используют соединение 14b, полученное в примере получения 25. Аморфное твердое вещество.
ИК νмакс (KBr): 3374, 1741, 1741, 1685, 1651, 1597, 1560, 1511 см-1.
ЯМР (CDCl3) δ: 1,11-1,60 (5Н, м), 1,47 (9Н, с), 1,63-1,96 (5Н, м), 3,20 (1Н, м), 3,60 (1Н, д, J=17,0 Гц), 3,66 (1Н, д, J=18,4 Гц), 3,82 (1Н, д, J= 18,4 Гц), 4,61 (1Н, д, J=17,0 Гц), 7,06-7,28 (2Н, м), 7,33-7,52 (2Н, м), 7,56-7,76 (2Н, м), 7,81 (1Н, шир. с), 7,88 (1Н, м).
Элементный анализ (C29H34F3N3O5):
Вычислено: С 62,02; H 6,10; F 10,15; N 7,48.
Найдено: С 61,79; H 6,08; F 9,89; N 7,39.
Пример 38. Циклогексил-(2-(N-(трет-бутоксикарбонилметил)-N-(N'- (м-(арилоксикарбонил) фенил)уреидометилкарбонил)амино) кетон 15с.
В соответствии со способом, описанным в примере 14, для получения целевого соединения 15с используют соединение 14с, полученное в примере получения 26. Аморфное твердое вещество.
ИК νмакс (KBr): 3374, 1722, 1685, 1650, 1594, 1555 см-1.
ЯМР (CDCl3) δ: 1,12-1,95 (10Н, м), 1,40 (9Н, с), 3,07 (1Н, м), 3,53 (1Н, д, J= 17,2 Гц), 3,73 (1Н, д, J=17,4 Гц), 3,93 (1Н, д, J=17,4 Гц), 4,77-4,82 (2Н, м), 4,80 (1Н, д, J=17,2 Гц), 5,19-5,47 (2Н, м), 5,89-6,22 (2Н, м), 7,13-7,35 (3Н, м), 7,48-7,78 (4Н, м), 7,80 (1Н, шир. с).
Элементный анализ (C32H39N3O7• 0,2H2O).
Вычислено: С 66,12; H 6,68; N 7,23.
Найдено: С 66,18; H 6,79; N 7,17.
Пример 39. Циклогексил-(2-(N-(трет-бутоксикарбонилметил)-N-(N'-(м- карбоксифенил) уреидометилкарбонил)амино)фенил) кетон 15d.
В соответствии со способом, описанным в примере 23, для получения целевого соединения 15d используют соединение 15с. T.пл. 175-181oC.
ИК νмакс (KBr): 3379, 1735, 1685, 1610, 1595, 1554 см-1.
ЯМР (CDCl3) δ: 1,08-1,55 (5Н, м), 1,46 (9Н, с), 1,61-1,98 (5Н, м), 3,19 (1Н, м), 3,60 (1Н, д, J=17,2 Гц), 3,66 (1Н, д, J=17,0 Гц), 3,83 (1Н, д, J= 17,0 Гц), 4,62 (1Н, д, J=17,2 Гц), 7,27(1Н, т, J=6,0 Гц), 7,51-7,75 (5Н, м), 7,86-7,93 (2Н, м).
Элементный анализ (C29H35N3O7• 1,2H2O):
Вычислено: С 62,29; H 6,74; N 7,51.
Найдено: С 62,11; H 6,35; N 7,37.
Пример 40. Циклогексил-(2-(N-(трет-бутоксикарбонилметил)-N-(N'- (м-карбометоксифенил) уреидометилкарбонил)амино)фенил)кетон 15е.
В соответствии со способом, описанным в примере 30, для получения целевого соединения 15е используют соединение 15d. Аморфное твердое вещество.
ИК νмакс (KBr): 3380, 1724, 1664, 1594, 1555 см-1.
ЯМР (CDCl3) δ: 1,13-1,93 (10Н, м), 1,43 (9Н, с), 3,07 (1Н, м), 3,49 (1Н, д, J=17,1 Гц), 3,75 (1Н, дд, J=17,1, 5,1 Гц), 3,88 (3Н, с), 3,90 (1Н, дд, J= 17,1, 5,1 Гц), 4,80 (1Н, д, J=17,1 Гц), 5,87 (1Н, шир. с), 6,93 (1Н, с), 7,43-7,84 (8Н, с), 7,94 (1Н, с).
Элементный анализ (C30H37N3O7• 0,2H2O):
Вычислено: С 64,90; H 6,79; N 7,57.
Найдено: С 64,95; H 6,52; N 7,48.
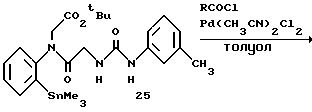
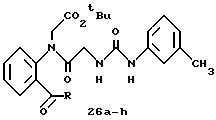
26a: X=4-CF3,
26b: X=2-F,
26c: X=4-CN,

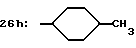
Пример 41. трет-Бутил ((2-(4-трифторметилбензоил)фенил)-(2-(3- м-толилуреидо)ацетил)амино)ацетат 26а.
К раствору 4-трифторметилбензоилхлорида (53 мкл, 0,36 ммоль) в толуоле (94 мл) добавляют дихлорбисацетонитрилпалладий (12,5 мг, 0,036 ммоль) при комнатной температуре. Затем добавляют трет-бутил ((2-триметилстаннилфенил)- (2-(3-м-толилуреидо)ацетил)амино)ацетат (соединение 25) (200 мг, 0,36 ммоль), и смесь перемешивают при 50oC в течение 20 минут. После добавления дихлорбисацетонитрилпалладия (6,2 мг, 0,018 ммоль) перемешивание продолжают еще в течение 10 минут. К реакционному раствору добавляют охлажденную льдом воду. После перемешивания водный слой экстрагируют дважды этилацетатом. Органический слой промывают насыщенным солевым раствором, сушат над безводным сульфатом магния и затем концентрируют. Остаток очищают с помощью колоночной хроматографии на силикагеле с получением целевого соединения 26а (93 мг). Выход 46%.
ЯМР (CDCl3) δ: 1,40 (9H, с), 2,28 (3H, с), 3,70 (1Н, д, J=17,2 Гц), 3,80 (1Н, дд, J=4,4, 17,2 Гц), 3,97 (1Н, дд, J=4,6, 17,7 Гц), 4,63 (1Н, д, J=17,2 Гц), 5,77-5,87 (1Н, м), 6,67 (1Н, шир. с), 6,80- 7,18 (4Н, м), 7,41-7,94 (8Н, м).
Пример 42. трет-Бутил ( (2-(4-фторбензоил) фенил)-(2-(3-м- толилуреидо)ацетил)амино)ацетат 26b.
В соответствии со способом получения соединения 26a для получения целевого соединения 26b используют трет-бутил ((2-триметил-станнилфенил) -(2-(3-м-толилуреидо)ацетил) амино)ацетат (соединение 25) (200 мг) и 2-фторбензоилхлорид (43 мкл). Выход 56 мг, 30%.
ЯМР (CDCl3) δ: 1,41 (9Н, с), 2,28 (3Н, с), 3,68 (1Н, д, J=17,6 Гц), 3,81 (1Н, дд, J=4,2, 17,5 Гц), 4,01 (1Н, дд, J=4,6, 17,5 Гц), 4,67 (1Н, д, J=17,6 Гц), 5,82-5,95 (1Н, м), 5,98-7,75 (13Н, м).
Пример 43. трет-Бутил ((2-(4-цианобензоил)фенил)-(2-(3-м-толилуреидо) ацетил)амино) ацетат 26c.
В соответствии со способом получения соединения 26а трет-бутил ((2-триметил-станнилфенил)-(2-(3-м-толилуреидо)ацетил)-амино)ацетат (соединение 25) (200 мг) и 4-цианобензоилхлорид (59 мкл) используют для получения целевого соединения 26с (88 мг). Выход 47%.
1H ЯМР (CDCl3) δ млн.дол.: 1,39 (9Н, с), 2,29 (3Н, с), 3,74 (1Н, д, J= 17,2 Гц), 3,80 (1Н, дд, J=4,6, 17,6 Гц), 3,93 (1Н, дд, J=4,2, 17,6 Гц), 4,60 (1H, д, J=17,2 Гц), 5,82-5,89 (1Н, м), 6,73-7,20 (5H, м), 7,42-7,94 (8Н, м).
Пример 44. трет-Бутил ((2-адамантан-1-карбонил)фенил)-(2-(3-м-толилуреидо) ацетил)амино)ацетат 26d.
В соответствии со способом получения соединения 26а для получения целевого соединения 26d (40 мг) используют трет-бутил ((2-триметилстаннилфенил)-(2-(3-м-толилуреидо)ацетил)амино)ацетат (соединение 25) (250 мг) и адамантан-1-карбонилхлорид (89 мг). Выход 16%.
1H ЯМР (CDCl3) δ млн. дол.: 1,43 (9Н, с), 1,71 (6Н, с), 1,90 (6Н, с), 2,05 (3Н, с), 2,30 (3Н, с), 3,69 (1Н, д, J=17,2 Гц), 3,90 (1Н, д, J=17,4 Гц), 4,01 (1Н, д, J=17,4 Гц), 4,63 (1Н, д, J=17,2 Гц), 5,83 (1Н, шир. с), 6,74-7,46 (9Н, м).
Пример 45. трет-Бутил ((2-(1-оксо-2-пропилпентил)-(2-(3-м-толилуреидо) ацетил)амино)ацетат 26е.
В соответствии со способом получения соединения 26а для получения целевого соединения 26е (7 мг) используют трет-бутил ((2-триметилстаннилфенил)-(2-(3-м-толилуреидо)ацетил)амино)-ацетат (соединение 25) (42 мг) и 2-н-пропил-н-валероилхлорид (12 мг). Выход 18%.
ЯМР (CDCl3) δ: 0,85-0,91 (6Н, с), 1,42 (9Н, с), 2,30 (3Н, с), 2,30 (3Н, с), 3,49 (1Н, д, J=17,4 Гц), 3,65 (1Н, д, J=17,4 Гц), 3,92 (1Н, д, J=17,4 Гц), 4,84 (1Н, д, J=17,4 Гц), 5,97 (1Н, шир. с), 6,80-7,18 (5Н, м), 7,38-7,78 (4Н, м).
Пример 46. трет-Бутил ((2-(циклопропанкарбонил)фенил)-(2- (3-м-толилуреидо)ацетил)амино) ацетат 26f.
В соответствии со способом получения соединения 26а трет-бутил ((2-триметилстаннилфенил)-(2-(3-м-толилуреидо)ацетил)-амино)ацетат (соединение 25) (112 мг) и циклопропанкарбонилхлорид (18,1 мкл) используют для получения целевого соединения 26f (45 мг). Выход 48%.
ЯМР (CDCl3) δ: 1,02-1,14 (2Н, м), 1,19-1,31 (2Н, м), 1,41 (9Н, с), 2,28 (3Н, с), 2,38-2,47 (1Н, с), 3,56 (1Н, д, J=17,4 Гц), 3,76 (1Н, дд, J=5,0 Гц, 17,5 Гц), 3,90 (1Н, дд, J=4,6 Гц, 17,5 Гц), 4,82 (1Н, д, J=17,4 Гц), 5,98-6,07 (1Н, м), 6,82 (1Н, д, J=7,0 Гц), 6,99-7,21 (4Н, м), 7,39-7,70 (3Н, м), 7,81-7,88 (1Н, м).
Пример 47. трет-Бутил ((2-(транс-4-метилциклогексан-1-карбонил) фенил)-(2-(3-м-толилуреидо)ацетил)амино)ацетат 26g.
В соответствии со способом получения соединения 26а трет-бутил ((2-триметилстаннилфенил)-(2-(3-м-толилуреидо)ацетил)амино)ацетат (соединение 25) (112 мг) и хлорангидрид кислоты, полученной из толилхлорида (120 мкл), и транс-4-метилциклогексан-1-карбоновой кислоты (29 мг) используют для получения целевого соединения 26g (35 мг). Выход 34%.
ЯМР (CDCl3) δ: 0,84-1,93 (9Н, м), 0,90 (3Н, д, J=6,4 Гц), 1,43 (9Н, с), 2,30 (3Н, с), 2,90-3,07 (1Н, м), 3,48 (1Н, д, J=17,2 Гц), 3,68 (1Н, дд, J= 4,6 Гц, 17,7 Гц), 3,89 (1Н, дд, J=4,6 Гц, 17,7 Гц), 4,80 (1Н, д, J=17,2 Гц), 5,85-5,99 (1Н, м), 6,74 (1Н, с), 6,85 (1Н, д, J=6,8 Гц), 7,02-7,32 (3Н, м), 7,47-7,76 (4Н, м).
Пример 48. трет-Бутил ((2-(N-(бензилоксикарбонил)пиперидин-4-карбонил) фенил)-(2-(3-м-толилуреидо)ацетил)амино)ацетат 26h.
В соответствии со способом получения соединения 26а ((2-триметилстаннилфенил)-(2-(3-м-толилуреидо)ацетил)амино) трет-бутил ацетат (соединение 25) (420 мг) и хлорангидрид кислоты, полученной из толилхлорида (220 мкл), и N-(бензилоксикарбонил)пиперидин-4-карбоновой кислоты (198 мг) (соединение, описанное в J.Med.Chem. 1988, 31, 613-617) используют для получения целевого соединения 26h (232 мг). Выход 48%.
ЯМР (CDCl3) δ: 1,41 (9Н, с), 1,50-1,92 (4Н, м), 2,28 (3Н, с), 2,77-3,02 (2Н, м), 3,16-3,36 (1Н, м), 3,50 (1Н, д, J=17,2 Гц), 3,72 (1Н, дд, J=4,6 Гц, 17,6 Гц), 3,85 (1Н, дд, J=4,2 Гц, 17,6 Гц), 4,04- 4,34 (2Н, м), 4,75 (1Н, д, J=17,2 Гц), 5,86-5,97 (1Н, м), 6,77-7,20 (5Н, с), 7,48-7,73 (4Н, м).


Пример 49. трет-Бутил ((2-(пиперидин-4-карбонил)фенил)-(2-(3-м- толилуреидо)ацетил)амино)ацетат 60.
трет-Бутил ((2-(N-(бензилоксикарбонил)пиперидин-4-карбонил)фенил)-(2- (3-м-толилуреидо)ацетил)амино)ацетат и соединение 26g (97 мг, 0,015 ммоль) растворяют в этаноле. К раствору добавляют гидроокись палладия- угольного порошка (2 мг) и перемешивают в атмосфере водорода (1 атм) при комнатной температуре в течение 24 часов. Реакционный раствор фильтруют и фильтрат концентрируют при пониженном давлении. Остаток очищают с помощью колоночной хроматографии на силикагеле и получают целевое соединение 60 (6,0 мг). Выход 79%.
ЯМР (CDCl3) δ: 1,42 (9H, с), 1,53-1,76 (2Н, м), 1,76-1,92 (2Н, м), 2,29 (3Н, с), 2,60-2,82 (2Н, м), 3,08-3,28 (3Н, м), 3,52 (1Н, д, J=17,2 Гц), 3,63-3,76 (1Н, м), 3,79-3,94 (1Н, м), 4,77 (1Н, д, J=17,2 Гц), 5,99 (1Н, шир. с), 6,83 (1Н, д, J=6,6 Гц), 7,02-7,19 (4Н, с), 7,46-7,77 (4Н, м).


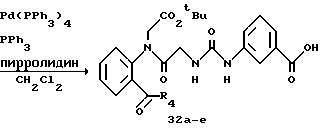
a: X=2-F,
b: X=4-CF3,
c: X=4-CN,

Пример 50. Аллил 3-(3-(трет-бутоксикарбонилметил-(2-(2-фторбензоил) фенилкарбамоилметил)уреидо)бензоат 31а.
В соответствии с процессом получения соединения 24 соединение 30a (350 мг) используют в качестве исходного материала для получения целевого соединения 31a (230 мг). Выход 65%.
ЯМР (CDCl3) δ: 1,38 (9H, с), 3,72 (1Н, д, J=17,6 Гц), 3,85 (1Н, дд, J= 4,4 Гц, 17,4 Гц), 4,04 (1Н, дд, J=5,2 Гц, 17,4 Гц), 4,65 (1Н, д, J=17,6 Гц), 4,78 (2Н, д, J= 5,4 Гц), 5,20-5,46 (2Н, м), 5,91-6,12 (2Н, м), 7,05-8,02 (13Н, м).
Пример 51. Аллил 3-(3-(трет-бутоксикарбонилметил-(2-(4- трифторметилбензоил)фенилкарбамоилметил)уреидо)бензоат 31b.
В соответствии с процессом получения соединения 24 для получения целевого соединения 31b (238 мг) в качестве исходного материала используют соединение 30b (300 мг). Выход 56%.
ЯМР (CDCl3) δ: 1,36 (9Н, с), 3,75 (1Н, д, J=17,2 Гц), 3,79 (1Н, дд, J= 4,8 Гц, 17,6 Гц), 4,00 (1Н, дд, J=4,8 Гц, 17,6 Гц), 4,61 (1Н, д, J=17,2 Гц), 4,78 (2Н, д, J= 5,4 Гц), 5,20-5,44 (2Н, м), 5,90-6,12 (2Н, м), 7,18-7,96 (13Н, м).
Пример 52. Аллил 3-(3-(трет-бутоксикарбонилметил-(2-(4-цианобензоил) фенилкарбамоилметил)уреидо)бензоат 31с.
В соответствии с процессом получения соединения 24 для получения целевого соединения 31с (270 мг) в качестве исходного материала используют соединение 30c (390 мг). Выход 53%.
ЯМР (CDCl3) δ: 1,36 (9Н, с), 3,80 (1Н, д, J=17,2 Гц), 3,83 (1Н, дд, J= 4,8 Гц, 17,6 Гц), 3,96 (1Н, дд, J=4,8 Гц, 17,6 Гц), 4,58 (1Н, д, J=17,2 Гц), 4,79 (2Н, д, J= 5,4 Гц), 5,21-5,44 (2Н, м), 5,91-6,12 (2Н, м), 7,17-7,94 (13Н, м).
Пример 53. Аллил 3-(3-(трет-бутоксикарбонилметил-(2- (адамантан-1-карбонил)фенилкарбамоилметил)уреидо) бензоат 31d.
В соответствии с процессом получения соединения 24 для получения целевого соединения 31d используют в качестве исходного материала соединение 30d (44 мг) (30 мг, выход 56%).
ЯМР (CDCl3) δ: 1,41 (9Н, с), 1,70 (6Н, с), 1,92 (6Н, с), 2,05 (3Н, с), 3,73 (1Н, д, J=17,2 Гц), 3,93 (1Н, дд, J=4,4 Гц, 17,5 Гц), 4,07 (1Н, дд, J= 4,8 Гц, 17,5 Гц), 4,63 (1Н, д, J=17,2 Гц), 4,79 (2Н, д, J=5,6 Гц), 5,22-5,46 (2Н, м), 5,91-6,13 (2Н, м), 7,22-8,02 (9Н, м).
Пример 54. Аллил 3-(3-(трет-бутоксикарбонилметил-(2- (1-оксопропилпентил)фенилкарбамоилметил)уреидо)бензоат 31e.
В соответствии с процессом получения соединения 24 для получения целевого соединения 31е (14 мг) в качестве исходного материала используют соединение 30e (200 мг). Выход 6%.
ЯМР (CDCl3) δ: 0,89 (6Н, т, J=7,0 Гц), 1,20-1,73 (8Н, м), 1,41 (9Н, с), 3,18-3,31 (1Н, м), 3,51 (1Н, д, J=17,2 Гц), 3,68 (1Н, дд, J=4,6 Гц, 17,6 Гц), 3,95 (1Н, дд, J=4,6 Гц, 17,6 Гц), 4,79 (1Н, д, J=5,6 Гц), 4,83 (2Н, д, J=17,2 Гц), 5,22-5,45 (2Н, м), 5,91-6,13(2Н, м), 7,10-8,00 (9Н, м).
Пример 55. 3-(3-(трет-Бутоксикарбонилметил(2-(2-фторбензоил)- фенилкарбамоилметил)уреидо)бензойная кислота 32a.
В соответствии с тем же способом, что описан в примере 21 (3), соединение 31а (60 мг) используют в качестве исходного материала для получения целевого соединения 32а (40 мг). Выход 71%.
ЯМР (CDCl3) δ: 1,48 (9H, с), 3,70 (1Н, д, J=17,0 Гц), 3,89 (1Н, дд, J= 3,2 Гц, 18,1 Гц), 4,05 (1Н, дд, J=3,2 Гц, 18,1 Гц), 4,74 (1Н, д, J=17,0 Гц), 7,05-7,80 (13Н, м), 8,20 (1Н, с), 8,34-8,43 (1Н, м).
Пример 56. 3-(3-(трет-Бутоксикарбонилметил(2-(4- трифторметилбензоил)фенилкарбамоилметил)уреидо)бензойная кислота 32b.
В соответствии с тем же способом, что описан в примере 21 (3), соединение 31b (130 мг) используют в качестве исходного материала для получения целевого соединения 32b (24 мг). Выход 20%.
ЯМР (CDCl3) δ: 1,46 (9H, с), 3,73 (1Н, д, J=17,2 Гц), 3,84 (1Н, дд, J= 3,8 Гц, 18,8 Гц), 3,94 (1Н, дд, J=3,8 Гц, 18,8 Гц), 4,70 (1Н, д, J=17,2 Гц), 7,17 (1Н, шир.с), 7,29-7,98 (11Н, м), 8,14 (1Н, с), 8,28 (1Н, д, J=7,6 Гц).
Пример 57. 3-(3-(трет-Бутоксикарбонилметил(2-(4- цианобензоил)фенилкарбамоилметил)уреидо)бензойная кислота 32с.
В соответствии с тем же способом, что описан в примере 21 (3), соединение 31с (200 мг) используют в качестве исходного материала для получения целевого соединения 32с (133 мг). Выход 71%.
ЯМР (CDCl3) δ: 1,47 (9H, c), 3,76 (1H, д, J=17,2 Гц), 3,83 (1H, дд, J= 4,0 Гц, 17,6 Гц), 3,94 (1Н, дд, J=4,0 Гц, 17,6 Гц), 4,68 (1Н, д, J=17,2 Гц), 7,16 (1Н, шир.с), 7,31-7,94 (м, 11H), 8,15 (1Н, с), 8,26-8,34 (1Н, м).
Пример 58. 3-(3-(трет-Бутоксикарбонилметил(2- (адамантан-1-карбонил)фенилкарбамоилметил)уреидо)бензойная кислота 32d.
В соответствии с тем же способом, что описан в примере 21(3), соединение 31d (30 мг) используют в качестве исходного материала для получения целевого соединения 32d (17 мг). Выход 61%.
ЯМР (CDCl3) δ: 1,49 (9Н, с), 1,68 (6Н, с), 1,90 (6Н, с), 2,05 (3Н, с), 3,73 (1Н, д, J=17,2 Гц), 3,96 (1Н, дд, J=3,6 Гц, 18,4 Гц), 4,10 (1Н, дд, J= 3,6 Гц, 18,4 Гц), 4,65 (1Н, д, J=17,2 Гц), 7,19 (1Н, шир.с), 7,30-7,78 (8Н, м), 8,15 (1Н, с), 8,34-8,41 (1Н, м).
Пример 59. 3-(3-(трет-Бутоксикарбонилметил(2-(1-оксо-2-пропил- пентил)фенилкарбамоилметил)уреидо)бензойная кислота 32е.
В соответствии с тем же способом, что описан в примере 21 (3), соединение 31е (14 мг) используют в качестве исходного материала для получения целевого соединения 32е (7 мг). Выход 54%.
ЯМР (CDCl3) δ: 0,90 (6H, т, J=7,0 Гц), 1,18-1,76 (8Н, м), 1,49 (9Н, с), 3,18-3,34 (1Н, м), 3,53 (1Н, д, J=17,2 Гц), 3,73 (1Н, дд, J=3,6 Гц, 18,2 Гц), 3,96 (1Н, дд, J=4,6 Гц, 17,6 Гц), 4,85 (1Н, д, J=17,2 Гц), 7,20-7,86 (7H, м), 8,23 (1H, с), 8,57 (1H, д, J=7,8 Гц).
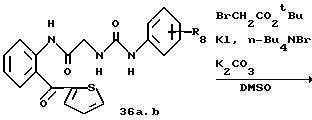
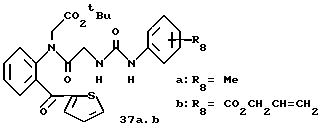

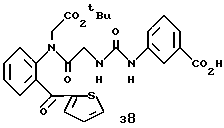
Пример 60. трет-Бутил ((2-(тиофен-2-карбонил)фенил)-(2-(3- м-толилуреидо)ацетил)амино)ацетат 37а.
В соответствии со способом получения соединения 24 соединение 36a используют для получения целевого соединения 37а. T.пл. 116oC.
ИК νмакс (KBr): 3347, 1745, 1645, 1614, 1563 см-1.
ЯМР (CDCl3) δ: 1,43 (9Н, с), 2,31 (3Н, с), 3,70 (1Н, д, J=17,1 Гц), 4,74 (1Н, д, J=17,1 Гц), 3,75 (1Н, д, J=17,4 Гц), 4,00 (1Н, д, J=17,4 Гц), 5,80 (1Н, шир. с), 6,67 (1Н, м), 6,87 (1Н, м), 7,01 (1Н, м), 7,10-7,22 (3Н, м), 7,50-7,70 (4Н, м), 7,75-7,80 (2Н, м).
Элементный анализ (C27H29N3O5S):
Вычислено: С 63,89; H 5,76; N 8,28; S 6,32.
Найдено: С 64,01; H 5,88; N 8,25; S 6,51.
Пример 61. Аллил 3-(3-(трет-бутоксикарбонилметил-(2-(тиофен-2-карбонил) фенилкарбамоилметил)уреидо) бензоат 37b.
В соответствии со способом получения соединения 24 соединение 36b используют для получения целевого соединения 37b. T.пл. 142oC.
ИК νмакс (KBr): 3343, 1742, 1722, 1645, 1595, 1561 см-1.
ЯМР (CDCl3) δ: 1,40 (9H, с), 3,69 (1Н, д, J=17,5 Гц), 4,71 (1Н, J=17,5 Гц), 3,78 (1Н, д, J=17,5 Гц), 4,00 (1Н, д, J=17,5 Гц), 4,80 (2Н, дт, J=6,0 Гц, 0,8 Гц), 5,26 (1Н, дд, J=9,0 Гц, 1,5 Гц), 5,39 (1Н, дд, J=17,4 Гц, 1,8 Гц), 5,80-6,08 (2Н, м), 7,02 (1Н, с), 7,15 (1Н, м), 7,31 (1Н, м), 7,50-7,70 (6Н, м), 7,78 (2Н, м), 7,93 (1Н, м).
Элементный анализ (C30H31N3O7S):
Вычислено: С 62,38; H 5,41; N 7,27; S 5,55.
Найдено: С 62,19; H 5,43; N 7,26; S 5,53.
Пример 62. 3-(3-(трет-Бутоксикарбонилметил(2-(тиофен-2-карбонил) фенилкарбамоилметил)уреидо)бензойная кислота 38.
В соответствии с тем же способом, что описан в примере 21 (3), соединение 37b используют в качестве исходного материала для получения целевого соединения 38. T.пл. 184-187oC.
ИК νмакс (KBr): 3385, 1735, 1698, 1648, 1560 см-1.
ЯМР (CDCl3) δ: 1,38 (9H, c), 3,58 (1H, дд, J=16,8 Гц, 4,2 Гц), 3,78 (1Н, дд, J= 16,8 Гц, 4,2 Гц), 3,72 (1Н, д, J=17,2 Гц), 4,29 (1Н, д, J=17,2 Гц), 6,37 (1Н, т, J=4,4 Гц), 7,20-7,35 (2Н, м), 7,40-7,80 (7Н, м), 7,99 (1Н, м), 8,18 (1Н, дд, J=5,0 Гц, 1,2 Гц), 8,99 (1Н, с).
Элементный анализ (C27H27N3O7S• 0,2H2O):
Вычислено: С 59,92; H 5,10; N 7,76; S 5,92.
Найдено: С 59,87; H 5,17; N 7,66; S 5,87.
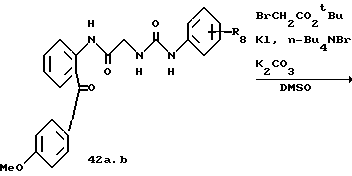

a: R8 = m - Me,
b: R8 = p-CO2CH2CH=CH2,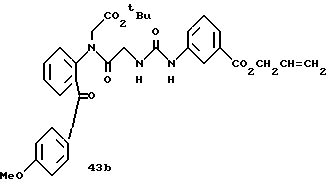
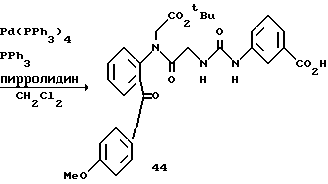
Пример 63. трет-Бутил ((2-(4-метоксибензоил)фенил)-(2-(3- м-толилуреидо)ацетил)амино)ацетат 43а.
В соответствии со способом получения соединения 24 соединение 42а используют для получения целевого соединения. T.пл. 228-230oC.
ИК νмакс (KBr): 3330, 1744, 1670, 1640, 1600 см-1.
ЯМР (DMCO-d6) δ: 1,36 (9Н, с), 2,22 (3Н, с), 3,62 (1Н, дд, J=18 Гц, 5,1 Гц), 3,68 (1Н, д, J=16,8 Гц), 3,77 (1Н, дд, J=18,0 Гц, 5,1 Гц), 3,83 (3Н, с), 4,20 (1Н, д, J=16,8 Гц), 6,36 (1Н, т, J=5,1 Гц), 6,70 (1Н, д, J=7,5 Гц), 7,05-7,18 (5Н, м), 7,52-7,76 (5H, м), 8,79 (1Н, с).
Элементный анализ (С30H33H3О6):
Вычислено: С 67,78; H 6,25; N 7,90.
Найдено: С 67,75; H 6,35; N 7,98.
Пример 64. Аллил 3-(3-(трет-бутоксикарбонилметил(2-(4-метоксибензоил) фенил)карбамоилметил)уреидо) бензоат 43b.
В соответствии со способом получения соединения 24 соединение 42b используют для получения целевого соединения. T.пл. 190-191oC.
ИК νмакс (KBr): 1741, 1721, 1645, 1599, 1566 см-1.
ЯМР (DMCO-d6) δ: 1,38 (9H, с), 3,60-3,85 (3Н, м), 3,84 (3Н, с), 4,20 (1Н, д, J= 16,8 Гц), 4,79 (2Н, д, J=5,4 Гц), 5,27 (1Н, д, J=7,5 Гц), 5,39 (1Н, д, J=17,1 Гц), 5,98-6,11 (1Н, м), 6,38 (1Н, т, J=4,5 Гц), 7,08 (2Н, д, J= 9,0 Гц), 7,37 (1Н, д, J=8,0 Гц), 7,49-7,76 (8Н, м), 8,10 (1Н, с), 9,07 (1Н, с).
Элементный анализ (C33H35N3O8):
Вычислено: С 65,88; H 5,86; N 6,98.
Найдено: С 65,70; H 5,91; N 6,97.
Пример 65. 3-(3-(трет-Бутоксикарбонилметил(2-(4-метоксибензоил) фенил)карбамоилметил)уреидо)бензойная кислота 44.
В соответствии с тем же способом, что описан в примере 21 (3), соединение 43b используют в качестве исходного материала для получения целевого соединения 44. T.пл. 198-200oC.
ИК νмакс (KBr) : 1743, 1694, 1647, 1599, 1557 см-1.
ЯМР (CD3OD) δ: 1,43 (9Н, с), 3,69 (1Н, д, J=17,2 Гц), 3,79 (1Н, д, J= 17,4 Гц), 3,85 (3Н, с), 3,94 (1Н, д, J=17,2 Гц), 4,39 (1Н, д, J=17,2 Гц), 7,02-7,05 (2H, м), 7,28-7,36 (1H, м), 7,49-7,83 (8H, м), 7,97-7,99 (1Н, м).
Элементный анализ (C30H31N3O8):
Вычислено: С 64,16; H 5,56; N 7,48.
Найдено: С 63,76; H 5,63; N 7,35.
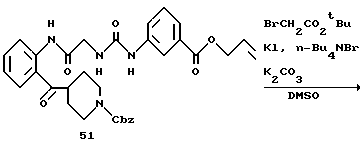
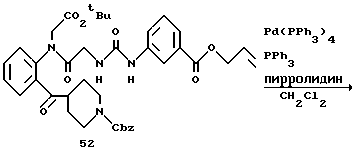
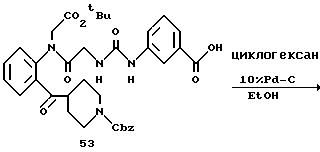
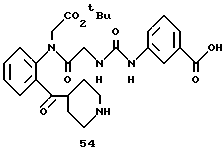
Пример 66. 3-(3-(трет-Бутоксикарбонилметил(2-(N-(бензилоксикарбонил) пиперидин-4-карбонил)фенилкарбамоилметил)-уреидо)бензоат 52.
В соответствии со способом получения соединения 24 аллил 3-(3-(2-(N-(бензилоксикарбонил)пиперидин-4-карбонил)фенил- карбамоилметил)уреидо)бензоат, соединение 51 (599 мг), используют в качестве исходного материала для получения целевого соединения 52 (140 мг). Выход 20%.
ЯМР (CDCl3) δ: 1,47-1,74 (2Н, м), 1,74-1,94 (2Н, м), 1,39 (9Н, с), 2,76-3,04 (2Н, м), 3,17-3,37 (1Н, м), 3,53 (1Н, д, J=17,6 Гц), 3,62 (1Н, дд, J= 4,4 Гц, 17,5 Гц), 3,88 (1Н, дд, J=4,8 Гц, J=17,5 Гц), 4,05-4,33 (2Н, м), 4,74 (1Н, д, J= 17,6 Гц), 4,77 (2Н, д, J=4,2 Гц), 5,12 (2Н, с), 5,22-5,44 (2Н, м), 5,90-6,17 (2Н, м), 7,20-7,41 (7Н, м), 7,47-7,76 (6Н, м), 7,93 (1Н, с).
Пример 67. 3-(3-(трет-Бутоксикарбонилметил (2-(N-(бензилоксикарбонил) пиперидин-4-карбонил)фенилкарбамоилметил)-уреидо)бензойная кислота 53.
В соответствии с тем же способом, что описан в примере 21 (3), аллил 3-(3-(трет-бутоксикарбонилметил (2-(N-(бензилоксикарбонил) пиперидин-4-карбонил)фенилкарбамоилметил)уреидо)-бензоат, соединение 52 (130 мг), используют в качестве исходного материала для получения целевого соединения 53 (96 мг). Выход 78%.
ЯМР (CDCl3) δ: 1,47 (9H, c), 1,51-1,95 (4H, м), 2,80-3,08 (2H, м), 3,20-3,44 (1H, м), 3,54 (1H, д, J=17,2 Гц), 3,69-3,98 (2H, м), 4,18-4,38 (2H, м), 4,79 (1Н, д, J=17,2 Гц), 5,11 (2Н, с), 7,16 (1Н, шир. с), 7,40-7,87 (8Н, м), 8,21-8,40 (2Н, м).
Пример 68. 3-(3-(трет-Бутоксикарбонилметил(2-(пиперидин-4- карбонил)фенилкарбамоилметил)уреидо)бензойная кислота 54.
К раствору 3-(3-(трет-бутоксикарбонилметил-(2-(N- (бензилоксикарбонил)пиперидин-4-карбонил)фенилкарбамоилметил)уреидо)- бензойной кислоты (соединение 53) (19 мг, 1,49 мкмоль) в этаноле (1,0 мл) добавляют циклогексен (144 мкл) и 10%-ный палладий-уголь (15 мг), и смесь нагревают с обратным холодильником при перемешивании в течение 30 минут. Реакционный раствор фильтруют и фильтрат концентрируют при пониженном давлении, получают целевое соединение 54 (12 мг). Выход 79%.
ЯМР (CD3OD) δ: 1,44 (9H, с), 1,65-2,19 (4Н, м), 3,17-3,91 (5Н, м), 3,64 (1Н, д, J=17,2 Гц), 3,68 (1Н, д, J=17,2 Гц), 3,84 (1Н, д, J=17,2 Гц), 4,65 (1Н, д, J=17,2 Гц), 7,12-7,84 (7Н, м), 8,17 (1Н, м).


Пример 69. 2-(N-(трет-Бутилкарбамоилметил)-N'-(м-(арилоксикарбамоил) фенил)уреидометилкарбониламино)бензофенон 16a.
В соответствии с тем же способом, что описан в примере 14, соединение 6b используют в качестве исходного материала для получения целевого соединения. Порошок.
ИК νмакс (KBr): 3372, 3068, 2969, 2931, 1719, 1662 см-1.
ЯМР (CDCl3) δ: 1,20 (7H, c), 1,36 (2H, c), 3,76 (1H, д, J=15,6 Гц), 3,84 (1H, дд, J=4,8 Гц, 17,4 Гц), 3,97 (1H, дд, J=4,8 Гц, 17,1 Гц), 4,32 (1Н, д, J= 15,6 Гц), 4,78 (1Н, д, J=3,8 Гц), 7,42-7,80 (12Н, м), 7,95 (1Н, т, J=1,8 Гц).
Элементный анализ (C32H34N4O6•0,2C6H14• 0,1H2O):
Вычислено: С 67,44; H 6,31; N 9,47.
Найдено: С 67,19; H 6,55; N 9,59.
Пример 70. 2-(N-(трет-Бутилкарбамоилметил)-N'-(м-карбоксифенил) уреидометилкарбониламино)бензофенон 16b.
В соответствии с тем же способом, что описан в примере 23, соединение 16а используют в качестве исходного материала для получения целевого соединения. Порошок.
ИК νмакс (KBr): 3376, 3067, 2969, 2931, 1661 см-1.
ЯМР (CDCl3 + CD3OD) δ: 1,24 (9H, с), 3,76 (1Н, д, J=15,6 Гц), 3,80 (1Н, д, J= 17,4 Гц), 3,99 (1Н, д, J=17,4 Гц), 4,40 (1Н, д, J=15,6 Гц), 7,30-7,89 (13Н, м).
Элементный анализ (C29H30N4O6•0,1C6H14• 0,25C4H10•0,4H2O):
Вычислено: С 65,06; H 6,19; N 9,92.
Найдено: С 64,92; H 6,48; N 10,22.
Гастринингибирующее фармакологическое действие соединения (I), полученного в примерах, проверялось опытами in vitro и in vivo.
Эксперимент 1. Испытание in vivo. Оценка ингибиторного действия на секрецию желудочной кислоты по методу Чайлд.
Самцов крыс Sprague Daily, содержавшихся в условиях голодания в течение 24 часов (воду давали вволю) (возраст крыс 8 недель), анестезируют уретаном (1,5 г/кг, подкожно (S. C. )) и дыхание поддерживают с помощью пищеводных канюль. После лапаротомии пищеводные канюли вставляют орально вплоть до прожелудочка и перевязывают вокруг кардиальной части желудка. Перфузионные канюли вставляют из двенадцатиперстной кишки в желудок и перевязывают вокруг пилоруса. Еще одни канюли помещают в двенадцатиперстную кишку и перевязывают для приема лекарства. После зашивания брюшной полости желудок перфузируют через пищеводные канюли физиологическим солевым раствором (37o), при этом с 15-минутным интервалом производят сбор перфузата. Перфузат подвергают титрованию 0,001% н NaOH раствором для определения кислотности. Когда базальное выделение кислоты становится стабильным, вводят пролонгированным образом пентагастрин (10 мкл/кг/час) через обычную каротидную вену в течение примерно 90 минут до тех пор, пока секреция кислоты не достигает приблизительно наивысшего уровня, и тогда в двенадцатиперстную кишку через канюли вводят испытуемое соединение (0,5% М.С.). Перфузат собирают с 15-минутным интервалом для регистрации секреции кислоты в течение 90 минут. Процент ингибирования вычислялся следующим образом:
Процент ингибирования (%) = 100 • (A-B)/(C-B),
A: минимальная величина общей кислотности, наблюдаемой после введения испытуемого соединения;
B: общая кислотность, полученная непосредственно перед введением пентагастрина;
С: общая кислотность, полученная непосредственно перед введением испытуемого соединения.
Результаты приводятся в таблице.
Эксперимент 2. Испытание in vitro по оценке антагонизма в отношении гастрина и/или CCK-B.
Фармакологическое действие соединений, полученных в приведенных выше примерах, оценивалось in vitro в отношении антагонистической активности против гастринового рецептора, CCK-B-рецептора или CCK-A-рецептора, с использованием клеток фундальных желез морских свинок, образца сырой мембраны из церебрального кортекса мышей или образца сырой мембраны из поджелудочной железы мышей соответственно.
Животные, используемые в испытании.
Используют самцов морских свинок Hartley (450-600 г) или самцов мышей ddY (23-30 г).
(1). Антагонизм в отношении гастринового рецептора.
Получение желудочных желез.
Самцов морских свинок Hartley (450- 600 г) убивают кровопусканием и сразу же из каждого животного извлекают желудок, из которого приготавливают желудочные железы.
Получение испытываемых соединений и процедуры анализа замещения.
Приготавливают 1 М раствор соединения, подвергаемого испытанию, в ДMCO и разбавляют 50%-ным диметилсульфоксидом с получением серии десятикратного разбавления.
Реакцию индуцируют добавлением желудочных желез к растворам различных концентраций, каждый из которых содержит 125I-меченый гастрин (конечная концентрация, 0,2 нМ). Смесь инкубируют в течение 30 минут при 25oC, центрифугируют в течение 5 минут при 2000 оборотов в минуту и супернатант удаляют с помощью аспирации. К лепешке добавляют охлажденный льдом инкубационный буфер и осторожно смешивают с последующим немедленным центрифугированием и удалением супернатанта с помощью аспирации. С помощью гамма-счетчика определяется радиоактивность. Ту же самую процедуру повторяют с использованием 50%-ного раствора в ДMCO или человеческого гастрина 1 (конечная концентрация 2 мкМ) вместо раствора испытываемого соединения так, чтобы получить контрольную величину, относящуюся к общему связыванию, или величину, относящуюся к неспецифическому связыванию, соответственно.
Вычисление IC50.
Величину IC50 (ингибирующая концентрация) определяют с помощью нанесения на график отношения (%) специфического связывания испытываемого соединения к величине связывания контроля на полулогарифмическом графике и получения концентрации, соответствующей 50%, где:
специфическое связывание контроля = общее связывание (срм) - неспецифическое связывание (срм);
и
специфическое связывание испытываемого соединения = общее связывание (срм) - неспецифическое связывание (срм).
(2). Антагонизм CCK-A-рецептору и антагонизм CCK-B-рецептору.
Получение препаратов CCK-рецепторов.
Самцов мышей ddY убивают обезглавливанием и немедленно извлекают церебральный кортекс (CCK-B) и поджелудочную железу (CCK-A). Каждый из церебрального кортекса и поджелудочной железы смешивают с 50 мМ Трис-HCI буфером (pH 7,4) и гомогенизируют с помощью тефлоново-стеклянного гомогенизатора и поллитрового гомогенизатора для получения образцов сырой мембраны.
Подготовка испытываемых соединений и процедуры анализа замещения.
Приготавливают 1 M раствор испытываемого соединения в ДMCO и разбавляют 50%-ным ДMCO для получения серии десятикратного разбавления.
Реакцию индуцируют добавлением образца сырой мембраны к растворам различной концентрации, каждый из которых содержит [3H]CCK-8 (конечная концентрация, 1 нМ). Смесь инкубируют в течение 90 минут при 25oC, фильтруют через стеклянный фильтр с аспирацией и промывают охлажденным 50 мМ Трис-буфером. После добавления коктейля Аквазол-2 подсчитывают радиоактивность. Ту же самую процедуру повторяют с использованием 50%-ного раствора ДMCO или Церулетида (конечная концентрация 1 мкМ) вместо раствора испытываемого соединения с тем, чтобы получить контрольную величину, относящуюся к общему связыванию, или величину, относящуюся к неспецифическому связыванию, соответственно.
Вычисление IC50.
Величину IC50 определяют с помощью нанесения на график отношения (%) специфического связывания испытываемого соединения к величине связывания контроля на полулогарифмическом графике и получения концентрации, соответствующей 50%, где:
специфическое связывание контроля = общее связывание (срм) - неспецифическое связывание (срм);
и
специфическое связывание испытываемого соединения = общее связывание (срм) - неспецифическое связывание (срм).
Результаты показаны в таблице.
Результаты экспериментов, показанные в таблице, демонстрируют, что соединения по настоящему изобретению проявляют антагонистическое действие против гастрин/CCK-рецептора.
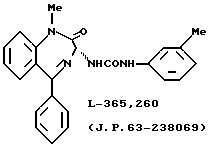
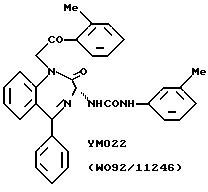
Следующие примеры рецептур или препаративных форм иллюстрируют композицию настоящего изобретения.
Препаративная форма 1.
Обычным образом приготавливают твердые желатиновые капсулы, содержащие 50 мг активного вещества, которые имеют следующий состав, мг:
2-(N-(трет-Бутоксикарбонилметил)-N' -(м-(2-(трифенилметил) тетразол-5-ил)фенил)уреидометилкарбониламино)бензофенон 7 - 50
Целлюлоза - 18
Лактоза - 55
Коллоидная двуокись кремния - 1
Натриевый карбоксиметилкрахмал - 10
Тальк - 10
Стеарат магния - 1
Препаративная форма 2.
Твердые желатиновые капсулы, содержащие 50 мг активного вещества, которые имеют следующий ниже состав (мг), приготавливают обычным образом.
Натриевая соль 2-[(трет-Бутоксикарбонил-метил)-[3-(м-(карбоксифенил) уреидометилкарбонил]]аминобензофенона 8ha - 50
Целлюлоза - 18
Лактоза - 55
Коллоидная двуокись кремния - 1
Натриевый карбоксиметилкрахмал - 10
Тальк - 10
Стеарат магния - 1
Препаративная форма 3.
Таблетку, содержащую 50 мг активного вещества, которая имеет следующий ниже состав (мг), приготавливают обычным образом.
2-[(трет-Бутоксикарбонил-метил)-[3-(м-(карбоксифенил) уреидометилкарбонил]]амино-бензофенон 8h - 50
Лактоза - 104
Целлюлоза - 40
Поливидон - 10
Натриевый карбоксиметилкрахмал - 22
Тальк - 10
Стеарат магния - 2
Коллоидная двуокись кремния - 2
Смесь гидроксицеллюлозы, глицерина и окиси титана (72:3,5:24,5) - Количество, требуемое для получения конечной таблетки с пленочным покрытием весом 245 мг
Препаративная форма 4.
Таблетка, содержащая 50 мг активного вещества, которая имеет следующий ниже состав (мг), приготавливают обычным образом.
2-(N-(трет-Бутоксикарбонилметил)-N'-(м-бромфенил) уреидометилкарбониламино)бензофенон 7v - 50
Лактоза - 104
Целлюлоза - 40
Поливидон - 10
Натриевый карбоксиметилкрахмал - 22
Тальк - 10
Стеарат магния - 2
Коллоидная двуокись кремния - 2
Смесь гидроксицеллюлозы, глицерина и окиси титана (72:3,5:24,5) - Количество, требуемое для получения конечной таблетки с пленочным покрытием весом 245 мг
Препаративная форма 5.
Приготавливают раствор для инъекций, содержащий 10 мг активного вещества, который имеет следующий состав, мг:
2-(N-(трет-Бутоксикарбонилметил)-N'-(м-карбоксиметилокси)фенил) уреидометилкарбониламино)-бензофенон 8j - 10
Бензойная кислота - 80
Бензиловый спирт, см3 - 0,06
Бензоат натрия - 80
Этанол, 95%, см3 - 0,4
Гидроокись натрия - 24
Пропиленгликоль, см3 - 1,6
Вода - Количество, необходимое для достижения общего количества 4 см3
Препаративная форма 6.
Приготавливают раствор для инъекций, содержащий 10 мг активного вещества, который имеет следующий состав, мг:
(2-(N-(трет-Бутоксикарбонилметил)-N'-(п-толил)-уреидометилкарбониламино) бензофенон 7z - 10
Бензойная кислота - 10
Бензиловый спирт, см3 - 0,06
Бензоат натрия - 10
Этанол, 95%, см3 - 0,4
Гидроокись натрия - 5
Пропиленгликоль, см3 - 1,6
Вода - Количество, необходимое для достижения общего количества 4 см3
Данные по исследованию токсичности.
Метод: одноразовое пероральное введение.
Исследуемое соединение: соединение 8h, полученное по примеру 23.
Животное: четыре (самцы (2) и самки (2)) крысы Sprague-Dawly (60-90 г веса) четырехнедельного возраста.
Результат: максимальная нетоксичная доза (мг/кг/день): > 2000; установлено, что летальная доза должна быть больше 2000 мг/кг.
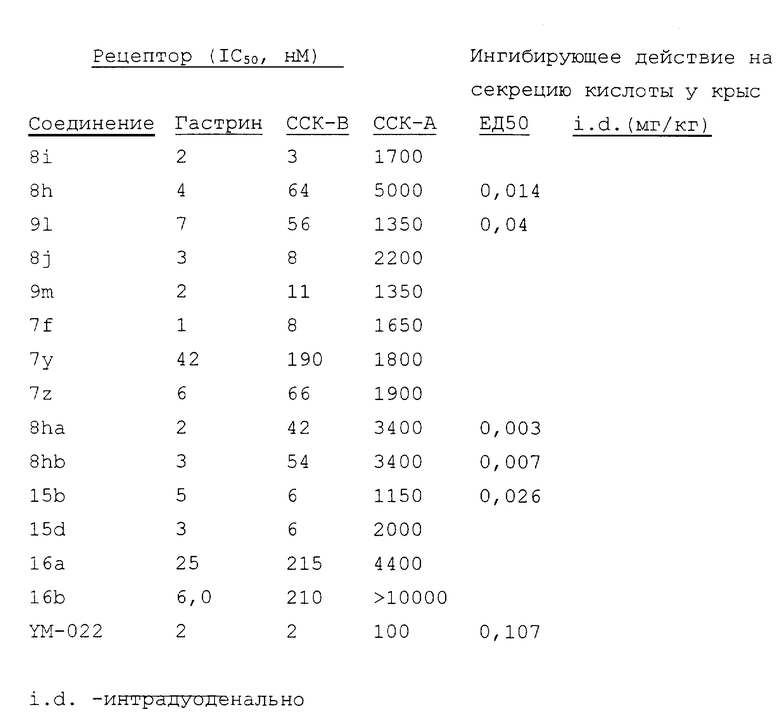
Описываются новые производные карбамоилмочевины общей формулы I, где R1 - атом водорода или низший алкил, R2 - низший алкокси, низший алкиламино, низший циклоалкил, необязательно замещенный фенил, при этом фенил может иметь заместитель, выбранный из группы амино, галоген, низший алкил, галогенированный низший алкил, или означает пирролидинил, R3 - нeoбязaтeльнo замещенный фенил, в котором заместители выбраны из группы галоген, низший алкил, галогенированный низший алкил, низший алкокси, циано, тетразолил, остаток формулы - R5(CH2)nR6, где n = 0 - 3, R5 - связь, -O-, -S- или -S(O)-, R6 - группа -СООR7-, где R7 - водород, низший алкил, низший алкенил, R4 - необязательно замещенный фенил, при этом фенил может иметь 1-3 заместителя, выбранных из группы амино, низший алкил, галогенированный алкил, галоген, низший алкокси, циано, C3-C7-циклоалкил, который может быть замещен низшим алкилом, С1-С10-алкил с прямой или разветвленной цепью, необязательно замещенная гетероциклическая группа, выбранная из пиперидинила, тиенила, или его фармацевтически приемлемая соль. Описывается фармацевтическая композиция на основе соединений формулы I, используемая для лечения различных заболеваний, связанных с рецепторами гастрина и/или ССК-В (холецистокинин). 2 с. и 7 з.п.ф-лы, 1 табл.
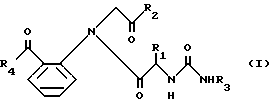

где R1 - атом водорода или низший алкил;
R2 - низший алкокси, низший алкиламино, низший циклоалкил, необязательно замещенный фенил, при этом фенил может иметь заместитель, выбранный из группы амино, галоген, низший алкил, галогенированный низший алкил, или означает пирролидинил;
R3 - необязательно замещенный фенил, в котором заместители выбраны из группы галоген, низший алкил, галогенированный низший алкил, низший алкокси, циано, тетразолил, остаток формулы -R5(CH2)nR6, где n = 0 - 3, R5 - связь, -О-, -S- или -S(O)-, R6 - группа COOR7, где R7 - водород, низший алкил, низший алкенил;
R4 - необязательно замещенный фенил, при этом фенил может иметь 1-3 заместителя, выбранных из группы амино, низший алкил, галогенированный алкил, галоген, низший алкокси, циано, C3-C7-циклоалкил, который может быть замещен низшим алкилом, C1-C10-алкил с прямой или разветвленной цепью, необязательно замещенная гетероциклическая группа, выбранная из пиперидинила, тиенила,
или их фармацевтически приемлемая соль.
Приоритет по признакам и пунктам:
09.02.94 - п.1: соединения общей формулы I, где R1, R2 имеют значения, указанные в п.1 формулы, R3 - фенил, замещенный в м - положении, R4 - незамещенный фенил; п.2: R1 - водород, R2 - низший алкокси, пп.4-7;
05.10.94 - п.1: соединения общей формулы I, где R3 - необязательно замещенный фенил, в котором заместители выбраны из группы, указанной в п.1 формулы, R4 - необязательно замещенный фенил, при этом фенил может иметь 1-3 заместителя, выбранных из группы, указанной в п.1 формулы; п.2: R1 - водород, низший алкил, п.3.
| СПОСОБ ПОЛУЧЕНИЯ \-КАРБАМОИЛ-Ы-АЛКИЛ/АРИЛ/-АМИНОКЕТОНОВ | 1971 |
|
SU420619A1 |
| Огнетушитель | 0 |
|
SU91A1 |
| Огнетушитель | 0 |
|
SU91A1 |
| Огнетушитель | 0 |
|
SU91A1 |
Авторы
Даты
1999-08-20—Публикация
1995-02-07—Подача