Настоящее изобретение относится к соединениям формулы I
цикло(aArg-aGly-aAsp-aX-aY),
в которой aArg обозначает Arg или aзaArg,
aGly обозначает Gly или азаGlу,
aAsp обозначает Asp или азаАsр,
аХ, aY каждый независимо друг от друга обозначает остаток аминокислоты,
выбранной из группы, включающей Ala, Asn, Asp, Arg, Cys, Gin, Glu, Gly, His, He, Leu, Lys, Met, Nie, Orn, Phe, Phg, Pro, Ser, Thr, Tic, Trp, Tyr, Val, NH-Q-CO- или соответствующие азаминокислоты,
Q обозначает алкилен с 1-6 С-атомами,
причем по меньшей мере в одной из представленных формулой I аминокислот Cα-углерод заменен на азот, указанные аминокислоты могут быть также дериватизированы, а аминокислотные остатки соединены друг с другом через α-амино- либо азагруппу и α-карбоксильные группы по типу пептидной связи и, если речь идет об остатках оптически активных аминокислот и о производных аминокислот, это понятие включает как D-, так и L-формы, а также к солям указанных соединений.
Подобные соединения циклических пептидов известны, например, из заявок ЕР 0632053, DE 19538741 или ЕР 0683173.
В основу изобретения была положена задача получить новые соединения с ценными фармакологическими свойствами и прежде всего такие, которые могли бы применяться для изготовления лекарственных средств.
Как было установлено, соединения формулы I и их соли наряду с хорошей совместимостью обладают ценными фармакологическими свойствами. В первую очередь они эффективны в качестве ингибиторов интегрина, причем прежде всего они подавляют взаимодействие рецепторов αv-, β3- или β5- интегрина с лигандами, как, например, связывание фибриногена с рецептором β3-интегрина. Особую эффективность действия соединения проявляют в случае интегринов αvβ1, αvβ3, αvβ5, αIIbβ3, а также αvβ6 и αvβ8, прежде всего были обнаружены высокоэффективные селективные ингибиторы витронектинового рецептора αvβ3. Эффективность этого действия может быть подтверждена, например, с помощью метода, описанного J.W. Smith и др. в Journ. Biol. Chem. 265. стр. 12267-12271 (1990).
Зависимость возникновения ангиогенеза от взаимодействия между васкулярными интегринами и внеклеточными матриксными белками описана Р.С. Brooks, R.A. clark и D.A. Cheresh в Science 264, стр. 569-571 (1994).
Возможность ингибирования этого взаимодействия и тем самым возможность для начала апоптоза (запрограммированной гибели клеток) ангиогенных васкулярных клеток с помощью циклического пептида описана Р.С. Brooks. Л.М. Montgomery, M. Rosenfeld, R.A. Reisfeld, T-Hu, G. Klier и D.A. Cheresh в Cell 79, стр. 1157-1164 (1994).
Соединения формулы I, блокирующие взаимодействие рецепторов интегрина с лигандами, например связывание фибриногена с фибриногенным рецептором (гликопротеин IIb/IIIa), препятствуют в качестве антагонистов гпIIb/IIIа метастазу раковых клеток. Это подтверждают следующие наблюдения:
Соединения могут ингибировать связывание металлопротеиназ с интегринами и тем самым препятствовать клеткам использовать ферментативную активность протеиназы. Одним из примеров, подтверждающих сказанное, может служить подавление цикло-RGD-пептидом связывания ММП-2 (матриксная металлопротеиназа 2) с витронектиновым рецептором αvβ3, как это описано у Р.С. Brooks и др. в Cell 85, стр. 683-693 (1996).
Распространение раковых клеток от местной опухоли в сосудистую систему происходит за счет образования микроагрегатов (микротромбов), обусловленного взаимодействием раковых клеток с тромбоцитами. Раковые клетки блокированы благодаря защите в микроагрегате и не распознаются клетками иммунной системы. Микроагрегаты могут закрепляться на стенках сосудов, что облегчает дальнейшее проникновение раковых клеток в ткань. Благодаря тому, что образованию микротромбов способствует связывание фибриногена с фибриногенными рецепторами на активированных тромбоцитах, гпIIa/IIIb-антагонисты могут рассматриваться как эффективные ингибиторы метастаз.
Соединения формулы I могут применяться в качестве активных веществ в лекарственных средствах, предназначенных для использования в медицине и ветеринарии, прежде всего для профилактики и/или терапии тромбоза, инфаркта миокарда, артериосклероза, воспалений, апоплексии, стенокардии, раковых заболеваний, остеолитических заболеваний, таких, как остеопороз, патологических ангиогенных заболеваний, таких, например, как воспаления, офтальмологических заболеваний, диабетической ретинопатии, макулярной дегенерации, миопии, глазного гистоплазмоза, ревматического артрита, остеоартрита, рубеотической глаукомы, язвенного колита, болезни Крона, атеросклероза, псориаза, рестеноза после ангиопластики, множественного склероза, вирусной инфекции, бактериальной инфекции, грибковой инфекции, при острой почечной недостаточности и при залечивании ран в качестве средств, способствующих ускорению процесса заживления.
Соединения формулы I могут применяться в качестве обладающих антимикробным действием субстанций при операциях, где используются биоматериалы, имплантаты, катетеры или водители ритма сердца. При этом они проявляют антисептический эффект. Эффект антимикробной активности может быть подтвержден с помощью метода, описанного у Р. Valentin-Weigund и др. в Infection and Immunity, 2851-2855 (1988).
Благодаря тому, что соединения формулы I представляют собой ингибиторы связывания фибриногена и тем самым лиганды фибриногенных рецепторов на тромбоцитах, их можно использовать in vivo в качестве диагностических средств для обнаружения и локализации тромбов в сосудистой системе, поскольку они могут замещаться, например, радиоактивным или определяемым по УФ-излучению остатком.
Соединения формулы I, являясь ингибиторами связывания фибриногена, могут использоваться также в качестве вспомогательных средств для изучения процесса метаболизма с участием тромбоцитов на различных стадиях активации или внутриклеточных механизмов передачи сигналов фибриногенного рецептора. Выявляемый фрагмент встраиваемой "метки", например, с помощью меченых 3Н-изотопов, позволяет после связывания с рецептором изучать указанные механизмы.
Представленные в соединениях формулы I аминокислоты могут быть модифицированы таким образом, что Cα-углерод в них заменен на азот, с образованием при этом боковой цепи. Речь идет в этих случаях о так называемых азааминокислотах. Так, например, в представленном ниже азатрипептиде, состоящем из аминокислот аргинин, глицин и аспарагиновой кислоты, Cα-углерод глицина заменен на азот: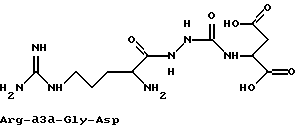
В соединениях формулы I по изобретению во всех случаях по меньшей мере одна аминокислота является азааминокислотой.
Указанные выше и в последующем сокращенные названия аминокислотных остатков обозначают остатки следующих аминокислот:
Ala аланин
Asn аспарагин
Asp аспарагиновая кислота
Arg аргинин
Cys цистеин
Gln глутамин
Glu глутаминовая кислота
Gly глицин
His гистидин
Гомо-Phe гомофенилаланин
Ile изолейцин
Leu лейцин
Lys лизин
Met метионин
Nle норлейцин
Orn орнитин
Phe фенилаланин
Phg фенилглицин
4-Hal-Phe 4-галогенфенилаланин
Pro пролин
Sar саркозин (N-метилглицин)
Ser серин
Tic тетрагидроизохинолин-3 -карбоновая кислота
Thr треонин
Trp триптофан
Tyr тирозин
Val валин
В качестве примеров представлены следующие азааминокислоты: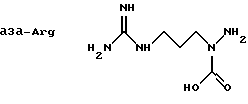
Далее приняты следующие сокращения, обозначающие:
Ас ацетил
БОК трет-бутоксикарбонил
БзОК бензилоксикарбонил
ДЦКИ дициклогексилкарбодиимид
ДИПЭА диизопропилэтиламин
ДМФ диметилформамид
ЭДКИ N-этил-N,N'-(диметиламинопропил)карбодиимид
Et этил
Fmoc 9-флуоренилметоксикарбонил
ГОБТ 1-гидроксибензотриазол
Me метил
МБГА 4-метилбензгидриламин
Мтр 4-метокси-2,3,6-триметилфенилсульфонил
N-МП N-метилпирролидон
N-ГОСу N-гидроксисукцинимид
OBzl бензиловый эфир
OtBu трет-бутиловый эфир
Окт октаноил
ОМе метиловый эфир
OEt этиловый эфир
Pbf 2,2,4,6,7-пентаметилдигидробензофуран-5-сульфонил
ФОА феноксиацетил
Сал салицилоил
TBTU O-(1Н-бензотриазол-1-ил)-N,N,N',N'-тетраметилуронийтетрафторборат
ТФК трифторуксусная кислота
Трт тритил (трифенилметил).
Поскольку вышеназванные аминокислоты могут быть представлены в нескольких энантиомерных формах, например, в качестве компонентов соединений формулы I, указанная группа включает все эти формы, равно как и их смеси (например, DL-формы). Кроме того, аминокислоты, например, в качестве компонентов соединений формулы I могут быть снабжены соответствующими известными защитными группами.
Предлагаемые согласно изобретению соединения включают также так называемые пролекарственные производные, т.е. модифицированные с помощью, например, алкильных или ацильных групп, сахаров или олигопептидов соединения формулы I, которые в организме быстро расщепляются до эффективных соединений по изобретению.
К этой группе относятся также биоразлагаемые полимерные производные соединений по изобретению, как это описано, в частности, в Int. Journ. Pharm. 115, 61-67 (1995).
Аминокислоты, конфигурация которых не указана особо, имеют (S)- либо (L) -конфигурацию.
Объектом изобретения является далее способ получения соединений формулы I согласно п.1 формулы изобретения, а также их солей. Способ отличается тем, что
а) соединение формулы II
H-Z-OH II
в которой Z обозначает -aArg-aGly-aAsp-aX-aY-,
-aGly-aAsp-aX-aY-aArg-,
-aAsp-aX-aY-aArg-aGly-,
-aX-aY-aArg-aGly-aAsp- или
-aY-aArg-aGly-aAsp-aX-,
a aArg, aGly, aAsp, aX и aY имеют значения, указанные в п.1 формулы изобретения, либо реакционноспособное производное соединения формулы II обрабатывают агентом циклизации или
б) соединение формулы I высвобождают из одного из его функциональных производных путем обработки средством сольволиза либо гидрогенолиза, и/или что основное или кислое соединение формулы I путем обработки кислотой или основанием переводят в одну из его солей.
Если не указано иное, то выше и в последующем остатки aArg, aGly, aAsp, aX и aY имеют значения, указанные в формулах I и II.
В вышеприведенных формулах алкил представляет собой метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил или трет-бутил, а, кроме того, также пентил, 1-, 2- или 3-метилбутил, 1,1-, 1,2- или 2,2-диметилпропил, 1-этилпропил, гексил, 1-, 2-, 3- или 4-метилпентил, 1,1-, 1,2-, 1,3-, 2,2-, 2,3-или 3,3-диметилбутил, 1- или 2-этилбутил, 1-этил-1-метилпропил, 1-этил-2-метилпропил, 1,1,2- или 1,2,2-триметилпропил.
Алкилен представляет собой предпочтительно метилен, этилен, пропилен, бутилен, пентилен или гексилен.
Указанные аминокислоты и остатки аминокислот могут быть также дериватизированы, причем предпочтительны N-метильные, N-этильные, N-пропильные, N-бензильные или Cα-метильные производные.
К предпочтительным относятся далее производные Asp и Gly, прежде всего метиловый, этиловый, пропиловый, бутиловый, трет-бутиловый, неопентиловый или бензиловый эфиры боковых цепей карбоксильных групп, кроме того, также производные Arg, который по -NH-C(=NH)-NH2-rpynne может быть замещен ацетильным, бензоильным, метоксикарбонильным или этоксикарбонильным остатком.
Понятие "аминозащитная группа" обозначает предпочтительно ацетил, пропионил, бутирил, фенилацетил, бензоил, толуил, ФОА, метоксикарбонил, этоксикарбонил, 2,2,2-трихлорэтоксикарбонил, БОК, 2-иодэтоксикарбонил, БзОК ("карбобензокси"), 4-метоксибензилоксикарбонил, Fmoc, Мтр или бензил.
Соединения формулы I могут иметь один или несколько хиральных центров и поэтому могут быть представлены в различных стереоизомерных формах. Формула I включает все эти формы.
В соответствии с этим объектом изобретения являются прежде всего такие соединения формулы I, в которых по меньшей мере один из названных остатков имеет одно из вышеуказанных предпочтительных значений. Некоторые предпочтительные группы соединений могут быть представлены следующими формулами Iа-Iв, подпадающими под формулу I и где не расшифрованные более подробно остатки имеют значения, указанные в формуле I, однако есть и отличия, а именно:
в a) aArg обозначает Arg,
aGly обозначает Aza-Gly,
aAsp обозначает Asp,
aX, aY каждый независимо друг от друга обозначает остаток аминокмслоты, выбранной из группы, включающей Ala, Asn, Asp, Arg, Cys, Gln, Glu, Gly, His, IIe, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr, Val или соответствующие азааминокислоты,
и названные аминокислоты также могут быть дериватезированы;
в
б) aArg обозначает Arg,
aGly обозначает азаGly,
aAsp обозначает Asp,
aX обозначает Gly, Phe, D-Phe или азаPhe и
aY обозначает Gly, Val, Leu, Pro, D-Val, D-Leu либо D-Pro или соответствующие аминокислоты, и названные аминокислоты также могут быть дериватизированы;
в) aArg обозначает Arg,
aGly обозначает азаGly,
aAsp обозначает Asp,
aX обозначает Gly, Phe либо D-Phe и
aY обозначает Gly, N-бензил-Glу, Lys, D-Lys, Val, D-Val, соответствующие N-алкильные производные или соответствующие азааминокислоты,
и названные аминокислоты также могут быть дериватезированы.
Соединения формулы I, равно как и исходные вещества для их получения в остальном получают по известным методам, описанным в литературе (например, в таких основополагающих публикациях, как Houben-Weyl, Methoden der organischen Chemie, изд-во Georg-Thieme-Verlag, Штутгарт), а именно при соблюдении условий, известных и пригодных для осуществления указанных реакций. При этом могут использоваться также известные, не поясняемые в данном описании более подробно варианты.
Исходные вещества при необходимости могут быть также образованы in situ, что исключает их обязательное выделение из реакционной смеси и обеспечивает возможность непосредственно превращать их в соединения формулы I.
Соединения формулы I можно получать предпочтительно циклизацией соединений формулы II в условиях синтеза пептидов. При этом целесообразно работать по обычным методам такого синтеза, описанным, например, в Houben-Weyl. l.с., том 15/II, стр. 1-806 (1974).
Реакцию осуществляют предпочтительно в присутствии агента дегидратации, например карбодиимида, такого, как ДЦКИ или ЭДКИ, можно использовать также, например, ангидрид пропанфосфоновой кислоты (ср. Angew. Chem. 92. 129 (1980)), дифенилфосфорилазид или 2-этокси-N-этоксикарбонил-1,2-дигидрохинолин, в инертном растворителе, например в галоидированном углеводороде, таком, как дихлорметан, в простом эфире, таком, как тетрагидрофуран или диоксан, в амиде, таком, как ДМФ или диметилацетамид, в нитриле, таком, как ацетонитрил, в диметилсульфоксиде, либо в смеси этих растворителей, при температурах в интервале от приблизительно -10 до 40oC, предпочтительно от 0 до 30oС. Для более эффективной внутримолекулярной циклизации перед внутримолекулярным связыванием пептидов целесообразно работать в разбавленных растворах.
Продолжительность реакции в зависимости от конкретных условий ее проведения составляет от нескольких минут до 14 дней.
Вместо соединений формулы II могут использоваться также производные соединений формулы II, предпочтительно предварительно активированная карбоновая кислота, либо галогенангидрид карбоновой кислоты, симметричный либо смешанный галогенангидрид или же активированный сложный эфир. Остатки такого типа, используемые для активации карбоксильной группы в типичных реакциях ацилирования, описаны в литературе (например, в таких основополагающих публикациях, как Houben-Weyl, Methoden der organischen Chemie, изд-во Georg-Thieme-Verlag, Штутгарт). Активированные эфиры целесообразно образовывать in situ, например, добавлением ГОБТ'а или N-гидроксисукцинимида.
Реакцию осуществляют, как правило, в инертном растворителе с использованием галогенангидрида карбоновой кислоты в присутствии связывающего кислоту агента, предпочтительно органического основания, такого, как триэтиламин, диметиланилин, пиридин или хинолин. Целесообразным и полезным могут оказаться также добавки гидроксида, карбоната либо бикарбоната щелочного или щелочноземельного металла либо другой соли слабой кислоты, образуемой взаимодействием с щелочными или щелочноземельными металлами, предпочтительно калия, натрия, кальция или цезия.
Исходные вещества формулы II являются, как правило, новыми. Их можно получать по известным методам синтеза пептидов.
Линейные пептиды можно синтезировать, например, согласно методу Меррифилда (Merrifield, Angew. Chem. 97, стр. 801-812 (1985)) с использованием способной к набуханию полистирольной смолы в качестве твердой фазы.
Другая возможность получения соединений формулы I состоит в том, что эти соединения высвобождают из их функциональных производных путем сольволиза, прежде всего гидролиза, или путем гидрогенолиза.
Предпочтительными исходными веществами для сольволиза, соответственно гидрогенолиза являются такие, которые вместо одной или нескольких свободных амино- и/или гидроксигрупп содержат соответствующие защитные амино- и/или гидроксигруппы, предпочтительно такие, которые вместо Н-атома, связанного с N-атомом, несут аминозащитную группу, например, такие, которые подпадают под формулу I, однако вместо NH2-группы содержат NHR'-группу (где R' обозначает аминозащитную группу, например БОК или БзОК).
К предпочтительным относятся далее исходные вещества, несущие вместо Н-атома гидроксигруппы гидроксизащитную группу, например, такие, которые подпадают под формулу I, однако вместо гидроксифенильной группы содержат R"O-фенильную группу (где R" обозначает гидроксизащитную группу).
Возможно также наличие в молекуле исходного вещества нескольких идентичных либо различных - амино- и/или гидроксизащитных групп.При наличии отличающихся друг от друга защитных групп последние во многих случаях можно селективным путем отщеплять.
Понятие "аминозащитная группа" общеизвестно и относится к группам, которые способны защищать (блокировать) аминогруппу от химических превращений, но которые можно легко удалять по завершении требуемой химической реакции в других местах молекулы. Типичными представителями таких групп являются прежде всего незамещенные либо замещенные ацильные, арильные, аралкоксиметильные или аралкильные группы. Поскольку аминозащитные группы по завершении требуемой реакции (или соответствующей стадии) удаляют, их тип и величина в остальном не играет существенной роли, предпочтительны, однако, группы с 1-20, прежде всего с 1-8 С-атомами.
Понятие "ацильная группа" применительно к предлагаемому способу используется в самом широком смысле. Оно включает ацильные группы, являющиеся производными алифатических, аралифатических, ароматических или гетероциклических карбоновых кислот либо сульфокислот, а также прежде всего алкоксикарбонильные, арилоксикарбонильные и в первую очередь аралкоксикарбонильные группы. В качестве примеров таких ацильных групп можно назвать алканоил, такой, как ацетил, пропионил, бутирил; аралканоил, такой, как фенилацетил; ароил, такой, как бензоил или толуил; арилоксиалканоил, такой, как ФОА; алкоксикарбонил, такой, как метоксикарбонил, этоксикарбонил, 2,2,2-трихлорэтоксикарбонил, БОК, 2-иодэтоксикарбонил аралкилоксикарбонил, такой, как БзОК ("карбобензокси"), 4-метоксибензилоксикарбонил, Fmoc; арилсульфонил, такой, как Мтр. Предпочтительными аминозащитными группами являются БОК и Мтр, а также БзОК, Fmoc, бензил и ацетил.
Понятие "гидроксизащитная группа" также общеизвестно и относится к группам, которые способны защищать гидроксигруппу от химических превращений, но которые можно легко удалять по завершении требуемой химической реакции в других местах молекулы. Типичными представителями таких групп являются указанные выше незамещенные либо замещенные арильные, аралкильные или ацильные группы, а также алкильные группы. Тип и величина гидроксизащитных групп не играют существенной роли, поскольку их по завершении требуемой химической реакции или соответствующей стадии снова удаляют; предпочтительны группы с 1-20, прежде всего с 1-10 С-атомами. В качестве примеров гидроксизащитных групп можно назвать среди прочих бензил, п-нитробензоил, п-толуолсульфонил, трет-бутил и ацетил, причем особенно предпочтительны из них бензил и трет-бутил. СООН-группы в аспарагиновой кислоте и глутаминовой кислоте предпочтительно защищать в форме их трет-бутиловых эфиров (например, Asp(OBut)).
Высвобождение соединений формулы I из их функциональных производных осуществляют в зависимости от используемой защитной группы, например с помощью сильных кислот, предпочтительно ТФК или перхлорной кислоты, а также с помощью других сильных неорганических кислот, таких, как соляная кислота или серная кислота, сильных органических карбоновых кислот, таких, как трихлоруксусная кислота, или сульфокислот, таких, как бензол- или п-толуолсульфокислота. Присутствие дополнительного инертного растворителя возможно, но не всегда обязательно. В качестве инертных растворителей пригодны предпочтительно органические растворители, например карбоновые кислоты, такие, как уксусная кислота, простые эфиры, такие, как тетрагидрофуран или диоксан, амиды, такие, как ДМФ, галоидированные углеводороды, такие, как дихлорметан, кроме того, спирты, такие, как метанол, этанол или изопропанол, а также вода. Могут использоваться и смеси названных растворителей. ТФК используют предпочтительно в избытке без добавления другого растворителя. Перхлорную кислоту используют в виде смеси из уксусной кислоты и 70%-ной перхлорной кислоты в соотношении 9:1.
Температура, необходимая для отщепления, находится предпочтительно в интервале от приблизительно 0 до приблизительно 50oС, целесообразно работать в интервале от 15 до 30oС (комнатная температура).
Отщепление групп БОК, OBut и Мтр может осуществляться, например, предпочтительно с помощью ТФК в дихлорметане или с помощью приблизительно 3 - 5 н. НСl в диоксане при 15-30oС, Fmoc-группу можно отщеплять с помощью приблизительно 5-50%-ного раствора диметиламина), диэтиламина или пиперидина в ДМФ при 15-30oС.
Тритильную группу используют для защиты таких аминокислот, как гистидин, аспарагин, глутамин и цистеин. Ее отщепление в зависимости от требуемого конечного продукта проводят с помощью ТФК/10% тиофенола, причем тритильную группу отщепляют от всех вышеназванных аминокислот; при использовании же ТФК/анизола или ТФК/тиоанизола тритильную группу отщепляют лишь от His, Asn и Gin, тогда как ее присутствие в боковой цепи Cys сохраняется.
Удаляемые гидрогенолитическим путем защитные группы (например, БзОК или бензил) могут отщепляться, например, за счет обработки водородом в присутствии катализатора (например, катализатора на основе благородного металла, такого, как палладий, предпочтительно на носителе, таком, как уголь). В качестве растворителей при этом можно использовать таковые, из числа указанных выше, прежде всего, например, спирты, такие, как метанол или этанол, либо амиды, такие, как ДМФ. Гидрогенолиз осуществляют, как правило, при температурах в интервале от приблизительно 0 до 100oС и давлении в пределах от порядка 1 до 200 бар, предпочтительно при 20-30oС и давлении 1-10 бар. Гидрогенолиз БзОК-группы целесообразно проводить, например, в присутствии 5-10%-ного Pd/C в метаноле или с помощью формиата аммония (вместо водорода) в присутствии Pd/C в метаноле/ДМФ при 20-30oС.
Основание формулы I может переводиться с помощью кислоты в соответствующую кислотно-аддитивную соль, например, взаимодействием эквивалентных количеств основания и кислоты в инертном растворителе, таком как этанол, и последующим упариванием. Для такой реакции пригодны прежде всего кислоты, которые образуют физиологически приемлемые соли. Так, в частности, можно использовать такие неорганические кислоты, как серная кислота, азотная кислота, галогеноводородные кислоты, такие, как хлористоводородная кислота либо бромистоводородная кислота, фосфорные кислоты, такие, как ортофосфорная кислота, сульфаминокислота, а также органические кислоты, прежде всего алифатические, алициклические, аралифатические, ароматические или гетероциклические одно- либо многоосновные карбоновые, сульфоновые или серные кислоты, как, например, муравьиная кислота, уксусная кислота, пропионовая кислота, пивалиновая кислота, диэтилуксусная кислота, малоновая кислота, янтарная кислота, пимелиновая кислота, фумаровая кислота, малеиновая кислота, молочная кислота, винная кислота, яблочная кислота, лимонная кислота, глюконовая кислота, аскорбиновая кислота, никотиновая кислота, изоникотиновая кислота, метан- или этансульфокислота, этандисульфокислота, 2-гидроксиэтансульфокислота, бензолсульфокислота, п-толуолсульфокислота, нафталинмоно- и -дисульфокислоты, лаурилсерная кислота. Касательно солей физиологически неприемлемых кислот, например пикратов, следует отметить, что они могут использоваться для выделения и/или очистки соединений формулы I.
С другой стороны, кислота формулы I взаимодействием с основанием может переводиться в одну из ее физиологически приемлемых металлических или аммониевых солей. В качестве таких солей могут рассматриваться прежде всего соли натрия, калия, магния, кальция и аммония, а также замещенные аммониевые соли, например соли диметил-, диэтил- или диизопропиламмония, соли моноэтанол-, диэтанол- или диизопропиламмония, соли циклогексил-, дициклогексиламмония, соли дибензилэтилендиаммония, кроме того, например, соли аргинина или лизина.
Еще одним объектом изобретения является применение соединений формулы I и/или их физиологически приемлемых солей для получения фармацевтических композиций, прежде всего нехимическим путем. При этом их можно использовать совместно с по меньшей мере твердым, жидким и/или полужидким носителем либо вспомогательным веществом и при необходимости в сочетании с одним или несколькими другими активными веществами для изготовления соответствующих дозированных форм.
Объектом изобретения являются далее фармацевтические композиции, содержащие в своем составе по меньшей мере одно соединение формулы I и/или одну из его физиологически приемлемых солей. Эти композиции могут применяться в качестве лекарственных средств в медицине и ветеринарии. В качестве носителей для этих композиций могут рассматриваться органические или неорганические вещества, пригодные для энтерального (например, орального), парентерального, местного введения или же для применения в форме ингаляционного спрея и не реагирующие с новыми соединениями, например вода, масла растительного происхождения, бензиловые спирты, алкиленгликоли, полиэтиленгликоли, триацетат глицерина, желатин, углеводы, такие, как лактоза или крахмал, стеарат магния, тальк, вазелины. Для орального назначения служат прежде всего таблетки, пилюли, драже, капсулы, порошки, грануляты, сиропы, микстуры или капли, для ректального применения - суппозитории, для парентерального применения - растворы, предпочтительно масляные либо водные растворы, кроме того, суспензии, эмульсии или имплантаты, для местного применения пригодны мази, кремы или пудра. Новые соединения можно также подвергать лиофилизации и полученные лиофилизаты использовать, например, для приготовления инъекционных препаратов. Указанные композиции можно стерилизовать и/или они могут содержать в своем составе вспомогательные вещества, такие, как замасливатели, консерванты, стабилизаторы и/или смачиватели, эмульгаторы, соли для регуляции осмотического давления, буферные субстанции, красители, вкусовые добавки и/или одно либо несколько других активных веществ, например один или несколько витаминов.
В качестве спрея для ингаляции могут применяться спреи, которые содержат активное вещество в растворенной или суспендированной форме в одном пропелленте либо в пропелленте из смеси (например, в СО2 или во фторхлоруглеводородах). Целесообразно при этом применять активное вещество в микронизированном виде, причем можно добавлять один или несколько дополнительных физиологически приемлемых растворителей, например этанол. Ингаляцию растворами можно проводить с помощью обычных ингаляторов.
Соединения формулы I и их физиологически приемлемые соли могут применяться в качестве ингибиторов интегрина в первую очередь при борьбе с такими болезнями, как тромбозы, инфаркт миокарда, ишемическая болезнь сердца, артериосклероз, опухоли, остеопороз, воспаления и инфекции.
Соединения формулы I с отличительными признаками по п.1 формулы изобретения и/или их физиологически приемлемые соли могут найти применение также при патологических процессах, связанных или обусловленных ангиогенезом, прежде всего при онкологических заболеваниях или ревматическом артрите.
Предлагаемые согласно изобретению субстанции, как правило, могут вводиться аналогично другим известным, коммерчески доступным пептидам, но прежде всего аналогично соединениям, описанным в US 4472305, предпочтительно в дозировках от порядка 0,05 до 500 мг, прежде всего от 0,5 до 100 мг на одну унифицированную дозу. Суточная доза составляет предпочтительно от порядка 0,01 до 2 мг/кг веса тела пациента. Однако при назначении конкретно тому или иному пациенту специальной дозы последняя зависит от самых разных факторов, например от эффективности применяемого соединения, от возраста и веса тела пациента, общего состояния здоровья, пола, особенностей питания, от времени и метода введения препарата, скорости выделения, комбинации лекарственных средств и степени тяжести соответствующего заболевания, которое требует данной терапии. Предпочтительно парентеральное применение.
Соединения формулы I могут применяться, кроме того, в качестве лигандов интегрина для изготовления колонок для аффинной хроматографии в целях получения чистых интегринов.
Лиганд, т.е. соединение формулы I, присоединяют при этом через анкерную функциональную группу, например карбоксильную группу аспарагиновой кислоты, по типу ковалентной связи к полимерному носителю. В качестве полимерных носителей пригодны известные в химии пептидов полимерные твердые фазы с предпочтительно гидрофильными свойствами, например сшитые полисахара, такие, как целлюлоза, сефароза или Sephadex®, акриламиды, полимер на основе полиэтиленгликоля или Tentakelpolymere®.
Получение материалов для аффинной хроматографии с целью очистки интегрина осуществляют в условиях, обычных и известных, которые используют при конденсации аминокислот.
Как указывалось выше, соединения формулы I содержат один или несколько хиральных центров и могут быть поэтому представлены в рацемической или оптически активной форме. Полученные рацематы могут по известным методам механическим или химическим путем разделяться на энантиомеры. Предпочтительно из рацемической смеси взаимодействием с оптически активным разделяющим агентом образуют диастереомеры. В качестве разделяющих агентов можно использовать, например, оптически активные кислоты, как, например, D- и L-формы винной кислоты, диацетилвинной кислоты, дибензоилвинной кислоты, миндальной кислоты, яблочной кислоты, молочной кислоты или различные оптически активные камфарные сульфокислоты, такие, как β-камфарная сульфокислота. Предпочтительно также проводить разделение на энантиомеры с помощью колонки, заполненной оптически активным разделяющим агентом (например, динитробензоилфенил-глицином); в качестве элюента пригодна, например, смесь гексан/изопропанол/ацетонитрил, например, в объемном соотношении 82:15:3.
Оптически активные соединения формулы I можно естественно получать также по описанным выше методам за счет применения исходных веществ, являющихся уже оптически активными.
Выше и в последующем все температуры указаны в градусах Цельсия. Под используемым в нижеследующих примерах понятием "обычная переработка" имеется в виду следующее: при необходимости добавляют воду, в зависимости от структурных особенностей конечного продукта устанавливают при необходимости на значения рН от 2 до 10, экстрагируют этилацетатом или дихлорметаном, фазы разделяют, органическую фазу сушат над сульфатом натрия, упаривают, очищают посредством хроматографии на силикагеле и/или путем кристаллизации. Rf-значения на силикагеле; элюенты: н-бутанол/уксусная кислота/вода в соотношении 3:1:1 (А), хлороформ/метанол в соотношении 9:1.
RT означает время удерживания (в минутах) при ЖХВР в следующих системах:
колонка: Nucleosil-5-C18 (250•4; 5 мкм);
в качестве элюентов использовали градиенты из ацетонитрила с 0,9% ТФК и воды с 1,1% ТФК (данные указаны соответственно в объемных процентах в пересчете на ацетонитрил);
обнаружение при 220 и 254 нм.
Разделение диастереомеров осуществляют предпочтительно в указанных выше условиях.
Масс-спектрометрия (МО: FAB (бомбардировка ускоренными атомами) (М+Н)+.
Пример 1
К раствору из 280 мг Fmoc-гидразина в 20 мл дихлорметана добавляют 1 эквивалент ДИПЭА и 200 мг п-нитрофенилового эфира хлормуравьиной кислоты (Cl-CO-Pnp) в 10 мл дихлорметана. Затем 2 эквивалента полученного Fmoc-NHNH-CO-Pnp в дихлорметане и 3 эквивалента ДИПЭА добавляют к 1 эквиваленту H-Asp(OtBu)-смолы и встряхивают в течение 1 ч. После промывки дихлорметаном, ДМФ и повторно дихлорметаном получают Fmoc-NHNH-CO-Asp(OtBu)-смолу. Fmoc-группу отщепляют 20%-ным раствором пиперидина в ДМФ. На последующих стадиях присоединяют Fmoc-Arg(Pbf)-ОН, Fmoc-Val-OH и Fmoc-D-Phe-OH, причем Fmoc-группы перед каждым последующим присоединением указанных соединений отщепляют с помощью пиперидина. Таким путем получают Fmoc-D-Phe-Val-Arg(Pbf)-NHNH-CO-Asp(OtBu)-смолу. Отщепление пептида от смолы проводят с помощью смеси уксусная кислота/трифторэтанол/дихлорметан (1:1:3). В результате получают Fmoc-D-Phe-Val-Arg(Pbf)-NHNH-CO-Asp(OtBu) -ОН.
Раствор из 0,1 ммоля ацетата Fmoc-D-Phe-Val-Arg(Pbf)-NHNH-CO-Asp(OtBu)-OH в 50 мл N-МП добавляют медленно по каплям к 50 мл раствора из 3 эквивалентов TBTU, 3 эквивалентов ГОБТ и 10 эквивалентов ДИПЭА в 50 мл N-МП. По истечении 2 часов растворитель удаляют и далее проводят обычную переработку. Таким путем получают цикло(Arg-a3aGly-Asp-D-Phe-Val), RT 12,8 мин (20-80, 30 мин); FAB 576.
Аналогичным путем получают следующие соединения:
цикло(Arg-aзaGly-Asp-Phe-D-Val), RT 9,5 мин. (20-80, 30 мин); FAB 576;
цикло(Arg-aзaGly-Asp-D-Phe-NMe-Val), FAB 590;
цикло(Arg-aзaSar-Asp-D-Phe-Val), FAB 590;
цикло(Arg-aзaAla-Asp-D-Phe-Val), FAB 590;
цикло(Arg-aзaGly-Asp-D-Lys-Val);
цикло(Arg-aзaGly-Asp-D-Phe-Lys);
цикло(Arg-aзaGly-Asp-D-Phe-Gly);
цикло(Arg-aзaGly-Asp-D-Phe-Ala);
цикло(Arg-aзaGly-Asp-D-Phe-Phe);
цикло(Arg-aзaGly-Asp-D-Phe-Leu);
цикло(Arg-aзaGly-Asp-D-Phg-Val);
цикло(Arg-aзaGly-Asp-Phe-Gly);
цикло(Arg-aзaGly-Asp-Phe-D-Ala).
В нижеследующих примерах представлены фармацевтические композиции и технология их приготовления в соответствующих дозированных формах.
Пример А: Склянки для инъекционных растворов
Раствор из 100 г активного вещества формулы I и 5 г гидрофосфата динатрия в 3 л дважды дистиллированной воды с помощью 2н. соляной кислоты устанавливают на рН 6,5, стерильно фильтруют, заполняют склянки, лиофилизуют в стерильных условиях и стерильно укупоривают. В каждой склянке содержится 5 мг активного вещества.
Пример Б: Суппозитории
Вначале приготавливают смесь из 20 г активного вещества формулы I, 100 г соевого лецитина и 1400 г масла какао, затем расплавляют, разливают в формы и дают застыть. Каждый суппозиторий содержит 20 мг активного вещества.
Пример В: Раствор
Приготавливают раствор из 1 г активного вещества формулы I, 9,38 г NaH2PO4•2H2O, 28,48 г Na2HPO4•12H2O и 0,1 г хлорида бензалкония в 940 мл дважды дистиллированной воды. Затем устанавливают на рН 6,8, доводят до объема 1 л и стерилизуют облучением. Этот раствор может применяться в виде глазных капель.
Пример Г: Мазь
При соблюдении асептических условий приготавливают смесь из 500 мг активного вещества формулы I и 99,5 г вазелина.
Пример Д: Таблетки
Приготавливают смесь из 1 кг активного вещества формулы I, 4 кг лактозы, 1,2 кг картофельного крахмала, 0,2 кг талька и 0,1 кг стеарата магния, которую затем таблетируют по обычной технологии таким образом, что каждая таблетка содержит 10 мг активного вещества.
Пример Е: Драже
Аналогично примеру Д прессуют таблетки, которые затем по обычной технологии покрывают оболочкой из сахарозы, картофельного крахмала, талька, траганта и красителя.
Пример Ж: Капсулы
Из 2 кг активного вещества формулы I по обычной технологии изготавливают капсулы с твердожелатиновым покрытием таким образом, что каждая капсула содержит 20 мг активного вещества.
Пример 3: Ампулы
Раствор из 1 кг активного вещества формулы I в 60 л дважды дистиллированной воды стерильно фильтруют, разливают в ампулы, в стерильных условиях лиофилизуют и стерильно укупоривают. В каждой ампуле содержится 10 мг активного вещества.
Пример И: Ингаляционный спрей
14 г активного вещества формулы I растворяют в 10 л изотонического NaCl-раствора и затем этот раствор разливают в обычные, коммерчески доступные баллончики, снабженные насосным приспособлением. Раствор может применяться для ингаляции полости рта и носа. Выдаваемая из баллончика за одно нажатие порция (примерно 0,1 мл) соответствует дозе приблизительно 0,14 мг.
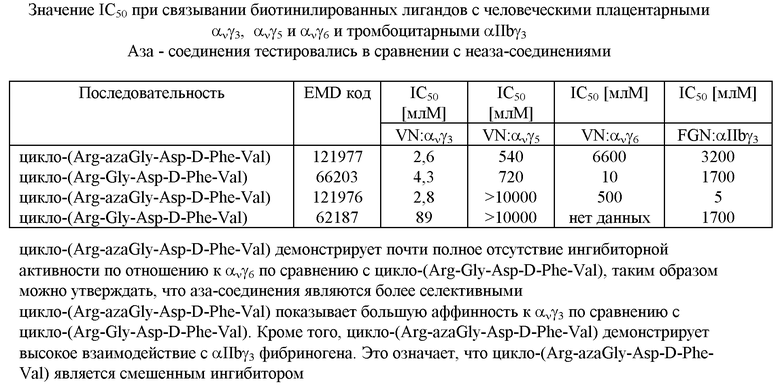
Данные о фармакологических испытаниях приведены в таблице.
Очищенные человеческие интегрины GPIIbilla (идентичные αIIbγ3) из тромбоцитов и ανγ3, ανγ5 и ανγ6 из плаценты в период беременности адсорбировались в микротитрационных лунках и спаривались с биотинилированными соответствующими лигандами - вибронекипин (VN) для ανγ3, ανγ5 и ανγ6 и фибриноген (FGN) для αIIbγ3 в присутствии увеличивающихся концентраций тестируемых соединений.
Способ: 1 мкг мл-1 биотин-лиганд выдерживался с 1 мкг мл-1 покрывающего рецептора в присутствии серийного разведения пептидов. После выдерживания в течение 4 ч при 30oС количество связанного лиганда измеряли посредством обнаружения с помощью антибиотин-щелочной фосфатазы.
Литература: Charo I.F., Nannizi L. Smith J.W. and Cheresh D.A.. J. Cell. Biol. Ill, 2795-2800 (1990).
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ЦИКЛОПЕПТИДОВ | 1997 |
|
RU2202557C2 |
| ЦИКЛОПЕПТИДЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 1996 |
|
RU2157379C2 |
| ЦИКЛОПЕПТИДЫ ИЛИ ИХ СОЛИ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И СПОСОБ ИХ ПОЛУЧЕНИЯ, СПОСОБ ЛЕЧЕНИЯ | 1993 |
|
RU2129563C1 |
| ЦИКЛОПЕПТИДЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1994 |
|
RU2130030C1 |
| БИОТИНОВЫЕ ПРОИЗВОДНЫЕ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1996 |
|
RU2171807C2 |
| ЦИКЛИЧЕСКИЕ ИНГИБИТОРЫ АДГЕЗИИ | 1997 |
|
RU2184121C2 |
| ПРОИЗВОДНЫЕ ЦИКЛОПЕПТИДОВ В КАЧЕСТВЕ ИНГИБИТОРОВ АДГЕЗИИ | 1998 |
|
RU2200166C2 |
| КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ЦИКЛИЧЕСКИЕ ПЕПТИДЫ, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2009 |
|
RU2555357C2 |
| ЦИКЛОПЕПТИДЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ | 1995 |
|
RU2151776C1 |
| ЦИКЛОПЕПТИДНЫЕ ПРОИЗВОДНЫЕ | 1996 |
|
RU2174520C2 |
Описываются новые циклические азапептиды общей формулы I цикло(aArg-aGly-aAsp-aX-aY), в которой aArg обозначает Arg, aGly обозначает азаGlу, aAsp обозначает Asp, aX обозначает остаток аминокислоты, выбранной из группы, включающей Lys и Phe, aY обозначает остаток аминокислоты, выбранный из группы Val, Gly, Ala, Leu,и, если речь идет об остатках оптически активных аминокислот и о производных аминокислот, это понятие включает как D-, так и L-формы, а также соли указанных соединений,способ получения целевых соединений формулы I путем циклизации соответствующего линейного пептида с последующим переводом полученного продукта в одну из его солей, а также фармацевтическая композиция, обладающая способностью ингибировать взаимодействие рецепторов интегрина с лигандами, содержащая в качестве активного ингредиента, по крайней мере, одно соединение формулы I. Описываемые соединения обладают более высокой способностью ингибировать взаимодействие рецепторов интегрина с лигандами, чем соответствующие соединения, не содержащие азаалеинокислот. 3 с. и 2 з.п.ф-лы, 1 табл.
цикло(aArg-aGly-aAsp-aX-aY),
в которой aArg обозначает Arg;
aGly обозначает азаGlу;
aAsp обозначает Asp;
аХ обозначает остаток аминокислоты, выбранной из группы, включающей Lys и Phe;
aY обозначает остаток аминокислоты, выбранный из группы Val, Gly, Ala, Leu;
и, если речь идет об остатках оптически активных аминокислот и о производных аминокислот, это понятие включает как D-, так и L-формы, а также соли указанных соединений.
а) цикло(Arg-aзaGly-Asp-D-Phe-Val),
б) цикло(Arg-aзaGly-Asp-Phe-D-Val), а также их соли.
H-Z-OH
в которой Z обозначает - aArg-aGly-aAsp-aX-aY-;
-aGly-aAsp-aX-aY-aArg-;
-aAsp-aX-aY-aArg-aGly-;
-aX-aY-aArg-aGly-aAsp- или
-aY-aArg-aGly-aAsp-aX-,
a aArg, aGly, aAsp, aX и aY имеют значения, указанные в п.1, либо реакционноспособное производное соединение формулы II обрабатывают агентом циклизации и/или что основное или кислое соединение формулы I путем обработки кислотой или основанием переводят в одну из его солей.
| Циклический аналог брадикинина,обладающий пролонгированным гипотензивным действием | 1980 |
|
SU892871A1 |
| RU 94011276 A1, 10.11.1997 | |||
| RU 95106821 A1, 10.01.1997 | |||
| ЦИКЛОПЕПТИД ИЛИ ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ, СПОСОБЫ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1991 |
|
RU2108342C1 |
| Домовый номерной фонарь, служащий одновременно для указания названия улицы и номера дома и для освещения прилежащего участка улицы | 1917 |
|
SU93A1 |
| Прибор для очистки паром от сажи дымогарных трубок в паровозных котлах | 1913 |
|
SU95A1 |
Авторы
Даты
2002-08-27—Публикация
1998-06-29—Подача