Настоящее изобретение относится к молекулярной биологии и химии нуклеиновых кислот. В частности, оно относится к способам и реагентам, предназначенным для обнаружения вируса иммунодефицита человека типа 1 (ВИЧ-1). Следовательно, областью применения изобретения является медицина в целом и более конкретно медицинская диагностика и молекулярная биология.
Создание способов амплификации определенных последовательностей нуклеиновых кислот, в частности полимеразной цепной реакции (ПЦР), делает возможным быстрое обнаружение нуклеиновых кислот, присутствующих в образце в столь малых количествах, что их ранее было невозможно обнаружить (см. патенты США 4683195, 4683202 и 4965188). В литературе имеются многочисленные данные о совершенствовании и применении ПЦР. Например, широкий спектр связанных с ПЦР проблем представлен в таких изданиях, как PCR Technology - principles and applications for DNA amplification, 1989 (ред. H.A.Erlich), Stockton Press, New York, NY; PCR Protocols: A guide to methods and applications, 1990 (ред. М. А. Innis и др.), Academic Press, San Diego, CA; и в PCR Strategies, 1995 (ред. М. А. Innis и др.), Academic Press, San Diego, CA. Коммерческие поставщики, такие как фирма Perkin Elmer (Norwalk, CT), поставляют на рынок реагенты для ПЦР и публикуют ПЦР-протоколы.
Обзор данных по применению ПЦР и гибридизации с использованием зондов для амплификации и обнаружения нуклеиновой кислоты ВИЧ-1 представлен у Kwok, 1992, Ann. Med. 24: 211-214; и у Coutlee и др., 1991, Mol. Cell. Probes 5: 241-259. Основанные на использовании ПЦР методы обнаружения ВИЧ-1 описаны, например, в патентах США 5008182 и 5176775; у Kellogg и Kwok, 1990, в PCR Protocols: A Guide to Methods and Applications, (ред. Innis и др.), Academic Press, San Diego, CA, 337-347; у Holodniy и др., 1991, J. Inf. Dis. 163: 802-865; Jackson и др., 1991, AIDS 5: 1463-1467; и у Mulder и др., 1994, J. Clin. Microbiol. 32(2): 292-300.
Коммерческие наборы для амплификации и обнаружения ВИЧ-1 поставляются фирмой Hoffmann-La Roche (Nutley, NY). Набор AmplicorTM HIV-1 Test предназначен для обнаружения in vitro провирусной ДНК ВИЧ-1. Набор AMPLICOR HIV-1 MONITORTM Test предназначен для количественной оценки in vitro РНК ВИЧ-1. В обоих тест-наборах Amplicor для амплификации нуклеиновых кислот ВИЧ-1 используется пара праймеров SK462 (SEQ ID NO: 5) и SK431 (SEQ ID NO: 6), описанных у Mulder и др., 1994, J. Clin. Microbiol. 32(2): 292-300, называемых в настоящем описании Amplicor-праймерами для ВИЧ-1.
ВИЧ-1 обладает значительной вариабельностью геномной последовательности. Филогенетический анализ последовательностей нуклеиновых кислот генов gag и env ВИЧ-1 описан в работе Myers и др., 1993, Human Retrovirus and AIDS, 1993, Los Alamos National Laboratory, Los Alamos, NM, включенной в настоящее описание в качестве ссылки. Внутри группы М были выявлены подтипы A-J.
В литературе описаны общепринятые методы молекулярной биологии и химии нуклеиновых кислот, относящиеся к области настоящего изобретения (см., например, Sambrook и др., 1989, Molecular Cloning - A Laboratory Manual, Cold Spring Harbor Laboratory, Cold Spring Harbor, New York; Oligonucleotide Synthesis (ред. M.J.Gait, 1984); Nucleic Acid Hybridization (ред. B.D.Hames и S.J.Higgins, 1984); и серии Methods in Enzymology (Academic Press, Inc.)).
Были выявлены многочисленные изоляты группы М вируса иммунодефицита человека типа 1 (ВИЧ-1), которые либо не амплифицируются, либо недостаточно эффективно амплифицируются с ранее описанными праймерами для гена gag, в частности с использованием Amplicor-праймеров для ВИЧ-1 SK462 (SEQ ID NO: 5) и SK431 (SEQ ID NO: 6). Эти изоляты проявляют не описанную ранее вариабельность последовательностей в области, включающей сайты связывания праймеров Amplicor-праймеров для ВИЧ-1.
Настоящее изобретение относится к улучшенным праймерам, способным эффективно амплифицировать эти недавно обнаруженные изоляты, в дополнение ко всем изолятам, которые способны амплифицироваться с использованием Amplicor-праймеров для ВИЧ-1. Кроме того, праймеры по изобретению способны амплифицировать все известные изоляты группы М ВИЧ-1 с приблизительно одинаковой эффективностью.
Настоящее изобретение относится далее к улучшенным олигонуклеотидным праймерам, способным осуществлять амплификацию с использованием полимеразной цепной реакции (ПЦР) области гена gag изолятов подтипов A-G группы М ВИЧ-1 с приблизительно одинаковой эффективностью и без одновременной амплификации последовательностей, не являющихся мишенями.
В частности, настоящее изобретение относится к олигонуклеотидным праймерам, предназначенным для амплификации нуклеиновой кислоты вируса иммунодефицита человека типа 1 (ВИЧ-1), причем указанный олигонуклеотидный праймер выбирают из группы, состоящей из SKCC1 (SEQ ID NO: 3) и SKCC3 (SEQ ID NO: 4).
Предпочтительно каждый из этих праймеров объединен в пару олигонуклеотидных праймеров, состоящую из SK145 (SEQ ID NO: 1) и SKCC1 (SEQ ID NO: 3), или в пару олигонуклеотидных праймеров, состоящую из SK145 (SEQ ID NO: 1) и SKCC3 (SEQ ID NO: 4).
В другом варианте эти пары праймеров могут быть объединены с праймером SK145M2 (SEQ ID NO: 2) в набор олигонуклеотидных праймеров, состоящий из олигонуклеотидных праймеров SK145 (SEQ ID NO: 1), SKCC1 (SEQ ID NO: 3) и SK145M2 (SEQ ID NO: 2), или в набор олигонуклеотидных праймеров, состоящий из олигонуклеотидных праймеров SK145 (SEQ ID NO: 1), SKCC3 (SEQ ID NO: 4) и SK145M2 (SEQ ID NO: 2).
Изобретение относится также к улучшенным способам амплификации области гена gag из подтипов группы М ВИЧ-1, включающим осуществление ПЦР с использованием праймеров по изобретению.
Настоящее изобретение далее относится к наборам, содержащим амплифицирующий праймер по настоящему изобретению. Эти наборы могут включать дополнительные реагенты, такие как зонды для обнаружения, или один или несколько реагентов для амплификации, например полимеразу, буферы и нуклеозидтрифосфаты.
Для лучшего понимания изобретения ниже определены некоторые понятия.
"Нуклеиновая кислота" и "олигонуклеотид" относятся к полидезоксирибонуклеотидам (содержащим 2-дезокси-D-рибозу), к полирибонуклеотидам (содержащим D-рибозу) и к любому другому типу полинуклеотида, представляющего собой N-гликозид пуринового или пиримидинового основания или модифицированного пуринового или пиримидинового основания. Понятия "нуклеиновая кислота" и "олигонуклеотид" не подразумевают различия в длине цепи и могут использоваться взаимозаменяемо. Эти понятия относятся только к первичной структуре молекулы. Таким образом, эти понятия включают двух- и одноцепочечную ДНК, а также двух- и одноцепочечную РНК.
Олигонуклеотиды могут быть получены любым пригодным для этой цели способом, включая, например, клонирование и рестрикцию соответствующих последовательностей и прямой химический синтез с помощью такого метода, как фосфотриэфирный метод, описанный у Narang и др., 1979, Meth. Enzymol. 68: 90-99; фосфодиэфирный метод, описанный у Brown и др., 1979, Meth. Enzymol. 68: 109-151; диэтилфосфорамидитный метод, описанный у Beaucage и др., 1981, Tetrahedron Lett. 22: 1859-1862; и метод с использованием твердой подложки, описанный в патенте США 4458066. Обзор методов синтеза представлен у Goodchild, 1990, Bioconjugate Chemistry, 1(3): 165-187.
Понятие "гибридизация" относится к образованию дуплексной структуры двумя одноцепочечными нуклеиновыми кислотами в результате комплементарного спаривания оснований. Гибридизация может происходить между полностью комплементарными цепочками нуклеиновой кислоты или между "практически комплементарными" цепочками нуклеиновой кислоты, которые содержат минорные области ошибочного спаривания. Условия, при которых могут гибридизироваться только полностью комплементарные цепочки нуклеиновой кислоты, называются "строгими условиями гибридизации" или "условиями гибридизации, специфичными для последовательности". Стабильные дуплексы практически комплементарных последовательностей могут быть получены при менее строгих условиях гибридизации; степень допустимых ошибочных спариваний может контролироваться с помощью соответствующего регулирования условий гибридизации. Специалисты в области технологии нуклеиновых кислот могут определить стабильность дуплекса эмпирическим путем, учитывая различные параметры, в том числе, например, длину и концентрацию пар оснований олигонуклеотидов, ионную силу и частоту ошибочных спариваний оснований, используя для этой цели известное в данной области техники руководство (см., например, Sambrook и др., 1989, Molecular Cloning - A Laboratory Manual, Cold Spring Harbor Laboratory, Cold Spring Harbor, New York; и Wetmur, 1991, Critical Reviews in Biochem. and Mol. Biol., 26(3/4): 227-259).
Понятие "праймер" относится к природному или синтетическому олигонуклеотиду, способному действовать в качестве точки инициации синтеза ДНК в условиях, при которых индуцируется синтез продукта удлинения праймера, комплементарного цепи нуклеиновой кислоты, т.е. в присутствии четырех различных нуклеозидтрифосфатов и агента, обеспечивающего полимеризацию (т.е. ДНК-полимеразы или обратной транскриптазы) в соответствующем буфере и при соответствующей температуре. Праймер предпочтительно представляет собой одноцепочечный олигодезоксирибонуклеотид. Соответствующая длина праймера зависит от целей применения праймера, но обычно составляет от 15 до 35 нуклеотидов. Короткие молекулы праймера обычно требуют более низких температур для формирования достаточно стабильных гибридных комплексов с матрицей. Не требуется, чтобы праймер отражал точную последовательность нуклеиновой кислоты-матрицы, но он должен быть в достаточной степени комплементарным, чтобы гибридизироваться с матрицей. Праймеры могут включать дополнительные структуры, которые позволяют обнаруживать или иммобилизировать праймер, но не изменяют основное свойство праймера, а именно способность действовать в качестве точки инициации синтеза ДНК. Например, праймеры могут содержать дополнительную нуклеотидную последовательность на 5'-конце, которая не гибридизируется с нуклеиновой кислотой-мишенью, но которая способствует клонированию амплифицированного продукта. Область праймера, комплементарная матрице в достаточной для гибридизации степени, в контексте настоящего описания обозначается как "область гибридизации".
В контексте настоящего описания понятие "праймер, инициирующий синтез против хода транскрипции" относится к праймеру, продукт удлинения которого представляет собой субпоследовательность кодирующей цепочки. "Праймер, инициирующий синтез по ходу транскрипции" относится к праймеру, продукт удлинения которого представляет собой субпоследовательность, комплементарную некодирующей цепочке.
Понятия "последовательность-мишень", "область-мишень" и "нуклеиновая кислота-мишень" относятся к области нуклеиновой кислоты, подлежащей амлификации, обнаружению или другому анализу.
В контексте настоящего описания праймер является "специфичным" для последовательности-мишени, если количество ошибочных спариваний, образующихся между праймером и последовательностью-мишенью, меньше, чем количество ошибочных спаривании, образующихся между праймером и последовательностями, не являющимися мишенями, которые могут присутствовать в образце. Могут быть выбраны такие условия гибридизации, при которых стабильные дуплексы формируются только в тех случаях, если количество присутствующих ошибочных спариваний не больше количества ошибочных спариваний, образующихся между праймером и последовательностью-мишенью. При таких условиях праймер, специфичный для мишени, может образовывать стабильный дуплекс только с последовательностью-мишенью. Таким образом, применение праймеров, специфичных для мишени, в условиях амплификации соответствующей строгости позволяет осуществлять специфическую амплификацию тех последовательностей, которые имеют сайты связывания, являющиеся мишенями для праймера. Аналогично этому применение зондов, специфичных для мишени, в условиях гибридизации соответствующей строгости дает возможность обнаруживать конкретную последовательность-мишень.
Понятие "смесь для реакции амплификации" относится к раствору, который содержит реагенты, необходимые для осуществления реакции амплификации, и который обычно содержит праймеры, термостабильную ДНК-полимеразу, дНТФ и катион двухвалентного металла в соответствующем буфере. Реакционная смесь называется полной, если она содержит все реагенты, необходимые для осуществления реакции, и называется неполной, если она содержит неполный набор необходимых реагентов. Для специалиста в данной области техники очевидно, что для удобства, сохранения стабильности при хранении или же для возможности регулировать концентрации компонентов в зависимости от назначения компоненты реакции обычно хранят в виде отдельных растворов, каждый из которых содержит неполный набор всех компонентов, а сами компоненты реакции объединяют до реакции для создания полной реакционной смеси. Кроме того, для специалиста в данной области техники очевидно, что для продажи компоненты реакции упаковывают по отдельности и что пригодные коммерческие наборы могут содержать любой неполный набор компонентов реакции, включающий праймеры по настоящему изобретению.
Праймеры для амплификации ВИЧ-1
Праймеры по настоящему изобретению обладают способностью амплифицировать нуклеиновую кислоту подтипов группы М ВИЧ-1. Праймеры являются существенно улучшенными по сравнению с ранее описанными праймерами в том отношении, что они обладают способностью амплифицировать практически с одинаковой эффективностью нуклеиновую кислоту из области гена gag всех изолятов подтипов A-G, принадлежащих группе М, включая недавно открытые изоляты. Нуклеотидные последовательности праймеров приведены ниже в ориентации слева направо 5'-->3'.
Праймеры, инициирующие синтез против хода транскрипции:
SK145 (SEQ ID NO: 1) AGTGGGGGGACATCAAGCAGCCATGCAAAT
SK145M2 (SEQ ID NO: 2) AGTGGGGGGACACCAGGCAGCAATGCAAAT
Праймеры, инициирующие синтез по ходу транскрипции:
SKCC1 (SEQ ID NO: 3) TACTAGTAGTTCCTGCTATGTCACTTCC
SKCC3 (SEQ ID NO: 4) TGAAGGGTACTAGTAGTTCCTGCTAT
Праймеры по настоящему изобретению, инициирующие синтез по ходу транскрипции, могут применяться с любым приведенным в настоящем описании праймером, инициирующим синтез против хода транскрипции. Праймеры по настоящему изобретению, инициирующие синтез по ходу транскрипции, предпочтительно применяют с инициирующим синтез против хода транскрипции праймером SK145 (SEQ ID NO: 1), необязательно в сочетании с инициирующим синтез против хода транскрипции праймером SK145M2 (SEQ ID NO: 2). Инициирующий синтез против хода транскрипции праймер SK145 (SEQ ID NO: 1) описан у Kellogg и Kwok, 1990, в PCR Protocols: A Guide to Methods and Applications (ред. Innis и др. ), Academic Press, San Diego, CA: 337-347. Второй инициирующий синтез против хода транскрипции праймер SK145M2 (SEQ ID NO: 2) гибридизируется с такой же областью, что и SK145 (SEQ ID NO: 1), но он создан для более точного спаривания с нуклеотидной последовательностью определенных изолятов подтипа А и Е ВИЧ-1. Как указано ниже в примерах, применение обоих инициирующих синтез против хода транскрипции праймеров может способствовать выравниванию эффективности амплификации определенных подтипов.
Амплификация
Амплификации осуществляют в условиях, которые позволяют амплифицировать все подтипы группы М ВИЧ-1, но которые обладают достаточной строгостью для того, чтобы избежать амплификации последовательностей, не являющихся мишенями. Предпочтительные условия реакции амплификации описаны в примерах у Mulder и др., 1994, J. Clin. Microbiol. 32(2): 292-300, и в инструкции, включенной в тест-набор AMPLICOR HIV-1 MONITOR Test. Точные условия не имеют решающего значения при практическом осуществлении изобретения. Оптимизация условий амплификации может быть проведена обычным способом, основываясь на руководстве, представленном в данном описании.
Предлагаемые праймеры и способы могут применяться для обнаружения либо провирусной ДНК ВИЧ-1, либо РНК ВИЧ-1. Амплификация РНК с использованием полимеразной цепной реакции с обратной транскриптазой (ОТ-ПЦР) хорошо известна в данной области техники и описана в патентах США 5322770 и 5310652; у Myers и Gelfand, 1991, Biochemistry, 30(31): 7661-7666; и у Young и др., 1993, J. Clin. Microbiol. , 31(4): 882-886. Амплификация РНК ВИЧ-1 с использованием ОТ-ПЦР описана у Mulder и др., 1994, J. Clin. Microbiol. 32(2): 292-300 и у Holodniy и др., 1991, J. Inf. Dis. 163: 802-865.
Методы подготовки образца, пригодные для амплификации ДНК и РНК ВИЧ-1, описаны в литературе. Выбор конкретного метода не имеет существенного значения при практическом осуществлении настоящего изобретения. Специалист в данной области техники может выбрать и оптимизировать пригодные методы получения образца, основываясь на руководстве, представленном в данном описании. Предпочтительные методы подготовки образца, применяемые для обнаружения провирусной ДНК ВИЧ-1, описаны у Casareale и др., 1992, PCR Methods and Applications, 2: 149-153, и у Butcher и Spadoro, 1992, Clin. Immunol. Newsletter, 12: 73-76. Предпочтительный набор для подготовки образца для обнаружения провирусной ДНК ВИЧ-1 имеется на рынке в виде части набора Amplicor HIV-1 Test. Предпочтительные методы подготовки образца, применяемые для обнаружения РНК ВИЧ-1 в плазме, описаны у Mulder и др., 1994, J. Clin. Microbiol. 32(2): 292-300. Предпочтительный набор для подготовки образца для обнаружения и/или количественной оценки РНК ВИЧ-1 имеется на рынке в виде части набора AMPLICOR HIV-1 MONITOR Test.
Анализ апдифицированного продукта
Праймеры для амплификации и способы по настоящему изобретению пригодны для любого применения, основанного на использовании амплифицированной нуклеиновой кислоты. Например, клонирование и/или секвенирование последовательностей ВИЧ-1 облегчается при использовании праймеров по настоящему изобретению. Методы обнаружения нуклеиновых кислот, амплифицированных с помощью ПЦР, хорошо известны в данной области техники. Метод, который применяется для анализа амплифицированной нуклеиновой кислоты, не имеет существенного значения при практическом осуществлении изобретения и поэтому может использоваться любой пригодный метод. Предпочтительно используют амплификацию РНК ВИЧ-1, как описано в примерах, касающихся количественной оценки содержания вируса.
Примеры способов обнаружения амплифицированной нуклеиновой кислоты включают анализ продукта амплификации с помощью гель-электрофореза и обнаружение с помощью гибридизации с комплементарными олигонуклеотидными зондами.
Пригодные методы анализа для исследования гибридизации мишень-зонд хорошо известны в данной области техники и включают такие методы, как дот-блоттинг и обратный дот-блоттинг.
При использовании метода дот-блоттинга амплифицированную ДНК-мишень иммобилизуют на твердой подложке, такой как найлоновая мембрана. Комплекс мембрана-мишень инкубируют с меченым зондом при соответствующих условиях гибридизации, негибридизованный зонд удаляют путем промывки в условиях соответствущей строгости и мембрану исследуют на присутствие связанного зонда. Обнаружение с помощью дот-блоттинга продуктов ПЦР-амплификации описано, например, у Saiki и др. , 1986, Nature, 324: 163-166, и в патенте США 5468613.
При использовании метода обратного дот-блоттинга зонды иммобилизуют на твердой подложке, такой как найлоновая мембрана, и метят амплифицируемую ДНК-мишень. ДНК-мишень обычно метят в процессе амплификации включением меченых праймеров. Один или оба праймера могут быть мечеными. Комплекс мембрана-зонд инкубируют с меченой амплифицируемой ДНК-мишенью при соответствующих условиях гибридизации, негибридизованную ДНК-мишень удаляют путем промывки в условиях соответствущей строгости и затем фильтр исследуют на присутствие связанной ДНК-мишени. Обнаружение с помощью методов обратного дот-блоттинга описано, например, у Saiki и др., 1989, Proc. Natl. Acad. Sci. USA, 86: 6230, и в патенте США 5468613.
В альтернативном варианте анализ на основе обратного дот-блоттинга может быть проведен с использованием твердой подложки, имеющей множество сайтов для отжига зонда или лунок. Например, микролуночный планшет наиболее пригоден для крупномасштабных клинических применений методов по настоящему изобретению. Зонды могут быть иммобилизованы на микролуночном планшете либо путем пассивного связывания, либо с помощью промежуточного протеина, такого как бычий сывороточный альбумин (БСА), который прилипает к микролуночным планшетам (см. Tung и др., 1991, Bioconjugate Chem., 2: 464-465). Методы на основе обратного дот-блоттинга, в которых используется микролуночный планшет, описаны в патенте США 5232829; у Loeffelholz и др., 1992, J. Clin. Microbiol. , 30(11): 2847-2851; у Jackson и др., 1991, AIDS, 5: 1463-1467; у Mulder и др., 1994, J. Clin. Microbiol. 32(2): 292-300; в инструкции, включенной в коммерческий набор Amplicor HIV-1 Test; и в инструкции, включенной в коммерческий набор AMPLICOR HIV-1 MONITOR Test.
Предпочтительно обнаружение и/или количественную оценку амплифицированного продукта осуществляют с помощью гибридизации с олигонуклеотидным зондом, иммобилизованным на микролуночном планшете, с использованием реагентов и протоколов Amplicor HIV-1 Test или AMPLICOR HIV-1 MONITOR Test. Применение методов по настоящему изобретению для количественной оценки РНК ВИЧ-1 описано ниже в примерах.
В другом варианте зонды, конъюгированные с БСА, связывают с магнитными микрочастицами. Связанные зонды гибридизируют в растворе с меченым продуктом амплификации и образовавшийся продукт удаляют из раствора магнитным путем. Иммобилизованные магнитным путем гибридные дуплексы затем выявляют описанными выше способами.
Другой пригодный метод анализа, названный 5'-нуклеазным методом, описан в патентах США 5210015 и 5487972 и у Holland и др., 1988, Proc. Natl. Acad. Sci. USA, 88: 7276-7280. В 5'-нуклеазном методе меченые обнаруживаемые зонды, которые были модифицированы таким образом, чтобы они не могли действовать в качестве праймеров в синтезе ДНК, добавляют в реакционную смесь в процессе амплификации. Любой зонд, который гибридизуется с ДНК-мишенью в течение каждой стадии синтеза, т.е. в процессе удлинения праймера, расщепляют с помощью 5'-->3' экзонуклеазной активности ДНК-полимеразы, например ДНК-полимеразы Taq. Затем выявляют продукт разложения зонда. Таким образом, присутствие продукта расщепления зонда свидетельствует как о том, что произошла гибридизация между зондом и ДНК-мишенью, так и о том, что произошла реакция амплификации. В патентах США 5491063 и 5571673 описаны улучшенные способы обнаружения расщепления зонда, которое сопутствует амплификации.
В описанных выше методах анализа для облегчения обнаружения гибридных дуплексов обычно используют меченые олигонуклеотиды. Олигонуклеотиды могут быть помечены путем включения метки, выявляемой спектроскопическим, фотохимическим, биохимическим, иммунохимическим или химическим методами. Пригодные метки включают 32Р, флуоресцентные краски, электронно-плотные реагенты, ферменты (например, такие, которые используются в методе ELISAS), биотин или гаптены и протеины, для которых доступны антисыворотка или моноклональные антитела. Меченые олигонуклеотиды по изобретению могут быть синтезированы и помечены с использованием способов, описанных выше для синтезируемых олигонуклеотидов.
Альтернативный метод обнаружения амплификации нуклеиновой кислоты ВИЧ-1 путем оценки увеличения общего количества двухцепочечной ДНК в реакционной смеси описан у Higuchi и др., 1992, Bio/Technology, 10: 413-417; Higuchi и др. , 1993, Bio/Technology, 11: 1026-1030; и в публикации европейской заявки 512334. Обнаружение двухцепочечной ДНК-мишени основано на возростании флуоресценции, которая проявляется, когда этидийбромид (EtBr) и другие связывающиеся с ДНК метки связываются с двухцепочечной ДНК. Метку, связывающуюся с ДНК, добавляют в реакционную смесь для амплификации. Амплификация последовательности-мишени приводит к увеличению количества двухцепочечной ДНК, что в свою очередь приводит к обнаруживаемому увеличению флуоресценции.
Настоящее изобретение также относится к наборам, многоконтейнерным наборам, содержащим соответствующие компоненты для практического осуществления способа по настоящему изобретению. Такой набор содержит, например, праймеры для ПЦР-амплификации нуклеиновой кислоты ВИЧ-1. Набор также может содержать средства для обнаружения амплифицированной нуклеиновой кислоты ВИЧ-1, такие как олигонуклеотидные зонды. В некоторых случаях зонды фиксируют на соответствующей подложке-мембране. Другие необязательные компоненты набора включают, например, агент, пригодный в качестве катализатора синтеза продуктов удлинения праймера, нуклеозидтрифосфаты в качестве субстрата, средства, применяемые для мечения (например, конъюгат авидин-фермент, или ферментный субстрат и хромоген в том случае, когда метка представляет собой биотин), соответствующие буферы для ПЦР или реакций гибридизации и инструкции по осуществлению настоящего метода.
Ниже изобретение подробнее проиллюстрировано на примерах, которые не ограничивают объем изобретения. Многочисленные варианты осуществления изобретения в объеме формулы изобретения, которые вытекают из примеров, должны быть очевидны специалистам в данной области техники на основе вышеприведенного описания и последующих примеров.
Пример 1
Конструирование количественного стандарта
Для количественной оценки содержания вируса, осуществляемой с помощью AMPLICOR HIV-1 MONITOR Test, используют количественный стандарт (КС), который амплифицируют с применением той же самой пары праймеров, но который выявляют с использованием другого зонда. КС добавляют к тестируемому образцу в известной концентрации с целью получить известный эталонный сигнал. Для широкого диапазона концентраций мишени сигнал, генерируемый амплифицированной мишенью или амплифицированным КС, пропорционален имеющемуся количеству. Количество копий мишени оценивают путем сравнения сигнала, генерируемого при амплификации неизвестной мишени, и сигнала, генерируемого известным КС.
Праймеры по настоящему изобретению амплифицируют область, которая не полностью охватывается КС, включенным в набор AMPLICOR HIV-1 MONITOR Test (KC-Amplicor). Поэтому для применения праймеров по настоящему изобретению конструировали новый КС. Новый КС конструировали из КС-Amplicor путем удлинения последовательности KC-Amplicor с целью включить сайты связывания SKCC1 (SEQ ID NO: 3) и SKCC3 (SEQ ID NO: 4). Образовавшийся КС может быть обнаружен с помощью КС-специфического зонда, используемого в AMPLICOR HIV-1 MONITOR Test. Конструирование плазмиды, содержащей последовательность нового КС, из которой транскрибируют РНК КС, может быть осуществлено с использованием стандартных методов, как описано ниже.
KC-Amplicor, полученный из AMPLICOR HIV-1 MONITOR Test, амплифицируют с использованием праймеров SK145 (SEQ ID NO: 1) и SK151 (SEQ ID NO: 7) в условиях, практически соответствующих таковым, которые описанны ниже в примере 2. В результате амплификации получали ДНК-продукт, содержащий сайты связывания для SK145 (SEQ ID NO: 1) и SK151 (SEQ ID NO: 7) и сохраняющий внутреннюю последовательность, содержащую сайт связывания КС-специфического зонда.
Далее образовавшийся амплифицированный продукт удлиняют для включения сайта связывания праймера SKCC1 (SEQ ID NO: 3) и добавляют линкер для возможности клонирования продукта. Этого достигают с помощью повторной амплификации продукта с использованием праймера SK145 (SEQ ID NO: 1), удлиненного на 5'-конце с той целью, чтобы включить линкер HindIII и SKCC1 (SEQ ID NO: 3). Соответствующие условия амплификации описаны у Kellogg и Kwok, 1990, в PCR Protocols: A Guide to Methods and Applications, (ред. Innis и др.), Academic Press, San Diego, CA: 337-347, за исключением того, что используют более низкую температуру отжига/удлинения (например, 42oС) для гибридизации SKCC1 (SEQ ID NO: 3).
После этого образовавшийся амплифицированный продукт еще раз удлиняют для включения сайта связывания праймера SKCC3 (SEQ ID NO: 4) и добавляют второй линкер к другому концу для возможности клонирования продукта. Этого достигают с помощью амплификации продукта с использованием праймера SK145 (SEQ ID NO: 1), удлиненного на 5'-конце с той целью, чтобы включить линкер HindIII, как описано выше, наряду с праймером SKCC3 (SEQ ID NO: 4), удлиненным на 5'-конце для включения линкера ХваI с использованием описанных выше условий амплификации.
Затем амплифицированный продукт встраивают в плазмиду. Амплифицированную ДНК и плазмиду pSP64 (фирма Promega, Madison, WI) по отдельности расщепляют с помощью HindIII и ХваI, а затем лигируют с использованием стандартных методов. Компетентные клетки трансформируют рекомбинантными плазмидами и получают клон, который содержит правильную вставку. Клонированную вставку в полученной рекомбинантной плазмиде необходимо секвенировать с целью определить, что в сайты связывания праймера или зонда не введены мутации.
РНК количественного стандарта транскрибируют исходя из рекомбинантной плазмиды, содержащей КС-последовательность, с использованием набора MEGAscriptTM SP6 (фирма Ambion, Inc., Austin, TX).
Пример 2
Количественная оценка РНК ВИЧ-1
В этом примере описан способ оценки относительной эффективности амплификации различных изолятов ВИЧ-1. Для сравнения также осуществляли амплификации с использованием набора AMPLICOR HIV-1 MONITOR Test.
Изоляты ВИЧ-1 получали из ВИЧ-1-положительных клинических образцов. Область гена gag клонировали и секвенировали по стандартным методам, а подтип клонируемого ВИЧ-1 определяли, основываясь на анализе последовательности. Был обнаружен ряд новых изолятов ВИЧ-1. Для этой цели на основе нуклеотидных последовательностей выбирали определенные изоляты, для которых предполагалось наличие проблем при использовании набора AMPLICOR HIV-1 MONITOR Test. Кроме того, использовали изоляты, которым была присуща вариабельность последовательности, характерная для подтипов группы М.
Нуклеиновая кислота-мишень
Конструировали плазмиды, содержащие область гена gag ВИЧ-1 из каждого изолята, и РНК-матрицы ВИЧ-1 транскрибировали практически в соответствии с методом, описанным у Holodniy и др., 1991, J. Inf. Dis., 163: 802-865. Готовили маточные растворы каждой матрицы и определяли концентрации матриц. Маточные растворы разбавляли, основываясь на определении относительных концентраций, таким образом, чтобы концентрация матриц, добавляемых в каждую реакционную смесь, была одинаковой. Абсолютное количество копий матрицы, добавляемых в реакционные смеси, составляло приблизительно 4000-8000.
Количественный стандарт
КС, описанный в примере 1, вносили в каждую реакционную смесь в известной концентрации, обычно приблизительно 100 копий на реакционную смесь.
Праймеры
Реакции А-Е осуществляли с использованием комбинаций праймеров, представленных в табл. А.
Все праймеры биотинилировали на 5'-конце для обнаружения методом обратного дот-блоттинга на микролуночном планшете. Последовательности дополнительных, не описанных выше праймеров приведены ниже в ориентации 5'-->3'.
Праймеры, инициирующие синтез против хода транскрипции:
SK462 (SEQ ID NO: 5) AGTTGGAGGACATCAAGCAGCCATGCAAAT
Праймеры, инициирующие синтез по ходу транскрипции:
SK431 (SEQ ID NO: 6) TGCTATGTCAGTTCCCCTTGGTTCTCT
SK151 (SEQ ID NO: 7) TGCTATGTCACTTCCCCTTGGTTCTCT
Амплификация
Реакцию амплификации А проводили с использованием реагентов и условий из набора AMPLICOR HIV-1 MONITOR Test.
Реакцию амплификации Б проводили в объемах по 100 мкл, содержащих следующие реагенты:
РНК-матрица ВИЧ-1
РНК КС
50 мМ бицин, рН 8,3
111 мМ К(ОАс)
3,6 мМ Мn(ОАс)2
500 мкМ дУТФ
300 мкМ каждого из дАТФ, дЦТФ и дГТФ
50 мкМ дТТФ
15%-ный глицерин
0,2 мкМ каждого биотинилированного праймера
2 единицы урацил-ДНК-гликозилазы (УДГ)*
10 единиц ДНК-полимеразы rTth*
*Производство и разработка фирмы Hoffmann-La Roche и продажа фирмой Perkin Elmer (Norwalk, CT).
Реакции амплификации В и Г осуществляли практически при таких же условиях, которые использовались в реакции Б, но со следующими изменениями:
100 мМ К(ОАс)
500 мкМ каждого из дАТФ, дЦТФ и дГТФ
7,5%-ный глицерин
10 единиц УДГ
Реакции амплификации Д и Е осуществляют практически при таких же условиях, которые использовались в реакциях В и Г, но за исключением того, что используемая концентрация глицерина составляла 10%. Небольшие различия в реакционных смесях были результатом предварительной оптимизации условий амплификации для каждой пары праймеров.
Реакции амплификации Б-Е проводили в ДНК-термоячейке типа ТС9600 (фирма Perkin Elmer, Norwalk, CT) с использованием следующего температурного профиля:
инкубация перед реакцией: - 50oС в течение 2 мин
обратная транскрипция: - 60oС в течение 30 мин
4 цикла: денатурация: - 95oС в течение 10 с
отжиг: - 55oС в течение 10 с
удлинение: - 72oС в течение 10 с
26 циклов: денатурация: - 90oС в течение 10 с
отжиг: - 60oС в течение 10 с
удлинение: - 72oС в течение 10 с
окончательное удлинение: - 72oС в течение 15 мин
Обнаружение амплифицированного продукта с помощью гибридизации с зондом
Амплифицированные продукты выявляли с использованием реагентов и протоколов из набора AMPLICOR HIV-1 MONITOR Test. Оцениваемую начальную концентрацию мишени вычисляли в соответствии с настоящим описанием.
Результаты
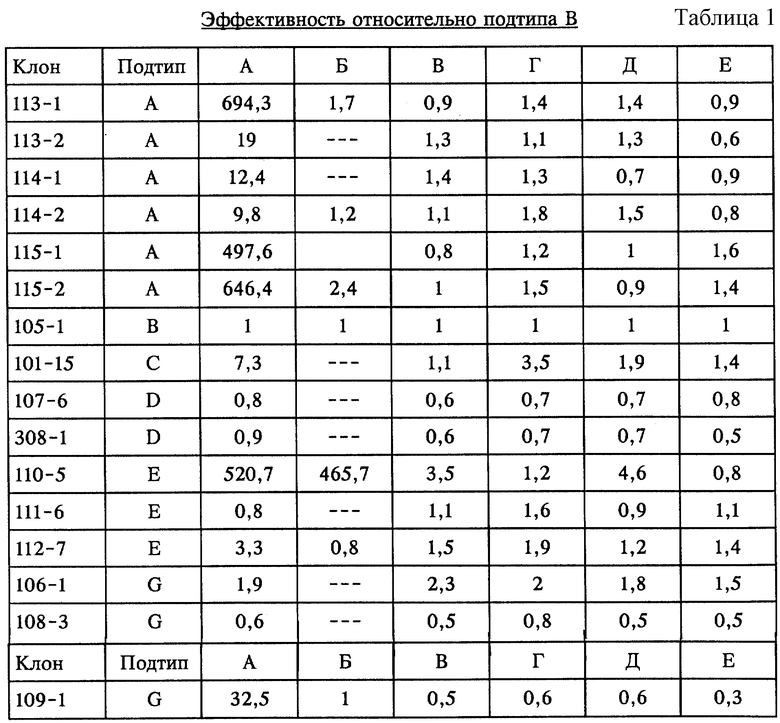
При использовании количественного метода AMPLICOR HIV-1 MONITOR Test начальную концентрацию мишени оценивают путем сравнения сигнала, генерированного после амплификации мишени, с сигналом, генерированным после амплификации КС известной концентрации. Поскольку известная концентрация КС представляет собой концентрацию перед амплификацией, а сравниваемые сигналы представляют собой сигналы, полученные после амплификации, то изменения в относительной эффективности амплификации должны оказывать влияние на оценку начальной концентрации неизвестной мишени. При количественной оценке с помощью AMPLICOR HIV-1 MONITOR Test используют калибровку, основанную на эффективности амплификации подтипа В ВИЧ-1. Известно, что другие подтипы ВИЧ-1 могут амплифицироваться с более низкой эффективностью и, следовательно, оцениваемая концентрация мишени может быть занижена по сравнению с истинной.
В настоящем эксперименте к каждой реакционной смеси добавляли РНК-мишень в известной концентрации. Таким образом, относительная эффективность амплификации для каждого изолята может быть определена путем сравнения оцениваемых концентраций мишени. Поскольку при количественной оценке в наборе AMPLICOR HIV-1 MONITOR Test используют калибровку, основанную на эффективности амплификации подтипа В ВИЧ-1, в качестве эталона использовали оцениваемую концентрацию мишени подтипа В (клон 105-1). Для каждого изолята оцениваемую концентрацию мишени подтипа В (клон 105-1) соотносили с оцениваемой концентрацией мишени для изолята, получая меру относительной эффективности амплификации. Эти относительные эффективности амплификации приведены в табл. 1. Символ "---" обозначает, что реакцию не проводили.
Результаты показывают, что при использовании набора AMPLICOR HIV-1 MONITOR Test (реакция А) различные изоляты ВИЧ-1 амплифицировались с существенно различной эффективностью. Некоторые из изолятов, включая изолят подтипа Е, клон 110-5, амплифицировались с эффективностью по крайней мере приблизительно в 500 раз более низкой, чем эффективность амплификации клона 105-1 подтипа В.
Хотя не все изоляты были исследованы, применение пары праймеров SK145 (SEQ ID NO: 1) и SK151 (SEQ ID NO: 7) (реакция Б) позволило существенно выровнять эффективность амплификации. Однако клон 110-5 подтипа Е по-прежнему амплифицировался с эффективностью по крайней мере приблизительно в 500 раз более низкой, чем эффективность амплификации клона 105-1 подтипа В.
Применение праймеров SK145 (SEQ ID NO: 1) и SKCC1 (SEQ ID NO: 3) (реакция В) позволило амплифицировать все изоляты, включая изолят подтипа Е, клон 110-5, с эффективностью приблизительно в 3 раза меньшей, чем эффективность амплификации клона 105-1 подтипа В. Добавление праймера SK145M2 (SEQ ID NO: 2) (реакция Г) еще более улучшило эффективность амплификации изолята 110-5, сделав ее практически равной таковой для эталонного штамма подтипа В.
Аналогично этому применение праймеров SK145 (SEQ ID NO: 1) и SKCC3 (SEQ ID NO: 4) (реакция Д) позволило амплифицировать все изоляты, включая изолят подтипа Е, клон 110-5, с эффективностью приблизительно в 5 раз меньшей, чем эффективность амплификации клона 105-1 подтипа В. Добавление праймера SK145M2 (SEQ ID NO: 2) (реакция Е) еще более улучшило эффективность амплификации изолята 110-5, сделав ее практически равной таковой для эталонного штамма подтипа В.
Пример 3
Количественная оценка ВИЧ-1 в клинических образцах
В этом примере 30 клинических образцов, полученных от пациентов из Сенегала с положительной серологической реакцией, анализировали на присутствие РНК ВИЧ-1. Подтипы, присутствующие в клинических образцах, не определяли. Однако подтипы А и D являются обычными для этого региона Африки, поэтому следовало ожидать, что некоторые из этих клинических образцов либо не будут амплифицироваться вовсе, либо будут амплифицироваться неэффективно при использовании AMPLICOR HIV-1 MONITOR Test.
Образцы готовили следующим образом. Образцы плазмы (80-250 мкл) объединяли в конической центрифужной пробирке объемом 1,5 мл с 20 мкл 0,25% (мас. /об.) красных полистироловых микросфер типа Estapor (фирма Bangs Laboratories, Inc., Carmel, IN) и центрифугировали в течение 1 ч при 25300xg при 4oС. Супернатант отсасывали и дебрис ресуспендировали в 250 мкл лизирующего буфера (50 мкл лизирующего буфера содержит 6,7 мкл 30 ед/мл RNasin (фирма Promega, Madison, WI); 0,67 мкл 100 мМ дитиотреитола (ДТТ); 2 мкл 10%-ного NP40 (фирма Pierce, Rockford, IL); 0,25 мкл 4 мг/мл poly-rA РНК; и 40,4 мкл обработанной Depc Н2О). Дебрисы инкубировали при комнатной температуре в течение по крайней мере 15 мин и интенсивно перемешивали для обеспечения полного смешения.
Амплификации осуществляли в реакционных смесях объемом 100 мкл, содержащих 50 мкл раствора вирусного лизата и 50 мкл 2-кратной смеси амплифицированных реагентов, составленной таким образом, чтобы конечная концентрация реагента соответствовала указанной выше. В каждую реакционную смесь в виде части смеси реагентов добавляли приблизительно 100 копий соответствующего КС. Обнаружение амплифицированного продукта осуществляли с использованием реагентов и протоколов AMPLICOR HIV-1 MONITOR Test, как описано выше.
Амплификации каждого образца проводили с комбинациями праймеров, представленных в табл. В.
Результаты, выраженные в виде количества копий ВИЧ-1-матрицы на 1 мл плазмы, обобщены в табл. 2.
Результаты свидетельствуют о том, что комбинации праймеров Б и В по настоящему изобретению позволяют амплифицировать большее количество клинических образцов. Комбинации праймеров Б и В позволяют амплифицировать все, кроме одного, из 30 образцов. В противоположность этому при использовании AMPLICOR HIV-1 MONITOR Test не удалось амплифицировать 6 из 29 образцов. Амплификация образца MIH 053 с использованием AMPLICOR HIV-1 MONITOR Test привела к получению сильного сигнала от мишени, но не удалось генерировать сигнал КС. Поэтому не удалось оценить количественно этот образец и он обозначен символом "+" в табл. 2.
Кроме того, для значительного количества образцов количество копий, выявленных с использованием как комбинации праймеров Б, так и В, было значительно выше, чем таковое, выявленное с использованием AMPLICOR HIV-1 MONITOR Test. Учитывая вариабельность эффективности амплификации, которая показана выше в примере 2, можно предположить, что более низкие выявленные концентрации матрицы, полученные с использованием AMPLICOR HIV-1 MONITOR Test, вероятно являются результатом существенно более низкой эффективности амплификации.
Вирусная РНК не была обнаружена в образце MIN 067. Однако неизвестно, является ли это следствием невыявленной вариабельности последовательности-мишени, что служит помехой для гибридизации праймера или зонда, либо это обусловлено какой-либо иной причиной.







Изобретение относится к области молекулярной биологии и может быть использовано для обнаружения вируса иммунодефицита человека типа 1 (ВИЧ-1). Для диагностики ВИЧ-1 используют способ амплификации, предусматривающий использование улучшенных олигонуклеотидных праймеров SKCC1 и SKCC3, а также их сочетание с праймером SK145, на основе данных праймеров созданы наборы, один из которых дополнительно к парам праймеров содержит праймер SK145M2, а другой - один праймер, пару праймеров или вышеописанный набор праймеров. Последовательности нуклеотидов перечисленных праймеров приведены в тексте описания. Предлагаемые праймеры способны эффективно амплифицировать новые, недавно обнаруженные изоляты группы М ВИЧ-1, а также все известные изоляты группы М ВИЧ-1 с приблизительно одинаковой эффективностью. 5 с. и 4 з.п. ф-лы, 4 табл.
| WO 9514109, 26.05.1995 | |||
| WO 9403635, 17.02.1994 | |||
| Способ амплификации фрагмента ДНК неизвестной последовательности, расположенного на некотором расстоянии от фрагмента ДНК известной последовательности | 1990 |
|
SU1792972A1 |
| US 5328825, 12.07.1994 | |||
| US 5196305, 23.03.1993 | |||
| US 5384242, 24.01.1995. | |||
Авторы
Даты
2002-07-27—Публикация
1998-01-16—Подача