Изобретение относится к области органической химии и медицины, конкретно к барбитуровым кислотам и их производным и предназначено для использования в качестве противовирусных средств по отношению к вирусам герпеса и средств, обладающих антихламидийной и иммуномодулирующей активностью.
Многие производные пиримидина являются биологически активными веществами. Спектр биологической активности соединений этого класса весьма широк Производные пиримидина являются нуклеиновыми основаниями (урацил, тимин, цитозин), витаминами (тиамин, фосфотиамин), коферментами (кокарбоксилаза), используются как фармацевтические препараты, обладающие снотворным, противосудорожным (барбитураты, гексамидин, бензонал), диуретическим (меркузал), противовоспалительным (пентоксил, метилурацил), антитиреоидным (метилтиоурацил) действием, являются синтетическими аналогами витаминов (бефотиамин), анаболическим (оротовая кислота), противовоспалительным и антибактериальным (сульфазин, сульфадимезин, сульфамонометоксин, сульфадиметоксин, бактрим, салазодиметоксин), антималярийным (хлоридин), противораковым (допан, фосфемид, этимидин, фторурацил, фторафур, цитарабин) действием [1, 2].
В последние десятилетия значительный интерес проявляется к системам, в которых пиримидиновый цикл сконденсирован с другими гетероциклами. Зачастую такие гетероциклические системы являются аналогами природных биологически активных веществ. К ним относятся пурины, входящие в состав природных и синтетических биологически активных веществ: нуклеиновых кислот (аденин, гуанин), АТФ, препаратов, возбуждающих центральную нервную систему, действующие на сердечно-сосудистую систему (кофеин, теобромин, теофиллин, нигексин, дипрофиллин, ксантинола никотинат), применяемые для подавления тканевой несовместимости при пересадке органов (азатиоприн) (цитостатический и иммунодепрессивный эффект), обладающие анаболическим (инозин), антилейкемическим (меркаптопурин) действием, пиразоло[3,4-d]пиримидины, используемые для лечения заболеваний, сопровождающихся гиперурикемией (аллопуринол), птеридины, используемые как диуретики (триамтрен), витамины (рибофлавин, фолиевая кислота), противораковые (метотрексат) препараты, пиримидо[5,4-d]пиримидины, обладающие сосудорасширяющим действием (дипиридамол) [1, 2].
Данные о биологической активности ряда производных 5-илиденбарбитуровых кислот суммированы в обзоре [3] , в котором отмечены антиконвульсантное, антимикробное, спазмолитическое, жаропонижающее, противоопухолевое действие этих веществ Материал этого обзора можно дополнить некоторыми новыми данными о пестицидной, инсектицидной [4], жаропонижающей [5,6], анальгезирующей [7], противовирусной [8-10] и фунгицидной [11-13] активностях, показанных у соединений этой группы химических веществ.
Таким образом, имеющиеся в литературе сведения о биологической активности 5-замещенных барбитуровых кислот и конденсированных систем, содержащих фрагмент пиримидиндиона, обладают пестицидным, инсектицидным, фунгицидным действием, противовоспалительной, противоопухолевой, противовирусной, антимикробной, антиаллергической активностью, действием на сердечно-сосудистую и иммуннную систему. Однако эффективность большинства уже известных веществ недостаточно высока, многие из них токсичны и обладают побочными эффектами. Кроме того, большая часть микробов, вызывающих заболевания человека и домашних животных, устойчивы к основным из существующих препаратов. Указанная устойчивость не позволяет эффективно справляться с такими опасными для жизни людей инфекциями, как туберкулез, герпес, хламидиозы [14-16]. Хорошо известна и высокая устойчивость опухолевых клеток к существующим противоопухолевым препаратам [17].
В литературе имеется лишь несколько примеров конденсации барбитуровой и 2-тиобарбитуровой кислот с карбонильными соединениями в соотношении 2 : 1 [18-22]. Так, барбитутуровая кислота с изатином и 1-метилизатином реагирует, образуя бисбарбитурилизатин [18], 2-тиобарбитуровая кислота при нагревании с бензальдегидом в анилине превращается в дианилиниевую соль 5,5'-бензилиденбис(2-тиобарбитуровой) кислоты [19], при нагревании 5-салицилиденбарбитуровой кислоты в этаноле она превращается, по данным авторов работ [19-22], в 5,5'-салицилиденбис(2-тиобарбитуровую) кислоту. Однако в работах [23,24] было показано, что барбитуровые и 2-тиобарбитуровые кислоты дают с салициловыми альдегидами 5-(4,6-диоксо-5-пиримидинил)хромено[2,3-d]пиримидины. Описание синтеза 5,5'-или-денбисбарбитуровых или 5,5'-илиденбис(2-тиобарбитуровых) кислот из алифатических альдегидов и кетонов [6,25], а также 5,5'-бензилиденбисбарбитуровой кислоты [26] является, по-видимому, ошибочным.
Известна также 5,5'-салицилиденбис(2-тиобарбитуровая) кислота. Ее химическое строение и свойства подробно описаны в [27]. Она малотоксична и продлевает сон, вызванный барбитуратами, но не другими симпатомиметиками; кроме того, она проявляет вазопрессорный эффект. Другой биологической активности у нее не обнаружено. Последнее соединение - наиболее близкое к заявляемым по своей химической природе. Поэтому оно выбрано в качестве прототипа изобретения.
Приведенный выше материал свидетельствует о перспективности поиска и создания новых эффективных биологически активных веществ путем конденсации барбитуровых кислот с карбонильными соединениями, приводящей, в частности, к 5,5'-арилиденбис(2-тиобарбитуровым) кислотам или солям 5,5'-арилиденбисбарбитуровых и 5,5'-арилиденбис(2-тиобарбитуровых) кислот.
Задача изобретения
Задачей изобретения является создание новой группы химических веществ, обладающих противомикробной, противовирусной, иммуномодулирующей и противоопухолевой активностями.
Сущность изобретения
Поставленная задача решается синтезом новых веществ - 5,5'-арилиденбис(2-тиобарбитуровых) кислот или солей 5,5'-арилиденбисбарбитуровых и 5 5'-арилиденбис(2-тиобарбитуровых) кислот общей формулы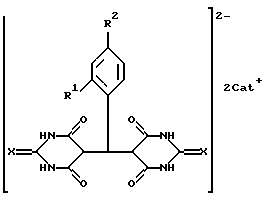
где: Х выбран из группы КИСЛОРОД, СЕРА,
R1 выбран из группы ВОДОРОД, НИТРОГРУППА. АЛКОКСИГРУППА,
R2 выбран из группы ВОДОРОД, НИТРОГРУППА, ГИДРОКСИГРУППА, АЛКОКСИГРУППА, ГАЛОГЕН,
Cat+ выбран из группы ПРОТОН, ПИРИДИНИЙ- или 2-ГИДРОКСИЭТИЛАММОНИЙ - КАТИОН
При этом лучшие известные заявителю варианты заявляемых веществ - при:
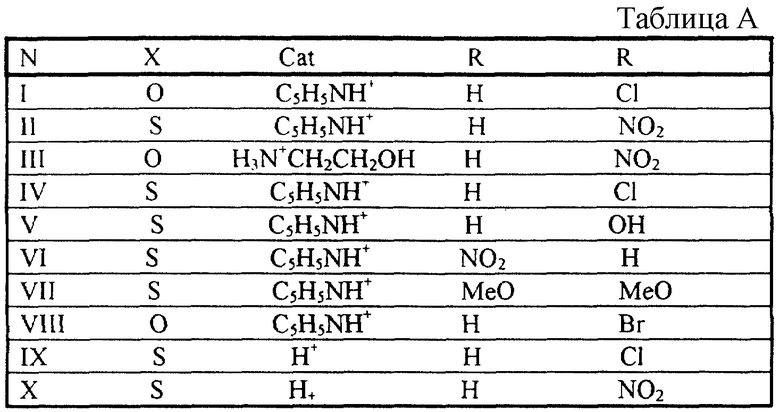
Х=O (кислород), Cat+ - пиридиний, R1=H (водород), R2=C1 (галоген) (I),
Х= O (кислород), Cat+ - пиридиний, R1=H (водород), R2=NO2(нитpoгpyппa) (II),
Х= O (кислород), Cat+ - Н3N+СН2СН2ОН (2-гидроксиэтиламмоний ), R1=H (водород), R2=NO2 (нитрогруппа) (III);
X=S (сера), Cat+ - пиридиний, R1=H (водород), R2=Cl (галоген) (IV);
X=S(cepa), Cat+ - пиридиний, R1=H(водород), R2=OH (гидроксигруппа) (V),
X=S (сера), Cat+ - пиридиний, R1=NO2 (нитрогруппа), R2=H (водород) (VI),
X=S (сера), Cat+ - пиридиний, R1=R2=MeO (алкоксигруппа) (VII);
Х= O (кислород), Cat+ - пиридиний, R1= H (водород), R2=Br (галоген) (VIII);
Х= O (кислород), Cat+ - H+ (протон), R1=H (водород), R2=Cl (галоген) (IX);
Х=O (кислород), Cat+ - H+ (протон), R1=H (водород), R2=NO2 (нитрогруппа) (X).
Следует отметить, что использование остальных представителей алкоксигруппы и галогенов не ведет к принципиальным отличиям в процессах синтеза и биологических свойств заявляемых веществ, т.е. существенное значение имеют не конкретные элементы, а их принадлежность к указанным в общей формуле химическим группам.
Предложенные лучшие варианты для наглядности представлены в таблице А.
Приведенная выше общая формула и все перечисленные конкретные варианты соединений являются новыми, они неизвестны заявителям из доступных источников информации.
Раскрытие изобретения
Сущность изобретения поясняется приведенными ниже восемью примерами синтеза заявляемых веществ, тремя таблицами физико-химических характеристик полученных веществ и результатами пяти серий экспериментов по определению сравнительных биологических свойств (с соответствующими таблицами количественных исследований), где
Пример 1 - вариант синтеза пиридиниевых солей 5,5'-арилиденбисбарбитуровых и 5,5'-арилиденбис(2-тиобарбитуровых) кислот (I, II, IV-VIII).
Пример 2 - вариант синтеза пиридиниевых солей 5,5'-арилиденбисбарбитуровых и 5,5'-арилиденбис(2-тиобарбитуровых) кислот (I, II, IV-VIII).
Пример 3 - вариант синтеза 2-гидроксиэтиламмониевой соли 5,5'-(n-нитробензилиден) бисбарбитуровой кислоты (III).
Пример 4 - вариант синтеза 5,5'-арилиденбис(2-тиобарбитуровых) кислот (IХ, Х).
Пример 5 - лучший известный авторам вариант синтеза пиридиниевой соли 5,5'-(n-бромбензилиден) бисбарбитуровой кислоты (VIII).
Пример 6 - лучший известный авторам вариант синтеза пиридиниевой соли 5,5'-(n-хлорбензилиден) бис(2-тиобарбитуровой) кислоты (IV).
Пример 7 - лучший известный авторам вариант синтеза 2-гидроксиэтиламмониевой соли 5,5'-(n-нитробензилиден)бисбарбитуровой кислоты (III).
Пример 8 - лучший известный авторам вариант синтеза 5,5'-(n-нитробензилиден) бис(2-тиобарбитуровой) кислоты (X).
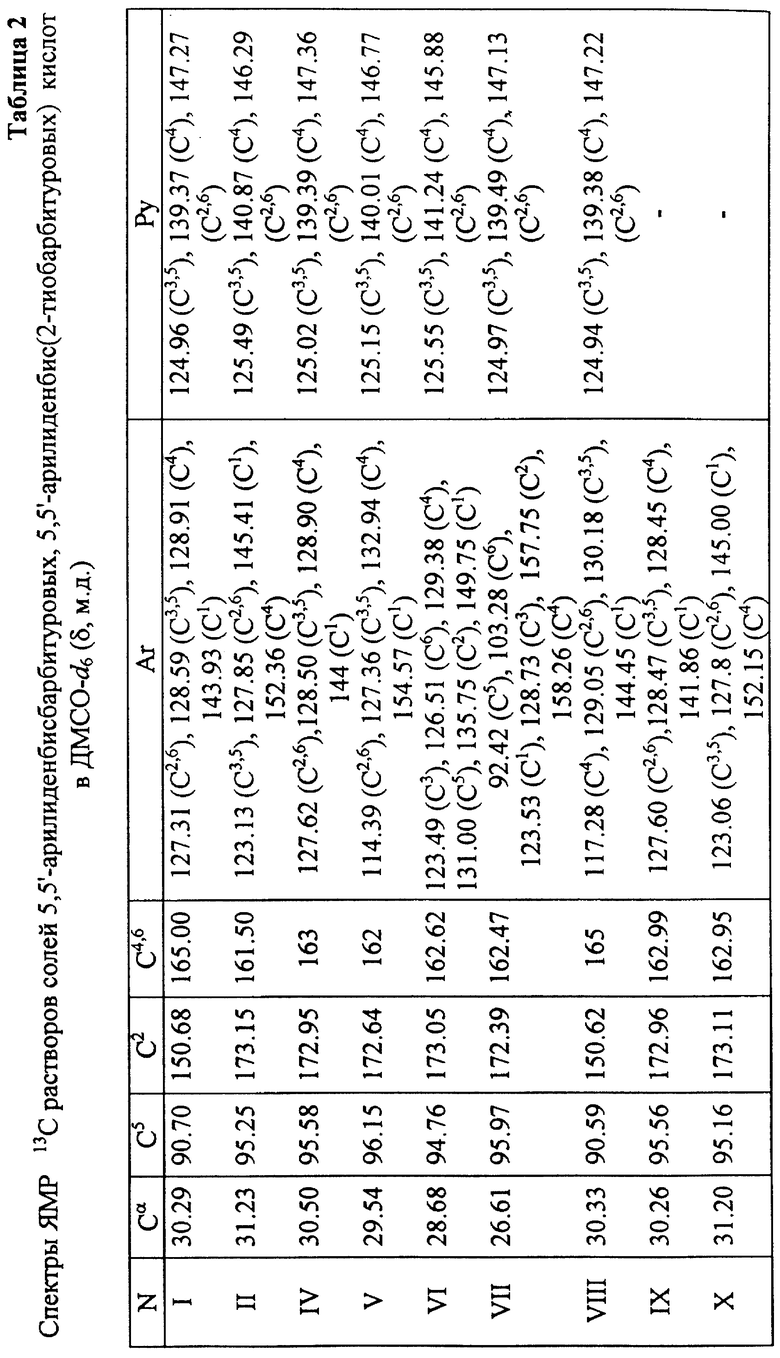
Таблица 1 - Спектры ПМР растворов полученных веществ в ДМСО-d6 (δ, м.д.)
Таблица 2 - Спектры ЯМР 13С растворов солей 5,5'-арилиденбисбарбитуровых, 5,5'-арилиденбис(2-тиобарбитуровых) кислот в ДМСО-d6 (δ, м.д.).
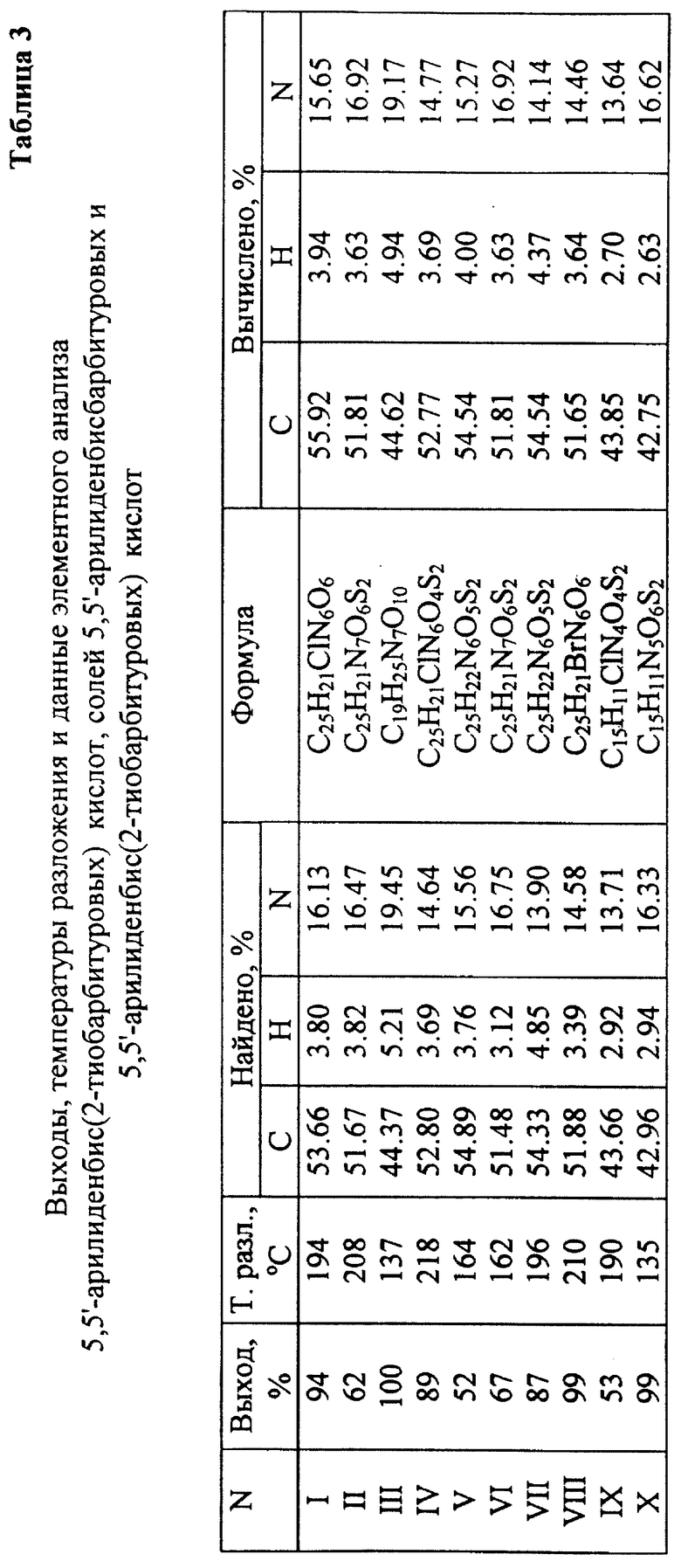
Таблица 3 - Выходы, температуры разложения и данные элементного анализа 5,5'-арилиденбис(2-тиобарбитуровых) кислот, солей 5,5'-арилиденбисбарбитуровых и 5,5'-арилиденбис(2-иобарбитуровых) кислот.
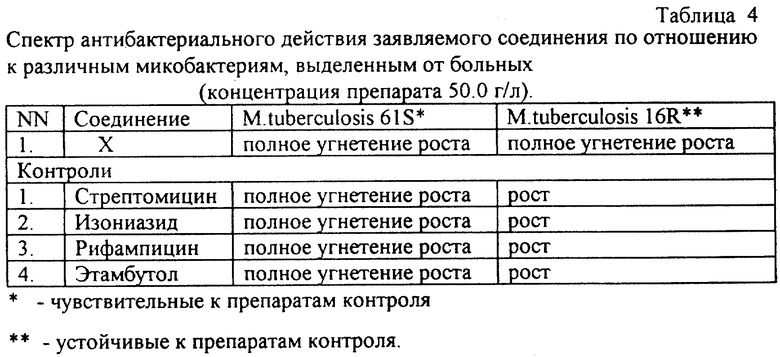
Эксперимент 1 - Определение действия соединений на патогенные микобактерии.
Эксперимент 2 - Определение острой токсичности заявляемых соединений.
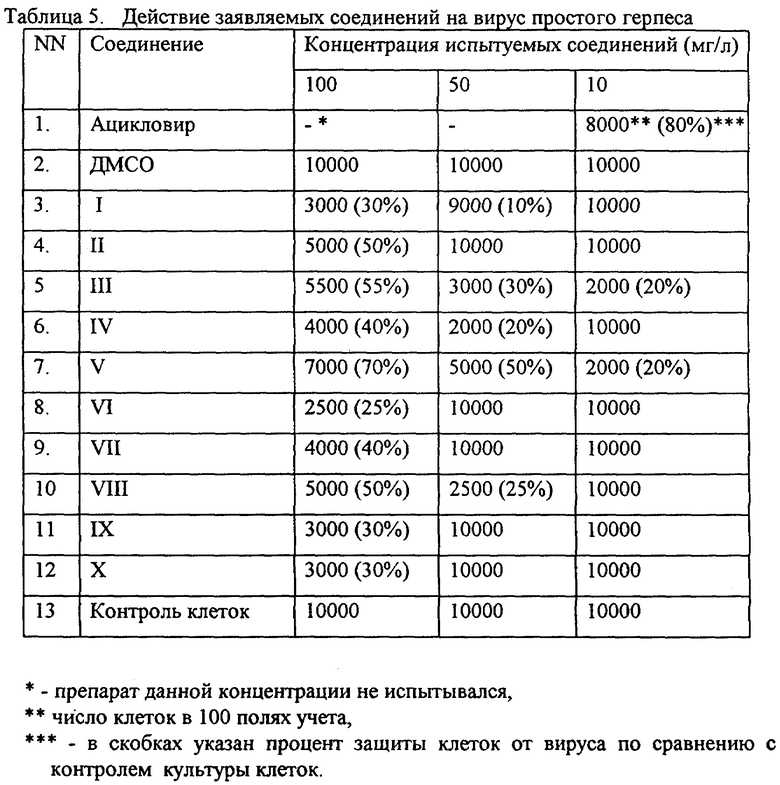
Эксперимент 3 - Определение действия заявляемых соединений на вирус герпеса.
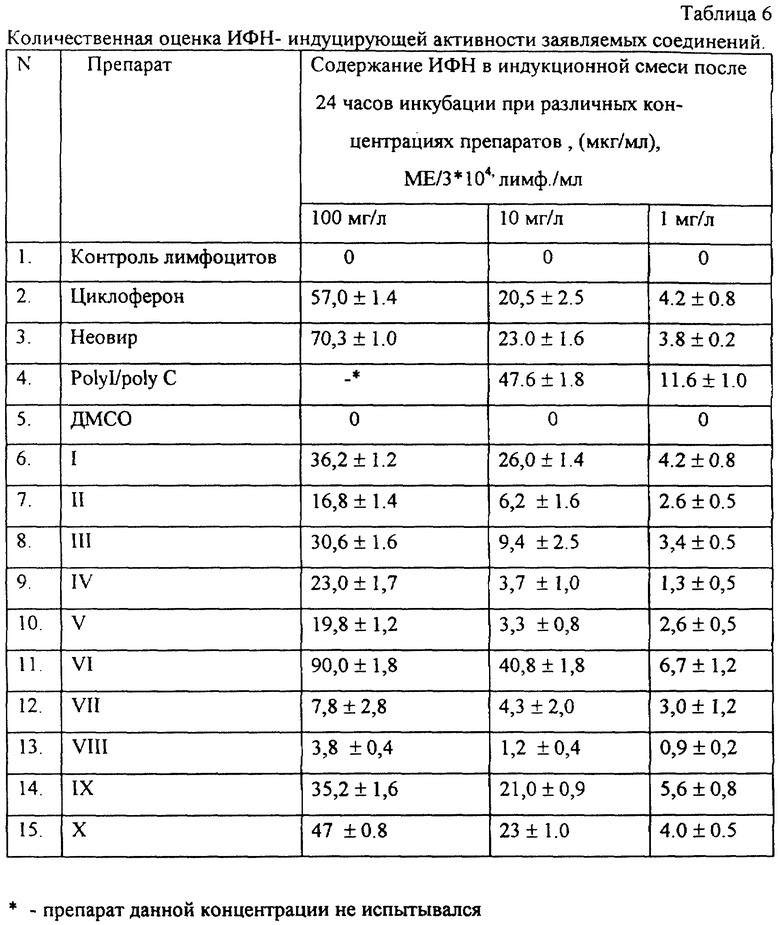
Эксперимент 4 - Определение интерферониндуцирующей активности заявляемых соединений.
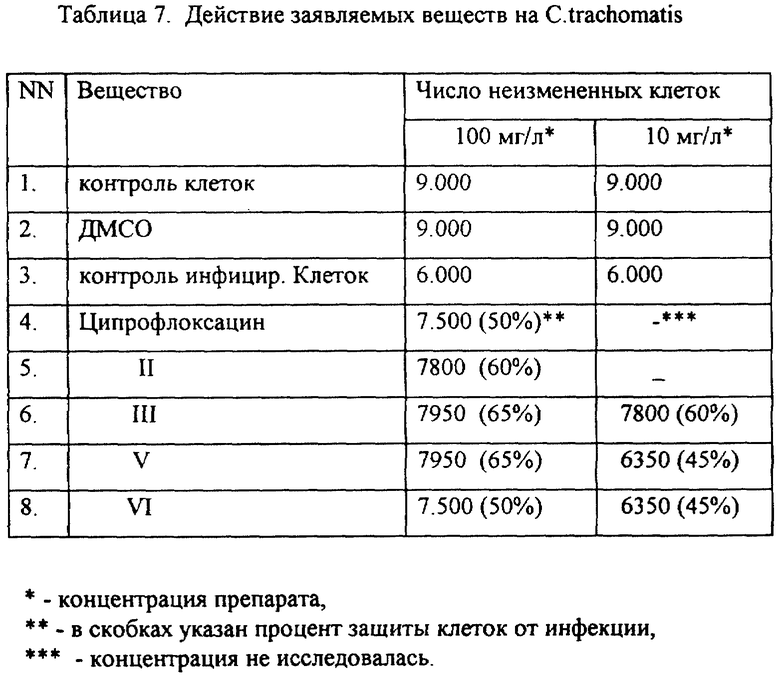
Эксперимент 5 - Определение действия заявляемых соединений на Chlamydia trachomatis.
Пример 1. Вариант синтеза пиридиниевых солей 5,5'-арилиденбисбарбитуровых и 5,5'-арилиденбис(2-тиобарбитуровых) кислот (I, II, IV-VIII).
Смесь 4.6 ммоль 5-арилиденбарбитуровой кислоты и 46 ммоль барбитуровой кислоты в 10-15 мл пиридина кипятят с обратным холодильником в течение 1-2 ч. После охлаждения реакционной массы осадок отфильтровывают, промывают ацетоном и сушат при 55-60oС при остаточном давлении 30 мм рт.ст. Для выделения тиопроизводных из реакционной массы к ней добавляют 10-20 мл диоксана или воды, выпавший осадок отфильтровывают, промывают этанолом и сушат.
Пример 2. Вариант синтеза пиридиниевых солей 5,5'-арилиденбисбарбитуровых и 5,5'-арилиденбис(2-тиобарбитуровых) кислот (I, II, IV-VIII).
Смесь 3 ммоль барбитуровой кислоты и 1.5 ммоль соответствующего альдегида в 10-15 мл пиридина кипятят с обратным холодильником в течение 1-2 ч. После охлаждения реакционной массы осадок отфильтровывают, промывают ацетоном и сушат при 55-60oС при остаточном давлении 30 мм рт.ст. Для выделения тиопроизводных из реакционной массы к ней добавляют 10-20 мл диоксана или воды, выпавший осадок отфильтровывают, промывают этанолом и сушат. Для проведения реакций используют 3 ммоля барбитуровой кислоты и 1,5 ммоля соответствующего альдегида. Синтез и выделение продуктов проводят аналогично предыдущей методике.
Пример 3. Вариант синтеза 2-гидроксиэтиламмониевой соли 5,5'-(n-нитробензилиден)бисбарбитуровой кислоты (III).
2 г пиридиниевой соли 5,5'-(n-нитробензилиден)бисбарбитуровой кислоты добавляют к раствору 0,4 г 2-аминоэтанола в 50 мл этанола. Смесь перемешивают при 20oС в течение 10 мин. Выпавший ярко-красный осадок отфильтровывают, промывают этанолом 3х40 мл, сушат при 50oС в вакууме. Выход количественный.
Пример 4. Вариант синтеза 5,5'-арилиденбис(2-тиобарбитуровых) кислот (IХ, Х).
К смеси 1 г 2-тиобарбитуровой кислоты и 10 мл этанола добавляют раствор 0.5 г бензальдегида в 10 мл этанола. После перемешивания реакционной массы при 20oС в течение 20-30 мин осадок отфильтровывают и сушат. Очистку можно проводить нагреванием осадка в ацетоне, в котором 5,5'-арилиденбис(2-тиобарбитуровые) кислоты не растворяются.
Примеры лучших известных авторам вариантов синтеза заявляемых веществ формулы (I)
Пример 5. Лучший известный авторам вариант синтеза пиридиниевой соли 5,5'-(n-бромбензилиден)бисбарбитуровой кислоты (VIII).
Смесь 4.6 ммоль 5-n-бромбензилиденбарбитуровой кислоты и 4.6 ммоль барбитуровой кислоты в 10-15 мл пиридина кипятят с обратным холодильником в течение 1-2 ч. После охлаждения реакционной массы осадок отфильтровывают, промывают ацетоном и сушат при 55-60oС при остаточном давлении 30 мм рт. ст.
Пример 6. Лучший известный авторам вариант синтеза пиридиниевой соли 5,5'-(n-хлорбензилиден)бис(2-тиобарбитуровой) кислоты (IV).
Смесь 3 ммоль 2-тиобарбитуровой кислоты и 1.5 ммоль n-хлорбензальдегида в 10-15 мл пиридина кипятят с обратным холодильником в течение 1-2 ч. После охлаждения реакционной массы к ней добавляют 10-20 мл диоксана или воды, выпавший осадок отфильтровывают, промывают этанолом и сушат при 55-60oС.
Пример 7. Лучший известный авторам пример синтеза 2-гидроксиэтиламмониевой соли 5,5'-(n-нитробензилиден)-бисбарбитуровой кислоты (III).
2 г пиридиниевой соли 5,5'-(n-нитробензилиден)бисбарбитуровой кислоты добавляют к раствору 0.4 г 2-аминоэтанола в 50 мл этанола. Смесь перемешивают при 20oС в течение 10 мин. Выпавший ярко-красный осадок отфильтровывают, промывают этанолом 3х40 мл, сушат при 50oС в вакууме. Выход количественный.
Пример 8. Лучший известный авторам пример синтеза 5,5'-(n-нитробензилиден)бис(2-тио-барбитуровой) кислоты (X).
К смеси 1 г 2-тиобарбитуровой кислоты и 10 мл этанола добавляют раствор 0.5 г бензальдегида в 10 мл этанола. После перемешивания реакционной массы при 20oС в течение 20-30 мин осадок отфильтровывают и сушат. Очистку можно проводить нагреванием осадка в ацетоне, в котором 5,5'-арилиденбис(2-тиобарбитуровые) кислоты не растворяются.
Экспериментальная проверка биологической активности заявляемых соединений
Эксперимент 1. Определение действия соединений на патогенные микобактерии
В эксперименте использованы штаммы, выделенные от больных в клиниках С. Петербурга (Россия) в 1996 году M.tuberculosis 61 (S), чувствительный к действию известных антимикробных препаратов (аминогликозидов, рифампицина, изониазида, этамбутола), M.tuberculosis 16®, устойчивый к основным антимикобактериальным препаратам; исследование проводили на среде Левенштейна-Йенсена. Препараты, растворенные в (ДМСО), добавляли в отдельные пробирки со средой в конечной концентрации 10 мг/л. После засева тест-штаммов на поверхность среды пробирки инкубировали в течение 30 суток. В контроле использовали ДМСО в соответствующих концентрациях и стандартные препараты, используемые для лечения туберкулеза и микобактериозов (таблица 4).
Полученные данные свидетельствуют, что указанные в таблице заявляемые соединения угнетают рост всех использованных в опыте видов и штаммов микобактерий. Таким образом, in vitro они действуют и на штамм микобактерий, выделенный от больных, устойчивый к основным препаратам, используемым для лечения туберкулеза. Остальные заявляемые соединения обладают в аналогичных условиях меньшей антимикобактериальной активностью.
Эксперимент 2. Определение острой токсичности заявляемых веществ
Определение острой токсичности проведено на беспородных белых мышах массой 18-20 г. Заявляемые соединения вводили в различных концентрациях: 1500, 700, 500, 100, 20 и 5 мг/кг. Для исследования каждой концентрации соединения использовали по 5 животных Препарат вводили один раз в сутки через рот или внутрибрюшинно. Период наблюдения составил 14 дней. На 1, 8 и 15 день проводили взвешивание животных в каждой группе. Для контроля использовали животных, которым вводили эмульсию, приготовленную без испытуемых соединений. Для макроскопического исследования внутренних органов проводили вскрытие всех животных, умерших в ходе опыта и выживших к концу эксперимента. В ходе проведенных исследований не наблюдалось: потери веса, изменения в поведении и внешнем виде, а также гибели животных. По результатам вскрытия макроскопической патологии со стороны внутренних органов животных как в опытной, так и в контрольной группах, обнаружено не было. Острая токсичность (LD 50) заявляемого вещества - соединения Х - 1000 мг/кг.
Полученные результаты свидетельствуют, что при приеме через рот или внутрибрюшинно некоторые заявляемые соединения в концентрации 1000 мг/кг не обладают острой токсичностью для мышей.
Эксперимент 3. Определение действия заявляемых соединений на вирус герпеса
Антивирусная активность определялась по отношению к вирусу герпеса I типа (ВПГ-I /Ленинград/248/88) по общепринятому методу (21).Вирусы выращивали на перевиваемой культуре клеток Vero, полученной из банка клеточных культур Института цитологии Российской Академии Наук.
Схема постановки опыта
К клеткам, выращенным на среде RPMI-1640 с 10% телячей сыворотки и помещенным в лунки 96 луночного плато, добавляли вирус в конечной концентрации 10 частиц/мл и заявляемые соединения, растворенные в ДМСО, в конечной концентрации 100, 10 и 1 мг/л. Для каждой испытанной концентрации препарата использовали 5 независимых лунок. Плато инкубировали в течение 60 мин при 38oС в СО2-инкубаторе. После инкубации вирус удаляли и снова вносили свежую среду, содержащую заявляемые соединения в использованных концентрациях. Результаты оценивали по наличию цитопатогенного действия вируса на клетки через 36 часов инкубации при 38oС в СО2-инкубаторе.
В опыте были использованы следующие контроли:
1. Контроль культуры клеток (способность к нормальному росту).
2. Контроль вируса (оценка способности к репродукции).
3. Контроль антивирусной активности противовирусного препарата - ацикловира.
4. Контроль соединений (токсичность соединений).
5. Контроль растворителя (ДМСО) на токсичность.
Для оценки цитопатического действия вируса подсчитывали число неизмененных клеток в 100 полях, образованных специальной сеткой окуляра инвертированного микроскопа. Полученные результаты представлены в таблице 5.
Полученные результаты указывают, что все заявляемые соединения обладают антигерпетической активностью, сравнимой с таковой у стандартного препарата ацикловира.
Эксперимент 4. Определение интерферониндуцирующей активности заявляемых соединений
Индукцию синтеза интерферонов заявляемыми препаратами проводили на первичной культуре человеческих лимфоцитов (именно данные клетки в организме человека являются основными продуцентами интерферонов). Для получения культуры лимфоцитов использовали свежую (12 часов после забора) кровь здоровых доноров (не второй группы). Для выделения лимфоцитов гепаринизированная кровь, полученная от здорового донора, подвергалась центрифугированию в градиенте плотности фиколл-верографин 1.71 г/см3 для выделения фракции иммунокомпетентных клеток. Указанная фракция отбиралась и разводилась питательной средой RPMI-1640, содержащей 5% эмбриональной сыворотки крупного рогатого скота, 0.3 мг/мл L-глутамина, 100 ед./мл пенициллина, 50 мг/мл стрептомицина. Концентрацию лимфоцитов учитывали после окрашивания метиленовым синим и подсчета количества клеток в камере Горяева. Исходные растворы заявляемых веществ разводили питательной средой RPMI-1640 так, чтобы конечные концентрации веществ составляли ряд: 100 мг/л, 10 мг/л, 1 мг/л после внесения суспензии лимфоцитов. Конечная концентрация лимфоцитов в индукционной смеси составила 3х106 клеток/мл.
Параллельно с опытными пробами проставлялись следующие контроли:
1) контроль спонтанной продукции интерферонов (ИФН) лимфоцитами;
2) контроль протекания процесса при воздействии стандартизированного индуктора ИФН N-метил-N-(α-D-глюкопиранозил)аммоний-10-метилен-карбоксилат акридона (циклоферон);
3) контроль протекания процесса при воздействии стандартизированного индуктора ИФН - Неовира (натрия 10-метиленкарбоксилат-9-акридон) с соответствующим содержанием ДМСО в опытных пробах;
4) контроль спонтанной продукции интерферонов в присутствии ДМСО в количестве, соответствующем испытуемым образцам.
Контрольные и опытные образцы инкубировали 24 часа при 37oС. После инкубации пробы центрифугировались при 2000 g для осаждения клеточных элементов и из проб отбирался ИФН-содержащий супернатант, который анализировали на количественное содержание ИФН. Осадок клеток ресуспендировали в прежнем объеме питательной среды, окрашивали витальным красителем - трипановым синим и подсчитывали число клеток в камере Горяева (как описано выше) для определения цитотоксического действия препаратов.
Количественное определение содержания ИФН в контрольных и опытных образцах производили с использованием иммуноферментной тест-системы на ИФН-а производства ТОО "Протеиновый контур" ProCon IF2 plus. Для определения количества интерферона в пробе использовали твердофазный иммуноферментный метод с использованием пероксидазы хрена в качестве индикаторного фермента. Активность связанной пероксидазы измеряли с использованием автоматического фотометра для микропланшетов с микропроцессором при длине волны 450 нм. Для подсчета результатов параллельно определяли активность ИФН у стандартных растворов ИФН, содержащих известное количество препарата. На основании полученных результатов строилась калибровочная кривая, позволяющая при использовании микропроцессора автоматического фотометра получать данные, выраженные в Международных единицах активности (ME). Результаты анализа выражаются в ME активности ИФН на мл в данной индукционной системе, содержащей 3•106 лимфоцитов/мл. Каждая опытная и контрольная точка исследовалась в 4-х параллелях.
Контроли иммуноферментной реакции:
1. Контроль ДМСО с питательной средой.
2. Контроль компонентов системы (согласно инструкции). Все результаты учитывались только при соответствии контролей паспортным данным системы.
Полученные результаты подвергались статистическому анализу по t-критерию и расчетам доверительного интервала при р=0.05. Произведен анализ сходимости результатов в параллельных опытах.
Проведенные исследования установили, что фактически все заявляемые вещества обладают способностью индуцировать синтез ИФН, что указывает на их эффективность против вирусных инфекций и противоопухолевую активность (Таблица 6).
Эксперимент 5. Определение действия заявляемых соединений на Chlamydia trachomatis
Антимикробную, активность заявляемых соединений определяли по отношению к C. trachomatis D323 - стандартному штамму из коллекции кафедры микробиологии С. Петербургского Государственного университета им. ак. И.П. Павлова. Данный штамм был выделен от больного с хламидийным уретритом, имеет морфологию и физиологическую активность, характерную для представителей данного вида, чувствителен к действию препаратов, используемых для лечения хламидийной инфекции. В работе использованы клеточные культуры МсСоу и L929, полученные из Института цитологии Российской Академии Наук.
Схема постановки опыта
Клетки выращивали во флаконах из нейтрального стекла в среде RPMI-1640 с добавлением 10% эмбриональной телячьей сыворотки. Опыт ставили в стеклянных (лишенных токсичности) плоскодонных флаконах с покровными стеклами. Клетки вносили в среду в конечной концентрации 1х10 кл/мл. После получения монослоя в пробирки вносили стандартные заражающие дозы хламидий, хранящиеся в замороженном состоянии при -70oС. Одновременно к клеткам добавляли испытуемый соединения в конечной концентрации 100 мг/л. Пробу центрифугировали при 2400g в течение 60 минут при комнатной температуре и инкубировали при 37oС в течение 2 часов. После этого меняли питательную среду на новую, содержащую 5% эмбриональной телячьей сыворотки и циклогексимид (2 мкг/мл) с повторным внесением заявляемых соединений в той же концентрации. Параллельно дублировали пробы, используя среду без циклогексемида, чтобы исключить его влияние на изучаемые субстанции. Пробы инкубировали в течение 48 часов в С02-инкубаторе.
Контроли включали: контроли культур клеток, контроль действия растворителей, контроль действия хламидий в отсутствии каких бы-то ни было препаратов, контроль чувствительности хламидий к стандартному антимикробному препарату - ципрофлоксацину [29], контроль испытуемых соединений на токсичность по отношению к культурам клеток.
Оценку результатов проводили путем выявления хламидийных цитоплазматических включений с помощью метода иммунофлюоресценции (MicroTrac Chlamydia trachomatis Direct Specimen Test) и хламидийных антигенов с помощью CylaMonoScreen (Russian-British Joint Venture 66 Regent's Parc Road London NW1 7SX) [30,31]. Эффект действия препарата определяли, анализируя состояние монослоя и число клеток с ЦПВ по сравнению с контролем (культура клеток, зараженная С. trachomatis D323), при этом учитывали число неизмененных клеток в 100 полях зрения, полученных при использовании специальной сетки окуляра микроскопа.
Результаты контрольных проб, удовлетворяющие требованиям эксперимента: контроль культуры клеток - морфология клеток и состояние монослоя соответствуют данному типу клеток, контроль роста хламидий в культуре клеток - наличие ЦПВ в монослое, контроль действия стандартного антимикробного препарата - уменьшение числа ЦПВ в монослое по сравнению с предыдущим контролем, контроль токсичности заявляемых соединений - токсичность отсутствует, контроль действия растворителей - токсическое действие на клетки отсутствует. Результаты проведенных испытаний представлены в таблице 7.
Полученные данные свидетельствуют, что заявляемые соединения, приведенные в таблице 7, обладают выраженной активностью против хламидий, превосходящей таковую у стандартного препарата - ципрофлоксацина.
Остальные заявляемые соединения обладают менее выраженной активностью по защите клеток от хламидий в выбранных условиях эксперимента.
Промышленная применимость
Примеры 1-8 синтеза, практической идентификации и анализа заявляемых соединений, приведенные в таблицах 1-3, подтверждают возможность лабораторного и промышленного синтеза всех десяти заявляемых соединений средствами, освоенными современной фармацевтической промышленностью, а также их четкую идентификацию общепринятыми методами контроля.
Приведенные выше результаты 5 серий экспериментов по определению биологической активности показали, что заявляемые соединения обладают биологической активностью по отношению к различным микроорганизмам, включая микобактерии, хламидии, вирус простого герпеса, а также интерферониндуцирующей активностью. Последнее указывает на возможность их использования в лечении герпеса, других вирусных и некоторых раковых заболеваний.
Приведенные факты доказывают достижение задач, поставленных изобретением: синтезирован новый класс гетероциклических соединений, обладающих высокой и широкой биологической активностью, в частности - антимикобактериальной, иммуностимулирующей, противохламидийной и противовирусной.
Таким образом, по нашему мнению, заявляемые средства (вещества) удовлетворяют всем требованиям, предъявляемым к изобретению: они новы, неочевидны и промышленно применимы.
Литература
1. Pharmaceutical microbiology, Ed. by W.B. Hugo and A.D. Russel Blackwell Scientific Publications, Oxford, 1987, 511 p.
2. Машковский М.Д. Лекарственные средства. Пособие по фармакологии для врачей. Вильнюс, Гамта, 1993, ч.2, стр.528.
3. Sans R.G., Chosas M.G. // Pharmazie. 1988. Bd 43. N 12. S. 827-829.
4. Kratt G. , Salbeck G. , Bonin W., Duewel D. Заявка Германии DE N 3903404, МКИ C 07 D 239/62, опубл 09.08.1990 (Chemical Abstracts, vol.114, 23984k).
5. Cowden W.B., Clark I.A., Hunt N.H. // Journal of Medical Chemistry, 1988. Vol. 31. N 4. P. 799-801.
6. Quijano M. L. , Nogueras M., Melguizo M., Alvarez de Cienfuegos G., Melgarejo M., Sanches A. // Nucleosides & Nucleotides. 1989. Vol. 8. N 8. P. 1519-1528.
7. Joshi K. C., Jain R., Sharma K., Bhattacharya S.K., Goel R.K. // J. Indian Chem. Soc. 1988. Vol. 65. N 3. P. 202-204.
8. Motawia M.S., Joergensen P.T., Larnkjaer A., Pedersen E.B., Nielsen С. //Monatsh. Chem. 1993. Bd 124. Н. 1. S. 55-64.
9. Nagamatsu Т., Yamasaki И., Hirota Т., Yamato M., Kido Y., Shibata M., Yoneda F. // Chem. Pharm. Bull. 1993, Vol. 41. N 2. P. 363-368.
10. Ahluwalia V. K., Batla R., Khurana A., Kumar R. // Indian J. Chem. 1990. Vol. 29B. N 12. P. 1141-1142.
11. Yoneda F., Sasaki Т. Заявка Японии JP 03. 81.276, МКИ C 07 D 471/04, опубликована 05.04.1991 (С.А Vol. 115. 255902F.)
12. Заявка Японии JP 05.213.755, МКИ А 61 К 3/505,опубл. 24.08.1993(С.А. 1993. Vol. 119.262520г.).
13. Jiang J.B., Isaacson D. Патент США 4656274, МКИ C 07 D 471/04, НКИ 544-250, (С.A. Vol. 107. 39643g.)
14. Saltzman R., Jurewicz R., Boon B, Safety of famciclovir in patients with herpes zoster and genital gerpes, Antimicrobial agents and Chemotheraphy, 1994, Vol.38, No. 10, P. 2454-2457.
15. Fenelon L.E., Mumtaz G., Ridgway G.L. The in-vitro susceptbility of Chlamydia pneumoniae, J. of Antimicrobial Chemotheraphy, 1990, vol.26, p. 763-767.
16. Grosset J. Current problems with tuberculosis treatment, Res. Microbiology. 1996, Vol. 147, No. 10-16.
17. Boyd M. R. The Future of new drug development. Current therapy in oncology 1992, P. 11-22.
18. King F. E. , King T.J. Thompson G.B. //J. Chem. Soc.1948. N 4. P. 2855-2862.
19. Ridi M. // Gazz. chim. ital., 1949. Vol.79. N 2-3. P. 2855-2862.
20. Sans R. G., Chozas M.G. // Pharmazie. 1988. Vol. 43. H. 6. P. 415-417.
21. Введенский В.М. // Химия гетероциклических соединений. 1969. 6. С. 1092-1095.
22. Введенский В.М., Макуха М.П., Макарина-Кибак Л.Я. // Химия гетероциклических соединений. 1969. 6. С. 1096-1098.
23. Ahluwalia V. K. , Sharma M.K., Aggarwal R., Chauhan A., Sharma R. Jndian J. Chem. Sec.B.,Vol.30, N 6, р.598-599.
24. Figueroa-Villar J.D., Cruz E.R., Tetrahedron., 1993,Vol.49, N 14, p. 2855-2862.
25. Cowden W. B. , Clark I.A. Заявка. PCT WO 88-04658 (C.A. Vol. 109. 210800f.)
26. Бузыкин Б.И., Лонщакова Т.Р., Киселева С.А., Китаев Ю.П. Материалы научной конференции ИОФХ им. Арбузова АН СССР, Казань. 1971, с.38-41.
27. Москвин А. В., Полковникова И.И. и Ивин Б.А. Исследование азолов и азинов, сообщение 92. Конденсация барбитуровой кислоты с ароматическими альдегидами при мольном соотношении реагентов 2:1. "Журнал общей химии", 1955, том 65. N 3, стр.507 - прототип.
28. Gentry G.A., Lawrency N., Lushbaugh N. Isolation and differentiation of Herpes simplex virus and Trichomonas vaginalis in cell culture, J. of Clinical Microbiology 1985. Vol. 22. No. 2, P. 199-204.
29. Senda S. , Fujimura H. Izumi I., заявки Японии NN 7912 - 7916 от 05.10.1961, опубликованы 22.04.1963.
30. Wang S.P., Grayston J.T. Serotyping of Clamydia trachomatis by inderect fluorescent-antibody staining of inclusions in cell culture with monoclonal antibodies. J. of Clinical Microbiology, 1991, Vol.29. No. 7, P. 1295-1298.
31. Judson B.A., Lambert P.P. Improved Syva MicroTrac Clamydia trachomatis direct test method, Journal of Clinical Microbiology, 1988, Vol.26, No. 12, P.2657-2658.

Изобретение относится к новым солям 5,5'-арилиденбисбарбитуровых и 5,5'-арилиденбис(2-тиобарбитуровых) кислот и 5,5' - арилиденбис(2-тиобарбитуровым) кислотам общей формулы I, обладающим противомикробным, противовирусным, иммуномодулирующим и противоопухолевым действием. В общей формуле I X выбран из кислорода или серы, R1 выбран из группы: водород, нитрогруппа, алкоксигруппа, R2 выбран из группы: водород, нитрогруппа, алкоксигруппа, галоген, Cat* выбран из группы: протон, пиридиний- или 2-гидроксиэтиламмонийкатион. Предпочтительны соединения, где Х=0, Cat+ - пиридиний, R1=H, R2= Cl (I); X=0, Cat+ - пиридиний, R1=H, R2=NO2 (II); X=O, Cat+ - NH2CH2CH2OH, R1=H, R2-NO2 (III); X-S, Cat+ - пиридиний, R1=H, R2=Cl (IV); X=S, Cat+ - пиридиний, R1=H, R2=OH (V); X=S, Cat+ - пиридиний, R1=NO2, R2=H (VI); X=S, Cat+ - пиридиний, R1=R2=MeO (VII); X=0, Cat+ - пиридиний, R1=H, R2=Br (VIII); X= 0, Cat+ -H, R1=H, R2=Cl (IX); X=0, Cat+ - H+, R1=H, R2=NO2 (X). 10 з.п. ф-лы, 8 табл.
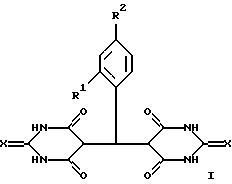
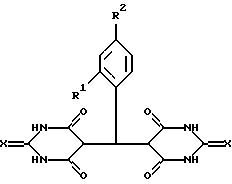
где Х выбран из кислорода или серы;
R1 выбран из группы: водород, нитрогруппа, алкоксигруппа;
R2 выбран из группы: водород, нитрогруппа, алкоксигруппа, галоген;
Cat+ выбран из группы: протон, пиридиний- или 2-гидроксиэтиламмонийкатион,
обладающие противомикробным, противовирусным, иммуномодулирующим и противоопухолевым действием.
| DE 3823255 A1, 11.01.1990 | |||
| СПОСОБ ПОЛУЧЕНИЯ ЛЮМОГЕНА КРАСНОГО 630-(639)- 5- | 0 |
|
SU175969A1 |
| Способ получения 2-арилиденкарбонильных соединений | 1981 |
|
SU1129202A1 |
| US 3402175 A, 17.09.1968 | |||
| 1972 |
|
SU416273A1 | |
| Устройство для подвода смазки к неразборному шпинделю прокатного стана | 1977 |
|
SU674807A1 |
Авторы
Даты
2002-08-27—Публикация
1997-11-19—Подача