Изобретение относится к продуктам присоединения диэфирамина, способам получения этих соединений и их использованию.
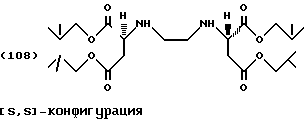
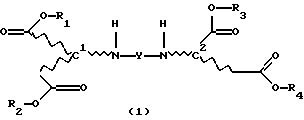
Продукты присоединения диэфирамина настоящего изобретения соответствуют формуле (1)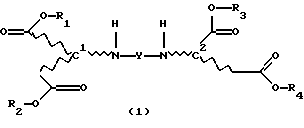
где R1, R2, R3 и R4, независимо один от другого, каждый обозначает С4-С22-алкил;
Y означает радикал формулы (lb)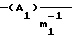
где A1 означает С2-С3-алкилен;
означает асимметрический атом углерода в R- или S-конфигурации, причем, если
C1=R, C2=R;
С1=S, C2=S и
С1=R, С2=S;
m1 равно 2;
при этом продукт присоединения может быть в виде свободного основания, кислоты, кислой соли или соли четвертичного аммония.
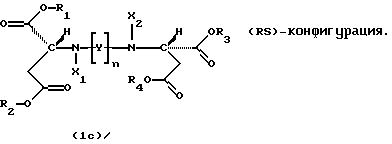
Продукты присоединения диэфирамина являются стереохимически однородными соединениями в (SS)-, (RR)- или (RS)-конфигурации, то есть соединениями, которые могут быть представлены формулами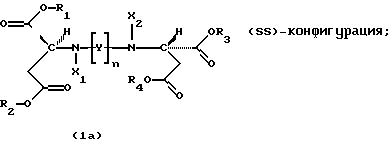

С1-С22-Алкил обозначает прямоцепочечный или разветвленный радикал алкила, например н-пропил, изопропил, н-бутил, втор-бутил, трет-бутил, амил, изоамил или трет-амил, гептил, октил, изооктил, нонил, децил, ундецил, додецил, тетрадецил, пентадецил, гексадецил, гептадецил или октадецил, либо эйкозил.
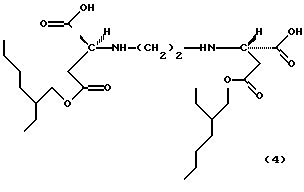
Примерами продуктов присоединения диэфирамина настоящего изобретения являются соединения формул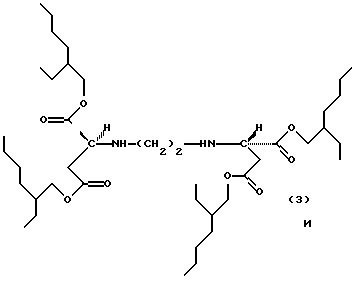
Новые продукты присоединения диэфирамина, которые являются стереохимически однородными в отношении атомов С1 и С2 (см. формулу (1)), получают известными per se методами путем взаимодействия аминодикарбоновой кислоты формулы (1d)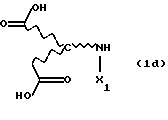
с избыточным количеством соответствующего спирта под действием газообразного НСl или тионилхлорида в реакторе с одним резервуаром. Такой процесс раскрывается, inter alia, в Chemical Abstracts 62, 11911g (1965). Соответствующие продукты присоединения диэфирамина можно превратить в соответствующие продукты присоединения диэфирамина формулы (1) путем взаимодействия полученных аминодикарбоксилатов формулы (1e)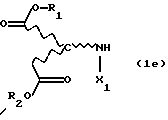
с дигалогенсоединением формулы (1f)
Hal-(A1)m-1Hal.
Полное протекание реакции можно представить следующим образом: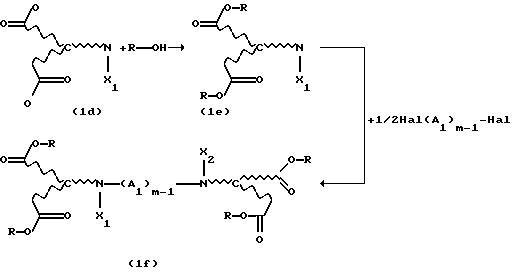
Тетраэфиры, которые являются стереохимически однородными в отношении каркаса аминокарбоновых кислот, также получают путем взаимодействия, например, диаминотетракарбоновой кислоты формулы (1g) или солей этой кислоты с тионилхлоридом и спиртом, с получением соответствующего соединения сложного эфира формулы (1f):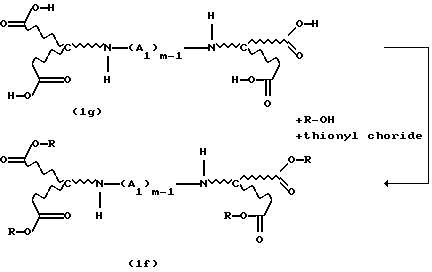
Тионилхлорид добавляют по каплям обычно при температуре в диапазоне от -70 до 80oС, предпочтительно от -10 до 30oС. В последующем температуру реакции повышают до 200oС, причем предпочтительная температура составляет от 40 до 80oС.
Тионилхлорид обычно используют в избыточном количестве. В принципе тионилхлорид может быть заменен газообразным хлороводородом.
По завершении реакции хлоргидраты тетраэфиров можно, при желании, выделить в виде кристаллического соединения и затем перекристаллизовать.
Спиртовой компонент используют в качестве растворителя реакционной смеси (высокий избыток).
Исходным соединением может быть водосодержащая тетракарбоновая кислота, например EDDS (этилендиаминдиянтарная кислота), имеющая содержание воды около 20%.
Сложные моноэфиры аминодикарбоновой кислоты могут быть получены с хорошими выходами традиционными способами путем взаимодействия карбоновой кислоты с соответствующим спиртом.
Смеси соединений формул (1a), (1b) и (1с) получают вначале эстерификацией ангидрида малеиновой кислоты со спиртом в соответствующий диэфир с последующим взаимодействием 2 молей соответствующего диэфира с диамином.
Для многих применений также можно заменять стереохимически однородные продукты смесями стереоизомеров формул (1а), (1b) и (1с), которые также получают вышеуказанным образом.
Стереохимически однородные соединения формулы (1) и продукты присоединения диэфирамина формулы (2)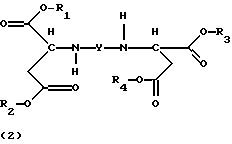
являются предшественниками соединений, имеющих выраженные комплексообразующие свойства. При физиологических условиях группы сложного эфира могут быть расщеплены с помощью эстераз. Химический гидролиз осуществляют в водной среде в присутствии ионов ОН- или OH+. Получают соединения, в которых R1=R2= R3=R4=H, например N,N'-этилендиаминдиянтарную кислоту (EDDS). Такие соединения поэтому способны эффективно связывать ионы тяжелых металлов, такие, как ионы железа, цинка, магния или меди, и предотвращать окисления, инициируемые металлами.
В противоположность свободным кислотам или солям кислот (R1=R2=R3=R4=H) соединения формулы (1) легко растворяются в органических растворителях, жирах и маслах, при этом получены новые области применения. Указанные соединения поэтому пригодны в качестве добавок к пищевым продуктам и напиткам, которые восприимчивы к окислению и склонны портиться или протухать. Пищевыми продуктами, восприимчивыми к окислению, являются, в частности, соединения или композиции, содержащие олефиновые двойные связи.
Благодаря своим комплексообразующим свойствам новые продукты присоединения диэфирамина могут также использоваться для удаления нежелательных отложений кальция, накипи и ржавчины. Они обычно используются для этой цели в щелочных ваннах (составах) для удаления ржавчины или отложений кальция.
Новые продукты присоединения также используются в продуктах личной гигиены, например в кремах, лосьонах, продуктах гигиены тела человека, таких, как дезодоранты, мыла или шампуни и мази, для предотвращения окисления, тухлости, помутнения и так далее.
При их использовании также можно добиться, в частности, смягчающего эффекта в отношении волос.
Кроме того, новые продукты присоединения диамина используются в качестве отбеливающих стабилизаторов, например для пербората натрия, в моющих средствах или при отбеливании текстиля или бумаги. Следовые количества тяжелых металлов, например железа, меди или магния, присутствуют в моющих составах, воде и текстиле, а также в бумажных материалах и катализируют разложение пербората натрия и других отбеливающих веществ, присутствующих в детергенте. Новые соединения связывают ионы этих металлов и препятствуют нежелательному разложению отбеливающей системы как во время хранения соответствующего детергента, так и во время нахождения в моющей жидкости. Таким образом повышается эффективность отбеливающей системы и предотвращается пагубное воздействие на волокна. Кроме того, достигается благоприятный защитный эффект против окислительного разрушения других чувствительных компонентов моющего средства, таких, как ферменты, флуоресцентные отбеливатели и ароматические добавки.
Новые продукты присоединения также могут использоваться в чистящих средствах и детергентах для удаления ионов металлов и в качестве консервантов. В жидких чистящих составах новые соединения могут быть с успехом использованы при концентрации от 0,05 до 15% по массе на основе общей массы состава.
Новые продукты присоединения диэфирамина также могут с успехом использоваться в текстильной промышленности для удаления следовых количеств тяжелых металлов во время изготовления и в процессе окраски натуральных и синтетических волокон. Они препятствуют образованию пятен при крашении текстильных материалов, плохой смачиваемости и неровности крашения.
Новые продукты присоединения диэфирамина формулы (1) также весьма пригодны в качестве пластификаторов для органических волокнистых материалов, таких, как бумага или, в особенности, текстильных волокнистых материалов. Особенно хорошие эффекты пластификации достигаются в случае применения разрыхленных волокон, пряжи, в частности тканых или вязаных изделий из натуральной целлюлозы, например хлопка, или из полиакрилонитрила. Эти продукты присоединения также можно использовать для придания мягкости волокнистым материалам из синтетических полиамидов или регенерированной целлюлозы. Хорошие пластифицирующие эффекты уже достигнуты в тканых покрытиях с содержанием предлагаемых соединений в количестве от 0,1 до 1%, предпочтительно от 0,2 до 0,6%.
Обработку волокон осуществляют путем обработки волокнистых материалов предпочтительно водным составом, например водным раствором или эмульсией этих продуктов присоединения, нанося продукты присоединения на волокна с последующей их сушкой. Удобно использовать от 0,5 до 5%, предпочтительно от 1 до 3%, примерно 20% эмульсии или раствора, на основе массы обрабатываемого волокнистого материала. Водные составы можно наносить на волокна способами пропитки, традиционно используемыми в промышленности (например, способ плюсовки или истощения). Растворы в органических растворителях часто используются посредством распыления.
Аналогичным образом можно обрабатывать бумажное полотно, нанося новые продукты присоединения посредством распыления или пропитки, что также приводит к получению полотна, мягкого на ощупь.
Новые продукты присоединения диэфирамина формулы (1) также можно использовать в качестве антистатиков для текстильных изделий, в частности для полиэфирных тканей.
В бумажной промышленности новые соединения могут быть использованы для элиминирования ионов тяжелых металлов и железа. Отложения железа на бумаге приводят к появлению так называемых горячих пятен (участков перегрева) как только начинается окислительная, каталитическая деградация целлюлозы.
Новые продукты присоединения диэфирамина также пригодны в качестве катализаторов органического синтеза, например для воздушного окисления парафинов или для гидроформилирования олефинов в спирты.
Новые продукты присоединения диэфирамина могут использоваться в любой желательной форме, например в виде порошка, гранулированного материала, пасты, жидкого состава, таблетки, капсулы, пилюли, суспензии или геля.
Если новые продукты присоединения используются, например, в качестве продуктов для ухода за телом, тогда такой продукт содержит от 0,01 до 15%, предпочтительно от 0,5 до 10% по массе, на основе общей массы композиции, продукта присоединения диэфирамина формулы (1) или (2), а также косметически совместимые вспомогательные вещества.
В зависимости от формы продукта для ухода за телом он содержит другие компоненты помимо продукта присоединения диэфирамина, например секвестранты, красители, парфюмерные масла, загустители или регуляторы консистенции, мягчительные средства, абсорберы ультрафиолетового излучения, вещества для защиты кожи, антиокислители, добавки, улучшающие механические свойства, такие, как дикарбоновая кислота и/или соли Al, Zn, Ca, Mg С14-С22-жирных кислот.
Благодаря своей хорошей растворимости в масле и спирте новые продукты присоединения диэфирамина можно без особого труда вводить в соответствующие составы.
Мыло имеет, например, следующий состав:
от 0,01 до 5 мас.% соединения формулы (1) или (2),
от 0,3 до 1 мас.% диоксида титана,
от 1 до 10 мас.% стеариновой кислоты,
добавка до 100% основания мыла, например натриевых солей жирной кислоты твердого жира и жирной кислоты кокосового ореха или глицеринов.
Шампунь имеет, например, следующий состав:
от 0,01 до 5 мас.% соединения формулы (1) или (2),
12,0 мас.% натрий-лаурет-2-сульфата,
4,0 мас.% кокамидопропилбетаина,
3,0 мас.% NaCl и
добавка воды до 100%.
Дезодорант имеет, например, следующий состав:
от 0,01 до 5 мас.% соединения формулы (1) или (2),
12,0 мас.% этанола,
4,0 мас.% кокамидопропилбетаина,
0,3 мас.% парфюмерного масла и
добавка воды до 100%.
Следующие не ограничивающие объем изобретения Примеры иллюстрируют изобретение более подробно. Используемый SS-DDS имеет содержание воды около 20%.
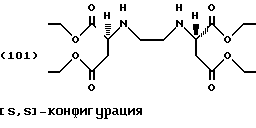
Пример 1: Сложный тетраэтиловый эфир [S,S]-этилендиаминдиянтарной кислоты
Этанол (300 г, 6,5 моль) и [S,S]-этилендиаминдиянтарную кислоту (21,92 г, 0,075 моль) помещают в сосуд с последующим добавлением по каплям тионилхлорида (53,0 г, 0,45 моль) при температуре от -5 до 5oС. Реакционную смесь медленно нагревают до комнатной температуры и перемешивают в течение 24 часов при комнатной температуре. Затем смесь нагревают еще 12 часов при температуре 60oС. Суспензия вначале превращается в раствор, а по истечении некоторого времени сложный тетраэфир выделяется как хлоргидрат в виде кристаллов белого цвета. Суспензию разбавляют 100 мл этанола и концентрируют в роторном испарителе при температуре 60oС.
Белый остаток суспендируют в 100 г смеси 1:1 льда/аммиачного раствора (25%). Водную фазу экстрагируют дважды метил-трет-бутиловым эфиром (300 мл). Органические фазы объединяют и затем промывают водой до нейтральности и сушат в присутствии Na2SО4. Удаление растворителя в вакууме (60oС) приводит к получению слегка загрязненного сложного тетраэфира формулы (101) в виде бесцветной жидкости.
Смесь может быть очищена колоночной хроматографией (силикагель G60, этилацетат/петролейный эфир [40/60] 8:2).
Выход: 20,4 г, 67 % от теоретического.
1H-ЯМР (200 МГц, CDCl3, тетраметилсилан): δ = 1,15-1,25 (м, СН3, 6Н), 2,0 (с, NH, 1Н), 2,52-2,85 (м, NCСH2СОО и CH2N, 4Н), 3,6 (т, NCH, 1Н), 4,07-4,25 (м, 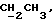 4Н).
4Н).
13С-ЯМР (200 МГц, CDCl3, тетраметилсилан): δ = 14,48 (СН3), 14,54 (СН3), 38,42 (CH2), 57,79 (СН), 60,98 (СН2), 61,31 (СН2), 171,19 (Скв), 173,88 (Скв).
Пример 2: Гидролиз сложного тетраэтилового эфира [S,S]-этилендиаминдиянтарной кислоты в EDDS
[S, S] -EDDS-тетраэтиловый эфир (1,00 г, 0,00247 моль) суспендируют в 50 мл воды и термостатируют до температуры 95oС. Используя контроллер рН, рН поддерживают на уровне 9,5-10 (1 н. раствор NaOH). Через 24 часа добавляют еще 50 мл воды и смесь концентрируют приблизительно до 40 мл в роторном испарителе при температуре 80oС. Остаток переносят в мерную колбу объемом 50 мл, заполняют до отметки градуировки водой и доводят до рН 9,5. Молярная удельная величина вращения гидролизата составляет [α]
Удельная величина вращения для раствора [S,S]-EDDS-тринатриевой соли, полученного из L-аспарагиновой кислоты и дибромоэтана, составляет [α]
Удельная величина вращения для раствора [S,S]-EDDS-тринатриевой соли, термостатированного в течение 24 часов при рН=9,5-10 до температуры 95oС, составляет [α]
Эти измерения показывают, что конфигурация при асимметрических атомах углерода в структуре EDDS вряд ли изменилась при использовании метода эстерификации.
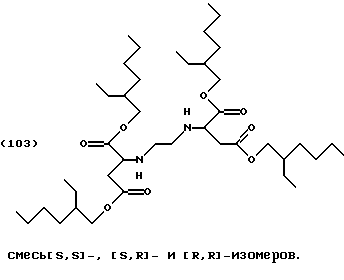
Пример 3: Сложный тетраизооктиловый эфир [S,S]-/[R,R]-/[R,S]-этилендиаминдиянтарной кислоты (смесь изомеров)
Малеиновый ангидрид (10,1 г), 2-этил-1-гексанол (28,7 г) и 2,6-ди(трет-бутил)-р-крезол (0,1 г) смешивают и нагревают до температуры 90oС. Через 2 часа добавляют 50 мл бензола и 0,6 г концентрированной серной кислоты. Азот пропускают через бензол и воду отгоняют азеотропно. После охлаждения смесь пополняют 2,6 г порошковидного карбоната натрия и перемешивают в течение 30 минут. Нерастворенный компонент реакционной смеси удаляют фильтрацией и фильтрат концентрируют в роторном испарителе под вакуумом, получая 38 г неочищенного сложного диэфира формулы (103), Перегонка под высоким вакуумом приводит к получению сложного диэфира формулы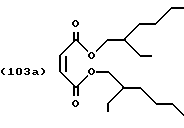
с выходом 90% от теоретического.
Элементный анализ:
вычислено, %: С 70,55; Н 10,66;
найдено, %: С 70,7; Н 10,9.
После загрузки 100 мл толуола сложным диэфиром формулы (103) (27,24 г, 0,08 моль) этилендиамин (2,4 г, 0,04 моль, растворенный в 5 мл толуола) прибавляют по каплям при температуре 20-25oС, и смесь нагревают в течение 4 часов при температуре 80oС. Растворитель удаляют в роторном испарителе под вакуумом. Остаток очищают колоночной хроматографией (силикагель 60, толуол/этилацетат 7:3).
Выход: 9,0 г, 30% от теоретического.
Элементный анализ:
вычислено, %: С 68,07; Н 10,88; N 3,78;
найдено, %: С 68,2; Н 10,8; N 3,7.
Пример 4: Сложный тетраизооктиловый эфир [S,S]-этилендиаминдиянтарной кислоты
2-Этил-1-гексанол (100 г, 0,77 моль) помещают в реактор с последующим добавлением тионилхлорида (28,4 г, 0,24 моль) по каплям при температуре от -5 до 5oС. [S, S]-Этилендиаминдиянтарную кислоту (11,68 г, 0,04 моль) добавляют порциями в реакционную смесь. Реакционную смесь медленно нагревают до комнатной температуры и перемешивают в течение 12 часов при комнатной температуре. Затем смесь нагревают еще 24 часа до температуры 60oС и потом перемешивают в течение 48 часов при комнатной температуре. Затем реакционную смесь добавляют, помешивая, в смесь льда/аммиачного раствора и обрабатывают, как описано в Примере 1. Для удаления 2-этил-1-гексанола органическую фазу концентрируют под высоким вакуумом.
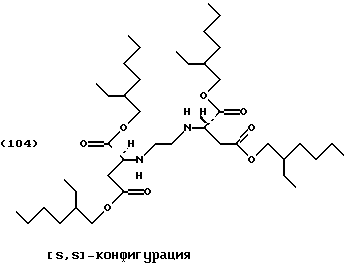
Это приводит к получению желтоватого масла, соответствующего формуле (104) слегка загрязненного тетраэфира (21 г, 73% от теоретического).
Продукт может быть очищен колоночной хроматографией (силикагель G60, этилацетат/петролейный эфир [40/60] 1:1).
1Н-ЯМР (200 МГц, CDCl3, тетраметилсилан): δ = [0,72-0,90 (м), 1,11-1,27 (м), 1,40-1,59 (м) алкильный радикал, 30Н], 1,91 (с, NH, 1H), 2,49-2,80 (м, NCCH2COO и CH2N, 4H), 3,57 (т, NCH, 1H), 3,88-4,10 (м, 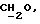 4H).
4H).
13С-ЯМР (200 МГц, CDCl3, тетраметилсилан): δ = 11,29, 11,47, 14,39, 23,33, 23,74, 24,07, 24,10, 29,27, 29,51, 30,53, 30,71, 38,48, 39,06, 39,09, 47,67, 57,83 (СН), 67,53 (СН2), 67,72 (CH2), 171,40 (Скв), 174,08 (Cкв).
Пример 5: Сложный тетраизопропиловый эфир [S,S]-этилендиаминдиянтарной кислоты
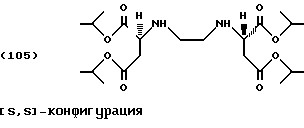
Изопропанол (150,0 г, 2,5 моль) помещают в реактор с последующим добавлением тионилхлорида (14,3 г, 0,12 моль) по каплям при температуре от -5 до 5oС. [S,S]-Этилендиаминдиянтарную кислоту (5,84 г, 0,02 моль) добавляют порциями в реакционную смесь. Реакционную смесь медленно нагревают до комнатной температуры и затем в течение 24 часов до температуры 60oС. После охлаждения образуются кристаллы хлоргидрата тетраэфира формулы (105), которые собирают фильтрацией и промывают 50 мл метил-третбутилового эфира.
После перемешивания фильтровальной лепешки в смеси льда/аммиачного раствора ее обрабатывают, как описано в Примере 1. Удаление растворителя под высоким вакуумом (60oС) приводит к получению слегка загрязненного тетраэфира в виде желтоватого масла (выход: 1,71 г, 19% от теоретического).
Продукт может быть очищен колоночной хроматографией (силикагель G60, этилацетат/петролейный эфир [40/60]/этанол (9:1:0,5).
1H-ЯМР (200 МГц, CDC13, тетраметилсилан): δ = 1,15-1,38 (м, СН3, 12Н), 1,99 (с, NH, 1Н), 2,54-2,85 (м, NCCH2СОО и CH2N, 4Н), 3,58 (т, NCH, 1Н), 4,93-5,12 (м, ОСН, 2Н).
13С-ЯМР (200 МГц, CDCl3, тетраметилсилан): δ = 22,11 (СН3), 22,15 (СН3), 22,21 (СН3), 38,72 (СН2), 47,60 (СН2), 57,99 (СН2), 68,41 (СН), 68,85 (СН), 170,72 (Скв), 173,41 (Скв).
Пример 6: Сложный тетрабутиловый эфир [S, S]-этилендиаминдиянтарной кислоты
n-Бутанол (200 г, 2,7 моль) помещают в реактор с последующим добавлением тионилхлорида (14,3 г, 0,12 моль) по каплям при температуре от -5 до 5oС. [S, S]-Этилендиаминдиянтарную кислоту (5,84 г, 0,02 моль) добавляют порциями в реакционную смесь. Реакционную смесь медленно нагревают до комнатной температуры и затем в течение 48 часов до температуры 60oС. Вначале суспензия превращается в раствор, а по истечении некоторого времени сложный тетраэфир выделяется как хлоргидрат в виде белых кристаллов. Смесь охлаждают до комнатной температуры и, после добавления 50 мл метил-третбутилового эфира, фильтруют. Фильтровальную лепешку промывают 50 мл метил-третбутилового эфира и быстро сушат с использованием разрежения.
Промывают 50 мл метил-третбутилового эфира и быстро сушат с использованием разрежения.
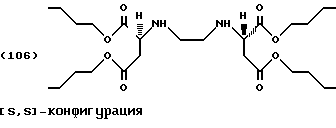
После перемешивания фильтровальной лепешки в смеси льда/аммиачного раствора ее обрабатывают, как описано в Примере 1, с получением тетраэфира формулы (106) в виде слегка желтоватой жидкости (выход: 5,0 г, 48,45% от теоретического).
1Н-ЯМР (200 МГц, CDCl3, тетраметилсилан): δ = 0,80-0,95 (м, СН3, 6Н), 1,22-1,24 (м, алкил-СН2, 4Н), 1,48-1,65 (м, алкил-СН2, 4Н), 1,94 (с, NH, 1Н), 2,59-2,81 (м, NCСH2СОО и СН2N, 4Н), 3,57 (т, NH, 1Н), 3,98-4,16 (м, ОСН2).
13С-ЯМР (200 МГц, СОС13, тетраметилсилан): δ = 13,99 (СН3), 19,42 (СН2), 19,61 (CH2), 30,94 (СН2), 30,95 (CH2), 38,44 (СН2), 47,56 (CH2), 57,79 (СН), 64,88 (CH2), 65,17 (СН2), 171,26 (Скв), 173,94 (Cкв).
Пример 7: Сложный тетра(2-бутиловый) эфир [S,S]-этилендиаминдиянтарной кислоты
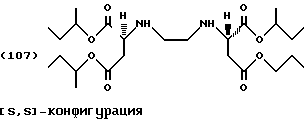
n-Бутанол (200 г, 2,7 моль) помещают в реактор с последующим добавлением тионилхлорида (14,3 г, 0,12 моль) по каплям при температуре от -5 до 5oС. [S, S]-Этилендиаминдиянтарную кислоту (5,84 г, 0,02 моль) добавляют порциями в реакционную смесь. Реакционную смесь медленно нагревают до комнатной температуры и затем перемешивают в течение 48 часов до температуры 60oС. Затем смесь нагревают до температуры 80oС и поддерживают в течение 16-ти часов при этой температуре. Чистый бесцветный раствор охлаждают до температуры 2oС, после чего сложный тетраэфир выделяется как хлоргидрат в виде белых кристаллов. Смесь фильтруют при температуре 5oС и продукт промывают 50 мл метил-третбутилового эфира.
После перемешивания фильтровальной лепешки в смеси льда/аммиачного раствора ее обрабатывают, как описано в Примере 1, с получением тетраэфира формулы (107) в виде слегка желтого масла (выход: 0,9 г, 9% от теоретического), которое можно очистить колоночной хроматографией (силикагель G60, этилацетат/петролейный эфир [40/60] 8:2) с получением бесцветного масла.
1Н-ЯМР (200 МГц, CDCl3, тетраметилсилан): δ = 0,88-0,98 (м, СН2СН3, 6Н), 1,10-1,28 (м, СНСН3, 6Н), 1,42-1,68 (м, CH2СН3, 4Н), 1,98 (с, NH, 1Н), 2,52-2,88 (м, NCCH2COO и СH2N, 4Н), 3,60 (т, NCH, 1Н), 4,78-4,96 (м, CH2N, 2Н).
13С-ЯМР (200 МГц, CDCl3, тетраметилсилан): δ = 10,46 (СН3), 109,51 (СН3), 20,17 (СН3), 20,28 (СН3), 29,54 (СН2), 29,56 (СН2), 39,18 (СН2), 48,1 (СН2), 58,53 (СН), 73,39 (СН), 73,88 (СН), 171,30 (Скв), 174,01 (Скв).
Пример 8: Сложный тетра(изобутиловый) эфир [S,S]-этилендиаминдиянтарной кислоты
Изобутанол (200 г, 2,7 моль) помещают в реактор с последующим добавлением тионилхлорида (14,3 г, 0,12 моль) по каплям при температуре от -5 до 5oС. [S,S]-Этилендиаминдиянтарную кислоту (5,84 г, 0,02 моль) добавляют порциями в реакционную смесь. Реакционную смесь медленно нагревают до комнатной температуры и затем перемешивают в течение 41 часа при температуре 60oС. Вначале суспензия превращается в раствор, а по истечении некоторого времени сложный тетраэфир выделяется как хлоргидрат в виде белых кристаллов. Смесь охлаждают до комнатной температуры и фильтруют. Фильтровальную лепешку промывают 50 мл метил-третбутилового эфира.
После перемешивания фильтровальной лепешки в смеси льда/аммиачного раствора ее обрабатывают, как описано в Примере 1, с получением тетраэфира формулы (108) в виде слегка желтого масла (выход: 6,8 г, 66% от теоретического), который может быть очищен колоночной хроматографией (силикагель G60, этилацетат/петролейный эфир [40/60] 8:2) с получением бесцветного масла.
1Н-ЯМР (200 МГц, CDCl3, тетраметилсилан): δ = 0,84-1,01 (м, СН3, 12Н), 1,84-2,08 (м, NH и 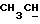 ), 2,55-2,88 (м, NCCH2COO и CH2N, 4Н), 3,65 (т, NCH, 1Н), 3,84-3,96 (м, OCH2, 4Н).
), 2,55-2,88 (м, NCCH2COO и CH2N, 4Н), 3,65 (т, NCH, 1Н), 3,84-3,96 (м, OCH2, 4Н).
13С-ЯМР (200 МГц, CDCl3, тетраметилсилан): δ = 18,39 (СН3), 26,99, 27,03, 37,43 (CH2), 46,61 (СН2), 56,80 (СН), 70,15 (СН2), 70,41 (СН2), 170,24 (Скв), 172,92 (Скв).
Пример 9: Микробиологический тест
Среда:
Пептонный агар на казеине и соевой муке (Merck)
Пептонный бульон на казеине и соевой муке (Merck)
Испытуемые микроорганизмы:
Staphylococcus aureus ATCC 9144 (Американская коллекция типовых культур)
Corynebacterium xerosis ATCC 373
Escherichia coli NCTC 8196 (Национальная коллекция типовых культур (Лондон, Великобритания))
Получение суспензий микроорганизмов:
Испытуемые микроорганизмы культивируют в течение ночи (около 18 часов) при температуре 37oС в бульоне Caso (5 мл контрольные пробирки). Количество микроорганизмов в результате ночного культивирования определяют методом спиралометра, и это количество должно быть на уровне 108-109 КВЕ/мл.
Культуру разбавляют примерно до 107 КВЕ/мл с помощью 0,85% раствора NaCl, pH 7,2.
Нижний слой:
Чашки Петри наполняют примерно 18 мл стерильного питательного агара, которому позволяют загустеть.
Верхний слой:
3,5 мл микроорганизма, разведенного в 0,85% растворе NaCl, переносят пипеткой в 500 мл все еще жидкого агара, который охлаждают в водяной бане до 47oС и гомогенизируют 6 мл агара, зараженного микроорганизмами, равномерно распределяют по отвердевшему нижнему слою. После сушки и хранения в течение около 24 часов при температуре 4oС чашки готовы для испытания.
Размер капель:
100 мкл 1% раствора тетраэфира формулы (104) в абсолютном этаноле отмеривают через пипетку в центр чашки и сушат около 30 минут при комнатной температуре (вещества проходят в зоны размером около 20-30 мм).
Результаты теста на диффузию в агаре (см. таблицу).
Через 48 часов инкубирования агаровых чашек при температуре 37oС оценивают рост испытуемых веществ в зоне капель.
Обнаружено селективное ингибирование Corynebacterium xerosis ATCC 373.

Изобретение относится к продуктам присоединения диэфирамина формулы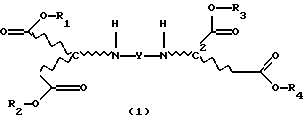
где R1, R2, R3 и R4, независимо один от другого, каждый обозначает С4-С22-алкил, Y означает радикал формулы (1b)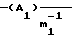
где А1 означает С2-С3-алкилен,
означает ассиметрический атом углерода в R- или S-конфигурации, причем, если С1 = R, С2 = R; С1 = S, С2 = S и С1 = R, С2 = S; m1 = 2 и при этом продукт присоединения может быть в виде свободного основания, кислоты кислой соли или соли четвертичного аммония; способу их получения путем взаимодействия диаминотетракарбоновой кислоты с тионилхлоридом и спиртом; продукту присоединия диэфирамина формулы (2)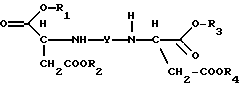
где значение R1-R4 имеют значения, указанные выше; может быть использован в качестве комплексообразователя; продуктов личной гигиены, таких, как дезодорант, мыло, шампунь; продукт (1) может быть использован в качестве пластификатора для материалов из органических волокон. 5 с. и 3 з.п. ф-лы, 1 табл.
где R1, R2, R3 и R4, независимо один от другого, каждый обозначает С4-С22-алкил;
Y означает радикал формулы (1b)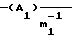
где А1 означает С2-С3-алкилен; означает асимметрический атом углерода в R - или S-конфигурации, причем, если С1 = R, С2 = R; С1 = S, С2 = S и С1 = R, С2 = S;
означает асимметрический атом углерода в R - или S-конфигурации, причем, если С1 = R, С2 = R; С1 = S, С2 = S и С1 = R, С2 = S;
m1 = 2,
при этом продукт присоединения может быть в виде свободного основания, кислоты, кислой соли или соли четвертичного аммония.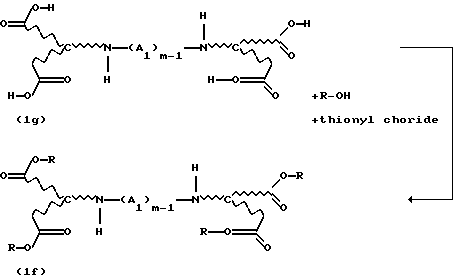
3. Продукт присоединения диэфирамина формулы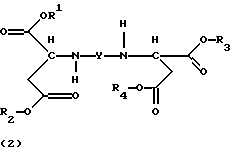
где R1, R2, R3, R4, Y имеют значения, приведенные в п. 1,
в качестве комплексообразователя.
| ПЕПТИДНЫЕ КЕТОНЫ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ИНГИБИРОВАНИЯ ИНТЕРЛЕЙКИН-1βПРОТЕАЗЫ | 1994 |
|
RU2133251C1 |
| СПОСОБ ДЛЯ БЫСТРОГО ОПРЕДЕЛЕНИЯ МЕСТОПОЛОЖЕНИЯ И ПЕРЕДАЧИ ДАННЫХ НА МОБИЛЬНОЕ УСТРОЙСТВО В СЕТИ БЕСПРОВОДНОЙ СВЯЗИ | 2005 |
|
RU2341045C2 |
| УНИВЕРСАЛЬНАЯ БЛОК-ФОРМА | 2005 |
|
RU2299809C2 |
| US 5652201 A, 29.07.1997 | |||
| Установка для нанесения клеящих веществ на изделия | 1978 |
|
SU710656A1 |
Авторы
Даты
2002-09-27—Публикация
1998-10-27—Подача