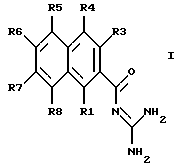
Изобретение относится к замещенным 2-нафтоилгуанидинам формулы I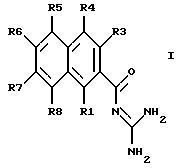
в которой по меньшей мере, один из заместителей R1, R3 - R8 означают XYaWZ или X'YaWZ, где
Х - О, S, NR(10) или CR(11)R(12);
R(10), R(11) и R(12),
независимо друг от друга, означают Н, алкил с 1,2,3,4,5 или 6 С-атомами, перфторалкил c 1,2,3 или 4 С-атомами или циклоалкил с 3,4,5,6 или7 атомами углерода;
Y означает алкилен с 1,2,3,4,5,6,7 или 8 группами СН2, причем одна из этих групп СН2 может быть заменена на О, S, NR(13) или о-, п- или м-фенилен;
R(13) означает Н, алкил с 1,2,3,4,5 или 6 атомами углерода, перфторалкил с 1,2,3 или 4 атомами углерода или циклоалкил с 3,4,5 или 6 атомами углерода;
а=0 или 1;
W означает СН2SO2S/=O//=NН/ или - в том случае, если W не следует непосредственно за гетероатомом группы XYa - то также О или NR(14);
R(14) означает Н, алкил с 1,2,3,4,5 или 6 атомами углерода, перфторалкил с 1,2,3 или 4 атомами углерода или циклоалкил с 3,4,5 или 6 атомами углерода;
Z означает C/=O/R(15), SO2R(15) или - в том случае, если W не означает О или NR(14) - то также NR(16)R(17);
R(15) означает N=C(NH2)2, NR(18)R(19), N(СН2)6NR(18)R(19) или OR(20);
b=2 или 3;
R(18) и R(19),
независимо друг от друга, означают Н, алкил с 1,2,3,4,5,6,7 или 8 атомами углерода или перфторалкил с 1,2,3 или 4 атомами углерода;
или
R(18) и R(19) вместе означают 4 или 5 метиленовых групп, из которых одна группа СН2 может быть заменена кислородом, S, NH, N-СН3, N-бензилом или N-(п-хлорфенилом);
R(20) означает Н, алкил с 1,2,3,4,5 или 6 атомами углерода, перфторалкил с 1,2,3 или 4 атомами углерода или циклоалкил с 3,4,5,6 или 7 атомами углерода;
R(16) и R(17), независимо друг от друга, означают Н, алкил с 1,2,3,4,5,6,7 или 8 атомами углерода или перфторалкил с 1,2,3 или 4 атомами углерода;
или
R(16) и R(17) вместе означают 4 или 5 метиленовых групп, из которых одна группа СН2 может быть заменена кислородом, S, NH, N-CH3, N-бензилом или N-(п-хлорфенилом);
X' - C=O, C/=O/NR(30), C/=O/O, SO, SO2, SO2NR(30), OC=O, NR(30)C=O, или NR/30/SO2,
причем связь с нафталиновым кольцом осуществляется соответственно через атом, занимающий левую позицию;
R(30) означает Н, алкил с 1,2,3,4,5 или 6 атомами углерода, перфторалкил с 1,2,3 или 4 атомами углерода или циклоалкил с 3,4,5 или 6 атомами углерода;
Z' - C/=O/R(15), SO2R(15), азотсодержащий гетероцикл с 1,2,3,4,5,6,7,8 или 9 атомами углерода;
причем содержащий азот гетероцикл связан чepeз N или С и незамещен или замещен 1-3 заместителями, выбранными из группы, состоящей из F, Сl, Br, СF3, метила, метокси и NR(21)R(22);
R(21) и R(22), независимо друг от друга, означают Н, алкил с 1,2,3 или 4 С-атомами или перфторалкил с 1,2,3 или 4 С-атомами;
R(15)- N=C(NH2)2, NR(18)R(19), N(CH2)b NR(18)R(19) или OR(20);
R(18) и R(19), независимо друг от друга, означают Н, алкил с 1,2,3,4,5,6,7 или 8 С-атомами или перфторалкил с 1,2,3 или 4 С-атомами;
или
R(18) и R(19) означают вместе 4 или 5 метиленовых групп, из которых одна группа СН2 может быть заменена кислородом, S, NH, N-СН3, N-бензилом или N-(п-хлорфенилом);
b=2 или 3;
R(20) - Н, алкил с 1,2,3,4,5 или 6 С-атомами, перфторалкил с 1,2,3 или 4 С-атомами или циклоалкил с 3,4,5,6 или 7 атомами углерода;
или
Z' - в том случае, если W не означает О или NR(14), - то NR(16)R(17);
R(16) и R(17) означают, независимо друг от друга, -Н, алкил с 1,2,3,4,5,6,7 или 8 С-атомами или перфторалкил с 1,2,3,4 С-атомами;
или
R(16) и R(17) означают вместе 4 или 5 метиленовых групп, из которых одна СН2-группа может быть заменена кислородом, S, NH, N-СН3, N-бензилом или N -(п-хлорфенилом);
и в каждом случае прочие заместители R1, R2, R3, R4, R5, R6, R7 и R8, которые еще не подпадают под приведенные выше значения, означают, независимо друг от друга Н, F, Cl, Br, I, CN, NO2, СF3, С2F5 или VpQqU; где
V - О, S, SO, SO2, NR(60), OC=O, C=O, C/=O/NR(60), С/=O/O или CR(66)R(67);
R(60), R(66) и R(67) означают, независимо друг от друга, -Н, алкил с 1,2,3,4,5,6 С-атомами, перфторалкил с 1,2,3 или 4 С-атомами или циклоалкил с 3,4,5,6 или 7 С-атомами;
р=0 или 1;
Q - алкилен с 1,2,3,4,5,6,7 или 8 СН2-группами, причем, одна из этих СН2-групп может быть заменена на О, S, NR(68) или о-, п- или м-фенилен;
R(68) означает
Н, алкил с 1,2,3,4,5 или 6 С-атомами; перфторалкил с 1,2,3 или 4 С-атомами или циклоалкил с 3,4,5 или 6 С-атомами;
q=0 или 1;
U - Н, алкил с 1,2,3,4,5,6 или 7 С-атомами, циклоалкил с 3,4,5,6 или 7 С-атомами, C/=O/R(65), SO2(65), NR(61)R(62) или фенил,
который незамещен или замещен 1-3 заместителями, выбранными из группы, состоящей из F, Cl, Вr, СF3 , метила, метокси и NR(63)R(64);
R(63) и R(64) означают,
независимо друг от друга, - Н, алкил с 1,2,3 или 4 С-атомами или перфторалкил с 1,2,3 или 4 С-атомами;
R(65) - N=C(NH2)2, NR(61)R(62) или OR(60); R(61) и R(62) означают,
независимо друг от друга, - Н, алкил с 1,2,3,4,5,6,7 или 8 С-атомами или перфторалкил с 1,2,3 или 4 С-атомами;
или
R(61) и R(62) означают
вместе 4 или 5 метиленовых групп, из которых одна группа СН2 может быть заменена кислородом, S, NH, N-СН3, N-бензилом или N-(п-хлорфенилом),
или
U - N-содержащий гетероцикл с 1,2,3,4,5,6,7,8 или 9 С-атомами,
причем N-содержащий гетероцикл через N или С связан и незамещен или замещен 1-3 заместителями, выбранными из группы, состоящей из F, Cl, Br, СF3, метила, метокси и NR(63)R(64);
причем, однако, по меньшей мере, один из заместителей R5, R6, R7 и R8 не является водородом;
а также их фармацевтически приемлемые соли.
Предпочтительны соединения формулы I, в которых означают: по меньшей мере, один из заместителей R1, R3 - R8 - XYaWZ или X'YaWZ'; где Х - О, S, NR(10);
R(10) - Н, алкил с 1,2,3 или 4 С-атомами, перфторалкил с 1 или 2 С-атомами или циклоалкил с 3,4,5 или 6 С-атомами;
Y - алкилен с 1,2,3,4 или 5 группами СН2,
причем одна из этих групп СН2 может быть заменена на О, S, NR(13) или о-, п- или м-фенилен;
R(13) - Н, алкил с 1,2,3 или 4 атомами С или циклоалкил с 3,4,5 или 6 С-атомами;
а = 0 или 1;
W - СН2 или - в случае, если W не следует непосредственно за гетероатомом группы ХYa - то также О или NR(14);
R(14) - Н, алкил с 1,2,3 или 4 С-атомами;
Z - C/=O/R(15), SO2 R(15) или - в случае, если W не означает О или R(14) - то также NR(16)R(17);
R(15) - N=C(NH2)2, NR(18)R(19), N (СН2)bR(18)R(19)
или OR(20);
b=2 или 3;
R(18) и R(19) означают,
независимо друг от друга, -Н или алкил с 1,2,3,4 или 5 С-атомами;
или
R(18) и R(19) означают
вместе 4 или 5 метиленовых групп, из которых одна группа СН2 может быть заменена кислородом, S, NH, N-СН3 или N-бензилом;
R(20) - Н, алкил с 1,2,3,4,5 или 6 С-атомами;
R(16) и R(17) означают,
независимо друг от друга, -Н, алкил с 1,2,3,4 или 5 С-атомами или перфторалкил с 1 или 2 С-атомами;
или
R(16) и R(17) означают
вместе - 4 или 5 метиленовых групп, из которых одна группа СН2 может быть заменена кислородом, S, NH, N-СН3, N-бензилом или N-(п-хлорфенилом);
X' - C/=O/NR(30), С/=O/O, SO2NR(30), ОС=O, NR(30)C=O или NR(30)SO2,
причем связь с нафталиновым кольцом в каждом случае осуществляется через атом, занимающий левую позицию;
R(30) - Н, алкил с 1,2,3 или 4 С-атомами, перфторалкил с 1 или 2 С-атомами или циклоалкил с 3,4,5 или 6 С-атомами;
Z' - C/=O/R(15), SO2R(15), N-содержащий гетероцикл с 1,2,3,4,5,6,7,8 или 9 С-атомами,
причем содержащий азот гетероцикл связан через N или С и незамещен или замещен 1-3 заместителями, выбранными из группы, состоящей из F, Cl, Вr, СF3, метила, метокси и NR(21)R(22);
R(21) и R(22) означают, независимо друг от друга, -Н, алкил с 1,2,3 или 4 С-атомами;
R(15)- N=C(NH2)2, NR(18)R(19), N (СН2)bNR(18)R(19) или OR(20);
R(18) и R(19) означают,
независимо друг от друга, -Н, алкил с 1,2,3,4 или 5 С-атомами,
или
R(18) и R(19) означают
вместе 4 или 5 метиленовых групп, из которых одна группа СН2 может быть замещена кислородом, S, NH, N-СН3 или N-бензилом;
b=2 или 3,
R(20) -Н, алкил с 1,2,3,4,5 или 6 атомами углерода;
или
Z' - в случае, если W не означает О или NR(14), - то NR(16)R(17);
R(16) и R(17) означают,
независимо друг от друга -Н, алкил с 1,2,3,4 или 5 С-атомами или перфторалкил с 1 или 2 атомами углерода;
или
R(16) и R(17) означают,
вместе 4 или 5 метиленовых групп, из которых одна группа СН2 может быть заменена кислородом, S, NH, N-СН3, N-бензилом или N-(п-хлорфенилом);
и прочие в каждом случае заместители Rl, R3, R4, R5, R6, R7 и R8, которые еще не подпадают под приведенные выше занчения, означают,
независимо друг от друга, -Н, F, Cl, Br, I, CN, NO2, CF3, С2F3 или VpQqU; где
V - О, S, SO2, NR(60), OC=O, C=O, C/=O/NR(60), C/=O/O или CR(66)R(67);
R(60), R(66) и R(67) означают,
независимо друг от друга, -Н, алкил с 1,2 или 3 С-атомами, перфторалкил с 1 или 2 атомами углерода или циклоалкил с 3,4,5 или 6 атомами углерода;
р=0 или 1;
q=0;
U - Н, алкил с 1,2,3 или 4 С-атомами, циклоалкил с 3,4,5 или 6 С-атомами, C/= O/R(65), NR(61)R(62) или фенил, который незамещен или замещен 1-3 заместителями, выбранными из группы, состоящей из F, Cl, Br, CF3, метила, метокси и NR(63)R(64);
R(63) и R(64) означают, независимо друг от друга, -Н, алкил с 1,2,3 или 4 С-атомами;
R(65) - N=C(NH2)2 или OR(60);
R(61) и R(62) означают,
независимо друг от друга, -Н, алкил с 1,2,3 или 4 С-атомами или перфторалкил с 1 или 2 атомами углерода;
или
R(61) и R(62) означают
вместе 4 или 5 метиленовых групп, из которых одна СН2 группа может быть заменена кислородом, S, NH, N-СН3 или N-бензилом;
или
U - N-содержащий гетероцикл с 1,2,3,4,5,6,7,8 или 9 С-атомами
причем содержащий азот гетероцикл связан через N или С и незамещен или замещен 1-3 заместителями, выбранными из группы, состоящей из F, Cl, Br, CF3, метила, метокси и NR(63)R(64);
причем, однако, по меньшей мере, один из заместителей R5, R6, R7 и R8 не является водородом;
а также их фармацевтически приемлемые соли.
Особенно предпочтительны соединения формулы I, в которых, по меньшей мере, один из заместителей R1, R3 - R8 означает XYaWZ, или X'YaWZ'; где Х - О;
Y - алкилен с 1,2,3,4 или 5 группами СН2, причем одна из этих групп СН2 может быть заменена O-, п- или м-фениленом;
а=0 или 1;
W - СН2 или - в случае, если W не следует непосредственно за гетероатомом группы ХYa - то также О или NR(14)
R(14) - Н или метил;
Z - C/= O/R(15) или - в случае, если W означает не О и не NR(14), - то также R(16)R(17);
R(15) - N=C(NH2)2, NR(18)R(19) или OR(20);
R(18) и R(19) означают,
независимо друг от друга, -Н, алкил с 1,2,3 или 4 атомами углерода; или R(18) и R(19) означают
вместе 4 или 5 метиленовых групп, из которых одна группа СН2 может быть заменена кислородом, NH, N-СН3 или М-бензилом,
R(20)-H или алкил с 1,2 или 3 атомами углерода, R(16) и R(17) означают,
независимо друг от друга, -Н или алкил с 1,2,3 или 4 атомами углерода;
или
R(16) и R(17) означают
вместе 4 или 5 метиленовых групп, из которых одна группа СН2 может быть заменена кислородом, S, NH, N-СНз, N-бензилом или N-(п-хлорфенилом);
X' - C/=O/NR(30), C/=O/O или SO2NR(30),
причем связь с нафталиновым кольцом в каждом случае осуществляется через атом, занимающий левую позицию.
R(30) - Н или метил;
Z - C/=O/R(15), N-содержаиий гетероцикл с 1,2,3,4,5,6,7,8 или 9 атомами углерода;
причем содержащий азот гетероцикл связан через N или С;
R(15) - N=C(NH2)2, NR(18)R(19) или OR(20);
R(18) и R(19) означают,
независимо друг от друга, -Н или алкил с 1,2,3 или 4 атомами углерода;
или
R(18) и R(19) означают
вместе 4 или 5 метиленовых групп, из которых одна группа СН2 может быть заменена кислородом, NH, N-СН3 или N-бензилом;
R(20) - Н, алкил с 1,2 или 3 С-атомами;
или
Z' - означает - в случае, если W не означает О или NR(14), - то NR(16)R(17);
R(16) и R(17) означают, независимо друг от друга, Н или алкил с 1,2,3 или 4 С-атомами;
или
R(16) и R(17) означают вместе 4 или 5 метиленовых групп, из которых одна группа СН2 может быть заменена кислородом, S, NH, N-СН3 или N-бензилом;
и соответственно остальные заместители Rl, R3, R4, R5, R6, R7 и R8, которые еще не подпадают под приведенные выше значения, означают, независимо друг от друга, - Н, F, Cl, Вr, I, СF3 или VpQqU, где
V - О, SO2, NR(60), ОС=O, C/=O/NR(60), C/=O/O или CR(66)R(67);
R(60), R(66) и R(67) означают, независимо друг от друга Н или алкил с 1,2 или 3 С-атомами;
р=0 или 1;
q=нулю;
U - Н, алкил с 1,2 или 3 С-атомами, C/=O/R(65), NR(61)R(62) или фенил,
который незамещен или замещен 1-3 заместителями, выбранными из группы, состоящей из F, Cl, Вr, СF3, метила, метокси и NR(63)R(64);
R(63) и R(64) означают, независимо друг от друга, Н или метил;
R(65) - N=C(NH2)2;
или
U означает М-содержащий гетероцикл с 1,2,3,4,5,6,7,8 или 9 С-атомами,
причем N-содержащий гетероцикл связан через N или С;
причем по меньшей мере, один из заместителей R5, R6, R7 и R8 не является водородом;
а также их фармацевтически приемлемые соли.
Если соединения формулы I содержат один или несколько центров асимметрии, то они могут иметь как S-, так и R-конфигурацию. Соединения могут находитьcя в виде оптических изомеров, диастереомеров, рацематов или их смесей.
Указанные алкильные остатки или перфторалкильные остатки могут быть как в виде прямых цепей, так и в виде разветвленных цепей.
В качестве азотсодержащих гетероциклов могут использоваться, в частности, пирролил, имидазолил, пиразолил, триазолил, тетразолил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиридил, пиразинил, пиримидинил, пиридазинил, индолил, изоиндолил, бензимидазолил, индазолил, хинолил, изохинолил, фталазинил, хиноксалинил, хиназолинил, хиннолинил.
Особенно предпочтительны азотсодержащие гетероциклы пирролил, имидазолил, хинолил, пиридил, пиразолил, пиразинил, пиримидинил и пиридазинил.
Изобретение относится, далее, к способу получения соединения формулы I, отличающемуся тем, что соединение формулы II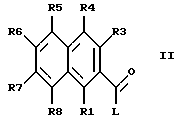
где L означает легко нуклеофильно замещаемую удаляемую группу, а остальные заместители имеют указанные выше значения, вводят во взаимодействие с гуанидином.
Активированные производные кислоты формулы II, где L означает алкокси-, предпочтительно метоксигруппу, фенокси-группу, фенилтиогруппу, метилтиогруппу, 2-пиридилтиогруппу, азотсодержащий гетероцикл, предпочтительно 1-имидазолил, предпочтительно получают само по себе известным способом из соответствующих хлорангидридов карбоновых кислот (формула II, L=Cl), которые, в свою очередь, опять само по себе известным способом можно получить из соответствующих карбоновых кислот (формула II, L=OH), например, с помощью тионилхлорида.
Наряду с хлорангидридами карбоновых кислот формулы II (L=Cl) можно получить другие активированные производные кислот формулы II из соответствующих производных нафтойной кислоты (формулы II, L=OH), как, например, сложные метиловые эфиры формулы II с L=ОСН3 путем обработки газообразным НСl в метаноле, имидазолиды формулы II путем обработки карбонилдиимидазолом /L= 1-имидазолил, Staad, Angew.Chem.Int.Ed.Engl. 1, 351-367 (1962)/, смешанные ангидриды формулы II - с помощью Cl-COOC2H5 или тозилхлорида в присутствии триэтиламина в инертном растворителе; активирование карбоновых кислот можно осуществить также с помощью дициклогексилкарбодиимида (ДСС) или тетрафторбората O-[/циано (этоксикарбонил)метилен)амино] 7-1,1, 3,3-тетраметилурония ("TOTU") [Proceedings of the 2 I.European Peptide Symposium, Peptides 1990, Editors E. Giralt and D.Andreu, Escom, Leiden, 1991]. Ряд пригодных способов получения активированных производных карбоновых кислот формулы II приведен с указанием литературных источников в J.March, Advanced Organic Chemistry, Third Edition(John Wiley & Sons, 1985), c.350.
Взаимодействие активированного производного карбоновой кислоты формулы II с гуанидином осуществляется само по себе известным способом в протонном или апротонном полярном, но инертном органическом растворителе. При этом взаимодействии метилового эфира нафтойной кислоты (II, L-ОМе) с гуанидином хорошо зарекомендовали себя метанол, изопропанол или тетра-гидрофуран (ТГФ) при температуре от 20oС до температуры кипения этих растворителей. При большей части взаимодействий соединений формулы II с несолевой формой гуанидина работали преимущественно в апротонном инертном растворителе, как, например, ТГФ, диметоксиэтил, диоксан, или диметилформамид (ДМФ). Однако можно использовать также воду с основанием, например, NаОН, в качестве растворителя при взаимодействии соединения формулы II с гуанидином.
Если L означает Cl, то работают предпочтительно с применением улавливателя кислоты, например, в виде избыточного гуанидина, для связывания галогеноводородной кислоты.
Часть соответствующих производных нафтойной кислоты формулы II известна и описана в литературе. Неизвестные соединения формулы II можно получать известными из литературы способами.
Гуанидины карбоновых кислот формулы I в общем являются слабыми основаниями и могут связывать кислоты с образованием солей. В качестве солей, получаемых путем соединения с кислотой, можно рассматривать соли всех фармакологически приемлемых кислот, например галогениды, в частности гидрохлориды, лактаты, сульфаты, цитраты, тартраты, ацетаты, фосфаты, метилсульфонаты, п-толуолсульфаты, малеинаты, фумараты.
Соединения формулы I являются замещенными ацилгуанидинами.
Наиболее часто встречающимся представителем ацилгуанидинов является производное пиразина амилорид, который находит применение в терапии в качестве диуретического средства, сберегающего калий. Многочисленные другие соединения типа амилорида описаны в литературе, как, например, диметиламилорид или этилизопропиламилорид.
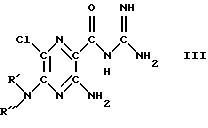
Амилорид: Р', R= Н, диметиламилорид: R', R=СН3, этилизопропиламилорид: R'=С2Н3, R=СН(СН3)2.
Исходя из этого, известны исследования, которые указывают на антиаритмические свойства амилорида [Circulation 79, 1257-63 (1989)]. Широкому применению в качестве антиаритмического лекарственного средства препятствует, однако, то, что этот эффект выражен лишь слабо и сопровождается понижающим давление и салуретическим действием, а эти побочные действия нежелательны при лечении нарушений ритмов сердца.
Указания на антиаритмические свойства амилорида были получены также при экспериментах на изолированном сердце животных [Eur.Heart J.9 (suppl.l): 167(1988) (book of abstracts)]. Так, например, на сердце крыс было найдено, что вызванное искусственно мерцание в желудочках сердца можно полностью подавить с помощью амилорида. Еще более эффективным, чем амилорид, было в случае этой модели упомянутое выше производное амилорида-этилизопропиламилорид.
Из патента США 4251545 известны 1-нафтоилгуанидины, которые в положении 4 замещены алкоксигруппами с длинными цепями. Для этих соединений описано применение в качестве фунгицидов при защите растений. В выложенной международной заявке 94/26709 описывают 2-нафтоилгуанидины, которые в позициях, соответствующих остаткам R5, R6, R7 и R8, несут атомы водорода.
Неакцептованная европейская заявка 682017 (Ное 94/F 123) описывает, наряду с бициклическими гетероароилгуанидинами, также некоторые нафтоилгуанидины, причем заместители R1 до R8 имеют, однако, иные, чем в настоящей заявке, значения.
В качестве единственного примера в этих публикациях патентов WO 94/26709 и EP-OS 682017 (Ное 94/F 123) приведен незамещенный 2-нафтоилгуанидин.
Известные из указанных публикаций соединения удовлетворяют, однако, не всем требованиям, которые необходимы для получения лекарственного средства из фармакологически эффективного соединения. Так, например, желательны более высокая резорбция, более благоприятные периоды полураспада, более высокая растворимость в воде, меньшая токсичность и большая селективность.
Этого удается достичь с помощью соединений согласно изобретению, которые, кроме того, не имеют никаких нежелательных и вызывающих осложнения салидиуретических свойств, однако обладают очень хорошими антиаритмическими свойствами, которые, например, важны для лечения болезней, вызванных кислородной недостаточностью. Соединения, вследствие своих фармакологических свойств, чрезвычайно пригодны для профилактики и лечения инфарктов, а также для лечения стенокардии, в качестве антиаритмического лекарственного средства с кардиозащитным компонентом, причем они также превентивно ингибируют или сильно снижают патофизиологические процессы при возникновении нарушений, индуцированных ишемией, в частности при развитии индуцированных ишемией сердечных аритмий. Благодаря своим защитным воздействиям против патологических гипоксических и ишемических ситуаций соединения формулы I согласно изобретению, вследствие ингибирования клеточного механизма обмена Na+/H+, могут использоваться в качестве лекарственного средства для лечения всех острых или хронических, вызванных ишемией нарушений или первично или вторично индуцированных этими нарушениями заболеваний. Это относится к их использованию в качестве лекарственного средства при оперативных вмешательствах, например при трансплантациях органов, причем соединения могут применяться как для защиты органов донора перед и во время изъятия, для защиты изъятых органов, например, при обработке или хранении в физиологических растворах, так и при перенесении в организм реципиента. Соединения являются также ценными, оказывающими защитное действие лекарственными средствами при проведении ангиопластических операций, например, на сердце, а также на периферических сосудах. В соответствии с их защитным действием против нарушений, индуцированных ишемией, соединения могут использоваться также в качестве лекарственных средств для лечения ишемий нервной системы, в частности центральной нервной системы, причем они пригодны для лечения, например, кровоизлияний в мозг или отеков мозга. Кроме того, соединения формулы I согласно изобретению пригодны также для лечения разновидностей шока, например аллергического, кардиогенного, гиповолемического и бактериального шока.
Кроме того, соединения согласно изобретению (формулы I) обладают сильно ингибирующим воздействием на пролиферацию клеток, например пролиферацию клеток фибропластов и пролиферацию гладких мышечных клеток сосудов. Поэтому соединения формулы I могут рассматриваться как ценные терапевтические средства при заболеваниях, при которых пролиферация клеток представляет первичную или вторичную причину, и поэтому могут использоваться в качестве антиатеросклеротических средств, средств против поздних диабетических осложнений, раковых заболеваний, фибротических заболеваний, как, например, фиброзы легких, фиброзы печени или фиброзы почек, гипертрофии и гиперплазии органов, в частности, при гиперплазии простаты или гипертрофии простаты.
Соединения согласно изобретению являются эффективными ингибиторами клеточного натрий-протонного антипорта (N+/H+ - обмен), который при многочисленных заболеваниях (эссенциальная гипертония, атеросклерозы, диабет и т.д.) также повышается в таких клетках, которые легко доступны измерениям, как, например, в эритроцитах, тромбоцитах или лейкоцитах. Соединения согласно изобретению пригодны поэтому для использования в качестве превосходных и одновременно простых научных инструментов, например, при их применении в качестве диагностических средств для определения и распознования определенных форм гипертонии, а также атеросклероза, диабета, пролиферативных заболеваний и т.д. Кроме того, соединения формулы I пригодны для превентивной терапии в целях предотвращения генеза высокого кровяного давления, например эссенциальной гипертонии.
Кроме того, было обнаружено, что соединения формулы I оказывают благоприятное влияние на сывороточные липопротеины. Общепризнано, что для возникновения артериосклеротических изменений сосудов, в особенности коронарной болезни сердца, значительный фактор риска представляют слишком высокие количества липидов в крови, так называемые гиперлипопротеинемии. Для профилактики и регрессии атеросклеротических изменений большое значение приобретает поэтому снижение повышенных количеств сывороточных липопротеинов. Наряду со снижением общего сывороточного липопротеина, придается большое значение снижению доли специфических атерогенных липидных фракций этого общего холестерина, в частности, липопротеинов низкой плотности (LDL) и липопротеинов очень низкой плотности (VLDL), так как эти липидные фракции представляют атерогенный фактор риска. Напротив, липопротеинам высокой плотности приписывают защитные функции против коронарной болезни сердца. В соответствии с этим гиполипидемические средства должны снижать не только уровень общего холестерина, но и, в особенности, VLDL- и LDL-фракции сывороточного холестерина. В настоящее время было найдено, что соединения формулы I проявляют высокооцениваемые, с точки зрения терапии, свойства в отношении влияния на уровень сывороточных липидов. Так, например, они заметно снижают повышенную концентрацию в сыворотке LDL и VLDL, которую, например, можно наблюдать при повышенном диэтическом приеме пищи, богатой холестерином и липидами, или при патологических изменениях обмена веществ, например, обусловленной гинетически гиперлипидемии. Их можно поэтому использовать для профилактики и регрессии атеросклеротических изменений за счет того, что они исключают причинный фактор риска. Сюда относятся не только первичные гиперлипидемии, но также некоторые вторичные гиперлипидемии, которые бывают, например. при диабете. Кроме того, соединения формулы I способствуют заметному снижению инфарктов, индуцированных аномалиями обмена веществ, и, в частности, существенному снижению индуцированной обширности инфарктов и степени их тяжести. Далее, соединения формулы I способствуют эффективной защите против эндотельных нарушений, индуцированных аномалиями обмена веществ. Благодаря этой защите сосудов против синдрома эндотелиальной дисфункции соединения формулы I являются ценными лекарственными средствами для предупреждения и лечения спазм коронарных сосудов, атерогенных и атеросклероза, левовентрикулярной гипертрофии и расширенной кардиомиопатии и тромботических заболеваний.
Названные соединения предпочтительно находят поэтому применение для получения лекарственных средств для лечения гиперхолестеринемии; для получения лекарственных средств в целях предупреждения атерогенеза; для получения лекарственных средств в целях предупреждения и лечения атеросклероза; для получения лекарственных средств в целях предупреждения и лечения болезней, вызванных повышенным уровнем холестерина, для получения лекарственных средств в целях предупреждения и лечения болезней, которые развиваются благодаря эндотелиальной дисфункции, для получения лекарственных средств в целях предупреждения и лечения гипертонии, индуцированной атеросклерозом; для получения лекарственных средств в целях предупреждения и лечения тромбозов, индуцированных атеросклерозом; для получения лекарственных средств в целях предупреждения и лечения ишемических нарушений и постишемических нарушений реперфузии, вызванных гиперхолестеринемической и эндотелиальной дисфункцией; для получения лекарственных средств в целях предупреждения и лечения кардиальных гипертрофии и кардиомиопатий, индуцированных гиперхолестеринемической и эндотелиальной дисфункцией; для получения лекарственных средств в целях предупреждения и лечения спазм коронарных сосудов и инфарктов миокарда, индуцированных гиперхолестеринемической и эндотелиальной дисфункцией; для получения лекарственного средства в целях лечения указанных заболеваний в комбинации с веществами, понижающими кровяное давление, предпочтительно, ингибиторами ангиомензинконвертирующего фермента (АСЕ) и антагонистами рецептора ангиотензина, причем комбинация ингибитора NНЕ формулы I с понижающим уровень липидов в крови биологически активным веществом, предпочтительно с ингибитором СоА-редуктазы человеческого менопаузального гонадотропина (например, повастатин или правастатин), причем последний придает гиполипидемическое действие и благодаря этому повышает липодемические свойства ингибитора NНЕ формулы I, оказалась благоприятной комбинацией с усиленным действием и потреблением меньшего количества биологически активного вещества.
Поэтому настоящее изобретение также относится к применению ингибиторов натрийпротонного обмена формулы I в качестве лекарственных средств для снижения повышенного уровня жира в крови, а также ингибиторов натрийпротонного обмена в комбинации с понижающими кровяное давление и/или оказывающими гиполипидемическое действие лекарственными средствами.
Лекарства, которые содержат соединение формулы I, могут вводиться при этом орально, парентерально, внутривенно, ректально или путем ингаляции, причем предпочтительный способ введения зависит от соответствующей клинической картины заболевания. Соединения формулы I могут при этом применяться отдельно или вместе с галеновыми вспомогательными веществами, а именно, как в ветеринарной, так и в человеческой медицине.
Какие вспомогательные вещества пригодны для желательной препаративной формы лекарственного средства, специалисту ясно, благодаря его специальным знаниям. Наряду с растворителями, гелеобразователями, суппозиторными основами, вспомогательными веществами для получения таблеток и другими носителями биологически активных веществ, могут использоваться также антиоксиданты, диспергирующие средства, эмульгаторы, пеногасители, корректоры вкусовых качеств, консервирующие средства, агенты растворения или красители.
Для оральной формы применения активные соединения смешивают с соответствующими пригодными для этой цели добавками, как, например, носители, стабилизаторы или инертные разбавители, и с помощью обычных способов приводят в соответствующую форму введения, как, например, таблетки, драже, разъемные капсулы с лекарством, водные, спиртовые или масляные растворы. В качестве инертных носителей могут использоваться, например, гуммиарабик, магнезия, карбонат магния, фосфат калия, лактоза, глюкоза или крахмал, в частности, кукурузный крахмал. При этом изготовление может осуществляться как в виде сухого гранулята, так и в виде влажного гранулята. В качестве масляных носителей или растворителей могут рассматриваться, например, растительные или животные масла, как, например, подсолнечное масло или рыбий жир.
Для подкожного или внутривенного вливания активные соединения, при желании, вместе с обычными для этого веществами, как, например, агенты растворения, эмульгаторы или другие вспомогательные вещества, растворяют, суспендируют или эмульгируют. В качестве растворителей могут рассматриваться, например, вода, физиологический соляной раствор или спирты, например, этанол, пропанол, глицерин, наряду с этим также растворы сакаров, как, например, растворы глюкозы или маннита, или также смесь из различных перечисленных растворителей.
В качестве фармацевтической препаративной формы для введения в виде аэрозолей или спреев годятся, например, растворы, суспензии или эмульсии биологически активного вещества формулы I в фармацевтически приемлемом растворителе, как, например, этанол или вода или смеси этих растворителей.
Препаративная форма может при необходимости содержать также еще и другие фармацевтические вспомогательные вещества, как, например, поверхностно-активные вещества, эмульгаторы и стабилизаторы, а также рабочий газ. Такая композиция содержит обычно биологически активное вещество в концентрации примерно от 0,1 до 10, в частности, от примерно 0,3 до 3 мас.%.
Дозировка вводимого биологически активного вещества формулы I и частота приема зависят от эффективности и продолжительности воздействия используемых соединений; кроме того, от рода и интенсивности подвергаемой лечению болезни, а также от пола, веса и индивидуальной чувствительности по отношению к нему млекопитающего, подлежащего лечению.
В среднем ежедневная доза соединения формулы I для пациента весом примерно 75 кг составляет, по меньшей мере, 0,001 мг/кг веса тела, предпочтительно 0,01 мг/кг, до, самое большое, 10 мг/кг, предпочтительно 1 мг/кг веса тела. При острых проявлениях болезни, например, непосредственно после перенесения сердечного инфаркта, могут потребоваться также более высокие и, прежде всего, более частые дозировки, например, до 4 разовых доз в день. В частности, при внутривенном применении, например, пациенту с инфарктом, находящемуся в отделении интенсивной терапии, могут потребоваться до 200 мг/кг в день.
Экспериментальная часть
Список сокращений
CDI - карбонилдиимидазол, ДМФ - N,N-диметилформамид, КТ - комнатная температура, т.пл. - точка плавления, FC - флэшхроматография, ТГФ - тетрагидрофуран, экв. - эквивалент, ЕЕ - этилацетат (EtOAc).
Общие методики получения нафтоилгуанидинов формулы (I)
Вариант 1А: из нафтойных кислот (II, L=OH)
1,0 экв. производного нафтойной кислоты формулы II растворяют или суспендируют в безводном ТГФ (5 мл/ммоль) и смешивают затем с 1,2 экв. карбонилдиимидазола. После перемешивания в течение 2 часов при комнатной температуре в реакционный раствор вводят 5,0 экв. гуанидина. После перемешивания в течение ночи отгоняют ТГФ при пониженном давлении (в ротационном испарителе), смешивают с водой и отфильтровывают соответствующий гуанидид (формула I). Полученные таким образом гуанидины карбоновой кислоты можно переводить в соответствующие соли путем обработки водным, метанольным или эфирным раствором соляной кислоты или других фармакологически совместимых кислот.
Вариант 1В: из алкиловых эфиров нафтойной кислоты (II, L=O-алкил)
1,0 экв. алкилового эфира карбоновой кислоты формулы II, а также 5,0 экв. гуанидина (свободное основание) растворяют или суспендируют в изопропаноле или в ТГФ и кипятят с обратным холодильником вплоть до полного превращения (контроль с помощью тонкослойной хроматографии) (типичное время реакции от 2 до 5 часов). Растворитель отгоняют при пониженном давлении (в ротационном испарителе), осадок помещают в этилацетат и промывают трижды раствором NаНСО3. Высушивают над Na2SO4, растворитель отгоняют в вакууме и хроматографируют на силикагеле с помощью соответствующего рабочего средства, например смеси этилацетата с метанолом ЕЕ/МеОН 5:1. (Образование соли см. вариант А).
Пример 1. Дигидрохлорид 6-(2-диметиламиноэтокси)-2-нафтоилгуанидина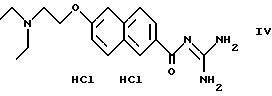
а) 6-гидрокси-2-нафтойную кислоту нагревают в безводном метаноле, который вначале насыщают газообразным НCl, в течение 2 ч, с обратным холодильником. Концентрируют, осадок подвергают перекристаллизации по 1 разу из метанола и из ацетона и получают метиловый эфир 6-гидрокси-2-нафтойной кислоты.
б) 3,2 г метилового эфира 6-гидрокси-2-нафтойной кислоты и 1,28 г метилата натрия смешивают с 50 мл ДМФ в течение 20 мин при 40oС под азотом. Затем добавляют 3,65 г диэтиламиноэтилхлорида и пермешивают еще 2 ч при 40oС. ДМФ отгоняют в ротационном испарителе, осадок погружают в разбавленную соляную кислоту и экстрагируют с помощью этилацетата. Водную фазу подщелачивают раствором едкого натра и снова экстрагируют с помощью этилацетата. После концентрирования этого экстракта получают 2,7 г метилового эфира 6-(2-диэтиламиноэтокси)-2-нафтойной кислоты.
в) 3.1 г метилового эфира 6-(2-диэтиламиноэтокси)-2-нафтойной кислоты и 1,2 г КОН растворяют в 20 мл метанола и нагревают при перемешивании в течение 3 ч. После отгонки метанола осадок растворяют в 20 мл воды и с помощью 10%-ной соляной кислоты доводят до рН 2,5. Выпавший осадок отсасывают и получают 2.7 г 6-(2-диэтиламиноэтокси)-2-нафтойной кислоты.
г) К суспензии из 1.0 г 6-(2-диэтиламиноэтокси)-2-нафтойной кислоты в 20 мл ДМФ добавляют 0,79 г карбонилдиимидазола и реакционную смесь перемешивают в течение ночи при комнатной температуре. Затем смешивают с 1,0 г гуанидина, снова перемешивают в течение ночи, концентрируют и перемешивают остаток с 20 мл воды. Образованный осадок отсасывают, суспендируют в эфире и после добавки эфирной соляной кислоты еще перемешивают в течение 3 часов. После отсасывания получают 0,9 г дигидрохлорида-6-(2-диэтиламиноэтокси)-2-нафтоилгуанидина; Т.пл.: 225oС.
1Н-ЯМР (дейтерированный диметилсульфоксид /ДМСО/): δ в ppm (миллионные доли)= 1,3(6Н), 3,25(4Н), 3,6(2Н), 4,55(2Н), 7,4(1Н), 7,55(1Н), 8,05(2Н), 8,15(1Н), 8,65(2Н), 8,9(2Н), 8,95(1Н), 10,5(1Н), 12,3(1Н).
Пример 2. Дигидрохлорид 6-(2-диизопропиламиноэтокси)-2-нафтоилгуанидина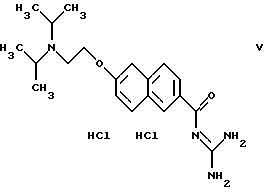
а) Из 3,2 г метилового эфира 6-гидрокси-2-нафтойной кислоты и 4,4 г диизопропиламиноэтилхлорида (полученного из гидрохлорида с помощью раствора едкого натра и экстракции с помощью простого эфира), аналогично примеру 1б, получают 4,2 г метилового эфира 6-(2-диизопропиламиноэтокси)-2-нафтойной кислоты.
б) 3,6 г метилового эфира 6-(2-диизопропиламиноэтокси)-2-нафтойной кислоты и 1,8 г КОН нагревают в метаноле в течение 5 ч с обратным холодильником. После концентрирования и
погружения в воду подкисляют соляной кислотой до рН 6, при этом продукт выпадает в осадок. Получают 3,3 г 6-(2-диизопропиламиноэтокси)-2-нафтойной кислоты. Т.пл.: 183-184oС.
в) 3,3 г 6-(2-диизопропиламиноэтокси)-2-нафтойной кислоты и 3,1 г карбонилдиимидазола суспендируют в ТГФ и перемешивают в течение ночи. После добавки 3.2 г гуанидина продолжают перемешивать еще 4 ч при комнатной температуре, растворитель отгоняют и остаток заливают до 170 мл водой. Выпавший в осадок продукт отсасывают, растворяют в 150 мл метанола и 50 мл этилацетата и перемешивают с избыточным количеством эфирной cоляной кислоты. Получают 1,8 г дигидрохлорида 6-(2-диизопропиламиноэтокси)-2-нафтоилгуанидина. Т.пл.: 259-260oС.
1Н ЯМР (дейтерированный диметилсульфоксид (ДМСО): δ в ррm (миллионные доли)= 1,5(12Н), 3,7(2Н), 3,9(2Н), 4,7(2Н), 7,5(1Н), 7,6(1Н), 8,(2Н), 8,3(1Н), 8,8(2Н), 9,0(2Н), 9,1(1Н), 9,9(1Н), 12,5(1Н).
Пример 3. Дигидрохлорид 6-[2-(4-морфолинил)этокси]-2-нафтоилгуанидина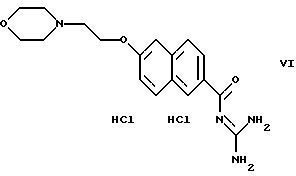
a) 6,4 г метилового эфира 6-гидрокси-2-нафтойной кислоты и 2,56 г метилата натрия перемешивают в 100 мл ДМФ в течение 30 мин при 40oC в атмосфере азота. Затем добавляют 8,04 г N-(2-хлорэтил)-морфолина и перемешивают при 80oС. Реакционную смесь выливают в воду и отсасывают выпавший осадок. Получают 9,2 г метилового эфира 6-[2-(4-морфолинил) этокси]-2-на-фтойной кислоты.
б) Путем омыления метилового эфира 6-(2-(4-морфолинил)-этокси)-2-нафтойной кислоты, аналогично примеру 1в, и последующего взаимодействия с карбонилдиимидазолом и гуанидином, в соответствии с общей методикой, вариант 1а, получают дигидрохлорид 6-[2-(4-морфолинил) этокси]-2-нафтоилгуанидина. Т.пл. 254-256oС.
Пример 4. Дигидрохлорид 6-(гуанидинокарбонилметокси)-2-нафтоилгуанидина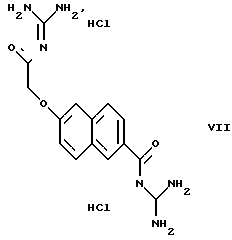
а) 3,2 г метилового эфира 6-гидрокси-2-нафтойной кислоты и 1,28 г метилата натрия размешивают в 50 мл ДМФ в течение 15 мин при 40oС в атмосфере азота. Затем добавляют 4,1 г метилового эфира бромоуксусной кислоты и перемешивают 6 ч при 70oС. Реакционную смесь выливают в 100 мл воды и отсасывают выпавший осадок, и подвергают перекристаллизации из изопропанола. Получают 2,3 г метилового эфира 6-(метоксикарбонилметокси)-2-нафтойной кислоты. Т.пл.: 138-139oС.
б) 2,3 г метилового эфира 6-(метоксикарбонилметокси)-2-нафтойной кислоты и 2,3 г КОН нагревают в 100 мл воды и 10 мл ДМФ в течение 3 ч с обратным холодильником. Затем с помощью соляной кислоты подкисляют до рН 0,3 и выпавший осадок отсасывают при комнатной температуре. Получают 1,7 г метилового эфира 6-(карбоксиметокси)-2-нафтойной кислоты. Т.пл.: >285oС.
в) 1.7 г метилового эфира 6-(карбоксиметокси)-2-нафтойной кислоты и 3,1 г карбонилдиимидазола растворяют в 50 мл ДМФ и перемешивают в течение ночи при комнатной температуре. После добавления 2,85 г гуанидина снова производят перемешивание в течение ночи при комнатной температуре, растворитель отгоняют в вакууме и осадок смешивают с водой. Образующийся осадок отсасывают, растворяют в метаноле и смешивают со смесью этилацетата с НCl. Получают 1,5 г дигидрохлорида 6-(гуа-нидинокарбонилметокси)-2-нафтоилгуанидина. Т. пл.: 264-265oС.
1Н ЯМР (дейтерированный диметилсульфоксид ДМСО): δ в ррm (миллионные доли)=5.0(2Н), 7.5-8.1(5Н), 8.4-8.8(8Н), 8.9(1Н), 11,7(1Н), 12.2(1Н).
Пример 5. Дигидрохлорид 6-(3-пиридилметиламинокарбонид)-2-нафтоилгуанидина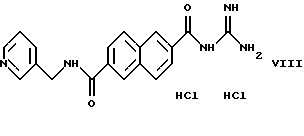
а) 4,9 г метилового эфира нафталин-2,6-дикарбоновой кислоты и 0.7 г КОН растворяют в 150 мл метиленхлорида и 30 мл метанола и перемешивают в течение ночи при комнатной температуре. Выпавшую в осадок калиевую соль отсасывают, растворяют в воде и подкисляют с помощью соляной кислоты. После отсасывания осадка получают 2,55 г монометилового эфира нафталин-2,6-дикарбоновой кислоты.
б) 2,07 г монометилового эфира нафталин-2,6-дикарбоновой кислоты и 1,62 г карбонилдиимидазола перемешивают в 25 мл ДМФ в течение ночи при комнатной температуре. Затем добавляют 1,08 г 3-пиколиламина, перемешивают еще в течение 3 ч, концентрируют и остаток перемешивают с водой. Выпавший в осадок продукт отсасывают и получают 1,35 г N-(3-пиридилметил)-амида 6-метоксикарбонил-нафталин-2-карбоновой кислоты.
в) 1,2 г N-(3-пиридилметил)-амида 6-метоксикарбонил-нафталин-2-карбоновой кислоты и 0,5 г КОН суспендируют в 25 мл метанола и перемешивают в течение 4 дней при комнатной температуре. Концентрируют в ротационном испарителе, перемешивают с 20 мл метиленхлорида, отсасывают осадок и растворяют его в 20 мл воды. После подкисления до рН 6,2 продукт выпадает в осадок и получают 0,8 г N-(3-пиридилметил)-амида карбокси-нафталин-2-карбоновой кислоты. Т.пл.: >250oС.
г) 0,75 г N-(3-пиридилметил)-амида 6-карбокси-нафталин-2-карбоновой кислоты, аналогично примеру 1, смешивают с карбонилдиимидазолом и гуанидином. Получают 0,5 г дигидрохлорида 6-(3-пиридилметиламинокарбонил)-2-нафтоилгуанидина. Т.пл.: 285oС.
1H ЯМР (дейтерированный диметилсульфоксид (ДМСО); δ в ppm=4,75(2Н), 7,95(2Н), 8,15(4Н), 8,45(1Н), 8,55-9,0(7Н), 9,65(1Н), 12,4(1Н).
Пример 6. Дигидрохлорид 6-[2-(гуанидинокарбонилокси)-этиламинокарбонил} -2-нафтоилгуанидина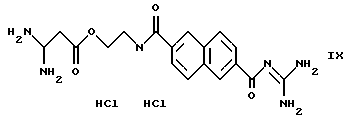
а) 2,1 г метилового эфира нафталин-2,6-дикарбоновой кислоты и 25 мл этаноламина нагревают в течение 3 ч до 150oС. Избыточный этаноламин отгоняют в вакууме и остаток растворяют в воде и экстрагируют с помощью этилацетата. После подкисления водной фазы выпавший в осадок продукт отсасывают и подвергают перекристаллизации из этанола. Получают 1,2 г 6-(2--гид-роксиэтиламинокарбонил)-2-нафтойной кислоты.
б) 1,2 г 6-(2-гидроксиэтиламинокарбонил)-2-нафтойной кислоты и 1,9 г карбонилдиимидазола растворяют в 13 мл ДМФ и перемешивают в течение ночи. Добавляют 2,2 г гуанидина, вновь перемешивают в течение ночи, концентрируют, смешивают с водой и отфильтровывают выпавший осадок. Получают 0,94 г 6-2-(гуанидинокарбонилокси)этиламинокарбонил] -2-нафтоилгуанидина. Т.пл.: 205oС. Путем растворения в разбавленной 2-молярной соляной кислоте и последующей сушки вымораживанием получают соответствующий дигидрохлорид. Т.пл.: около 270oС.
Пример 7: Дигидрохлорид 6-{2-[4-(4-хлорфенил)-1-пиперазинил]этокси}-2-нафтоилгуанидина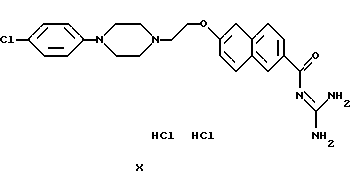
а) 2.11 г метилового эфира 6-гидрокси-2-нафтойной кислоты и 0,84 г метилата натрия перемешивают в 50 мл ДМФ в течение 30 мин. при 40oС в атмосфере азота. Затем добавляют 4,6 г 4-(п-хлорфенил)-пиперазиноэтилхлорида и перемешивают 8 ч при 40oС. Реакционную смесь разбавляют 350 мл метанола и отсасывают выпавший осадок. Растворяют в 80 мл ДМФ и 10 мл воды, смешивают с 3,8 г КОН и перемешивают в течение 10 ч при 100oС. ДМФ удаляют в ротационном испарителе, остаток выливают в воду, подкисляют и выпавший осадок отсасывают. Получают 2,5 г 6-{2-[4-(4-хлорфенил)-1-пиперазинил]-этокси}-2-нафтойной кислоты. Т.пл.: 197-199oС.
б) 2,4 г 6-{2-[4-(4-хлорфенил)-1-пиперазинил]-этокси}-2-нафтойной кислоты, в соответствии с общими методиками (вариант 1а) смешивают с карбонилдиимидазолом и гуанидином. Получают 1,4 г дигидрохлорида 6-{2-[4-(4-хлорфенил)-1-пиперази-нил]-этокси}-2-нафтоилгуанидина. Т.пл.: 269-271oС.
1Н-ЯМР (дейтерированный диметилсульфоксид (ДМСО)): δ в ррm=3,3(4Н), 3,7(4Н), 3,9(2Н), 4,7(2Н), 7,0(2Н), 7,3(2Н). 7,4(2Н), 7,6(2Н), 8,0(2Н), 8,2(1Н). 8,6(2Н), 8,0(3Н), 11,4 (1Н), 12,3(1Н).
Пример 8. Дигидрохлорид 4-диэтиламиноэтилокси-6-метокси-1-метил-2-нафтоилгуанидин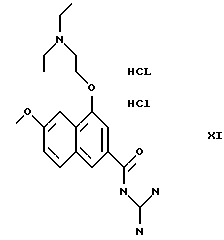
а) К раствору 11,2 г (0.1 моль) калий-трет.бутанолята в 100 мл третичного бутанола добавляют каплями при 70oС смесь из 15 г (0.1 моль) п-метоксиацетофенона и 29 г (0.2 моль) метилового эфира янтарной кислоты, растворенного в 100 мл третичного бутанола. Нагревают еще 4 ч до 70oС, затем реакционную смесь концентрируют, смешивают с водой и экстрагируют дважды с этилацетатом, а экстракт сушат над МgSO4 и в вакууме. Остаток (21 г) нагревают с 6,2 г (0.08 моль) ацетата натрия в 120 мл ацетангидрида в течение 4 ч с обратным холодильником. Производят концентрирование в вакууме, смешивают с водой, экстрагируют этилацетатом и промывают раствором соды. После концентрирования органической фазы и очистки с помощью хроматографии при среднем давлении получают 8.0 г метилового эфира 4-ацетокси-6-метокси-1-метил-2-нафтойной кислоты,
б) 7,5 г (26 ммоль) метилового эфира 4-ацетокси-6-метокси-1-метил-2-нафтойной кислоты перемешивают с 9,4 г (52 ммоль) 30%-ного раствора метанолята натрия в течение 30 мин при комнатной температуре. Концентрируют, подкисляют разбавленной соляной кислотой и экстрагируют этилацетатом. После сушки органической фазы над MgSO4 и концентрирования в вакууме получают 4,1 г метилового эфира 4-гидрокси-6-метокси-1-метил-2-нафтойной кислоты.
в) 1,5 г (6,1 ммоль) метилового эфира 4-гидрокси-6-метокси-1-метил-2-нафтойной кислоты и 0,49 г (9,1 ммоль) в ДМФ перемешивают в течение 15 мин при 40oС под аргоном. Затем добавляют 1,4 г диэтиламиноэтилхлорида и перемешивают 30 мин при 40oС. ДМФ отгоняют с помощью ротационного испарителя, остаток погружают в разбавленную соляную кислоту и экстрагируют этилацетатом. Водную фазу подщелачивают раствором едкого натра и снова экстрагируют этилацетатом. После концентрирования этого экстракта получают 1,8 г сырого метилового эфира 4-диэтиламиноэтилокси-6-метокси-1-метил-2-нафтойной кислоты, который путем 2-часового кипячения с 1 г КОН в 20 мл метанола омыляют непосредственно в кислоту. После концентрирования реакционной смеси остаток растворяют в 20 мл воды и подкисляют концентрированной соляной кислотой до рН 5.5, при этом продукт выпадает в осадок. Получают 0,5 г 4-диэтиламиноэтилокси-6-метокси-1-метил-2-нафтойной кислоты. Т.пл.: 170oС.
г) К суспензии 0,5 г диэтиламиноэтокси-6-метокси-1-метил-2-нафтойной кислоты в 18 мл ТГФ добавляют 0,35 г карбонилдиими-дазола и полученный раствор перемешивают 4 ч при комнатной температуре. Затем добавляют 0,44 г гуанидина; дополнительно перемешивают еще 1.5 ч, концентрируют и остаток смешивают с водой. Выпавший в осадок продукт отсасывают и получают 0,23 г 4-диэтиламиноэтилокси-6-метокси-1-метил-2-нафтоилгуанидина. Т.пл.: 135oС, который можно перевести с помощью эфирной соляной кислоты в дигидрохлорид. Т.пл.: 235oС.
Фармакологические данные
Ингибирование обмена Na+/H+ в эритроцитах кроликов:
Белые новозеландские кролики (Иванова) получали стандартную диету с 2% холестерина в течение 6 недель, чтобы активировать обмен Na+/H+ и чтобы таким образом можно было определить пламеннофотометрическим методом приток Na+ в эритроциты через обмен Na+/H+. Кровь отбирали из ушных артерий и с помощью 25 IE/мл калий-гепарина придавали ей свойства несвертываемости. Часть каждой пробы использовали для двойного определения гематокрита путем центрифугирования. Аликвоты по 100 мкл служили для измерения исходного содержания Na+ в эритроцитах.
Для того, чтобы определить чувствительный к амилориду приток натрия, по 100 μl каждой пробы крови инкубировали в каждом случае в 5 мл гиперосмолярной, включающей соль с сахаром, среде (ммоль/л: 140 NaCl, 3 KCl, 150 сахарозы, 0.1 уабаина, 20 тригидроксиметиламинометана) при рН 7.4 и 37oС. Эритроциты затем трижды промывали охлажденным льдом раствором МgдCl2 с уабаином (ммоль/л: 112 MgCl2, 0/1 уабаина) и гемолизировали в 2,0 мл дистиллированной воды. Внутриклеточное содержание натрия определяли с помощью пламенной фотометрии.
Чистый приток Na+ определяли из разности между исходными значениями содержания Na и содержанием натрия в эритроцитах после инкубирования. Ингибируемый с помощью амилорида приток натрия получался из разницы в содержании натрия в эритроцитах после инкубирования с амилоридом и без амилорида 3 х 10-4 ммоль/л. Таким же образом проводили эксперимент с соединениями согласно изобретению (см таблицу).
| название | год | авторы | номер документа |
|---|---|---|---|
| ЗАМЕЩЕННЫЕ 1-НАФТОИЛГУАНИДИНЫ И ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ИХ ОСНОВЕ | 1997 |
|
RU2182901C2 |
| ЗАМЕЩЕННЫЕ БЕНЗИЛОКСИКАРБОНИЛГУАНИДИНЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И СРЕДСТВО, ИНГИБИРУЮЩЕЕ NA/H-ОБМЕН | 1996 |
|
RU2188191C2 |
| ОРТОЗАМЕЩЕННЫЕ БЕНЗОИЛГУАНИДИНЫ И ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ИХ ОСНОВЕ | 1997 |
|
RU2193025C2 |
| ЗАМЕЩЕННЫЕ ГУАНИДИДЫ ТИОФЕНИЛАЛКЕНИЛКАРБОНОВОЙ КИСЛОТЫ И ЛЕКАРСТВЕННОЕ СРЕДСТВО | 1997 |
|
RU2193033C2 |
| ЗАМЕЩЕННЫЕ ГУАНИДИДЫ КОРИЧНОЙ КИСЛОТЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1996 |
|
RU2190601C2 |
| ИМИДАЗО-АННЕЛИРОВАННЫЕ ИЗО- И ГЕТЕРОЦИКЛЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1992 |
|
RU2076105C1 |
| ФЕНИЛЗАМЕЩЕННЫЕ ГУАНИДИДЫ АЛКЕНИЛКАРБОНОВОЙ КИСЛОТЫ И ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ИХ ОСНОВЕ | 1997 |
|
RU2193026C2 |
| ИНДЕНОИЛГУАНИДИН, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЛЕКАРСТВЕННОЕ СРЕДСТВО | 1996 |
|
RU2182902C2 |
| ЗАМЕЩЕННЫЕ АЗОЛЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1991 |
|
RU2047604C1 |
| НОВЫЕ ЦИКЛОАЛКИЛЬНЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ РЕЗОРБЦИИ КОСТИ И АНТАГОНИСТОВ РЕЦЕПТОРА ВИТРОНЕКТИНА | 1997 |
|
RU2180331C2 |

Изобретение относится к соединениям формулы (I), где R1, R3-R8 означает XYaWZ или X'YaWZ', где Х - О; Y - алкилен с 1-4 атомами СН2, а = 0, W - СН2 или, если W не следует непосредственно за гетероатомом группы ХYа, то также О; Z - это -C(=O)R(15) или, если W не означает О, также NR(16)R(17); R(15) - это -N=C(NH2)2, R(16) и R(17) - водород или алкил или R(16) и R(17) означают вместе 4 или 5 метиленовых групп, из которых одна СН2-группа может быть заменена кислородом или N-(п-хлорфенилом); X' - это -C(=O)NR(30); Z' означает -C(= O)R(15), N-содержащий гетероцикл с 1-5 С-атомами, причем N-содержащий гетероцикл связан через С; другие R1, R3-R8, которые не подпадают под приведенные выше значения, независимо друг от друга означают VpQqU, где V - O, р=0 или 1, q=0, U - водород, алкил, причем один из заместителей R5-R8 не являются водородом. Указанные соединения обладают ингибирующей активностью в отношении Na+/H+-обмена и поэтому могут использоваться в качестве активно действующего вещества в лекарственном средстве для лечения различных заболеваний, связанных с вышепоказанным свойством этих соединений. 2 с. и 8 з.п. ф-лы, 1 табл.
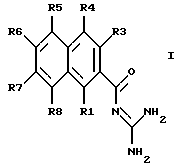
где по меньшей мере один из заместителей R1, R3 - R8 означает XYaWZ или Х'YaWZ', где Х - О; Y - алкилен с 1, 2, 3 или 4 группами СН2; а = 0 или 1; W - СН2 или, если W не следует непосредственно за гетероатомом группы XYa, то также О, Z - C/=O/R(15) или, если W не означает О, также NR(16)R(17), где R(15) - N = C(NH2)2; R(16) и R(17) независимо друг от друга, означают Н, алкил с 1, 2, 3 или 4 С-атомами или R16 и R17 означают вместе 4 или 5 метиленовых групп, из которых одна СН2-группа может быть заменена кислородом или N-(п-хлорфенилом), X' - С/=O/NR30, где R30 - Н, алкил с 1, 2, 3 или 4 С-атомами; Z' - C(=O)R15, N-содержащий гетероцикл с 1, 2, 3, 4 или 5 С-атомами, причем N-содержащий гетероцикл связан через С; R(15) - N = C(NH2)2,
и соответственно остальные заместители R1, R3 - R8, которые еще не подпадают под приведенные выше значения, независимо друг от друга, означают VpQqU, где V - О; р = 0 или 1; q = 0; U - Н, алкил с 1, 2, 3 или 4 С-атомами, причем по меньшей мере один из заместителей R5, R6, R7 и R8 не являются водородом,
а также их фармацевтически приемлемые соли.
| Фунгицид | 1972 |
|
SU847893A3 |
| DE 4318658 A1, 08.12.1994. | |||
Авторы
Даты
2002-10-10—Публикация
1997-05-28—Подача