Изобретение относится к замешенным гуанидидам коричной кислоты формулы (I):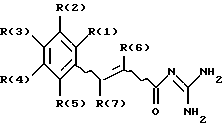 (I)
(I)
где по меньшей мере один из заместителей R(1), R(2), R(3), R(4) и R(5) обозначает -Хa - Уб - Ln -U, где
Х обозначает СR(16)R(17), О, S или NR(18);
R(16), R(17) и R(18) независимо друг от друга обозначают Н, алкил с 1, 2, 3 или 4 С-атомами или перфторалкил с 1, 2, 3 или 4 С-атомами;
а = 0 или 1;
У обозначает алкилен с 1, 2, 3, 4, 5, 6, 7 или 8 С-атомами, алкилен-Т с 1, 2, 3, 4, 5, 6, 7 или 8 С-атомами в алкиленовой группе;
Т, Т - алкилен с 1, 2, 3, 4, 5, 6, 7 или 8 С-атомами в алкиленовой группе; где Т обозначает NR(20), O, S или фенилен, причем фенилен не замещен или замещен 1-3-мя заместителями, выбираемыми из группы, состоящей из F, Cl, CF3, метила, метокси-группы и NR(21) R(22); где R(20), R(21) и R(22) независимо друг от друга обозначают Н, алкил с 1, 2, 3 или 4 С-атомами; или перфторалкил с 1, 2, 3 или 4 С-атомами; б = 0 или 1;
L обозначает О, S, NR(23) или СкН2к; где
к = 1, 2, 3, 4, 5, 6, 7, 8;
n = 0 или 1;
U обозначает NR(24)R(25) или N-содержащий гетероцикл с 1, 2, 3, 4, 5, 6, 7, 8 или 9 С-атомами;
R(24) и R(25) независимо друг от друга, обозначают водород, алкил с 1, 2, 3, 4, 5, 6, 7 или 8 С-атомами, перфторалкил с 1, 2, 3, 4, 5, 6, 7 или 8 С-атомами;
или
R(24) и R(25) обозначают вместе 4 или 5 метиленовых групп, из которых одна СН2-группа может быть заменена кислородом, S, NH, N-СН3 или N-бензилом;
причем N-содержащие гетероциклы соединены мостиком через N или С и не замещены или замещены 1-3-мя заместителями, выбираемыми из группы, состоящей из F, Cl, CF3, метила, метокси-группы и N R(27) R(28); причем
R(23) R(27) и R(28) независимо друг от друга обозначают Н, алкил с 1, 2, 3 или 4 С-атомами или перфторалкил с 1, 2, 3 или 4 С-атомами;
каждый другой заместитель R(1), R(2), R(3), R(4) и R(5) независимо друг от друга обозначает Н, F, Cl, Br, I, CN; -On-Cm-H2m+1; -Ор-(CH2)-CqF2q+1 или CrH2rR (10),
где
n = 0 или 1;
m = 0, 1, 2, 3, 4, 5, 6, 7 или 8;
р = 0 или 1;
q = 1, 2, 3, 4, 5, 6, 7 или 8;
s = 0, 1, 2, 3 или 4;
r = 0, 1, 2, 3 или 4;
R(10) обозначает циклоалкил с 3, 4, 5, 6, 7 или 8 С-атомами или фенил, причем фенил не замещен или замещен 1-3-мя заместителями, выбираемыми из группы, состоящей из F, Cl, CF3, метила, метокси-группы и HR(11) R(12), где R(11) и R(12) независимо друг от друга обозначают Н, алкил с 1, 2, 3 или 4 С-атомами или перфторалкил с 1, 2, 3 или 4 С-атомами;
R(6) и R(7) независимо друг от друга обозначают водород, F, Cl, Br, I, CN, алкил с 1, 2, 3, 4, 5, 6, 7 или 8 С-атомами, перфторалкил с 1, 2, 3, 4, 5, 6, 7 или 8 С-атомами, циклоалкил с 3, 4, 5, 6, 7 или 8 С-атомами или фенил, который не замещен или замещен 1-3-мя заместителями, выбираемыми из группы, состоящей из F, Cl, CF3, метила, метокси-группы и NR(14) R(15), причем
R(14) и R(15) независимо друг от друга обозначают Н, алкил с 1, 2, 3 или 4 С-атомами или перфторалкил с 1, 2, 3 или 4 С-атомами;
а также к их фармацевтически приемлемым солям.
Предпочтительны соединения формулы (I), в которых:
по меньшей мере один из заместителей R(1), R(2), R(3), R(4) и R(5) обозначает -Хa-Уб-Ln-U; где X обозначает CR(16) R(17), О, S или HR(18), причем
R(16), R(17) и R(18) независимо друг от друга обозначают Н, СН3 или CF3;
а = 0 или 1;
У обозначает алкилен с 1, 2, 3, 4, 5, 6, 7 или 8 С-атомами, алкилен-Т с 1, 2, 3, 4, 5, 6, 7 или 8 С-атомами в алкиленовой группе;
Т, Т - алкилен с 1, 2, 3, 4, 5, 6, 7 или 8 С-атомами в алкиленовой группе;
Т обозначает NR(20), О, S или фенилен, причем фенилен не замещен или замещен 1-3-мя заместителями, выбираемыми из группы, состоящей из F, Cl, CF3, метила, метокси-группы и NR(21) R(22); где
R(20), R(21) и R(22) независимо друг от друга обозначают Н, СН3 или CF3;
б = 0 или 1;
L обозначает О, S, NR(23) или СкН2к; где к = 1, 2, 3, 4, 5, 6, 7, 8;
n = 0 или 1;
обозначает NR(24) R(25) или Н-содержащий гетероцикл с 1, 2, 3, 4, 5, 6, 7, 8 или 9 С-атомами;
R(24) и R(25) независимо друг от друга обозначают водород, алкил с 1, 2, 3, 4, 5, 6, 7 или 8 С-атомами, перфторалкил с 1, 2, 3, 4, 5, 6, 7 или 8 С-атомами;
или
R(24) и R(25) обозначают вместе 4 или 5 метиленовых групп, из которых одна СН2-группа может быть заменена кислородом, S, NH, N-CH3 или N-бензилом;
причем N-содержащие гетероциклы соединены мостиком через N или С и не замещены или замещены 1-3-мя заместителями, выбираемыми из группы, состоящей из F, Cl, CF3, метила, метокси-группы и NR(27) R(28), причем R(23), R(27) и R(28) независимо друг от друга обозначают Н, СН3 или CF3; и каждый из других заместителей R(1), R(2), R(3), R(4) и R(5) независимо друг от друга обозначает Н, F, Cl, Br, I, CN; -On-Cm-H2m+1; -Ор-(CН2)s-CqF2q+1 или CrH2rR(10);
где
n = 0 или 1;
m = 0, 1, 2, 3 или 4;
р = 0;
q = 1, 2, 3, 4, 5, 6, 7 или 8;
s = 0;
r = 0, 1 или 2;
R(10) обозначает циклоалкил с 3, 4, 5, 6, 7 или 8 С-атомами или фенил, причем фенил не замещен или замещен 1-3-мя заместителями, выбираемыми из группы, состоящей из F, Cl, CF3, метила, метокси-группы и NR(11) R(12);
где
R(11) и R(12) независимо друг от друга обозначают Н, СН3 или CF3;
R(6) и R(7) независимо друг от друга обозначают водород, F, Cl, Br, I, CN, алкил с 1, 2, 3 или 4 С-атомами, перфторалкил с 1, 2, 3 или 4 С-атомами, циклоалкил с 3, 4, 5, 6, 7 или 8 С-атомами или фенил, который не замещен или замещен 1-3-мя заместителями, выбираемыми из группы, состоящей из F, Cl, CF3, метила, метокси-группы и NR(14) R(15),
где
R(14) и R(15) независимо друг от друга обозначают Н, СН или CF3;
а также их фармацевтически приемлемые соли.
Особенно предпочтительны соединения формулы (I), в которых: по меньшей мере один из заместителей R(2), R(3) и R(4) обозначает -Хa-Уб-Ln-U; где
Х обозначает CR(16)R(17), О, S или NR(18), причем R(16), R(17) и R(18) независимо друг от другa обозначают Н, СН3 или CF3;
а = 0 или 1;
У обозначает алкилен с 1, 2, 3, 4, 5, 6, 7 или 8 С-атомами, алкилен Т с 1, 2, 3, 4, 5, 6, 7 или 8 С-атомами в алкиленовой группе; Т, Т-алкилен с 1, 2, 3, 4, 5, 6, 7 или 8 С-атомами в алкиленовой группе;
Т обозначает NR(20), О, S или фенилен, причем фенилен не замещен или замещен 1-3-мя заместителями, выбираемыми из группы, состоящей из F, Cl, CF3 метила, метокси-группы и NR(21) R(22); причем R(20), R(21) и R(22) независимо друг от друга обозначают Н, СН3 или CF3;
б = 0 или 1;
L обозначает О, S, NR(23) или СкН2к, где
к = 1, 2, 3, 4, 5, 6, 7, 8;
n = 0 или 1;
U обозначает NR(24) R(25) или N-содержащий гетероцикл с 1, 2, 3, 4, 5, 6, 7, 8 или 9 С-атомами;
R(24) и R(25) независимо друг от друга обозначают водород, алкил с 1, 2, 3 или 4 С-атомами или CF3;
или
R(24) и R(25) обозначают вместе 4 или 5 метиленовых групп, из которых одна СН2-группа может быть заменена кислородом, S, NН, N-СН3 или Н-бензилом;
причем N-содержащие гетероциклы связаны мостиком через П- или С и не замещены или замещены 1-3-мя заместителями, выбираемыми из группы, состоящей из F, Cl, СF3, метила, метокси-группы и NR(27) R(28), причем
R(23), R(27) и R(28) независимо друг от друга обозначают Н, СН3 или CF3;
и каждый из других заместителей R(1), R(2), R(3), R(4) и R(5) независимо друг от друга обозначает Н, F, Cl, Br, I, CN; -On-Cm-H2m+1; или CF3; где
n = 0 или 1;
m = 0, 1, 2, 3 или 4;
R(6) и R(7) независимо друг от друга обозначают водород, Р, Cl, Br, I, СN, алкил с 1, 2, 3 или 4 С-атомами, CF3, циклоалкил с 5, 6 или 7 С-атомами или фенил, который не замещен 1-3-мя заместителями, выбираемыми из группы, состоящей из F, Cl, CF3, метила, метокси-группы и NR(14) R(15);
где R(14) и R(15) независимо друг от друга обозначают Н, СН3 или СF3;
а также их фармацевтически приемлемые соли.
В высшей степени предпочтительны соединения:
гуанидид Е-3-(4-диметиламинофенил)-2-метил-акриловой кислоты;
гуанидид Е-3-/4-(3-диметалминопропокси)фенил/-2-метил-акриловой кислоты;
гуанидид Е-3-/4-(3-пиридилокси)-3-трифторметил)фенил/-2-метил-акриловой кислоты;
гуанидид Е-3-/4-(4-пиридилтио)-3-(3-трифторметил)фенил/-2-метил-акриловой кислоты;
гуанидид Е-3-/3-циано-4-диметиламино-2-фтор-фенил)-2-метил-акриловой кислоты;
гуанидид Е-3-/4-(3-диметиламинопропокси)фенил/-2-фтор-акриловой кислоты;
гуанидид Е-3-/4-(4-(2-диметиламиноэтилен)фенокси)фенил/-2-метил-акриловой кислоты;
гуанидид Е-3/3,5-дифтор-4-(4-(2-диметиламиноэтилен)фенокси)фенил/-2-метил-акриловой кислоты;
гуанидид Е-3-/3,5-дифтор-4-(3-диметиламино-фенокси)фенил/-2-фтор-акриловой кислоты;
гуанидид Е-3-/3,5-дифтор-4-(3-диметиламинофенокси)фенил/-2-метил-акриловой кислоты;
гуанидид Е-3-/2,6-дифтор-4-(3-диметиламинофенокси)фенил/-2-метил-акриловой кислоты;
гуанидид Е-3-/2,4-дифтор-6-(3-диметиламинофенокси)фенил/-2-метил-акриловой кислоты,
а также их фармацевтически приемлемые соли.
Если соединения формулы (I) содержат один или несколько центров асимметрии, то они могут быть как в S-, так и в R-конфигурации. Соединения могут находиться в виде оптических изомеров, в виде диастереомеров, в виде рацематов или в виде их смесей.
Геометрия двойной связи соединений формулы (I) может быть как Е, так и Z. Соединения могут находиться в виде смеси изомеров по двойной связи.
Указанные алкильные остатки и перфторалкильные остатки могут быть как линейными, так и разветвленными.
В качестве N-содержащих гетероциклов с 1, 2, 3, 4, 5, 6, 7, 8 или 9 С-атомами имеют значение в особенности пирролил, имидазолил, пиразолил, триазолил, тетразолил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиридил, пиразинил, пиримидинил, пиридазинил, индолил, изоиндолил, бензимидазолил, индазолил, хинолил, изохинолил, фталазинил, хиноксалинил, хиназолинил, циннолинил.
Особенно предпочтительны N-содержащие гетероциклы пирролил, имидазолил, пиразолил, пиридил, пиразинил, пиримидинил и пиридазинил.
Изобретение относится, далее, к способу получения соединения формулы (I), отличающемуся тем, что соединение формулы (II):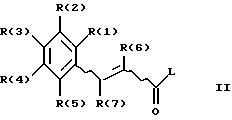
где R(1)-R(7) имеют указанное значение, а L обозначает легко нуклеофильно замещаемую удаляемую группу, вводят во взаимодействие с гуанидином.
Активированные производные кислоты формулы (II), где L обозначает алкокси-, предпочтительно метокси-группу, фенокси-группу, фенилтио-, метилтио-, 2-пиридилтио-группу, азотсодержащий гетероцикл, предпочтительно 1-имидазолил, получают предпочтительно само по себе известным образом из соответствующих хлорангидридов кислот (формула (II), L=C1), которые, со своей стороны, опять само по себе известным образом, можно получать из соответствующих карбоновых кислот (формула (II), L=ОН), например с помощью тионилхлорида.
Наряду с хлорангидридами карбоновых кислот формулы (II) (L=Cl) само по себе известным образом можно также получать другие активированные производные кислоты формулы (II) непосредственно из соответствующих производных бензойной кислоты (формула (II), L=ОН), как, например, сложные метиловые эфиры (II) с L=ОСН3 - путем обработки с помощью газообразного HCl в метаноле; имидазолиды формулы (II) - путем обработки с помощью карбонилдиимидазола [L= 1-имидазолил; Staab, Angew. Chem. Int. Ed. Engl. 1, 351-367 (1962)] ; смешанные ангидриды формулы (II) - с помощью Cl-COOC2H5 или тозилхлорида в присутствии триэтиламина в инертном растворителе, как также активированные производные бензойных кислот - с помощью дициклогексилкарбодиимида (ДЦК) или с помощью O-[(циано(этоксикарбонил)метилен)амино]-1,1,3,3-тетраметилуроний-тетрафторбората ("TOTU") [Proceeding of the 21. European Peptide Symposium, Peptides 1990, изд. Е. Giralt и D. Andreu, Escom, Leiden, 1994. Ряд пригодных способов получения активированных производных карбоновой кислоты формулы (II) приводится при указании литературных источников в J. March, Advanced Organic Chemistry, 3-е издание (John Wiley & Sons, 1985), с. 350.
Взаимодействие активированного производного карбоновой кислоты формулы (II) с гуанидином осуществляют само по себе известным образом в протонном или апротонном полярном инертном органическом растворителе. При этом взаимодействие метилового эфира бензойной кислоты (формула II), L=OCH3) с гуанидином осуществляют в метаноле, изопропаноле или ТГФ при температуре от 20oС до температуры кипения этого растворителя. В случае большинства взаимодействий соединений формулы (II) с не содержащим солей гуанидином предпочтительно работают в апротонных инертных растворителях, как ТГФ, диметоксиэтан, диоксан. Однако, при использовании основания, как, например, NаОН, можно применять также воду в качестве растворителя при взаимодействии соединения формулы (II) с гуанидином.
Когда L = Cl, предпочтительно работают при добавке улавливателя кислоты, например, в виде избыточного количества гуанидина, для связывания галогенводородной кислоты.
Часть соответствующих производных бензойной кислоты формулы (II) известна и описана в литературе. Неизвестные соединения формулы (II) можно получать согласно известным из литературы способам. Полученные алкенилкарбоновые кислоты, согласно одному из вышеописанных вариантов способа, можно превращать в предлагаемые согласно изобретению соединения формулы (I).
Введение некоторых заместителей осуществляют с помощью известных из литературы способов путем реакции перекрестного сочетания в присутствии палладия, арилгалогенидов, соответственно арилтрифлатов, например с оловоорганическими соединениями, борорганическими кислотами или органоборанами или медь-, соответственно цинкорганическими соединениями.
Гуанидиды карбоновых кислот формулы (I) в общем, являются слабыми основаниями и могут связывать кислоту с образованием солей. В качестве солей присоединения кислоты применяют соли всех фармакологически приемлемых кислот, например галогениды, в частности гидрохлориды, лактаты, сульфаты, цитраты, тартраты, ацетаты, фосфаты, метилсульфонаты, п-толуолсульфонаты.
Соединения формулы (I) представляют собой замещенные ацилгуанидины. Имеющим самое большое значение представителем ацилгуанидинов является производное пиразина амилорид, которое находит применение в терапии в качестве "сберегающего" калий диуретического средства. В литературе описываются многочисленные другие соединения типа амилорида, как, например, диметиламилорид или этилизопропиламилорид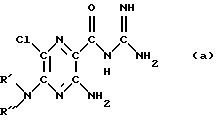
амилорид: R', R''=Н; диметиламилорид: R', R''=СН3; этилизопропиламилорид: R'=С2Н5; R''=СН(СН3)2
Сверх того, известны исследования, которые указывают на антиаритмические свойства амилорида [Circulation 79, 1257-1263, (1989)]. Широкому применению в качестве антиаритмического средства, однако, противостоит то, что этот эффект выражен только слабо и сопровождается понижающим кровяное давление и салуретическим действием и эти побочные действия нежелательны при лечении нарушений сердечного ритма. Указания на антиаритмические свойства амилорида получают также при экспериментах на изолированных сердцах животных [Eur. Heart J. 9 (дополнение 1): 167 (1988) (book of abstracts)]. Так, например, при экспериментах на сердцах крыс найдено, что искусственно вызванное мерцание желудочков сердца полностью подавляется амилоридом. Еще более сильнодействующим, чем амилорид, в этой модели является вышеупомянутое производное амилорида - этилизопропиламилорид.
Из ВОИС-84/00875 известны гуанидиды коричной кислоты (Ra и Rc соответственно, Rb и Rd = двойная связь; R(1) = замещенный фенил); однако они во всех случаях на гуанидине дополнительно замещены алкильными группами, вследствие чего они не проявляют никакого ПНЕ-ингибирования. Кроме того, не описывается или не предусматривается основной заместитель, как -Xa-Уb-Z.
Из патента США 734904 известны гуанидиды коричной кислоты (Р = замещенный фенил; алкил = алкенилен), однако также не описываются или не предусматриваются никакие основные заместители, как -Хa-Уb-Z.
В заявке на патент ФРГ Р 4421536.3 (НОЕ 94/F 168) предлагаются гуанидиды коричной кислоты (х=О, у=О), однако одним из заместителей R(1), R(2), R(4), R(5), R(С) или R(D) должна быть перфторалкильная группа; кроме того, эти соединения не содержат никакой основной -Хa-Уб-Ln-U- группы.
Известные и также предложенные соединения, однако, соответствуют не всем желательным требованиям; так, их водорастворимость оставляет еще желать лучшего (преимущество основной группы).
Кроме того, они еще не селективны в желательной степени. Поэтому желательны соединения с улучшенной водорастворимостью и селективностью. Этого достигают благодаря предлагаемым в изобретении соединениям, которые не обладают никакими нежелательными и отрицательными салуретическими, однако обладают очень хорошими антиаритмическими свойствами, которые, например, важны для лечения заболеваний, возникающих вследствие недостатка кислорода. Благодаря своим фармакологическим свойствам соединения исключительно пригодны в качестве лекарственных средств с кардиозащитным компонентом для профилактики инфаркта и лечения инфаркта, а также для лечения стенокардии, причем они также превентивно ингибируют или сильно уменьшают патофизиологические процессы при возникновении ишемически индуцированных нарушений, в особенности при возникновении ишемически индуцированных сердечных аритмий. Из-за своих защищающих действий против патологических гипоксических и ишемических ситуаций предлагаемые согласно изобретению соединения формулы (I) вследствие ингибирования клеточного механизма обмена Na+/H+ можно применять в качестве лекарственных средств для лечения любых острых или хронических вызываемых ишемией нарушений или индуцированных за счет этого первичных или вторичных заболеваний. Это относится к их применению в качестве лекарственных средств в случае оперативных вмешательств, например, при трансплантациях органов, причем соединения могут применяться как для защиты органов в доноре до и во время изъятия, для защиты изъятых органов, например, при обработке с помощью или при их хранении в физиологических жидкостях, так и при перенесении в организм реципиента. Соединения также представляют собой ценные, действующие как защитные лекарственные средства при осуществлении ангиопластических оперативных вмешательств, например, в случае сердца, как также в случае периферических сосудов. Соответственно их защитному действию против ишемически индуцированных нарушений, соединения также пригодны в качестве лекарственных средств для лечения ишемий нервной системы, в особенности центральной нервной системы, причем они пригодны, например, для лечения инсульта или отека мозга. Сверх того, предлагаемые согласно изобретению соединения формулы (I) также пригодны для лечений форм шока, например аллергического, кардиогенного, гиповолемического и бактериального шока.
Сверх того, предлагаемые согласно изобретению соединения формулы (I) отличаются сильным ингибирующим воздействием на пролиферации клеток, например пролиферацию фибробластовых клеток и пролиферацию клеток гладких мышц сосудов. Поэтому соединения формулы (I) применяют в качестве ценных терапевтических средств для заболеваний, при которых первичной или вторичной причиной является пролиферация клеток, и вследствие этого их можно применять в качестве средств против атерокслероза, средств против поздних диабетических осложнений, раковых заболеваний, фибротических заболеваний, как фиброз легких, фиброз печени или фиброз почек, гипертрофии органов и гиперплазии органов, в особенности при гиперплазии простаты, соответственно гипертрофии простаты.
Предлагаемые согласно изобретению соединения являются эффективными ингибиторами клеточного натрий-протонного антипорта (Na+/H+-обмен), который в случае многочисленных заболеваний (эссенциальная гипертония, атеросклероз, диабет и т.д.) также повышен в таких клетках, которые легко доступны для измерений, как, например, в эритроцитах, тромбоцитах или лейкоцитах. Предлагаемые согласно изобретению соединения поэтому пригодны в качестве исключительных и простых "научных инструментов", например, при их применении в качестве диагностических средств для определения и распознавания определенных форм гипертонии, однако также атеросклероза, диабета, пролиферативных заболеваний, и т.д. Сверх того, соединения формулы (I) пригодны для превентивной терапии с целью предотвращения генеза высокого кровяного давления, например эссенциальной гипертонии.
Лекарственные средства, которые содержат соединение формулы (1), при этом можно вводить орально, парентерально, внутривенно, ректально или путем ингаляции, причем предпочтительное применение зависит от соответствующей клинической картины заболевания. Соединения формулы (I) при этом могут применяться индивидуально или вместе с галеновыми вспомогательными веществами, а именно как в ветеринарии, так и также в медицине человека.
Какие вспомогательные вещества для получения необходимых лекарственных форм пригодны, специалисту известно на основании его специального знания. Наряду с растворителями, гелеобразующими агентами, основами свечей, вспомогательными веществами для таблеток и другими носителями биологически активных веществ можно применять, например, антиоксиданты, диспергаторы, эмульгаторы, антивспениватели, улучшающие вкус вещества, консерванты, агенты растворения или красители.
Для оральной формы применения, активные соединения смешивают с пригодными для этой цели добавками, такими как носители, стабилизаторы или инертные разбавители, и обычными способами доводят до пригодных дозировочных форм, таких как таблетки, драже, разъемные капсулы с лекарством, водные, спиртовые или масляные растворы. В качестве инертных носителей можно применять, например, гуммиарабик, магнезию, карбонат магния, фосфат калия, молочный сахар, глюкозу или крахмал, в особенности кукурузный крахмал. При этом приготовление можно осуществлять как в виде сухого, так и в виде мокрого гранулята. В качестве масляных носителей или в качестве растворителей, например, принимают во внимание растительные или животные масла, такие как подсолнечное масло или рыбий жир.
Для подкожного или внутривенного применения активные соединения, при желании вместе с обычными для этой цели веществами, такими как агенты растворения, эмульгаторы или другие вспомогательные вещества, растворяют, суспендируют или эмульгируют. В качестве растворителей применяют, например, воду, физиологический раствор хлорида натрия или спирты, например, такие как этанол, пропанол, глицерин; наряду с ними также растворы сахаров, такие как растворы глюкозы или маннита, или также смесь из различных указанных растворителей.
В качестве фармацевтической формы для введения в виде аэрозолей или пульверизуемых препаратов пригодны, например, растворы, суспензии или эмульсии биологически активного вещества формулы (I) в фармацевтически приемлемом растворителе, в особенности этанол или вода, или в смеси таких растворителей.
Препараты при необходимости также могут содержать еще другие фармацевтические вспомогательные вещества, такие как поверхностно-активные вещества, эмульгаторы и стабилизаторы, а также рабочий газ. Такая композиция содержит биологически активное вещество обычно в концентрации примерно 0,1-10, в особенности примерно 0,3-3 мас.%.
Дозировка применяемого биологически активного вещества формулы (I) и частота введения зависят от эффективности действия и длительности действия используемых соединений; кроме того, также от рода и интенсивности излечиваемого заболевания, а также от пола, возраста, веса и индивидуальной предрасположенности подвергающегося лечению млекопитающего. В среднем суточная доза соединения формулы (I) составляет в случае пациента весом примерно 75 кг по меньшей мере 0,001 мг/кг, предпочтительно 0,01 мг/кг, вплоть до самое большее 10 мг/кг, предпочтительно 1 мг/кг веса тела. В случае острых вспышек заболевания, например непосредственно после перенесения инфаркта сердца, также могут быть необходимы еще более высокие и прежде всего более частые дозировки, например, вплоть до 4-х разовых доз в день. В особенности при внутривенном применении, например, в случае пациентов с инфарктом при лечении в стационаре, могут быть необходимы дозы вплоть до 200 мг в день.
Перечень сокращений:
МеОН = метанол; ДМФ = N,N-диметилформамид; Е1 = электронный удар, DСl = десорбционно-химическая ионизация; КТ = комнатная температура; ЭЭ = этилацетат; т. пл. = температура плавления; ГЕП = н-гептан; ДМЭ = диметоксиэтан; ES = распыление электронов; FAB = бомбардировка быстрыми атомами; СН2Сl2 = дихлорметан; ТГФ = тетрагидрофуран; экв. = эквивалент.
Экспериментальная часть
Общие методики для получения гуанидидов алкенилкарбоновых кислот формулы (I)
Вариант 1A. Получение из алкенилкарбоновых кислот (формула (II), L=ОН
1,0 экв. Производного карбоновой кислоты формулы (II) растворяют, соответственно суспендируют в безводном ТГФ (5 мл/ммоль) и затем смешивают с 1,1 экв. карбонилдиимидазола. После перемешивания в течение 2-х часов при комнатной температуре в реакционный раствор вносят 5,0 экв. гуанидина. После перемешивания в течение ночи ТГФ отгоняют при пониженном давлении (на ротационном испарителе), остаток смешивают с водой, устанавливают рН=6-7 с помощью 2н. НСl и отфильтровывают соответствующий гуанидид (формула 1)). Таким образом полученные гуанидиды карбоновых кислот путем обработки с помощью водного, метанольного или эфирного раствора НСl или других фармакологически приемлемых кислот можно переводить в соответствующие соли.
Вариант 1Б. Получение из сложных алкиловых эфиров алкенилкарбоновых кислот (формула (II), L=O-алкил)
1,0 экв. Сложного алкилового эфира карбоновой кислоты формулы (II), а также 5,0 экв. гуанидина (свободное основание) растворяют в изопропаноле или суспендируют в ТГФ и кипятят с обратным холодильником вплоть до полного превращения (контроль с помощью тонкослойной хроматографии) (обычно время реакции составляет 2-5 часов). Растворитель отгоняют при пониженном давлении (ротационный испаритель), обрабатывают этилацетатом и промывают 3 раза с помощью раствора NаНСО3. Сушат над сульфатом натрия, растворитель отгоняют в вакууме и хроматографируют остаток на силикагеле с помощью пригодного растворителя, например смеси этилацетата с метанолом в соотношении 5:1. (Солеобразование см. вариант А).
Пример 1. Гидрохлорид гуанидида Е-3-(4-диметиламинофенил)-2-метилакриловой кислоты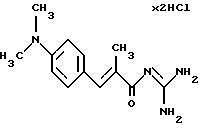
1a). 1 экв. Триэтилового эфира 2-фосфонопропионовой кислоты при 0oС депротонируют с помощью 1 экв. н-бутиллития в гексане и затем при комнатной температуре смешивают с 1 экв. 4-диметиламинобензальдегида. После полного взаимодействия альдегида смесь обрабатывают водой и трижды экстрагируют толуолом. После высушивания объединенных органических фаз над сульфатом магния растворитель удаляют в вакууме и остающийся сырой продукт разделяют хроматографически на силикагеле с помощью смесей этилацетата с гептаном в качестве элюирующего средства. Выделяют этиловый эфир Е-3-(4-диметиламинофенил)-2-метил-акриловой кислоты. Оранжево-желтоватое масло. Масс-спектр: 233 (М+).
1б). Сложный эфир из стадии 1а) омыляют согласно стандартному способу (гидроксид натрия в метаноле). Выделяют Е-3-(4-диметиламинофенил)-2-метил-акриловую кислоту. Т.пл. = 190-194oС. Масс-спектр: 205 (М+).
1в). Карбоновую кислоту из стадии 1б) согласно варианту 1А переводят в гидрохлорид гуанидида коричной кислоты. Т. пл. = 194oС. Масс-спектр: 247 (М+1)+
Пример 2. Дигидрохлорид гуанидида Е-3-/4-(3-диметиламинопропокси-2-метил-акриловой кислоты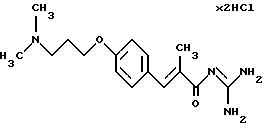
2а). Этиловый эфир Е-3-/4-(3-диметиламинопропокси)фенил/-2-метил-акриловой кислоты получают по аналогии с примером 1 а) из 4-(3-диметиламинопропокси)бензальдегида. Желтоватое масло. Масс-спектр: 291 (М+).
2б). Сложный эфир из стадии 2а) омыляют согласно стандартному способу (гидроксид натрия в метаноле). Выделяют Е-3-/4-(3-диметиламино-пропокси)фенил/-2-метил-акриловую кислоту.Т.пл. > 190oС. Масс-спектр: 264 (М+1)+.
2в). Карбоновую кислоту из стадии 2б) согласно варианту 1А переводят в дигидрохлорид гуанидида коричной кислоты. Т.пл. = 216oС.
Пример 3. Дигидрохлорид гуанидида Е-3-/4-(3-пиридилокси)-3-(трифторметил)фенил/-2-метил-акриловой кислоты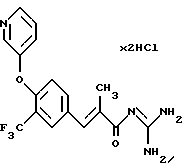
3а). По аналогии с примером 1 этиловый эфир Е-2-метил-3-(4-фтор-3-трифторметил-фенил)акриловой кислоты получают из 4-фтор-3-трифторметилбензальдегида. Желтоватое масло. Масс-спектр: 277 (М+1)+.
3б). Сложный эфир из стадии 3а), 3 экв. карбоната калия и 1,1 экв. 3-гидроксипиридина в ДМФ кипятят с обратным холодильником в течение 3-х часов. После стандартной обработки и очистки получают этиловый эфир Е-3-/4-(3-пиридилокси)-3-(трифторметил)фенил/-2-метил-акриловой кислоты. Желтоватое масло. Масс спектр: 352 (М+1)+.
3в). Сложный эфир из стадии 3б) в стандартных условиях переводят в акриловую кислоту. Т.пл. = 133oС. Масс-спектр: 323 (М+1)+.
3г). Переведение карбоновой кислоты из стадии 3в) осуществляют согласно общей методике 1А. Гигроскопичное твердое вещество. Т.пл. = 54oС. Масс-спектр: 365 (М+1)+
Пример 4. Дигидрохлорид гуанидида Е-3-/4-(4-пиридилтио)-3-(трифторметил)фенил/-2-метил-акриловой кислоты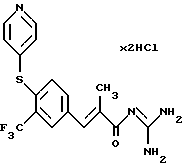
4а). Сложный эфир из примера 3а) аналогично примеру 3б) вводят во взаимодействие с 4-меркапто-пиридином. Выделяют этиловый эфир Е-3-/4-(4-пиридилтио)-3-(трифторметил)фенил/-2-метил-акриловой кислоты. Желтоватое масло. Масс-спектр: 368 (М+1)+.
4б). После омыления по стандартной методике до свободной карбоновой кислоты 4в) (бесцветное твердое вещество, т.пл. > 200oС) ее согласно варианту 1А, переводят в гуанидид. Бесцветные кристаллы. Т.пл. = 109oС.
Пример 5. Гидрохлорид гуанидида Е-3-/3-циано-4-диметиламино-2-фтор-фенил)-2-метил-акриловой кислоты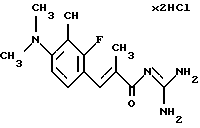
Пример 5 осуществляют по аналогии с примером 1 исходя из 3-циано-4-диметиламино-2-фтор-бензальдегида.
Этиловый эфир Е-3-/3-циано-4-диметиламино-2-фтор-фенил/-2-метилакриловой кислоты (5а): бесцветное масло; масс-спектр: 277 (M+1)+ E-3-(3-циано-4-диметиламино-2-фтор-фенил)-2-метил-акриловая кислота;
(5а); масс-спектр: 249 (М+1)+
гидрохлорид гуанидида Е-3-(3-циано-4-диметиламино-2-фтор-фенил)-2-метил-акриловой кислоты. Т.пл. = 221oС; масс-спектр: 290 (М+1)+
Пример 6. Дигидрохлорид гуанидида Е-3-/4-(3-диметиламинопропокси)фенил/-2-фтор-акриловой кислоты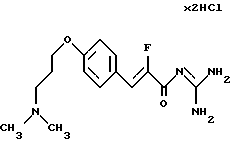
6а). Руководствуясь известным из литературы способом (Cousseau и др., Tetetrahedron Letters 34 (1993) 6903) и исходя из 4-(3-диметиламинопропокси)бензальдегида, синтезируют альфа-фторпроизводное - этиловый эфир Е-3-/4-(3-диметиламинопропокси)фенил/-2-фторакриловой кислоты. Бесцветное масло. Масс-спектр: 296 (М+1)+.
6б). Сложный эфир из стадии 6а) согласно варианту 1Б переводят в гуанидид. Т.пл. > 200oС. Масс-спектр: 309 (М+1)+
Пример 7. Дигидрохдорид гуанидида Е-3-/4-(4-(2-диметиламиноэтилен)-фенокси)фенил/-2-метил-акриловой кислоты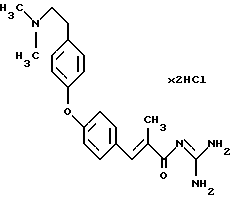
7а). Соответственно примеру 1a) из 4-фторбензальдегида получают этиловый эфир Е-3-/4-фторфенил/-2-метил-акриловой кислоты. Бесцветное масло. Масс-спектр: 209 (М+1)+
7б). Сложный эфир из стадии 7а), 3 экв. карбоната калия и 1,1 экв. 4-(2-диметиламиноэтилен)фенола в ДМФ кипятят с обратным холодильником в течение ночи. После обработки и хроматографии выделяют этиловый эфир Е-3-/4-(4-(2-диметиламиноэтилен) фенокси)фенил/-2-метил-акриловой кислоты. Бесцветное масло. Масс-спектр: 354 (M+1)+.
7в). Омыление сложного эфира из стадии 7б) дает Е-3-/4-(4-(2-диметиламиноэтилен)фенокси)фенил/-2-метил-акриловую кислоту. Бесцветные кристаллы. Т.пл. > 220oС. Масс-спектр: 326 (М+1)+.
7г). Свободную карбоновую кислоту из стадии 7в) соответственно варианту 1А переводят в гуанидид. Бесцветные кристаллы. Т.пл. 170-175oС. Масс-спектр: 367 (М+1)+.
Пример 8. Дигидрохлорид гуанидида Е-3-/3,5-дифтор-4-(4-(2-диметиламиноэтилен)фенокси)фенил/-2-метил-акриловой кислоты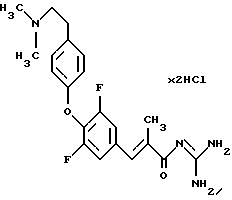
8а). Соответственно примеру 1а) исходя из 3,4,5-трифторбензальдегида получают этиловый эфир Е-3-/3,4,5-трифтор-фенил/-2-метил-акриловой кислоты. Бесцветное масло. Масс-спектр: 245 (М+1)+.
8б). Сложный эфир из стадии 8а), 3 экв. карбоната калия и 1,1 экв. 4-(2-диметиламиноэтилен)фенола в ДМФ перемешивают 4 часа при 150-175oС. Стандартная обработка и очистка дают этиловый эфир Е-3-/3,5-дифтор-4-(4-(2-диметиламиноэтилен)фенокси)фенил/-2-метилакриловой кислоты. Бесцветное масло. Масс-спектр: 390 (М+1)+.
8в). Сложный эфир из стадии 8б) согласно варианту 1Б переводят в гуанидид. Бесцветное твердое вещество. Т.пл. > 230oС. Масс-спектр: 403 (М+1)+.
Пример 9. Дигидрохлорид гуанидида Е-3-/3,5-дифтор-4-(4-(2-диметиламиноэтилен)фенокси)фенил/-2-фтор-акриловой кислоты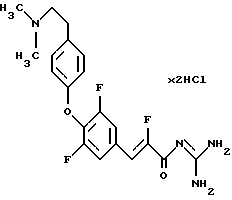
9а). По аналогии с примером 6 и исходя из 3,4,5-трифтор-бензальдегида получают этиловый эфир Е-3-/3,4,5-трифторфенил /2-фтор-акриловой кислоты. Бесцветное твердое вещество. Т.пл. <55oС. Масс-спектр: 249 (М+1)+.
9б). Сложный эфир из стадии 9б) 3 экв. карбоната калия и 1,1 экв. 4-(2-диметиламиноэтилен)фенола в ДИФ кипятят с обратным холодильником в течение 4-х часов. Стандартная обработка и очистка дают этиловый эфир Е-3-/3,5-дифтор-4-(4-(2-диметиламиноэтилен)фенокси)фенил/-2-фтор-акриловой кислоты. Бесцветное масло. Масс-спектр: 394 (М+1)+.
9в). Сложный этиловый эфир из стадии 9б) аналогично варианту 1Б переводят в гуанидид. Бесцветное твердое вещество. Т.пл. 215oС. Масс-спектр: 407 (М+1)+.
Пример 10. Гидрохлорид гуанидида Е-3-/3,5-дифтор-4-(3-диметиламино-фенокси)фенил/-2-метил-акриловой кислоты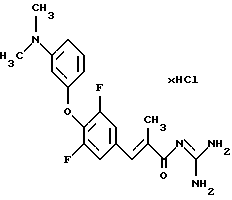
10а). Сложный эфир из примера 8а), 3 экв. карбоната калия и 1,1 экв. 3-диметиламинофенола в ДМФ перемешивают в течение 5 часов при 150oС. После обработки и очистки выделяют этиловый эфир Е-3-/3,5-дифтор-4-(3-диметиламинофенокси)фенил/-2-метил-акриловой кислоты. Бесцветное масло. Масс-спектр: 362 (М+1)+.
10б). Сложный эфир из стадии 10а) согласно варианту 1Б переводят в гуанидид. Т.пл. 150-160oС. Масс-спектр: 375 (М+1)+.
Пример 11 и Пример 12. Гуанидид Е-3-/2,6-дифтор-4-(3-диметиламино-фенокси)фенил/-2-метил-акриловой кислоты и гуанидид Е-3-/2,4-дифтор-6-(3-диметиламинофенокси)-фенил/-2-метил-акриловой кислоты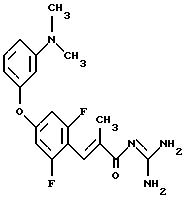
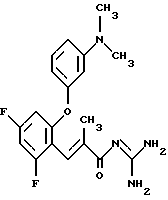
11а)/12а). По аналогии с примером 8а) и исходя из 2,4,6-трифторбензальдегида синтезируют этиловый эфир Е-3-/2,4,6-трифторфенил/-2-метил-акриловой кислоты. Бесцветное масло. Масс-спектр: 245 (М+1)+
11б)/12б). Сложный эфир из стадии 11а)/12а), 3 экв. карбоната калия и 1,1 экв. 3-диметиламинофенола в ДМФ перемешивают 3 часа при 150oС. Выделяют смесь изомеров сложного этилового эфира Е-3-/2,6-дифтор-4-(3-диметиламинофенокси)фенил/-2-метил-акриловой кислоты и сложного этилового эфира Е-3-/2,4-дифтор-6-(3-диметиламино-фенокси)фенил/-2-метил-акриловой кислоты. Бесцветное масло. Масс-спектр: 362 (М+1)+.
11в)/12в). Смесь сложных эфиров из стадии 11б)/12б) согласно варианту 1Б переводят в соответствующие гуанидиды и выделяют в виде смеси. Твердое вещество. Масс-спектр: 375 (М+1).
Фармакологические данные
Ингибиторы Na+/H+-обмена в случае эритроцитов кроликов
Белые новозеландские кролики (Ivanovas) получают стандартную диету с 2% холестерина в течение 6 недель, чтобы активировать Na+/H+-обмен и, таким образом, чтобы можно было определить с помощью пламенной фотометрии приток Na+ в эритроцитах через Na+/H+-обмен. Кровь отбирают из ушных артерий и делают ее несвертываемой за счет 25 1Е /мл калий-гепарина. Одну часть каждой пробы используют для двойного определения гематокрита благодаря центрифугированию. Аликвоты по 100 мкл служат для определения исходного содержания Nа+ в эритроцитах.
Для того чтобы определить чувствительный к амилориду приток натрия по 100 мкл каждой пробы крови в 5 мл гиперосмолярной среды на основе соли и сахарозы (ммоль/л: 140 NaCl; 3 КСl; 150 сахарозы; 0,1 Квабаина; 20 трис-/гидроксиметил-аминометана) инкубируют при рН=7,4 и при 37oС. Эритроциты затем трижды промывают с помощью охлажденного льдом раствора MgCl2 и Квабаина (ммоль/л: 112 MgCl2; 0,1 Квабаина) и гемолизируют в 2,0 мл дистиллированной воды. Внутриклеточное содержание натрия определяют с помощью пламенной фотометрии.
Приток Na+ рассчитывают из разницы между исходными количествами натрия и содержанием натрия в эритроцитах после инкубации. Подавляемый Амилоридом приток натрия получают из разницы в содержании натрия в эритроцитах после инкубации с Амилоридом в концентрации 3•10-4 моль/л и без него. Таким образом поступают также в случае предлагаемых в изобретении соединений.
Результаты по ингибированию Na+/H+-обмена:
Пример - ИД50 (мкмоль/л)
1 - <1
2 - <1
(ИД = ингибирующая доза)о
| название | год | авторы | номер документа |
|---|---|---|---|
| ФЕНИЛЗАМЕЩЕННЫЕ ГУАНИДИДЫ АЛКЕНИЛКАРБОНОВОЙ КИСЛОТЫ И ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ИХ ОСНОВЕ | 1997 |
|
RU2193026C2 |
| ЗАМЕЩЕННЫЕ ГУАНИДИДЫ ТИОФЕНИЛАЛКЕНИЛКАРБОНОВОЙ КИСЛОТЫ И ЛЕКАРСТВЕННОЕ СРЕДСТВО | 1997 |
|
RU2193033C2 |
| ЗАМЕЩЕННЫЕ БЕНЗИЛОКСИКАРБОНИЛГУАНИДИНЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И СРЕДСТВО, ИНГИБИРУЮЩЕЕ NA/H-ОБМЕН | 1996 |
|
RU2188191C2 |
| ГУАНИДИДЫ АЛКЕНИЛКАРБОНОВЫХ КИСЛОТ, СПОСОБ ИХ ПОЛУЧЕНИЯ, СПОСОБ ИНГИБИРОВАНИЯ КЛЕТОЧНОГО NA/H-ОБМЕНА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1996 |
|
RU2164913C2 |
| ОРТО-ЗАМЕЩЕННЫЕ БЕНЗОИЛГУАНИДИНЫ И СОДЕРЖАЩИЕ ИХ ЛЕКАРСТВЕННЫЕ СРЕДСТВА | 1997 |
|
RU2212400C2 |
| СУЛЬФОНИМИДАМИДЫ, ФАРМАЦЕВТИЧЕСКИЙ СОСТАВ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1996 |
|
RU2180658C2 |
| ЗАМЕЩЕННЫЕ 2-НАФТОИЛГУАНИДИНЫ И ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ИХ ОСНОВЕ | 1997 |
|
RU2190600C2 |
| ОРТОЗАМЕЩЕННЫЕ БЕНЗОИЛГУАНИДИНЫ И ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ИХ ОСНОВЕ | 1997 |
|
RU2193025C2 |
| СЛОЖНЫЙ 17-ДЕЗОКСИ-КОРТИКОИД-21-ЭФИР КАРБОНОВОЙ КИСЛОТЫ, СПОСОБЫ ЕГО ПОЛУЧЕНИЯ, ЛЕКАРСТВЕННОЕ СРЕДСТВО | 1995 |
|
RU2161624C2 |
| ЗАМЕЩЕННЫЕ 1-НАФТОИЛГУАНИДИНЫ И ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ИХ ОСНОВЕ | 1997 |
|
RU2182901C2 |
Описываются новые замещенные гуанидиды коричной кислоты формулы (I), где R(3) обозначает -Ха-Уб-Ln-U; Х обозначает О, S; а = 0 или 1; У обозначает алкилен с 1, 2, 3, 4, 5, 6, 7 или 8 С-атомами; Т, Т - алкилен с 1, 2, 3, 4, 5, 6, 7 или 8 С-атомами в алкиленовой группе; Т обозначает фенилен; n = 0; U обозначает NR(24) R(25) или пиридил; причем R(24) и R(25) обозначают алкил с 1, 2, 3, 4, 5, 6, 7 или 8 С-атомами; R(1), R(2), R(4) и R(5) обозначают H, F, Cl, Br, I, CN, -Op-(СН2)s-CqF2q+1; где р = 0; q = 1, 2, 3, 4, 5, 6, 7 или 8; s = 0; R(6) и R(7) независимо друг от друга обозначают водород, F, Cl, Br, I, алкил с 1, 2, 3, 4, 5, 6, 7 или 8 С-атомами, а также их фармацевтически приемлемые соли. Новые соединения являются ингибиторами клеточного натрийпротонного обмена. Также описываются способ получения соединений формулы (I) и фармацевтическая композиция, обладающая ингибирующей активностью в отношении Na+/H+ - обмена, содержащая в качестве активного вещества соединение формулы (I). 3 с. и 3 з.п.ф-лы.
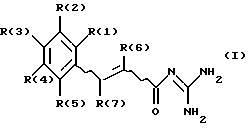
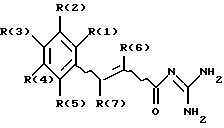
где R(3) обозначает -Xа-Yб-Ln-U, где Х обозначает О, S;
а = 0 или 1;
Y обозначает алкилен с 1, 2, 3, 4, 5, 6, 7 или 8 С-атомами; Т; Т-алкилен с 1, 2, 3, 4, 5, 6, 7 или 8 С-атомами в алкиленовой группе;
Т обозначает фенилен;
n = 0;
U обозначает NR(24)R(25) или пиридил, причем R(24) и R(25) обозначают алкил с 1, 2, 3, 4, 5, 6, 7 или 8 С-атомами;
R(1), R(2), R(4), R(5) обозначают Н, F, Cl, Br, I, CN, -Op-(СН2)s-CqF2q+1,
где р = 0; q = 1, 2, 3, 4, 5, 6, 7 или 8; s = 0;
R(6) и R(7), независимо друг от друга, обозначают водород, F, Cl, Br, I, алкил с 1, 2, 3, 4, 5, 6, 7 или 8 С-атомами,
а также их фармацевтически приемлемые соли.
гуанидида Е-3-(4-диметиламинофенил)-2-метил-акриловой кислоты;
гуанидида Е-3-[4-(3-диметиламинопропокси)фенил] -2-метилакриловой кислоты;
гуанидида Е-3-[4-(3-пиридилокси)-3-(трифторметил)фенил] -2-метил-акриловой кислоты;
гуанидида Е-3-[4-(4-пиридилтио)-3-(трифторметил)фенил]-2-метил-акриловой кислоты;
гуанидида Е-3-(3-циано-4-диметиламино-2-фтор-фенил)-2-метил-акриловой кислоты;
гуанидида Е-3-[4-(3-диметиламинопропокси)фенил]-2-фторакриловой кислоты;
гуанидида Е-3-[4-(3-(2-диметиламиноэтилен)фенокси] -2-метил-акриловой кислоты;
гуанидида Е-3-[3,5-дифтор-4-(4-(2-диметиламиноэтилен)-фенокси)фенил] -2-метил-акриловой кислоты;
гуанидида Е-3-[3,5-дифтор-4-(4-(2-диметиламиноэтилен-фенокси)фенил]-2-фтор-акриловой кислоты;
гуанидида Е-3-[3,5-дифтор-4-(3-диметиламинофенокси)фенил]-2-метил-акриловой кислоты;
гуанидида Е-3-[2,6-дифтор-4-(3-диметиламинофенокси)фенил]-2-метил-акриловой кислоты;
гуанидида Е-3-[2,4-дифтор-6-(3-диметиламинофенокси)фенил] -2-метил-акриловой кислоты.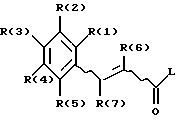
где R(1) - R(7) имеют указанные в п.1 значения;
L обозначает легко нуклеофильно замещаемую удаляемую группу,
вводят во взаимодействие с гуанидином.
| Способ получения бензоилгуанидина | 1990 |
|
SU1836338A3 |
| DE 4327244 А1, 16.02.1995 | |||
| ЕР 0556672 А, 25.08.1993 | |||
| СПОСОБ И УСТРОЙСТВО ДЛЯ ГЕРМЕТИЗАЦИИ ОБЛАСТИ КОНТАКТНЫХ УЧАСТКОВ ЭЛЕКТРИЧЕСКИХ ПРОВОДНЫХ СОЕДИНЕНИЙ | 2017 |
|
RU2734904C2 |
Авторы
Даты
2002-10-10—Публикация
1996-07-25—Подача