Изобретение относится к органической химии, к способу получения гетероциклических соединений, а именно транс-2-R-3-(5-Х-фурил-2)-акрилонитрилов общей формулы (I)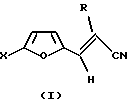
где Х - водород, низший алкил или фенил;
R - водород или низший алкил, которые используются в синтезе биологически активных соединений.
Известно несколько различных способов синтеза фурилакрилонитрилов. Японские ученые с 73% выходом получили смесь цис- и трансформ 1-фенил-2-фурилакрилонитрила посредством конденсации фурфурола с бензилцианидом под действием щелочи (Tazaduro К., Hideo Т. Synthesis of disubstituted propionitriles and their derivatives // Tohoku Yakka - 1964. - 11. -Р.75).
Взаимодействием фурфурола с циануксусной кислотой в присутствии ацетата аммония в среде кипящих толуола и пиридина в течение двух дней с выходом 78% синтезирован фурилакрилонитрил в виде смеси цис- и трансизомеров (В кн.: Синтезы органических препаратов. - М.: Мир. - 1964. - Сб. 12.-С.167).
При изучении поведения фурфурола и его 5-замещенных в реакции Виттига (Saikachi H., Nakamura S. Stereospecification of the Wittig Reaction // Vakugara Zasshi. - 1968. Vol. 88. - 1 - P. 110) с выходом до 75% был разработан способ получения 5-замещенных фурилакрилонитрилов.
Однако все перечисленные способы получения не стереоселективны и в качестве целевых продуктов дают смесь цис- и трансформ фурилакрилонитрилов.
Исследователи из Чехословакии получили серию замещенных транс-(2-фурил)винилцианидов (Pavazanec F., Kovac J. Syntheza a spectralne vlastnosti substituovanych R-(2-Furul)vinylzynidovi // Zb. Prac. Chem., Fakulty Technickey - 1975-1976. -P.147). При использовании данного способа выход фурилакрилонитрила невысок (42%).
Наиболее близким аналогом к заявляемому способу, позволяющим проводить одностадийный синтез транс-2-R-3-(5-Х-фурил-2)акрилонитрилов, является (авт. св. СССР 1199754. Способ получения транс-2-R-3-(5-Х-фурил-2)-акрилонитрилов / П. А. Павлов, В.Г. Кульневич, Г.Д. Крапивин. - БИ 1985. 47), который заключается в том, что к 1 молю соответствующего фурилакролеина формулы: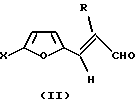
где Х-водород, низший алкил или фенил;
R-водород или низший алкил,
прибавляют бензольный раствор, содержащий 1,1 моль азотистоводородной кислоты, вносят 0,2 моль безводного перхлората магния, включают мешалку и при 20-35oС прикалывают катализатор - перхлорат диоксания, полученный взаимодействием 0,2 моль 1,4-диоксана и 0,15 моль 72% хлорной кислоты. Скорость прикапывания катализатора регулируется током выделяющегося азота, который должен быть не бурным. Его расчетное количество выделяется за 3-4,5 ч. Реакционную смесь обрабатывают водой, отгоняют бензол под пониженным давлением и выделяют продукт перекристаллизацией или вакуумной перегонкой с елочным дефлегматором.
Технический результат предлагаемого изобретения заключается в повышении выхода и упрощении процесса получения транс-2-R-3-(5-Х-фурил-2)-акрилонитрилов.
Для достижения технического результата предлагается в качестве исходного продукта использовать фурановый альдегид общей формулы (II), азотисто-водородную кислоту, в качестве органического растворителя берут хлороформ, катализатором выбирают гидратированный перхлорат магния Mg(ClO4)2•2,5H2O, взятых в соотношении 1:1, 1:1, нагревают до температуры кипения азотистоводородной, кислоты, а затем температуру повышают до температуры кипения хлороформа и кипятят до прекращения выделения азота.
Предлагаемый способ получения транс-2-R-3-(5-Х-фурил-2)-акрилонитрилов общей формулы (I) отличается от наиболее близкого тем, что в качестве катализатора используют гидратированный перхлорат магния Mg(ClO4)2•2,5H2O, который одновременно связывает выделяющуюся в результате реакции воду, что по сравнению с прототипом позволило исключить необходимость использования труднодоступного безводного перхлората магния, который получают обезвоживанием перхлората магния при 200-300oС в вакууме, стадии приготовления и использования перхлората 1,4-диоксания. В качестве органического растворителя применяют хлороформ, который индифферентен к азотистоводородной кислоте и негорюч, а следовательно, способ более безопасен. Следующим отличительным признаком является условия нагревания. В предлагаемом способе нагревание ведут в два этапа, т.к. наиболее интенсивное разложение азотистоводородной кислоты наблюдается при температуре ее кипения, а заканчивают реакцию при температуре кипения хлороформа, повышая тем самым выход целевого продукта.
Общая методика получения транс-2-R-3-(5-Х-фурил-2)акрилонитрилов
К 0,1 моль соответствующего фурилакролеина прибавляют хлороформенный раствор, содержащий 0,11 моль азотистоводородной кислоты, вносят 0,1 моль ангидрона, включают мешалку и при температуре 35-40oС выдерживают 1 ч, затем температурный режим доводят до 60oС и кипятят в течение двух часов. Реакционную массу охлаждают до комнатной температуры, обрабатывают водой, отделяют хлороформенный слой, промывают еще раз водой, отгоняют хлороформ под пониженным давлением и выделяют продукт перекристаллизацией или вакуумной перегонкой с елочным дефлегматором.
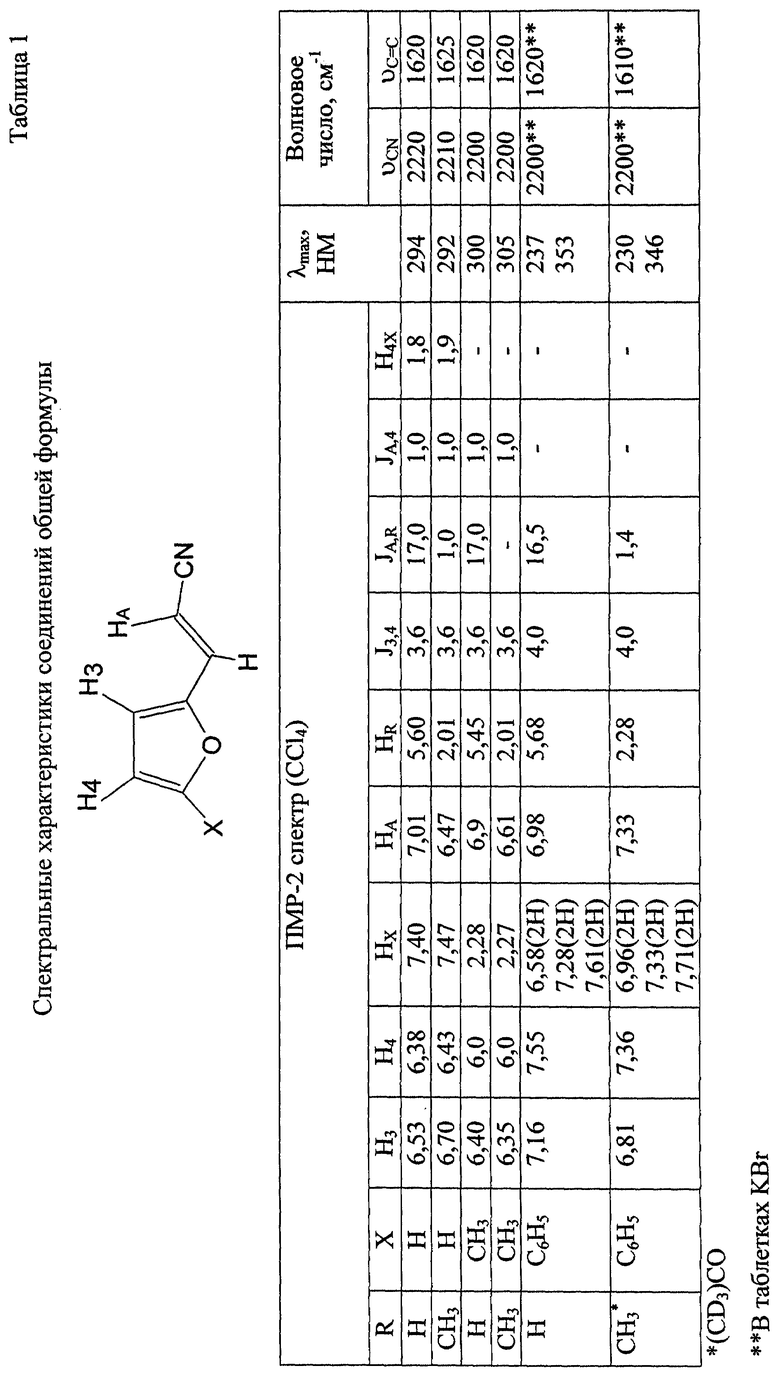
Пример 1. Транс-3-(2-фурил)акрилонитрил.
Реакцию проводят при 35-60oС. Выход 7,56 г (84%), Тпл 95-96oС (при 11 мм рт. ст., Тпл 34oС). Вещество кристаллизуется уже при перегонке или после непродолжительного стояния.
Вычислено, %: С 70, 58; Н 4,20; N 11,76.
C7H5NO.
Найдено, %: С 71, 20; Н 4,44; N 11,92.
Пример 2. Транс-3-(5-метилфурил-2)акрилонитрил. Реакцию проводят при 35-60oС. Выход 12,2 г (92%). Ткип 96oС/5 мм рт.ст., (d4 20 1,1898; n4 20 1,6036.
Вычислено, %: С 72,18; Н 5,26; N 10,52.
C8H7NO.
Найдено, %: С 72,85; Н 5,48; N 10,70.
Пример 3. Транс-2-метил-3-(2-фурил)акрилонитрил. Реакцию проводят при 35-60oС. Выход 9,57 г (82%). Ткип 94oС/4 мм рт.ст., d4 20 1,1732; n4 20 1,5665.
Вычислено, %: С 72,18; Н 5,26; N 10,52. C8H7NO.
Найдено, %: С 72,76; Н 5,64; N 10,73.
Пример 4. Транс-2-метил-3-(5-метилфурил-2)акрилонитрил. Реакцию проводят при 35-60oС. Выход 12,0 г (82%). Ткип 111-112oС/5 мм рт.ст., d4 20 1,1611; n4 20 1,6810.
Вычислено, %: С 73,46; Н 6,12; N 9,52.
C8H9NO.
Найдено, %: С 73, 98; Н 6,36; N 9,60.
Пример 5. Транс-3-(5-фенилфурил-2)акрилонитрил. Реакцию проводят при 35-60oС. Выход 17,34 (91%).
После перекристаллизации из этанола Тпл 71oС.
Вычислено, %: С 80,00; Н 4,61; N 7,17.
C13H9NO.
Найдено, %: С 80, 56; Н 4,80; N 7,23.
Пример 6. Транс-2-метил-3-(5-фенилфурил-2)акрилонитрил. Реакцию проводят при 35-60oС. Выход 19,22 г (92%).
После перекристаллизации из этанола Тпл 138oС.
Вычислено, %: С 80,38; Н 5,26; N 6,69.
C14H11NO.
Найдено, %: С 81,00; Н 5,38; N 6,71.
Спектральные характеристики, подтверждающие структуру полученных соединений, приведены в табл. 1.
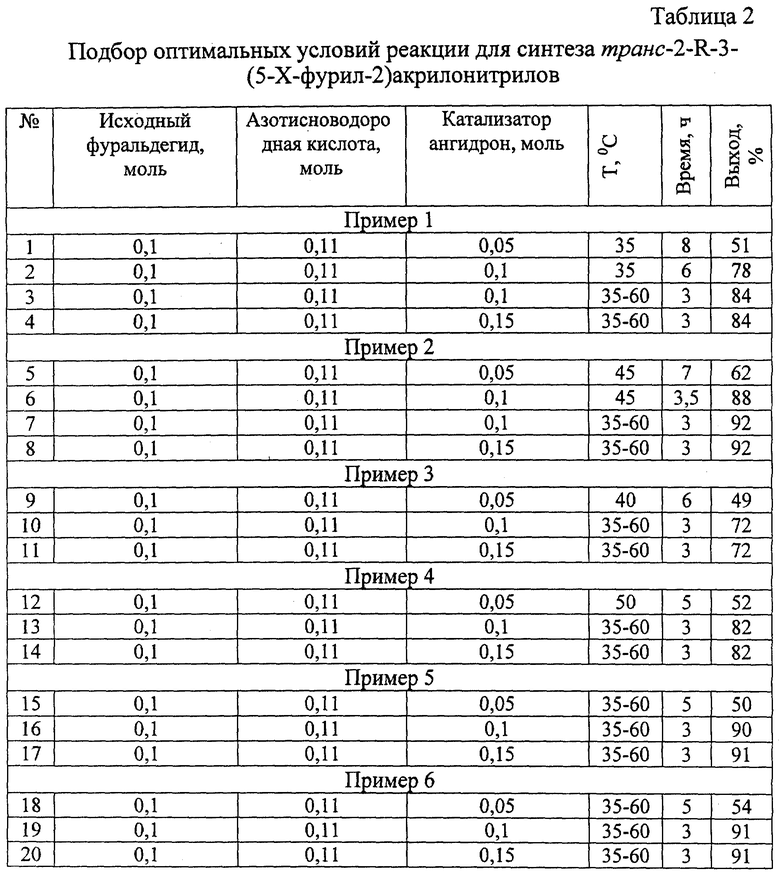
По каждому из приведенных примеров были отобраны условия проведения реакции, которые помещены в табл. 2.
Из табл. 2 видно, что оптимальные соотношение исходного альдегида, азотистоводородной кислоты и катализатора 1:1,1:1. Оптимальным температурным режимом является нагревание при температуре в начале 35-45oС, а затем повышение ее до 60oС. На примерах 1,5,9 видно, что, подогревая один раз до 35-45oС, чтобы увеличить выход целевого продукта, нужно греть 6-8 ч. Этот результат достигается, подогревая в 2 этапа, увеличивая температуру до температуры кипения хлороформа. Примеры 3, 4, 7, 8, 11, 14, 17, 20.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 5-ЗАМЕЩЕННЫХ-2-ЦИАНОФУРАНОВ | 2000 |
|
RU2189978C2 |
| Способ получения транс-2- @ -3-/5-х-фурил-2/-акрилонитрилов | 1983 |
|
SU1199754A1 |
| Способ получения 5-замещенных 2-цианфуранов | 1983 |
|
SU1130566A1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 7,8-ФТАЛОИЛАКРИДОНА | 2007 |
|
RU2332407C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ N-3-ОКСОАЛКИЛТИОАМИДОВ | 1994 |
|
RU2068411C1 |
| СПОСОБ ПОЛУЧЕНИЯ СЛОЖНЫХ ЭФИРОВ КАРБОНОВЫХ КИСЛОТ | 1993 |
|
RU2074853C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ БИС(5-ФЕНИЛФУР-2-ИЛ)МЕТАНА | 2000 |
|
RU2165930C1 |
| СПОСОБ ПОЛУЧЕНИЯ N-ЗАМЕЩЁННЫХ ЭТИЛ-(2-ДИАЛКОКСИФОСФОРИЛ-4ЦИАНО)-БУТАНИМИДАТОВ | 2003 |
|
RU2236414C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 3-АРОИЛАНТРА-[1,9-cd]ИЗОКСАЗОЛ-6-ОНА | 2007 |
|
RU2330028C1 |
| Способ получения 2-галогенвинилоксиорганосиланов | 1978 |
|
SU740784A1 |
Изобретение относится к органической химии, в частности к способу получения 2-R-3-(5-Х-фурил-2)-акрилонитрилов общей формулы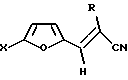 (I)
(I)
где Х - атом водорода, низший алкил или фенил, R - атом водорода или низший алкил, которые являются исходными продуктами в синтезе биологически активных соединений. Способ заключается в том, что фурилакролеин формулы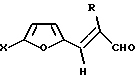 (II)
(II)
где Х и R имеют вышеуказанные значения, подвергают взаимодействию с азотистоводородной кислотой в среде хлороформа в присутствии в качестве катализатора гидратированного перхлората магния состава Mg(ClO4)2•2,5Н2O при мольном соотношении соответствующего фурилакролеина, азотистоводородной кислоты и катализатора соответственно 1:1, 1:1 в интервале температур кипения в начале азотистоводородной кислоты, а затем хлороформа до прекращения выделения азота. Технический результат: повышение выхода и упрощение процесса. 2 табл.
Способ получения транс-2-R-3-(5-Х-фурил-2)-акрилонитрилов общей формулы I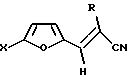
где Х - атом водорода или низший алкил, или фенил, R - атом водорода или низший алкил, взаимодействием фурилакролеинов общей формулы II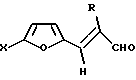
где R имеет вышеуказанные значения с азотистоводородной кислотой в среде органического растворителя при нагревании в присутствии катализатора, отличающийся тем, что в качестве катализатора используют гидратированный перхлорат магния Mg(ClO4)2•2,5H2O и процесс проводят при мольном соотношении фуранового альдегида формулы II, азотистоводородной кислоты и катализатора соответственно 1:1, 1:1 в среде хлороформа в интервале температур кипения в начале азотистоводородной кислоты, а затем хлороформа до прекращения выделения азота.
| Способ получения транс-2- @ -3-/5-х-фурил-2/-акрилонитрилов | 1983 |
|
SU1199754A1 |
| Способ получения 2,5-дицианурана | 1973 |
|
SU448714A1 |
Авторы
Даты
2002-10-10—Публикация
2000-01-10—Подача