Данная заявка подтверждает приоритет предварительной заявки с регистрационным 60/062947, поданную 9 октября 1997 года.
Предпосылки к созданию изобретения
1. Область изобретения
Изобретение относится с способам и фармацевтическим композициям, применяемым для предотвращения токсичности, вызванной введением циклоспорина или такролимуса.
2. Описание предшествующего уровня техники
Циклоспорины представляют собой нейтральные липофильные циклические ундекапептиды с молекулярными массами около 1200. Они применяются внутривенно или перорально в качестве иммунодепрессантов для увеличения продолжительности функционирования аллогенных трансплантатов, включая кожу, костный мозг, сердце, почки, поджелудочную железу и другие органы, а также для лечения аутоиммунных заболеваний.
Одной из основных категорий побочных реакций, связанных с циклоспориновой терапией, является почечная дисфункция и токсичность, приводящая к ограничениям для клинического применения циклоспоринов. Действительно, в течение последних более чем 15 лет несмотря на улучшенные одно- и двухгодичный показатели выживаемости почечных аллотрансплантатов, средний период полужизни в 8 лет для трупного почечного трансплантата, то есть функционирование за один год мало изменилось при использовании циклоспоринов для иммуносупрессии. Неблагоприятное воздействие циклоспоринов, и особенно наиболее часто используемого из них циклоспорина А (СуА), на долгосрочную структуру и функцию почки нельзя исключить в качестве важного фактора синдрома хронической несостоятельности аллогенного трансплантата. См. Bennett et al., Kidney Intl., 50: 1089-1100 (1996).
Установлено, что СуА вызывает дозозависимое снижение почечной функции у экспериментальных животных и у человека, которое, как полагают, связано с влиянием препарата на возникновение вазоконстрикции афферентных артериол, и, в конечном счете, со сниженным уровнем гломерулярной фильтрации. Однако эти острые гемодинамические эффекты, которые должны быть в значительной степени контролируемы четким мониторингом и дозированием, очевидно не единственные неблагоприятные последствия для почек при назначении СуА. Как было показано не только у пациентов, подвергшихся терапии с СуА с целью предотвращения отторжения органного трансплантата, но также у пациентов с аутоиммунными заболеваниями, как было показано, развиваются морфологические повреждения, состоящие из областей полосатого интерстициального фиброза почечных канальцев, тубулярной атрофии и афферентной артериолопатии. Отличительным признаком нефропатии, вызванной СуА, являются эти сосудистые повреждения, которые не обязательно являются дозозависимыми и которые могут наблюдаться у некоторых пациентов, получающих такие низкие дозы СуА, как 2-4 мг/кг. См. Bennett et al. . Kidney Intl., 50:1089-1100 (1996); Pankewycz et al.. Kidney Intl., 50: 1634-1640 (1996).
Ранее в этой области не было найдено эффективного способа длительного введения терапевтических доз СуА и других циклоспоринов, исключающего серьезные последствия нефротоксичности. Было высказано предположение о том, что кальциевые антагонисты могут модифицировать метаболизм СуА, делая возможным применение низких доз для достижения адекватной иммуносупрессии. Предполагалось также, что дигидропиридиновые блокаторы кальциевых каналов могут замедлить интерстициальный фиброз у реципиентов почечного трансплантата, не оказывая при этом влияния на метаболизм циклоспорина. Польза от этих предложенных способов лечения не была доказана, однако могли быть побочные эффекты, вызванные длительным введением кальциевых антагонистов или блокаторов кальциевых каналов, которые перевесили бы приносимую ими пользу в качестве вспомогательных агентов для циклоспоринов, даже если бы они были эффективны в предотвращении поражения почек.
Краткое содержание изобретения
Цель настоящего изобретения состоит в обеспечении способа предотвращения или существенного снижения нефротоксичности, вызванной введением циклоспоринов больным млекопитающим.
Другая цель настоящего изобретения состоит в обеспечении способа, который не только останавливает патологический процесс, но фактически делает его обратимым и вызывает регрессию сморщивания почек.
Дальнейшая цель изобретения состоит в обеспечении способа, который делает возможным введение относительно высоких эффективных доз циклоспоринов пациентам, нуждающимся в лечении циклоспоринами, и в то же время позволяет избежать вызываемой циклоспоринами нефротоксичности и нефропатии.
Еще одна цель настоящего изобретения состоит в обеспечении способа, использующего коммерчески доступный фармацевтический агент, который не является токсичным и, по всей вероятности, не вызывает серьезных побочных эффектов.
С учетом этих и других целей, которые станут очевидными позднее, сущность изобретения, заявленная кратко, состоит в способе предотвращения, снижения или обращения индуцированной циклоспорином нефротоксичности и почечной дисфункции у больных млекопитающих, получающих циклоспориновую терапию, состоящую во введении таким пациентам эффективного в снижении нефротоксичности количества полисульфата пентозана (PPS) или его фармацевтически приемлемой соли. Предпочтительным способом введения PPS является пероральное введение.
В другом аспекте сущность настоящего изобретения состоит в способе лечения больных млекопитающих, которым требуется иммуносупрессивная терапия для предотвращения отторжения аллотрансплантата или лечения аутоиммунного заболевания путем сочетанного введения эффективного количества циклоспорина, индуцирующего иммуносупрессию, и эффективного количества PPS, снижающего нефротоксичность, или его фармацевтически приемлемой соли. В качестве альтернативы эффективному количеству PPS может сопутствовать введение FK-506 (от фирмы Fujisawa), известного также как такролимус, который применяется для того, чтобы обеспечить иммуносупрессию у пациентов с органотрансплантатом, особенно в случаях с печеночными трансплантатами.
Краткое описание чертежей
Фиг.1А представляет собой микрофотографию почки крысы, которая в течение двух недель находилась на рационе с низким содержанием натрия, а затем была обработана СуА в виде ежедневных инъекций в течение 45 дней.
Фиг.1Б представляет собой микрофотографию почки крысы, которая в течение двух недель находилась на рационе с низким содержанием натрия, а затем была обработана СуА и PPS (ELMIRON®) в виде ежедневных инъекций в течение 45 дней.
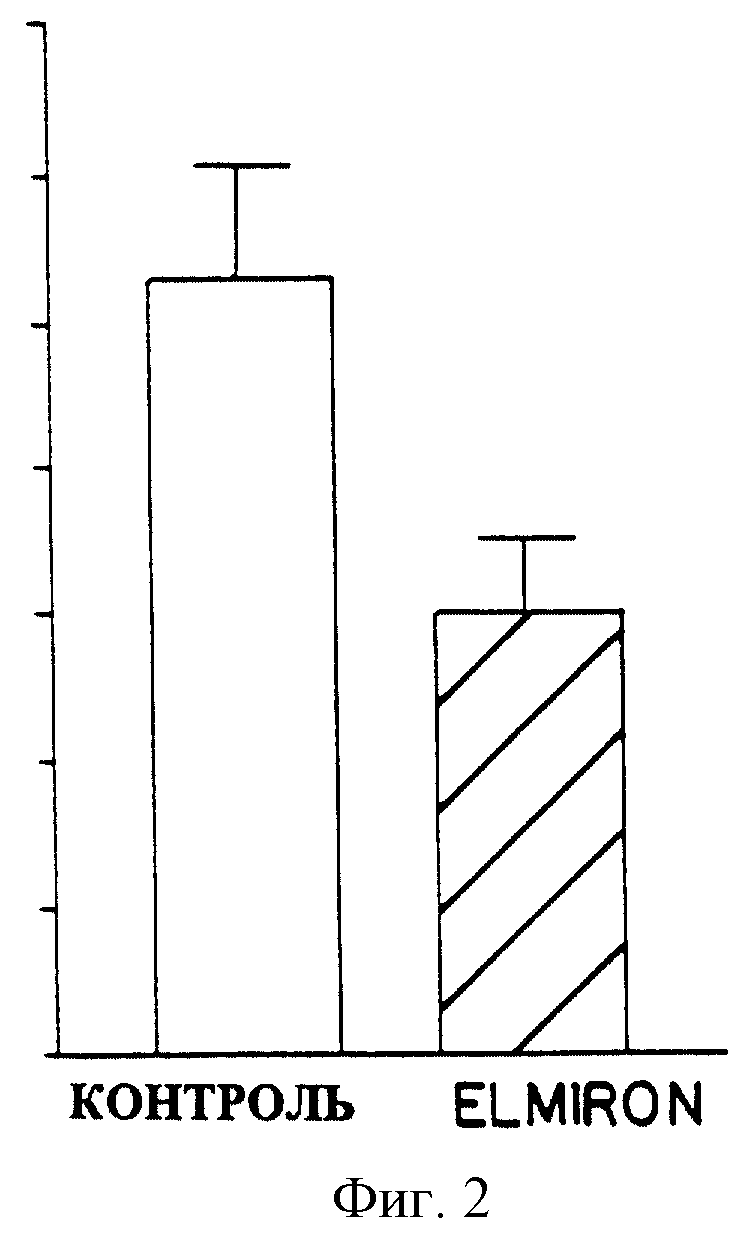
Фиг. 2 представляет собой гистограмму, отражающую количественное сопоставление распространенности фиброза (выраженное в произвольных единицах), обнаруженного при морфометрическом исследовании почек крыс, описанных по фиг.1А и 1Б соответственно.
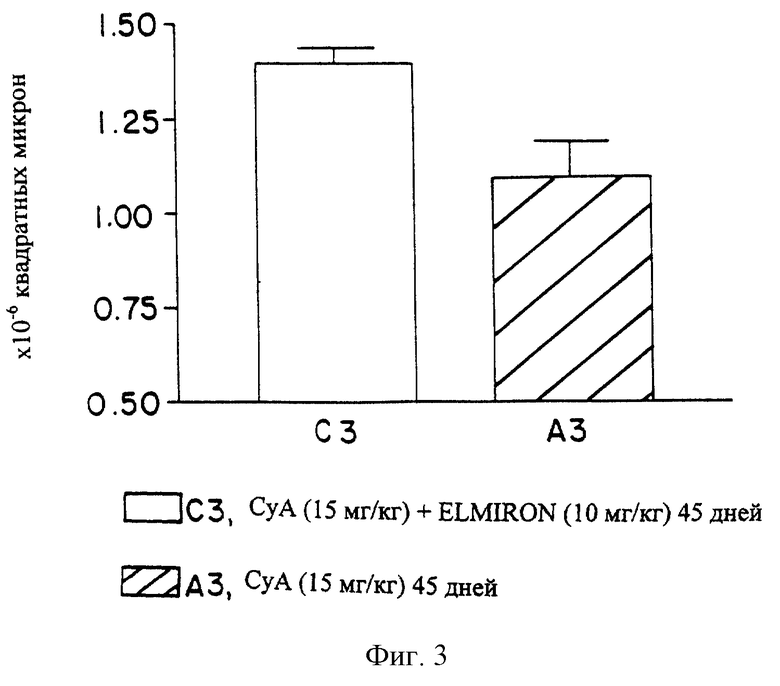
Фиг. 3 представляет собой гистограмму, отражающую количественное сопоставление гломерулярного объема, оцененного с помощью морфометрического исследования почек крыс, описанных по фиг.1А и 1Б соответственно.
Фиг. 4 представляет собой микрофотографию почки крысы, которая в течение двух недель находилась на рационе с низким содержанием натрия, а затем была обработана СуА в виде ежедневных инъекций в течение 15 дней.
Фиг.4Б представляет собой микрофотографию почки крысы, которая в течение двух недель находилась на рационе с низким содержанием натрия, а затем была обработана СуА и PPS (ELMIRON®) в виде ежедневных инъекций в течение 15 дней.
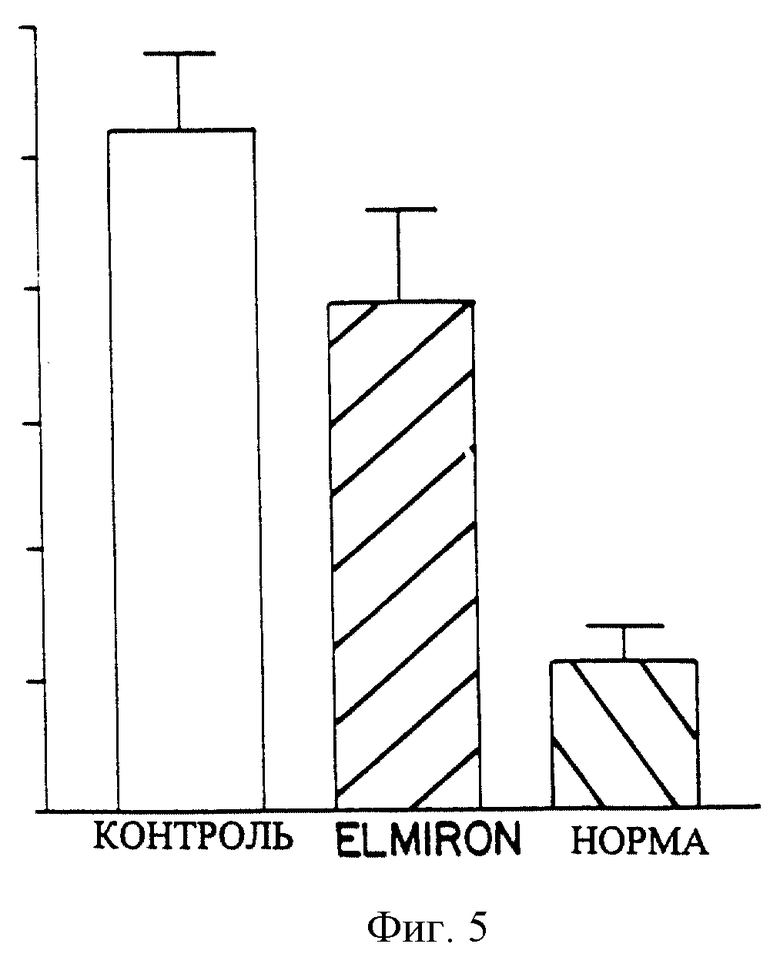
Фиг. 5 представляет собой гистограмму, отражающую количественное сопоставление числа фибриноидных повреждений, обнаруженных в почках крыс, описанных по фиг.4А (контроль) и 4Б (ELMIRON®), и у не обработанных крыс соответственно.
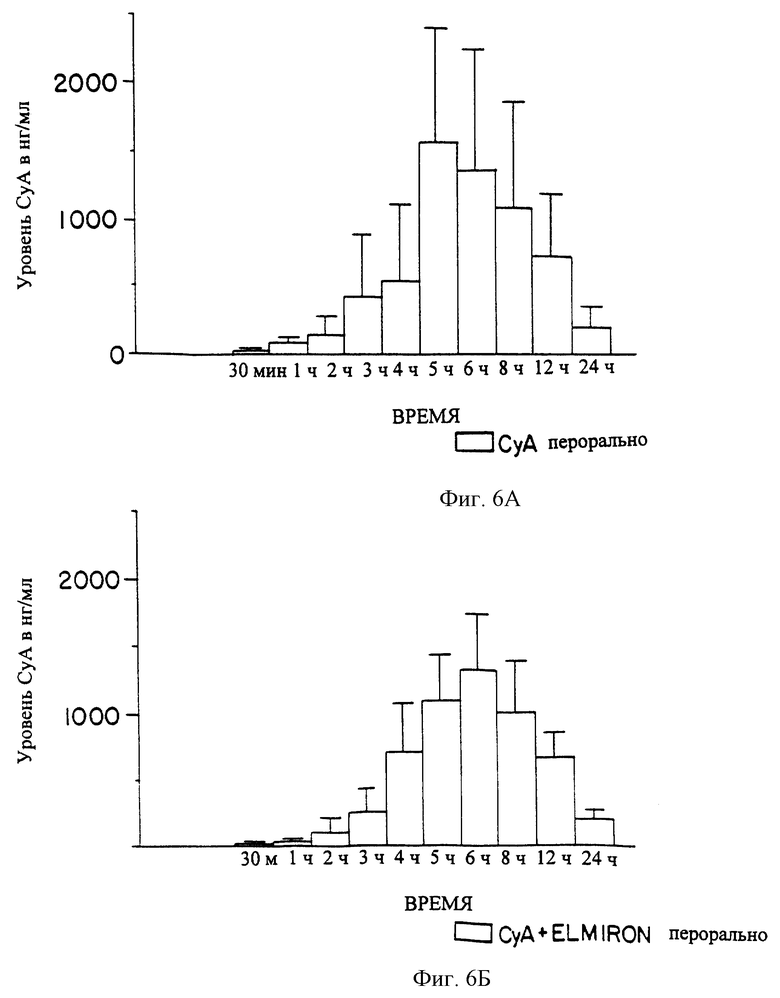
Фиг. 6А представляет собой гистограмму, отражающую уровни СуА в крови, определенные в течение 24-часового периода времени в группе крыс, которым через желудочный зонд вводили СуА в оливковом масле.
Фиг. 6Б представляет собой гистограмму, отражающую уровни СуА в крови, определенные в течение 24-часового периода времени в группе крыс, которым через желудочный зонд вводили СуА в оливковом масле и PPS (ELMIRON®) в воде.
Подробное описание изобретения
Полисульфат пентозана (PPS) является высокосульфатированным полусинтетическим полисахараидом с молекулярной массой, в диапазоне примерно от 1500 до 6000 Да, в зависимости от способа выделения. PPS может быть отнесен к тому же общему классу соединений, к которому принадлежат гепарины и гепариноиды, однако между PPS и гепарином имеется множество различий в химической структуре, в методах получения производных и в физико-химических свойствах. В то время, как гепарин обычно выделяют из тканей млекопитающих, таких, как мышцы, печень и кишечник быка и свиньи, PPS является полусинтетическим соединением, полисахаридный скелет которого, ксилан, экстрагируют из коры бука или других растительных источников, а затем обрабатывают сульфатирующими агентами, такими, как хлорсульфоновая кислота или сульфурилхлорид и кислота. После сульфатирования PPS обычно обрабатывают гидроксидом натрия, чтобы получить натриевую соль. Структурная формула PPS приведена ниже:
Как видно, PPS представляет собой сульфатированный линейный полимер, состоящий из повторяющихся единичных мономеров D-ксилозы, пятиуглеродного углевода, пентозы, в циклической пиранозной форме. В то время, как гепарин вращает плоскость поляризованного света вправо, PPS является левовращающим.
Что касается биологических свойств, то PPS продлевает неполное тромбопластиновое время и применялся для предотвращения тромбозов глубоких вен, но он обладает только примерно одной пятнадцатой от антикоагулянтной эффективности гепарина (см. Wardle, J. Int. Med. Res., 20:361-370, 1992). PPS был также раскрыт в патенте inter alia в качестве средства, применяемого для лечения инфекций мочевых путей и интерстициальных циститов (патент США 5180715); в комбинации с ангиостатическим стероидом он останавливает ангиогенез и образование капилляров, клеточных или мембранных неплотностей (патент США 4820693); и для лечения хронических прогрессирующих сосудистых заболеваний (патент США 5643892), включая фиброзные поражения почек, такие, как гломерулосклероз.
Некоторые исследователи показали, что PPS ингибирует пролиферацию клеток гладкой мышцы и снижает гиперлипидемию, и на основании этих данных предположили, что PPS может применяться профилактически для ограничения образования атеросклеротических бляшек, подавления мезангиальной клеточной пролиферации и предотвращения развития коллагеноза и гломерулосклероза (Paul et al. , Thromb. Res., 46:793-800, 1987; Wardle, там же). Однако ранее никто не обратил внимания на почечную интерстициальную ткань или мелкие кровеносные сосуды (в противоположность подавлению клеточной пролиферации) и не продемонстрировал, что можно задержать и/или устранить острое сосудистое нарушение и сморщивание почки, т.е. PPS не рассматривался в этом контексте. Более того, ни одно из прежних предположений в этой области о возможном применении PPS при заболеваниях, связанных с рубцеванием, не было подкреплено какими-либо существенными научными данными об эффективности, полученными на интактных животных, а вместо этого предположения основывались на исследованиях клеток in vitro, выделенных из ткани(ей) животных.
Несмотря на то, что недавно в патенте было раскрыто применение PPS при подавлении фиброза и образовании рубцов (см., например, Roufa et al., патент США 5605938), эта программа имеет дело с подавлением инвазии фибробластов в кожу и связанные с ней ткани, но не с острыми или хроническими заболеваниями, связанными с рубцеванием гладкой мышцы и/или почечной интерстициальной ткани, которые отличаются по этиологии и патологии.
В одном аспекте или варианте воплощения настоящее изобретение относится к способу предотвращения, снижения или обратимости индуцированной циклоспорином или такролимусом нефротоксичности у больных млекопитающих, подвергающихся терапии циклоспорином или такролимусом, к упомянутому способу, состоящему во введении таким пациентам эффективного в снижении нефротоксичности количества полисульфата пентозана (PPS) или его фармацевтически приемлемой соли. Во втором аспекте или варианте воплощения изобретение относится к способу лечения пациентов, нуждающихся в терапии циклоспорином, например, пациентов, которым требуется подавить иммунитет для предотвращения отторжения трансплантата или для лечения иммунных заболеваний, посредством сочетанного введения, по меньшей мере, одного циклоспорина и эффективного в снижении нефротоксичности количества PPS.
В настоящее время циклоспорины применяются или предложены для применения в клинической практике в качестве агентов для профилактики отторжения органа, например, при аллогенных трансплантатах почки, печени, поджелудочной железы, костного мозга и сердца; при лечении аутоиммунных заболеваний, например ревматоидных артритов, системной красной волчанки, множественного склероза, тяжелой миастении, болезни Крона и первичного билиарного цирроза (см. , например, патент США 5204329); и иммуновоспалительных заболеваний кожи, таких, как псориаз, атопические дерматиты, контактные дерматиты, экзематозные дерматиты, себоррейные дерматиты, красный плоский лишай, пузырчатка, пемфигоид, врожденный буллезный эпидермолиз, крапивница, ангиоотеки, васкулиты, эритемы и кожные эозинофилии (см., например, патент США 5286730).
В соответствии с изобретением больному млекопитающему, уже получающемуся или собирающемуся получать циклоспорин для лечения любого из упомянутых выше заболеваний или каких-либо других клинических симптомов, вводят эффективное в снижении нефротоксичности количество PPS или его фармацевтически приемлемой соли. Выражение "эффективное в снижении нефротоксичности количество", как оно использовано здесь, означает количество PPS или его соли, включенное в фармацевтический состав, которое эффективно, если дается один или несколько раз в день в течение определенного периода времени (периода, который может начинаться до, одновременно или после начала терапии циклоспорином), в предотвращении или существенном ослаблении нефротоксических эффектов, вызванных введением циклоспорина.
У человека эффективной в достижении терапевтической цели, состоящей в предотвращении, ослаблении или обратимости индуцированной циклоспорином нефротоксичности и нефропатии, является общая дневная доза PPS или соли PPS примерно 2-50 мг/кг, предпочтительно примерно 5-30 мг/кг веса тела пациента или примерно 140-3500 мг в день для взрослых пациентов (и предпочтительно примерно 350-2000 мг), введенная в виде от одной до четырех отдельных доз. У мелких млекопитающих интервалы доз могут быть повышены или понижены в зависимости от веса тела, вида и природы заболевания.
Предпочтительным вариантом осуществления нового способа лечения является введение пациенту фармацевтической композиции, включающей эффективное количество PPS или соли PPS и, по меньшей мере, одного фармацевтически приемлемого инертного ингредиента. Состав может быть в любой стандартной лекарственной форме, но предпочтительной является лекарственная форма для перорального введения.
Лекарственные формы для пероральной доставки могут включать обычные таблетки, таблетки с покрытием, капсулы или каплетки, медленно распадающиеся таблетки, капсулы или каплетки, леденцы, жидкости, эликсиры или любые другие лекарственные формы, известные в области фармации.
В качестве фармацевтически приемлемых инертных ингредиентов предполагаются наполнители, связующие вещества, растворители и т.д., которые не оказывают влияния на желаемую активность PPS. При необходимости регулировать объем лекарственной формы можно также использовать наполнители, такие, как глины или кремнезем.
Другие ингредиенты, такие, как наполнители и носители, могут быть необходимы для того, чтобы обеспечить желаемые физические свойства лекарственной формы. Такими физическими свойствами являются, например, скорость высвобождения, структура и объем. Примерами наполнителей и носителей, применимыми для пероральных лекарственных форм, являются воски, такие, как пчелиный воск, касторовый воск, гликовоск и карнаубский воск, производные целлюлозы, такие, как метилцеллюлозы, этилцеллюлоза, карбоксиметилцеллюлоза, ацетат-фталат целлюлозы, гидроксипропилцеллюлоза и гидроксипропилметилцеллюлоза, поливинилхлорид, поливинилпирролидон, стеариловый спирт, моностеарат глицерина, производные метакрилата, такие, как полиметакрилат, метилметакрилат и этиленгликольдиметакрилат, полиэтиленгликоль и гидрофильные смолы.
Желательно, чтобы в составах по настоящему изобретению ингредиент с активностью PPS присутствовал в количестве между примерно 50 мг и примерно 300 мг на единичную дозу. Точная доза, введенная каждому пациенту, будет зависеть от состояния и физических характеристик пациента, таких, как возраст и вес тела.
Активным фармацевтическим ингредиентом может быть PPS или его фармацевтически приемлемая соль, например натриевая соль. Одной из приемлемых лекарственных форм для перорального применения по способу данного изобретения является EMIRON® в виде желатиновых капсул (от фирмы Baker Norton Pharmaceuticals, Inc., Майами, Флорида), которые содержат 100 мг натриевой соли PPS и в качестве наполнителей - микрокристаллическую целлюлозу и стеарат магния.
Хотя пероральный путь введения и является предпочтительным, настоящий способ лечения охватывает также введение PPS и его соли с помощью парентерального, трансдермального и трансмукозального путей или с помощью любого другого пути введения, известного и обычно применяемого в медицинской и фармацевтической областях. Более того, композиции по изобретению могут включать PPS в фармацевтически приемлемой парентеральной, трансдермальной, трансмукозальной лекарственных формах или в других известных носителях наряду с соответствующими инертными растворителями, наполнителями и вспомогательными веществами. Многие примеры таких фармацевтически приемлемых носителей можно найти в монографии Remington's Pharmaceutical Sciences (17-oe издание, 1985 г. ) и в других стандартных текстах. Независимо от используемого пути введения или типа фармацевтической лекарственной формы дневная доза для активного ингредиента с активностью PPS находится в интервале от примерно 2 до примерно 50 мг/кг веса тела пациента или примерно от 140 до примерно 3500 мг для взрослых пациентов и предпочтительно от примерно 5 до примерно 30 мг/кг или примерно от 350 до примерно 2000 мг, хотя при парентеральном введении могли бы использоваться величины доз на нижнем пределе этого интервала.
Фармацевтические композиции, применяемые по способу данного изобретения, могут включать активные ингредиенты, иные чем PPS или соль PPS, например, другие агенты, которые могут оказаться полезными в предотвращении вызванного циклоспорином повреждения почек или проявления токсичности.
В соответствии с различными вариантами воплощения способа по настоящему изобретению композиции, содержащие PPS (или соль PPS), можно вводить пациенту до начала терапии циклоспорином или такролимусом (например, до нескольких дней перед началом), одновременно с циклоспорином или такролимусом и/или в течение соответствующего периода времени после окончания терапии циклоспорином или такролимусом. В предпочтительном варианте воплощения изобретения, по меньшей мере, одну дозу PPS или соли PPS вводят пациенту в течение 24 ч до, вместе или через 24 ч после введения циклоспорина или такролимуса. Композиции, содержащие PPS, можно вводить пациенту в то же самое время, что и композиции с циклоспорином или такролимусом, но в отдельной лекарственной форме или можно вводить пациенту в другое время суток, чем композиции, содержащие циклоспорин или такролимус.
В качестве альтернативы в дальнейшем варианте воплощения настоящего изобретения комбинированные лекарственные формы PPS (или соли PPS) и циклоспорина (или такролимуса) можно вводить пациентам, нуждающимся в иммуносупрессивной терапии. Такие комбинированные лекарственные формы содержат эффективное в индуцировании иммуносупрессии количество или циклоспорина, или такролимуса, например, примерно от 25 до примерно 200 мг циклоспорина предпочтительно СуА. Комбинированные лекарственные формы содержат также эффективное в снижении нефротоксичности количество PPS или соли PPS, например, от примерно 50 до примерно 500 мг. Такие лекарственные формы могут быть в любом виде, пригодном для пероральной или парентеральной доставки или введения описанными выше способами, и могут содержать любые фармацевтически приемлемые наполнители, связующие вещества, растворители, носители и другие наполнители или инертные ингредиенты, которые специалисты в области фармации считают подходящими.
Циклоспорином, который в настоящее время наиболее широко применяется в клинической практике для достижения иммуносупрессии или для лечения аутоиммунных или иммуновоспалительных заболеваний, является СуА, известный также как циклоспорин. Однако введение композиций по настоящему изобретению, содержащих PPS в сочетании с циклоспорином с целью предотвращения нефротоксичности можно осуществлять с применением любого циклоспорина, например, циклоспоринов A-Z и их производных. Более того, любой из циклоспоринов A-Z или какой-либо другой циклоспорин можно применять в сочетании с PPS или солью PPS в новой комбинированной лекарственной форме по изобретению. Очевидно также, что вследствие схожести путей внутриклеточной передачи сигнала и характера почечной токсичности FK-506, или такролимуса, и СуА токсичность, связанная с введением такролимуса, должна также уменьшаться при совместном введении с PPS или солью PPS.
Структуры циклоспоринов A-Z (все циклические ундекапептиды) приведены в таблице.
Следующие примеры демонстрируют эффективность нового способа в предотвращении или существенном снижении и обращении вызванной циклоспорином нефротоксичности, особенно некротических повреждений артериол в почках. Эти примеры являются только иллюстративными и не претендуют на описание диапазона материалов, композиций, составов или доз, которые могут эксклюзивно применяться для осуществления на практике настоящего изобретения.
Пример 1
Двум группам крыс лини Sprague-Dawley устанавливали рацион с низким содержанием соли в течение двух недель до начала экспериментального исследования и держали на этом рационе в продолжении всего исследования. Затем первой группе (контроль) вводили 15 мг/кг/день СуА путем инъекции в течение периода 45 дней. Второй группе вводили такую же дозу СуА, как первой группе, но также ежедневно проводили инъекции 10 мг/кг PPS (ELMIRON®) в течение 45-ти дневного периода. По окончании эксперимента животных умерщвляли и их почки подвергали микроскопическому исследованию и морфометрической оценке.
Как видно на микрофотографиях на фиг. 1А и 1Б, в почках контрольной группы крыс обнаружены большие области интерстициального фиброза. Отмечено небольшое количество воспалительных клеток, находящихся внутри фиброзных участков. В почках крыс, получавших как СуА, так и ELMIRON®, обнаружено, что большинство почечных канальцев тесно прилегают друг к другу, как в нормальном состоянии, и отмечено четкое уменьшение в распространении фиброза или клеточного инфильтрата между канальцами.
Количественная оценка интерстициального фиброза в каждой из опытных групп была проведена с помощью морфометрического исследования почек. Как показано на фиг.2, у обработанных с ELMIRON® крыс наблюдалось примерно 50%-ное уменьшение интерстициального фиброза.
Размеры клубочков в почках крыс в контрольной группе и в группах, обработанных с ELMIRON®, измеряли с помощью видеоанализа. Пятьдесят клубочков, отобранных последовательно, оценивали с помощью стандартной морфометрической техники. Как показано на фиг.3, средний объем клубочка в группе, получавшей инъекции как СуА, так и ELMIRON®, был значительно больше, чем объем клубочка в контрольной группе, получавшей только СуА. Из этого следовало, что в обработанной группе PPS защищал почечные клубочки крыс от ишемической ретракции, вызываемой СуА.
Пример 2
Двум группам крыс лини Sprague-Dawley устанавливали рацион с низким содержанием соли в течение двух недель до начала экспериментального исследования и держали на этом рационе в продолжении всего исследования. Затем первой группе (контроль) вводили 15 мг/кг/день СуА путем инъекции в течение периода 15 дней. Второй группе вводили такую же дозу СуА, как первой группе, но ежедневно проводили также инъекции 10 мг/кг PPS (ELMIRON®) в течение 15-ти дневного периода. По окончании эксперимента животных умерщвляли и их почки подвергали микроскопическому исследованию.
Фиг. 4А и 4Б представляют микрофотографии, показывающие поперечные срезы клубочков почек крыс из контрольной группы (фиг.4А) и из группы, обработанной с ELMIRON® (фиг.4Б) соответственно. На фиг.4А небольшую (афферентную) артериолу с "фибриноидным" некрозом по всей стенке можно видеть справа от клубочка (в центре поля).
В отличие от этого, не было никаких повреждений в афферентных и эфферентных артериолах в гломерулярном сосудистом полюсе, показанном на фиг.4Б.
В почках контрольной и обработанной с ELMIRON® групп, а также в группе нормальных, не обработанных крыс линии Sprague-Dawley оценивали число "фибриноидных" повреждений в афферентных артериолах. Оценке подвергали пятьдесят последовательных сосудистых полюсных участков в каждой почке. Как показано на фиг. 5, количество повреждений, обнаруженных в обработанной с ELMIRON® группе, было значительно меньше, чем в группе животных, получавших только СуА.
Пример 3
Это исследование проводили для того, чтобы установить, оказывает ли PPS влияние на усвоение СуА в желудочно-кишечном тракте, определяемое по уровням СуА в крови.
Одна группа из десяти крыс линии Spague-Dawley получала СуА (10 мг/кг) в оливковом масле с помощью желудочного зонда. Все образцы крови брали у каждого животного чрез 30 мин, 1 ч, 2 ч, 3 ч, 4 ч, 5 ч, 6 ч, 8 ч, 12 ч и 24 ч после введения СуА. Уровни СуА в образцах измеряли с помощью иммуноферментного анализа ELISA.
Средние значения уровня СуА для этой группы показаны на фиг.6А. Максимальные уровни в крови достигались через 5-8 ч после введения и возвращались к значениям базовой линии через 24 ч. Наблюдались значительные колебания в значениях между животными внутри группы, обычные для этой формы СуА.
Вторая группа из десяти крыс линии Sprague-Dawley получала СуА (10 мг/кг) в оливковом масле, а также PPS (ELMIRON®), 5 мг/кг в воде с помощью желудочного зонда. Все образцы крови брали у животных в те же временные интервалы, что в контрольной группе, и измеряли уровни СуА. Средние значения для группы в каждый интервал времени приведены на фиг. 6Б.
Оказалось, что кривая, приведенная на фиг.6Б, напоминает таковую на фиг. 6А, хотя колебания в значениях между животными внутри группы были значительно меньше. Эти результаты указывают на то, что сочетанное введение пероральной формы PPS и пероральной формой СуА не уменьшает кишечную абсорбцию СуА или не снижает достигаемые уровни СуА в крови. Подобным образом сочетанное введение PPS и СуА не оказывает воздействия на исчезновение СуА из плазмы.
Таким образом, предложены способы и композиции, которые обеспечивают достижение различных целей по изобретению и которые хорошо адаптированы к тому, чтобы соответствовать условиям практического применения.
Поскольку возможны различные предлагаемые варианты воплощения по описанному выше изобретению и поскольку различные изменения могут быть сделаны в вариантах осуществления изобретения, упомянутых выше, следует понимать, что все приведенные здесь материалы должны интерпретироваться как иллюстративные и не с целью ограничения.
То, что заявляется как новое и претендует на защиту патентной грамотой, приведено далее в следующих пунктах формулы изобретения.
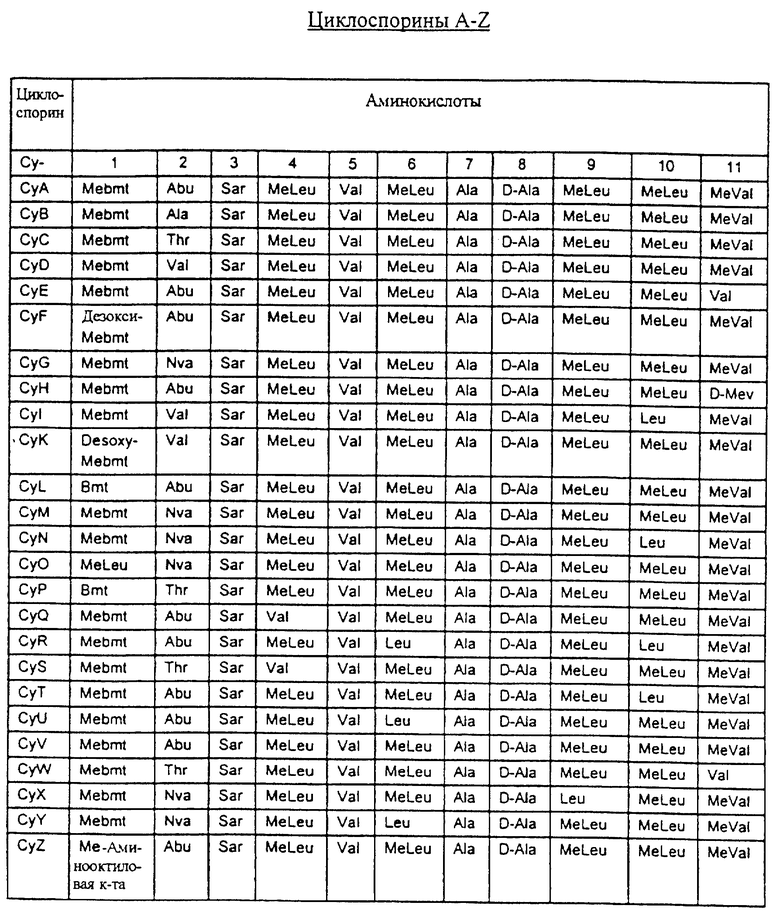

Изобретение относится к медицине, в частности к иммунологии и нефрологии. Способ включает сочетанное введение пациенту циклоспорина либо такролимуса и полисульфата пентозана (РРS) или его фармацевтически приемлемой соли. Предпочтительным является пероральный способ введения. Общая дневная доза PPS или соли PPS находится в интервале от 2 до 50 кг/кг веса тела пациента или от 140 до 3500 мг в день для взрослого человека. Предложен также способ иммуносупрессивной терапии, позволяющий избежать индуцированную циклоспорином или такролимусом нефротоксичность. Для этих целей предлагаются также и фармацевтические композиции. Изобретение обеспечивает профилактику осложнений такого вида иммуносупрессии. 3 с. и 39 з.п.ф-лы, 6 ил., 1 табл.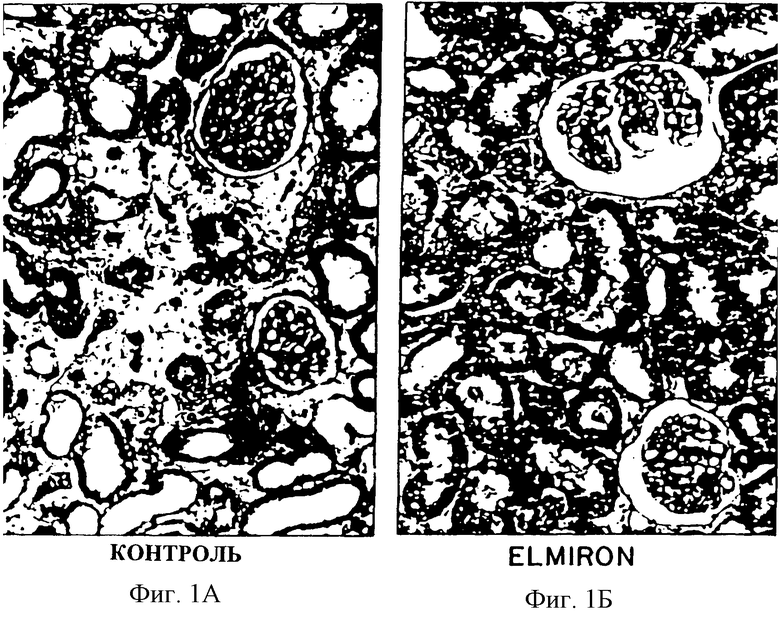
| СПОСОБ ОЧИСТКИ СУСПЕНЗИЙ И ВИБРАЦИОННЫЙ ФИЛЬТР-СГУСТИТЕЛЬ ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 1992 |
|
RU2027471C1 |
| ЦИКЛОСПОРИНЫ | 1991 |
|
RU2085589C1 |
| КОМПОЗИЦИЯ ДЛЯ ВНУТРИВЕННОГО ВВЕДЕНИЯ ДЛЯ ЗАЩИТЫ ПОЧЕК ОТ ТОКСИЧЕСКОГО ДЕЙСТВИЯ НЕФРОТОКСИЧНЫХ ЦИТОСТАТИЧЕСКИХ СРЕДСТВ И ИММУНОСУПРЕССОРОВ | 1989 |
|
RU2077883C1 |
| US 5204329 А, 20.04.1993 | |||
| US 5605938 А, 26.02.1997 | |||
| ПЕРЕВОДЧИКОВА Н.И | |||
| Противоопухолевая химиотерапия | |||
| - М.: Медицина, 1993, с.23-24, 191-205. | |||
Авторы
Даты
2002-10-20—Публикация
1998-10-09—Подача