Данное изобретение касается новых производных аспартилового дипептидного эфира, а также подсластителей и продуктов, таких как сладкие пищевые продукты питания, содержащих указанные производные в качестве активного ингредиента.
В последние годы, когда питание значительно улучшилось, возникла проблема ожирения, вызванного избыточным потреблением сахара, и болезней, сопровождающихся ожирением. Соответственно, существует потребность в создании низкокалорийного подсластителя для замены сахара. В настоящее время в качестве подсластителя широко используют аспартам, отличающийся высокой безвредностью и хорошими вкусовыми свойствами. Однако его стабильность несколько проблематична. В WO 94/11391 указано, что производные, у которых в аминогруппу составляющей аспартам аспарагиновой кислоты введена алкильная группа, имеют заметно улучшенную подслащивающую способность и слегка повышенную стабильность. Лучшим соединением, как сообщается в этом документе, является 1-метиловый сложный эфир N-[N-(3,3-диметилбутил)-L-α-аспартил]-L-фенилаланина, имеющий 3,3-диметилбутильную группу в качестве алкильной группы, подслащивающая способность которого в 10000 раз превышает подслащивающую способность сахара. Там же указаны производные аспартама с 20 типами введенных в них заместителей, отличающихся от 3,3-диметилбутильной группы, и сообщается, что их подслащивающая способность составляет менее чем 2500-кратную подслащивающую способность сахара. Указаны также производные с 3-(замещенный фенил)пропильной группой в качестве алкильной группы. Однако сообщается, что подслащивающая способность 1-метилового сложного эфира N-[N-(3-фенилпропил)-L-α-аспартил]-L-фенилаланина в 1500 раз превышает подслащивающую способность сахара, а 1-метилового сложного эфира N-[N-(3-(3-метокси-4-гидроксифенил)пропил]-L-α-аспартил]-L-фенилаланина - в 2500 раз превышает подслащивающую способность сахара. Таким образом, эта способность намного меньше, чем подслащивающая способность (10000-кратная) 1-метилового эфира N-[N-(3,3-диметилбутил)-L-α-аспартил] -L-фенилаланина. Кроме того, там приведен 1-метиловый эфир N-[N-(3,3-диметилбутил)-L-α-аспартил]-L-тирозина в качестве примера производных, у которых метиловый эфир L-фенилаланина замещен на другой сложный эфир аминокислоты, и сообщается, что его подслащивающая способность в 4000 раз превышает подслащивающую способность сахара.
В этой связи, требуется создание низкокалорийного подсластителя с высокой подслащивающей способностью.
Решаемая проблема состоит в создании новых производных аспартилового дипептидного эфира, обладающих высокой безвредностью и имеющих подслащивающую способность, равную либо большую, чем подслащивающая способность 1-метилового сложного эфира N-[N-(3,3-диметилбутил)-L-α-аспартил]-L-фенилаланина, а также в получении низкокалорийного подсластителя, содержащего такое производное в качестве активного ингредиента и т.п.
Для решения этой задачи авторы изобретения синтезировали несколько производных аспартама, у которых различные 3-(замещенный фенил)пропильные группы введены по атому азота аспарагиновой кислоты, составляющей производные аспартама, причем группа метилового сложного эфира L-фенилаланина в аспартаме замещена другим сложным эфиром аминокислоты, посредством восстановительного алкилирования с применением циннамальдегидов, имеющих различные заместители и легко доступных, или 3-фенилпропиональдегида, имеющего различные заместители, которые могут быть легко получены из альдегида-предшественника, и исследовали их подслащивающую способность. В результате они обнаружили, что в отношении подслащивающей способности найденные ими новые соединения намного эффективнее не только 1-метилового эфира N-[N-(3,3-диметилбутил)-L-α-аспартил] -L-тирозина, который, как сообщается в WO 94/11391, имеет подслащивающую способность в 4000 раз выше таковой у сахара, но также 1-метилового эфира N-[N-(3,3-диметилбутил)-L-α-аспартил] -L-фенилаланина, способность которого, как сообщается там же, в 10000 раз превышает подслащивающую способность сахара, а также, что соединения, представленные ниже формулой (1), особенно хороши в качестве подсластителей. Эти находки легли в основу настоящего изобретения.
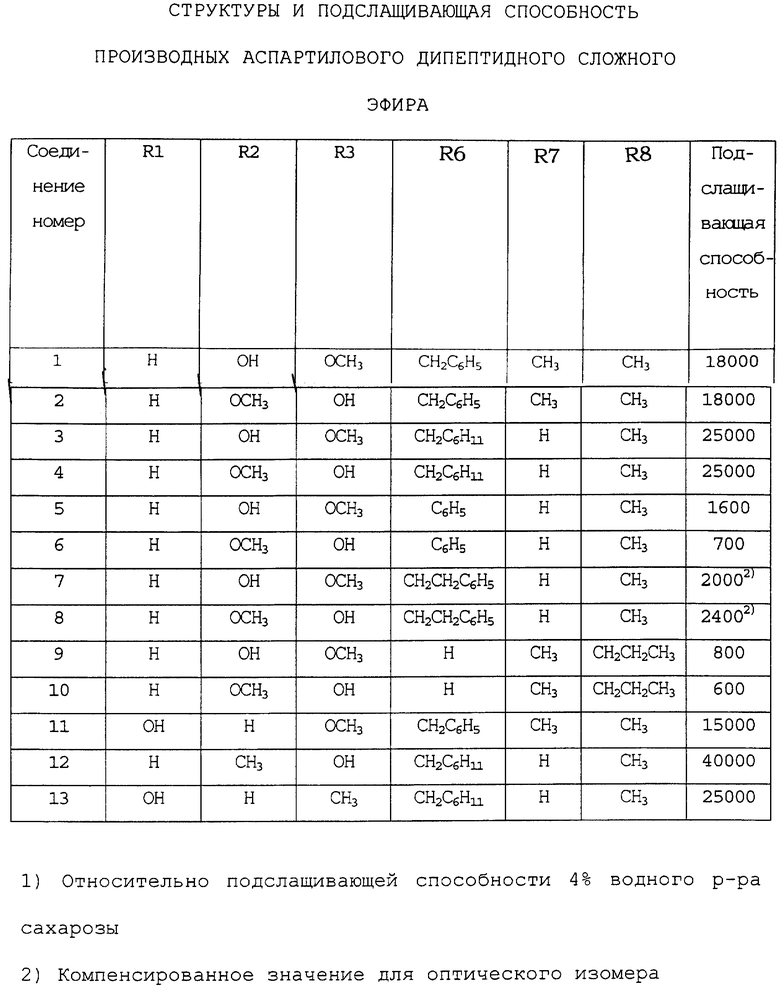
Настоящее изобретение касается новых производных аспартилового дипептидного сложного эфира (включая их соли), представленных следующей общей формулой (1):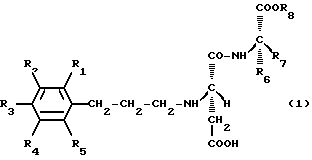
где каждый из R1, R2, R3, R4 и R5 независимо друг от друга обозначает заместитель, выбранный из атома водорода (Н), гидроксильной группы (ОН), алкоксильной группы с 1-3 атомами углерода (ОСН3, ОСН2СН3, ОСН2СН2СН3 и т.д. ), алкильной группы с 1-3 атомами углерода (СН3, СН2СН3, СН2СН2СН3 и т.д.) и гидроксиалкилоксильной группы с 2 или 3 атомами углерода (O(СН2)2ОН, ОСН2СН(ОН)СН3 и т.д.), или R1 и R2, или R2 и R3 вместе образуют метилендиоксильную группу (OCH2O), причем каждый из R4, R5 и R1 или R3, не образующий метилендиоксильную группу, независимо друг от друга обозначает любой из вышеупомянутых заместителей, указанных для R1, R3, R4 и R5 соответственно;
R6 обозначает заместитель, выбранный из атома водорода, бензильной группы (CH2C6H5), п-гидроксибензильной группы (СН2С6Н4-п-ОН), циклогексилметильной группы (CH2C6H11), фенильной группы (C6H5), циклогексильной группы (C6H11), фенилэтильной группы (CH2CH2C6H5) и циклогексилэтильной группы (CH2CH2C6H11);
R7 обозначает заместитель, выбранный из атома водорода, метильной группы (СН3), этильной группы (СН2СН3) и изопропильной группы (СН(СН3)2);
R8 обозначает заместитель, выбранный из метильной группы, этильной группы, изопропильной группы, н-пропильной группы (СН2СН2СН3) и трет-бутильной группы (С(СН3)3);
при условии, что исключаются производные, у которых R6 представляет бензильную группу, а R7 в то же время представляет атом водорода, и производные, у которых R6 представляет п-гидроксибензильную группу, а R7 в то же время представляет атом водорода.
ВАРИАНТЫ ВЫПОЛНЕНИЯ ИЗОБРЕТЕНИЯ
Новые производные аспартилового дипептидного эфира по изобретению включают соединения, представленные вышеуказанной общей формулой (1), а также их соли.
Составляющая эти производные аспарагиновая кислота является L-изомером, а другая составляющая их аминокислота может быть L- или D-изомером.
В число предпочтительных соединений, составляющих варианты выполнения изобретения, входят следующие из описанных выше соединений по изобретению.
[1] Из числа соединений, представленных вышеуказанной общей формулой (1), эти соединения, у которых R7 является заместителем, выбранным из метильной группы, этильной группы и изопропильной группы; каждый из R1, R2, R3, R4 и R5, независимо друг от друга, является заместителем, выбранным из атома водорода, гидроксильной группы, алкоксильной группы с 1-3 атомами углерода, алкильной группы с 1-3 атомами углерода и гидроксиалкилоксильной группы с 2 или 3 атомами углерода (например, O(СН2)2OН, ОСН2СН(ОН)СН3 и т.д.), или R1 и R2 или R2 и R3 вместе образуют метилендиоксильную группу (ОСН2О), причем каждый из R4, R5 и R1 или R3, не образующий метилендиоксильную группу, независимо друг от друга, является заместителем, выбранным из любого указанного заместителя, обозначающего или приведенного в качестве примера для R1, R3, R4 и R5 соответственно; R6 является заместителем, выбранным из атома водорода, бензильной группы, п-гидроксибензильной группы, циклогексилметильной группы, фенильной группы, циклогексильной группы, фенилэтильной группы и циклогексилэтильной группы; R8 является заместителем, выбранным из метильной группы, этильной группы, изопропильной группы, н-пропильной группы и трет-бутильной группы.
[2] Из числа соединений, представленных общей формулой (1), - это соединения, у которых R6 является заместителем, выбранным из атома водорода, циклогексилметильной группы, фенильной группы, циклогексильной группы, фенилэтильной группы и циклогексилэтильной группы; каждый из R1, R2, R3, R4 и R5, независимо друг от друга, является заместителем, выбранным из атома водорода, гидроксильной группы, алкоксильной группы с 1-3 атомами углерода, алкильной группы с 1-3 атомами углерода и гидроксиалкилоксильной группы с 2 или 3 атомами углерода (например, O(СН2)2OН, ОСН2СН(ОН)СН3 и т.д.), или R1 и R2 или R2 и R3 вместе образуют метилендиоксильную группу (ОСН2О), причем каждый из R4, R5 и R1 или R3, не образующий метилендиоксильную группу, независимо друг от друга, является заместителем, выбранным из любого заместителя, указанного для обозначения или приведенного в качестве примера для R1, R3, R4 и R5 соответственно; R7 является заместителем, выбранным из атома водорода, метильной группы, этильной группы и изопропильной группы; R8 является заместителем, выбранным из метильной группы, этильной группы, изопропильной группы, н-пропильной группы и трет-бутильной группы.
[3] Из числа соединений, представленных общей формулой (1), - это соединения, у которых R2 является гидроксильной группой, R3 является метоксильной группой, R1, R4 и R5 являются атомами водорода, R6 является бензильной группой, a R7 и R8 являются метильными группами.
[4] Из числа соединений, представленных общей формулой (1), - это соединения, у которых R2 является метоксильной группой, R3 является гидроксильной группой, R1, R4 и R5 являются атомами водорода, R6 является бензильной группой, a R7 и R8 являются метильными группами.
[5] Из числа соединений, представленных общей формулой (1), - это соединения, у которых R2 является гидроксильной группой, R3 является метоксильной группой, R1, R4, R5 и R7 являются атомами водорода, R6 является циклогексилметильной группой, a R8 является метильной группой.
[6] Из числа соединений, представленных общей формулой (1), - это соединения, у которых R2 является метоксильной группой, R3 является гидроксильной группой, R1, R4, R5 и R7 являются атомами водорода, R6 является циклогексилметильной группой, a R8 является метильной группой.
[7] Из числа соединений, представленных общей формулой (1), - это соединения, у которых R2 является гидроксильной группой, R3 является метоксильной группой, R1, R4, R5 и R7 являются атомами водорода, R6 является фенильной группой, а R8 является метильной группой.
[8] Из числа соединений, представленных общей формулой (1), - это соединения, у которых R2 является метоксильной группой, R3 является гидроксильной группой, R1, R4, R5 и R7 являются атомами водорода, R6 является фенильной группой, а R8 является метильной группой.
[9] Из числа соединений, представленных общей формулой (1), - это соединения, у которых R2 является гидроксильной группой, R3 является метоксильной группой, R1, R4, R5 и R7 являются атомами водорода, R6 является 2-фенилэтильной группой, a R8 является метильной группой.
[10] Из числа соединений, представленных общей формулой (1), - это соединения, у которых R2 является метоксильной группой, R3 является гидроксильной группой, R1, R4, R5 и R7 обозначают атомы водорода, R6 является 2-фенилэтильной группой, a R8 является метильной группой.
[11] Из числа соединений, представленных общей формулой (1), - это соединения, у которых R2 является гидроксильной группой, R3 является метоксильной группой, R1, R4, R5 и R6 являются атомами водорода, R7 является метильной группой, а R8 является н-пропильной группой.
[12] Из числа соединений, представленных общей формулой (1), - это соединения, у которых R2 является метоксильной группой, R3 является гидроксильной группой, R1, R4, R5 и R6 являются атомами водорода, R7 является метильной группой, а R8 является н-пропильной группой.
[13] Из числа соединений, представленных общей формулой (1), - это соединения, у которых R1 является гидроксильной группой, R3 является метоксильной группой, R2, R4 и R5 являются атомами водорода, R6 является бензильной группой, a R7 и R8 являются метильными группами.
[14] Из числа соединений, представленных общей формулой (1), - это соединения, у которых R2 и R8 являются метильными группами, R3 является гидроксильной группой, R1, R4, R5 и R7 являются атомами водорода, a R6 является циклогексилметильной группой.
[15] Из числа соединений, представленных общей формулой (1), - это соединения, у которых R1 является гидроксильной группой, R3 и R8 являются метильными группами, R2, R4, R5 и R7 являются атомами водорода, a R6 является циклогексилметильной группой.
[16] Подсластители или продукты, такие как имеющие сладость пищевые продукты, включающие в качестве активного ингредиента по меньшей мере одно производное, выбранное из производных по изобретению. Эти подсластители или продукты могут дополнительно включать носитель или наполнитель для подсластителей.
[17] Способ придания сладости, предусматривающий включение или внесение (добавление, смешивание или тому подобное) по меньшей мере одного соединения, выбранного из производных по изобретению, в продукты, требующие сладости, такие как пищевые продукты, питьевые продукты (напитки), продукты гигиены полости рта и тому подобные.
[18] Способ получения соединений общей формулы (1), предусматривающий стадию реакции альдегида, представленного следующей общей формулой (2) или (3), с производным аспартама, представленным следующей формулой (4), в условиях восстановительного алкилирования.
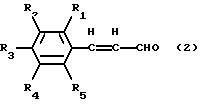
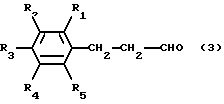
где R1, R2, R3, R4 и R5 имеют те же значения, что и значения R1, R2, R3, R4 и R5, указанные для приведенной выше формулы (1) производных по изобретению.
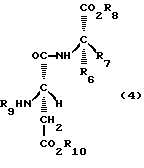
где R6, R7 и R8 имеют те же значения, что и значения R6, R7 и R8, указанные для приведенной выше общей формулы (1) производных по изобретению; R9 обозначает заместитель, выбранный из атома водорода и заместителя, способного превращаться в атом водорода в условиях восстановительного алкилирования; R10 обозначает заместитель, выбранный из атома водорода и заместителя, который может быть использован для защиты карбоксильной группы, такого как бензильная группа и трет-бутильная группа.
Указанный способ включает стадию реакции в любых условиях восстановительного алкилирования и может дополнительно включать другую стадию (другие стадии), например любые стадии для получения соединения общей формулы (1), такие как стадии удаления защитной группы и образования солей после стадии реакции в условиях восстановительного алкилирования, если требуется.
В качестве заместителя, способного превращаться в атом водорода в условиях восстановительного алкилирования, может быть выбран любой заместитель из числа известных заместителей, удовлетворяющих указанным условиям, например, бензилоксикарбонильная группа. Что касается условий восстановительного алкилирования, то могут использоваться, подходящие условия восстановления, как уже известные сами по себе, так и обнаруженные позднее, такие как условия с использованием гидрида металла.
Данное изобретение предпочтительно включает, в качестве варианта выполнения способ согласно по вышеуказанному выполнению [18], где одна или более гидроксильных групп в альдегиде, представленном вышеуказанной формулой (2) или (3), защищены подходящими защитными группами (например, бензильной группой) в случае альдегида с одной или более гидроксильными группами.
Примеры солей соединений по изобретению включают: соли щелочных металлов, таких как натрий или калий; соли щелочноземельных металлов, таких как кальций и магний; соли аммония с аммиаком; соли с аминокислотами, такими как лизин и аргинин; соли с неорганическими кислотами, такими как соляная кислота и серная кислота, и соли с органическими кислотами, такими как лимонная кислота и уксусная кислота. Как указано выше, они входят в число производных по изобретению.
Производные аспартилового дипептидного эфира по изобретению легко могут быть получены восстановительным алкилированием производных аспартама, у которых группа метилового эфира L-фенилаланина в аспартаме замещена другим сложным эфиром аминокислоты, альдегидами коричной кислоты, имеющими различные заместители, в присутствии восстанавливающего агента (например, водорода/палладия на углероде в качестве катализатора). Альтернативно эти производные могут быть получены из производных аспартама (например, метилового эфира β-O-бензил-α-L-аспартил-L-аминокислоты), имеющих защитную группу в карбоновой кислоте в бета-положении и получаемых обычным способом пептидного синтеза (Izumya et al., Basis of Peptide Synthesis and Experiments Thereof, Maruzen, published January 20, 1985), восстановительным алкилированием с применением альдегидов коричной кислоты, имеющих различные заместители, и восстанавливающего агента (например, NaB(OAc)3H) (A.F. Abdel-Magid et al., Tetrahedron Letters, 31, 5595 (1990)) и последующим удалением защитной группы. Однако способ получения соединений по изобретению этим не ограничивается. 3-Фенилпропиональдегиды с различными заместителями или их ацетальпроизводные могут, конечно, использоваться, как и предшествующие альдегиды, в восстановительном алкилировании вместо альдегидов коричной кислоты, имеющих различные заместители.
В результате органолептической оценки установлено, что соединения по изобретению и их соли обладают сильной подслащивающей способностью и имеют органолептические свойства, подобные свойствам сахара. Например, подслащивающая способность 1-метилового эфира N-[N-[3-(3-гидрокси-4-метоксифенил)пропил] -L-α-аспартил] -L-(α-метил)фенилаланина является приблизительно 18000-кратной (по сравнению с сахаром), 1-метилового эфира N-[N-[3-(3-метокси-4-гидроксифенил)пропил] -L-α-аспартил] -L-(α-метил)фенилаланина - приблизительно 18000-кратной (по сравнению с сахаром), 1-метилового эфира N-[N-[3-(3-гидрокси-4-метоксифенил)пропил] -L-α-аспартил] -3-циклогексил-L-аланина - приблизительно 25000-кратной (по сравнению с сахаром), N-[N-[3-(3-метокси-4-гидроксифенил)пропил] -L-α-аспартил] -3-циклогексил-L-аланина - приблизительно 25000-кратной (по сравнению с сахаром) и N-[N-[3-(3-метил-4-гидроксифенил)пропил]-L-α-аспартил]-3-циклогексил-L-аланина - приблизительно 40000-кратной (по сравнению с сахаром).
В таблице приведены структуры производных аспартилового дипептида, представленных следующей общей формулой (5), и результаты их органолептической оценки.
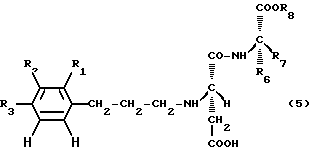
Как видно из результатов таблицы, новые производные по данному изобретению обладают великолепной подслащивающей способностью.
Когда производные (включая соединения по изобретению и их соли) по изобретению используют в качестве подсластителей, они, конечно, могут использоваться в сочетании с другими подсластителями, если не возникают какие-либо особые проблемы.
При использовании производных по изобретению в качестве подсластителей могут также применяться соответствующие носители и/или соответствующие наполнители, если требуется. В продаже имеются такие носители, наполнители или подобные вещества, известные по себе и применяемые для подсластителей.
Производные по изобретению могут использоваться в качестве подсластителей или их ингредиентов и, кроме того, в качестве подсластителей для таких продуктов, как пищевые продукты и т.п., которым требуется придать сладкий вкус, например конфеты, жевательная резинка, продукты гигиены, парфюмерия, косметика, фармацевтические продукты и ветеринарные продукты для животных. Более того, они могут использоваться в форме продуктов, имеющих сладкий вкус, включающих производные по изобретению, и могут использоваться в способе подслащивания продуктов, требующих придания сладости. Способ этот может быть известным по себе способом, например традиционным способом использования подслащивающего ингредиента в подсластителях или в способе придания сладости.
ПРЕДПОЧТИТЕЛЬНЫЕ ВАРИАНТЫ ВЫПОЛНЕНИЯ ИЗОБРЕТЕНИЯ
Данное изобретение иллюстрируется более подробно последующими примерами. Эти примеры не должны ограничивать настоящее изобретение.
В последующих примерах ЯМР-спектр получали на устройстве "Varian Gemini-300 (300 МГц)", а МС-спектр - на устройстве "Thermo Quest TSQ700.
ПРИМЕР 1.
Синтез 1-метилового эфира N-[N-[3-(3-гидрокси-4-метоксифенил)пропил]-L-α-аспартил]-L-(α-метил)фенилаланина.
Двадцать миллилитров метанола охлаждали до 0oС. Добавляли к нему по каплям 1,09 мл (15,0 ммоль) тионилхлорида. Затем к смеси добавляли 1,0 г (5,58 ммоль) L-(α-метил)фенилаланина и перемешивали в течение 1 часа при 0oС и далее до утра при 70oС. Растворитель удаляли при пониженном давлении. К остатку добавляют 5% водный раствор бикарбоната натрия и дважды экстрагировали 50 мл метиленхлорида. Органический слой сушили над безводным сульфатом магния и сульфат магния удаляли фильтрованием. Фильтрат концентрировали при пониженном давлении, получая 0,95 г (4,92 ммоль) метилового эфира L-(α-метил)фенилаланина в виде масла.
К 30 мл метиленхлорида добавляли 0,95 г (4,92 ммоль) метилового эфира L-(α-метил)фенилаланина и 1,59 г (4,92 ммоль) β-бензилового эфира N-трет-бутоксикарбонил-L-аспарагиновой кислоты. Смесь охлаждали до 0oС. К смеси добавляли 730 мг (5,41 ммоль) 1-гидроксибензотриазолгидрата (HOBt) и 1,04 г (5,41 ммоль) водорастворимого гидрохлорида карбодиимида, перемешивали при 0oС в течение 1 часа и далее при комнатной температуре до утра. Реакционную смесь концентрировали при пониженном давлении и к остатку добавляли 50 мл воды, смесь дважды экстрагировали 50 мл этилацетата. Органический слой дважды промывали 50 мл 5% водного раствора лимонной кислоты, однократно 50 мл насыщенного водного раствора хлористого натрия, дважды 50 мл 5% водного раствора бикарбоната натрия, затем однократно 50 мл насыщенного водного раствора хлористого натрия. Затем органический слой сушили над безводным сульфатом магния и сульфат магния удаляли фильтрованием. Фильтрат концентрировали при пониженном давлении, получая 2,07 г (4,15 ммоль) метилового эфира N-трет-бутоксикарбонил-β-О-бензил-α-L-аспартил-] -L-(α-метил)фенилаланина в виде вязкого масла.
Десять миллилитров раствора 4 н. НСl/диоксана добавляли к 1,04 г (2,08 ммоль) метилового эфира N-трет-бутоксикарбонил-β-О-бензил-α-L-аспартил-L-(α-метил)фенилаланина и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор концентрировали при пониженном давлении.
К остатку добавляли пятьдесят миллилитров 5% водного раствора бикарбоната натрия и смесь дважды экстрагировали 50 мл этилацетата. Органический слой промывали насыщенным водным раствором хлористого натрия и сушили над безводным сульфатом магния. Затем сульфат магния удаляли фильтрованием и фильтрат концентрировали при пониженном давлении, получая 822 мг (2,06 ммоль) метилового эфира β-О-бензил-α-L-аспартил-L-(α-метил)фенилаланина в виде вязкого масла.
Метиловый эфир β-О-бензил-α-L-аспартил-L-(α-метил)фенилаланина (822 мг, 2,06 ммоль) растворяли в 20 мл тетрагидрофурана (ТГФ) и раствор выдерживали при 0oС. К этому раствору добавляли 554 мг (2,06 ммоль) 3-бензилокси-4-метоксициннамальдегида, 0,11 мл (2,06 ммоль) уксусной кислоты и 636 мг (3,0 ммоль) NаВ(ОАс)3Н. Смесь перемешивали при 0oС в течение 1 часа и далее при комнатной температуре до утра. К реакционному раствору добавляли 50 мл насыщенного водного раствора бикарбоната натрия и смесь дважды экстрагировали 50 мл этилацетата. Органический слой промывали насыщенным водным раствором хлористого натрия и сушили над безводным сульфатом магния. Затем сульфат магния удаляли фильтрованием и фильтрат концентрировали при пониженном давлении. Остаток очищали PTLC (препаративной тонкослойной хроматографией), получая 1,17 г (1,80 ммоль) 1-метилового эфира N-[N-[3-(3-бензилокси-4-метоксифенил)пропенил]-β-О-бензил-L-α-аспартил]-L-(α-метил)фенилаланина в виде вязкого масла.
1-Метиловый эфир N-[N-[3-(3-бензилокси-4-метоксифенил)пропенил] -β-О-бензил-L-α-аспартил]-L-(α-метил)фенилаланина (1,173 г, 1,78 ммоль) растворяли в растворителе из смеси 30 мл метанола с 1 мл воды и добавляли 350 мг 10% палладия на углероде (содержание воды 50%). Смесь восстанавливали в потоке водорода при комнатной температуре в течение 3 часов. Катализатор удаляли фильтрованием и фильтрат концентрировали при пониженном давлении. Для удаления адсорбированного запаха остаток очищают PTLC, получая 553 мг (1,17 ммоль) 1-метилового эфира N-[N-[3-(3-гидрокси-4-метоксифенил)пропил] -L-α-аспартил]-L-(α-метил)фенилаланина в виде твердого вещества.
1H-ЯМР (DMSO-d6) δ: 1,27 (с,3Н), 1,60-1,72 (м,2Н), 2,30-2,60 (м,6Н), 3,10 (дд, 2Н), 3,50-3,62 (м, 1Н), 3,56 (с,3Н), 3,71 (с,3Н), 6,54 (дд,1Н), 6,61 (д, 1Н), 6,79 (д,1Н), 7,04-7,10 (м,2Н), 7,22-7,34 (м,3Н), 8,40 (с,1Н), 8,80 (шир.с,1Н).
ESI (ионизация распылением электронов)-MS 473,3 (МН+).
Подслащивающая способность (по сравнению с сахаром): 18000-кратная.
ПРИМЕР 2.
Синтез 1-метилового эфира N-[N-[3-(3-метокси-4-гидроксифенил)пропил]-L-α-аспартил]-L-(α-метил)фенилаланина.
Повторяли пример 1, за исключением того, что использовали 3-метокси-4-гидроксициннамальдегид вместо 3-бензилокси-4-метоксициннамальдегида для получения 1-метилового эфира N-[N-[3-(3-метокси-4-гидроксифенил)пропил]-L-α-аспартил] -L-(α-метил)фенилаланина способом, подобным указанному выше, с общим выходом 42,7% в виде твердого вещества.
1H-ЯМР (DMSO-d6) δ: 1,28 (с,3Н), 1,60-1,72 (м,2Н), 2,24-2,58 (м,6Н), 3,14 (дд,2Н), 3,43-3,50 (м,1Н), 3,56 (с,3Н), 3,74 (с,3Н), 6,56 (д,1Н), 6,65 (д,1Н), 7,07 (д,2Н), 7,20-7,32 (м,3Н), 8,33 (с,1Н), 8,65 (ушир.с,1Н).
ESI-MS 473,3 (МН+).
Подслащивающая способность (по сравнению с сахаром): 18000-кратная.
ПРИМЕР 3.
Синтез 1-метилового эфира N-[N-[3-(3-гидрокси-4-метоксифенил)пропил]-L-α-аспартил]-3-циклогексил-L-аланина.
Повторяли пример 1 за исключением того, что использовали 3-циклогексил-L-аланин вместо L-(α-метил)фенилаланина для получения 1-метилового эфира N-[N-[3-(3-гидрокси-4-метоксифенил)пропил] -L-α-аспартил] -3-циклогексил-L-аланина способом, подобным указанному выше, с общим выходом 30,0% в виде твердого вещества.
1H-ЯMP (DMSO-d6) δ: 1,11 (м,2Н), 1,64 (м,10Н), 2,27 (м,1Н), 2,38 (м,1Н), 2,45 (м, 4Н), 3,38 (м,2Н), 3,51 (м,1Н), 3,61 (с,3Н), 3,71 (с,3Н), 4,37 (м, 1Н), 6,57 (м,2Н), 6,78 (м,1H), 8,47 (м,1Н).
ESI-MS 465,3 (МH+).
Подслащивающая способность (по сравнению с сахаром): 25000-кратная.
ПРИМЕР 4.
Синтез 1-метилового эфира N-[N-[3-(3-метокси-4-гидроксифенил)пропил]-L-α-аспартил]-3-циклогексил-L-аланина.
Повторяли пример 1 за исключением того, что использовали 3-циклогексил-L-аланин вместо L-(α-метил)фенилаланина и 3-метокси-4-бензилоксициннамальдегид вместо 3-бензилокси-4-метоксициннамальдегида для получения 1-метилового эфира N-[N-[3-(3-метокси-4-гидроксифенил)пропил]-L-α-аспартил]-3-циклогексил-L-аланина способом, подобным указанному выше, с общим выходом 28,7% в виде твердого вещества.
1H-ЯМР (DMSO-d6) δ: 1,10 (м,2Н), 1,62 (м,10Н), 2,25 (м,1Н), 2,38 (м,1Н), 2,49 (м, 4Н), 3,38 (м,2Н), 3,52 (м, 1Н), 3,60 (с,3Н), 3,73 (с,3Н), 4,36 (м, 1Н), 6,63 (м,3Н), 8,46 (м, 1Н).
ESI-MS 465,3 (МН+).
Подслащивающая способность (по сравнению с сахаром): 25000-кратная.
ПРИМЕР 5.
Синтез 1-метилового эфира N-[N-[3-(3-гидрокси-4-метоксифенил)пропил]-L-α-аспартил]-L-фенилглицина.
Повторяли пример 1 за исключением того, что использовали L-фенилглицин вместо L-(α-метил)фенилаланина для получения 1-метилового эфира N-[N-[3-(3-гидрокси-4-метоксифенил)пропил] -L-α-аспартил] -L-фенилглицина способом, подобным указанному выше, с общим выходом 19,0% в виде твердого вещества.
1H-ЯМР (DMSO-d6) δ: 1,63 (м,2Н), 2,30 (м,1Н), 2,42 (м, 1H), 2,48 (м,4Н), 3,38 (м, 1Н), 3,63 (с, 3Н), 3,71 (с,3Н), 5,44 (м,1Н), 6,55 (м,2Н), 6,78 (м, 1Н), 7,38 (м,5Н), 8,96 (м,1Н).
ESI-MS 445,3(МН+).
Подслащивающая способность (по сравнению с сахаром): 1600-кратная.
ПРИМЕР 6.
Синтез 1-метилового эфира N-[N-[3-(3-метокси-4-гидроксифенил)пропил]-L-α-аспартил]-L-фенилглицина.
Повторяли пример 1 за исключением того, что использовали L-фенилглицин вместо L-(α-метил)фенилаланина и 3-метокси-4-бензилоксициннамальдегид вместо 3-бензилокси-4-метоксициннамальдегида для получения 1-метилового эфира N-[N-[3-(3-метокси-4-гидроксифенил)пропил] -L-α-аспартил] -L-фенилглицина способом, подобным указанному выше, с общим выходом 23,5% в виде твердого вещества.
1H-ЯМР (DMSO-d6) δ: 1,65 (м,2Н), 2,29 (м,1Н), 2,43 (м, 1H), 2,50 (м,4Н), 3,58 (м, 1H), 3,63 (с, 3Н), 3,73 (с,3Н), 5,44 (м,1Н), 6,41 (м,3Н), 7,38 (м, 5Н), 8,94 (м,1Н).
ESI-MS 445,3 (МН+).
Подслащивающая способность (по сравнению с сахаром): 700-кратная.
ПРИМЕР 7.
Синтез 1-метилового эфира N-[N-[3-(3-гидрокси-4-метоксифенил)пропил]-L-α-аспартил]-DL-гомофенилаланина.
Повторяли пример 1 за исключением того, что использовали DL-гомофенилаланин вместо L-(α-метил)фенилаланина для получения 1-метилового эфира N-[N-[3-(3-гидрокси-4-метоксифенил)пропил] -L-α-аспартил] -DL-гомофенилаланина способом, подобным указанному выше, с общим выходом 16,7% в виде твердого вещества.
1H-ЯМР (DMSO-d6) δ: 1,68 (м,2Н), 1,96 (м,2Н), 2,32 (м,1Н), 2,46 (м,1Н), 2,58 (м,4Н), 3,37 (м,2Н), 3,52 (м,1Н), 3,60 (2с,3Н), 3,70 (2с,3Н), 4,21 (м, 1Н), 6,68 (м,3Н), 7,23 (м,5Н), 8,58 (м,1Н).
ESI-MS 473,3 (МН+).
Подслащивающая способность (по сравнению с сахаром): 1000-кратная.
ПРИМЕР 8.
Синтез 1-метилового эфира N-[N-[3-(3-метокси-4-гидроксифенил)пропил]-L-α-аспартил]-DL-гомофенилаланина.
Повторяли пример 1 за исключением того, что использовали DL-гомофенилаланин вместо L-(α-метил)фенилаланина и 3-метокси-4-бензилоксициннамальдегид вместо 3-бензилокси-4-метоксициннамальдегида для получения 1-метилового эфира N-[N-[3-(3-метокси-4-гидроксифенил)пропил]-L-α-аспартил]-DL-гомофенилаланина способом, подобным указанному выше, с общим выходом 18,4% в виде твердого вещества.
1H-ЯMP (DMSO-d6) δ: 1,70 (м,2Н), 1,96 (м,2Н), 2,34 (м,1Н), 2,45 (м,1Н), 2,56 (м,4Н), 3,40 (м,2Н), 3,55 (м, 1Н), 3,60 (2с,3Н), 3,70(2с,3Н), 4,21 (м, 1Н), 6,68 (м,3Н), 7,23 (м,5Н), 8,58 (м,1Н).
ESI-MS 473,3 (МН+).
Подслащивающая способность (по сравнению с сахаром): 1200-кратная.
ПРИМЕР 9.
Синтез 1-н-пропилового эфира N-[N-[3-(3-гидрокси-4-метоксифенил)пропил] -L-α-аспартил]-D-аланина.
Повторяли пример 1 за исключением того, что использовали гидрохлорид н-пропилового эфира D-аланина вместо метилового эфира L-(α-метил)фенилаланина для получения 1-н-пропилового эфира N-[N-[3-(3-гидрокси-4-метоксифенил)пропил] -L-α-аспартил] -D-аланина способом, подобным указанному выше, с общим выходом 37,3% в виде твердого вещества.
1H-ЯМР (DMSO-d6) δ: 0,87 (т,3Н), 1,28 (д,3Н), 1,50-1,60 (м,2Н), 1,60-1,70 (м,2Н), 2,18-2,60 (м,6Н), 3,43-3,51 (м,1Н), 3,71 (с,3Н), 3,95-4,02 (м, 2Н), 4,20-4,30 (м,1Н), 6,54 (д,1Н), 6,61 (с,1Н), 6,78 (д,1Н), 8,50 (д,1Н), 8,80 (ушир.с,1Н).
ESI-MS 411,4 (МH+).
Подслащивающая способность (по сравнению с сахаром): 800-кратная.
ПРИМЕР 10.
Синтез 1-н-пропилового эфира N-[N-[3-(3-метокси-4-гидроксифенил)пропил] -L-α-аспартил]-D-аланина.
Повторяли пример 1 за исключением того, что использовали гидрохлорид н-пропилового эфира D-аланина вместо метилового эфира L-(α-метил)фенилаланина и 3-метокси-4-гидроксициннамальдегид вместо 3-бензилокси-4-метоксициннамальдегида для получения 1-н-пропилового эфира N-[N-[3-(3-метокси-4-гидроксифенил)пропил] -L-α-аспартил] -D-аланина способом, подобным указанному выше, с общим выходом 27,8% в виде твердого вещества.
1H-ЯМР (DMSO-d6) δ: 0,87 (т,3Н), 1,28 (д,3Н), 1,50-1,62 (м,2Н), 1,62-1,73 (м,2Н), 2,20-2,60 (м,6Н), 3,45-3,51 (м,1Н), 3,74 (с,3Н), 3,94-4,02 (м, 2Н), 4,20-4,30 (м,1Н), 6,56(дд,1Н), 6,65 (д,1Н), 6,74 (д,1Н), 8,51 (д,1Н), 8,60 (ушир.с,1Н).
ESI-MS 411,4 (МН+).
Подслащивающая способность (по сравнению с сахаром): 600-кратная.
ПРИМЕР 11.
Синтез 1-метилового эфира N-[N-[ 3-(2-гидрокси-4-метоксифенил)пропил]-L-α-аспартил]-L-(α-метил)фенилаланина.
Повторяли пример 1 за исключением того, что использовали 2-бензилокси-4-метоксициннамальдегид вместо 3-бензилокси-4-метоксициннамальдегида для получения 1-метилового эфира N-[N-[3-(2-гидрокси-4-метоксифенил)пропил]-L-α-аспартил] -L-(α-метил)фенилаланина способом, подобным указанному выше, с общим выходом 44,0% в виде твердого вещества.
1H-ЯМР (DMSO-d6) δ: 1,27 (с,3Н), 1,58-1,68 (м,2Н), 2,23-2,33 (дд,1Н), 2,35-2,48 (м, 5Н), 3,03 (д,1Н), 3,25 (д,1Н), 3,43-3,48 (м,1Н), 3,56 (с,3Н), 3,65 (с, 3Н), 6,28 (дд, 1Н), 6,35 (д,1Н), 6,92 (д,1Н), 7,05-7,10 (м,2Н), 7,20-7,31 (м,3Н), 8,35 (с,1Н).
ESI-MS 473,2 (МH+).
Подслащивающая способность (по сравнению с сахаром): 15000-кратная.
ПРИМЕР 12.
Синтез 1-метилового эфира N-[N-[3-(3-метил-4-гидроксифенил)пропил]-L-α-аспартил]-3-циклогексил-L-аланина.
Повторяли пример 1 за исключением того, что использовали 3-циклогексил-L-аланин вместо L-(α-метил)фенилаланина и 3-метил-4-бензилоксициннамальдегид вместо 3-бензилокси-4-метоксициннамальдегида для получения 1-метилового эфира N-[N-[3-(3-метил-4-гидроксифенил)пропил] -L-α-аспартил]-3-циклогексил-L-аланина способом, подобным указанному выше, с общим выходом 35,6% в виде твердого вещества.
1H-ЯМР (DMSO-d6) δ: 0,83-1,65 (м,11Н), 1,49-1,60 (м,2Н), 1,63-1,68 (м, 2Н), 2,08 (с,3Н), 2,24-2,40 (м,2Н), 2,41-2,51 (м,4Н), 3,49-3,53 (м,1Н), 3,61 (с, 3Н), 4,33-4,50 (м,1Н), 6,65 (д,1Н), 6,78 (д,1Н), 6,86 (с,1Н), 8,48 (д, 1Н), 9,04 (ушир.с,1Н).
ESI-MS 449,3 (МН+).
Подслащивающая способность (по сравнению с сахаром): 40000-кратная.
ПРИМЕР 13.
Синтез N-[N-[3-(2-гидрокси-4-метилфенил)пропил]-L-α-аспартил]-3-циклогексил-L-аланина.
Повторяли пример 1 за исключением того, что использовали 3-циклогексил-L-аланин вместо L-(α-метил)фенилаланина и 2-бензилокси-4-метилциннамальдегид вместо 3-бензилокси-4-метоксициннамальдегида для получения N-[N-[3-(2-гидрокси-4-метилфенил)пропил] -L-α-аспартил] -3-циклогексил-L-аланина способом, подобным указанному выше, с общим выходом 26,2% в виде твердого вещества.
1H-ЯМР (DMSO-d6) δ: 0,82-1,65 (м,11Н), 1,49-1,59 (м,2Н), 1,61-1,66 (м, 2Н), 2,17 (с,3Н), 2,23-2,41 (м,2Н), 2,44-2,48 (м,4Н), 3,47-3,53 (м,1Н), 3,61 (с, 3Н), 4,33-4,41 (м,1Н), 6,50 (д,1Н), 6,59 (с,1Н), 6,89 (д,1Н), 8,50 (д, 1Н), 9,12 (ушир.с,1Н).
ESI-MS 449,3 (MH+).
Подслащивающая способность (по сравнению с сахаром): 25000-кратная.
ПРИМЕР 14.
Синтез 1-метилового эфира N-[N-[3-(3-гидрокси-4-метоксифенил)пропил]-L-α-аспартил]-L-(α-метил)фенилаланина.
Реакцию и обработку осуществляли по примеру 1 за исключением того, что использовали 3-(3-бензилокси-4-метоксифенил)пропиональдегид вместо 3-бензилокси-4-метоксициннамальдегида для получения 1-метилового эфира N-[N-[3-(3-гидрокси-4-метоксифенил)пропил]-L-α-аспартил]-L-(α-метил)фенилаланина.
ПОЛОЖИТЕЛЬНЫЙ РЕЗУЛЬТАТ ИЗОБРЕТЕНИЯ
Новые производные аспартилового дипептидного эфира по изобретению являются низкокалорийными. Кроме того, эти производные обладают превосходной подслащивающей способностью по сравнению с традиционными подсластителями. Данное изобретение может обеспечить новые химические вещества, обладающие превосходными свойствами как подсластители. Таким образом, подобные новые соединения по изобретению могут использоваться в качестве подсластителей, а также могут придавать сладость таким продуктам, как напитки и пищевые продукты, требующие сладости.
| название | год | авторы | номер документа |
|---|---|---|---|
| СЛОЖНОЭФИРНЫЕ ПРОИЗВОДНЫЕ АСПАРТИЛДИПЕПТИДОВ И ПОДСЛАЩИВАЮЩИЕ ВЕЩЕСТВА | 1999 |
|
RU2179979C1 |
| КОМПОЗИЦИИ ВЫСОКОИНТЕНСИВНЫХ ПОДСЛАСТИТЕЛЕЙ, ИМЕЮЩИЕ УСОВЕРШЕНСТВОВАННУЮ СЛАДОСТЬ, МОДИФИКАТОР ВКУСА И ИХ ПРИМЕНЕНИЕ | 2000 |
|
RU2238945C2 |
| ПРОИЗВОДНОЕ СЛОЖНОГО ЭФИРА N-АЛКИЛАСПАРТИЛДИПЕПТИДА И ПОДСЛАЩИВАЮЩИЙ АГЕНТ | 1999 |
|
RU2207344C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ ФЕНИЛАЛАНИНА | 2001 |
|
RU2286340C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНОГО ГЛУТАМИНОВОЙ КИСЛОТЫ И ПРОИЗВОДНОГО ПИРОГЛУТАМИНОВОЙ КИСЛОТЫ И НОВОЕ ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ ДЛЯ ПОЛУЧЕНИЯ ЭТИХ ПРОИЗВОДНЫХ | 2003 |
|
RU2342360C2 |
| СУЛЬФИРОВАННЫЕ АМИНОКИСЛОТНЫЕ ПРОИЗВОДНЫЕ И СОДЕРЖАЩИЕ ИХ ИНГИБИТОРЫ МЕТАЛЛОПРОТЕИНАЗ | 1997 |
|
RU2198656C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ БЕНЗОЦИКЛОАЛКЕНИЛДИГИДРООКСИАЛКАНОВЫХ КИСЛОТ | 1990 |
|
RU2012554C1 |
| ПОЛИМЕР НА ПРОПИЛЕНОВОЙ ОСНОВЕ, ИЗДЕЛИЯ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2009 |
|
RU2527036C2 |
| ПРОИЗВОДНОЕ БЕНЗОТИАЗОЛА ИЛИ ЕГО ФАРМАКОЛОГИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ | 1992 |
|
RU2041216C1 |
| ПРОИЗВОДНЫЕ ИНДОЛИНА, ИСПОЛЬЗУЕМЫЕ КАК ИНГИБИТОРЫ ПРОТЕИНКИНАЗЫ | 2002 |
|
RU2316554C2 |
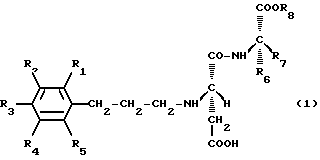
Предложены новые производные аспартилового дипептидного эфира (включая их соли), представленные формулой (1), где каждый из R1, R2, R3, R4 и R5 независимо друг от друга обозначает заместитель, выбранный из атома водорода (Н), гидроксильной группы (ОН), алкоксигруппы (ОСН3, ОСН2СН3, ОСН2СН2СН3 и т. д.) с 1-3 атомами углерода, алкильной группы (СН3, СН2СН3, СН2СН2СН3 и т. д. ) с 1-3 атомами углерода; R6 обозначает заместитель, выбранный из атома водорода, бензильной группы (СН2С6H5), циклогексилметильной группы (СН2С6Н11), фенильной группы (С6Н5), циклогексильной группы (С6Н11), фенилэтильной группы (СН2СН2С6H5) и циклогексилэтильной группы (СН2СН2С6Н11);
R7 обозначает заместитель, выбранный из атома водорода, метильной группы (СН3), этильной группы (СН2СН3) и изопропильной группы (СН(СН3)2); R8 обозначает заместитель, выбранный из метильной группы, этильной группы, изопропильной группы, н-пропильной группы (СН2СН2СН3) и трет-бутильной группы (С(СН3)3), при условии, что исключаются производные, у которых R6 обозначает бензильную группу, а R7 в то же время обозначает атом водорода, и производные, у которых R6 обозначает п-гидроксибензильную группу, а R7 в то же время обозначает атом водорода. Соединения обладают высокой подслащивающей способностью, а также повышенной стабильностью по отношению к гидролизу. Предложен также подсластитель, содержащий соединения по изобретению. 2 с. и 13 з.п.ф-лы, 1 табл.
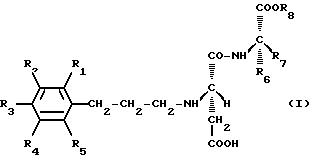
где каждый из R1, R2, R3, R4 и R5, независимо друг от друга, обозначает заместитель, выбранный из атома водорода (H), гидроксильной группы (ОН), алкокси-группы (ОСН3, ОСН2СН3, ОСН2СН2СН3 и т. д. ) с 1-3 атомами углерода, алкильной группы (СН3, СН2СН3, СН2СН2СН3 и т. д. ) с 1-3 атомами углерода;
R6 обозначает заместитель, выбранный из атома водорода, бензильной группы (СН2С6Н5), циклогексилметильной группы (СН2С6Н11), фенильной группы (С6Н5), циклогексильной группы (С6Н11), фенилэтильной группы (СН2СН2С6Н5) и циклогексилэтильной группы (СН2СН2С6Н11);
R7 обозначает заместитель, выбранный из атома водорода, метильной группы (СН3), этильной группы (СН2СН3) и изопропильной группы (СН(СН3)2);
R8 обозначает заместитель, выбранный из метильной группы, этильной группы, изопропильной группы, н-пропильной группы (СН2СН2СН3) и трет-бутильной группы (С(СН3)3), при условии, что исключаются производные, у которых R6 обозначает бензильную группу, а R7 в то же время означает атом водорода, и производные, у которых R6 обозначает п-гидроксибензильную группу, a R7 в то же время обозначает атом водорода.
| СТАБИЛИЗИРОВАННЫЕ КОМПОЗИЦИИ ДЛЯ ОФТАЛЬМОЛОГИЧЕСКОГО ПРИМЕНЕНИЯ, СОДЕРЖАЩИЕ ОМЕГА-3-КИСЛОТЫ | 2015 |
|
RU2697844C2 |
| АГЕНТ ДЛЯ ПОДСЛАЩИВАНИЯ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1990 |
|
RU2053239C1 |
| US 5480668 A, 02.06.1996 | |||
| US 4645678 A, 24.02.1987. | |||
Авторы
Даты
2002-11-10—Публикация
1999-06-07—Подача