Область техники, к которой относится изобретение
В общих чертах настоящее изобретение относится к области биохимической эндокринологии, молекулярной биологии и химии белков. Более конкретно, настоящее изобретение относится к новым способам характеризации соединений, которые стимулируют экспрессию STF-1 в клетках панкреатических островков.
Описание предшествующего уровня техники
Глюкозный гомеостаз требует согласованного действия многочисленных нейроэндокринных систем. Панкреатические островки рассматриваются как первичный "глюкозный сенсор" у млекопитающих. Панкреатические островки содержат четыре популяции клеток, которые характеризуются, главным образом, как клетки, продуцирующие инсулин, глюкагон, соматостатин или панкреатический полипептид. Из этих клеток преобладающими являются инсулинпродуцирующие β-клетки. Секреция и продуцирование инсулина стимулируется возрастанием глюкозы в сыворотке, то есть событием, необходимым для последующего поглощения глюкозы в некоторых тканях. Поэтому дисфункция или деструкция β-клеток приводит к повышенным уровням глюкозы в сыворотке и, в конечном счете, к развитию сахарного диабета.
Анализ на генетическую связь указывает, что наследственные факторы сильно влияют на восприимчивость организма к развитию диабетического статуса. Например, по крайней мере, 18 генетических локусов до некоторой степени связаны с инсулин-зависимым сахарным диабетом (IDDM). Один из локусов восприимчивости к этому заболеванию, обозначаемый (IDDM2), включает ген инсулина человека и ассоциируется с модифицированной транскрипционной регуляцией функции инсулинового промотора. Следовательно, нарушение процессов, регулирующих экспрессию гена инсулина, может быть частично ответственно за развитие диабета. Согласно этой гипотезе, нарушение функции β-клеток является наиболее общим признаком диабета.
Инсулин-независимый сахарный диабет (NIDDM) развивается в результате влияния как внешних факторов, так и комплексных генетических факторов. Интересно отметить, что аллельные варианты в инсулиновом локусе сами были ассоциированы с этим заболеванием. Очевидно, что эти варианты содержат нормальный ген инсулина, но обладают измененными свойствами по отношению к транскрипционной регуляции.
По оценкам специалистов, вплоть до 20 миллионов американцев могут страдать инсулин-независимым сахарным диабетом (Типа II). Для развития этого заболевания, очевидно, необходимо как влияние факторов окружающей среды, так и присутствие определенных, пока еще, по большей части, не идентифицированных генов восприимчивости к диабету, которые могут вносить свой вклад в периферическую инсулинорезистентность диабета Типа II, где ткани теряют способность к утилизации глюкозы в ответ на инсулиновый сигнал. Альтернативно, генетические факторы могут быть ответственны за снижение восприимчивости к глюкозе инсулинпродуцирующих панкреатических β-клеток у этих индивидуумов. Конечным результатом таких физиологических состояний является выраженная гипергликемия, которая представляет собой главный признак диабета.
Транскрипционный контроль гена инсулина осуществляется посредством короткой области фланкирующей ДНК, которая взаимодействует с клетко-специфическими и глюкозо-специфическими сигнальными молекулами. Конкретная природа этой регуляторной организации остается не совсем ясной, хотя в общих чертах известно, что решающими компонентами транскрипционного механизма, управляющего β-клетко-специфической экспрессией инсулина являются основной элемент "спираль-петля-спираль" (bHLH) и гомеодомен-содержащие факторы. Островково-специфический основной комплекс "спираль-петля-спираль" взаимодействует с проксимальным Е-боксом, который иногда обозначают Nir, IEB1 или ICE; причем этот элемент дважды повторяется в гене крысиного инсулина, но в гене крысиного инсулина II и в гене инсулина человека он встречается лишь один раз.
Экспресс-анализ инсулинпродуцирующих клеточных линий позволяет предположить, что Е-бокс-связывающие факторы обладают синергическим действием вместе с белками, которые связываются с соседней АТ-богатой последовательностью, называемой FLAT и несущей признаки гомеодомен-узнающей последовательности. Было показано, что некоторые охарактеризованные гомеодоменные белки связываются с FLAT-элементом, включая белки Is1-1, lmx-1, cdx-3 и STF-1. Кроме того, последний из них соответствует главной связывающей активности в эволюционно консервативной АТ-богатой последовательности, называемой Р-элементом. Isl-1 слабо связывается с FLAT-элементом и, очевидно, отсутствует в FLAT-связывающих комплексах, обнаруженных с помощью экстрактов из инсулинпродуцирующих клеток. Современные данные подтверждают, что Isl-1 играет более важную роль в развитии нервной ткани. Гомеодоменные факторы lmx-1 и cdx-3 обладают интересными трансактивирующими свойствами по отношению к функции инсулинового промотора в гетерологичных клетках, однако их распределение в клетках и FLAT-связывающая способность внутри β-клеток остаются неясными. Кроме того, имеется немного данных, касающихся непосредственно функции этих факторов в β-клеточных линиях.
Из группы факторов, обладающих способностью связываться с инсулиновым промотором, STF-1, вероятно, является наиболее "обещающим" кандидатом на истинного регулятора функции инсулинового промотора. У мышей STF-1 был впервые обнаружен, главным образом, у 8,5-дневных эмбрионов в ядре примордиальных клеток, которые образуются в поджелудочной железе незадолго до самой ранней детектируемой стадии экспрессии инсулина в этой области. В последующем процессе развития эндокринной поджелудочной железы STF-1 и инсулин экспрессируются, главным образом, совместно. Кроме того, в экстрактах, полученных от инсулинпродуцирующих клеточных линий, STF-1 является, очевидно, компонентом эндогенной ДНК-связывающей активности в обоих FLAT- и Р-элементах в инсулиновом промоторе. STF-1 обладает также сильным синергическим действием в сочетании с Е-бокс-связывающим фактором Рап-1, как, впрочем, и ожидалось от FLAT-связывающего фактора. Однако анализ на связывание ДНК показывает, что другие неизвестные факторы из β-клеточного экстракта также могут вносить значительный вклад в обнаруживаемую FLAT-связывающую активность. Однако остается неясным, требует ли FLAT-опосредованная инсулинстимулирующая активность присутствия всего набора указанных обнаруженных факторов или только одной их субпопуляции.
Хотя STF-1 первоначально экспрессируется как в экзокринных, так и эндокринных клетках развивающейся поджелудочной железы, однако продуцирование STF-1 постепенно ограничивается инсулин- и соматостатинпродуцирующими островковыми клетками. Очевидно, что в этих клетках действие STF-1 играет важную роль для поддержания высокого уровня экспрессии как генов соматостатина, так и генов инсулина.
STF-1 распознает два хорошо определенных островково-специфических элемента на инсулиновом промоторе, обозначаемых FLAT и Р. При связывании с этими сайтами, STF-1 стимулирует транскрипцию инсулина, вместе с Е47, белком, содержащим структуру "спираль-петля-спираль" и распознающим два Е-бокс-элемента, обозначаемых Far и Nir. Аналогично, STF-1 регулирует экспрессию соматостатина в островковых клетках посредством двух островково-специфических элементов, обозначаемых TSEI и TSEII.
Было обнаружено, что гомеодоменные белки, такие как STF-1, играют важную роль в формировании клеток или сегментной идентичности. В противоположность их специфическим и различным эффектам in vivo большинство гомеодоменных белков обнаруживают низкую и перекрывающуюся специфичность к ДНК-связыванию in vitro. Однако недавние исследования показали, что некоторые белковые кофакторы действуют как детерминанты ДНК-связывающей специфичности гомеодоменов in vivo. Так, например, было показано, что в дрозофиле экстрадентикль (exd) модулирует активность гомеозисных белков, не изменяя характера их экспрессии. Вернее, экстрадентикль стимулирует, по-видимому, селекцию гена-мишени путем усиления ДНК-связывающей специфичности гомеодоменных белков. Действительно, экстрадентикль является в высокой степени консервативным у позвоночных и его последовательность имеет значительное сходство с последовательностью (71%) протоонкогена Pbxl человека.
В большинстве случаев, было установлено коммитирование клеток в специфические линии дифференцировки в процессе их развития благодаря относительной экспрессии различных гомеодоменных (НОХ) белков-селекторов, которые опосредуют активацию различных генетических программ. Однако механизмы, с помощью которых отдельные НОХ-гены сами направляются для экспрессии в клетках различных типов, остаются, в основном, невыясненными.
Поджелудочная железа позвоночных состоит из эндокринных и экзокринных компонентов, которые образуются из общих клеток-предшественников в дуоденальном зародыше (1). В эндокринном компоненте поджелудочной железы плюрипотентная клетка-предшественник, которая первоначально экспрессирует множество островковых гормонов, подвергается прогрессивной рестрикции с образованием четырех субпопуляций клеток, составляющих островки Лангерганса взрослых: клетки, продуцирующие инсулин, соматостатин, глюгакон и панкреатический полипептид (2, 3). Механизм, благодаря которому активируется этот путь развития, пока неясен, однако данные, полученные в последнее время, дают основание предположить, что гомеобокс-фактор STF-1 (IPF-1/IDX-1) является важным и решающим фактором в этом процессе. Действительно, необходимость присутствия STF-1 в процессе развития подтверждается исследованиями гомологичной рекомбинации, в которых целевое разрушение гена STF-1/IPF-1 приводило к врожденному отсутствию поджелудочной железы (4). Экспрессия STF-1 (обозначаемого также Pdxl) была сначала детектирована у 8,5-дневного эмбриона, в зародышевых клетках поджелудочной железы и в плюрипотентных клетках-предшественниках. При кратковременной экспрессии в эндокринных и экзокринных компонентах развивающейся поджелудочной железы продуцирование STF-1 постепенно ограничивается образованием инсулин- и соматостатинпродуцирующими островковыми клетками (5, 6). В этих клетках STF-1, очевидно, регулирует гены инсулина и соматостатина путем связывания с функциональными элементами в каждом промоторе (5, 7-16).
В настоящее время отсутствуют какие-либо эффективные способы регуляции экспрессии гомеодоменного белка STF-1 в панкреатических клетках. Настоящее изобретение позволяет решить эту давно назревшую проблему.
Краткое описание изобретения
Хотя STF-1 является важным регулятором панкреатических генов, механизм, с помощью которого происходит самонаправленная экспрессия STF-1 в панкреатических клетках, остается невыясненным. Настоящее изобретение продемонстрировало, что 6, 5-т.п.о.-фрагмент промотора STF-1 является достаточным для регуляции островково-специфической экспрессии гена-репортера β-галактозидазы у трансгенных мышей, а также в культивированных дуоденальных клетках. В этом 6,5-т.п.о-фрагменте особенно важную роль в промоторной активности STF-1 играет Е-бокс-элемент, расположенный у-104 по отношению к сайту инициации трансляции. Этот элемент распознается расположенным выше активатором, который играет главную роль в экспрессии STF-1 в островковых клетках. Действительно, этот промотор STF-1 является в 20-100 раз более активным в отношении усиления направленной экспрессии STF-1 в островковых клетках. Делекция проксимальной последовательности Е-бокса у-104 полностью прекращает экспрессию STF-1 в клетках HIT. Кроме того, антисыворотка против USF (вышерасположенного фактора) ингибирует образование С1, С2 и С3, что свидетельствует о том, что эти белки образованы белком USF.
Кроме того, энхансерный элемент STF-1 был обнаружен в области 530 п.о., которая простирается на 600 п. о. выше от сайта инициации транскрипции. Промоторные конструкции, содержащие этот 530 п.о.-фрагмент, полностью подавлялись путем обработки дексаметазоном, однако при минимальной конструкции промотора STF-1, содержащей сайт распознавания широко распространенного USF-1, такого не наблюдалось. 530 п.о.-область обнаруживала в 5-10 раз большую активность в клетках HIT-T15 по сравнению с клетками COS-7, что свидетельствовало о том, что этот фрагмент обладает островково-специфичной активностью. Поэтому для скрининга соединений, которые усиливают экспрессию STF-1 в клетках панкреатических островков, в настоящем изобретении был использован гибридный ген STF-1-lacZ. Соединения, которые стимулируют продуцирование STF-1, усиливают В-клеточную функцию панкреатических островков, то есть продуцирование инсулина. Так, например, соединения, идентифицированные методом, описанным в настоящем изобретении, были, в частности, использованы для лечения пациентов с сахарным диабетом Типа II, у которых непереносимость к глюкозе была обусловлена ограничением функции островковых клеток.
В одном из своих вариантов настоящее изобретение относится к способу тестирования соединений, индуцирующих транскрипцию STF-1.
Линию клеток панкреатических островков, которая экспрессирует гибридный ген STF-1/lacZ, выделяли путем совместного осаждения фосфатом кальция. Для оценки влияния различных соединений на экспрессию STF-1 соединение, представляющее интерес, добавляли к клеткам, экспрессирующим STF-1/lacZ. Затем контрольные и обработанные клетки подвергали количественной оценке на lacZ-активность путем колометрического анализа. С использованием этого метода может быть скринировано большое число соединений, и STF-1-индуцирующие соединения могут быть легко индентифицированы.
В одном из вариантов своего осуществления настоящее изобретение относится к способу использования промотора STF-1 для in vivo-мечения инсулинпродуцирующих клеток панкреатических островков. Для этого в качестве индикатора служил белок с флуоресценцией в зеленом диапазоне (GFP). Экспрессия белка с зеленой флуоресценцией может быть детектирована без разрушения структуры, как описано Ogawa et al. , Proc.Natl. Acad. Sci. USA, 1995, 92: 11899-11903. Для облегчения выделения β-клеток из поджелудочной железы животного промотор STF-1 присоединяли к гену, кодирующему GFP. Введение трансгена "STF-1 - белок с зеленой флуоресценцией" свиньям позволяет быстро и эффективно выделить инсулинпродуцирующие клетки из поджелудочной железы. Короче говоря, у свиней вырезают поджелудочную железу и обрабатывают коллагеназой для диспергирования клеток. Инсулинпродуцирующие островковые клетки эффективно выделяются методом сортировки клеток с активацией флуоресценции (FACS), основанным на экспрессии трансгена "STF-1 - белок с зеленой флуоресценцией". Очищенная популяция β-клеток может быть использована для клеточной терапии пациентов, страдающих диабетом.
В одном из своих аспектов настоящее изобретение относится к способу определения способности испытуемых соединений стимулировать клетки панкреатических островков для индуцирования транскрипции STF-1, где указанный способ включает следующие стадии: получение вектора, содержащего энхансер STF-1, имеющий последовательность, выбранную из SEQ ID No: 1 или SEQ ID No: 2 или их фрагментов, промотор и ген-репортер, находящийся под транскрипционным контролем указанного энхансера STF-1 и указанного промотора, где указанный ген-репортер способен сообщать детектируемый сигнал указанной клетке-хозяину; перенос указанного вектора в указанную клетку-хозяина; культивирование указанной клетки-хозяина в присутствии тестируемого соединения с целью определения способности указанного тестируемого соединения стимулировать продуцирование указанного сигнала в указанной клетке-хозяине; и анализ этого сигнала для определения способности указанного тестируемого соединений стимулировать в указанной клетке-хозяине продуцирование указанного детектируемого сигнала, где присутствие указанного сигнала свидетельствует о том, что указанное тестируемое соединение стимулирует индуцирование транскрипции STF-1 в клетках панкреатических островков, и где отсутствие указанного сигнала свидетельсвует о том, что указанное тестируемое соединение не стимулирует индуцирование транскрипции STF-1 в клетках панкреатических островков. В предпочтительном варианте осуществления этой цели настоящего изобретения в качестве гена-репортера используют фермент, в более предпочтительном варианте, этот фермент выбирают из люциферазы и β-галактозидазы.
В другом варианте настоящего изобретения указанную стадию переноса осуществляют путем введения трансгена животным методом трансфекции или микроинъекции.
Другой целью настоящего изобретения является разработка способа мечения инсулинпродуцирующих клеток панкреатических островков in vivo, включающего следующие стадии: получение вектора, содержащего промотор STF-1, и ген-репортер, находящийся под транскрипционным контролем указанного промотора, где указанный ген-репортер способен сообщать детектируемый сигнал указанной клетке-хозяину; введение указанного вектора в качестве трансгена в эмбрион животного; выращивание указанного эмбриона в животном, имеющем клетки панкреатических островков; и анализ на детектируемый сигнал с целью определения способности каких-либо клеток панкреатических островков указанного животного экспрессировать указанный ген-репортер, где присутствие указанного сигнала свидетельствует о присутствии инсулинпродуцирующих клеток панкреатических островков и где отсутствие указанного сигнала свидетельствует об отсутствии инсулинпродуцирующих клеток панкреатических островков.
В предпочтительном варианте осуществления этой цели изобретения ген-репортер продуцирует флуоресцентный белок, а указанный способ, кроме того, включает стадию сортировки инсулинпродуцирующих клеток панкреатических островков от инсулиннепродуцирующих клеток панкреатических островков методом клеточного сортинга с активацией флуоресценции (FACS).
Другие и дополнительные аспекты, отличительные признаки и преимущества настоящего изобретения будут понятны из нижеследующего описания предпочтительных вариантов осуществления изобретения.
Краткое описание чертежей
Для того, чтобы указанные выше отличительные признаки, преимущества и цели настоящего изобретения могли быть достигнуты и были более понятны, ниже приводится подробное описание настоящего изобретения, которое было кратко изложено выше, со ссылками на конкретные варианты его осуществления, проиллюстрированные прилагаемыми чертежами. Эти чертежи являются частью описания изобретения. Однако следует отметить, что прилагаемые чертежи иллюстрируют предпочтительные варианты осуществления настоящего изобретения, а поэтому не должны рассматриваться как некое ограничение его объема.
Фиг. 1 иллюстрирует локализацию гена STF-1 в хромосоме. На фиг.1А показано, что ген STF-1 кодируется гомеобокс-содержащим геном "орфаном", расположенным в дистальной области хромосомы 5 (мыши); на схематической диаграмме показано положение STF-1 (обозначенного Pdxl) по отношению к другим маркерам на мышиной хромосоме 5. Справа указана шкала в сантиморганах (сМ). На фиг. 1В представлена таблица, иллюстрирующая частоту рекомбинации между STF-1 и различными маркерами на хромосоме 5. В левой колонке указаны маркеры, используемые для обозначения распределения на хромосоме. На этом чертеже STF-1 обозначен Pdx1.
Фиг. 2 иллюстрирует промотор STF-1, который не имеет ТАТА-фрагмента и в котором используются множественные сайты инициации транскрипции. На фиг.2 схематически представлен геномный 15 п.о.-клон STF-1 с указанной наверху шкалой в тысячах пар оснований (т.п.о). На чертеже показаны 6,5 т.п.о 5'-конца, 4 т.п.о.-интрон и 3 т.п.о 3'-конца. IVS относится к 4 т.п.о-интрону, который прерывает экзоны I (заштрихован и обозначен I) и II (заштрихован и обозначен II). На фиг.2В показана нуклеотидная последовательность 5'-фланкирующей области гена STF-1. Сайты инициации транскрипции, картированные путем защиты от РНКазы (заштрихованые стрелкой) и удлинения праймера (незаштрихованные стрелки), обозначены S1 (главный сайт инициации, подчеркнут), S2 и S3. Потенциальные сайты связывания вышерасположенного фактора для bHLH/bHLH-ZIP-белков (Е-бокс)/ CTF/NF-1 (СААТ) и с/ЕВР подчеркнуты и помечены в месте их локализации по отношению к главному старт-сайту. На фиг.3 проиллюстрирован анализ РНК Тu6 на защиту от РНКазы (Tu6, дорожка 2) или контрольной дрожжевой тРНК (дрожжи, дорожка 3) с использованием антисмыслового по отношению к STF-1 РНК-зонда. Негидролизованный зонд показан слева (дорожка 1). На фиг.2D показаны результаты анализа на удлинение праймеров, проведенные на дрожжах (дорожка 4), мРНК Тu6 (дорожка 5) или мРНК RIN (дорожка 6) с использованием антисмыслового по отношению к STF-1 праймера. Ступенчатое секвенирование показано справа (GATC, дорожки 7-10). Отмечено соответствие между защищенными от РНКазы продуктами и продуктами удлинения праймера и показаны первые три старт-сайта, обозначенные S1, S2 и S3 (см. также внизу на фиг.2В).
Фиг. 3 иллюстрирует 6,5 т.п.о-фрагмент промотора STF-1, регулирующего направленную экспрессию гена-репортера β-галактозидазы в островковых клетках трансгенных мышей. Характерные криосрезы зрелой поджелудочной железы от трансгенных (вверху) и контрольных (внизу) детенышей были оценены на lacZ-активность с использованием Xgal в качестве хромогенного субстрата. Стрелки указывают на клетки панкреатических островков.
Фиг.4 демонстрирует, что дистальные и проксимальные элементы в промоторе STF-1 направляют экспрессию STF-1 в клетки панкреатических островков. На фиг. 4А показана активность плазмиды, содержащей -6500-область "STF-1-люциферазный репортер", после ее трансфекции в клетки панкреатических островков (βTC3, HIT) по сравнению с неостровковой клеточной линией (РС12, COS, HeLa). Репрезентативный анализ иллюстрирует активность промотора STF-1 в клетках HIT (100%) по отношению к другим клеточным линиям после ее нормализации ко-трансфецированной контрольной плазмидой RVS-CAT. Этот анализ повторяли, по крайней мере, три раза. На фиг.4В проиллюстрирован репрезентативный анализ промоторной конструкции "STF-1 - люцифераза" (STF - luc) после трансфекции в клетки HIT. Эти конструкции обозначали в соответствии с границей 5'-промотора по отношению к главному сайту инициации транскрипции (S1, см. фиг.2А и 2В).
На схематичной диаграмме показано положение потенциальных сайтов связывания для нуклеарных факторов, где главный сайт инициации транскрипции обозначен заштрихованной стрелкой. Звездочкой отмечена неохарактеризованная связывающая активность в дистальных 3 т.п.о. Для каждой конструкции после нормализации за эффективность трансфекции с использованием RVS-CAT в качестве внутреннего контроля вычисляли активность по отношению к -6500 STF Luc. Анализ повторяли, по крайней мере, в течение четырех раз.
Фиг. 5 демонстрирует, что проксимальный элемент Е-бокс в промоторе STF-1 связывается с вышерасположенным фактором USF. На фиг.5 показаны результаты анализа на защиту от ДНКазы с использованием 32Р-меченного фрагмента промотора STF-1, простирающегося от -182 до -37 (145 пар оснований). Авторадиограмма показывает характер гидролиза в отсутствие экстракта (дорожки 1 и 4), в присутствии нуклеарных экстрактов от клеток HIT или HeLa (дорожки 2 и 3 соответственно) или в присутствии рекомбинантного USF-1 (дорожка 5).
Фиг.5 иллюстрирует анализ на сдвиг электрофоретической подвижности нуклеарного экстракта HIT, инкубированного с 32P-меченным двухцепочечным олигонуклеотидом, содержащим Е-бокс STF-1 (-118/-95)(дорожка 1). Немеченные конкурентные олигонуклеотиды (в 50-кратном молярном избытке) добавляли для проведения реакции связывания, как показано на чертеже (дорожки 2-5): Е-бокс STF-1 представляет собой олигонуклеотид Е-бокса STF-1 дикого типа; STF-E MUT обозначает мутантный олигонуклеотид STF-E, содержащий замены в мотиве Е-бокса на участке -106 (С/А) и -103 (T/G). Ins-1 (P) представляет собой Р-элемент инсулинового промотора I; a Ga14 обозначает сайт распознавания Ga14.
Фиг. 5С, слева, иллюстрирует результаты анализа на сдвиг в геле экстрактов нуклеарных клеток HIT с использованием STF-Е-бокса в качестве зонда (дорожка 1). Добавление антитела против USF или TFE-3 к реакционной смеси проводили, как показано на чертеже (дорожки 2 и 3). Комплексы C1, C2, С3 помечены. На фиг.5С, справа, показаны результаты анализа на сдвиг в геле для HIT-экстрактов (дорожки 1-3) с использованием STF-E в качестве зонда. Добавление специфической антисыворотки против USF-1 и USF-2 к реакционной смеси проводили, как показано на чертеже.
Фиг. 6 иллюстрирует, что связывание USF с -104 Е-боксом имеет важное значение для активности промотора STF-1. На фиг.6А показано действие мутаций Е-бокса на USF-связывющую активность. Показаны результаты анализа на сдвиг в геле для нуклеарных HIT-экстрактов, проведенного с использованием в качестве зондов Е-бокса STF-1 дикого типа (E-WT) или мутантного Е-бокса STF-1 (E-MUT), где последовательности зонда дикого типа и мутантного зонда от -106 до -102 показаны внизу. С1-3 означает комплексы C1, C2 и С3. На фиг.6В показано действие мутаций Е-бокса на STF-1-промоторную активность в клетках HIT. Проиллюстрирован репрезентативный анализ клеток HIT, трансфецированных Е-боксом STF-1 дикого типа, мутантным Е-боксом STF-1 или делетированными (-118/-95) мотивами Е-бокса STF-1 в окружении ("контексте"), 6500 п.о. или 190 п.о. промотора STF-1. Показана активность репортера по отношению к конструкции -6500 STF-1 Luc дикого типа (100%) после ее нормализации за эффективность трансфекции ко-трансфецированной контрольной плазмидой RVS-САТ. Анализы повторяли, по крайней мере, три раза.
Фиг.7 демонстрирует, что гликокортикоиды подавляют экспрессию STF-1 посредством островково-специфического энхансера в 5'-фланкирующей области гена STF-1.
Фиг. 7А иллюстрирует активность конструкции промотора STF-1 после обработки клеток HIT-T15 дексаметазоном (10-7М) или контрольным этаноловым наполнителем в течение 18-24 часов. Активность -6,2/-5,67-STF-1 Luc-репортера составляла 100%. Все конструкции оценивали в "контексте" векторной "STF-1- люцифераза" (STF-1 Luc)- последовательности, которая содержит 120 оснований 5'-фланкирующей области. Последовательности STF-1, встроенные в ген-репортер STF-1 Luc, обозначены номерами нуклеотидов. Так, например, -6,2/-5,67-STF-1 Luc содержит последовательности от -6500 до -6200, присоединенные к проксимальным 120 основаниям 5'-фланкирующей области STF-1. Дистальные области, которые содержат активирующие элементы, показаны овалами и квадратами, а минимальный промотор STF-1 показан прямоугольниками. Стандартные ошибки обозначены блоками. Анализы повторяли, по крайней мере, три раза. Активность STF-1-репортера была нормализована за эффективность трансфекции с использованием ко-трансфецированной контрольной плазмиды CMV-β-gal.
Фиг. 7В (вверху) иллюстрирует результаты анализа кратковременной трансфекции конструкции STF-1-репортер в клетках HIT T15. Активность -6500 STF Luc-конструкции, содержащей 6500 оснований 5'-фланкирующей последовательности, составляла 100%. Каждый анализ повторяли в дубликатах, по крайней мере, четыре раза. Стандартные ошибки были такими, как показано на чертеже. (Внизу) Показана активность плазмиды, содержащей конструкцию "STF-1 - люцифераза-репортер", после кратковременной трансфекции в клетки COS-7. Промоторная активность была нормализована за контрольную активность CMV-β-gal, что позволило провести прямое сравнение с активностью конструкции "STF - репортер" в клетках HIT.
Фиг. 7С иллюстрирует нуклеотидную последовательность минимального островково-специфического энхансера в гене STF-1, который простирается от -6,2 до -5,6 т.п.о. HNF-3 и Е-бокс-связывающие мотивы указаны и подчеркнуты.
Фиг. 8 демонстрирует, что островково-специфичный энхансер в гене STF-1 содержит связывающие сайты для HNF-β3 и ВЕТА-2.
Фиг. 8А иллюстрирует результаты анализа на защиту от ДНКазы неочищенных нуклеарных экстрактов, полученных от островковых клеток HIT T15, HeLa или COS-7 с использованием 32Р-меченного STF-1-зонда, простирающегося от -5870 до -6100 промотора STF-1 крысы. NONE: контрольная реакция без добавления экстракта; HNF-3α: реакция с использованием рекомбинантного протеина.
Фиг. 8В иллюстрирует результаты анализа на сдвиг подвижности в геле для неочищенных экстрактов от HeLa, HepG2, глюкагон-продуцирующей клеточной линии αTC, или инсулинпродуцирующих клеточных линий HIT и RIN, как показано на каждой дорожке. Анализ проводили с использованием 32Р-меченного олигонуклеотидного STF-1-зонда, содержащего Н-элемент. Ниже показаны нуклеотидная последовательность Н-элемента дикого типа (WT) и мутантная последовательность (МТ) Н-элемента. Добавление 100-кратного избытка немеченного дикого типа ДНК-конкурента или мутантного ДНК-конкурента проводили, как показано на дорожках.
Фиг. 8С иллюстрирует результаты анализа на сдвиг подвижности в геле неочищенного нуклеарного экстракта от инсуломы HIT (HIT NE) и первичных культивированных островковых клеток взрослой крысы (ISLET NE) с использованием 32Р-меченного олигонуклеотидного STF-зонда, содержащего Н-элемент и простирающегося от -5907 до -5927. Добавление антисыворотки против HNF-3 α, β, или γ в реакционную смесь показано на каждой дорожке - антисыворотку не добавляли. I и II: комплексы белок - ДНК и антитело со сверхсдвигом соответственно.
Фиг. 8D иллюстрирует результаты анализа на сдвиг подвижности в геле неочищенного нуклеарного экстракта от клеток HIT T15 с использованием 32Р-меченного зонда, содержащего В-элемент и простирающегося от -5963 до -5981 промотора STF-1. Добавление антисыворотки против BETA-2, E2A или STF-1 к реакции для связывания показаны на каждой дорожке. Добавление 100-кратного избытка немеченной последовательности дикого типа (WT: 5'-TCAGTGACAGATGGAGTCCT -3') или мутантной последовательности (МТ: 5'-TCAGTGAAAGACGGAGTCCT-3') ДНК конкурента проводили, как показано на чертеже. Связывающая активность, полученная от лизата ретикулоцитов, запрограммированная кДНК ВЕТА-2 и Е-47, показана на дорожке 7. Верхняя полоса на дорожке 7 является характерной для лизата ретикулоцитов.
Фиг. 9 демонстрирует, что глюкокортикостероиды ингибируют экспрессию STF-1 путем блокирования воздействия HNF-3 на островково-специфический энхансер.
Фиг. 9А иллюстрирует результаты анализа на кротковременную трансфекцию плазмид, содержащих конструкцию STF-1- репортер, в клетках инсулиномы HIT T15. Активность конструкции -6,2/-5,67-STF Luc, содержащей минимальный островково-специфический энхансер (от -6200 до -5700), достигает 100 %. Конструкции, содержащие точковые мутации в Н- и В-элементах, которые разрушают связывание HNF-3β и ВЕТА/Е2А, обозначены Х в овале или квадрате. Точковые мутации, соответствующие мутациям в Е-бокс- и Н-элементах, использовали в анализе на сдвиг подвижности в геле (см. фиг.8).
Фиг.9В демонстрирует влияние сверхэкспрессии HNF-3β на активность конструкции -6,2/-5,67-STF Luc, содержащей дикого типа (заштрихованные блоки) и мутантный (светлые блоки) Н-элемент в контрольных (-) и обработанных дексаметазоном (+) клетках HIT-T15. Активность конструкции -6,2/-5,67-STF Luc, содержащей минимальный островково-специфический энхансер (от -6200 до -5700), достигает 100 %. Стандартные ошибки показаны соответствующими блоками. Эксперименты повторяли, по крайней мере, четыре раза.
Фиг. 9С иллюстрирует влияние возрастающих уровней эффекторной плазмиды HNF-3β на активность конструкции "STF-1 (-6500 STF-1 Luc) - репортер" дикого типа в клетках HIT-T15. Количество HNF-3β эффекторной плазмиды в (мкг) показано ниже у каждого столбца. Полное количество эффекторной плазмиды в каждом анализе поддерживалось постоянным путем уравновешивания пустым вектором экспрессии CMV. Показаны контрольные клетки (ЕТОН) и клетки, обработанные дексаметазоном (DEX).
Подробное описание изобретения
В настоящем изобретении продемонстрировано, что STF-1, гомеодоменный белок, который участвует в панкреатическом морфогенезе и в глюкозном гомеостазе, кодируется гомеоблоксодержащим геном "орфаном", локализованным на мышиной хромосоме 5. При присоединении его к гену-репортеру β-галактозидазы, геномный 65 т. п.о.-фрагмент 5'-фланкирующей последовательности гена STF-1 обнаруживает специфичную в отношении панкреатических островков активность у трансгенных мышей. Два различных элемента в промоторе STF-1 необходимы для ограниченной островковой экспрессии дистальной энхансерной последовательности, расположенной между -3 и -6,5 т.п.о, и проксимальной последовательности Е-бокса, расположенной у нуклеотида -104, которая, главным образом, распознается нуклеарным фактором USF, содержащим структуру "спираль-петля-спираль (bHLH)/-лейциновая молния (ZIP)". Поскольку точковые мутации в-104 Е-боксе нарушают связывание USF и соответственно блокируют активность промотора STF-1, то настоящее изобретение продемонстрировало, что USF является важным компонентом регуляторного аппарата, который направляет экспрессию STF-1 в клетки панкреатических островков. Кроме того, было обнаружено, что глюкокортикоиды возможно подавляют экспрессию гена STF-1 путем блокирования активности дистальной области островково-специфического энхансера, который распознает два эндодермальных фактора: HNF-3β и ВЕТА-2/Е47. Мутации в энхансере STF-1, которые блокируют связывание либо HNF-3β, либо ВЕТА-2/Е47 соответственно, разрушают активность промотора STF-1. Способность НМР-3β-экспрессирующего вектора "спасать" активность энхансера STF-1 в обработанных глюкокортикоидом клетках свидетельствует о том, что HNF-3β действительно является важным регулятором экспрессии STF-1.
Одной из целей настоящего изобретения является разработка способа тестирования соединений, которые индуцируют транскрипцию STF-1. Клеточные линии панкреатических островков, экспрессирующие гибридный ген STF-1/lacZ, выделяли путем совместного осаждения с использованием фосфата кальция. Для оценки влияния различных соединений на экспрессию STF-1 к STF-l/lacZ-экспрессирующим клеткам добавляли соединение, представляющее интерес. Количественную оценку lacZ-активности в контрольных и обработанных клетках проводили с помощью колориметрического анализа. С использованием этот метода может быть скринировано большое число соединений, и SТF-1-индуцирующие соединения могут быть легко идентифицированы.
Другой целью настоящего изобретения является разработка способа использования промотора STF-1 для in vivo-мечения инсулинпродуцирующих клеток панкреатических островков. Для этого в качестве витального индикатора служил флуоресцентный белок, дающий зеленую окраску (GFP). Экспрессия GFP может быть детектирована без разрушения клеток, как описано Ogawa et al., Proc.Natl. Acad. Sci. , 1995, 92: 11899-11903. Для облегчения выделения β-клеток из поджелудочной железы животных промотор STF-1 был присоединен к гену, кодирующему GFP. Введение трансгена STF-1-GFP свиньям позволило осуществить эффективное и быстрое выделение инсулинпродуцирующих клеток из поджелудочной железы. Короче говоря, у свиней удаляли поджелудочную железу и обрабатывали ее коллагеназой для диспергирования клеток. Инсулинпродуцирующие островковые клетки выделяли методом флуоресцентно-активируемой клеточной сортировки (FACS), проводимой на основе экспрессии трансгена STF-1-флуоресцентного белка с зеленой окраской. Затем очищенную популяцию β-клеток использовали в клеточной терапии пациентов, страдающих диабетом.
В одном из своих аспектов настоящее изобретение относится к способу определения способности испытуемых соединений стимулировать клетки панкреатических островков для индуцирования транскрипции STF-1, где указанный способ включает следующие стадии: получение вектора, содержащего энхансер STF-1, имеющий последовательность, выбранную из SEQ ID No:l или SEQ ID No:2 или их фрагментов, промотор, и репортерный ген, находящийся под транскрипционным контролем как указанного энхансера STF-1, так и указанного промотора, где указанный ген-репортер способен сообщать детектируемый сигнал указанной клетке-хозяину; перенос указанного вектора в указанную клетку-хозяина; культивирование указанной клетки-хозяина в присутствии тестируемого соединения с целью определения способности указанного тестируемого соединения стимулировать указанную клетку-хозяина на продуцирование указанного сигнала и анализ этого сигнала для определения способности указанного тестируемого соединения стимулировать указанную клетку-хозяина на продуцирование указанного детектируемого сигнала, где присутствие указанного сигнала свидетельствует о том, что указанное тестируемое соединение стимулирует индуцирование транскрипции STF-1 в клетках панкреатических островков, и где отсутствие указанного сигнала свидетельствует о том, что указанное тестируемое соединение не стимулирует индуцирование транскрипции STF-1 в клетках панкреатических островков.
В предпочтительном варианте осуществления этой цели настоящего изобретения ген-репортер используют в качестве фермента. В более предпочтительном варианте этот фермент выбирают из люциферазы и β-галактозидазы.
В другом варианте настоящего изобретения указанную стадию переноса осуществляют путем введения трансгена животным методом трансфекции или микроинъекции.
Другой целью настоящего изобретения является разработка способа получения инсулинпродуцирующих клеток панкреатических островков in vivo, включающего следующие стадии: получение вектора, содержащего промотор STF-1, и ген-репортер, находящийся под транскрипционным контролем указанного промотора, где указанный ген-репортер способен сообщать детектируемый сигнал указанной клетке-хозяину; введение указанного вектора в качестве трансгена в эмбрион хозяина; выращивание указанного эмбриона с продуцированием животного, имеющего клетки панкреатических островков; и анализ на детектируемый сигнал с целью определения, способны ли какие-либо клетки панкреатических островков хозяина экспрессировать указанный ген-репортер, где присутствие указанного сигнала свидетельствует о присутствии инсулинпродуцирующих клеток панкреатических островков и где отсутствие указанного сигнала свидетельствует об отсутствии инсулинпродуцирующих клеток панкреатических островков.
В предпочтительном варианте осуществления этой цели изобретения ген-репортер продуцирует флуоресцентный белок, а указанный способ, кроме того, включает стадию сортировки инсулинпродуцирующих клеток панкреатических островков от не продуцирующих инсулин клеток панкреатических островков методом клеточного сортинга с активацией флуоресценции (FACS).
Геном человека содержит четыре кластера генов, называемых Нох или гомеотическими селекторными генами, которые являются очень важными детерминантами образования набора аксиальных телец в процессе эмбриогенеза (Krumlauf, 1994, Cell, 78: 191-201). Каждый из этих четырех кластеров содержит до 13 генов, и данный ген в одном из кластеров обычно обладает высокой степенью гомологии с членами других трех семейств генов. Такие родственные гены называются паралогами; поэтому все HoxAl, HoxBl, HoxCl и HoxDl являются близкородственными паралогами, при этом каждый из них находится в различных Нох-кластерах и на разных хромосомах. НохВ-комплекс находится на длинном плече хромосомы 17, так, например, были идентифицированы гены НохВ1-НохВ9.
Очевидно, что глюкозо-зависимая регуляция инсулинового гена происходит в соответствии с глюкозо-опосредованным увеличением секреции инсулина. Это может быть отчасти обусловлено увеличением уровня внутриклеточного кальция. Кроме того, глюкозо-восприимчивая функция промотора инсулина может быть реализована, по крайней мере, частично, путем модуляции активности FLAT-связывающих белков. НохВ13 связывает функционально важный элемент FLAT инсулинового промотора с высокой степенью аффинности. Кроме того, добавление комбинации HoxBl3 и фактора Раn-1, связывающего ICE/Nir-элемент, способствует сильной активации инсулинового промотора. Этот факт соответствует наблюдению, которое показало, что FLAT- и Nir-элементы действуют синергически в инсулинпродуцирующих клетках. Эти вместе взятые данные дают основание предположить, что кальций-зависимый путь передачи сигнала может регулировать функцию HoxB13.
В соответствии с этим настоящее изобретение может быть использовано в стандартной молекулярной биологии, микробиологии и в технике рекомбинантных ДНК, хорошо известной специалистам. Эта техника подробно описана в литературе. См. , например, Maniatis Т., Fritsch & Sambrook, "Molecular Cloning: A Laboratory Manual" (1982); "DNA Cloning: A Practical Approach", Volumes I и II (D. N. Glover ed. 1985); "Oligonucleotide Synthesis" (M.J.Gait ed.1984); "Nucleic Acid Hybridization" [B. D. Hames & S. I.Higgins eds. (1985)]; "Transcription and Translation" [B. D. Hames & S.J.Higgins eds. (1984)]; "Animal Cell Culture" [R.I. Freshney, ed. (1986)]; "Immobilized Cells and Enzymes" [IRL Press, (1986)]; B.Perbal, "A Practical Guide To Molecular Cloning" (1984).
Поэтому ниже приводятся определения терминов, используемых в настоящем описании.
Термин "вектор" означает репликон, такой как, плазмида, фаг или космида, в который может быть встроен другой сегмент ДНК так, чтобы осуществлялась репликация встроенного сегмента.
Термин "молекула ДНК" обозначает полимерную форму дезоксирибонуклеотидов (аденина, гуанина, тимина или цитозина) либо в виде ее одноцепочечной последовательности, или в виде ее двухцепочечной спирали. Этот термин относится только к первичной и вторичной структуре молекулы и не ограничивается какими-либо конкретными третичными формами. Так, например, этот термин включает двухцепочечную ДНК, присутствующую, inter alia, в линейных ДНК-молекулах (например, фрагменты рестрикции), вирусах, плазмидах и хромосомах. В настоящем описании, при обсуждении структуры последовательностей, эти последовательности в соответствии с общепринятыми нормами даются только в направлении 5' -- > 3' вдоль нетранскрибированной цепи ДНК (то есть эта цепь является гомологичной мРНК).
Термин "сайт инициации репликации" означает ДНК-последовательность, которая участвует в синтезе ДНК.
Термин "кодирующая последовательность" ДНК означает двухцепочечную ДНК-последовательность, которая при помещении ее под контроль соответствующих регуляторных последовательностей, транскрибируется и транслируется in vivo с образованием полипептида. Границы кодирующей последовательности определяются старт-кодоном у 5' (амино)-конца и кодоном терминации трансляции у 3' (карбоксильного) конца. Такими кодирующими последовательностями могут быть, но не ограничиваются ими, прокариотические последовательности, кДНК от эукариотической мРНК, геномные ДНК-последовательности от эукариотической ДНК (например, ДНК млекопитающего) и даже синтетические ДНК-последовательности. Сигнал полиаденилирования и последовательность терминации трансляции обычно расположены у 3'-конца кодирующей последовательности.
Последовательностями, осуществляющими транскрипционный и трансляционный контроль, являются регуляторные ДНК-последовательности, такие как промоторы, энхансеры, сигналы полиаденилирования, терминаторы и т.п., то есть последовательности, обеспечивающие экспрессию кодирующей последовательности в клетке-хозяине.
Термин "промоторная последовательность" означает регуляторную область ДНК, способную связываться с РНК-полимеразой в клетке и инициировать транскрипцию расположенной ниже (в направлении --> 3') кодирующей последовательности. Для лучшего понимания настоящего изобретения следует упомянуть, что промоторная последовательность ограничивается у его 3'-конца сайтом инициации транскрипции и простирается вверх (в направлении --> 5'), включая минимальное число оснований или элементов, необходимых для инициации транскрипции на обнаружимом уровне, превышающем фоновый уровень. В этой промоторной последовательности обнаружен сайт инициации транскрипции (обычно определяемый путем картирования нуклеазой SI), a также белок связывающие домены ("консенсусные последовательности"), ответственные за связывание с РНК-полимеразой. Эукариотические промоторы часто, но не всегда, содержат "ТАТА"-боксы и "CAT"-боксы. Прокариотические промоторы, помимо -10 и -35 последовательностей "консенсуса", содержат последовательности Шайна-Дальгарно.
Термин "экспрессионные регуляторные последовательности" означает ДНК-последовательности, осуществляющие контроль и регуляцию транскрипции и трансляции других ДНК-последовательностей. Кодирующая последовательность находится "под контролем" транскрипционных и трансляционных регуляторных последовательностей в клетке, когда РНК-полимераза транскрибирует кодирующую последовательность в мРНК, которая затем транслируется с образованием белка, кодируемого кодирующей последовательностью.
"Сигнальная последовательность" может находиться перед кодирующей последовательностью. Эта последовательность
кодирует сигнальный пептид, N-концевой пептид полипептида, который сообщается с клеткой-хозяином для направления полипептида к клеточной поверхности или для секреции полипептида в среду и который отщепляется от клетки-хозяина перед тем, как белок покинет клетку. Сигнальные последовательности могут быть ассоциированы с рядом нативных белков прокариотов и эукариотов.
Термин "олигонуклеотид", используемый в настоящем описании применительно к зонду настоящего изобретения, означает молекулу, состоящую из двух или более, а предпочтительно более 8 рибонуклеотидов. Точный размер олигонуклеотида зависит от многих факторов, которые, в свою очередь, зависят от конечной функции и использования этого олигонуклеотида.
Термин "праймер", используемый в настоящем описании применительно к олигонуклеотиду, является либо природным олигонуклеотидом, очищенным путем рестрикционного гидролиза, либо синтетически продуцированным олигонуклеотидом, который способен действовать как точка инициации синтеза, при помещении его в условия, при которых индуцируется синтез продукта удлинения праймера, являющегося комплементарным нуклеиновокислотной цепи, то есть в условия, где присутствуют нуклеотиды и индуцирующий агент, такой как ДНК-полимераза, при соотвествующих температуре и рН. Праймер может быть одноцепочечным или двухцепочечным и должен быть достаточно длинным для праймирования синтеза нужного продукта удлинения в присутствии индуцирующего агента. Точная длина праймера зависит от многих факторов, включая температуру, источник праймера и метод его использования. Так, например, если праймер используется в целях диагностики, то в зависимости от сложности последовательности-мишени, олигонуклеотидный праймер обычно содержит 15-25 или более нуклеотидов, хотя он может содержать и меньшее число нуклеотидов.
В соответствии с настоящим изобретением, праймеры выбирают так, чтобы они были "в основном" комплементарными различным цепям конкретной ДНК-последовательности-мишени. Это означает, что эти праймеры должны быть достаточно комплементарными для гибридизации с их соответствующими цепями. Поэтому последовательность праймера не обязательно должна быть точной копией последовательности матрицы. Так, например, некомплементарный нуклеотидный фрагмент может быть присоединен к 5'-концу праймера, при этом остальная последовательность праймера будет комплементарной данной цепи. Альтернативно, некомплементарные основания или более длинные последовательности могут быть вставлены в праймер, при условии, что последовательность праймера обладает достаточной комплементарностью по отношению к данной последовательности или гибридизируется с ней и тем самым образует матрицу для синтеза продукта удлинения.
Используемые в настоящем описании термины "рестриктирующие эндонуклеазы" и "рестриктирующие ферменты" относятся к бактериальным ферментам, каждый из которых разрезает двухцепочечную ДНК в специфической нуклеотидной последовательности или возле нее.
Клетки являются "трансформированными" экзогенной или гетерологичной ДНК, в том случае, когда эта ДНК была введена вовнутрь клетки. Такая трансформирующая ДНК может быть, а может и не быть интегрированной (ковалентно вшитой) в геном клетки. Например, в прокариотах, дрожжах и в клетках млекопитающих, трансформирующая ДНК может находиться на эписомальном элементе, таком как плазмида. Что касается эукариотических клеток, то стабильно трансформированной клеткой является такая клетка, в которой трансформирующая ДНК интегрируется в хромосому так, что она наследуется дочерними клетками посредством хромосомной репликации. Эта стабильность подтверждается способностью эукариотических клеток генерировать клеточные линии или клоны, состоящие из популяции дочерних клеток, содержащих трансформирующую ДНК. "Клон" представляет собой популяцию клеток, происходящих от одной клетки или общего предшественника путем митоза. "Клеточная линия" представляет собой клон первичных клеток, способных к стабильному росту in vitro с образованием множественного потомства. ДНК-последовательности являются "в основном гомологичными", если, по крайней мере, около 75% (предпочтительно, по крайней мере, около 80%, а наиболее предпочтительно, по крайней мере, от около 90 до около 95%) нуклеотидов имеют соответствие по всей длине ДНК-последовательностей. Последовательности, которые являются в основном гомологичными, могут быть идентифицированы путем сравнения последовательностей с использованием стандартной программы, имеющейся в банке данных последовательностей, или с помощью эксперимента по Сау-зерн-гибридизации, например, в жестких условиях, определенных для каждой конкретной системы. Определение подходящих условий гибридизации можно найти в литературе. См., например, Maniatis Т., et al., см. выше; DNA Cloning, vol. I & II, см. выше; Nucleic Acid Hybridization, см. выше.
"Гетерологичная" область ДНК-конструкции представляет собой идентифицируемый сегмент ДНК в более крупной молекуле ДНК, которая в природе не ассоциируется с этой более крупной молекулой. Таким образом, если гетерологичная область кодирует ген млекопитающего, то этот ген будет, очевидно, фланкирован ДНК, которая не фланкирует геномную ДНК в геноме организма-источника. В другом примере, кодирующая последовательность представляет собой конструкцию, где в естественных условиях сама кодирующая последовательность отсутствует (например, кДНК, где геномная кодирующая последовательность содержит интроны или синтетические последовательности, имеющие кодоны, отличающиеся от кодонов нативного гена). Аллельные варианты или природные мутационные события не создают гетерологичную область ДНК, определенную в настоящем описании.
Метками, наиболее широко используемыми в этих исследованиях, являются радиоактивные элементы, ферменты, химические соединения, которые флуоресцируют при их экспонировании ультрафиолетовым светом, и др. Некоторые флуоресцентные материалы известны специалистам и могут быть использованы в качестве меток. Такими материалами являются, например, флуоресцеин, родамин, аурамин, техасский красный, АМСА голубой и люциферовый желтый. В частности, детектирующим материалом является антикроличье антитело, продуцированное у коз и конъюгированное с флуоресцеин-изотиоцианатом.
Могут быть также использованы ферментные метки, и эти метки могут быть детектированы любым из применяемых в настоящее время методов, таких как колориметрическая, спектрофотометрическая, флуороспектрофотометрическая, амперометрическая или газометрическая техника. Этот фермент конъюгируют с селектируемой частицей посредством реакции с мостикообразующими молекулами, такими как карбодиимиды, диизоцианаты, глутаральдегиды и т.п. Многие ферменты, которые могут быть использованы в этих процедурах, являются известными и могут быть использованы в настоящем изобретении. Предпочтительными являются пероксидаза, β-глюкуронидаза, β-D-глюкозидаза, β-D-галактозидаза, уреаза, глюкозооксидаза + пероксидаза и щелочная фосфатаза. Примеры других материалов и способов мечения описаны в патентах США 3654090, 3850752 и 4016043.
Нижеследующие примеры приводятся в целях иллюстрации различных вариантов настоящего изобретения и не должны рассматриваться как некое ограничение его объема.
Пример 1
Хромосомное картирование
Хромосомное картирование гена STF-1 осуществляли с использованием панели возвратного скрещивания (В6 х SPRET)F1 х SPRET ДНК, полученной из Центра Jackson Laboratory Backcross DNA Panel Map Service и с использованием 32Р-меченного кДНК-фрагмента STF-1 в качестве зонда.
Пример 2
Генерация трансгенных мышей и окрашивание β-галактозидазой
Гибридный ген, содержащий 6500 пар оснований, расположенных выше STF-1-последовательности перед геном-репортером β-галактозидазы, конструировали с использованием стандартной техники клонирования и инъецировали в мужской пронуклеус оплодотворенных ооцитов. Мышей-производителей идентифицировали с использованием блоттинга и техники PCR-амплификации. Экспрессию гена STF-1/β-галактозидазы в трансгенных тканях оценивали на 20 мкМ-срезах фиксированных параформальдегидом тканей с использованием Х-gа1 в качестве хромогенного субстрата.
Пример 3
Антитела
Антитела, не различающие USF-1,2 и использованные в экспериментах на сверхсдвиг, поставлялись от Santa Cruz Biotechnology. Антитела к TFE3 получали от K.Jones. Антитела, которые специфически распознавали USF-1 или USF-2, получали от М. Sawadogo (17,18).
Пример 4
Выделение геномных клонов STF-1
Ген STF-1 выделяли из крысиной геномной библиотеки EMBL 3 с использованием 32Р-меченного кДНК-фрагмента STF-1 в качестве гибридизационного зонда. Геномные фрагменты, содержащие STF-1, были субклонированы в EcoRI-сайты плазмиды SK II (Stra-tagene).
Пример 5
Защита от РНКазы и удлинение праймера
ро1у(А)+РНК получали с использованием системы Oligotex (dT) 30 (Quiagen). Олигонуклеотидные праймеры для эксперимента на удлинение праймера были помечены у 5'-конца с использованием γ-32P-ATP и полинуклеотидкиназы Т4. 5 мкг ро1у(А)+РНК инкубировали с меченным по концу антисмысловым праймером в течение 5 минут при 80oС, а затем инкубировали в течение 16 часов при 42oС. Реакцию для удлинения праймера осуществляли с использованием обратной транскриптазы AMV в течение 1 часа при 37o С, и полученные продукты анализировали на 5% денатурирующем полиакриламиде. Анализ на защиту от РНКазы осуществляли с использованием 25 мкг всей РНК, экстрагированной из клеток Тu6 (19). Антисмысловой STF-1-РНК-зонд генерировали с использованием геномного фрагмента STF-1, простирающегося от -185 до +93 по отношению к сайту инициации трансляции. 32Р-меченную антисмысловую STF-1-РНК синтезировали in vitro с использованием РНК-полимеразы Т7 и 32P-UTP. STF-1-антисмысловой РНК-зонд и мРНК отжигали в течение 5 минут при 80oС, а затем инкубировали в течение 16 часов при 65oС. Затем продукты реакции отжига обрабатывали 40 мкг/мл РНКазы при комнатной температуре в течение 1 часа и продукты гидролиза анализировали с помощью электрофореза на 5% денатурирующем полиакриламидном геле.
Пример 6
Репортерные клоны и кратковременная трансфекция
Все фрагменты промотора клонировали в остов люциферазы р(А)3, полученный от D. Helinski (20) с использованием стандартных методов клонирования. 5'-Фланкирующие последовательности от промотора STF-1 присоединяли к гену люциферазы у +68 (-6500 STF Luc, -3500 STF Luc, -540 STF Luc, -410 STF Luc, -225 STF Luc, -140 STF Luc) или +78 (-190 STF Luc, -130 STF Luc, -120 STF Luc, -95 STF Luc, -35 STF Luc) no отношению к главному сайту инициации транскрипции. Плазмиды переносили в клетки HIT-T15 (АТСС), βТС, 3 (поставлялся от D. Hanahan (21)), в клетки НС12, COS и HeLa путем осаждения фосфатом кальция. Уровень люциферазы количественно оценивали на монохроматическом люминометре и нормализовали на САТ-активность, полученную исходя из ко-транфецированной внутренней контрольной плазмиды RSV-CAT.
Пример 7
Анализ на сдвиг в геле и анализ на защиту от ДНКазы
Для проведения электрофоретического анализа на сдвиг мобильности в геле, олигонуклеотидные зонды метили α32P-dCTP с помощью реакции застраивания концов с использованием фрагмента Кленова. 4 мкг нуклеарного экстракта инкубировали с 0,5 нг 32Р-меченного двухцепочечного олигонуклеотида и подвергали электрофорезу на неденатурирующем полиакриламиде, как было описано ранее (9). Для проведения анализа на сверхсдвиг, белки предварительно инкубировали с антителом, а затем инкубировали с радиоактивным двухцепочечным олигонуклеотидом и проводили электрофорез. Анализ на защиту от ДНКазы осуществляли, как описано ранее (22).
Информацию для анализа на связывание с ДНК получали путем сканирования исходных фотографий с использованием сканера HP ScanJet 3С и собирали с использованием программного обеспечения Canvas на компьютере Macintosh. Сканированные изображения воспроизводили на Tektronix Phaser II SDX.
Пример 8
Локализация на хромосоме и геномная организация гена STF-1
С использованием кДНК STF-1 в качестве гибридизационного зонда на панели обратного скрещивания ДНК, полученной из лаборатории (Jackson Laboratories), одну копию гена STF-1 картировали до дистальной области мышиной хромосомы 5 (фиг.1А). С использованием дистальных маркеров PmV12 или lapls3-9 каких-либо рекомбинантов не было обнаружено, тогда как с помощью более дистального локуса Actb было обнаружено шесть рекомбинантов (фиг.1В). Эти результаты дают основание предположить, что ген STF-1 может быть обнаружен соответственно на крысиной хромосоме 14 и человеческой хромосоме 7q в локусах, которые не соответствуют ни одному из четырех гомеотических НОХ-кластеров. Эти результаты указывают на то, что STF-1 может быть классифицирован как ген гомеобокса "орфана".
Для выделения гена, кодирующего STF-1, из крысиной геномной библиотеки EMBL 3 с использованием 32Р-меченного кДНК-зонда STF-1 было скринировано 106 бактериофаговых клона и получено два положительных клона, каждый из которых содержал геномную вставку из 15 тысяч пар оснований (т.п.о.). Помимо 6,5 т. п. о. 5'-фланкирующей и 3,5 т.п.о. 3'-фланкирующей последовательности, геномный 15 т.п.о.-фрагмент STF-1 содержал всю STF-1-кодирующую область, которая прерывается одним 4 т.п.о.-интроном, встроенным непосредственно выше (А1а 135) гомеобокс-кодирующей последовательности (аминокислоты 140-215) (фиг.2А).
Консенсусная последовательность ТАТА-бокса и инициирующая последовательность в 5'-фланкирующей области геномного клона STF-1 (фиг.2В) отсутствовали. Затем были картированы сайты инициации транскрипции для этих генов. С помощью анализов на защиту от РНКазы и на удлинение праймера, проводимых для оценки уровня мРНК в инсулинпродуцирующих клеточных линиях RIN и Тu6 (фиг. 2С и фиг.2D), были идентифицированы три главных старт-сайта S1, S2 и S3, которые были локализованы в положениях нуклеотидов 91, 107 и 120/125 выше от сайта инициации трансляции соответственно. Был обнаружен также четвертый минорный сайт инициации транскрипции, который был локализован в положении 137 выше от сайта инициации трансляции. Подобно другим промоторам, у которых отсутствовал ТАТА-бокс, промотор STF-1 содержал 30 п.о. G/A- и G/C-богатых последовательностей, расположенных выше старт-сайтов S1 и S2 (23-25).
Пример 9
Активность промотора STF-1 в клетках панкреатических островков
Для того, чтобы определить, являются ли последовательности в 5'-фланкирующей области гена STF-1 достаточными для направленной экспрессии STF-1 в клетках панкреатических островков, 6500 пар оснований 5'-фланкирующей последовательности STF-1 присоединяли к гену β-галактозидазы и экспрессию этой конструкции "STF-l/lacZ-репортер" оценивали в трансгенных мышах. С использованием Х-gа1 в качестве хромогенного субстрата β-галактозидазная активность была детектирована в панкреатических островках трансгенных мышей, но не в контрольном потомстве от трех независимых линий-производителей (фиг.3А).
В соответствии с ранее описанной картиной экспрессии для эндогенного белка STF-1 не было обнаружено какой-либо значительной β-галактозидазной активности в экзокринных ацинарных клетках (фиг.3В) или в непанкреатических тканях, таких как печень и селезенка трансгенных мышей (не показано). В соответствии с описанной экспрессией эндогенного гена STF-1 в двенадцатиперстной кишке (8, 13) исследования методом in suti-гибридизации с использованием антисмыслового β-галактозидазного РНК-зонда также выявили экспрессию трансгена в эпителиальных клетках двенадцатиперсной кишки трансгенных животных (не показано). Эти результаты указывают на то, что 6500 п.о. промотора STF-1 действительно являются достаточными для направленной экспрессии STF-1 в клетках панкреатических островков и двенадцатиперстной кишки.
Для определения функциональных элементов, которые направляют экспрессию STF-1 в клетки панкреатических островков, была оценена активность конструкции "-6500 STF Luc-репортер" в двух различных клеточных линиях панкреатических островков (βТС 3, HIT). Как было предположено исходя из результатов, полученных от трансгенных мышей, конструкция STF-1-репортер показала в 20-100 раз большую активность в этих островковых клетках по сравнению с неостровковыми клетками, такими как HeLa, PC12 и COS (фиг.4А). В отличие от этого 4 т.п.о.-интрон и 3 т. п.о. S'-фланкирующей области гена STF-1 не обнаруживали такой активности при их введении в плазмиду с минимальным промотором CAT SV40 (не показано), что дает основание предположить, что 6,5 т.п.о.-фрагмент STF-1-промотора является специфически ответственным за направленную экспрессию STF-1 в островковых клетках.
Для определения размеров последовательностей в промоторе STF-1, который обеспечивает экспрессии в островковых клетках, была генерирована серия конструкций с 5'-делециями и эти репортеры были проанализированы путем их трансфекции в клетки HIT (фиг.4В). Делеция последовательностей от -6500 до -3500 п.о. из конструкции -6500 STF-репортер приводила к снижению активности STF-1-репортера в 4 раза, что дало основание предположить о присутствии дистальной активирующей последовательности в этой области. Дополнительное усечение конструкции STF-1-промотор от -3500 п.о. до -190 п.о. не оказывало значительного влияния на активность репортера в клетках HIT (фиг.4В). Однако делеция последовательностей STF-1-промотора от -19- до -95 п.о. значительно ослабляла репортерную активность в клетках HIT, что свидетельствовало о том, что проксимальный элемент также необходим для функционирования промотора STF-1. Исследование последовательности в области -190 - -95 промотора STF-1 выявило три консенсусных мотива Е-бокса (фиг.2А). Хотя удаление двух тандемных Е-бокса в положении у нуклеотида -177 не приводило к снижению промоторной активности, однако делеция проксимальной последовательности Е-бокса у нуклеотида -104 (-95 STF Luc) приводила к полному прекращению экспрессии STF-1 в клетках HIT.
Пример 10
Проксимальный Е-бокс в промоторе STF-1 распознает USF-содержащий комплекс
Для характеризации вышерасположенных факторов ("вверх по течению"), которые связываются с функциональными элементами в промоторе STF-1, был проведен анализ на защиту от ДНКазы 1 с использованием нуклеарных экстрактов из клеток HIT и HeLa (фиг.5А). В обоих экстрактах наблюдалась преобладающая футпринтинг-активность, границы которой совпадали с функционально важным проксимальным Е-бокс-мотивом (-118/-95). Для дополнительной характеризации белков, которые связываются с критическим Е-бокс-мотивом (-104) в экстрактах HIT по сравнению с экстрактами HeLa, осуществляли анализ на сдвиг подвижности в геле. С использованием двухцепочечноого STF-1-олигонуклеотида, простирающегося от -118 до -95, эти комплексы, обозначенные C1, C2 и С3, наблюдали для обоих нуклеарных экстрактов (фиг.5В, правая панель, дорожки 1 и 4). Образование комплексов Cl, C2 и СЗ ингибировалось 50-кратным избытком немеченного STF-1-Е-бокс-олигонуклеотида-конкурента в реакциях связывания. Мутантный Е-бокс-олигонуклеотид или неспецифические ДНК-конкуренты не оказывали влияния на указанные активности связывания, однако это свидетельствовало о том, что C1, C2 и С3 являются действительно специфичными по отношению к последовательности Е-бокса STF-1 (фиг.5В). При этом не было замечено какого-либо качественного различия в структуре этих комплексов для экстрактов HeLa и HIT (не показано), что дает основание предположить, что Е-бокс-мотив в положении -104 может распознавать факторы, которые экспрессируются на сравнимом уровне в клетках обоих типов.
Полученные ранее данные продемонстрировали, что Е-боксы подобно -118/-95-мотиву STF-1 (CACGTG) преимущественно связываются с белками bHLH-ZIP, такими как myc, max, TFE-3, TFE-B и USF. Было проведено исследование для того, чтобы определить, который из этих белков-кандидатов содержится в комплексах C1, C2 и С3 (26, 27). Способность -118/-95 Е-бокса связываться с белком для противодействия тепловой денатурации (не показано) навела на мысль провести исследование в целях определить, является ли USF (термостабильный фактор, расположенный выше) компонентом C1, C2 и С3 (28). Примечательно, что добавление антисыворотки против USF в реакцию для анализа на сдвиг подвижности в геле приводило к ингибированию образования всех трех комплексов (фиг.5С). Однако антисыворотка против TFE-3 не оказывала воздействия на комплексы C1, C2 и С3, что позволяет предположить, что эти комплексы, по всей вероятности, образованы белками USF. В анализе на сдвиг в геле рекомбинантный USF способствует образованию комплекса "белок-ДНК", который мигрирует в то же самое относительное положение, что и комплекс C2 (не показано). Исследования по защите от ДНКазы и исследование методом футпринтинга на активность рекомбинантного USF-1 совпадали с данными, наблюдаемыми в экстрактах HIT (фиг.5А).
Очевидно, что в большинстве типов клеток экспрессируются две формы USF, обозначаемые USF-1 и USF-2 (18). Для того, чтобы выявить, который из этих белков USF содержится в комплексах C1, C2 и С3, экстракт HIT или HeLa инкубировали либо с антисывороткой, специфичной к USF-1, либо с антисывороткой, специфичной к USF-2 (фиг.5D). Хотя антисыворотка к USF-1 должна давать "сверхсдвиг" для всех трех комплексов, антисыворотка, специфичная к USF-2, лишь ингибировала образование комплексов C1 и С3. Полученные результаты дают основание предположить, что комплексы C1 и С3 соответствуют гетеродимерам USF-1/USF-2, тогда как C2 может содержать гомодимер USF-1.
Для того, чтобы проверить, является ли последовательность Е-бокса (CACGTG) главной для активности промотора STF-1, был сконструирован мутантный STF-1 -олигонуклеотид, который содержал замены в двух парах оснований в Е-боксе (-118/-95). В анализах на сдвиг подвижности в геле, проведенных с использованием нуклеарных экстрактов HIT, этот мутантный Е-бокс-мотив (AACGCG) не мог образовывать комплексы C1, C2 и С3 и не мог конкурировать за связывание USF-1 с Е-бокс-олигонуклеотидом дикого типа (фиг.6А). В соответствии с этим плазмиды с конструкцией полноразмерного (6,5 т.п.о.) STF-1 и усеченного (-190 STF) репортера, содержащие мутантный STF-E-мотив, были примерно в 10 раз менее активными в клетках панкреатических островков, чем их аналоги дикого типа (фиг.6В). Эти результаты свидетельствуют о том, что проксимальный Е-бокс, который связывается с USF, играет действительно решающую роль в активности промотора STF-1.
Таким образом, очевидно, что для островково-специфической экспрессии важное значение имеют два элемента в первых 6500 п.о. 5'-последовательности гена STF-1, а именно дистальный элемент, расположенный между -6500 и -3500, и проксимальный элемент, расположенный в положении -104. Проксимальный элемент -104 состоит из консенсусного Е-бокс-мотива, который распознает расположенный выше активатор USF. Наблюдаемые мультиплетные линии дают основание предположить, что USF имеет важное значение для активности промотора STF-1. Во-первых, антитела, не различающие USF-1 и USF-2, так же как антитела, специфичные к USF-1 и USF-2, распознают комплексы, являющиеся специфическими для STF-1-Е-бокса. Во-вторых, связывающая активность STF-1-Е-бокса в нуклеарных экстрактах HIT обладает свойствами, напоминающими свойства USF: эти комплексы являются термостабильными и обнаруживают период полужизни, аналогичный периоду полужизни рекомбинантного USF-1. И, наконец, точковые мутации, которые ингибируют образование комплексов USF на STF-E-боксе, соответственно ослабляют активность конструкции "STF-1-репортер". Эти результаты позволяют предположить, что комплексы USF действительно имеют важное значение для активности промотора STF-1, а следовательно, и для панкреатического органогенеза.
Помимо USF, другие нуклеарные факторы, особенно mуc и mах, также могут связываться с высокой степенью сродства с мотивом Е-бокса STF-1 (CACGTG). Было показано, что mуc стимулирует транскрипцию целевого гена путем связывания в качестве гетеродимера с mах с Е-бокс-мотивами (32, 33). Поскольку экспрессия гена myc обычно не детектируется в клетках на постмитотической стадии, таких как клетки панкреатических островков, то комплексы myc-max могут не участвовать в регуляции промотора STF-1 в этих клетках. Однако очевидно, что в процессе развития, экспрессия STF-1 концентрируется в пролиферирующих клетках протоков (6), а myc может соответственно стимулировать экспрессию STF-1 в этих условиях. В этой связи, глубокие изменения в экспрессии STF-1, которые наблюдаются в процессе развития поджелудочной железы, могут частично отражать изменения в активности связывания Е-бокса, которые, в конечном счете, ограничивают продуцирование STF-1 в клетках панкреатических островков.
Пример 11
Анализы на сдвиг в геле и анализы на защиту от ДНКазы
Для проведения электрофоретического анализа на сдвиг мобильности в геле двухцепочечные олигонуклеотиды метили α32P-dCTP путем застраивания концов с использованием фрагмента Кленова. Пять микрограммов нуклеарного экстракта инкубировали с 0,5 нг 32Р-меченного олигонуклеотида и 1 мкг неспецифического ДНК-конкурента в течение 30 минут на льду и подвергали электрофорезу на неденатурированном полиакриламидном геле. Для проведения анализа на сверхсдвиг нуклеарные экстракты предварительно инкубировали с антисывороткой в течение периода времени от 30 минут до 1 часа на льду, после чего добавляли меченый зонд. Антитела против HNF-3α, HNF-3β и HNF-3γ были любезно предоставлены S. Dunkan и J. Darnell. Антитела против ВЕТА-2 были великодушно предоставлены M. J.Tsai. Антитела против Е2А поставлялись от Santa Cruz Biochemicals. Анализ на защиту от ДНКазы I осуществляли так, как было описано ранее (37). Рекомбинантный HNF-3α был подарен K.Zaret.
Пример 12
Нозерн-блоттинг
Клетки соматостатиномы/инсулиномы Тu6 культивировали в этаноле или 10-7 дексаметазоне для варьирования их количества со временем. Полную РНК экстрагировали методом с использованием гуанидиния-фенола. Пятнадцать микрограммов полной РНК подвергали электрофорезу на агарозном геле, содержащем формальдегид, и переносили на Zeta-зонд. Неспецифически праймированные ДНК STF-1 и тубулина генерировали с использованием набора для рандомизированного праймирования (Amersham).
Пример 13
Эндодермальные факторы HNF-3β и BETA-2 регулируют экспрессию STF-1 под контролем островково-специфического энхансера
Промоторные конструкции, содержащие 530 п.о.-фрагмент, простирающийся от -6200 до -5670 гена STF-1, полностью подавлялись обработкой дексаметазоном, однако при использовании конструкции с минимальным STF-1-промотором, содержащей сайт распознавания широко распространенного USF-1, такого не наблюдалось (фиг.7а). Та же самая 530 п.о.-область гена STF-1 обнаруживала примерно в 5-10 раз большую активность в клетках HIT-T15 по сравнению с клетками COS-7, что свидетельствовало о том, что этот фрагмент содержит островково-специфическую активность (фиг. 7b). Исследование нуклеотидной последовательности клетко-специфического STF-1-энхансера выявило консенсусные мотивы, характерные для Е-бокс-связывающих белков (от -5,98 до -5,963) и для HNF-3 (от -5,927 до -5,907) (фиг.7с). Этот Е-бокс-мотив, названный В-элементом, является в этой последовательности идентичным мотиву NIR- и FAR-элементов в промоторе крысиного инсулина I и II (34). HNF-3-сайт, названный Н-элементом, также соответствует сайту связывания с консенсусом HNF-3 в 9 из 12 положений.
Для того, чтобы определить, действительно ли В- и Н-элементы распознаются островково-специфическими нуклеарными белками, мы провели анализ на защиту от ДНКазы I с использованием 32Р-меченного фрагмента STF-1-энхансера, простирающегося от -5870 до -6100. Было обнаружено, что нуклеарные экстракты, полученные от клеток HIT Т 15, содержат ДНК-связывающую активность на протяжении В- (Е-бокс-мотив) и Н- (HNF-3-мотив) сайтов (фиг.8а, ср. дорожки 1 и 2). В анализе на защиту от ДНКазы I В-элемент был сравнительно защищен в случае нуклеарных экстрактов от клеток HIT, HeLa и COS-7, тогда как защита Н-элемента наблюдалась лишь в экстрактах от клеток HIT (фиг.8а, ср. дорожки 2 и 4). Известный сайт гиперчувствительности, который прерывает футпринт Н-элемента, также наблюдался в реакциях, содержащих очищенный рекомбинантный белок HNF-3α, что навело нас на мысль сделать предположение, что член семейства регуляторов HNF-3 связывается с Н-элементом STF-1 в клетках Н1Т-Т15 (фиг.8 а, ср. дорожки 2 и 5).
Для дополнительной характеризации нуклеарных факторов мы провели анализ на сдвиг подвижности в геле с использованием 32Р-меченного зонда для Н-элемента STF-1. В реакциях, содержащих HIT- или RIN-нуклеарные экстракты, наблюдался один крупный комплекс с низкой подвижностью, и образование этого комплекса специфически ингибировалось добавлением 100-кратного избытка немеченого ДНК-конкурента дикого типа, но не мутантного ДНК-конкурента Н-элемента (фиг.8b, ср. дорожки 4-5, 9-10, 14-15). В реакциях, содержащих HeLa-нуклеарные экстракты, не наблюдались комплексы "белок-ДНК", что указывало на то, что Н-элемент может узнавать нуклеарные факторы с органиченным типом экспрессии (фиг. 8b, ср. дорожки 1, 6). Присутствие Н-элемент-специфического комплекса в экстрактах гепатомы HepG2 обнаруживалось при той же подвижности, что и комплекса RIN/HIT-T15, однако это позволило предположить, что Н-элемент-связывающий белок может в основном экспрессироваться в клетках эндодермального происхождения (фиг.8b, ср. дорожи 3-5).
Семейство HNF-3 нуклеарных активаторов состоит из трех генов α, β и γ, которые связываются с ДНК посредством в высокой степени консервативного крайнего домена-спирали. Для того, чтобы определить, соответствует ли Н-элемент-связывающая активность в экстрактах HIT активности члена семейства HNF-3, мы провели исследование на сдвиг подвижности в геле с использованием специфической антисыворотки против каждого из членов HNF-3. Хотя каждый из трех белков HNF-3 был обнаружен в нуклеарных экстрактах клеток инсуломы HIT-T15 с помощью Вестерн-блот-анализа (не показано), с использованием того же самого экстракта с Н-элемент-зондом было установлено, что лишь антисыворотка против HNF-3β блокирует образование главного комплекса белок-ДНК (фиг.8с, дорожки 1-4). Идентичные результаты были получены в анализе на сдвиг в геле, проведенном для экстрактов, полученных от первичных культур островковых клеток взрослой крысы (фиг.8с, дорожки 5-8).
В-элемент в STF-1-энхансере содержит консенсусный Е-бокс-мотив, который идентичен Е-бокс-элементам в инсулиновом промоторе. В предшествующей работе было продемонстрировано, что островково-специфический фактор ВЕТА-2 активирует активность инсулинового промотора путем связывания с элементами этого инсулинового промотора, присутствующими в виде гетеролимера с широкораспространенным фактором Е47, что навело нас на мысль провести тест на образование гетеродимера ВЕТА-2/Е47 на В-элементе STF-1. В анализе на сдвиг подвижности в геле, проведенном для HIT-нуклеарных экстрактов, наблюдалось, что 32Р-меченный В-элементный зонд образует четыре специфических комплекса ДНК-белок, которые могли конкурировать при добавлении немеченых дикого типа, но не мутантных, В-элементных олигонуклеотидов (фиг.8d, ср. дорожки 1, 5, 6). Наиболее медленный комплекс мигрировал в то же самое положение, что и рекомбинантный гетеродимерный комплекс Е2А/ВЕТА2 (фиг.8d, ср. дорожки 1 и 7). Хотя несвязанная антисыворотка не влияла на активность связывания с В-элементом (фиг. 8d, ср. дорожку 4), однако антисыворотка к ВЕТА-2 или Е2А специфически ингибировала образование наиболее медленного комплекса (фиг.8d, ср. дорожки 2 и 3), что свидетельствовало о том, что гетеродимер ВЕТА-2/Е47 действительно узнает В-элемент в HIT-нуклеарных экстрактах.
Для того, чтобы оценить важную роль сайтов распознавания HNF-3β и Е2А/ВЕТА-2 при опосредующей активности энхансера STF-1, мы продуцировали точковые мутации в В- и Н-элементах, которые нарушали связывание этих близкородственных факторов in vitro. При тестировании в окружении ("контексте") 530 п.о.-энхансера STF-1-репортерсодержащая плазмида, имеющая точковые мутации либо в В-элементе, либо в Н-элементе, обнаруживала гораздо меньшую активность в клетках HIT-T15, чем конструкция дикого типа (фиг.9а). В противоположность этому, конструкции с мутантными В- и Н-элементами были одинаково активными с -6500 STF-1-репортером дикого типа в клетках COS-7; однако было обнаружено, что эти мутации разрушают транскрипционную активность, которая специфически ассоциируется с островковыми клетками. В соответствии с этим плазмиды, содержащие мутантные В- и Н-элементы в конструкции "STF-1-репортер", были также невосприимчивыми к дексаметазоновой индукции в клетках HIT-T15, что свидетельствовало о том, что этот гормон может специфически препятствовать активности либо Е2А/ВЕТА-2, либо HNF-3β (фиг.9b).
Для того, чтобы определить, ингибирует ли дексаметазон экспрессию STF-1 путем разрушения активности HNF-3β или ВЕ-ТА2/Е47 на дистальном энхансере, были проведены анализы на кратковременную трансфекцию с использованием эффекторных плазмид, содержащих HNF-3β или ВЕТА2 и Е47. Сверхэкспрессия либо HNF-3β (фиг.9b), либо ВЕТА-2/Е47 (не показано) оказывала минимальное влияние на экспрессию конструкции "STF1-репортер" в нестимулированных клетках HIT-T15 (фиг. 9b, ср. блоки 1 и 5). Было обнаружено, что HNF-3β подавляет ингибирующее действие дексаметазона на активность "STF-1-репортер" дикого типа (фиг. 9b, ср. блоки 1, 3, 7), но при этом активаторы, такие как ВЕТА-2/Е47, STF-1 и HNF-4, не "спасают" активность промотора STF-1 при обработке клеток дексаметазоном (не показано). В экспериментах по титрованию с использованием возрастающих количеств эффекторной плазмиды было установлено, что HNF-3β спасает активность конструкции "-6500 STF-1 Luc-репортер" дозозависимым образом (фиг.9с). HNF-3β не потенцирует активность плазмиды с мутантной конструкцией "STF-1-репортер", содержащей мутацию в Н-элементе, однако есть основания предполагать, что супрессорное действие этого активатора реализуется посредством его сайта распознавания в STF-1-энхансере (фиг.9b, ср. блоки 2, 4, 6, 8).








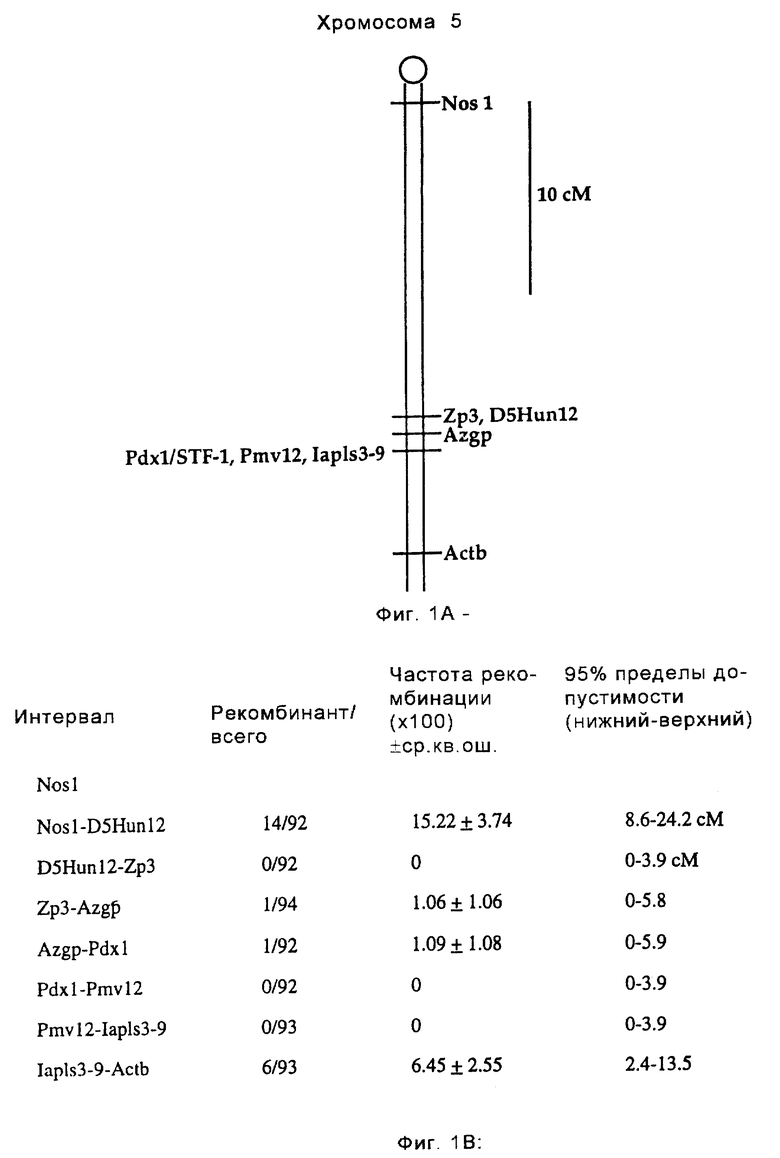
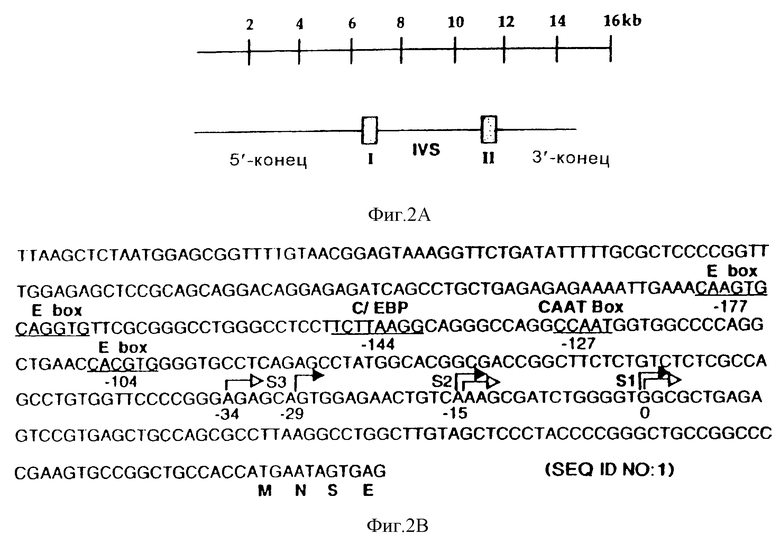
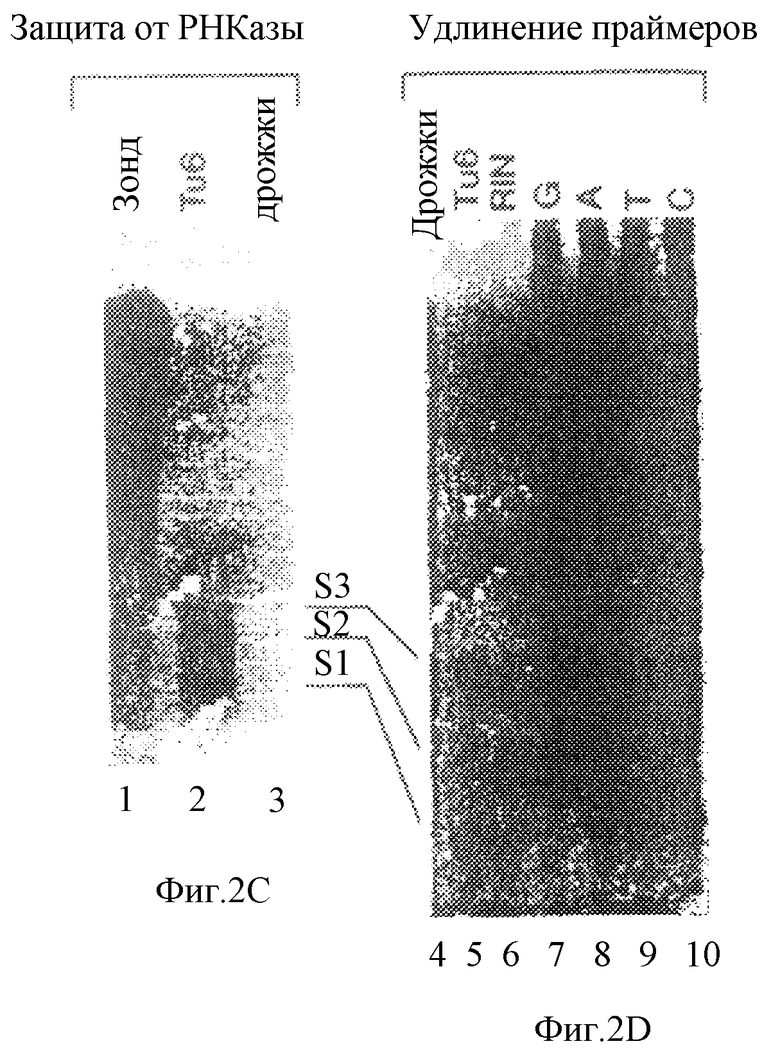
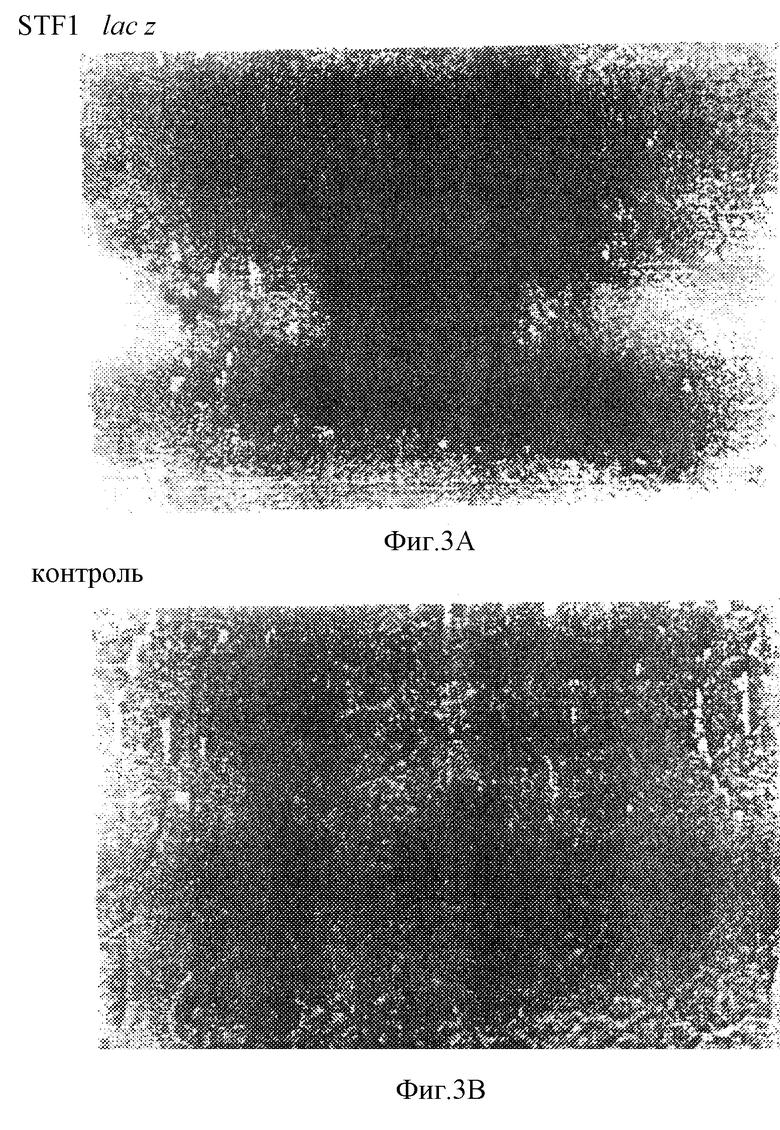
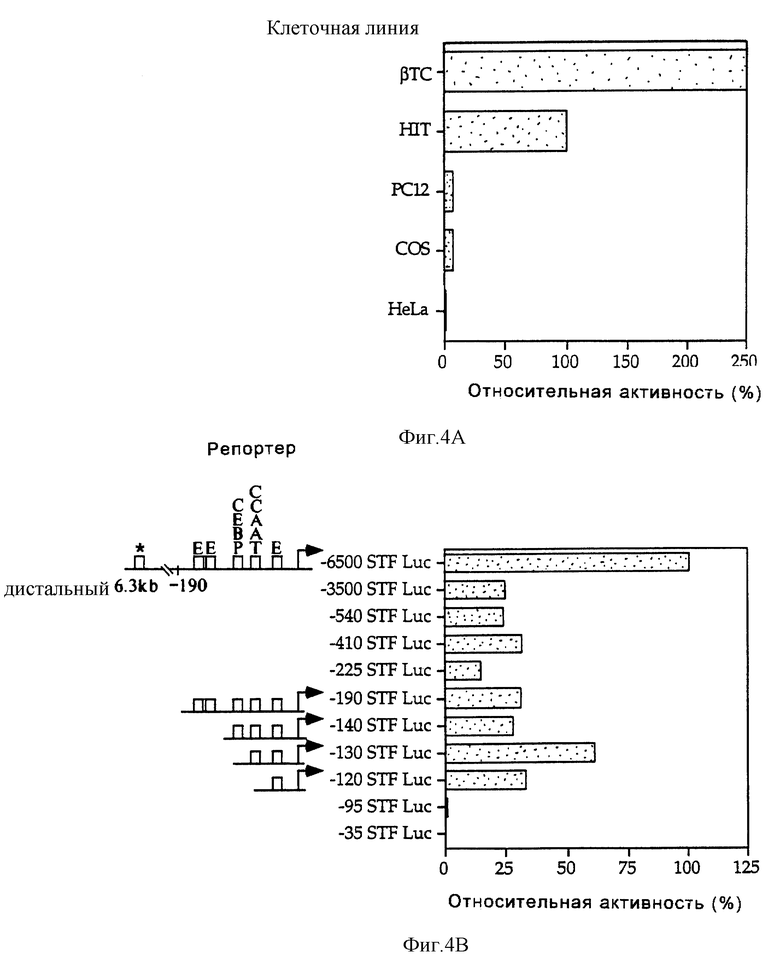
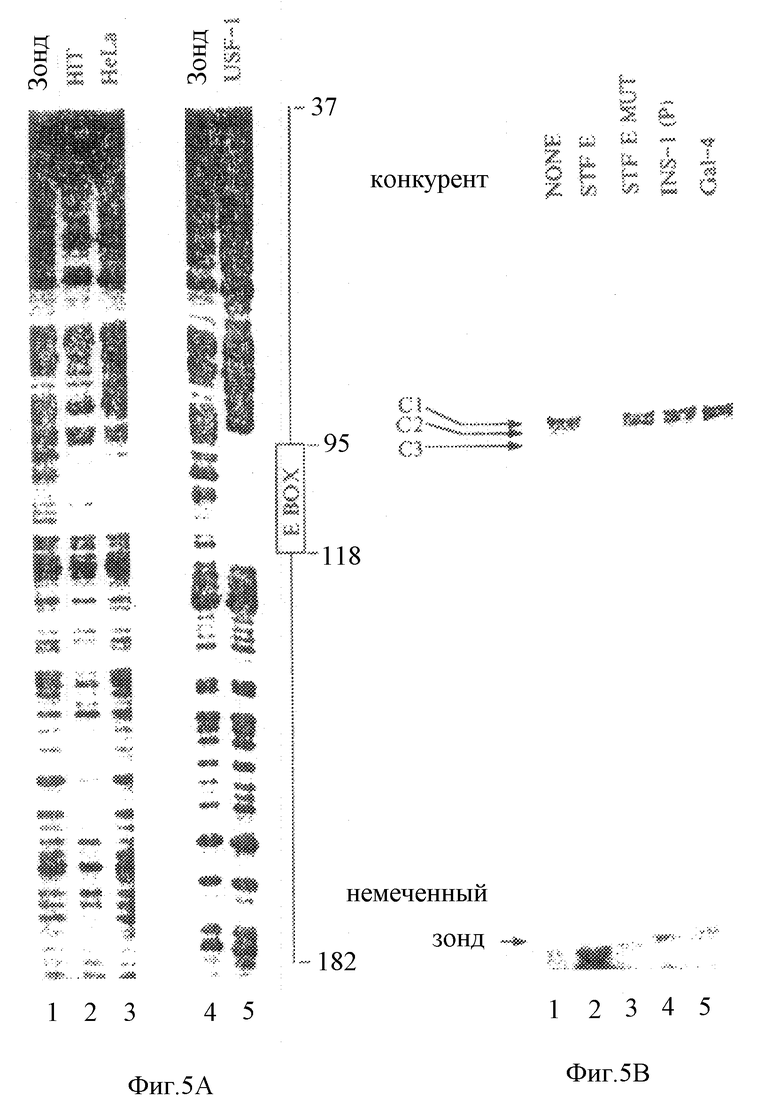
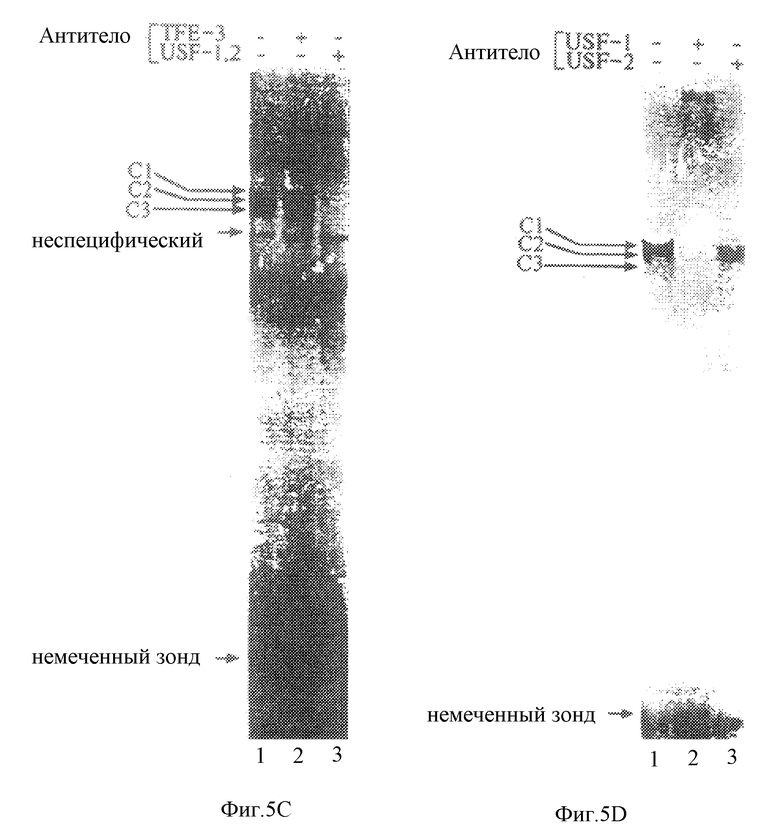

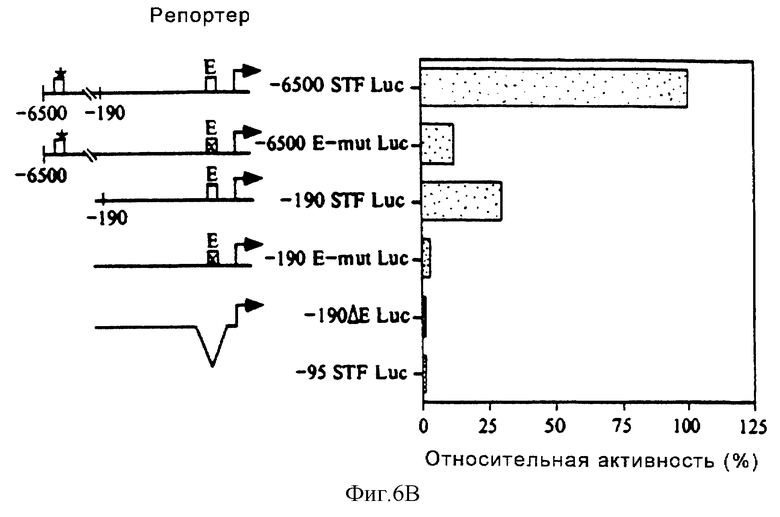
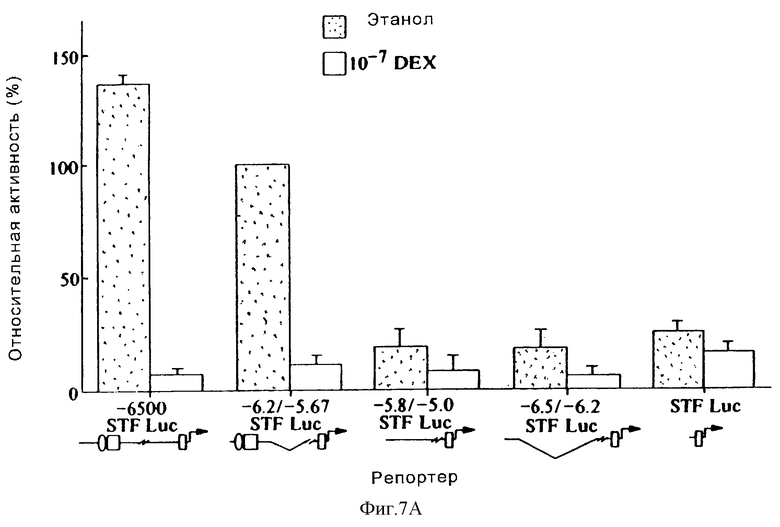
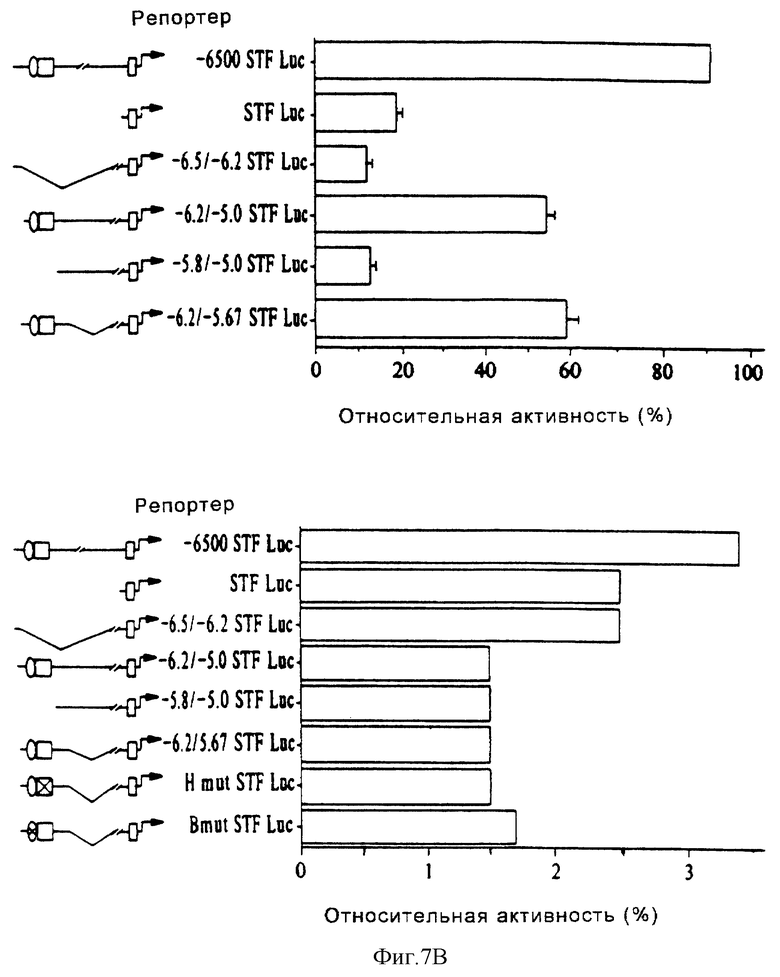

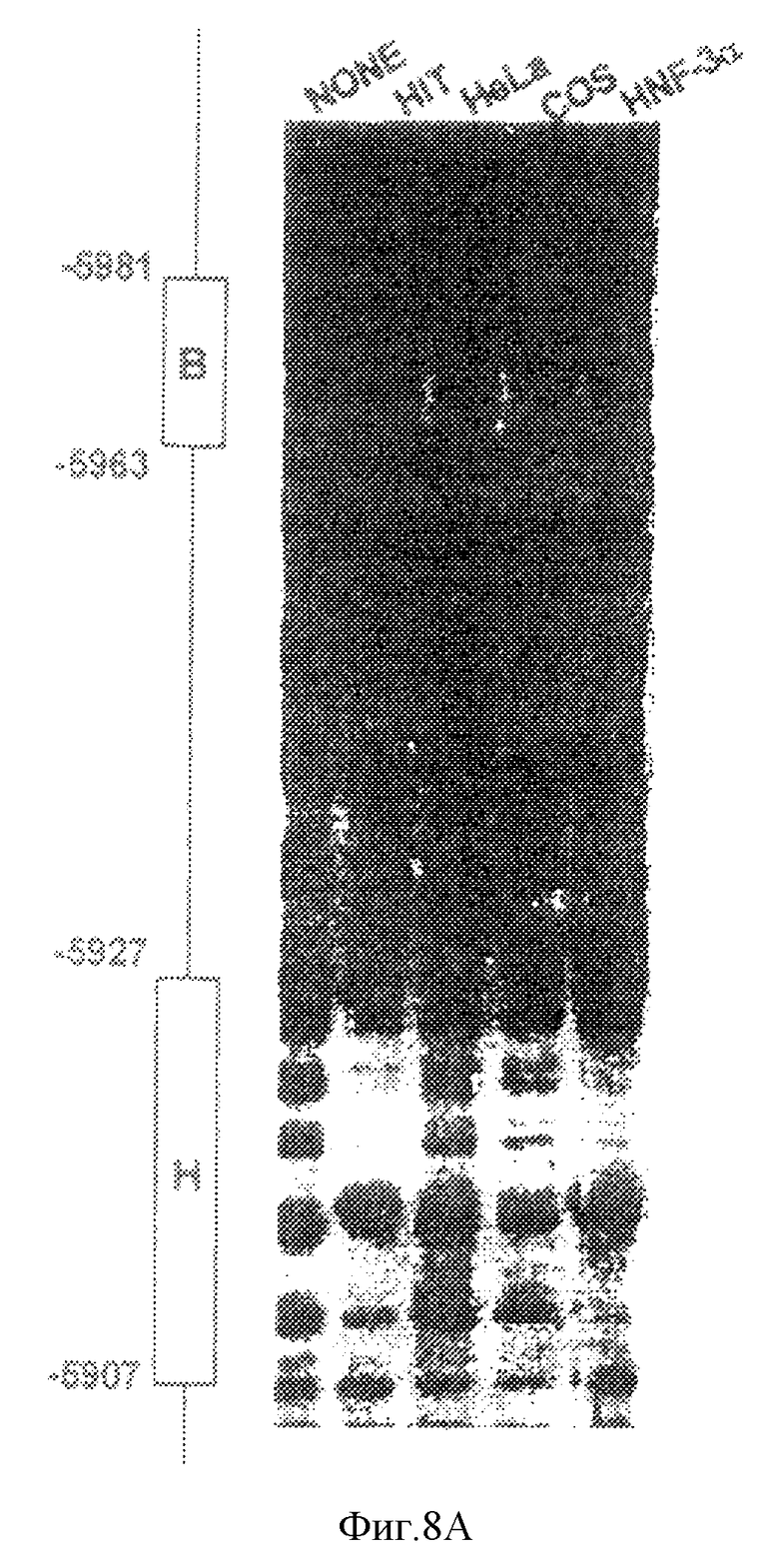
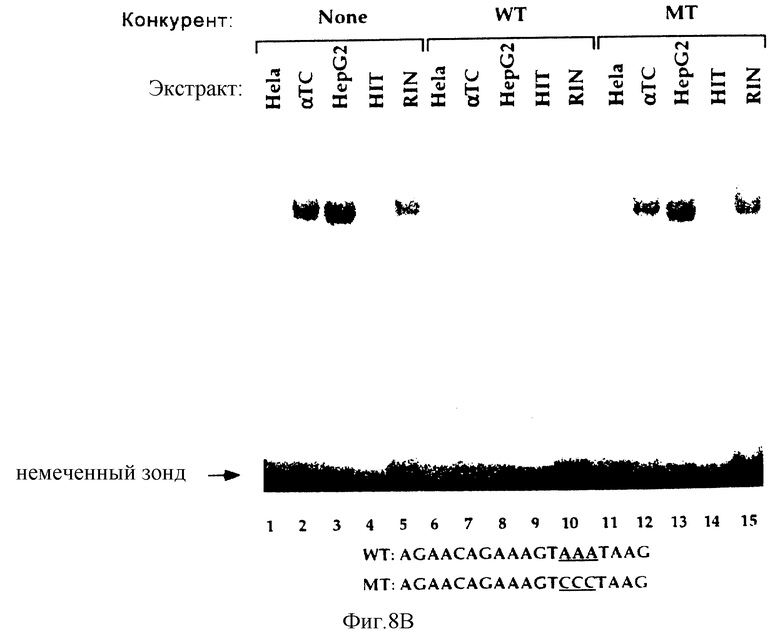
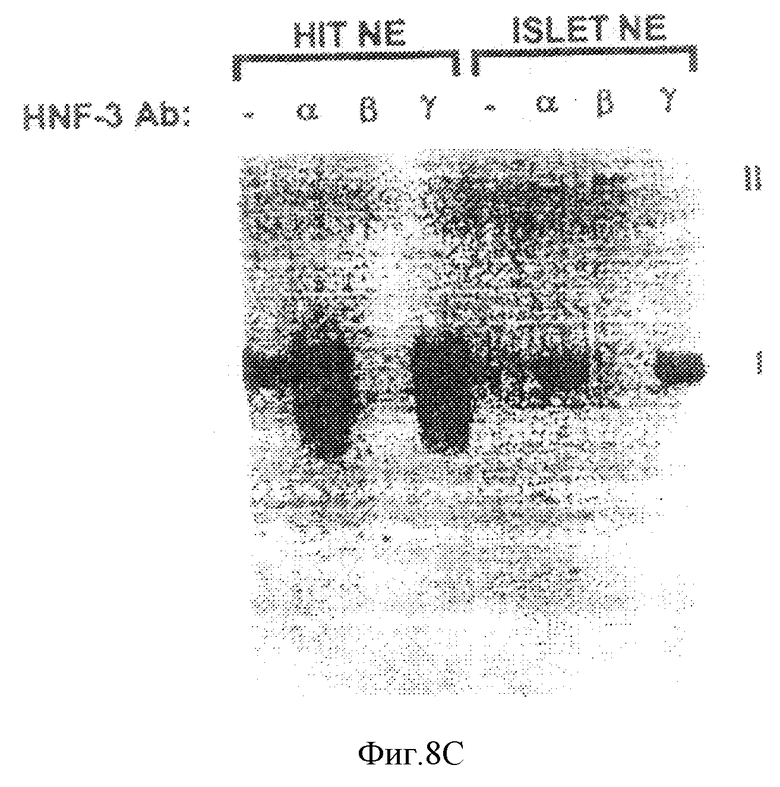
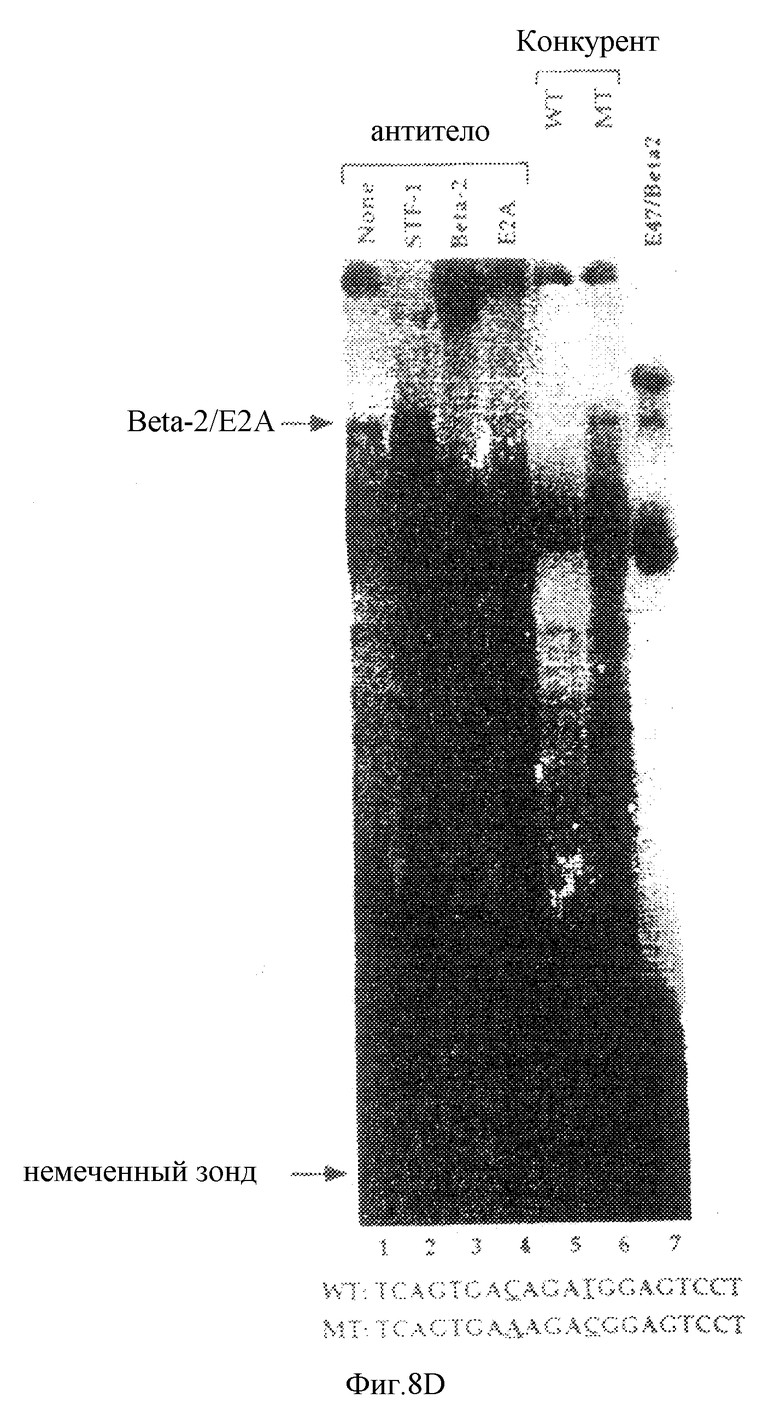
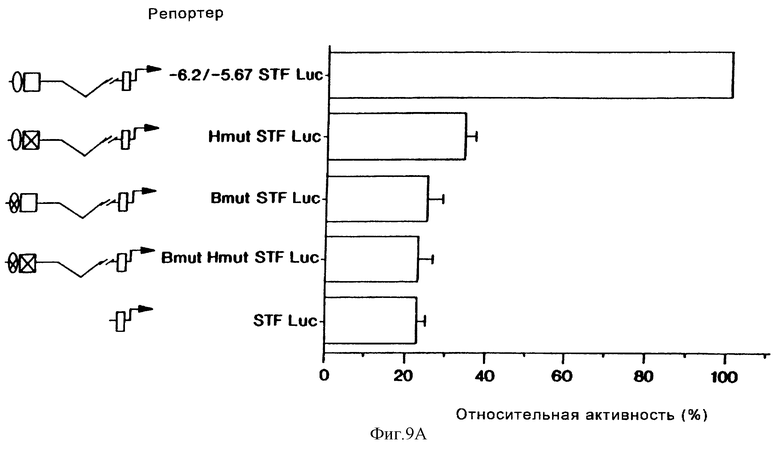
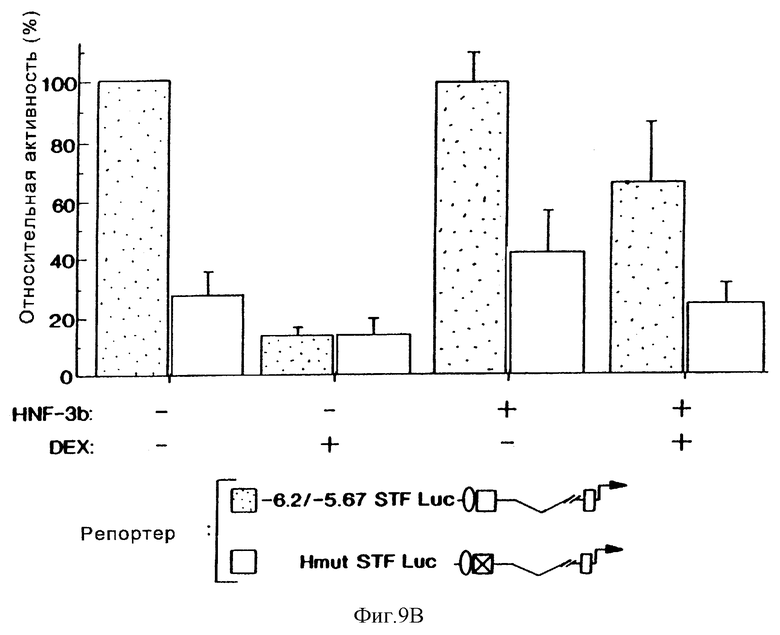
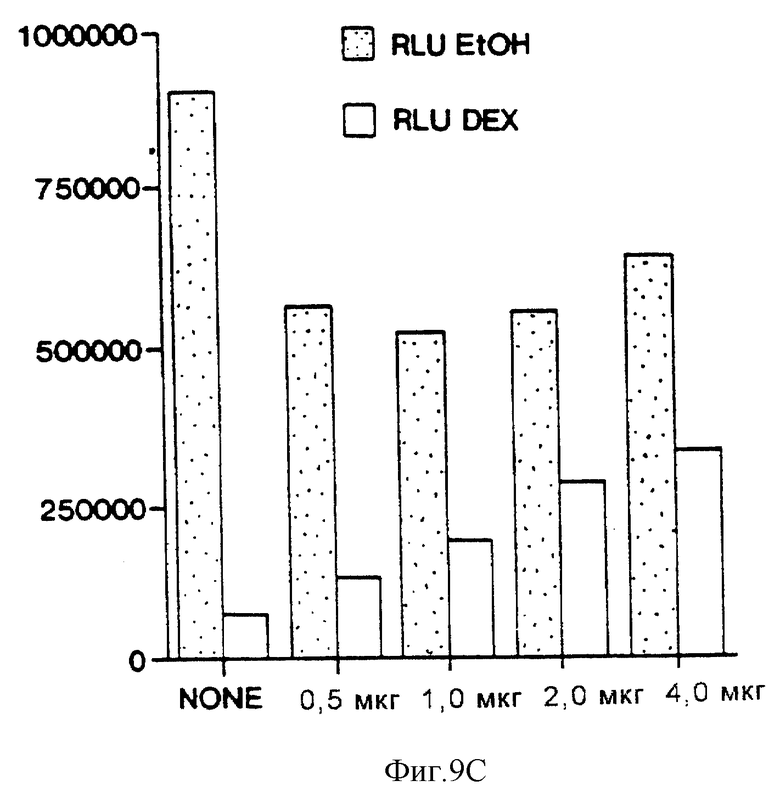
Изобретение относится к области медицинской биотехнологии. Сущность изобретения состоит в способе тестирования соединений, которые могут индуцировать транскрипцию JTF-I. Для этого клетки панкреатических островков, экспрессирующие гибридный ген STF- 1/lacZ, выделяют, а затем оценивают влияние различных соединений на экспрессию ТГ-1 путем добавления к ТГ-1/lacZ - экспрессирующим клеткам представляющего интерес соединения. Затем с помощью колометрического анализа проводят количественную оценку lаcZ-активности в контрольных и обработанных клетках. С использованием этого способа может быть скринировано большое число соединений и STР-1-индуцирующие соединения могут быть легко идентифицированы. Другой аспект изобретения - способ использования промотора STF-I для мечения инсулинпродуцирующих клеток панкреатических островков in vivo. В этом способе в качестве индикатора используют белок с флуоресценцией в зеленой области спектра. Введение свиньям трансгена "STF-I - белок с зеленой флуоресценцией" дает возможность быстро и эффективно выделять инсулинпродуцирующие клетки из поджелудочной железы. Технический результат - расширение арсенала средств для регулирования нейроэндокринной системы. 2 с. и 7 з.п. ф-лы, 9 ил.
| US 4693969, 15.09.1987. |
Авторы
Даты
2002-06-20—Публикация
1997-01-22—Подача