Изобретение относится, в общем, к областям биохимической эндокринологии, молекулярной биологии и химии белка. В частности данное изобретение относится к скринингу-анализу соединений, стимулирующих продуцирование соматостатина и инсулина.
Гомеостаз глюкозы требует согласованных усилий многочисленных эндокринных систем. Однако, как полагают, панкреатические островки являются основным "глюкозным сенсором" у млекопитающих. Островки содержат четыре популяции клеток, которые характеризуются примансулином, глюкагоном, соматостатином или панкреатическим полипептидом. Среди клеток превалируют инсулинпродуцирующие β-клетки. Секреция и продуцирование инсулина стимулируются при повышении глюкозы в сыворотке, событие, которое вызывает последующее поглощение глюкозы в некоторых тканях. Следовательно, дисфункция или разрушение β-клеток приводит к повышению уровня сывороточной глюкозы, в конечном счете к развитию диабета.
Анализ генетической связи указывает на то, что наследственные факторы оказывают сильное влияние на чувствительность к восприимчивости диабетического состояния. Например, по крайней мере 18 генетических локусов имеют некоторую степень связи с инсулинзависимым сахарным диабетом (IDDM). Один чувствительный к болезни локус, называемый IDDM2, заключает в себе ген человеческого инсулина, и он ассоциируется с измененной регуляцией транскрипции функции промотора инсулина. Следовательно, нарушение процессов, которые регулируют экспрессию гена инсулина, могут быть отчасти причиной диабетогенеза (возникновения диабета). В соответствии с этой гипотезой ослабленная функция β-клеток представляет общий признак диабета.
Как полагают, инсулиннезависимый сахарный диабет (NIDDM) является результатом как внешнего, так и сложного генетического воздействия. Интересно, что аллельные варианты инсулинового локуса как такового ассоциируются с этим заболеванием. Эти варианты, по-видимому, содержат нормальный инсулиновый ген, но демонстрируют измененные свойства в отношении регуляции транскрипции.
Оценки указывают на то, что не менее 20 миллионов американцев могут страдать от диабета Тип II. Для развития этого заболевания, по-видимому, требуются как факторы окружающей среды, так и некоторые все еще в значительной степени неидентифицированные гены, чувствительные к диабету, которые могут вносить вклад в периферическую инсулинрезистентность при диабете Тип II, при котором ткани не в состоянии утилизировать глюкозу в ответ на инсулиновый сигнал. Альтернативно, генетические факторы могут быть причиной пониженной чувствительности к глюкозе инсулинпродуцирующих панкреатических β-клеток у этих индивидуумов. Конечным результатом обоих этих физиологических состояний является заметная гипергликемия, которая представляет первичный основной признак диабета.
Контроль транскрипции инсулинового гена осуществляется при помощи короткой области фланкирующей ДНК, которая взаимодействует с клеточно-специфичными и глюкозочувствительными сигнальными молекулами. Точная природа этой регуляторной организации остается плохо понимаемой, хотя признано, что основные спираль-петля-спираль (bHLH) и гомеодоменсодержащие факторы являются существенными компонентами транскрипционного механизма, который регулирует специфическую экспрессию инсулина β-клетки. Островок-специфический основной спираль-петля-спираль комплекс взаимодействует с проксимальным Е-bох, который называют Nir, IEB1 или ICE; этот элемент присутствует в гене крысиного инсулина I, но только один раз в генах крысиного инсулина II и человеческого инсулина.
Транзиентные анализы в инсулинпродуцирующих клеточных линиях подтверждают, что Е-bох-связывающие факторы действуют совместно с β-клетка-специфичными белками, которые связывают соседнюю АТ-обогащенную последовательность, называемую FLAT и несущую признаки последовательности узнавания гомеодомена. FLAT связывающие факторы включают Isl-1, lmx-1, cdx-3 и STF-1. Кроме того, последний из этих факторов соответствует основной активности связывания у эволюционно консервативной АТ-обогащенной последовательности, называемой Р-элементом. Isl-1 связывает FLAT элемент слабо и, по-видимому, не присутствует во FLAT-связывающих комплексах, детектируемых в экстрактах из инсулинпродуцирующих клеток. Имеющиеся данные подтверждают более важную роль для Isl-1 в развитии нервной системы. Факторы гомеодомена lmx-1 и cdx-3 имеют интересные трансактивационные свойства в отношении функции инсулинового промотора в гетерологических клетках, но их клеточное распределение и FLAT-связывающая способность внутри β-клетки остаются невыясненными. Кроме того, имеется мало данных, которые касаются непосредственно функции этих факторов в линиях β-клеток.
Внутри группы факторов с инсулиновой промотор-связывающей активностью STF-1, возможно, является наиболее обещающим кандидатом в добросовестные (bona fide) регуляторы функции инсулинового промотора. У мышей STF-1 впервые определяется на 8,5 день брионального развития в ядрах примордиальных клеток, которые со временем формируют поджелудочную железу, незадолго до самой ранней детектируемой экспрессии инсулина в этой области. На протяжении последующего развития поджелудочной железы STF-1 и инсулин в основном экспрессируются совместно. Кроме того, в экстрактах из инсулинпродуцирующих клеточных линий STF-1, по-видимому, является компонентом (представляет компонент) эндогенной ДНК-связывающей активности как у FLAT, так и Р-элементов в инсулиновом промоторе. STF-1 также строго действует совместно с Е-bох-связывающим фактором Раn-1, как можно ожидать от FLAT-связывающего фактора. Однако исследования связывания ДНК указывают, что другие, неизвестные, факторы из экстрактов β-клеток также вносят большой вклад в детектируемую FLAT-связывающую активность. Остается неясным, требует ли FLAT-опосредованная инсулинпромотирующая активность всех, или только субпопуляции этих определенных видов.
Взрослая поджелудочная железа состоит как из эндокринного, так и экзокринного компонентов, которые, как полагают, возникают из обычных клеток-предшественников в развивающейся кишке (в первичной кишечной трубке). Такие клетки-предшественники экспрессируют гомеодоменный белок, называемый STF-1 [14, 20] или IPF-1 [19] , IDX [17] или XlNbox 8 [22] , важность которого иллюстрируется с помощью "нокаут" исследований, где направленное разрушение STF-1 гена ведет к врожденному отсутствию поджелудочной железы [10] . Хотя STF-1 сначала экспрессируется как в экзокринных клетках, так и в эндокринных клетках развивающейся поджелудочной железы, продуцирование STF-1 прогрессивно ограничивается островковыми клетками [7] , продуцирующими инсулин и соматостатин. В этих клетках действие STF-1, по-видимому, является важным для поддержания высокого уровня экспрессии как гена соматостатина, так и инсулинового гена [14, 17, 19, 20, 22] .
STF-1 распознает два хорошо определенных островковых специфических элемента на инсулиновом промоторе, называемых FLAT и Р. При связывании с этими сайтами STF-1 стимулирует транскрипцию инсулина согласно с Е47, спираль-петля-спираль белок, который распознает два Е-bох элемента, называемых Far и Nir. Аналогично, STF-1 регулирует экспрессию соматостатина в островковых клетках посредством двух островковых специфичных элементов, называемых TSEI и TSEII [14, 17] .
Обнаружено, что помимо стимуляции транскрипции некоторых генов гомеодоменные белки, такие как STF-1, играют важную роль в развитии путем установления клеточной или сегментной идентичности. В противоположность своим специфическим и отличным действиям in vivo, большинство гомеодоменных белков демонстрируют низкую и частично совпадающую специфичность связывания ДНК in vitro. Однако последние исследования подразумевают вовлечение некоторых белковых ко-факторов в качестве детерминант специфичности связывания ДНК гомеодоменом in vitro [8, 13] . У Drosophila, например, экстрадентикль (exstradenticle) (exd), как было показано, модулирует активность гомеотических белков без изменений их картины экспрессии [21, 24] . Скорее, экстрадентикль, по-видимому, промотирует отбор гена-мишени путем повышения специфичности некоторых гомеодоменных белков к ДНК связыванию [2, 25] . В самом деле, экстрадентикль высоко консервативен у позвоночных, имея сходство экстенсивной последовательности (71%) с человеческим прото-онкогеном Pbxl [23] .
Согласно предшествующему уровню техники имеется дефицит в эффективных средствах повышения связывания гомеодоменных белков, таких как STF-1. Данное изобретение выполняет эту длительно существующую потребность и необходимость в данной области.
Было показано, что ряд гомеодоменных белков регулирует клеточное развитие путем стимулирования транскрипции специфических генов-мишеней. Однако в противоположность их различным активностям in vivo большинство гомеодоменных белков беспорядочно связывается с потенциальными сайтами-мишенями in vitro, подтверждая тем самым вовлечение ко-факторов, которые определяют выбор сайта-мишени. Показано, что один такой ко-фактор, называемый экстрадентиклем (exd), оказывает влияние на сегментальный морфогенез у Дрозофил (Drosophila) путем кооперативного связывания с некоторыми гомеодоменными белками, торпедируя регуляционные элементы. Данное изобретение демонстрирует, что STF-1, орфонный гомеодоменный белок, необходимый для панкреатического развития у млекопитающих, стимулирует транскрипцию панкреотического островкового гормонального гена, кодирующего соматостатин, путем кооперативного связывания с ДНК с помощью Рbх, гомолога экстрадентикля млекопитающего. Кооперативное связывание с Рbх требует пентапептидного мотива (FPWMK), который хорошо сохраняется среди большой субпопуляции гомеодоменных белков. FPWMK мотив не достаточен для того, чтобы придать Рbх-кооперативность другим гомеодоменным белкам, однако N-концевое плечо STF-1 гомеодомена также существенно. Когда кооперативное связывание с Pbх происходит только на субпопуляции потенциальных сайтов-мишеней STF-1, данное изобретение показывает, что Рbх может определять выбор гена-мишени в развивающейся поджелудочной железе, образуя гетеродимерные комплексы с STF-1. Действительно, данное изобретение демонстрирует, что TSEII элемент соматостатинового промотора распознает гетеромерный комплекс, состоящий из STF-1 и Рbх, в панкреатических островковых клетках. Таким образом, специфичность STF-1 действия в поджелудочной железе может частично диктоваться способностью потенциальных сайтов промотора мишени распознавать STF-1 РЬх гетеромерный комплекс.
Таким образом, в одном варианте воплощения данного изобретения обеспечивается разработка анализа ДНК связывания, чтобы определить соединения, эффективные для промотирования связывания STF-1 с STF-1 связывающим сайтом, включающего стадии: комбинирования меченной на конце двутяжевой ДНК, имеющей STF-1 связывающий сайт, с STF-1 в качестве контроля в первом контейнере; комбинирования меченной на конце двутяжевой ДНК, имеющей STF-1 связывающий сайт, с STF-1 и испытываемым соединением в качестве пробы во втором контейнере; инкубирования указанных первого и второго контейнеров; помещения (нагружения) указанного контроля и указанной пробы на электрофорезный гель; приложения электрического тока к указанному электрофорезному гелю с тем, чтобы заставить указанный контроль и указанную пробу мигрировать внутри указанного геля; детектирования указанного контроля и указанной пробы; сравнения миграции указанного контроля с миграцией указанной пробы, причем, если указанная проба более медленно мигрирует, чем указанный контроль, указанное испытываемое соединение эффективно в промотировании STF-1 связывания с указанным STF-1 связывающим сайтом.
В другом варианте воплощения данного изобретения обеспечивается анализ ДНК связывания, чтобы определить соединения, эффективные для промотирования связывания STF-1 с STF-1 связывающим сайтом, включающий стадии: трансфекции первой экспрессионной плазмиды, которая конститутивно экспрессирует STF-1, и второй экспрессионной плазмиды, которая экспрессирует ген-репортер под контролем STF-1 связывающего сайта в соответствующую клеточную линию; трансфекции третьей плазмиды в указанную трансфецированную соответствующую клеточную линию, причем указанная третья экспрессионная плазмида экспрессирует испытываемое (trest) соединение; измерения величины транскрипции указанного гена-репортера, где, если указанная транскрипция имеет место, указанное испытываемое соединение эффективно для промотирования связывания STF-1 с указанным STF-1 связывающим сайтом.
Другие и дополнительные аспекты, признаки и преимущества данного изобретения становятся очевидными из нижеследующего описания предпочтительных вариантов воплощения изобретения, представленных с целью раскрытия существа изобретения.
Таким образом, чтобы проблема (предмет), где вышеперечисленные признаки, преимущества и цели данного изобретения можно было понять детально, более конкретные описания изобретения, кратко суммированные выше, могут быть представлены путем отсылки к некоторым вариантам воплощения изобретения, которые иллюстрируются прилагаемыми фигурами. Эти фигуры составляют часть описания. Следует иметь в виду, однако, что прилагаемые фигуры иллюстрируют предпочтительные варианты данного изобретения, и поэтому их не следует рассматривать как ограничивающие его объем.
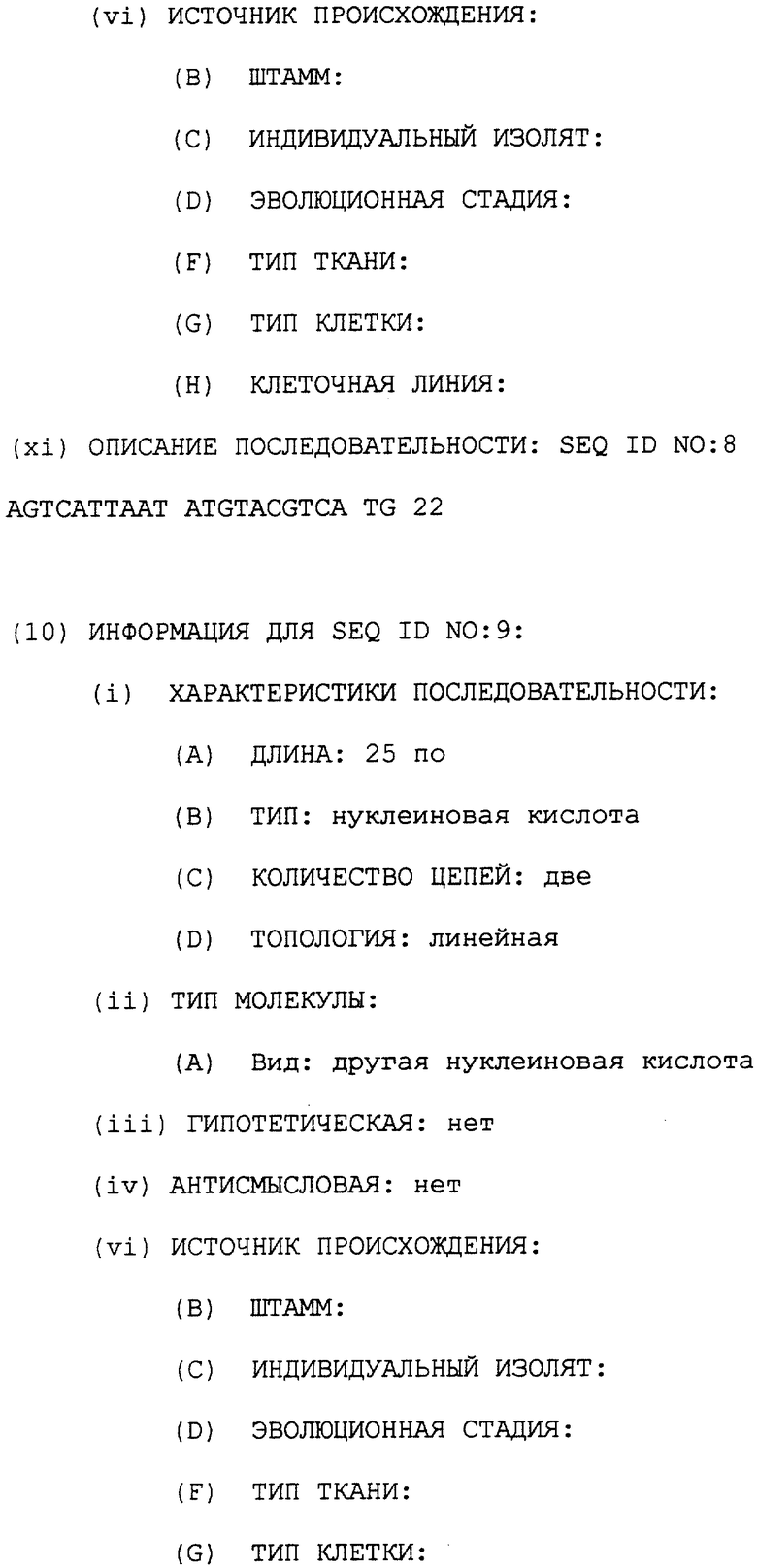
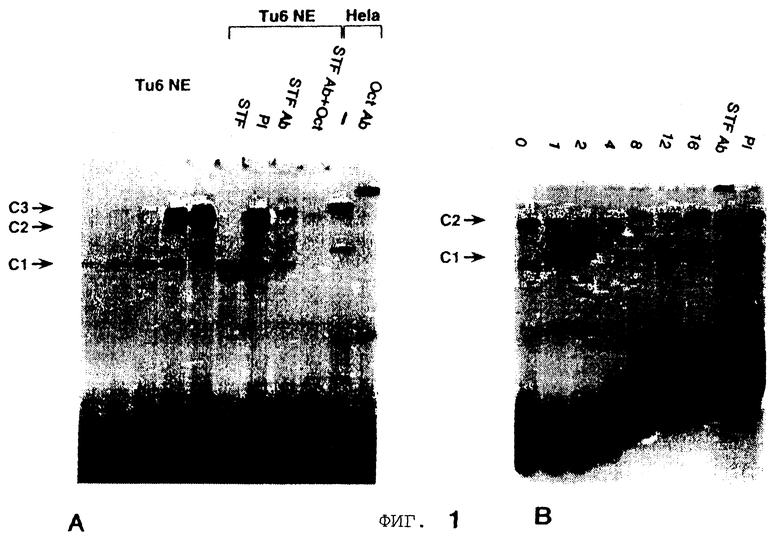
Фиг. 1 демонстрирует, что панкреатический гомеобокс фактор STF-1 кооперативно связывается с клеточным специфическим регуляторным элементом в соматостатиновом промоторе с повсеместно распространенным в клетках ядерным фактором. Фигура 1А демонстрирует исследование сдвига подвижности в геле неочищенных ядерных экстрактов из Тu-6 клеток панкреатического островка при использовании двутяжевого олигонуклеотида соматостатина TSEII, расположенного от -303 до -281. Указаны Cl, C2 и С3 белковые ДНК комплексы. Жирная стрелка указывает возрастающее количество ядерного экстракта. STF, только рекомбинантный STF-1 белок; Tu-6 NE и Hela NE, ядерный экстракт из Tu-6 и Hela клеток соответственно. PI, пре-иммунная антисыворотка. STF-1, Ab, STF-1 антисыворотка, полученная против С-концевой части STF-1 белка. STF-1 Ab+ Oct олиго, STF-1 антисыворотка плюс Oct 1 связывающий сайт (Sph1 мотив) SV40. Oct. Ab, моноклональная Oct 1 антисыворотка (дар. W. Негг), полученная против человеческого Oct l белка. Фигура 1В показывает полный анализ комплексов, образованных зондом TSEII соматостатина и Tu-6 ядерным экстрактом (предварительно инкубированным с немеченым Oct 1 олиго, чтобы анализировать только С1 и С2 комплекс), как описано ниже. Комплексы С1 и С2 обозначены. Время (в минутах) после добавления 1000-кратного избытка немеченой ДНК конкурента TSEII указано над каждой линией. Р1, пре-иммунная сыворотка; STF-1 Ab, STF-1 антисыворотка, добавленная в анализе сдвига в геле. Фигура 1С демонстрирует анализ сдвига подвижности в геле рекомбинантного STF-1 белка при использовании олиго TSE II соматостатина в качестве зонда. STF-1 связывающую активность испытывали в отсутствии (-) или присутствии (+) гетерологичного ядерного экстракта из Jurkat клеток, которые не содержат определяемых уровней STF-1 белка с помощью Вестерн-блот анализа. Жирные стрелки указывают возрастающее количество рекомбинантного STF-1 белка. Комплексы С1 и С2 обозначены. На Фигуре ID представлен полный анализ комплексов С1 и С2 в реконструированных экстрактах, содержащих рекомбинантный STF-1 плюс Jurkat ядерный экстракт. Точки времени (в минутах) после добавления немеченого TSEII конкурента (1000-кратный избыток) указаны над каждой дорожкой.
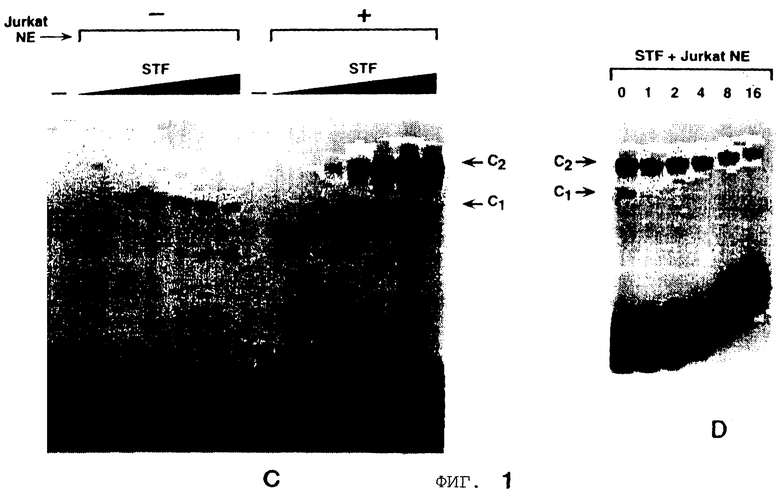
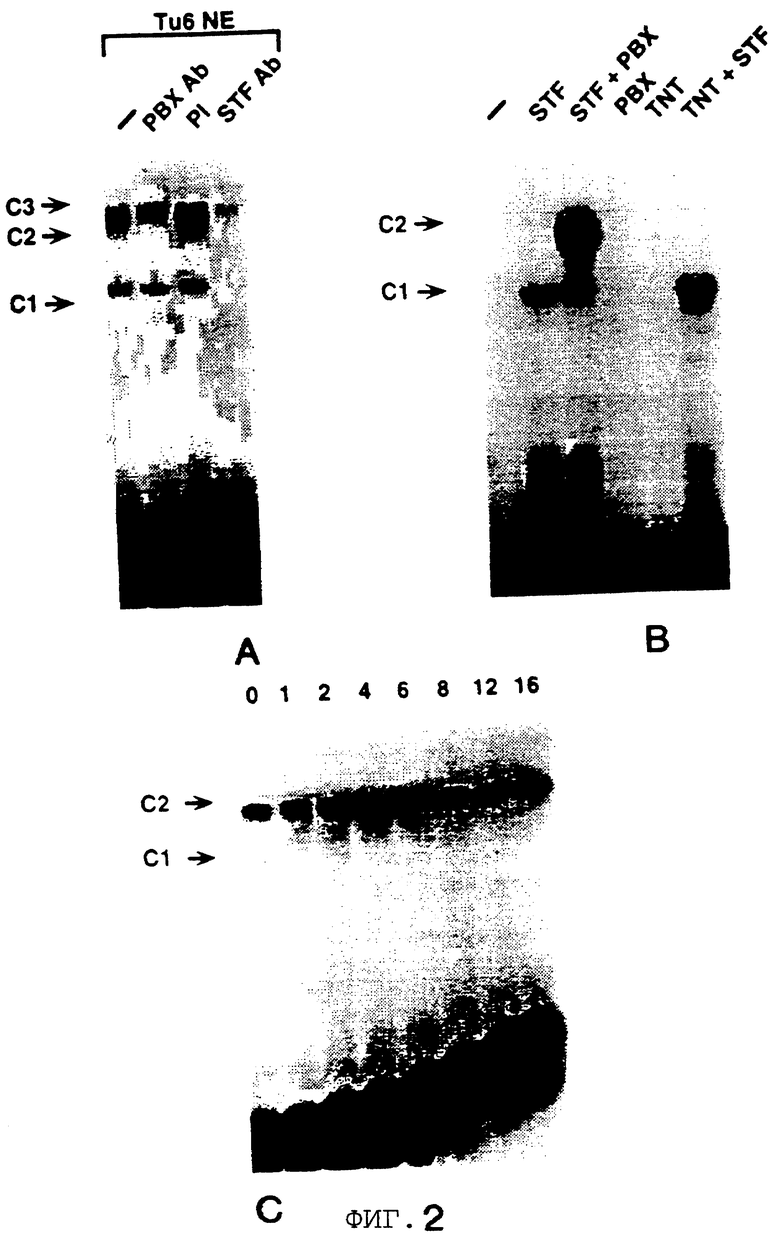
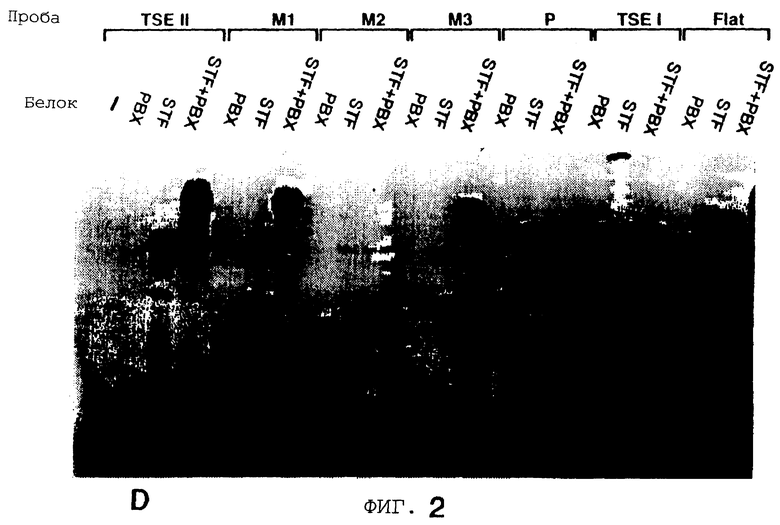
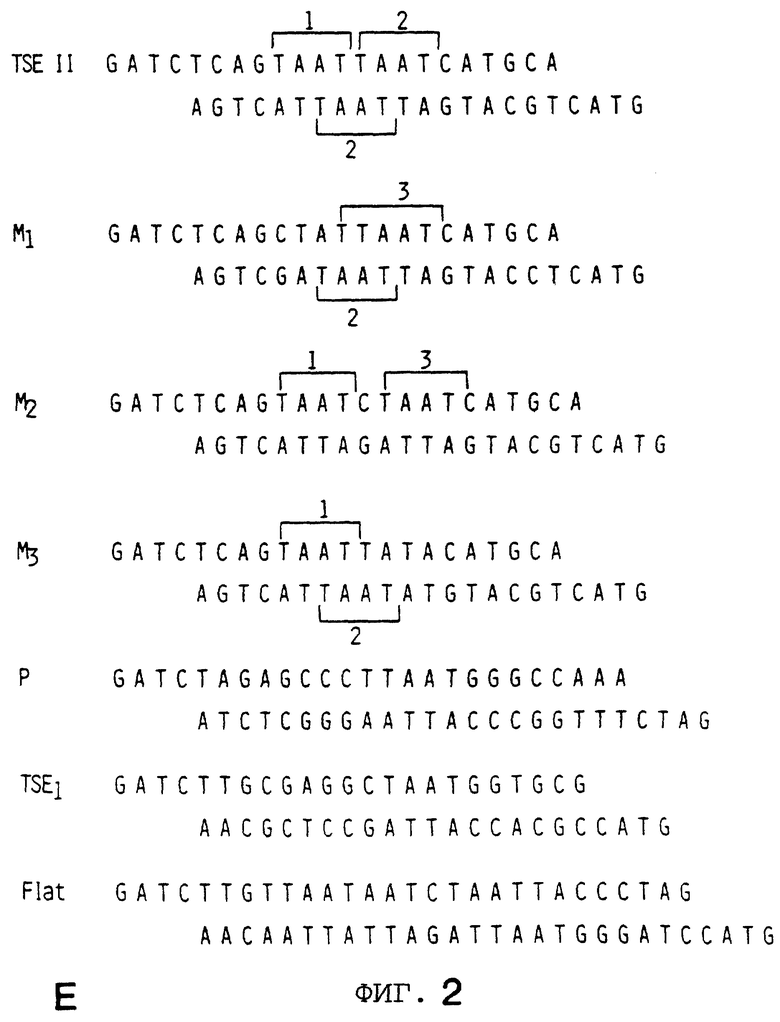
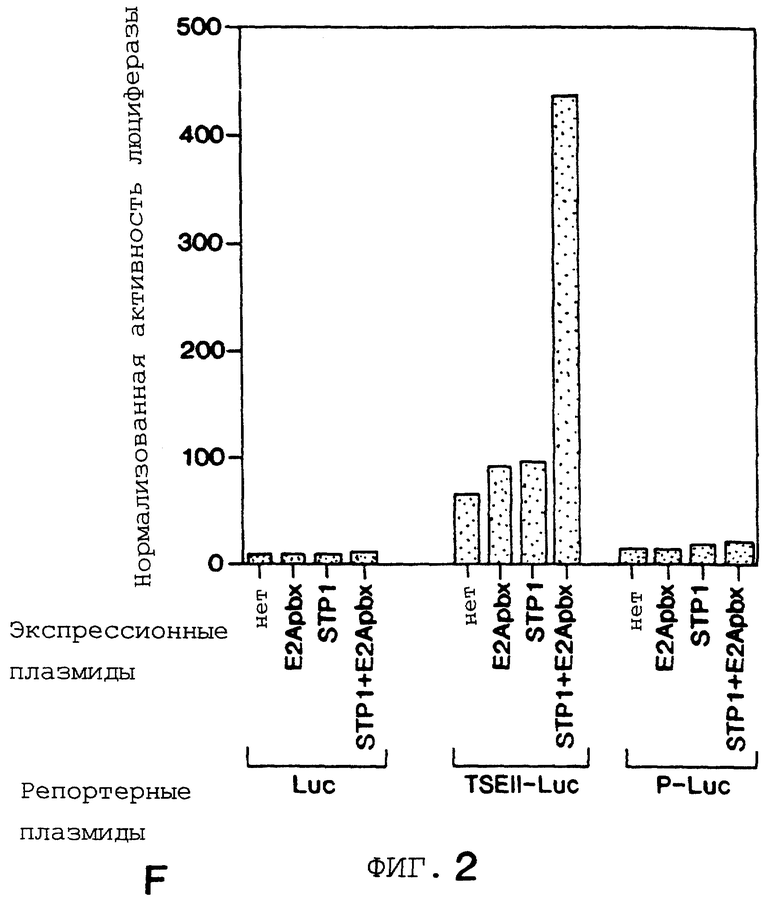
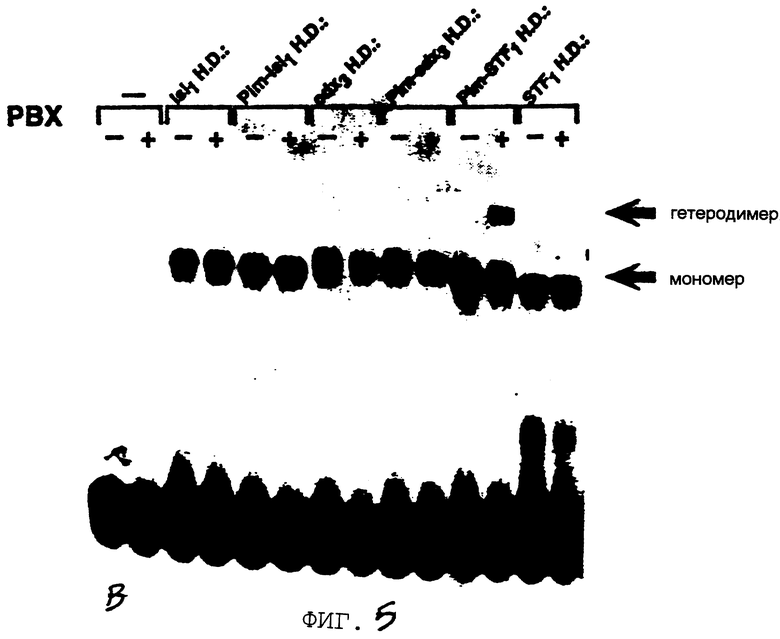
Фигура 2 показывает, что повсеместно распространенный гомеобокс белка Рbх образует гетеромерный комплекс с STF-1 на элементе TSEII саматостатина. На Фигуре 2А представлен анализ сдвига подвижности в геле Tu6 NE при использовании TSE II олигонуклеотида в качестве зонда. Комплексы C1, C2 и С3 указаны. РВХ Аb, Рbх антисыворотка включенные в реакцию. Р1, пре-иммунная сыворотка. STF-1 Ab, STF-1 антисыворотка. Фигура 2В показывает действие in-vitro транслированного РЬх белка (РВХ) на STF-1 связывающую активность. Анализ сдвига подвижности в геле с использованием TSE II олигонуклеотида плюс STF-1 и/или Рbх, указанными над каждой дорожкой. TNT, контрольный лизат. Фигура 2С показывает, что РВХ стабилизирует связывание STF-1 с TSEII комплексом. Полный анализ STF-1 и STF-1 Рbх комплексов с использованием олигонуклеотида TSE II соматостатина в качестве зонда. Указано время (в минутах) после добавления избытка немеченого TSE II олиго. Соответственно указаны комплексы C1 и C2, соответствующие STF-1 мономеру и STF-1/PBX гетеродимеру. На Фигуре 2D представлен анализ образования STF-1/PBX гетеродимера на последовательностях промоторов соматостатина и инсулина. TSE II, олигонуклеотид TSE II дикого типа. Ml, M2 и М3; мутантные TSE II олигонуклеотиды, в которых ТААТ мотивы мутированы, как показано на Фигурах 3D и 3Е. Р и FLAT, элементы промотора инсулина I, которые распознают STF-1 с высоким сродством. TSEI, элемент промотора соматостатина, который связывает STF-1. РВХ, in vitro транслированный РВХ белок, добавленный в реакции связывания; STF, рекомбинантный STF-1 белок полной длины. На Фигуре 2Е представлены последовательности олигонуклеотида дикого типа и мутантного олигонуклеотида, используемые в анализах сдвига в геле на Фигуре 3В. Скобки указывают консенсусные мотивы ТААТ, которые являлись мишенью для мутагенеза. Фигура 2F показывает, что STF-1 и Рbх действуют кооперативно на субпопуляцию сайтов промотора. Анализ неустойчивой трансфекции GC клеток с использованием STF-1 и Е2А-Рbх эффекторных плазмид, указанных ниже каждого отрезка. Столбик показывает активность люциферазы, полученную из рецепторной констукции, содержащей только промотор (Luc) минимального роста (GH), с двумя копиями элемента TSEII соматостатина против хода транскрипции GH промотора (TSEII-Luc), или двумя копиями инсулинового Р-элемента (P-Luc). Активности нормализованы к совместно-трансфецированной RSV-CAT контрольной плазмиде.
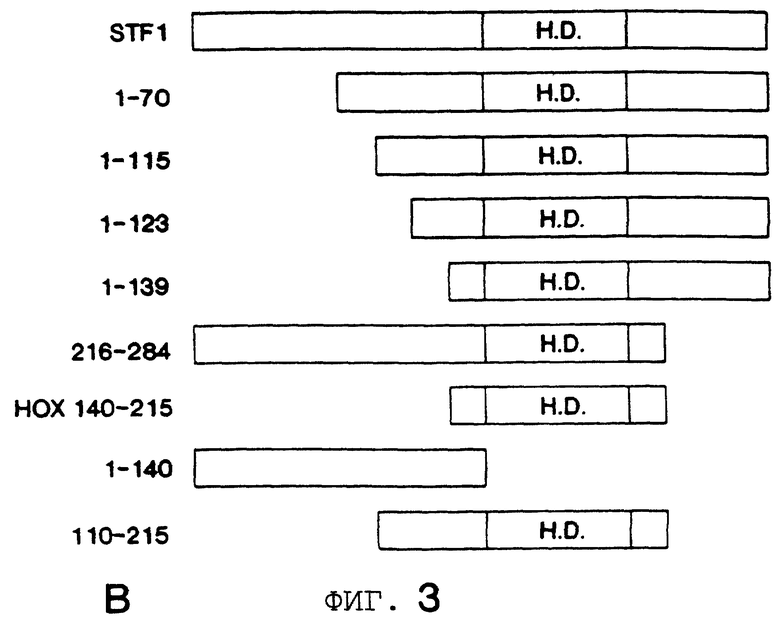
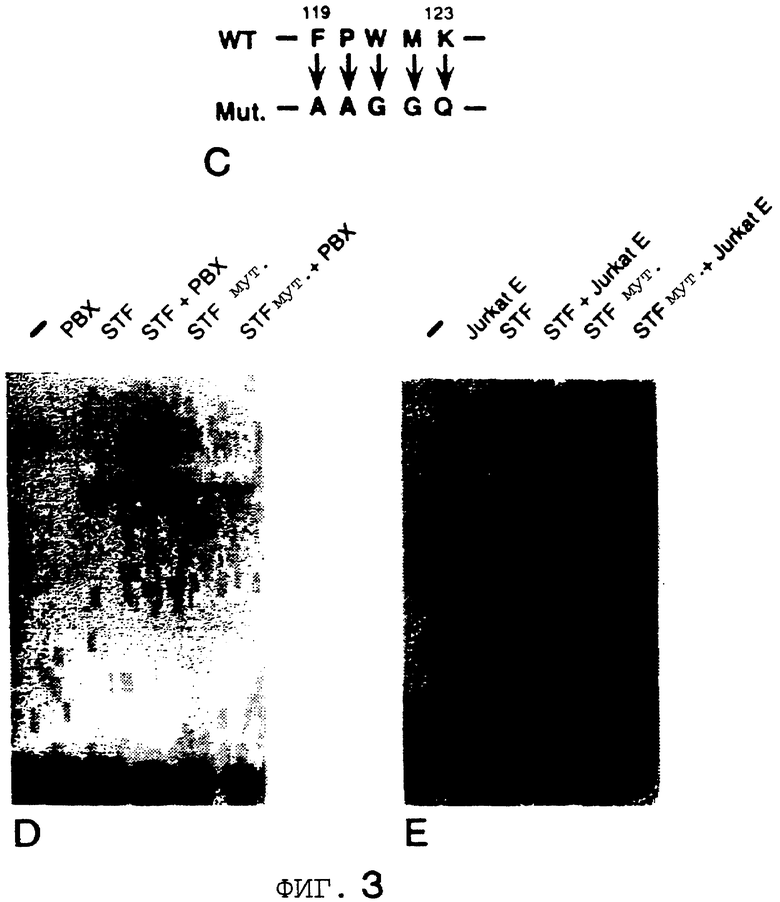
Фигура 3 показывает, что консервативный пентапептидный мотив в STF-1 является существенным для кооперативного связывания с Рbх. На Фигуре 3А представлен анализ образования STF-1 мономера (комплекс С1) и STF-1/Pbx гетеродимера (комплекс С2) для дикого типа и усеченного рекомбинантного STF-1 полипептидов. Концы делеции в мутантных STF-1 полипептидах показаны над каждой дорожкой. Например, D 1-70 обозначает STF-1 полипептид, у которого отсутствуют остатки 1-70. Нох 140-215, STF-1 гомеодоменный полипептид. На Фигуре 3В представлено схематическое изображение конструкций, используемых в вышеупомянутых анализах сдвига в геле. H. D. , STF-1 гомеодомен (аминокислотные остатки 140-215). STF-1 белок полной длины простирается от аминокислотных остатков 1-284. Фигура 3С показывает, что мутагенез консервативного пентапептидного мотива разрушает кооперативность с Рbх последовательностью дикого типа и мутантного STF-1 белка с указанными аминокислотными числами. Фигура 3D показывает анализ сдвига в геле STF белков дикого типа (WT) и мутантного (MUT) одних и в комбинации с in vitro транслированным РВХ или Е. Jurkat ядерным экстрактом.
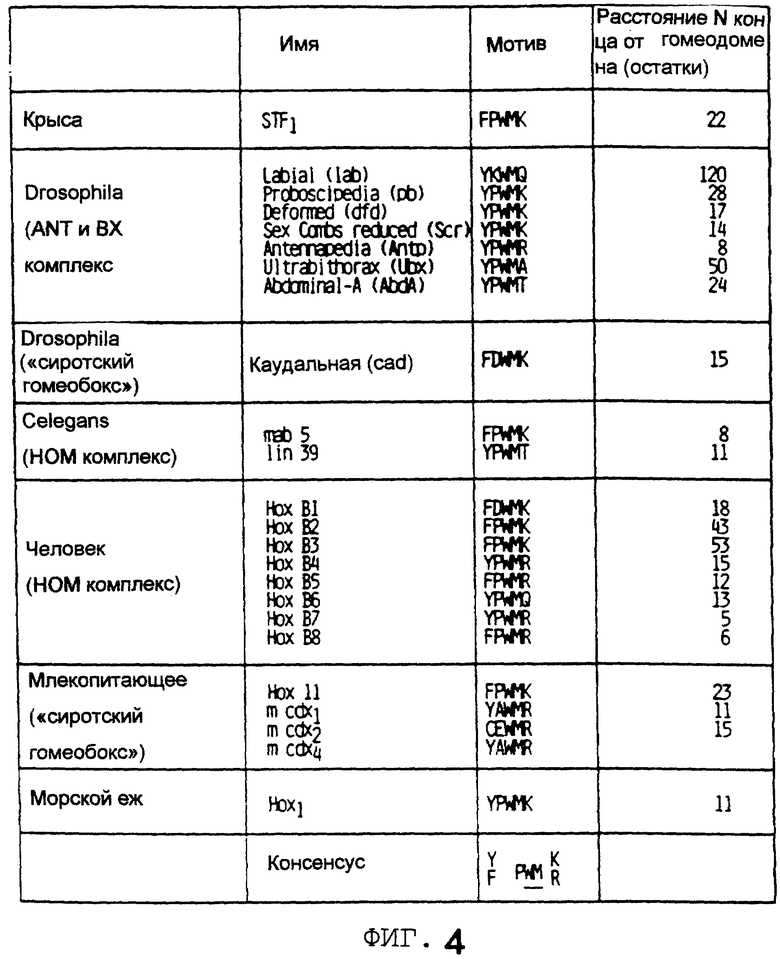
Фигура 4 показывает, что пентапептидный мотив в STF-1, который необходим для образования гетеродимера с Рbх на сайте TSEII сомастатина, сохраняется в ряде гомеобоксов белков. Различные гомеобоксы белков классифицированы по видам и перечислены по названию. Для каждого белка последовательности, относящиеся к мотиву в STF-1 приводятся в первичном аминокислотном коде как расстояние от N-конца к гомеодомену, указанному справа.
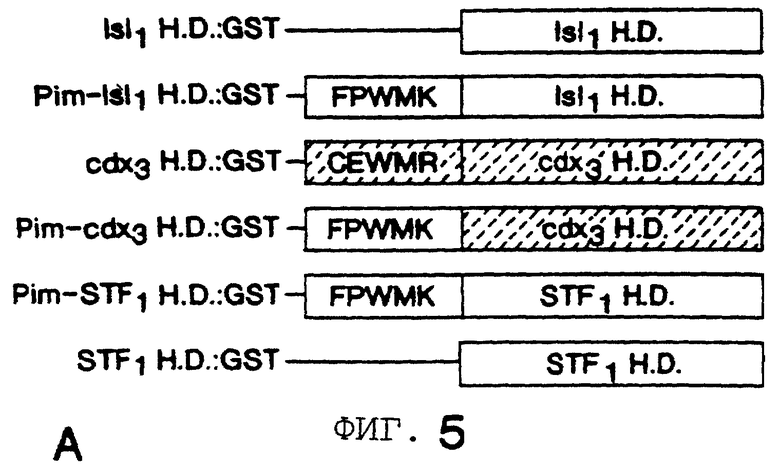
Фигура 5 показывает, что консервативный РВХ мотив взаимодействия (Pim) необходим, но недостаточен для того, чтобы способствовать кооперативному связыванию между белками РВХ и гомеобокса. На Фигуре 5А схематично показаны рекомбинантные GST-слитые белки, использованные в анализе сдвига в геле. Isll H. D. , гомеодомен фактора Isll домена lim. РВХ мотив взаимодействия-Isll H. D. , STF-1-Isll слитый белок, содержащий область мотива взаимодействия STF-1 РВХ (аминокислотные остатки 110-138), слитую с Isll гомеодоменом. cdx3 H. D. , гомеодомен панкреатического гомеобокс белка cdx3 (аминокислотные остатки 143-253). РВХ мотив взаимодействия-сdх3, слитый белок, содержащий область мотива взаимодействия STF-1 РВХ (аминокислотные остатки 110-138), слитую с cdx3 гомеодоменом (аминокислотные остатки 176-253). РВХ мотив взаимодействия-STF-l, STF-1 полипептид, содержащий область мотива взаимодействия РВХ (110-138), слитую с STF-1 гомеодоменом (аминокислотные остатки 140-215). STF-1 H. D. , STF-1 гомеодомен, один, без области мотива взаимодействия РВХ. На Фигуре 5В показан анализ подвижности сдвига в геле с использованием сайта TSEII соматостатина в качестве 32Р-меченного зонда. - и + указывают отсутствие или присутствие ретикулоцитного лизата, программируемом РВХ ДНК. Кооперативность с РВХ испытана с гомеодомен слитыми белками, показанными над каждой дорожкой. Мономерные и гетеродимерные комплексы мечены.
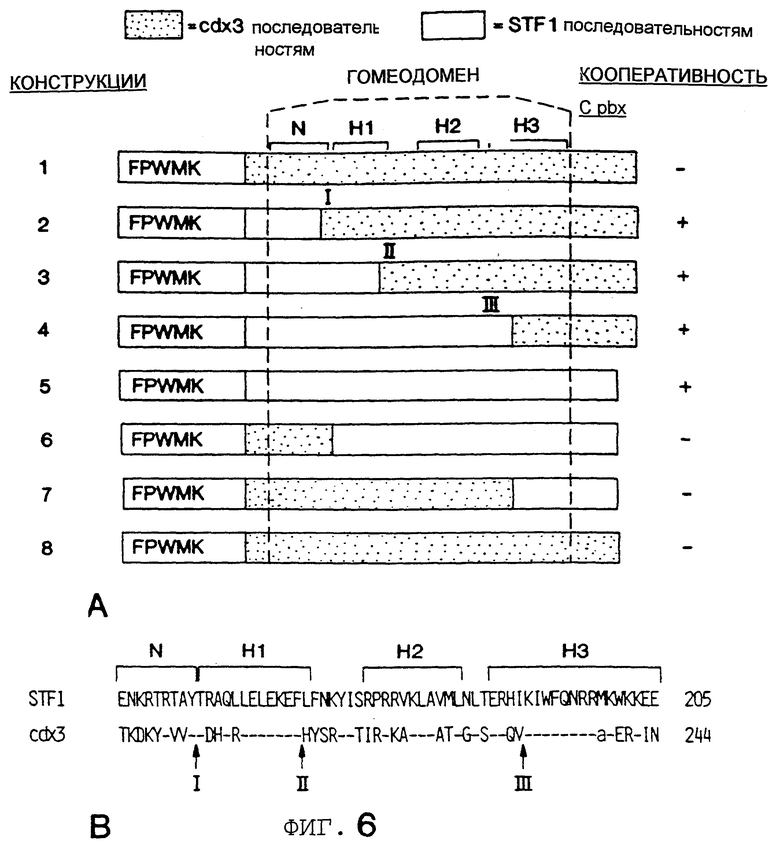
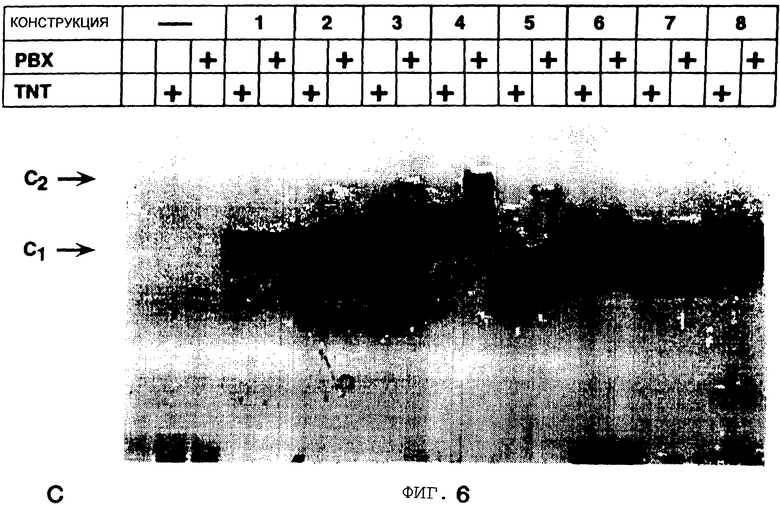
Фигура 6 показывает, что N-концевое плечо STF-1 гомео-домена необходимо для кооперативности с Рbх. Анализ сдвига в геле конструкций слияния РВХ мотив взаимодействия-сdх3, содержащих мотив мотива взаимодействия STF-1 РВХ (аминокислотные остатки 110-138), плюс различные области STF-1 гомеодомена, замещенного вместо cdx3 гомеодомена. Фигура 6А показывает структуру и активность конструкций слияния STF-l/cdx3. cdx3 последовательности затенены, STF-1 последовательности без затенения. Относительное положение N-концевого плеча (N), и спирали 1, 2 и 3 (HI, Н2, Н3) указаны. Кооперативное связывание с Рbх в анализах сдвига в геле указаны (+, -) справа. Фигура 6В показывает положение аминокислот STF-1 и cdx3 гомеодоменов, показанных ниже, с номером аминокислоты С-концевого остатка, показанным справа. Пунктиры указывают тождественные аминокислоты (идентичность аминокислот) между STF-1 и cdx3. Стрелки указывают на аминокислотные концы (I, II, III), используемые для конструкций слияния. Фигура 6С показывает анализ сдвига в геле рекомбинантных слитых белков STF-l/cdx3. Номера конструкций относятся к конструкциям, изображенным схематически (вверху). Присутствие in-vitro транслированного Pbx (PBX) или непрограммированного ретикулоцитного лизата (TNT) в реакциях связывания указано. Cl, C2; комплексы, соответствующие STF-1 мономеру и Pbx/STF-1 гетеродимеру соответственно.
Человеческий геном содержит четыре кластера гомеотичеcких селекторных генов, называемых Нох генами, которые являются критическими детерминантами образования аксиальной картины тела во время эмбриогенеза (Krumlauf, 1994 Cell 78: 191-201). Четыре кластера, каждый, содержат вплоть до 13 генов, и данный ген в одном кластере обычно имеет особенно высокую гомологию с членом других трех семейств. Такие родственные гены называют паралогичными; следовательно HoxAl, HoxBl, HoxCl и HoxDl являются, все, близко родственными паралогичными, каждый в различном Нох кластере на различной хромосоме. НохВ комплекс находится на длинном плече хромосомы 17, и, например, HoxBl был идентифицирован посредством НохВ9.
Глюкозозависимая регуляция инсулинового гена, по-видимому, происходит в согласии с глюкозоопосредованными повышениями в секреции инсулина. Это может быть обусловлено отчасти увеличениями внутриклеточного кальция. Кроме того, глюкозоответная функция инсулинового промотора может происходить, по крайней мере отчасти, путем модулирования активности FLAT-связывающих белков. НохВ13 с высоким сродством связывает функционально важный FLAT элемент инсулинового промотора. Дополнительно, НохВ13 и инсулин ICE/Nir элементсвязывающий фактор Рап-1 сильно активируют инсулиновый промотор при добавлении в комбинации. Это согласуется с наблюдением, что FLAT и Nir элементы функционируют синергитически в инсулинпродуцирующих клетках. Вместе эти данные подтверждают, что кальцийзависимые сигнальные пути могут регулировать функцию НохB13.
Согласно данному изобретению можно использовать методы обычной молекулярной биологии, микробиологии и техники рекомбинантных ДНК в пределах квалификации специалиста в данной области. Такие методы подробно рассмотрены в литературе. Смотри, например, Maniatis, Fritsch & Sambrook, "Molecular Cloning: A Laboratory Manual (1982); "DNA Cloning: A Practical Approach, " Volumes I and II (D. N. Glover ed. 1985); "Oligonucleotides Synthesis" (M. J. Gait ed "Nucleic Acid Hybridization" [B. D. Hames & S. J. Higgins eds. (1985)] ; "Trascription and Translation" [B. D. Hames & S. J. Higgins eds. (1984)] ; "Animal Cell Culture" [R. I. Freshney, ed. (1986)] ; "Immobilized Cells and Enzymes" [IRL Press, (1986)] ; В. Perbal, "A Practical Guide To Molecular Cloning" (1984).
Кроме того, нижеследующие термины, если они представлены здесь, будут иметь данные ниже определения.
Аминокислота, описанная здесь, предпочтительно находится в "L" изомерной форме. Однако любой остаток L-аминокислоты может быть замещен на остатки в "D" изомерной форме, поскольку требуемое функциональное свойство связывания иммуноглобулина сохраняется благодаря полипептиду. NH2 относится к свободной аминогруппе, присутствующей на амино-конце полипептида. СООН относится к свободной карбоксигруппе, присутствующей на карбокси-конце полипептида. В соответствии со стандартной номенклатурой полипептидов, J Biol. Chem. , 243: 3552-59 (1969), аббревиатуры остатков аминокислот показаны в таблице соответствия (см. в конце описания)
Следует заметить, что все последовательности аминокислотных остатков представлены здесь формулами, левая и правая ориентация которых находится в обычном направлении от амино-конца к карбокси-концу. Кроме того, следует заметить, что пунктир в начале или конце последовательности аминокислотного остатка указывает пептидную связь с дополнительной последовательностью одного или нескольких аминокислотных остатков. Вышеуказанная таблица представлена для корреляции трехбуквенных и однобуквенных обозначений, которые могут появляться альтернативно.
Термин "репликон" означает любой генетический элемент (например, плазмида, хромосома, вирус), который функционирует как независимая (automous) единица ДНК репликации in vivo; то есть способная к репликации под своим собственным контролем.
Термин "вектор" означает репликон, такой как плазмида, фаг или космида, к которому может быть присоединен другой ДНК сегмент так, чтобы осуществить репликацию присоединенного сегмента.
Термин "ДНК молекула" относится к полимерной форме дезоксирибонуклеотидов (аденин, гуанин, тимин или цитозин) в tis либо одноцепочечной форме либо в двутяжевой спирали. Этот термин относится только к первичной и вторичной структуре молекулы и не ограничивает его любыми конкретными третичными формами. Таким образом, этот термин включает двутяжевую ДНК, найденную, между прочим, в линейных ДНК молекулах (например, фрагменты рестрикции), вирусах, плазмидах, и хромосомах. При обсуждении структуры согласно принятым нормам дается только последовательность в направлении от 5' к 3' вдоль нетранскрибируемой цепи ДНК (например, цепь, имеющая последовательность, гомологичную мРНК).
Термин "начало репликации" относится к тем ДНК последовательностям, которые принимают участие в ДНК синтезе.
ДНК "кодирующая последовательность" означает последовательность двутяжевой ДНК, которая транскрибируется и транслируется в полипептид in vivo, когда она находится под контролем соответствующих регуляторных последовательностей. Границы кодирующей последовательности определяются стартовым кодоном при 5' (амино) конце и стор кодоном трансляции при 3' (карбоксил) конце. Кодирующая последовательность может включать, но не ограничиваться, прокариотические последовательности, кДНК из эукариотической мДНК, последовательности геномной ДНК из эукариотической (например, млекопитающего) ДНК, и даже последовательности синтетической ДНК. Сигнал полиаденилирования и последовательность терминации транскрипции обычно располагают в 3' (конце) кодирующей последовательности.
Транскрипционные и трансляционные контрольные последовательности представляют ДНК регуляторные последовательности, такие как промоторы, энхансеры, сигналы полиаденилирования, терминаторы, и т. п. , которые обеспечивают экспрессию кодирующей последовательности в клетке-хозяине.
Термин "промотерная последовательность" означает регуляторную область ДНК, способную связывать РНК полимеразу в клетке и инициировать транскрипцию по ходу (3' направление) кодирующей последовательности. Для целей данного изобретения промотерная последовательность связана на ее 3' конце сайтом инициации транскрипции и распространяется против хода транскрипции (5' направление), включая минимальное число оснований или элементов, необходимых для инициирования транскрипции на уровнях, определяемых выше уровня фона. Внутри промотерной последовательности обычно находится сайт инициации транскрипции (удобно определяемый путем картирования нуклеазой S1), а также домены связывания белка (консенсусные последовательности), ответственные за связывание РНК-полимеразы. Эукариотические промотеры часто, но не всегда, содержат "ТАТА" боксы и "CAT" боксы. Прокариотические промотеры содержат Shine-Dalgarno последовательности в дополнение к -10 и -35 консенсусным последовательностям.
Термин "последовательность контроля экспрессии" означает ДНК последовательность, которая контролирует и регулирует транскрипцию и трансляцию другой ДНК последовательности. Кодирующая последовательность находится "под контролем" транскрипционной и трансляционной контрольных последовательностей в клетке, когда РНК полимераза транскрибирует кодирующую последовательность в мРНК, которая затем транслируется в белок, кодируемый кодирующей последовательностью.
"Сигнальная последовательность" может быть включена перед кодирующей последовательностью. Эта последовательность кодирует сигнальный пептид, N-концевой к полипептиду, который связывается с клеткой-хозяином, чтобы направить (в направлении) полипептид к поверхности клетки или секретировать полипептид в среду, и этот сигнальный пептид отрезается клеткой-хозяином до того, как белок покинет клетку. Сигнальные последовательности, как установлено, могут быть ассоциированы с рядом белков нативно в прокариотах и эукариотах.
Используемый здесь в отношении зонда данного изобретения термин "олигонуклеотид" определяется как молекула, включающая два или несколько рибонуклеотидов, предпочтительно более чем три. Его точный размер будет зависеть от многих факторов, которые, в свою очередь, зависят от конечной функции и использования олигонуклеотида.
Термин "праймер", используемый здесь, относится к олигонуклеотиду независимо от того, является ли он природного происхождения в виде очищенного продукта рестрикционного расщепления или получен синтетически, который способен действовать в качестве точки инициации синтеза, при помещении его в условия, в которых индуцируется синтез продукта удлинения праймера, который комплементарен цепи нуклеиновой кислоты, то есть в присутствии нуклеотидов и индуцирующего агента, такого как ДНК-полимераза, и при подходящей температуре и рН. Праймер может быть либо однотяжевым, либо двутяжевым и должен быть достаточно длинным, чтобы праймировать синтез требуемого увеличения продукта в присутствии индуцирующего агента. Точная длина праймера будет зависеть от многих факторов, включая температуру, источник праймера и использование способа. Например, для диагностических применений в зависимости от сложности последовательности-мишени олигонуклеотидный праймер обычно содержит 15-25 или более нуклеотидов, хотя он может содержать меньше нуклеотидов.
Здесь праймер выбирают так, чтобы он был "в основном" комплементарен различным цепям конкретной последовательности ДНК-мишени. Это означает, что праймеры должны быть достаточно комплементарны, чтобы гибридизоваться с их соответствующими цепями. Поэтому для последовательности праймера нет необходимости отражать точную последовательность матрицы. Например, некомплементарный фрагмент нуклеотида может быть присоединен к 5' концу праймера, причем остаток последовательности праймера комплементарен цепи. Альтернативно, некомплементарные основания или более длинные последовательности могут быть встроены в праймер при условии, что последовательность праймера имеет достаточную комплементарность с данной последовательностью или гибридизирует с ней, и тем самым образуют матрицу для синтеза продукта расширения.
Используемые здесь термины "эндонуклеазы рестрикции" и "ферменты рестрикции" относятся к бактериальным ферментам, каждый из которых разрезает двутяжевую ДНК при или около конкретной нуклеазной последовательности.
Клетка "трансформируется" с помощью экзогенной или гетерологичной ДНК, когда такую ДНК вводят внутрь клетки. Трансформирующая ДНК может быть интегрирована или может быть не интегрирована (ковалентно связана) в геном клетки. В прокариотах, дрожжах и клетках млекопитающего, например, трансформирующая ДНК может сохраняться в эписомальном элементе, таком как плазмида. Что касается эукариотических клеток, стабильно трансформированная клетка представляет клетку, в которой трансформирующая ДНК интегрирована в хромосому так, чтобы она наследовалась дочерними клетками через репликацию хромосомы. Эта стабильность демонстрируется способностью эукариотической клетки создавать клеточные линии или клоны, включающие популяцию дочерних клеток, содержащих трансформирующую ДНК. "Клон" означает популяцию клеток, полученных из единичной клетки или (monnon) предка с помощью митоза. "Клеточная линия" представляет клон первичной клетки, которая способна к стабильному росту in vivo для многих генераций.
Две ДНК последовательности являются "в основном гомологичными", когда по крайней мере приблизительно 75% (предпочтительно по крайней мере приблизительно 80%, наиболее предпочтительно по крайней мере приблизительно 90 или 95%) нуклеотидов соответствуют на протяжении определенной длины ДНК последовательностей. Последовательности, которые являются в основном гомологичными, могут быть идентифицированы путем сравнения последовательностей, при использовании стандартной программы, доступной в банке данных последовательностей, или в эксперименте Саузерн гибридизации, например, в строгих условиях, определенных для такой конкретной системы. Условия, определяющие соответствующую гибридизацию, известны специалисту в данной области. Смотри, например, Maniatis et al. , supra; DNA Cloning, Vols. I & II, supra; Nucleic Acid Hybridization, supra.
"Гетерологичная" область ДНК конструкции представляет идентифицицируемый сегмент ДНК внутри большей по размеру ДНК молекулы, которая не находится в связи (ассоциации) с большей по размеру молекулой в природе. Таким образом, когда гетерологичная область кодирует ген млекопитающего, ген обычно ограничивается (фланкируется) ДНК, которая не граничит (фланкирует) с геномной ДНК млекопитающего в геноме организма-первоисточника. В другом примере кодирующая последовательность представляет конструкцию, где кодирующая последовательность сама по себе не имеется в природе (например, кДНК, где геномная кодирующая последовательность содержит интроны, или синтетические последовательности, имеющие кодоны, отличные от нативного гена). Аллельные вариации или встречающиеся в природе мутантные случаи не приводят к определенной здесь гетерологичной области ДНК.
Метки, чаще всего обычно применяемые для этих исследований, представляют радиоактивные элементы, ферменты, химические средства, которые флуоресцируют при экспонировании ультрафиолетовым светом, и другие. Ряд флуоресцентных веществ известен, и их можно использовать в качестве меток. Эти вещества включают, например, флуоресцеин, родамин, аурамин, Texas Red, AMCA Blue и Lucifer Yellow. Особым детектирующим веществом является к кроличьим антителам антитело, полученное у коз и конъюгированное с флуоресцеином при помощи изотиоцианата.
Белки также могут быть мечены радиоактивным элементом или ферментом. Радиоактивная метка может быть определена с помощью любой из в настоящее время доступных методик счета. Предпочтительные изотопы могут быть выбраны из 3Н, 14С, 32P, 35S, 36Cl, 51Cr, 57Co, 58Со, 59Fe, 90Y, 125I, 131I, и 186Re.
Ферментные метки также полезны и их можно детектировать с помощью любой из используемых в настоящее время техникколориметрической, спектрофотометрической, флуороспектрофотометрической, амперометрической или газометрической. Фермент конъюгируют с выбранной частицей путем взаимодействия с мостиковыми молекулами, такими как карбодиимиды, диизоцианаты, глутаральдегид и т. п. Многие ферменты, которые могут быть использованы в этих процедурах, известны, и их можно применить. Предпочтительными являются пероксидаза, β-глюкуронидаза, β-D-глюкозидаза, β-D-галактозидаза, уреаза, глюкозооксидаза плюс пероксидаза и щелочная фосфатаза. Пат. США 3654090, 3850752 и 4016043 относятся к примерам раскрытия альтернативных веществ для мечения и способам.
Конкретная система анализа, разработанная и используемая в данной области, известна как рецепторный анализ. В рецепторном анализе вещество, подлежащее анализу, соответственно метят, и затем некоторые клеточные испытываемые колонии инокулируют некоторым количеством из двух меток, после чего проводят изучение связывания для определения степени, до которой меченое вещество связывается с рецепторами клетки. Таким путем могут быть установлены различия в сродстве между веществами.
Анализ, используемый в данной области, известен как "цис/транс" анализ. Кратко, в этом анализе применяются две гинетические конструкции, одна из которых представляет обычно плазмиду, которая непрерывно экспрессирует конкретный рецептор, представляющий интерес при трансфецировании в соответствующую клеточную линию, и вторая из которых представляет плазмиду, которая экспрессирует репортер, такой как люциферазу, под контролем комплекса рецептор/лиганд. Таким образом, например, если требуется оценить соединение в качестве лиганда для конкретного рецептора, одна из плазмид должна быть конструкцией, которая приводит к экспрессии рецептора в выбранной клеточной линии, в то время как вторая плазмида должна обладать промотером, связанным с геном люциферазы, в котором вставлен элемент ответа к конкретному рецептору. Если соединение при испытании является агонистом для рецептора, лиганд будет образовывать комплекс с рецептором, и образующийся комплекс будет связывать элемент ответа и инициировать транскрипцию гена люциферазы. Возникающую хемилюминесценцию затем измеряют фотометрически и получают кривые доза-ответ и сравнивают с кривыми известных лигандов. Вышеприведенный протокол детально описан в Пат. США 4981784 и PCT International Publication 88/03168.
Данное изобретение раскрывает, что STF-1 связывается с Рbх и это связывание приводит к усиленной транскрипции сома-тостатина и, наиболее вероятно, инсулина. Связывание STF-1 с Рbх требует пентапептида (FPWMK). STF-1 и Рbх действуют синергично только на субпопуляцию сайтов, которые распознают STF-1-Pbx гетеродимер. Как показано ниже, аминокислотные остатки 115-123 STF-1 требуются для кооперативности с Рbх. То есть, поскольку мутантная кДНК STF-1 не может кооперировать с Pbx, Pim является необходимым. Кроме того, показано, что подвижное N-концевое плечо STF-1 гомеодомена, включающее аминокислотные остатки 145-153, является существенным для кооперативности с Pbx.
Нижеследующие примеры приводятся с целью иллюстрации различных вариантов воплощения изобретения, и подразумевается, что они не ограничивают данное изобретения каким-либо образом.
ПРИМЕР 1
Конструкции плазмид и экспрессия белков
Конструкции делеции STF-1, показанные на фигуре 3В, описаны ранее [20] . Плазмиды делеции STF-1 конструируют, используя процедуру амплификации с помощью полимеразной цепной реакции (ПСР, PCR). Используя кДНК STF-1 в качестве матрицы, один смысловой олигонуклеотид, перекрывающий делецию, инкубируют с антисмысловым олигонуклеотидом, соответствующим 3' концу кДНК STF-1. Фрагменты кДНК STF-1, содержащие соответствующие делеции внутри кодирующей области, получают путем ПСР амплификации, используя Taq полимеразу. кДНК Pbxl (дар С. Murre) (18) и мутанты делеции STF-1 Dl-70, Dl-115, D1-139 и D216-284 получают, используя Promega систему сочетания транскрипции/трансляции лизата ретикулоцитов кролика TNT, согласно протоколу производителя. STF-1 белок полной длины и мутанты делеции STF-1 hox 140-215, 1-140 и 110-215 (смотри Фигуру 3А) экспрессируют в E. coli, используя бактериальный вектор экспрессии рGЕХ3Х. Рекомбинантные белки очищают, как описано ранее [14] ; STF-1 полипептиды первоначально экспрессируют в виде слитых белков, которые содержат глутатион-S-трансферазу (GST) на их N-концах. GST-STF-1 полипептиды очищают от бактериальных лизатов с помощью аффинной хроматографии над глутатион-сефарозными смолами. Затем очищенные белки могут быть элюированы из смол при использовании глутатиона (10 мМ), или протеолитически расщеплены с помощью сайта расщепления фактора X, который встраивают между GST и STF-1 последовательностями. Рекомбинантные белки элюируют из глутатион-сефарозных гранул путем переваривания с 4 мкг фактора Ха в течение 16 часов при комнатной температуре.
GST-слитые белки, описанные на Фигуре 5, также экспрессируют в Е. Coli, используя pGEX3X вектор. Последовательности, кодирующие крысиный Isll гомеодомен [12] (аминокислота 176-248), гомеодомен cdx3 хомяка [6] (аминокислота 143-253) и STF-1 гомеодомен (аминокислота 140-215), амплифицируют с помощью полимеразной цепной реакции и сливают в рамке pGEX3X плазмиды. Для РВХ мотива взаимодействия гомеодомен слитые белки, STF-1 кодирующую последовательность от остатка 110 до 138, включающую FPWMK мотив, лигируют в рамке против хода кодирующей последовательности гомеодомена Isll (аминокислота 176-248), гомеодомена cdx3 (аминокислота 176-253) и гомеодомена STF-1 (аминокислота 140-215), и встраивают в pGEX3X вектор. GST-слитые белки экспрессируют и очищают, как описано ранее (14) и элюируют из гранул 5 мМ восстановленным глутатионом.
ПРИМЕР 2
Анализы по подвижности сдвига в геле
Анализы по подвижности сдвига в геле осуществляют в соответствии с тем, как описано ранее [20] , используя 0,1 нг меченного на конце двутяжевого олигонуклеотида, чьи последовательности представлены на Фигуре 2С. Для полного (off-rate) анализа пробу TSEII сначала инкубируют с белками при комнатной температуре в течение 30 минут, затем добавляют 1000-кратный избыток немеченого олигонуклеотида TSEII и аликвоты нагружают с определенным временным интервалом на работающий (running) гель. В анализах сверхсдвига экстракт TU6 ядерных клеток предварительно инкубируют с 1 мкл Рbх [11] или STF-антисыворотки [20] в течение 15 минут при комнатной температуре до добавления TSEII зонда. Рbх-антисыворотка не различается между членами (представителями) Рbх
семейства (Pbx 1, 2, 3).
ПРИМЕР 3
Специфические белковые ДНК комплексы С1, С2, и С3.
В панкреатических опухолевых клеточных линиях, экспрессия соматостатина и инсулина гормональными генами панкреатических островков зависит от гомеобокса фактора STF-1. STF-1 регулирует экспрессию соматостатина в Тu-6 клетках путем связывания двух ткане-специфичных регуляторных элементов, называемых TSEI и TSEII [14] . Используя олигонуклеотидный зонд 32Р-меченного TSEII сайта в анализах сдвига подвижности в геле неочищенного Тu-6 ядерного экстракта, детектируют три специфических белковых ДНК комплекса и называют здесь комплексом С1, комплексом С2, и комплексом С3 (Фигура 1А). Комплексы С1 и С2 наблюдают только в клеточных экстрактах панкреатических островков, в то время как комплекс С3 детектируют при сравнимых уровнях в не-островковых линиях, такой как Hela. Комплекс С3, по-видимому, содержит повсеместно присутствующий Oct-1 белок, обнаруженный с помощью "суперсдвигового анализа" с Oct-1 антисывороткой. В противоположность этому комплексы С1 и С2 содержат STF-l белок, определенный по его чувствительности к добавлению STF-1 антисыворотки.
Комплекс С2 увеличивается экспоненциально как функция концентрации экстракта, в то время как комплекс С1 увеличивается линейно в анализах сдвига подвижности в геле. Рекомбинантный STF-1 белок полной длины генерирует единственный комплекс, мигрирующий в такое же положение как комплекс С1 (Фигура 1А, дорожка 6), подтверждая, что комплекс С1 содержит только STF-1 белок, в то время как комплекс С2 представляет гетеромерный STF-1 комплекс с высоким сродством. В этом отношении исследования данных полного анализа показали, что период полураспада для комплекса С1 меньше, чем 1 минута по сравнению с периодом полураспада приблизительно 15 минут для гетеромерного STF-1 комплекса С2 (Фигура 1В).
Чтобы подтвердить, что С2 комплекс не соответствует гомодимерной форме STF-1, исследуют возрастающие концентрации рекомбинантного STF-1 белка в анализах сдвига подвижности в геле с TSEII зондом (Фигура 1С). То, что не наблюдаются более медленно мигрирующие комплексы при больших количествах STF-1 белка, указывает на то, что комплекс С2 должен содержать дополнительный белковый компонент, который сильно стабилизирует связывание STF-1 с ДНК.
Для демонстрации, что этот компонент повсеместно экспрессируется, неочищенные Jurkat (или Hela) ядерные экстракты добавляют в реакции, содержащие рекомбинантный STF-1 белок. В этих условиях образование комплекса С2 легко наблюдается и зависит от добавления рекомбинантного STF-1 (Фигура 1С). Полный анализ для С2 комплекса в воссозданных экстрактах сравним с полным анализом в Тu-6 экстрактах (около 15 минут), что указывает на то, что повсеместно присутствующий фактор стабилизирует связывание STF-1 с TSEII сайтом (Фигура ID).
Гомеобокс белка Drosophila, названный экстрадентиклем, связывается кооперативно с другими гомеодоменными белками для того, чтобы сделать мишенью сайты промотора [2, 25] . Затем исследуют, содержится ли гомолог экстрадентикля млекопитающего, называемый Рbх [23] , в комплексе С2. При добавлении к неочищенным Тu-6 ядерным экстрактам, Рbх антисыворотка специфически блокирует образование комплекса С2, но эта антисыворотка не оказывает влияния на образование С1, который содержит только STF-1 (Фигура 2А, дорожка 2). Кроме того, совместная инкубация Рbх и рекомбинантных STF-1 белков приводит к образованию гетеромерного С2 комплекса в анализах по сдвигу в геле (Фигура 2В). Стабильность этого Pbx-STF-1 комплекса, оцениваемая с помощью полного анализа, сравнима с эндогенным С2 комплексом в Тu-6 ядерных экстрактах (Фигура 2С).
Чтобы определить, могут ли Рbх и STF-1 кооперативно связываться с другими сайтами мишени STF-1, кроме TSEII, анализы сдвига в геле проводят с рекомбинантным STF-1 и Рbх белками на элементах TSEI соматостатина или Р и FLAT инсулина, сайтах, которые требуются для ограниченной островковыми клетками экспрессии генов соматостатина и инсулина 1 крысы, соответственно в панкреатических клетках (Фигура 2D и Фигура 2Е). В противоположность TSEII элементу (Фигура 2D, дорожки 1-4), не наблюдается гетеромерного STF-1-Pbx комплекса на TSEI, P или FLAT элементах. В самом деле, гетеромерные STF-1 комплексы также не детектируются, когда TSEI, Р или FLAT элементы используют в анализах сдвига в геле неочищенных экстрактов панкреатических клеток (данные не показаны) [20] .
Чтобы определить, может ли STF-1 и Рbх стимулировать транскрипцию кооперативным способом, осуществляют анализы по случайной трансфекции, используя вектор-репортер, который содержит две копии сайта TSEII соматостатина против хода (транскрипции) промотора гормона минимального роста (Фигура 2F). Чтобы оптимизировать регуляторные вклады от трансфецированной Рbх экспрессионной плазмиды, применяют Е2А-Рbх вектор, который экспрессирует домен активации Е2А, слитый с Рbх [15] . При трансфекции раздельно в GC клетки STF-1 и Е2А-Рbх экспрессионные векторы имеют незначительное влияние на TSEII люциферазную репортерную активность. Совместная трансфекция STF-1 и Е2А-Рbх эффекторной плаэмиды заметно увеличивает TSEII репортерную активность, тем не менее, давая возможность предположить, что STF-1 в самом деле может кооперировать с Рbх на сайте TSEII. В противоположность этому такой кооперативности между STF-1 и Е2А-Рbх не наблюдается при использовании плазмиды-репортера, которая содержит Р элемент инсулина (P-Luc). Поскольку Р-элемент неспособен образовать STF-1-Pbx гетеродимеры в анализах связывания ДНК (Фигура 2D), эти результаты демонстрируют, что STF-1 и Рbх могут действовать синергично только на субпопуляцию сайтов, которые способны распознавать гетеродимер STF-1-Pbx.
Чтобы идентифицировать последовательности в элементе TSEII соматостатина, которые важны для Pbx-STF-1 кооперативности, конструируют несколько мутантных TSEII олигонуклеотидов (Фигура 2D, Фигура 2Е). Сайт TSEII содержит 3 ТААТ мотива, основной мотив распознавания гомеодомена белков. Мутация ТААТ мотивов 1 или 3 (Ml и М3, плюс цепь) оказывает минимальное влияние на кооперативное связывание между STF-1 и Рbх, но мутация ТААТ мотива 2 (минус цепь) полностью уничтожает Pbx-STF-1 кооперативность, указывая на важность этого специального ТААТ мотива для образования STF-1-Pbx комплекса. Мутация третьего ТААТ мотива (М3) также влияет на образование STF-1 мономерного С1 комплекса.
Чтобы идентифицировать остатки в STF-1, которые промотируют кооперативное связывание с Рbх, исследуют ряд усеченных STF-1 полипептидов в анализах сдвига в геле, используя TSEII зонд (Фигура 3А и Фигура 3В). Деления С-концевых остатков до гомеобокса домена не влияет на кооперативное связывание с Pbx (D216-284 мутант). И N-терминально усеченные STF-1 полипептиды с отсутствующим доменом транс-активации STF-1 (аминокислота 1-115) также сохраняют способность кооперативно связываться с TSEII сайтом. Но дополнительная делеция остатков от аминокислоты 115 до 123 уничтожает кооперативность с Pbx, давая возможность предположить, что область вне STF-1 гомеодомена важна для образования гетеродимера (Фигура 3А и Фигура 3В). Действительно, гомеобокс область STF-1 (Нох 140-215) образует мономерный комплекс на сайте TSEII, но не связывается кооперативно с Pbx. STF-1 полипептиды, содержащие N-концевые последовательности в дополнение к STF-1 гомеодомену (аминокислота 110-215), показывают кооперативность с Pbx, указывая, N-концевые остатки, граничащие с STF-1 гомеобоксом, могут образовывать белок-белок контакты с Pbx при связывании с сайтом TSEII.
В процессе сравнения остатков в STF-1 с другими гомеодоменами белков Drosophila, которые связываются кооперативно с ДНК экстрадентикля, замечают гомолог Pbx Drosophila пентапептидный мотив FPWMK, который расположен внутри этой N-концевой области STF-1 (аминокислота 115-123) и который является консервативным во многих гомеобелках из целого ряда метазоанов [5] . Для иллюстрации важности этого пептидного мотива для кооперативности с Pbx конструируют мутантную кДНК STF-1, содержащую аминокислотные заместители в каждом остатке мотива (FPWMK-AAGGQ) (Фигура 3С). При сравнении с STF-1 белком дикого типа в анализах сдвига подвижности в геле мутированный STF-1 белок лишен способности кооперироваться либо с рекомбинантным Pbx, либо с эндогенным Pbx из Jurkat экстрактов (Фигура 3D и Фигура 3Е соответственно). В противоположность этому мутантный STF-1 белок показывает активность связывания дикого типа на Р и Flat элементах инсулина, сайтах, которые не образуют гетеродимерный комплекс. Эти результаты демонстрируют, что мотив взаимодействия Pbx в STF-1, называемый областью мотива взаимодействия Pbx или pim, действительно необходим для кооперативности с Pbx.
Чтобы определить, является ли область мотива взаимодействия Рbх достаточной для кооперативности с Рbх, исследуют способность этого мотива придавать Рbх кооперативность при слиянии с гетерологичными гомеобоксами белков (Фигура 5В). В анализах сдвига подвижности в геле lim гомеодомен белкa Isll распознает сайт TSEII соматостатина с высоким сродством, но не способен гетеродимеризоваться с Рbх. Примечательно, что слияние области мотива взаимодействия РВХ против хода (транскрипции) Isll гомеобокса не промотирует кооперативность с Рbх. Каудальный фактор cdxl содержит мотив взаимодействия РВХ, родственный мотиву CEWMR против хода его гомеодомена. Но, подобно Isll, cdx3 не гетеродимеризуется с Рbх; и добавление области мотива взаимодействия РВХ в cdx3 гомеодомен не промотировало Рbх кооперативность. Примечательно, что расстояние между областью мотива взаимодействия РВХ и гомеобоксом сравнимо для STF-1 и обоих слитых белков, РВХ мотив взаимодействия-Isll и РВХ мотив взаимодействия - сdх3, подтверждая, что расстояние (удаленность) от гомеобокса домена не может объяснить их неспособность кооперироваться с Рbх. Кроме того, химерные белки (РВХ мотив взаимодействия-Isll, РВХ мотив взаимодействия - сdх3), по-видимому, связываются с ДНК со сродством дикого типа, указывая на то, что отсутствие кооперативности не может отражать некорректную укладку. Вместе взятые, эти результаты подтверждают, что хотя область мотива взаимодействия РВХ требуется для образования гетеромерного комплекса с Рbх, для кооперативного связывания с сайтом TSEII соматостатина требуются дополнительные остатки внутри STF-1 гомеодомена.
Чтобы охарактеризовать остатки внутри гомеодомена STF-1, которые в дополнение к области мотива взаимодействия РВХ функционально важны для кооперативного связывания с Рbх, сегменты внутри cdx3 гомеодомена заменяют соответствующими сегментами STF-1 (Фигура 6С). Используя РВХ мотив взаимодействия - сdх3 в качестве гибридной (слитой) матрицы для таких экспериментов, было установлено, что N-концевое плечо STF-1 спасает кооперативность с Рbх, но другие области STF-1 гомеодомена (спирали 1, 2 или 3) не показывают такой активности. Эти результаты демонстрируют, что как мотив взаимодействия РВХ, так и N-концевое плечо STF-1 необходимы для образования комплекса с Рbх.
Экстрадентикль, Drosophila гомолог Рbх, по-видимому, является существенным для собственной активации субпопуляции генов-мишеней, таких как бескрылых, teashirt, и decapentaplegic во время развития [24] . Экстрадентикль, по-видимому, индуцирует эти гены-мишени путем кооперативного связывания ДНК вместе с различными гомеотическими белками [2, 25] . Данное изобретение демонстрирует, что Рbх, человеческий гомолог экстрадентикля, образует гетеродимерный комплекс с STF-1 на элементе TSEII соматостатина. По сравнению только с STF-1 STF-1-Pbx комплекс является высокостабильным, как измерено по уменьшению значений сдвига подвижности в геле при анализе этого комплекса. Важно отметить, однако, что эти результаты не различаются для различных членов Рbх семейства (Pbx-1, 2, 3), каждый из которых, очевидно, обладает способностью кооперативно связываться с НОХ белками.
Образование STF-1-Pbx гетеродимера на сайте TSEII соматостатина требует пентапептидного мотива (FPMWK), который консервативен в ряде гомеотических белков, не только в позвоночных, но также в Drosophila [5] и C. elegans. Таким образом, C. elegans гомеотические белки mab5 или lin-39, которые содержат этот мотив, могут аналогичным образом кооперироваться с белком ceh-20, который, по-видимому, является гомологичным Рbх [1] . Используя искусственную последовательность-мишень для индуцирования образования гетеродимера Pbx: hox, Chang et al. установил важность этого консервативного мотива для кооперативного связывания с Рbх в ДНК [3] . Эти результаты подтверждают, что действия Рbх не ограничиваются белками в hox комплексе, но включают орфанные (orphan) гомеобоксовые белки, такие как STF-1.
Хотя Chang et al. установили, что слияние консервативного YPMWK мотива с Hox A10 достаточно для промотирования кооперативности с Рbх [3] , индукции кооперативности не наблюдали, когда этот мотив переносили в белки гомеодомена островковых клеток, таких как isll и cdx-3. Эти результаты указывают на то, что дополнительные остатки внутри гомеодомена сами по себе могут требоваться для образования STF-1/Рbх комплекса. В этом отношении было установлено, что гибкое N-концевое плечо STF-1 гомеодомена (аминокислоты 145-153) является существенным для кооперативности с Pbx. N-концевое плечо, как было показано, придает функциональную специфичность гомеодоменным белкам, таким как Antennapedia, хотя лежащий в основе механизм остается неохарактеризованным [4; 26] . Структурные исследования показали, что N-концевое плечо расположено внутри минорного желобка ДНК, где оно придает тонкие различия при ДНК связывании или при белок-белок взаимодействиях. Хотя эти результаты не дают возможности различить эти модели, делаются попытки спекулировать на том, что образование STF-1/Pbx комплекса может отчасти опираться на способность N-концевого плеча образовывать специфические контакты минорного желобка.
Образование STF-1-Pbx гетеродимера происходит только на субпопуляции потенциальных сайтов-мишеней STF-1. Эти результаты подтверждают, что данное предпочтение может составлять основу для отбора сайта-мишени в развивающихся островковых клетках. Ранее отмечалось, например, что STF-1 индуцирует как экспрессию инсулина, так и экспрессию соматостатина, хотя в различных типах клеток (β и d соответственно) внутри панкреатического островка. В β-клетках, STF-1, по-видимому, индуцирует экспрессию инсулина путем действия кооперативно со спираль - петля - спираль белка Е47. В противоположность этому STF-1, по-видимому, промотирует экспрессию соматостатина в d клетках путем связывания кооперативно с TSEII сайтом вместе с Pbx. Эти наблюдения подтверждают, что коммутирование клеток внутри направления дифференцировки островка экспрессировать либо инсулин, либо соматостатин, может зависеть от относительной экспрессии Е-бокс связывающих (факторов) в сравнении с белками Рbх типа.
Комбинаторный механизм для эволюционной регуляции подобен механизму, представляемому здесь для развития поджелудочной железы, также описан для дрожжей. В этом отношении гомеодоменнный белок Mata2 кооперируется с Mata1 в диплоидных а/а клетках, связывая hsg операторы и подавляя гаплоидспецифические гены. Но в гаплоид а или а клетках, Mata2, по-видимому, кооперируется с другим активатором, МСМ1 и тем самым активирует другую генетическую программу [9] .
Присутствие консервативного мотива, который допускает взаимодействие между Рbх и некоторыми гомеобоксами белков, может объяснить отчасти глобальное влияние этого регулятора в развитии. Ген соматостатина экспрессируется рядом тканей помимо поджелудочной железы, включая мозг, желудок и медуллярную щитовидную железу. Хотя факторы, которые направляют экспрессию соматостатина в этих тканях, не идентифицированы, эти результаты предсказывают, что такие белки могут стимулировать экспрессию соматостатина на элементе TSEII путем образования гетеродимерных комплексов с Рbх.
Любые патенты или публикации, упомянутые в этом описании, являются показательными для развития уровня области техники, к которой относится данное изобретение. Эти патенты и публикации, приведены здесь для сведения в той же самой степени, как если бы каждая индивидуальная публикация была приведена для сведения конкретно и индивидуально (см. в конце описания).
Любой специалист в данной области оценит, что данное изобретение хорошо адаптировано для выполнения целей и получения конечных результатов и упомянутых преимуществ, а также результатов и преимуществ, присущих ему. Данные примеры наряду со способами, процедурами, обработками, молекулами и конкретными соединениями, описанными здесь, являются в настоящее время образцами предпочтительных вариантов воплощения, являются иллюстративными и не ограничивают объем изобретения. Специалистам в данной области очевидны изменения в них и другие применения, которые не выходят за рамки существа данного изобретения, определенного объемом формулы изобретения.
















Изобретение относится к области медицины. Сущность изобретения состоит в том, что создан способ конструирования соединений, которые имитируют действия Рbx в стабилизирующем связывании фактора 1 транскрипции соматостатина (STF-1). Используя известные анализы связывания ДНК, предполагают, что специалист в данной области способен скринировать соединения, чтобы определить лекарственные средства, эффективные в промотировании STF-1 связывания с ДНК. Таким путем можно будет открыть новые соединения, полезные в стимулировании продуцирования соматостатина и инсулина. Технический результат - расширение арсенала способов скрипинг-анализа полезных соединений для нормализации работы эндокринных систем. 2 с. и 4 з. п. ф-лы, 6 ил. , 1 табл.
| US A 4693969, 15.09.1987 | |||
| McGinnis W | |||
| et al | |||
| Cell, 68, 1992, 283-302. |
Авторы
Даты
2002-01-27—Публикация
1996-11-27—Подача