Предшествующий уровень техники
Область техники, к которой относится изобретение
Изобретение относится, в основном, к новым ДНК-последовательностям, кодирующим переносчики катионных аминокислот. Более конкретно, настоящее изобретение относится к новым способам использования указанных ДНК-последовательностей и антител против экспрессируемых белков для лечения патофизиологических заболеваний.
Описание прототипов
у+-Транспортная система значительно облегчает транспорт катионных аминокислот (АА), таких как аргинин, лизин и орнитин, натрий-независимым способом. Недавно сообщалось Dr. J. Cunningham (Гарвардская медицинская школа) о выделении кДНК-клона переносчика катионных АА. Другие кДНК-клоны, выделенные в более прямых экспериментах, кодируют белки, которые модифицируют транспорт АА; однако, маловероятно, что эти белки имеют непосредственное отношение к транспорту АА. Указанные белки называют вспомогательными белками или белками-активаторами.
Ген mСАТ-2 первоначально назывался Теа-геном. Однако в последующем его назвали переносчиком мышиных катионных аминокислот (murino Cationic amino acid fransporter) (mCAT-2) благодаря его функции, описанной в настоящей заявке.
Аргинин, который является необходимым для синтеза белков, играет главную роль в биосинтезе других АА и является непосредственным предшественником мочевины в мочевинном цикле. Аргинин необходим для синтеза высокоэнергичного фосфагена, креатинфосфата, который осуществляется путем передачи донорно-амидиновой группы глицину в первой стадии креатинового синтеза. Печень не является чистым поставщиком аргинина из-за высокого уровня аргиназы. Аргининовый обмен между почками и системой кровообращения нуждается в транспортных механизмах для ввода и вывода аргинина в результате клубочковой фильтрации. Поэтому каждый орган в организме, помимо печени и почек, получает аргинин из плазмы посредством транспортных механизмов. В противоположность этому, лизин, который является незаменимой аминокислотой, должен поступать в организм с пищей. Эта аминокислота не синтезируется млекопитающими, а поэтому все клетки должны обладать способностью к транспорту лизина для осуществления белкового синтеза.
Аргинин оказывает сильное стимулирующее действие на железы внутренней секреции. Внутривенное или пероральное введение аргинина взрослому человеку стимулирует секрецию гипоспизарного гормона роста, пролактина и инсулина. Кроме того, аргинин оказывает воздействие на иммунную систему организма независимо от полиаминового синтеза.
Аргинин является единственным предшественником, ответственным за синтез окиси азота (NO). NO представляет собой наиболее сильный из известных вазомодуляторов, и является необходимым элементом для осуществления нормальных функций макрофагов и Т-клеток. От окиси азота зависит цитотоксическая активность макрофагов, а продуцирование NO в эндотелии сосудов регулирует давление крови, и, кроме того, NO является нейромодулятором. Как и все свободные радикалы, NO является высокореактивным, а поэтому крайне нестабильным соединением, которое быстро превращается в нитрат или нитрит. Продуцирование NO частично регулируется IL-2, TNF-альфа и TNF-гамма.
В предшествующих работах отсутствуют какие-либо описания эффективных методов регуляции продуцирования окиси азота. Поэтому назревшая необходимость в разработке таких методов явилась предпосылкой создания настоящего изобретения.
Краткое описание изобретения
В одном из вариантов своего осуществления настоящее изобретение относится к рекомбинантному полипептиду, содержащему аминокислотную последовательность Т-клеточного белка, кодируемого геном 20.5.
В другом своем варианте настоящее изобретение относится к антисыворотке, продуцируемой против двух форм mCAT-2-белка.
В еще одном варианте настоящее изобретение относится к фармацевтической композиции, содержащей антисыворотку, продуцированную против mCAT-2-белков.
В другом своем варианте настоящее изобретение относится к способу ингибирования транспорта катионных аминокислот, заключающемуся в том, что человеку или другому животному вводят фармакологически эффективную дозу фармацевтической композиции настоящего изобретения.
В следующем варианте настоящее изобретение относится к способу ингибирования продуцирования окиси азота, заключающемуся во введении животному фармакологически эффективной дозы фармацевтической композиции настоящего изобретения.
В еще одном варианте настоящее изобретение относится к способу лечения патофизиологических состояний у животного, связанных с продуцированном нежелательных уровней окиси азота, причем указанный способ предусматривает введение этому животному фармакологически эффективную дозу фармацевтической композиции настоящего изобретения.
Другие варианты, преимущества и отличительные признаки настоящего изобретения очевидны из нижеследующего описания предпочтительных вариантов его осуществления, иллюстрируемых прилагаемыми ниже рисунками.
Краткое описание рисунков
Описываемые ниже рисунки представлены в целях иллюстрации различных вариантов и способов осуществления настоящего изобретения. Для большей ясности и наглядности некоторые из этих рисунков даны в схематической форме, а некоторые их фрагменты приводятся в увеличенном виде.
На рис. 1 проиллюстрирована экспрессия 5 различных SL12.4-специфических кДНК-клонов, которая была определена с помощью Нозерн-блот-анализа.
На рис.2 проиллюстрированы Саузерн-блот-гибридизации различных SL12.4-специфических кДНК-клонов.
На рис. 3 показаны ДНК и выведенная последовательность белка для кДНК клона 20.5 (mGAT-2).
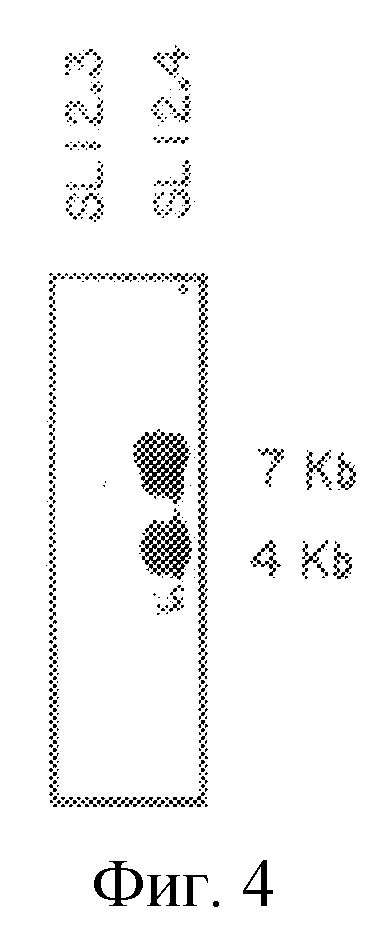
На рис. 4 проиллюстрирована экспрессия мРНК гена mСАТ-2 (обозначаемого ранее Tea) в клеточных линиях SL12.3 и SL12.4.
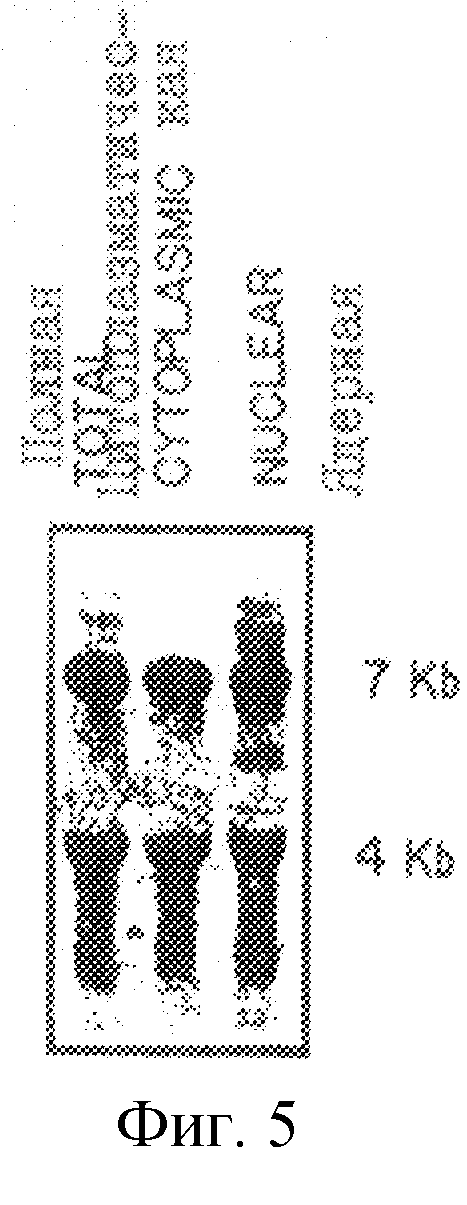
На рис. 5 проиллюстрирована экспрессия суммарной клеточной, цитоплазматической и ядерной мРНК пгСАТ-2 в клеточных линиях SL12.4.
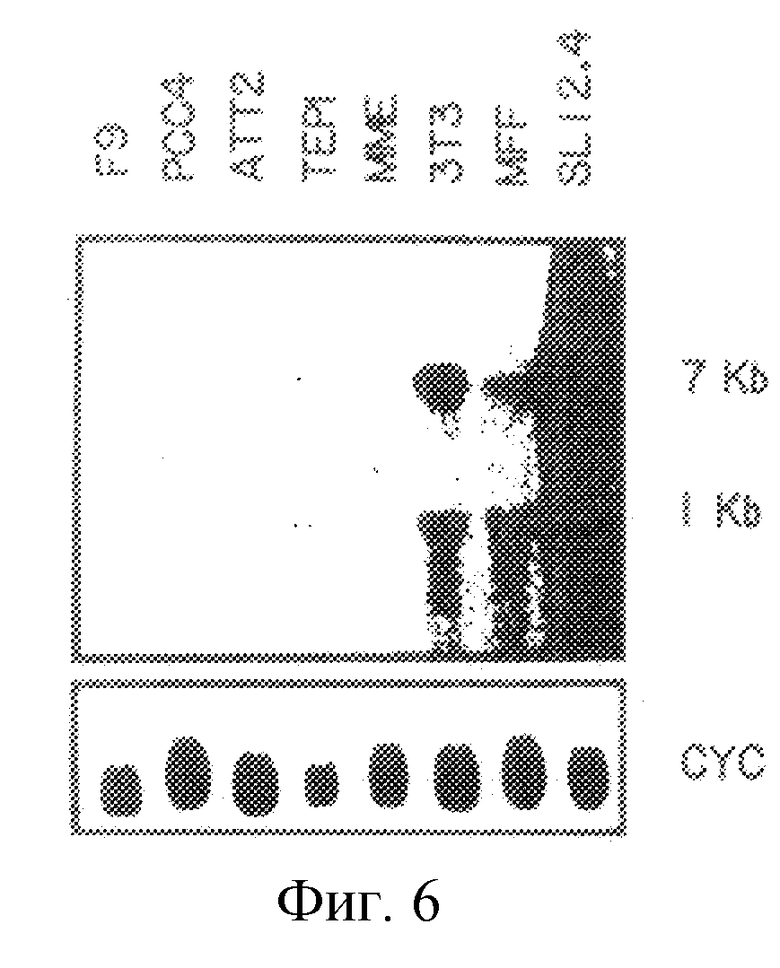
На рис. 6 проиллюстрирована экспрессия мРНК mСАТ-2 в сериях мышиных клеточных линий.
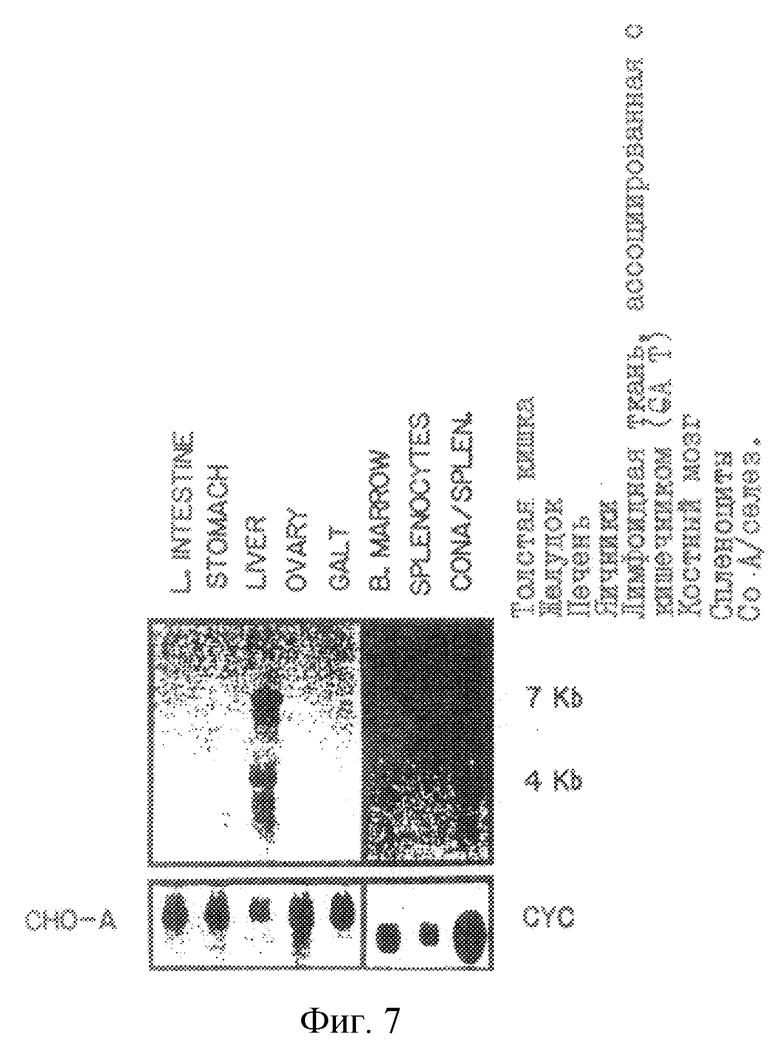
На рис. 7 проиллюстрирована экспрессия мРНК гена mСАТ-2 в указанных нормальных тканях Balb/c-мышей. CALT означает лимфоидную ткань, ассоциированную с кишечником.
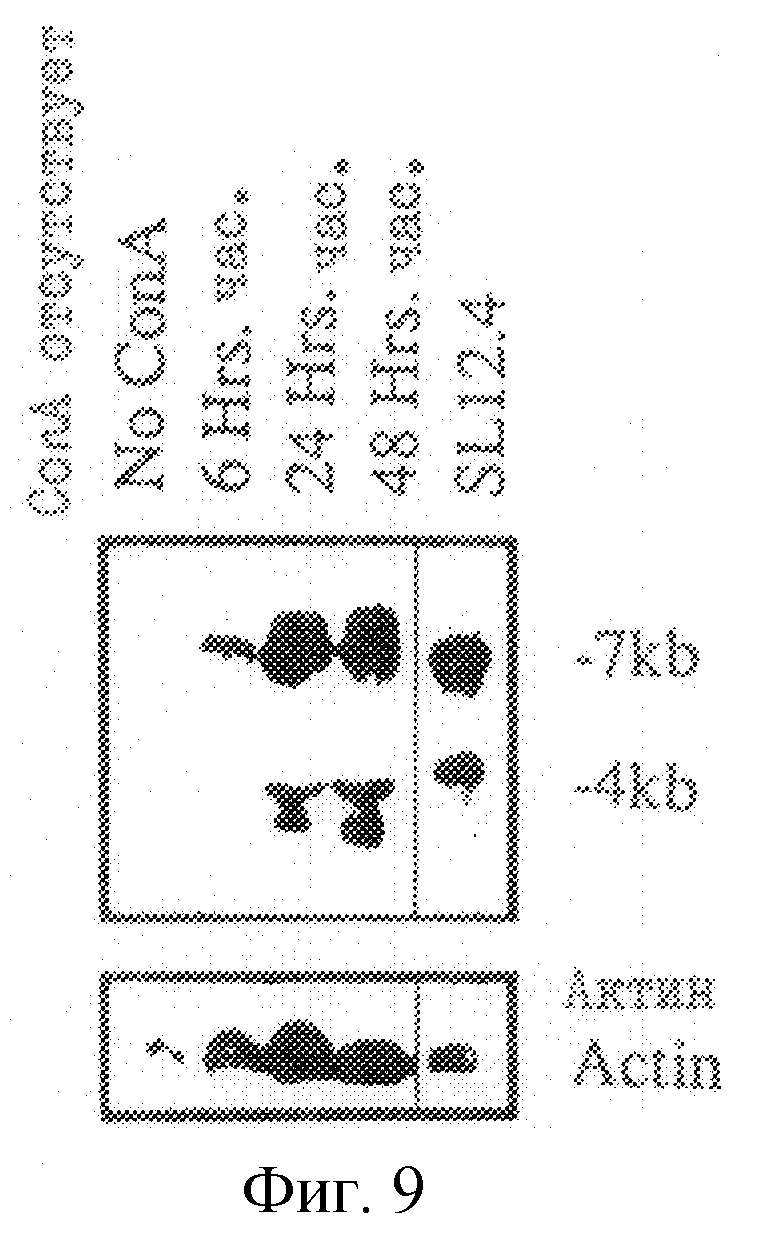
На рис.8 показана кинетика индуцирования экспрессии гена mСАТ-2 в активированных спленоцитах.
На рис. 9 проиллюстрирована кинетика индуцирования экспрессии гена Tea или mСАТ-2 в активированных спленоцитах. Контрольное зондирование указывает на относительное количество мРНК, загруженного на каждую дорожку.
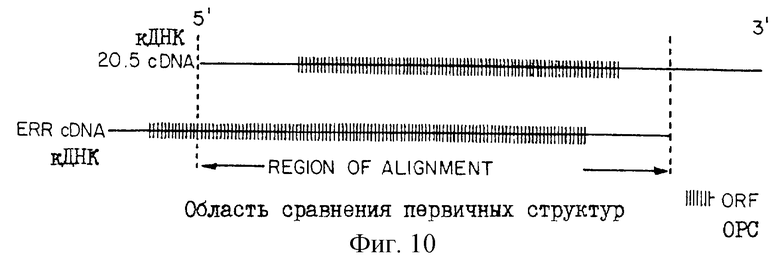
На рис.10 проиллюстрирован сравнительный анализ первичных кДНК-последовательностей 20.5 или mСАТ-2 и ERR.
На рис. 11 (A-D) сравниваются первичные последовательности кДНК 20.5 (верхняя) и кДНК KRR (нижняя).
На рис. 12 проиллюстрирован сравнительный анализ предсказанной последовательности белка, кодированного mGAT-2-геном, и последовательности экотропного ретровирусного рецептора.
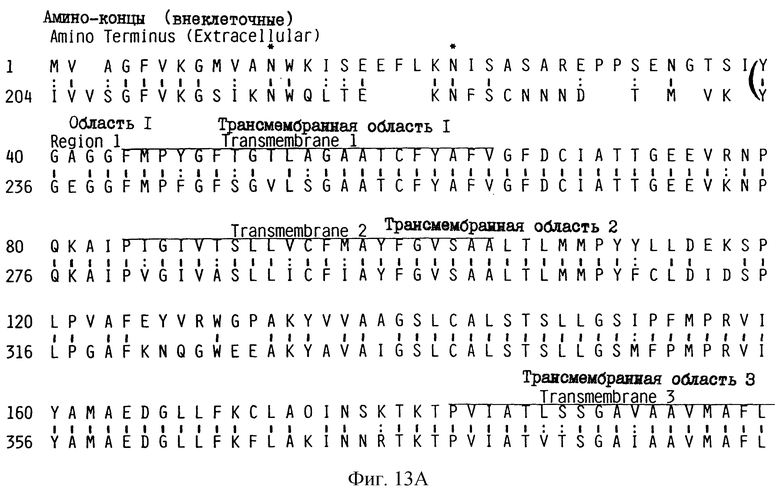
На рис.13 (А-В) проиллюстрировано сравнение предсказанной последовательности mGAT-2-белка с последовательностью экотропного ретровирусного рецептора.
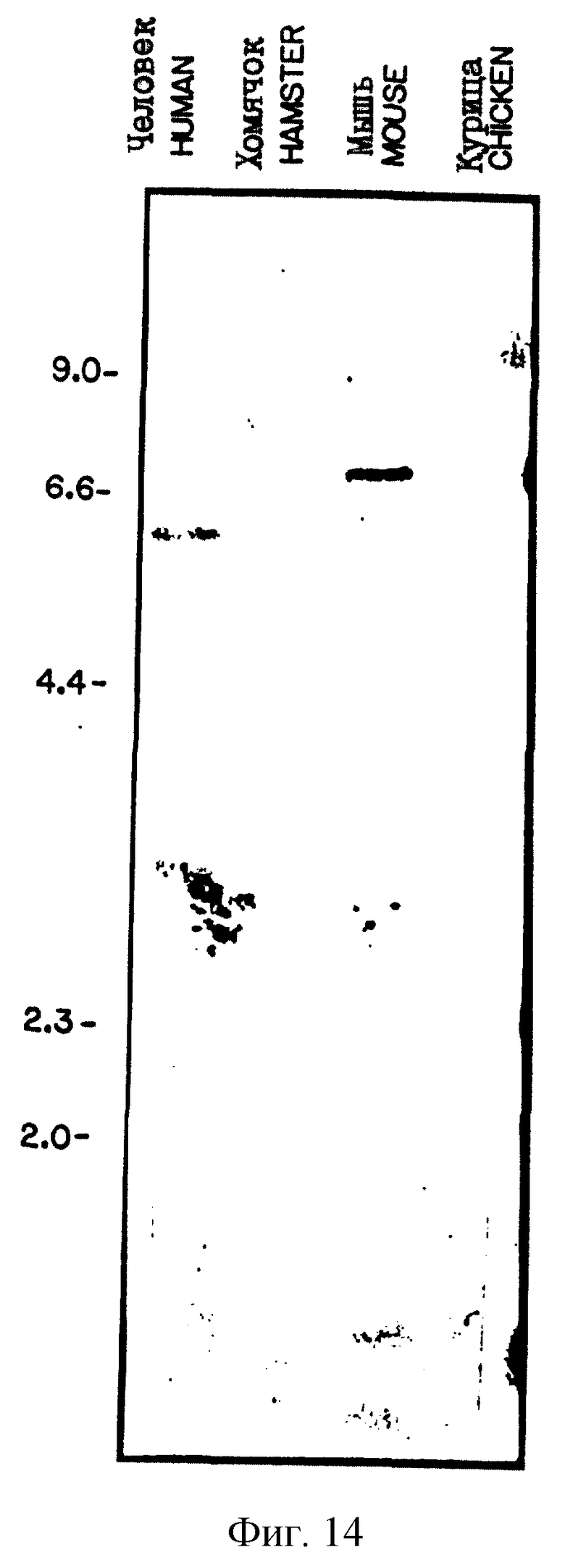
На рис.14 проиллюстрирован Саузерн-анализ ДНК от различных видов животных.
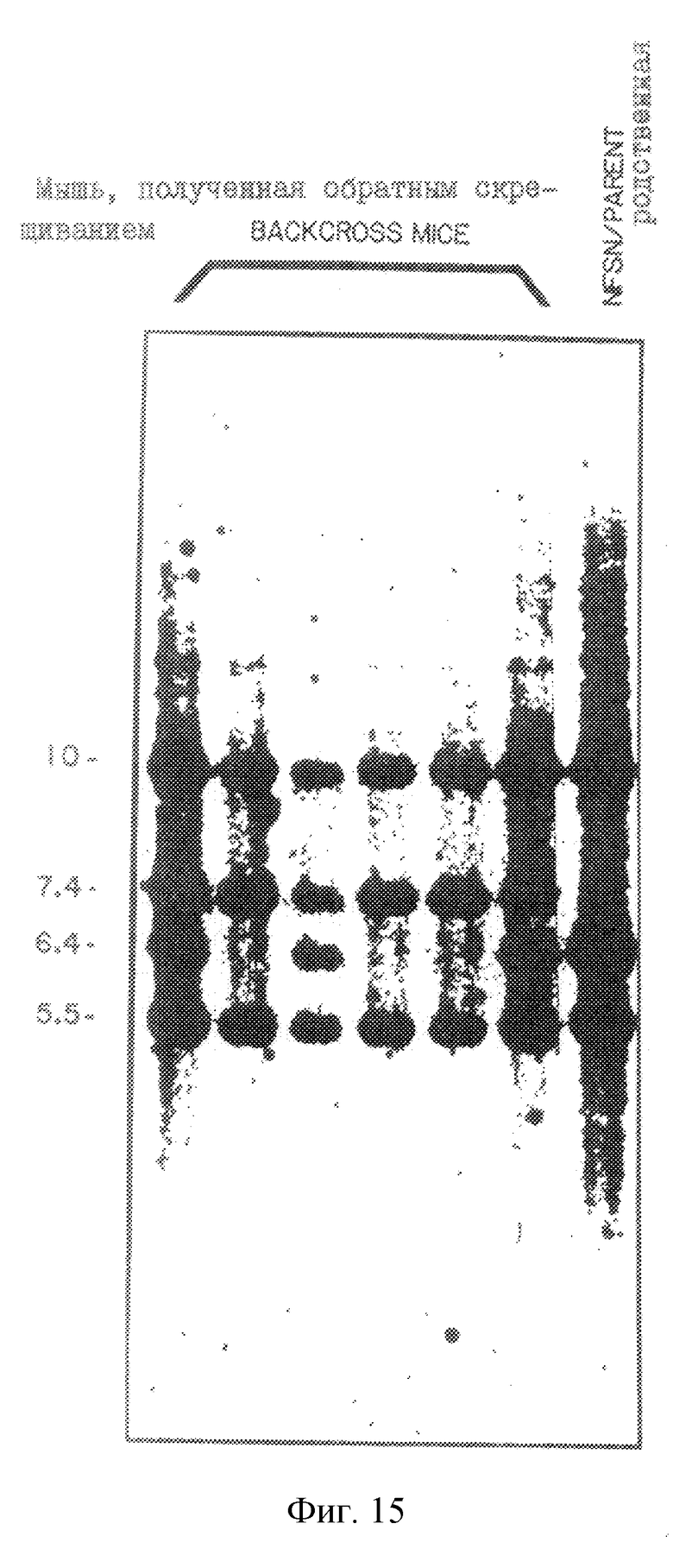
На рис.15 проиллюстрирован Саузерн-анализ рекомбинантной инбредной ДНК в положении rnCAT-2-гена на хромосоме 8.
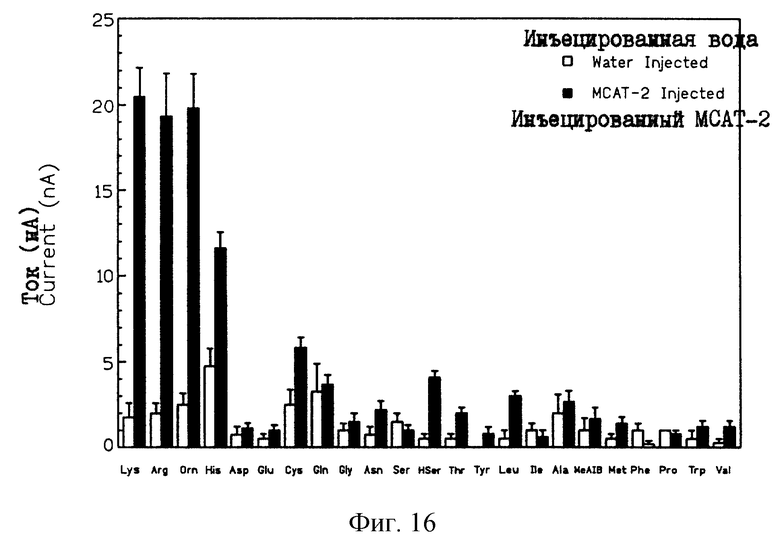
На рис. 16 проиллюстрирована субстратная специфичность mСАТ-2-опосредованного аминокислотного транспорта в ооцитах Xenopus. Транспорт оценивали путем измерения внутренних токов, зарегистрированных в ответ на 30-секундное введение 10,0 мМ аминокислоты (тирозин - 5 мМ). Эти данные были получены для 4-14 ооцитов с инъецированными 30 или 75 нг mCAT-2-кРНК или DEPC-воды. Полученные величины представляют собой средние изменения тока ± ср.кв.ош. при фиксированном потенциале около 60 мВ.
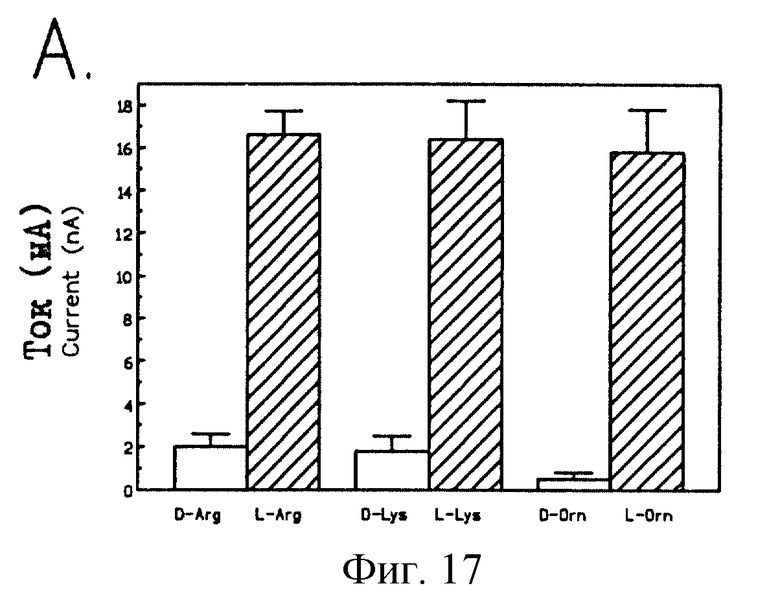
На рис.17 проиллюстрирована стерическая специфичность и степень зависимости mCAT-2-опосредованного транспорта от присутствия натрия. Стерическую специфичность оценивали в ооцитах с инъецированной rnСАТ-2-кРНК (30 или 75 нг), обработанных 1,0 мМ D- и L-изоформ аргинина, лизина или орнитина. Полученные данные представляют собой средние изменения тока ± ср.кв.ош. для 5-6 различных ооцитов (Р<0,0001 для аргинина, лизина и орнитина).
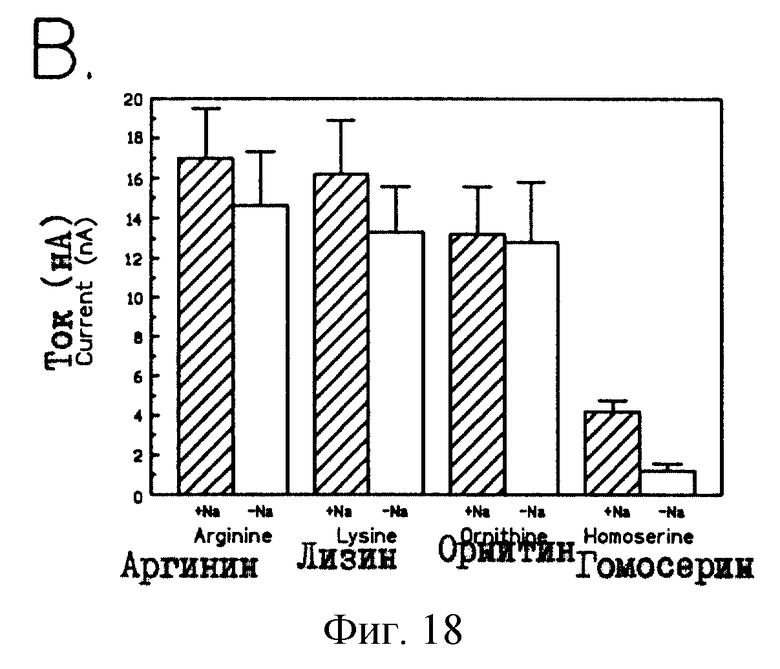
На рис.18 проиллюстрирован натрий-независимый транспорт в ооцитах с инъецированной rnСАТ-2-кРНК. Последовательность ДНК 20.5 обозначали как SEQ ID 1, а предсказанную аминокислотную последовательность обозначали как SEQ ID 2. Натрий-зависимый транспорт в ооцитах с инъецированной mCAT-2-кДНК (30 или 75 нг) оценивали посредством измерения тока в присутствии и в отсутствие натрия. Хлорид натрия заменяли эквимолярным количеством холинхлорида. Затем с использованием 5-6 ооцитов строили диаграмму среднего изменения тока ± ср. кв. ош. Фиксированный потенциал составлял ~60 мВ. Концентрации аргинина (Р= 0,5248), лизина (Р<0,4326), орнитина (0,9191) составляла 1,0 мМ, а гомосерина 10,0 мМ (Р<0,0025).
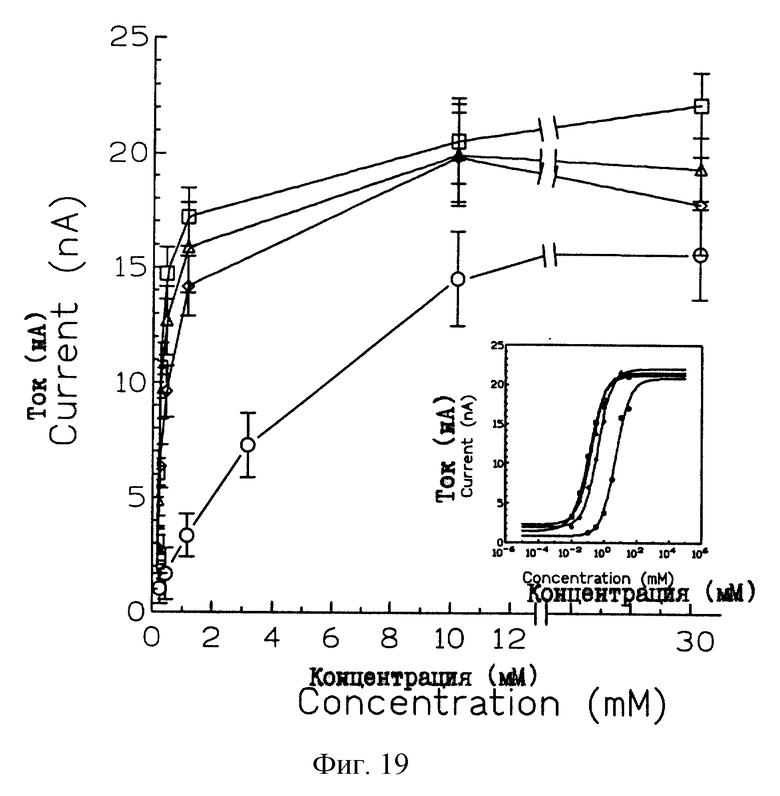
На рис. 19 показано, что mСАТ-опосредованный транспорт является насыщаемым. Ооциты с инъецированной rnCAT-2-кРНК были перфузированы при концентрациях аргинина, лизина, орнитина и гистидина от 0,01 мМ до 30,0 мМ. Полученные данные представляют собой средние изменения тока ± ср.кв.ош. для 3-7 ооцитов, в которые было предварительно инъецировано 50-200 нг rnСАТ-2-кРНК. Вставка: график линейной регрессии данных насыщения соответствует сигмоидальной кривой, построенной с использованием GraphPad-программы InPlot 4.03. С помощью указанной линейной регрессии были определены величины Iмакс и Km. Последовательность ДНК 20.5 обозначали как SEQ ID 1, а последовательность ДНК ERR обозначали как SEQ ID 3.
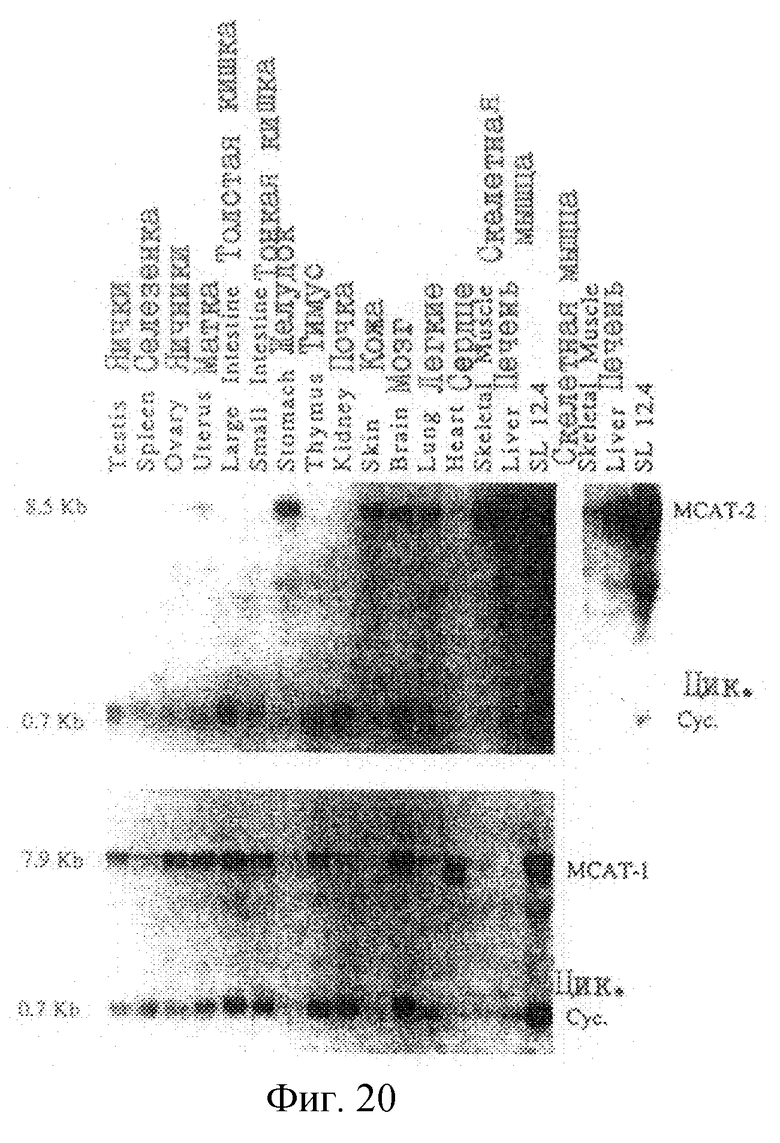
На рис.20 проиллюстрирован Нозерн-анализ mСАТ-2- и mCAT-1-транскриптов в нормальных тканях. Последовательность ДНК 20.5 обозначали как SEQ ID 8, а последовательность ДНК ERR обозначали как SEQ ID 9. Полная РНК была получена из тканей взрослых животных и из клеток лимфомы SL 12.4. Предсказанную аминокислотную последовательность белка mСАТ-2 обозначали как SEQ ID 2, а аминокислотную последовательность ERR обозначали как SEQ ID 4. Нозерн-блоты получали в дубликатах и зондировали на экспрессию, либо mСАТ-2, либо mСАТ-1. Циклофиллиновый зонд использовали для контроля на РНК-загрузку. Для иллюстрации размера транскрипта справа также показаны mCAT-2-зондированные РНК скелетной мышцы, печени и SL 12.4 при более слабом экспонировании.
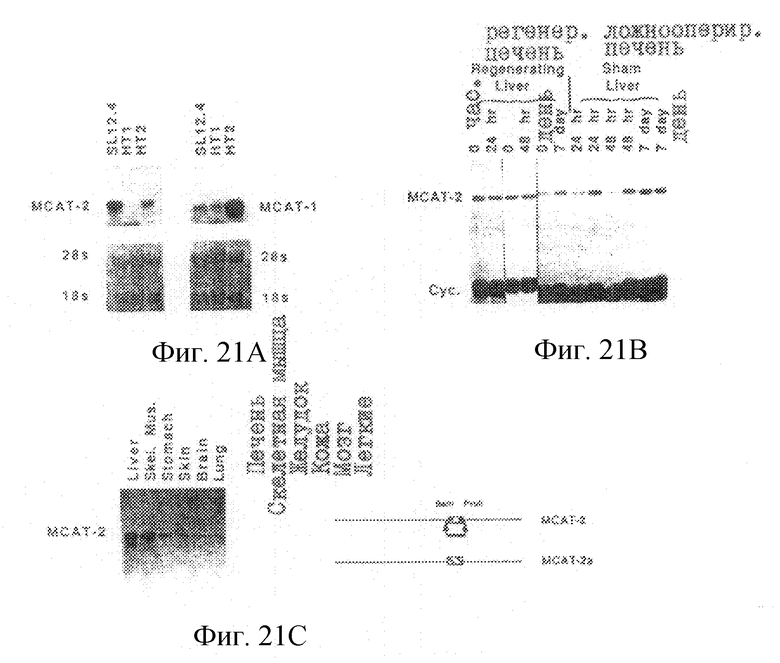
На рис. 21 (А-С) проиллюстрирован Нозерн-анализ mCAT-2-транскриптов. На рис.21 А показаны дубликатные нозерн-блоты полной РНК от клеток Т-лимфомы SL 12.4 и двух линий гепатом HTI (НТ1080С) и НТ2 (Нера 1с1с7), которые были зондированы САТ-1 и mСАТ-2, как указывается на рис. 21А. Эти блоты были окрашены метиленовым синим для иллюстрации количества 18S- и 28S -рРНК; фотографии помещены ниже авторадиограмм. На рис.21В показаны полные РНК ткани контрольной печени, регенерирующей печени и печени ложнооперированных животных. Для сравнения количества РНК, присутствующего на каждом фильтре, эти РНК были зондированы mСАТ-2 и циклофиллином (Сус). Предсказанную аминокислотную последовательность белка mСАТ-2 обозначали как SEQ ID 2, а аминокислотную последовательность ERR обозначали как SEQ ID 4. Каждая дорожка представляет РНК от отдельного животного. На рис.21С показан нозерн-блот РНК (с указанием ткани), который был зондирован с использованием 132 п.о. - mCAT-2-фрагмента, изображенного с правой стороны рис.21С в целях иллюстрации отличия этого транскипта от mСАТ-2а.
На рис.22 схематически показана структура предсказанного mCAT-2-белка.
Подробное описание изобретения
Настоящее изобретение относится к новым ДНК-последовательностям и к антисыворотке, которая связывается с белками, кодированными этими ДНК-последовательностями. В другом своем варианте настоящее изобретение относится к кДНК-клону (обозначаемому ранее 20.5 или Tea), который был переименован и назван геном mСАТ-2. mCAT-2-транскрипт был индуцирован в спленоцитах, активированных митогеном СоnА для Т-клеток.
ДНК для указанного Т-клеточного белка настоящего изобретения может быть получена от млекопитающего любого вида. При этом необходимо только, чтобы генетическая последовательность для Т-клеточных белков (TCP) экспрессировалась в прокариотическом или эукариотическом организме. Предпочтительно, если ДНК, экспрессирующая Т-клеточные белки (TCP), происходит от мыши. Особенно предпочтительной является ДНК-последовательность, кодирующая Т-клеточный белок, который является способным к иммунологической перекрестной реакции между различными видами животных (например, мышь, кролик, морской лев или человек).
Рекомбинантный Т-клеточный белок может содержать полную аминокислотную последовательность ТСР-белка либо он может содержать лишь его специфическую детерминанту. Животное, иммунизированное Т-клеточным рекомбинантным белком, будет продуцировать антитела, связывающиеся с эпитопами, присутствующими на рекомбинантных или природных полипептидах. Таким образом, может быть осуществлено промышленное продуцирование Т-клеточных рекомбинантных белков.
Благодаря настоящему изобретению может быть получено антитело против трансмембранного Т-клеточного белка, которое может быть затем использовано в качестве зонда для трансмембранных белков настоящего изобретения и в качестве ингибитора связывания натуральных лигандов с трансмембранными Т-клеточными белками настоящего изобретения, а также в качестве лекарственного средства или системы направленной доставки метки к мишени.
Настоящее изобретение относится к рекомбинантному полипептиду, включающему в себя аминокислотную последовательность Т-клеточного белка, кодированного геном 20.5, а по новому обозначению геном mСАТ-2.
Кроме того, настоящее изобретение относится к поликлональным антителам, продуцированным против белка, заявленного в п.1 формулы изобретения, а также к фармацевтической композиции, содержащей антисыворотку, заявленную в п.2 формулы изобретения.
Способы настоящего изобретения могут быть применены к любому животному. Однако наиболее предпочтительно, если новые композиции, используемые в методах настоящего изобретения, будут введены человеку.
В общих чертах, новые антителосодержащие фармацевтические композиции, используемые в методах настоящего изобретения, могут быть введены в любых дозах, ингибирующих продуцирование окиси азота у животного. Любой специалист, работающий в области фармакологии и фармакокинетики, может легко определить соответствующую дозу новой фармацевтической композиции настоящего изобретения.
В основном, способы настоящего изобретения могут быть использованы для лечения любого заболевания или патофизиологического состояния, ассоциированного с продуцированием в организме нежелательных уровней окиси азота. Способ настоящего изобретения предпочтительно использовать для лечения таких заболеваний, как саркома Капоши, церебральная малярия, синдром капиллярной проницаемости и аутоиммунные заболевания. Характерными аутоиммунными заболеваниями являются системная красная волчанка, ревматоидный артрит и рассеянный склероз.
Доза композиции настоящего изобретения, вводимая согласно методу, рассматриваемому в настоящей заявке, зависит от возраста и веса пациента, от способа конкурентной терапии (если таковая проводится) и от природы патофизиологического состояния. Эффективная композиция настоящего изобретения может быть изготовлена в виде капсул, таблеток, искусственных липидных везикул для инкапсуляции, жидких растворов, суспензий, или эликсиров для перорального введения, либо в виде жидких стерильных форм, таких как растворы, суспензии или эмульсии. При этом предпочтительно использовать инертный носитель, такой как физиологический или фостатно-буферный раствор, либо любой носитель, в котором соединения, используемые в способах настоящего изобретения, обладают соответствующей растворимостью.
Новые композиции, используемые в способах настоящего изобретения, могут быть введены в фармацевтически приемлемом носителе. В качестве фармацевтически приемлемого носителя может служить любой растворитель, с которым совместимо антитело настоящего изобретения и который является нетоксичным в количествах, вводимых пациентам. Фармакологическая доза нового соединения, содержащего антитело и используемого в способах настоящего изобретения, соответствует количеству этого соединения, ингибирующему продуцирование окиси азота.
Настоящее изобретения также относится к способу ингибирования транспорта катионных аминокислот, включая аргинин, заключающемуся в том, что человеку или другому животному вводят фармакологически эффективную дозу вышеуказанной фармацевтической композиции. Кроме того, настоящее изобретений относится к способу ингибирования продуцирования окиси азота, заключающемуся в том, что животному вводят фармакологически эффективную дозу вышеуказанной фармацевтической композиции. Существуют три вида переносчиков, осуществляющих двунаправленный катионный транспорт. Любой из этих переносчиков может быть селективно блокирован для осуществления транспорта другими переносчиками. Даже, если один из указанных видов переносчиков является доминирующим в отношении субстрата для синтеза NO, то он может быть специфически ингибирован или блокирован с использованием ДНК-последовательностей, кодирующих белок настоящего изобретения.
Для более полного понимания настоящего изобретения ниже приводятся конкретные примеры. Эти примеры даются лишь в иллюстративных целях и не должны рассматриваться как некое ограничение настоящего изобретения.
Пример 1. Выделение, характеризация и культивирование клеток
Выделение, характеризация и условия культивирования клеточных линий Т-лимдомы, SL12.1, SL12.3 и SL12.4 и образованных ими соматических клеточных гибридов подробно описаны в работах: Hays и др.. Int.,J. Cancer. 38: 597-601 (1986); MacLeod и др., Cancer Research 44: 1784-1790 (1984) и MacLeod и др., Nat. Cancer Inst 74: 875-882 (1985).
Фенотипы клеточных клонов SL12.3 и SL12.4 систематизированы в Таблице 1. Экспрессию транскриптов, синтеза поверхностного белка, онкогенность и тип опухоли определяли с помощью Нозерн-анализа, проточной цитометрии и in vivo инъекции клонированных клеток сингенным животным соответственно. 1,0 кв и 1,3 кв- TCP - β-транскрипты кодируют последовательности (D) - J-C и V - D-J-C соответственно. Глюкокортикоидный ответ определяли путем культивирования клеток в 1 мМ дексаметазоне.
Клетки лимфомы культивировали в модифицированной по способу Дульбекко среде Игла, дополненной 10% плодной телячьей сывороткой, глутамином, пенциллином и стремпомицином. Клетки от двух клеточных линий карциномы яичника человека 20008 и COLO 316 культивировали в RPMl-1640-среде, в которую были добавлены 5% плодной сыворотки теленка, глутамин и 1% Fungi-bact. В случае использования клеток для получения РНК клетки собирали во время экспоненциальной фазы роста при плотности около 5-8•105 кл./мл. Спленоциты, полученные от мышей BALB/c, высевали при плотности 3•106 кл./мл и стимулировали 20 мкг/мл СоnА за два дня до сбора РНК.
Совместное культивирование клеток SL12.4 и тимусных эпителиальных монослоев осуществляли в следующих условиях. SL12.4-клетки засевали при такой плотности, чтобы их конечная концентрация после трех дней совместного культивирования составляла 1•106 кл./мл. Через три дня TEL или TEPI достигали состояния сплошности. Клетки культивировали в модифицированной по способу Дульбекко среде Игла, содержащей 10% плодную сыворотку теленка и дополненной глутамином и пенициллином/стрептомицином, при 37oС.
Пример 2. Исследование экспрессии 20.5 или nСАТ-2 в клеточных линиях
В исследованиях экспрессии 20.5 или mСАТ-2 использовали клеточные линии эмбриональных карцином F9 и РСС4, опухоли гипофиза ATt 20, эпителия тимуса TEP1, эпителия молочной железы (АТСС 92) и МЕF. Эти клетки культивировали в модифицированной по способу Дульбекко среде Игла, дополненной 10% плодной сывороткой теленка, глутамином, пенициллином и стрептомицином. Клетки, используемые для получения РНК, собирали во время экспоненциальной фазы роста при плотности 5-8•105 кл./мл. Спленоциты, полученные от мышей BALB/c, засевали при плотности 3•106 кл/мл в RPM1 1640-среду, дополненную, как описано выше и стимулированную 10 мкг/мл СоnА за 6, 24, 48 или 72 часа до сбора РНК.
Пример 3. Клонирование и скрининг
В качестве матрицы для получения двухцепочечной (дц) кДНК использовали poly/A/+ мРНК из клеток SL12.4. К предварительно метилированной дцДНК добавляли EcoRI-линкеры. Дефосфорилированные спейсерные фрагменты λ-gt10 лигировали с кДНК и упаковывали в лямбда-фаг с использованием экстракта для упаковки (Stratagene) в соответствии с инструкциями производителей.
Субтракционную гибридизацию осуществляли следующим образом. Одноцепочечную кДНК получали из 10 мг poly/A/+ РНК SL12.4 с использованием 250 мкС 32Р dCTP (Amersham) в присутствии 100 мкг/мл актиномицина D и гибридизовали при Rot 1260 (моль нуклеотидов/литр•сек) с 25 мг poly/A/+ РНК от SL12.3-клеток в объеме 8 мл, при 68oС, в течение 18 часов. После гибридизации оц кДНК собирали путем хроматографии на колонке с гидроксиапатитом. Из 1 мкг исходной SL12.4-кДНК получали приблизительно 120 нг кДНК (12% от исходной кДНК, содержащей 3•10 имп. /мин) и использовали для зондирования двух 150 мм-нитроцеллюлозных фильтров, содержащих 20000 λ-gt 10-бляшек на фильтр. Первый из двух дубликатных фильтровальных отборов из SL12.4 λ-gt 10-библиотеки зондировали полной кДНК, полученной из мРНК SL12.3, а второй фильтровальный отбор зондировали с использованием субтракционно-обогащенной кДНК SL12.4, полученной как описано выше. Очищенные методом бляшек клоны λ-фага были идентифицированы как SL12.4-cпeцифичecкие посредством двух скринингов (с использованием отдельно полученных субтракционных зондов), после чего эти клоны подвергали Нозерн-анализу для того, чтобы убедиться, что они гибридизируются только с мРНК от клеток SL12.4, но не от клеток SL12.3. ДНК-вставки удаляли из λ-ДНК путем переваривания рестрикционными ферментами HindIII и BgIII, выделяли на легкоплавкой агарозе (Sea Kem) и субклонировали в плазмидном векторе рТ7/Т3 (Bethes da Research Laboratory), переваренном ферментами HindIII и BamHI. Эти вставки не могли быть вырезанными из фага с помощью фермента EcoRI, поскольку во всех изолятах EcoRI-сайты были разрушены.
Пример 4. Нозерн-блот-анализ
Полную клеточную РНК выделяли из клеточных линий и тканей с помощью гуанидинизоцианатного метода (Maniatis и др., в "Molecular Cloning: A Laboratory Manual. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1983)), модифицированного как описано Wilkinson и др. (EMBO J. 7:101-109(1988)). Для осуществления Нозерн-анализа 10 мкг РНК подвергали электрофорезу в 1% агарозном геле, содержащем формальдегид, а затем переносили на нитроцеллюлозные мембраны.
Равную загрузку и перенос РНК на дорожку оценивали путем окрашивания акридиновым оражевым и гибридизации с кДНК актина, СНО-А и/или циклофиллина. Нозерн-блоты гибридизовали с произвольно праймированным (Amersham) 32Р-меченным кДНК-вставками в присутствии 10% декстрансульфата и 50% формамида (12-18 час при 42oС), а затем постадийно промывали с конечной 30-минутной промывкой в 0,1% SSPE, 0,1%ДСН при 42oС или 50oС. Для удаления меченного зонда РНК-блоты промывали 0,IX SSPE и 0,1% ДСН при 90oС, охлаждали до комнатной температуры, осушали воздухом и хранили в условиях вакуума до использования в последующей гибридизации. Для проведения Нозерн-блот-анализа РНК mСАТ-2 (20.5 или Tea) из SL12.4, SL12.3 и свежих тканевых препаратов, полученных от Balb/ о-мышей, выделяли полную клеточную РНК с использованием гуанидинизотиоцианатного метода. Цитоплазматическую или ядерную РНК получали, как описано выше для Нозерн-анализов. 10 мкг РНК подвергали электрофорезу в 1% агарозном геле, содержащем формальдегид, а затем переносили на нитроцеллюлозные мембраны.
Пример 5. Саузерн-блот-анализ
Полную клеточную ДНК выделяли из клеток Т-лимфомы, соматических клеточных гибридов мыши и хомячка, и из тканей от других видов животных, а затем переваривали рестрикционными ферментами в соответствии с рекомендациями поставщиков. 10 мкг переваренной ДНК наносили на каждую дорожку 0,7% агарозного геля, подвергали электрофорезу и блотировали на носителя Nytran, после чего гибридизировали и промывали, как описано выше для Нозерн-блот-анализа. Саузерн-блот-анализ 20.5 проводили в соответствии с процедурой, описанной выше, за некоторыми исключениями, указанными ниже. Полную клеточную ДНК выделяли из SL12.4-клеток печени мыши и хомячка, и из соматических клеточных гибридов. ДНК от кур и человека получали в виде коммерческих препаратов, поставляемых Cionetec, Palo Alto, CA. Полученные ДНК переваривали рестриктирующими ферментами, как указано выше. 10 мкг переваренной ДНК наносили на каждую дорожку 0,8% агарозного геля и в течение, по крайней мере, 48 часов подвергали электрофорезу в Трис-ацетатном буфере, после чего блотировали на носителе Nytran, гибридизовали и промывали, как описано выше для Нозерн-блот-анализа. Блоты, содержащие ДНК от других видов, промывали в условиях более низкой жесткости; при этом конечную промывку осуществляли 2 х SSPE при комнатной температуре.
Пример 6. Выделение новых кДНК-клонов с использованием субтракционно-обогащенного дифференциального скрининга
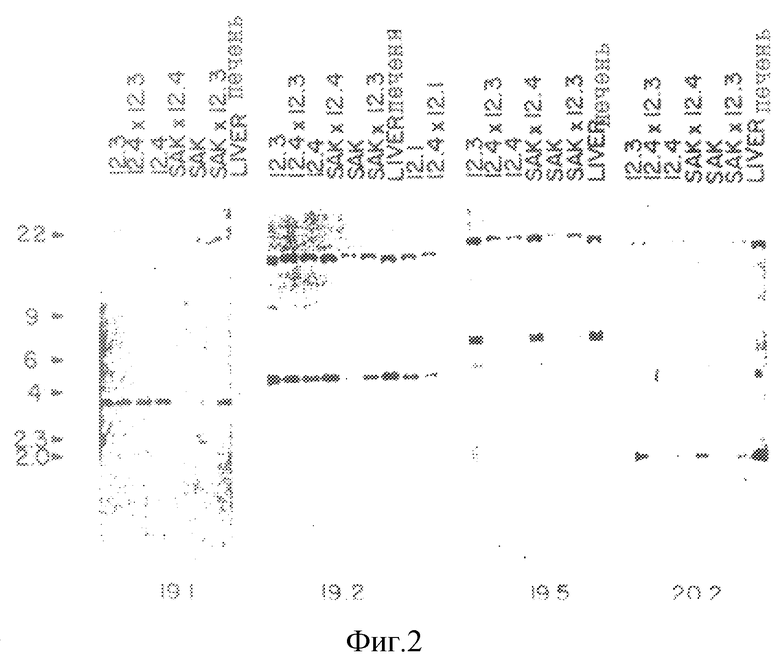
Нозерн-блоты РНК из клеток SL12.3 и SL12.4 показали, что выделенные кДНК-клоны были дифференциально экспрессированы в клетки SL12.3 и SL12.4, как показано на рис.1. Вставки, выделенные из соответствующих SL12.4 - Т-клеточно-специфических кДНК-клонов, подвергали мечению и использовали для зондирования Нозерн-блотов. Как показано на рис.1, каждая дорожка содержала 10 мкг полной клеточной РНК от клеточных линий SL12.4 и SL12.3. Затем был зондирован блот, содержащий указанную радиоактивно меченную кДНК-вставку. Стрелки указывают на относительную подвижность 18S-и 28S-pPHK-транскриптов. Как было определено путем гибридизации с СНО-А-зондом, количества загруженной РНК SL12.3 и SL12.4 на дорожку эквивалентны.
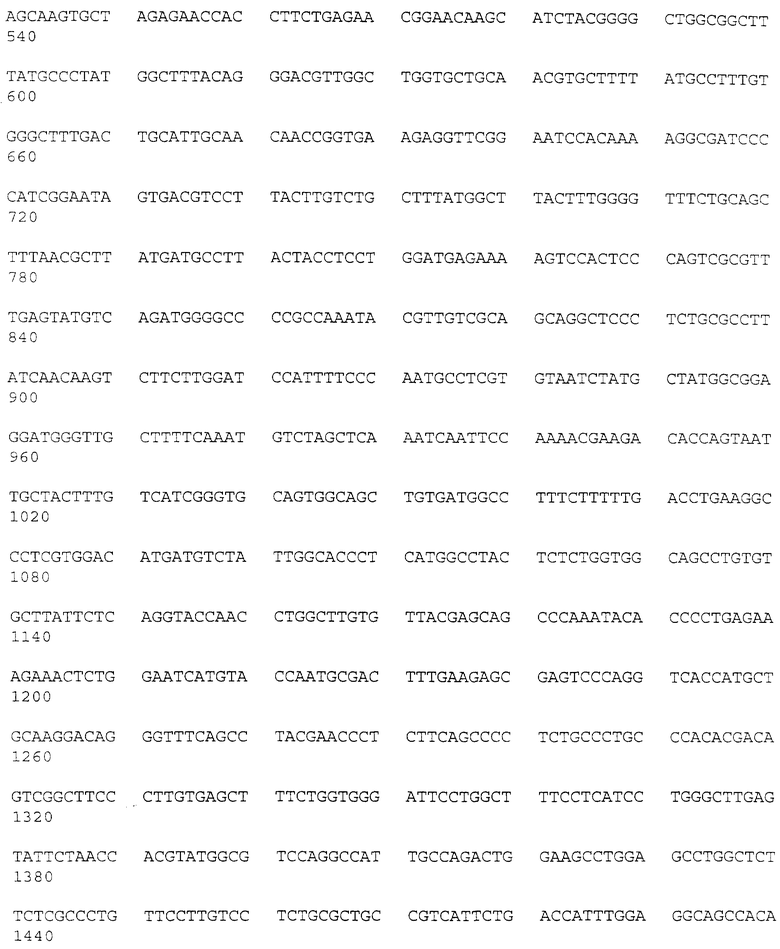
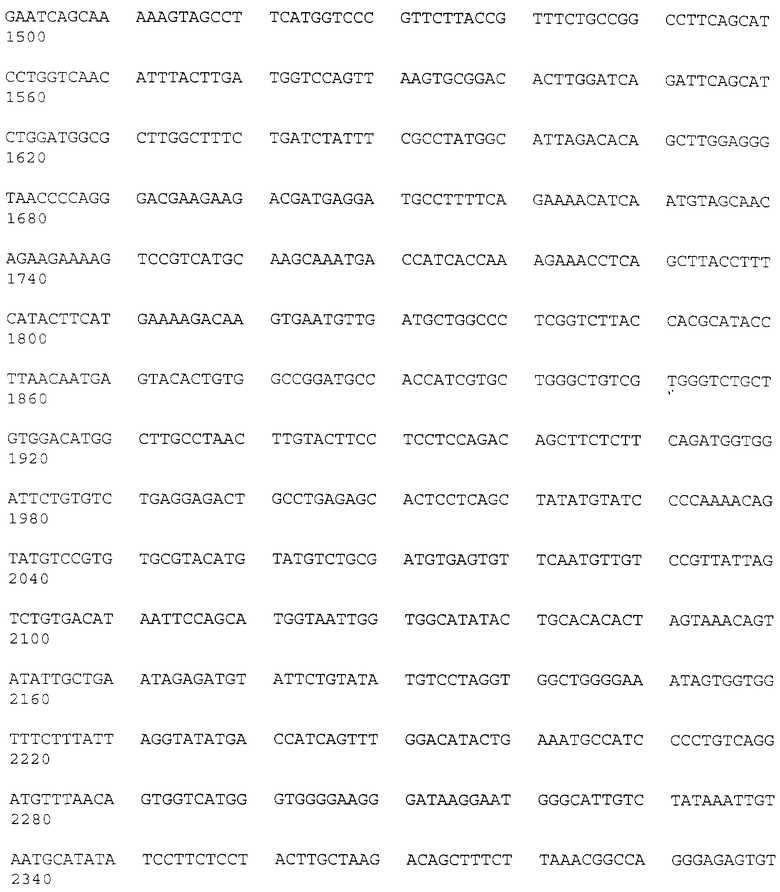
Геномную ДНК из клеток SL12.3 и SL12.4 и ДНК нормальной печени переваривали ферментами EcoRI, HindIII или PstI и анализировали с использованием очищенных вставок-зондов к кДНК-клонам. На рис.2 проиллюстрирована Саузерн-блот-гибридизации SL12.4-cпeцифичecкиx кДНК-клонов. Геномную ДНК (10 мкг на дорожку) из клеточных линий мышиной печени АКР, SL12.3, SL12.4 и клонированных клеток Т-лимфомы SAK, а также из гибридных клеток SL12.3 х SL12.4, SAK х SL12.4, SAK х SL12.3, переваривали ферментом EcoRI и анализировали путем Саузерн-блот-гибридизации с вышеуказанным кДНК-клоном. Сбоку указаны размеры фрагментов в тыс. пар оснований (кв), определенные путем совместной миграции HindIII-переваренной λ-ДНК. Один или несколько рестрикционных фрагментов распознавались зондами, что свидетельствовало о том, что соответствующие гены присутствуют при небольшом числе копий в геноме обеих мышиных клеточных линий. На всех дорожках интенсивность гибридизации была одинаковой, что свидетельствовало о том, что гены присутствуют в SL12.3-клeтoчнoй ДНК примерно в одинаковых количествах и без заметной реаранжировки (как было показано с использованием четырех различных ферментов) (рис.2). Отсюда следует, что, по всей вероятности, различия в экспрессии генов в SL12-клеточных клонах обусловлены клеточно-специфической регуляцией, а не потерей генов или их значительной реаранжировкой. Однако при этом не исключена возможность небольших реаранжировок или точечных мутаций в SL12.3-клетках. SL12.4-cпeцифичecкий кДНК-клон 20.5 (mCAT-2) был полностью секвенирован. Последовательность этого гена показана на рис.3.
Пример 7. Конструирование кДНК-библиотеки, скрининг и анализ последовательности
Конструирование кДНК-библиотеки и скрининг на присутствие гена 20.5 или САТ-2 осуществляли, как описано выше. КДНК-вставку выделяли из лямбда-ДНК путем переваривания рестрикционными ферментами HindIII и BgIII и субклонировали в плазмидный вектор рТ7/13. Затем строили рестрикционную карту и фрагменты субклонировали в плазмиду рТ713, очищенную на хлориде цезия и непосредственно секвенированную дидезокси-методом с использованием секвеназных реагентов (U. S. Biochemical Corp. Cleveland. Ohio). Часть последовательности определяли с использованием праймеров для плазмиды хозяина и других специфических олигонуклеотидных праймеров (17-меры) для кДНК, полученных из UCSD Cancer Ctnter Core Molecular Biology Facility. Обе ДНК-нити были секвенированы во всей их полноте и вся последовательность была определена, по крайней мере, в двух реакциях, осуществленных в дубликате. Для сбора информации в перекрывающихся последовательностях и для осуществления начального анализа ДНК-последовательности использовали компьютерные программы Microgenie. Для выделения полных клонов получали новую кДНК-библиотеку с использованием первоначального mCAT-2-клона. При этом было получено семь новых клонов.
Пример 8. Выделение и секвенирование последовательностей кДНК-клона 20.5 или mСАТ-2
SL12.4-кДНК-библиотеку из 40000 членов в лямбда-gt10 скринировали с использованием SL12.4-кДНК-зонда, субтрактированного в отношении SL12.3-MPHK, и одновременно на дубликатных фильтрах с использованием полной SL12.30кДНК, как описано выше. Для характеризации гена 20.5 использовали метод скрининга. Исходя из характеристик его экспрессии кДНК-клон, описанный выше, был сначала обозначен Теа-геном (Теа-Т, ceII early activation, т.е. ранняя активация Т-клеток). Затем, как описано ниже, этот ген был переименован в ген mСАТ-2. Вставку из этого клона секвенировали по обеим нитям с использованием дидезокси-метода (последовательность этого гена показана на рис.3). Указанная кДНК-вставка имеет длину 2397 п.о. и содержит одну длинную открытую рамку считывания, начинающуюся с 409 п.о. и простирающуюся до 1769 п.о. кДНК не содержит сигнала полиаденилирования или poly А-область. 20.5-кДНК-последовательность позволяет предсказать синтез трансмембранного белка сложной структуры. На рис. 3 показана 453-аминокислотная последовательность предсказанного белка, молекулярная масса которого составляет 49,57 кДа (немодифицированный). Указанная ДНК, очевидно, содержит полную кодирующую область, поскольку предсказанный N-концевой метиониновый кодон находится в окружении консенсусной последовательности Kozak (CXC AUGG, где Х может быть A, U, G или С), которая представляет собой оптимальный сайт инициации трансляции; а предсказанные 5'- и 3'-нетранслируемые области содержат несколько стоп-кодонов во всех трех рамках считывания. Позже эти данные проверялись с использованием новых кДНК-клонов. Физические свойства предсказанного белка были проанализированы с использованием программ Microgenie и PC. Три потенциальных сайта N-гликозилирования показаны звездочками на рис.4-7. Предсказанный белок имеет 9 в высокой степени гидрофобных областей (подчеркнуты на рис. 3), причем 7 из них имеют свойства трансмембранных доменов (исходя из анализа с использованием программ системы программного обеспечения IntelliGenetics: SOAP HELIXMEM, NOVOTNY и RAOARGOS).
Ген Tea и mCAT-2 дифференциально экспрессируется в клетках Т-лимфомы и в активированных Т-лимфоидных клетках нормальной селезенки. Бала проанализирована экспрессия траскриптов, распознаваемых 20.5-кДНК-клоном. Экспрессия Теа-гена проиллюстрирована на рис.3. Очищенную вставку, содержащую полную кодирующую область, метили 32P путем рандомизированного праймирования и использовали для зондирования Нозерн-блотов, где каждая дорожка содержала 10 мкг полной клеточной РНК (либо, в случае панели В, цитоплазматической и ядерной РНК) от клеток SL12.4 и SL12.3 (все указанные клеточные линии или ткани были взяты от нормальной Bakb/c-мыши). Авторадиограммы Нозерн-блотов показаны на рис.4-7. На рис.4 проиллюстрировано сравнение экспрессии Tea или mСАТ-2 в клеточных линиях SL12.3 и SL12.4. На рис.5 проиллюстрирована экспрессия Tea или mСат-2-мРНК в полной, цитоплазматической и ядерной РНК от клеток SL12.4. На рис.6 проиллюстрирована экспрессия Теа-мРНК в сериях мышиных клеточных линий, описанных в тексте, а на рис.7 показана экспрессия РНК от нормальных тканей Balb/c-мышей (GALT означает лимфоидную ткань, ассоциированную с кишечником). На каждой панели указан размер транскриптов (в тыс. пар оснований, кв), который был оценен посредством их относительной миграции по отношению к BPL-маркерам и эндогенным рибосомным РНК 18S и 28S. Эквивалентную загрузку и перенос РНК на всех дорожках оценивали путем окрашивания акридиновым оранжевым и путем гибридизации с 32Р-циклофиллин (Сус)- и/или 32Р-Cho-А-меченной кДНК.
20.5-кДНК-зонд распознавал два транскрипта приблизительно 4,5 кв и 8,5 кв, которые присутствовали в клетках SL12.4, но отсутствовали в клетках Т-лимфомы SL13.2 (рис.4). Был проведен анализ на субклеточную локализацию этих двух транскриптов для того, чтобы определить, являются ли они оба зрелыми транскриптами, обнаруженными в цитоплазме, либо более крупная РНК является ядерным предшественником. Очевидно, что оба транскрипта являются полностью процессированными РНК, поскольку они обнаружены в цитоплазме (рис.5). Происхождение этих двух транскриптов пока не ясно; они могут быть продуцированы в результате альтернативной инициации транскрипции, альтернативного сплайсинга транскрипта или утилизации альтернативных сигналов полиаденилирования. Оба зрелых цитоплазматических транскрипта (8,5 и 4,5 кв) являются более крупными, чем кДНК-клон. Таким образом, кДНК является неполной, хотя, по-видимому, и содержат полную кодирующую область. Оба траскрипта обнаруживали с помощью зондов, полученных 5'-области (нуклеотиды 1-380) и 3'-области (нуклеотиды 2005-2394) кДНК-клона, что свидетельствует о том, что указанный кДНК-клон не является артефактом клонирования, который соединяет два различных транскрипта. Помимо этих двух зрелых РНК было обнаружено несколько более крупных и гораздо в меньших количествах транскриптов, присутствующих в ядерных и суммарных РНК-препаратах, которые могут быть несплайсированными или частично спланированными ядерными предшественниками (рис.5). Полученные результаты послужили поводом для последующего скрининга новой SL12.4-кДНК-библиотеки и выделения дополнительных кДНК-клонов.
Несколько мышиных клеточных линий, происходящих от эмбриональной ткани (F9 и РСС4), эпителия молочной железы (ММЕ) и нервной ткани (ATt20), анализировали на экспрессию Теа-РНК. Ни одна из этих клеточных линий не обнаруживала заметной экспрессии Теа-РНК. В противоположность этому клеточные линии, происходящие от эпителия тимуса (TEPI), и фибробласты (ЗТЗ, МЕF) содержали мРНК Tea, хотя и в гораздо меньшем количестве, чем клетки Т-лимфомы SL12.4 (рис.6).
Для того, чтобы определить экспрессирует ли Теа-ген нормальные ткани и клетки лимфоидной линии дифференцировки, были исследованы Нозерн-блоты, полученные от мРНК мышиных тканей. Клетки тимуса, неактивной селезенки, лимфоидной ткани, ассоциированной с кишечником (CALT), и костного мозга не обнаруживали заметной экспрессии Теа-мРНК (рис.7). Однако Теа-транскрипты были индуцированы в нормальных клетках селезенки, активированных Т-клеточным митогеном, колнканавалином A (Con А, рис.7). Con A использовали для имитации активации Т-клеток селезенки, которая обычно происходит в клеточном клоне специфическим образом после соответствующей презентации чужеродного антигена. Из нелимфоидных тканей лишь ткани печени экспрессировали умеренное количество Теа-мРНК. Теа-транскрипты не были обнаружены в кишечнике, желудке, яичниках (рис.7), головном мозге, сердце, легких, почке, поджелудочной железе или яичках. Таким образом, экспрессия Теа-гена ограничена лишь определенными типами клеток, таких как клетки активированной селезенки, эпителиальные клетки тимуса, клетки Т-лимфомы и клетки печени.
Пример 9. Индуцирование Теа-мРНК
РНК получали через 6, 24 и 72 часов после добавления Con А к спленоцитам. На рис. 8 показана кинетика индуцирования Теа-гена в активированных спленоцитах. Осуществляли Нозерн-анализ РНК от неактивированных и активированных клеток селезенки, собранных через вышеуказанные промежутки времени после активации Т-клеточным митогеном Con А. На рис.8 конечный интервал после добавления Con A составляет 72 часа, а на рис.9 показаны различные блоты РНК вместе с контрольным зондированием циклофиллином (Сус) для иллюстрации относительного количества мРНК, загруженной на каждой дорожке. В отличие от Сус-мРНК загрузка рРНК на каждой дорожке была одинаковой, как было показано путем окрашивания акридиновым оранжевым. Теа-транскрипты не были обнаружены в лимфоцитах неактивированной селезенки, но через 6 часов было обнаружено некоторое их количество, которое достигало максимального значения примерно через 48 часов. Хотя полное количество РНК на каждой дорожке одинаково (10 мкг) (как показало окрашивание акридиновым оранжевым), однако отношение рибосомной РНК к мРНК, очевидно, меняется в процессе активации Т-клеток, поскольку количество актинового, СНО-А- и циклофиллинового траскриптов (10 мкг суммарной РНК) возрастает (рис.8). При этом индуцирование экспрессии Теа-гена по отношению к контрольной РНК в процессе активации Т-клеток совершенно очевидно.
Пример 10. Гомология 20.5-ДНК и АА-последовательности с мышиным ERR
Поиски гомологичных последовательностей, проводимые с использованием базы данных Bionet, не обнаружили какого-либо значительного сходства между 20.5-кДНК и другими известными ранее ДНК-последовательностями. Однако сравнение этой последовательности с кДНК-клоном мышиного экотропного ретровирусного рецептора (ERR) показало значительную идентичность последовательностей. Ген, который кодирует экотропный ретровирусный рецептор, было обозначен Rec-1, a теперь переименован mСАТ-1. На рис.10 области ERR- и 20.5-кДНК-последовательностей, включенные в сравнительный анализ, отмечены вертикальными линиями. Для каждой кДНК указаны открытые рамки считывания. На рис. 11 полная кДНК-последовательность 20.5 показана в верхней строке каждой пары линий, а кДНК-последовательность ERR показана в нижней строке; причем в ERR-кДНК-последовательности (п. о. 400-2425) отсутствуют, первые 400 п.о. горизонтальные линии указывают положения, в которых последовательности являются идентичными. Это сравнение было проведено с использованием программного обеспечения Microgenie и с соответствующими пробелами, которые были сделаны для выявления последовательностей с наибольшим сходством. Процент идентичности вычисляли лишь для явно перекрывающихся кДНК-областей. 20.5-кДНК является гораздо более длинной у 3'-конца, а ERR-кДНК является значительно более длинной у 5'-конца.
На схеме, изображающей две кДНК, видно, что ERR-кДНК длиннее у 5'-конца, а 20.5-кДНК значительно длиннее у 3'-конца; причем эти две кДНК имеют сходство по всей своей длине. Кодирующая область обозначена заштрихованной частью каждого кДНК-клона. Сравнительный ДНК-анализ первичных структур показал, что идентичность ДНК-последовательностей между перекрывающимися областями 20.5-кДНК (п.о. 1-2047) и ERR-ДНК (п.о. 400-2425) составляет 59%; а одна область 20.5-кДНК (п.о. 1011-1088) является идентичной на 80%. 5'-некодирующая область 20.5-кДНК-последовательности (п.о. 1-410) на 68% идентична перекрывающейся 5'-кодирующей области ERR-кДНК-последовательности, что позволяет предположить, что эти два гена произошли от общей последовательности в результате дупликации гена.
Теа-белок имеет структурное сходство с предсказанным ERR-белком, происходящим от ERR-кДНК-последовательности. Сравнительный анализ Теа-белка с ERR-белком обнаружил две области с высокой степенью сходства аминокислот (рис. 7). На рис.7 проиллюстрирован сравнительный анализ последовательности Теа-белка с последовательностью мышиного экотропного ретровирусного рецептора. На рис.7 схематически показаны сравниваемые области двух предсказанных белковых продуктов; при этом Теа-белок простирается от 1 до 404 аминокислоты, а ERR-белок простирается от 204 до 603 аминокислоты. На рис.13 аминокислотная последовательность предсказанного белка, кодируемого 20.5-кДНК, показана в верхней строке, а белка, кодируемого ERR-кДНК, - в нижней строке. Две области, обозначенные жирными скобками на рис.13, обнаруживают высокую степень идентичности: Область 1 (192 аминокислот) показала идентичность 81,3%, а Область 2 (79 аминокислот) показала идентичность 51,9%. Область 1, обозначенная в скобках, обнаруживает идентичность последовательностей на 81% и схожесть аминокислот (на протяжении 193 а.к.) на 91%. Область 2 имеет идентичность последовательностей на 62%, а схожесть (на протяжении 60 аминокислот) на 75%. Различия консервативных аминокислот обозначены двумя точками между ними, а идентичность аминокислот показана сплошной черточкой между ними.
Пример 11. Картирование mCAT-2-гена в хромосоме 8
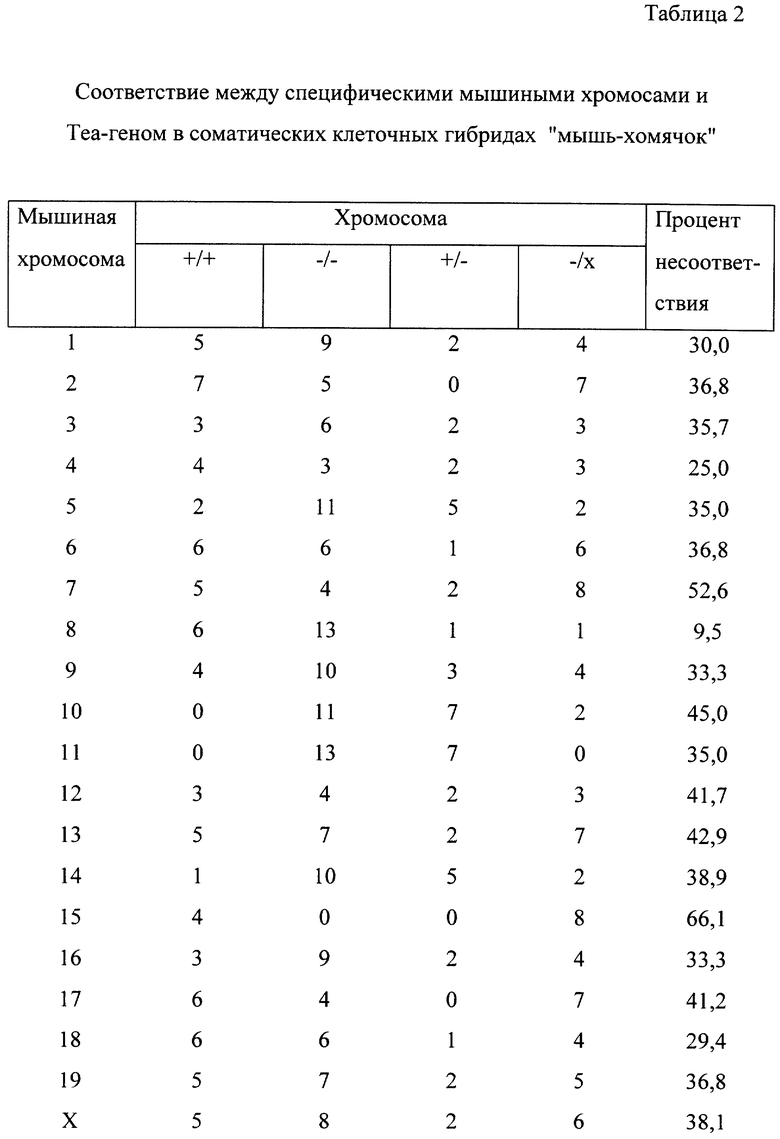
Продуцирование и характеризация соаматических клеточных гибридов "китайский хомячок-Х-мышь" описаны Hogga и др., J. Virol., 62: 1055-1056 (1988). Короче говоря, мышиный штамм NFS/N был получен от Division of Natural Resources, NIH, Bethesda, MD. Домовых мышей (Mus Musculus) получали из лабораторных колоний, происходящих от мышей, первоначально пойманных в Скиве (Дания) и содержавшихся затем под наблюдением д-ра М. Поттера (NCl, NIH, Cjntract NOI-CB2-55894) в лаборатории Hazelton Laboratories, Roclville, MD. Самки гибридных мышей "NFS/Nx X.m." были подвергнуты обратному скрещиванию с самцами домовых мышей, в результате чего были получены экспериментальные животные. Из печени этих мышей экстрагировали ДНК, которую затем переваривали ферментами Sacl и Bam HI, подвергали электрофорезу в 0,4% агарозном геле в течение 48 ч при 24 В и переносили на найлоновые мембраны (Hybond N+, Amersham). Мембраны гибридизировали с [32Р]-меченной 20.5-кДНК и с 438 п.о.-зондом, представляющим ген ДНК-полимеразы В, присутствующий на хромосоме 8. После этого мембраны промывали и зондировали. Образцы, взятые от почек тех же самых мышей, типировали на наследование маркеров Cu-I и Es-I путем гистохимического окрашивания после электрофореза на крахмальных гелях.
Поскольку ERR-генный продукт функционирует как вирусный рецептор, то осуществляли картирование Теа-гена для того, чтобы определить, присутствует ли он на хромосоме, о которой известно, что она кодирует один из других известных ретровирусных рецепторов. Каждый из нескольких различных соматических клеточных гибридов, образованных между клетками китайского хомячка и мыши, сохранял ограниченное число различных мышиных хромосом. Эти гибриды были использованы для картирования Теа-гена. Саузерн-анализ ДНК, полученных от гибридных клеток и переваренных ферментом Pst I, показал, что 7 из 21 гибрида содержали мышь-специфические ДНК-фрагменты. Сравнение известного содержания мышиных хромосом посредством положительной гибридизации с мышь-специфическими ДНК-фрагментами показало наилучшую корреляцию с мышиной хромосомой 8 (Таблица 2).
Картирование Tea-гена проводили с использованием соматических клеточных гибридов "мышь-хомячок". Символ (+/) указывает на присутствие, а символ (-/) на отсутствие рестрикционного Tea-фрагмента по отношению к присутствию (+/) или отсутствию (-/) конкретной мышиной хромосомы (обозначенной цифрой в левой колонке), обнаруженной путем гибридизации с 20.5-кДНК-зондом. Число противоречивых наблюдений представляет собой сумму (+/-) и (-/+)-наблюдений.
Ни один из этих гибридов не был кариотипирован. Они были типированы для других маркеров, поэтому, возможно, (+/-)-гибридная клетка содержит фрагменты хромосомы 8, либо небольшой процент клеток содержит эту хромсому. (-/+)-Клетка может содержать часть хромосомы 8, но в ней отсутствует область, содержащая Теа-ген.
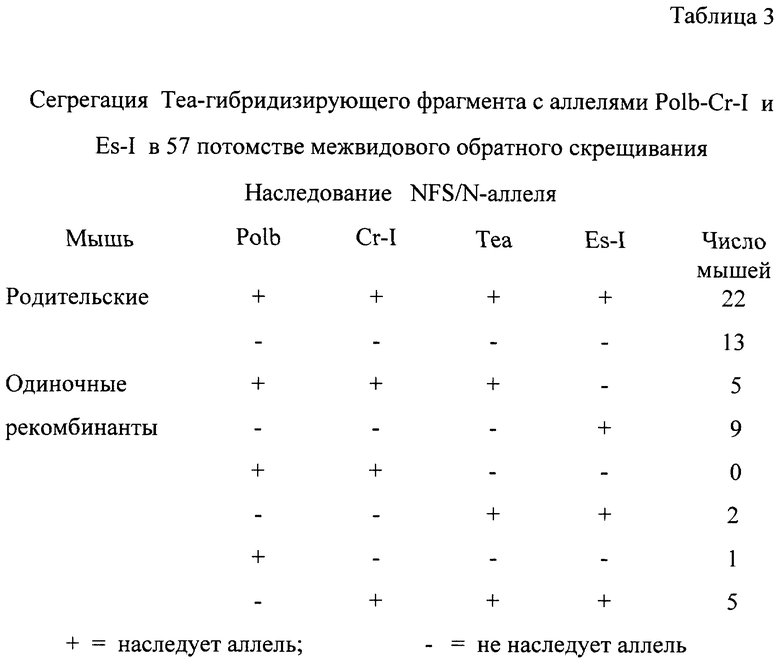
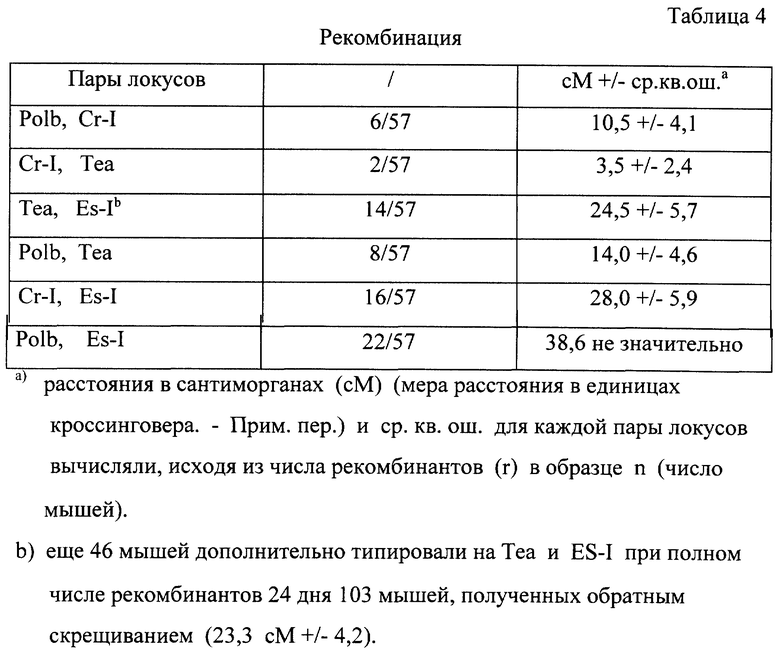
Кроме того, с помощью анализа путем межвидового обратного скрещивания было установлено, что Теа-ген находится на хромосоме 8. Sst-1 переваренная ДНК мышей NFS/N продуцировала перекрестно-реактивные полосы 10,0, 7,4 и 5,5 кb. ДНК от самцов домовой мыши продуцировала фрагменты 10,0; 6,4 и 5,5 кb. На рис. 9В показана картина гибридизации 20.5-кДНК-зонда в эксперименте с обратным скрещиванием "NFS/N х M.m.mus. FI" - мыши с самцом домовой мыши (M. m. mus. ). Картина сегрегации указанного полиморфизма рестрикционных фрагментов с другими маркерами на хромосоме 8 свидетельствует о том, что этот ген связан с Сr-1 и Es-1 в следующем порядке: центромера-Polb-Cr-I-Tea-Es-I (Таблицы 3 и 4).
Локализация Теа-гена на хромосоме 8 свидетельствует о том, что этот ген отличается от гена Rec-1, который кодирует ERR, и расположен на хромосоме 5. Полученные данные также исключают возможность того, что Tea представляет собой ген, кодирующий ретровирусный рецептор фактора MCF и расположенный на хромосоме 1.
Пример 12. Получение кДНК для микроинъекции
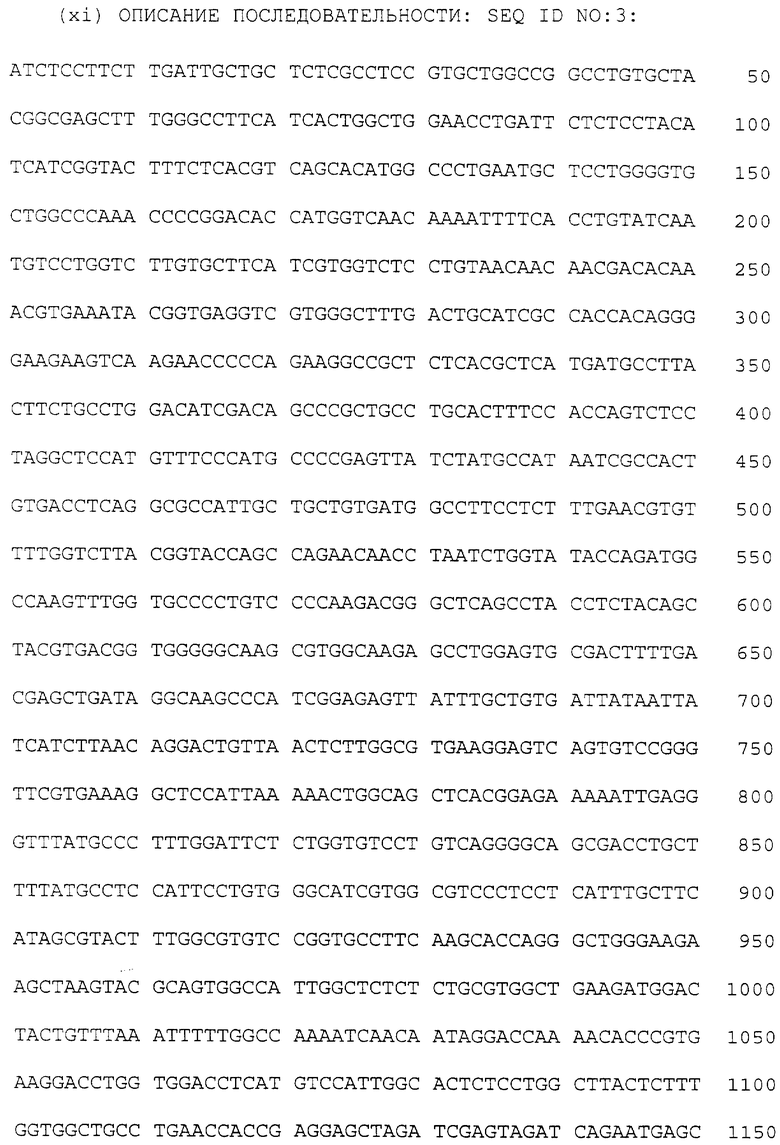
Теа-кДНК непосредственно субклонировали в плазмиду pSP72 (Promega) так, чтобы 5'-концы были соединены с SР6-промотором. Теа-pS P72 плазмиду линеаризовали в 3'-конце кодирующей области с помощью фермента Styl и транскрибировали in vitro с использованием SР6-полимеразы (Promegf, Madison, WI), в присутствии 0,3 мМ 5-7 meGppp5 G для кэппинга РНК в соответствии с инструкциями изготовителей. ERR-pS P72 (mCAT-1) субклонировали из pJet. Транскрипты анализировали на агарозном геле и в результате этого анализа получали размеры кРНК: 2,5 кb (Tea) и 1,9 и 2,4 кb (mCAT-1). кРНК экстрагировали смесью фенола и хлороформа (1:1) и хлороформом, осаждали ацетатом аммония и изопропанолом, растворяли в DEPC-обработанной воде (при 1,0-4,0 мг/мл) и использовали для инъекции в ооциты Xenopus.
Пример 13. Микроинъецирование в ооциты Xenopus
У африканской шпорцевой лягушки (Xenopus leavis) хирургически удаляли ооциты, которые затем в течение 2 часов обрабатывали коллагеназой (1,28 мг/мл) типа 1А (Sigma, St. Louis, МО.) в не содержащем кальция растворе Барта (см. ниже), промывали не содержащим кальция раствором Барта и инкубировали в течение 2 часов в не содержащем кальция растворе Барта. Из этих ооцитов вручную удаляли фолликулы и инкубировали в течение ночи при 18oС в растворе Барта: NaCl (88 мМ), КСl (1 мМ), NаНСО3 (2,4 мМ), HEPES (15 мМ), Ca(NO2)2•4H2O (0,33 мМ), CaCl2•2H2O (0,41 мМ), MgSO4•7H2O (0,82 мМ), гентамицин (10 мкг/мл), пировиноградная кислота (3,1 мМ), после чего в эти ооциты инъецировали 30-200 нг кРНК в 50 нл воды. Затем ооциты инкубировали при 18oС в растворе Барта в течение 2-3 дней.
Пример 14. Электрофизиология
Транспортные токи в ооцитах регистрировали приблизительно при 60 мВ с использованием 2-микроэлектродного метода фиксации напряжения. Регистрацию осуществляли в бане, аналогичной бане Барта, но не содержащей гентамицина или пировиноградной кислоты. Аминокислоты растворяли в растворе для регистрации при рН 7,3 и вводили путем смены бани, используя при этом регистрирующую камеру с постоянным потоком. Отдельные ооциты были получены в нескольких
различных концентрациях и вводились в течение периодов времени за 30 секунд до и после промывки регистрирующим солевым раствором, не содержащем аминокислот. Токи измеряли методом фиксации напряжения с использованием Axoclamp-2A (Axon Instruments, Foster City, CA), a прохождение сигнала отслеживали с помощью терморегистрирующего устройства. Используемые ооциты имели начальное остаточное напряжение, по крайней мере, около 46 мВ. Для измерения в отсутствии натрия, в регистрирующем солевом растворе, хлорид натрия заменяли эквимолярным количеством холинхлорида. Контрольные ооциты получали из той же самой партии клеток, что и испытуемые ооциты. В эти контрольные ооциты были инъецированы либо 50 мл DEPC-воды, либо 50 мл in vitr-транскриборованной G Iu Р3-кРНК.
Пример 15. Хирургические операции на животных
Частичную гепатэктомию осуществляли путем продольного резреза так, чтобы у анастезированной (70 мг/кг фенобарбитол-натрия) мыши АКР (в возрасте 6-8 недель) было удалено приблизительно 60% печени, Затем животных умерщвляли и выделяли РНК из печени животных через 24 часа, 48 часов и 7 дней после операции. Полную РНК, извлеченную из ткани печени после резекции, использовали в качестве временного нуль-контроля. Девять гепатэктомизированных животных мышей подвергали анализу (три мыши для каждого временного интервала). В этот анализ были включены шесть ложно прооперированных животных.
Пример 16. Нозерн-анализ
Полную тканевую РНК получали от мышей АКР, а РНК из ткани яичек получали от "голых" мышей Balb/c. Для этого ткани быстро собирали, гомогенизировали в 10-кратном избытке (масс./объем) буфера для лизиса ткани, и полную РНК получали с использованием одностадийного метода экстракции фенолом. РНК хранили в водном растворе, содержащем 5% 2-меркаптоэтанол, 5 мМ 3D ТА и 0,5% Саркозила, при -70oС. Клеточные линии культивировали в модифицированной по способу Дульбекко среде Игла (DMEM с высоким содержанием глюкозы), в которую был добавлен 1% глутамина (при 37oС) в 5% CO2. Клетки промывали фосфатно-буферным раствором, лизировали 10-тью объемами буфера для олизиса тканей и получали полную РНК.
Полную РНК (10 мкг) от каждой ткани анализировали (в дубликате) на простом денатурирующем формальдегидном/агарозном геле и переносили на мембранный носитель NitroPlus (MSI, Westboro, МА, 01581). Отпечатки зондировали произвольно праймированными меченными кДНК-фрагментами. Для того, чтобы различить две изоформы mСАТ-2, получали специфический зонд (132 п.о.) путем BamHI/Pvu II-переваривания исходного 20.5-кДНК-клона. Одну половину дубликатного Нозерн-блота зондировали смесью mСАТ-2 (2,1 kb-pJet-фрагмент) и циклофиллина (0,7 кb), а другую половину одновременно зондировали Теа-кДНК (2,4 кb) и циклофиллином с использованием идентичных условий гибридизации и зондов с эквивалентной специфической активностью. Затем эти блоты промывали вместе в условиях конечной жесткости (0,1 • SSPE, 0,1% ДСН, при 42oС, в течение 30 минут) и экспонировали с пленкой в течение того же самого промежутка времени.
Пример 17. Транспорт катионных аминокислот в микро-инъецированных ооцитах
На рис. 10 изображена гистограмма, иллюстрирующая ответ кДНК- и водо-инъецированных ооцитов Xenopus на 20 главных аминокислот, необходимых для синтеза белка, а также на орнитин, гомосерин, и MeAlB [альфа-(метиламино)изомасляная кислота; специфический субстрат системы А]. Транспорт оценивали путем определения изменения мембранного тока, индуцированного аминокислотами. Ооциты с инъецированной Теа-кРНК генерировали значительные внутренние токи в присутствии аргинина, лизина и орнитина. Таким образом, Теа-кРНК кодирует белок, который опосредует специфический транспорт указанных катионных аминокислот. Исходя из этого, ген Tea переименован в ген mCAT-2 (murine cationic amino acid transporter - переносчик мышиных катионных аминокислот). Результаты, полученные для водо-инъецированных контролей, позволяют предположить постоянное присутствие небольшой эндогенной транспортной активности, поскольку внутренние токи менее, чем 1 нА наблюдаются для большинства аминокислот, причем максимальное значение этого тока не превышает 5 нА (рис.16). Умеренный ток также наблюдался при стимулировании ооцитов гистидином (при рН 7,3). Возможно, что наблюдаемый транспорт небольшого количества гистидина (рис.16) обусловлен незначительным количеством гистидина, который является катионным при рН 7,3. Возможно, что этим катионным переносчиком распознается лишь протонированная форма гистидина. Кроме того, транспорт лизина и орнитина, опосредованный mСАТ-1 и mCAT-2, был практически неразличимым.
Для оценки стерео-специфичности транспорта было проведено сравнение L- и D-форм аргинина, лизина и орнитина. Из рис.17 видно, что L-аргинин, L-лизин и L-орнитин в концентрации 1 мМ генерируют внутренние токи, которые в 8 раз превышают токи, генерируемые D-изомерами. Таким образом, mCAT-2-опосредованный транспорт является специфичным в отношении биологически активных форм из аминокислотных субстратов.
Пример 18. mCAT-2-опосредованный транспорт является натрий-независимым
Переносчики аминокислот, по-видимому, варьируются по своей зависимости от трансмембранного Nа+-градиента. Поэтому, с использованием ооцитов был проведен анализ на необходимость присутствия ионов натрия для транспорта аргинина, лизина, орнитина и гомосерина. Для этого, в целях поддержания осмомолярности в растворе для регистрации, натрийхлорид был заменен на холинхлорид. Как видно из рис.18, транспорт аргинина, лизина и орнитина протекает независимо от присутствия внеклеточного Na+. В противоположность этому транспорт диполярного гомосерина является в ощутимой степени натрий-зависимым (р=0,0025), хотя значения транспортных токов очень малы (у+ - система опосредует транспорт катионных аминокислот, который не зависит от присутствия натрия; однако, это присутствие необходимо в случае импорта диполярных аминокислот, таких как гомосерин).
Пример 19. Сродство к субстрату и насыщение mСАТ-опосредованного транспорта
Переносчики аминокислот обнаруживают характерные свойства субстратного насыщения. Насыщение наблюдается при концентрации 1 мМ аргинина, лизина и орнитина и 10 мМ гистидина (рис.19). Как и ожидалось для систему у+ переносчиков аминокислот, концентрация, необходимая для транспорта таких катионных аминокислот, как аргинин, лизин и орнитин, оказалась ниже, чем концентрация, необходимая для транспорта гистидина.
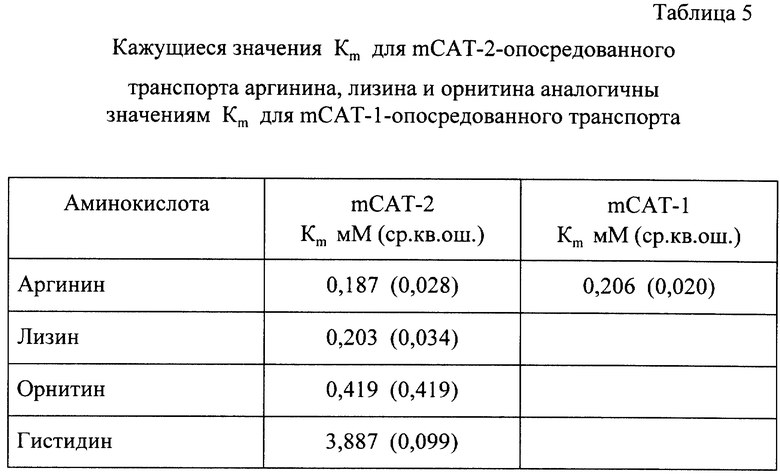
Кажущиеся Кm-значения для аргинина, орнитина, лизина и гистидина измеряли с использованием концентраций каждой аминокислоты в диапазоне 0,01-30 мМ. Эти значения представлены в Таблице 1. Указанные величины Кm были определены с помощью нелинейно-регрессионного анализа данных дозо-зависимого ответа (см. вставку на рис.19) с использованием GraphPad-прогшраммы InPlot 4.03. mCAT-2-белок обнаруживал кажущееся сродство к аргинину, лизину и орнитину в более высокой степени, чем к гистидину (рис.13). Стандартная гибка в среднем не превышала 2,0 для аргинина, 2,4 для лизина и орнитина и 3,8 для гистидина. Кажущиеся значения Кm приводятся в Таблице 5.
Кажущиеся Кm-величины для mСАТ-2 были получены на основании данных, представленных на рис.19, а Кm-величины для mСАТ-1 были получены идентичным способом с использованием GraphPad-программы InPlot 4.03. Величины Кm для mСАТ-1 определяли с использованием 13 ооцитов; а величины Кm для mСАТ-2 определяли с использованием 17 ооцитов для аргинина, 7 ооцитов для лизина, 8 ооцитов для орнитина и 3 ооцитов для гистидина. В ооциты было инъецировано 30-185 нг кДНК.
Кажущиеся Кm-величины, полученные для каждой аминокислоты, были примерно одинаковыми для различных ооцитов, тогда как величины Iмакc, имели тенденцию к флуктуации. Варьирование величин Iмакc, вероятно, обусловлено различными уровнями экспрессии mСАТ-2 - белка в отдельных ооцитах, тогда, как величины Кm не зависят от числа молекул-переносчиков. Однако, величины I для различных аминокислот, происходящих от одной клетки, согласуются друг с другом. Максимальные токи, генерированные в ответ на данную аминокислоту, не обнаруживают заметного различия, и пределах одного ооцита, а отклонение максимального значения тока от среднего значения составляет менее, чем 3,5 нА для аргинина, лизина, орнитина и гистидина.
Кm-величина (0,187) для mCAT-2-опосредованного транспорта аргинина значительно превышает исходное значение для лг САТ-1 (0,07-0,077). Поэтому для того, чтобы убедиться в различии аффинитета двух белков по отношению к аргинину, был определен кажущийся аффинитет mСАТ-1-белка по отношению к аргинину в ооцитах. В Таблице 5 представлены значения Кm полученные из экспериментов по сравнению транспорта аргинина опосредованного либо mСАТ-1 (0,206 мМ ± 0,02 ср.кв.ош.), либо mСАТ-2 (0,187 мМ ± 0,028 ср.кв.ош.).
Пример 20. Экспрессия mСАТ-1- и mCAT-2-PHK в тканях и клеточных линия
На рис.20 показана экспрессия mСАТ-1 и mСАТ-2-генов, оцененная с использованием Нозерн-анализа. mCAT-1-мРНК обнаруживалась во всех 15 тканях за исключением печени. Отсутствие mСАТ-1-белка в печени обусловлено неспособностью экотропных ретровирусов инфицировать этот вид ткани. Два mСАТ-1-транскрипта (7,9 кb и 7,0 кb) были обнаружены в яичниках, матке, толстой и тонкой кишках, тимусе, сердце, и в следовых количествах, в коже и скелетных мышцах (лишь после длительной экспозиции).
Что касается mCAT-2-PHK, то наиболее обильная экспрессия наблюдалась в печени, и высокие уровни экспрессии наблюдались в скелетной мышце. Обнаружимая экспрессия mCAT-2-транскриптов наблюдалась в тканях желудка, кожи, головного мозга, легких, и матки, а в тканях яичек, яичников и сердца наблюдались лишь следовые количества mCAT-2-мРНК. mСАТ-2-мРНК не была обнаружена в покоящихся лимфоцитах селезенки, в толстой и тонкой кишках, в тимусе, и в почке.
Все из 15 проанализированных тканей экспрессировали либо один, либо два mСАТ-гена. mСАТ-1- и mCAT-2-транс крипты одновременно экспрессировались в нескольких видах тканей, а именно, в тканях матки, головного мозга, и легких. Совместная экспрессия указанных генов наблюдалась в клеточной линии Т-лимфомы SLI2.4 и двух клеточных линиях гепатомы (рис.20). В тканях зрелого организма, один ген, обычно, является доминирующим. Например, в печени экспрессируется лишь mCAT-2-мРНК, тогда как mCAT-1-мРНК обнаруживается исключительно в тканях кишок, в покоящихся Т-клетках селезенки, и в тимусе.
Пример 21. В нормальной и регенерирующей печени наблюдается экспрессия глСАТ-2-, но не m САТ-1-мРНК
В печени, в которой наблюдается постоянная экспрессия mСАТ-2, эта экспрессия гена может изменяться, если печень находится в митогенно-активном состоянии. Была исследована РНК, полученная от печени контрольных, ложнооперированных, и частично гепатэктомизированных животных, и была проведена оценка экспрессии обоих mСАТ-генов (рис.20). mCAT-1-мРНК отсутствовала в печени, но быстро индуцировалась при культивировании печеночных клеток; и присутствовала в двух клеточных линиях гепатомы (см. рис.21). mCAT-1-PHK не была обнаружена в контрольной и в регенерирующей печени, а также в печени ложнооперированных животных. В противоположность этому, экспрессия mCAT-2-PHK наблюдалась в контрольной и регенерирующей печени, и в печени ложнооперированных животных, причем, эта экспрессия не индуцировалась при значительном изменении условий под действием массивного митоза, которому были подвергнуты клетки печени через 24 часа после гепатэктомии (рис.21В).
Исходная изоформа mСАТ-2 экспрессировалась в нормальной ткани, причем, специфический зонд для этой области был получен из кДНК (рис.21С). Нозерн-анализ (рис. 210 показал, что эта изоформа mСАТ-2 действительно экспрессируется во всех шести испытуемых тканях.
Пример 22. Характеризация mCAT-2-белков
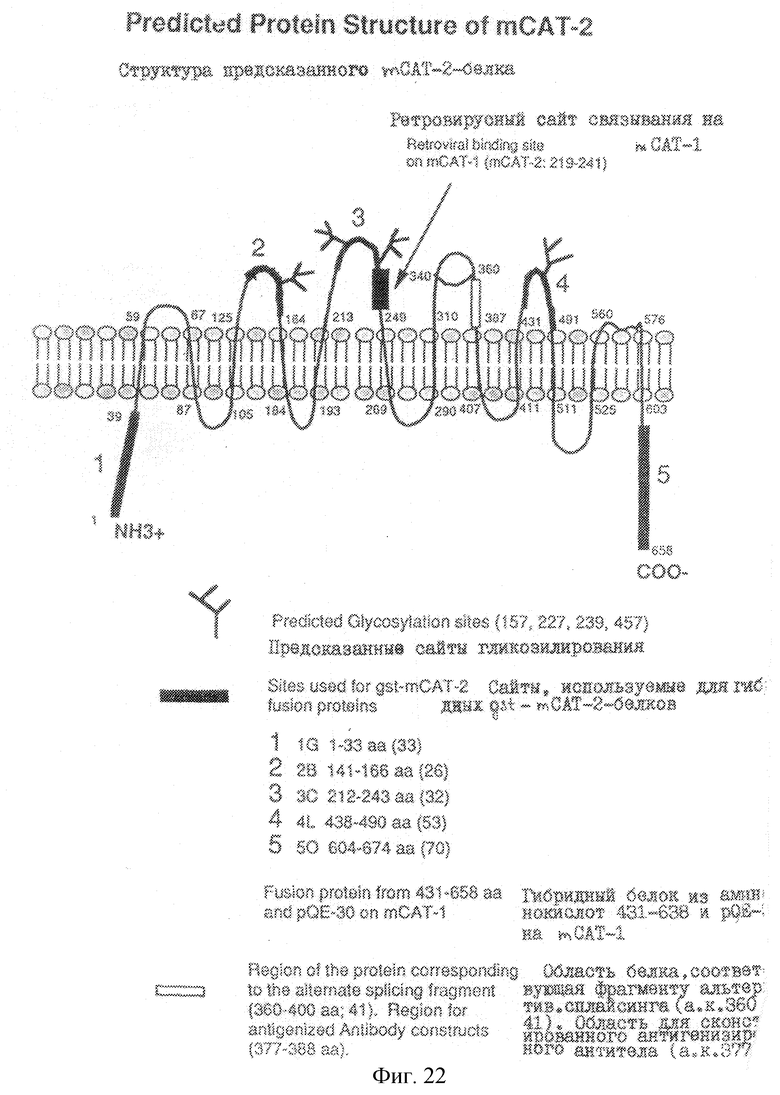
Каждая mCAT-изоформа содержат специфические последовательности, которые наделяют каждый белок-переносчик уникальными функциями. Одна из таких особенностей заключается в различии их карбокои-концов. Обе изоформы mСАТ-2 имеют одинаковую СООН-концевую последовательность, которая полностью отличается от концевой последовательности mСАТ-1 и длиннее ее на 31 амино-кислоту. mCAT-2-белок содержит карбокси-концевую (из 55 аминокислот) гидрофильную область, расположенную за последним трансмембранным доменом, и соприкасающуюся как и предполагалось с цитоплазмой (MSI-3). Этого достаточно, чтобы осуществлялось взаимодействие с другими внутриклеточным белками для передачи сигнала или образования каналов для прохождения транспортируемых аминокислот в данный внутриклеточный пул. Если указанным карбокси-конец является внутриклеточным, то он может быть ассоциирован с аргиназой в каждой ткани, но преимущественно в печени. Печень может экспрессировать белок-переносчик (mСАТ-2а) с очень высоким уровнем Кm в перипортальных клетках, что способствует предупреждению истощения аргинина (или лизина) из портальной крови. Независимо от того, является ли карбокси-конец внеклеточным или внутриклеточным, он может участвовать в связывании других вспомогательных молекул, о которых известно, что они также принимают участие в транспорте аминокислот.
Второй отличительной особенностью является АА-связывающий домен mCAT-2-белка. Две изоформы: mСАТ-2 являются идентичными, за исключением того, что сегмент из 32 аминокислот, генерированный альтернативным использованием 2 экзонов имеет идентичность по всей последовательности 97%. Однако, вариант mСАТ-2а имеет Кm который в 10 раз превышает Кm (при измерении в ооцитах Xenopus). В противоположность этому, гомология последовательностей mСАТ-1 и mСАТ-2 составляет лишь 61%, несмотря на то, что эти два переносчика имеют идентичные Кm, и при экспрессии в ооцитах Xenopus, они функционально неразличимы. Поэтому, в основном, низкая аффиность mСАТ-2а по отношению к аргинину может означать, что он выполняет другие физиологические функции.
Пример 23. Продуцирование антител
Антитела продуцировали по методам Billetta и Zanetti Immunomethods 1: 41-51 Э1992). В основном, этот метод заключается в том, что двухцепочечным одигонуклеотид, кодирующий специфический эпитоп, вводят в высоко - вариабельную область (CDP3) цепи зрелого иммуноглобулина, в результате чего эта область становится "антитенизированной". При этом, были выбраны олигонуклеотиды, которые представляли дивергентные последовательности mСАТ-2 и mСАТ-2А. Эти последовательности и их длину выбирали по трем критериям: 1) антигенный потенциал; 2) достаточное отличие друг от друга для продуцировал антител, специфичных к каждому эпитопу;
3) они должны, быть введены, в вариабельную область цепи IgG.
Для сравнения, ниже приводятся последовательности доменов, связывающихся с лигандом, в предсказанных белках для трех изоформ mСАТ (рис.22):
mCAT-1 GSMFPMPRVIYAMAEDGLLFKFLAKINNRTKTPVIATVTSGAIA
mCAT-2 GSIFPMPRVIYAMAEDGLLFKCLAQINSKTKTPVIATLSSGAVA
mCAT-2A GSMFPLPRILFAMARDGLLFRFLARV-SKRQSPVAATMTAGVIS
**. **. **... *** *****. **....... ** **... *...
"х" означает идентичные остатки; "." означает консервативные замещения. Область белка, соответствующая фрагменту альтернативного сплайсинга, находится в а. к. 360-400. Область для анти-генизированных антительных конструкций находится в аминокислотах 377-388. Кроме того, на рис.22 показаны сайты, использованные для синтеза gst-mCAT-2-гибридных белков, а именно:
(1) IG или аминокислоты 1-33;
(2) 2В или аминокислоты 141-166;
(3) 3С или аминокислоты 212-243;
(4) 4L или аминокислоты 438-490; и
(5) 50 или аминокислоты 604-674.
Синтетический олигонуклеотид, кодирующий последовательности mСАТ-2, показанные выше жирными линиями, гибридизовали с комплементарным синтетическим олигонуклеотидом, и вводили в СОК3-область соответствующим образом реаранжированного мышиного УН62-гена. Рестрикционные сайты конструировали таким образом, чтобы олигонуклеотид был интегрирован с сохранением своей собственной рамки считывалия или рамки считывания тяжелой цепи. Ориентация и рамка считывания были подтверждены путем секвенирования. Полную СОК3-область, содержащую сконструированный mСАТ-фрагмент, вырезали и клонировали выше гена, кодирующего константную область гамма-1 и содержащегося в экспрессрующем векторе pN-гамма I млекопитающего. Конечная конструкция содержала химерную последовательность mСАТ/ДНК тяжелой цепи IgG мыши/человека; ген резистентности к неомицину для селекции клеток-трансформантов млекопитающих, и ген резистентности к ампициллину для селекции в бактериях. Были также сконструированы аналогичные конструкции олигонуклеотидов, кодирующих mСАТ-2а- и mСАТ-1-специфические последовательности. Кроме того, была получена четвертая последовательность для mСАТ-2, локализованная в 3'-конце кодирующей последовательности.
Каждую конструкцию вводили путем электропорации в мышиные клетки J 558L, которые конститутивно экспрессируют легкую цепь лямбда-1 мыши. G418-резистентные клеточные клоны, секретирующие сконструированное антитело, отбирали и размножали. Секретированные антигенизированные антитела очищали и использовали для продуцирования антисыворотки в соответствии с традиционной схемой иммунизации.
Кроличью антисыворотку очищали с помощью последовательной аффинной хроматографии. Эту антисыворотку наносили на сефарозу, связанную с гамма-1 человека для удаления антител против константной области цепи гамма-1 человека, затем на сефарозу, связанную с мышиным VH62 для удаления антител против VH62, и, наконец, на сефарозу, связанную со специфическим пептидом для аффиной очистки антител, которые специфически распознают отдельные САТ-эпитопы. Специфичность антитела затем исследовали с помощью Вестерн-анализа GST/mCAT- и нативных mСАТ-белков. Лизаты SL2.3- и SL12.4 использовали в качестве источника нативных белков. Клетки SLI2.3 использовали в качестве контроля, поскольку они экспрессируют mСАТ-1, и не экспрессируют изоформы mСАТ-2.
Пример 24.
Анти-mСАТ2 антисыворотки могут быть введены пациенту или животному после смешивания с фармацевтическим носителем. Фармацевтические носители, которые способствуют доставке антитела к пораженным тканям индивидуума хорошо известны специалистам в данной области. При применении в терапии in vivo анти-mСАТ2 антисыворотки по настоящему будут применяться в терапевтически эффективных количествах, т.е. в количествах, которые позволяют эффективно ингибировать транспорт катионных аминокислот в организме подвергающегося лечению индивидуума или животного. Одним способом, которым антисыворотки могут быть введены, является внутривенное введение. Количество вводимой антисыворотки обычно будет находится в интервале от приблизительно 0,1 до приблизительно 100 мг/кг массы тела пациента. Для внутривенного введения иммунотоксины могут быть включены в разовую дозированную форму для инъекций (раствор, суспензию, эмульсию). Возможные эффективные фармацевтические носители для внутривенного введения представляют собой воду, солевой раствор, раствор Рингера, раствор декстрозы и 5% раствор человеческого сывороточного альбумина. Также могут применяться неводные носители, такие как нелетучие масла и этилолеат, равно как и липосомы. Носитель может содержать минорные количества добавок, таких как вещества, улучшающие изотоничность и химическую стойкость, например, буферы и консерванты. Другие фармацевтически приемлемые носители могут применяться для других способов введения и хорошо известны специалистам в данной области.




















Изобретение относится к фармакологии, а именно к средствам, ингибирующим транспорт катионных аминокислот, и раскрывает кроличью антисыворотку, индуцированную против Т-клеточного белка, кодируемого геном mСAТ-2, и фармацевтическую композицию, включающую указанную антисыворотку. Изобретение обеспечивает ингибирование транспорта катионных аминокислот. 2 c.п.ф-лы, 22 ил., 5 табл.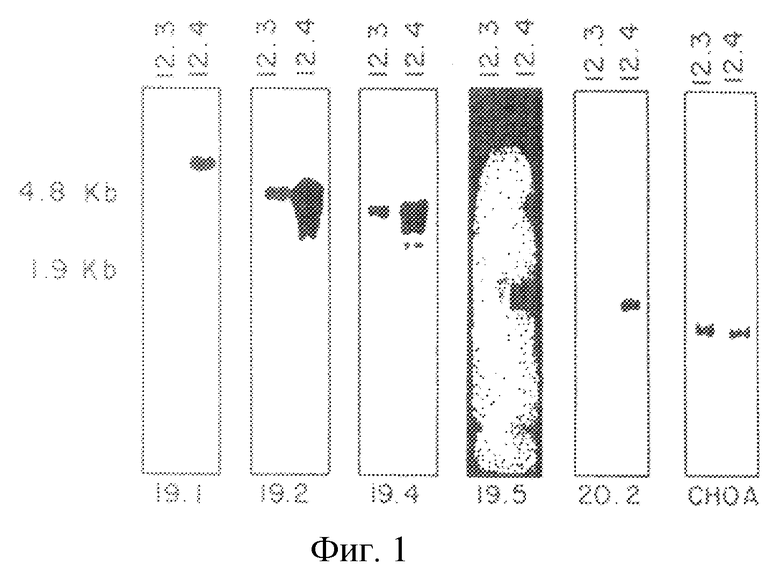
| US 5252477 C1, 12.10.1993 | |||
| US 4722890 C1, 02.02.1988 | |||
| Grossbard M.L | |||
| et al | |||
| Monoccloning antibody - based therapies of leukemia and lymhoma | |||
| Blood, v | |||
| Капельная масленка с постоянным уровнем масла | 0 |
|
SU80A1 |
| Прибор для определения скорости движения и пройденного пути вагонами, автомобилями и т.п. | 1915 |
|
SU863A1 |
| Способ получения альфа-фетопротеина | 1976 |
|
SU583536A1 |
Авторы
Даты
2002-08-10—Публикация
1995-01-25—Подача