Изобретение относится к технологии получения стерильной плазмы и препаратов из плазмы крови и может быть использовано в медицинской промышленности и биотехнологии.
Плазма крови человека и полученные из нее компоненты являются эффективными лечебными средствами при ряде заболеваний и широко применяются в медицинской практике. Одной из ответственных стадий при подготовке плазмы и препаратов из плазмы к хранению и дальнейшему использованию является стерилизация с целью инактивации возможно присутствующих в ней вирусов, бактерий и других микроорганизмов с одновременным сохранением биологической активности и других свойств.
Известен ряд способов стерилизации препаратов крови путем их тепловой обработки, например пастеризации (Заявка ЕПВ 0103196, МПК А 61 L 2/04, опубл. 21.03.84 г.; Заявка ЕПВ 094611, МПК А 61 L 2/04, опубл. 23.11.83 г.).
Однако в процессе такой обработки препараты крови теряют значительную часть биохимических свойств.
Для снижения температуры и времени экспонирования при тепловой обработке препаратов крови вводят дополнительно стабилизаторы, например спирты ряда cахаров (Заявка ЕПВ 0117064, МПК А 61 L 2/04, опубл.29.08.84 г.), или химические реагенты, усиливающие инактивирующее воздействие на микроорганизмы и вирусы, например, сульфат аммония (Заявка ЕПВ 0124506, МПК А 61 L 2/04, опубл. 07.11.84 г.; Заявка ФРГ 3330770, МПК A 61 L 2/04, опубл. 14.03.85 г.).
Однако после тепловой стерилизации (свыше 40-60oС) препараты значительно теряют свои биохимические свойства. Кроме того, введение химических реагентов требует последующей очистки препарата, что значительно усложняет технологию.
Известен способ стерилизации жидких продуктов, контаминированных вирусами, бактериями, микоплазмами и другими патогенными микроорганизмами путем обработки продуктов радиационным излучением дозой до 32 кГр (Патент США 5362442, МПК А 61 L 2/08, опубл. 08.11.94).
Однако такой способ не пригоден для стерилизации плазмы и препаратов из плазмы, которые после радиационной обработки при положительных температурах (в жидком виде) значительно теряют свои биохимические свойства.
Известен способ стерилизации медицинского препарата путем нагрева его до 50-65oС и обработки излучением дозой 5-35 кГр (авторское свид. СССР 322907, МПК6 А 61 L 1/00, опубл. 25.08.77 г.).
Однако такой способ непригоден для стерилизации плазмы и препаратов из плазмы, которые после нагревания до указанной температуры и радиационной обработки значительно теряют свои биохимические свойства.
Известен способ стерилизации фармацевтических препаратов, включающий предварительное введение в препарат радиопротектора, например маннита (многоатомный спирт), с последующей его обработкой ионизирующим излучением с дозой облучения 25 кГр (заявка Великобритании 2222081, МПК6 А 61 К 41/00, опубл. 1990г.).
Однако радиопротектор является нежелательным компонентом в препарате, который после стерилизации необходимо удалять, что значительно усложняет технологию.
Известен способ стерилизации термолабильных жидкостей путем облучения их ультразвуком с плотностью акустической энергии порядка 1-10 Вт/см2 при частоте 20-25 кГц в течение 30-50 мин (Патент США 4086057, МПК А 61 L 2/02, опубл. 1978г.).
Однако такой способ не обеспечивает полную инактивацию многих вирусов, например, таких как аденовирусы, гепатит А и В.
Известен способ стерилизации бактериологически контаминированных жидкостей, включающий одновременное воздействие на продукт излучения и ультразвука (Патент США 3672823, МПК6 А 61 L 2/02; 2/08, опубл. 27.06.72 г.). В качестве излучения используют ультрафиолет в диапазоне 1800-4500 ангстрем с интенсивностью 0,11 Вт/см2. Ультразвуковое поле имеет частоту от 5 до 150 кГц и средний уровень плотности звуковой энергии, равной 1 Вт на 1 л жидкости.
Однако при стерилизации плазмы и препаратов из плазмы таким способом, с одной стороны, не обеспечивается полная инактивация многих вирусов, например, таких как аденовирусы, гепатит А и В, если одновременное воздействие на препарат ультразвука и ультрафиолетового излучения кратковременно (не более 10-20 мин), а с другой стороны, при длительном одновременном воздействии указанных физических факторов (более 60 минут) препараты значительно теряют свои биохимические свойства и становятся непригодны для многих медицинских целей.
Ближайшим по технической сущности и достигаемому результату к предложенному способу является способ стерилизации плазмы и препаратов из плазмы, включающий замораживание образцов препаратов крови при температуре от -20 до -60oС, их обработку гамма-излучением с дозой от 20 до 60 кГр с последующим размораживанием указанных образцов (Европейский патент 0334679, МПК А 61 L 2/08, опубл. 27.09.89 г.).
Недостатком известного способа является то, что при высоких дозах одноразового облучения (50-60 кГр) плазма и препараты из плазмы значительно теряют свои биохимические свойства и становятся непригодны для многих медицинских целей, а при низких дозах одноразового облучения (20-30 кГр) не обеспечивается полная инактивация вирусов, бактерий и других микроорганизмов. Кроме того, в прототипе не указаны режимы (скорости) замораживания и размораживания плазмы, а неконтролируемое замораживание и оттаивание портит многие параметры плазмы.
Задачей предлагаемого изобретения является создание такого способа стерилизации, который позволил бы полностью инактивировать вирусные и другие микробные объекты с сохранением биохимических свойств плазмы и препаратов из плазмы крови.
Технический результат заключается в обеспечении максимальной сохранности биохимических свойств плазмы и препаратов из плазмы крови с одновременным увеличением надежности стерилизации и эффективности процесса.
Технический результат достигается тем, что в способе стерилизации плазмы и препаратов из плазмы крови, включающем замораживание образцов, их обработку гамма-излучением с дозой 40-50 кГр с последующим размораживанием указанных образцов, согласно изобретению образцы замораживают со скоростью 0,2-2,0oС/мин до минус 60-196oС, обработку гамма-излучением осуществляют дробно с максимальной дозой однократного излучения не более 25 кГр, с интервалом времени между облучениями не менее одного часа, а размораживание образцов после облучения производят со скоростью 20-30oС/мин до 5-10oС.
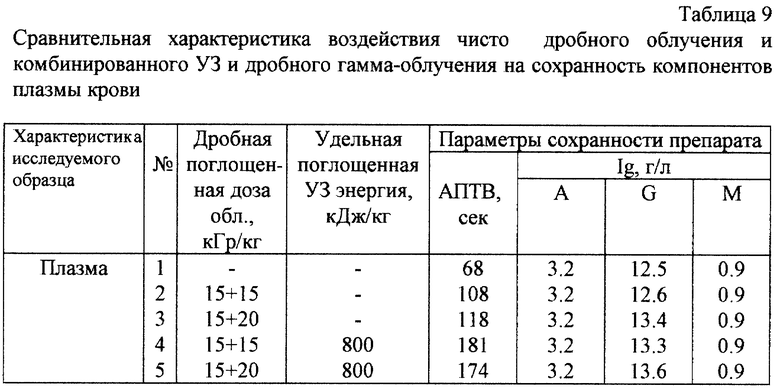
Образцы препаратов крови для повышения надежности стерилизации перед замораживанием могут быть дополнительно подвергнуты ультразвуковой обработке с частотой 22 кГц и удельными поглощенными энергиями 103 - 106 кДж/кг.
Дробное воздействие на препарат гамма-излучением позволяет создать более "мягкие" условия процесса стерилизации, которые обеспечивают полную инактивацию вирусных и других микробных объектов с сохранением качества плазмы и препаратов из плазмы крови по сравнению с однократным их облучением с дозой облучения более 50 кГр.
Последовательное комбинированное воздействие на препарат вначале ультразвуком, а затем гамма-излучением позволяет повысить эффективность стерилизации плазмы и препаратов из плазмы крови.
При температуре ниже -80oС снижается эффективность процесса инактивации вирусов, а при температуре выше -50oС начинают разрушаться компоненты плазмы крови.
Замораживание образцов плазмы крови со скоростью 0,2-2,0oС/мин и размораживание их со скоростью 20-30oС/мин обеспечивает более полное сохранение биохимических свойств.
На фиг.1 приведена сравнительная хроматограмма для образцов плазмы крови, обработанных при комнатной температуре и при -78oС.
Пример 1. Способ стерилизации плазмы и препаратов из плазмы крови радиационным облучением.
Образцы плазмы крови объемом от 2 до 400 мл замораживают со скоростью 0,2-2,0oС/мин до температуры не менее -60oС. Далее проводят обработку замороженных образцов гамма-излучением дробно с максимальной дозой однократного облучения не более 25 кГр. Интервал времени между облучениями составляет не менее 1 часа. Размораживание образцов после облучения производят со скоростью 20-30oС/мин до температуры не более 10oС.
Для замораживания образцов применяют термостатируемые морозильные камеры с постоянными температурами в интервале от -10 до -40oС. Затем образцы дозамораживают в криостатах до температур в интервале от -60 до -90oС. Конечная температура замораживания варьируется в интервале от -60 до -196oС (рассматриваемый диапазон выбирался, с одной стороны, по данным устойчивости при облучении микробов и вирусов при разных температурах, а с другой - по устойчивости плазмы и других препаратов из плазмы крови при тех же режимах).
Гамма-облучение замороженных образцов проводят на изотопной установке с мощностью поглощенной дозы 60 - 110 Гр/мин.
Размораживание образцов со скоростями в интервале от 20 до 30oС/мин осуществляют в термостатах с водой с температурой 30-40oС до температуры +10oС.
Пример 2. Способ стерилизации плазмы и препаратов из плазмы крови путем ультразвуковой обработки и радиационного облучения.
Образцы плазмы и препаратов из плазмы крови подвергают ультразвуковой обработке с частотой 22 кГц и удельными поглощенными энергиями от 103 до 106 кДж/кг. Для этого используют ультразвуковой (УЗ) диспергатор УЗДН-2Т.
Основные характеристики ультразвуковй обработки на диспергаторе УЗДН-2Т: частота колебаний УЗ - 22 кГц; удельная поглощенная УЗ энергия - от 0 до 3000 кДж/кг; мощность УЗ - 30-50 Вт; средняя по объему плотность акустической энергии УЗ - 10-15 Вт/см2; объем обрабатываемых образцов - 20-30 мл.
Обработанные ультразвуком образцы объемом от 2 до 400 мл замораживают со скоростью (0,2-2,0)oС/мин до температуры не менее -60oС, обработку гамма-излучением осуществляют дробно с максимальной дозой однократного облучения не более 25 кГр, а размораживание образцов после облучения производят со скоростью 20-30oС/мин до температуры не более 10oС. Для этого используют оборудование и технологические режимы, описанные в примере 1.
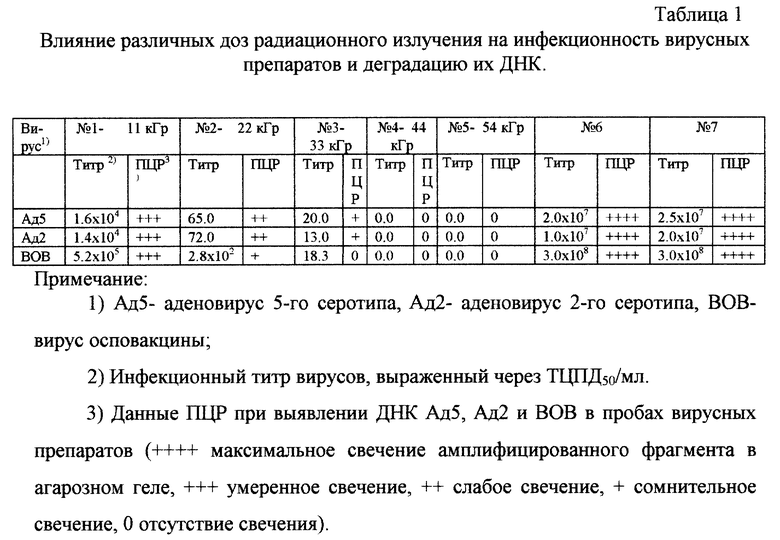
Пример 3. Влияние доз гамма-излучения на инфекционность вирусных препаратов и деградацию их нуклеиновых кислот.
Результаты по влиянию доз гамма-излучения на инфекционность вирусных препаратов и деградацию их нуклеиновых кислот представлены в табл.1.
Как следует из данных табл.1, радиационная обработка препаратов аденовируса 2-го и 5-го серотипов и вируса осповакцины максимальными дозами в 44 и 54 кГр приводила к полной инактивации вирусов и деградации их ДНК до уровня ниже предела чувствительности метода ПЦР, при начальных титрах от 107 до 3•108.
Полнота инактивации вирусов облучением (дозы 54 и 44 кГр) была доказана так же "слепым" пассажем. Клетки, инфицированные неразведенными пробами 5 и 4 (не показавшие на первом пассаже после облучения наличия инфекционного вируса), были отобраны и использованы для инфицирования свежего монослоя культуры клеток 293. Признаков цитопатогенного воздействия вирусов на клетки не было выявлено на протяжении всего срока наблюдения (7 суток). Метод ПЦР показал отсутствие недеградированной вирусной ДНК в этих клетках.
Определена зависимость эффективности инактивации от режимов облучения образцов (табл.2).
Из табл. 2 следует, что эффективность инактивации тем меньше, чем ниже температура обрабатываемого образца при облучении. Так, при облучении препаратов вирусов при -196oС (жидкий азот) остаточная инфекционность сохранялась даже при обработке дозой 40 кГр. Облучение дозой 40 кГр при -78oС (сухой лед) приводило к полной инактивации вирусных препаратов, обработка дозой 20 кГр и дробное облучение (10+10 кГр) приводили к значительному снижению инфекционных титров вирусных препаратов (примерно в 10000 раз) при сохранении остаточной инфекционности (102-103 ТЦПД50/мл). При более высокой температуре обработки образцов (при 0oС) эффективность инактивации была выше, однако при облучении дозами 15, 20 кГр полной инактивации препаратов достигнуто не было. Наиболее эффективно процесс инактивации происходил, когда облучение проводилось при комнатной температуре (вирусные препараты находились в жидкой фазе). Облучение дозой 10 кГр приводило в этих условиях к полной инактивации инфекционности вирусных препаратов.
Дробное облучение вирусного препарата более эффективно инактивирует инфекционность по сравнению с однократным непрерывным облучением той же (или даже более высокой) дозой. Однократное облучение препарата аденовируса 2-го серотипа с инфекционным титром 1,33•106 ТЦПД50/мл дозой 5 кГр при -78oС приводит к снижению инфекционности до 1,70•105 ТЦПД50/мл, в то время как дробная обработка дозами 2,5+2,5 кГр приводила к снижению инфекционности до 1,30•104 ТЦПД50/мл, то есть эффективность обработки увеличивалась более чем в 10 раз.
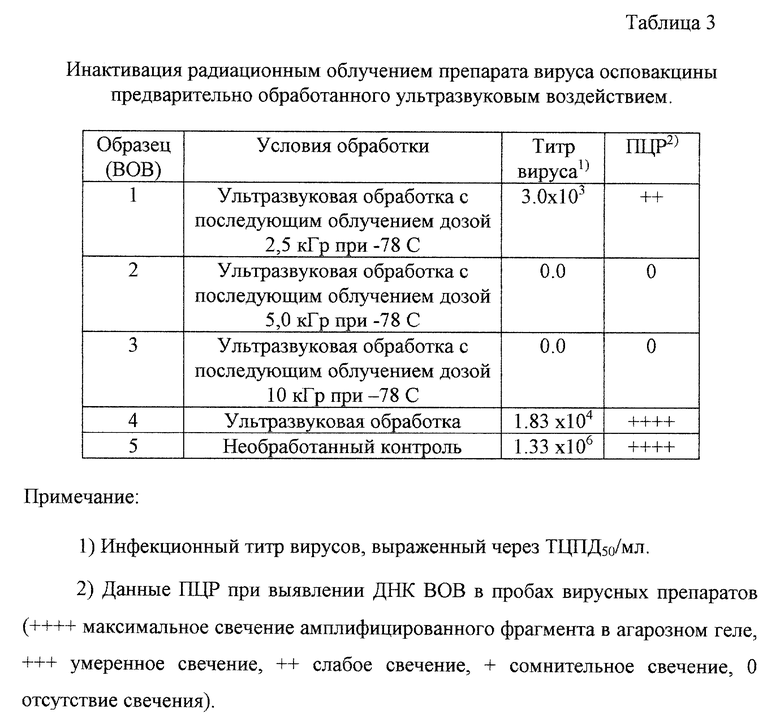
Увеличение эффективности инактивации вирусных препаратов в замороженном состоянии было достигнуто предварительной обработкой образцов ультразвуковым воздействием перед их замораживанием. В табл.3 представлены результаты эксперимента по определению эффективности инактивации радиационным облучением препарата очищенного вируса осповакцины, предварительно обработанного ультразвуком.
Ультразвуковое воздействие вызывало снижение инфекционного титра препарата примерно в 100 раз. При последующей обработке гамма-облучением полная инактивация вируса достигалась при использовании доз в 5 и 10 кГр. Таким образом, наиболее перспективной для инактивации вирусов в препаратах плазмы является схема, состоящая из предварительной обработке плазмы ультразвуковым воздействием с последующим радиационным облучением замороженных при -78oС препаратов относительно невысокими дозами.
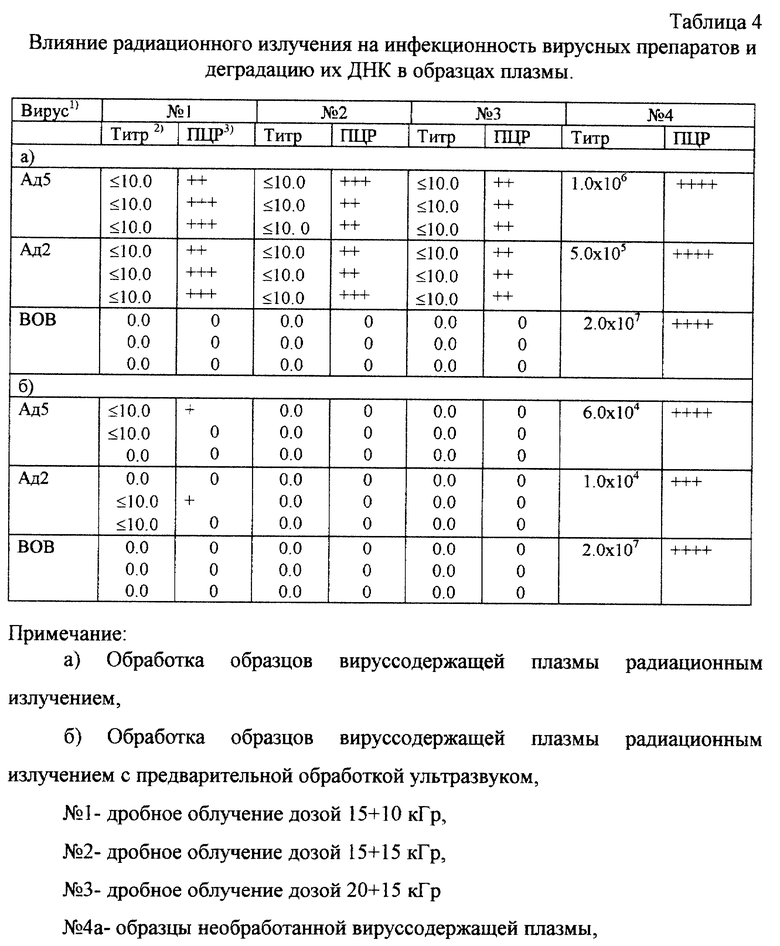
Пример 4. Инактивация вирусов радиационным облучением в препаратах плазмы.
Эффективность инактивации радиационным облучением вируссодержащих препаратов плазмы определяли в варианте с предварительной обработкой образцов ультразвуком и без нее. С этой целью были приготовлены образцы плазмы (50 мл), содержащие соответствующий вирус (вирусные препараты добавляли к образцам плазмы в соотношении 1:20). Инфекционные титры вирусов в препаратах плазмы указаны в табл.4. Образцы плазмы, содержащие соответствующий вирус, были разделены на две аликвоты, одна из которых (30 мл), была подвергнута ультразвуковому воздействию. Образцы плазмы, содержащие соответствующие вирусы, были расфасованы на 20 проб (10 проб вируссодержащей плазмы, обработанной ультразвуковым воздействием, и 10 проб без обработки ультразвуком). После этого пробы были заморожены и подвергнуты облучению различными дозами радиационного облучения (на каждую дозу облучения было сделано 3 повтора) при -78 С. Результаты исследования представлены в табл.4.
Инфекционность вируса осповакцины в препаратах плазмы была инактивирована при облучении всеми использованными дозами независимо от того, были ли они подвергнуты предварительному ультразвуковому воздействию или нет. Полученные результаты свидетельствуют о том, что вирус осповакцины в составе плазмы оказался весьма чувствительным к облучению. Так, дробное облучение 15+10 кГр приводило к полной инактивации инфекционности. Аденовирусы в составе плазмы проявили значительно более высокую устойчивость к облучению. Радиационное облучение всеми использованными в данном эксперименте дозами необработанных ультразвуком образцов вируссодержащей плазмы не привело к полной инактивации вирусной инфекционности. Остаточная инфекционность сохранялась при облучении максимальной в данном эксперименте дозой 20+15 кГр. Однако в случае облучения образцов аденовируссодержащей плазмы, предварительно обработанных ультразвуковым воздействием, была достигнута полная инактивация инфекционности (дробное облучение дозами 15+15 и 20+15 кГр).
С целью выявления возможного отрицательного воздействия схемы обработки, обеспечивающей полную инактивацию вирусов, на полноценность препаратов плазмы был проведен следующий эксперимент. К препаратам плазмы были добавлены концентрированные очищенные препараты аденовирусов или вируса осповакцины (вирусные препараты к плазме добавляли в соотношении 1:20, объем образцов - 60 мл). Половина объема вируссодержащей плазмы (30 мл) была подвергнута ультразвуковому воздействию. Радиационную обработку обоих образцов плазмы осуществляли дробным облучением дозами 20+15 кГр при -78oС. Результаты представлены в табл.5.
Обработка вышеуказанной дозой радиационного облучения препарата вируссодержащей плазмы, подвергнутого предварительному ультразвуковому воздействию, приводила к полной инактивации инфекционности вирусов (подтвержденной также "слепым" пассажем).
Аналогичные результаты получены для вирусов гепатитов А, В и С.
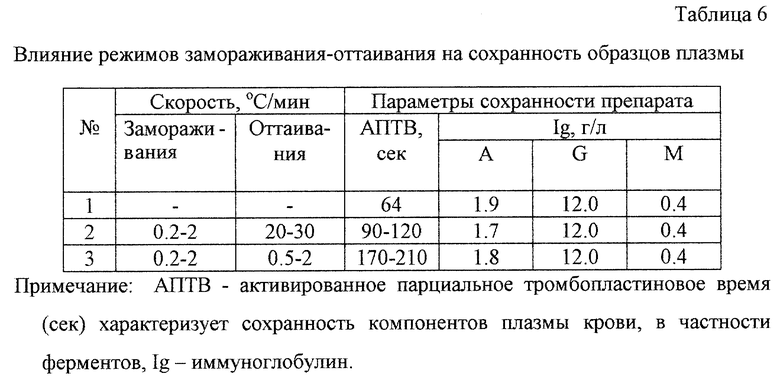
Пример 5. Действие антивирусной обработки на сохранность свойств плазмы.
Выбранный интервал скоростей замораживания от 0,2 до 2oС/мин образцов плазмы крови определяется, с одной стороны, ограничениями в скоростях охлаждения (при высоких скоростях происходит плохое фазовое разделение растворенных веществ и кристаллизующегося растворителя, существуют большие температурные градиенты по объему образца, в результате чего происходит образование нестабильной фазовой структуры твердого раствора, имеющего наихудшую радиационную устойчивость в ряду аналогичных твердых фаз), а с другой - оптимизацией технологических параметров (при скоростях, меньших 0,2oС/мин, время замораживания до температур минус 60-80oС имеет величину, большую 7,5-9 часов). Процесс оттаивания должен проводиться при более высоких скоростях 20-30oС/мин (максимальная скорость при оттаивании образцов в термостате с водой с температурой 30-40oС, табл.6).
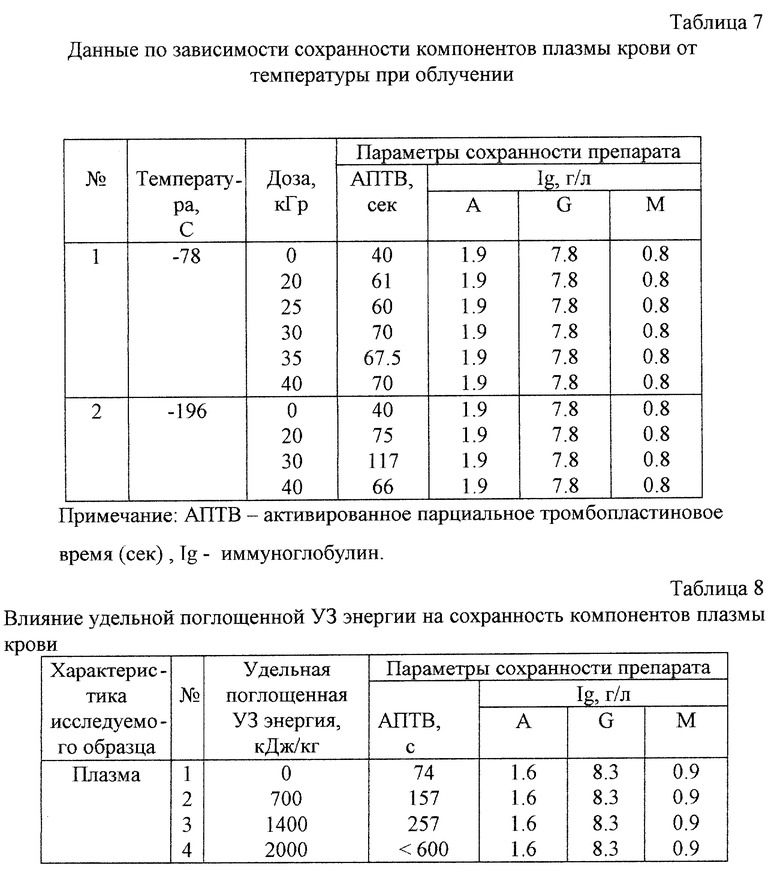
Границы температурной области, до которой необходимо замораживать образцы плазмы и препаратов из плазмы крови, определяются радиационной устойчивостью компонентов плазмы и радиорезистентностью (D10) микробов и вирусов при разных температурах (табл. 2, фиг.1). При температурах выше точки кристаллизации растворов и суспензий (комнатная или близкая к ней) радиорезистентность вирусов наименьшая, но при этом высок процент разрушения компонентов плазмы (по данным электрофореза, наблюдается полное размытие белковых структур на электрофореграммах). При температурах, близких к температурам кипения жидкого азота при нормальных условиях, сохранность плазмы наибольшая, но при этом сильно увеличивается радиорезистентность вирусов (в 2-4 раза), что приводит к увеличению необходимой для надежной стерилизации дозы, а соответственно, и к увеличению общего времени обработки. С другой стороны, различий в сохранности препаратов плазмы крови после облучения при температурах в интервале от -196 до -78oС не наблюдается (табл.7). Температуры в области от -60 до -100oС являются наиболее оптимальными с точки зрения реализации технологии стерилизации препаратов плазмы крови.
Таким образом, показано, что предлагаемая технология стерилизации плазмы и препаратов из плазмы крови обеспечивает сохранность большинства компонентов плазмы, которые остаются неизменными в пределах ошибки эксперимента или изменяются в пределах допустимого колебания параметров плазмы здоровых доноров.
Таким образом, экспериментальные исследования подтверждают, что заявленные параметры замораживания и оттаивания образцов плазмы крови, а также технологические параметры ультразвукового и радиационного облучения обеспечивают максимальное сохранение биохимических свойств плазмы крови, которые могут быть использованы для медицинских и биотехнологических целей.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ИНАКТИВАЦИИ ВИРУСА ИММУНОДЕФИЦИТА ЧЕЛОВЕКА И ДРУГИХ ВИРУСОВ В ПЛАЗМЕ КРОВИ ЧЕЛОВЕКА С СОХРАНЕНИЕМ ФУНКЦИОНАЛЬНОЙ АКТИВНОСТИ БЕЛКОВ ПЛАЗМЫ КРОВИ | 1998 |
|
RU2152994C2 |
| СПОСОБ ИНАКТИВАЦИИ ВИРУСНОЙ КОНТАМИНАЦИИ В ПРЕПАРАТЕ ЧЕЛОВЕЧЕСКОГО ЛЕЙКОЦИТАРНОГО ИНТЕРФЕРОНА | 1994 |
|
RU2080877C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОГЛОБУЛИНОВОГО ПРЕПАРАТА ДЛЯ ПРОФИЛАКТИКИ И ТЕРАПИИ БАКТЕРИАЛЬНЫХ И ВИРУСНЫХ ИНФЕКЦИЙ, ИММУНОГЛОБУЛИНОВЫЙ ПРЕПАРАТ ДЛЯ ПРОФИЛАКТИКИ И ТЕРАПИИ БАКТЕРИАЛЬНЫХ И ВИРУСНЫХ ИНФЕКЦИЙ (ВАРИАНТЫ) И СУППОЗИТОРИИ НА ОСНОВЕ ИММУНОГЛОБУЛИНОВОГО ПРЕПАРАТА | 2003 |
|
RU2255766C2 |
| СПОСОБ ИЗГОТОВЛЕНИЯ КОСТНЫХ ИМПЛАНТОВ | 2013 |
|
RU2526429C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА ВАКЦИНЫ ОТ ПОЛИОМИЕЛИТА ПУТЕМ ОБРАБОТКИ ВИРУССОДЕРЖАЩЕЙ ЖИДКОСТИ ВЫСОКОЭНЕРГЕТИЧЕСКИМИ ЭЛЕКТРОНАМИ | 2024 |
|
RU2838518C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЛЕКАРСТВЕННОГО СРЕДСТВА, ОБЛАДАЮЩЕГО ПРОТИВОВИРУСНОЙ, ГЕПАТОПРОТЕКТОРНОЙ И ИММУНОСТИМУЛИРУЮЩЕЙ АКТИВНОСТЬЮ | 1999 |
|
RU2155051C1 |
| ИНАКТИВИРОВАННЫЕ ВАКЦИНЫ ПРОТИВ ВИРУСА ВЕТРЯНОЙ ОСПЫ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2011 |
|
RU2633058C2 |
| Комбинированный способ стерилизации костных имплантатов | 2016 |
|
RU2630464C1 |
| Способ патогенинактивации плазмы крови | 2021 |
|
RU2770646C1 |
| СПОСОБ ПОВЫШЕНИЯ СПЕЦИФИЧЕСКОЙ АКТИВНОСТИ АНТИТЕЛ IGG КЛАССА | 2003 |
|
RU2254874C2 |


Изобретение относится к технологии получения стерильной плазмы и препаратов из плазмы крови, а также в медицинской промышленности и биотехнологии. Способ включает в себя замораживание образцов плазмы или препаратов из плазмы крови, их обработку гамма-излучением с дозой 40-50 кГр с последующим размораживанием указанных образцов. Образцы препаратов крови замораживают со скоростью 0,2-2,0oС/мин до минус 60-196oС. Обработку гамма-излучением осуществляют дробно с перерывом между этапами облучения, а размораживание образцов после облучения производят со скоростью 20-30oС/мин до 5-10oС. Кроме того, образцы плазмы и препаратов из плазмы крови перед замораживанием могут быть дополнительно подвергнуты ультразвуковой обработке с определенной частотой и удельными поглощенными энергиями 103 - 106 кДж/кг. Предлагаемый способ стерилизации позволяет полностью инактивировать вирусные и другие микробные объекты с максимальным сохранением качества препаратов плазмы крови. 1 з.п. ф-лы, 9 табл., 1 ил.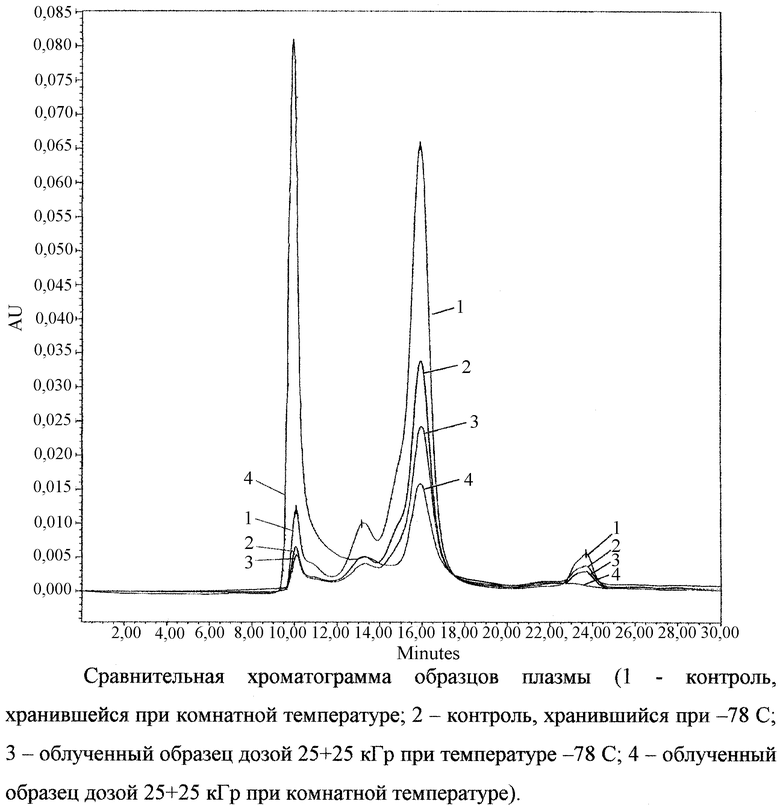
| 0 |
|
SU334679A1 | |
| US 4944918, А, 31.02.1990 | |||
| СПОСОБ СТЕРИЛИЗАЦИИ АМПУЛИРОВАННЫХ ЖИДКИХ ИНЪЕКЦИОННЫХ ПРЕПАРАТОВ И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ "СТЕРИЛИЗАТОР ВИТАГОР" | 1991 |
|
RU2036663C1 |
Авторы
Даты
2002-12-10—Публикация
2000-04-17—Подача