Изобретение относится к медицинской биотехнологии, а именно к производству медицинских биологических препаратов.
На современном этапе развития трансфузиологии и службы крови возрастает потребность в препаратах крови, в первую очередь в иммунных препаратах направленного действия. Актуальность получения иммунных препаратов связана, в частности, с тем фактом, что терапия инфекционных заболеваний антибиотиками зачастую бывает малоэффективной и связанной с побочными реакциями или безрезультатной из-за появления резистентных штаммов микроорганизмов. Необходимо также отметить, что потребности в лечебных и диагностических препаратах из донорской крови удовлетворяются пока еще недостаточно. Увеличение выпуска препаратов крови достигается главным образом за счет увеличения объема перерабатываемого сырья, роста трудовых и материальных затрат и в значительно меньшей степени за счет совершенствования технологического процесса. Это подтверждает целесообразность наращивания производства препаратов крови прежде всего за счет модифицирования технологических процессов.
Препараты иммуноглобулинов представляют собой концентрат антител, опсонизирующая, комплиментсвязывающая и нейтрализующая активность которых является основным фактором их клинической эффективности. Иммуноглобулины-антитела распознают и связывают антигены. Пулы плазмы от нескольких сотен доноров содержат антитела различных специфичностей, и иммуноглобулиновые препараты из таких пулов содержат также измеримые количества иммуноглобулинов, которые направлены против эпитопов вирусов, бактерий, паразитов, также против аутоантигенов. Вследствии этого они используются против многих инфекций и при самых различных иммунопатологических состояниях. При определенных обстоятельствах желательно применять иммуноглобулиновый препарат с высокой специфической активностью антител. До сих пор получение таких препаратов связано с большими затратами, трудоемкостью и высокой стоимостью специальных пулов плазмы доноров с повышенным содержанием специфических антител. Например, по многим показаниям иммунизацию доноров не осуществляют из-за развития побочных реакций, а отбор доноров после перенесения специфической болезни с высоким титром является дорогостоящей процедурой. К тому же донорская плазма может быть зараженной вирусами в предсерологической фазе, в частности, различными вирусами гепатита и СПИДа. Известно, что получение донорской плазмы крови и препаратов иммуноглобулинов с повышенным содержанием антител и высокой функциональной активностью возможно различными путями. В мировой практике с целью получения антительных специфических препаратов используют наиболее традиционные подходы: иммунизацию доноров, оттитровывание гипериммунного сырья - плазмы, аффинную очистку антител и более современный - получение моноклональных специфических антител (1, 2, 3). Для повышения специфической активности антител применяют множество специальных подходов и методов. Существует способ выделения антител из сырья с невысоким их титром с помощью аффинной хроматографии (противостолбнячный иммуноглобулин фирмы “Мерье”, Франция). Однако при получении противостолбнячного иммуноглобулина этим методом большое значение имеет начальное содержание антител в исходном сырье, не ниже 1-2 МЕ/мл (4). В литературе широко описываются методы усиления антительной активности с помощью химической модификации вариабельных доменов (5, 6), катионизации (7), гликозилирования (8), замены одного аминокислотного остатка на другой (9, 10), карбодиимид-обработки (11). В настоящее время способы повышения специфической активности антител методом криорадиационной обработки не описаны. Известно использование гамма-облучения для инактивации вирусов в плазме и в факторах свертывания (12). Гамма-радиация также использовалась для облучения клеточных компонентов крови с целью предупреждения HLA-аллоиммунизации и трансфузион-ассоциированных побочных реакций (13). При этом используемые дозы облучения были в пределах 25-50 кГр.
Наиболее широко в настоящее время гамма-облучение и схожие с ним типы облучения - Х-лучи, электронные лучи используют для стерилизации медицинского стекла, медицинских инструментов и устройств, пищевых продуктов, фармацевтических препаратов и лекарственных средств, в основном в дозах от 1 до 50 кГр (14).
Преимуществами данного способа являются технологичность, легкость исполнения, кратковременность и одномоментность воздействия. Технологичность также заключается в использовании стандартного оборудования для гамма-стерилизации, используемого при повседневной стерилизации медицинского инструментария, оборудования, ампул, продуктов питания и т.д.
Задачей, на решение которой направлено данное изобретение, является разработка нового способа повышения специфической активности антител в иммуноглобулин G-содержащих фракциях.
Технический результат выражается в повышении специфической активности иммуноглобулина G, увеличении титра, авидности и снижении атикомплементарной активности.
Впервые авторы изобретения для повышения специфической активности антител использовали метод криорадиационной обработки.
Сущность изобретения состоит в следующем: иммуноглобулин G-содержащие фракции - плазма или сыворотка крови человека, животных, или готовые препараты иммуноглобулина в жидком или лиофилизированном состоянии, полученные любым известным способом, замораживают при температуре минус 20-196°С и в замороженном состоянии подвергают радиационному облучению в дозах 5-50 кГр.
Способ осуществляют следующим образом. В качестве сырья используют иммуноглобулин G-содержащие фракции. Замораживают сырье до температуры от -20°С до -196°С любым известным способом, например в жидком азоте при температуре -196°С, в сухом льду при температуре -78°С, низкотемпературном холодильнике. Затем осуществляют гамма-облучение в дозах от 5 кГр до 50 кГр, поддерживая вышеуказанную температуру любым известным способом - в сухом льду, термостатированием подходящим агентом жидким азотом, фреоном, этиленгликолем. Радиационная обработка не приводит к значительным необратимым конформационным изменениям иммуноглобулинов именно при низких температурах от -20°С до -196°С. Дозы облучения менее 5 кГр не оказывают статистически значимого повышения специфических антител, дозы свыше 50 кГр могут вызвать денатурацию, полимеризацию иммуноглобулинов, и соответственно понизить функциональные свойства (15).
В качестве радиационного источника может применяться любое стандартное оборудование, коммерчески доступное во всех странах. Может быть использован электронный ускоритель (16) для получения электронных лучей. Альтернативно радиационным (гамма) источником может быть использован - RS 3000 Blood Irradiator (Rad Source Technologies, Inc. Announces the Acquisitionof Rad Source, Inc. of Coral Springs, Fla) - для продуцирования X-лучей.
Определение титров специфических антител может осуществляться любыми доступными иммуноферментными тест-системами, предназначенными для определения антител IgG класса.
Радиационную обработку плазмы и препаратов иммуноглобулина проводили на гамма-установке РЦ-100М с мощностью поглощенной дозы 60-110 Гр/мин.
Специфическая активность антител в донорской плазме и препаратах иммуноглобулинов оценивали методом иммуноферментного анализа in vitro и в реакции биологической нейтрализации на белых мышах in vivo no общепринятой методике (17). С целью определения уровня функциональной активности антител (in vitro) определяли индекс авидности. Как известно, эффективность антител зависит не только от содержания антител, но и от силы связывания антигенов этими антителами. Сила связывания антител может быть охарактеризована авидностью и аффинностью. (18) Аффинность - это прочность связи одного антигенсвязывающего центра антитела с индивидуальным эпитопом антигена. Авидность - это функциональная аффинность, суммарная сила взаимодействия антитела с антигеном. Высокоаффинные антитела гораздо активнее низкоаффинных в таких биологических реакциях как связывание комплемента, опсонизация. нейтрализация вирусов и т.д. (19). В литературе имеются многочисленные данные, в которых отражена корреляция активности антител с авидностью. Например, с увеличением авидности антител снижается концентрация антител, необходимая для гибели пневмококка (20).
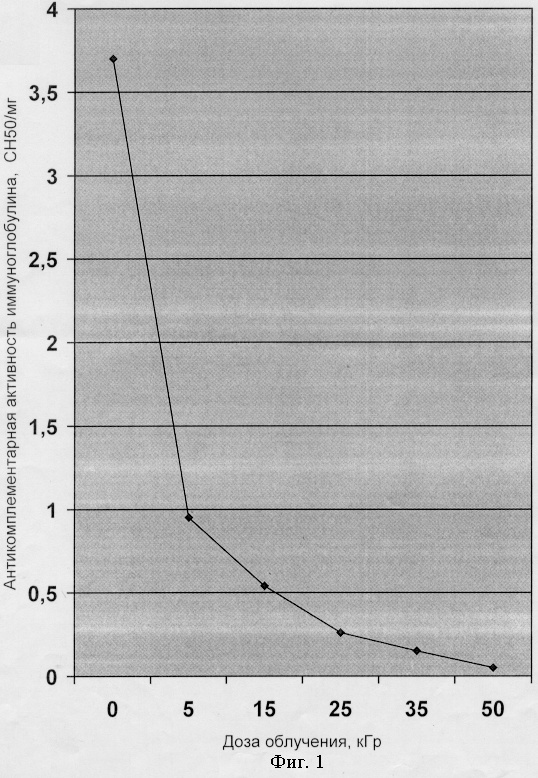
Заявляемый способ позволил получить следующие преимущества. Криорадиационная обработка позволила получить повышение титров специфических антител в донорской плазме крови и препаратах иммуноглобулинов в 1,2-4,0 раза (табл.1), повышение нейтрализующей активности препаратов иммуноглобулина, повышение авидности иммуноглобулинов.
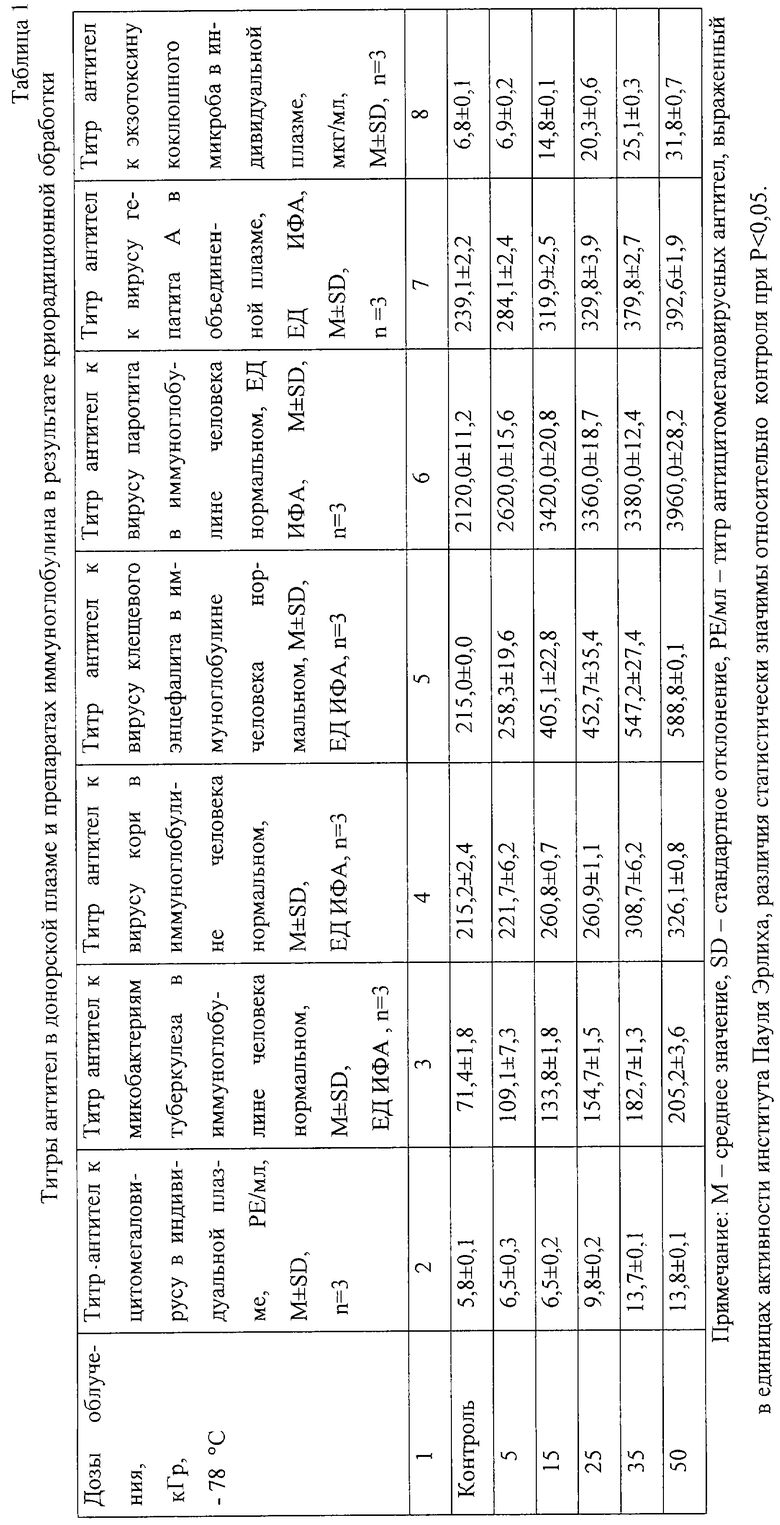
Криорадиационная обработка значительно снизила антикомплементарную активность (АКА) до пределов 1 и менее СН50/ мг, разрешающих клиническое внутривенное применение (фиг.1), так как при радиационой обработке происходит избирательная модификация Fc полисахаридной части иммуноглобулина, ответственной за связывание комплемента. Снижение АКА иммуноглобулина до указанных выше пределов предотвращает развитие анафилактических реакций при внутривенном введении. Значительное понижение АКА в настоящее время было возможно только в результате специальной обработки либо ферментативной - пепсином, либо химической - бета-пропиолактоном. В отличие от пепсиновой обработки гетерологичным чужеродным свиным пепсином преимуществом гамма-облучения является минимальное содержание фрагментов после обработки. Препараты иммуноглобулинов оценивали по следующим методикам: молекулярные параметры определяли на сефадексе G200 (21), антикомплементарную активность - по Европейской Фармакопее (22).
Примеры конкретного выполнения.
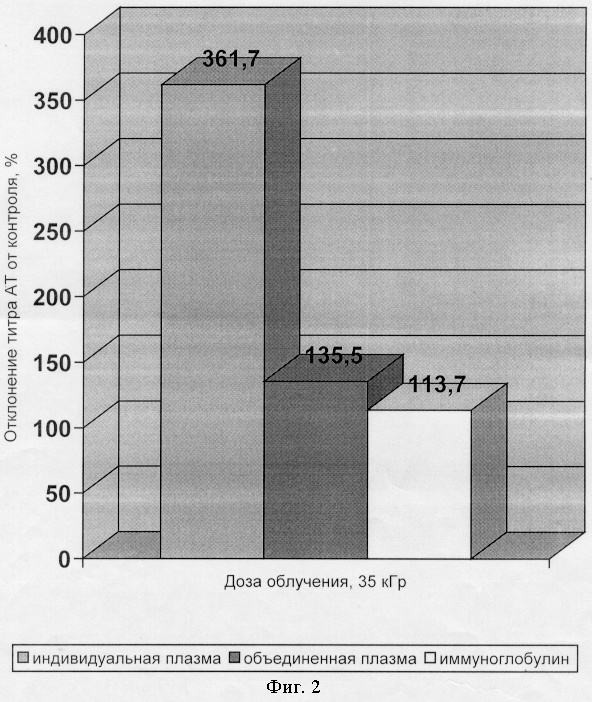
Пример 1. Сырье - индивидуальная донорская плазма, объединенная донорская плазма от 300 доноров и препарат иммуноглобулина человека нормальный замораживали при минус 196°С в жидком азоте. Затем осуществляли гамма-облучение в дозе 35 кГр, поддерживая вышеуказанную температуру в процессе облучения. Определение титра антител к цитомегаловирусу осуществляли иммуноферментным методом в тест-системе “ЦМВ-скрин” фирмы “Биосервис”, Москва. Полученные результаты представлены на фиг.2. Как видно из чертежа использование предлагаемого метода в значительной степени повышает титры специфических антител в донорской плазме и препаратах иммуноглобулина.
Пример 2. Сырье - препарат иммуноглобулина человека нормальный, полученный методом Кона, замораживали при минус 20°С в морозильнике. Затем осуществляли гамма-облучение в дозе 25 кГр, поддерживая вышеуказанную температуру в процессе облучения. Авидность антицитомегаловирусных антител определяли с помощью иммуноферментной тест-системы для выявления низкоавидных иммуноглобулинов G к цитомегаловирусной инфекции “ЦМВ-Диагност” фирмы “Биосервис”, Москва. Согласно инструкции по ее применению высокоавидными считали образцы с индексом авидности более 42%. В результате криорадиационной обработки титр антицитомегаловирусных антител, достигаемый в полученном препарате иммуноглобулина, оказывался в 1,6 раза выше, чем в необлученном препарате иммуноглобулина. Как видно из представленных данных (табл.2) использование предлагаемого способа позволяет получить препарат с более высоким титром антител к цитомегаловирусу и существенно повысить авидность антицитомегаловирусных антител с 42% до 65%.
Пример 3. Сырье - иммуноглобулин лошадиный антирабический (“Биолек”, Украина) замораживали при температуре минус -78°С в низкотемпературном холодильнике. Затем осуществили гамма-облучение в дозе 35 кГр, поддерживая вышеуказанную температуру в процессе облучения с помощью сухого льда. Определение содержания антирабических антител осуществили методом иммуноферментного анализа (23, 24) и в реакции биологической нейтрализации (17). Полученные результаты приведены в табл.3. Как видно из представленных данных использование предлагаемого способа в значительной степени повышает титр антирабических антител по данным ИФА в 3,8 раза и протективную активность в 1,8 раза.
Пример 4.
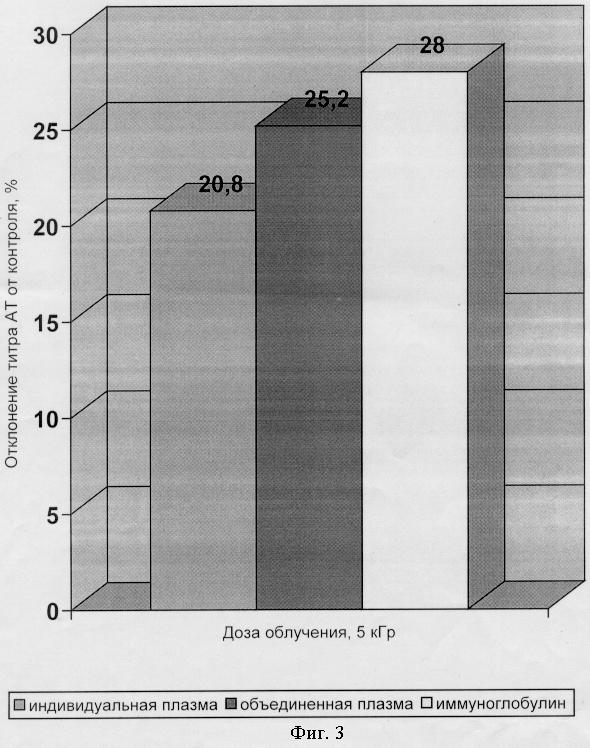
Сырье - индивидуальная плазма от 5 доноров, объединенная донорская плазма от 300 доноров и препарат иммуноглобулина человека нормальный (полученный методом Кона), замораживали при минус 50°С в морозильнике. Затем осуществляли гамма-облучение в дозе 5 кГр, поддерживая вышеуказанную температуру в процессе облучения. Определение титра антител к вирусу гепатита А осуществляли иммуноферментным методом в тест-системе фирмы “Вектор-Бест”, Новосибирск. Полученные результаты представлены на фиг.2. Как видно из чертежа использование предлагаемого метода в значительной степени повышает уровень специфических антител в донорской плазме и препаратах иммуноглобулина.
Список литературы
1. ЕР 0664834. Recombinanant humanized anti-citomegalovirus antibodies. A 61 K 39/42. Дата публикации 1995-08-16.
2. Tardy M. et al. In: Cromatography of syntetic and biological polimers (R. Epton, ed.), Chimestr: Ellis Horwood, 1978, 2, 298-313.
3. US Patent 5811524. Neutralising high affinity human monoclonal antiebodies specific to RSV F - protein and methods for their manufacture and therapeutic use their. Brams; Peter; Chamat; Soulaima Salim; Pan; Li-Zhen; Walsh; Edvard E.; Heard; Cheryl Janne; Newman; Roland Anthony. CO07 K016/00, A 61 K 039/395. Publication date 1998-03-22.
4. US Patent 5215889. Modified antibodies with increased affinity. J.Bruce. Linn, Jr. C.Preston, Mize, Patrick D. - 1993.
5. Kamyshny A., Magdassi S., Relkin P. Chemically modified human immunoglobulin G: hydrophobicity and surface activity at air/solution interface. // J. of Colloid and Interface Science, - 1999-212. - P.74-80.
6. US Patent 5821123. Modified antibody variable domens. Studnicka Gary M. A61K39/395. Publication date 1998-10-13.
7. Pardridge W.M., Buciak J., Yang J., Diagne A. Treatment of human immunodeficiency virus-infected lymfocytes with cationized human immunoglobulins //J. Infect. Dis. - 1994. - Sep. - 170(3). - P.563-572.
8. US Patent 5714350. Increasing antibody affinity by altering glycocosylation in the immunoglobulin variable region. Co; Man Sang; Scheinberg; David A.; Queen; Cary L. A61K039/395. Publication date 1998-02-03.
9. US Paten 5624821. Antibodies with altered effector functions. Winter; Gregory P.; Duncan; Alexander R.; Burton; Dennis R. A61K039/395. Publication date 1997-04-10.
10. US Patent 5367058. Modified antibodies with increased affinity. Pitner; J. Bruce; Linn, Jr. C. Preston; Mize; Patrick D. C 07 K 015/28. Publication date 1994-11-22.
11. Winkelhake J.L. Effects of chemical modification of antibodies on their clearance from the circulation. Addition of sample aliphatic compounds by reductive alkylation and carbodiimide-promoted amide formation. // J. Biol. Chem. - 1977. - 252(6). - P.1865-1873.
12. HiemstraH., Tersmette at al. Inactivation of humanimmunodeficiency virus by gamma radiation and its effect on plasma and coagulation factors. // The journal of the American Association of Blood Banks. - 1991. - V.31. -.№1.
13. Donna Przepiorka MD, PHD, German F. Leparc MD, Marilyn A. Stovall MPH, Jochewed Werch MD, Benjamin Lichtiger MD, PHD // Use of irradiated blood components. - American Journal of Clinical Pathology. - 1996. - Vol.106. №1.
14. FDA.1997. Irradiation in the production, processing and handling of food. Federal Register 62(232):64107-64121).
15. Нигматуллин Т.Г., Мирхайдарова М.Р., Гареева А,Б., Трофимов В.И. Криорадиационная стерилизация в производстве препаратов иммуноглобулинов. / Роль иммунобиологических препаратов в современной медицине. Материалы международного симпозиума. Уфа, 1995, ч.2, с.129-133.
16. Auslender V.L., Meshkov I.N., Powerful single-cavity RF accelerators and their use in the industrial radiation chemical processing lines. Radiat. Phys.Chem.35, 627.
17. Методы лабораторных исследований по бешенству, ВОЗ, 1975.
18. Роит А., Бростофф Дж., Мейл Д. Иммунология. М.: Мир. 2000. С.528.
19. Bachmann M.F., Kalinke U. The role antibody concentration and avidity in antiviral protection. Science. - 1997. - v.276. - p.2024.
20. Romero-Steiner Sandra, Mushe Daniel M., Cetron Marty S., Pais Lorna В., Groover Jean E., Fiore Antony E., Plikaytis Briand, Carlone George M. Reduction infunctional antibody activity against Streptococcus pneumoniae in vaccinated elderly individuals highly correlateswith decreased IgG antibody avidity. // Clin. Infec. Deseases. - 1999. - 29, N 2. - Р.281-291.
21. ФС 42-344ВС-90 Физико-химические, химические, физические и иммунохимические методы контроля медицинских иммунобиологических препаратов.
22. Методические указания по определению антикомплементарной активности препаратов иммуноглобулинов // Т.А.Крайнева, В.В.Анастасиев, Т.В.Короткова, Т.Б.Значинская // Москва, 1997. С.1-16.
23. Хисматуллина Н.А., Юсупов Р.Х. ТУ 9388-083-00008064-98 к “Набору препаратов для лабораторной диагностики бешенства методом иммуноферментного анализа (ИФА)” Утв. ДВ МСХ и П РФ 11.12.98 г.
24. Хисматуллина Н.А., Юсупов Р.Х., Янбарисова С.Р. и др. Методические указания по лабораторной диагностике бешенства животных. Утв. ДВ МСХ и П.14.05.97 г. - Казань, 1997.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРЕПАРАТ ИММУНОГЛОБУЛИНА ЧЕЛОВЕКА ПРОТИВ ЦИТОМЕГАЛОВИРУСА ДЛЯ ВНУТРИВЕННОГО ВВЕДЕНИЯ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2009 |
|
RU2404250C1 |
| ПРЕПАРАТ ИММУНОГЛОБУЛИНА ЧЕЛОВЕКА ПРОТИВ ЦИТОМЕГАЛОВИРУСА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2002 |
|
RU2239453C2 |
| Способ получения антирабического иммуноглобулина | 1990 |
|
SU1745257A1 |
| Способ получения антирабического иммуноглобулина человека | 1983 |
|
SU1258417A1 |
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОГЛОБУЛИНА ДЛЯ ВНУТРИВЕННОГО ВВЕДЕНИЯ, ОБОГАЩЕННОГО ИММУНОГЛОБУЛИНОМ М, И ПРЕПАРАТ, ПОЛУЧЕННЫЙ ЭТИМ СПОСОБОМ | 2010 |
|
RU2470664C2 |
| ПРЕПАРАТ, СОДЕРЖАЩИЙ ИММУНОГЛОБУЛИН ПРОТИВ БОЛИВИЙСКОЙ ГЕМОРРАГИЧЕСКОЙ ЛИХОРАДКИ ИЗ СЫВОРОТКИ КРОВИ ЛОШАДЕЙ, РАСТВОР ДЛЯ ВНУТРИМЫШЕЧНОГО ВВЕДЕНИЯ | 2007 |
|
RU2342952C1 |
| ПРЕПАРАТ ГЕТЕРОЛОГИЧНОГО АНТИРАБИЧЕСКОГО ИММУНОГЛОБУЛИНА ДЛЯ ВНУТРИВЕННОГО И ВНУТРИМЫШЕЧНОГО ВВЕДЕНИЯ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2006 |
|
RU2339401C2 |
| ПРЕПАРАТ, СОДЕРЖАЩИЙ ИММУНОГЛОБУЛИН ПРОТИВООСПЕННЫЙ ИЗ СЫВОРОТКИ КРОВИ ЛОШАДЕЙ, РАСТВОР ДЛЯ ВНУТРИМЫШЕЧНОГО ВВЕДЕНИЯ | 2007 |
|
RU2342951C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОГЛОБУЛИНА ПРОТИВОДИФТЕРИЙНОГО ЧЕЛОВЕКА | 1995 |
|
RU2150960C1 |
| СПОСОБ ЛЕЧЕНИЯ ОСТРОЙ ОЖОГОВОЙ ТОКСЕМИИ ОРГАНИЗМА И СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА ДЛЯ ЛЕЧЕНИЯ ОСТРОЙ ОЖОГОВОЙ ТОКСЕМИИ ОРГАНИЗМА | 2016 |
|
RU2647414C2 |
Изобретение относится к области медицинской биотехнологии и касается производства медицинских биологических препаратов. Сущностью изобретения является повышение специфической активности иммуноглобулинов класса G за счет того, что фракции, содержащие иммуноглобулин G, замораживают до температуры от -20 до -196°С и подвергают гамма-облучению в дозах 5-50 кГр с мощностью поглощенной дозы 60-110 Гр/мин. Техническим результатом является повышение специфической активности иммуноглобулина G, увеличение титра, авидности и снижение антикомплементарной активности. 3 табл., 3 ил.
Способ повышения специфической активности иммуноглобулинов класса G, отличающийся тем, что фракции, содержащие иммуноглобулин G, замораживают до температуры от -20 до -196°С и подвергают гамма-облучению в дозах 5-50 кГр с мощностью поглощенной дозы 60-110 Гр/мин.
| US 5714350 А, 03.02.1998 | |||
| US 5367058 А, 22.11.1994 | |||
| ТЕРСКИХ В.А | |||
| и др | |||
| Пути к повышению специфической активности человеческого противоэнцефалитного иммуноглобулина, Новое в трансфузиологии, 1999, №23, с.81-84. |
Авторы
Даты
2005-06-27—Публикация
2003-07-25—Подача