Изобретение относится к химической технологии и неорганической химии и может быть использовано для получения соединений лития и ванадия, находящих применение в качестве материалов для литиевых аккумуляторов или в качестве катализаторов.
В последнее время в связи с бурным производством и применением персональных компьютеров, видеокамер, сотовых телефонов и другой многочисленной портативной техники сильно возрос спрос на малогабаритные аккумуляторные батареи. Основное внимание уделяется литий-ионным аккумуляторам, обладающим высокой удельной энергией, небольшой массой и безопасностью. В качестве катодных материалов в таких аккумуляторах используются оксиды лития и переходных металлов со слоистой или шпинельной структурой. Одним из перспективных соединений этой группы является литий-ванадиевый оксид, Li1+xV3O8, который обладает высокой емкостью и электропроводностью, стабилен на воздухе и относительно просто получается.
Для повышения рабочих характеристик Li1+xV3O8, как катодного материала, необходимо 1) уменьшить размеры его частиц, т.е. увеличить удельную поверхность, что позволит проводить процесс интеркаляции/деинтеркаляции лития при разряде/заряде аккумулятора в кинетическом режиме; 2) создать структуру, более устойчивую к процессам интеркаляции/деинтеркаляции лития, что должно предотвратить появление при разряде/заряде новых фаз с более эффективной электронной структурой и, тем самым, обеспечить стабильность процесса циклирования.
Вэдслей установил [1] , что Li1+xV3О8 - это бронзоподобное соединение, которое кристаллизуется в пространственной группе Р21/m. Структура сформирована октаэдрами VO6, сгруппированными в зигзагообразные цепи. Слои удерживаются между собой ионами лития. Часть ионов ванадия в Li1+xV3O8 находится в степени окисления 4+. Изогнутость цепей и длина диффузионных каналов в структуре Li1+xV3O8, электронное состояние ионов ванадия, а также кристалличность и размеры частиц продукта могут варьироваться в зависимости от способа получения.
Известен способ получения Li1+xV3O8, в котором синтез осуществляют из V2O5 и Li2СО3 при 560oС в течение 24-28 часов в твердой фазе [2]. Для получения однородного продукта в результате твердофазного взаимодействия производят промежуточные перетирания смеси.
Недостатком данного способа является его длительность и трудоемкость, а также невысокая удельная поверхность и емкость при циклировании.
Известен способ получения Li1+xV3O8, в котором с целью ускорения процесса синтеза и получения однородного продукта указанную выше смесь плавят при 680oС в течение нескольких часов [3].
Недостатком указанного способа, помимо невысокой удельной поверхности, является выделение ядовитых газообразных паров V2O5, а также агрессивное воздействие расплава на поверхность рабочих контейнеров.
Для устранения указанных недостатков используют низкотемпературные способы получения.
Так, в [4, 5] показано, что улучшить электрохимические показатели Li1+xV3O8 можно путем уменьшения размеров частиц, а также путем получения материала в аморфном состоянии. В известном способе [4] в раствор, содержащий 2 моля LiOH, медленно добавляли 3 моля V2O5 при непрерывном перемешивании. В результате медленного растворения V2O5 в течение 24-30 ч раствор приобретал красно-коричневую окраску, характерную для бронз. Осадок отфильтровывали, промывали Н2О или СН3ОН и сушили под вакуумом. После ручного перетирания получали мелкий и аморфный, в соответствии с данными РФА, порошок. Установлено, что приготовленный указанным способом Li1+xV3O8 содержит в межслоевом пространстве большое количество воды. Отсутствие длиннодействующего кристаллографического порядка уменьшает диффузионные пути для ионов лития. В результате увеличения межслоевого пространства аморфный Li1+xV3O8 способен включать до 9 Li+ на 1 молекулу Li1+xV3O8 вместо 6 Li+ в кристаллическом образце. Это становится возможным благодаря повышенной гибкости цепей из-за большей подвижности VO6 октаэдров. Кроме того, гидратированный аморфный Li1+xV3O8 перспективен в использовании в аккумуляторах с высокими скоростями разряда.
Известен способ [5], согласно которому смеси Li2СО3 и NН4VО3 с атомным соотношением Li/V= l/3 растворяли в воде при перемешивании и нагревании. Через 0,5-1 ч твердые соли полностью переходили в кипящий раствор. Полученный раствор выпаривали и сушили при 300-400oС в атмосфере N2 в течение 10 ч.
Недостатками указанных низкотемпературных способов являются длительность процесса и образование в ходе получения Li1+xV3O8 большого количества сточных вод.
Наиболее близким по технической сущности (прототип) является способ получения высокодисперсного Li1+xV3O8 [6] , согласно которому Li1+xV3O8, полученный из Li2СО3 и V2O5 при 630oС, измельчают в вибромельнице, а затем прессуют с усилием более 15 т/см2. При этом размер частиц уменьшается с 40 мкм (после измельчения) до 1 мкм.
Недостатком указанного способа является многоступенчатость процесса, включая первоначальный высокотемпературный синтез Li1+xV3O8 в расплаве, измельчение и прессование. Кроме этого, использование вибромельницы для измельчения уже синтезированных сложных оксидов, обладающих, как правило, высокой твердостью, ведет к загрязнению размалываемого вещества материалом мелющих тел.
Задача изобретения - упрощение способа получения Li1+xV3O8; создание более простого и экологически чистого способа, исключающего как образование ядовитых паров соединений ванадия, так и токсичных сточных вод; получение Li1+xV3O8 в высокодисперсном состоянии с кристаллической и электронной структурой, облегчающей процесс интеркаляции/деинтеркаляции ионов лития при циклировании.
Поставленная задача решается за счет того, что в заявляемом способе получения высокодисперсного литий-ванадиевого оксида, Li1+xV3O8 , включающем использование соединений лития и ванадия, их смешение и измельчение, исходные соединения лития и ванадия подвергают совместной механической активации (МA) на воздухе в активаторах при подводимой мощности 10-50 Вт/ч в течение 1-10 мин при отношении массы реагентов к массе активирующих тел 0,025-0,05 и атомном отношении Li/V=1,0/3-1,1/3.
При необходимости для завершения химического взаимодействия реагентов в смесях, активированных в условиях (времени и подводимой мощности), недостаточных для получения однофазного кристаллического продукта, активированную смесь подвергают термической обработке при температуре 200-400oС в течение 1-4 ч.
В качестве активирующих аппаратов предпочтительно используют центробежно-планетарные мельницы.
Указанная совокупность признаков является новой и обладает изобретательным уровнем, так как использование метода механической активации с указанной мощностью, выбранное атомное отношение Li/V и отношение массы реагентов к массе активирующих тел позволяет проводить процесс синтеза продукта непосредственно путем механической активации, а также с последующей термической обработкой активированных смесей для расширения свойств Li1+xV3O8.
Исходными реагентами в данном способе получения могут являться LiOH, LiOH•H2O, Li2СО3, Li2O, Li2O2 и V2О5.
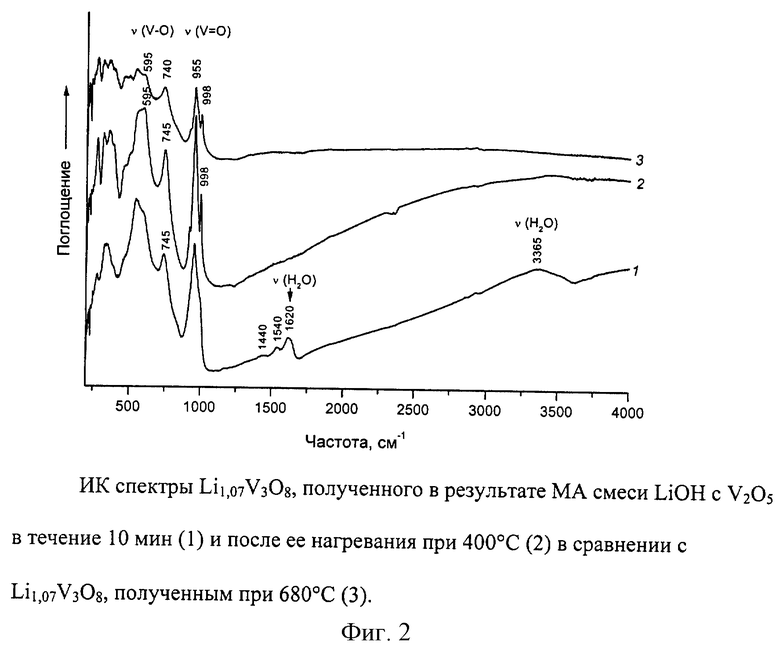
Изобретение поясняется фиг.1 и 2.
По данным рентгенофазового анализа и ИК спектроскопии после 10 мин МА смеси LiOH (или LiOH•H2O, или Li2СО3) с V2O5 образуется рентгеноаморфный продукт - Li1+xV3O8, содержащий в своей структуре остаточные молекулы Н2О или СО2. Термическая обработка продукта при 200-400oС приводит к удалению остаточных молекул Н2О и СО2 и процессу кристаллизации, сопровождающемуся небольшим уменьшением удельной поверхности. Удельная поверхность Li1+xV3O8, полученного в результате МА и отжига при 400oС, составляет 7 м2/г, в то время как для образца, полученного традиционным высокотемпературным способом, - 2-3 м2/г.
При уменьшении времени МА до 1-3 мин наблюдается неполное взаимодействие реагентов: на дифрактограммах и ИК спектрах присутствуют рефлексы и полосы поглощения исходных соединений. Однако нагревание активированных образцов при 200-400oС приводит к получению однофазного кристаллического конечного продукта. При большем уменьшении времени МА (меньше 1 мин) последующий нагрев вплоть до 400oС сопровождается образованием неоднородной смеси продуктов: бронз различного состава и исходных соединений.
Уменьшение подводимой удельной мощности, как и увеличение отношения массы реагентов к массе активирующих тел, приводят к аналогичным результатам. Напротив, увеличение времени МА, подводимой мощности или уменьшение отношения массы реагентов к массе активирующих тел приводят, с одной стороны, к ускорению процесса синтеза и кристаллизации конечного продукта с одновременным удалением адсорбированных молекул Н2О и СО2, а с другой - к загрязнению продукта материалом мелющих тел и повышению энергозатрат.
Выбранный интервал температур является оптимальным, поскольку он обеспечивает завершение протекания химического взаимодействия, с одной стороны, и не приводит к резкому уменьшению удельной поверхности, с другой. В заявляемом способе атомное отношение Li/V в исходной смеси реагентов должно составлять 1,0/3-1,1/3. С уменьшением Li/V, помимо Li1+xV3O8, образуются литий-ванадиевые бронзы другого состава, а при увеличении - примесь LiVО3.
По данным ЭПР спектроскопии образцы Li1+xV3O8, полученные с применением МА и отжига при 200-400oС, характеризуются наличием ионов ванадия VO2+ с сильным обменным взаимодействием, осуществляемым посредством электронного газа в структуре. Такая электронная структура синтезированных образцов должна приводить к хорошей электрохимической и каталитической активности.
Примеры конкретного выполнения заявляемого способа.
Пример 1. Для получения Li1+xV3O8 взята смесь гидроксида лития LiOH и пентоксида ванадия V2O5 с атомным отношением Li/V=1,0/3 и подвергнута механической активации при удельной мощности 50 Вт/г в течение 10 мин, отношение массы реагентов к массе активирующих тел 0,025. Методом РФА и ИКС установлено, что продуктом реакции является однофазный аморфный Li1+xV3O8, содержащий в своей структуре остаточные молекулы Н2О. Данный продукт может быть использован в качестве катодного материала.
Пример 2. В условиях примера 1 проведена механическая активация смеси гидроксида лития LiOH и пентоксида ванадия V2O5, взятых с атомным отношением Li/V= 1,1/3. Получен однофазный аморфный продукт - Li1+xV3O8, содержащий в своей структуре остаточные молекулы Н2О.
Пример 3. В условиях примера 1 проведена механическая активация смеси карбоната лития Li2CO3 и пентоксида ванадия V2O5. Получен однофазный аморфный продукт - Li1+xV3O8, содержащий в своей структуре остаточные молекулы СО2.
Пример 4. В условиях примера 1 проведена механическая активация и последующая термообработка смеси гидроксида лития LiOH и пентоксида ванадия V2O5 при 200oС в течение 4 ч. Продукт отличается большей кристалличностью и пониженным по сравнению с продуктом, полученным в условиях примера 1, содержанием примесных молекул. Удельная поверхность составляет 7,5 м2/г.
Пример 5. В условиях примера 1 проведена механическая активация и последующая термообработка смеси гидроксида лития LiOH и пентоксида ванадия V2O5 при 400oС в течение 4 ч. Продукт отличается высокой кристалличностью и отсутствием примесных молекул. Удельная поверхность 6,9 м2/г. Данный продукт может быть использован в качестве катодного материала и катализатора.
Пример 6. В условиях примера 1 проведена механическая активация смеси гидроксида лития LiOH и пентоксида ванадия V2O5 в течение 1 мин. Продукт представляет собой смесь плохоокристаллизованных бронз различного состава и исходных реагентов. После термообработки активированной смеси при 400oС в течение 4 ч продукт представляет собой однофазный кристаллический Li1+xV3O8 с удельной поверхностью 6,7 м2/г.
Пример 7. В условиях примера 1 проведена механическая активация смеси гидроксида лития LiOH и пентоксида ванадия V2O5 в течение 10 мин при удельной мощности 10 Вт/г. Продукт представляет собой смесь исходных реагентов. После термообработки активированной смеси при 400oС в течение 4 часов продукт представляет собой однофазный Li1+xV3O8 с удельной поверхностью 6,8 м2/г.
Источники информации
1. A. D. Wadsley. Crystal chemistry of non-stoichiometric pentavalent vanadium oxides: crystal structure of Li1+xV3O8. Acta crystallorg. 10 (1957), 261-267.
2. D. G. Wickham. A study of the solid solutions Li1+xV3O8+λ and the preparation of LiVO3, and Li3VO4. Inorg. Nucl. Chem. 27 (1965), 1939-1946.
3. S. Panero, M. Pasquali, G. Pistoia. Rechargeable Li/Li1+xV3O8 cells. J. Electrochem. Soc. 130 (1983), 1225-1226.
4. G. Pistoia, M. Pasquali, G. Wang, L. Li. Li/Li1+xV3O8 secondary batteries. Synthesis and characterization of an amorphous form of the cathode. J. Electrochem. Soc. 137 (1990), 2365-2370.
5. J. Dai, S. F.Y. Li, Z. Gao, K.S. Siow. Low-temperature synthesized LiV3O8 as a cathode material for rechargeable lithium batteries. J. Electrochem. Soc. 145 (1998), 3057-3062.
6. G. Pistoia, M. Pasquali, Y. Geronov, V. Manev, R.V. Moshtev. Small particle-size high-rate rechargeable lithium batteriaes. J. Power Sources 27 (1989), 35-43.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ СОЕДИНЕНИЯ LiMnO СО СТРУКТУРОЙ ШПИНЕЛИ | 1998 |
|
RU2132818C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГАММА-АЛЮМИНАТА ЛИТИЯ | 2004 |
|
RU2251526C1 |
| Способ получения композиционного катодного материала на основе NaV(PO)F для натрий-ионных аккумуляторов | 2020 |
|
RU2747565C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГАММА-АЛЮМИНАТА ЛИТИЯ | 2007 |
|
RU2347749C1 |
| Способ получения твердого электролита LiAlTi(PO) для твердотельных литий-ионных аккумуляторов | 2023 |
|
RU2821885C1 |
| Способ получения композита ортованадат лития/углерод | 2018 |
|
RU2683094C1 |
| Способ получения композиционного анодного материала TiNbO/C для литий-ионных аккумуляторов | 2022 |
|
RU2799067C1 |
| СПОСОБ ПОЛУЧЕНИЯ ВИСМУТА ГАЛЛОВОКИСЛОГО ОСНОВНОГО | 2001 |
|
RU2193013C2 |
| ДИСПЕРСНЫЙ ГЕЛЕОБРАЗУЮЩИЙ СОСТАВ ДЛЯ РАЗРАБОТКИ НЕФТЯНЫХ МЕСТОРОЖДЕНИЙ ЗАВОДНЕНИЕМ | 2002 |
|
RU2211316C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТЕРМОСТОЙКИХ НЕОРГАНИЧЕСКИХ ПИГМЕНТОВ | 1997 |
|
RU2114886C1 |
Изобретение относится к технологии синтеза соединений ванадия и лития для литий-ионных аккумуляторов или катализаторов. Смесь исходных соединений лития и ванадия подвергают механической активации путем измельчения в центробежно-планетарных мельницах. Мощность, подводимая к активатору, 10-50 Вт/г. Время активации 1-10 мин. Отношение массы реагентов к массе активирующих тел 0,025:0,05. Атомное соотношение Li:V=1,0/3-1,1/3. При необходимости активированную смесь подвергают термообработке при 200-400oС в течение 1 - 4 ч. Способ позволяет получать высокоактивный литий-ванадиевый оксид. 2 з.п. ф-лы, 2 ил.
| PISTOIA G | |||
| et al, Small particle-size high-rate rechargeable lithium batteries, J.Power Sources, 1989, v.27, p.35-43 | |||
| SU 215910 A, 11.04.1968 | |||
| Способ получения гексаванадата лития | 1986 |
|
SU1388386A1 |
| US 5520903 A, 28.05.1996 | |||
| Экономайзер | 0 |
|
SU94A1 |
| WO 00/44673 А1, 03.08.2000. | |||
Авторы
Даты
2002-12-10—Публикация
2001-02-22—Подача