Область техники, к которой относится изобретение
Изобретение относится к химической технологии, а именно, к новому способу получения высокодисперсного твердого электролита Li1,3Al0,3Ti1,7(PO4)3 с улучшенными проводящими свойствами для литий-ионных аккумуляторов.
Уровень техники
В настоящее время идет непрерывный процесс совершенствования существующих устройств накопления энергии для удовлетворения разнообразных потребностей общества, начиная от мелкосерийной бытовой электроники и заканчивая крупногабаритными транспортными средствами и сетевыми накопителями энергии. Накопители энергии на основе перезаряжаемых литий-ионных аккумуляторов (ЛИА) являются наиболее перспективными и часто используемыми благодаря своим характеристикам (высокая удельная энергия и продолжительный срок службы), которые превосходят все другие виды аккумуляторов [1. Scrosati, B., Hassoun, J., Sun, Y.K. Lithium-Ion Batteries. A Look into the Future. Energy Environ. Sci. - 2011. - V.4. - P. 3287-3295]. Увеличение сфер применения ЛИА требует дальнейшего увеличения их емкостных и мощностных характеристик, снижения скорости деградации и повышения безопасности в процессе эксплуатации и хранения.
Среди большого разнообразия электродных материалов для ЛИА можно выделить катодные материалы со слоистой структурой (LiCoO2), структурой шпинели (LiMn2O4) и структурой оливина (LiFePO4), а также анодные материалы со слоистой структурой (графит С), структурой шпинели (Li4Ti5O12) и блочной структурой кристаллографического сдвига (TiNb2O7). Усовершенствование электрохимических характеристик данных типов электродных материалов позволяет увеличить энергоемкость аккумулятора в целом, однако проблемы, связанные с использованием жидкого электролита, остаются нерешенными.
Используемый на сегодняшний день жидкий электролит, состоящий из солей лития и органических растворителей, является токсичным и воспламеняемым, что ограничивает области применения ЛИА [2. Xu, K. Nonaqueous Liquid Electrolytes for Lithium-Based Rechargeable Batteries. Chem. Rev. - 2004. - V.104. - P. 4303-4418; 3. Xing, J., Bliznakov, S., Bonville, L., Oljaca, M., Maric, R. A Review of Nonaqueous Electrolytes, Binders, and Separators for Lithium-Ion Batteries. Electrochemical Energy Reviews. - 2022. - V.5. - P. 1-34]. Альтернативой жидким электролитам могут выступать высокопроводящие твердые электролиты, которые являются термически устойчивыми и экологически безопасными, что позволяет использовать аккумуляторы на их основе как при комнатной температуре, так и при повышенных температурах [4. Bachman, J.C., Muy, S, Grimaud, A, Chang, H.-H., Pour, N., Lux, S.F., Paschos, O., Maglia, F., Lupart, S., Lamp, P., Giordano, L., Shao-Horn, Y. Inorganic Solid-State Electrolytes for Lithium Batteries: Mechanisms and Properties Governing Ion Conduction. Chem. Rev. - 2016 - V.116. - P. 140-162]. Замена жидкого электролита твердым электролитом может обеспечить более длительный срок службы аккумулятора, а также позволит увеличить плотность энергии за счет отсутствия сепараторов.
В настоящее время предложен ряд литий-проводящих твердых электролитов, среди которых наиболее интересными являются твердые полимерные электролиты [5. Zhou, D, Shanmukaraj, D, Tkacheva, A., Armand, M., Wang, G. Polymer Electrolytes for Lithium-Based Batteries: Advances and Prospects. Chem. - 2019. - V.5. - P. 2326-2352.], аргиродиты Li6PS5X (где X = Cl, Br, или I) [6. Zhou, L., Park, K.-H., Sun, X., Lalère, F., Adermann, T., Hartmann, P., Nazar, L.F. Solvent-Engineered Design of Argyrodite Li6PS5X (X = Cl, Br, I) Solid Electrolytes with High Ionic Conductivity. ACS Energy Lett. - 2019. - V.4. - P. 265-270.], гранаты Li6La3Zr2O12 [7. Zhao, N., Khokhar, W., Bi, Z. Shi, C. Guo, X., Fan, L.-Z, Nan, C.-W. Solid Garnet Batteries. Inorg. Chem. - 2013. - V.52. - P. 9290-9296; 8. Subramanian, K., Alexander, G.V., Karthik, K., Patra, S, Indu, M.S. Sreejith, O.V., Viswanathan, R, Narayanasamy, J., Murugan, R. A brief review of recent advances in garnet structured solid electrolyte based lithium metal batteries. Journal of Energy Storage. - 2021. - V.33. - P. 102157.], перовскиты Li3xLa2/3-xTiO3 [9. Lu, J., Li, Y. Perovskite-type Li-ion solid electrolytes: a review. J Mater Sci: Mater Electron. - 2021. - V.32. - P. 9736-9754] и антиперовскиты Li3OX (X = Cl, Br, I) [10. Xia, W., Zhao, Y., Zhao, F., Adair, K., Zhao, R., Li, S., Zou, R., Zhao, Y., Sun, X. Antiperovskite Electrolytes for Solid-State Batteries. Chem. Rev. - 2022. - V.122. - P. 3763−3819], LIPON [11. LaCoste, J.D., Zakutayev, A., Fei, L. A Review on Lithium Phosphorus Oxynitride. J. Phys. Chem. C. - 2021. - V.125. - P. 3651−3667.] и электролиты со структурой типа NASICON (Na Super Ion Conductor) LiB2(PO4)3 (B = Ti4+, Zr4+, Ge4+, Hf4+, Sn4+) [12. Dias, J.A., Silvia, H., Santagneli, S.H., Messaddeq, Y. Methods for Lithium Ion NASICON Preparation: From Solid-State Synthesis to Highly Conductive Glass-Ceramics. J. Phys. Chem. C. - 2020. - V.124. - P. 26518-26539]. Проводимость представленных твердых электролитов практически соизмерима с проводимостью жидких электролитов, что позволяет рассматривать их для дальнейшего применения в ЛИА. Твердые полимерные электролиты являются перспективными благодаря высокой гибкости и простоте обработки. Однако подвижность анионов в твердых полимерных электролитах соизмерима или превышает подвижность катионов (из-за низкого значения числа переноса tLi+), что является проблемой применения данных электролитов в ЛИА. Аргиродиты (Li6PS5X) и гранаты (Li6La3Zr2O12) обладают высоким значением ионной проводимости лития: выше⋅10-3 См⋅см-1 при комнатной температуре. Однако взаимодействие данных твердых электролитов с H2O и CO2 из воздуха приводит к ухудшению их проводимости. Перовскит Li3xLa2/3-xTiO3 является перспективным твердым электролитом для применения в твердотельных аккумуляторах. Однако условия его приготовления затруднительны, а ионная проводимость недостаточно высока. Твердый электролит типа антиперовскита Li3OX обладает высокой ионной проводимостью и может применяться как в объемных, так и в тонкопленочных твердотельных аккумуляторах. Однако данный электролит является гигроскопичным и требует работы в инертной атмосфере. Твердый электролит LIPON может быть применен для тонкопленочных твердотельных аккумуляторов. Однако данный электролит не применим в твердотельных аккумуляторах объемного типа из-за низкой ионной проводимости 10-6-10-5 См⋅см-1 при комнатной температуре.
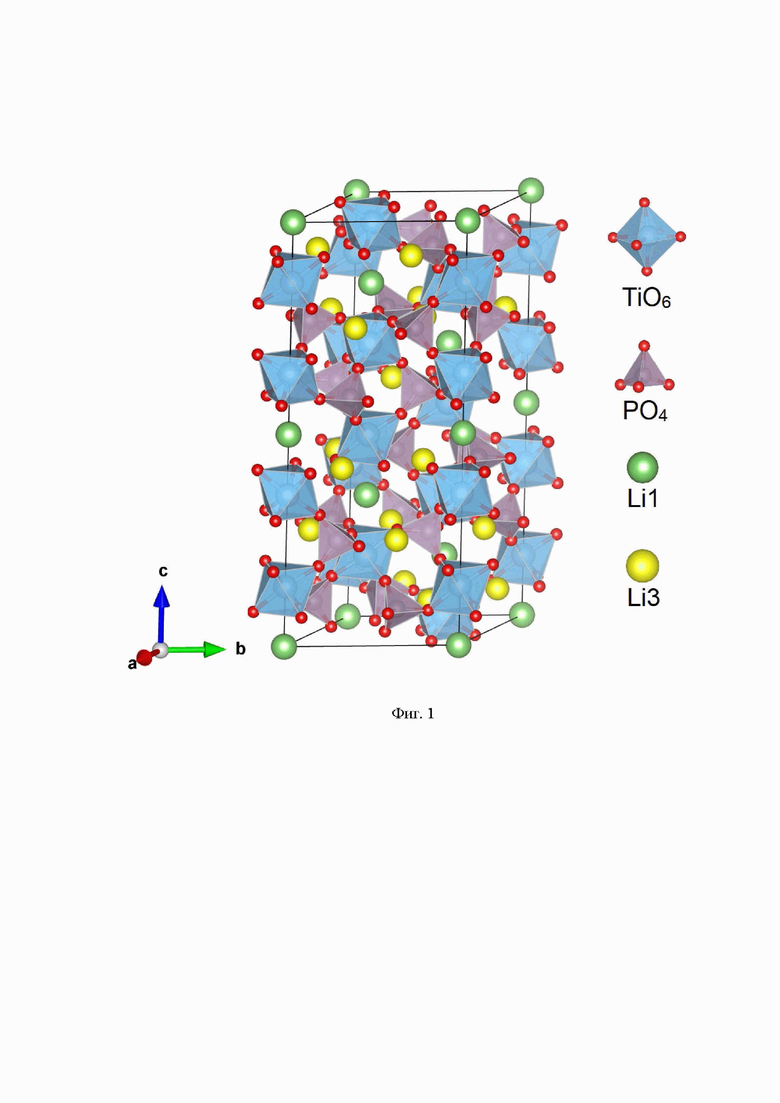
Электролиты со структурой типа NASICON LiB2(PO4)3 (В = Ti4+, Zr4+, Ge4+, Hf4+, Sn4+) являются наиболее химически и термически устойчивыми. Проводимость данных электролитов по литию находится в пределах от 10-6 См⋅см-1 до 10-3 См⋅см-1 в зависимости от природы переходного металла в структуре. Среди перечисленных электролитов наибольший интерес представляет титансодержащий фосфат лития LiTi2(PO4)3 (LTP) [13. Lin, Z.-H., Yu, H.-J., Li, S.-C., Tian, S.-B., Lithium ion conductors based on LiTi2P3O12 compound. Solid State Ionics. - 1988. - V.31. - P. 91-94]. LTP кристаллизуется в ромбоэдрической сингонии с пространственной группой R-3c и состоит из TiO6 октаэдров и PO4 тетраэдров, соединенных вершинами (Фиг. 1). Два TiO6 октаэдра и три PO4 тетраэдра имеют общие атомы кислорода и образуют мотив в виде «фонариков», комбинация которых формирует 3D каналы для миграции ионов лития. В структуре можно выделить два положения подвижных ионов лития внутри каналов: Li1 и Li2. Li1 окружен шестью атомами кислорода и находится на пересечении трех каналов проводимости, в то время как Li2 окружен 8 атомами кислорода. Ионы Li предпочтительно занимают октаэдрические позиции Li1 (6b), координаты которых равны (0;0;0). Ионы Ti, P, O1 и O2 находятся в позициях Вайкоффа (12c), (18e), (36f) и (36f) соответственно.
Частичное замещение ионов Ti4+ в структуре LTP на ионы M3+ (М = Al, Sc, Y, La и т.д.) может привести к увеличению ионной проводимости за счет увеличения концентрации носителей заряда [14. Aono, H., Sugimoto, E. Ionic Conductivity of the Lithium Titanium Phosphate (Lil+xMxTi2-x(PO4)3, M = Al, Sc, Y, and La) systems. J. Electrochem. Soc. - 1989. - V.136. - P. 590]. Например, введение ионов Al3+ с ионным радиусом 0,535 Å в структуру LTP приводит к увеличению прочности связи Ti-O, а также к увеличению длины связи Li-O в структуре, что улучшает ионную проводимость с 2,6⋅10-6 См/см до 7,0⋅10-4 См/см. Среди различных составов Li1+xAlxTi2-x(PO4)3, состав Li1,3Al0,3Ti1,7(PO4)3 (LATP) имеет наибольшую ионную проводимость и является наиболее изученным твердым электролитом со структурой типа NASICON [15. Wu, P., Zhou, W., Su, X., Li, J., Su, M., Zhou, X., Sheldon, B.W., Lu, W. Recent Advances in Conduction Mechanisms, Synthesis Methods, and Improvement Strategies for Li1+xAlxTi2−x(PO4)3 Solid Electrolyte for All-Solid-State Lithium Batteries. Adv. Energy Mater. - 2023. - V.13. - P. 2203440].
Способы получения твердого электролита Li1,3Al0,3Ti1,7(PO4)3 со структурой типа NASICON
В литературе представлены различные методы синтеза Li1,3Al0,3Ti1,7(PO4)3 со структурой типа NASICON, которые можно разделить на жидкофазные (гидротермальный, золь-гель, электроспиннинг и т.д.) и твердофазные. Представленные методы синтеза применимы к любым твердым электролитам со структурой типа NASICON, независимо от природы иона переходного металла (Ti4+, Zr4+, Ge4+, Hf4+, Sn4+). К ним относятся LiTi2(PO4)3, LiZr2(PO4)3, LiGe2(PO4)3 и т.п.
Гидротермальный синтез
Известен гидротермальный метод получения твердого электролита LiTi2(PO4)3 со структурой типа NASICON [16. Patent CN104477870A. Porous sheet lithium ion battery LiTi2(PO4)3 electrode material and preparation method thereof. Заявка от 18.12.2014. Опубл. 01.04.2015]. Данный метод включает в себя предварительную стадию гидролиза Ti-содержащего реагента (тетра-н-бутилтитаната C16H40O4Ti или изопропилата титана Ti[OCH(CH3)2]4) в растворе ацетона и дистиллированной воды с последующим смешением c фосфатом аммония (NH4)3PO4 и соединениями щелочных металлов (LiOH, CH3COOLi). Синтез проводят в автоклаве при температуре 160-200°C в течение 6-12 часов. После обработки в автоклаве полученный прекурсор промывают этиловым спиртом и высушивают при температуре 70-90°C. Полученный порошок подвергают термической обработке в инертной атмосфере (N2, Ar) при температуре 650-850°C в течение 8-12 часов.
Известен гидротермальный метод синтеза LATP с использованием различных прекурсоров титана, таких как тетра-н-бутилтитанат C16H40O4Ti, изопропилат титана Ti[OCH(CH3)2]4, ацетилацетонат титана C20H28O8Ti и тетраэтил-титанат C8H20O4Ti [17. Patent CN111740167B. Nano titanium aluminum lithium phosphate solid electrolyte, preparation method thereof, lithium ion battery and electric equipment. Заявка от 06.07.2020. Опубл. 05.11.2021]. Источниками фосфора, алюминия и лития выступают следующие реагенты: ацетат лития, ацетат алюминия, гидрофосфат аммония, а в качестве растворителя используют этанол, ацетон, этиленгликоль и дистиллированная вода. Полученную смесь реагентов выдерживают при значении рН, равном 7,0, и перемешивают до получения раствора прекурсора. Полученный раствор подвергается термической обработке в автоклаве при температуре 180°С в течение 10 часов (давление 0,4 МПа) с последующим охлаждением до комнатной температуры. Полученный осадок отфильтровывают, высушивают и термически обрабатывают в две стадии при 500°С в течение 4 часов и при 800°С в течение 6 часов для получения LATP.
Известен гидротермальный метод синтеза LATP с использованием следующих реагентов: LiOH⋅H2O, Li2SO4⋅H2O, Al2(SO4)3⋅16H2O, TiOSO4⋅1,5H2O и H3PO4 [18. Patent JP7130460B2. Method for producing LATP crystal particles for solid electrolyte of secondary battery. Заявка от 21.06.2018. Опубл. 05.09.2022]. Смесь реагентов Li2SO4⋅H2O, Al2(SO4)3⋅16H2O, TiOSO4⋅1,5H2O перемешивают в дистиллированной воде для получения смешанного раствора А. LiOH⋅H2O и H3PO4 смешивают в дистиллированной воде для получения раствора В. Водородный показатель рН раствора 2 поддерживают равным 7,0. Раствор А перемешивают при скорости 200 об/мин в течение 60 мин при комнатной температуре. Раствор В добавляют к раствору А с дозировкой 50 мл/мин. Полученный раствор перемешивают при 200 об/мин в течение 30 мин, рН данной смеси составляет 4,5 при 25°С. Полученный после перемешивания раствор помещают в автоклав и термически обрабатывают при температуре 180°С и давлении 1,3 МПа в течение 5 часов. Полученный осадок промывают и высушивают при 80°С в течении 12 часов. Он представляет собой набор фаз Li3PO4, AlPO4 и Ti(OH)1,36(HPO4)1,32⋅2,3H2O, который в дальнейшем обрабатывают при 600°С в течение 4 часов в атмосфере воздуха для получения кристаллического LATP.
Известен гидротермальный метод синтеза LTP [19. Patent CN111591971A. Titanium lithium phosphate nanocomposite, preparation method and application in aqueous battery. Заявка от 15.05.2020. Опубл. 28.08.2020]. В раствор дистиллированной воды и этилового спирта добавляют полиэтиленгликоль (молекулярная масса 6000), полиакрилат натрия и перемешивают. Затем к полученному раствору добавляют мочевину и перемешивают до полного растворения. После растворения мочевины в полученный раствор добавляют карбонат лития и перемешивают раствор в течение 1 часа, после чего добавляют диоксид титана и непрерывно перемешивают в течение 30 мин. В полученную суспензию добавляют дигидрофосфат аммония и непрерывно перемешивают в течение 1 часа. После чего в раствор добавляют глюкозу и перемешивают данный раствор в течение 1 часа. Для удаления пены в раствор добавляют изопропанол. Полученный смешанный раствор помещают в автоклав объемом 200 мл и проводят гидротермальный синтез в течение 6 часов при температуре 200°С. После завершения синтеза полученный осадок отфильтровывают и высушивают для получения твердого продукта. Полученный твердый продукт измельчают и термически обрабатывают при температуре 750°С в течении 2 часов в атмосфере азота.
Недостатками гидротермального метода синтеза являются его многостадийность, использование дорогого Ti-содержащего прекурсора и необходимость утилизации жидких отходов.
Золь-гель синтез
Известен золь-гель метод синтеза LATP [20. Patent CN112531203A. Solid electrolyte with high ionic conductivity and preparation method thereof. Заявка от 10.12.2020. Опубл. 19.03.2021]. LiNO3, Al(NO3)3, изопропоксид титана Ti[OCH(CH3)2]4, и H3PO4 по отдельности растворяют в этаноле. Растворы LiNO3 и H3PO4 по каплям добавляют к раствору Al(NO3)3 и Ti[OCH(CH3)2]4 соответственно для получения двух смешанных растворов. Далее, в процессе перемешивания, раствор, содержащий LiNO3 и Al(NO3)3, добавляют порционно к раствору Ti[OCH(CH3)2]4 и H3PO4. Полученный конечный раствор помещают на водяную баню при температуре 60-80°С для формирования геля. Светло-желтый гель получают при 80°С. Полученный гель термически обрабатывают при температуре 400-600°С в течение 5 часов. После термической обработки полученный порошок подвергают измельчению и термической обработке при 850°С в течение 5 часов для получения LATP. Скорость нагрева в процессе термической обработки составляет 1°С/мин.
Известен золь-гель метод синтеза LATP [21. Patent CN114804055A. Solid electrolyte with high density and small size and preparation method thereof. Заявка от 16.05.2022. Опубл. 29.07.2022]. Тетрабутилтитанат Ti(OC(CH3)3)4 и лимонную кислоту C6H8O7 растворяют в этиловом спирте для приготовления растворов А и В соответственно. Раствор А постепенно добавляют к раствору В для получения смешанного раствора С. LiNO3, Al(NO3)3, и H3PO4 добавляют к раствору С и регулируют рН данного раствора с помощью NH4OH, поддерживая значение, равное 7. Полученный конечный раствор помещают на водяную баню при перемешивании в течение 4 часов для получения белого геля. Полученный гель выдерживают при комнатной температуре в течение 24 часов. В дальнейшем белый гель нагревают на водяной бане при температуре 90°С в течение 8 часов и высушивают при температуре 150°С в течение 4 часов для получения желтого геля. Полученный гель помещают в печь и нагревают при 500°С со скоростью 2°С/мин в течение 4 часов. Для получения конечного продукта порошок дополнительно термически обрабатывают при различных температурах для получения серии образцов твердого электролита LATP-750°С, LATP-800°С, LATP-850°С, LATP-900°С и LATP-950°С.
Недостатками золь-гель метода являются использование дорогих органических солей титана, многостадийность процесса синтеза, а также необходимость утилизации жидких отходов.
Электроспиннинг
Известен метод синтеза LATP с использованием электроспиннинга [22. Patent CN115312848A. Preparation method of LATP inorganic solid electrolyte material. Заявка от 10.10.2022. Опубл. 11.08.2022]. Ацетат лития CH3COOLi⋅2H2O, нитрат алюминия Al(NO3)3⋅9H2O и NH4H2PO4 добавляют в этиленгликоль C2H6O2 при перемешивании. В процессе перемешивания в раствор по каплям добавляют азотную кислоту (0,1-0,2 от общего объема) для формирования раствора А. Время перемешивания данного раствора составляет 5 часов. Поливинилпирролидон (ПВП) и тетрабутилтитанат Ti(OC(CH3)3)4 добавляют в диметилформамид (ДМФА) с последующим перемешиванием раствора в течение 5 часов для получения раствора В. Дополнительно в раствор В добавляют ацетилацетон C5H8O2 (0,1-0,2 от общего объема) для предотвращения гидролиза тетрабутилтитаната Ti(OC(CH3)3)4. Далее раствор А добавляют к раствору В, формируя смешанный раствор С. Содержание ПВП в растворе С составляет 8 масс.%. Полученный раствор С перемешивают в течение 12 часов. В процессе перемешивания к раствору добавляют 30% перекись водорода H2O2 (0,05-0,06 от общего объема) для предотвращения формирования и осаждения комплексов титана и получения прядильного раствора. Полученный прекурсор в ходе процесса электроспиннинга подвергают спеканию при температуре 900-1200°С в течение 6 часов с использованием муфельной печи для получения неорганического твердого электролита LATP.
Недостатками данного метода синтеза являются многостадийность процесса изготовления, а также высокая стоимость и токсичность органических реагентов.
Твердофазный синтез
Известен твердофазный метод синтеза LATP [23. Patent CN112768755B. Preparation method of NASION type solid electrolyte aluminum-containing phosphate. Заявка от 04.01.2021. Опубл. 20.05.2022]. Гидроксид лития LiOH растворяют в фосфорной кислоте H3PO4 до образования прозрачного раствора. Гидроксид алюминия Al(OH)3 добавляют в прозрачный раствор с последующим перемешиванием для образования суспензии А. Наноразмерный оксид титана добавляют к суспензии А с последующей ультразвуковой обработкой суспензии в течение 10 мин для получения суспензии В. Для получения суспензии С, суспензию В перемешивают в течение 8 часов. После перемешивания суспензию С высушивают при температуре 100°С. Полученный порошок измельчают и подвергают термической обработке при 700°С в течение 4 часов для получения LATP.
Недостатками данного твердофазного метода синтеза являются его многостадийность и продолжительность синтеза.
Твердый электролит LATP получают с использованием индукционного плавления реагентов Al(PO3)3, LiH2PO4, TiO2, Ta2O5 и SiO2 в кварцевом тигле при температуре 1500-1650°C на воздухе [24. Patent EP3298643B1. Glass-ceramic electrolytes for lithium-sulfur batteries. Заявка от 11.05.2016. Опубл. 12.06.2019]. Расплав выливают на металлическую пластину с образованием стеклообразного прекурсора толщиной от 3 мм до 8 мм и диаметром от 30 мм до 40 мм. Часть стекла заливают на двухвалковое устройство для получения стеклообразных лент для производства порошка. Обработка полученного стекла проходит в две стадии: 1) стекло отжигают чуть ниже температуры стеклования при 530°C и медленно охлаждают до комнатной температуры (скорость 20°C/ч); 2) полученные образцы стекла отжигают при 850-950°C в течение 12 часов и медленно охлаждают до комнатной температуры для получения стеклокерамики LATP. Основная фаза имеет структуру NASICON с номинальным составом Li1,6Al0,5Ti0,95Ta0,5(PO4)3, изоструктурную LiGe2(PO4)3 и LiTi2(PO4)3. Наличие примеси кристобалита SiO2 незначительно (<2 масс.%).
Известен твердофазный метод получения LATP [25. Patent US11345597B2. Precursor glass of lithium phosphorus complex oxide and method of producing same, method of producing precursor crystallized glass of lithium phosphorus complex oxide, and lithium phosphorus complex oxide powder and method of producing same. Заявка от 20.12.2017. Опубл. 31.05.2022]. В качестве основных реагентов для синтеза LATP используют карбонат лития Li2CO3, метафосфат лития LiPO3, фосфат алюминия Al(PO3)3, пирофосфат титана Ti2P2O7 и оксид титана TiO2. Данные реагенты перемешивают и доводят до расплава для получения стеклообразного прекурсора. Полученный стеклообразный прекурсор нагревают при 500°C в течение 10 часов, а затем при 700°C в течение 10 часов для получения кристаллического прекурсора. Данный прекурсор погружают в водный раствор азотной кислоты HNO3 (3 моль/л) и перемешивают при 60°C в течение 2 часов для получения белого мутного раствора. Диспергированные частицы удаляют из белого мутного раствора путем фильтрования и высушивания при 120°C для получения белого порошка.
Известен твердофазный метод получения LATP [26. Patent US20170222260A1. Solid electrolyte powder, all-solid-state lithium ion secondary battery, and method of manufacturing solid electrolyte powder. Заявка от 19.04.2017. Опубл. 03.08.2017]. Для синтеза LATP используют следующие исходные реагенты: фосфорную кислоту H3PO4, дигидрофосфат аммония NH4H2PO4, карбонат лития Li2CO3, гидроксид алюминия Al(OH)3, оксид титана TiO2. Данную смесь реагентов расплавляют при температуре 1500°С, равной или превышающей температуру плавления смеси. Расплавленную смесь LATP охлаждают естественным путем для получения кристаллического материала, имеющего структуру NASICON. Кристаллический материал в дальнейшем измельчают в ступке. Измельчение производится таким образом, чтобы средний размер частиц кристаллического материала находился в диапазоне от 1 мкм до 10 мкм. Измельченный порошок подвергается термической обработке при температурах выше 700°C и ниже 1000°C и времени отжига от 1 часа до 12 часов. Оптимальная температура составляет 800°C.
Известен твердофазный метод получения LATP [27. Patent US20180105450A1. Method of Producing LTP or LATP Crystal Particle. Заявка от 10.05.2016. Опубл. 19.04.2018]. Реакционную смесь метафосфата лития LiPO3, фосфата алюминия Al(PO3)3 и оксид титана TiO2 гомогенизируют и расплавляют для получения прекурсора в виде стекла. Полученный прекурсор подвергается двухстадийной термической обработке при 520°С в течение 20 часов и при 850°C в течение 20 часов. Полученный кристаллический прекурсор обрабатывают в 5 н растворе азотной кислоты при 60°С в течение 12 часов с последующей фильтрацией.
Недостатками данного твердофазного метода синтеза являются его многостадийность и использование высоких температур для получения расплава, а также большая продолжительность синтеза.
Наиболее близким техническим решением, выбранным за прототип, является твердофазный метод получения LATP [28. Patent CN114976217A. Method for modifying LATP solid electrolyte and solid electrolyte thereof. Заявка от 11.05.2022. Опубл. 30.08.2022]. Карбонат лития Li2CO3 (с избытком 10 масс.%), оксид алюминия Al2O3, оксид титана TiO2 и дигидрофосфат аммония NH4H2PO4 берут в стехиометрическом соотношении и измельчают в ступке в течение 2 часов. Измельченную смесь помещают в тигель из оксида алюминия и нагревают в муфельной печи в несколько стадий: 1) до 150°С с выдержкой 2 часа; 2) до 350°С с выдержкой 4 часа и 3) до 800°С с выдержкой 8 часов для получении конечного продукта. Скорость нагрева на всех этапах термической обработки составляет 4°С/мин. Синтезированный LATP измельчают в ступке в течении 1 часа с добавлением этанола. Измельченный продукт высушивают при температуре 80°С в течение 1 часа в потоке воздуха. К измельченному и высушенному порошку LATP добавляют 70 мкл поливинилового спирта с массовой долей 5% и дополнительно измельчают, данную смесь в течение 40 мин. Полученную смесь в количестве 400 мг помещают в форму для таблетирования с внутренним диаметром 15 мм, уплотняют, прессуют образец под давлением 4 МПа и поддерживают давление в течение 1 минуты для получения таблетки с твердым электролитом LATP. Полученную таблетку помещают в муфельную печь и проводят спекание со скоростью нагрева 3°/мин поэтапно: нагрев до 150° с выдержкой в течение 2 часов, затем нагрев до 350° с выдержкой в течение 4 часов и нагрев до 900° с выдержкой в течение 12 часов.
Недостатками выбранного за прототип твердофазного метода синтеза являются его многостадийность, использование высоких температур, а также большая продолжительность синтеза.
Сущность изобретения
Техническая проблема состоит в разработке простого, быстрого и дешевого способа получения высокодисперсного твердого электролита Li1,3Al0,3Ti1,7(PO4)3 со структурой типа NASICON и улучшенными проводящими свойствами.
Данная техническая проблема решается благодаря тому, что в заявляемом способе реализуется получение высокодисперсного литий-проводящего твердого электролита Li1,3Al0,3Ti1,7(PO4)3 для литий-ионных аккумуляторов, включающий измельчение реакционной смеси, содержащей оксид титана, карбонат лития, оксид алюминия и дигидрофосфат аммония; термическую обработку; охлаждение; измельчение синтезированного твердого электролита, при этом исходные компоненты смешивают с углеродом и активируют в механохимическом активаторе с удельной мощностью 10-80 Вт/г в течение 3-10 минут, после чего полученную смесь подвергают термической обработке на воздухе в две стадии при температурах 350°С и 750°С в воздушной атмосфере и выдержке в течение 1,5 часов и 2 часов соответственно, охлаждают до комнатной температуры и диспергируют в механохимическом активаторе мощностью 10-80 Вт/г в течение 1-30 минут в инертной атмосфере. Диспергированный твердый электролит прессуют в таблетки при давлении 100 бар и медленно нагревают в течение 5 часов при 850°С с выдержкой 4 часа.
Предпочтительно, в качестве соединений алюминия используют гидроксид алюминия Al(OH)3.
Предпочтительно, в реакционную смесь вводят 5 масс.% углерода.
Предпочтительно, реакционную смесь измельчают в механическом активаторе в течение 5 минут.
Предпочтительно, синтезированный твердый электролит диспергируют в механохимическом активаторе в течение 20 минут.
При получении высокопроводящего твердого электролита Li1,3Al0,3Ti1,7(PO4)3 с использованием твердофазного метода синтеза в качестве соединений титана используют диоксид титана (анатаз) TiO2, в качестве соединений алюминия гидроксид алюминия Al(OH)3, а в качестве источника лития и фосфора - карбонат лития Li2CO3 и дигидрофосфат аммония NH4H2PO4. Карбонат лития Li2CO3 берут в избытке 10 мол.%. Синтез протекает по следующей реакции:
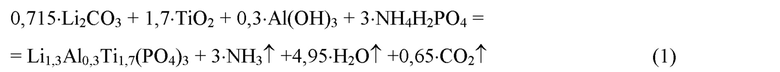
Синтезированный твердый электролит диспергируют в механохимическом активаторе с мощностью 10-80 Вт/г в течение 1-30 минут в инертной атмосфере для уменьшения среднего размера частиц. Диспергированный твердый электролит прессуют в таблетки при давлении 100 бар и отжигают в муфельной печи при температуре 850°С в течение 4 часов.
Совокупность отличительных признаков позволяет решить техническую проблему получения высокодисперсного твердого электролита Li1,3Al0,3Ti1,7(PO4)3 с высокой ионной проводимостью.
Одним из технических результатов, достигаемых в настоящем изобретении, является упрощение процесса синтеза и получение конечного продукта в высокодисперсном состоянии без примесей, что осуществляется за счет проведения предварительной механической активации реагентов в высоконапряженных механохимических активаторах с удельной мощностью 10-80 Вт/г в течение 3-10 минут и введения углерода для подавления вспенивания реакционной смеси. Используемые условия являются оптимальными для измельчения и гомогенизации реагентов. Увеличение времени механической активации может привести к постепенной агломерации первичных частиц, а также увеличению степени загрязнения конечного продукта материалом мелющих тел.
Другим техническим результатом, достигаемым в настоящем изобретении, является удешевление процесса получения твердого электролита Li1,3Al0,3Ti1,7(PO4)3 со структурой типа NASICON за счет понижения температуры синтеза, сокращения времени отжига и отсутствия необходимости использования дорогостоящих Ti-содержащих прекурсоров. Добавление углерода к реакционной смеси предотвращает загрязнение тиглей, тем самым, сохраняя соотношение регентов и увеличивая чистоту конечного продукта. После отжига весь углерод превращается в оксид углерода и переходит в газовую фазу.
Дополнительное измельчение синтезированного Li1,3Al0,3Ti1,7(PO4)3 позволяет регулировать размер частиц, что положительно отражается на плотности керамики и проводящих свойствах данного твердого электролита.
Описание полученных материалов
Образцы твердого электролита Li1,3Al0,3Ti1,7(PO4)3 были получены механохимически стимулированным твердофазным методом синтеза из оксида титана, карбоната лития, гидроксида алюминия и дигидрофосфата аммония с добавлением углерода. Реакционная смесь была механически активирована в течение 3-10 мин. Оптимальное время механической активации составляет 5 мин. Снижение времени механической активации не позволяет полностью гомогенизировать реакционную смесь, а увеличение времени не влияет на конечный результат. Как было отмечено ранее, добавление углерода к реакционной смеси в ходе механической активации реагентов способствует подавлению пенообразования на этапе дегазации, а сам углерод переходит в газообразное состояние в виде оксидов углерода при нагревании. На Фиг. 2 показаны механически активированные реакционные смеси для синтеза LATP без углерода и с добавление углерода до (Фиг. 2а), а также после процесса дегазации при 350°С в течение 1,5 часов (Фиг. 2б). После дегазации безуглеродная реакционная смесь демонстрирует вспенивание (Фиг. 2б), в результате которого часть смеси оказывается за пределами тигля, в то время как в углеродсодержащих реакционных смесях пенообразования в ходе дегазации не наблюдается. В результате образования пены часть реагентов остается на тигле после извлечения дегазированной реакционной смеси (Фиг. 2в). Для углеродсодержащих реакционных смесей такой проблемы не наблюдается. Дегазированная реакционная смесь с углеродом не прилипает к стенкам тигля и извлекается без каких-либо усилий и потери материала. Благодаря отсутствию вспенивания реакционная смесь, содержащая углерод, не требует перетирания после дегазации. В процессе синтеза LATP при 750°С изначально присутствовавший в реакционной смеси углерод удаляется. Проведена оценка влияния количества углерода в реакционной смеси на пенообразование в ходе синтеза LATP (Фиг. 3). Показано, что оптимальное количество углерода должно составлять не менее 2,5 масс. % для подавления пенообразования в ходе синтеза.
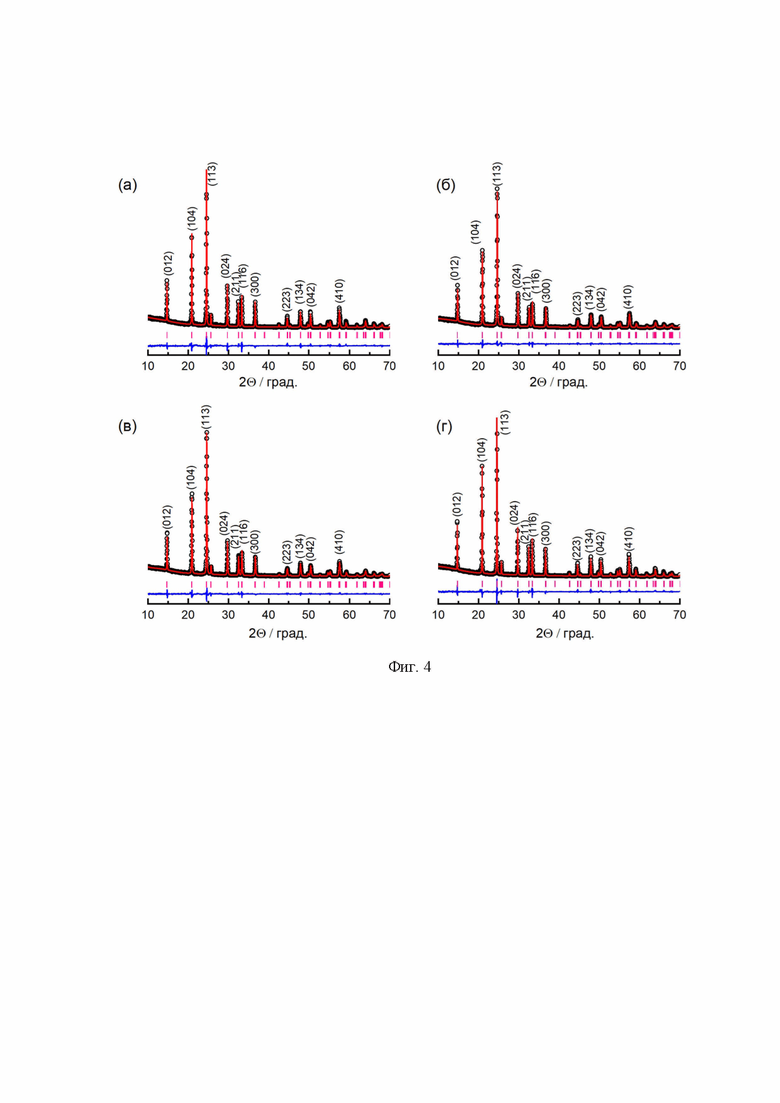
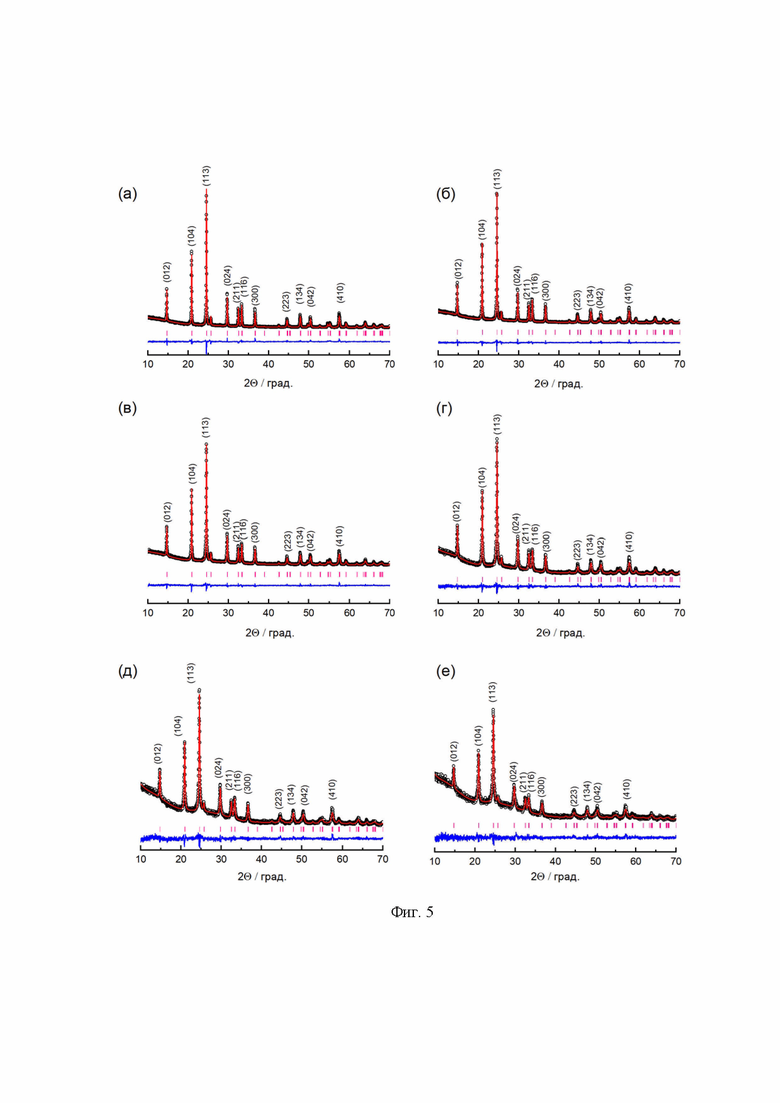
Синтезированный LATP был диспергирован в течение 1,0 мин., 2,5 мин., 5,0 мин., 10,0 мин., 20,0 мин. и 30,0 мин. для улучшения плотности и проводящих свойств керамики. По данным рентгенофазового анализа все полученные материалы являются однофазными (Фиг. 4 и Фиг. 5). Параметры решетки, рассчитанные с использованием метода Ритвельда, представлены в Таблице 1. Независимо от содержания углерода в реакционной смеси, параметры решетки синтезированных образцов LATP практически не изменяются. Однако по мере увеличения времени измельчения наблюдается рост параметра a, в то время как параметр c уменьшается. Причиной этого может служить искажение кристаллической решетки LATP, вызванное механическим воздействием в ходе измельчения. Полученные параметры соответствуют литературным данным.
Таблица 1. Параметры решетки синтезированных образцов Li1,3Al0,3Ti1,7(PO4)3
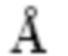
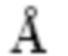
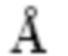 3
3
 3
3
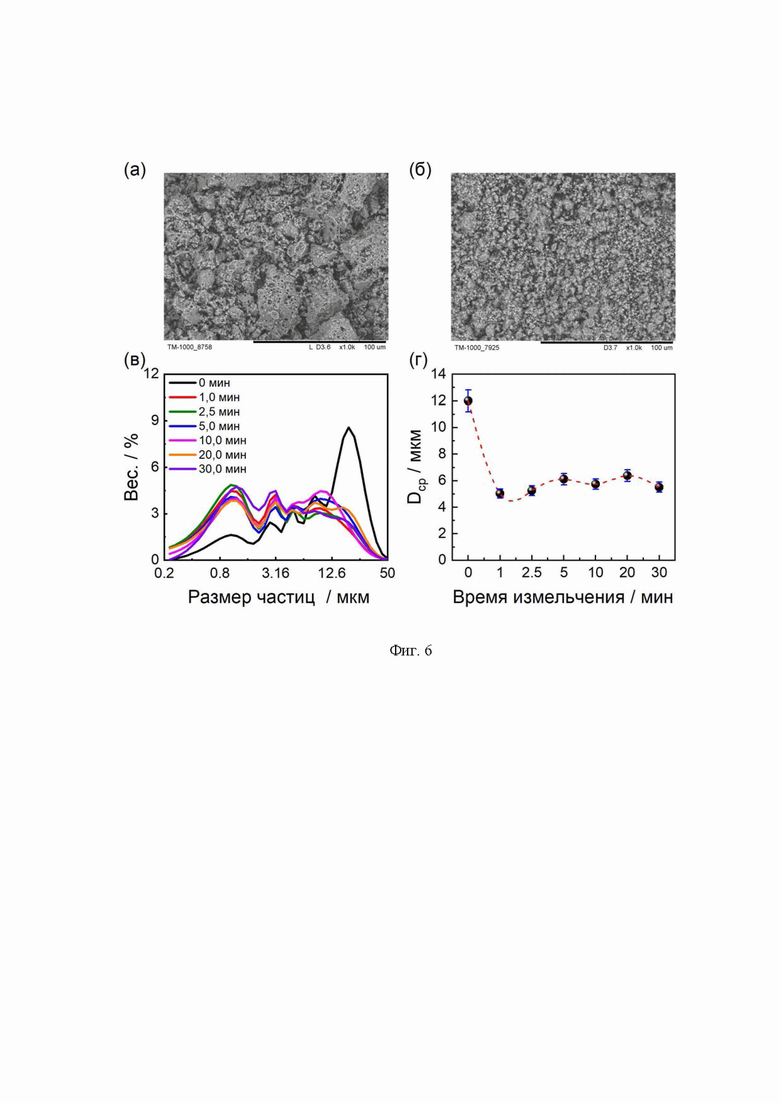
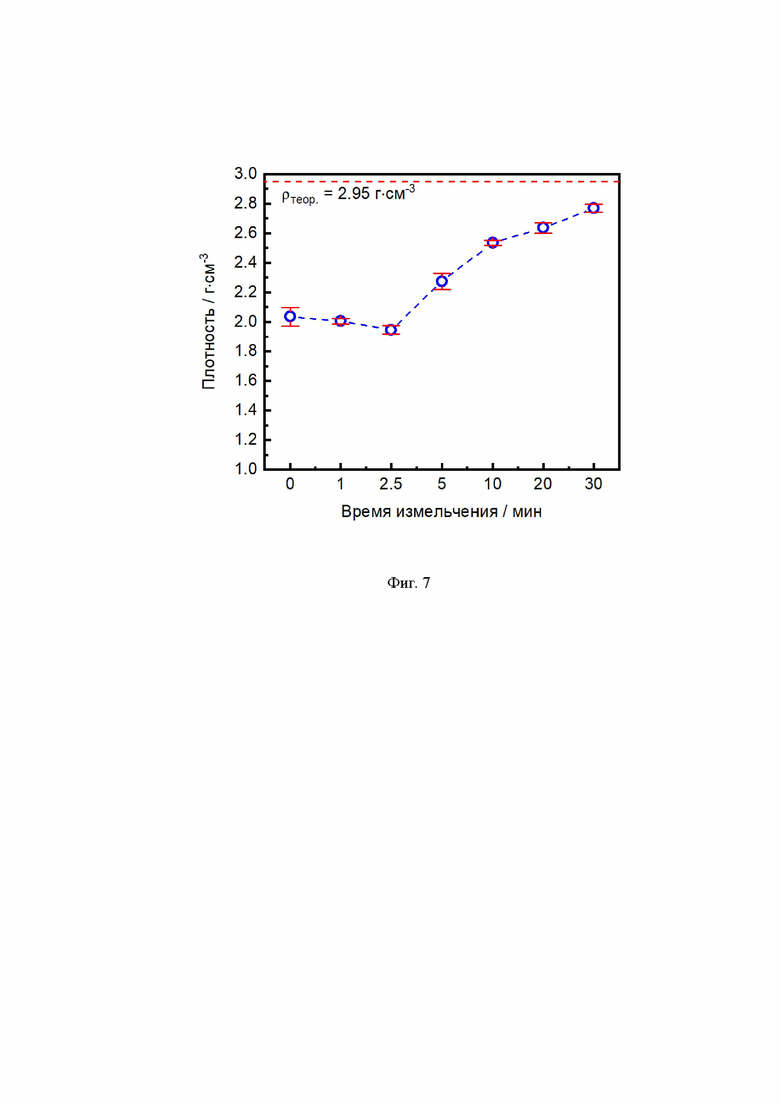
Исходя из данных сканирующей электронной микроскопии, частицы имеют нерегулярную форму независимо от времени измельчения (Фиг. 6а, б). Согласно данным гранулометрического анализа, для всех образцов LATP наблюдается мультимодальное распределение частиц (Фиг. 6в). Зависимость среднего размера частиц от времени измельчения с учетом всех мод показывает, что после 1 мин измельчения происходит значительное уменьшение среднего размера частиц с 12 мкм до 5 мкм, однако при дальнейшем измельчении резких изменений не наблюдается (Фиг. 6г). Рассматривая моды по отдельности, можно заметить, что в процессе измельчения мода, отвечающая за наличие мелких частиц, постепенно увеличивается, в то время как мода, соответствующая крупным частицам, постепенно уменьшается. Увеличение мелкой фракции частиц в ходе измельчения дает преимущество в процессе таблетирования и спекания. Мелкие частицы занимают пространство между крупными частицами, создавая более плотную упаковку, что положительно сказывается на увеличении плотности керамики. Зависимость геометрической плотности керамики от времени измельчения представлена на Фиг. 7. Увеличение плотности керамики LATP наблюдается после 5 мин измельчения и продолжает расти с увеличением времени измельчения (Таблица 2). Максимально наблюдаемое значение плотности равно 2,77 г⋅см-3, что составляет 94 % от теоретического значения.
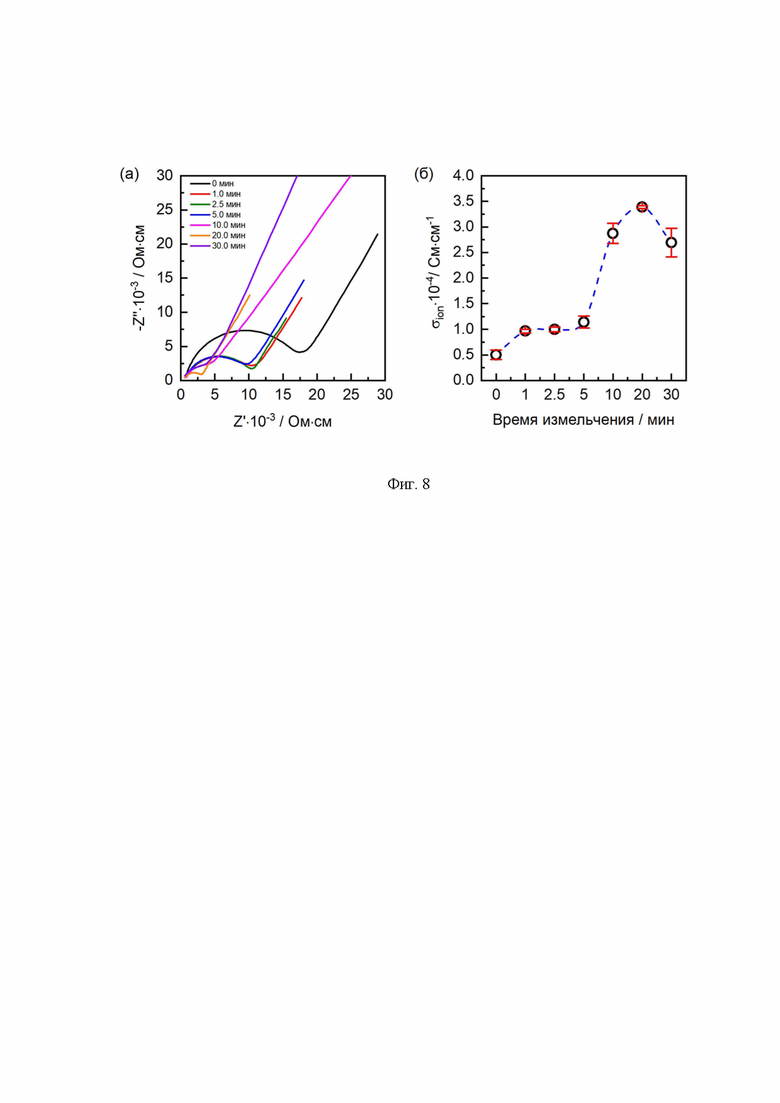
Изучение ионной проводимости твердого электролита LATP было проведено с использованием спектроскопии электрохимического импеданса. Были использованы серебряные электроды, полученные путем нанесения серебросодержащей проводящей пасты с последующим удалением органического растворителя при 300°С в течение 30 мин. На Фиг. 8а представлены спектры импеданса для LATP при различном времени измельчения. Данные спектры состоят из двух частей: полуокружности в диапазоне высоких частот и наклонной линии в диапазоне низких частот. Полуокружность представляет собой общее сопротивление (Rобщ), равное сумме объемного сопротивления (Rоб) и сопротивления на границах зерен (Rмз), а наклонная линия соответствует сопротивлению переноса ионов Li+ между твердым электролитом и блокирующим электродом Ag. Из-за ограничения частоты прибора (до 1 МГц) разделения вклада Rоб и Rмз затруднительно, в результате чего оценка проводимости LATP проводилась исходя из значения Rобщ. На Фиг. 8б представлена зависимость проводимости от времени измельчения. В процессе измельчения наблюдается постепенный рост проводимости. Максимальное значение ионной проводимости, равное 3,4·10-4 См⋅см-1, достигается после 20 мин измельчения. Данное значение проводимости практически в семь раз превышает проводимость неизмельченного LATP (Таблица 2).
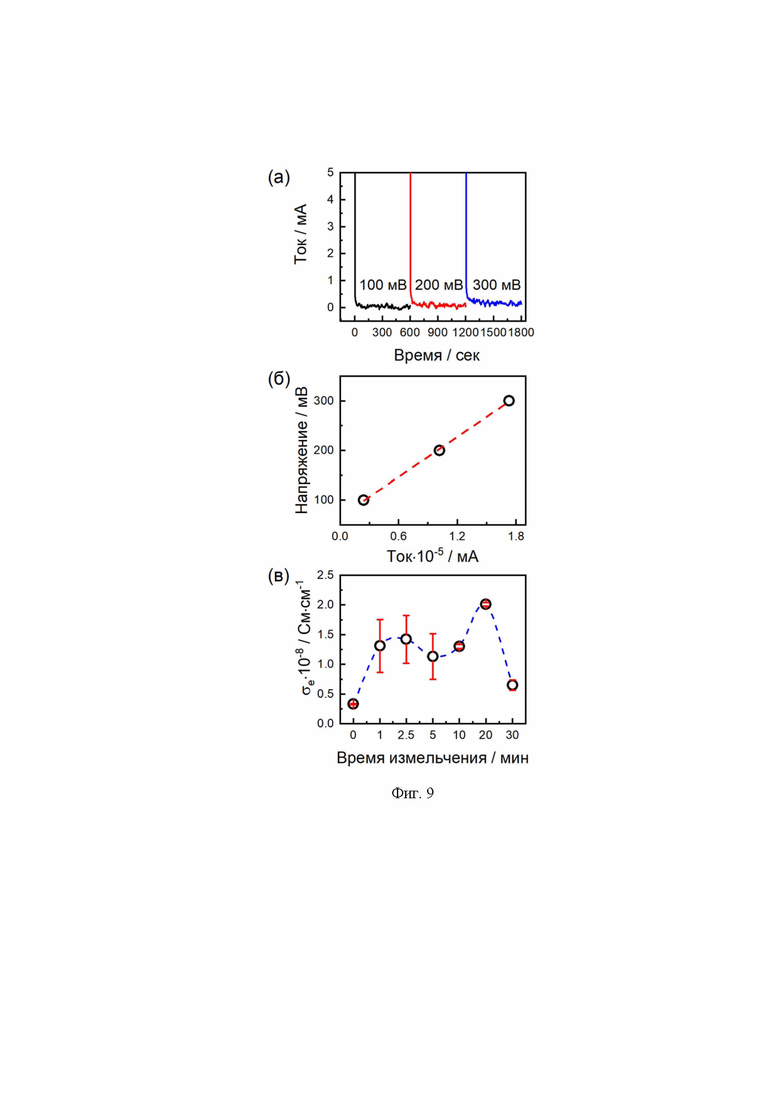
В связи с введением углерода в реакционную смесь на этапе синтеза твердого электролита LATP была оценена электронная проводимость керамики с использованием хроноамперометрии при различном значении подаваемого напряжения (0,1-0,3 В) (Фиг. 9). Согласно полученным данным, значение электронной проводимости незначительно и колеблется в пределах от 10-9 до 10-8 См⋅см-1 (Таблица 2).
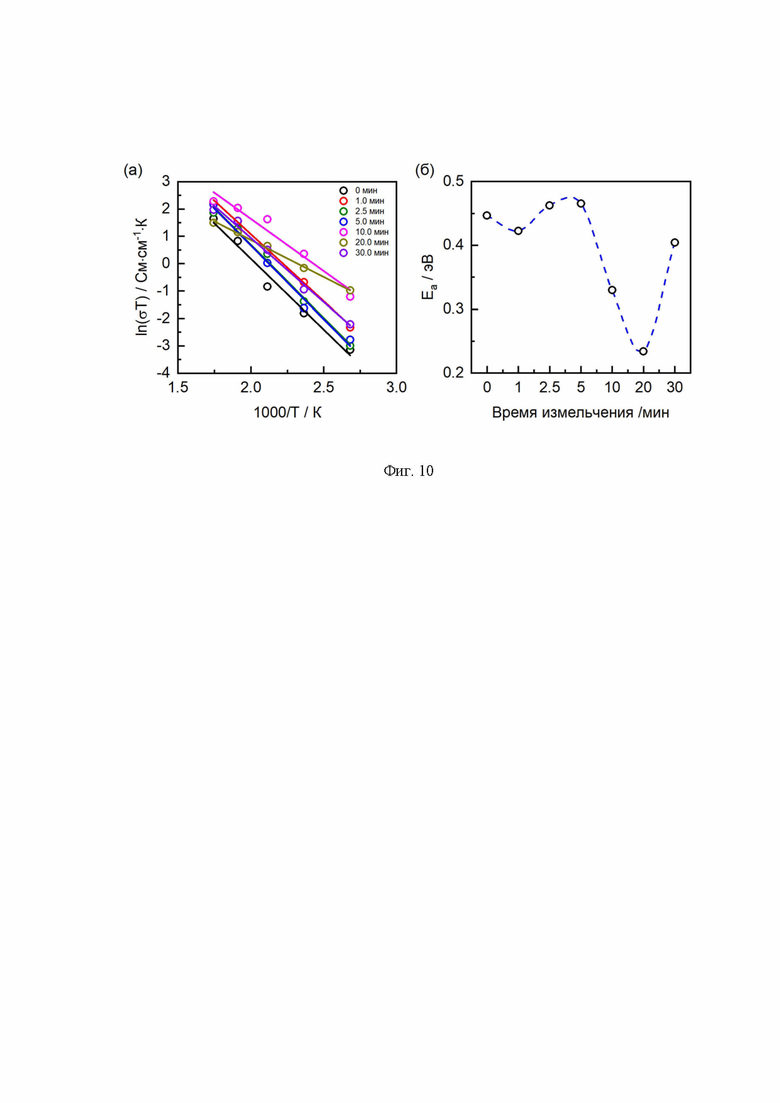
Для оценки энергетических барьеров для образцов LATP с различным временем измельчения были проведены измерения проводимости в интервале температур от 100°С до 300°С (Фиг. 10а). Зависимость энергии активации (Ea) от времени измельчения представлена на Фиг. 10б. Минимальное значение Ea для LATP достигается после 20 мин измельчения, что согласуется с данными по проводимости (Фиг. 8).
Таблица 2. Плотность и проводимость синтезированной керамики Li1,3Al0,3Ti1,7(PO4)3
Таким образом, преимущество данного технического решения заключается в совокупности заявляемых оптимальных условий твердофазного механохимически стимулированного синтеза, что позволяет создать простой, дешевый и безотходный способ получения высокодисперсного литий-проводящего твердого электролита Li1,3Al0,3Ti1,7(PO4)3 с высокой ионной проводимостью для литий-ионных аккумуляторов.
Уменьшение времени синтеза и высокая дисперсность материала могут быть достигнуты путем применения предварительной механической активации и введения углерода в реакционную смесь в качестве добавки для подавления пенообразования в процессе дегазации. Высокая дисперсность Li1,3Al0,3Ti1,7(PO4)3 достигается путем измельчения синтезированного твердого электролита в шаровой мельнице в течение определенного времени (1-30 мин).
Технический результат, достигаемый благодаря заявляемому способу, заключается в получении высокодисперсного литий-проводящего твердого электролита Li1,3Al0,3Ti1,7(PO4)3 с улучшенными характеристиками, в частности, с повышенной плотностью керамики с 2,04 г⋅см-3 до 2,77 г⋅см-3 и ростом проводимости с 0,5⋅10-4 См⋅см-1 до 3,4⋅10-4 См⋅см-1, а также позволяет упростить процесс синтеза и удешевить стоимость получаемого продукта.
Примеры конкретного выполнения
Пример 1. Для демонстрации оптимально подобранных условий синтеза получен высокодисперсный Li1,3Al0,3Ti1,7(PO4)3, не содержащий углерода в реакционной смеси. В качестве реагентов для синтеза используют TiO2 (анатаз), Al(OH)3, Li2CO3 и NH4H2PO4. Реакционная смесь подвергается смешению, диспергированию и активации в механохимическом активаторе АГО-2 с удельной мощностью 10-80 Вт/г в течение 3-10 мин в атмосфере аргона и последующей двухстадийной термической обработке на воздухе. Первая обработка проводится при 350°С в течение 1,5 часов и сопровождается вспениванием реакционной смеси. Дегазированную смесь извлекают из тигля и перетирают в агатовой ступке до полной гомогенизации. Вторая стадия термической обработки включает в себя нагрев до 750°С с выдержкой в течение 2 часов.
Пример 2. Для получения Li1,3Al0,3Ti1,7(PO4)3 в одну стадию без вспенивания в ходе дегазации, в реакционную смесь, представленную в примере 1, добавляют углерод в количестве 1,0 масс. %, 2,5 масс. % или 5,0 масс. % к готовому продукту. Реакционная смесь подвергается смешению, диспергированию и активации в механохимическом активаторе АГО-2 с удельной мощностью 10-80 Вт/г в течение 3-10 мин в атмосфере аргона и последующей термической обработке на воздухе. Первая обработка проводится при 350°С в течение 1,5 часов. После дегазации данной реакционной смеси температура в печи увеличивается до 750°С, и смесь выдерживается 2 часов до получения конечного продукта, не содержащего углерода. Оптимальное содержание углерода в реакционной смеси составляет 5 масс. %. Синтезированный Li1,3Al0,3Ti1,7(PO4)3 прессуют в таблетки при давлении 100 бар и спекают на воздухе при 850°С в течение 4 часов. Плотность данной керамики составляет 2,04 г⋅см-3 (69 % от теор.), а значения ионной проводимости и энергии активации равны 0,5⋅10-4 См⋅см-1 и 0,45 эВ соответственно.
Пример 3. Для получения высокодисперсного литий-проводящего твердого электролита, Li1,3Al0,3Ti1,7(PO4)3, синтезированный по примеру 2, диспергируют в механохимическом активаторе АГО-2 с удельной мощностью 10-80 Вт/г в течение 1 мин. Диспергированный Li1,3Al0,3Ti1,7(PO4)3 прессуют в таблетки при давлении 100 бар и спекают на воздухе при 850°С в течение 4 часов. Плотность данной керамики составляет 2,01 г⋅см-3 (68 % от теор.), а значения проводимости и энергии активации равны 0,9⋅10-4 См⋅см-1 и 0,42 эВ соответственно.
Пример 4. Для получения высокодисперсного литий-проводящего твердого электролита, Li1,3Al0,3Ti1,7(PO4)3, синтезированный по примеру 2, диспергируют в механохимическом активаторе АГО-2 с удельной мощностью 10-80 Вт/г в течение 2,5 мин. Диспергированный Li1,3Al0,3Ti1,7(PO4)3 прессуют в таблетки при давлении 100 бар и спекают на воздухе при 850°С в течение 4 часов. Плотность данной керамики составляет 1,95 г⋅см-3 (66 % от теор.), а значения ионной проводимости и энергии активации равны 1,0⋅10-4 См⋅см-1 и 0,46 эВ соответственно.
Пример 5. Для получения высокодисперсного литий-проводящего твердого электролита, Li1,3Al0,3Ti1,7(PO4)3, синтезированный по примеру 2, диспергируют в механохимическом активаторе АГО-2 с удельной мощностью 10-80 Вт/г в течение 5 мин. Диспергированный Li1,3Al0,3Ti1,7(PO4)3 прессуют в таблетки при давлении 100 бар и спекают на воздухе при 850°С в течение 4 часов. Плотность данной керамики составляет 2,27 г⋅см-3 (77 % от теор.), а значение ионной проводимости и энергии активации равны 1,1⋅10-4 См⋅см-1 и 0,47 эВ соответственно.
Пример 6. Для получения высокодисперсного литий-проводящего твердого электролита, Li1,3Al0,3Ti1,7(PO4)3, синтезированный по примеру 2, диспергируют в механохимическом активаторе АГО-2 с удельной мощностью 10-80 Вт/г в течение 10 мин. Диспергированный Li1,3Al0,3Ti1,7(PO4)3 прессуют в таблетки при давлении 100 бар и спекают на воздухе при 850°С в течение 4 часов. Плотность данной керамики составляет 2,53 г⋅см-3 (86 % от теор.), а значения ионной проводимости и энергии активации равны 2,9⋅10-4 См⋅см-1 и 0,33 эВ соответственно.
Пример 7. Для получения высокодисперсного литий-проводящего твердого электролита, Li1,3Al0,3Ti1,7(PO4)3, синтезированный по примеру 2, диспергируют в механохимическом активаторе АГО-2 с удельной мощностью 10-80 Вт/г в течение 20 мин. Диспергированный Li1,3Al0,3Ti1,7(PO4)3 прессуют в таблетки при давлении 100 бар и спекают на воздухе при 850°С в течение 4 часов. Плотность данной керамики составляет 2,64 г⋅см-3 (90 % от теор.), а значения ионной проводимости и энергии активации равны 3,4⋅10-4 См⋅см-1 и 0,23 эВ соответственно.
Пример 8. Для получения высокодисперсного литий-проводящего твердого электролита, Li1,3Al0,3Ti1,7(PO4)3, синтезированный по примеру 2, диспергируют в механохимическом активаторе АГО-2 с удельной мощностью 10-80 Вт/г в течение 30 мин. Диспергированный Li1,3Al0,3Ti1,7(PO4)3 прессуют в таблетки при давлении 100 бар и спекают на воздухе при 850°С в течение 4 часов. Плотность данной керамики составляет 2,77 г⋅см-3 (94 % от теор.), а значения ионной проводимости и энергии активации равны 2,7⋅10-4 См⋅см-1 и 0,40 эВ соответственно.
Краткое описание чертежей
Сущность изобретения поясняется чертежами.
Фиг. 1 Кристаллическая структура твердого электролита типа NASICON.
Фиг. 2 Процесс дегазации механически активированных реакционных смесей для синтеза LATP: механически активированные реакционные смеси без углерода (0 масс.%) и с углеродом (5 масс.%) (а), дегазированные механически активированные реакционные смеси при 350°С (б), тигли после извлечения дегазированной смеси (в).
Фиг. 3 Дегазированные реакционные смеси, содержащие различное количество углерода: 1 масс.% (а), 2,5 масс.% (б), 5 масс.% (в).
Фиг. 4 Дифрактограммы образцов LATP, синтезированных с различным содержанием углерода в реакционной смеси: без углерода (а), 1 масс.% (б), 2,5 масс.% (в), 5 масс.% (г).
Фиг. 5 Дифрактограммы образцов LATP после измельчения: 1,0 мин (а), 2,5 мин (б), 5,0 мин (в), 10,0 мин (г), 20,0 мин (д), 30,0 мин (е).
Фиг. 6 Микрофотографии образцов LATP до измельчения (а) и после 30 мин измельчения. Распределение частиц по размерам (в) и зависимость среднего размера частиц от времени измельчения (г).
Фиг. 7 Зависимость геометрической плотности спеченных керамических таблеток LATP от времени измельчения.
Фиг. 8 Спектры импеданса (а) и зависимость проводимости от времени измельчения (б) для синтезированного LATP.
Фиг. 9 Оценка электронной проводимости с использованием метода хроноамперометрии: изменение тока от времени (а), зависимость подаваемого напряжения от регистрируемого тока (б), зависимость электронной проводимости керамики LATP от времени измельчения.
Фиг. 10 Температурная зависимость проводимости (а) и зависимость энергии активации LATP от времени измельчения (б).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ЧАСТИЦ ТВЕРДОГО ЭЛЕКТРОЛИТА LiAlTi(PO) (0,1≤x≤0,5) | 2012 |
|
RU2493638C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОРОШКООБРАЗНОГО ТВЕРДОГО ЭЛЕКТРОЛИТА С ВЫСОКОЙ ПРОВОДИМОСТЬЮ ПО ИОНУ ЛИТИЯ | 2015 |
|
RU2583762C1 |
| Способ получения композиционного анодного материала TiNbO/C для литий-ионных аккумуляторов | 2022 |
|
RU2799067C1 |
| Способ получения фосфатосиликата циркония и натрия состава NaZrSiPO со структурой NASICON | 2022 |
|
RU2780211C1 |
| СПОСОБ ПОЛУЧЕНИЯ ВЫСОКОДИСПЕРСНЫХ КАТОДНЫХ МАТЕРИАЛОВ LiFeMPO/C СО СТРУКТУРОЙ ОЛИВИНА | 2010 |
|
RU2444815C1 |
| ЭЛЕКТРОЛИТ ДЛЯ НАТРИЙ-ИОННЫХ АККУМУЛЯТОРОВ, СПОСОБ ЕГО ИЗГОТОВЛЕНИЯ И АККУМУЛЯТОР НА ЕГО ОСНОВЕ | 2018 |
|
RU2707575C1 |
| Способ получения композиционного катодного материала на основе NaV(PO)F для натрий-ионных аккумуляторов | 2020 |
|
RU2747565C1 |
| СПОСОБ ПОЛУЧЕНИЯ NaSn(PO) СО СТРУКТУРОЙ NASICON | 2021 |
|
RU2777643C1 |
| Способ получения твердого электролита | 2019 |
|
RU2720349C1 |
| Композитный твердый электролит для твердотельных литиевых электрохимических устройств | 2021 |
|
RU2778549C1 |


Изобретение относится к химической технологии и может быть использовано при создании твердотельных литий-ионных аккумуляторов. Способ получения высокодисперсного литий-проводящего твердого электролита Li1,3Al0,3Ti1,7(PO4)3 для литий-ионных аккумуляторов включает измельчение, тонкое смешение и активацию реакционной смеси, содержащей оксид титана, карбонат лития, гидроксид алюминия, дигидрофосфат аммония и углерод; термическую обработку; охлаждение и диспергирование синтезированного твердого электролита. Добавление в механически активированную реакционную смесь углерода приводит к подавлению вспенивания данной смеси в ходе процесса дегазации, после чего углерод окисляется. Технический результат заключается в получении с применением механической активации и пеноподавляющей добавки (углерода) высокодисперсного литий-проводящего твердого электролита Li1,3Al0,3Ti1,7(PO4)3 с улучшенными проводящими свойствами. 4 з.п. ф-лы, 10 ил., 2 табл., 8 пр.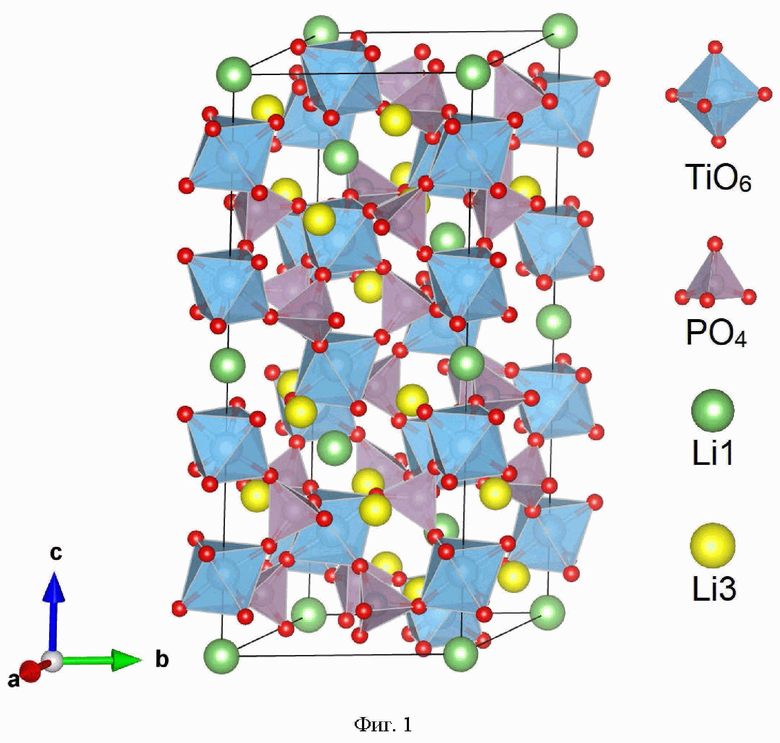
1. Способ получения высокодисперсного литий-проводящего твердого электролита Li1,3Al0,3Ti1,7(PO4)3 для литий-ионных аккумуляторов, включающий измельчение реакционной смеси, содержащей оксид титана, карбонат лития, оксид алюминия и дигидрофосфат аммония; термическую обработку; охлаждение; измельчение синтезированного твердого электролита, отличающийся тем, что исходные компоненты смешивают с углеродом и активируют в механохимическом активаторе с удельной мощностью 10-80 Вт/г в течение 3-10 минут, после чего полученную смесь подвергают термической обработке на воздухе в две стадии при температурах 350°С и 750°С в воздушной атмосфере и выдержке в течение 1,5 часа и 2 часов соответственно, охлаждают до комнатной температуры и диспергируют в механохимическом активаторе мощностью 10-80 Вт/г в течение 1-30 минут в инертной атмосфере, диспергированный твердый электролит прессуют в таблетки при давлении 100 бар и медленно нагревают в течение 5 часов при 850°С с выдержкой 4 часа.
2. Способ по п. 1, отличающийся тем, что в качестве соединений алюминия используют гидроксид алюминия Al(OH)3.
3. Способ по п. 1, отличающийся тем, что в реакционную смесь вводят 5 масс. % углерода.
4. Способ по п. 1, отличающийся тем, что реакционную смесь измельчают в механическом активаторе в течение 5 минут.
5. Способ по п. 1, отличающийся тем, что синтезированный твердый электролит диспергируют в механохимическом активаторе в течение 20 минут.
| CN 114976217 A, 30.08.2022 | |||
| US 2018105450 A1, 19.04.2018 | |||
| JP 6385452 B2, 05.09.2018 | |||
| EP 3298643 B1, 12.06.2019 | |||
| Электродный материал для натрий-ионных аккумуляторов, способ его получения, электрод и аккумулятор на основе электродного материала | 2020 |
|
RU2748159C1 |
Авторы
Даты
2024-06-27—Публикация
2023-12-06—Подача