Это изобретение было осуществлено при частичной поддержке правительства США грантами No. CA 12623 и СА 53001 из The National Cancer Institute, Department of Health and Human Services. Таким образом, правительство США может иметь определенные права на это изобретение.
Неопластические заболевания, характеризующиеся пролиферацией клеток, не подвергаются нормальному контролю клеточного роста, в большинстве своем вызывают смерть у людей. Клиническое испытание по химиотерапии продемонстрировало, что для лечения этих заболеваний желательными являются новые и более эффективные лекарства. Такой эксперимент продемонстрировал также, что лекарства, которые разрушают систему микротрубочек цитоскелета, могут быть эффективными в ингибировании пролиферации опухолевых клеток.
Система микротрубочек эукариотических клеток составляет основной компонент цитоскелета и находится в динамическом состоянии - упорядоченная структура и разупорядоченная структура; таким образом, что гетеродимеры тубулина полимеризуются с образованием микротрубочек, а микротрубочки деполимеризуются до составляющих их компонентов. Микротрубочки играют ключевую роль в регулировании клеточной архитектуры, метаболизма и деления. Динамическое состояние микротрубочек является критическим для их нормальных функций. Что касается клеточного деления, тубулин полимеризуется в микротрубочки, которые образуют митотическое веретено. Затем микротрубочки деполимеризуются, когда используемое митотическое веретено заполнится. Таким образом, агенты, которые нарушают полимеризацию или деполимеризацию микротрубочек, и тем самым ингибируют митоз, включают некоторые наиболее эффективные химиотерапевтические агенты для клинического применения.
Такие антимитотические агенты или яды могут быть классифицированы на три группы на основании их молекулярного механизма действия. Первая группа состоит из агентов, включающих колхицин и колцемид, которые ингибируют образование микротрубочек за счет разрушения тубулина. Вторая группа состоит из агентов, включающих винбластин и винкристин, которые индуцируют образование паракристаллических агрегатов тубулина. Винбластин и винкристин являются хорошо известными противораковыми лекарствами. Их действие разрушения микротрубочек митотического веретена, преимущесвенно ингибирует гиперпролиферативные клетки. Третья группа состоит из агентов, включающих таксол, который ускоряет полимеризацию тубулина и таким образом стабилизирует структуру микротрубочек.
Однако большинство из них, обладающих активностью в качестве противоопухолевого агента, не гарантирует эффективность против опухолевой клетки и, конечно, не против опухолевой клетки, которая проявляет фенотип сопротивления лекарству. Алкалоиды Винка, такие как винбластин и винкристин, являются эффективными против опухолевых клеток и опухолей, однако, у них отсутствует активность против некоторых опухолей и клеток с сопротивлением лекарству. Одной из основ опухолевой клетки, проявляющей сопротивление лекарству (DR) или множественное сопротивление лекарству (MDR), является сплошная сверх-экспрессия Р-гликопротеина. Соединения, которые являются плохими субстратами для транспорта Р-гликопротеина, должны быть пригодными для разрушения таких DR или MDR фенотипов.
Таким образом, проявление DR или MDR фенотипа многими опухолевыми клетками и клинически доказанная форма действия противомикротрубочковых агентов против опухолевых клеток делает необходимым развитие антимикротрубочковых агентов цитотоксических в отношении опухолевых клеток с отсутствием сопротивления лекарству, а также цитотоксических в отношении к опухолевым клеткам с фенотипом сопротивления лекарству. Агенты, которые являются обещающими в этом отношении, включают класс соединений, известных как криптофицины.
Что касается способов получения криптофицинов, в настоящее время не известен способ полного синтеза криптофицинов. Криптофициновые соединения в настоящее время получают путем выделения из зелено-голубых водорослей или путем полусинтетических вариантов способа таких естественно полученных соединений. Отсутствие полного синтетического способа неизбежно делает трудным получение стереоспецифических криптофицинов, способа, который может привести к максимальной активности и увеличению стабильности соединения. Например, исследование показало, что криптофицины с неактивным макроциклическим кольцом являются более активными. Таким образом, полный синтетический способ, который может давать криптофицины с макроциклическим кольцом, которое является более стабильным, чем в естественно полученных криптофицинах, будет желательным. Настоящее изобретение решает эти проблемы.
Настоящее изобретение обеспечивает новые криптофициновые соединения, имеющие следующую структуру: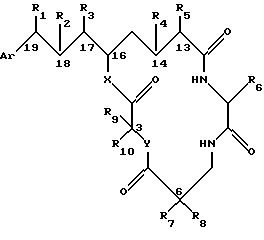
где Аr представляет метил или фенил, или любую простую незамещенную, или замещенную ароматическую, или гетероароматическую группу;
R1 представляет галоид, SH, амино, моноалкиламино, диалкиламино, триалкиламмоний, алкилтио, диалкилсульфоний, сульфат или фосфат;
R2 представляет ОН или SH; или
R1 и R2 могут объединяться вместе с образованием эпоксидного кольца, азиридинового кольца, эписульфидного кольца, сульфатного кольца или моноалкилфосфатного кольца; или
R1 и R2 могут объединяться вместе с образованием двойной связи между C18 и C19;
R3 представляет низшую алкильную группу;
R4 и R5 представляют Н; или
R4 и R5 могут объединяться вместе с образованием двойной связи между С13 и C14;
R6 представляет бензильную, оксибензильную, алкоксибензильную, галоидоксибензильную, дигалоидоксибензильную, галоидалкоксибензильную или дигалоидалкоксибензильную группу;
R7, R8, R9 и R10 каждый независимо представляют Н или низшую алкильную группу; и
Х и Y каждый независимо представляют О, NH или алкиламино.
Настоящее изобретение далее обеспечивает общие синтетические способы получения криптофицинов. Настоящее изобретение также обеспечивает применение криптофицинов в фармацевтических препаратах для ингибирования пролиферации клеток млекопитающего и для лечения опухоли.
Фигура 1 представляет общую структуру выбранных криптофициновых соединений настоящего изобретения и систему чисел для оксикислотных элементов А и D и аминокислотных элементов В и С в выбранных вариантах;
фигуры 2А и 2В графически изображают влияние криптофициновых соединений и винбластина на клеточную пролиферацию Jurkat и прогрессию клеточного цикла. Клетки Jurkat проинкубированы с указанными концентрациями криптофициновых соединений (А) или винбластина (В) в течение 24 часов. Для каждого образца были определены число жизнеспособных клеток (▪) и митотический индекс ( □), как описано в экспериментальной части. Величины представляют значение +/- стандартное отклонение (sd) для трех образцов в одном из трех подобных экспериментов;
фигура 3 графически изображает обратимость влияния винбластина, криптофицинов и таксола на клеточный рост. SKOV3 клетки были обработаны 0.1 нМ винбластина (□ ), 0.1 нМ криптофицинов (▪) или 1 нМ таксола (х) в момент времени = 0. Эти концентрации ингибировали клеточный рост на 50% для каждого соединения. Через 24 часа клетки промывали и инкубировали в среде, свободной от лекарства, в течение указанного времени. Плотность клеток определяли с помощью окрашивания сульфородамином В (SRB), как описано в экспериментальной части, и экспрессировали в виде +/- sd поглощения при 560 нм для тройных образцов в одном из трех экспериментов;
фигура 4 изображает изоболограммы для комбинационных эффектов винбластина и криптофицинов на клеточную пролиферацию. SKOV3 клетки были обработаны винбластином (0-600 пкМ) и/или криптофицинами (1-100 пкМ) в течение 48 часов. Затем количество клеток было определено с помощью окрашивания SRB, как описано в экспериментальной части, и были определены величина IC50s (▪) и линия аддитивности (---) для комбинаций винбластина и криптофициновых соединений. Величины представляют значения для двух экспериментов, каждый содержащий тройные образцы;
фигура 5 представляет первую схему синтеза криптофицинов в соответствии с настоящим изобретением;
фигура 6 представляет схему для получения оксикислотного элемента А;
фигура 7 представляет схему для получения субединицы криптофицина, включающей оксикислотный элемент А и аминокислоту В;
фигура 8 представляет схему для получения субединицы криптофицина, включающей аминокислотный элемент С и оксикислоту D;
фигура 9 представляет первую схему для синтеза выбранных криптофицинов в соответствии с настоящим изобретением;
фигура 10 представляет вторую схему для синтеза выбранных криптофицинов в соответствии с настоящим изобретением;
фигура 11 представляет схему для синтеза субединицы криптофицина, включающей оксикислоту D;
фигура 12 представляет третью схему для синтеза выбранных криптофицинов в соответствии с настоящим изобретением;
фигура 13 представляет четвертую схему для синтеза выбранных криптофицинов в соответствии с настоящим изобретением; и
фигура 14 представляет пятую схему для синтеза выбранных криптофицинов в соответствии с настоящим изобретением.
Настоящее изобретение обеспечивает новые криптофициновые соединения, имеющие следующую структуру: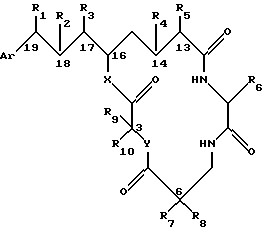
где Аr представляет метил, или фенил, или любую простую незамещенную или замещенную ароматическую или гетероароматическую группу;
R1 представляет галоид, SH, амино, моноалкиламино, диалкиламино, триалкиламмоний, алкилтио, диалкилсульфоний, сульфат или фосфат;
R2 представляет ОН или SH; или
R1 и R2 могут объединяться вместе с образованием эпоксидного кольца, азиридинового кольца, эписульфидного кольца, сульфатного кольца или моноалкилфосфатного кольца; или
R1 и R2 могут объединяться вместе с образованием двойной связи между C18 и C19.
R3 представляет низшую алкильную группу;
R4 и R5 представляют Н; или
R4 и R5 могут объединяться вместе с образованием двойной связи между C13 и C14;
R6 представляет бензильную, оксибензильную, алкоксибензильную, галоидоксибензильную, дигалоидоксибензильную, галоидалкоксибензильную или дигалоидалкоксибензильную группу;
R7, R8, R9 и R10 каждый независимо представляют Н или низшую алкильную группу; и
Х и У каждый независимо представляют О, NH или алкиламино.
В одном из аспектов настоящего изобретения обеспечиваются новые криптофициновые соединения, имеющие следующую структуру: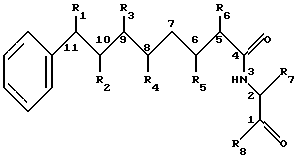
где R1 представляет Н, ОН, галоид, О кетогруппы, NH2, SH, низшую алкокси группу или низшую алкильную группу;
R2 представляет Н, ОН, О кетогруппы, NH2, SH, низшую алкокси группу или низшую алкильную группу; или
R1 и R2 могут объединяться вместе с образованием эпоксидного кольца азиридинового кольца, эписульфидного кольца, или двойной связи между С10 и С11; или
R1 и R2 могут объединяться вместе с образованием тетрагидрофуранового кольца;
R3 представляет Н или низшую алкильную группу;
R4 представляет ОН, низшую алканоильную группу или низшую α-оксиалканоилокси группу;
R5 представляют Н или ОН группу;
R6 представляет Н; или
R5 и R6 могут объединяться вместе с образованием двойной связи между С5 и С6;
R7 представляет бензильную, оксибензильную, метоксиксибензильную, галоидоксибензильную, дигалоидоксибензильную, галоидметоксибензильную или дигалоидметоксибензильную группу;
R8 представляет ОН, низшую β-аминокислоту, С1 связывается с N β-аминокислоты, или этерифицированной низшей β-аминокислоты, где С1 связывается с N этерифицированной низшей β-аминокислотной группы;
R4 и R8 могут объединяться вместе с образованием дидепсипептидной группы, состоящей из низшей β-аминокислоты, связанной с низшей α-оксиалкановой кислотой; и
R5 и R8 могут объединяться вместе с образованием дидепсипептидной группы, состоящей из низшей 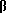 -аминокислоты, связанной с низшей α-оксиалкановой кислотой; и
-аминокислоты, связанной с низшей α-оксиалкановой кислотой; и
со следующими условиями:
R1 представляет Н, низшую алкильную группу или низшую алкокси группу только, если R2 представляет ОН, О кетогруппы, NH2, SH;
R2 представляет Н, низшую алкильную группу или низшую алкокси группу только, если R1 представляет ОН, О кетогруппы, NH2, SH;
если R1 представляет ОН, R2 представляет ОН, R3 представляет метил, R5 и R6 могут объединяться вместе с образованием двойной связи между C5 и C6, R4 и R8 объединяются вместе с образованием дидепсипептидной группы со структурой X: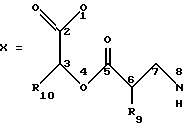
где O1 указанного X соответствует R4, N8 указанного Х соответствует R8, R9 представляет метил и R10 представляет изобутил, R7 не является 3-хлор-4-метоксибензилом;
если R1 и R2 объединяются вместе с образованием эпоксидного кольца, R9 представляет метил, R5 и R6 объединяются вместе с образованием двойной связи между C5 и С6, R4 и R8 объединяются вместе с образованием дидепсипептида со структурой X, R9 представляет метил и R10 представляет изобутил, R7 не является 3-хлор-4-метоксибензилом;
если R1 и R2 объединяются вместе с образованием двойной связи между С10 и С11, R3 представляет метил, R5 и R6 объединяются вместе с образованием двойной связи между C5 и С6, R4 и R8 объединяются вместе с образованием дидепсипептида со структурой X, R9 представляет метил и R10 представляет изобутил, R7 не является 3-хлор-4-метоксибензилом; и
если R1 и R2 объединяются вместе с образованием эпоксидной группы, R9 представляет метил, R5 и R6 объединяются вместе с образованием двойной связи между C5 и С6, R4 связывается с концевой карбоксильной группой лейциновой кислоты и R8 присоединяется к азоту концевой группы либо 3-амино-2-метилпропионовой кислоты, либо метилового эфира 3-амино-2-метилпропионовой кислоты, R7 не является 3-хлор-4-метоксибензилом.
Изобретение далее обеспечивает криптофициновые соединения, где, по крайней мере, одна из групп, присоединенных в C2, C8, С9, С10 и С11, обладает R-стереохимией. В дальнейшем варианте изобретения, по крайней мере, одна из групп, присоединенных в С2, С8, С9, С10 и С11, обладает S-стереохимией.
Изобретение далее обеспечивает криптофициновые соединения в соответствии с приведенной выше структурой, где структура дидепсипептида, который образуется, если R4 или R5 объединяется вместе с R8, имеет следующую структуру X:
где O1 указанного X соответствует R4 или R5, N8 указанного X соответствует R8, R9 представляет Н или низшую алкильную группу и R10 представляет Н или низшую алкильную группу.
Следующие термины, как они использованы здесь, имеют указанные значения, если не оговорено противоположное значение, четко имеются в виду из использования в контексте:
"низшая β-аминокислота" подразумевает β-аминокислоту, имеющую от трех до восьми атомов углерода, и включает линейные и нелинейные углеводородные цепи; например, 3-амино-2-метилпропионовую кислоту.
"Этерифицированная низшая β-аминокислота" подразумевает β-аминокислоту, имеющую от трех до восьми атомов углерода, где водород карбоксильной группы замещается метильной группой; например метиловый эфир 3-амино-2-метилпропионовой кислоты.
"Низшая алканоилокси группа" подразумевает алканоилокси группу с одним-семью атомами углерода и включает линейные и нелинейные углеводородные цепи.
"Низшая α-оксиалканоилокси группа" подразумевает α-оксиалканоилокси группу с двумя-семью атомами углерода и включает линейные и нелинейные углеводородные цепи, например, 2-окси-4-метилвалерьяновую кислоту.
"Низшая алкоксильная группа" подразумевает любую алкильную группу с одним-пятью атомами углерода, связанными с атомом кислорода.
"Низшая алкильная группа" подразумевает алкильную группу с одним-пятью атомами углерода и включает линейные и нелинейные углеводородные цепи, включающие, например, метильные, этильные, пропильные, изопропильные, бутильные, изобутильные, трет-бутильные, сескви-бутильные, метилированные бутильные группы, пентильные и трет-пентильные группы.
"Аллильно замещенный алкен" подразумевает алкен, который содержит алкильный заместитель.
"Эпоксидное кольцо" подразумевает трехчленное кольцо, чей скелет состоит из двух атомов углерода и атома кислорода.
"Азиридиновое кольцо" подразумевает трехчленное кольцо, чей скелет состоит из двух атомов углерода и атома азота.
"Эписульфидное кольцо" подразумевает трехчленное кольцо, чей скелет состоит из двух атомов углерода и атома серы.
"Сульфатное кольцо" подразумевает пятичленное кольцо, состоящее из углерод-углерод-кислород-сера-кислородного скелета с двумя дополнительными атомами кислорода, связанными с атомом серы.
"Мономалкилфосфатное кольцо" подразумевает пятичленное кольцо, состоящее из углерод-углерод-кислород-фосфор-кислородного скелета с двумя дополнительными атомами кислорода, один из которых содержит низшую алкильную группу, соединенную с атомом фосфора.
"Простая незамещенная ароматическая группа" относится к обычным ароматическим кольцам, содержащим 4n+2pi электронов в моноциклической сопряженной системе (например, фурил, пирролил, тиенил, пиридил) или бициклической сопряженной системе (например, индолил или нафтил).
"Простая замещенная ароматическая группа" относится к фенильной группе, замещенной единичной группой (например, низшей алкильной группой или галоидом).
"Гетероароматическая группа" относится к ароматическим кольцам, которые содержат один или больше неуглеродных заместителей, таких как кислород, азот или сера.
"Галоид" относится к тем членам группы в периодической таблице элементов, которые известны как галоиды. Способы галоидирования включают, но не ограничиваются ими, присоединение галоидводородов, замещение при повышенной температуре, фотогалоидирование и т.д. и такие способы известны специалистам в этой области.1,2.
Один из вариантов криптофицинового соединения настоящего изобретения представляет соединение, где R1 и R2 объединяются вместе с образованием эпоксидной группы, R3 представляет метил, R5 и R6 объединяются вместе с образованием двойной связи между C5 и С6, R7 представляет 4-метоксибензил и R4 и R8 объединяются вместе с образованием дидепсипептида со структурой X, где R9 представляет метил и R10 представляет изобутил. Структура этого соединения, Криптофицина 2, является следующей: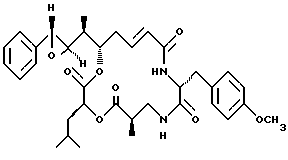
Криптофицин 2
Другой вариант соединения настоящего изобретения представляет соединение, где R1 и R2 объединяются вместе с образованием двойной связи между С10 и С11 атомами углерода, R3 представляет метил, R5 и R6 объединяются вместе с образованием двойной связи между С5 и С6, R7 представляет 4-метоксибензил и R4 и R8 объединяются вместе с образованием дидепсипептида со структурой X, где R9 представляет метил и R10 представляет изобутил. Структура этого криптофицинового соединения, Криптофицина 4, является следующей: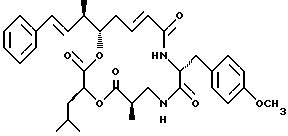
Криптофицин 4
Другой вариант соединения настоящего изобретения представляет соединение, где R1 и R4 объединяются вместе с образованием тетрагидрофуранового кольца, R2 представляет ОН группу, R3 представляет метил, R5 и R6 объединяются вместе с образованием двойной связи между C5 и С6, R7 представляет 3-хлор-4-метоксибензил и R8 представляет (2-карбометоксипропил)амино группу. Структура этого соединения, Криптофицина 6, является следующей:
Криптофицин 6
Другой вариант соединения настоящего изобретения представляет соединение, где R1 и R4 объединяются вместе с образованием тетрагидрофуранового кольца, R2 и R8 являются ОН группами, R3 представляет метил, R5 и R6 объединяются вместе с образованием двойной связи между С5 и С6 таким образом, что представляют двойную связь, R7 представляет 3-хлор-4-метоксибензил. Структура этого соединения, Криптофицина 7, является следующей: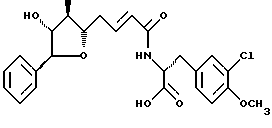
Криптофицин 7
Другой вариант соединения настоящего изобретения представляет соединение, где R1 представляет хлор, R2 представляет ОН группу, R3 представляет метил, R5 и R6 объединяются вместе с образованием двойной связи между C5 и С6, R7 представляет 3-хлор-4-метоксибензил и R4 и R8 объединяются вместе с образованием дидепсипептида со структурой X, где R9 представляет метил и R10 представляет изобутил. Структура этого соединения, Криптофицина 8, является следующей: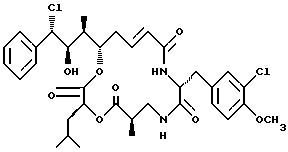
Криптофицин 8
Другой вариант соединения настоящего изобретения представляет соединение, где R1 представляет метокси группу, R2 представляет ОН группу, R3 представляет метил, R5 и R6 объединяются вместе с образованием двойной связи между C5 и С6, R7 представляет 3-хлор-4-метоксибензил и R4 и R8 объединяются вместе с образованием дидепсипептида со структурой X, где R9 представляет метил и R10 представляет изобутил. Структура этого соединения, Криптофицина 9, является следующей: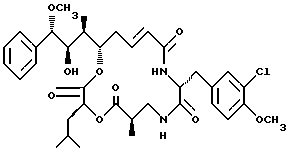
Криптофицин 9
Другой вариант соединения настоящего изобретения представляет соединение, где R1 представляет метокси группу, R2 и R4 являются ОН группами, R3 представляет метил, R5 и R6 объединяются вместе с образованием двойной связи между C5 и С6, R7 представляет 3-хлор-4-метоксибензил и R8 представляет (2-карбоксипропил)амино группу. Структура этого соединения, Криптофицина 10, является следующей:
Криптофицин 10
Другой вариант соединения настоящего изобретения представляет соединение, где R1 и R4 объединяются вместе с образованием тетрагидрофуранового кольца, R2 представляет ОН группу, R3 представляет метил, R5 и R6 объединяются вместе с образованием двойной связи между C5 и С6, R7 представляет 3-хлор-4-метоксибензил и R8 представляет (2-карбоксипропил)амино группу. Структура этого соединения, Криптофицина 12, является следующей: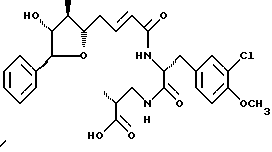
Криптофицин 12
Другой вариант соединения настоящего изобретения представляет соединение, где R1 и R2 объединяются вместе с образованием двойной связи между С10 и С11 атомами углерода, R3 представляет метил, R4 представляет ОН группу, R5 и R6 объединяются вместе с образованием двойной связи между C5 и С6, R7 представляет 3-хлор-4-метоксибензил и R8 представляет (2-карбоксипропил)амино группу. Структура этого соединения, Криптофицина 14, является следующей: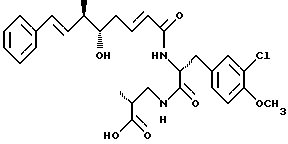
Криптофицин 14
Другой вариант соединения настоящего изобретения представляет соединение, где R1 и R2 объединяются вместе с образованием эпоксидной группы, R3 представляет метил, R5 и R6 объединяются вместе с образованием двойной связи между C5 и С6, R7 представляет 3-хлор-4-гидроксибензил и R4 и R8 объединяются вместе с образованием дидепсипептида со структурой X, где R9 представляет метил и R10 представляет изобутил. Структура этого соединения, Криптофицина 16, является следующей: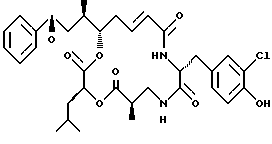
Криптофицин 16
Другой вариант соединения настоящего изобретения представляет соединение, где R1 и R2 объединяются вместе с образованием двойной связи между С10 и С11 атомами углерода, R3 представляет метил, R5 и R6 объединяются вместе с образованием двойной связи между C5 и C6, R7 представляет 3-хлор-4-гидроксибензил и R4 и R8 объединяются вместе с образованием дидепсипептида со структурой X, где R9 представляет метил и R10 представляет изобутил. Структура этого соединения, Криптофицина 17, является следующей: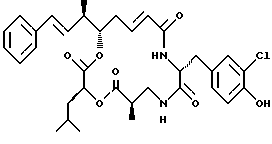
Криптофицин 17
Другой вариант соединения настоящего изобретения представляет соединение, где R1 и R2 объединяются вместе с образованием двойной связи между С10 и С11 атомами углерода, R3 представляет метил, R5 и R6 объединяются вместе с образованием двойной связи между С5 и С6, R7 представляет 3-хлор-4-метоксибензил и R4 и R8 объединяются вместе с образованием дидепсипептида со структурой X, где R9 представляет метил и R10 представляет втор-бутил. Структура этого соединения, Криптофицина 18, является следующей: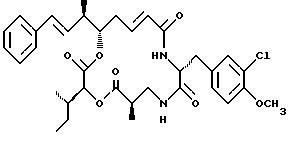
Криптофицин 18
Другой вариант соединения настоящего изобретения представляет соединение, где R1 и R2 объединяются вместе с образованием двойной связи между С10 и С11 атомами углерода, R3 представляет метил, R5 и R6 объединяются вместе с образованием двойной связи между C5 и С6, R7 представляет 3-хлор-4-метоксибензил и R4 и R8 объединяются вместе с образованием дидепсипептида со структурой X, где R9 представляет метил и R10
представляет изопропил. Структура этого соединения, Криптофицина 19, является следующей: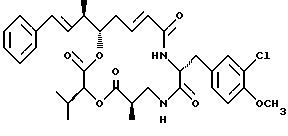
Криптофицин 19
Другой вариант соединения настоящего изобретения представляет соединение, где R1 и R2 объединяются вместе с образованием эпоксидного кольца, R3 представляет метил, R5 и R6 объединяются вместе с образованием двойной связи между C5 и С6, R7 представляет 3-хлор-4-метоксибензил и R4 и R8 объединяются вместе с образованием дидепсипептида со структурой X, где R9 представляет водород и R10 представляет изобутил. Структура этого соединения, Криптофицина 21, является следующей: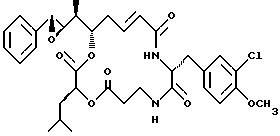
Криптофицин 21
Другой вариант соединения настоящего изобретения представляет соединение, где R1 и R2 объединяются вместе с образованием эпоксидного кольца, R3 представляет метил, R5 и R6 объединяются вместе с образованием двойной связи между C5 и С6, R7 представляет 3,5-дихлор-4-гидроксибензил и R4 и R8 объединяются вместе с образованием дидепсипептида со структурой X, где R9 представляет метил и R10 представляет изобутил. Структура этого соединения, Криптофицина 23, является следующей: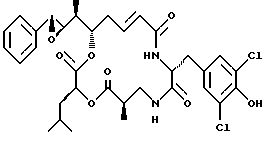
Криптофицин 23
Другой вариант соединения настоящего изобретения представляет соединение, где R1 и R2 объединяются вместе с образованием эпоксидного кольца, R3 представляет метил, R5 и R6 объединяются вместе с образованием двойной связи между C5 и C6, R7 представляет 4-метоксибензил и R4 и R8 объединяются вместе с образованием дидепсипептида со структурой X, где R9 представляет водород и R10 представляет изобутил. Структура этого соединения, Криптофицина 24, является следующей: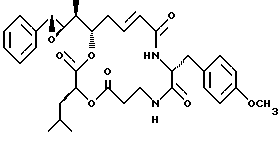
Криптофицин 24
Другой вариант соединения настоящего изобретения представляет соединение, где R1 и R2 объединяются вместе с образованием двойной связи между С10 и С11 атомами углерода, R3 представляет метил, R4 представляет гидрокси, R6 представляет водород, R7 представляет 3-хлор-4-метоксибензил и R5 и R8 объединяются вместе с образованием дидепсипептида со структурой X, где R9 представляет метил и R10 представляет изобутил. Структура этого соединения, Криптофицина 26, является следующей: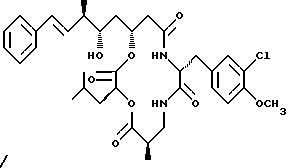
Криптофицин 26
Другой вариант соединения настоящего изобретения представляет соединение, где R1 и R2 объединяются вместе с образованием двойной связи между С10 и С11 атомами углерода, R3 представляет водород, R5 и R8 объединяются вместе с образованием двойной связи между C5 и C6, R7 представляет 3-хлор-4-метоксибензил и R4 и R8 объединяются вместе с образованием дидепсипептида со структурой X, где R9 представляет метил и R10 представляет изобутил. Структура этого соединения, Криптофицина 28, является следующей:
Криптофицин 28
Другой вариант соединения настоящего изобретения представляет соединение, где R1 и R2 объединяются вместе с образованием двойной связи между С10 и С11 атомами углерода, R3 представляет водород, R5 и R8 объединяются вместе с образованием двойной связи между C5 и C6, R7 представляет 3-хлор-4-метоксибензил и R4 и R8 объединяются вместе с образованием дидепсипептида со структурой X, где R9 представляет водород и R10 представляет изобутил. Структура этого соединения, Криптофицина 29, является следующей: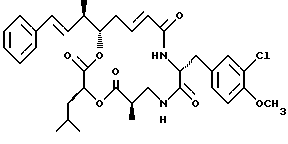
Криптофицин 29
Другой вариант соединения настоящего изобретения представляет соединение, где R1 и R2 объединяются вместе с образованием двойной связи между С10 и С11 атомами углерода, R3 представляет метил, R5 представляет гидрокси, R6 представляет водород, R7 представляет 3-хлор-4-метоксибензил и R4 и R8 объединяются вместе с образованием дидепсипептида со структурой X, где R9 представляет метил и R10 представляет изобутил. Структура этого соединения, Криптофицина 30, является следующей: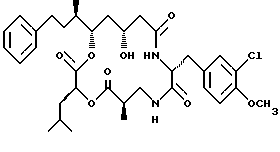
Криптофицин 30
Другой вариант соединения настоящего изобретения представляет соединение, где R1 и R2 объединяются вместе с образованием эпоксидной группы, R3 представляет метил, R5 и R6 объединяются вместе с образованием двойной связи между C5 и С6, R7 представляет 3,5-дихлор-4-метоксибензил и R4 и R8 объединяются вместе с образованием дидепсипептида со структурой X, где R9 представляет метил и R10 представляет изобутил. Структура этого соединения, Криптофицина 31, является следующей:
Криптофицин 31
Другой вариант соединения настоящего изобретения представляет соединение, где R1 и R2 объединяются вместе с образованием эпоксидной группы, R3 представляет метил, R5 представляет гидрокси, R6 представляет водород, R7 представляет 3-хлор-4-метоксибензил и R4 и R8 объединяются вместе с образованием дидепсипептида со структурой X, где R9 представляет метил и R10 представляет изобутил. Структура этого соединения, Криптофицина 35, является следующей: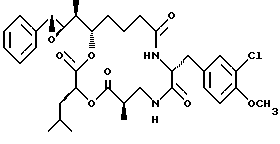
Криптофицин 35
Другой вариант соединения настоящего изобретения представляет соединение, где R1 и R2 объединяются вместе с образованием эпоксидной группы, R3 представляет водород, R5 и R6 объединяются вместе с образованием двойной связи между C5 и С6, R7 представляет 3-хлор-метоксибензил, и R4 и R8 объединяются вместе с образованием дидепсипептида со структурой X, где R9 представляет метил и R10 представляет изобутил. Структура этого соединения, Криптофицина 40, является следующей: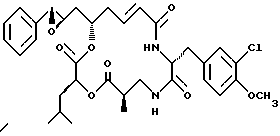
Криптофицин 40
Другой вариант соединения настоящего изобретения представляет соединение, где R1 и R2 объединяются вместе с образованием двойной связи между С10 и С11 атомами углерода, R3 представляет водород, R5 и R6 объединяются вместе с образованием двойной связи между C5 и С6, R7 представляет 3,5-дихлор-гидроксибензил, и R4 и R8 объединяются вместе с образованием дидепсипептида со структурой X, где R9 представляет метил и R10 представляет изобутил. Структура этого соединения, Криптофицина 45, является следующей: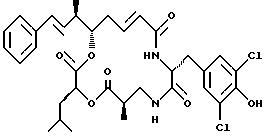
Криптофицин 45
Другой вариант соединения настоящего изобретения представляет соединение, где R1 и R2 объединяются вместе с образованием эпоксидной группы, R3 представляет метил, R5 и R6 объединяются вместе с образованием двойной связи между C5 и С6, R7 представляет 3-хлор-метоксибензил, и R4 и R8 объединяются вместе с образованием дидепсипептида со структурой X, где R9 представляет метил и R10 представляет пропил. Структура этого соединения, Криптофицина 49, является следующей: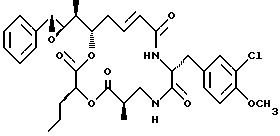
Криптофицин 49
Другой вариант соединения настоящего изобретения представляет соединение, где R1 и R2 объединяются вместе с образованием двойной связи между С10 и С11 атомами углерода, R3 представляет водород, R5 и R6 объединяются вместе с образованием двойной связи между C5 и C6, R7 представляет 3-хлор-4-метоксибензил, и R4 и R8 объединяются вместе с образованием дидепсипептида со структурой X, где R9 представляет метил и R10 представляет пропил. Структура этого соединения, Криптофицина 50, является следующей: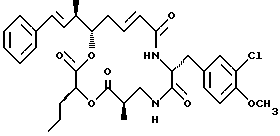
Криптофицин 50
Другой вариант соединения настоящего изобретения представляет соединение, где R1 и R2 объединяются вместе с образованием эпоксидной группы, R3 представляет метил, R5 и R6 объединяются вместе с образованием двойной связи между C5 и С6, R7 представляет 3-хлор-метоксибензил, и R4 и R8 объединяются вместе с образованием дидепсипептида со структурой X, где R9 представляет метил и R10 представляет втор-бутил. Структура этого соединения, Криптофицина 54, является следующей: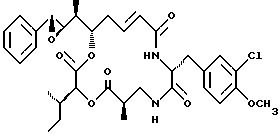
Криптофицин 54
Из вышеприведенных соединений, Криптофицины 2, 4, 16-19, 21, 23, 24, 26, 28-31, 40, 43, 45, 49, 50 и 54 являются метаболитами, продуцированными штаммом Nostoc sp. зелено-голубых водорослей (цианобактерий), которые были культивированы этими соединениями, впоследствии выделенными из этой культуры. Криптофицины 6 и 7 являются артефактами, которые продуцируются, если процедура выделения использует растворители, содержащие метанол. Криптофицины 8, 9, 10-12, 14 и 35 являются производными этих естественно продуцированных метаболитов, которые были химически модифицированы способами, описанными в экспериментальной части этой заявки, с альтернативными способами для создания приведенных в качестве примеров соединений, а также не приведенных в качестве примеров соединений, доступных для специалистов в этой области.
Настоящее изобретение обеспечивает способы продуцирования вышеприведенных криптофициновых соединений за счет культивирования штамма Nostoc sp. Морфологические характеристики Nostoc sp. зелено-голубых водорослей (цианобактерий), как они раскрыты в патенте США 4946835, являются такими, что они являются нитевидными и состоят из растительных клеток. В более длинных волокнах гетероцисты периодически наблюдаются в интеркалярном положении; акинеты не наблюдаются. Репродуцирование происходит за счет гормогоний дополнительно к статистическим трихомным разрывам. Основа для идентификации Nostoc sp. может быть найдена в J. Gen. Micro., 111:1-61 (1979).
Изобретение далее обеспечивает тот вариант, в котором Nostoc sp. могут быть культивированными и новые криптофициновые метаболиты, а также и предварительно описанные криптофициновые метаболиты, могут быть выделены из этой культуры. В предпочтительном варианте настоящего изобретения штамм Nostoc sp. , обозначенный GSV 224, представляет штамм, который культивируется и из которого выделяются соединения, представленные следующей структурой: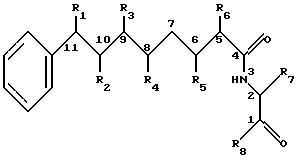
Где R1 представляет Н, ОН, галоид, О кетонной группы, NH2, SH, низшую алкоксильную группу или низшую алкильную группу;
R2 представляет Н, ОН, О кетонной группы, NH2, SH, низшую алкоксильную группу или низшую алкильную группу; или
R1 и R2 могут объединяться вместе с образованием эпоксидного кольца, азиридинового кольца, эписульфидного кольца или двойной связи между С10 и С11; или
R1 и R2 могут объединяться вместе с образованием тетрагидрофуранового кольца;
R3 представляет Н или низшую алкильную группу;
R4 представляют ОН, низшую алканоилокси группу или низшую α-оксиалканоилокси группу;
R5 представляют Н или ОН группу;
R6 представляет Н; или
R5 и R6 могут объединяться вместе с образованием двойной связи между C4 и С6;
R7 представляет бензильную, оксибензильную, метоксибензильную, галоидоксибензильную, дигалоидоксибензильную, галоидметоксибензильную или дигалоидметоксибензильную группу;
R8 представляют ОН, низшую β-аминокислоту, где C1 связывается с N β-аминокислоты, или этерифицированную низшую β-аминокислоту, где C1 связывается с N этерифицированной β-аминокислотной группы;
R4 и R8 могут объединяться вместе с образованием дидепсипептидной группы, состоящей из низшей β-аминокислоты, связанной с низшей α-оксиалканоильной кислотой; или
R5 и R8 могут объединяться вместе с образованием дидепсипептидной группы, состоящей из низшей β-аминокислоты, связанной с низшей α-оксиалканоильной кислотой;
при следующих условиях:
R1 представляет H, низшую алкильную группу или низшую алкоксильную группу только, если R2 представляет ОН, О кетонной группы, NH2, SH.
В предпочтительном варианте изобретения химически модифицированный криптофициновый метаболит, выделенный вышеописанным способом, точно обеспечивает соединение, также имеющее эту структуру. Способы химической модификации криптофициновых соединений с получением дополнительных соединений в пределах объема настоящего изобретения являются доступными специалистам в этой области. Однако дополнительные способы описываются более детально в экспериментальной части этой заявки.
Дополнительно к новым криптофициновым соединениям настоящего изобретения, настоящее изобретение обеспечивает новые способы получения, а также применения вышеприведенных соединений, которые включают следующие ранее раскрытые криптофициновые соединения, Криптофицины 1, 3, 5, 13 и 15. Структуры I этих соединений представлены в конце описания.
Изобретение при этом направляется на обеспечение любого штамма Nostoc sp. и, предпочтительно на обеспечение штамма Nostoc sp., GSV 224, для продуцирования криптофициновых соединений. С этой целью GSV 224, штамм Nostoc sp. , был помещен в банк данных 7 октября 1993 согласно Budapest Treaty Международного банка данных микроорганизмов с целью процедуры патентования с патентной культурой, помещенной в банк данных коллекции American Type Culture, 12301 Parklawn Drive, Rockville, Maryland 20852 U.S.A. под номером АТСС Acession N 55483. Другие штаммы Nostoc sp., в частности, штамм MB 5357, ранее помещенные в банк данных Merck and Co. под номером АТСС N 53789, представляют штаммы, которые могут быть рассмотрены для использования в практике настоящего изобретения.
Как это имеет место с другими организмами, характеристики Nostoc sp., подвергаются изменениям. Например, могут быть получены рекомбинанты, варианты или мутанты специфических штаммов путем обработки различными известными физическими или химическими мутагенами, такими как ультрафиолетовое излучение, радиационное излучение, гамма-излучение или путем обработки N-метил-N'-нитро-N-нитрозогуанидином. Все естественные и индуцированные варианты, мутанты и рекомбинанты специфических штаммов, которые сохраняют характеристики продуцирования криптофицинового соединения, включаются в пределы объема заявленного изобретения.
Криптофициновые соединения настоящего изобретения могут быть получены культивированием штамма Nostoc sp. в аэробных условиях, погруженных в соответствующую культурную среду до продуцирования, в основном, антибиотиковой активности. Другие приемы использования культуры, такие как рост на поверхности на отвержденной среде также могут быть использованы для продуцирования этих соединений. Культурные среды, использованные для роста специфических штаммов, могут включать любую среду из многих азотных и углеродных источников и неорганических солей, которые известны специалистам в этой области. Экономия в процессе продуцирования, оптимальные выходы и легкость выделения продукта являются теми факторами, которые принимаются в расчет при выборе углеродных источников и источников азота, которые используются. Среди питальных неорганических солей, которые могут быть введены в культурные среды, используются обычные растворимые соли, способные давать ионы железа, калия, натрия, магния, кальция, аммония, хлорида, карбоната, фосфата, сульфата, нитрата и им подобные ионы.
Следы ценных элементов, которые являются необходимыми для роста и развития организмов, должны быть также включены в культурную среду. Такие следы ценных элементов обычно присутствуют в виде примесей в других составляющих среды в количествах, достаточных для того, чтобы удовлетворять требованиям роста организмов. Может быть желательным добавление небольших количеств (т. е. 0.2 мл/л) антивспенивающего агента, такого как полипропиленгликоль (с мол. весом около 2000) для крупномасштабного культивирования среды, если вспенивание становится проблемой.
Для получения значительных количеств криптофициновых соединений может быть использовано аэробное культивирование с погружением в танки. Небольшие количества могут быть получены с использованием культуры во встряхиваемой колбе. Так как время задержки в проявлении продуцирования метаболита обычно связывается с инокуляцией больших танков организмами, предпочтительным является использование вегетативного инокулюма. Вегетативный инокулюм готовится путем инокуляции культурной среды малого объема фрагментами вегетативной трихомы или формой организма, содержащей гетероцисты для получения свежей, активно растущей культуры организма. Вегетативный инокулюм затем переносится в большой танк. Среда,
использованная для вегетативного инокулюма, может быть такой же как та, которая использовалась для крупномасштабных культиваций или ферментаций, но может быть использована и другая среда.
Организмы могут быть выращены при температурах между 20oС и 30oС и интенсивности падающего излучения от около 100 до 200 мкмоль фотонов м-2 сек-1 (фотосинтетически активного излучения).
Как это является обычным в процессах аэробно погруженной культуры этого типа, газообразная двуокись углерода вводится в культуру путем добавления в стерильный воздушный поток, пробулькиваемый через культурную среду. Для эффективного получения криптофициновых соединений, количество двуокиси углерода должно составлять около 1% (при 24oС и давлении одна атмосфера).
Ранее известные приемы, в частности, патент США 4946835, обеспечивает способы культивирования Nostoc sp., содержание которого вводится здесь ссылкой.
Производство криптофицинового соединения может протекать в процессе культивирования испытываемыми образцами бульона по отношению к организмам, которые, как известно, являются чувствительными к этим антибиотикам. Одним из пригодных проверенных организмов является Candida albicans.
После их получения в аэробных условиях погруженной культуры, криптофициновые соединения изобретения могут быть выделены из культуры и из культурной среды способами, известными специалистам в этой области. Выделение обычно сопровождается первоначально фильтрованием культурной среды для отделения клеток водоросли и затем лиофильной сушкой выделенных клеток. Лиофильно высушенные водоросли могут быть подвергнуты экстрагированию подходящим растворителем, таким как этанол, метанол, изопропанол или дихлорметан. Криптофицины могут быть выделены за счет того, что этот экстракт, а также культурная среда подвергаются быстрому хроматографированию на колонке с обращенной фазой. Криптофицины могут быть очищены с помощью жидкостной гель-проникающей хроматографии с обращенной фазой (HPLC).
Как будет очевидно из структур криптофицинов, криптофициновые соединения содержат группы, которые являются способными к химической модификации. Исходное соединение настоящего изобретения рассматривает те криптофицины, которые обладают противоопухолевой активностью. Например, производные, приведенные в качестве примера в настоящем изобретении, включают соединения, содержащие эпоксидный кислород или гидроксильные группы на С-7 и С-8 звене А или группу лейциновой кислоты звена В фигуры 1. Такие производные новых и ранее описанных соединений, которые обладают желаемой противоопухолевой активностью, включаются в заявляемое изобретение. Кроме того, связь между структурой криптофициновых соединений и противоопухолевой активностью обеспечивается в экспериментальной части, приведенной ниже.
В то время как выбранные криптофициновые соединения, которые, как известно, являются метаболитами, продуцированными водорослями настоящего изобретения, другие криптофициновые соединения, например Криптофицины 8-15, могут быть получены из метаболитов с использованием опубликованных приемов, которые являются известными специалистам в этой области; например, синтезом, описанным в патентах США 4868208, 4845086 и 4845085, содержание которых вводится здесь ссылкой, или за счет использования других способов, известных специалистам в этой области. Кроме того, настоящее изобретение в экспериментальной части обеспечивает способы получения производных.
Криптофицины являются мощными противоопухолевыми и противогрибковыми депсипептидами из зелено-голубых водорослей (цианобактерий), принадлежащих к Nostocaceae. Первое криптофициновое соединение, Криптофицин 1, было выделено из живущего на земле Nostoc sp., АТСС 53789, и было найдено, что он является очень активным против грибов, особенно штамм Cryptococcus (R.E. Schwarz et al. , J.lnd.Microbiol. 1990, 5:113-124). Криптофицин 1 был также выделен из живущего на земле Nostoc sp. GSV 224, вместе с 24 дополнительными аналогами криптофицина в виде минимальных составляющих водоросли и было найдено, что оно является очень активным против подкожно-трансплантированных твердых опухолей у мышей (G.Trimurtulu et al., J.Am.Chem.Soc. 1994, 16:4729-4737; R. Borrow et al. , J.Am.Chem.Soc. 1995, 117:2479-2490). Два аналога из Nostoc sp. , GSV 224, Криптофицины 3 и 5, были описаны ранее в виде полусинтетических аналогов Криптофицина 1 (D.F.Sesin, патент США 4845085, опубликованный 4 июля 1989; D.F.Sesin et al., патент США 4868208, опубликованный 19 сентября 1989). Криптофицины проявляли значительную селективную цитотоксичность к опухоли в анализе Corbett и были в равной степени цитотоксичными по отношению к опухолевым клеткам, чувствительным к лекарству, и к опухолевым клетка с сопротивлением лекарству. Криптофицин 1 проявляет такую же форму действия как винбластин, но отличается от последнего лекарства в необратимости ингибирования микротрубочкового ансамбля (С.D.Smith et al., Cancer Res. 1994, 54:3779-3784). Один из криптофицинов из Nostoc sp., GSV 224, Криптофицин 24, был выделен из морской губки и назван ареностатином A (M.Kobayashi et al., Tetrahedron Lett. 1994, 35:7969-72; M.Kobayashi et al., Tennen Yuki Kagobutsu Toronkai Koen Yoshishu 1994, 36st, 104-110).
Двадцать два дополнительных криптофициновых соединения, обозначенных здесь Криптофицинами 2, 4, 6, 7, 16-19, 21, 23, 24, 26, 28-31, 40, 43, 45, 49, 50 и 54, раскрываются в патентной заявке N 08/172632, поданной 21 декабря 1993, и 08/249955, поданной 27 мая 1994, и Международной заявке N PCT/US94/14740, поданной 21 декабря 1994, такие соединения являются либо метаболитами, выделенными из штамма Nostoc sp., либо полученными полусинтетическим путем из таких метаболитов. Кроме того, раскрытое в этих патентных заявках является характеристикой выбранных криптофициновых соединений в качестве антимикротрубчатых агентов с активностью клинического типа, проявляемой в отношении широкого спектра опухолей, имплантированных мышам, включая DR и MDR опухоли.
Настоящее изобретение обеспечивает новые криптофициновые соединения, имеющие следующую структуру: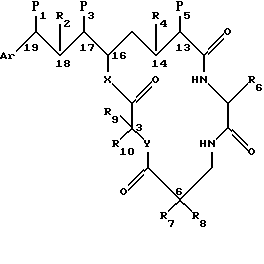
где Аr представляет метил, или фенил, или любую простую незамещенную, или замещенную ароматическую или гетероароматическую группу;
R1 представляет галоид, SH, амино, моноалкиламино, диалкиламино, триалкиламмоний, алкилтио, диалкилсульфоний, сульфат или фосфат;
R2 представляет ОН или SH; или
R1 и R2 могут объединяться вместе с образованием эпоксидного кольца, азиридинового кольца, эписульфидного кольца, сульфатного кольца или моноалкилфосфатного кольца; или
R1 и R2 могут объединяться вместе с образованием двойной связи между C18 и C19;
R3 представляет низшую алкильную группу;
R4 и R5 представляют Н; или
R4 и R5 могут объединяться вместе с образованием двойной связи между С13 и C14;
R6 представляет бензильную, оксибензильную, алкоксибензильную, галоидоксибензильную, дигалоидоксибензильную, галоидалкоксибензильную или дигалоидалкоксибензильную группу;
R7 , R8, R9 и R10 каждый независимо представляют Н или низшую алкильную группу; и
X и Y каждый независимо представляют О, NH или алкиламино.
В предпочтительном варианте этого криптофицинового соединения, R8 криптофицина представляет этил, пропил, изопропил, бутил, изобутил, пентил или изопентил. В другом предпочтительном варианте этого криптофицинового соединения R7 представляет этил, пропил, изопропил, бутил, изобутил, пентил или изопентил. В дополнительном предпочтительном варианте этого криптофицинового соединения R7 представляет Н, R8 представляет метил, R3 представляет метил; Х и Y не являются оба О.
Настоящее изобретение обеспечивает дополнительный предпочтительный вариант этого криптофицинового соединения, где R3 представляет этил, пропил, изопропил, бутил, изобутил, пентил или изопентил. В другом предпочтительном варианте этого криптофицинового соединения R9 представляет метил, этил, пропил, бутил, изобутил, пентил или изопентил. В другом предпочтительном варианте этого криптофицинового соединения R10 представляет метил, этил, пропил, бутил, изобутил, пентил или изопентил.
Изобретение далее обеспечивает криптофициновые соединения, где, по крайней мере, одна из групп, присоединенных к С3, С6, С10, C16, C17, и C18 обладает R-стериохимией. В другом варианте изобретения, по крайней мере, одна из групп, присоединенных к С3, С6, С10, C16, C17, и C18, обладает S-стериохимией.
Один вариант криптофицинового соединения настоящего изобретения представляет соединение, когда Аr представляет фенил, R1 и R2 объединяются вместе с образованием двойной связи между C18 и C19, R3, R7 и R8 представляют метил, R4 и R5 объединяются вместе с образованием двойной связи между C13 и С14, R6 представляет 3-хлор-4-метоксибензил, R9 представляет изобутил, R10 представляет водород, и Х и Y являются кислородом. Структура этого соединения, Криптофицина 51, является следующей: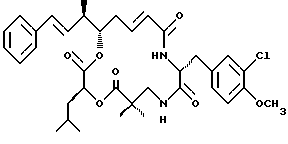
КРИПТОФИЦИН 51
Другой вариант соединения настоящего изобретения представляет соединение, когда Аr представляет фенил, R1 и R2 объединяются вместе с образованием R,R-эпоксидного кольца, R3, R7 и R8 представляют метил, R4 и R5 объединяются вместе с образованием двойной связи между C13 и С14, R6 представляет 3-хлор-4-метоксибензил, R9 представляет изобутил, R10 представляет водород, и Х и Y являются кислородом. Структура этого соединения, Криптофицина 52, является следующей: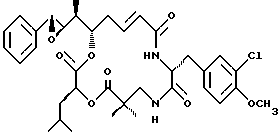
КРИФТОФИЦИН 52
Другой вариант соединения настоящего изобретения представляет соединение, когда Аr представляет фенил, R1 и R2 объединяются вместе с образованием S,S-эпоксидного кольца, R3, R7 и R8 представляют метил, R4 и R5 объединяются вместе с образованием двойной связи между C13 и С14, R6 представляет 3-хлор-4-метоксибензил, R9 представляет изобутил, R10 представляет водород, и Х и Y являются кислородом. Структура этого соединения, Криптофицина 53, является следующей: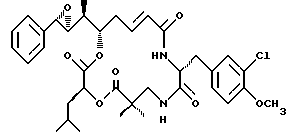
КРИПТОФИЦИН 53
Другой вариант соединения настоящего изобретения представляет соединение, когда Аr представляет фенил, R1 представляет S-хлор, R2 представляет R гидроксильную группу, R3, R7 и R8 представляют метил, R4 и R5 объединяются вместе с образованием двойной связи между C13 и С14, R6 представляет 3-хлор-4-метоксибензил, R9 представляет изобутил, R10 представляет водород, и Х и Y являются кислородом. Структура этого соединения, Криптофицина 55, является следующей: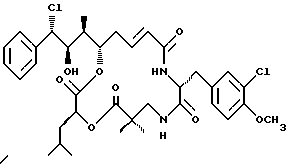
КРИПТОФИЦИН 55
Другой вариант соединения настоящего изобретения представляет соединение, когда Аr представляет фенил, R1 и R2 объединяются вместе с образованием R,R-эпоксидного кольца, R3, R7 и R8 представляют метил, R4 и R5 представляют водород, R6 представляет 3-хлор-4-метоксибензил, R9 представляет изобутил, R10 представляет водород, и Х и Y являются кислородом. Структура этого соединения, Криптофицина 57, является следующей: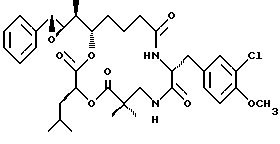
КРИПТОФИЦИН 57
Другой вариант соединения настоящего изобретения представляет соединение, когда Аr представляет фенил, R1 представляет S-хлор, R2 представляет R-гидроксильную группу, R3, R7 и R8 представляют метил, R4 и R5 представляют водород, R6 представляет 3-хлор-4-метоксибензил, R9 представляет изобутил, R10 представляет водород, и Х и Y являются кислородом. Структура этого соединения, Криптофицина 58, является следующей: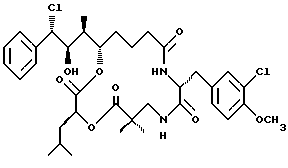
КРИПТОФИЦИН 58
Другой вариант соединения настоящего изобретения представляет соединение, когда Аr представляет фенил, R1 и R2 объединяются вместе с образованием R, R-эписульфидного кольца, R3, R7 и R8 представляют метил, R4 и R5 объединяются вместе с образованием двойной связи между C13 и С14, R6 представляет 3-хлор-4-метоксибензил, R9 представляет изобутил, R10 представляет водород, и Х и Y являются кислородом. Структура этого соединения, Криптофицина 61, является следующей: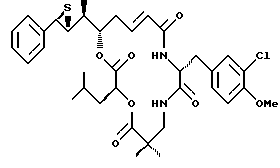
КРИПТОФИЦИН 61
Другой вариант соединения настоящего изобретения представляет соединение, когда Аr представляет п-метоксифенил, R1 и R2 объединяются вместе с образованием двойной связи между C18 и C19, R3 и R7 представляют метил, R4 и R5 объединяются вместе с образованием двойной связи между С13 и C14, R6 представляет 3-хлор-4-метоксибензил, R9 представляет изобутил, R10 представляет водород, и Х и Y являются кислородом. Структура этого соединения, Криптофицина 81, является следующей: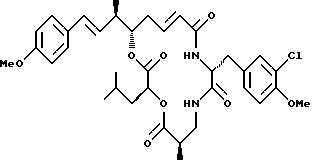
КРИПТОФИЦИН 81
Другой вариант соединения настоящего изобретения представляет соединение, когда Аr представляет метил, R1 и R2 объединяются вместе с образованием двойной связи между C18 и С19, R3 и R7 представляют метил, R4 и R5 объединяются вместе с образованием двойной связи между С13 и С14, R6 представляет 3-хлор-4-метоксибензил, R9 представляет изобутил, R10 представляет водород, и Х и Y являются кислородом. Структура этого соединения, Криптофицина 82, является следующей: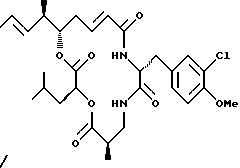
КРИПТОФИЦИН 82
Другой вариант соединения настоящего изобретения представляет соединение, когда Аr представляет метил, R1 и R2 объединяются вместе с образованием R, R-эпоксидного кольца, R3 и R7 представляют метил, R4 и R5 объединяются вместе с образованием двойной связи между C13 и С14, R6 представляет 3-хлор-4-метоксибензил, R9 представляет изобутил, R10 представляет водород, и Х и Y являются кислородом. Структура этого соединения, Криптофицина 90, является следующей: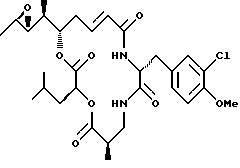
КРИПТОФИЦИН 90
Другой вариант соединения настоящего изобретения представляет соединение, когда Аr представляет метил, R1 и R2 объединяются вместе с образованием S, S-эпоксидного кольца, R3 и R7 представляют метил, R4 и R5 объединяются вместе с образованием двойной связи между C13 и С14, R6 представляет 3-хлор-4-метоксибензил, R9 представляет изобутил, R8 и R10 представляют водород, и X и Y являются кислородом. Структура этого соединения, Криптофицина 91, является следующей: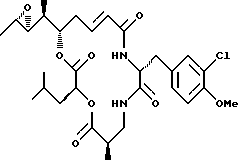
КРИПТОФИЦИН 91
Другой вариант соединения настоящего изобретения представляет соединение, когда Аr представляет фенил, R1 и R2 объединяются вместе с образованием R, R-азиридинового кольца, R3, R7 и R8 представляют метил, R4 и R5 объединяются вместе с образованием двойной связи между C13 и С14, R6 представляет 3-хлор-4-метоксибензил, R9 представляет изобутил, R10 представляет водород, и Х и Y являются кислородом. Структура этого соединения, Криптофицина 97, является следующей:
КРИПТОФИЦИН 97
Другой вариант соединения настоящего изобретения представляет соединение, когда Аr представляет п-фторфенил, R1 и R2 объединяются вместе с образованием двойной связи между C18 и C19, R3 и R7 представляют метил, R4 и R5 объединяются вместе с образованием двойной связи между С13 и С14, R6 представляет 3-хлор-4-метоксибензил, R9 представляет изобутил, R8 и R10 представляют водород, и Х и Y являются кислородом. Структура этого соединения, Криптофицина 110, является следующей: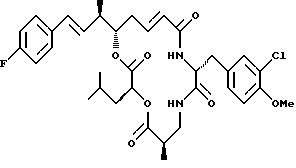
КРИПТОФИЦИН 110
Другой вариант соединения настоящего изобретения представляет соединение, когда Аr представляет п-толил, R1 и R2 объединяются вместе с образованием двойной связи между С18 и C19, R3 и R7 представляют метил, R4 и R5 объединяются вместе с образованием двойной связи между С13 и С14, R6 представляет 3-хлор-4-метоксибензил, R9 представляет изобутил, R8 и R10 представляют водород, и Х и Y являются кислородом. Структура этого соединения, Криптофицина 111, является следующей: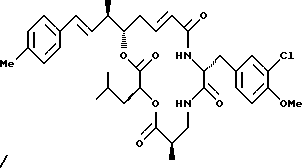
КРИПТОФИЦИН 111
Другой вариант соединения настоящего изобретения представляет соединение, когда Аr представляет 2-тиенил, R1 и R2 объединяются вместе с образованием двойной связи между C18 и C19, R3 и R7 представляют метил, R4 и R5 объединяются вместе с образованием двойной связи между C13 и С14, R6 представляет 3-хлор-4-метоксибензил, R9 представляет изобутил, R8 и R10 представляют водород, и Х и Y являются кислородом. Структура этого соединения, Криптофицина 112, является следующей: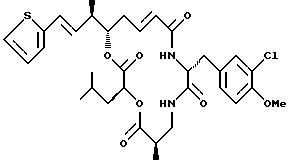
КРИПТОФИЦИН 112
Другой вариант соединения настоящего изобретения представляет соединение, когда Аr представляет п-фторфенил, R1 и R2 объединяются вместе с образованием R,R-эпоксидного кольца, R3 и R7 представляют метил, R4 и R5 объединяются вместе с образованием двойной связи между C13 и С14, R6 представляет 3-хлор-4-метоксибензил, R9 представляет изобутил, R8 и R10 представляют водород, и Х и Y являются кислородом. Структура этого соединения, Криптофицина 115, является следующей: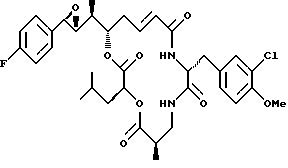
КРИПТОФИЦИН 115
Другой вариант соединения настоящего изобретения представляет соединение, когда Аr представляет п-фторфенил, R1 и R2 объединяются вместе с образованием S,S-эпоксидного кольца, R3 и R7 представляют метил, R4 и R5 объединяются вместе с образованием двойной связи между С13 и С14, R6 представляет 3-хлор-4-метоксибензил, R9 представляет изобутил, R8 и R10 представляют водород, и Х и Y являются кислородом. Структура этого соединения, Криптофицина 116, является следующей: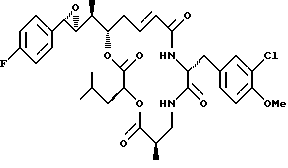
КРИПТОФИЦИН 116
Другой вариант соединения настоящего изобретения представляет соединение, когда Аr представляет п-толил, R1 и R2 объединяются вместе с образованием R, R-эпоксидного кольца, R3 и R7 представляют метил, R4 и R5 объединяются вместе с образованием двойной связи между C13 и C14, R6 представляет 3-хлор-4-метоксибензил, R9 представляет изобутил, R8 и R10 представляют водород, и Х и Y являются кислородом. Структура этого соединения, Криптофицина 117, является следующей: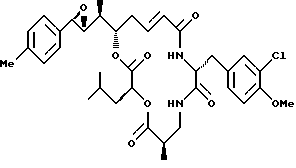
КРИПТОФИЦИН 117
Другой вариант соединения настоящего изобретения представляет соединение, когда Аr представляет п-толил, R1 и R2 объединяются вместе с образованием S, S-эпоксидного кольца, R3 и R7 представляют метил, R4 и R5 объединяются вместе с образованием двойной связи между С13 и C14, R6 представляет 3-хлор-4-метоксибензил, R9 представляет изобутил, R8 и R10 представляют водород, и Х и Y являются кислородом. Структура этого соединения, Криптофицина 118, является следующей: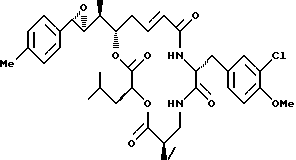
КРИПТОФИЦИН 118
Другой вариант соединения настоящего изобретения представляет соединение, когда Аr представляет 2-тиенил, R1 и R2 объединяются вместе с образованием R, R-эпоксидного кольца, R3 и R7 представляют метил, R4 и R5 объединяются вместе с образованием двойной связи между C13 и С14, R6 представляет 3-хлор-4-метоксибензил, R9 представляет изобутил, R8 и R10 представляют водород, и Х и Y являются кислородом. Структура этого соединения, Криптофицина 119, является следующей: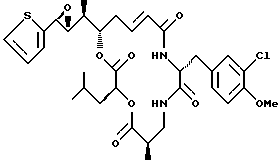
КРИПТОФИЦИН 119
Другой вариант соединения настоящего изобретения представляет соединение, когда Аr представляет 2-тиенил, R1 и R2 объединяются вместе с образованием S, S-эпоксидного кольца, R3 и R7 представляют метил, R4 и R5 объединяются вместе с образованием двойной связи между C13 и С14, R6 представляет 3-хлор-4-метоксибензил, R9 представляет изобутил, R8 и R10 представляют водород, и Х и Y являются кислородом. Структура этого соединения, Криптофицина 120, является следующей: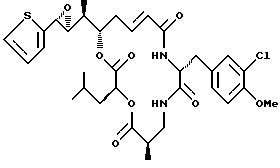
КРИПТОФИЦИН 120
Другой вариант соединения настоящего изобретения представляет соединение, когда Аr представляет фенил, R1 и R2 объединяются вместе с образованием двойной связи между C18 и C19, R3 и R7 представляют метил, R4 и R5 объединяются вместе с образованием двойной связи между С13 и C14, R6 представляет 3-хлор-4-метоксибензил, R9 представляет изобутил, R8 и R10 представляют водород, Х представляет кислород и Y представляет азот, несущий один водород. Структура этого соединения, Криптофицина 121, является следующей: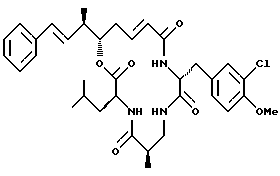
КРИПТОФИЦИН 121
Другой вариант соединения настоящего изобретения представляет соединение, когда Аr представляет фенил, R1 и R2 объединяются вместе с образованием R, R-эпоксидного кольца, R3 и R7 представляют метил, R4 и R5 объединяются вместе с образованием двойной связи между С13 и С14, R6 представляет 3-хлор-4-метоксибензил, R9 представляет изобутил, R8 и R10 представляют водород, Х представляет кислород и Y представляет азот, несущий один водород. Структура этого соединения, Криптофицина 122, является следующей: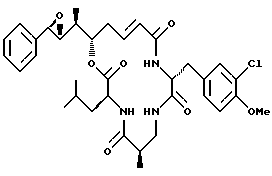
КРИПТОФИЦИН 122
Другой вариант соединения настоящего изобретения представляет соединение, когда Аr представляет фенил, R1 и R2 объединяются вместе с образованием S, S-эпоксидного кольца, R3 и R7 представляют метил, R4 и R5 объединяются вместе с образованием двойной связи между C13 и С14, R6 представляет 3-хлор-4-метоксибензил, R9 представляет изобутил, R8 и R10 представляют водород, Х представляет кислород и Y представляет азот, несущий один водород. Структура этого соединения, Криптофицина 123, является следующей: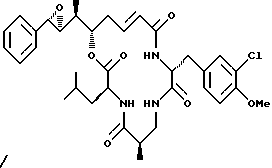
КРИПТОФИЦИН 123
Другой вариант соединения настоящего изобретения представляет соединение, когда Аr представляет п-хлорфенил, R1 и R2 объединяются вместе с образованием двойной связи между C18 и C19, R3 и R7 представляют метил, R4 и R5 объединяются вместе с образованием двойной связи между С13 и С14, R6 представляет 3-хлор-4-метоксибензил, R9 представляет изобутил, R8 и R10 представляют водород, и Х и Y представляют кислород. Структура этого соединения, Криптофицина 124, является следующей: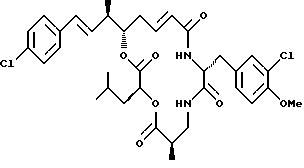
КРИПТОФИЦИН 124
Другой вариант соединения настоящего изобретения представляет соединение, когда Аr представляет п-хлорфенил, R1 и R2 объединяются вместе с образованием R,R-эпоксидного кольца, R3 и R7 представляют метил, R4 и R5 объединяются вместе с образованием двойной связи между C13 и С14, R6 представляет 3-хлор-4-метоксибензил, R9 представляет изобутил, R8 и R10 представляют водород, и Х и Y представляют кислород. Структура этого соединения, Криптофицина 125, является следующей: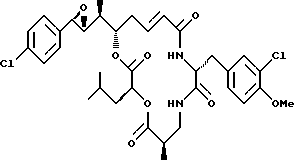
КРИПТОФИЦИН 125
Другой вариант соединения настоящего изобретения представляет соединение, когда Аr представляет п-хлорфенил, R1 и R2 объединяются вместе с образованием S,S-эпоксидного кольца, R3 и R7 представляют метил, R4 и R5 образованием S, S-эпоксидного кольца, R3 и R7 представляют метил, R4 и R5 объединяются вместе с образованием двойной связи между C13 и С14, R6 представляет 3-хлор-4-метоксибензил, R9 представляет изобутил, R8 и R10 представляют водород, и Х и Y представляют кислород. Структура этого соединения, Криптофицина 126, является следующей: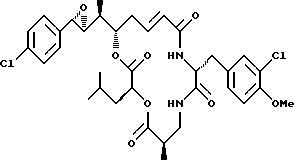
КРИПТОФИЦИН 126
Другой вариант соединения настоящего изобретения представляет соединение, когда Аr представляет фенил, R1 представляет S-хлор, R2 представляет R-гидроксильную группу, R3 и R7 представляют метил, R4 и R5 объединяются вместе с образованием двойной связи между С13 и С14, R6 представляет 3-хлор-4-метоксибензил, R9 представляет изобутил, R8 и R10 представляют водород, Х представляет кислород и Y представляет азот несущий единичный водород. Структура этого соединения, Криптофицина 127, является следующей: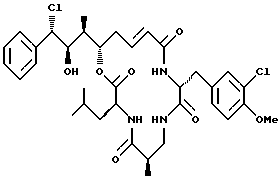
КРИПТОФИЦИН 127
Другой вариант соединения настоящего изобретения представляет соединение, когда Аr представляет фенил, R1 представляет S-хлор, R2 представляет R-гидроксильную группу, R3 и R7 представляют метил, R4 и R5 объединяются вместе с образованием двойной связи между C13 и С14, R6 представляет 3-хлор-4-метоксибензил, R9 представляет изобутил, R8 и R10 представляют водород, Х представляет кислород и Y представляет азот несущий единичный водород. Структура этого соединения, Криптофицина 127, является следующей: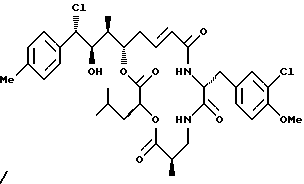
КРИПТОФИЦИН 128
Другой вариант соединения настоящего изобретения представляет соединение, когда Аr представляет п-толил, R1 представляет S-хлор, R2 представляет S-гидроксильную группу, R3 и R7 представляют метил, R4 и R5 объединяются вместе с образованием двойной связи между С13 и C14, R6 представляет 3-хлор-4-метоксибензил, R9 представляет изобутил, R8 и R10 представляют водород, и Х и Y представляют кислород. Структура этого соединения, Криптофицина 130, является следующей: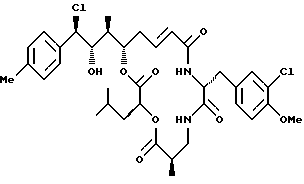
КРИПТОФИЦИН 130
Другой вариант соединения настоящего изобретения представляет соединение, когда Аr представляет п-толил, R1 представляет R-хлор, R2 представляет R-гидроксильную группу, R3 и R7 представляют метил, R4 и R5 объединяются вместе с образованием двойной связи между C13 и С14, R6 представляет 3-хлор-4-метоксибензил, R9 представляет изобутил, R8 и R10 представляют водород, и Х и Y представляют кислород. Структура этого соединения, Криптофицина 131, является следующей: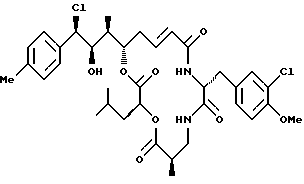
КРИПТОФИЦИН 131
Другой вариант соединения настоящего изобретения представляет соединение, когда Аr представляет п-хлорфенил, R1 представляет S-хлор, R2 представляет R-гидроксильную группу, R3 и R7 представляют метил, R4 и R5 объединяются вместе с образованием двойной связи между С13 и С14, R6 представляет 3-хлор-4-метоксибензил, R9 представляет изобутил, R8 и R10 представляют водород, и Х и Y представляют кислород. Структура этого соединения, Криптофицина 132, является следующей: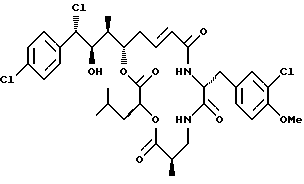
КРИПТОФИЦИН 132
Другой вариант соединения настоящего изобретения представляет соединение, когда Аr представляет п-хлорфенил, R1 представляет R-хлор, R2 представляет S-гидроксильную группу, R3 и R7 представляют метил, R4 и R5 объединяются вместе с образованием двойной связи между C13 и С14, R6 представляет 3-хлор-4-метоксибензил, R9 представляет изобутил, R8 и R10
представляют водород, и X и Y представляют кислород. Структура этого соединения, Криптофицина 133, является следующей: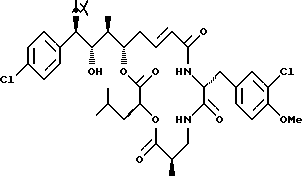
КРИПТОФИЦИН 133
Другой вариант соединения настоящего изобретения представляет соединение, когда Аr представляет п-хлорфенил, R1 представляет R-хлор, R2 представляет R-гидроксильную группу, R3 и R7 представляют метил, R4 и R5 объединяются вместе с образованием двойной связи между C13 и С14, R6 представляет 3-хлор-4-метоксибензил, R9 представляет изобутил, R8 и R10 представляют водород, и Х и Y представляют кислород. Структура этого соединения, Криптофицина 134, является следующей: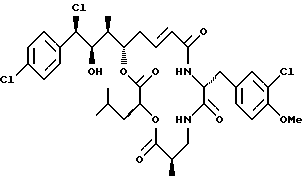
КРИПТОФИЦИН 134
Впредь набор, приведенный ниже представляет криптофициновые соединения, чьи замещающие группы основаны на следующей структуре: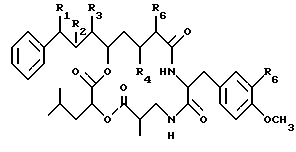
где R1 представляет Н или галоид;
R2 представляет Н кислород котонной группы; или
R1 и R2 могут объединяться вместе с образованием эпоксидного кольца, или R1 и R2 могут объединяться вместе с образованием эписульфидного кольца;
R3 представляет Н или низшую алкильную группу;
R4 и R5 представляют Н; или
R4 представляет Н или ОН;
R5 представляет Н или ОН; или
R4 и R5 могут объединяться вместе с образованием двойной связи;
R6 представляет Н или галоид;
При следующем условии,
если R1 и R2 объединяются вместе с образованием эпоксидного кольца, R4 и R5 объединяются вместе с образованием двойной связи и R6 представляет хлор, R3 не является метилом.
R7, R8, R9 и R10 каждый независимо представляют Н или низшую алкильную группу; и
Х и Y каждый независимо представляют О, NH или алкиламино.
Вариант криптофицинового соединения настоящего изобретения представляет соединение, когда R1 представляет водород, R2 представляет кислород кетонной группы, R3 представляет S-метил, R4 и R5 объединяются вместе с образованием двойной связи и R6 представляет хлор. Структура этого соединения, Криптофицина 20, является следующей: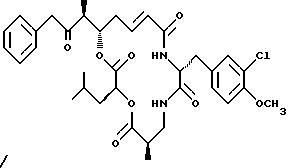
КРИПТОФИЦИН 20
Другой вариант соединения настоящего изобретения представляет соединение, когда R1 представляет S-бром, R2 представляет R гидроксильную группу, R3 представляет S-метил, R4 и R5 объединяются вместе с образованием двойной связи и R6 представляет хлор. Структура этого соединения, Криптофицина 25, является следующей: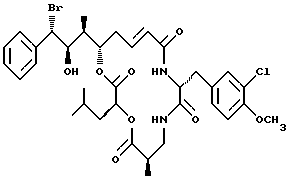
КРИПТОФИЦИН 25
Другой вариант соединения настоящего изобретения представляет соединение, когда R1 представляет R-бром, R2 представляет R-гидроксильную группу, R3 представляет S-метил, R4 и R5 объединяются вместе с образованием двойной связи и R6 представляет хлор. Структура этого соединения, Криптофицина 27, является следующей:
КРИПТОФИЦИН 27
Другой вариант соединения настоящего изобретения представляет соединение, когда R1 и R2 объединяются вместе с образованием R,R-эпоксидного кольца, R3 представляет S-метил, R4 и R5 являются водородом и R6 представляет хлор. Структура этого соединения, Криптофицина 32, является следующей: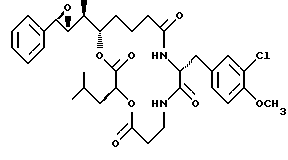
КРИПТОФИЦИН 32
Другой вариант соединения настоящего изобретения представляет соединение, когда R1, R4 и R5 являются водородом, R2 представляет S-гидроксильную группу, R3 представляет R-метил, и R6 представляет хлор. Структура этого соединения, Криптофицина 33, является следующей: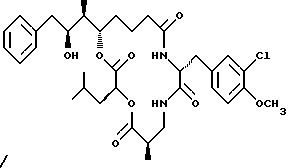
КРИПТОФИЦИН 33
Другой вариант соединения настоящего изобретения представляет соединение, когда R1, R2, R4 и R5 являются водородом, R3 представляет R-метил, и R6 представляет водород. Структура этого соединения, Криптофицина 34, является следующей: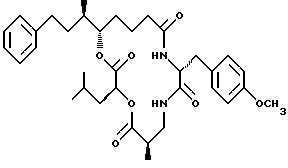
КРИПТОФИЦИН 34
Другой вариант соединения настоящего изобретения представляет соединение, когда R1 представляет R-бром, R2, представляет R-гидроксильную группу, R3 представляет S-метил, R4 и R5 объединяются вместе с образованием двойной связи, и R6 представляет хлор. Структура этого соединения, Криптофицина 37, является следующей: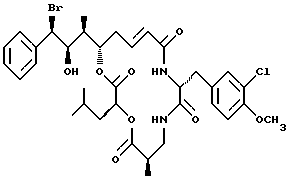
КРИПТОФИЦИН 37
Другой вариант соединения настоящего изобретения представляет соединение, когда R1 и R2 объединяются вместе с образованием S,S-эпоксидного кольца, R3 представляет S-метил, R4 и R5 объединяются вместе с образованием двойной связи, и R6 представляет хлор. Структура этого соединения, Криптофицина 38, является следующей: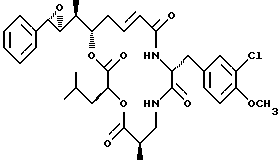
КРИПТОФИЦИН 38
Другой вариант соединения настоящего изобретения представляет соединение, когда R1 и R2 объединяются вместе с образованием S,R-эпоксидного кольца, R3 представляет S-метил, R4 и R5 объединяются вместе с образованием двойной связи, и R6 представляет хлор. Структура этого соединения, Криптофицина 39, является следующей: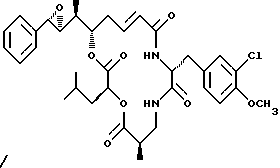
КРИПТОФИЦИН 39
Другой вариант соединения настоящего изобретения представляет соединение, когда R1 и R2 объединяются вместе с образованием R,R-эпоксидного кольца, R3 представляет S-метил, R4 представляет S-гидроксильную группу и R5 представляет R-гидроксильную группу и R6 представляет хлор. Структура этого соединения, Криптофицина 41, является следующей: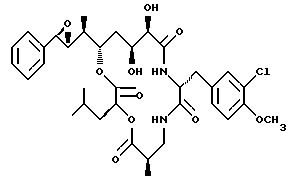
КРИПТОФИЦИН 41
Другой вариант соединения настоящего изобретения представляет соединение, когда R1 и R2 объединяются вместе с образованием R,R-эпоксидного кольца, R3 представляет S-метил, R4 представляет R-гидроксильную группу и R5 представляет S-гидроксильную группу и R6 представляет хлор. Структура этого соединения, Криптофицина 42, является следующей: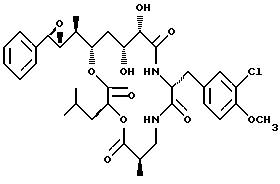
КРИПТОФИЦИН 42
Другой вариант соединения настоящего изобретения представляет соединение, когда R1 представляет водород, R2 представляет S-гидроксильную группу, R3 представляет R-метил, R4 и R5 объединяются вместе с образованием двойной связи и R6 представляет хлор. Структура этого соединения, Криптофицина 48, является следующей: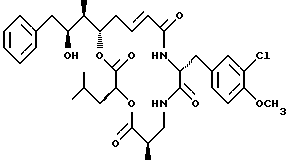
КРИПТОФИЦИН 48
Другой вариант соединения настоящего изобретения представляет соединение, когда R1 представляет S-хлор, R2 представляет R-гидроксильную группу, R3 представляет S-метил, R4 и R5 представляют водород и R6 представляет хлор. Структура этого соединения, Криптофицина 59, является следующей: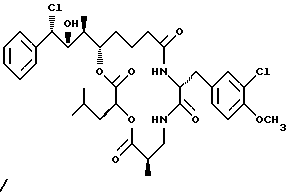
КРИПТОФИЦИН 59
Другой вариант соединения настоящего изобретения представляет соединение, когда R1 и R2 объединяются вместе с образованием S,S-эписульфидного кольца, R3 представляет S-метил, R4 и R5 объединяются вместе с образованием двойной связи и R6 представляет хлор. Структура этого соединения, Криптофицина 60, является следующей: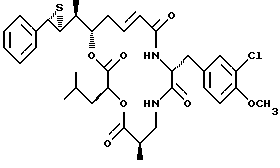
КРИПТОФИЦИН 60
Другой вариант соединения настоящего изобретения представляет соединение, когда R1 представляет S-хлор, R2 представляет R-гидроксильную группу, R3 представляет водород, R4 и R5 объединяются вместе с образованием двойной связи и R1 представляет хлор. Структура этого соединения, Криптофицина 63, является следующей: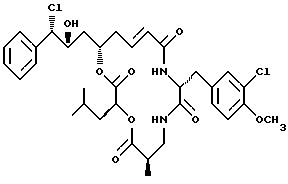
КРИПТОФИЦИН 63
Другой вариант соединения настоящего изобретения представляет соединение, когда R1 представляет R-хлор, R2 представляет R-гидроксильную группу, R3 представляет S-метил, R4 и R5 представляют водород и R6 представляет хлор. Структура этого соединения, Криптофицина 64, является следующей: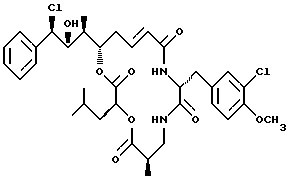
КРИПТОФИЦИН 64
Другой вариант соединения настоящего изобретения представляет соединение, когда R1 представляет R-хлор, R2 представляет S-гидроксильную группу, R3 представляет S-метил, R4 и R5 объединяются вместе с образованием двойной связи и R6 представляет хлор. Структура этого соединения, Криптофицина 69, является следующей:
КРИПТОФИЦИН 69
Другой вариант соединения настоящего изобретения представляет соединение, когда R1 представляет S-хлор, R2 представляет S-гидроксильную группу, R3 представляет S-метил, R4 и R5 объединяются вместе с образованием двойной связи и R6 представляет хлор. Структура этого соединения, Криптофицина 70, является следующей: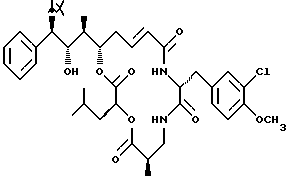
КРИПТОФИЦИН 70
Другой вариант соединения настоящего изобретения представляет соединение, когда R1 представляет R-бром, R2 представляет S-гидроксильную группу, R3 представляет S-метил, R4 и R5 объединяются вместе с образованием двойной связи и R6 представляет хлор. Структура этого соединения, Криптофицина 71, является следующей: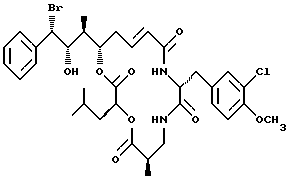
КРИПТОФИЦИН 71
Другой вариант соединения настоящего изобретения представляет соединение, когда R1 представляет S-бром, R2 представляет S-гидроксильную группу, R3 представляет S-метил, R4 и R5 объединяются вместе с образованием двойной связи и R6 представляет хлор. Структура этого соединения, Криптофицина 72, является следующей: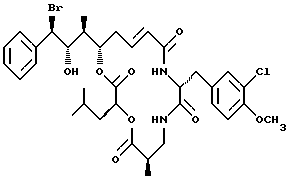
КРИПТОФИЦИН 72
Другой вариант соединения настоящего изобретения представляет соединение, когда R1 представляет S-хлор, R2 представляет S-гидроксильную группу, R3 представляет S-метил, R4 и R5 объединяются вместе с образованием двойной связи и R6 представляет хлор. Структура этого соединения, Криптофицина 73, является следующей: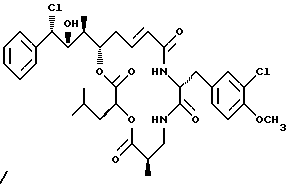
КРИПТОФИЦИН 73
Другой вариант соединения настоящего изобретения представляет соединение, когда R1 представляет S-хлор, R2 представляет R-гидроксильную группу, R3 представляет S-метил, R4 и R5 объединяются вместе с образованием двойной связи и R6 представляет водород. Структура этого соединения, Криптофицина 74, является следующей: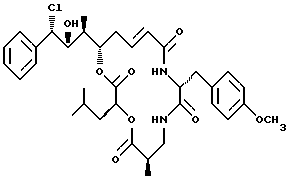
КРИПТОФИЦИН 74
Другой вариант соединения настоящего изобретения представляет соединение, когда R1 представляет S-фтор, R2 представляет R-гидроксильную группу, R3 представляет S-метил, R4 и R5 объединяются вместе с образованием двойной связи и R6 представляет хлор. Структура этого соединения, Криптофицина 75, является следующей: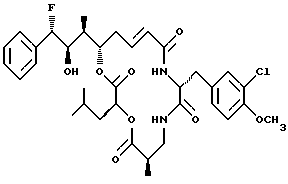
КРИПТОФИЦИН 75
Другой вариант соединения настоящего изобретения представляет соединение, когда R1 представляет R-фтор, R2 представляет R-гидроксильную группу, R3 представляет S-метил, R4 и R5 объединяются вместе с образованием двойной связи и R6 - представляет хлор. Структура этого соединения, Криптофицина 76, является следующей: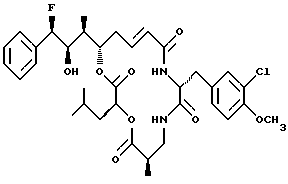
КРИПТОФИЦИН 76
Настоящее изобретение обеспечивает способы получения приведенных выше криптофициновых соединений, а также ранее известных криптофицинов посредством полного синтеза.
Изобретение далее обеспечивает то обстоятельство, что новые криптофициновые метаболиты, а также ранее описанные криптофициновые метаболиты могут быть синтезированы с использованием способов, обеспеченных в этом изобретении.
Настоящее изобретение обеспечивает способ получения криптофицинового соединения, включающего селективный аллильнозамещенный Е алкен; перегруппировку аллильно замещенного Е алкена через стереоспецифическую перегруппировку Виттига; превращение этого соединения в первую δ-аминокислоту или δ-оксикислоту, сочетание первой кислоты со второй α-аминокислотой с образованием первой субединицы; сочетание третьей β-аминокислоты с четвертой α-оксикислотой или 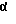 -аминокислотой с образованием второй субединицы; и сочетание первой субединицы со второй субединицей с образованием криптофицина.
-аминокислотой с образованием второй субединицы; и сочетание первой субединицы со второй субединицей с образованием криптофицина.
Настоящее изобретение далее обеспечивает предпочтительный вариант способа, где полученное криптофициновое соединение имеет следующую структуру: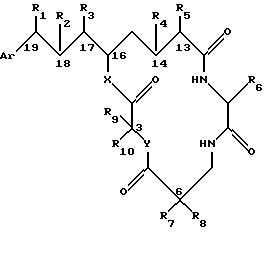
где Аr представляет метил или фенил или любую простую незамещенную или замещенную ароматическую или гетероароматическую группу;
R1 представляет галоид, SH, амино, моноалкиламино, диалкиламино, триалкиламмоний, алкилтио, диалкилсульфоний, сульфат или фосфат;
R2 представляет ОН или SH; или
R1 и R2 могут объединяться вместе с образованием эпоксидного кольца, азиридинового кольца, эписульфидного кольца, сульфатного кольца или моноалкилфосфатного кольца; или
R1 и R2 могут объединяться вместе с образованием двойной связи между C18 и C19;
R3 представляет низшую алкильную группу;
R4 и R5 представляют Н; или
R4 и R5 могут объединяться вместе с образованием двойной связи между С13 и С14;
R6 представляет бензильную, оксибензильную, алкоксибензильную, галоидоксибензильную, дигалоидоксибензильную, галоидалкоксибензильную или дигалоидалкоксибензильную группу;
R7, R8, R9 и R10 каждый независимо представляют Н или низшую алкильную группу; и
Х и Y каждый независимо представляют О, NH или алкиламино.
В предпочтительном варианте настоящего изобретения, способ дает криптофициновое соединение, где Аr представляет фенил, R3 представляет метил и R6 представляет галоидметоксибензил, R7 представляет Н; R8 представляет метил; R9 представляет изобутил; R10 представляет Н; Х представляет О; и Y представляет О.
Кроме того, что настоящее изобретение обеспечивает криптофициновые соединения с приведенной выше структурой, настоящее изобретение обеспечивает способы получения ранее раскрытых криптофициновых соединений и известных в литераторе криптофициновых соединений. Криптофициновые соединения 1, 8 и 35 были получены с помощью полного синтеза. Приведенное здесь ниже соединение является примером ранее раскрытых и известных ранее в литераторе криптофициновых соединений, полученных путем полного синтеза: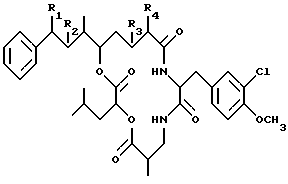
где R1 представляет галоид; R2 представляет ОН; или
R1 и R2 могут объединяться вместе с образованием эпоксидного кольца;
R3 представляет Н; и R4 представляют Н; или
R3 и R4 могут объединяться вместе с образованием двойной связи.
Настоящее изобретение обеспечивает также фармацевтическую композицию, полезную для ингибирования пролиферации гиперпролиферативной клетки млекопитающего, включающую эффективное количество криптофицинового соединения со следующей структурой: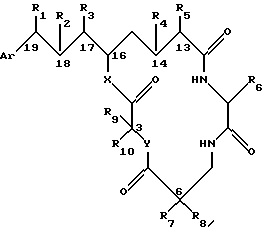
где Аr представляет метил или фенил или любую простую незамещенную или замещенную ароматическую или гетероароматическую группу;
R1 представляет галоид, SH, амино, моноалкиламино, диалкиламино, триалкиламмоний, алкилтио, диалкилсульфоний, сульфат или фосфат;
R2 представляет ОН или SH; или
R1 и R2 могут объединяться вместе с образованием эпоксидного кольца, азиридинового кольца, эписульфидного кольца, сульфатного кольца или моноалкилфосфатного кольца; или
R1 и R1 могут объединяться вместе с образованием двойной связи между C18 и C19;
R3 представляет низшую алкильную группу;
R4 и R5 представляют Н; или
R4 и R5 могут объединяться вместе с образованием двойной связи между C13 и C14;
R6 представляет бензильную, оксибензильную, алкоксибензильную, галоидоксибензильную, дигалоидоксибензильную, галоидалкоксибензильную или дигалоидалкоксибензильную группу;
R7, R8, R9 и R10 каждый независимо представляют Н или низшую алкильную группу; и
Х и Y каждый независимо представляют О, NH или алкиламино;
вместе с фармацевтически приемлемым носителем.
В предпочтительном варианте настоящего изобретения фармацевтическая композиция далее включает, по крайней мере, один дополнительный противоопухолевый агент.
Настоящее изобретение обеспечивает также способ ингибирования пролиферации клетки млекопитающего, включающий контактирование клетки млекопитающего с криптофициновым соединением в количестве, достаточном для ингибирования пролиферации клетки, криптофицинового соединения, имеющего следующую структуру: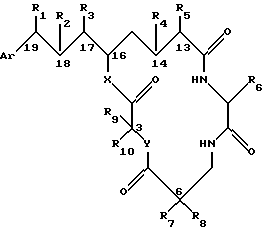
где Аr представляет метил, или фенил, или любую простую незамещенную или замещенную ароматическую или гетероароматическую группу;
R1 представляет галоид, SH, амино, моноалкиламино, диалкиламино, триалкиламмоний, алкилтио, диалкилсульфоний, сульфат или фосфат;
R2 представляет ОН или SH; или
R1 и R2 могут объединяться вместе с образованием эпоксидного кольца, азиридинового кольца, эписульфидного кольца, сульфатного кольца или моноалкилфосфатного кольца; или
R1 и R2 могут объединяться вместе с образованием двойной связи между С18 и C19,
R3 представляет низшую алкильную группу;
R4 и R5 представляют Н; или
R4 и R5 могут объединяться вместе с образованием двойной связи между С13 и C14;
R6 представляет бензильную, оксибензильную, алкоксибензильную, галоидоксибензильную, дигалоидоксибензильную, галоидалкоксибензильную или дигалоидалкоксибензильную группу;
R7, R8, R9 и R10 каждый независимо представляют Н или низшую алкильную группу; и
Х и Y каждый независимо представляют О, NH или алкиламино.
В предпочтительном варианте настоящего изобретения этот способ далее включает контактирование клетки с, по крайней мере, одним дополнительным противоопухолевым агентом. В предпочтительном варианте настоящего изобретения клетка млекопитающего, которая подвергается контактированию, является гиперпролиферативной. В другом предпочтительном варианте настоящего изобретения гиперпролиферативная клетка является человеческой.
Настоящее изобретение обеспечивает также способ ингибирования пролиферации гиперпролиферативной клетки млекопитающего, имеющей множество фенотипов сопротивления лекарству, способ, включающий контактирование клетки с количеством криптофицинового соединения, эффективным для нарушения динамического состояния микротрубочковой полимеризации и деполимеризации, для задержки клеточного митоза, тем самым ингибируя пролиферацию клетки, криптофицинового соединения, имеющего следующую структуру: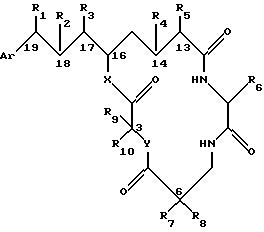
где Ar представляет метил, или фенил, или любую простую незамещенную или замещенную ароматическую или гетероароматическую группу;
R1 представляет галоид, SH, амино, моноалкиламино, диалкиламино, триалкиламмоний, алкилтио, диалкилсульфоний, сульфат или фосфат;
R2 представляет ОН или SH; или
R1 и R2 могут объединяться вместе с образованием эпоксидного кольца, азиридинового кольца, эписульфидного кольца, сульфатного кольца или моноалкилфосфатного кольца; или
R1 и R2 могут объединяться вместе с образованием двойной связи между С18 и C19;
R3 представляет низшую алкильную группу;
R4 и R5 представляют Н; или
R4 и R5 могут объединяться вместе с образованием двойной связи между C13 и С14;
R6 представляет бензильную, оксибензильную, алкоксибензильную, галоидоксибензильную, дигалоидоксибензильную, галоидалкоксибензильную или дигалоидалкоксибензильную группу;
R7, R8, R9 и R10 каждый независимо представляют Н или низшую алкильную группу; и
Х и Y каждый независимо представляют О, NH или алкиламино.
В предпочтительном варианте настоящего изобретения способ далее включает контактирование клетки с, по крайней мере, одним дополнительным противоопухолевым агентом. В другом предпочтительном варианте настоящего изобретения клетка млекопитающего является человеческой.
Настоящее изобретение обеспечивает также способ смягчения патологического состояния, вызванного гиперпролиферирующими клетками млекопитающего, способ, включающий введение субъекту эффективного количества фармацевтической композиции, раскрытой здесь, для ингибирования пролиферации клеток. В предпочтительном варианте настоящего изобретения клетки млекопитающего являются человеческими.
В предпочтительном варианте настоящего изобретения, способ далее включает проведение субъекту, по крайней мере, одной дополнительной терапии, направленной на смягчение патологического состояния. В предпочтительном варианте настоящего изобретения патологическое состояние характеризуется образованием опухолей. В другом предпочтительном варианте настоящего изобретения опухоли выбираются из группы, состоящей из молочной железы, малокамерного легкого, немалокамерного легкого, калоректальной лейкемии, меланомы, панкреатической аденокарциномы, центральной нервной системы (CNS), яичниковой простаты, саркомы мягкой ткани или кости, головы и шеи, гастрита, который включает панкреатический гастрит и желудочный гастрит, желудка, миеломы, мочевого пузыря, ренальной нейроэндокринии, которая включает щитовидную железу и опухоли, не связанные с заболеванием Ходкинса, и опухоли, связанные с заболеванием Ходкинса.
Способ приготовления криптофициновых соединений суммируется в схеме 1, как отражено на фигуре 5. Исходное вещество представляет ЗЕ-алкен (а) замещенный в С-2 положение ХН группой в S-конфигурации, где Х представляет кислород или NH. L-аланин и L-молочная кислота служат в качестве недорогого источника исходного вещества а. Ключевой стадией в синтезе является стереселективная [2, 3] перегруппировка Виттига (D.J. - S.Tsai et al., J.Org. Chem. , 1984, 49:1842-1843; K.Mikami et al., Tetrahedron 1984, 25:2303-2308; N.Sayo et al., Chem. Lett., 1984, 259-262) пропаргилового эфира а (б) в (3R, 4R)-3-(ХН-замещенный)-4-алкилгепт-5(Е)-ен-1-ин (с), где Х представляет кислород или защищенный азот (например, трет-бутилдиметилсилиламино). Соединение с может быть затем превращено в δ-окси или аминокислотное звено А предшественника криптофицинового соединения, метил(5S,6R)-5-(ХР-замещенный)-6-алкил-8-арил-окта-2Е, 7Е-диеноат (d), где Р является пригодной защищающей группой, используя способы, известные специалистам в этой области.
Одной из стратегий синтеза криптофицинового соединения, которое составляется из δ-окси или аминокислотного звена А, α-аминокислотного звена В, β-аминокислотного звена С и α-окси или аминокислотного звена D, является создание узла макроцикла из двух предшественников, представляющих остатки криптофициновой молекулы, например, А-В предшественника (е), содержащего δ-окси или аминокислотное звено А и α-аминокислотное звено В и C-D предшественника (f), содержащего β-аминокислотное звено С и α-окси или аминокислотное звено D.
В способе, описанном здесь, криптофициновое соединение составляется из А-В и C-D предшественников в две стадии путем (1) соединения концевых звеньев А и D в А-В и C-D предшественниках с образованием циклического продукта.
В синтезе Криптофицина 51, описанном в экспериментальной части, эфирная связь образуется между δ-окси группой звена А в А-В остатке и группой карбоновой кислоты звена D в C-D фрагменте с образованием ациклического С-D-A-B интермедиата и затем амидная связь образуется между группой карбоновой кислоты звена В в А-В остатке и β-амино группой звена С в C-D остатке. Соединение К является предшественником А-В остатка, соединение Р является предшественником C-D остатка, и соединение R является ациклическим предшественником C-D-A-B Криптофицина 51. Соединения К и Р содержат защищающие группы на группе карбоновой кислоты звена В и β-амино группу звена С для ограничения сочетания с образованием эфира между звеньями А и D в стадии 1. Эти защищающие группы удаляются из C-D-A-B интермедиата таким образом, чтобы могло иметь место образование амида между звеньями В и С в стадии 2.
Синтез метил(5S,6R)-5-трет-бутилдиметилсилилокси-6-метил-8-фенил-окта-2Е, 7Е-диеноата (G), звена А предшественника Криптофицина 51 суммируется на схеме 2 (фигура 6). (S)транс-3-пентен-2-ол (А), исходное вещество было приготовлено с помощью ферментативного расщепления рацемического соединения. Реакция A с пропаргилхлоридом и основанием в условиях фазового переноса дает пропаргиловый эфир В с 86% выходом. Обработка В бутиллитием при -90oС приводит к спирту С с 71% выходом. Желаемое 3R,4R антисоединение С было продуктом, полученным только при перегруппировке Виттига. После защиты гидроксильной группы С в виде трет-бутилдиметилсилилового эфира (или трет-бутилдиметилсилилового эфира), гидроборирование тройной связи (Н.С. Brown, Organic Synthesis Via Boranes, Willey, 1975) приводит к альдегиду D с 73% выходом от С. Затем D было превращено в транс α, β-ненасыщенный эфир Е реакцией Хорнера-Эмонса с 90% выходом. Селективный озонолиз двойной связи С6-С7 в D дает альдегид F с 83% выходом. Наконец, реакция Виттига F с бензилтрифенилфосфонийхлоридом в присутствии бутиллития дает G с 80% выходом. Выход G от А составлял 26%.
Реакция сочетания звена А предшественника Q с D-3-(3-хлор-4-метоксифенил)аланином звена В с образованием А-В предшественника (К) суммируется на схеме 3 (фигура 7). Гидролиз группы метилового эфира в G гидроокисью лития в ацетоне дает карбоновую кислоту Н с 95% выходом. Сочетание Н с трихлорэтиловым эфиром I с образованием J может быть выполнено с 65% выходом за счет обработки раствора Н в N,N-диметилформамиде (ДМФА) небольшим избытком пентафторфенилдифенилфосфината (FDPP), эквимолярным количеством трифторацетатной соли I, с последующей обработкой 3 эквивалентами диизопропилэтиламина (DIEA) при 25oС (S. Chen et al., Tetrahedron Lett. 1991, 32:6711-6714). Фтордесилилирование J затем приводит к К с 95% выходом.
Защищенная аминокислота I была приготовлена из D-тирозина в пять стадий. Сначала, D-тирозин был прохлорирован сульфурилхлоридом в ледяной уксусной кислоте (R. Zeynek, Hoppe-Seyler's Z.f. Physiol. Chemie 1926, 144:247-254). Затем N-(тpeт-бyтoкcикapбoнил)-3-(3-xлop-4-гидpoкcифeнил)-D-aлaнин был получен с 94% выходом за счет обработки суспензии аминокислоты в 50% водном растворе диоксана дитрет-бутилдикарбонатом в присутствии триэтиламина. Полученный продукт был деметилирован диметилсульфатом в присутствии карбоната калия кипячением с обратным холодильником в ацетоне с 84% выходом. Затем метиловый эфир был омылен гидроокисью натрия в водном растворе диоксана с образованием N-(трет-бутоксикарбонил)-3-(3-хлор-4-метоксифенил)-D-аланина с 86% выходом. Выдерживание ВОС-защищенной аминокислоты с трихлорэтанолом, пиридином и DDC в дихлорметане приводит к трихлорэтиловому эфиру I с 65% выходом. Обработка этого вещества трифторуксусной кислотой (ТФУК) приводит к количественному выходу трифторацетатной соли I.
Синтез (2S)-2-[3'(трет-бутоксикарбонил)амино-2',2'-диметилпропаноилокси] -4-метилпентановой кислоты (Р), C-D предшественника, суммируется на схеме 4 (фигура 8). Исходной точкой для звена С части Р был аминоспирт L. Защита амино группы в L за счет обработки ди-трет-бутилкарбонатом в присутствии триэтиламина (с 93% выходом), с последующим окислением первичного спирта четырехокисью рения (P.H.J, Cerlsen et al., J.Org.Chem. 1981, 46: 3936-3938) дает карбоновую кислоту М (с 66% выходом). L-лейциновая кислота была превращена в аллиловый эфир N с 93% выходом, в условиях фазового переноса, за счет выдерживания ее в смеси аллилбромида в дихлорметане и водном растворе бикарбоната натрия, содержащем тетра-н-бутиламмонийхлорид (S.Friedrich-Bochnitschek et al., J.Org.Chem., 1989, 54: 751-756). Реакция сочетания М с N была проведена с 4-диметиламинопиридином (DМАР) и дихлорциклокарбодиимидом (DCC) в дихлорметане с образованием О с 75% выходом. Расщепление аллилового эфира О было проведено в ТГФ, содержащем морфолин и катализатор тетракис(трифенилфосфин)-палладий с образованием Р с 95% выходом (P.D.Jeffrey et al., J.Org.Chem. 1982, 47:587-590).
Сочетание А-В предшественника (К) и C-D предшественника (Р) было выполнено как показано на схеме 5 (фигура 9). Обработка К и Р смесью DCC/DMAP в дихлорметане приводит к полностью защищенному C-D-A-B интермедиату (Q) с 84% выходом. Восстановительное расщепление группы трихлорэтилового эфира в Q было достигнуто с использованием активированной цинковой пыли в уксусной кислоте. ВОС-защищенная группа была затем удалена трифторуксусной кислотой с образованием R в виде трифторацетатной соли с 91% общим выходом от Q.
Макролактамизация R с помощью FDPP приводит к Криптофицину 51 с 61% выходом (J. Dudash, Jr.et al., Synth.Commun, 1993, 23:349-356). Общий выход из S-транс-3-пентен-2-ола (А) составлял 7%.
Криптофицин 51 служил в качестве предшественника Криптофицина 52, R,R-эпоксида, и Криптофицина 53 S,S-эпоксида. В свою очередь, Криптофицин 52 служил в качестве предшественника Криптофицина 55, 18R,19S-хлоргидрина и Криптофицина 57, 13,14-дигидроаналога. Криптофицин 57 служил в качестве предшественника Криптофицина 58. Криптофицин 53 служил в качестве предшественника Криптофицина 61 с использованием способа, описанного T.H. Chan and J.F. Finkenbine, J.Am.Chem.Soc., 1972, 94:2880-2882, и Криптофицина 97 с использованием способа, описанного Y. Ittah et al., J.Org.Chem., 1978, 43: 4271-4273.
Для синтеза криптофицинов, которые содержали Аr группы, которые отличаются от фенила, звено А предшественников общей формулы d (схема 1, R3=Ме) может быть приготовлено реакцией Виттига альдегида F (схема 2; TBS-защищающая группа) или S (схема 6; TBPS-защищающая группа) с соответствующим арилтрифенилфосфонийхлоридом в присутствии бутиллития. Криптофицин 81 был приготовлен из предшественника d (Аr=п-метоксифенил, R3=Ме) как показано на схемах 6 и 7 (фигуры 10 и 11).
Аr группа может быть также введена в новый криптофицин на более поздней стадии синтеза. Сначала предшественник d(Аr=R3=Ме) был превращен в Криптофицин 82 реакцией сочетания соответствующих А-В (е) и C-D (f) предшественников, как показано на схеме 8 (фигура 12). Селективный озонолиз Криптофицина 82 или окисление периодной кислотой соответствующих эпоксидов Криптофицинов 90 и 91 приводит к альдегиду Криптофицина 108. Реакция Виттига Криптофицина 108 с соответствующим арилтрифенилфосфонийхлоридом в присутствии бутиллития дает новый криптофицин (схема 9; фигура 13). Используя эту процедуру, были получены Криптофицин 110 (Аr= п-фторфенил), Криптофицин 111 (Аr=п-толил), Криптофицин 112 (Аr=2-тиенил) и Криптофицин 124 (Аr=п-хлорфенил). Криптофицин 110 служил в качестве предшественника эпоксидов Криптофицинов 115 и 116. Криптофицин 111 служил в качестве предшественника эпоксидов Криптофицинов 117 и 118 и хлоргидринов Криптофицинов 128, 130 и 131. Криптофицин 112 служил в качестве предшественника эпоксидов Криптофицинов 119 и 120. Криптофицин 124 служил в качестве предшественника эпоксидов Криптофицинов 125, 126 и хлоргидринов Криптофицинов 132, 133 и 134.
Другой стратегией при синтезе криптофицина является создание узла макроцикла из трех предшественников, например, А-В предшественника (е), содержащего δ-окси или аминокислотное звено А, предшественника, содержащего δ-окси или аминокислотное звено D, и предшественника, содержащего α-аминокислотное звено С. В способе, описанном здесь, криптофицин составляет узел из А-В, С и D предшественников в три стадии за счет (1) соединения концевых А и D в А-В и D предшественниках с образованием ациклического D-A-B интермедиата, (2) соединения концевых звеньев D и С в D-А-В и С предшественниках с образованием ациклического C-D-A-B интермедиата и (3) соединения концевых звеньев В и С с образованием циклического продукта.
В синтезе криптофицина 121, описанном в экспериментальной части, эфирная связь образуется между δ-окси группой звена А в А-В остатке и группой карбоновой кислоты звена D в D фрагменте с образованием ациклического D-A-B интермедиата. Затем образуется амидная связь между группой карбоновой кислоты звена С и α-аминогруппой звена D в D-A-B фрагменте. Наконец, амидная связь образуется между группой карбоновой кислоты звена В в А-В остатке и β-амино группой звена С в C-D остатке. Соединение К является предшественником с А-В остатком, BOC-L-лейцинальдегид является предшественником звена D и соединение AL является предшественником звена С. Соединение АК является ациклическим C-D-A-B предшественником Криптофицина 121 (схема 10; фигура 14). Соединения К и BOC-L-лейцинальдегида содержат защищающие группы на группе карбоновой кислоты звена В и α-аминогруппе звена D для ограничения реакции сочетания с образованием эфира между звеньями А и D в стадии 1. Защищающая группа удаляется из δ-амино группы звена D в D-A-B интермедиате, таким образом, что может происходить образование амида между амино группой звена С и карбоновой кислотой С в стадии 2. Эти защищающие группы удаляются из C-D-A-B интермедиата таким образом, что может происходить образование амида между звеньями В и С в стадии 2.
Новые криптофициновые соединения настоящего изобретения содержат эпоксидные кольца, которые раскрываются с помощью нуклеофилов с другими скоростями, чем эпоксидное кольцо Криптофицина 1, или содержат хлоргидриновые функциональные группы, которые образуют эпоксидные кольца с другими скоростями, чем хлоргидриновые функциональные группы Криптофицина 8, превращаясь в эпоксидное кольцо Криптофицина 1. Эпоксидное кольцо Криптофицина 1 или хлоргидриновая функциональная группа (замаскированное эпоксидное кольцо) Криптофицина 8 является существенной для оптимальной активности in vivo. Если эпоксидный кислород удаляется (так как найдено в Криптофицине 3) или эпоксидное кольцо гидролизуется до диола (так как найдено в Криптофицине 15), антиопухолевая активность сильно снижается. Криптофицин 1 обнаруживает заметную токсичность у животных, по сравнению с Криптофицином 8. Это отражается в отношении Т/С (в большей части выше 0%) и суммарных величинах Log уничтожения (в большей части ниже 2.0) для Криптофицина 1, по сравнению с этими величинами для Криптофицина 8 (в большей части Т/С величин 0% и суммарных величин Log уничтожения выше 2.8). Криптофицин 25, соответствующий бромгидриновому аналогу, показывает отношение Т/С и суммарные величины Log уничтожения, которые являются сравнимыми с этими величинами для Криптофицина 1. Это поразительное различие в активности in vivo подтверждает, что бромгидрин Криптофицина 25 превращается более быстро в Криптофицин 1 in vivo, чем Криптофицин 8. Это дальнейшее подтверждение того, что менее токсичный Криптофицин 8 может иметь больше времени для аккумулирования в участке опухоли до превращения в активное соединение Криптофицина 1. Эпоксидная группа Криптофицина 1, вероятно, связывается ковалентно с его рецептором мишенью в опухолевой клетке. Новые криптофицины в настоящем изобретении могут потенциально обладать лучшей активностью in vivo, чем Криптофицин 1 и Криптофицин 8 за счет проявления более благоприятных скоростей образования эпоксида in vivo из соответствующих хлоргидриновых пролекарств и ковалентного связывания с рецетором-мишенью в опухолевой клетке.
Соединения настоящего изобретения являются более устойчивыми по отношению к гидролизу и сольволизу, чем Криптофицины 1 и 21. Эфирная связь, соединяющая звенья С и D в Криптофицине 1, является относительно чувствительной к мягкому основному гидролизу, расщеплясь при рН 11 до гидрокси кислоты с периодом полужизнеспособности 0.83 часа. C-D эфирная связь в Криптофицине 21, в котором недостает метильной группы С-2 на атоме звена С, раскрывается с большей скоростью с периодом полужизнеспособности 0.25 часа. C-D эфирная связь является также чувствительной к сольволизу. Если в схеме выделения используют метанол, имеет место значительный метанолиз Криптофицинов 1 и 21. Криптофицин 21 является гораздо более восприимчивым к метанолизу, чем Криптофицин 1. Криптофицин 1 проявляет противоопухолевую активность, тогда как Криптофицин 21 является неактивным, вероятно, потому, что C-D эфирная связь Криптофицина 21 гидролизуется быстрее, чем C-D эфирная связь Криптофицина 1 in vivo. Гидролизом C-D эфирной связи можно также объяснить частичное снижение активности in vivo Криптофицина 1 при внутрибрюшинном и подкожном путях введения лекарства. C-D эфирная связь криптофицинов, содержащих две метильные группы на С-2 атоме звена С, такая как найдена в Криптофицине 52, является устойчивой при рН 11.
Соединения настоящего изобретения и ранее открытые криптофициновые соединения могут быть применены терапевтически в качестве противоопухолевых агентов и тем самым использоваться в способах лечения опухолевых заболеваний. Термин "неопластический", как он использован здесь, относится к опухоли, которая подвергается аномальному росту, такому росту, который имеет место из-за пролиферации клеток, которые не подвергаются обычным ограничениям роста. Термин "анти-неопластический агент" (противоопухолевый агент), как он использован здесь, относится к любому соединению, композиции, смеси, совместной смеси или комбинации, которые ингибируют, удаляют, замедляют или меняют неопластический фенотип клетки,
Химиотерапия, хирургия, радиационная терапия, терапия с биологическими модификаторами ответа и иммунотерапия используются в настоящее время при лечении рака. Каждый вид терапии имеет специфические указания, которые известны специалистам в этой области, и один из видов терапии или все могут быть применены для достижения полного разрушения неопластических клеток. Химиотерапия, использующая один или больше криптофицинов, обеспечивается настоящим изобретением. Кроме того, комбинация процессов химиотерапии, химиотерапии, использующей криптофицины в комбинации с другими неопластическими агентами, также обеспечивается объектом изобретения в виде комбинированной терапии, которая является обычно более эффективной, чем использование единственных неопластических агентов. Таким образом, дальнейший аспект настоящего изобретения обеспечивает композиции, содержащие терапевтически эффективное количество, по крайней мере, одного нового криптофицинового соединения настоящего изобретения, включающего их нетоксичные соли присоединения, которые служат для обеспечения вышеперечисленного терапевтического благотворного влияния. Такие композиции могут быть также обеспечены вместе с физиологически подходящей жидкостью, гелем или твердыми носителями, разбавителями, адъювантами и наполнителями. Такие носители, разбавители, адъюванты и наполнители могут быть найдены в United States Pharmacopeia Vol. XXII and National Formulary Vol. XVII. U.S. Pharmacopeia Convention, Inc., Rockville, MD (1989), содержание которой вводится здесь ссылкой. Дополнительные формы обработки обеспечиваются в AHFS Drug Information, 1993 ed. by American Hospital Formulary Service, pp.522-660, содержание которой вводится здесь ссылкой.
Настоящее изобретение далее обеспечивает то, что фармацевтическая композиция, использованная для лечения неопластического заболевания, содержит, по крайней мере, одно криптофициновое соединение и, по крайней мере, один дополнительный противоопухолевый агент. Противоопухолевые соединения, которые могут быть использованы в комбинации с криптофицином, включают такие соединения, которые обеспечены в The Merck Index. 11th ed. Merck and Co., Inc. (1989) pp. Ther 16-17, содержание которой вводится здесь ссылкой. В другом варианте изобретения, противоопухолевые агенты могут быть антиметаболитами, которые могут включать, но не ограничиваются ими, метотриксан, 5-фторурацил, 6-меркаптопурин, цитозин арабинозид, гидроксимочевину и 2-хлордеоксиаденозин. В другом варианте настоящего изобретения, противоопухолевые агенты рассматривают алкилирующие агенты, которые могут включать, но не ограничиваются ими, циклофосфамид, мельфалан, бусульфан, параплатин, хлорамбуцил и азотную горчицу (nitrogen mustard). В другом варианте объекта изобретения, противоопухолевые агенты представляют растительные алкалоиды, которые могут включать, но не ограничиваются ими, винкристин, винбластин, таксол и этопсид. В другом варианте настоящего изобретения, рассмотренные противоопухолевые агенты представляют антибиотики, которые могут включать, но не ограничиваются ими, доксорубицин (адриамицин), даунорубицин, митомицин с и блеомицин. В другом варианте объекта изобретения, рассмотренные противоопухолевые агенты представляют гармоны, которые могут включать, но не ограничиваются ими, калустерон, диомоставолон, проипонат, эпитиостанол, мепитиостан, тестолактон, тамоксифен, полиэстрадиол фосфат, мегестерол ацетат, флутамид, нилутамид и трилотан. В другом варианте объекта изобретения, рассмотренные противоопухолевые агенты включают ферменты, которые могут включать, но не ограничиваются ими, L-Аспарагиназу или аминоакридиновые производные, которые могут включать, но не ограничиваются ими, амсакрин. Дополнительные противоопухолевые агенты включают те агенты, которые обеспечены в Skeel, Roland Т., "Противоопухолевые лекарства и модификатор биологического ответа: классификация, применение и токсичность клинически полезных агентов", Handbook of Cancer Chemotherapy (3rd ed.), Little Brown and Co. (1991), содержание которой вводится здесь ссылкой.
Криптофициновые соединения настоящего изобретения и композиции могут быть введены млекопитающим для ветеринарного использования, таким как домашние животные, и клинического использования для человека, способом аналогичным другим терапевтическим агентам. В основном, доза, требуемая для терапевтической эффективности будет меняться в соответствии с типом использования и формой введения, а также конкретными требованиями индивидуальных хозяев. Обычно дозы будут находиться в области от около 0.001 до 1000 мг/кг, более обычно от 0.01 до 10 мг/кг веса тела хозяина. Или же дозы в пределах этих областей могут быть введены путем постоянного вливания в течение более протяженного периода времени, обычно превышающего 24 часа, до того момента, когда будет достигнуто желаемое терапевтическое воздействие. Действительно, лекарственная доза, а также путь введения должны быть выбраны на основании относительной эффективности, относительной токсичности, характеристик роста опухоли и влияния криптофицинов на клеточный цикл, лекарственные фармакокинетические характеристики, возраст, пол, физическое состояние пациента и прежнее лечение.
Криптофициновые соединения с или без дополнительных противоопухолевых агентов, могут быть составлены в терапевтические композиции в натуральном виде или в солевой форме. Фармацевтически приемлемые, нетоксичные соли включают основные соли присоединения (полученные со свободными карбоксильными или другими анионными группами), которые могут быть получены из неорганических оснований таких как, например, гидроокиси натрия, калия, аммония, кальция или железа, и таких органических оснований, как изопропиламин, триметиламин, 2-этиламиноэтанол, гистидин, прокаин и им подобных. Такие соли могут быть также получены в виде кислых солей присоединения с любыми свободными катионными группами и будут обычно образовываться с неорганическими кислотами, такими как, например, соляная или фосфорная кислоты, или органическими кислотами, такими как уксусная, щавелевая, винная, миндальная кислота и им подобными. Дополнительные наполнители, которые далее обеспечивает изобретение, представляют те наполнители, которые доступны специалистам в этой области, например, те, которые найдены в United States Pharmacopeia Vol. XXII and National Formulary Vol.XVII, U.S. Pharmacopeia Convention, Inc., Rockville, MD (1989), содержание которой вводится здесь ссылкой.
Пригодность конкретного носителя для включения в данную терапевтическую композицию зависит от предпочтительного пути введения. Например, противоопухолевые композиции могут быть составлены для орального введения. Такие композиции обычно готовятся либо в виде жидкого раствора, либо в виде суспензий или в виде твердых форм. Оральные композиции, обычно, включают такие обычно применяемые добавки, как связующие, наполнители, носители, консерванты, стабилизирующие агенты, эмульгаторы, буферы и наполнители, такие как, например, фармацевтической марки маннитол, лактоза, крахмал, стеарат магния, натрий сахарин, целлюлоза, карбонат магния и им подобные. Эти композиции готовятся в форме растворов, суспензий, таблеток, пилюль, капсул, подвергающихся высвобождению композиций, или порошков, и обычно содержат 1-95% активного ингредиента, предпочтительно, 2-70%.
Композиции настоящего изобретения могут быть также приготовлены в виде инъецируемых, либо в виде жидких растворов, суспензий, или эмульсий; твердых форм, пригодных для растворения в, суспендирования в, или могут быть приготовлены жидкими до инъецирования. Такие инъекции могут быть введены подкожно, внутривенно, внутрибрюшинно, внутримышечно, внутритрахеально или внутриплеврально. Активный ингредиент или ингредиенты часто смешиваются с разбавителями или наполнителями, которые являются физиологически толерантными или совместимыми с активным ингредиентом(тами). Пригодные разбавители и наполнители являются, например, водой, солевым раствором, декстрозой, глицерином или им подобными и их комбинациями. Кроме того, если желательно, композиции могут содержать минимальные количества вспомогательных веществ, таких как смачивающие или эмульгирующие агенты, стабилизирующие или рН буферные агенты.
Изобретение далее обеспечивает способы для использования криптофициновых соединений, объединенных общим типом структуры, для ингибирования пролиферации клеток млекопитающего за счет контактирования этих клеток с криптофициновым соединением в количестве, достаточном для ингибирования пролиферации клетки млекопитающего. Предпочтительный вариант представляет способ ингибирования пролиферации гиперпролиферативных клеток млекопитающего. Для целей этого изобретения, "гиперпролиферативные клетки млекопитающего" представляют клетки млекопитающего, которые не подвергаются характерным ограничениям роста, например, запрограммированной клеточной смерти (апоптозу). Другой предпочтительный вариант представляет вариант, когда клетка млекопитающего является человеческой. Изобретение далее обеспечивает контактирование клетки млекопитающего с, по крайней мере, одним криптофициновым соединением и, по крайней мере, с одним дополнительным противоопухолевым агентом. Типы рассмотренных противоопухолевых агентов являются такими же как те, которые раскрывались здесь выше,
Изобретение далее обеспечивает способы использования криптофициновых соединений, объединенных общим типом структуры, для ингибирования пролиферации гиперпролиферативных клеток с фенотипами сопротивления лекарству, включающему соединения с множеством фенотипов сопротивления лекарству, за счет контактирования указанной клетки с криптофициновым соединением в количестве, достаточном для ингибирования пролиферации гиперпролиферативных клеток млекопитающего. Предпочтительный вариант представляет вариант, когда клетка млекопитающего является человеческой. Изобретение далее обеспечивает контактирование клетки млекопитающего с криптофициновым соединением и, по крайней мере, одним дополнительным противоопухолевым агентом. Типы рассмотренных противоопухолевых агентов представляют такие как те, которые раскрыты здесь выше.
Изобретение далее обеспечивает способ облегчения патологических состояний, вызванных гиперпролиферирующими клетками млекопитающего, например, неоплазии, путем введения субъекту эффективного количества фармацевтической композиции, обеспеченной здесь выше, для ингибирования пролиферации гиперпролиферирующих клеток. Термин "патологическое состояние", как он использован здесь, относится к любой патологии, возникающей при пролиферации клеток млекопитающего, которые не подвергаются нормальным ограничениям клеточного роста. Такая пролиферация клеток может быть обусловлена опухолями, включающими, но не ограничивающимися ими, следующие опухоли: молочной железы, малокамерного легкого, немалокамерного легкого, калоректальной лейкемии, меланомы, панкреатической аденокарциномы, центральной нервной системы (CNS), яичниковой простаты, саркомы мягкой ткани или кости, головы и шеи, гастрита, который включает панкреатический гастрит и желудочный гастрит, желудка, миеломы, мочевого пузыря, ренальной нейроэндокринии, которая включает щитовидную железу и неоплазмы, не связанные с заболеванием Ходкинса, и неоплазмы, связанные с заболеванием Ходкинса. В другом варианте изобретения, опухолевые клетки являются человеческими. Настоящее изобретение обеспечивает далее способы облегчения таких патологических состояний, используя криптофицин в комбинации с другой терапией, а также с другими противоопухолевыми агентами. Такие терапии и их соответствие различным опухолям могут быть найдена в Cancer Principles and Practice of Oncology. 4th.ed/, Editors De Vita, V., Hellmann, S. and Rosenberg, S., Uppincott Co. (1993), содержание которой вводится здесь ссылкой.
В настоящем изобретении криптофициновые соединения проявляются в сильно нарушенной микротрубочковой структуре в культивированных клетках. Кроме того, в противоположность алкалоидам Vinca криптофициновые соединения являются очевидно, плохими субстратами для оттока лекарства из Р-гликопротеина. Криптофицин 1 является наиболее цитотоксичным для штамма зелено-голубых водорослей (цианобактерий) Nostoc sp., обозначенного как GSV 224 и проявляет превосходную активность по отношению к опухолям, имплантированным мышам. Этот циклический дидепсипептид был ранее выделен из Nostoc sp. ATCC N 53789 в качестве противогрибкового агента и его полная структура была определена ранее. Относительная и абсолютная стереохимия этого потенциально важного лекарства была установлена с использованием комбинации химических и спектральных методов. Двадцать четыре дополнительных криптофициновых соединения, Криптофицины 2-7, 16-19, 21, 23, 24, 26, 28-31, 40, 43, 45, 49, 50 и 54, также были выделены из GSV 224 и определены их полные структуры и цитотоксичность. Некоторые производные и продукты деструкции описываются с химической и фармацевтической точки зрения.
Следующие примеры служат для иллюстрации определенных предпочтительных вариантов и аспектов настоящего изобретения и не рассматриваются, как ограничивающие объем изобретения.
Экспериментальная часть.
В описании экспериментальной части, которая следует далее, все веса даются в граммах (г), миллиграммах (мг), микрограммах (мкг), нанограммах (нг), пикограммах (пкг), молях (моль) или миллимолях (ммоль), все концентрации даются в виде объемных процентов (%), молярных (М), миллимолярных (мМ), микромолярных (мкМ), наномолярных (нМ), пикомолярных (пкМ) или нормальных (н), все объемы даются в литрах (л), миллитриах (мл) или микролитрах (мкл) и линейные измерения в миллиметрах (мм), если не оговорено особо.
Следующие примеры иллюстрируют выделение и синтез криптофициновых соединений, а также их применение в качестве терапевтических агентов в соответствии с изобретением.
В экстрактах около 1000 зелено-голубых водорослей (цианобактерий), подвергнутых испытанию на противоопухолевую активность, было найдено, что липофильный экстракт Nostoc sp. GSV 224 обладает наиболее сильной цитотоксичностью3, проявляя минимальные ингибирующие концентрации (MICs) 0.24 нг/мл против KB, против человеческой линии клеток назофарингиальной карциномы, и 6 нг/мл против LoVo, человеческой линии клеток калоректальной аденокарциномы. Более важно, что этот экстракт проявляет значительную селективную цитотоксичность к опухоли в анализе Corbett. Биоанализ, регистрируемый с помощью хроматографии с обращенной фазой, водорослевого экстракта приводил к фракции, которая преимущественно представляла Криптофицин 1, мощный фунгицид, который бал выделен ранее из Nostoc sp. АТСС 53789 исследователями фирмы Merck и было найдено, что он является очень активным против штаммов Cryptococcus.
Криптофицин 1 являлся ответственным за большую часть цитотоксичной активности неочищенного водорослевого экстракта Nostoc sp. GSV 224 и чистого соединения, показывая величины IC50 3 и 5 пкг/мл против KB и LoVo, соответственно. В анализе Corbett было найдено, что Криптофицин 1 являлся высоко селективным к опухоли и в равной степени цитотоксичным против чувствительности к лекарству и против сопротивления лекарству опухолевых клеток. Иммунофлуоресцентный анализ показывает, что Криптофицин 1 взаимодействует с клеточной мишенью подобно тому, как это имеет место с винбластином, но отличается от последнего лекарства тем, что обладает более продолжительным временем действия и не образует паракристаллических тел. В предварительных экспериментах in vivo Криптофицин 1 проявляет очень обещающую активность против опухолей, имплантированных мышам.
Минимальные количества некоторых других криптофициновых соединений присутствовали в Nostoc sp. GSV 224. Двадцать одно из этих соединений может быть выделено в достаточных количествах для определения структуры и противоопухолевой оценки in vitro путем экстракции водорослей смесью 1:5 дихлорметана/ацетонитрила и жидкостной гель-проникающей хроматографии с обращенной фазой экстракта. Криптофицины 2, 3, 4, 16, 17, 18, 19, 21, 23, 24, 26, 28, 29, 30, 31, 40, 43, 45, 49, 50 и 54, сопровождающие Криптофицин 1, в фракции, элюированной из флеш-колонки с обращенной фазой смесью 65:35 ацетонитрил/вода. Криптофицины 2, 3, 4, 5, 6 и 7 были найдены только, если водоросли экстрагировали метанолом и хроматографию с обращенной фазой проводили в смеси метанол/вода. Криптофицины 2, 3, 4, 5 и 6 были элюированы смесью 3:1 метанол/вода и Криптофицин 7, найденный в более ранней, менее токсичной фракции, элюировали смесью 1:3 метанол/вода. Ациклические Криптофицины 5, 6 и 7 являлись случайными продуктами, генерированными за счет разложения Криптофицина 1 в процессе процедуры выделения.
Криптофицины 3 и 5 были идентичными с фунгицидными полусинтетическими соединениями, приготовленными из Криптофицина 1, исследователями фирмы Merck8,9. Криптофицин 3 был приготовлен обработкой Криптофицина 1 цинк-медной парой или дифосфортетраиодидом 8, Криптофицин 5 был приготовлен метанолизом Криптофицина 19.
Пример 1. Определение структуры
Определение структур новых соединений, а именно Криптофицинов 2, 4, 6, 7, 8, 9, 10, 12, 14, 16, 17, 18, 19, 21, 23, 24, 26, 28, 29, 30, 31, 40, 43, 45, 49, 50 и 54, а также тех, которые были раскрыты ранее, было проведено прямым способом с использованием методологии, которая является хорошо известной специалистам в этой области. Масс-спектральные данные согласовывались с молекулярными составами. Данные протонного магнитного резонанса и углеродного ядерного магнитного резонанса, полученные из COSY, HMQC, НМВС и NOESY спектров позволяют собрать все основные структуры этих депсипептидного типа соединений. Присутствие различных гидроксильных и аминокислотных звеньев в каждом соединении были подтверждены с помощью газохроматографического масс-спектрального анализа. Полные структуры, включающие абсолютную стереохимию, были определены с использованием комбинации методов химической деструкции и спектрально-аналитических методов соответствующих производных криптофициновых соединений.
Пример 2. Зависимости структура-активность (SAR)
Для изучения структурных характеристик Криптофицина 1, необходимых для оптимальной активности, все соединения, описанные здесь, были оценены на цитотоксичность по отношению к линии клеток KB (человеческой назофарингиальной карциномы), по отношению к LoVo, (человеческой карциномы ободочной (толстой) кишки) и SKOV3 (яичниковой человеческой карциномы). Величины IC50 приведены в таблицах 1 и 2. Сравнение цитотоксичности показывает, что интактное (неактивное) макролидное кольцо, эпокси и метильные группы и двойная связь в 7,8-эпокси-5-гидрокси-6-метил-8-фенил-2-октеновом кислотном звене (смотри звено А на фигуре 1), хлор и O-метильных группах в 3-(3-хлор-4-метоксифенил)аланиновом звене (звено В), метильной группе в звене 3-амино-2-метилпропионовой кислоты (звено С), и изобутильной группе в звене лейциновой кислоты (звено D) Криптофицина 1, являются необходимыми для оптимальной цитотоксичности. Сильная цитотоксичность Криптофицина 8, наиболее вероятно, обусловлена хлоргидриновой функциональностью, которая выступает в качестве маскирующего агента эпоксида.
Наиболее активные соединения были также оценены на селективную цитотоксичность против четырех различных типов клеток, а именно, мышиной лейкемии (L1210 или Р388), мышиной твердой опухоли (аденокарциномы толстой кишки 38, панкреатической аденокарциномы протоки 03, аденокарциномы молочной железы М16/М17), человеческой твердой опухоли (толстой кишки СХ-1, НСТ8, Н116; легкого Р125; молочной железы МХ-1, MCF-7) и фибробласта (LML) со слабым злокачественным развитием с использованием анализа Corbett4, диффузного дискового анализа, смоделированного после анализа, обычно используемого в противогрибковом и противобактериальном испытании. Результаты, показанные в таблице 1, свидетельствуют о том, что Криптофицины 1-5 и 8 не являются селективными ни по отношению к твердой опухоли, ни по отношению к лейкемии, но гораздо более активны против линий клеток опухоли, включая те линии клеток опухоли, которые оказывают сопротивление лекарству, такие как М17. Ни одно из соединений не проявляет зоны ингибирования для любых линий клеток твердой опухоли, такой зоны, которая составляла бы зону из 250 единиц, т.е. 7.5 мм, больше чем зона ингибирования для линии клеток лейкемии. Криптофицины 1-5 и 8, однако, проявляют заметно большие зоны ингибирования (зону из 400 единиц) для всех линий клеток опухоли, по сравнению с зоной ингибирования для фибробласта LML.
Диагностически было найдено, что LML ведет себя в большей степени как нормальная клетка, а не как опухолевая клетка по отношению к клинически полезным цитотоксичным агентам (смотри данные анализа Corbett для 5-фторурацила, этопсида и таксола в таблице 1). Так как различные цитотоксичности были для зоны больше 250 единиц, Криптофицины 1-5 и 8 были селективны к опухоли. Поэтому эти соединения стали кандидатами для испытания in vivo.
Криптофицин 1 является активным против широкого спектра мышиных и человеческих опухолей, имплантированных мышам, включая опухоли сопротивления лекарству (таблица 3). Криптофицин 1 проявляет превосходную активность против пяти ранних стадий мышиных опухолей, а именно, аденокарцином слепой кишки # 38 и # 51, опухоли молочной железы, чувствительной к таксолу и оказывающей сопротивление таксолу #16/C/RP, и панкреатической двойной аденокарциномы #03 и двух ранних стадий человеческих опухолей, испытанных у мышей с (SСID)-тяжелым комбинированным иммунодефицитом, а именно МХ-1 груди и Н125 аденосаркомы легкого, проявляющих величины опухолевого предрасположения Т/С (среднее опухолевое предрасположение у обработанных животных/среднее опухолевое предрасположение у необработанных животных), которые составляют меньше чем 10%.
Величины Т/С, которые составляют меньше, чем 42% считаются активными согласно NCl стандартам; величины Т/С, которые составляют меньше, чем 10% считаются, что имеют превосходную активность и потенциальную клиническую активность согласно NCl стандартам4. Два из трех испытаний показывают суммарные величины Log уничтожения (опухолевой клетки) 2.0. Суммарную величину Log уничтожения определяют в виде Т-С/3.2 Td, где Т представляет среднее время в сутках для опухолей обработанной группы для достижения опухоли в 750 мг, С представляет среднее время в сутках для опухолей контрольной группы для достижения опухоли в 750 мг, и Td представляет время удвоения объема опухоли. Суммарные величины Log уничтожения выше 2.8, 2.0-2.8, 1.3-1.9, 0.5-0.8 и ниже 0.5 с продолжительностью обработки лекарством 5-20 суток считает ++++, +++, ++, + и - (неактивный), соответственно. Характеристика активности от +++ до ++++, которая является указанием клинической активности, является необходимой для частичного влияния или полной регрессии масс размером 100-300 мг большинства трансплантированных твердых опухолей мышей.
Криптофицин 8 также является активным против широкого спектра опухолей, трансплантированных мышам (таблица 4). Он проявляет превосходную активность против всех испытанных на сегодняшний день опухолей, показывая величины опухолевого предрасположения Т/С меньше 10%, но более важно, суммарные характеристики активности Log уничтожения от +++ до ++++ и в некоторых случаях вылечивание.
Хорошая активность in vivo была также обнаружена с Криптофицином 35 в одном испытании, которое было проведено на сегодняшний день.
Летальная токсичность, наблюдавшаяся в процессе испытаний Криптофицинов 1 и 8, была приписана лейкопении, которая является обычной для всех клинически используемых противоопухолевых лекарств.
Пример 3. Состояния культуры
Nostoc sp. GSV 224 был получен от профессора C.P. Wolk, MSU-DOE Plant Research Laboratory, Michigan State University. Nostoc sp. ATCC 53789 был куплен у
American Type Culture Collection. Была использована 1 л склянка культуры водорослей для инокулирования автоклавированной 20 л стеклянной емкости, содержащей неорганическую среду, обозначенную BG-113, рН которой была доведена до 7.0 NaOH. Культуры непрерывно облучали светом с интенсивностью падающего света 200 мкмолей фотонов м-2 сек-1 (фотосинтетически активного излучения) от скамьи флуоресцентных трубок холодного белого свечения и аэрировали со скоростью 5 л/мин смесью СО2 и воздуха при температуре 24o+/-1oС. Обычно культуру собирали фильтрованием через 21 день. Выходы лиофилизованного Nostoc sp. GSV 224 и АТСС 53789 в среднем составляли 0.61 и 0,3 г/л культуры, соответственно.
Пример 4. Выделение
Способ А: Лиофилизованный Nostoc sp. GSV 224 экстрагировали 2 л смеси 1: 5 СН2Сl2/СН3СN в течение 48 часов и экстракт концентрировали в вакууме, получая темно-зеленое твердое вещество. Остаток (1 г; KB MIC 0.24 нг/мл) был помещен в кремниевую колонку, покрытую ODS (55 г, 7•5 см) и подвергнут флеш-хроматографии смесью 1:3 CH3CN/H2O (0.8 л), 1:1 СН3СN/Н2О (0.8 л), 65:35 СН3СN/Н2О (1.0 л), МеОН (0.8 л) и CH2Cl2 (0.5 л). Фракция, которая была элюирована 65:35 СН3СN/Н2О (420 мг KB MIC 14 пкг/мл) была подвергнута обработке с помощью жидкостной гель-проникающей хроматографии с обращенной фазой (Econosil C18, 10 мк, 25 см•21,5 мм, УФ-детектирование при 250 нм, 65:35 СН3СN/Н2О, скорость потока 6 мл/мин) с получением Криптофицина 1 (tR 49.3 мин, 220 мг) и ряда примесных фракций. Фракция, элюированная из Econosil C18 колонки при tR 28.8 мин, была далее очищена с помощью жидкостной гель-проникающей хроматографии с нормальной фазой (силикагель Econosil 5 мк картридж, 250•4,6 мм, 6: 4 этилацетат/гексан, 3 мл/мин) с получением Криптофицина 16 (3.0 мг). Фракция, элюированная из Econosil C18 колонки при tR 32.5 мин, была подвергнута обработке с помощью жидкостной гель-проникающей хроматографии на колонке силикагель Econosil с использованием смеси 55:45 этилацетат/гексан при скорости 3 мл/мин с получением Криптофицина 24 (0.8 мг). Фракция, элюированная из Econosil C18 колонки при tR 35.5 мин, была дважды подвергнута обработке с помощью жидкостной гель-проникающей хроматографии на колонке силикагель Econosil сначала с использованием 1:1 смеси этилацетат/гексан при скорости 3 мл/мин и затем с использованием смеси 4:6 этилацетат/метиленхлорид при скорости 2.5 мл/мин с получением Криптофицина 23 (1.2 мг) и Криптофицина 43 (0.1 мг). Фракция, элюированная из Econosil С18 колонки при tR 39.5 мин, была подвергнута обработке с помощью жидкостной гель-проникающей хроматографии на колонке силикагель Econosil с использованием 1: 1 смеси этилацетат/гексан при скорости 3 мл/мин с получением Криптофицина 2 (6 мг) и Криптофицина 21 (14 мг) и комплексной смеси криптофицинов, элюированных при tR 32.5 мин. Эта последняя фракция, собранная из 400 г сухих водорослей, была подвергнута хроматографированию на селективной полупрепаративной колонке (partisil C18, 250•9,4 мм, 10 мк) смесью 65:35 вода/ацетонитрил и аналитической колонке с обращенной фазой (Econosil, 150•4,6 мм, 5 мк) смесью 5:4:1 вода/ацетонитрил/метанол при скорости 1.3 мл/мин с получением Криптофицина 50 (tR 34.8, 0.4 мг) и Криптофицина 40 (tR 38.8 мин, 0.3 мг). Фракция, элюированная из Econosil C18 колонки при tR 44.5 мин, была дважды подвергнута обработке с помощью жидкостной гель-проникающей хроматографии на колонке силикагель Econosil 1:1 смесью этилацетат/гексан при скорости 3 мл/мин с получением Криптофицина 17 (0.3 мг). Очистка с помощью жидкостной гель-проникающей хроматографии с нормальной фазой, фракции, элюированной из Econosil C18 колонки при tR 54.5 мин, в виде плеча к Криптофицину 1, давала Криптофицин 45 (tR 6.7 мин, 0.1 мг), Криптофицин 26 (tR 8.9 мин, 0.5 мг) и Криптофицин 54 (tR 19.8 мин, меньше 0.1 мг) с элюированием смесью 1:1 этилацетат/гексан. Фракцию, элюированную из Econosil C18 колонки в виде широкого пика (tR 58 до 70 минут) подвергали анализу с помощью жидкостной гель-проникающей хроматографии на Econosil силикагелевой колонке с 43:57 этилацетат/гексан при 2,5 мл/мин, с получением Криптофицина 4 (tR 19.6 мин, 1,5 мг), Криптофицина 31 (tR 9.4 мин, 0,8 мг), Криптофицина 19 (tR 25/8 мин, 1,5 мг), Криптофицина 40 (tR 28 мин, 0,1 мг), Криптофицина 28 (tR 29.0 мин, 0,5 мг) и примеси Криптофицина 29) tR 52.5 мин, 2,0 мг) и Криптофицина 30 (tR 49 мин, 3.0 мг). Чистые Криптофицины 29 и 30 получали после обработки с помощью гель-проникающей хроматографии с обращенной фазой (Econosil C18, 10 мк, 250•10 мм, 3:1 метанол/вода). Фракция, элюированная из Econosil C18 колонки при tR 78.9 мин, была подвергнута обработке с помощью гель-проникающей хроматографии на Econosil силикагелевой колонке с получением Криптофицина 3 (tR 16.4 мин, 3.0 мг). Фракция, элюированная из Econosil C18 колонки при tR 82.8 мин была подвергнута обработке с помощью гель-проникающей хроматографии на Econosil силикагелевой колонке с 45: 55 этилацетат/гексан при скорости 3 мл/мин и давала Криптофицин 18 (tR 19.2, 0,8 мг).
Способ Б:
Лиофилизованный Nostoc sp. GS V 224 (12.23 г), был дважды проэкстрагирован 700 мл и 400 мл порциями МеОН в течение 12 и 5 часов (h), соответственно. Экстракты объединяли и концентрировали в вакууме с получением 1,84 г темно-зеленого твердого вещества, которое было распределено между водой и CH2Cl2. Липофильную часть (0,65 г, KB MIC 0,24 нг/мл) загружали в ODS - покрытую силикагелевую колонку (55 г, 7•5 см) и подвергали флеш-хроматографированию с 1:3 MeOH/H2O, 1:1 MeOH/H2O (0,8 л), 3:1 МеОН/Н2О (0,8 л), МеОН (0,8 л) и CH2Cl2 (0,5 л). Фракция, которая была элюирована 3:1 МеОН/Н2О (22 мг, KB MIC 14 пкг/мл), которая считалась, по существу, вся обладающая цитотоксической активностью, была подвергнута обработке с помощью жидкостной гель-проникающей хроматографии с обращенной фазой (Econosil C18, 10 мк, 250•10 мм, обнаружение с помощью УФ при 250 нм, скорость потока 3 мл/мин) с использованием 1: 5 MeOH/H2O в качестве элюента, давала Криптофицины 7 (tR 7.6 мин, 0,2 мг), 5 (tR 15.4 мин, 2,3 мг), 2 (tR 16.0 мин, 1,0 мг), 1 (tR 19.0 мин, 12.0 мг), 4 (tR 26.5 мин, 1,2 мг) и 3 (tR 30.2 мин, 1,4 мг). Фракция (8.1 мг), которая элюировалась из флеш-колонки с помощью 1:3 МеОН/Н2О, из одной из культур, проявляла среднюю цитотоксичность (KB MIC 2 мкг/мл). Очистка с помощью жидкостной гель-проникающей хроматографии с использованием 2:3 MeOH/H2O в качестве элюента давала Криптофицин G (7, tR 6.0 мин, 2.4 мг).
Пример 5. Спектральные данные для Криптофицинов 1-7.
Выделенные курсивом буквы относятся к звеньям A-D (на фиг.1).
Криптофицин 1.
[α] D +33.8o (МеОН, С 1.83); УФ λmax(ε) 208 (42,400), 218 (33,700), 228 (23,800), 280 (2,210); КД [θ]202 +15,900, [θ]206 +64,900, [θ]214 +26,900, [θ] 224 +46,300, [θ] 237 +10,500. ИК (CHCl3) νmax 3425, 2963, 1751, 1719, 1677, 1502, 1259 cm-1. EIMS m/z (относит. интенсивность) 654/656 (20/9), 412/414 (33/12), 280/282 (31/12), 227 (80), 195/197 (92/44), 91 (100); высокого разрешения EIMS m/z 654.2665 (рассчитано для С35Н43СlN2О8, 4.3 mmu ошибка). 1H ЯМР (CDCl3): амино или гидрокси кислотное звено δ (положение углерода, мультиплетность; J в Гц) 7,8- эпокси-5-гидрокси-6-метил-8-фенил-2-октеновая кислота (А) 5.74 (2, dt; 15.5 и 0.9), 6.68 (3, ddd; 15.5, 9.6 и 5.2), 2.45 (4, ddd; 14.2, 11.1 и 9.6), 2.55 (4, brdd; 14.2 и 5.2). 5.16 (5, ddd; 11.1, 4.9 и 1.9), 1.80 (6, m), 1.14 (6-Me, d; 7.1). 2.92 (7, dd; 7.5 и 2.0), 3.69 (8, d; 2.0), 7.25 (10/14, m), 7.34-7.39 (11/12/13, m); лейциновая кислота (D) 4.83 (2, dd; 6.8 и 3.3), 1.70 (3, m), 1.36 (3, m), 1.70 (4, m), 0.86 (5, d; 6.6), 0.85 (4-Me, d; 6.6); 3-амино-2-метилпропионовая кислота (С) 2.71 (2, m), 1.22 (2-Me, d; 7.1), 3.30 (3, ddd; 13.4, 5.8 и 3.8), 3.48 (3, ddd; 13.4, 6.3 и 5.8), 6.93 (3-NH, brt; 5.8); 3-хлор-4-метоксифенилаланин (В) 4.80 (2, ddd; 8.7, 7.3 и 5.4), 5.61 (2-NH, d; 8.7), 3.03 (3, dd; 14.4 и 7.3), 3.13 (3, dd; 14.4. и 5.4.), 7.21 (5, d; 2.1), 3.87 (7-ОСН3,s), 6.83 (8, d; 8.5), 7.07 (9, dd; 8.5 и 2.1). 13С ЯМР (СDСl3): звено δ (положение углерода) А 165.3 (1), 125.3 (2), 141.0 (3), 36.7 (4), 76.2 (5), 40.6 (6), 13.5 (6-Me), 63.0 (7), 59.0 (8), 136.7 (9), 125.6 (10/14), 128.7 (11/13), 128.5 (12); D 170.7 (1), 71.3 (2), 39.4 (3), 24.5 (4), 22.9 (5), 21.3 (4-Me); С 175.6 (1), 38.2 (2), 14.1 (2-Me), 41.1 (3); В 170.9 (1), 53.6 (2), 35.0(3), 129.7 (4), 131.0 (5), 122.4 (6), 154.0 (7), 56.1 (7-ОСН3), 112.2 (8), 128.4 (9).
Криптофицин 2
[α] D +20.4o (МеОН, с 0.54); УФ λmax(ε) 206 (43,800), 218 (37,500), 232 (22,900), 278 (2,410); КД [θ]203 +54,100, [θ]212 +16,500, [θ]225 +53,600, [θ] 236 - 14,000. ИК (СНСl3) νmax 3423, 3029, 2961, 1742, 1724, 1678, 1512, 1258 cm-1. EIMS m/z (относит. интенсивность, отнесение) 620 (11,М+), 431 (3), 378 (8), 377 (6), 311 (11), 246 (10), 244 (8), 227 (14), 195 (17), 161 (84, СН3О-С3Н4-СН= СН= СО+), 121 (79, СН3О-С6Н4-СН2 +), 91 (100); высокое разрешение EIMS m/z 620.3094 (рассчитано для С35Н44N2O8, 0.3 mmu ошибка); 161.0605 (рассчитано для С10Н9О2, - 0.2 mmu ошибка); 121.0658 (рассчитано для С8Н9О, - 0.4 mmu ошибка). 1H ЯМР (CDCl3): амино или гидроксикислотное звено δ (положение углерода, мультиплетность; J в Гц) 7,8-эпокси-5-гидрокси-6-метил-8-фенил-октеновая кислота (А) 5.71 (2, dd; 15.4 и 1.3), 6.70 (3. ddd; 15.4, 10.2 и 5.0), 2.45 (4, m), 2.55 (4, m), 5.18 (5, ddd; 11.3, 4.8 и 2.0), 1.79 (6, m), 1.14 (6-Me, d; 7,0), 2.92 (7, dd; 7.7 и 2.0), 3.68 (8, d; 2.0), 7.24 (10/14, m), 7.34-7.39 (11/12/13, m); лейциновая кислота (D) 4.82 (2, dd; 10.1 и 3.7), 1.70 (3, m), 1.33 (3, m), 1,70 (4, m), 0.86 (5, d; 6.4), 0.84 (4-Me, d; 6.4); 3-амино-2-метилпропионовая кислота (С) 2.68 (2, m), 1.23 (2-Me, d; 7.3), 3.39 (3-Н2, m), 7.02 (3-NH, brt; 6.0); O-метилтирозин (В) 4.79 (2, ddd; 8.1, 7.0 и 5.7), 5,55 (2-NH, d; 8.1), 3.07 (3, dd; 14.5 и 7.0), 3.13 (3, dd; 14.5 и 5.7, 7.10 (5/9, d; 8.6), 6.81 (6/8, d; 8.6), 3.78 (7-ОСН3,s). 13С ЯМР (CDCl3): звено δ (положение углерода) A 165.1 (1), 125.1 (2), 141.1 (3), 36.7 (4), 76.0 (5), 40.7 (6), 13.6 (6-Me), 63.0 (7), 59.0 (8), 136.7 (9), 125.6 (10/14), 128.7 (11/13), 128.5 (12); D 170.6 (1), 71.3 (2), 39.4 (3), 24.5 (4), 21.3 (5), 22.9 (4-Me); С 176.0 (1), 38.1 (2), 14.2 (2-Me), 40.7 (3); В 171.1 (1), 53.3 (2), 35.3 (3), 131.0 (4), 130.2 (5/9), 114.1 (6/8), 158.6 (7), 55.2 (7-ОСН3).
Криптофицин 3.
[α] D +20.3o (МеОН, с 1.13); УФ λmax(ε) 206 (51,700), 218 (31,200), 230 (22,900), 246 (18,800), 280 (3,230); КД [θ]205 +50,000, [θ]212 - 390, [θ]218 -47,200, [θ]233 - 100, [θ]251 +33,400, [θ]271 +4,310. ИК (СНСl3) νmax 3417, 2926, 1742, 1721, 1676, 1499, 1336 cm-1. EIMS m/z (относит. интенсивность) 638/640 (2/0.7, М+), 412/414 (63/19), 280/282 (15/5), 227 (100), 195 (63), 91 (98); высокое разрешение EIMS m/z 638.2764 (рассчитано для C35H43ClN2O7, - 0.5 mmu ошибка), 412.1516 (рассчитано для С20Н27СlNО6, 1.1 mmu ошибка), 227.1293 (рассчитано для C15H17NO, 1.0 mmu ошибка). 1Н ЯМР (CDCl3): амино или гидроксикислотное звено δ (положение углерода, мультиплетность; J в Гц) 5-гидрокси-6-метил-8-фенил-2,7-октадиеновая кислота (А) 5.77 (2, d; 15.5), 6.68 (3, ddd; 15.5, 9.5 и 5.3), 2.37 (4, m), 2.54 (4, m), 5.01 (5, ddd; 11.4, 6 и 1,5), 2.56 (6, m), 1.14 (6-Me, d; 7.0), 6.01 (7, dd; 15.8 и 8.8), 6,41 (8, d; 15.8), 7.28-7.34 (10/11/13/14, m), 7.23 (12, m); лейциновая кислота (D) 4.84 (2, dd; 10.1 и 3.6), 1.62 (3, m), 1.36 (3, m), 1.62 (4, m), 0.77 (5, d; 6.5), 0.73 (4-Me, d; 6.3); 3-амино-2-метилпропионовая кислота (С) 2.71 (2, m), 1.22 (2-Me, d; 7.3), 3.28 (3, dt; 13.5 и 7.0), 3.50 (3, ddd; 13.5, 4.9 и 4), 6.93 (3-NH, brt; 6.3); 3-хлор-4-метоксифенилаланин (В) 4.82 (2, m), 5.64 (2-NH, d; 8.8), 3.05 (3, dd; 14.5 и 7.0), 3.13 (3, dd; 14.5 и 5.5), 7.22 (5, d; 2.2), 3.87 (7-ОСН3,s), 6.84 (8, d; 8.5), 7.08 (9, dd; 8.5 и 2.2). 13С ЯМР (CDCl3): звено δ (положение углерода) А 165.4 (1), 125.2 (2), 141.4 (3), 36.5 (4), 77.1 (5), 42.3 (6), 17.3 (6-Ме), 130.1 (7), 130.0 (8), 136.7 (9), 126.1 (10/14), 128.6 (11/13), 128.4 (12); D 170.1 (1), 71.6 (2), 39.5 (3), 24.5 (4), 21.2 (5), 22.7 (4-Ме); С 175.6 (1), 38.3 (2), 14.0 (2-Ме), 41.2 (3); В 170.9 (1), 53.5 (2), 35.1 (3), 129.8 (4), 131.0 (5), 122.4 (6), 154.0 (7), 56.1 (7-ОСН3), 112.2 (8), 127.6 (9).
Криптофицин 4
[α] D +36.7o (МеОН, с 1.93); УФ λmax(ε) 206 (41.800), 228 (25.000), 240 (21,200), 248 (22,500), 280 (3,000), 290 (1,230); КД [θ]205 +63,900, [θ]211 +3,040, [θ]218 -71,900, [θ]229 -11,700, [θ]234 -130, [θ]252 +47,500, [θ]270, +5,400. ИК (СНСl3) νmax 3410, 2962, 2917, 1741, 1718, 1678, 1511, 1251 cm-1. EIMS m/z (относит. интенсивность) 604 (2,М+), 378(74), 246(11), 227(46), 161(100), 91(96); высокое разрешение EIMS m/z 604.3127 (рассчитано для С35Н44N2O7, 2.2 mmu ошибка), 378.1910 (рассчитано для C20H28NO6, 0.7 mmu ошибка), 227.1293 (рассчитано для C15H17NO, 1.7 mmu ошибка), 161.0605 (рассчитано для С10Н9O2, - 0.2 mmu ошибка). 1Н ЯМР (СDСl3): амино или гидроксикислотное звено δ (положение углерода, мультиплетность; J в Гц) 5-гидрокси-6-метил-8-фенил-2,7-октадиеновая кислота (А) 5.74 (2, dd; 15.3 и 1.2), 6.71 (3, ddd; 15.3, 10.3 и 5.0), 2.37 (4, m), 2.53 (4, m), 5.03 (5, ddd; 11.2, 6.4 и 2.0), 2.55 (6, m), 1.13 (6-Me, d; 6.8), 6.01 (7, dd; 15.8 и 8.8), 6.40 (8, d; 15.8), 7.28-7.37 (10/11/13/14, m), 7.22 (12, m); лейциновая кислота (D) 4.84 (2, dd; 10.1 и 3.6), 1.65 (3, m), 1.34 (3, m), 1.65 (4, m), 0.75 (5, d; 6.5), 0.72 (4-Me, d; 6.3); 3-амино-2-метилпропионовая кислота (С) 2.69 (2, m), 1.22 (2-Me, d; 7.5), 3.39 (3-H2, m), 7.03 (3-NH, brt; 6.0); O-метилтирозин (В) 4.79 (2, m), 5.61 (2-NH, d; 7,8), 3.08 (3, dd; 14.5 и 7.0), 3.13 (3, dd; 14.5 и 5.3), 7.11 (5/9, d; 8.8), 6.81 (6/8, d; 8.8), 3.78 (7-ОСН3,s). 13С ЯМР (CDCl3): звено δ (положение углерода) А 165.3 (1), 125.1 (2), 141.5 (3), 36.5 (4), 77.1 (5), 42.3 (6), 17.3 (6-Me), 130.1 (7), 131.8 (8), 136.7 (9), 126.2 (10/14), 128.7 (11/13), 127,6 (12); D 170.8 (1), 71.6 (2), 39.5 (3), 24.5 (4), 21.2 (5), 22.7 (4-Ме); С 175.9 (1), 38.2 (2), 14.2 (2-Me), 40.9 (3); В 171.2 (1), 53.8 (2), 35.3 (3), 131.0 (4), 130.2 (5/9), 114.1 (6/8), 158.6 (7), 55.2 (7-ОСН3).
Криптофицин 5
[α] D +36.0o (МеОН, с 0.55); УФ λmax(ε) 206 (45,600), 218 (37,700), 280 (3,790), 286 (3,480), 325 (2,080); КД [θ]203 +7,710, [θ]206 +29,000, [θ]210 +21,400, [θ] 222 +59,800, [θ]234 +12,800, [θ]241 +13,700. ИК (CHCl3) νmax/ 3426, 2958, 1728, 1672, 1502, 1259 cm-1. EIMS m/z (относит. интенсивность) 686/688 (0.1510.05), 655/657 (1/0.3), 654/656 (1.5/0.5), 311/313 (75/27), 195 (66), 155 (54), 121 (51), 91 (100); высокое разрешение EIMS m/z 686.2983 (рассчитано для C36H47ClN2O9, - 1.3 mmu ошибка). 1Н ЯМР (СDСl3): амино или гидроксикислотное звено δ (положение углерода, мультиплетность; J в Гц 7,8-эпокси-5-гидрокси-6-метил-8-фенил-2-октеновая кислота (А) 5.87 (2, d; 15.3), 6.72 (3, dt; 15.3 и 6.8), 2.60 (4, m), 2.52 (4, ddd; 15.2, 7.8, и 6.8), 5.11 (5, ddd; 12.3, 7.8, и 7.1), 1.87 (6, m), 1.12 (6-Me, d; 7.1), 2.91 (7, dd; 7.3 и 2.1), 3.70 (8, d; 2.1), 7.24 (10/14, brd; 7.4), 7,29-7.36 (11/12/13, m); лейциновая кислота (D) 4.09 (2, m), 2.86 (2-ОН, brd, 6.1), 1.83 (3, m), 1,42 (3, m), 1.86 (4, m), 0.90 (5, d; 6.6), 0.87 (4-Me, d; 6.8); 3-амино-2-метилпропионовая кислота (С) 3.64 (1-OCH3,s), 2.60 (2, m), 1.07 (2-Me, d; 7.3), 3.27 (3, ddd; 13.5, 8.0 и 5.5), 3.39 (3, m), 6.32 (3-NH, t; 5.4); 3-хлор-4-метоксифенилаланин (В) 4.59 (2, dt; 6 и 7.5), 6.30 (2-NH, d; 7.5), 2.95 (3, dd; 13.6 и 7.5), 3.0 (3, dd; 13.6 и 6.0), 7.2 (5, d; 2.1), 3.86 (7-OCH3, s), 6.84 (8, d; 8.5), 7.05 (9, dd, 8.5; 2.1). 13С ЯМР (СDСl3): звено δ (положение углерода) А 164.8 (1), 126.5 (2), 139.2 (3), 34.4 (4), 75.5 (5), 39.2 (6), 12.9 (6-Me), 63.3 (7), 58.7 (8), 136.8 (9), 125.7 (10/14), 128.6 (11/13), 128.4 (12); D 175.1 (1), 69.2 (2), 43.2 (3), 24.3 (4), 21.2 (5), 23.2 (4-Me); С 175.4 (1), 51.9 (1-ОМе), 39.1 (2), 14.7 (2-Me), 41.6 (3); в 170.6 (1), 54.6 (2), 37.4 (3), 129.5 (4), 131.0 (5), 122.4 (6), 154,1 (7), 56.1 (7-OMe), 112.2 (8), 128.4 (9).
Криптофицин 6
[α] D +17.1o (МеОН, С 1.1); УФ λmax(ε) 206 (40,000), 218 (30,100), 228 (21,400), 282 (2,430); КД [θ]203 +37,700, [θ]210 -5,430, [θ]213 -1,260, [θ] 221 +24,100, [θ] 232 +8,480, [θ]240 +13,400, [θ]254 +790. ИК (СНСl3) νmax 3425, 3006, 2956, 1726, 1672, 1641, 1502, 1462, 1259 cm-1. MC с бомбардировкой быстрыми атомами (тиоглицерин) m/z, (относит. интенсивность) 573/575 (13/6) [M-H2O] +, 217 (26), 91 (100). 1H ЯМР (CDCl3): амино или гидроксикислотное звено δ (положение углерода, мультиплетность; J в Гц) 5,7,8-тригидрокси-6-метил-8-фенил-2-октеновая кислота (А) 5.92 (2, dt; 15.0 и 1.5),
6.94 (3, dt, 15 и 7.5), 2.51 (4, m), 2,64 (4, m), 3.97 (5, ddd; 9,3, 6.5 и 4.5), 2.03 (6, m), 1.10 (6-Me, d; 6.5), 3.70 (7, dd; 9.0 и 7.5), 4.64 (8, d; 7.5), 7.33-7.39 (10/11/13/14, m), 7.28 (12, tt; 6.5 и 2.0); 3-хлор-4-метоксифенилаланин (В) 4.60 (2, td; 8.0 и 6.0), 6.09 (2-NH, brd; 8.0), 2.96 (3, dd; 13.8 и 8.0), 3.02 (3, dd; 13.8 и 6.0), 7.22 (5, d; 2.0), 3.86 (7-ОСН3, s), 6.84 (8, d; 8.5), 7.07 (9, dd; 8.5 и 2.0) 3-амино-2-метилпропионовая кислота (С) 3.63 (1-ОСН3,s), 2.58 (2, m), 1.07 (2-Me, d; 7.0), 3.24 (3, ddd; 13.8, и 6.5), 3.41 (3, ddd; 13.8, 6.5 и 4.8), 6.21 (3-NH, brt; 6.5). 13С ЯМР (СDСl3): звено δ (положение углерода) A 165.2 (1), 125.6 (2), 141.3 (3), 36.9 (4), 82.5 (5), 46.3 (6), 14.3 (6-Me), 85.1 (7), 84.8 (8), 140.9 (9), 125.8 (10/14), 128.6 (11/13), 127.8 (12); В 170.6 (1), 54.5 (2), 37.3 (3), 129.6 (4), 131.0 (5), 122.5 (6), 154.1 (7), 56.1 (7-ОСН3), 112.2 (8), 128.5 (9) С 52.0 (1-ОСН3), 175.4 (1), 39.2 (2), 14.7 (2-Me), 41.6 (3).
Криптофицин 7
[α] D -51.9o (МеОН, с 0.89); УФ λmax(ε) 206 (23,400), 220 (14,900), 282 (1,670); КД [θ]202 +35,400, [θ]206 -1,730, [θ]211 -19,200, [θ]220 -15,800, [θ]232 +29,000, [θ]263 +2,040. ИК (СНСl3) νmax 3426, 2946, 1732, 1675, 1501, 1258 cm-1. EIMS m/z (относит. интенсивность) 455/457 (1/0.3, [M-2H2O]+), 105 (100), 77 (98); МС с бомбардировкой быстрыми атомами m/z (проведение испытаний в матрице) 496/498 [M-H2O+Na] +, (тиоглицериновая матрица) 474/476 [М-H2О+Н] +1H ЯМР (СО3ОD): амино или гидроксикислотное звено α (положение углерода, мультиплетность; J в Гц) 5,7,8-тригидрокси-6-метил-8-фенил-2-октеновая кислота) (А) 6.06 (2, ddd; 15.5, 1.3 и 1.0), 6.80 (3, dt; 15.5 и 7.5), 2.49 (4, m), 2.59 (4, m), 3.92 (5, ddd; 9.5, 6.3 и 4.7), 1,95 (6, m), 1.08 (6-Me, d; 6.7), 3.59 (7, dd; 9.0 и 7.8), 4.56 (8, d; 7.8), 7.37 (10/14, brd; 7.3), 7.31 (11/13, brt; 7.3), 7.24 (12, tt; 7.3 и 1.5); 3-хлор-4-метоксифенилаланин (В) 4.52 (2, dd; 6.9 и 5.0), 2.93 (3, dd; 13.8 и 6.9), 3.15 (3, dd; 13.8 и 5.0), 7.20 (5, d; 2.2), 3.78 (7-ОСН3,s), 6.88 (8, d; 8.4), 7.08 (9, dd; 8.4 и 2.2). 13С ЯМР (СО3OD): звено δ (положение углерода) А 167.4 (1), 127.6 (2), 140.9 (3), 37.9 (4), 84.0 (5), 47.6 (6), 14.4 (6-Me), 86.0 (7), 85.8 (8), 142.9 (9), 127.1 (10/14), 129.3 (11/13), 128.5 (12); В 177.6 (1), 57.3 (2), 38.2 (3), 132.8 (4), 132.1 (5), 122.9 (6), 155.0 (7), 56.5 (7-ОСН3), 113.2 (8), 130.1 (9).
Криптофицин 16
[α] D -41.3o (МеОН, с 5,2); УФ λmax(ε) 242 (4963), 280 (2430), 286 (2212), ИК (чистое вещество) νmax 3402, 3270, 2960, 1748, 1724, 1676, 1514, 1466, 1343, 1239, 1177 cm-1; EIMS m/z (относит. интенсивность) 640/642 (66/27), 398/400 (47/16), 265 (55), 227 (93), 181 (100); высокое разрешение EIMS m/z 640.25676 (рассчитано для C34H41ClN2O8, -1.6 mmu ошибка). 1H ЯМР (CDCl3): амино или гидроксикислотное звено δ (положение углерода, мультиплетность; J в Гц) 7,8-эпокси-6-гидрокси-6-метил-8-фенил-2-октеновая кислота (А) 5.74 (2, d; 16), 6.67 (3, add; 15.3, 9.7 и 5.5), 2.45 (4, dt; 14.3 и 10.4), 2.55 (4, brdd; 14.3 и 5.3), 5.15 (5, ddd; 11.2, 4.8 и 1.8), 1.8 (6, m), 1.14 (6-Me, d; 7.0), 2.92 (7, dd; 7.5 и 2.0), 3.69 (8, d; 2.0), 7.24-7.26 (10/14, m), 7.33-7.39 (11/12/13, m); 3-хлор-4-гидроксифенилаланин (В) 4.8 (2, m), 5.64 (2-NH, d; 8.8), 3.03 (3, dd; 14.5 и 7.0), 3.11 (3, dd; 14.4 и 5.6), 7.17 (5, d; 2.2), 5.61 (7-OH, s), 6.91 (8, d; 8.3), 7.0 (9, dd; 8.3 и 2.2); 3-амино-2-метилпропионовая кислота (С) 2.71 (2, m), 1.22 (2-Me, d; 7.3), 3.28 (3, dt; 13.6 и 6.8), 3.49 (3, ddd; 13.6, 5 и 4.1), 6.92 (3-NH, br t; 6.1); лейциновая кислота (D) 4.83 (2, dd; 10.1 и 3.3), 1.36 (3, m), 1.67-1.75 (3, m), 1,67-1.75 (4, m), 0.85 (5, d; 7.5), 0.86 (4-Me, d; 6.8). 13С ЯМР (CDCl3) звено δ (положение углерода) А 165.3 (1), 125.3 (2), 141.0 (3), 36.7 (4), 76.2 (5), 40.6 (6), 13.5 (6-Me), 63.0 (7), 59.0 (8), 136.8 (9), 125.6 (10/14), 128.7 (11/13), 128.6 (12); В 170.9 (1), 53.6 (2), 35.1 (3), 129.9 (4), 129.6 (5), 120.0 (6), 150.4 (7), 116.4 (8), 129.2 (9); С 175.6 (1), 38.3 (2), 14.1 (2-Me), 41.1 (3), D 170.8 (1), 71.3 (2), 39.4 (3), 24.6 (4), 21.3 (5), 22.9 (4-Me).
Криптофицин 17
[α] D -27.8o (СНСl3 с. 0.37); УФ λmax(ε) 248 (14740), 268 (8100), 278 (3400), 284 (2840); ИК (чистое вещество) νmax 3412, 2958, 1750, 1723, 1668, 1504, 1463, 1290, 1177, 751 cm-1; EIMS m/z (относит. интенсивность) 624/626 (10/3), 398/400 (95/35), 284 (100), 149 (95); высокое разрешение EIMS m/z 624.26161 (рассчитано для C34H41ClN2O7, -1.4 mmu ошибка). 1Н ЯМР (CDCl3): амино или гидроксикислотное звено δ (положение углерода, мультиплетность; J в Гц) 5-гидрокси-6-метил-8-фенил-2,7-октадиеновая кислота (А) 5.77 (2, d; 15.4), 6.67 (3, ddd; 15.4, 9,5 и 5.3), 2.37 (4, m), 4.99 (5, ddd; 11.2, 6.3 и 1.6), 2.54 (6, m), 1.14 (6-Me, d; 6.7), 6.01 (7, dd; 15,7, и 8,7), 6.41 (8, d; 15.9), 7.28-7.34 (10/11/13/14, m), 7.23 (12, m); 3-хлор-4-гидроксифенилаланин (В) 4.82 (2, m), 5.63 (2-NH, d; 8.7), 3.12 (3, dd; 14.7 и 5.6), 3.03 (3', dd; 14.7, и 7.1), 7.18 (5, d; 2.0), 5.47 (7-OH, br s), 6.91 (8, d; 8.3), 7.02 (9, dd; 8.3 и 2.0); 3-амино-2-метилпропионовая кислота (С) 2.71 (2, m), 1.21 (2-Me, d' 6.9), 3.25 (3, m), 3.52 (3', m), 6.89 (3-NH, br t; 6.1); лейциновая кислота (D) 4.84 (2, dd; 9.6 и 3.1), 1.62 (3, m), 1,36 (3', m), 1.62 (4, m), 0.77 (5, d' 6.5), 0.73 (4-Me, d; 6.5); 13С ЯМР (СDСl3) звено δ (положение углерода) А 165.4 (1), 125.3 (2), 141.3 (3), 36.5 (4), 77.1 (5), 42.3 (6), 17.3 (6-Ме), 130.0 (7), 129.9 (8), 136.7 (9), 126.2 (10/14), 128.6 (11/13), 127.6 (12); В 170,9 (1), 53.5 (2), 35.1 (3), 129.6 (4), 131.9 (5), 126.2 (6), 150.3 (7), 116.3 (8), 127.6 (9); С 175.9 (1), 38.4 (2), 13.9 (2-Me), 41.3 (3); D 170.9 (1), 71.6 (2), 39.5 (3), 24.5 (4), 21.2 (5), 22.7 (4-Me).
Криптофицин 18
[α] D +54.9o (МеОН, с 0,93); УФ λmax(ε) 250 (20518), 284 (3857); ИК (чистое вещество) νmax 3411, 3271, 2966, 1746, 1728, 1668, 1505, 1463, 1258, 1178 cm-1; EIMS m/z (относит. интенсивность) 638/640 (4.5/1.1), 412/414 (59/19), 280 (17), 227 (100); высокое разрешение EIMS m/z 638.272934 (рассчитано для C35H43ClN2O7, 2.9 mmu ошибка). 1H ЯМР (CDCl3): амино или гидроксикислотное звено δ (положение углерода, мультиплетность; J в Гц) 5-гидрокси-6-метил-8-фенил-2,7-октадиеновая кислота (А) 5.76 (2, d; 15.5), 6.65 (3, ddd; 15.4, 9.2 и 6.2), 2.38-2.47 (4, m), 5.08 (5, ddd; 10.6, 4.9 и 2.2), 2.58 (6, m), 1.15 (6-Me, d; 6.8), 6.07 (7, dd; 15.9 и 8.5), 6.43 (8, d; 15.9), 7.21-7.35 (10/11/12/13/14, m); 3-хлор-4-метоксифенилаланин (В) 4.83 (2, m), 3.05 (3, dd; 14.5 и 7.1), 5.65 (2-NH, d; 8.7), 3.14 (3, dd; 14.4 и 5.5), 7.21 (5, d; 2.4), 3.86 (7-ОСН3, s), 6.83 (8, d; 8.3), 7.08 (9, dd; 8.3 и 2.2); 3-амино-2-метилпропионовая кислота (С) 2.73 (2, m), 1.23 (2-Me, d; 7.2), 3.23 (3, dt; 13.5 и 6.8), 3.56 (3, ddd; 13.5, 5.7 и 4.0), 6.85 (3-NH, dd; 7.1 и 6.2); лейциновая кислота (D) 4.8 (2, d; 4.6), 1.86-1.89 (3, m), 0.94 (3-Me, d; 7.0), 1.20-1.26 (4, m), 1.39-1.44 (4, m), 0.77 (5, d; 7.4), 13С ЯМР (CDCl3) звено δ (положение углерода) А 165.5 (1), 125.2 (2), 141.5 (3), 36.4 (4), 77,7 (5), 41.9 (6), 17.1 (6-Me), 129.8 (7), 131.9 (8), 136.8 (9), 128.6 (10/14), 126.2 (11/13), 127.6 (12); В 170.0 (1), 53,5 (2), 35.1 (3), 129.9 (4), 131.1 (5), 122.4 (6), 153.9 (7), 56.1 (7-ОСН3), 112.2 (8), 128.5 (9); С 175.3 (1), 38.6 (2), 14.0 (2-Me), 41.4 (3); D 169.5 (1), 76.6 (2), 36.2 (3), 15.5 (3-Me), 24.2 (4), 14.0 (5).
Криптофицин 19
[α] D +62.6o (МеОН, с 0.67); УФ (МеОН) λmax(ε) 204 (44900), 230 (17000), 248 (15600), 280 (2500); ИК (чистое вещество) νmax 3413, 3272, 2966, 1745, 1726, 1672, 1504, 1258, 1199, 1178, 1066, 692 cm-1; EIMS m/z (относит. интенсивность) 624/626 (3.0/1.4), 398/400 (58/21), 280/282(15/5), 227 (100), 195/197 (57/22); высокое разрешение EIMS m/z 624.2585 (рассчитано для С34Н41СlN2O7, -1.8 mmu ошибка). 1Н ЯМР (CDCl3): амино или гидроксикислотное звено δ (положение углерода, мультиплетность; J в Гц) 5-гидрокси-6-метил-8-фенил-2,7-октадиеновая кислота (А) 5.76 (2, d; 15.2), 6.64 (3, ddd; 15.4, 9.1 и 6.2), 2.38 (4, m), 2.47 (4, m), 5.04 (5, ddd; 7.1, 5.1 и 1.8), 2.57 (6, m), 1.15 (6-Me, d; 6.9), 6.05 (7, dd; 15.8 и 8.5), 6.43 (8, d; 15.8), 7.29-7.35 (10/11/13/14, m), 7.23 (12, m); 3-хлор-4-метоксифенилаланин (В) 4.84 (2, m), 5.67 (2-NH, d; 8.9), 3.04 (3, dd; 14.3 и 7.1), 3.14 (3, dd; 14.3 и 5.3), 7.22 (5, d; 2.0), 3.86 (7-ОСН3,s), 6.83 (8, d; 8.2), 7.08 (9, dd; 8.2 и 2.0); 3-амино-2-метилпропионовая кислота (С) 2.75 (2, m), 1.23 (2-Me, d; 7.1), 3.19 (3, m), 3.59 (3, m), 6.80 (3-NH, brt; 6.7); 2-гидроксиизовалерьяновая кислота (D) 4.73 (2, d; 4.2), 2.09 (3, m), 0.84 (4, d; 6.9), 0.95 (3-Me, d; 6.9). 13С ЯМР (CDCl3) звено δ (положение углерода) А 165.5 (1), 125.3 (2), 141.3 (3), 36.3 (4), 77.7 (5), 42.0 (6), 17.1 (6-Me), 129.9 (7), 131.9 (8), 136.8 (9), 126.1 (10/14), 128.6 (11/13), 127.6 (12); В 171.0 (1), 53.4 (2), 35.1 (3), 130.0 (4), 131.1 (5), 122.4 (6), 153.9 (7), 56.1 (7-ОМе), 112.2 (8), 128,5 (9); С 175.1 (1), 38.7 (2), 13.9 (2-Me), 41.5 (3); D 169.6 (1), 76.9 (2), 29.8 (3), 19.0 (4), 16.7 (3-Me).
Криптофицин 21
[α] +40.2o (СНСl3 с 0.72); УФ (МеОН) λmax(ε) 240 (6700), 280 (2400), 288 (2100); ИК (чистое вещество) νmax 3403, 3279, 2957, 1731, 1673, 1503, 1464, 1409, 1372, 1258, 1174, 1065, 1023, 889 cm-1; EIMS m/z (относит. интенсивность) 640/642 (10/4), 612 (5), 478 (15), 398 (40), 266 (33), 227 (76), 195 (95), 155 (100), 127 (90); высокое разрешение EIMS m/z 640.2550 (рассчитано для С34Н41СlN2O8, -0.2 mmu ошибка). 1H ЯМР (CDCl3): амино или гидроксикислотное звено δ (положение углерода, мультиплетность; J в Гц) 7,8-эпокси-5-гидрокси-6-метил-8-фенилоктановая кислота (А) 5.73 (2, d; 15.4), 6.68 (3, ddd; 15.0, 9.9 и 4.9), 2.45 (4, m), 2.56 (4, m), 5.19 (5, ddd; 11.2, 5.1 и 1.5), 1.80 (6, m), 1.14 (6-Me, d; 7.1), 2.92 (7, dd; 7.5 и 2.0), 3.68 (8, d; 1.8), 7.25 (10/14, m), 7.33-7.38 (11/12/13, m); 3-хлор-4-метоксифенилаланин (В) 4.74 (2, ddd; 8.2, 6.8 и 6.2), 5.68 (2-NH, d; 8.6), 2.98 (3, dd; 14.3 и 7.7), 3.14 (3, dd; 14.3, и 5.6), 7.21 (5, d; 2.0), 3.86 (7-OMe, s), 6.83 (8, d; 8.4), 7.07 (9, dd; 8.4 и 2.0); 3-аминопропионовая кислота (С) 2.56 (2, m), 3.51 (3, m), 3.45 (3, m), 6.90 (3-NH, br t; 5.8); лейциновая кислота (D) 4.89 (2, dd; 10.0 и 3.3), 1.67 (3, m), 1.31 (3, m), 1.67 (4, m), 0.84 (5, d; 6.4), 0,83 (4-Me, d; 6.4); 13С ЯМР (CDCl3) звено δ (положение углерода) А 165.5 (1), 125.3 (2), 141.0 (3), 36.7 (4), 75.9 (5), 40.6 (6), 13.5 (6-Ме), 63.0 (7), 59.0 (8), 136.7 (9), 125.6 (10/14), 128.7 (11/13), 128.5 (12); В 170.7 (1), 53.9 (2), 35.0 (3), 129.8 (4), 130.9 (5), 122,4 (6), 153.9 (7), 56.1 (7-OMe), 112.2 (8), 128.3 (9); С 172.6 (1), 32.4 (2), 34.4 (3); D 170.5 (1), 71.2 (2), 39.5 (3), 24.4 (4), 22.8 (5), 21.2 (4-Me).
Криптофицин 23
[α]D +47o (МеОН, с 1.55); УФ λmax(ε) 240 (4571), 282 (2174), 290 (2177); ИК (чистое вещество) νmax 3284, 2960, 1747, 1724, 1653, 1540, 1490, 1339, 1272, 1174 cm-1; EIMS m/z (относит. интенсивность) 674/675/678 (47/35/8), 432/434/436 (11/5/2), 299/301/303 (39/30/7), 227 (64), 215/217/219 (31/20/8), 141 (100); высокое разрешение EIMS m/z 674.21643 (рассчитано для С34H4Сl2N2О8, -0.3 mmu ошибка). 1H ЯМР (СDСl3): амино или гидроксикислотное звено δ (положение углерода, мультиплетность; J в Гц) 7,8-эпокси-5-гидрокси-6-метил-8-фенил-2-октеновая кислота (А) 5.77 (2, d; 15.4), 6.65 (3, ddd; 15.4, 9.3 и 6.0), 2.47 (4, dt; 14.2 и 10.2), 2.55 (4, br dd; 14.2 и 5.6), 5.13 (5, ddd; 11.0, 4.6 и 1.6), 1.81 (6, m), 1.15 (6-Me, d; 6.9), 2.93 (7, dd; 7.6 и 2.0), 3.7 (8, d; 2.0), 7.22-7.26 (10/14, m), 7.32-7.39 (11/12/13, m); 3,5-дихлор-4-гидроксифенилаланин (В) 4.81 (2, m), 5.69 (2-NH, d; 8.6), 3.11 (3, dd; 14.5 и 5.6), 3.50 (3, dd; 14.3 и 7.0), 7.13 (5/9, s), 5.78 (7-ОН, s), 3-амино-2-метилпропионовая кислота (С) 2.73 (2, m), 1.22 (2-Me, d; 7.1), 3.19 (3, dt; 13.4 и 6.9), 3.58 (3, ddd; 13.6, 5.8 и 4.1), 6.82 (3-NH, br t; 5.9); лейциновая кислота (D) 4.84 (2, dd; 9.9 и 3.2), 1.38 (3, m), 1.68-1.75 (3, m), 1.68-1.75 (4, m), 0.86 (4-Me, d; 6.7), 0.87 (5, d; 6.7). 13С ЯМР (CDCl3) звено δ (положение углерода) А 165.4 (1), 125.4 (2), 140.9 (3), 36.7 (4), 76,3 (5), 40.6 (6), 13.5 (6-Me), 63.0 (7), 58.9 (8), 136.7 (9), 125.6 (10/14), 128.7 (11/13), 128.6 (12); В 170.7 (1), 53.3 (2), 35.0 (3), 130.3 (4), 129.0 (5/9), 121.0 (6/8), 146.7 (7); С 175.3 (1), 38.4 (2), 13.9 (2-Me), 41.5 (3); D 170.8 (1), 71.3 (2), 39.4 (3), 24.6 (4), 21.3 (4-Me), 22.9 (5).
Криптофицин 24
[α] D +48.8o (СНСl3, с 0.63); УФ λmax(ε) 228 (19006), 242 (8249), 274 (2351); ИК (чистое вещество) νmax 3400, 3284, 2959, 1732, 1678, 1652, 1514, 1248, 1178 cm-1; EIMS m/z (относит. интенсивность, отнесение) 606 (2, М+), 364 (7), 161 (55, СН3О-С6Н4-СН=CН=СО+), 121 (100, CH3O-C6H4-CH2 +), 91 (68); высокое разрешение EIMS m/z 606.2954 (рассчитано для С34Н42N2O8, -1.3 mmu ошибка); 1H ЯМР (CDCl3): амино или гидроксикислотное звено δ (положение углерода, мультиплетность; J в Гц) 7,8-эпокси-5-гидрокси-6-метил-8-фенил-2-октеновая кислота (А) 5.70 (2, dd; 15.2 и 1.3), 6.70 (3, ddd; 15.2, 10.3 и 4.7), 2.43 (4, dt; 14.3 и 10.9), 2.56 (4, m), 5.20 (5, ddd; 11.3, 5.1 и 2.0), 1.79 (6, m), 1.14 (6-Me, d; 7.0), 2.92 (7, dd; 7.5 и 2.0), 3.68 (8, d; 2.0), 7.23-7.38 (10/11/12/13/14, m); O-метилтирозин (В) 4.73 (2, m), 5.58 (2-NH, d; 8.3), 3.03 (3, dd; 14.5 и 7.5), 3.14 (3, dd; 14.5 и 5.7), 7.11 (5/9, d; 8.6), 6.81 (6/8, d; 8.6), 3,78 (7-OMe, s); 3-аминопропионовая кислота (С) 2.55 (2-Н2, m), 3.42 (3, m), 3.53 (3, m) 6.97 (3-NH, br t; 5.7); лейциновая кислота (D) 4.89 (2, dd; 9.9 и 3.5), 1.29 (3, m), 1.62-1.70 (3/4, m), 0.83 (5, d; 5.9), 0.84 (4-Me, d; 6.1); 13С ЯМР (CDCl3) звено 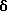 (положение углерода) A 165.4 (1), 125.3 (2), 141.0 (3), 36.7 (4), 75.9 (5), 40.6 (6), 13.4 (6-Me), 63.0 (7), 59.0 (8), 136.7 (9), 125.6 (10/14), 128.7 (11/13), 128.5 (12); В 170.7 или 170.6 (1), 54.1 (2), 35.2 (3), 128.5 (4), 130.2 (5/9), 114.1 (6/8), 158.6 (7), 55.2 (7-ОМе); С 172.8 (1), 32.5 (2), 34.2 (3); D 170.6 или 170.7 (1), 71.2 (2), 39.5 (3), 24.4 (4), 21.3 (5), 22.8 (4-Me).
(положение углерода) A 165.4 (1), 125.3 (2), 141.0 (3), 36.7 (4), 75.9 (5), 40.6 (6), 13.4 (6-Me), 63.0 (7), 59.0 (8), 136.7 (9), 125.6 (10/14), 128.7 (11/13), 128.5 (12); В 170.7 или 170.6 (1), 54.1 (2), 35.2 (3), 128.5 (4), 130.2 (5/9), 114.1 (6/8), 158.6 (7), 55.2 (7-ОМе); С 172.8 (1), 32.5 (2), 34.2 (3); D 170.6 или 170.7 (1), 71.2 (2), 39.5 (3), 24.4 (4), 21.3 (5), 22.8 (4-Me).
Криптофицин 26
[α] D +28.2o (СНСl3, с 1.31); УФ λmax(ε) 254 (14615), 284 (2949), ИК (чистое вещество) νmax 3299, 2960, 1732, 1644, 1504, 1258, 1209 cm-1; EIMS m/z (относит. интенсивность) 656/658 (0.5/0.1, М+), 638/640 (1.7/1.0), 525/527 (3.7/1.8), 412/414 (10/4), 280/282 (12/11), 227 (20), 195 (48), 131 (68); высокое разрешение EIMS m/z 656.2836 (рассчитано для C35H45ClN2O8, 2.8 mmu ошибка); 638.2712 (рассчитано для C35H43ClN2O7, 4.7 mmu ошибка); 1H ЯМР (CDCl3): амино или гидроксикислотное звено δ (положение углерода, мультиплетность; J в Гц) 3,5-дигидрокси-6-метил-8-фенил-7-октеновая кислота (A) 2.46 (2, dd; 14.8 и 7.8), 2,58 (2, dd; 14.8 и 3.0), 5.46 (3, m), 1.86-1.90 (4-Н2, m), 3.61 (5, m), 2.37 (6, m), 1.14 (6-Me, d; 6.8), 6.06 (7, dd; 16 и 8.7), 6.47 (8, d; 16), 7.37 (10/14, br d; 7.9), 7.32 (11/13, br t; 7.6), 77.22-7.28 (12, m); 3-хлор-4-метилоксифенилаланин (В) 4.73 (2, br dt; 6.4 и 8.1), 6.14 (2-NH, d; 8.6), 2.84 (3, dd; 14.4 и 8), 3.18 (3, dd; 14.4 и 6.3), 7.21 (5, d; 2.2), 3.85 (7-OMe, s), 6.82 (8, d; 8.6), 7.08 (9, dd; 8.6 и 2.2); 3-амино-2-метилпропионовая кислота (С) 2.87 (2, m), 1.19 (2-Me, d; 7.0), 3.01 (3, ddd; 13.4, 10.6 и 4.9), 3.73 (3, ddd; 13.4, 8,2 и 4.7), 6.72 (3-NH, br dd; 7.3 и 5.2); лейциновая кислота (D) 4.95 (2, dd; 9.7 и 4.2), 1.62-1.72 (3, m), 1.79-1.84 (3, m), 1.62-1.72 (4, m), 0.90 (4-Me, d; 6.4), 0.95 (5, d; 6.4). 13С ЯМР (CDCl3) звено δ (положение углерода) А 170.0 (1), 41.5 (2), 71.4 (3), 37.3 (4), 71.9 или 71.8 (5), 43.6 (6), 16.6 (6-Ме), 130.8 (7), 132.5 (8), 136.8 (9), 126.2 (10/14), 128.6 (11/13), 127.6 (12); В 170.9 (1), 53,2 (2), 34.7 (3), 130.3 (4), 131.1 (5), 122.2 (6), 153.8 (7), 56.1 (7-OMe), 112.2 (8), 128.5 (9); С 174.3 (1), 40.1 (2), 14.4 (2-Me), 42.5 (3); D 170.7 (1), 71.8 или 71.9 (2), 38.9 (3), 24.6 (4), 21.6 (4-Me), 22.9 (5).
Криптофицин 28
[α] D +65.6o (МеОН, с 0.93); УФ (МеОН) λmax(ε) 204 (48000), 230 (19300), 248 (18700), 280 (3400); ИК (чистое вещество) νmax 3413, 3270, 2958, 1745, 1726, 1665, 1504, 1258, 1197, 1175, 1066, 694 cm-1; EIMS m/z (относит. интенсивность) 624/626 (3.0/1.3), 412/414 (70/24), 280/282 (13/6), 213 (100), 195/197 (86/40); высокое разрешение EIMS m/z 624.2626 (рассчитано для C34H41ClN2O7, - 2.4 mmu ошибка); 1Н ЯМР (СDСl3): амино или гидроксикислотное звено δ (положение углерода, мультиплетность; J в Гц) 5-гидрокси-8-фенил-2,7-октадиеновая кислота (А) 5.78 (2, d; 15.6), 6.71 (3, ddd; 15.6, 9.9 и 5.4), 2.40 (4, m), 2.53 (4, m), 5.17 (5, m), 2.53 (6-H2, br t; 6.7), 6.07 (7, dt; 15.8 и 7.4), 6.44 (8, d; 15.8), 7.27-7.38 (10/11/13/14, m) 7.22 (12, m); 3-хлор-4-метоксифенилаланин (В) 4.82 (2, m), 5.72 (2-NH, d; 8.5), 3.04 (3, dd; 14.5 и 7.2), 3.14 (3, dd; 14.5 и 5.4), 7.22 (5, d; 2.0), 3.87 (7-OMe, s), 6.84 (8, d; 8.5), 7.08 (9, dd; 8.5 и 2.0); 3-амино-2-метилпропионовая кислота (С) 2.72 (2, m), 1.21 (2-Me, d; 7.2), 3.29 (3, dt; 13.5 и 7.0), 3.49 (3, ddd; 13.5, 4.9 и 3.8), 6.97 (3-NH, br t; 5.6); лейциновая кислота (D) 4.82 (2, m), 1.40 (3, m), 1.62 (3, m), 1.62 (4, m), 0.76 (4-Me, d; 6.3), 0.74 (5, d; 6.3); 13С ЯМР (СDСl3) звено δ (положение углерода) А 165.4 (1), 125.2 (2), 141.2 (3), 38.5 (4), 73.5 (5), 38.6 (6), 124.1 (7), 133.8 (8), 136.7 (9), 126.1 (10/14), 128.6 (11/13), 127.6 (12); B 170.9 (1), 53.6 (2), 35.1 (3), 129.8 (4), 131.0 (5), 122.4 (6), 154.0 (7), 56.1 (7-OMe), 112.3 (8), 128.4 (9); С 175.6 (1), 38.3 (2), 14.0 (2-Me), 41.2 (3); D 170.9 (1), 71.6 (2), 39.6 (3), 24.5 (4), 21.5 (4-Me), 22.6 (5).
Криптофицин 29
[α] D +22.2o (СНСl3, с 1.13); Уф λmax(ε) 250 (17000), 284 (3300); ИК (чистое вещество) νmax 3415, 3272, 2960, 1744, 1734, 1674, 1504, 1259, 1197, 1174, 1067, 694 cm-1; EIMS m/z (относит. интенсивность) 624/626 (2.6/1.1), 398/400 (44/15), 227 (100), 195/197 (50/16), 155/157 (59/20), 131 (63), 91 (95); высокое разрешение EIMS m/z 624.2607 (рассчитано для C34H41ClN2O7, - 0.5 mmu ошибка); 1H ЯМР (CDCl3): амино или гидроксикислотное звено δ (положение углерода, мультиплетность; J в Гц) 5-гидрокси-6-метил-8-фенил-2,7-октадиеновая кислота (А) 5.75 (2, dd; 15.3 и 1.1), 6.69 (3, ddd; 15.3, 10.1 и 5.3), 2.36 (4, m), 2.54 (4, m), 5.03 (5, ddd; 11.0, 6.4 и 1.8), 2.56 (6, m), 1.14 (6-Me, d; 6.8), 6.01 (7, dd; 15,8 и 8.8), 6.41 (8, d; 15.8), 7.28-7.33 (10/11/13/14, m), 7.22 (12, m); 3-хлор-4-метоксифенилаланин (В) 4.76 (2, m), 5.67 (2-NH, d; 8.6), 3.0 (3, dd; 14.4 и 10.2), 3.14 (3, dd; 14.4 и 5.9), 7.22 (5, d; 2.2), 3.87 (7-OMe, s), 6.83 (8, d; 8.4), 7.08 (9, dd; 8.4 и 2.2); 3-аминопропионовая кислота (С) 2.55 (2-H2, m), 3.44 (3, m), 3.55 (3, m), 6.89 (3-NH, br t; 5.7); лейциновая кислота (D) 4.90 (2, dd; 9.9 и 3.5), 1.34 (3, ddd; 15.4, 10.3 и 3.5), 1.63 (3, m), 1.63 (4, m), 0.76 (4-Ме, d; 6.4), 0.72 (5, d; 6.4); 13С ЯМР (СDСl3) звено δ (положение углерода) А 165.6 (1), 125.2 (2), 141.5 (3), 36.4 (4), 77.1 (5), 42.3 (6), 17.3 (6-Me), 130.1 (7), 131.8 (8), 136.7 (9), 126.2 (10/14), 128.6 (11/13), 127,6 (12); В 170.9 (1), 53.8 (2), 34.9 (3), 129.9 (4), 131.0 (5), 122.4 (6), 153.9 (7), 56.1 (7-ОМе), 112.2 (8), 128.4 (9); С 172.6 (1), 32.4 (2), 34.5 (3); D 170.4 (1), 71.5 (2), 39.7 (3), 24.4 (4), 21.2 (4-Ме), 22.6 (5).
Криптофицин 30
[α] D -12.3o (СНСl3, с 1.53); УФ λmax(ε) 254 (17200), 284 (3600); ИК (чистое вещество) νmax 3414, 3306, 2961, 1738, 1729, 1660, 1504, 1258, 1205, 1183, 1066, 695 cm-1; EIMS m/z (относит. интенсивность) 656/658 (1.0/0.3), 638/640 (3.0/1/0), 525/527 (3.8/1.3), 412/414 (10.5/3.6), 280/282 (10.3/3.8), 227 (29), 195/197 (48/17), 155/157 (74/21), 131 (100); высокое разрешение EIMS m/z 656.2852 (рассчитано для С35Н45СlN2O8, 1.5 mmu ошибка); 1H ЯМР (СDСl3): амино или гидроксикислотное звено δ (положение углерода, мультиплетность; J в Гц) 3,5-дигидрокси-6-метил-8-фенил-7-октеновая кислота (А) 2.25 (2, dd; 16.0 и 9.6), 2.64 (2, brd; 16.0), 3.89 (3, m), 2.51 (3-ОН, d; 6.4), 1.77 (4, ddd; 14.3, 9.8 и 2.1), 1.88 (4, ddd; 14.3, 11.3 и 3.8), 4.88 (5, ddd; 11.3, 6.2 и 2.1), 2.53 (6, m), 1.10 (6-Me, d; 6.8), 5.99 (7, dd; 15.9 и 9.0), 6.40
(8, d; 15,9), 7.28-7.33 (10/11/13/14, m), 7.23 (12, т); 3-хлор-4-метоксифенилаланин (В) 4.60 (2, m), 6.61 (2-NH, d; 8.1), 3.09 (3, dd; 14.2 и 5.6), 3.15 (3, dd; 14.2 и 7.3), 7.22 (5, d; 2.1), 3.86 (7-OMe, s), 6.83 (8, d; 8.3), 7.07 (9, dd; 8.3 и 2.1); 3-амино-2-метилпропионовая кислота (С) 2.67 (2, m), 1.21 (2-Me, d; 7.3), 3.26 (3, ddd; 13,6, 7.3 и 6.4), 3.63 (3, ddd; 13.6, 6.2 и 3.9), 6.75 (3-NH, br t; 6.3); лейциновая кислота (D) 4.83 (2, dd; 9.6 и 4.1), 1.42 (3, m), 1.64 (3, m), 1.64 (4, m), 0.79 (4-Me, d; 6.4) 0.76 (5, d; 6.4); 13С ЯМР (CDCl3) звено δ (положение углерода) А 171.6 (1), 42.4 (2), 66.0 (3), 41.3 (4), 76.0 (5), 42.0 (6), 17.3 (6-Ме), 130.0 (7), 131.9 (8), 136.7 (9), 126.1 (10/14), 128.6 (11/13), 127.6 (12); В 170.8 (1), 54.3 (2), 35.1 (3), 130.1 (4), 131.1 (5), 122.2 (6), 153.8 (7), 56.1 (7-OMe), 112.1 (8), 128.7 (9); С 175.6 (1), 39.7 (2), 13.8 (2-Me), 41,5 (3); D 171.9 (1), 72.1 (2), 39.1 (3), 24.6 (4), 21.4 (4-Me), 22.7 (5).
Криптофицин 31
[α]D +50.6o (МеОН, с 1.13); УФ λmax(ε) 242 (3800), 284 (700); ИК (чистое вещество) νmax 3412, 3272, 2961, 1745, 1725, 1678, 1537, 1481, 1270, 1196, 1176, 1000, 698 cm-1; EIMS m/z (относит. интенсивность) 688/690 (1.2/1.0/0.4), 446/448/450 (7.9/6.7/3.1), 314/316/318 (17/11/3), 91 (100); высокое разрешение EIMS m/z 688.2336 (рассчитано для C35H42Cl2N2O8, -1.8 mmu ошибка); 1H ЯМР (СDСl3): амино или гидроксикислотное звено δ (положение углерода, мультиплетность; J в Гц) 7.8-эпокси-5-гидрокси-6-метил-8-фенил-2-октеновая кислота (А) 5.78 (2, d; 15.5), 6.66 (3, ddd; 15.5, 9.4 и 6.0), 2.47 (4, ddd; 14.1, 10.8 и 9.4), 2.56 (4, m), 5.14 (5, ddd; 10.8, 4.7 и 1.7), 1.82 (6, m), 1.15 (6-Me, d; 7.1), 2,93 (7, dd; 7.5 и 1.9), 3.70 (8, d; 1.9), 7.24-7.26 (10/14, m), 7.34-7.39 (11/12/13, m); 3,5-дихлор-4-метоксифенилаланин (В) 4.83 (2, m), 5.68 (2-NH, d; 9.0), 3.0 (3, dd; 14.4 и 7.3), 3.14 (3, dd; 14.4 и 5.6), 7.16 (5/9, s), 3.87 (7-OMe, s); 3-амино-2-метилпропионовая кислота (С) 2.74 (2, m), 1.22 (2-Me, d; 7.1), 3.20 (3, m), 3.58 (3, ddd; 13.5, 5.6 и 4.1), 6.82 (3-NH, br t; 5.6); лейциновая кислота (D) 4.83 (2, m), 1.38 (3, m), 1.72 (3, m), 1.72 (4, m), 0.87 (4-Me, d; 6.8), 0.86 (5, d; 6.8); 13С ЯМР (CDCl3) звено δ (положение углерода) А 165.4 (1), 125.4 (2), 141.0 (3), 36.7 (4), 76.3 (5), 40.6 (6), 13.5 (6-Me), 63.0 (7), 58.9 (8), 136.7 (9), 125.6 (10/14), 128.7 (11/13), 128.6 (12); В 170.8 (1), 53.3 (2), 35.2 (3), 129.3 (4), 129.6 (5/9), 134.5 (6/8), 151.2 (7), 60.6 (7-OMe); С 175.3 (1), 38.3 (2), 13.9 (2-СН3), 41.5 (3); D 170.6 (1), 71.3 (2), 39.4 (3), 24.6 (4), 22.9 (4-Ме), 21.3(5).
Криптофицин 40
[α] D +41.6o (СНСl3, С 0.31); УФ λmax(ε) 242 (4974), 266 (3911), 274 (3666), 286 (2359), 328 (511); ИК (чистое вещество) νmax 3415, 2959, 1748, 1723, 1667, 1505, 1463, 1289, 1176 cm-1; EIMS m/z (относит. интенсивность) 640/642 (5/2), 280/282 (7/3), 213 (13), 195/197 (51/17), 155 (29), 141 (32), 121 (28), 91 (100), 69 (47); высокое разрешение EIMS m/z 640.2570 (рассчитано для C34H41ClN2O8, -1.8 mmu ошибка); 1H ЯМР (СDСl3): амино или гидроксикислотное звено δ (положение углерода, мультиплетность; J в Гц) 7,8-эпокси-5-гидрокси-8-фенил-2-октеновая кислота (А) 5.77 (2, d; 15.1), 6.72 (3, ddd; 15.1, 9.7 и 4.9), 2.42 (4, m), 2.58 (4, m), 5.33 (5, m), 1.89 (6, ddd; 12.9, 8.1 и 5.0), 2.13 (6, ddd; 12.9, 9.3 и 5.0), 2.98 (7, ddd; 6.7, 4.5 и 1.9), 3.64 (8, d; 1.9), 7.31-7.39 (10/11/13/14, m) 7.22 (12, m); 3-хлор-4-метоксифенилаланин (В) 4.83 (2, m), 5.64 (2-NH, d; 8.6), 3.03 (3, dd; 14.3 и 7.5), 3.14 (3, dd; 14.3 и 5.4), 7.21 (5, d; 2.0), 3.87 (7-OMe, s), 6.84 (8, d; 8.3), 7.08 (9, dd; 8.3 и 2.0); 3-амино-2-метилпропионовая кислота (С) 2.72 (2, m), 1.23 (2-Me, d; 7.3), 3.31 (3, dt; 13.8 и 6.9), 3.50 (3, ddd; 13.6, 5.7 и 3.9), 6.96 (3-NH, br t; 6.0); лейциновая кислота (D) 4,85 (2, dd; 6.7 и 3.4), 1.42 (3, m), 1.72 (3, m), 1.72 (4, m), 0.86 (4-Me, d; 3.7), 0.87 (5, d; 3.7); 13С ЯМР (CDCl3) звено δ (положение углерода) А 165.3 (1), 125.2 (2), 140.9 (3), 39.0 (4), 72.0 (5), 37.3 (6), 59.0 (7), 58.7 (8), 140.9 (9), 125.6 (10/14), 128.7(11/13), 128.5 (12); B 170.9 (1), 53.6 (2), 35.1 (3), 129.8 (4), 131.0 (5), 122.5 (6), 157.0 (7), 56.1 (7-OMe), 112.3 (8), 128.4 (9); С 175.6 (1), 38.3 (2), 14.1 (2-Me), 41.1 (3); D 170.9 (1), 71.4 (2), 39.4 (3), 24.5 (4), 21.5 (4-Me), 22.8 (5).
Криптофицин 43
[α] D +20o (СНСl3, с 0.2); УФ λmax(ε) 250 (20512), 282 (4083), 294 (1734); ИК (чистое вещество) νmax 3400, 3272, 2927, 1727, 1660, 1516, 1455, 1242, 1175 cm-1; EIMS m/z (относит. интенсивность) 533 (24), 484 (3), 445 (14), 398 (9), 364 (29), 227 (59), 149 (67), 91 (100); высокое разрешение EIMS m/z 590.3044 (рассчитано для C34H41N2O7, -5.2 mmu ошибка); 1H ЯМР (СDСl3): амино или гидроксикислотное звено δ (положение углерода, мультиплетность; J в Гц) 5-гидрокси-6-метил-8-фенил-2,7-октадиеновая кислота (А) 5.75 (2, d; 15.3), 6.69 (3, ddd; 15.3, 9.9 и 5.3), 2.37 (4, dt; 14.2 и 10.4), 2.52 (4, m), 5.01 (5, ddd; 11.2, 6.4 и 1.8), 2.55 (6, m), 1.13 (6-Me, d; 6.9), 6.01 (7, dd; 15.8 и 8.9), 6.41 (8, d; 15.8), 7.21-7.34 (10/11/12/13/14, m); 4-метоксифенилаланин (В) 4.80 (2, m), 5.64 (2-NH, d; 8.4), 3.06 (3, dd; 14.5 и 7.2), 3.13 (3, dd; 14.4 и 5.3), 7.06 (5/9, d; 8.4), 6.74 (6/8, d; 8.4); 3-амино-2-метилпропионовая кислота (С) 2.69 (2, m), 1.22 (2-Me, d; 7.3), 3.33 (3, m), 3.44 (3, dt; 14.0 и 4.7), 7.0 (3-NH, m); лейциновая кислота (D) 4.84 (2, dd; 10.0 и 3.6), 1.60-1.67 (3, m), 1.35 (3, m), 1.60-1.67 (4, m), 0.76 (5, d; 6.4), 0.73 (4-Me, d; 6.7); 13С ЯМР (CDCl3) звено δ (положение углерода) А 125.2 (2), 141.5 (3), 36.5 (4), 77.5 (5), 42.3 (6), 17.3 (6-Me), 130.1 (7), 131.8 (8), 136.8 (9), 126.2 (10/14), 128.6 (11/13), 127,6 (12); в 53.8 (2), 35.3 (3), 129.8 (4), 130.5 (5/9), 115.6 (6/8), 154.6 (7); С 38.3 (2), 14.1 (2-Me), 41.0 (3); D 71.6 (2), 39.6 (3), 24.5 (4), 21.2 (5), 22.9 (4-Me). Из-за небольшого размера образца, сигналы карбонильного углерода не могут быть видны.
Криптофицин 45
[α] D +72.0o (МеОН, с 0.12); УФ λmax(ε) 250 (25500), 284 (5300); ИК (чистое вещество) νmax 3407, 3239, 2958, 1743, 1727, 1667, 1538, 1469, 1242, 1196, 1177, 694 cm-1; EIMS m/z (относит. интенсивность) 658/660/662 (2.1/1.4/0.3), 483 (7.6), 432/434/436 (9.5/6.4/1.8), 300/302/304 (8.0/5.5/1.2), 227 (100) 91 (87); высокое разрешение EIMS m/z 658.2207 (рассчитано для С34Н40Сl2N2O7, 0.6 mmu ошибка); 1Н ЯМР (CDCl3): амино или гидроксикислотное звено δ (положение углерода, мультиплетность; J в Гц) 5-гидрокси-6-метил-8-фенил-2,7-октадиеновая кислота (А) 5.80 (2, d; 14.7), 6.66 (3, ddd; 14.7, 8.5 и 5.5), 2.38 (4, m), 2.53 (4, m), 4.97 (5, br dd; 10.4 и 6.2), 2.57 (6, m), 1.14 (6-Me, d; 6.7), 6.01 (7, dd; 15.9 и 8.7), 6.42 (8, d; 15.9), 7.28-7.34 (10/11/13/14, m), 7.22 (12; m); 3,5-дихлор-4-гидроксифенилаланин (В) 4.82 (2, m), 5.73 (2-NH, br d; 8.7), 3.02 (3, dd; 14.3 и 6.2), 3.10 (3, dd; 14.3 и 5.2), 7.14 (5/9, s), 5.79 (7-OH, s); 3-амино-2-метилпропионовая кислота (С) 2.73 (2, m), 1.21 (2-Me, d; 7.0), 3,17 (3, m), 3,60 (3, m), 6.81 (3-NH, br t; 6.7); лейциновая кислота (D) 4.84 (2, dd; 10.0 и 3.2), 1.38 (3, ddd; 14.9, 10.2 и 3.2), 1.65 (3, m), 1.65 (4, m), 0.78 (4-Me, d; 6.5), 0.73 (5, d; 6.5); 13С ЯМР (CDCl3) звено δ (положение углерода) А 165.5 (1), 125.4 (2), 141.2 (3), 36.4 (4), 77.6 (5), 42.3 (6), 17.3 (6-Me), 130.0 (7), 131.9 (8), 136.7 (9), 126,2 (10/14), 128.6 (11/13), 127.6 (12); В 171.0 (1), 53.2 (2), 35.0 (3), 130.4 (4), 129.1 (5/9), 121.0 (6/8), 146.7 (7); С 175.2 (1), 38.5 (2), 13.9 (2-Ме), 41.6 (3); D 170.7 (1), 71.5 (2), 39.5 (3), 24.6 (4), 22.7 (4-Ме), 21.2 (5).
Криптофицин 49
[α] D +68.1o (МеОН, с 0.075); Уф λmax(ε) 246 (25500), 284 (5200); ИК (чистое вещество) νmax 3401, 3282, 2962, 1744, 1728, 1668, 1540, 1505, 1464, 1258, 1198, 1177, 1066, 694 cm-1; EIMS m/z (относит. интенсивность) 624/626 (0.8/0.3), 398/400 (43/14), 227 (78), 195/197 (58/26) 91 (100); высокое разрешение EIMS m/z 624.2650 (рассчитано для C34H41ClN2O7, -4.8 mmu ошибка); 1Н ЯМР (CDCl3): амино или гидроксикислотное звено δ (положение углерода, мультиплетность; J в Гц) 5-гидрокси-6-метил-8-фенил-2,7-октановая кислота (А) 5.77 (2, d; 14.1), 6.67 (3, m), 2.38 (4, m), 2.50 (4, m), 5.01 (5, m), 2.56 (6, m), 1.13 (6-Me, d; 6.5), 6.03 (7, dd; 15.8 и 8.6), 6.42 (8, d; 15.8), 7.29-7.35 (10/11/13/14, m), 7.23 (12; m); 3-хлор-4-метоксифенилаланин (В) 4.82 (2, m), 5.64 (2-NH, m), 3.06 (3, m), 3.13 (3, m), 7.22 (5, m), 3.87 (7-OMe, s), 6,83 (8, m), 7.08 (9, m); 3-амино-2-метилпропионовая кислота (С) 2.72 (2, m), 1.22 (2-Me, d; 6.7), 3.26 (3, m), 3.53 (3, m), 6.90 (3-NH, m); 2-гидроксивалерьяновая кислота (D) 4.81 (2, dd; 8.8 и 3.9), 1.63 (3, m), 1.68 (3, m), 1.33 (4-Н2, m), 0.74 (5, t; 7.3).
Криптофицин 50
[α] D +32.0o (СНСl3, с. 0.44); УФ λmax(ε) 242 (4933), 262 (3996), 274 (3719), 286 (2430), 332 (359); ИК (чистое вещество) νmax 3412, 3274, 2958, 1752, 1724, 1676, 1648, 1503, 1465, 1258, 1177, 1066, 753 cm-1; EIMS m/z (относит. интенсивность) 640/642 (4/2), 398/400 (11/4), 280/282 (10/3), 227 (17), 195/197 (57/18), 157 (20), 141 (31), 91 (100); высокое разрешение EIMS m/z 640.2531 (рассчитано для C34H41ClN2O8, 2.1 mmu ошибка); 1H ЯМР (CDCl3): амино или гидроксикислотное звено δ (положение углерода, мультиплетность; J в Гц) 7,8-эпокси-5-гидрокси-6-метил-8-фенилоктановая кислота (А) 5.73 (2, d; 15.7), 6.67 (3, ddd; 15.7, 9.7 и 5.4), 2.45 (4, m), 2.55 (4, m), 5.13 (5, ddd; 11.2, 5.0 и 1.7), 1.78 (6, m), 1.15 (6-Me, d; 6.9), 2.91 (7, dd; 7.5 и 1.9), 3.68 (8, d; 1.7), 7.25 (10/14, m), 7.33-7.38 (11/12/13; m); 3-хлор-4-метоксифенилаланин (В) 4.80 (2, ddd; 8.3, 7.1 и 5.4), 5.61 (2-NH, d; 8.3), 3.03 (3, dd; 14.4 и 7.3), 3.13 (3, dd; 14.4 и 5.6), 7,21 (5, d; 1.9), 3.87 (7-OMe, s), 6.83 (8, d; 8.4), 7.07 (9, dd; 8.4 и 2.2); 3-амино-2-метилпропионовая кислота (С) 2.71 (2, m), 1.22 (2-Me, d; 7.3), 3.29 (3, dt; 13.6 и 6.9), 3.49 (3, ddd; 13.6, 6.7 и 5.0), 6.92 (3-NH, br t; 6.7); 2-гидроксипентановая кислота (D) 4.75 (2, dd; 9.2 и 3.7), 1.55 (3, m), 1.65 (3, m), 1.33 (4-Н2, m), 0.84 (5, t; 7.3); 13С ЯМР (CDCl3) звено δ значения (положение углерода) А 165.3 (1), 125.3 (2), 141.0 (3), 36.9 (4), 76.3 (5), 40.8 (6), 13.6 (6-Ме), 63.2 (7), 59.1 (8), 136.8 (9), 125.5 (10/14), 128.7 (11/13), 128.5 (12); В 170.9 (1), 53.6 (2), 35.1 (3), 129.8 (4), 131,0 (5), 122.5 (6), 154.0 (7), 56.1 (7-ОМе), 112.3 (8), 128.5 (9); С 175.6 (1), 38.4 (2), 14.1 (2-Ме), 41.2 (3); D 170.4 (1), 72.4 (2), 32.7 (3), 18.4 (4), 13.5 (5).
Криптофицин 54
EIMS m/z (относит. интенсивность) 654/656 (17/10), 493 (5), 411/413 (12/4), 280 (16), 227 (25), 195/197 (45/25), 141 (30), 91 (100); высокое разрешение EIMS m/z 654.2686 (рассчитано для C35H43ClN2O8, 2.2 mmu ошибка); 1H ЯМР (CDCl3): амино или гидроксикислотное звено δ (положение углерода, мультиплетность; J в Гц) (А) 5.73 (2, d; 15.4), 6.66 (3, ddd; 15.4, 9.7 и 5.7), 2.46 (4, m), 2.53 (4. m), 5.16 (5, ddd; 11.0, 4,2, 1.7), 1.79 (6, m), 1.14 (6-Me, d; 6.8), 2.89 (7, dd; 7.4 и 1.8), 3.69 (8, d; 1.9), 7.25 (10/14, m), 7.30-7.38 (11/12/13, m); (B) 4.81 (2, m), 5.63 (2-NH, d; 8.6), 3.03 (3, dd; 14.5, 7.3), 3.13 (3, dd; 14.5, 5.5), 7.21 (5, d; 2.2), 3.87 (7-OMe, s), 6.83 (8, d; 8.4), 7.07 (9, dd; 8.4 и 2.2); (С) 2.73 (2, m), 1.22 (2-Me, d; 7.3), 3.26 (3, ddd; 13.4, 6.8, 6.8), 3.51 (3, ddd; 13.4, 6.8, 5.3), 6.88 (3-NH, br t; 6.8); (D) 4.73 (2, d; 4.2), 1.78-1.82 (3, m), 0.92 (3-Me, d; 6.8), 1.36-1.41 (4, m), 1.18-1.20 (4, m), 0.80 (5, t; 7.5); 13С ЯМР (CDCl3) звено δ (положение углерода) А 165.3 (1), 125.4 (2), 141.0 (3), 36.6 (4), 76.3 (5), 40.6 (6), 13.2 (6-Me), 63.1 (7), 58.7 (8), 136.7(9), 125.4 (10/14), 128.6 (11/13), 128.5 (12); В 170.9 (1), 53.5 (2), 35.0 (3), 129.8 (4), 131.0 (5), 125,2 (6), 153.9 (7), 56.1 (7-OMe), 112.2 (8), 128.4 (9); С 175.4 (1), 38.5 (2), 14.0 (2-Me), 41.3 (3); D 169.4 (1), 76.5 (2), 36.1 (3), 15.6 (3-Me), 24.0 (4), 11.2 (5).
Пример 6. Синтез производных Криптофицина
Криптофицин 8
К раствору 3.8 мг Криптофицина 1 в 1.5 мл 2:1 смеси 1,2-диметоксиэтана/воды было добавлено 9 мкл 1N Hcl. Раствору позволяли перемешиваться в течение 4 часов, нейтрализовали карбонатом калия и упаривали. Остаток был в виде перегородки между водой и CH2Cl2, СН2Сl2 - растворимая часть была очищена с помощью жидкостной гель-проникающей хроматографии с обращенной фазой с получением 3.3 мг чистого Криптофицина 8.
(Здесь и далее во всех последующих примерах)
Данные EIMS-электронной эмиссионной спектроскопии m/z (относительная интенсивность) 690/692/694 (0.8/0.5/0.2). EIMS высокого разрешения m/z 690.2533 (рассчитано для C35H44Cl2N2O8 -5.8 mmu ошибка). 1Н-ЯМР (СDСl3) - данные протонного магнитного резонанса; амино или гидроксикислотное звено δ (положение углерода, мультиплетность, J в Гц) 8-хлор-5,7-дигидрокси-6-метил-8-фенил-2-октеновая кислота (А) 5.79 (2, d - дублет; 15.4), 6.69 (3, ddd - тройной дублет; 15.4, 9.7 и 5.6), 2.68 (4, ddt - двойной дублет триплет; 14.0, 5.5 и 1.8), 2.38 (4, m - мультиплет); 5.11 (5, ddd - тpoйнoй дублет; 10.8, 8.6 и 1.8), 2.51 (6, m - мультиплет), 1.05 (6-Me, d - дублет; 7.0), 4.01 (7dd - двoйнoй дублет; 9.6 и 1.4),4.65 (8, d - дублет; 9.6), 7.36-7.41 (10/11/12/13/14, m) лейциновая кислота (D) 4.92 (2, dd; 10.1 и 3.5), 1.76 (3/4, m), 1.45 (3, m), 0.94 (5, d; 6.6), 0.94 (4-Me, d; 6.4); 3-амино-2-метилпропионовая кислота (С) 2.73 (2, m), 1.22 (2-Me, d; 7.2), 3.25 (3, ddd; 13.6, 6.8 и 6.1), 3.54 (3, ddd; 13.5, 6.1 и 3.4), 6.91 (3-NH, brt; 6.1); 3-хлоро-4-метоксифенилаланин (В) 4.82 (2, ddd; 8.8, 7.2 и 6.6), 5.64 (2NH, d; 8.8), 3.03 (3, dd; 15.4 и 7.2), 3.16 (3, dd; 15.4 и 5.6), 7.23 (5, d; 2.2), 3.88 (7-ОСН3, s), 6.85 (8, d; 8.5), 7.09 (9, dd; 8.5 и 2.2).
Криптофицин 9
К раствору 10 мг Криптофицина 1 в 1 мл сухого метанола было добавлено 10 мкл HCl (полученного путем обработки 1.25 г тионилхлорида 25 мл МеОН). После перемешивания в течение 4 часов, растворитель удаляли в вакууме и образец оставляли в вакууме на 12 часов. Очистка с помощью жидкостной гель-проникающей хроматографии с обращенной фазой давала 8 мг чистого Криптофицина 9.
1Н ЯМР (CDCl3): амино или гидроксикислотное звено δ (положение углерода, мультиплетность; J в Гц) 5,7-дигидрокси-8-метокси-6-метил-8-фенил-2-октановая кислота (А) 5.76 (2, d; 15.5), 6.67 (3, ddd; 15.5, 9.5 и 5.6), 2.34 (4, ddd; 14.1, 11.1 и 9.5), 2.62 (4, dddd; 14.1, 5.6, 1.8 и 1.5), 5.09 (5, ddd; 11.1, 7.8 и 1.8), 2.24 (6, dqd; 7.8, 7.0 и 2.2), 1.03 (6-Me, d; 7.0), 3.71 (7, dd; 8.3 и 2.2), 4.03 (8, d; 8.3), 3.20 (8-ОСН3, s), 7.31-7.40 (10/11/12/13/14, m); лейциновая кислота (D) 4.86 (2, dd; 9.8 и 3.5), 1.71 (3/4, m), 1.41 (3, m), 0.89 (5/4-Me, d; 6.4); 3-амино-2-метилпропионовая кислота (С) 2.71 (2, ddq; 6.8, 3.9 и 7.2), 1.21 (2-Me, d; 7.2), 3.23 (3, ddd; 13.5, 6.8 и 6.0), 3.52 (3, ddd; 13.5, 6.0 и 3.9), 6.90 (3-NH, brt; 6.0), 3-хлоро-4-метилоксифениламинин (В) 4.82 (2, ddd; 8.8, 7.4 и 5.7), 5,66 (2-NH, d; 8.8), 3.02 (3, dd; 14.4, 7.4), 3.15 (3, dd; 14.4 и 5.5), 7.23 (5, d; 2.2), 3.87 (7-ОСН2, s), 6.84 (8, d; 8.5), 7.08 (9, dd; 8.5 и 2.2).
Криптофицин 10
К перемешиваемому раствору 7 мг Криптофицина 9 в 1 мл ацетона и 0.3 мл воды было добавлено 8 мкл 2 N раствора NaOH. После перемешивания в течение 4 часов, раствор подвергали нейтрализации до рН 7 1 N раствором HCl и растворитель удаляли при пониженном давлении. Остаток подвергали обработке с помощью жидкостной гель-проникающей хроматографии с обращенной фазой с использованием смеси 7:3 МеОН/Н2О с получением чистого Криптофицина 10 (5 мг).
1Н ЯМР (CD2OD): амино или гидроксикислотное звено δ (положение углерода, мультиплетность; J в Гц) 5,7-дигидрокси-8-метокси-6-метил-8-фенил-2-октановая кислота (А) 5.99 (2,dt; 15.4 и 1.3), 6.82 (3, dt; 15.4 и 7.3), 2.30 (4, m), 2.50 (4, m), 3.66 (5, td; 7.8 и 3.5), 2,05 (6, d; 1.8, и 7.0), 0.96 (6-Me, d; 7.0), 4.04 (7, dd; 8.8 и 2.0), 4.01 (8, d; 8.8), 3.12 (8-ОСН3, s), 7.26-7.36 (10/11/12/13/14, m); 3-амино-2-метилпропионовая кислота (С) 2.50 (2, m), 1.02 (2-Me, d; 7.3), 3,16 (3, dd; 13.4 и 6.9), 3.82 (3, dd; 13.4 и 6.6); 3-хлоро-4-метилоксифениламинин (В) 4.57 (2, dd; 8.5 и 6.5), 2.82 (3, dd; 13.9 и 8.6), 3,03 (3, dd; 13.9 и 6.5), 7.25 (5, d; 2.2), 3.82 (7-ОСН3, s), 6.96 (8, d; 8.6), 7.13 (9, dd; 8.6 и 2.2). 13С ЯМР (CD3OD): δ 179.5, 173.4, 168.2, 155.4, 143.7, 141.7, 131.9, 131.7, 129.8, 129.3, (2С), 129.2 (2С), 128.8, 126.2, 123.2, 113.4, 85.9, 74.5, 74.1, 56.8, 56.6, 56.3, 43.3, 41.2, 40,2, 38.8, 38.0, 15.5, 9.9.
Криптофицин 12
К раствору 5 мг Криптофицинов 1, 5 или 8 в 1 мл 4:1 смеси ацетон/вода было добавлено 15 мкл 2 N раствора NaOH. После перемешивания при комнатной температуре в течение 5 часов, реакционную смесь подвергали нейтрализации до рН 7 1 N раствором HCl и растворитель упаривали. Вещество, растворимое в CH2Cl2 пропускали через небольшой кремниевый картридж с CH2Cl2, 1:1 EtOAc/CH2Cl2, и ЕtOАс. Фракция, элюированная EtOAc, содержала чистый Криптофицин 12.
1H ЯМР (CD3OD): амино или гидроксикислотное звено δ (положение углерода, мультиплетность; J в Гц) 5,7,8-тригидрокси-6-метил-8-фенил-2-октановая кислота (А) 6.07 (2, ddd; 15.5, 1.3 и 1.2), 6.40 (3, dt; 15.5 и 7.3), 2.49 (4, m), 2.60 (4, m), 3.92 (5, ddd; 9.3, 6.7 и 4.5), 1.94 (6, m), 1.07 (6-Me, d; 6.6), 3.61 (7, dd; 8.9 и 7.6), 4.56 (8, d; 7.6), 7.36 (10/14, dd; 7.4 и 1.5), 7.32 (11/13, brt; 7.5), 7.25 (12, m); 3-амино-2-метилпропионовая кислота (С) 2,54 (2, ddq; 7.0, 6.6 и 7.0), 1.02 (2-Me, d; 7.0), 3.14 (3, dd; 13.5 и 7.0), 3.42 (3, dd; 13.4 и 6.6); 3-хлоро-4-метилоксифениламинин (B) 4.57 (2, dd; 8.4 и 6.7), 2.83 (3, dd; 13.8 и 8.4), 3.02 (3, dd; 13.8 и 6.6), 7.25 (5, d; 2.1), 3.82 (7-ОСН3, s), 6.95 (8, d; 8.5), 7.12 (9, dd; 8.5 и 2.1). Метилирование Криптофицина 12 диазометаном давало Криптофицин 6.
Криптофицин 14
К раствору 3 мг Криптофицина 6 в 1 мл 3:1 смеси ацетон/вода было добавлено 5 мкл 2 N раствора NaOH. После перемешивания в течение 5 часов, реакционную смесь подвергали нейтрализации до рН 7 1 N раствором HCl и затем упаривали досуха. Остаток подвергали обработке с помощью жидкостной гель-проникающей хроматографии с обращенной фазой с получением 2.4 мг Криптофицина 14,
1H ЯМР (CD3OD): амино или гидроксикислотное звено δ (положение углерода, мультиплетность; J в Гц) 5-гидрокси-6-метил-8-фенил-2,7-октадиеновая кислота (А) 5.98 (2, d; 15.3), 6.78 (3, dt; 15.3 и 7.5), 2.35 (4, m), 3.64 (5, td; 7.2 и 4.8), 2.47 (6, m), 1.14 (6-Me, d; 6.9), 6.22 (7, dd; 15.9 и 8.1), 6.39 (8, d; 15.9), 7.24-7.36 (10/11/12/13/14, m), 3-амино-2-метилпропионовая кислота (С) 2.35 (2, m), 1.02 (2-Me, d; 6.9), 3.18 (3, dd; 13.2 и 6.6), 3.36 (3, dd; 13.2 и 4.5); 3-хлоро-4-метилоксифенилаланин (В) 4.58 (2, dd; 8.7 и 6.3), 2.80 (3, dd; 13.8 и 9,0), 3.05 (3, dd; 13.8 и 6.3), 7.25 (5, d; 2.1), 3.82 (7-ОСН3, s), 6.95 (8, d; 8.4), 7.13 (9, dd; 8.4 и 2.1).
Криптофицин 35
Каталитическое количество PtO2 было добавлено в колбу, содержащую 0.5 мл CH2Cl2. Колба была подвергнута вакуумированию, был введен Н2 и смесь перемешивали при комнатной температуре в течение 20 минут. Раствор 10 мг Криптофицина 1 в минимальном количестве CH2Cl2 был добавлен и смесь перемешивали при комнатной температуре в течение 45 минут. Катализатор удаляли фильтрованием через целит/хлопковую ткань и растворитель упаривали. Обработка остатка с помощью жидкостной гель-проникающей хроматографии с обращенной фазой с использованием С18 колонки давала 6.5 мг Криптофицина 35.
EIMS m/z (относит. интенсивность) 656/658 (25/10), 412/414 (25/12), 280/282 (20/10), 195/197 (78/25), 141 (58), 91 (100); высокое разрешение EIMS m/z 656.2864 (рассчитано для C35H45ClN2O8, 0.0 mmu ошибка); 1H ЯМР (CDCl3): амино или гидроксикислотное звено δ значения (положение углерода, мультиплетность; J в Гц) 2,3-дигидро-7,8-эпокси-5-гидрокси-6-метил-8-фенил октановая кислота (А) 2.32 (2, ddd; 14.5, 9.2, 5.8), 2.10 (2, ddd; 14.5, 9.2, 6.2), 1.5-1,8 (3/4 наложение m), 5.07 (5, ddd; 12.5, 5.6, 2.0), 1.80 (6, m), 1.12 (6-Me, d; 7.0), 2.90 (7, dd; 7.4, и 1.8), 3.67 (8, d; 1.8), 7.24 (10/14, m), 7.32-7.38 (11/12/13, m); 3-хлор-4-метоксифенилаланин (В) 4.71 (2, ddd; 8.7, 6.4, 6.3), 5.62 (2-NH, d; 8.7), 3.08 (2Н-3, br d; 6.4), 7.19 (5, d; 2.0), 3,87 (7-OMe, s), 6.83 (8, d; 8.5), 7.07 (9, dd; 8.4, 2.0); 3-амино-2-метилпропионовая кислота (С) 2.72 (2, m), 1.18 (2-Me, d; 6.9), 3.12 (3, ddd; 11.4, 10.6, 5.6), 3.70 (3, ddd), 6.76 (3-NH, br t; 6.0); лейциновая кислота (D) 4.83 (2, dd; 9.9, 3.8), 1.39 (3, m), 1.70 (3, m), 1.72 (4, m), 0.87 (4-Me, d; 5.3), 0.86 (5, d; 5.3); 13С ЯМР(СDСl3) звено δ значения (положение углерода) А 172.4 (1), 36.2 (2), 32.0 (3), 21.1 (4), 76.6 (5), 40.2 (6), 13.6 (6-Me), 63.3 (7), 59.2 (8), 136.8 (9), 125.6 (10/14), 128.7 (11/13), 128.6 (12); B 170,7 (1), 53.7 (2), 35.5 (3), 130.0 (4), 131.1 (5), 122.2 (6), 153.8 (7), 56.1 (7-OMe), 112,1 (8), 128.5 (9); С 175.2 (1), 38.2 (2), 13.6 (2-Me), 42.1 (3); D 171.9 (1), 71.7 (2), 39.6 (3), 24.5 (4), 22.9 (4-Me), 21.4 (5).
Пример 7. Анализ активности криптоциновых соединений в микротрубочковой деполимеризации.
Винбластин, цитохалазин В, тетраметилродамин изотиоцианат (TRITC)-фалоидин, сульфородамин В (SRB) и антитела против β-тубулина и виментина были получены из Sigma Chemical Company. Базальная среда орла, содержащая соли Earle (BME), была из Gibco и фетальная бычья сыворотка (FBS) была куплена у Halcone Laboratories.
Линии клеток
Jurkat Т линия клетки лейкемии и клеток А-10 гладкой мышцы крысиной аорты были получены из American Type Culture Collection и культивированы в BME, содержащем 10% FBS и 50 мкг/мл гентамицин сульфата. Клетки яичниковой человеческой карциномы (SKOV3) и суб-линия, которая выбрана для сопротивления винбластину (SKVLB1), были великодушным подарком от Dr.Victor Ling из Ontario Cancer Institute. Обе линии клеток содержали в BME, содержащем 10% FBS и 50 мкг/мл гентамицин сульфата. Винбластин добавляли с конечной концентрацией 1 мкг/мл в SKVLB1 клетки через 24 часа после пассажа для поддержания выбранного давления для Р-гликопротеин-сверхэкспрессирующих клеток.
Анализы клеточной пролиферации и задержки цикла.
Анализы клеточной пролиферации были выполнены, как описано Skehan et.al. 11. Для Jurkat клеток, культуры обрабатывали инкубированными лекарствами, как описано в Skehan et.al.11, и общие клеточные наборы определяли с помощью подсчета клеток в гемацитометре. Процентное содержание клеток в митозе определяли с помощью окрашивания 0.4% Giemsa в PBS с последующими тремя быстрыми промывками PBS. По крайней мере, 1000 клеток на обработку были подсчитаны на присутствие миотических структур и миотического индекса, рассчитанного в виде отношения клеток с миотическими структурами к общему числу подсчитанных клеток.
Влияние криптофицинов и винбластина на пролиферацию клеток Jurkat и клеточного цикла.
Кривые доза-ответ для эффектов криптофициновых соединений и винбластина на клеточную пролиферацию и процентное содержание клеток в митозе показываются на фигурах 2А и 2В, соответственно. Меньше, чем 3% необработанных клеток, обнаруживают митотические структуры. И криптофициновые соединения и винбластин вызывают зависимое от дозы увеличение процента клеток, наблюдавшихся в митозе. Увеличение в митотическом индексе близко коррелировало с уменьшением клеточной пролиферации, т.е. концентрации и криптофициновых соединений и винбластина, которые заставляли 50% клеток аккумилироваться в митозе, были фактически такими же, как концентрация, которая ингибировала клеточную пролиферацию на 50%. Величины IC50 для криптофициновых соединений и винбластина для этих эффектов составляли 0.2 и 8 нМ соответственно.
Влияние цитохалазина В. винбластина и криптофицинов на цитоскелет
Клетки (А-10) гладкой мышцы аорты были выращены на стеклянных покровных стеклах и обработаны PBS, 2 мкМ цитохалазина В, 100 нМ винбластина или 10 нМ криптофициновых соединений. Спустя 24 часа, микротрубочковые и виментиновые промежуточные волокна были визуализованы с помощью непрямого иммунофлуоресцентного анализа и микроволокна были окрашены с использованием TRITC-фаллоидина. Были исследованы морфологические эффекты каждого лекарства. Необработанные клетки проявляли полностью расширенные микротрубочковые сетки с окружающими ядро микротрубочковыми организующими центрами. Виментиновые промежуточные волокна были также равномерно распределенными по всей цитоплазме, в то время как пучки микроволокон были сконцентрированы вдоль большой оси клетки. Цитохалазин В вызывал полную деполимеризацию микроволокон наряду с аккумулированием паракристаллических остатков. Это соединение не оказывало влияния ни на распределение микротрубочек, ни на распределение промежуточных волокон. И винбластин и криптофициновое соединение вызывали заметное опустошение микротрубочек. Ни одно из соединений не оказывало влияния на организацию микроволокна; однако виментиновые промежуточные волокна сплющивались, образуя концентрические кольца вокруг ядра клеток, обработанных либо винбластином, либо криптофициновым соединением.
Влияние криптофицинов и винбластина на таксол-стабилизированные микротрубочки
Клетки А-10 были обработаны в течение 3 часов 0 или 10 мкМ таксола до добавления PBS, 100 нМ винбластина или 10 нМ криптофицинового соединения. Спустя 24 часа, организация микротрубочек была исследована с помощью иммунофлуоресцентного анализа, как описано выше. По сравнению с контрольными клетками, микротрубочки в таксол-обработанных клетках были интенсивно связаны, особенно в клеточных полярных областях. Как и прежде, винбластин вызывал полную деполимеризацию микротрубочек в необработанных предварительно клетках. Однако предварительная обработка таксолом предотвращала микротрубочки от деполимеризации в ответ на винбластин. Аналогично, предварительная обработка таксолом полностью стабилизировала микротрубочки против криптофицин-индуцированной деполимеризации.
Обратимость деполимеризации микротрубочек за счет винбластина и криптофицина
Клетки А-10 были обработаны либо 100 нМ винбластина, либо 10 нМ криптофицинов в течение 24 часов, приводя в результате к полной деполимеризации микротрубочек. Затем клетки были промыты и проинкубированы в среде, свободной от лекарства, в течение 1 часа или 24 часов. Микротрубочки подвергались быстрой повторной полимеризации после удаления винбластина, показывая значительные уровни микротрубочек спустя 1 час и полное морфологическое восстановление за 24 часа. Напротив, микротрубочки не появляются повторно в клетках, обработанных криптофициновыми соединениями, ни через 1 час, ни через 24 часа после удаления соединения.
Обратимость ингибирования клеточной пролиферации криптофицинами, винбластином и таксолам
SKOV3 клетки были обработаны в течение 24 часов ранее установленными IC50 дозами винбластина, криптофициновых соединений или таксола (т.е. величинами, определенными в опытах суммированных в таблице 5). В течение этого времени плотность клетки увеличивалась от 0.4 до 0.5±0.05 единиц поглощения (фигура 3), указывал на 25% увеличение количества клеток для всех трех обработок. Удаление лекарства приводило к быстрому росту клеток, обработанных винбластином, так что их количество увеличивалось приблизительно в три раза в течение 24 часов. Напротив, клетки, обработанные криптофициновыми соединениями или таксолом, оставались блокированными, увеличиваясь только в 0,2-0,4 раза в течение 24 часов после удаления лекарства. Пролиферативная способность клеток, обработанных криптофицинами или таксолом, впоследствии восстанавливалась, так как клетки затем удваивались в следующие 24 часа.
Влияние комбинаций винбластина и криптофицинов на клеточную пролиферацию
SKOV3 клетки были обработаны комбинациями криптофицинов и винбластина в течение 48 часов. Затем было определено процентное содержание выживших клеток и были рассчитаны величины IC50 для каждой комбинации. Влияние этих обработок указанными комбинациями, а также обработок одним лекарством, изображается в виде изоболограмм (фигура 4). Величины IC50 для комбинаций криптофициновых соединений и винобластина очень близко приближается к линии аддитивности, указывая на то, что эти два лекарства индуцируют только аддитивное ингибирование клеточной пролиферации.
Токсичность криптофицинов, винбластина и таксола по отношению к SKOV3 и SKVLBI клеткам
SKVLBI клетки оказывают сопротивление противораковым лекарствам натурального происхождения из-за их сверх экспрессии Р-гликопротеина 12. Способности таксола, винбластина и криптофициновых соединений к ингибированию роста SKOV3 и SKVLBI клеток суммируется в таблице 5. Таксол вызывает зависимое от дозы ингибирования пролиферации обеих линий клеток с величинами IC50 для SKOV3 и SKVLBI клеток 1 и 8000 и М, соответственно. Винбластин также ингибирует рост обеих линий клеток, с величинами IC50 0,35 и 4200 нМ для SKOV3 и SKVLBI клеток, соответствно. Криптофицины демонстрируют величины IC50 7 и 600 пкМ для SKOV3 и SKVLBI клеток, соответственно. Результатирующие факторы сопротивления для SKVLBI клеток соединениям рассчитываются в виде IC50 для SKVKBI. IC50 для SKOV3 клеток также указываются в таблице 5.
Таким образом, это демострирует, что настоящее изобретение обеспечивает новые криптофициновые соединения, а также ранее описанные криптофициновые соединения, которые являются мощными ингибиторами клеточной пролиферации, действующими за счет разрыва сетки микротрубочек и ингибирования митоза. Криптофициновые соединения разрушают организацию микротрубочек и, таким образом, нормальные клеточные функции, включающие функции митоза.
Классические антимикротрубочковые агенты, такие как колхицин и алкалоиды Винка, задерживают клеточное деление при митозе. Кажется уместным сравнить эффект одного из этих агентов на клеточную пролиферацию с криптофициновыми соединениями. Для этой цели винбластин алкалоида Винка был выбран в качестве представителя антимикротрубочковых агентов. Таким образом, было проведено сравнение влияния криптофициновых соединений и винбластина на пролиферацию и развитие клеточного цикла клеточной линии Jukart Т-клеток лейкемии. Оба соединения вызывали параллельное зависимое от дозы ингибирование клеточной пролиферации и аккумулирование клеток в митозе.
Так как антимитотические эффекты обычно опосредуются разрушением микротрубочек в митотических веретенах, эффекты криптофициновых соединений на цитоскелетные структуры были охарактеризованы с помощью флуоресцентной спектроскопии. Иммунофлуоресцентное окрашивание клеток, обработанных либо криптофициновым соединением, либо винбластином, четко демонстрирует, что оба соединения вызывают полную потерю микротрубочек. Аналогичные исследования с SKOV3 клетками демонстрируют, что антимикротрубочковые эффекты криптофициновых соединений не являются уникальными для линии клеток гладкой мышцы. Ни одно лекарство оказывает влияние на уровни или распределение микроволокнистых пучков, что было легко проиндуцировано цитохалазином В, указывая на то, что потеря микротрубочек не может быть обусловлена неспецифическим механизмом, например, активацией протеаз или потерей энергетического заряда. И винбластин и криптофициновые соединения также заметно ускоряют схлопывание виментиновых промежуточных волокон так, что яркоокрашенные кольца образуются вокруг клеточных ядер.
Удаление винбластина из культурной среды приводит к быстрой повторной полимеризации микротрубочек. Напротив, клетки, обработанные криптофициновыми соединениями, оставались истощенными по отношению к микротрубочкам в течение, по крайней мере, 24 часов после того как соединение было удалено из культур.
Настоящее изобретение демонстрирует, что криптофициновые соединения нарушают Р-гликопротеин-опосредованное многократное сопротивление лекарству. Транспорт за счет Р-гликопротеина ограничивает способность противораковых лекарств натурального продукта к ингибированию роста опухолевых клеток с требуемым или de novo сопротивлением лекарству13-15. Алкалоиды Винка, хотя и очень полезные как начальный источник химиотерапии, являются чрезвычайно хорошими сусбтратами для транспорта Р-гликопротеина и, таким образом, являются очень ограниченно полезными против Р-гликопротеин-опосредованных MDR опухолей.
Поэтому, идентификация агентов, которые могут перекрывать многократное сопротивление лекарству, должна приводить к развитию полезных и новых противораковых агентов. Криптофициновые соединения настоящего изобретения оказывается являются такими агентами, так как они являются плохими субстратами для Р-гликопротеин-опосредованного транспорта. Этот факт отражается в низком факторе клеточного сопротивления для криптофициновых соединений, по сравнению с винбластином, таксолом и другими натуральными лекарственными продуктами.
Полный синтез криптофицинов.
Структуры новых синтезированных соединений, а именно Криптофицинов 51, 52, 53, 55, 56, 57, 58 и 61 были подтверждены непосредственным образом с использованием методологии, которая является хорошо известной специалистам в этой области. Масс-спектральные данные согласовывались с молекулярными составами. Данные протон и углерод ЯМР-спектров были аналогичны данным для криптофицина 1 и соответствующих аналогов природного происхождения и полусинтетических аналогов.
Следующие примеры демонстрируют полный синтез криптофициновых соединений, а также их применение в качестве терапевтических агентов в соответствии с изобретением.
Пример 8. Синтез Криптофицина 51
S-транс-3-пентен-2-ол (А)
Смесь рацемического транс-3-пентен-2-ола (933 мг, 11 ммолей), трифторэтиллаурата (4.14 г, 15 ммолей) и свиной панкретит липазы (PPL, 2,0 г) в 25 мл безводного диэтилового эфира перемешивали в течение 80 часов. Затем PPL отфильтровывали и промывали три раза. Эфирные фильтраты упаривали и липкое масло затем подвергали вакуумной разгонке с коротким дефлегматором. S-транс-3-пентен-2-ол (А) конденсировался в ловушке, охлаждаемой жидким азотом (338 мг).
1Н-ЯМР (CDCl3) δ 5.57 (4-Н; dq, -15.3/6.0). 5.47 (3-H; ddd, -15.3/6.4/1.2), 4.19 (2-Н; 1: 4:6:4:1 pentuplet. 6.4). 2.24 (OH; bs), 1.63 (5-Н3; d. 6.0), 1.19 (1-Н3; d, 6.4). 13С NMR (CDCl3) δ 135.5 (3), 125.5 (4). 68.7 (2), 23.3 (5), 17.5 (1).
S-транс-2-(2-пропинилокси)-3-пентен (B)
К интенсивно перемешиваемой смеси S-энантиомера А (628 мг, 7.3 ммоля), тетрабутиламмоний гидросульфата (138 мг, 0.41 ммоля) и 40% NaOH в воде (5 мл) при 0oС добавляют по каплям хлористый пропаргил (767 мг, 10.3 ммоля, 745 мкл), Интенсивное перемешивание продолжают в течение ночи после чего смесь нейтрализуют HCl при 0oС и пропаргиловый эфир экстрагируют в пентан. Экстракт упаривают и пропаргиловый эфир очищают на короткой колонке с силикагелем (2% диэтиловый эфир/пентан) с получением 778 мг пропаргилового эфира В,
[α] D -118.9o (с 2.0, СНСl3): 1Н NMR (CDCl3) δ 5.70 (4-H; dq, 18.5/6.5), 5.31 (3-H; ddd, 18.5/7.2/1.4), 4.15 (1'-Н; dd, -15.6/2.1), 4.01 (1'-Н; dd, -15.6/2.1), 4.01 (2-H; m), 2.38 (3'-H; t, 2.1), 1.73 (5-Н; dd, 6.5/1.4). 1.25 (1Н; d, 6.3).
(3R,4R)-4-Метилгепт-5(Е)-ен-1-ин-3-ол (С)
Аликвоту гексанового раствора бутиллития (2.5 M, 5,1 мл, 12.8 ммоля) упаривают в вакууме и остаток охлаждают до -90oС. Медленно добавляют раствор пропаргилового эфира В (454 мг, 3.66 ммоля) в 10 мл ТГФ. После этого позволяют температуре подняться в течение ночи до комнатной температуры, реакционную смесь гасят раствором NH4Cl. Экстракция эфиром три раза, выпаривание высушенного экстракта и очистка остатка на колонке с силикагелем (:% ЕtOАс/гексан) дает 332 мг спирта С (выход 71%).
[α]D +32.9o (с 3.0, СНСl3); IR (NaCl) νmax 3306, 2968, 1455, 1379, 1029, 975 cm-1. 1H NMR (CDCl3) δ 5.61 (6-H; dq, 15.3/6.3), 5.38 (5-H; dd, 15.3/7.7). 4.13 (3-H; bs), 2.45 (1-Н; d, 1.5), 2.38 (4-H; m), 2.20 (ОН; bd, 3.3), 1.68 (7-Н; d, 6.2), 1.09 (4-СН3; d, 6.8), 13C NMR (CDCl3) 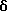 131.5 (5), 127.9 (6), 83.5 (2), 73.6 (1), 66.2 (3), 43.4 (4), 18.1 (7), 15.7 (4-Ме).
131.5 (5), 127.9 (6), 83.5 (2), 73.6 (1), 66.2 (3), 43.4 (4), 18.1 (7), 15.7 (4-Ме).
(3S,4R)-3-трет-Бутилдиметилсилилокси-4-метилгепт-5Е-еналь(D).
К перемешиваемому раствору спирта С (248 мг, 2 ммоля) и имидазола (340 мг, 5 ммолей) в 3 мл сухого ДМФА добавляют трет-бутилдиметилсилил хлорид (452 мг, 3 ммоля). После перемешивания смеси в течение ночи, добавляют 10 мл 10% раствора NaOH для разрушения избытка трет-бутилдиметилсилил хлорида. Продукт экстрагируют в эфир и экстракт промывают последовательно водой, 0.5 N HCl, и водой, сушат и выпаривают. Очистка остатка с помощью хроматографии на силикагеле с гексаном дает 457 мг (3R,4R)-3-трет-бутилдиметилсилилокси-4-метилгепт-5Е-ен-1-ина (выход 96%).
1H-ЯМР(CDCl3) δ 5.50 (6-H; dq, 15.3/6.1), 5.38 (5-H; dd, 15.3/7.5). 4.16 (3-H; dd, 5.7/1.7), 2.37 (1-H; d, 1.7), 2.35 (4-H; m), 1.68 (7-H; d, 6.1), 1.07 (4-Me; d, 6.8), 0.90 (СМe3; s), 0.12 (SiMe; s), 0.09 (SiMe; s).
Используя ту же процедуру, соответствующее TBDPS производное (3R,4R)-3-трет-бутилдифенилсилилокси-4-метилгепт-5Е-ен-1-ина было получено с выходом 92%.
[α] D +32.9o (с 3.0, СНСl3). 1Н NMR (CDCl3) δ 7.72/7.38 (2Ph-H5), 5.32 (6-H; m), 5.25 (5-H; dd, 16.2/7.3), 4.29 (3-H; dd, 5.2/2.0), 2.38 (4-H; m), 2.33 (1-H; d, 2.0), 1.64 (7-H, d, 5.3), 1.11 (4-Me; d, 6.9), 1.06 (СМе3). 13С NMR (CDCl3) δ 136.1/135.9/133.6 /129.7/129.6/127.5/127.3 (Ph), 132.4 (5), 126.1 (6), 83.3 (2), 73.5 (1), 68.0 (3), 43.6 (4), 26.9 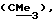 19.4
19.4 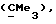 18.0 (7), 14.7 (4-Me).
18.0 (7), 14.7 (4-Me).
2-Метилбутен (1.15 мл, 2М раствор в ТГФ, 2.3 ммоля) был добавлен к 1.1 мл раствора ВF3 в ТГФ (1М, 1.1 ммоля) при -25oС и смесь перемешивали в бане со льдом в течение двух часов. Затем температуру понижали до -50oС и сразу добавляли раствор TBS производного (238 мг, 1 ммоль) в 1 мл ТГФ. Охлаждающую баню удаляли и реакционной смеси позволяли нагреться до комнатной температуры и оставляли при комнатной температуре в течение одного часа. Затем добавляли 2.2 М раствор КН2РО4/K2НРО4 (4.8 мл) и 30% Н2О2 (0.8 мл) при 0oС. Спустя 1 час, ТГФ упаривали и остаток экстрагировали в эфир. Сухой эфирный экстракт выпаривали, остаток хроматографировали на силикагеле (1% ЕtOАс/гексан) с получением 194 мг альдегида D (выход 76%).
1Н NMR (CDCl3) δ 9.78 (1-H; t, 2.3), 5.46 (6-H; dq, 15.3/6.1), 5.34 (5-H; dd, 15.3/7.5), 4.13 (3-H; m), 2.47 (2-H; m), 2.31 (4-H; m). 1.66 (7-H; br d, 6.1), 0.99 (4-Me; d, 6.8), 0.87 (СМe3; s), 0.07 (SiMe; s), 0.04 (SiMe; s).
Производное трет-бутилдифенилсилилового эфира (TBDPS) альдегида получали с 83% выходом, 1Н-ЯМР (СDСl3) δ 9.52 (1-H; t, 2.4), 7.69/7.40 (2Ph-H5), 5.28 (6-H; m), 5.22 (5.Н; dd, 16.2/6.2), 4.19 (3-H; m), 2.42 (2-H; m). 2.29 (4-H; m), 1.60 (7-H; d, 5.4), 1.07 (СМе5), 1.02 (4-Me; d, 6.9). 13C NMR (CDCl3) δ 202.0 (1), 136.1/133.6/133.3/130.2/129.7/127.7/127.6 (Ph), 132.3 (5), 126.2 (6), 72.8 (3), 47.6 (2), 42.2 (4), 27.1 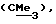 19.6
19.6 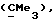 18.3 (7), 14.9 (4-Me).
18.3 (7), 14.9 (4-Me).
Метил(5S, 6R)-5-трет-Бутилдиметилсилилокси-6-метил-7-оксонона-2Е,7Е-диеноат (E)
К перемешиваемому раствору альдегида D (0.74 г, 2.9 ммоля) и триметилфосфонацетата (632 мг, 3,5 ммоля) в 5 мл ТГФ, охлажденного до -78oС, добавляли тетраметилгуанидин (435 мкл, 3.5 ммоля). Через 30 минут охлаждающую баню удаляли и смесь перемешивали дополнительно четыре часа. Смесь нейтрализовали 1 N HCl и продукт экстрагировали в эфир. Выпаривание высушенного эфирного экстракта оставляло остаток, который хроматографировали на силикагеле (5% ЕtOАс/гексан) с получением 0.814 г Е (выход 96%). 1Н-ЯМР (CDCl3) δ 6.93 (3-H; dt, 15.6/7.8), 5.62 (2-H; dd, 15.6/1.2). 5.37 (8-H, m), 5.37 (7-H, m), 3.71 (ОСН3, s), 3.61 (5-H, m), 2.29 (4-H2, m), 2.22 (6-H, m), 1.66 (9-Н3; br d, 6.1), 0.99 (6-Me; d, 6.8), 0.88 (CMe3; s), 0.03 (SiMe; s), 0.01 (SiMe; s).
Производное трет-бутилдифенилсилилового эфира (TBDPS) альдегида получали с 90% выходом, 1Н-ЯМР (СDСl3) δ 7.68/7.38 (2Ph-H5), 6.75 (3-H; dt, 15.6/7.4), 5.62 (2-Н; d, 15.6), 5.34 (8-H, m), 5.29 (7-H, m), 3.70 (5-H, m), 3.68 (OCH3, s), 2.28 (4-Н2, m), 2.20 (6-Н, m), 1.62 (9-Н3; d, 5.3), 1.08 (СМе5), 0.99 (6-Me; d, 6.9), 13C NMR (CDCl3) δ 166.7 (1), 146.4 (3), 136.0/134.2/133.8/129.62/129.56/127.5/127.4 (Рh), 132.5 (7), 125.8 (8), 122.6 (2), 76.2 (5), 51.3 (ОСН3), 41.7 (6), 36.8 (4), 27.0 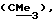 19.4
19.4  18.1 (9), 14.7 (6-Me).
18.1 (9), 14.7 (6-Me).
Метил(5S, 6R)-5-трет-Бутилдиметилсилилокси-6-метил-7-оксогепт-2(Е)-7-еноат (F)
Озон пропускали через раствор метилового эфира Е (328 мг, 1.0 ммоля) и 97 мкл пиридина в 15 мл CH2Cl2 при -78oС и за протеканием озонолиза наблюдали с помощью тонкослойной хроматографии. После того как был израсходован метиловый эфир, добавляли около 500 мг цинковой пыли и 1 мл ледяной уксусной кислоты. Температуру медленно повышали до 25oС. Смесь отфильтровывали и фильтрат последовательно промывали насыщенными растворами CuSO4 и NaHCO3. После упаривания растворителя, неочищенный альдегид F (249 мг, 83%) использовали в следующей стадии без дальнейшей очистки. 1H-ЯМР (CDCl3) δ 9.96 (7-Н; t, 2.3), 6.96 (3-H, dt, 15.7/7.6), 5.90 (2-Н, dd, 15.7/0.7), 4.05 (5-Н; m), 3.74 (OMe; s), 2.51 (6-H; m), 2.45 (4-H3; m), 1.09 (6-Me; d, 6.9), 0.88 (СМe3; s), 0.04 (SiMe; s), 0.03 (SiMe; s).
Метил(5S, 6R)-5-трет-бутилдиметилсилилокси-6-метил-8-фенил-окта-2(Е), 7Е-диеноат (G)
К перемешиваемому раствору альдегида F (25.0 мг, 0.08 ммоля) в 1.5 мл ТГФ при -78oС добавляли 0.80 мл охлажденной (-78oС) смеси бензилтрифенилфосфонийхлорида (268 мг, 0,69 ммоля, в 6.9 мл ТГФ) и н-бутиллития (280 мкл, 2.5 М в гексане). Через 15 минут охлаждающую баню удаляли и перемешивание продолжали в течение двух часов. Реакцию гасили насыщенным раствором хлористого аммония и ТГФ упаривали. Концентрат экстрагировали в гексан дважды и объединенные экстракты промывали солевым раствором, сушили и выпаривали. Оставшееся масло, 5: 1 смесь Е и Z изомеров, растворяли в 1.5 мл бензола, содержащего тиофенол (0.02 М) и 1.1'-азобис(циклогексанкарбонитрил) (VAZO, 0.006 М), и смесь кипятили с обратным холодильником в течение 5 часов. После охлаждения до комнатной температуры, добавляли гексан (15 мл) и органический раствор последовательно промывали 10% раствором NaOH и солевым раствором, сушили (МgSO4) и выпаривали. Хроматографирование остатка на силикагеле (2% ЕtOАс/гексан) приводило к получению 24 мг (выход 80%) продукта G.
[α]D +68.2o (с 1.5, СНСl3); EIMS m/z 374 (<1%; М+), 359 (1; М+-СН3), 317 (10; М+-Bu), 275 (10), 243, (73), 143 (20), 115 (10), 97 (64), 89 (31), 73 (100); HREIMS m/z 374.2232 (C22H34O3Si, Δ+4.5 mmu), 359.2031 (С21Н31O3Si, Δ+1.1 mmu). 317.1579 (C18H25O3Si, Δ-0.6 mmu); UV (MeOH) λmax(ε) 206 (33500), 252 (20100) nm; IR νmax 2952, 2855, 1725, 1657, 1435, 1257, 1168, 1097, 970, 836, 775 cm-1; 1H NMR δ 7.2-7.4 (Ph-H5; m), 6.96 (3-H; ddd, 15.6/7.8/7.5), 6.37 (8-Н; d, 15,9), 6.16 (7-Н; dd, 15.9/8.1), 5.84 (2-Н; d, 15.6), 3.75 (5-Н; ddd, 10.2/6.0/4.2), 3.72 (OMe; s), 2.44 (6-H;
m), 2.36 (4-H2; m), 1.10 (6-Me; d, 6.9), 0.91 (Si-CMe3; s), 0.06 (Si-Me, s), 0.05 (Si-Ме; s); 13С NMR δ 166.8 (1), 146.4 (3), 137.6 (Ph 1'), 131.9 (8), 130.4 (7), 128.5 (Ph 3'/5'), 127.0 (Ph 4'), 126.0 (Ph 2'/6'), 122.9 (2), 75.0 (5), 51.4 (ОМе), 42.8 (6), 37.6 (4), 25.9 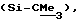 18.1
18.1 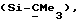 16.2 (6-Me), -4.4 (Si-Me), -4.5 (Si-Me), Calcd for C22H34O3Si: С, 70.52; Н, 9.17. Found: С. 70.72; Н, 9.42.
16.2 (6-Me), -4.4 (Si-Me), -4.5 (Si-Me), Calcd for C22H34O3Si: С, 70.52; Н, 9.17. Found: С. 70.72; Н, 9.42.
(5S, 6R)-5-трет-бутилдиметилсилилокси-6-метил-8-фенилокта-2Е,7Е-диеновая кислота (Н)
К раствору сложного эфира Сr (159 мг, 0,43 ммоля) в 7 мл ацетона было добавлено 5 мл 1 N LiOH. Смесь перемешивали при температуре 25oС в течение 3 часов, разбавляли 20 мл Et2O и окисляли 1 N Hcl до ~ рН 4. Органический слой отделили и промывали порциями по 20 мл рассола и воды, сушили (Mq SО4) и выпаривали. Оставшееся масло подвергали хромотографии на силикагеле (40% EtOAc в гексане, содержащем 0,5% АсОН с получением чистой кислоты Н в виде бледно-желтого маловязкого масла (145 мг, с выходом 95%).
[α] D +87.0o (с 1.4, CHCl3); EIMS m/z: 343 (1; M+-OH), 303 (5), 275 (9), 257 (4), 229 (62), 213 (16), 171 (22), 143 (37), 131 (16), 115 (23), 97 (100), 91 (44); HREIMS m/z 343.2107 (С21Н31O2Si, Δ-1.3 mmu), 229.1220 (С15Н17O2, Δ+0.9 mmu); UV λmax(ε) 206 (24500), 252 (15600) nm; IR νmax 3300-2800 (br), 2956, 2856, 1697, 1651, 1419, 1256, 1097, 836, 693 cm-1, 1H NMR δ 10.4 (CO2H; bs, W1/2≈100), 7.2-7.4 (Ph-H5; m), 7.09 (3-Н; ddd, 15.6/7.6/7.6), 6.39 (8-Н; d, 15.9), 6,16 (7-H; dd, 15.9/8.1), 5.85 (2-Н; d, 15.6), 3.78 (5-Н; ddd, 6.0/6.0/4.2), 2.46 (6-Н; m), 2.40 (4-Н2; m), 1.12 (6-Me; d, 6.9), 0.92 (Si-СМе3; s), 0.07 (SiMe2; s); 13С NMR δ 171.6 (1), 149.1 (3), 137.5 (Ph 1'), 131.8 (8), 130.5 (7), 128.5 (Ph 3'/5'), 127.1 (Ph 4'), 126.1 (Ph 2'/6'), 122.7 (2), 74.9 (5), 42.9 (6), 37.6 (4), 25,8 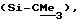 18.1
18.1 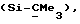 16.1 (6-Ме), -4.4 (Si-Me), -4.5 (Si-Me).
16.1 (6-Ме), -4.4 (Si-Me), -4.5 (Si-Me).
2,2,2-трихлорэтиловый эфир 3-(3-хлор-4-метоксифенил)-D-аланина (I)
Образец производного D-хлортирозина ВОС (160 мг, 0.35 ммоля) растворяли в 3 мл чистой трифторуксусной кислоты и оставляли при комнатной температуре на 1 час. Избыток реагента удаляли при пониженном давлении, возвращая желаемый амин I в виде трифторацетатной соли (165 мг, 100% выход).
[α] D +1.7o(с 5.2, СНСl3); IR νmax 3400-2500 (br), 1760, 1680, 1500, 1200, 1130, 1070, 805, 710 cm-1; 1H NMR δ 8.07 (NH2; br m, W1/2≈45), 7.27 (5-H; s), 7.12 (9-H; d, 8.1), 6.88 (8-H; d, 8.1), 4.86/4.67 (СН2СCl3; АВ q, -12.0), 4.41 (2-Н; bs, W1/2≈20), 3.86 (OMe; s), 3.33 (3-H; dd, -14.4/3.6), 3.22 (3-H'; dd, -14.4/6.6); 13C NMR δ 167.6 (1), 155.0 (7), 130.9 (5), 128.8 (9), 125.4 (4), 123.1 (6), 112.7 (8), 93.4 (ССl3), 75.3  56.1 (OMe), 54.2 (2), 34.9 (3).
56.1 (OMe), 54.2 (2), 34.9 (3).
Соединение J
К перемешиваемому раствору H (25 мг, 0.07 ммоля) в 3 мл безводного ДМФА в атмосфере аргона последовательно добавляли пентафордифенилфосфинат (FDPP, 32 мг, 0.08 ммоля), трифторацетатную соль 1 (35 мг, 0.07 ммоля) и диизопропилэтиламин (DIEA, 27 мг, приблизительно 36 мкл, 0.21 ммоля, приблизительно 3 эквивалента). Перемешивание продолжали в течение одного часа при 25oС и затем реакционную смесь экстрагировали 20 мл Et2O. Эфирный экстракт промывали 10 мл 1 N HCl, с последующей промывкой 10 мл насыщенного раствора NаНСО3, 20 мл рассола и 20 мл воды, сушили (MgSO4) и выпаривали. Оставшееся бледно-желтое масло подвергали хроматографии на силикагеле (15% ЕtOАс в гексане) с получением J в виде бесцветного масла (32 мг, с выходом 65%):
[α] D +11.8o (с 1.2, СНСl3); EIMS m/z: 644/646/648/650 (7/8/6/3; M+-Bu), 570/572/574 (46/100/21), 536/538 (18/15), 394/396 (67/29), 275 (20), 155/157 (29/9); HREIMS m/z 644.0981 (C29H34Cl4NO5Si, Δ-2.13 mmu): UV λmax(ε) 204 (54900), 230 (23200), 248 (19200), 284 (3500) nm; IR νmax 3290, 2980, 2850, 1760, 1680, 1640, 1505, 1380, 1270, 1169, 990, 720 cm-1; 1H NMR unit A δ 1.2-7.4 (Ph-H5; m), 6.87 (3-H; ddd, 15.0/7.8/7.5), 6.37 (8-H; d, 16.2), 6.18 (7-Н; dd. 16.2/8,1), 5.82 (2-Н; d, 15.0), 3.75 (5-H; ddd, 9.9/6.0/4.8), 2.46 (6-Н; m), 2.36 (4-Н2; m), 1.11 (6-Me; d, 6.9), 0.91 (SiCMe3; s), 0.07 (SiMe; s), 0.06 (SiMe; s); unit В δ 7.19 (5-H; d, 2.1), 7.04 (9-Н; dd, 8.4/2.1), 6.85 (8-H; d, 8.4), 5.85 (NH, d, 7.8), 5.08 (2-Н; ddd, 7.8/6.0/5.7), 4.81/4.74 (СН2ССl3; АВ q, -11.7), 3.87 (OMe; s), 3.22 (3-Н, dd, -14 1/5.7), 3.12 (3-Н'; dd,-14.1/6.0), 13C NMR unit A δ 165.1 (1), 143.0 (3), 137.6 (9), 132.0 (8), 130.4 (7), 128.5 (11/13), 127.0 (12), 126.0 (10/14), 124.7 (2), 75.0 (5), 42.6 (6), 37.6 (4), 25.9 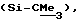 18.1
18.1 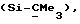 16.5 (6-Ме), -4.3 (Si-Me), -4.6 (Si-Me); unit B δ 170.1 (1), 154.3 (7), 131.1 (5), 128.5 (4/9), 122.6 (6), 112.2 (8), 94.2 (CCl3), 74.8
16.5 (6-Ме), -4.3 (Si-Me), -4.6 (Si-Me); unit B δ 170.1 (1), 154.3 (7), 131.1 (5), 128.5 (4/9), 122.6 (6), 112.2 (8), 94.2 (CCl3), 74.8 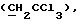 56.1 (OMe), 53.0 (2), 36.5 (3).
56.1 (OMe), 53.0 (2), 36.5 (3).
(1', R, 5S, 6R)-N-1'-(карбо-2'', 2'',2''-трихлорэтокси)-2'-(3-хлор-4-метоксифенил)этил-5-трет-бутилдиметилсилилокси-6-метил-8-фенил-окта-2Е, 7Е-диенамид (К)
К раствору J (50 мг, 0.07 ммоля) в 4 мл MeCN добавляли 400 мкл 50% водного раствора HF и смесь перемешивали в течение 1 часа при 25oС. Экстракция в 30 мл Et2O с последующим промыванием эфирного экстракта 30 мл порциями насыщенного раствора NaHCO3, рассола и воды, высушиванием (MgSO4) и выпариванием давала спирт К в виде бесцветной пены (40 мг, выход 95%):
[α]D -6.1o (с 1.3, СНСl3); EIMS m/z (rel intensity) 587/589/591/593 (М+, <1%), 552/554/556 (1/2/0.5), 456/458/460/462 (1/2/1/0.2), 342/344/346 (7/8/4), 212/214 (15/5), 195/197 (6/2), 155/157 (99/34), 131 (100), 91 (77); HREIMS m/z 587.0721 (C27H29 35Cl4NO5, Δ+7.9 mmu); UV λmax 204 (56500), 230 (22100), 248 (18100), 284 (3600) nm; IR νmax 3400, 3300, 2980, 1780, 1680, 1640, 1505, 1270, 1180, 1090, 1000, 770 cm-1, 1H NMR unit A δ 7.2-7.4 (Ph-H5; m), 6.92 (3-H; ddd, 15.3/7.8/7.5), 6.46 (8-Н; d, 15.9), 6.14 (7-Н; dd, 15.9/8.4), 5.90 (2-Н; d, 15.3), 3.65 (5-H; ddd 7.8/5.6/4.0), 2.39 (6-Н/4-Н2; bm), 1.78 (ОН; bs, W1/2≈40 Hz), 1.14 (6-Me; d, 6.9); unit В δ 7.18 (5-Н; d, 1.8), 7.03 (9-Н; dd, 8.4/1.8), 6.84 (8-H; d, 8.4), 5.97 (NH; d, 7.8), 5.06 (2-Н; ddd, 7.8/6.0/5.7), 4,79/4.72 (CH2CCl3; AB q, -12.0), 3.86 (OMe; s), 3.20 (3-H; dd, -14.1/5.7), 3.10 (3-H'; dd,-14.1/6.0). 13C NMR unit A δ 165.3 (1), 142.6(3), 137.0 (9), 131.7 (8), 131.0 (7), 128.5 (11/13), 127.3 (12), 126.1 (10/14), 125.0 (2), 73.8 (5), 43.2 (6), 37.2 (4), 16.8 (6-Me); unit В δ 170.2 (1), 154.2 (7), 131.0 (5), 128.4 (9), 128.3 (4), 122.5 (6), 112.2 (8), 94.2 (ССl3), 74.7 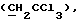 56.1 (OMe), 53.0 (2), 36.5 (3).
56.1 (OMe), 53.0 (2), 36.5 (3).
3-(трет-Бутоксикарбонил)амино-2,2-диметилпропановая кислота (М).
К раствору 3-амино-2,2-диметилпропан-1-ола (L) (3 г, 29 ммолей) в 51 мл 10% раствора триэтаноламина в МеОН добавляли ди-трет-бутил дикарбонат (6.7 г, 31 ммоль) и смесь перемешивали при 25oС в течение 1 часа. После удаления растворителя, остаток растворяли в CH2Cl2 (30 мл) и раствор дважды промывали 1 М раствором КНSО4 (рН 2) и один раз насыщенным раствором NaCl и сушили (МgSO4). Удаление растворителя в вакууме давало 5.8 г, (выход 93%) 3-(трет-бутоксикарбонил)амино-2,2-диметилпропанола в виде белого твердого вещества, которое непосредственно использовали для следующей стадии без дальнейшей очистки (выше 95% чистоты по данным ЯМР анализа), т.пл 70.5-71.5oС;
IR νmax 3350, 1685, 1456 cm-1; 1H NMR δ 4.87 (NH; br s), 3.72 (ОН; br s), 3.19 (1-H2; d, 5.1), 2.95 (3-H2, d, 6.0), 1.44 (СМе3; s), 0.85 (2-Мe2; s); 13С NMR (CDCl3) δ 157.6  79.7
79.7  68.1 (1), 47.1 (3), 36.7 (2), 28.3
68.1 (1), 47.1 (3), 36.7 (2), 28.3 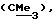 22,4 (2-Мe2).
22,4 (2-Мe2).
К раствору спирта 3-(трет-бутоксикарбонил)амино-2,2-диметилпропанола (5.3 г, 25.9 ммоля) и периодата натрия (16.6 г, 77.7 ммоля) в четыреххлористом углероде (52 мл), ацетонитриле (52 мл) и воде (78 мл) добавляли гидрат треххлористого рутения (122 мг) и смесь перемешивали при 25oС в течение 1 часа. Смесь отфильтровывали через целит и добавляли насыщенный раствор карбоната калия в воде (50 мл). Водный слой отделяли, промывали эфиром (20 мл), подкисляли HCl до рН 2 при 0oС и экстрагировали CH2Cl2 (и экстрагировали 3 раза по 30 мл). Объединенные экстракты промывали насыщенным раствором NaCl и сушили (MgSO4). Удаление растворителя в вакууме давало остаток, который сначала подвергали флеш-хроматографии с обращенной фазой на С18 кремниевой колонке (ODS 120 А, 50 до 90% МеОН) и затем кристаллизовали из эфира с получением 3.7 г, (выход 66%) М в виде белого твердого вещества, т.пл. 106-108oС;
EIMS m/z (rel intensity) 217 (0.1), 161 (11), 98 (25), 88 (71), 57 (100); HREIMS m/z, 217.1292 (C10H19NO4, Δ+2.2 mmu); IR νmax/ 3450-2500, 1710, 1694, 1510 cm-1; 1H NMR of major conformer δ 5.03 (NH; br s), 3.26 (3-H2; m), 1.45 (СМе3; s), 1.24 (2-Me2; s); 13С NMR (СОСl3) δ 183.2 (1), 156.3 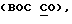 79.6
79.6 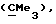 49.5/47.9 (2/3), 28.4
49.5/47.9 (2/3), 28.4 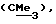 22.9 (2-Ме2).
22.9 (2-Ме2).
Аллил (2S)-2-гидрокси-4-метилпентаноат (N).
К раствору 2.66 г L-лейциновой кислоты (20 ммолей) и 1.74 г бикарбоната натрия (20 ммолей) в 30 мл воды при 0oС добавляли 30 мл раствора 6,44 г тетрабутиламмоний хлорида (20 ммолей) и 1.74 мл аллилбромида (20 ммолей) в CH2Cl2. После интенсивного перемешивания смеси в течение 24 часов, CH2Cl2 выпаривали. Добавляли около 50 мл воды и водный слой экстрагировали четыре раза Et2O. Эфирный раствор сушили над безводным сульфатом натрия и затем выпаривали. Остаток пропускали через короткую Si колонку с получением 3.21 г аллилового эфира N (выход 93%) в виде бесцветного масла,
[α] D -8.4o (с 1.1, СНСl3); IR νmax 3464, 2957, 1732, 1203, 1140, 1087 cm1; 1H NMR δ 5.92 (allyl 2-H; m), 5.34 (allyl 3-HZ; dd, 17.4/1.1), 5.28 (allyl 3-HE; dd, 10.5/1.1), 4.67 (allyl 1-H2; d, 5.7), 4.23 (2-H; br s), 2.64 (ОН; br s), 1.89 (4-H; m), 1.57 (3-H2; m), 0.96 (5-Н3; d, 6.5), 0.95 (4-Me; d, 6.7); 13C NMR δ 175.3 (1), 131.4 (allyl C-2), 118.6 (3), 68.9 (2), 65.7 (allyl C-1), 43.2 (3), 24.1 (4), 23.0 (5), 21.3 (4-Me).
Аллил (2S)-2-[3'(трет-Бутоксикарбонил)амино-2',2'-диметилпропаноилокси] -4-метилпентаноат (O).
К раствору 0.8 г М (3.7 ммоля), 0.76 г N (4.4 ммоля) и 92 мг DМАР в 10 мл сухого CH2Cl2 при 0oС добавляли 0.84 г DDC (4.1 ммоля) в CH2Cl2. Смесь перемешивали при 25oС в течение 3 часов и фильтровали. Фильтрат промывали насыщенным водным раствором бикарбоната натрия, сушили (Na2SO4) и выпаривали в вакууме. Флеш-хроматография (силикагель, 5% EtOAc/гексан) давала 1.0 г (выход 92%) чистого О в виде бесцветного масла, Rf 0.68 (17:83 EtOAc/гексан),
[α] D -29.4o (с 18.1, СНСl3); EIMS m/z (rel intensity) 371 (2, M+), 242 (13), 184 (12), 126 (20), 84 (100); HREIMS m/z 371.2317 (C19H33NO6, Δ-0.9mmu); IR (neat) νmax 3385, 2963, 1731, 1720, 1513 cm-1; 1H NMR (300 MHz, CDCl3) unit С δ 5.39 (NH; obscured br s), 3.33 (3-H;dd, -13.5/7.4), 3,27 (3-H'; dd, -13.5/5.9), 2.78 (2-H, m). 1.44 (CMe3; s), 1.23 (2-Me; s), 1.22 (2-Мe; s); unit D δ 5,91 (allyl 2-H, ddt, 16.6/10.3/6.0 Hz), 5.34 (allyl 3-H2; bd, 16.6), 5.27 (allyl 3-HE; bd, 10.3), 5.08 (2-H; dd, 9.6/3.6), 4.65 (allyl 1-H2; m), 1.6-1.9 (3-H2/4-H; m), 0.94 (5-Н3; d, 6.3), 0.94 (4-Me; d, 7.3). 13С NMR unit С δ 176.5 (1), 156.3 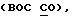 79.0
79.0 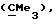 48.6 (3), 44.0 (2), 28.4
48.6 (3), 44.0 (2), 28.4 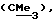 22.2/23.0 (2-Me2); unit D δ 170.6 (1), 131.4 (allyl C-2), 119.1 (allyl C-3), 70.9 (2), 66.0 (allyl C-1), 39.5 (3), 24.8 (4), 23.0 (5), 21.5 (4-Ме).
22.2/23.0 (2-Me2); unit D δ 170.6 (1), 131.4 (allyl C-2), 119.1 (allyl C-3), 70.9 (2), 66.0 (allyl C-1), 39.5 (3), 24.8 (4), 23.0 (5), 21.5 (4-Ме).
(2S)-2-[3'(трет-Бутоксикарбонил)амино-2', 2'-диметилпропаноилокси] -4-метилпентановая кислота (Р).
К 10 мл раствора 180 мг (0.49 ммоля) 0 и 60 мг (0.05 ммоля) тетракис(трифенилфосфин)палладия в сухом ТГФ (в атмосфере аргона) медленно добавляли 470 мкл (5.4 ммоля) сухого морфолина в течение 10 минут. После перемешивания в течение 50 минут, добавляли 40 мл эфира и раствор промывали 1 N HCl (40 мл) и затем экстрагировали насыщенным раствором бикарбоната натрия (2 раза по 30 мл). Водный экстракт подкисляли раствором 0.5 N HCl и экстрагировали эфиром (40 мл). Эфирный экстракт промывали водой (2 раза по 30 мл), сушили (MgSO4) и упаривали в вакууме с получением Р в виде бесцветного подвижного масла (152 мг, выход 95%):
[α] D -22.2o (с 2.2, CHCl3); EIMS m/z (rel intensity) 331 (1, M+), 275 (1), 258 (4), 231 (9), 202 (36), 174 (13), 144 (31), 126 (16), 114 (14), 98 (54), 88 (50), 84 9100); HREIMS m/z 331.2004 (C16H29NO6, Δ-1.0 mmu). 1H NMR (СDСl3) unit С δ 5.41 (NH; dd, 5.7/5.4), 3.30 (3-H2; m), 2.68 (2-H; m), 1.43  br s), 1.22 (2-Me; s), 1.21 (2-Me; s); unit D δ 6.47 (1-ОН; br s, W1/2≈35), 5.09 (2-H; dd, 9.3/2.7), 1.7-1.9 (3-Н2/4-Н; m), 0.97 (5-H3; d, 6.0), 0.94 (4-Me; d, 6.0). 13С NMR (СDСl3) unit С δ 176.5 (1), 156.5
br s), 1.22 (2-Me; s), 1.21 (2-Me; s); unit D δ 6.47 (1-ОН; br s, W1/2≈35), 5.09 (2-H; dd, 9.3/2.7), 1.7-1.9 (3-Н2/4-Н; m), 0.97 (5-H3; d, 6.0), 0.94 (4-Me; d, 6.0). 13С NMR (СDСl3) unit С δ 176.5 (1), 156.5 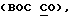 79.3
79.3 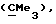 48.6 (3), 44.0 (2), 28.3
48.6 (3), 44.0 (2), 28.3 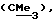 23.0 (2-Me), 22.2 (2-Me); unit D δ 175.4 (1), 70.6 (2), 39.5 (3), 24.8 (4), 23.0 (5), 21.4 (4-Me).
23.0 (2-Me), 22.2 (2-Me); unit D δ 175.4 (1), 70.6 (2), 39.5 (3), 24.8 (4), 23.0 (5), 21.4 (4-Me).
Соединение О.
К раствору спирта К (80 мг, 0.14 ммоля), кислоты Р (68 мг, 0.21 ммоля) и DМАР (4 мл) в сухом CH2Cl2 (4 мл), перемешиваемому при 0oС в атмосфере аргона, добавляли DDC (44 мг, 0.21 ммоля) в сухом CH2Cl2 (1 мл). Смесь перемешивали при 0oС в течение 30 минут, время в течение которого образовывался белый осадок, и затем позволяли нагреться до комнатной температуры и перемешивали дополнительно еще 4 часа. Осадок офильтровывали и фильтрат разбавляли Et2O (40 мл) и промывали последовательно разбавленным раствором HCl (1 М, 40 мл), насыщенным водным раствором бикарбоната натрия (40 мл), и рассолом (40 мл). Эфирный слой сушили (Мg2SO4) и выпаривали в вакууме с получением воскообразного твердого вещества. Хроматография (силикагель, ЕtOАс: гексан 1:3) дает чистый Q в виде бесцветного вязкого масла (103 мг, выход 84%),
[α] D-3.1o(с 2.9. CHCl3); EIMS m/z 800/802/804/806 (<1, М+-С5H8О2), 415/417/419/421 (5/3/3/2), 342/344/346 (7/9/4), 286/288/290 (2/6/2), 207 (34), 178 (22), 155/157 (66/24), 131 (36), 91 (70), 70 (100); HREIMS m/z 800.2179 (C38H48N2O8 35Cl4, Δ-1.4 mmu); UV (MeOH) λmax(ε) 204 (51200), 230 (18500), 248 (17200), 282 (2200) nm; IR (NaCl) νmax 3376, 2965, 1755, 1728, 1712, 1678, 1504, 1258, 1150, 1067, 732 cm-1. 1H NMR (CDCl3) δ unit A: 7.28-7.33 (10-Н/14-Н/11-Н/13-Н; m), 7.22 (12-Н; m), 6.78 (3-Н; ddd, 15.8/6.4/6.3), 6.40 (8-H; d, 15.8), 6.01 (7-Н; dd, 15.8/8.7), 5.88 (2-Н; d, 15.8), 5.06 (5-Н; bm, W1/2≈20 Hz), 2.62 (6-Н; M), 2.53 (4-Н2, bm, W1/2≈15 Hz), 1.12 (6-СН3; d, 6.8); unit В 7.18 (5-H; d, 2.0), 7.05 (9-H; dd, 8.5/2.0), 6.83 (8-H; d, 8.5), 6.49 (NH; d, 7.9), 5.06 (2-H; bm, W1/2≈20 Hz), 4.79/4.70 (СН2ССl3; ABq, -11.7), 3.85 (ОСН3; s), 3.20 (3-Нb; dd, -14.1/5.8), 3.07 (3-Н2; dd, -14.1/6.7); unit С 5.38 (NH; bt, 6.5), 3.27 (3-H2; d, 6.5), 1.20 (2-СН3; s), 1.15 (2-СН3'; s); unit D 4.92 (2-H; dd, 10.0/3.8), 1.72 (4-H; bm, W1/2≈20 Hz), 1.67 (3-Нb; ddd, -14.1/10.0/5.0/), 1.56 (3-Н2; ddd, -14.1/9.1/3.8), 1.43 (СО2СМe3; s), 0.86 (4-СН3; d, 6.4), 0,82 (5-Н3; d, 6.4). 13C NMR (CDCl3) δ unit A 165.4 (1), 139.3 (3), 136.9 (9), 131.7 (8), 130.1 (7), 128.6 (11/13), 127.5 (12), 126.2 (10/14), 125.4 (2), 76.5 (5), 41.1 (6), 33.4 (4), 16.7 (6-Me); unit В 170.0 (1), 154.1 (7), 131.2 (5), 128.8 (4), 128.5 (9), 122.3 (6), 112.1 (8), 94.3 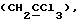 74.6
74.6 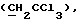 56.1 (7-ОМe), 53.2 (2), 36.6 (3); unit С 176.9 (1), 156.4
56.1 (7-ОМe), 53.2 (2), 36.6 (3); unit С 176.9 (1), 156.4 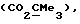 79.1
79.1 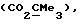 48.7 (3), 44.0 (2), 22.8 (2-Ме), 22.3 (2-Me'); unit D 170.7 (1), 71.4 (2), 39.5 (3), 28.4
48.7 (3), 44.0 (2), 22.8 (2-Ме), 22.3 (2-Me'); unit D 170.7 (1), 71.4 (2), 39.5 (3), 28.4 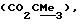 24.8 (4), 23.0 (4-Ме), 21.4 (5),
24.8 (4), 23.0 (4-Ме), 21.4 (5),
Аминокислота R.
К аминокислоте Q (100 мг, 0.11 ммоля) добавляли активированную цинковую пыль (400 мг, избыток) и АсОН (4 мл). Гетерогенную смесь подвергали воздействию ультразвука в течение 45 минут, перемешивали дополнительно в течение 90 минут при комнатной температуре и затем выливали на целитовую подкладку. Органическое вещество смывали с целитовой подкладки CH2Cl2. Растворитель удаляли в вакууме, оставляя карбоновую кислоту в виде бесцветного аморфного твердого вещества.
Полученную неочищенную кислоту без очистки растворяли в трифторуксусной кислоте (ТФУК, 5 мл) и позволяли оставаться при комнатной температуре в течение 1 часа. Спустя это время, избыток ТФУК удаляли в вакууме и получающееся аморфное твердое вещество затем подвергали хроматографической очистке (Sep-PakTM, силикагель, сначала CH2Cl2, затем 10% MeOH/CH2Cl2) с получением желаемого соединения в виде трифторацетатаммонийной соли. Повторная лиофилизация водного раствора соли дает свободную аминокислоту R в виде бесцветного аморфного твердого вещества (68 мг, выход 91% в двух стадиях); ИК (NaCl) νmax 3300, 3200, 2965, 1693, 1606, 1504, 1441, 1259, 1201, 1146, 1066, 727 cm-1. 1H NMR (CD3OD) δ unit A: 7.33 (10-Н/14-Н; d, 7.4), 7.28 (11-Н/13-Н; t, 7.4), 7.18-7.23 (12-Н; m), 6.69 (3-Н; ddd, 15.6/7.7/7.0), 6.43 (8-Н; d, 15.8), 6.04 (7-Н; dd, 15.8/8.9), 6.00 (2-Н; d, 15.6), 5.01 (5-Н; ddd, 9.1/6.9/3.1), 2.64 (4-Нb; bm, W1/2≈30 Hz), 2.60 (6-Н; bm, W1/2≈20 Hz), 2.49 (4-H2; ddd, 15.8/9.1/7.7), 1.13 (6-Me; d, 6.7); unit В 7.18-7.23 (5-Н; m), 7.11 (9-H; dd. 8.3/1.6), 6.92 (8-H; d, 8.3), 4.59 (2-H; bm, W1/2≈20 Hz). 3.81 (ОСН3; s), 3.14 (3-Hb; dd, -13.7/4.3), 2.96 (3-H2; m, W1/2≈20 Hz); unit С 2.96 (3-H2; bm, W1/2≈20 Hz), 1.31 (2-СН3; s), 1.25 (2-CH3'; s); unit D 4.90 (2-H; dd, 9.6/4.0), 1.66 (4-Н; bm, W1/2≈25 Hz), 1.59 (3-Hb; ddd, -14.4/9.6/4.8), 1.53 (3-Н2, ddd, -14.4/9.1/4.0), 0.81 (4-Me; d, 6.5), 0.74 (5-Н3; d, 6.5). 13С NMR (CD3OD) δ unit A 167.7 (1), 140.7 (3), 138.4 (9), 133.0 (8), 131.7 (7), 129.6 (11/13), 128.5 (12), 127.3 (10/14), 127.1 (2), 78.4 (5), 43.1 (6), 35.7 (4), 17.4 (6-Ме), unit В 179.8 (1), 155.2 (7), 132.3 (4), 132.1 (5), 130.1 (9), 123.0 (6), 113,4 (8), 56.6 (7-ОМе), 56.6 (2), 37.8 (3), unit С 176.8 (1), 48.2 (3), 42.2 (2), 23.3 (2-Ме), 23.3 (2-Me'), unit D 172.0 (1), 73.4 (2), 40.7 (3), 26.0 (4), 23.1 (4-Me), 21.8 (5).
Криптофицин 51
К перемешиваемому раствору аминокислоты Т (75 мг, 0.11 ммоля) в безводном ДМФА (20 мл) при комнатной температуре в атмосфере аргона добавляли диизопропилэтиламин (DIEA, 44 мг, 60 мкл, 0.34 ммоля, приблизительно 3 эквивалента) с последующим добавлением пентафтордифенилфосфината (FDPP, 55 мг, 0.14 ммоля, приблизительно 1,3 эквивалента) в ДМФА (2 мл). Смесь перемешивали в течение 12 часов, добавляли Et2O (40 мл) и H2O (40 мл), сушили (МgSO4) и упаривали при пониженном давлении. Остаточное воскообразное твердое вещество очищали далее с помощью хроматографии с обращенной фазой (ODC, 10 мкл 30% Н2О/МеСN, 3 мл мин-1) с получением Криптофицина 51 в виде бесцветного аморфного твердого вещества (45 мг, выход 61%),
[α] D +26.4o (с 0.25, CHCl3); EIMS m/z 652/654 (М+, 3/1), 632/634 (3/2), 426/428 (51/15), 227 (64), 195/197 (64/22), 155/157 (71/15), 131 (59), 91 (100); HREIMS m/z 652.2936 (С36H45N2O7 35Сl, Δ-2.1 mmu); UV (MeOH) λmax(ε) 204 (52000), 228 (20400), 250 (13400), 284 (2800) nm; IR (NaCl) νmax 3376, 3270, 2960, 1747, 1721, 1659, 1536, 1514, 1259, 1150, 1066, 1013, 980, 694 cm-1. 1H NMR (CDCl3) δ unit A 7.32 (10-Н/14-Н; dd. 8.0/1.5), 7.29 (11-Н/13-Н; t, 8.0), 7.24 (12-Н; bm, W1/2≈15 Hz), 6.77 (3-Н; ddd, 15.2/10.8/4.3), 6.40 (8-Н; d, 15.8), 6.01 (7-Н; dd, 15.8/8.8), 5.76 (2-Н; dd, 15.2/1.1), 5.04 (5-Н; ddd, 11.1/6.4/1.9), 2.54 (4-Нb/6-Н; bm, W1/2≈15 Hz), 2.37 (4-Ha; ddd, -14.3/11.1/10.8), 1.13 (6-Me; d, 6.8); unit B 7.20 (5-Н; d, 2.0), 7.05 (9-Н; dd, 8.4/2.0), 6.84 (8-Н; d, 8.4), 5.61 (NH; d, 7.8), 4.74 (2-Н; ddd, 7.8/7.6/5.4), 3.87 (OMe; s), 3.11 (3-Нb; dd, -14.2/5.4), 3.06 (3-Нa; dd, -14.2/7.6); unit С 7.24 (NH; bm. W1/2≈15 Hz), 3.40 (3-Hb; dd, -13.5/8.5), 3.12 (3-Нa; dd. -13.5/3.6), 1.22 (2-Ме; s), 1.15 (2-Me', s); unit D 4.85 (2-H; dd, 10.2/3.6), 1.66 (3-Hb, ddd, -14.0/10.2/4.6), 1.61 (4-H; bm W1/2≈20.0 Hz), 1.33 (3-Ha, ddd, -14.0/9.0/3.6), 0.74 (4-Me; d, 6.6), 0.72 (5-Н3; d, 6.6). 13С NMR (CDC13) δ unit A 165.1 (1), 142.2 (3), 136.7 (9), 131.7 (8), 130.1 (7), 128,6 (11/13), 127.5 (12), 126.1 (10/14), 124.6 (2), 77.0 (5), 42.2 (6), 36.5 (4), 17.3 (6-Me); unit В 170.3 (1), 154.1 (7), 130.9 (5), 129.5 (4), 128.3 (9), 122.5 (6), 112.3 (8), 56.1 (7-ОМе), 54.2 (2), 35.3 (3); unit C 178.0 (1), 46.5 (3), 42.7 (2), 22.8 (2-Ме), 22.6 (2-Me'), unit D 170.6 (1), 71.5 (2), 39.5 (3), 24.5 (4), 22.7 (4-Ме), 21.2 (5).
Пример 9. Синтез Криптофицина 52 и Криптофицина 53.
К перемешиваемому раствору Криптофицина 51 (75 мг, 0.12 ммоля) в безводном дихлорметане при 0oС в атмосфере аргона добавляли раствор м-хлорпербензойной кислоты (mСРВА, 50 мг, 0.23 ммоля, приблизительно 2 эквивалента на 80% активный кислород) в дихлорметане (1 мл). Спустя 30 минут реакционной смеси позволяют нагреться до комнатной температуры и перемешивают дополнительно в течение 12 часов. Затем растворитель удаляют при пониженном давлении с получением 1.8:1 смеси Криптофицинов 52 и 53 (по данным ЯМР анализа), соответственно, в виде аморфного твердого вещества. Смесь региоизомерных эпоксидов растворяли в минимальном количестве ацетонитрила и подвергали хроматографированию с обращенной фазой (YMC-ODS, 10 мк, 250 мм•22.5 мм, 30% H2O/MeCN, 6 мл мин-1) для разделения Криптофицина 52 (37 мг, выход 48%) и Криптофицина 53 (19 мг, выход 25%).
Спектральные данные для Криптофицина 52
[α] D +19.9o (с 0.5. СНСl3); EIMS m/z 668/670 (4/2, M+), 445 (35), 244 (12), 227 (22), 195/197 (66/27), 184 (45), 155/157 (38/10), 91 (100); HREIMS m/z 668.2873 (C36H45N2O8 35Cl, Δ-0.9 mmu), 445.2497 (С25Н35NО6, Δ-3.3 mmu); UV (MeOH) λmax(ε) 204 (35100), 218 (20900) nm; IR (NaCl) νmax 3415, 3270, 2960, 1748, 1721, 1650, 1536, 1504, 1260, 1192, 1150, 1066, 1013, 800, 698 cm-1. 1H NMR (CDCl3) δ unit A 7.33-7.38 (11-Н/12-Н/13-Н; bm, W1/2≈25 Hz), 7.24 (10-H/14-H; m, W1/2≈15 Hz), 6.76 (3-H; ddd, 15.1/10.8/4.3), 5.71 (2-H; dd, 15.1/1.7), 5.20 (5-H; ddd, 11.0/5.0/1.8), 3.68 (8-H; d, 1.9), 2.92 (7-H; dd, 7.5/1.9), 2.57 (4-Нb; ddd, -14.6/1.8/1.7), 2.45 (4-Ha; ddd, -14.6/11.0/10,8), 1.78 (6-H; bm, W1/2≈15 Hz), 1.14 (6-Me; d, 6.9), unit В 7.18 (5-H; d, 2.2), 7.04 (9-H; dd, 8.4/2.2), 6.83 (8-Н; d, 8.4), 5.56 (NH; d, 7.9), 4.73 (2-Н; ddd, 7.9/7.4/5.3), 3.87 (OMe; s), 3.09 (3-Hb; dd, -14.6/5.3), 3.05 (3-Ha, dd, -14.6/7.4); unit С 7.20 (NH; dd, 8.6/3.2), 3.41 (3-Hb; dd, -13.4/8.6), 3.10 (3-Ha, dd, -13.4/3.2), 1.22 (2-Me; s), 1.15 (2-Me'; s); unit D 4.82 (2-H; dd, 10.2/3.5), 1.73 (3-Hb; bm, W1/2≈20 Hz), 1.66 (4-H; bm, W1/2≈20 Hz), 1.31 (3-Ha, ddd, -13.8/9.1/3.5), 0.84 (4-Me; d, 6.6), 0.82 (5-H3; d, 6.6); 13C NMR (СDСl3) δ unit A 164.9 (1), 141.8 (3), 136.7 (9), 128.7 (11/13), 128.3 (12), 125.6 (10/14), 124.7 (2), 75.9 (5), 63.0 (7), 59.0 (8), 40.7 (6), 36.9 (4), 13.5 (6-Ме), unit В 170.3 (1), 154.1 (7), 130.9 (5), 129.5 (4), 128.5 (9), 122.6 (6), 112.4 (8), 56.1 (7-ОМе), 54.3 (2), 35.3 (3), unit С 178.0 (1), 46.5 (3), 42.8 (2), 22.8 (2-Me), 22.8 (2-Me'), unit D 170.5 (1), 71.2 (2), 39.3 (3), 24.6 (4), 22.7 (4-Ме), 21.2 (5).
Спектральные данные для Криптофицина 53
[α] D +20,8o (с 1.7, СНСl3); EIMS m/z 668/670 (5/4, М+), 445 (32), 244 (15), 227 (24), 195/197 (64/21), 184 (60), 155/157 (33/9), 91 (100); HREIMS unit 668.2853 (С36Н45N2Oa 35Сl, Δ1.1 mmu); UV (МеОН) λmax(ε) 204 (38700), 218 (22900) nm; IR (NaCl) νmax 3415, 3280, 2917, 2849, 1748, 1722, 1660, 1504, 1465, 1260, 1190, 1150, 1066, 755 cm-1. 1H NMR (CDCl3) δ unit A 7.29-7.36 (11-H/12-H/13-H, bm, W1/2≈20 Hz), 7.23 (10-H/14-H; dd, 8.3/1.7), 6.77 (3-H; ddd, 15.1/10.9/4.3), 5.81 (2-H; dd, 15.1/1.3), 5.17 (5-H; ddd, 11.2/4.9/1.8), 3,58 (8-H; d, 1.7), 2.90 (7-H; dd, 7.8/1.7), 2.67 (4-Hb; ddd, 14.7/11.2/10.9), 2.56 (4-Ha; dddd, 14.7/4.3/1.8/1.3), 1.67-1.78 (6-H; bm, W1/2≈45), 1.03 (6-CH3; d, 7.1); unit В 7.21 (5-H; d, 2.1), 7.07 (9-H; dd, 8.5/2.1), 6.84 (8-H; d, 8.4), 5.90 (2-NH; d, 7.9), 4.75 (2-H; ddd, 7.9/7.9/4.9), 3.85 (7-ОСН3; s), 3.14 (3-Hb; dd, 14.5/4.9), 3.03 (3-Ha; dd, 14.5/7.9); unit С 7.29-7.36 (3-NH; bm, W1/2≈25), 3.43 (3-Нb; dd. 13.7/8.8), 3.10 (3-Ha; dd, 13.7/3.4), 1.23 (2-СН3; s), 1.17 (2-СН3'; s); unit D 4.92 (2-H; dd, 10.3/3.2), 1.67-1.78 (3-Нb/4-Н; bm, W1/2≈45), 1.48 (3-Ha; ddd, 13.9/8.8/3.2), 0.89 (4-СН3; d, 6.6), 0.86 (5-H3; d, 6.6). 13С NMR (CDCl3) δ unit A 165.1 (1), 142.0 (3), 137.0(9), 128.5 (11/13), 128.5 (12), 125.3 (10/14), 124.6 (2), 76.7 (5), 63.2 (7), 56.2 (8), 40.8 (6), 36.7 (4), 13.4 (6-Mе); unit B 170.4 (1), 154.0 (7), 130.8 (5), 129.7 (4), 128.2 (9), 122.5 (6), 112.3 (8), 56.1 (7-ОМе), 54.4 (2), 35.3 (3); unit С 177.9 (1), 46.4 (3), 42.7 (2), 23.0 (2-Me), 22.7 (2-Me'); unit D 170.5 (1), 71.3 (2), 39.2 (3), 24.7 (4), 22.8 (4-Ме), 21.3 (5).
Пример 10. Синтез Криптофицина 55
К раствору Криптофицина 52 (6 мг, 0.009 ммоля) в 0.6 мл 2:1 смеси 1,2-диметоксиэтан/вода добавляли 2 мкл 12 N раствора HCl. Раствору позволяли перемешиваться при комнатной температуре в течение 20 часов, нейтрализовали карбонатом калия, фильтровали через 5 мк фильтр и упаривали. Вещество, нерастворимое в ацетонитриле, очищали с помощью гель-проникающей хроматографии с обращенной фазой на С18 колонке (250•10 мм колонка) с использованием 4:1 смеси MeOH/H2O с получением 3,0 мг Криптофицина 55 (выход 48%).
[α] D +42.5o (с 1.1, CHCl3); EIMS m/z 704/706/708 (М+<1), 668/670 (1.5/0.5, M+-HCl), 445 (6), 226 (8), 195/197 (16/5), 184 (10), 155/157 (33/11), 135 (100), 91 (99), 77 (30); HREIMS m/z 668.2873 (M+-HCl, C36H45N2O8 35Cl, Δ-0.8 mmu); UV (MeOH) λmax(ε) 204 (48400), 218 (29200), 284 (1600) am; IR (NaCl) νmax 3410, 3286, 2959, 1748, 1723, 1666, 1538, 1504, 1455, 1257, 1178, 1066, 753 cm-1. 1H NMR (CDCl3) δ unit A 7.35-7.42 (10-Н/11-Н/12-Н/13-Н/14-Н; m), 6.78 (3-H; ddd, 15.1/10.6/4.5), 5.78 (2-H; dd, 15.1/1.7), 5.16 (5-H; ddd, 11.1/8.3/2.1), 4.65 (8-H; d, 9.7), 4.01 (7-H; bd, 9.7), 2.69 (4-Нb; dddd, -14.5/4.5/2.1/1.7), 2.50 (6-H; bm, W1/2≈15), 2.38 (4-Ha; ddd, -14.5/11.1/10.6), 1.53 (7-OH, s), 1.04 (6-Ме, d, 7.1); unit В 7.21 (5-H; d, 2.2), 7.07 (9-H; dd, 8.5/2.2), 6.85 (8-H; d. 8.5), 5.57 (2-NH; d, 7.8), 4.74 (2-H; ddd, 7.8/7.6/5.2), 3.88 (7-ОСН3; s), 3.13 (3-Hb; dd. 14.5/5.2), 3.05 (3-Ha; dd, 14.5/7.6); unit С 7.21 (3-NH; m), 3.38 (3-Hb; dd, 13.5/8.3), 3.17 (3-Ha; dd, 13.5/4.1), 1.23 (2-CH3; s), 1.17 (2-CH3; s), unit D 4.93 (2-H; dd, 10.1/3.5), 1.78 (3-Hb; ddd, 13.5/10.1/5.0), 1.72 (4-H; bm, W1/2≈20), 1.43 (3-Ha; ddd, 13.5/8.8/3.5), 0.92 (4-СН3; d. 6.6), 0.92 (5-Н3, d, 6.4), 13C NMR (CDCl3) δ unit A 165.1 (С-1), 142.4 (С-3), 138.4 (С-9), 129.0 (С-11/13), 128.3 (С-12), 128.0 (С-10/14), 124.6 (С-2), 76.1 (С-5), 74.1 (С-7), 62.0 (С-8), 38.4 (С-6), 36.5 (С-4), 8.6 (6-Me); unit В 170.3 (С-1), 154.1 (С-7), 130.9 (С-5), 129.6 (С-4), 129.2 (С-9), 122.6 (С.6), 112.3 (С-8), 56.1 (7-ОМе), 54.3 (С-2), 35.3 (C-3); unit С 177.8 (С-1), 46.5 (С-3), 42.8 (С-2), 22.9 (2-Ме), 23.0 (C-2-Me'); unit D 170.3 (С-1), 71.3 (С-2), 39.7 (С-3), 24.8 (С-4), 22.7 (4-Мe), 21.6 (C-5).
Получали также соответствующий диол, Криптофицин 56 (2.8 мг, выход 44%).
Пример 11. Синтез Криптофицина 57
Небольшое количество РtO2 (около 1 мг) добавляли в склянку, содержащую 0.5 мл CH2HCl2. Удаляли воздух из склянки и вводили Н2 и смесь перемешивали при комнатной температуре в течение 20 минут. Добавляли раствор, содержащий 10.2 мг Криптофицина 52 (0.015 ммоля) в CH2HCl2 (0.3 мл), и смесь перемешивали при комнатной температуре в течение 20 минут. Катализатор удаляли фильтрованием через целит/хлопковую ткань и растворитель удаляли в вакууме. Жидкостная гель-проникающая хроматография с обращенной фазой (ODS, 10 мк, 250•22.5 мм, MeCN/Н2О (3:1), 5 мл мин-1) давала чистый Криптофицин 57 (9.1 мг, выход 89%).
[α] D +3.4 (с= 4.5, СНСl3); EIMS m/z 670/672 (M+, 9/3), 447 (10), 246 (63), 229 (20), 195/197 (78/25), 184 (58), 155/157 (39/13), 128 (21), 91 (100), 77 (23); HREIMS m/z 670.3037 (С36H47N2O8 35Cl, Δ-1.6 mmu); UV (MeOH) λmax(ε) 204 (31400), 218 (12000), 284 (1200) nm; 1H NMR (CDCl3) δ unit A: 7.30-7.37 (11/12/13-H, bm), 7.23 (10/14-H, bdd, 7.9, 1.9), 5.03 (5-Н, ddd, 9.0, 5.6, 3.4), 3.66 (8-H, d, 2.1). 2.89 (7-Н, dd, 7.7, 2,1), 2.27 (2-Hb, ddd, 14.3, 8.7, 6.2), 2.04 (2-Нa, ddd, 14.3, 8.8, 6.8), 1.64-1.75 (6-Н/4-Н2, bm), 1.61 (3-H2, bm, W1/2≈25), 1.11 (6-СН3, d, 7.1), unit В: 7.19 (5-Н, d, 2.1), 7.04 (9-Н, dd, 8.3, 2.1), 6.83 (8-H, d, 8.3), 5.55 (2-NH, d, 8.3), 4.65 (2-Н, ddd, 8.3, 7.3, 5.3), 3.87 (7-OСН3, s), 3.16 (3-Нb, dd, 14.3, 7.3), 3.08 (3-Нa, dd, 14.3, 5.3), unit С: 6.91 (3-NH, dd, 6.4, 6.4), 3.41 (3-Нb, dd, 13.5, 6.4), 3.30 (3-Нa, dd, 13.5, 6.4), 1.21 (2-СН3, s), 1.13 (2-СН2', s), unit D: 4.80 (2-Н, dd, 9.8, 4.1), 1.64-1.75 (3-Hb/4-H, bm), 1.34 (3-Ha, ddd, 15.4, 10.1, 4.1), 0.86 (4-СН3, d, 6.5), 0.84 (5-H3, d, 6.5); 13C NMR (CDCl3) δ unit A: 172.6 (1), 136.9 (9), 128.7 (11/13), 128.5 (12), 125.6 (10/14), 76.8 (5), 63.4 (7), 59.2 (8), 40.2 (6), 36.2 (2), 32.2 (4), 21.4 (3), 13.6 (6-Me), unit В: 170.4 (1), 154.0 (7), 131.1 (5), 130.0 (4), 128.5 (9), 122.5 (6), 112.2 (8), 56.1 (7-ОМe), 54.3 (2), 35.3 (3), unit C: 177.6 (1), 47.0 (3), 43.1 (2), 22.5 (2-Мe'), 22.4 (2-Me), unit D: 171.7 (1), 72.0 (2), 39.0 (3), 24.6 (4), 22.8 (4-Мe), 21.8(5).
Пример 12. Синтез Криптофицина 58
К перемешиваемому раствору Криптофицина 57 (5.5 мг, 0.008 ммоля) в 3 мл хлороформа, свободного от этанола, при температуре около -60oС добавляли TMSCI (использовали в таком виде, как получали из Aldrich, около 4.5 мг, около 5.2 мкл, около 0.04 ммоля). Реакционную смесь перемешивали в течение 20 минут, время за которое не оставалось исходного материала. Затем летучие компоненты, удаленные при пониженном давлении, оставляли аморфное твердое вещество. Это вещество поглощали ацетонитрилом и подвергали обработке с помощью жидкостной гель-проникающей хроматографии (ODS, 10 мк, 250•22.5 мм, MeCN/H2O (3: 1), 5 мл мин-1) для выделения чистого Криптофицина 58 (5.4 мг, выход 93%) в виде основного продукта.
[α] D +7.2 (с=2.1, СНСl3); EIMS m/z 706/708/710 (М+, 27/23/8), 670/672 (M+-HCl, 14/13), 583 (54), 581 (53), 485 (23), 483 (21), 447 (34), 294 (21), 282 (39), 246 (57), 195/197 (87/27), 184 (73), 155/157 (45/10), 128 (30), 91 (95), 77 (30), 69 (100); HREIMS m/z 706.2844 (С36Н48N2O8 35Сl2, Δ-5.6 mmu), m/z 670.3070 (M+-HCl, С36Н47N2O8 35Сl,  -4.9 mmu); UV (MeOH) λmax(ε) 204 (331900), 218 (11800), 284 (1800) nm; 1H NMR (CDCl3) δ unit A: 7.34-7.42 (10/11/12/13/14-Н, bm), 5.01 (5-Н, ddd, 9.6, 8.3. 2.5), 4.65 (8-Н, d, 9.6), 4.00 (7-H, dd, 9.6, 1.9), 2.42 (6.Н, ddq, 8.3, 1.9, 7.0), 2.29 (2-Нb, ddd, 14.3. 9.4, 4.5), 2.06 (2-Ha, ddd, 14.3, 8.3, 7.5), 1.62-1.82 (3-H2/4-H2, bm), 0.99 (6-СН3, d, 7.0), unit В: 7.20 (5-H, d, 2.1), 7.06 (9-Н, dd, 8.3, 2.1), 6.84 (8-Н, d, 8.3), 5.62 (2-NH, d, 8.3), 4.61 (2-Н, ddd, 8.3, 7.7, 5.4), 3.87 (7-ОСН3, s), 3.17 (3-Нb, dd, 14.3, 7.7), 3.11 (3-Ha, dd, 14.3, 5.4), unit C: 6.97 (3-NH, dd, 6.4. 6.2), 3.43 (3-Нb, dd, 13.4, 6.2), 3.31 (3-Нa, dd, 13.4, 6.4), 1.23 (2-СН3, s), 1.16 (2-СН3', s), unit D: 4.93 (2-Н, dd, 10.0, 4.0), 1.86 (3-Hb, ddd, 14.0, 10.0, 5.5), 1.58 (3-Ha, ddd, 14.0, 8.3, 4.0), 0.97 (4-CH3, d. 6.8), 0.94 (5-Н3, d, 6.6); 13C NMR (CDCl3) δ unit A: 172.8 (1), 138.7 (9), 129.0 (12), 128.9 (11/13), 128.0 (10/14), 76.5 (5), 73.8 (7), 62.1 (8), 38.1 (6), 35.9 (2), 31.8 (4), 21.4 (3), 8.7 (6-Me), unit В: 170.6 (1), 153.9 (7), 131.0 (5), 130.2 (4), 128.5 (9), 122.4 (6), 112.2 (8), 56.1 (7-ОМе), 54.4 (2), 35.0 (3), unit С: 177.2 (1), 47.0 (3), 43.2 (2), 22.5 (2-Ме'), 22.4 (2-Me), unit D: 171.8 (1), 72.0 (2), 39.4 (3), 24.9 (4), 22.9 (4-Мe), 21.7 (5).
-4.9 mmu); UV (MeOH) λmax(ε) 204 (331900), 218 (11800), 284 (1800) nm; 1H NMR (CDCl3) δ unit A: 7.34-7.42 (10/11/12/13/14-Н, bm), 5.01 (5-Н, ddd, 9.6, 8.3. 2.5), 4.65 (8-Н, d, 9.6), 4.00 (7-H, dd, 9.6, 1.9), 2.42 (6.Н, ddq, 8.3, 1.9, 7.0), 2.29 (2-Нb, ddd, 14.3. 9.4, 4.5), 2.06 (2-Ha, ddd, 14.3, 8.3, 7.5), 1.62-1.82 (3-H2/4-H2, bm), 0.99 (6-СН3, d, 7.0), unit В: 7.20 (5-H, d, 2.1), 7.06 (9-Н, dd, 8.3, 2.1), 6.84 (8-Н, d, 8.3), 5.62 (2-NH, d, 8.3), 4.61 (2-Н, ddd, 8.3, 7.7, 5.4), 3.87 (7-ОСН3, s), 3.17 (3-Нb, dd, 14.3, 7.7), 3.11 (3-Ha, dd, 14.3, 5.4), unit C: 6.97 (3-NH, dd, 6.4. 6.2), 3.43 (3-Нb, dd, 13.4, 6.2), 3.31 (3-Нa, dd, 13.4, 6.4), 1.23 (2-СН3, s), 1.16 (2-СН3', s), unit D: 4.93 (2-Н, dd, 10.0, 4.0), 1.86 (3-Hb, ddd, 14.0, 10.0, 5.5), 1.58 (3-Ha, ddd, 14.0, 8.3, 4.0), 0.97 (4-CH3, d. 6.8), 0.94 (5-Н3, d, 6.6); 13C NMR (CDCl3) δ unit A: 172.8 (1), 138.7 (9), 129.0 (12), 128.9 (11/13), 128.0 (10/14), 76.5 (5), 73.8 (7), 62.1 (8), 38.1 (6), 35.9 (2), 31.8 (4), 21.4 (3), 8.7 (6-Me), unit В: 170.6 (1), 153.9 (7), 131.0 (5), 130.2 (4), 128.5 (9), 122.4 (6), 112.2 (8), 56.1 (7-ОМе), 54.4 (2), 35.0 (3), unit С: 177.2 (1), 47.0 (3), 43.2 (2), 22.5 (2-Ме'), 22.4 (2-Me), unit D: 171.8 (1), 72.0 (2), 39.4 (3), 24.9 (4), 22.9 (4-Мe), 21.7 (5).
Пример 13. Синтез Криптофицина 61
К раствору Криптофицина 53 (5 мг, 0.007 ммоля) в сухом бензоле добавляли сульфид трифенилфосфина (4 мг, 0.014 ммоля) с последующим добавлением 0.65 мкл трифторуксусной кислоты в виде раствора в сухом бензоле (100 мкл). Раствору позволяли перемешиваться при комнатной температуре в течение 6 часов, нейтрализовали бикарбонатом натрия, фильтровали и упаривали. Остаток разделяли между водой и CH2Cl2. Вещество, растворимое в CH2Cl2, очищали с помощью гель-проникающей хроматографии с обращенной фазой на С18 колонке с использованием 4:1 смеси МеОН/Н2О с получением чистого Криптофицина 61 (1.9 мг, выход 37%).
[α] D +28.4 (с=0.7, СНСl3); EIMS m/z 684/686 (M+, not observed), 652/654 (M+-S, 5/4), 426/428 (90/29), 294 (10), 227 (100), 195/197 (57/20), 184 (20), 155/157 (34/9), 131 (45), 129 (44), 91 (76), 77 (27); HREIMS m/z 652.2973 (M+-S, C36H45N2O7 35Cl, Δ-5.8 mmu); UV (MeOH) λmax(ε) 204 (26700), 218 (11600), 284 (820) nm; IR (NaCl) νmax 3410, 3271, 2958, 1749, 1724, 1670, 1503, 1463, 1258, 1176, 1066, 758 cm-1. 1H NMR (CDCl3) δ unit A 7.29-7.34 (11/12/13-Н; m), 7.25 (10/14-Н, bd, 6.6), 6.73 (3-H, ddd, 15.2/10.6/4.5), 5.66 (2-Н; dd, 15.2/1.7), 5.22 (5-Н, ddd, 11.2/4.2/2.0), 3.68 (8-Н, d, 5.1), 3.01 (7-Н, dd. 8.4/5.1), 2.52 (4-Нb, dddd, -14.4/4.5/2.0/1.7). 2.41 (4-Ha, ddd, -14.4/11.2/10.6), 1.68-1.74 (6-Н, m), 1.14 (6-Me, d, 6.9); unit В 7.18 (5-H, d, 2.2), 7.04 (9-Н, dd, 8.4/2.2), 6.84 (8-Н, d, 8.4), 5.45 (NH, d, 7.8), 4.75 (2-Н, ddd, 7.8/7.3/5.4), 3.87 (OMe, s), 3.09 (3-Hb, dd, -14.5/5.4), 3.05 (3-Нa, dd, -14.5/7.3); unit С 7.17 (NH, dd, 8.3, 3.9), 3.39 (3-Hb, dd, -13.5/8.3), 3.14 (3-Ha, dd, -13.5/3.9), 1.23 (2-Me, s), 1.16 (2-Me', s); unit D 4.86 (2-Н, dd, 10.2/3.4), 1.77 (3-Hb, ddd, -14.0/10.2/4.9), 1.68-1.74 (4-Н, m), 1.42 (3-Нa, ddd, -14.0/8.7/3.4), 0.92 (4-Me, d, 6.6), 0.88 (5-Н3, d, 6.4). 13С NMR (СDСl3) δ unit A 164.9 (1), 141.7 (3), 138.3 (9), 128.8 (11/13), 128.0 (12), 126.7 (10/14), 124.7 (2), 76.6 (5), 45.8 (7), 43.9 (8), 43.9 (6), 36.6 (4), 16.0 (6-Me), unit В 170.2 (1), 154.1 (7), 130.9 (5), 129.4 (4), 128.3 (9), 122.8 (6), 112.4 (8), 56.1 (7-ОМе), 54.2 (2), 35.3 (3), unit C 177.9 (1), 46.5 (3), 42.7 (2), 22.9 (2-Me), 22.8 (2-Me'), unit D 170.4 (1), 71.3 (2), 39.4 (3), 24.7 (4), 22.7 (4-Me), 21.4 (5).
Пример 14 Синтез Криптофицина 81
Соединение S
Соединение S представляет трет-бутилдифенилсилиловый эфир (TBDVS) производное F.
Соединение Т
К 10 мл ТГФ раствора п-метоксибензилтрифенилфосфоний хлорида (1 ммоля) при -78oС добавляли 400 мкл бутиллития (1 ммоль, 2.5 М в гексане). Смесь перемешивали в течение 30 минут и затем добавляли 2.64 мл аликвоту 3 мл ТГФ раствора альдегида S (75.0 мг, 0.24 ммоля) при -78oС. Спустя 30 минут, охлаждение прекращали, но перемешивание продолжали дополнительно в течение двух часов, время в течение которого температура медленно поднималась до 25oС. Реакцию гасили насыщенным раствором хлористого аммония и ТГФ упаривали. Продукт экстрагировали в гексан дважды и объединенные органические экстракты промывали рассолом, сушили и затем концентрировали. Остаток переносили в флеш-колонку с силикагелем (3% ЕtOАс/гексан) и получали 63 мг соединения Т и 40 мг смеси Т и Z-изомеров.
Соединение Т имело следующие свойства:
[α] D +110.5o (СНСl3, с 0.75); IR νmax 2956, 2857, 1724, 1608, 1511, 1428, 1250, 1173, 1111, 1037, 821, 703, 505 cm-1: EIMS m/z (relative intensity %) 497 (<1, M+-OMe), 471 (31, M+-Bu'), 367 (56), 294 (31), 199 (75), 135 (100); high-resolution EIMS 497.24770 (calcd for C32H37O3Si, Δ+3.5 mmu, M+-ОМе), 471.19859 (calcd for С29Н31O4Si, Δ+0.6 mmu, M+-Bu'). 1H NMR δ 7.71/7.68 (SiPh2, 2'-H, 6'-H/2''-H, 6''-H; d; 6.5), 7.45/7.43 (SiPh2, 4'-H/4''-H; t; 7.4), 7.39/7.38 (SiPh2, 3'-Н, 5'-Н/3"-Н, 5''-Н; dd; 7.4. 6.5), 7.24 (10-Н, 14-Н; d; 8.7), 6.85 (11-H, 13-H; d; 8.7), 6.79 (3-H; dt; 15.7, 7.5), 6.19 (8-Н, d, 16.1), 6.00 (7-Н, dd, 16.1. 8.1), 5.66 (2-Н, dt, 15.7, 1.3), 3.82 (5-Н, m), 3.81 (-ОСН3, S), 3.69 (CO2CH3, S), 2.41 (6-Н, m), 2.36 (4-Н, m), 2.30 (4-Н, m), 1.12 (6-СН3, d, 7.0), 1.09 (CMe3, S). 13С NMR δ 166.7 (1), 158.8 (12), 146.0 (3), 136.0 (SiPh2, 2', 6'/2'', 6''), 134.1/133.7 (SiPh2, 1'/1''), 130.4 (9), 130.0 (8), 129.7/129.6 (SiPh2, 4'/4''), 129.5 (7), 127.6/127.5 (3', 5'/3'', 5''), 127.1 (10, 14), 122.8 (2), 113.9 (11, 13), 76.4 (5), 55.2 (ОСН3), 51.3 (СО2СН3), 42.1 (6), 37.1 (4), 27.0 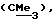 19.5
19.5 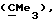 16.2 (6-СН3).
16.2 (6-СН3).
Дополнительно соединение Т получали из смеси Т и Z-изомеров, 40 мг смеси Е и Z-изомеров растворяли в 4 мл раствора бензола, содержащего тиофенол (0.002 М) и ACN (0.006 М). Смесь нагревали при кипячении с обратным холодильником в течение 5 часов. Обработка и очистка на короткой силикагелевой колонке давала 37.2 мг соединения Т.
Соединение U
К 6 мл ацетонового раствора соединения Т (76 мг, 0.15 ммоля) добавляли 4.4 мл 1 N LiOH в воде. Прозрачный раствор перемешивали в течение ночи. Ацетон упаривали и водный раствор подкисляли 1 N раствором HCl. Продукт три раза экстрагировали ЕtOАс Органический слой сушили и концентрировали. Очистка на силикагелевой колонке (20% EtOAc/гексан с 0,5% АсОН) давала 62.2 мг кислоты соединения U (выход 81%);
[α]D +120.8o (СНСl3, с 3.1); IR νmax 2960, 2858, 1695, 1650, 1511, 1427, 1250, 1111, 1036, 702 cm-1; 1H NMR δ 7.73/7.70 (SiPh2, 2'-Н, 6'-Н/2''-Н, 6''-Н, d, 7.0), 7.50 (SiPh2, 4'-H/4''-H, m), 7.44 (SiPh2, 3'-H, 5'-Н/3''-Н, 5''-Н, m), 7.29 (10-Н, 14-Н, d, 8.6), 6.96 (3-Н; dt; 15.6, 7.8), 6.89 (11-Н, 13-Н, d, 8.6), 6.22 (8-Н, d, 16.0), 6.03 (7-H, dd, 16.0, 7.9), 5.70 (2-H, d, 15.6), 3.88 (5-Н, m), 3.83 (OCH3, S), 2.43 (6-Н, m), 2.40 (4-Н, m), 1.17 (6-СН3, d, 6.9), 1.14 (CMe3, s); 13С NMR, 171.7 (1), 158.8 (12), 148.8 (3), 135.0 (SiPh2, 2', 6'/2'', 6''), 133.9/133.7 (SiPh2, 1'/1''), 130.3 (9), 130.0 (8), 129.7 (SiPh2, 4'/4''), 129.4 (7), 127.6 (SiPh2, 3', 5'/3'', 5''), 127.1 (10, 14), 122.5 (2), 113.9 (11, 13), 76.2 (5), 55.2 (ОСН3), 42.3 (6), 37.1 (4), 27.0 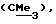 19.5
19.5  16.0 (6-СН3).
16.0 (6-СН3).
Соединение V
Соединение U (59 мг, 0.12 ммоля), трифторацетатную соль соединения I (57,2 мг, 0.12 ммоля) и диизопропилэтиламин (DIEA, 62 мкл, 0.36 ммоля) растворяли в 1.5 мл сухого ДМФА. К этому раствору добавляли пентафордифенифосфинат (FDPP, 55 мг, 0,14 ммоля) в 0.6 мл ДМФА) и реакционную смесь перемешивали в течение двух часов. Добавляли эфир и органический слой последовательно промывали 1 N раствором HCl, насыщенного раствора бикарбоната натрия, и рассолом, соответственно. Концентрирование и очистка с помощью хроматографии (силикагелевая колонка, 8% ЕtOАс/гексане) давали 74.2 мг соединения V (выход 72%).
[α] D +53.8o (CHCl3, с 1.6); IR νmax 3286, 2959, 1760, 1667, 1640, 1607, 1510, 1253, 1174, 1111, 1067, 1027, 703 cm-1; EIMS m/z (relative intensity %) 798/799/800/801/802/803/804/805 (31/14/44/17/23/10/6/3. M+-Bu'), 766 (40), 694/695/696/697/698/699/700/701 (70/31/100/38/58/19/14/5), 662 (67), 622 (71), 544 (70), 518 (83); high-resolution EIMS 798.1443 (calcd for C40H40Cl4NO6Si, Δ-6.4 mmu, M+-Bu'). 1H NMR δ unit A 7.69/7.65 (SiPh2, 2'-H, 6'-Н/2''-Н, 6''-Н; d; 6.5), 7.41 (SiPh2, 4'-H/4''-H, m), 7.35 (SiPh2, 3'-H, 5'-Н/3''-Н, 5''-Н, m), 7.24 (10-Н, 14-Н; d, 8.7), 6.85 (11-Н, 13-Н, d, 8.7), 6.65 (3-Н, dt, 15.3, 7.5), 6.20 (8-Н, d, 16.1), 6.03 (7-Н, dd, 16.1, 8.0), 5.50 (2-H, d, 15.3), 3.81 (OCH3, S), 3.77 (5-Н, m), 2.39 (6-Н, m), 2.34 (4-Н, m), 2.29 (4-Н', m), 1.11 (6-Ме, d, 6.9), 1.06 (CMe3, S); unit В 7.15 (5-H, d, 1.8), 7.00 (9-H, dd, 8.4, 1.8), 6.83 (8-Н, d, 8.4), 5.65 (NH, d, 7.7), 5.01 (2-Н, ddd, 7.7, 6.0, 5.5), 4.78/4.72 (СН2ССl3, ABq, -11.9), 3.86 (OMe, S), 3.15 (3-Н; dd, 6.1, -14.5), 3.08 (3-Н', dd, 5.8, -14.5). 13C NMR δ unit A 165.1(1), 158.8(12), 142.5(3), 136.0 (SiPh2, 2', 6'/2'', 6''), 134.2/133.6 (SiPh2, 1'/1''), 130.4 (9), 129.9 (8), 129.7/129,6 (SiPh2, 4'/4''), 129.5 (7), 127.6/127.5 (SiPh2, 3', 5'/3'', 5''), 127.1 (10, 14), 124.6 (2), 113.9 (11, 13), 76.4 (5), 55.2 (OMe), 42.1 (6), 37.2 (4), 27.0 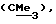 19.5
19.5 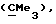 16.6 (6-Me); unit В 170.0 (1), 154.2 (7), 131.0 (5), 128.4 (4/9), 122.5 (6), 112.1 (8), 94.2 (ССl3), 74.7
16.6 (6-Me); unit В 170.0 (1), 154.2 (7), 131.0 (5), 128.4 (4/9), 122.5 (6), 112.1 (8), 94.2 (ССl3), 74.7 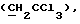 56.1 (OMe), 52.9 (2) 36.4 (3).
56.1 (OMe), 52.9 (2) 36.4 (3).
Соединение W
К раствору соединения V (55.8 мг, 0.065 ммоля) в 5.7 мл ацетонитрила добавляли 0.2 мл 49% гидрофторидной кислоты при 0oС. Баню со льдом удаляли через пять минут и реакционную смесь интенсивно перемешивали в течение 17 часов. Продукт экстрагировали в эфир, промывали последовательно насыщенным раствором бикарбоната натрия и рассолом. Концентрирование и очистка с помощью хроматографии с нормальной фазой (силикагелевая колонка, 25% EtOAc/ гексан) давала 31.6 мг соединения W (выход 79%);
[α] D -3.7o (СНСl3, с 1.3); IR νmax 3286, 2961, 1756, 1668, 1634, 1607, 1510, 1251, 1175, 1066, 812 cm-1. 1H NMR δ unit А 7.27 (10-Н, 14-Н, d, 8.5), 6.93 (3-H, dt, 15.4, 7.6), 6.83 (11-H, 13-H, d, 8.5), 6.34 (8-Н, d, 15.9), 5.88 (7-Н, dd, 15.9, 8.2), 5.86 (2-Н, d, 15.4), 3.81 (OMe, S), 3.80 (5-Н, m), 2.40 (6-H, m), 2.36 (4-H, m), 1.13 (6-Ме, d, 6.8); unit В 7.17 (5-Н, d, 1.9), 7.05 (9-Н, dd, 8.5, 1.9), 6.83 (8-Н, d, 8.5), 5.90 (NH, d, 7.7), 5.03 (2-Н, ddd, 7.8, 5.9, 5.6), 4.79/4.72 (СН2ССl3, ABq, -11.9), 3.86 (ОСН3, S), 3.20 (3-H, dd, 6.0, -14.3), 3.09 (3-H', dd, 5.9, -14.3), 13C NMR δ unit A 165.2 (1), 159.1 (12), 142.6 (3), 131.3 (9), 129.8 (7), 128.7 (8), 127.3 (10, 14), 125.0 (2), 114.0 (11, 13), 73.8 (5), 55.3 (OMe), 43.3 (6), 37.2 (4), 16.9 (6-Me) unit В 170.1 (1), 154.2 (7), 131.0 (5), 128.5 (4/9), 122.5 (6), 112.2 (8), 94.2 (ССl3), 74.7 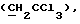 56.1 (OMe), 53.0 (2), 36.5 (3).
56.1 (OMe), 53.0 (2), 36.5 (3).
(2S, 2'R)-2-[3'(трет-Бутоксикарбонил)амино-2'-метилпропаноил-окси] -4-метилпентановая кислота (АС)
Раствор метил(S)-(+)-3-гидрокси-2-метилпропаноата (X) (10 г, 85 ммолей) в 300 мл приблизительно 9 М аммиака в метаноле нагревали до 50oС в откаченной стеклянной ампуле в течение 168 часов, продували аргоном для удаления избытка аммиака и затем выпаривали досуха в вакууме. Остаток, растертый с эфиром, оставлял после себя (S)-(+)-3-гидрокси-2-метилпропанамид (5.7 г, выход 66%) в виде твердого белого вещества, т.пл 85.5-87.5oС
[α] D +28.7o (с 3.5, МеОН); EIMS m/z (rel intensity) 88 (19, М-Ме), 85 (35), 73 (69); HREIMS m/z 88.0397 (С3Н6NO2, Δ+0.2 mmu); IR νmax 3384, 2960, 1671, 1473 cm-1; 1H NMR δ 5.83 (NH; br s), 5.42 (NH; br s), 3.73 (3-H2; m), 2.55 (2-H; m), 1.19 (2-Me; d, 7.2); 13С NMR δ 180.7 (1), 65.4 (3), 44.0 (2), 14.5 (2-Me). Anal. Found: С, 46.45; H, 8.83. Calcd for C4H9NO2: С, 46.59; H, 8.79.
Суспензию (S)-(+)-3-гидрокси-2-метилпропанамида (2.1 г, 20 ммолей) в безводном ТГФ (20 мл) медленно добавляли к 1 М комплексу бор-ТГФ (61 ммоль, 61 мл), охлажденному до 0oС. Смесь кипятили с обратным холодильником в течение 6 часов, охлаждали до 0oС, осторожно разлагали концентрированной HCl (10 мл) и концентрировали в вакууме. Концентрат насыщали NaOH (20 г), экстрагировали СНСl3 (4 раза по 15 мл) и объединенные экстракты сушили (MgSO4). После фильтрования и удаления растворителя, разгонка в вакууме давала 1.4 г (выход 77%) (R)-3-амино-2-метилпропан-1-ола (Y) в виде бесцветного масла с т. кип. 110-112oС (40 мм Hg).
[α] D+8.9o (с 22.6, МеОН); IR νmax 3358, 1873, 1598, 1466 cm-1; 1H NMR δ 5.18 (NH2, br s), 3.8 (1-H2; m), 2.95 (3-H; m), 2.68 (3-H; m), 1.81 (2-H; m), 0.82 (2-Me; d, 7.2); 13С NMR δ 66.9 (1), 46.4 (3), 37.1 (2), 14.4 (2-Ме).
К раствору аминоспирта Y (2.0 мг, 22 ммоля) в 39 мл 10% раствора триэтиламина в МеОН добавляли ди-трет-бутил-дикарбонат (5.4 мг, 25 ммолей) и смесь перемешивали при 25oС в течение 30 минут. После удаления растворителя, остаток растворяли в CH2Cl2 и раствор дважды промывали 1 М KHSO4 (pH 2) и один раз насыщенным раствором NaCl и сушили (MgSO4). Удаление растворителя в вакууме давало 4.3 г (выход 100%) (R)-3-(трет-бутоксикарбонил)амино-2-метилпропан-1-ола в виде вязкого масла, которое использовали непосредственно в следующей стадии без дальнейшей очистки (больше 95% чистоты, по данным ЯМР анализа);
IR νmax 3356, 1976, 1686, 1523, 1456 cm-1; 1H NMR δ 4.82 (NH; br s), 3.54 (1-H; dd, -11.4/4.2), 3.31 (1-Н/3-Н; m), 3.25 (3-H; dd, -14.1/6.6), 1.77 (2-H; m), 1.44 (СМе3; s), 0.87 (2-Me; d, 6.9).
К раствору спирта (R)-3-(трет-бутоксикарбонил)амино-2-метилпропан-1-ола (2.2 г, 12 ммолей) периодата натрия (7.5 г, 35 ммолей) в четыреххлористом углероде (25 мл), ацетонитриле (25 мл) и воде (38 мл) добавляли гидрат треххлористого рутения (51 мг, 0.25 ммоля) и смесь перемешивали при 25oС в течение 1 часа. Смесь разбавляли CH2Cl2 (100 мл) и затем отфильтровывали через целит. Фильтрат подкисляли (pH 9) 2 М раствора K2СО3 и водный слой промывали эфиром. Водный слой подкисляли раствором 1 М KHSO4 до pH 2 при 0oС и экстрагировали CH2Cl2 (3 раза по 20 мл). Объединенные экстракты промывали насыщенным раствором NaCl и сушили (MgSO4). Удаление растворителя в вакууме давало 2.0 г (выход 85%) (R)-3-(трет-бутоксикарбонил)амино-2-метилпропановой кислоты (Z) в виде липкого твердого вещества. Чистую Z (1.75 г, выход 74%) кристаллизовали из эфира, т.пл. 69.5-70.5oС.
[α]D -18.4o (с 2, МеОН); EIMS m/z (rel intensity) 147 (60; М+-Мe2С=СН2), 130 (12), 74 (29), 57 (100); HREIMS m/z 147.0517 (C5H9NO4, Δ+1.4 mmu); IR νmax 3322-2400, 2797, 1711, 1654, 1413 cm-1; 1H NMR of major conformer δ 5.00 (NH; br s), 3.32 (3-H; m), 3.24 (3-H'; m), 2.71 (2-H; m), 1.44 (CMe3; s), 1.20 (2-Me; d); 13C NMR of major/minor (2: 1 ratio) conformers δ 180.7/179.5 (1), 156.0/157.7 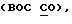 79.5/81.0
79.5/81.0 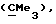 42.7/44.0 (3), 39.9/40.2 (2), 28.3/28.3
42.7/44.0 (3), 39.9/40.2 (2), 28.3/28.3 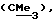 14.6/14.6 (2-Me), Anal. Found: С, 53.04; H, 8.62. Calcd for C9H17NO4: С, 53.18; Н, 8.43.
14.6/14.6 (2-Me), Anal. Found: С, 53.04; H, 8.62. Calcd for C9H17NO4: С, 53.18; Н, 8.43.
К раствору 2.66 г L-лейциновой кислоты (20 ммолей) и 1.74 г бикарбоната натрия (20 ммолей) в 30 мл воды при 0oС добавляли 30 мл раствора 6.44 г тетрабутиламмоний хлорида (20 ммолей) и 1.74 мл аллилбромида (20 ммолей) в CH2Cl2. После интенсивного перемешивания смеси в течение 24 часов, CH2Cl2 выпаривали. Добавляли около 50 мл воды и водный слой экстрагировали четыре раза Et2O. Эфирный раствор сушили над безводным сульфатом натрия и затем выпаривали. Остаток пропускали через короткую Si-колонку с получением 3.21 г аллил (2S)-2-гидрокси-4-метилпентаноата (АА) (выход 93%) в виде бесцветного масла,
[α] D -8.4o (с 1.1, СНСl3); IR νmax 3464, 2957, 1732, 1203, 1140, 1087 cm-1; 1H NMR δ 5.92 (allyl 2-H; m), 5.34 (allyl 3-H2; dd, 17.4/1.1), 5.28 (allyl 3-HE; dd, 10.5/1.1), 4.67 (allyl 1-H2; d, 5.7), 4.23 (2-H; br s), 2.64 (ОН; br s), 1.89 (4-H; m), 1.57 (3-H2; m), 0.96 (5-Н3; d, 6.5), 0.95 (4-Me; d, 6.7); 13С NMR δ 175.3 (1), 131.4 (allyl C-2), 118.6 (3), 68.9 (2), 65.7 (allyl C-1), 43.2 (3), 24.1 (4), 23.0(5), 21.3 (4-Me).
К раствору 1.74 г Z (8.55 ммоля), 1.34 г АА (8.0 ммолей) и 64 мг DMAP в 12 мл сухого CH2Cl2 при 0oС добавляли по каплям 8 мл раствора DDC (2.47 г, 12 ммолей) в CH2Cl2. Прозрачный раствор перемешивали при 0oС в течение 30 минут и затем при 23oС в течение 3 часов. Белый осадок отфильтровали, растворитель выпаривали и остаток повторно растворяли в Et2O. Эфирный раствор промывали последовательно холодным 0.5 N раствором NaCl, раствором бикарбоната натрия и рассолом. Высушенный эфирный слой (Na2SO4) выпаривали и продукт очищали с помощью флеш-хроматографии (силикагель) с получением 2.62 г (выход 92%) чистого аллил(2S,2'R)-2-[3'(трет-бутоксикарбонил)амино-2'-метилпропаноил-окси]-4-метилпентаноата (АВ) в виде бесцветного масла,
[α] D -51.3o (с 3.41, СНСl3); EIMS m/z (rel intensity) 301 (5.2), 284 (4.0), 258 (1.5), 228 (43.5), 170 (41.8), 130 (74.5), 112 (100); HREIMS m/z, 301.1532 (C14H23NO6, Δ-0.7 mmu, М-Ме2С=СН2), 284.1496 (C14H22NO5, Δ+0.2 mmu); IR νmax 3395, 2962, 1747, 1715, 1515, 1251, 1175, 1083 cm-1. 1H NMR unit С  5.17 (NH; br s), 3.42 (3-H; m), 3.22 (3-H'; m), 2.78 (2-Н, m), 1.43 (СМе3; br s), 1.21 (2-Me; d. 7.1); unit D δ 5.90 (allyl 2-H; m), 5.33 (allyl 3-НZ; d, 16.3), 5.27 (allyl 3-НE; d, 10.3), 5.09 (2-H; dd, 9.7/3.7), 4.63 (allyl 1-H2; m), 1.80 (3-H2; m), 1.64 (4-H; m), 0.96 (5-H3; d, 6.5), 0.94 (4-Me; d, 7.3), 13С NMR unit C δ 174.7 (1), 156.0
5.17 (NH; br s), 3.42 (3-H; m), 3.22 (3-H'; m), 2.78 (2-Н, m), 1.43 (СМе3; br s), 1.21 (2-Me; d. 7.1); unit D δ 5.90 (allyl 2-H; m), 5.33 (allyl 3-НZ; d, 16.3), 5.27 (allyl 3-НE; d, 10.3), 5.09 (2-H; dd, 9.7/3.7), 4.63 (allyl 1-H2; m), 1.80 (3-H2; m), 1.64 (4-H; m), 0.96 (5-H3; d, 6.5), 0.94 (4-Me; d, 7.3), 13С NMR unit C δ 174.7 (1), 156.0  79.2
79.2 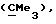 43.1 (3), 40.3 (2), 28.3
43.1 (3), 40.3 (2), 28.3 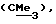 14.5 (2-Me); unit D δ 170.4 (1), 131.4 (allyl C-2), 119.0 (allyl C-3), 70.9 (2), 65.9 (allyl C-1), 39.6 (3), 24.7 (4), 23.0 (5), 21.5 (4-Me).
14.5 (2-Me); unit D δ 170.4 (1), 131.4 (allyl C-2), 119.0 (allyl C-3), 70.9 (2), 65.9 (allyl C-1), 39.6 (3), 24.7 (4), 23.0 (5), 21.5 (4-Me).
К 10 мл раствора 282 мг (0.8 ммоля) АВ и 91 мг (0.08 ммоля) тетракис(трифенилфосфин)палладия в сухом ТГФ медленно добавляли 688 мкл (8 ммолей) сухого морфолина. После перемешивания в течение 40 минут, растворитель упаривали и добавляли 100 мл CH2Cl2. Раствор последовательно промывали 2 N HCl (40 мл) и водой. Органический слой отфильтровывали и фильтрат экстрагировали дважды насыщенным раствором бикарбоната натрия. После обратного промывания CH2Cl2, водный слой сначала подкисляли до рН 3 холодным раствором KHSO4 при 0oС и затем экстрагировали три раза эфиром. Высушенный эфирный экстракт выпаривали с получением 250 мг (2S,2'R)-2-[3'(трет-бутоксикарбонил)амино-2'-метилпропаноил-окси] -4-метилпентановой кислоты (АС) (выход 100%) в виде воскоподобного твердого вещества,
[α]D -47.9o (с 4.7, СНСl3); EIMS m/z (rel intensity) 261 (12), 244 (18), 217 (28), 198 (17), 188 (100), 160 (61); HREIMS m/z 261.1221 (С11Н19NO6, Δ-0.8 mmu, М-Ме2C=СН2), 244.1221 (C11H18NO5, Δ-3.6 mmu); IR νmax 3376, 2960, 1738, 1518, 1174, 786 cm-1, 1H NMR (CDCl3+D2O) unit С δ 3.49 (H-3; dd, -13.8/3.5), 3.12 (3-H; dd, -13.8/8.7), 2.68 (2-Н; m), 1.43 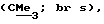 1.21 (2-Me; d, 7.1); unit D δ 5.12 (2-H; dd, 9.6/3.5), 1.90-1.68 (3Н/4-Н; m), 0.97 (5-Н; d, 6.1), 0.94 (4-Me; d, 6.0). 13C NMR unit С δ 174.6 or 174.8 (1), 156.1
1.21 (2-Me; d, 7.1); unit D δ 5.12 (2-H; dd, 9.6/3.5), 1.90-1.68 (3Н/4-Н; m), 0.97 (5-Н; d, 6.1), 0.94 (4-Me; d, 6.0). 13C NMR unit С δ 174.6 or 174.8 (1), 156.1  79.5
79.5 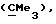 43.0 (3), 40.4 (2), 28.3
43.0 (3), 40.4 (2), 28.3 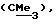 14.5 (2-Me): unit D δ 174.6 or 174.8 (1), 70.5 (2), 39.5 (3), 24.7 (4), 23.0 (5), 21.4 (4-Me).
14.5 (2-Me): unit D δ 174.6 or 174.8 (1), 70.5 (2), 39.5 (3), 24.7 (4), 23.0 (5), 21.4 (4-Me).
Соединение АD
Спирт W (34.8 мг, 0.056 ммоля), соединение АС (26.8 мг, 0.085 ммоля) и DМАР (1.74 мг) растворяли в 283 мкл дихлорметана. К этой смеси добавляли 666 мкл раствора DDC (17.5 мг, 0.085 ммоля) в дихлорметане. Реакционную смесь перемешивали в течение ночи. Растворитель упаривали с потоком азота, добавляли эфир и отфильтровывали белый осадок. Фильтрат последовательно промывали 0.5 N раствором HCl, насыщенным раствором бикарбоната натрия и рассолом. Концентрирование и хроматографирование (колонка с силикагелем, 25% ЕtOАс/гексан) давало 46 мг соединения AD (выход 90%);
[α] D -11.8o (СНСl3, с 2.0); IR νmax 3369, 2961, 1737, 1511, 1252, 1174, 1066, 813, 756 cm-1. 1H NMR (500 MHz) δ unit A 7.25 (10-Н/14-Н, dt, 8.5. 2.1), 6.84 (11-Н/13-Н, dt, 8.5, 2.1), 6.76 (3-Н, ddd, 15.5, 6.5, 6.4), 6.34 (8-Н, d, 15.6), 5.88 (2-H, bd, 15.5), 5.86 (7-Н, dd, 15.6, 8.7), 5.04 (5, m), 3.80 (ОМе, s), 2.56 (6-Н, m), 2.52 (4-H, m), 1.10 (6-Ме, d, 6.8); unit В 7.19 (5-H, d, 2.1), 7.05 (9-Н, dd, 8.5, 2.1), 6.83 (8-Н, d, 8.5), 6.55 (NH, bd, 7.3), 5.04 (2-H, m), 4.78/4.70 (СН2ССl3, ABq, -11.8), 3.85 (ОСН3, S), 3.19 (3-Н, dd, 6.3, -13.8), 3.08 (3-Н', dd, 6.8. -13.8); unit С 5.14 (NH, bt, 6.3), 3.32 (3-H, m), 3.20 (3-H', m), 2.73 (2-H, m), 1.42 (CMe3, s), 1.18 (2-Me, d, 7.0); unit D 4.93 (2-H, dd, 10.0, 3.7), 1.67 (3-H/4-H, m), 1.55 (3-H', m), 0,86 (5-H, d, 6.5), 0.83 (4-Me-H, d, 6.5). 13C NMR δ unit A 165.4 (1), 159.1 (12), 139.3 (3), 131.1 (9), 129.7 (7), 128.5 (8), 127.3 (10, 14), 125.4 (2), 114.0 (11, 13), 76.5 (5), 55.3 (ОМe), 41.1 (6), 33.4 (4), 16.7 (6-Me); unit В 170.5 (1), 154.1 (7), 131.2 (5), 128.9 (4), 128.5 (9), 122.4 (6), 112.1 (8), 94.3 (CCl3), 74.6  56.1 (ОМе), 53.2 (2), 36.6 (3); unit С 175.2 (1), 156.0
56.1 (ОМе), 53.2 (2), 36.6 (3); unit С 175.2 (1), 156.0 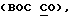 79.3
79.3 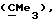 43.1 (3), 40.4 (2), 28.3
43.1 (3), 40.4 (2), 28.3 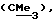 14.4 (2-Me); unit D 170,1 (1), 71.4 (2), 39.5 (3), 24.7 (4), 22.9 (5), 21.4 (4-Ме).
14.4 (2-Me); unit D 170,1 (1), 71.4 (2), 39.5 (3), 24.7 (4), 22.9 (5), 21.4 (4-Ме).
Криптофинин 81
Соединение AD (46 мг, 0.05 ммоля) смешивали с активированной Zn пылью (178 мг, избыток) в 1.3 мл НОАс. Смесь подвергали воздействию ультразвука в течение 45 минут и затем перемешивали дополнительно 90 минут. Добавляли около 30 мл дихлорметана. Твердое вещество отфильтровывали и фильтрат выпаривали в вакууме. Остаток растворяли в 1.1 мл ТФУК и раствор перемешивали в течение одного часа. ТФУК выпаривали в вакууме и добавляли воду. Проведение лиофильной сушки давало свободную аминокислоту. Аминокислоту растворяли в 4.6 мл ДМФА. К этому раствору добавляли 26 мкл DIEA и FDPP (30 мг, 0.075 ммоля, в 2.2 мл ДМФА), соответственно. После перемешивания в течение 6 часов, растворитель упаривали и добавляли ЕtOАс. Раствор промывали 0.5 N раствором HCl и рассолом соответственно. Выпаривание растворителя с последующей хроматографической очисткой (силикагель, эфир) давало 20.5 мг Криптофицин 81 (выход 61%).
[α]D +34.9o (СНСl3, с 0.45); IR νmax 3409, 3270, 2958, 1746, 1725, 1672, 1511, 1251, 1175, 1066, 1025, 972, 816 cm-1. 1H NMR (500 MHz) δ unit A 7.26 (10-Н/14-Н; dt, 8.6, 2.5), 6.84 (11-Н/13-Н, dt, 8.6, 2.5), 6.68 (3-H, ddd, 15.4, 9.9, 5.6), 6.35 (8-Н, d, 15.9), 5.86 (7-Н, dd, 15.9, 8.8), 5.77 (2-H, dd, 15.4, 0.9), 4.99 (5-H, ddd, 11.2, 6.0, 1.7), 3.80 (ОСН3, S), 2.53 (4-Н/6-Н, m), 2.37 (4-Н', ddd, 11.2, 9.9,-14.6), 1.12 (6-Me, d, 6.9); unit B 7.22 (5-H, d, 2.2), 7.08 (9-Н, dd, 8.4, 2.4), 6.84 (8-Н, d, 8.4), 5.64 (NH, d, 8.6), 4.81 (2-H, m), 3.86 (OMe, S), 3.13 (3-H; dd, 5.6, -14.5), 3.05 (3-H', dd, 7.1, -14.5); unit C, 6.93 (NH, bdd, 5.8, 5.6), 3.50 (3-H, ddd, 5.2, 3.9, -13.5), 3.28 (3-H', ddd, 6.9, 6.7, -13.5), 2.71 (2-H, m), 1.22 (2-Me; d, 7.3); unit D 4.84 (2-H, dd, 10.1, 3.4), 1.67 (3-H/ 4-Н; m), 1.38 (3-H', m), 0.78 (5-Н, d, 6.5), 0.75 (4-Me-H, d, 6.5). 13C NMR (125 MHz) δ unit A 165.4 (1), 159.2 (12), 141.4 (3), 131.1 (9), 129.6 (7), 128.4 (8), 127.3 (10, 14), 125.2 (2), 114.1 (11, 13), 77.5 (5), 55.3 (OMe), 42.2 (6), 36.4 (4), 17.4 (6-Me): unit В 171.0 (1), 154.0 (7), 131.2 (5), 129.9 (4), 128.4 (9), 122.5 (6), 112.1 (8), 56.2 (OMe), 53.5 (2), 35.1 (3); unit С 175.6 (1), 41.2 (3), 38.3 (2), 14.0 (2-Me); unit D 170.9 (1), 71.6 (2), 39.5 (3), 24.5 (4), 22.7 (5), 21.3 (4-Мe).
Пример 15. Синтез Криптофицина 82
Соединение АЕ
Соединение АЕ представляет производное трет-бутилдифенилсилилового эфира (TBDMS) Е.
Соединение AF
Гидролиз АЕ (150 мг) проводили с 87% выходом с использованием процедуры, описанной выше для гидролиза Т и U.
1Н NMR δ 7.69/7.64 (SiPh2, 2'-Н, 6'-Н/2''-Н, 6''-Н, d, 6.3), 7.41 (SiPh2, 4'-H/4''-H, m), 7.39 (SiPh2, 3'-H, 4-Me-H/ 3''-Н, 5''-Н, m), 6.86 (3-H; dt; 15.5, 7.5), 5.62 (2-H, d, 15.5), 5.30 (7-Н/8-Н, m).
Соединение AG
Получение AG (96 мг) из АF (76 мг, 0.18 ммоля) проводили с 70% выходом с использованием процедуры, описанной выше для получения V из U.
1H NMR δ unit А 7.67 (SiPh2, 2'-H, 6'-H/2''-H, 6''-H; m), 7.46-7.31 (SiPh2, 3'-H, 4'-H, 4-Ме-Н/3''-Н, 4''-Н, 5''-Н, m), 6.62 (3-H, dt, 15.4, 7.6), 5.51/5.48 (2-H, d, 15.4), 5.33 (7/8, m), 3.70 (5-Н, m), 2.22 (4-Н/6-Н, m), 1.61 (9, bd, 7.4), 1.06 (CMe2, S), 0.98 (6-Мe, d, 6.8); unit В 7.16 (5-H, d, 1.7), 7.00 (9-Н, dd, 8.5, 1.7), 6.83/6.82 (8-Н,
d, 8.5), 5.68/5.66 (NH, d, 7.3), 5.03 (2-H, m), 4.78/4.73 (СН2ССl3, ABq, -11.9), 3.87 (OMe, S), 3.16 (3-H; m), 3.09 (3-Н', m). 13С NMR δ unit A 165.1 (1), 143.0/142.9 (3), 136.0 (SiPh2, 2', 6'/2'', 6''), 134.3/133.7 (SiPh2, 1'/1''), 132.5 (7), 129.6 (8), 129.6 (SiPh2, 4'/4''), 127.5 (SiPh2, 3', 4-Ме/3'', 5''), 125.7/125.4 (2), 76.3 (5), 41.6 (6), 36.9/36.8 (4), 27.0 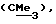 19.5
19.5 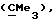 18.1 (9), 16.4/16.3 (6-Ме); unit В 170.0 (1), 154.2 (7), 131.0 (5), 128.4 (4/9), 122.5 (6), 112.1 (8), 94.2 (ССl3), 74.7
18.1 (9), 16.4/16.3 (6-Ме); unit В 170.0 (1), 154.2 (7), 131.0 (5), 128.4 (4/9), 122.5 (6), 112.1 (8), 94.2 (ССl3), 74.7 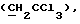 56.1 (OMe), 52.9 (2) 36.4 (3).
56.1 (OMe), 52.9 (2) 36.4 (3).
Соединение АН
Получение АН (53.4 мг) из AG (84 мг, 0.11 ммоля) проводили с 92% выходом с использованием процедуры, описанной выше для получения W из V.
1Н NMR δ unit А 6.83 (3-Н, dt, 15.4. 7.5), 5,80 (2-H, d, 15.4), 5.51 (8-Н, m), 5.33 (7-Н, dd, 15.2, 8.3), 3.50 (5-Н, m), 2.42 (4-Н, m), 2.30 (4-Н', m), 2.28 (6, m), 1.68 (9, d, 7.3), 0.99 (6-Ме, d, 6.7); unit В 7.20 (5-H, d, 1.8), 7.03 (9-Н, dd, 8.4, 1.8), 6.80 (8-Н, d, 8.4), 6.10 (NH, bd, 7.0), 5.07 (2-H, m), 4.80/4.70 (СН2ССl3, ABq, -11.5), 3.88 (ОСН3, S), 3.20 (3-Н, dd, 5.5, -14.3), 3.10 (3-Н', dd, 7.2, -14.3). 13C NMR δ unit A 165.4 (1), 142.8 (3), 132.2 (7), 127.7 (8), 125.7 (2), 73.6 (5), 42.8 (6), 36.9 (4), 18.1 (9), 16.8 (6-Me); unit В 170.2 (1), 154.2 (7), 131.0 (5), 128.5 (4/9), 122.5 (6), 112.2 (8), 94.2 (ССl3), 74.7 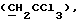 56.1 (OMe), 53.1 (2), 36.5 (3).
56.1 (OMe), 53.1 (2), 36.5 (3).
Криптофицин 82
Соединение А1 (36.8 мг, выход 86%) получали из 27.4 мг (0.052 ммолей) соединения АН с использованием процедуры, описанной выше для AD.
Соединение А1 (68 мг, 0.083 ммоля) было подвергнуто циклизации до Криптофицина 82 (28.5 мг) с использованием процедуры, описанной выше для циклизации AD до Криптофицина 81;
[α] D+19.9o (СНСl3, с 2.0). 1Н NMR (500 MHz) δ unit A 6.65 (3-H, ddd, 15.4, 9.5, 5.6), 5.76 (2-H, d, 15.4), 5.48 (8-H, dq, 15.3, 6.5), 5.27 (7-Н, ddd, 15.3, 8.4, 1.5), 4.89 (5-Н, ddd, 10.7, 5.6, 1.5), 2.38 (4-Н, m), 2.33 (4-Н'/6-Н, m), 1.66 (9-Н, dd, 6.4, 1.5), 1.00 (6-Me, d, 6.9); unit В 7.22 (5-H, d, 2.0), 7.08 (9-Н, dd, 8.4, 2.0), 6.83 (8-H, d, 8.4), 5.74 (NH, m), 4.81 (2-H, ddd, 8.5, 7.3, 5.6), 3.87 (OMe, S), 3.13 (3-H; dd, 5.6, -14.4), 3.04 (3-Н', dd, 7.3, -14.4); unit С, 6.93 (NH, bdd, 6.7, 4.7), 3.52 (3-Н, ddd, 4.7, 3.9, -13.5), 3.27 (3-Н', ddd, 6.8, 6.7. -13.5), 2.72 (2-H, dqd, 7.1, 6.8, 3.9), 1.20 (2-Me; d, 7.1); unit D 4.88 (2-H, dd, 9.6, 3.4), 1.75 (3-Н/4-Н; m), 1.47 (3-Н', m), 0.94 (5-H, d, 6.2), 0.91 (4-Me-H, d, 6.4). 13С NMR (125 MHz) δ unit A 165.5 (1), 141.7 (3), 131.4 (7), 127.1 (8), 125.2 (2), 77.7 (5), 41.5 (6), 36.2 (4), 17.9 (9), 17.2 (6-Me); unit В 171.0 (1), 153.9 (7), 131.1 (5), 129.9 (4), 128.4 (9), 122.4 (6), 112.2 (8), 56.1 (OMe), 53.5 (2), 35.1 (3); unit С 175.5 (1), 41.3 (3), 38.2 (2), 14.0 (2-Me); unit D 170.9 (1), 71.5 (2), 39.6 (3), 24.6 (4), 23.0 (5), 21.5 (4-Мe).
Пример 16. Синтез Криптофицина 90 и Криптофицина 91
Общая процедура для эпоксидирования Криптофицинов стирольного типа.
К раствору криптофицина (около 10 мг/мл) в дихлорметане добавляли три эквивалента м-хлорбензойной кислоты в дихлорметане (около 10 мг/мл). Раствор перемешивали при комнатной температуре до тех пор пока весь исходный материал не прореагирует. Раствор пропускали через короткую колонку с силикагелем с использованием CH2Cl2 и затем 1:4 CH2Cl2:Et2O с получением смеси двух эпоксидов. Эпоксиды разделяли с помощью жидкостной гель-проникающей хроматографии (С-18, 7:3 MeCN:H2O).
Используя эту процедуру, Криптофицин 82 (5 мг) был превращен в 2.2 мг Криптофицина 90 и 1,2 мг Криптофицина 91.
Спектральные данные для Криптофицина 90
1H-ЯМР (500 МГц) δ-звено А
6.67 (3-Н, ddd, 15.4, 9.5, 5.8), 5.79 (2-H, d, 15.4), 5.09 (5-H, ddd, 10.4, 4.5, 2.6), 2.84 (8-H, qd, 5.2, 2.2), 2.57 (7-Н, dd, 7.6, 2.2), 2.46 (4-Н, m), 1.82 (6-Н, m), 1.32 (9-Н, d, 5.2), 1.03 (6-Me, d, 6.9); unit B 7.22 (5-H, d, 2.2), 7.08 (9-Н, dd, 8.4, 2.2), 6.84 (8-H, d, 8.4), 5.74 (NH, d, 8.6), 4.81 (2-Н, ddd, 8.3, 7.4, 5.7), 3.87 (OMe, S), 3.14 (3-Н; dd, 5.4, -14.5), 3,03 (3-Н', dd, 7.3, -14.5); unit С, 6.95 (NH, bdd, 6.7, 4.8), 3.52 (3-H, ddd, 4.8, 3.7, -13.4), 3.29 (3-Н', ddd, 6.7, 6.5, -13.4), 2.74 (2-H, dqd, 7.3, 6.5, 3.7), 1.24 (2-Me; d, 7.3); unit D 4.90 (2-H, dd, 9.9, 3.7), 1.75 (3-Н, m), 1.60 (4-Н; m), 1.49 (3-Н', ddd, 8.7, 3.7, -13.7), 0.95 (5-Н, d, 6.5), 0.91 (4-Me-H, d, 6.7). 13С NMR (125 MHz) δ unit А 165.4 (1), 141.1 (3), 125.3 (2), 76.3 (5), 60.0 (7), 56.8 (8), 40.2 (6), 36.5 (4), 17.5 (9), 13.3 (6-Me); unit В 171.0 (1), 154.0 (7), 131.1 (5), 129.9 (4), 128.4 (9), 122.5 (6), 112.3(8), 56.1 (ОМе), 53.6 (2), 35.1 (3); unit С 175.5 (1), 41.2 (3), 38.3 (2), 14.1 (2-Me); unit D 170.7 (1), 71.4 (2), 39.6 (3), 24.7 (4), 23.0 (5), 21.5 (4-Ме)
Спектральные данные для Криптофицина 91
1Н-ЯМР (500 МГц) δ-звено А
6.68 (3-Н, ddd, 15.4, 9.8, 5.4), 5.78 (2-H, d, 15.4), 5.09 (5-Н, ddd, 11.1, 3.7, 2.0), 2.75 (8-Н, m), 2.62 (7-Н, dd, 9.5, 2.1), 2.48 (4-Н, m), 1.78 (6-Н, m), 1.32 (9-Н, d, 5.2), 0.99 (6-Me, d, 7.1); unit В 7.23 (5-H, d, 1.9), 7.09 (9.Н, dd, 8.4, 1.9), 6.85 (8-Н, d, 8.4), 5.68 (NH, d, 8.4), 4.82 (2-H. m), 3.88 (OMe, S), 3.15 (3-Н; dd, 5.4, -14.4), 3.04 (3-Н', dd, 7.2, -14.4); unit С, 6.95 (NH, bdd, 6.0, 4.6), 3.53 (3-Н, ddd, 5.0, 4.0, -13.4), 3.29 (3-Н', ddd, 6.9, 6.7, -13.4), 2.75 (2-H, m), 1.23 (2-Me; d, 6.7); unit D 4.92 (2-H, dd, 9.8, 3.4), 1.77 (3-Н, m), 1.58 (4-Н; m), 0.96 (5-H, d, 7.3), 0.92 (4-Me-H, d, 6.7).
Пример 17. Синтез Криптофицина 97
К раствору циклического депсипептида, Криптофицина 53 (9 мг, 0.013 ммоля), растворенного в диметилсульфоксиде (1 мл), добавляли азид цинка (40 мг) и концентрированную серную кислоту (4 мкл). Затем смеси позволяли перемешиваться при 75-85oС в течение 2 суток. После этого времени реакционную смесь охлаждали до комнатной температуры, разбавляли EtzO (15 мл) и органический слой промывали рассолом (2 раза по 20 мл) и водой (20 мл). Затем эфирный экстракт сушили (MgSO4) и растворитель удаляли в вакууме с возвращением аморфного бесцветного твердого вещества, которое было преимущественно азидоспиртом, Криптофицином 86. Очистки продукта достигали за счет хроматографии с обращенной фазой (ODS, 10 мкл, 250•1-мм, 25% H2O/MeCN, 3 мл мин-1) с возращением чистого азидоспирта, Криптофицина 86, в виде аморфного бесцветного твердого вещества (7.4 мг, выход 77%).
Спектральные данные для Криптофицина 86
[α] D -22.0 (с=3.0, СНСl3); MS (EI) m/z 482/484 (highest observed ion, M+-229, 8/3), 625/627 (14/5), 259 (7), 195/197 (100/34), 184 (14), 155/157 (82/70), 91 (23), 77 (22); HRMS, obsd m/z 482.1791, С23Н31N2O7 35Сl (Δ 2.9 mmu); MS (FAB) m/z (magic bullet matrix) 712/714 (M+ +H, 79/36), 686/688 (31/12), 232 (74), 184 (100). 1H NMR (CDCl3) δ unit A: 7.37-7.42 (10/11/12/13/14-Н, bm, W1/2≈20), 6.77 (3-H, ddd, 15.2, 10.6, 4.4), 5.77 (2-Н, dd, 15.2, 1.3), 5.45 (5-Н, ddd, 11.0, 4.2, 2.0), 4.55 (8-H, d, 5.7), 3.75 (7-Н, dd, 7.3, 5.7), 2.55 (4-Нb, dddd, 14.5, 4.4, 2.0, 1.3), 2.43 (4-Ha, ddd, 14.5, 11.0, 10.6), 2.34 (7-ОН, s), 1.80 (6-Н, ddq, 7.3, 4.2, 7.0), 0.99 (6-Me, d. 7.0), unit В: 7.20 (5-H, d, 2.2), 7.06 (9-Н, dd, 8.4, 2.2), 6.84 (8-H, d, 8.4), 5.76 (NH, d, 7.7), 4.74 (2-Н, ddd, 7.7, 7.5, 5.5), 3.87 (ОСН3, s), 3.10 (3-Hb, dd, 14.5, 5.5), 3.06 (3-Ha, dd, 14.5, 7.5), unit С: 7.22 (NH, dd, 8.4, 3.7), 3.40 (3-Hb, dd, 13.6, 8.4), 3.14 (3-Ha, dd, 13.6, 3.7), 1.23 (2-CH3, s), 1.16 (2-СН3', s), unit D: 4.85 (2-Н, dd, 9.5, 5.1), 1.71 (3-Hb, ddd, 13.6, 9.5, 5.9), 1.59 (4-Н, bm, W1/2≈25), 1.50 (3-Ha, ddd, 13.6, 7.9, 5.1), 0.89 (4-СН3, d, 6.6), 0.85 (5-H3, d, 6.6); 13C NMR (CDCl3) δ unit A: 165.3 (1), 143.0 (3), 135.1 (9), 129.1 (12), 128.9 (11/13), 128.6 (10/14), 124.3 (2), 75.1 (7), 74.6 (5), 67.8 (8), 39.3 (6), 34.7 (4), 11.9 (6-Me), unit В: 170.5 (1), 154.1 (7), 130.9 (5), 129.7 (4), 128.3 (9), 122.5 (6), 112.4 (8), 56.1 (7-ОМe), 54.3 (2), 35.3 (3), unit С: 177.8 (1), 46.5 (3), 42.8 (2), 22.9 (2-Ме), 22.7 (2-Me'), unit D: 170.2 (1), 71.4 (2), 39.4 (3), 24.7 (4), 22.6 (4-Мe), 21.8 (5).
Криптофицин 97
К раствору циклического депсипептида, Криптофицина 86 (5.5 мг, 0.008 ммоля), растворенного в смеси Et2O/CH2Cl2 (3: 1 мл, 0,5 мл), добавляли эфирный раствор (0.5 мл) трифенилфосфина (3 мг, 0.011 ммоля). Затем смеси позволяли перемешивался при комнатной температуре в течение 3 суток. После этого времени растворитель удаляли в вакууме и остаток растворяли в CH2Cl2 и подвергали очистке с помощью жидкостной гель-проникающей хроматографии (CN колонка, 10 мк, 250•10 мм, 80% EtOAc/CH2Cl2, 3 мл мин-1) с возращением чистого Криптофицина 97, в виде аморфного бесцветного твердого вещества (4.2 мг, выход 82%).
UV (MeOH) λmax(ε) 202 (24400), 218 (9400), 284 (2200) nm; MS (EI) m/z 667/669 (M+, 11/3), 639/641 (41/16), 442 (21), 226 (17), 195 (43), 196 (32), 197 (100), 198 (71), 199 (11), 182/184 (25/16), 155/157 (63/22), 146 (30), 91 (40), 77 (29), HRMS, obsd m/z 667.3061, С36Н46N3О7 35Сl (Δ-3.6 mmu). 1H NMR (СDСl3) δ unit A 7.35 (11-Н/13-Н; m, W1/2≈15 Hz), 7.28 (12-H, m), 7.16 (10-Н/14-Н; m, W1/2≈15 Hz), 6.74(3-H; ddd, 15.2/9.0/6.1), 5.69 (2-H; d, 15.2), 5.21 (5-H; ddd, 9.2/4.3/4.2), 2.79 (8-H, bs), 2.51 (4-H2, m), 2.11 (7-H, bd, 6.5), 1.48 (6-H, m), 1.13 (6-Ме, d, 6.9); unit В: 7.18 (5-Н, d, 2.1), 7.04 (9-H, d, 8.4, 2.1), 6.83 (8-H, d, 8.4), 5.53 (NH, m), 4.73 (2-H, ddd, 7.6, 5.6, 5.4), 3.87 (OMe, s), 3.09 (3-Hb, dd, 14.7, 5.4), 3.04 (3-Ha, dd, 14.7, 7.6), unit С: 7.20 (NH, m), 3.40 (3-Hb, dd, 13.5, 8.6), 3.11 (3-Ha, dd, 13.5, 3.3), 1.22 (2-Me, s), 1.15 (2-Me, s), unit D: 4.84 (2-H, dd, 10.1, 3.7). 1.71 (3-Hb, m), 1.67 (4.Н, bm, W1/2≈25), 1.35 (3-Ha, m), 0.86 (4-Me, d, 6.7), 0.84 (5-Н3, d, 6.5); 13C NMR (CDCl3) δ unit A: 165.0 (1), 142.1 (3), 139.2 (9), 128.8 (11/13), 127.5 (12), 125.4 (10/14), 124.6 (2), 76.6 (5), 42.5 (6), 42.1 (7), 40.5 (8), 36.6 (4), 14.8 (6-Me), unit В: 170.2 (1), 154.1 (7), 130.9 (5), 129.5 (4), 128.2 (9), 122.6 (6), 112.4 (8), 56.1 (7-ОМе), 54.3 (2), 35.3 (3), unit С: 177.9 (1), 46.5 (3), 42.7 (2), 22.8 (2-Me/2-Me'), unit D: 170.5 (1), 71.3 (2), 39.5 (3), 24.6 (4), 22.7 (4-Me), 21.3 (5).
Пример 18. Синтез криптофицинов 110-112 и 124
Криптофицин 108
К смеси Криптофицина 90 и Криптофицина 91 (27 мг, 0.045 ммоля) в 0.8 мл тетрагидрофурана добавляли 400 мкл водного раствора периодной кислоты (32 мг, 0.14 ммоля). Прозрачный раствор перемешиваться при комнатной температуре в течение 5 часов. Добавляли воду и водный раствор экстрагировали дважды этилацетатом. Органический слой промывали водой, сушили и концентрировали. Остаток очищали с помощью хроматографии с обращенной фазой на ODS колонке (1:1 MeCN/H2O) с получением выхода Криптофицина 108 90%.
1Y-ЯМР (500 МГц) δ-звено А 9.64 (7-Н, d, 1.9), 6.67 (3-Н, ddd, 15.3, 10.0, 5.4), 5.81 (2-Н, dd, 15.3, 0.9), 5.32 (5-H, ddd, 11.0, 6.6, 2.1), 2.65 (6-Н, qdd, 7.2, 6.9, 1.9), 2.53 (4-Н, m), 2.44 (4-Н', m), 1.17 (6-Me, d, 7.2); unit B 7.21 (5-H, d, 2.2), 7.08 (9-Н, dd, 8.4, 2.2), 6.84 (8-Н, d, 8.4), 5.91 (NH, d, 8.4), 4.80 (2-Н, m), 3.86 (OMe, S), 3.16 (3-Н; dd, 5.4, -14.6), 3.00 (3-Н', dd, 7,8, -14.6); unit C 7.05 (NH, bdd, 6.9, 5.0), 3.47 (3-H, ddd, 4.6, 4.2, -13.5). 3.32 (3-Н', ddd, 6.9, 6.6, -13.5), 2.73 (2-Н, m), 1.23 (2-Me; d, 7.2); unit D 4.83 (2-Н, dd, 9.5, 3.6), 1.75 (3-Н, m), 1.70 (4-Н; m), 1.40 (3-Н', ddd, 9.5, 3.9, -14.0), 0.93 (5-H, d, 6.6), 0.88 (4-Ме-Н, d, 6.6). 13C NMR (125 MHz) δ unit A 200.6 (7), 165.4 (1), 140.5 (3), 125.6 (2), 73.7 (5), 50.1 (6), 36.1 (4), 10.8 (6-Me), unit В 171.1 (1), 154.0 (7), 131.0 (5), 129.9 (4), 128.3 (9), 122.4 (6), 112.3 (8), 56.1 (OMe), 53.8 (2), 35.0 (3); unit С 175.6 (1), 41.0 (3), 38.1 (2), 14.1 (2-Me); unit D 170.4 (1), 71.3 (2), 39.3 (3), 24.6 (4), 22.9 (5), 21.4 (4-Мe).
Криптофицин 108 получали также селективным озонолизом Криптофицина 82 с использованием процедуры, описанной выше для озонолиза Е в F.
Общая процедура для реакции Виттига
Бутиллитий (0.4 мл, 2.5 М в гексане) добавляли к 10 мл раствора арилтрифенилфосфоний хлорида (1 ммоль) в ТГФ при -78oС. Реакционную смесь перемешивали в течение 15 минут при -78oС и затем помещали на 1 час в баню со льдом. Три эквивалента указанной выше смеси добавляли к раствору Криптофицина 108 в ТГФ (около 30 мг/мл) при -78oС. Раствор перемешивали в течение 20 минут до удаления охлаждающей бани. Когда температура поднималась до 25oС, реакцию гасили насыщенным водным раствором хлористого аммония. Смесь экстрагировали дважды этилацетатом. Органический экстракт промывали водой, сушили и концентрировали. Остаток очищали на флеш-колонке ODS колонке (65:35 MeCN/H2O) с получением смеси Е и Z-изомеров (содержание от 8% до 13% Z-изомеров зависело от природы арильной группы; анализ определяли с помощью ЯМР). Желаемый Е-изомер кристаллизовали из эфира.
Криптофицин 110
Реакция Виттига приводила к 5.1 мг п-фторфенильного аналога (содержавшего около 8% Z-изомера) из 7.3 мг Криптофицина 108 (было возвращено около 1 мг непрореагировавшего альдегида). После кристаллизации из эфира, получали 4.0 мг чистого Криптофицина 110.
[α] D +42.4o (МеОН, с 2.1). 1Н NMR δ unit A 7.29 (10-Н/14-Н; dd, 8.6, 5.6), 6.98 (11-Н/13-Н, dt, 8.6, 8.5), 6.68 (3-Н, ddd, 15.3, 9.7, 5.6), 6.38 (8-H, d, 15.8), 5.83 (7-Н, dd, 15.8, 8.8), 5.78 (2-Н, d, 15.3), 5.00 (5-H, ddd, 10.8, 7.3, 1.3), 2.53 (4-Н/6-Н, m), 2.36 (4-Н', m), 1.13 (6-СН3, d, 6.8); unit В 7.21 (5-H, d, 1.8), 7.07 (9-Н, dd, 8.4, 1.8), 6.84 (8-Н, d, 8.4), 5.68 (NH, d, 8.5), 4.82 (2-Н, m), 3.87 (ОМе, s), 3.14 (3-Н; dd, 5.6, -14.4), 3.04 (3-H', dd, 7.2, -14.4); unit С, 6.95 (NH, bdd, 6.8, 5.9), 3.50 (3-Н, td, 4.4, -13.5), 3.28 (3-Н', ddd, 6.8, 6.7, -13.5), 2.72 (2-Н, m), 1.23 (2-Me; d, 7.2); unit D 4.82 (2-Н, m), 1.65 (3-Н/4-Н; m), 1.35 (3-Н', ddd, 4.5, 3.8, -10.9), 0.78 (5-H, d, 6.4), 0.74 (4-Mе-H, d, 6.4). 13C NMR (15 MHz) δ unit 165.4 (1), 162.3 (12, d, 1JC-F 245.8 Hz), 141.4 (3), 132.9 (9), 130.6 (7), 129.9 (8), 127.6 (10/14, d, 3JC-F 8.0 Hz), 125.2 (2), 115.5 (11/13, d, 2JC-F 21.5 Hz), 77.4 (5), 42.2 (6), 36.4 (4), 17.3 (6-Me); unit В 170.9 (1), 153.9 (7), 131.0 (5), 129.9 (4), 128.4 (9), 122.4 (6), 112.2 (8), 56.1 (ОМе), 53.6 (2), 35.1 (3); unit С 175.6 (1), 41.1 (3), 38.3 (2), 14.0 (2-Me); unit D 170.9 (1), 71.5 (2), 39.5 (3), 24.5 (4), 22.7 (5), 21.2 (4-Ме).
Криптофицин 111
Реакция Виттига приводила к 43 мг п-толильного аналога (содержавшего около 9% Z-изомера) из 55 мг Криптофицина 108. После кристаллизации из эфира, получали 34 мг чистого Криптофицина 111.
[α] D +44.3o (СНСl3, с 06); EIMS m/z (relative intensity %) 652 (2.9, M+), 497 (3.6), 412 (23.8), 242 (20), 145 (46), 105 (75); highresolution EIMS 652.29094 (calcd for C36H45ClN2O7, Δ-0.6 mmu, M+). 1Н NMR δ unit A 7.21 (10-Н/14-Н; d, 8.0), 7.11 (11-H/13-H, d, 8.0), 6.68 (3-Н, ddd, 15.2, 9.6, 5.4), 6.37 (8 H, d, 15.8), 5.95 (7-H, dd, 15.8, 8.6), 5.76 (2-Н, d, 15.2), 4.99 (5-H, dd, 10.4, 6.2), 2.51 (4-Н/6-Н, m), 2.38 (4-Н', m), 2.32 (12-Ме, s), 1.13 (6-СН3, d, 6.8); unit В 7.22 (5-H, d, 2.1), 7.08 (9-H, dd, 8.4, 2,1), 6.83 (8-Н, d, 8.4), 5.80 (NH, d, 8.4), 4.81 (2-Н, m), 3.86 (OMe, s), 3.14 (3-Н; dd, 5.6, 14.4). 3.03 (3-Н', dd, 7.3, -14.4); unit C 6.98 (NH, bdd, 6.0, 5.7), 3.49 (3-H, td, 4.6, -13,4), 3.29 (3-Н', ddd, 6.7, 6.6, -13.4), 2.70 (2-Н, m), 1.22 (2-Me; d, 7.2); unit D 4.81 (2-Н, m), 1.65 (3-Н/4-Н; m), 1.37 (3-Н', m), 0,78 (5-Н, d, 5.8), 0.73 (4-Ме-Н, d, 6.4). 13C NMR (75 MHz) δ unit A 165.5 (1), 141.5 (3), 137.4 (12), 133.9 (9), 131,7 (7), 129.3 (10/14), 129.0 (8), 126.0 (11/13), 125.1 (2), 77.4 (5), 42.2 (6), 36.4 (4), 21.1 (12-Ме), 17.3 (6-Ме), unit В 171.0 (1), 153.9 (7), 131.0 (5), 129.9 (4), 128.4 (9), 122.4 (6), 112.2 (8), 56.1 (OMe), 53.6 (2), 35.1 (3); unit С 175.6 (1), 41.1 (3), 38.3 (2), 14.1 (2-Me); unit D 170.9 (1), 71.6 (2), 39.5 (3), 24.5 (4), 22.7 (5), 21.2 (4-Ме).
Криптофицин 112
Реакция Виттига приводила к 35 мг 2-тиенильного аналога (содержавшего около 13% Z-изомера) из 51 мг Криптофицина 108. После кристаллизации из эфира, получали 25 мг чистого Криптофицина 111.
1Н NMR (500 MHz) δ unit А 7.12 (12-Н; d, 4.9), 6.94 (11-Н, dd, 4.9, 3.4), 6.90 (10-Н, d, 3.4), 6.68 (3-H, ddd, 15.2, 9,5, 5.3), 6.54 (8-Н, d, 15.7), 5.83 (7-Н, dd, 15.7, 8.7), 5.78 (2-Н, d, 15.2), 4.96 (5-H, dd, 9.5, 6.5), 2.51 (4-Н/6-Н, m), 2.35 (4-Н', m), 1.13 (6-СН3, d, 6.8); unit В 7.21 (5-H, d, 1.6), 7.07 (9-Н, dd, 8.4, 1.6), 6.84 (8-Н, d, 8.4), 5.74 (NH, d, 7.1), 4.82 (2-Н, m), 3.87 (OMe, s), 3.13 (3-H; dd, 5.5, -14.4), 3,04 (3-H', dd, 7.1, -14.4); unit С, 6.97 (NH, bt, 5.8), 3.50 (3-H, ddd, 4.4, 4.3, -13,4), 3.28 (3-H', ddd, 6.8, 6.6, -13.4), 2.71 (2-Н, m), 1.22 (2-Me; d, 7.2); unit D 4.82 (2-Н, m), 1.67 (3-Н/4-Н; m), 1.39 (3-H', m), 0.80 (5-H, d, 6.4), 0.77 (4-Me-H, d, 6,4).
Криптофицин 124
Реакция Виттига приводила к 131 мг п-хлорфенильного аналога (содержавшего около 10% Z-изомера) из 153 мг Криптофицина 108. После кристаллизации из эфира, получали 107 мг чистого Криптофицина 124;
[α] D +29.2o (СНСl3, с 0.5); high-resolution EIMS m/z 672.23691 (calcd for С35Н42Сl2N2O7, Δ 0.0 mmu). 1H NMR (500 MHz) δ unit A 7.26 (10-Н/11-Н/13-Н/14-Н, s), 6.68 (3-H, ddd, 15.2, 9.6, 5.4), 6.36 (8-Н, d, 15.8), 5.98 (7-Н, dd, 15.8, 8.8), 5.77 (2-Н, d, 15.2), 5.00 (5-H, bdd, 9.4, 6.3), 2.54 (4-Н/6-Н, m), 2.38 (4-Н', m), 1.13 (6-СН3, d, 6.8); unit В 7.22 (5-H, d, 1.7), 7.07 (9-Н, dd, 8.4, 1.7), 6.84 (8-Н, d, 8.4), 5.73 (NH, bd, 7.8), 4.82 (2-Н, m), 3.86 (OMe, s), 3.13 (3-H; dd, 5.5, -14.4), 3.04 (3-H', dd, 7.2, -14.4); unit С. 6.97 (NH, bt, 5.8), 3.49 (3-H, td, 4.2, -13.4), 3.29 (3-H', ddd, 6.7, 6.6, -13.4), 2.71 (2-Н, m), 1.22 (2-Ме; d, 7.2); unit D 4.81 (2-H, m), 1.65 (3-Н/4-Н; m), 1.35 (3-H', m), 0.77 (5-Н, d, 7.1), 0.75 (4-Me-H, d, 7.1). 13C NMR (75 MHz) δ unit A 165.4 (1), 141.3 (3), 135.2 (12), 133.2 (9), 130.9 (7), 130.6 (8), 128.7 (11/13), 127.3 (10/14), 125.2 (2), 77.3 (5), 42.2 (6), 36.5 (4), 17.3 (6-Me): unit В 170.9 (1), 153.9 (7), 131.0 (5), 129.8 (4), 128.4 (9), 122.4 (6), 112.2 (8), 56.1 (ОМе), 53.6 (2), 35.1 (3); unit C 175.6 (1), 41.1 (3), 38.3 (2), 14.1 (2-Me); unit D 170.8 (1), 71.5 (2), 39.6 (3), 24.5 (4), 22.8 (5), 21.3 (4-Ме).
Пример 19. Синтез криптофицинов 115-120 и 126
Криптофицины 115 и 116
Используя общую процедуру, описанную выше для эпоксидирования криптофицинов стирольного типа, Криптофицин 110 (3.5 мг) был превращен в 2.0 мг Криптофицина 115 и 1 мг Криптофицина 116.
Спектральные данные для Криптофицина 115
[α] D +29.1o (МеОН, с 0.8); EIMS m/z (relative intensity %) 672 (1.9, M+), 412 (5.8), 245 (17), 195 (52), 155 (31), 141 (23), 135 (15), 109 (100); high-resolution EIMS 668.2853 (calcd for C35H42ClFN2O8, Δ+3.4 mmu, M+). 1Н NMR (500 MHz) δ unit A 7.22 (10-Н/14-Н; ddt, 8.7, 5.2, 2.0), 7.01 (11-Н/13-Н, ddt, 8.7, 8.5, 2.0), 6.68 (3-H, ddd, 15.2, 9.7, 5.2), 5.74 (2-H, dd, 15.2, 0.8), 5.15 (5-Н, ddd, 11.2, 5.0, 1.8), 3.67 (8-Н, d, 2.0), 2.88 (7-Н, dd, 7.4, 2.0), 2.54 (4-Н, dtd, 5.2, 1.8, -14.4), 2.44 (4-Н', ddd, 11.2, 9.7. -14.4), 1.79 (6-Н, m), 1.13 (6-СН3, d, 6.8); unit В 7.21 (5-H, d, 2.0), 7.06 (9-Н, dd, 8.3, 2.0), 6.83 (8-Н, d, 8.3), 5.63 (NH, d, 8.4), 4.80 (2-H, ddd, 8.4, 7.2, 5.4), 3.87 (ОМе, s), 3.14 (3-Н; dd, 5.4, -14.4), 3.03 (3-H', dd, 7.2, -14.4); unit C 6.94 (NH, bdd, 6.7, 5.0), 3.48 (3-H, ddd, 5.0, 3.7, -13.4), 3.30 (3-H', ddd, 6.8, 6.7, -13.4), 2.72 (2-H, m), 1.22 (2-Me; d, 7.4); unit D 4.83 (2-H, dd, 9.9, 3.6), 1.70 (3-Н/4-Н; m), 1.35 (3-H', m), 0.87 (5-H, d, 6.5), 0.85 (4-Me-H, d, 6.5). 13C NMR (125 MHz) δ unit А 165.3 (1), 162.9 (12, d, 1jC-F 245.4 Hz), 141.0 (3), 132.5 (9), 127.3 (10/14, d, 3JC-F 8.3 Hz), 125.3 (2), 115.7 (11/13, d, 2JC-F 21.9 Hz), 76.1 (5), 63.0 (7), 58.3 (8), 40.5 (6), 36.7 (4), 13.4 (6-Мe); unit В 170.9 (1), 154.0 (7), 131.0 (5), 129.7 (4), 128.4 (9), 122.5 (6), 112.3 (8), 56.1 (ОМе), 53.6 (2), 35.0 (3); unit С 175.6 (1), 41.1 (3), 38.2 (2), 14.1 (2-Me); unit D 170.7 (1), 71.3 (2), 39.4 (3), 24.5 (4), 22.9 (5), 21.3 (4-Ме).
Криптофицины 117 и 118
Используя общую процедуру, описанную выше для эпоксидирования криптофицинов стирольного типа, Криптофицин 111 (6.2 мг) был превращен в 3.5 мг Криптофицина 117 и 1 мг Криптофицина 118.
Спектральные данные для Криптофицина 117
[α] D +25.5o (МеОН, с 1.8); EIMS m/z (relative intensity %) 668 (4.8, M+), 412 (6.2), 280 (11), 173 (9.4), 145 (15), 135 (34), 105 (100); high-resolution EIMS m/z 668.28532 (calcd for С36H45СlN2О8, Δ+1.1 mmu, M+). 1H NMR (500 MHz) δ unit A 7.17/7.13 (10-Н/11-Н/13-Н/14-Н, A2B2 q, 8.0), 6.67 (3-H, ddd, 15.4, 9.8, 5.6), 5.73 (2-H, dd, 15.4, 0.9), 5.14 (5-Н, ddd, 11.2, 4.9, 2.0), 3.65 (8-Н, d, 2.0), 2.91 (7-Н, dd, 7.6, 2.0), 2.54 (4-Н, bdd, 5.6, -14.3), 2.44 (4-Н', ddd, 10.7, 9.8, -14.3), 2.35 (12-Ме, s), 1.77 (6-Н, m), 1.14 (6-СН3, d, 6.9); unit В 7.21 (5-H, d, 2.2), 7.07 (9-Н, dd, 8.5, 2.2), 6.83 (8-Н, d, 8.5), 5.65 (NH, d, 8.5), 4.80 (2-Н, ddd, 8.3, 7.4, 5.6). 3.87 (ОМе, s), 3.13 (3-H; dd, 5.6, -14.5), 3.02 (3-H', dd, 7.4, -14.5); unit С 6.93 (NH, bd, 6.8, 5.1), 3.48 (3-H, ddd, 5.1, 3.8, -13.2), 3.29 (3-H', ddd, 6.9, 6.8, -13.2), 2.71 (2-Н, m), 1.22 (2-Me: d, 7.1); unit D 4.82 (2-Н, dd, 9.8, 3.6), 1.70 (3-Н/4-Н; m), 1.33 (3-H', m), 0.85 (5-H, d, 6.5), 0.84 (4-Me-H, d, 6.5). 13C NMR (125 MHz) δ unit A 165.3 (1), 141.0 (3), 138.4 (12), 133.7 (9), 129.4 (10/14), 125.6 (11/13), 125.3 (2), 76.2 (5), 62.9 (7), 59.0 (8), 40,7 (6), 36.7 (4), 21.1 (12-Ме), 13.6 (6-Me); unit В 170.9 (1), 154.0 (7), 131.0 (5), 129.8 (4), 128.4 (9), 122.4 (6), 112.3 (8), 56,1 (ОМе), 53.6 (2), 35.1 (3); unit С 175.5 (1), 41.1 (3), 38.3 (2), 14.1 (2-Me); unit D 170.7 (1), 71.3 (2), 39.4 (3), 24.5 (4), 22.8 (5), 21.2 (4-Ме).
Спектральные данные для Криптофицина 118
1H-МР спектр указанного Криптофицина являлся подобным спектру Криптофицина 38 за исключением мультиплетов при 7.30-7.38 для фенильных протонов, заменявшихся 4Н мультиплетом при 7.15 и 3Н синглетом при 2.35 для р-толильных протонов.
Криптофицины 119 и 120
Используя общую процедуру, описанную выше для эпоксидирования криптофицинов стирольного типа, Криптофицин 112 (8 мг) был превращен в 1.2 мг Криптофицина 119 и 0.5 мг Криптофицина 120.
Спектральные данные для Криптофицина 119
1Н-ЯМР (500 МГц) δ unit A 7.28 (12-H, d, 5.2), 7.11 (10-Н, d, 3.3), 7.00 (11-H, dd, 5.2, 3.3), 6.68 (3-Н, ddd, 15.1, 9.9, 5.2), 5.76 (2-H, dd, 15.1, 1.3), 5.15 (5-Н, ddd, 11.2, 5.5, 1.8), 3.94 (8-Н, d, 2.0), 3.10 (7-Н, dd, 7.5, 2.0), 2.56 (4-H, bdd, 5.2, -14.3), 2.44 (4-H', ddd, 11.2, 9.9, -14.3), 1.76 (6-H, m), 1.13 (6-СН3, d, 6.8); unit B 7.21 (5-H, d, 2.3), 7.07 (9-Н, dd, 8.4, 2.3), 6.83 (8-Н, d, 8.4), 5.63 (NH, d, 8.4), 4.80 (2-H, ddd, 8.5, 7.4, 5.7), 3.87 (OMe, s), 3.13 (3-Н; dd, 5.7, -14.5), 3.03 (3-Н', dd, 7.4, -14.5); unit С 6.95 (NH, bd, 6.5, 5.3), 3.48 (3-Н, ddd, 5.3, 3.6, -13.5), 3.31 (3-Н', ddd, 6.8, 6.5, -13.5), 2.72 (2-H, m), 1.23 (2-Me; d, 7.3); unit D 4.85 (2-H, dd, 10.3, 3.5), 1.70 (3-Н/4-Н; m), 1.33 (3-Н', m), 0.86 (5-H, d, 6.3), 0.85 (4-Me-H, d, 6.3).
Криптофицины 125 и 126
Используя общую процедуру, описанную выше для эпоксидирования криптофицинов стирольного типа, Криптофицин 124 (47 мг) был превращен в 26 мг Криптофицина 125 и 12 мг Криптофицина 126.
Спектральные данные для Криптофицина 125
[α]D +35.6o (СНСl3, с=0.9); high-resolution EIMS m/z 688.2301 (calcd for С35Н42Сl2N2O8, Δ+1.7 mmu). 1H NMR (500 MHz) δ unit A 7.33 (11-Н/13-Н, dt, 8.5, 2.0), 7.18 (10-H/14-H, dt, 8.5. 2.0), 6.67 (3-Н, ddd, 15.1, 9.9, 5.2), 5.73 (2-H, dd, 15.1, 0.9), 5.15 (5-H, ddd, 11.0, 4.7, 1.5), 3.66 (8-Н, d, 1.9), 2.87 (7-Н, dd, 7.4, 1.9), 2.53 (4-H, m), 2.42 (4-H', ddd, 10.6, 10.5, -14.4), 1.78 (6-H, m), 1.12 (6-СН3, d, 7.0); unit В 7.20 (5-H, d, 2.1), 7.06 (9-Н, dd, 8.3, 2.1), 6.83 (8-Н, d, 8.3), 5.72 (NH, d, 8.1), 4.79 (2-H, ddd, 8.3, 7.9, 5.4), 3.86 (OMe, s), 3.12 (3-Н; dd, 5.4, -14.5), 3.02 (3-Н', dd, 7.4, -14.5); unit С 6.97 (NH, bdd, 6.3, 5.5), 3.46 (3-Н, ddd, 4.4, 4.1, -13.7), 3.22 (3-Н', ddd, 7.0, 6.3, -13.7), 2.70 (2-H, m), 1.22 (2-Me; d, 7.2); unit D 4.82 (2-H, dd, 9.9, 3.4), 1.70 (3-Н/4-Н; m), 1.33 (3-Н', m), 0.87 (5-Н, d, 6.5), 0.84 (4-Me-H, d, 6.5). 13С NMR (125 MHz) δ unit A 165.3 (1), 141.0 (3), 135.3 (12), 134.4 (9), 128.9 (11/13), 126.9 (10/14), 125.3 (2), 76.0 (5), 63.1 (7), 58.2 (8), 40.4 (6), 36.7 (4), 13.4 (6-Me); unit В 170.9 (1), 154.0 (7), 131.0 (5), 129.8 (4), 128.3 (9), 122.4 (6), 112.3 (8), 56.1 (ОМe), 53.7 (2), 35.0 (3); unit С 175.6 (1), 41.0 (3), 38.2 (2), 14.1 (2-Me); unit D 170.7 (1), 71.2 (2), 39.4 (3), 24.5 (4), 22.9 (5), 21.3 (4-Ме).
Спектральные данные для Криптофицина 126
1Н-МР (300 МГц) unit А δ 7.26 (11-Н/13-Н, d, 8.1), 7.17 (10-Н/14-Н, d, 8.1), 6.70 (3-Н, ddd, 15.1, 9.4, 5.3), 5.81 (2-Н, d, 15.1), 5.14 (5-H, bdd, 10.0, 4.5), 3.57 (8-Н, bs), 2.85 (7-Н, bd, 7.6), 2.66 (4-Н, m), 2.59 (4-Н', m), 1.77 (6-Н, m), 1.04 (6-СН3, d, 7.0); unit В 7.23 (5-H, bs), 7.08 (9-Н, bd, 8.4), 6.83 (8-Н, d, 8.4), 5.82 (NH, d, 6.8), 4.81 (2-Н, ddd, 7.2, 6.8, 5.4), 3.86 (OMe, s), 3.14 (3-Н; dd, 5.4, -14.1), 3.03 (3-Н', dd, 7.4, -14.1); unit С 7.03 (NH, bt, 5.7), 3.47 (3-Н, ddd, 4.0, 3.7, -13.1), 3.34 (3-Н', ddd, 6.8, 6.4, -13.1), 2.72 (2-Н, m), 1.24 (2-Me; d, 7.0); unit D 4.90 (2-Н, dd, 10.0, 2.5), 1.74 (3-Н/4-Н; m), 1.45 (3-Н', m), 0.91 (5-H, d, 6.5), 0.86 (4-Me-H, d, 6.5). 13С NMR (125 MHz) δ unit A 165.4 (1), 141.3 (3), 135.6 (12), 134.1 (9), 128.8 (11/13), 126.8 (10/14), 125.2 (2), 76.8 (5), 63.3 (7), 55.6 (8), 40.8 (6), 36.7 (4), 13.4 (6-Me); unit В 170.9 (1), 153.9 (7), 131.0 (5), 129.8 (4), 128.4 (9), 122.3 (6), 112.2 (8), 56.1 (OMe), 53.7 (2), 35.0 (3); unit С 175.7 (1), 41.0 (3), 38.2 (2), 14.1 (2-Me); unit D 170.8 (1), 71.4 (2), 39.3 (3), 24.6 (4), 23.1 (5), 21.3 (4-Ме).
Пример 20. Синтез Криптофицинов 121-123 и 127
Соединение AJ
К раствору моногидрата BOC- -лейцина (1.245 г, 5 ммолей) в 30 мл безводного CH2Cl2 добавляли твердый EDC (1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорид) (0.53 г, 2.75 ммоля) в атмосфере N2 при перемешивании при 0oС. После перемешивания при 0oС в течение 1.5 часов, смесь концентрировали ниже 5oС и остаток разбавляли 35 мл холодного ЕtOАс, последовательно промывали двумя порциями (10 мл) каждого, охлажденного на льду раствора, 5% водного раствора KHSO4, 5% водного NаНСО3, рассолом. Органическую фазу отделяли, сушили (MgSO4) при 5oС и выпаривали ниже 5oС. Оставшееся масло разбавляли охлажденным на льду ТГФ (5 мл) и добавляли раствор соединения К (295 мг, 0,5 ммоля) в охлажденный на льду безводный ТГФ (5 мл). Затем были добавлены несколько кристаллов DMAP к смеси, которую перемешивали и позволяли смеси достигнуть 25oС в течение ночи. Добавляли раствор 5% водного NaHCO3 (5 мл) и полученную двухфазную смесь интенсивно перемешивали при 25oС в течение 2 часов. Добавляли ЕtOАс (40 мл), водную фазу экстрагировали добавлением ЕtOАс (2 раза по 20 мл) и объединенные органические слои промывали водой и рассолом, сушили (NaSO4), фильтровали и выпаривали. Остаток отфильтровывали через слой силикагеля с 25% ЕtOАс в гексане с получением соединения AJ в виде бесцветного масла (385 мг, выход 96%).
-лейцина (1.245 г, 5 ммолей) в 30 мл безводного CH2Cl2 добавляли твердый EDC (1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорид) (0.53 г, 2.75 ммоля) в атмосфере N2 при перемешивании при 0oС. После перемешивания при 0oС в течение 1.5 часов, смесь концентрировали ниже 5oС и остаток разбавляли 35 мл холодного ЕtOАс, последовательно промывали двумя порциями (10 мл) каждого, охлажденного на льду раствора, 5% водного раствора KHSO4, 5% водного NаНСО3, рассолом. Органическую фазу отделяли, сушили (MgSO4) при 5oС и выпаривали ниже 5oС. Оставшееся масло разбавляли охлажденным на льду ТГФ (5 мл) и добавляли раствор соединения К (295 мг, 0,5 ммоля) в охлажденный на льду безводный ТГФ (5 мл). Затем были добавлены несколько кристаллов DMAP к смеси, которую перемешивали и позволяли смеси достигнуть 25oС в течение ночи. Добавляли раствор 5% водного NaHCO3 (5 мл) и полученную двухфазную смесь интенсивно перемешивали при 25oС в течение 2 часов. Добавляли ЕtOАс (40 мл), водную фазу экстрагировали добавлением ЕtOАс (2 раза по 20 мл) и объединенные органические слои промывали водой и рассолом, сушили (NaSO4), фильтровали и выпаривали. Остаток отфильтровывали через слой силикагеля с 25% ЕtOАс в гексане с получением соединения AJ в виде бесцветного масла (385 мг, выход 96%).
[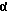 ]D 13.6o (с=0.63, CHCCl3); EIMS m/z (rel. intensity) 805/803/801 (M+, 1%), 568/570/572/574 (9/10/6/2), 523/525/527 (5/6/1), 418/420/422/424 (15/15/6/2), 341/343/345/347 (58/70/35/9), 307/309/311 (29/22/10), 224/227/228/229 (10/100/31/14), 208/210/211/2'12 (20/83/45/54); HREIMS m/z 800.2218 (C35H48 35Cl4N2O8, Δ-5.3 mmu): 1H NMR (СDСl3) unit A δ 7.21-7.35 (Ph-H5; m), 6.77 (3-H; ddd, 6.7/6.7/15.3), 6.4 (8-H; d, 15.8), 6.05 (7-Н; dd, 8.7/15.8), 5.9 (2-Н; d, 15.3), 5.0 (5-Н; m), 2.6 (6-Н; m), 2.55 (4-H2; m), 1.17 (6-Me; d, 6.7); unit В δ 7.22 (5-H; s), 7.05 (9-H; d, 8.1), 6.84 (8-Н; d, 8.1), 6.55 (NH; d, 7.8), 5.0 (2-Н; ddd, 5.5/7.1/7.8), 4.68-4.8 (CH2CCl3; ABq, 11.9), 3.86 (ОМe; s), 3.2 (3-H; dd, 5.5/14.0), 3.06 (3-H'; dd, 7.1/14.0); unit D δ 4.8 (NH; d), 4.2 (2-H; m), 1.65 (4-H; m), 1.55 (3-H; m), 1.4
]D 13.6o (с=0.63, CHCCl3); EIMS m/z (rel. intensity) 805/803/801 (M+, 1%), 568/570/572/574 (9/10/6/2), 523/525/527 (5/6/1), 418/420/422/424 (15/15/6/2), 341/343/345/347 (58/70/35/9), 307/309/311 (29/22/10), 224/227/228/229 (10/100/31/14), 208/210/211/2'12 (20/83/45/54); HREIMS m/z 800.2218 (C35H48 35Cl4N2O8, Δ-5.3 mmu): 1H NMR (СDСl3) unit A δ 7.21-7.35 (Ph-H5; m), 6.77 (3-H; ddd, 6.7/6.7/15.3), 6.4 (8-H; d, 15.8), 6.05 (7-Н; dd, 8.7/15.8), 5.9 (2-Н; d, 15.3), 5.0 (5-Н; m), 2.6 (6-Н; m), 2.55 (4-H2; m), 1.17 (6-Me; d, 6.7); unit В δ 7.22 (5-H; s), 7.05 (9-H; d, 8.1), 6.84 (8-Н; d, 8.1), 6.55 (NH; d, 7.8), 5.0 (2-Н; ddd, 5.5/7.1/7.8), 4.68-4.8 (CH2CCl3; ABq, 11.9), 3.86 (ОМe; s), 3.2 (3-H; dd, 5.5/14.0), 3.06 (3-H'; dd, 7.1/14.0); unit D δ 4.8 (NH; d), 4.2 (2-H; m), 1.65 (4-H; m), 1.55 (3-H; m), 1.4 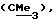 s), 1.37 (3-H'; m), 0.85 (4-Me; d, 6.5), 0.8 (5-Н; d, 6.5); 13C NMR unit А δ 165.4 (1), 139.3 (3), 137.0 (9), 131.5 (8), 130.5 (7), 128.5 (11/13), 127.3 (12), 126.2 (10/12), 125.8 (2), 76.2 (5), 40.8 (6), 33.4 4), 16.8 (6-Me); unit В δ 170.0 (1), 154.2 (7), 131.0 (5), 129.0 (9), 122.5 (6), 112.2 (8), 94.4
s), 1.37 (3-H'; m), 0.85 (4-Me; d, 6.5), 0.8 (5-Н; d, 6.5); 13C NMR unit А δ 165.4 (1), 139.3 (3), 137.0 (9), 131.5 (8), 130.5 (7), 128.5 (11/13), 127.3 (12), 126.2 (10/12), 125.8 (2), 76.2 (5), 40.8 (6), 33.4 4), 16.8 (6-Me); unit В δ 170.0 (1), 154.2 (7), 131.0 (5), 129.0 (9), 122.5 (6), 112.2 (8), 94.4  74.7
74.7 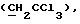 56.1 (ОМe), 53.3 (2), 36.5 (3), unit D δ 173.2 (1), 155.7
56.1 (ОМe), 53.3 (2), 36.5 (3), unit D δ 173.2 (1), 155.7 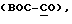 80.0
80.0 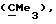 52.4 (2), 41.2 (3), 28.3
52.4 (2), 41.2 (3), 28.3 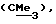 24.8 (4), 22.8 (4-Ме), 21.6 (5).
24.8 (4), 22.8 (4-Ме), 21.6 (5).
Соединение АК
Соединение AJ (115 мг, 0.134 ммоля) растворяли в ТФУК (3 мл) и оставляли при 25oС в течение 1 часа. Растворитель удаляли и остаток выпаривали повторно из CH2Cl2 с получением в результате аморфного твердого вещества. Это твердое вещество растворяли в безводном ТГФ (5 мл) и добавляли достаточное количество диэтилизопропиламина с доведением рН раствора до 8-9, когда аликвота раствора оставляла пятно на влажной рН бумаге. Раствор охлаждали до 0oС с перемешиванием и добавляли раствор соединения AL в ТГФ (3 мг). Для приготовления соединения AL, соединение Z (55 мг, 0.27 ммоля) растворяли в ТГФ (3 мл) и добавляли диэтилизопропиламин (0.046 мл, 0.27 ммоля). К этой смеси после охлаждения до -15oС добавляли по каплям пивалоилхлорид (0.033 мл, 0.27 ммоля) и раствор перемешивали при -15oС в течение 10 минут и при 0oС в течение 20 минут. Полученную суспензию переносили затем в раствор соединения AJ в ТГФ. Полученную смесь перемешивали при -0oС и позволяли достигнуть температуры 25oС в течение ночи. Через 12 часов нахождения при температуре 25oС добавляли 5% водный раствор NaHCO3 и полученную смесь интенсивно перемешивали при 25oС в течение 1.5 часов. Добавляли ЕtOАс (40 мл) и фазы разделяли. Водную фазу экстрагировали дополнительно ЕtOАс (2 раза по 10 мл). Объединенные органические экстракты промывали 5% водным раствором NaHCO3 (20 мл), 5% водным раствором KHSO4 (20 мл) и рассолом, сушили (NаSО4) и выпаривали. Оставшееся масло хроматографировали на силикагеле, элюируя 35% EtOAc в гексане с получением соединения АК в виде бесцветной пены (98 мг, выход 83%).
[α]D -8.3 (с 0.88, СНСl3); 1Н NMR (СDСl3) unit А δ 7.28-7.35 (Ph-H4; m), 7.22 (H-12; m), 6.75 (H-3; ddd, 6.4/6.4/15.4), 6.4(H-8; d, 15.9), 6.04 (H-7; dd, 8.6/15.9), 5.95 (Н-2; d, 15.4), 5.0 (Н-5; m), 2.6 (Н-4; m), 1.1 (6-Ме; d, 6.8); unit В δ 7.22 (Н-5, d, 1.5), 7.15 (NH; d, 7.6), 7.05 (Н-9; dd, 1.5/8.2), 6.85 (Н-8; d, 8.2), 5.0 (Н-2; m), 4.8-4.68 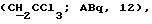 3.86 (OMe; s), 3.2 (Н-3; m), 3.1 (Н-3'; dd, 7.2/14.1); unit C δ 5.0 (NH; m), 3.2 (Н2-3; m), 2.55 (Н-2; m), 1.1 (2-Me; d, 7.1); unit D δ 6.12 (NH; m), 4.4 (Н-2; m), 1.65 (H-4; m), 1.55 (Н-3; m), 1.4 (Н-3'; m), 0.86 (4-Me; d, 6.8), 0.81 (5-Н; d, 6.8); 13C NMR (CDCl3) unit A δ 165.8 (1), 138.9 (3), 131.5 (8), 130.4 (7), 128.6 (11/13), 127.4 (12), 126.2 (10/14), 125.8 (2), 76.3 (5), 33.6 (4), 16.6 (6-Me); unit В δ 170.2 (1), 154.1 (7), 136.9 (4), 131.2 (5), 128.6 (9), 122.3 (6), 112.2 (8), 94.4
3.86 (OMe; s), 3.2 (Н-3; m), 3.1 (Н-3'; dd, 7.2/14.1); unit C δ 5.0 (NH; m), 3.2 (Н2-3; m), 2.55 (Н-2; m), 1.1 (2-Me; d, 7.1); unit D δ 6.12 (NH; m), 4.4 (Н-2; m), 1.65 (H-4; m), 1.55 (Н-3; m), 1.4 (Н-3'; m), 0.86 (4-Me; d, 6.8), 0.81 (5-Н; d, 6.8); 13C NMR (CDCl3) unit A δ 165.8 (1), 138.9 (3), 131.5 (8), 130.4 (7), 128.6 (11/13), 127.4 (12), 126.2 (10/14), 125.8 (2), 76.3 (5), 33.6 (4), 16.6 (6-Me); unit В δ 170.2 (1), 154.1 (7), 136.9 (4), 131.2 (5), 128.6 (9), 122.3 (6), 112.2 (8), 94.4 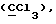 74.5
74.5 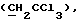 56.1 (ОМе), 53.4 (2), 36.6 (3); unit С δ 175.4 (1), 156.3
56.1 (ОМе), 53.4 (2), 36.6 (3); unit С δ 175.4 (1), 156.3 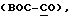 79.5
79.5 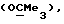 43.6 (3), 41.3 (2), 15.1 (2-Me); unit D δ 172.6 (1), 51.3 (2), 40.5 (3), 24.5 (4), 22.7 (4-Ме), 21.5 (5).
43.6 (3), 41.3 (2), 15.1 (2-Me); unit D δ 172.6 (1), 51.3 (2), 40.5 (3), 24.5 (4), 22.7 (4-Ме), 21.5 (5).
Криптофицин 121
Соединение АК (73 мг, 0.082 ммоля) растворяли в АсОН (3.5 мл), добавляли активированную Zn пыль и полученную суспензию подвергали ультразвуковому воздействию в течение 45 минут. После перемешивания при 25oС дополнительно в течение 1.5 часов смесь разбавляли CH2Cl2 (5 мл) и фильтровали через целит R. Твердое вещество промывали дополнительно CH2Cl2 (10 мл) и полученный фильтрат упаривали. Остаток без дальнейшей очистки растворяли в ТФУК (3 мл), хранили при 25oС в течение 1 часа и растворитель удаляли в вакууме. Остаток повторно выпаривали из CH2Cl2, затем из толуола до получения бесцветного твердого вещества. Это твердое вещество растворяди в ДМФА (3 мл), добавляли FDPP (43 мг, 0.108 ммоля) с последующим добавлением достаточного количества диэтилизопропиламина с доведением рН раствора до рН 8-9, когда аликвота оставляла пятно на влажной рН бумаге. После
перемешивания при 25oС в течение 16 часов, смесь разбавляли эфиром (40 мл) и промывали 5% водным раствором KHSO4 (2 раза по 1 мл), 5% водным раствором NaHCO3 (15 мл) и рассолом. После сушки (Na2SO4) и выпаривания остаток очищали с помощью гель-проникающей жидкостной хроматографии с обращенной фазой на С-18 колонке с силикагелем (EconosilR С-18, 22•250 мм), элюируя смесью СН3СN/вода 65:35 при 6 мл/мин, фракцию, элюируемую при tR 48 минут, собирали и выпаривали с получением аморфного твердого вещества (26 мг, выход 50%).
[α] D +46.5o (с 0.81, СНСl3); EIMS m/z 637/639 (М+, 1%), 449/451 (2/1), 420 (5), 411/413 (7/5), 227/228 (9/7), 195 (10), 184 (15), 167/168/169 (40/86/29), 155/157 (100/26), 91 (85), 69 (86); HREIMS m/z 637.2864 (C35H44 35ClN3О6, Δ+5.5 mmu); 1H NMR unit A δ 7.21-7.35 (Pn-H5; m), 6.75 (H-3; ddd, 4.2/10.8/16), 6,4 (H-8; d, 16), 6.04 (H-7; dd, 8.8/16), 5.75 (H-2; d, 16), 5,1 (Н-5; m), 2.55 (Н-4; m, Н-6; m), 2.35 (H-4'; m); unit В δ 7.18 (Н-5; d, 2), 7.05 (Н-9; dd, 2.0/8.3), 6.85 (Н-8; d, 8.3), 5.7 (NH; d, 7.2), 4.7 (H-2; ddd, 4.9/7.2/7.7). 3.86 (ОМе; s), 3,1 (H-3; dd, 4.9/14.4), 3.0 (Н-3'; dd, 7.7/ 14,4); unit С δ 7.25 (NH; m), 3.5 (H-3; m), 3.4 (H-3'; m). 2.55 (H-2; m), 1.2 (2-Me; d, 7,2); unit D δ 5.8 (NH; d, 7.2), 4.4 (Н-2; m), 1.55 (Н-4, m), 1.38 (H2-3; dd, 7.2/7.7), 0.76 (4-Me; d, 6.6), 0.74 (H-5; d, 6.6); 13С NMR (CDCl3) unit A δ 165.1 (1), 141.9 (3), 136.8 (9), 131,7 (8), 130.2 (7), 128.5 (11/13), 127.3 (14), 126.1 (10/12), 125.1 (2), 76.5 (5), 42.3 (6), 36.3 (4), 17.2 (6-Ме); unit B δ 171.0 (1), 154.1 (7), 130.8 (5), 129.6 (4), 128.4 (9), 122.5 (6), 112,4 (8), 56.2 (ОМe), 54.4 (2), 35.4 (3); unit С δ 175.8 (1), 41.0 (3), 38.6 (2), 14.8 (2-Me); unit D δ 173.2 (1), 51.1 (2), 40.9 (3), 24.7 (4), 23.4 (4-Me), 21.5 (5)
Криптофицины 122 и 123
К перемешиваемому раствору (0oС) Криптофицина 121 (0.011 ммоля) в безводном CH2Cl2 (1.3 мл) добавляли 99% м-СРВА (17 мг, 0.1 ммоля) в виде одной порции. Затем добавляли безводный толуол (0.7 мл) и полученную смесь перемешивали при 25oС в течение 72 часов. Растворитель выпаривали в вакууме и оставшееся твердое вещество очищали с помощью гель-проникающей жидкостной хроматографии с обращенной фазой на С-18 колонке с силикагелем (EconosilR C-18, 22•250 мм), элюируя смесью СН3СМ/вода 65:35 при 6 мл/мин, Криптофицин 122 (9 мг, выход 44%) элюировали при tR 37.5 минут и Криптофицин 123 (5 мг, выход 23%) элюировали при tR 40 минут.
Криптофицин 122
[α]D +35.0 (с 1, СНСl3); EIMS m/z 653/655 (1.6/0.7, M+), 411/413 (20/5), 280/282 (39/19), 252/254 (13/8), 223/225/227 (19/10/23), 211/213 (18/6), 195/197 (51/13), 184/186(49/11), 176/168/169(20/16/21), 155/156/157(95/59/42), 139/141/143 (60/40/24), 135/135 (30/11), 129/131(40/29), 91(100); HREIMS m/z 653.2906 (С35Н44 35ClN3О7, Δ-3.8 mmu); 1Н NMR (d6-acetone) unit А δ 6.65 (Н-3; ddd, 38/11.0/15.0), 5,9 (H-2; dd, 1.9/15.0), 5.25 (H-5; ddd, 1.9/4.9/11.5), 3.82 (H-8; d, 2.0), 3.0 (H-7; dd, 2.0/7.7), 2.65 (H-4; dddd, 2.0/2.0/3.8/14.5), 2.4 (H-4'; ddd, 11.0/11.5/ 14.5), 1.85 (Н-6; dqd, 4.9/7.4/7.7), 1.1 (6-Ме; d, 6.9); unit В δ 7,45 (NH; d, 7.9), 7.22 (Н-9; dd, 2.0/8.4), 7.0 (H-8; d, 8.4), 4.45 (H-2; ddd, 3.6/7.9/11.2), 3.84 (OMe; s), 3.2 (Н-3; dd, 3.6/14.5), 2.75 (Н-3'; dd, 11.2/14.5); unit С δ 7.8 (NH; d, 8.8), 3.65 (Н-3; ddd, 3.3/8.8/13.2), 3.1 (H-3'; ddd, 2.1/2.1/13.2), 2.55 (H-2; m); unit D δ 7.35 (NH; d, 8.1), 4.25 (H-2; ddd, 4.8/8.1/10.8), 1.65 (Н-4; m), 1.45 (Н-3; ddd, 5.1/10.8/13.7), 1.35 (Н-3'; 4.8/9.0/13.7), 0.8 (4-Me/ H-5; d, 6.5); 13C NMR unit A δ 165.9 (1), 140.8 (3), 138.6 (9), 129.4 (11/13), 129.2 (12), 126.7 (2), 126.6 (10/14), 76.0 (5), 63.9 (7), 59.3 (8), 41.2 (6), 37.7 (4), 13.9 (6-Me); unit В δ 171.9 (1), 154.6 (7), 132.5 (4), 131.4 (5), 129.0 (9), 122.4 (6), 113.3 (8), 56.9 (2), 65.4 (ОМе), 36.4 (3); unit C δ 177.2 (1), 41.3 (3), 38.9 (2), 15.7 (2-Me); unit D δ 174.2 (1), 51.7 (2), 40.6 (3), 25.3 (4), 23.1 (4-Мe), 21.5 (5).
Криптофицин 123
[α] D +25.2o (с 0.58, СНСl3); 1H NMR (СDСl3) unit A δ 7.21- 7.35 (Ph-H5; m), 6.75 (H-3; ddd, 4.1/10.9/14.1), 5.85 (H-2; dd, 1.4/15.2), 5.25 (H-5; m), 3.6 (H-8; d, 2.0), 2.9 (H-7; dd, 2.0/7.8), 2.7 (Н-4; m), 2.55 (Н-4; m), 1.75 (Н-6; m), 1.05 (6-Ме; d, 7.1), unit В δ 7.18 (H-5; d, 2.0), 7.05 (H-9; dd, 2.0, 8.5), 6.85 (H-8; d, 8.5), 5.95 (NH; d, 7.7). 4.7 (H-2; ddd, 4.9/7.7/8.1), 3.86 (OMe; s), 3.15 (H-3; dd, 4.9/14.5), 3.05 (H-3'; dd, 8.1/14.5); unit С δ 7.25 (NH; m), 3.55 (H-3; ddd, 4.6/8.7/13.3). 3.15 (H-3'; ddd, 3.0/3.1/13.3), 2.55 (H-2; m), 1.2 (2-Me; d, 7.3); unit D δ 6.0 (NH; d, 8.2), 4.45 (H-2; m), 1.6 (Н-4; m), 1.55 (Н2-3; m), 0.88 (4-Me; d, 7.1), 0.87 (5-Н; d, 7.1);
Криптофицин 127
Криптофицин 122 (5 мг, 0.0075 ммоля) растворяли в CHCl3 (2 мл) и охлаждали до -40oС в атмосфере N2. Добавляли по каплям триметилсилилхлорид (0,02 мл, 0.157 ммоля) и полученную смесь перемешивали при -40oС в течение 1 часа. Растворитель выпаривали и остаток фильтровали через слой силикагеля с 15% ЕtOН в диэтиловом эфире с получением Криптофицина 127 (4 мг, выход 77%).
[α] D +28.6 (с 1.16, СНСl3); EIMS m/z 653 (0.5; M+-HCl); 411(2); 182/184 (22/26); 153/155 (68/40); 135(31); 107/108/109 (55/22/31); 91/92 (100/30); 79/81 (45/35); HREIMS m/z 653, 2841 (С35Н44 35СlN3O7, Δ 2.6 mmu); 1H NMR (CHCl3) unit A δ 7.3-7.4 (Ph-H5; m), 6.75 (Н-3; ddd, 4.2/10.9/15.0), 5.8 (H-2; dd, 1.5/15.0), 5.2 (H-5; ddd, 1.9/9.9/9.9), 4.65 (H-8; d, 9.6), 4.0 (H-7; brd, 9.6), 2.65 (Н-4; m), 2.48 (Н-6; m), 2.35 (H-4'; ddd, 10.9/11.2/14.5), 1.02 (6-Ме; d, 7.0); unit В δ 7.18 (H-5; d, 2.2), 7.05 (Н-9; dd, 2.2/8.6), 6.85 (H-8; d, 8.6), 6.05 (NH; d, 7.7), 4.65 (H-2; ddd, 4.7/7.7/8.6), 3.86 (OMe; s), 3.15 (Н-3; dd, 4.7/14.6), 2.9 (Н-3'; dd, 8.6/14.6); unit С δ 7.25 (NH; brdd, 4.1/5.7), 3.4 (Н2-3; m), 2.55 (H-2; m), 1.15 (2-Me; d, 7.5); unit D δ 6.2 (NH; d, 8.2), 4.45(H-2; m), 1.65 (H-4; m), 1.55 (H2-3; m), 0.93 (4-Me; d, 6.8), 0.92 (5-Me; d, 6.8); 13C NMR (СDСl3) unit A δ 165.4 (1), 142.4 (3), 138.8 (9), 128.8 (11/13), 128.2 (12), 128.0 (10/14), 124.0 (2), 75.6 (5), 73.9 (7), 62.1 (8), 38.6 (6), 36.4 (4), 8.5 (6-Me); unit В δ 171.1 (1), 154.0 (7), 130.8 (5), 129.8 (4), 128.2 (9), 122.4 (6), 112.4 (8), 56.1 (ОМе), 54.5 (2), 35.4 (3); unit С δ 175.8 (1), 41.1 (3), 38.8 (2), 14.8 (2-Me); unit D δ 173.2 (1), 51.1 (2), 40.9 (3), 25.0 (4), 22.8 (5), 21.8 (4-Мe).
Пример 21. Синтез Криптофицинов 128 и 130-134
Криптофицины 128, 130 и 131
Неочищенную 2:1 смесь 5.7 мг Криптофицинов 117 и 118 растворяли в СНСl3 (0.5 мл) и обрабатывали триметилсилилхлоридом (5 мкл) при -60oС в течение 3 часов.
Разделение с помощью гель-проникающей жидкостной хроматографии с обращенной фазой, полученной смеси хлоргидринов давало Криптофицин 128, Криптофицин 130 и Криптофицин 131. Дальнейшая очистка с помощью гель-проникающей жидкостной хроматографии с нормальной фазой давала чистый Криптофицин 128 (2.1 мг).
Спектральные данные для Криптофицина 128
[α] D +51.4o (СНСl3, с 0.4); IR νmax 3408, 3281, 2958, 1747, 1731, 1668, 1538, 1505, 1258, 1179, 1067, 910, 733 cm-1; EIMS m/z (relative intensity %) 668 (0.3. М+-НСl), 500 (1.2), 445 (4.2), 407 (6), 318 (12), 274 (17), 240 (33), 199 (29), 155 (31), 141 (23), 135 (15), 109 (100); high-resolution EIMS 668.2851 (calcd for C36H45ClN2O8. Δ+1.3 mmu, M+-HCl). 1Н NMR (500 MHz) δ unit A A 7.27 (10-Н/14-Н, d, 8.0), 7.18 (11-Н/13-Н, d, 8.0), 6.69 (3-Н, ddd, 15.2, 9.6, 5.4), 5.79 (2-H, dd, 15.2, 0.8), 5.10 (5-Н, ddd, 11.0, 8.4, 1.7), 4.63 (8-Н, d, 9.6), 3.99 (7-Н, bd, 9.6), 2.67 (4-Н, bdd, 5.4, -14.2), 2.49 (6-Н, dqd, 7.6, 7.6, 1.7), 2.36 (4-Н', td, 10.7, -14.2), 2.35 (12-Me, s), 1.04 (6-СН3, d, 7.1); unit В 7.23 (5-Н, d, 2.1). 7.09 (9-Н, dd, 8.5, 2.1), 6.84 (8-Н, d, 8.5), 5.83 (NH, d, 8.6), 4.80 (2-H, ddd, 8.2, 7.5, 5.7), 3.87 (ОМе, s), 3.16 (3-Н; dd, 5.6. -14.4), 3.00 (3-Н', dd, 7.5, -14.4); unit С 6.94 (NH, bt, 5.8), 3.53 (3-Н, ddd, 5.4, 4.1, -13.5), 3.24 (3-Н', ddd, 6.9, 6.6, -13.5), 2.74 (2-H, m), 1.22 (2-Me; d, 7.3); unit D 4.92 (2-H, dd, 9.9, 3.2), 1.75 (3-Н/4-Н; m), 1.47 (3-Н', m), 0.94 (5-H, d, 6.4), 0.92 (4-Мe-H, d, 6.4). 13С NMR (125 MHz) δ unit A 165.6 (1), 141.6 (3), 139.2 (12), 135.3 (9), 129.7 (10/14), 127.9 (11/13), 125.2 (2), 76.4 (5), 74.0 (7), 62.0 (8), 38.4 (6), 36.3 (4), 21.1 (12-Me), 8.6 (6-Ме): unit В 171.1 (1), 153.9 (7), 131.0 (5), 130.0 (4), 128.4 (9), 122.4 (6), 112.2 (8), 56.1 (ОМе), 53.6 (2), 35.0 (3); unit С 175.3 (1), 41.3 (3), 38.3 (2), 14.0 (2-Me); unit D 170.6 (1), 71.3 (2), 39.7 (3), 24.7 (4), 23.1 (5), 21.5 (4-Ме).
Спектральные данные для Криптофицина 130
1Н-ЯМР (300 МГц) δ unit A 7.27 (10-H/14-H, d, 7.8), 7.16 (11-Н/13-Н, d, 7.8), 6.69 (3-H, ddd, 15.1, 9.6, 5.2), 5.75 (2-Н, d, 15.1), 5.40 (5-Н, ddd, 10.6, 3.0, 1.8), 5.05 (8-Н, d, 5.9), 3.74 (7-Н, ddd, 10.5, 5.4, 5.2), 2.59 (4-Н, m), 2.55 (6-Н, m), 2.37 (4-Н', m), 2.33 (12-Me, s), 1.06 (6-СН3, d, 6.9); unit В 7.21 (5-Н, bs), 7.07 (9-H, bd, 8.4), 6.83 (8-H, d, 8.4), 5.77 (NH, d, 6.6), 4.80 (2-H, m), 3.87 (ОМе, s), 3.12 (3-H; dd, 5.6, -14.4). 3.02 (3-H', dd, 7.2, -14.4); unit С 7.00 (NH, bt, 6.5), 3.47 (3-H, ddd, 4.3, 4.0, -13.3), 3.24 (3-H', ddd, 6.7, 6.6, -13.3), 2.72 (2-H, m), 1.23 (2-Me; d, 7.3); unit D 4.80 (2-H, m), 1.70 (3-Н/4-Н; m), 1.42 (3-H', ddd, 7.9, 4.7, -13.0), 0.91 (5-Н, d, 6.4), 0.86 (4-Me-H, d, 6.4). 13C NMR (125 MHz) unit A 165.5 (1), 142.1 (3), 138.8 (12), 135.2 (9), 129.5 (10/14), 127.5 (11/13), 124.8 (2), 77.8 (5), 74.2 (7), 67.2 (8), 39.4 (6), 34.6 (4), 21.1 (12-Me), 12.3 (6-Ме); unit В 171.0 (1), 153.9 (7), 131.0 (5), 129.5 (4), 128.4 (9), 112.2 (8), 56.1 (ОМe), 53.6 (2), 35.0 (3)' unit C 175.6 (1), 41.1 (3), 38.3 (2), 14.1 (2-Me); unit D 170.3 (1), 71.5 (2), 39.5 (3), 24.6 (4), 22.7 (5), 21.6 (4-Мe).
Спектральные данные для Криптофицина 131
1H-ЯMP (300 МГц) δ unit A 7.18 (10-Н/11-Н/13-Н/14-Н, s), 6.64 (3-H, ddd, 15.2, 9.8, 5.4), 5.70 (2-H, d, 15.2), 5.06 (5-Н, bt, 9.1), 4.86 (8-H, d, 9.7), 4.06 (7-Н, bd, 9.7), 2.54 (4-Н, bdd, 5.2, -14.2), 2.37 (12-Me, s), 2.13 (4-Н', m), 1.85 (6-Н, m), 0.97 (6-СН3, d, 6.6); unit В 7.21 (5-H, d, 2.1), 7.07 (9-H, dd, 8.4, 2.1), 6.83 (8-H, d, 8.4), 5.66 (NH, d, 10.0), 4.79 (2-H, bq, 7,7), 3.87 (OMe, s), 3.14 (3-H; dd, 5.6, -14.4), 3.02 (3-H', dd, 7.2. -14.4); unit С 6.93 (NH, bt, 6.2), 3.51 (3-H, ddd, 5.0, 4.2. -13.5), 3.27 (3-H', ddd, 6.7, 6.4, -13.5), 2.73 (2-H, m), 1.23 (2-Me; d, 7.3); unit D 4.86 (2-H, dd, 9.7, 3.4), 1.75 (3-Н/4-Н; m), 1.46 (3-H', m), 0.94 (5-Н, d, 6.0), 0.93 (4-Ме-Н, d, 6.4).
Криптофицин 132, 133 и 134
Смесь Криптофицина 124 и изомера Z (134 мг, 0.199 ммолей) растворяли в дихлорметане (6 мл) и позволяли взаимодействовать с м-хлорпербензойной кислотой (103 мг, 0.598 ммолей) при комнатной температуре в течение 36 часов. Добавляли фосфатный буфер (10 мл, рН 8) для удаления хлорбензойной кислоты, образующейся в процессе реакции. Через 30 минут водный слой заменяли диметилсульфоксидом (50 мкл) и свежим образцом фосфатного буфера (10 мл). Перемешивание продолжали в течение 30 минут. Органический слой отделяли, растворитель упаривали и остаток очищали с помощью жидкостной гель-проникающей хроматографии с обращенной фазой (Econosil ODS силикагель, 22•250 мм, 35% смесь вода/СН3СN, при 6 мл/мин) с получением Криптофицина 134 (tR 52.5 мин, 9 мг, выход 6%), частично чистого Криптофицина 133 (tR 61 мин, 32 мг, выход 22%) и неочищенного Криптофицина 132 (tR 67.5 мин, 72 мг). Дальнейшая очистка с помощью жидкостной гель-проникающей хроматографии с нормальной фазой (Econosil силикагель, 10•250 мм, 56% ЕtOАс/гексан, 3 мл/мин) давала чистый Криптофицин 132 (65 мг, выход 45%).
Спектральные данные для Криптофицина 132
[α] D +60.1o (СНСl3, с=1.1); EIMS m/z (relative intensity %) 688 (1.6, M+-НСl), 412 (10), 261 (11), 195 (57), 184 (28), 165 (28), 155 (92), 135 (85); high-resolution EIMS m/z 688.23563 (calcd for C35H42Cl2N2O8, Δ -3.8 mmu, M+-HCl). 1H NMR (500 MHz) δ unit A 7.33 (10-H/11-H/13-H/14-H, s), 6.67 (3-H, ddd, 15.2, 9.9, 5.1), 5.79 (2-H, dd, 15.2, 1.1), 5.10 (5-Н, ddd, 11.1, 8.1, 1.5), 4.63 (8-Н, d, 9.5), 3.98 (7-Н, bd, 9.3), 2.62 (4-Н, bdd, 5.1, -14.2), 2.47 (6-Н, dqd, 7.4, 7.4, 1.5), 2.40 (4-Н', td, 10.8, -14.2), 2.35 (12-Ме, s), 1.02 (6-СН3, d, 7.0); unit В 7.21 (5-H, d, 2.1), 7.06 (9-Н, dd, 8.4, 2.1), 6.82 (8-Н, d, 8.4), 6.04 (NH, d, 8.5), 4.74 (2-H, td, 8.0, 5.4), 3.85 (OMe, s), 3.13 (3-H; dd, 5.3, -14.4), 2.95 (3-H', dd, 7.8, -14.4); unit С 7.00 (NH, bt, 5.9), 3.48 (3-H, ddd, 5.0. 3.9, -13.4), 3.23 (3-H', ddd, 6.6, 6.3, -13.4), 2.71 (2-H, m), 1.21 (2-Me; d, 7.2); unit D 4.91 (2-H, dd, 9.7, 3.4), 1.75 (3-Н/4-Н; m), 1.45 (3-Н', m), 0.92 (5-H, d, 6.6), 0.91 (4-Me-H, d, 6.6). 13C NMR (125 MHz) δ unit A 165.7 (1), 141.6 (3), 137.3 (12), 134.8 (9), 129.4 (11/13), 129.0 (10/14), 125.2 (2), 76.4 (5), 74.0 (7), 61.4 (8), 38.4 (6), 36.2 (4), 8.7 (6-Me); unit В 171.1 (1), 153.9 (7), 131.0 (5), 130.1 (4), 128.4 (9), 122.3 (6), 112.2 (8), 56.1 (ОМe), 53.8 (2), 34.9 (3); unit C 175.3 (1), 41.0 (3), 38.1 (2), 14.1 (2-Me); unit D 170.6 (1), 71.3 (2), 39.7 (3), 24.7 (4), 23.1 (5), 21.5 (4-Ме).
Спектральные данные для Криптофицина 134
1H-ЯМР спектр является подобным спектру Криптофицина 27, за исключением того, что два мультиплета при 7.31 (10/14) и 7.36-7.40 (11/12/13) для фенильных протонов заменялись на два дублета при 7.26 (10/14) и 7.36 (11/13) для п-хлорфенильных протонов.
Пример 22. Отношения структура-активность (SAR) и оценка in vivo
Цитотоксичности Криптофицинов 1, 3 и 8 и новых криптофицинов по отношению к человеческим линиям KB и LoVo опухолевых клеток показывают в таблице 6. Криптофицин 51 и Криптофицин 3 проявляют сравнимые цитотоксичности (IC50 3.5-5.8 нМ). Криптофицин 52 (IC50 43-70 пкМ), однако обладает слегка меньшей цитотоксичностью, чем Криптофицин 1 (IC50 9-29 пкМ), и Криптофицин 55 (IC50 33-47 пкМ), обладает слегка меньшей цитотоксичностью, чем Криптофицин 8 (IC50 9-19 пкМ). Цитотоксичность IC50 для Криптофицинов 117, 122, 125, 127, 128 и 132 является сравнимой с цитотоксичностью для Криптофицинов 1, 8, 52 и 55; однако данные не позволяют в настоящий момент провести более полные сравнения.
Криптофицин 52 является активным in vivo, но требует, грубо, применения три раза по полной дозе, по сравнению с Криптофицином 1. Активность in vivo Криптофицина 52 против пяти твердых опухолей мышиного происхождения и трех человеческих твердых опухолей суммируется в таблице 7. Аналогично Криптофицин 55 был активен in vivo, но требовал также применения трех полных дозировок, по сравнению с Криптофицином 8. Активность in vivo Криптофицина 55 против шести твердых опухолей мышиного происхождения и четырех человеческих твердых опухолей суммируется в таблице 8. Данные in vivo оказывается коррелируют с данными in vitro.
Криптофицины 117, 125, 128 и 132 являются активными in vivo против панкреатической аденокарциномы мышиного происхождения (Panc 03). Криптофицины 117 и 128 оказывается являются более сильными, так что они требуют меньших общих доз, чем Криптофицины 1 и 8, соответственно, тогда как Криптофицины 125 и 132 являются менее сильными, так что они требуют более высоких общих доз, чем Криптофицины 1 и 8, соответственно. Данные суммируются в таблице 9.
Величины Т/С, которые составляют меньше чем 42%, считаются активными согласно NCl стандартам; считается, что величины Т/С, которые составляют меньше, чем 10%, имеют превосходную активность и потенциальную клиническую активность согласно NCl стандартам. Суммарную величину Log уничтожения определяют в виде Т-С/3.2 Td, где Т представляет среднее время в сутках для опухолей обработанной группы для достижения опухоли в 750 мг, С представляет среднее время в сутках для опухолей контрольной группы для достижения опухоли в 750 мг, и Td представляет время удвоения объема опухоли. T.H. Corbett et. al. , Cytotocxic Anticancer Drugs: Model and Conceptd for Drug Discovery and Development, pp. 35-87; Kluwer: Norwell, 1992). Суммарные величины Log уничтожения выше 2.8, 2.0-2.8, 1.3-1.9, 0.7-1.2 и ниже 0.7 с продолжительностью обработки лекарством 5-20 суток считают ++++, +++, ++, + и - (неактивный), соответственно. Характеристика активности от +++ до ++++, которая является указанием на клиническую активность, является необходимой для частичного влияния или полной регрессии масс с 100-300 мг размером большинства трансплантированных твердых опухолей мыши. Криптофицин 52 показывает величины Т/С, находящиеся в области от 0 до 14% для мышиных опухолей и от 4.1 до 16 для человеческих опухолей и суммарные величины Log уничтожения от 1.1 до 2 для мышиных опухолей и от 0 до 3.2 для человеческих опухолей. Криптофицин 1 показывает величины Т/С, находящиеся в области от 0 до 27% и величины Log уничтожения в области меньше 1 до 2. Криптофицин 55 показывает величины Т/С, находящиеся в области от больше чем 0 до 4.4% и величины Log уничтожения в области от 2.1 до больше 4.6 (кривые) для всех, но одного из трех. Colon 26 эксперимента, который показывает суммарную величину Log уничтожения 1.2. Криптофицин 8 показывает величины Т/С, больше чем 0 и величины Log уничтожения больше 2.8 (некоторые кривые), как показано в таблице 10. Оказывается что Криптофицины 117 и 125 имеют величины Т/С и суммарные величины Log уничтожения, которые сравнимы с этими величина для других криптофицинов эпоксидного типа, а именно Криптофицинов 1 и 52, тогда как Криптофицины 128 и 132 имеют величины Т/С и суммарные величины Log уничтожения, которые являются сравнимыми с этими величинами для других криптофицинов хлорфицинового типа, а именно Криптофицинов 8 и 55.
Все публикации и патентные заявки, перечисленные в этом описании, но не индивидуально и конкретно введенные здесь ссылкой, вводятся здесь ссылкой, как если бы они были указаны как конкретно и индивидуально введенными ссылкой.
Хотя вышеприведенное изобретение было описано в некоторых деталях с помощью иллюстрации и примера с целью разъяснения и понимания, для специалиста в этой области будет очевидно в свете описания этого изобретения, что некоторые изменения и модификации могут быть проведены в нем без отклонения от сути и объема заявляемого в формуле изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ТАКСАНА | 1992 |
|
RU2128654C1 |
| 10-ДЕЗАЦЕТОКСИТАКСОЛ ИЛИ ЕГО ПРОИЗВОДНЫЕ | 1992 |
|
RU2114836C1 |
| ПРОИЗВОДНЫЕ ТАКСАНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ | 1994 |
|
RU2137764C1 |
| ЦИКЛОПЕПТОЛИД, ШТАММ ГРИБА, СПОСОБ ПОЛУЧЕНИЯ ЦИКЛОПЕПТОЛИДА, ТЕРАПЕВТИЧЕСКИЙ СОСТАВ | 1995 |
|
RU2155772C2 |
| ЗАМЕЩЕННЫЕ БЕНЗ/А/АКРИДИНЫ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ТЕРАПЕВТИЧЕСКИЙ СПОСОБ ИНГИБИРОВАНИЯ РОСТА РАКОВЫХ КЛЕТОК | 1997 |
|
RU2174116C2 |
| ПИРИМИДО[5,4-b]ИНДОЛИЗИНОВОЕ ИЛИ ПИРИМИДО[5,4-b]ПИРРОЛИЗИНОВОЕ СОЕДИНЕНИЕ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ | 2017 |
|
RU2721774C1 |
| СПОСОБЫ ФОРМИРОВАНИЯ ГЛИКОЗИДНЫХ СВЯЗЕЙ, ХИМИЧЕСКАЯ КОМПОЗИЦИЯ, ГЛИКОЗИД И ГЛИКОЗИДНАЯ БИБЛИОТЕКА | 1994 |
|
RU2134693C1 |
| АЛКОГОЛЯТЫ МЕТАЛЛОВ | 1994 |
|
RU2098413C1 |
| МОЛЕКУЛЫ С ПЕСТИЦИДНОЙ ФУНКЦИЕЙ И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ, КОМПОЗИЦИИ И СПОСОБЫ, СВЯЗАННЫЕ С НИМИ | 2016 |
|
RU2735602C2 |
| СОЕДИНЕНИЯ СУЛЬФОНАМИДА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ STAT5 | 2015 |
|
RU2707094C2 |
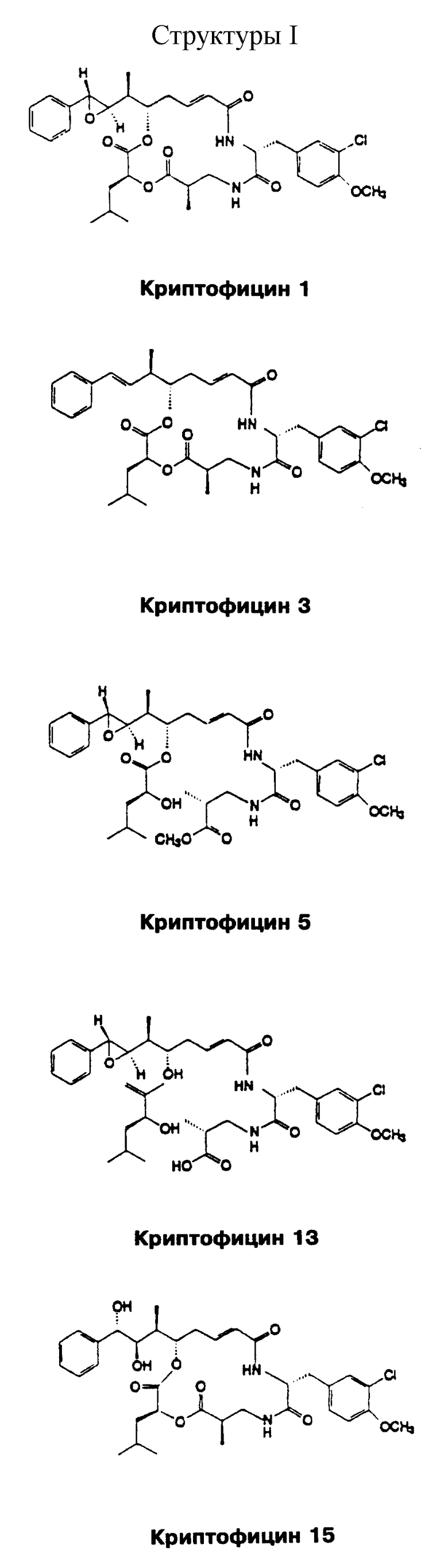

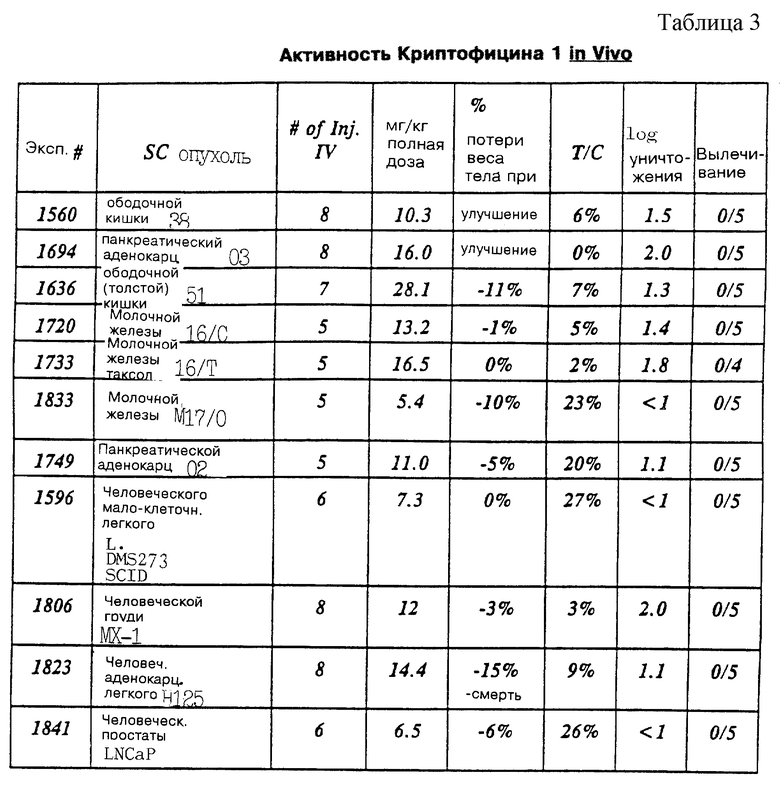
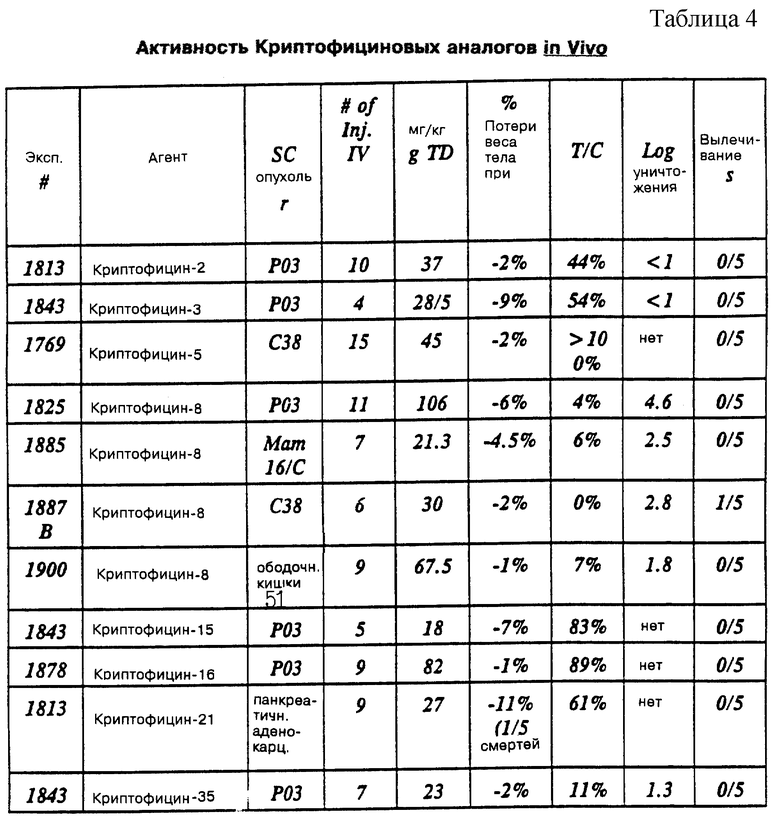
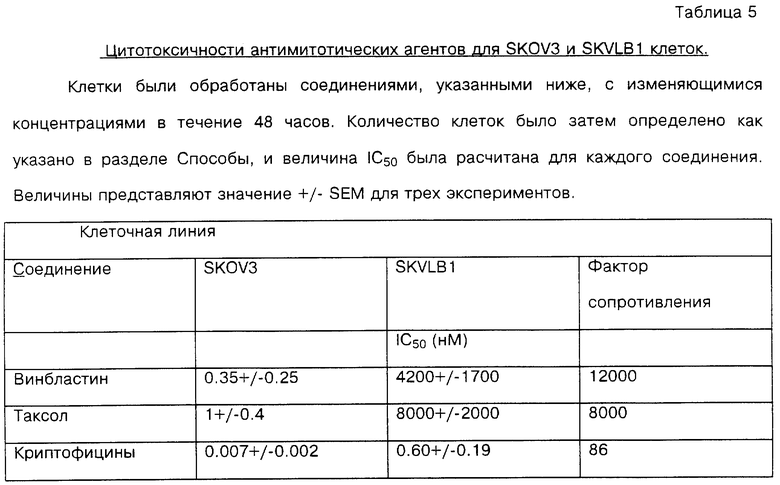

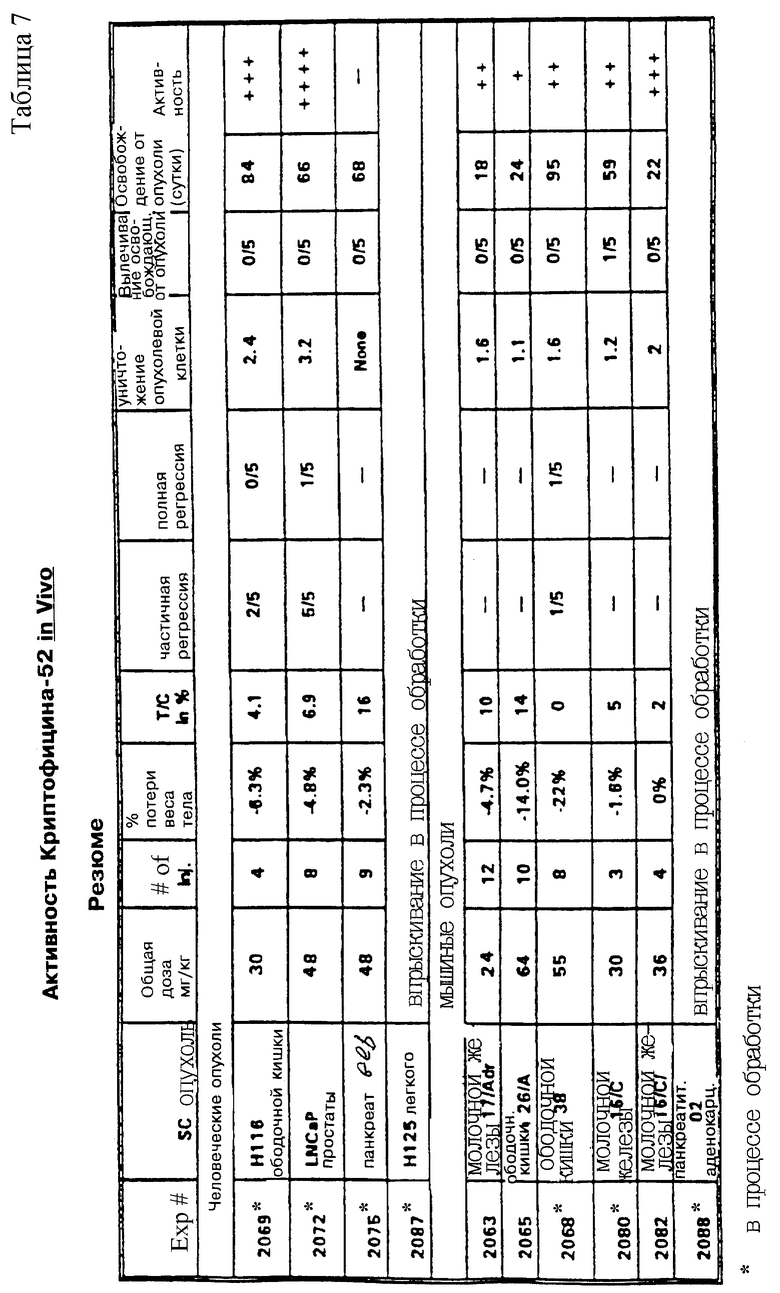
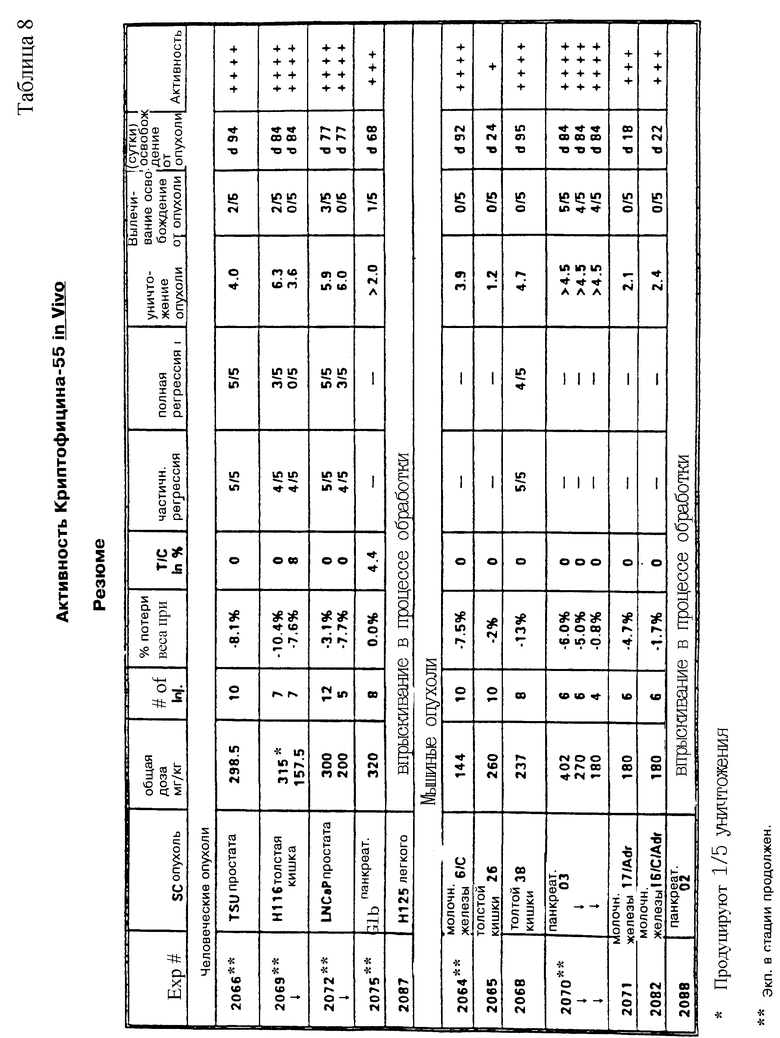
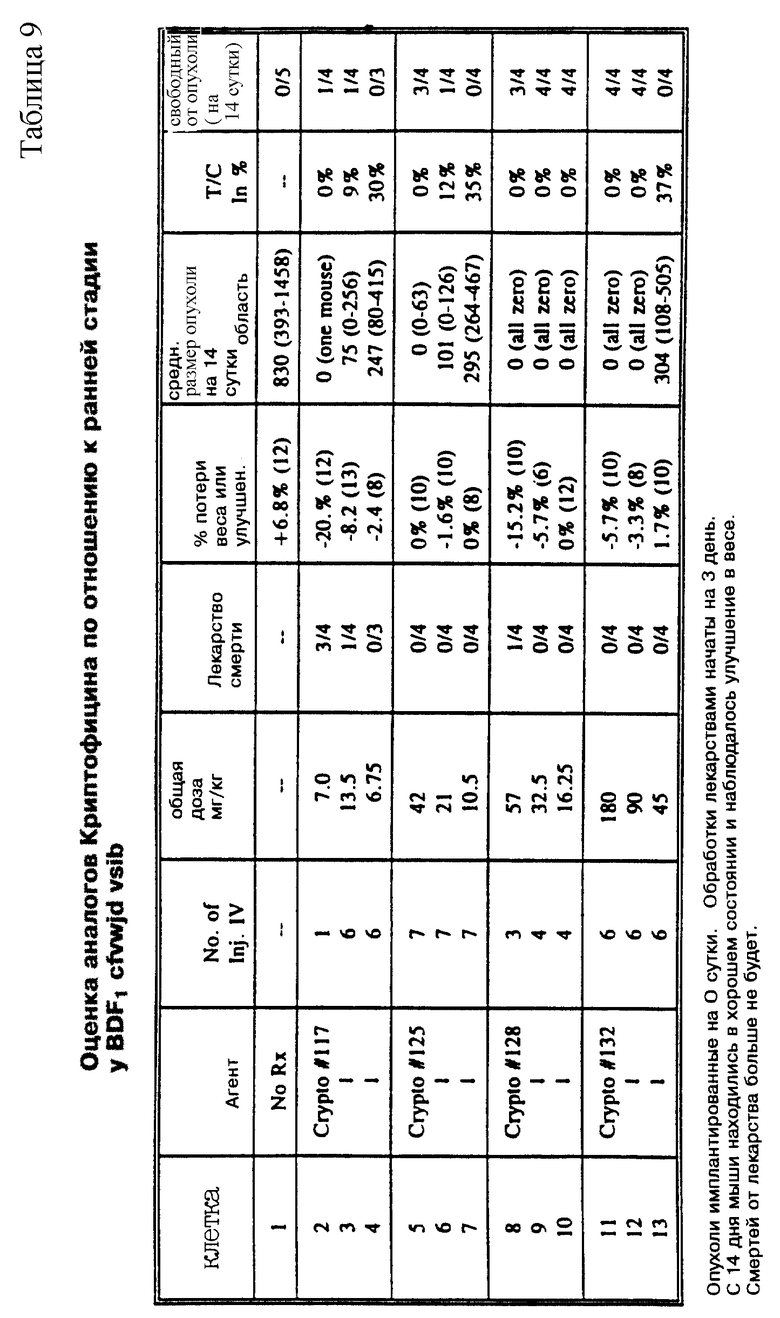


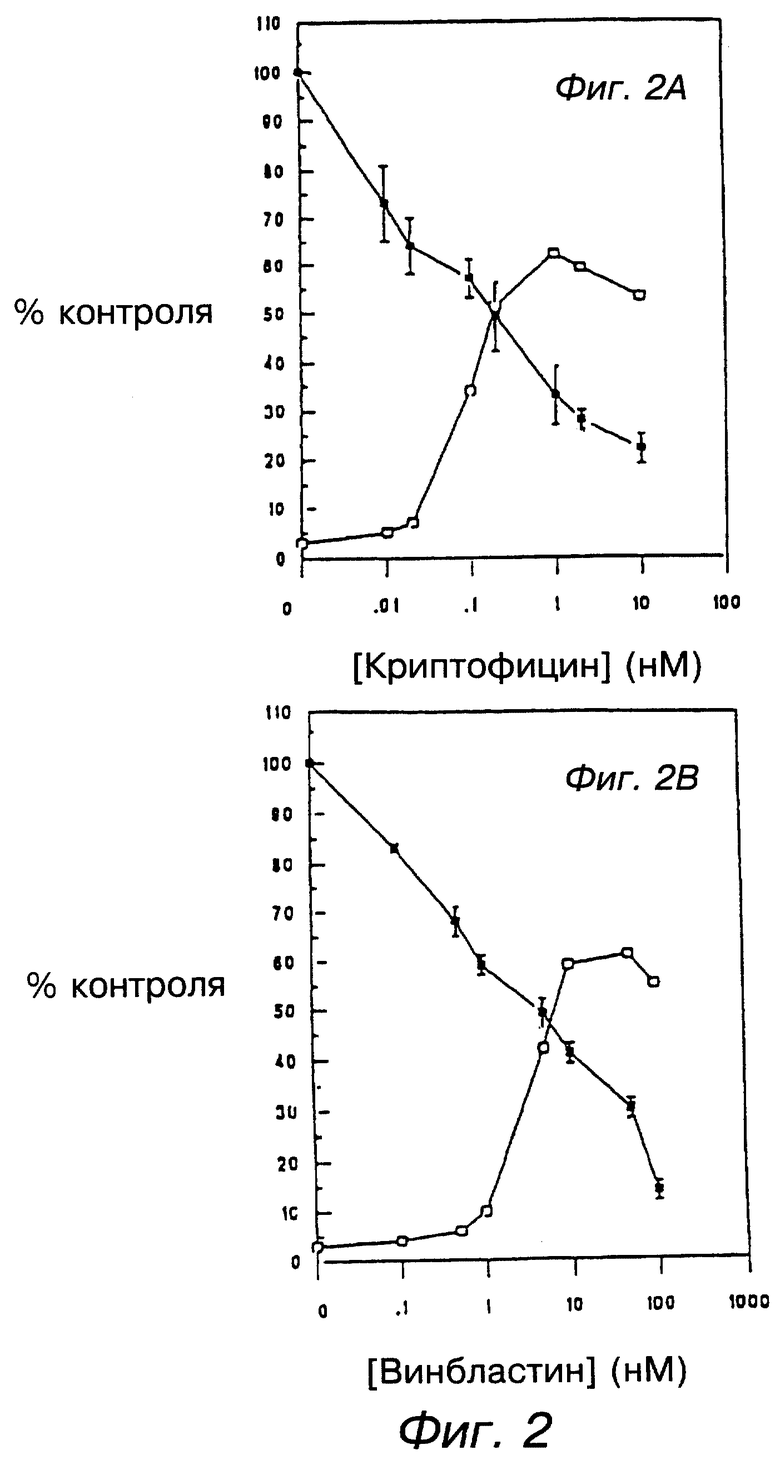
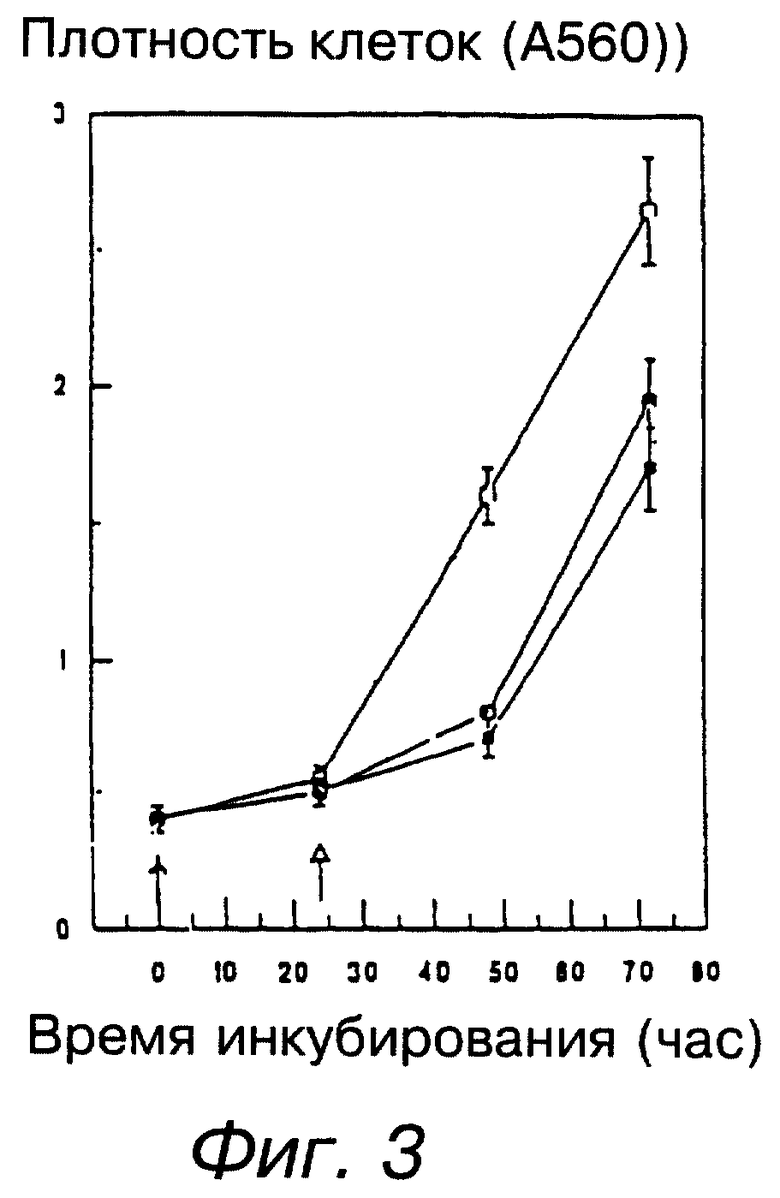
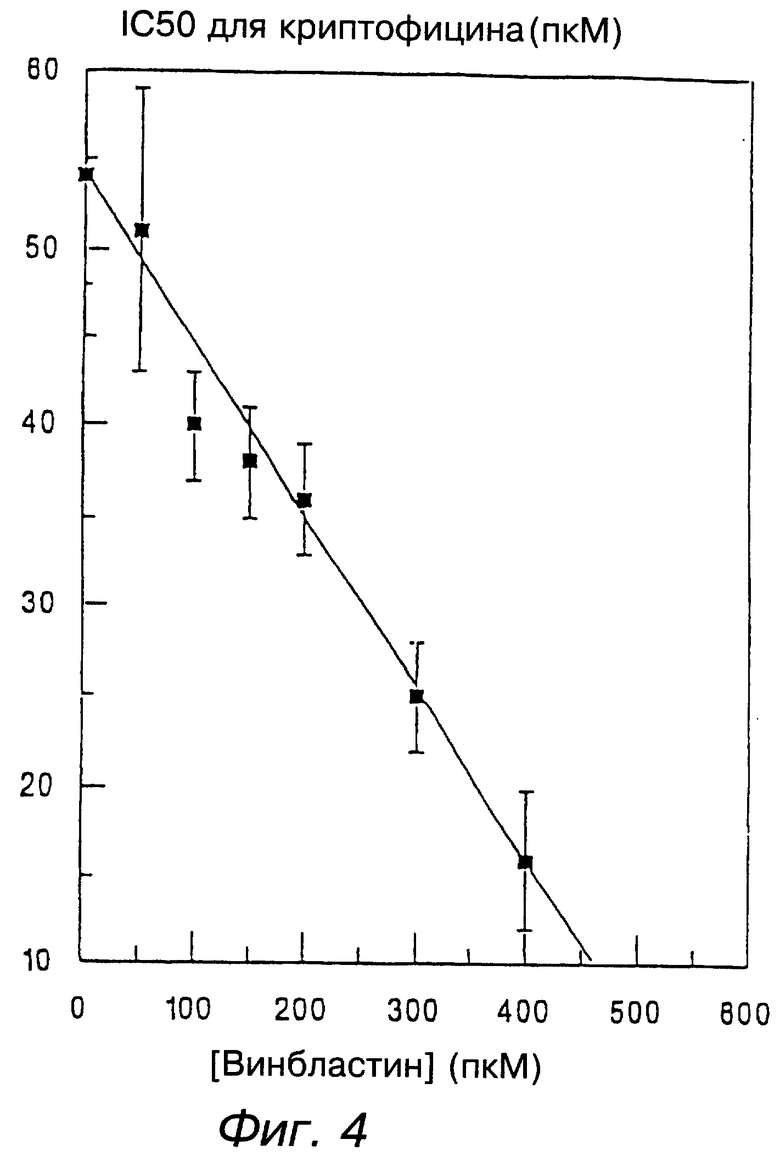
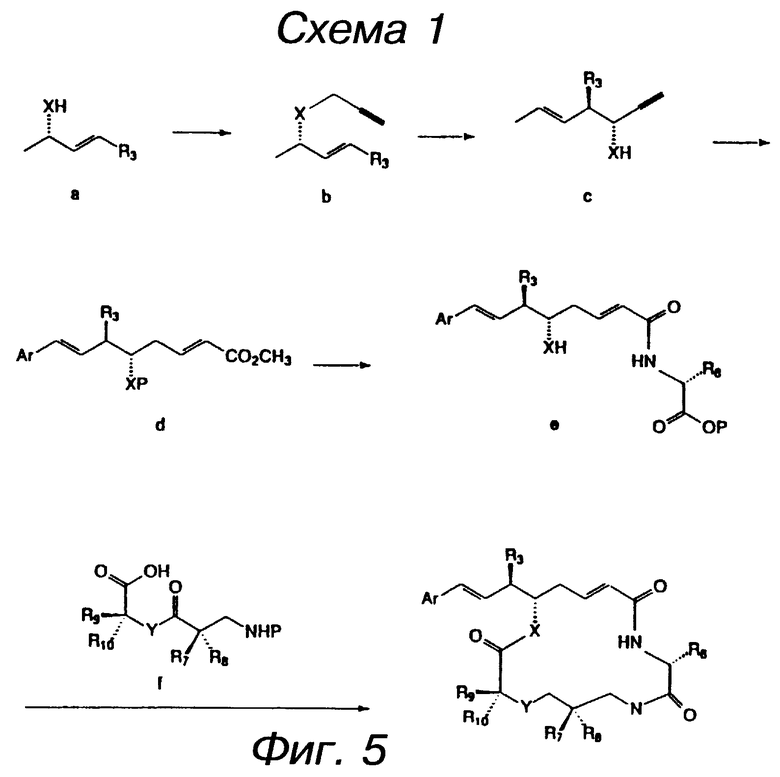
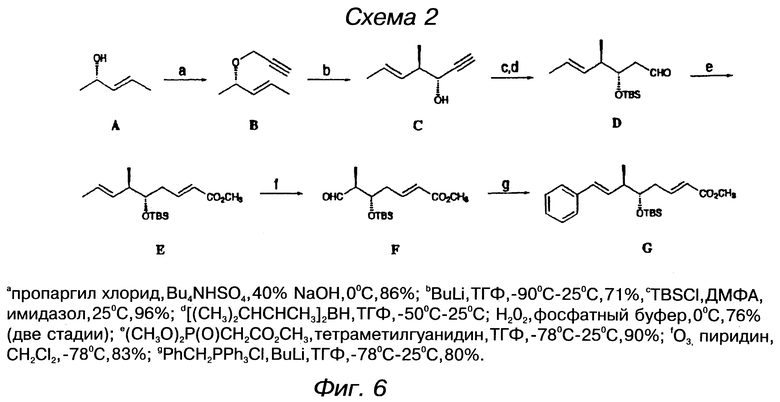
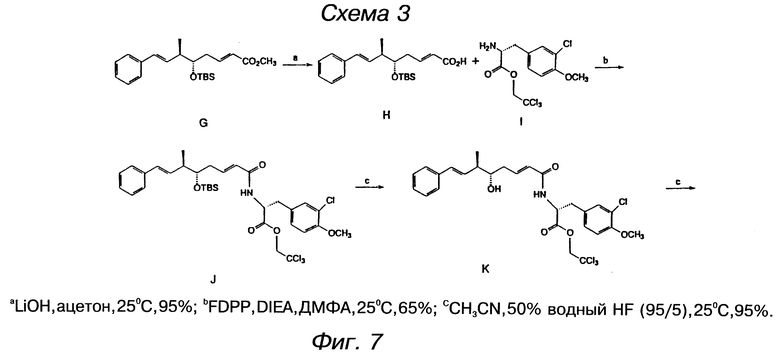

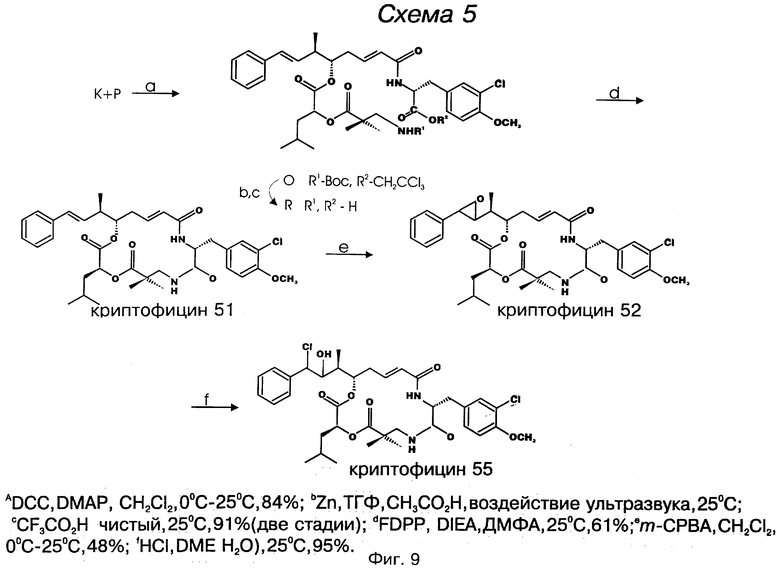
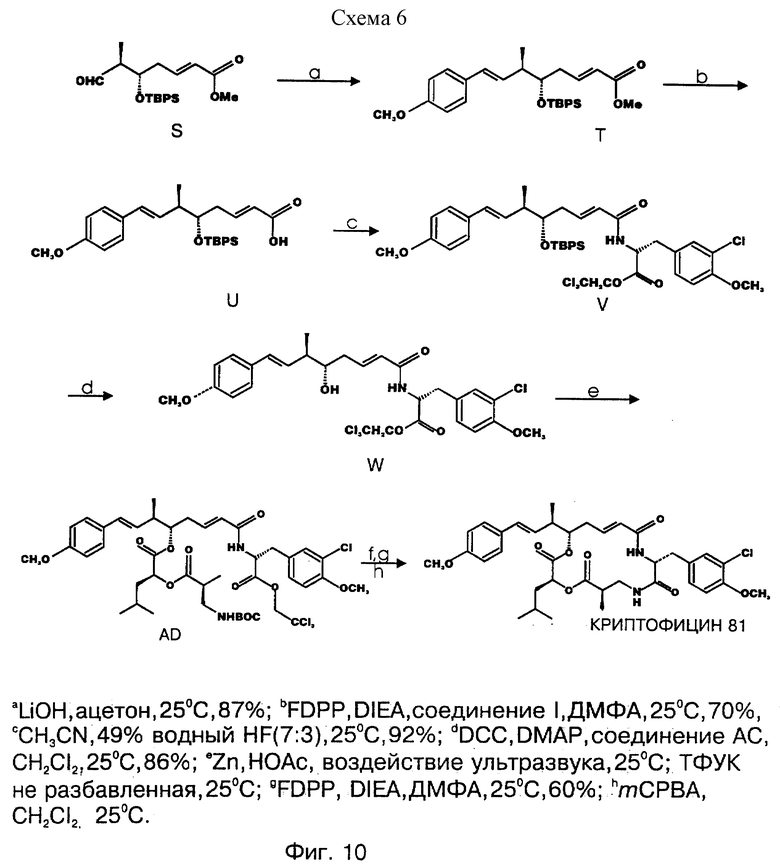
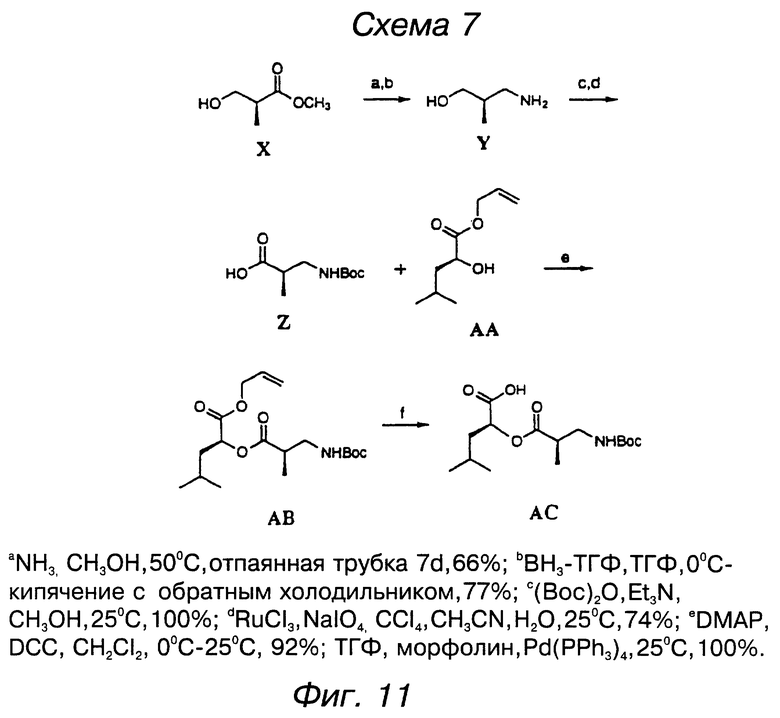
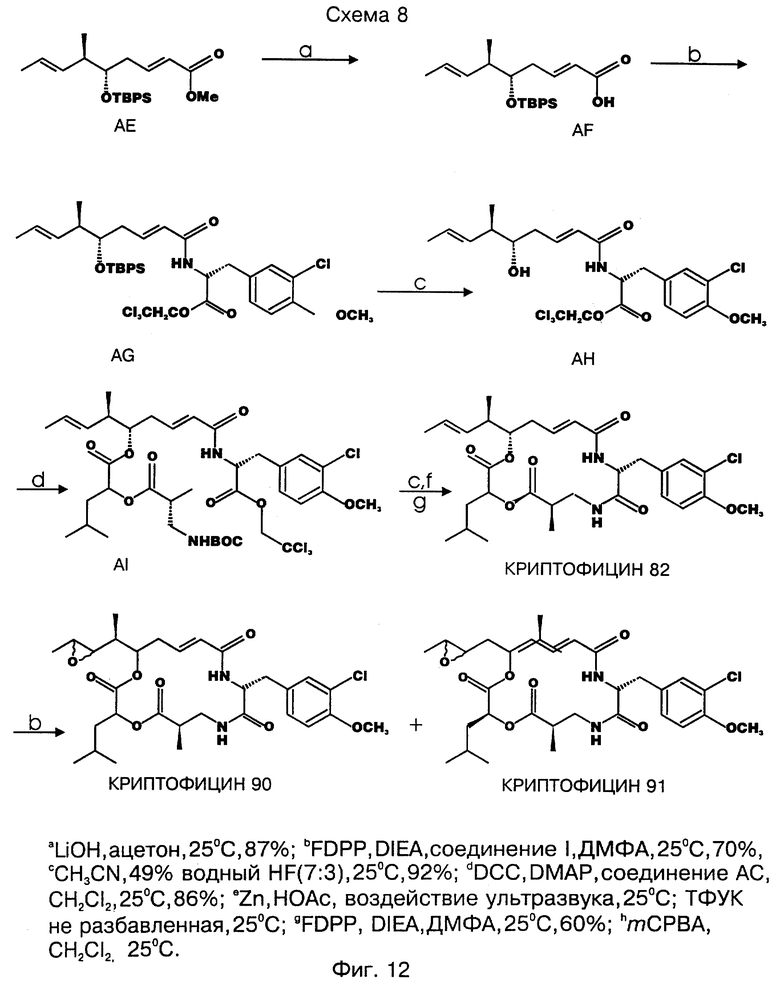
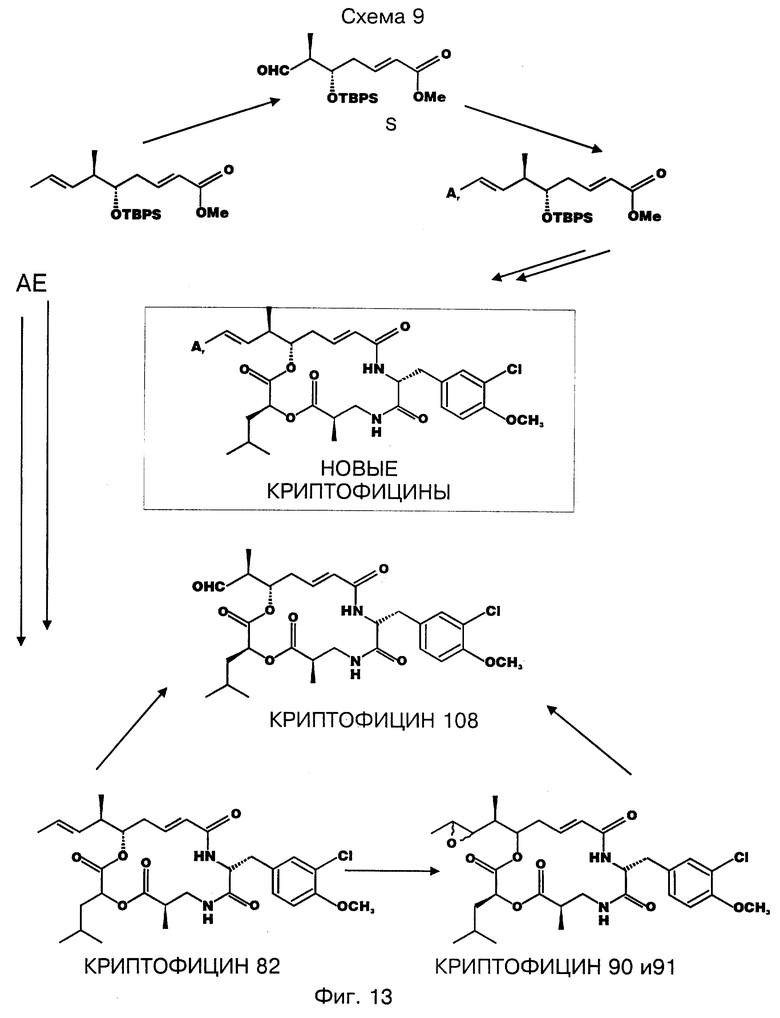
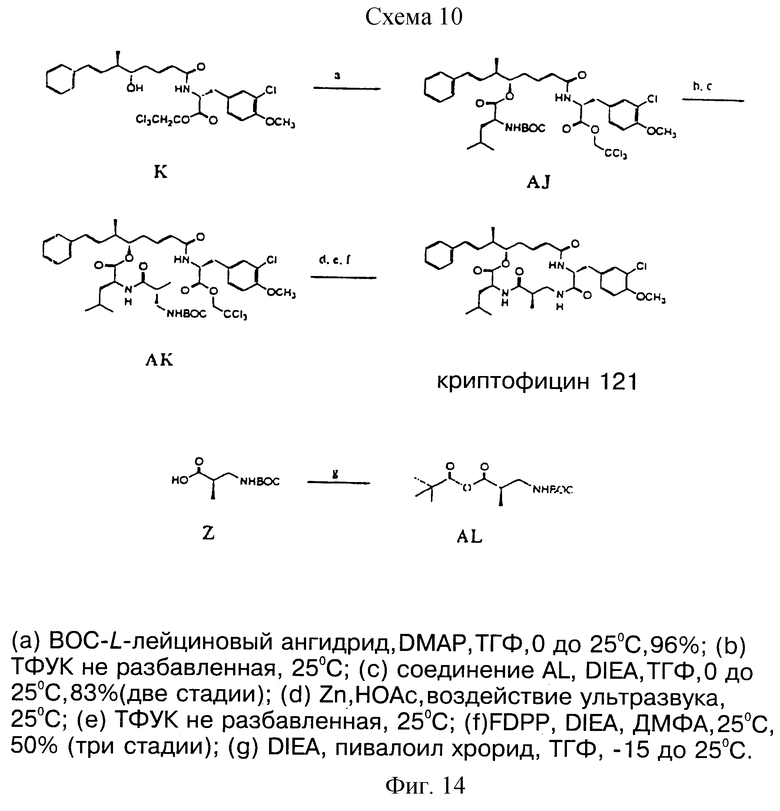
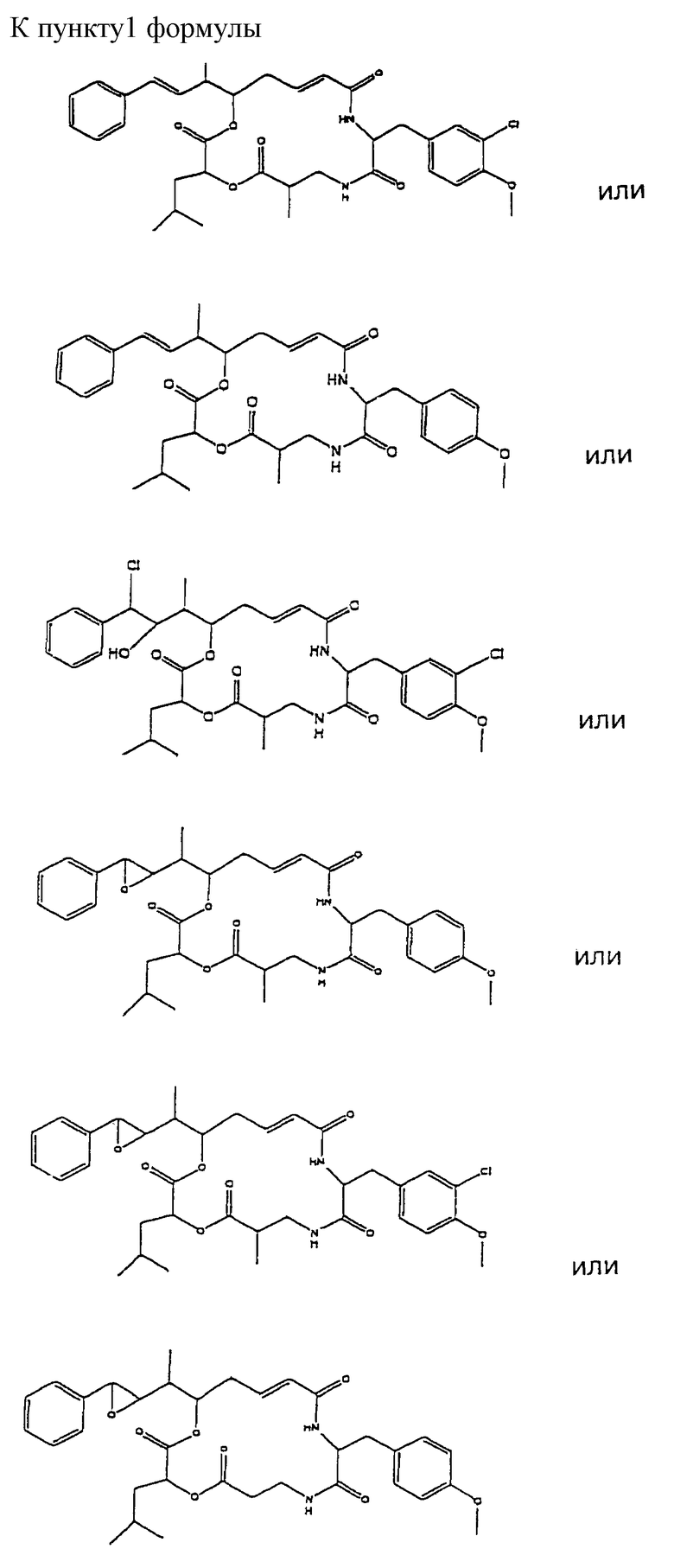
Изобретение относится к новому криптофициновому соединению формулы 1, в которой Аr представляет метил, или фенил, или любую простую незамещенную, или замещенную ароматическую, или гетероароматическую группу; R1 представляет галоген; R2 представляет ОН или R1 и R2 могут объединяться вместе с образованием эпоксидного кольца, азиридинового кольца; R1 и R2 могут объединяться вместе с образованием двойной связи между C18 и С19; R3 представляет низшую алкильную группу; R4 и R5 представляют Н; или R4 и R5 могут объединяться вместе с образованием двойной связи между С13 и С14; R6 представляет бензильную, гидроксибензильную (оксибензильную), алкоксибензильную, галоидоксибензильную, дигалоидоксибензильную, галоидалкоксибензильную или дигалоидалкоксибензильную группу; R7, R8, R9 и R10 каждый независимо представляют Н или низшую алкильную группу; и Х и Y каждый независимо представляют О, NH. Соединения могут быть использованы для ингибирования пролиферации клеток млекопитающего и для лечения опухоли. Описаны также фармацевтическая композиция на основе соединений и способы использования. 5 с. и 51 з.п.ф-лы, 10 табл., 14 ил.
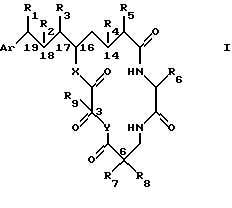
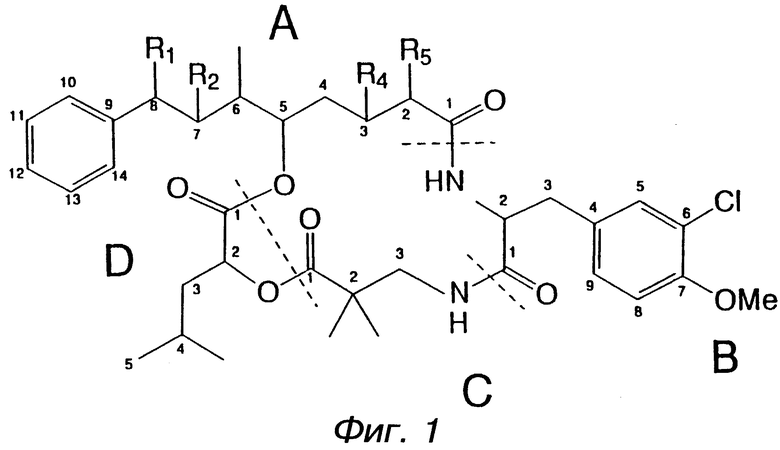
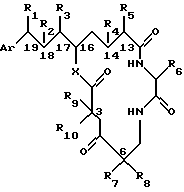
где Аr представляет метил, или фенил, или любую простую незамещенную или замещенную ароматическую или гетероароматическую группу;
R1 представляет галоген;
R2 представляет ОН или
R1 и R2 могут объединяться вместе с образованием эпоксидного кольца, азиридинового кольца;
R1 и R2 могут объединяться вместе с образованием двойной связи между C18 и C19;
R3 представляет низшую алкильную группу;
R4 и R5 представляют Н; или
R4 и R5 могут объединяться вместе с образованием двойной связи между C13 и С14;
R6 представляет бензильную, гидроксибензильную (оксибензильную), алкоксибензильную, галоидоксибензильную, дигалоидоксибензильную, галоидалкоксибензильную или дигалоидалкоксибензильную группу;
R7, R8, R9 и R10 каждый независимо представляют Н или низшую алкильную группу; и Х и Y каждый независимо представляют О, NH или алкиламино, при условии, что соединение криптофицина не является (см. графическую часть).
| 0 |
|
SU358418A1 | |
| Огнетушитель | 0 |
|
SU91A1 |
| 1,12-Диаза-2,5,8,11,15-пентаоксациклогептадекан и способ его получения | 1990 |
|
SU1726475A1 |
Авторы
Даты
2002-12-27—Публикация
1996-03-07—Подача