Изобретение относится к новым химическим соединениям, а именно к эфирам 2-фурфурилиден-2-цианоуксусной кислоты общей формулы: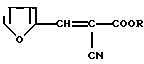 (I)
(I)
где R: СН2СF3 (Iа), СН(СF3)2 (Iб), СН2(CF2)2СF3 (Iв), CH2(CF2)4H (Iг), СН2РhХ (Iд), СН2С(СН3)(Х)2 (Iе), СН2С(С2Н5)(Х)2 (Iи), СН2С(Х)3 (Iк) при Х: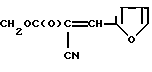
Указанные соединения наиболее эффективно могут быть использованы в качестве ингибиторов для предотвращения преждевременной полимеризации непредельных соединений при их синтезе, переработке и хранении.
Соединения формулы (I) и их свойства в литературе не описаны.
Известны аналогичные соединения α-фурфурилиден-α-цианоацетаты общей формулы: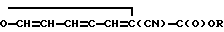
где R: CH2CF2CF2H; СН2СН2OС6Н5; 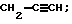 СН(СН3)СС1=ССl2
СН(СН3)СС1=ССl2
Получают их путем конденсации цианацетатов с фурфуролом в присутствии окиси алюминия в качестве катализатора, который добавляют при перемешивании к смеси эквимолекулярных количеств цианацетата и фурфурола. Продукт конденсации экстрагируют хлористым метиленом, фильтруют и упаривают растворитель в вакууме. Описанные соединения могут быть использованы как ингибиторы в радикальной полимеризации непредельных соединений и для их хранения [1. SU, 1273360, С 07 D 307/68, 1986]. На примере метилметакрилата показано, что
α-фурфурилиден- α-цианоацетаты проявляют ингибирующие свойства в течение 24 часов при 80oС, а при добавлении их в количестве 0,01-0,5 маc.% в метил-метакрилат, стирол, этил-2-цианоакрилат и диметиловый эфир 2-метилбутадиен-тион 0-фосфоновой кислоты проявляют ингибирующее действие в течение 6 месяцев при 20oС.
Недостатком данного технического решения является ограниченный 6 месяцами срок хранения непредельных соединений при температуре 20oС. Еще один недостаток - невозможность использования указанных ингибиторов при температуре выше 80oС, т.е. в процессах синтеза и переработки мономеров.
Известным ингибитором радикальной полимеризации является гидрохинон [2. Энциклопедия полимеров, М, СЭ, 1974, т.2, с.205], который широко используют в промышленности для предотвращения спонтанной полимеризации в процессе синтеза и при хранении акрилатов, метакрилатов, акрилонитрила, а также цианоакрилатов [3. SU, 1526200, С 09 J 4/04, 1995] в количестве 0,01 - 0,1 мас.%. Однако гидрохинон является ингибитором только в присутствии растворенного кислорода. При продолжительном хранении мономеров в течение 2-3 месяцев примеси, способные окисляться могут снизить содержание растворенного кислорода, поэтому в процессе хранения в емкости с мономерами необходимо периодически продувать воздух. Кроме того, при температуре выше 25oС ингибирующие свойства гидрохинона падают. Гидрохинон легко окисляется и переходит в п-бензохинон, который не обладает ингибирующими свойствами. Еще один недостаток - трудности, возникающие при очистке мономеров. Перед полимеризацией мономеры освобождают от ингибитора сначала промывкой 2-5%-ным раствором щелочи, затем водой с последующим высушиванием и перегонкой в атмосфере инертного газа. Кроме того, такая очистка неприемлема для цианакрилатов: промывка раствором щелочи и водой исключается из-за мгновенной полимеризации цианакрилатов в присутствии этих веществ. По той же причине исключается контакт цианакрилатов с кислородом воздуха, вследствие этого срок хранения цианакрилатов с гидрохиноном при температуре 5-10oС не более 6 месяцев.
К недостаткам гидрохинона относится также его ограниченная растворимость в других мономерах, например в стироле. Поэтому стирол обычно ингибируют трет-бутилпирокатехином в количестве 0,01-0,1 мас.% [2]. Ингибитор удаляют промывкой разбавленной щелочью, после чего тщательно высушивают и перегоняют в вакууме.
Задачей настоящего изобретения является получение новых соединений 2-фурфурилиден-2-цианоуксусной кислоты и ее эфиров формулы I, обладающих ингибирующими свойствами для предотвращения преждевременной полимеризации непредельных соединений при их синтезе, переработке и хранении.
Поставленная задача осуществляется тем, что соединения формулы (I) получают конденсацией фурфурола с различными цианоацетатами в присутствии основной окиси алюминия в качестве катализатора по следующей схеме: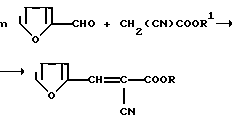
n=l R1:CH2CF3, CH(CF3)2, CH2(CF2)2CF3, CH2(CF2)4H;
n=2 R1:CH2PhY;
n=3 R1:CH2C(CH3)(Y)2, CH2C(C2H5)(Y)2;
n=4 R1:CH2C(Y)3
при Y: CH2OC(O)CH2CN
Для получения соединений Ia, Iб, Iв, Iг берут эквимолекулярные количества соответствующего фторалкилцианоацетата и фурфурола, для получения соединения Iд берут смесь цианоацетата с фурфуролом в соотношении 1:2, для получения Iв, Iи берут смесь цианоацетата с фурфуролом в соотношении 1:3 и для получения соединения Iк берут смесь цианоацетата с фурфуролом в соотношении 1:4. Полученные смеси растворяют в хлористом метилене или ацетоне из расчета 1 л растворителя на 1 моль одного из исходных реагентов. При перемешивании добавляют 2-4 моля основной окиси алюминия и дополнительно перемешивают при комнатной температуре в течение 30-60 минут. Катализатор отфильтровывают, растворитель упаривают в вакууме, получают твердый продукт, который перекристаллизовывают из этилового спирта или из смеси этилового спирта с ацетоном в соотношении 10:1. Получают 42-87,9% кристаллического продукта высокой степени чистоты с постоянной температурой плавления, хорошо растворимого в органических растворителях, стабильного при хранении.
Структура продуктов подтверждается данными элементного анализа и ПМР спектроскопии. ПМР спектры 20%-ных растворов (I) в дейтероацетоне снимали в ИНЭОС РАН на приборе "Брукер WP-200-SY" на частоте 200,13 МГц. В табл. 1 приведены выход, температура плавления, элементный анализ и ПМР спектры новых химических соединений.
Примеры конкретного выполнения заявляемого изобретения.
Пример 1. Синтез 1,1-дигидротрифторэтил-2-фурфурилиден-2-цианоацетата.
Растворяют 3.34 г (0.02 моля) 1,1-дигидротрифторэтилцианацетата в 30 мл хлористого метилена, добавляют при перемешивании 1,92 г (0,02 моля) фурфурола и 3 г основной окиси алюминия. Перемешивают смесь в течение 20-30 минут, фильтруют. К твердому остатку добавляют 50 мл хлористого метилена и экстрагируют продукт реакции, затем фильтруют. Органические фракции объединяют и упаривают растворитель в вакууме. Полученный продукт перекристаллизовывают из 60 мл этанола. Получают 3,87 г кристаллического продукта белого цвета.
Выход и характеристики приведены в табл.1.
Пример 2. Синтез 1-гидрогексафторизопропил-2-фурфурилиден-2-цианоацетата.
Загружают 4,7 г (0,02 моля) 1-гидрогексафторизопропилцианоацетата и 1,92 г (0,02 моля) фурфурола. Синтезируют аналогично примеру 1. Получают 3,25 г кристаллического продукта желтого цвета.
Выход и характеристики приведены в табл.1.
Пример 3. Синтез 1,1-дигидрогептафторбутил-2-фурфурилиден-2-цианоацетата.
Загружают 5,34 г (0,02 моля) 1,1-дигидрогептафторбутилцианоацетата и 1,92 г (0,02 моля) фурфурола. Синтезируют аналогично примеру 1. Получают 5,72 г кристаллического продукта белого цвета.
Выход и характеристики приведены в табл.1.
Пример 4. Синтез 1,1,5-тригидрооктафторамил-2-фурфурилиден-2-цианоацетата.
Загружают 5,98 г (0,02 моля) 1,1,5-тригидрооктафторамилцианоацетата и 1,92 г (0,02 моля) фурфурола. Синтезируют аналогично примеру 1. Получают 6,41 г кристаллического продукта белого цвета.
Выход и характеристики приведены в табл.1.
Пример 5. Синтез 2.2'-дифурфурилиден-2.2'-дицианоацетата пара-ксилендиола.
Загружают 2,7 г (0,01 моля) дицианоацетата пара-ксилендиола и 1,92 г (0,02 моля) фурфурола. Синтезируют аналогично примеру 1. Получают 2,91 г кристаллического продукта белого цвета.
Выход и характеристики приведены в табл.1.
Пример 6. Синтез 2,2',2"-трифурфурилиден-2.2',2"-трицианоацетата триметилолэтана.
Загружают 3,21 г (0,01 моль) трицианоацетата триметилолэтана и 2,88 г (0,03 моля) фурфурола. Синтезируют аналогично примеру 1. Полученный продукт перекристаллизовывают из 10%-ного раствора ацетона в этаноле. Получают 4,8 г кристаллического продукта белого цвета.
Выход и характеристики приведены в табл.1.
Пример 7. Синтез 2,2'2"-трифурфурилиден-2,2',2"-трицианоацетата триметилолпропана.
Загружают 3,25 (0,01 моль) трицианоацетата триметилопропана и 2,88 г (0,03 моля) фурфурола. Синтезируют аналогично примеру 1. Перекристаллизовывают из 10%-ного раствора ацетона в этаноле. Получают 5,0 г кристаллического продукта белого цвета.
Выход и характеристики приведены в табл.1.
Пример 8. Синтез тетрафурфуридентетрацианоацетата пентаэритритола.
Загружают 2,02 г (0,05 моля) тетрацианоацетата пентаэритритола и 1,92 г (0,02 моля) фурфурола. Синтезируют аналогично примеру 1. Перекристаллизовывают из 20%-ного раствора ацетона в этаноле. Получают 1,65 г кристаллического продукта белого цвета.
Выход и характеристики приведены в табл.1.
Пример 9. Определение ингибирующего действия соединений формулы (I) в процессе хранения метилметакрилата.
В свежеперегнанный метилметакрилат добавляют 0,001-0,01 мас.% ингибитора (I) и оставляют на хранение при комнатной температуре (20+5oС). Для сравнения в тех же условиях оставляют на хранение свежеперегнанный метилметакрилат, не содержащий ингибитора, а также содержащий в качестве ингибитора гидрохинон и ингибитор по аналогу [1. SU, 1273360, С 07 D 307/68, 1986] пропаргил-2-фурфуридиден-2-цианоацетат в количестве 0,05 мас.%. Через 12 месяцев определяют содержание полимера, образовавшегося в процессе длительного хранения, путем осаждения избытком этанола из расчета 10 мл этанола на 1 мл смеси мономер-полимер. Осадок отфильтровывают, высушивают до постоянного веса и взвешивают.
Результаты испытаний приведены в табл.2.
Пример 10. Определение ингибирующего действия соединений формулы (I) в процессе термоинициированной радикальной полимеризации мономеров.
В свежеперегнанные метилметакрилат, стирол, диметилвинилэтинил-карбинол и этил-2-цианоакрилат добавляют 0,001-0,01 мас.% ингибитора (I). Ингибированные мономеры выдерживают в одинаковых условиях: в вакуумированных стеклянных ампулах при температуре 100+2oС в течение 24 часов. Для сравнения в тех же условиях выдерживают метилметакрилат без ингибитора, с гидрохиноном (0,05 мас. %) и с ингибитором по аналогу [1. SU, 1273360, С 07 D 307/68, 1986] (пропаргил-2-фурфурилиден-2-цианоацетат 0.05 мас. %), а также стирол с трет-бутил-пирокатехином (0,1 мас. %) и с ингибитором по аналогу [1. SU, 1273360, С 07 D 307/68, 1986] (пропаргил-2-фурфурилиден-2-цианоацетат 0,05 мас. %). Затем ампулы вскрывают, образовавшийся полимер из смеси мономер-полимер осаждают избытком этанола из расчета 10 мл этанола на 1 мл смеси. Осадок отфильтровывают, высушивают до постоянного веса и взвешивают.
Результаты испытаний приведены в табл.2 и 3.
Испытания соединений (I) показывают, что они проявляют ингибирующие свойства при термоинициированной радикальной полимеризации метилметакрилата, стирола, диметилвинилэтинилкарбинола и этил-2-цианоакрилата при температуре 100oС в течение 24 часов и при хранении метилметакрилата при комнатной температуре (20+5oС) в течение 12 месяцев (табл. 2, 3). Во всех случаях в течение всего срока испытаний не наблюдалось образование осадка полимера, в то время как аналогичные испытания, проведенные с ингибитором по аналогу [1], показали образование осадка полимера в значительном количестве: 50-60% метилметакрилата при хранении при комнатной температуре в течение 12 месяцев превратилось в полимер и 80-90% мономеров, подвегнутых термоинициированной радикальной полимеризации при 100oС, также заполимеризовались.
Заявляемые соединения формулы (I) - сильные ингибиторы. При меньшем в 10-50 раз содержании (I) в мономерах по сравнению с прототипом они оказывают более сильное ингибирующее действие и могут быть использованы для подавления преждевременной полимеризации как при хранении мономеров при комнатной температуре, так и в процессе их синтеза и переработки при температуре 100oС.
Кроме того, заявляемые ингибиторы обладают комплексом преимуществ по сравнению с широко применяемым в промышленности гидрохиноном. Они хорошо растворяются во многих мономерах в отличие от гирохинона, который из-за ограниченной растворимости не может, например, применяться для стабилизации стирола. Стирол, ингибированный трет-бутил-пирокатехином, и метилметакрилат, ингибированный гидрохиноном, после проведенных испытаний заполимеризовались практически на все 100%.
При использовании новых ингибиторов при длительном хранении не требуется продувка воздухом емкостей с мономерами. Очистка мономеров от ингибиторов в случае необходимости осуществляется одной перегонкой, исключаются стадии промывки щелочью, водой и последующей сушки. Эти свойства позволяют рекомендовать соединения формулы (I) для ингибирования эфиров 2-цианоакриловой кислоты.
Литература
1. SU, 1273360, C 07 D 307/68, 1986.
2. Энциклопедия полимеров, М, СЭ, 1974, т. 2, с. 205.
3. SU, 1526200, C 09 J 4/04, 1995.
| название | год | авторы | номер документа |
|---|---|---|---|
| @ -Фурфурилиден- @ -цианоацетаты в качестве ингибиторов радикальной полимеризации непредельных соединений при их хранении | 1985 |
|
SU1273360A1 |
| КЛЕЕВАЯ КОМПОЗИЦИЯ | 2001 |
|
RU2193586C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1-АМИНО-4-ВИНИЛБЕНЗОЛА | 2011 |
|
RU2472773C1 |
| БИС-(3-АМИНО-5-ФЕНОКСИ)ФЕНИЛОВЫЙ ЭФИР ГИДРОХИНОНА И ПОЛИИМИДЫ НА ЕГО ОСНОВЕ ДЛЯ ТЕРМОСТОЙКИХ МАТЕРИАЛОВ | 1994 |
|
RU2072350C1 |
| СПОСОБ СВОБОДНОРАДИКАЛЬНОЙ ПОЛИМЕРИЗАЦИИ СТИРОЛА И "СПЯЩИЕ" ИНГИБИТОРЫ ДЛЯ ЭТОГО ПРОЦЕССА | 2004 |
|
RU2277104C1 |
| 4-ТРИМЕТИЛСИЛОКСИМЕТИЛФОСФИНИЛ-2-ТРИМЕТИЛСИЛОКСИ -2- ЦИАНОБУТИРОНИТРИЛ В КАЧЕСТВЕ ПОЛУПРОДУКТА СИНТЕЗА 4-МЕТИЛГИДРОКСИФОСФИНИЛ-2-АМИНОБУТАНОВОЙ КИСЛОТЫ, ОБЛАДАЮЩЕЙ ГЕРБИЦИДНОЙ АКТИВНОСТЬЮ, И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1992 |
|
RU2054430C1 |
| ПОЛИОКСИАМИНОФЕНИЛЕНСУЛЬФИДЫ В КАЧЕСТВЕ ОТВЕРДИТЕЛЯ ЭПОКСИДНЫХ ОЛИГОМЕРОВ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1992 |
|
RU2044003C1 |
| 2-ХЛОР-3-ПОЛИФТОРАЛКОКСИ-[1,4]-НАФТОХИНОНЫ, ПОВЫШАЮЩИЕ ТЕРМОСТОЙКОСТЬ ПОЛИМЕТИЛМЕТАКРИЛАТА | 2021 |
|
RU2772749C1 |
| СОПОЛИМЕР СТИРОЛА И МЕТИЛМЕТАКРИЛАТА С ПОЛИГЕТЕРОАРИЛЕНОМ ДЛЯ ПОЛИМЕРНЫХ МАТЕРИАЛОВ | 2000 |
|
RU2188209C2 |
| СПОСОБ ПОЛУЧЕНИЯ СШИТОГО ГИДРОФИЛЬНОГО ПОЛИМЕРА, ПРОЯВЛЯЮЩЕГО СВОЙСТВА СУПЕРАБСОРБЕНТА | 2011 |
|
RU2467017C1 |
Изобретение относится к новым химическим соединениям, а именно к эфирам 2-фурфурилиден-2-циануксусной кислоты общей формулы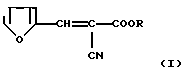
где R: СН2СF3 (Iа), СН(СF3)2 (Iб), CH2(CF2)2CF3 (Iв), CH2(CF2)4H (Iг), CH2PhX (Iд), СН2С(СН3)(Х)2 (Iе), СН2С(С2Н5)(Х)2 (Iи), СН2С(Х)3 (Iк),
при Х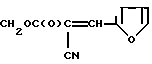
Эти соединения могут быть использованы в качестве ингибиторов для предотвращения преждевременной полимеризации непредельных соединений при их синтезе, переработке и хранении, таких как метилметакрилат, стирол, диметилвинилэтинилкарбинол, этил-2-цианоакрилат и других. Указанные ингибиторы хорошо растворяются во многих мономерах и при их использовании во время длительного хранения не требуют продувки воздухом емкостей с мономерами. Технический результат - высокая ингибирующая активность и упрощение использования данного ингибитора. 3 табл.
2-Фурфурилиден-2-цианоуксусная кислота и ее эфиры общей формулы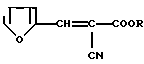
где R: Н (Iа), СН2СF3 (Iб), СН(СF3)2 (Iв), CH2(CF2)2CF3 (Iг), CH2(CF2)4H (Iд), CH2PhX (Ie), СН2С(СН3)(Х)2 (Iи), СН2С(С2Н5)(Х)2 (Iк), СН2С(Х)3 (Iл),
при Х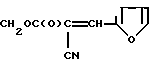
в качестве ингибиторов радикальной полимеризации непредельных соединений.
| B.Heuck, Ber | |||
| Способ повышения реакционной способности (активирования) торфа | 1922 |
|
SU1894A1 |
| RU 95107306 А1, 20.03.1997 | |||
| @ -Фурфурилиден- @ -цианоацетаты в качестве ингибиторов радикальной полимеризации непредельных соединений при их хранении | 1985 |
|
SU1273360A1 |
Авторы
Даты
2003-01-10—Публикация
2001-04-12—Подача