Изобретение относится к области ветеринарной медицины, в частности иммунологии сельскохозяйственных животных и птиц.
В настоящее время иммунитет является актуальной проблемой в ветеринарии. Снижение иммунитета влечет за собой нарушение гомеостаза, организма и вытекающих из него последствий: снижение сохранности молодняка, снижение репродуктивной способности и т.д. Для чего, необходимо определение микробицидных свойств системы крови в частности определения миелопероксидазы в нейтрофильных гранулоцитах. Пероксидазы их простетическая группа представлена гемом. Пероксидаза донор: Н2О2 - оксидоредуктаза, КФ (1.11.1.7) относятся к оксидоредуктазам (1). Пероксидаза катализирует окисление различных веществ с помощью перекиси водорода:
Донор + Н2О2 = Окислительный донор + 2Н2О
Активность миелопероксидазы присуща молодым клеткам. Обычно активность миелопероксидазы высокая в клетках крови у клинически здоровых животных, а у больных - снижена. Так, снижение активности фермента в нейтрофилах обнаружена при инфекционных лейкоцитозах и некоторых метастазирующих опухолях. Определение активности миелопероксидазы в мазках крови относится к тестам II уровня диагностики иммунного статуса организма животных и птиц.
Известен метод (Определения пероксидазы в мазках периферической крови и костного мозга человека [Graham (1966) З. Лойда, Р. Госсрай, Т. Шиблер Гистохимия ферментов. Лабораторные методы. Пер. с англ. к.б.н. И. Б. Бухвалова, к. м. н. О. В. Копьева, под ред. проф. Н.Т. Райхлина, М.: изд. "Мир", 1982, стр. 206]).
Известно изобретение (определение миелопероксидазы в крови [см. Пирс (1962 г.) - Справочник. Медицинские лабораторные технологии. /Под редакцией А. И. Карпищенко, издательство Санкт-Петербурга "Интермедика", 1999. Т. 2 стр. 298] ), включающий подготовку биологического субстрата, обработку его буферно-инкубационной смесью, инкубацию биологического субстрата с последующим высушиванием и микроскопированием.
Недостатками данного метода является затруднительное получение растворения бензидина в органических растворителях и нагревание раствора, что влечет за собой разложение бензидина, а также отсутствие окраски ядер нейтрофилов.
Техническим решением задачи является повышение эффективности иммунологических исследований за счет повышения точности измерений и сокращения времени.
Поставленная задача достигается тем, что в способе цитологического определения активности миелопероксидазы в мазках крови животных, включающий подготовку биологического субстрата, обработку его буферно-инкубационной смесью, инкубацию биологического субстрата с последующим высушиванием и микрокопировалием, готовят 0,1 М трис-НСl буферной смеси, рН 7,2-7,5, далее в темноте готовят две буферно-инкубационные смеси: первую - на основе медного купороса, к 1 г которого добавляют буферную смесь до 100 мл, а для второй смеси используют основной бензидин, 10 мг которого растворяют в 1-1,5 мл 96 об.% этиловом спирте, затем разбавляют 10 мл дистиллированной воды, добавляют 13,5-14 мл буферной смеси и 2-3 капли 1% раствора перекиси водорода, доводят рН смеси до 7,2-7,5 и осуществляют инкубацию мазков крови в темноте - сначала в первой буферно-инкубационной смеси в течение 2 мин с последующим промыванием дистиллированной водой, затем во второй буферно-инкубационной смеси в течение 2 мин, затем вновь промывают дистиллированной водой, высушивают и дополнительно окрашивают мазки крови 0,5% раствором нейтрального красного в течение 0,5-1 мин, далее промывают дистиллированной водой, сушат и по количеству окрашенных гранул в цитоплазме нейтрофилов судят об активности миелопероксидазы. Подготовку биологического субстрата осуществляют, фиксируя мазки крови животных 96 об.% этиловым спиртом в парах 40% формалина.
Новизна заявляемого способа заключается в том, что является наиболее быстрым и точным, т.к. фермент поступает из тканей (жировых), в форменные элементы крови и локализуется в их цитоплазме в виде гранул (лизосом) по сравнению с известным методом определения в экстракте из мяса уже убитых животных, как с научной, так и с экономической стороны, показывает активность изучаемого фермента в нейтрофильных гранулоцитах и возможность оценки цитохимической реакции; в мазке определяются состояние микробицидных систем крови, принимающих участие в формировании неспецифической резистентности организма; определяется активность миелопероксидазы в клетках крови по четырем степеням.
Кроме того, заявляемый способ является более экономичным, т.к. не требует применения особо дорогостоящих химических реактивов. Новизна обусловлена также тем, что осуществляется: подбор сочетания солей, обладающих буферными свойствами с получением определенного рН системы, и не способны ингибировать активность определяемого фермента. Дополнительная окраска ядер клеток в мазках крови 0,5%-водным раствором сафранина или нейтральным красным, позволяющая легко определить нейтрофилы по форме ядер.
Заявляемый способ является экспресс-методом для проведения цитохимического анализа активности миелопероксидазы в нейтрофильных гранулоцитах в мазках крови. Применение методики - бензидиновой реакции основана на окислении бензидина пероксидпероксидной системой до нестабильного бензидинового синего, который самопроизвольно превращается в стабильный бензидиновый коричневый. Т. к. пероксидаза относится к железопорфириновым соединениям добавление в инкубационную смесь медного купороса (Сu5SO4•5Н2O) приводит к замещению свободных ионов железа в геме (ионы железа вытесняют медь из их соединений), и ионы меди проникают внутрь цитоплазмы нейтрофилов, затем, образуя комплекс с бензидином их гранулы становятся стойко окрашенными в сине-коричневый цвет, по которому можно определить активность миелопероксидазы в нейтрофилах. Для активации миелопероксидазы в инкубационную систему вводили буферную смесь, состоящую из трис (гидроксиметил) аминометан - С4Н11NО3 с относительной молекулярной массой М = 121,14 и 0,1 М НС1 рН 7,2-7,5.
Сущность изобретения поясняется чертежом, где представлена микроскопия по степеням активности фермента локализованных в нейтрофилах.
Пример конкретного осуществления способа цитохимического определения активности миелопероксидязы в мазках крови животных
Кровь для исследования брали у животных из яремной вены. У птицы кровь брали из крыловой вены. Из крови делали мазок. Для этого каплю крови наносили на край сухого обезжиренного стекла, которое удерживали между большим и средним пальцами левой руки. Впереди капли под углом 45o подводили шлифованный край покровного стекла так, чтобы образовавшийся угол между стеклами был равномерно заполнен кровью. Движением правой руки от себя каплю распределяют тонким слоем по предметному стеклу. Хорошим мазком будет такой, в котором кровь располагается на поверхности стекла без просветов, в виде равномерной полоски, не выходящей за ее края. Мазки сушат на воздухе и фиксируют в течение 3-4 мин в парах 40% формалина и непосредственно ив мазок наливают 96 об.% этиловый спирт. Для этого на дно эксикатора наливают около 150 мл формалина, оставляют под закрытой крышкой на 30 минут для возгонки паров формалина. Затем осторожно снимают крышку и на решетку эксикатора помещают мазки и закрывают крышкой. Таким образом, мазки фиксируются.
Приготовление буферных растворов.
В начале проводили калибровку иономеров рН 150. В состав буферной смеси входили: 0,1 М раствор триса, из которого готовили раствор - А, для этого брали 1,2114 г триса и растворяли в дистиллированной воде в объеме на 100 мл; затем готовили раствор - Б, состоящий из 0,1 М НС1 (с относительной молекулярной массой 36,465). Затем к 50 мл раствора А - (триса) добавляют 44,7 мл раствора Б (0,1 М НСl) доводили дистиллированной водой до 100 мл. Очень важно подобрать буферную смесь и получить рН в пределах от 7,2 до 7,5, а также способности состава буферной смеси активировать фермент - миелопероксидазу.
Приготовление буферно-инкубационных смесей 1 и 2.
Правильное приготовление инкубационной смеси имеет немаловажное значение для дальнейшей окраски мазков. Готовить инкубационную смесь желательно в затемненной комнате. Для ее приготовления готовят раствор 1 и 2.
Приготовление буферно-инкубационной смеси 1 (раствор 1).
1 г медного купороса растворяли в небольшом количестве воды и доливали до 100 мл буферной смесью (рН 7,5).
Полученные растворы смешивают, фильтруют в темноте желательно через стеклянный фильтр.
Приготовление буферно-инкубационной смеси 2 (раствор 2).
10 мг основного бензидина растворяли в небольшом количестве 96 об.% этиловом спирте (1-1,5 мл) добавляли 10 мл дистиллированной воды небольшими порциями, для лучшего растворения, затем в раствор вносили 13,5-14 буферной смеси, и 2-3 капли 1% раствора перекиси водорода. Полученный раствор фильтровали через стеклянный фильтр.
Инкубация мазков.
После фиксации мазки хорошо промывают в дистиллированной воде и сушат на воздухе в темном месте. Инкубация мазков проводится исключительно в темноте в течение 4 минут. На фиксированные мазки на две минуты наносится равномерным слоем инкубационная смесь - сначала раствор 1 - медный купорос 1%, приготовленный на буферной смеси, затем промывают дистиллированной водой и следом наносят на 2 минуты раствор 2 - бензидин с перекисью водорода, приготовленный на буферной смеси. После инкубации мазки промывают в дистиллированной воде и высушивают на воздухе в темном месте.
Для дифференцировки нейтрофильных гранулоцитов от других клеток крови в дальнейшем окрашивали ядра клеток краской 0,5% водным раствором нейтральным красным в течение 0,5 -1 минуты. После краску сливают, промывают дистиллированной водой и высушивают на воздухе в темноте.
Микроскопия мазков.
Микроскопию проводят с использованием иммерсионной системы при увеличении (90х15). Активность миелопероксидазы определяют по количеству гранул сине-коричневого цвета в цитоплазме нейтрофилов, ядра которых докрашены в красный цвет.
Визуально проводят оценку цитохимической реакции:
0 - степень - окрашено только ядро, цитоплазма не окрашена, не видно контуров гранул;
1-я степень - вся цитоплазма диффузно окрашена или окрашено не более 1/4 цитоплазмы;
2-я степень - в цитоплазме видны хорошо окрашенные гранулы, окрашено более 1/4 цитоплазмы;
3-я степень - всю цитоплазму занимают гранулы, но ядро свободно 3/4 и более цитоплазмы;
4-я степень - гранулы занимают всю цитоплазму и наслаиваются на ядро.
Средний цитохимический индекс (СЦИ) выводят по следующей формуле, предварительно подсчитывая 100 нейтрофилов,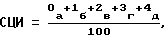
где а, б, в, г, д - количество клеток соответственно 0, 1, 2, 3, 4-й степени.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПРЕДЕЛЕНИЯ АКТИВНОСТИ КИСЛОЙ ФОСФАТАЗЫ В МАЗКАХ КРОВИ | 2000 |
|
RU2196987C2 |
| Способ определения активности миелопероксидазы нейтрофилов в мазках крови животных | 2015 |
|
RU2612149C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АКТИВНОСТИ ЩЕЛОЧНОЙ ФОСФАТАЗЫ В МАЗКАХ КРОВИ КРУПНОГО РОГАТОГО СКОТА И ПТИЦ | 2000 |
|
RU2212843C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АКТИВНОСТИ ЩЕЛОЧНОЙ ФОСФАТАЗЫ В ГОМОГЕНАТЕ ИЗ ОРГАНОВ И ТКАНЕЙ У ПЧЕЛ | 2003 |
|
RU2256703C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АКТИВНОСТИ КИСЛОЙ ФОСФАТАЗЫ ГОМОГЕНАТА ИЗ ОРГАНОВ И ТКАНЕЙ ПЧЕЛ | 2003 |
|
RU2256918C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АКТИВНОСТИ КИСЛОЙ ФОСФАТАЗЫ В МАЗКАХ ГЕМОЛИМФЫ У ПЧЕЛ | 2003 |
|
RU2256919C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АКТИВНОСТИ ЩЕЛОЧНОЙ ФОСФАТАЗЫ В МАЗКАХ ГЕМОЛИМФЫ У ПЧЕЛ | 2003 |
|
RU2253679C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ДИФФЕРЕНЦИРОВКИ T-, B-, NK-ЛИМФОЦИТОВ В МАЗКАХ КРОВИ ЖИВОТНЫХ И ПТИЦ | 2000 |
|
RU2192638C2 |
| СПОСОБ ВЫЯВЛЕНИЯ ПЕРОКСИДАЗЫ В ИММУНОКОМПЕТЕНТНЫХ ОРГАНАХ ЖИВОТНЫХ | 2000 |
|
RU2198403C2 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ РАКА ШЕЙКИ МАТКИ | 2012 |
|
RU2488823C1 |
Изобретение относится к ветеринарной медицине. Способ включает подготовку мазков крови животных. Затем готовят 2 буферно--инкубационной смеси и в темноте проводят последовательно инкубацию мазков крови животных с промыванием после каждого этапа инкубации. Первая буферно-инкубационная смесь содержит медный купорос, трис-НСl и дистиллированную воду. Вторая буферно-инкубационная смесь содержит бензидин, этиловый спирт, трис-НСl, перекись водорода и дистиллированную воду. После чего мазки крови животных высушивают, дополнительно окрашивают 0,5% раствором нейтрального красного. Об активности миелопероксидазы судят по количеству окрашенных гранул нейтрофилов. Способ повышает эффективность иммунологических исследований. 1 з.п. ф-лы, 1 ил.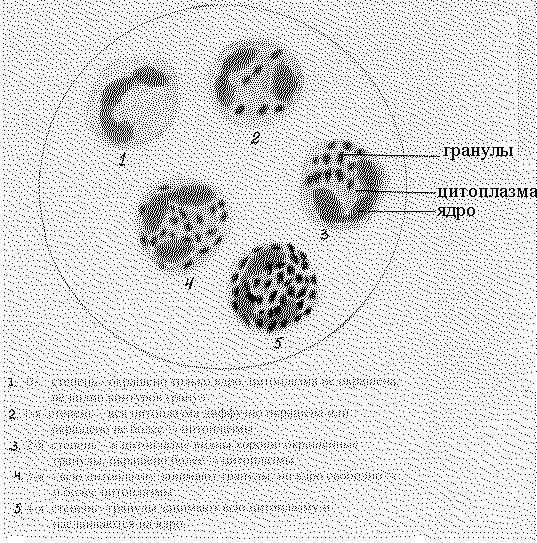
| КАРПИЩЕНКО А.И | |||
| Справочник - Медицинские лабораторные технологии: - СПб, Интермедина, 1999, т.2, c.298 | |||
| ЛОЙДА З | |||
| и др | |||
| Гистохимия ферментов: Лабораторные методы | |||
| М.: Мир, 1982, с.206 | |||
| РОМЕЙС Б | |||
| Микроскопическая техника | |||
| - М.: Издательство иностранной литературы, 1954, с.280. |
Авторы
Даты
2003-01-20—Публикация
2000-04-18—Подача