Изобретение относится к области биотехнологии, биохимии и медицины, а именно к способам синтеза веществ с бифункциональной и мультифункциональной биологической активностью, и может найти применение в конструировании иммуноферментных, иммуногенных, гормонбелковых и других подобных конъюгатов для биологии и медицины.
Известны способы конъюгации белков химической связью с помощью бифункциональных соединений, а также способы конъюгации белков с предварительно активированными полисахаридами [1].
Наибольшее распространение получили два способа активации (создания реакционных групп белка): посредством обработки полисахарида цианогенбромидом и посредством периодатного окисления [2, 3].
Наиболее близким по сущности к предлагаемому способу является способ получения декстран-белковых конъюгатов, при котором декстран активируют цианогенбромидом и используют в качестве гаптена для присоединения к белку-носителю [4]. Однако данный способ не позволяет получать конъюгаты с бифункциональной и полифункциональной активностью.
Изобретение направлено на создание способа синтеза конъюгатов, который предусматривает использование растворимого активированного полисахарида в качестве носителя или мостика для совместного присоединения к нему конъюгируемых белков. Способ позволяет свободно комбинировать состав конъюгата, независимо от наличия или отсутствия углеводных остатков в структуре конъюгируемых белков. Предлагаемым способом могут быть получены не только би-, но также три- и мультимолекулярные конъюгаты, так как к полисахариду-носителю совместно могут быть присоединены белковые вещества любого заданного состава.
Сущность изобретения сводится к следующему.
Способ получения растворимых конъюгатов биологически активных веществ предусматривает соединение белка с полисахаридом - декстраном. В отличие от прототипа декстран использован в качестве носителя. К нему присоединяют белки с различной функциональной активностью. К декстрану можно присоединить фермент пероксидазу и детекторные белки для определения иммуноглобулинов, а в качестве детекторных белков для определения иммуноглобулинов - IgG-фракции, или белок А золотистого стафилококка, или белок G стрептококка. Наилучшие результаты получают при молярном соотношении соединяемых компонентов декстран:детекторный белок: пероксидаза 1:5:5-1:5:10.
Способ реализуется следующим образом.
Пример 1.
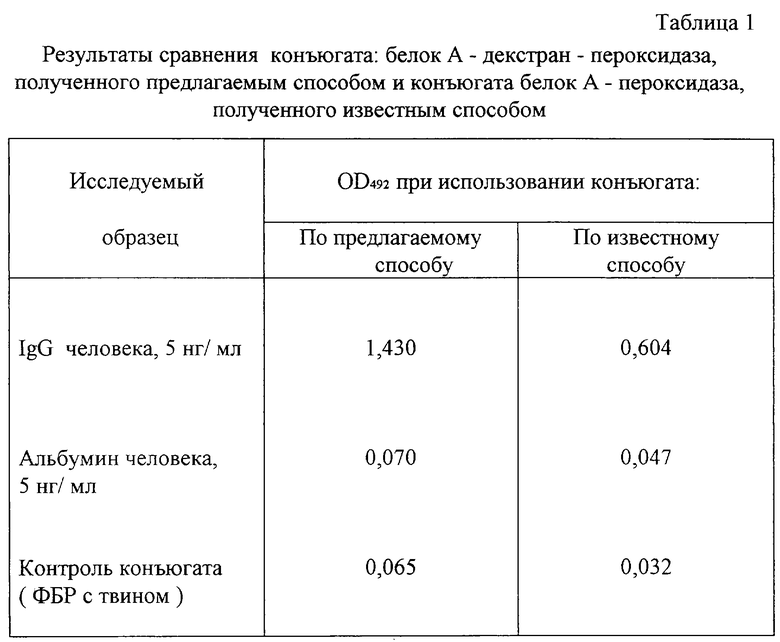
Получают конъюгат для иммуноферментного анализа (ИФА) IgG человека. В качестве детектора IgG используют белок А золотистого стафилококка, селективно реагирующий с Fc фрагментом IgG [7]. В качестве фермента используют пероксидазу хрена. Декстран с молекулярной массой 4400 D в количестве 4,4 мг растворяют в 10,0 мл Н2О и при постоянном перемешивании добавляют одной порцией 2 мг сухого CNBr: немедленно вслед за этим добавляют 2 М раствор NaOH - по каплям, под контролем рН-метра, поддерживая рН среды на уровне 10,5±0,1 в течение 15 минут при температуре 20±5oС.
Затем в реагентную смесь добавляют одной порцией при постоянном перемешивании свежеприготовленный раствор белков: очищенного белка А (200 мг) и пероксидазы хрена (200 мг) в 20 мл 0,2 М карбонат-бикарбонатного буферного раствора рН 9,2±0,1. Смесь оставляют при перемешивании на роторной мешалке при 20±5oС на 18-20 часов, после чего ее нейтрализуют 0,1 н. раствором НСl и наносят на колонку с сефадексом G-200 диаметром 35 мм и высотой слоя геля 500 мм, уравновешанную 0,1 М фосфатным буферным раствором рН 7,2±0,1. Гельфильтрацию ведут со скоростью 2 мл/час/см2 под контролем ультрафиолетового абсорбциометра при длине волны 280 нм. Блок-содержащую фракцию (50 мл) собирают в составе свободного объема. Остальные фракции гель-фильтрата удаляют.
Целевую фракцию гель-фильтрата - очищенный конъюгат - разводят до концентрации пероксидазы 100нг/мл 0,15 М фосфатным буферным раствором (ФБР) рН 7,2±0, l с твином в концентрации 0,025% и используют в ИФА как рабочее разведение конъюгата. В лунках полистирольного планшета для ИФА сорбируют IgG человека, для чего в лунки вносят 0,1 мл раствора IgG в концентрации 10 нг/мл в 0,1 М глициновом буферном растворе рН 8,2±0,1 и выдерживают при 37±0,1oС в течение 1 часа. После удаления раствора IgG и 4-х кратного промывания лунок ФБР с твином в них вносят конъюгат, полученный указанным выше способом в рабочем разведении. Для сравнения в другие лунки с сорбированным IgG вносят конъюгат белка А с пероксидазой, полученный известным способом (ФС 42-3428-97) в рабочем разведении - с концентрацией пероксидазы 100 нг/мл. Планшеты выдерживают 40 минут при 37±0,5oС, после чего раствор конъюгата удаляют и в лунки вносят по 0,1 мл субстратной смеси с ортофенилендиамином (6 мг ортофенилендиамина растворяют в 10 мл цитратно-фосфатного буферного раствора 0,1 М рН 5,0±0,1 и добавляют 10 мкл 33% раствора пергидроля) выдерживают 30 минут в темноте и останавливают реакцию добавлением 2Н H2SO4 по 0,1 мл в каждую лунку. Оптическую плотность продукта реакции измеряют при длине волны 492 нм (ОД492).
Получают следующие результаты (табл.1). Активность конъюгата, полученного предлагаемым способом, более чем в 2 раза выше активности конъюгата, приготовленного известным способом. Конъюгат высокоспецифичен - ОД492 в контроле с альбумином и ФБР находится на уровне сотых долей и ею можно пренебречь.
Пример 2.
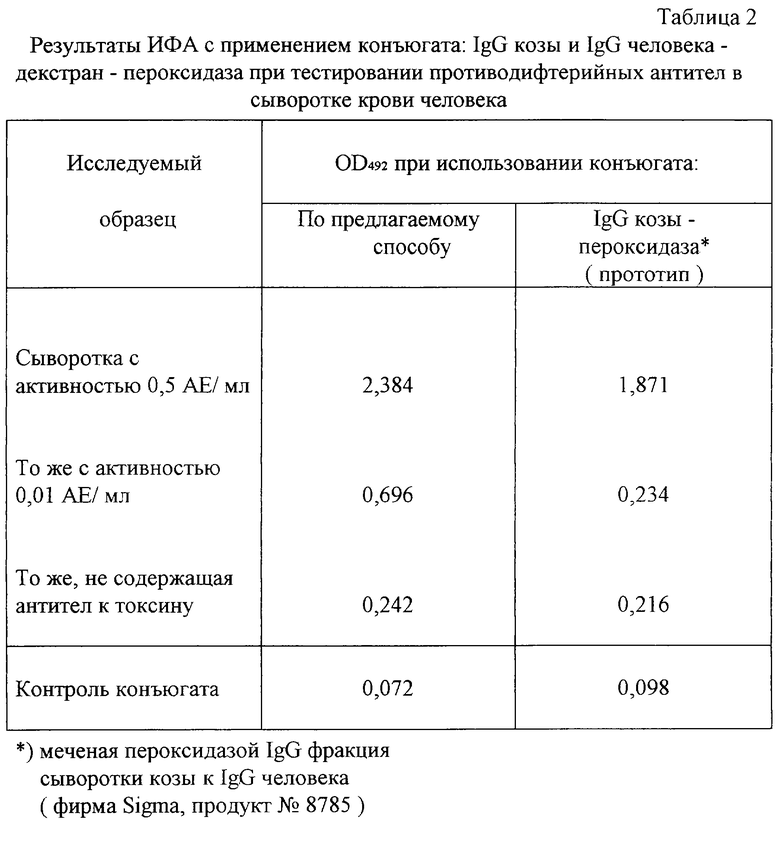
Получают конъюгат для ИФА IgG человека, используя следующие реагенты: декстран 4,4 мг, IgG-фракцию антисыворотки козы к IgG человека 800 мг и пероксидазу хрена 200 мг. Остальные условия выполнения способа аналогичны примеру 1. Получают 50 мл очищенного гельфильтрацией конъюгата IgG-декстран-пероксидаза. Его разводят до рабочей концентрации 100 нг пероксидазы в 1 мл и используют в опыте определения антител к дифтерийному токсину.
Дифтерийный анатоксин в концентрации 0,5 мкг/мл на глициновом буферном растворе рН 8,2±0,1 сорбируют в лунках полистирольного планшета для иммунологических реакций 16 часов +4oС. Лунки промывают 0,15 М раствором NaCl в 0,15 М фосфатном буферном растворе, содержащем твин-20 в концентрации 0,025% и инкубируют в них исследуемые сыворотки человека в разведении 1:400: а) сыворотку, содержащую антитоксические антитела в количестве 0,5 АЕ/мл по данным титрацитарной биопробы в коже кролика; б) сыворотку, содержащую антитела в концентрации 0,001 АЕ/мл и в) сыворотку, не содержащую антитоксических противодифтерийных антител по данным биопробы. Планшеты с сывороткой инкубируют 2 часа при 37±0,5oС, после чего сыворотку удаляют, лунки 4-х кратно промывают и производят детекцию IgG человека (антител, сорбировавшихся на антигене), как описано в примере 1, но в качестве детектора используют рабочее разведение конъюгата IgG козы декстран-пероксидаза.
Получают следующие результаты (табл. 2). Конъюгат, приготовленный по предлагаемому способу, имеет преимущества, особенно при анализе низкоактивной сыворотки, содержащей 0: 01 АЕ/мл противодифтерийного антитоксина. Конъюгат, полученный известным способом, не позволяет достоверно определить наличие или отсутствие антител в низкоактивной сыворотке, хотя это важно, так как концентрация антитоксина 0,02 АЕ/мл считается минимальным защитным уровнем гуморального иммунитета против дифтерии и служит критерием для определения тактики вакцинации населения.
Пример 3.
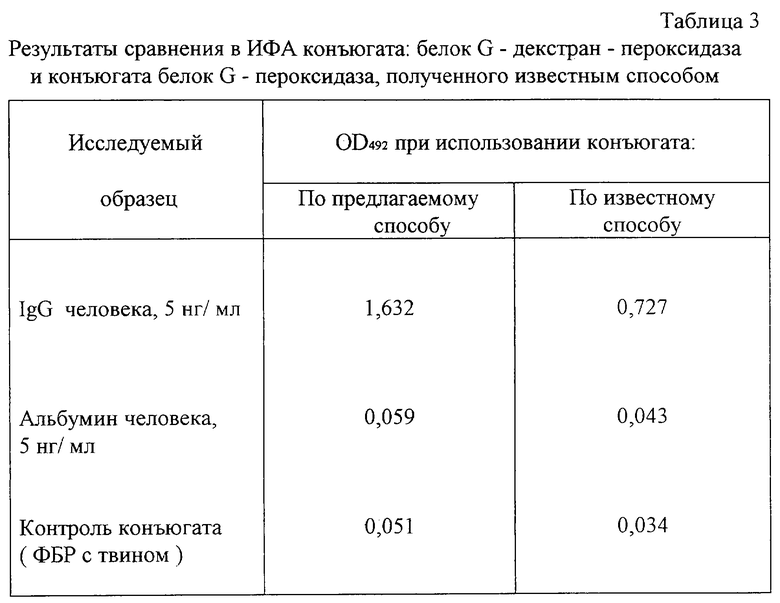
Выполняют в точном соответствии с примером 1 с тем отличием, что вместо белка А золотистого стафилококка используют белок G рекомбинантный с молекулярной массой 42 KD, в количестве 200 мл. По биологической активности белок G стрептококка также реагирует с Fc-фрагментом IgG человека и млекопитающих других видов и используется в качестве заменителя анти-IgG антител [8] . Остальные операции по приготовлению конъюгата и его испытанию проводят аналогично примеру 1.
Получают данные оптической плотности продукта реакции (табл.3), которые демонстрируют преимущества предлагаемого способа конструирования конъюгата: существенно более высокую активность активность при тестировании IgG при низких значениях неспецифических реакций.
Пример 4.
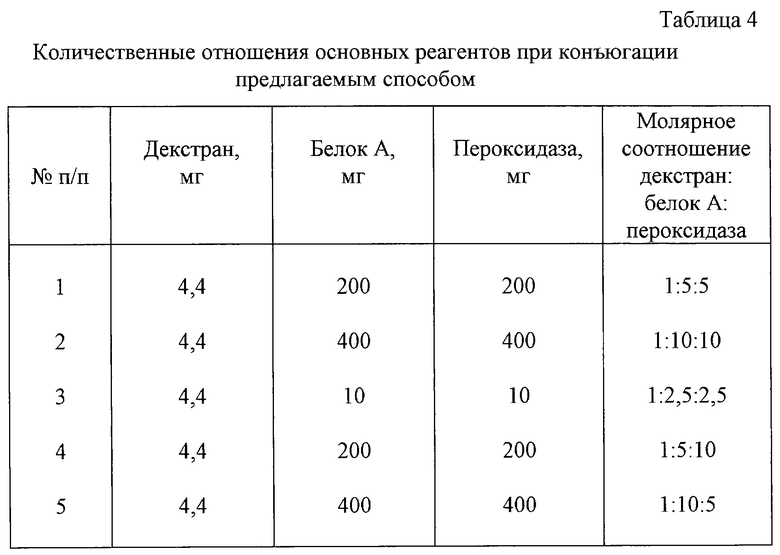
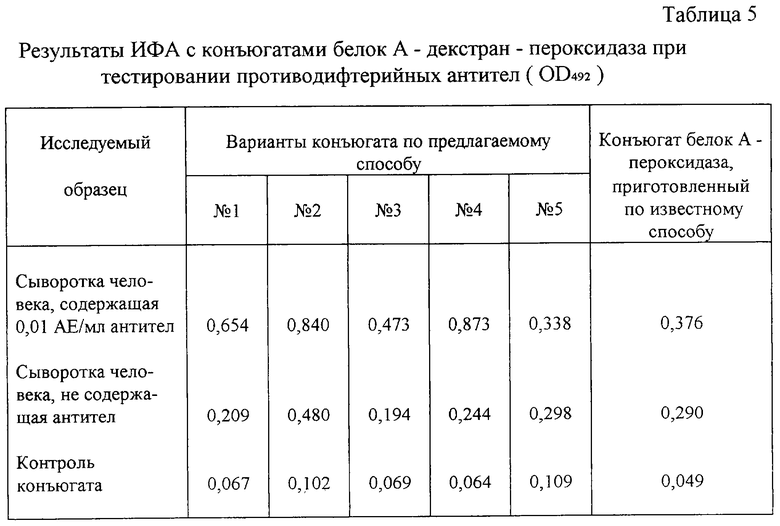
В целях определения зоны концентраций реагентов, дающей воспроизводимые результаты, используют следующие соотношения основных компонентов (табл.4). Конъюгаты белок А-декстран-пероксидаза получают при указанных соотношениях реагентов в соответствии с условиями примера 1. Конъюгаты испытывают, как указано в примере 3, при тестировании антитоксических противодифтерийных антител в сыворотке человека с низким содержанием антител (0,01 АЕ/мл).
Результаты представляют в табл.5. Полученные данные показывают, что наибольшие преимущества перед известным конъюгатом имеют предлагаемые конъюгаты, полученные при молярных соотношениях декстран:детекторный белок:пероксидаза, равных 1:5:5-1:5:10.
Пример 5.
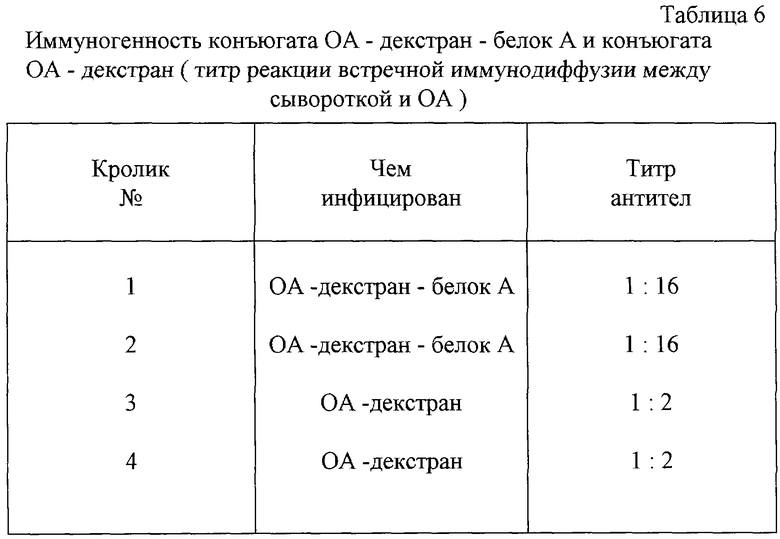
Получают конъюгат: овальбумин декстран - белок А золотистого стафилококка. Конъюгацию осуществляют с соблюдением условий примера 1 с тем отличием, что вместо пероксидазы используют овальбумин (ОР). Конечный продукт конъюгации используют для иммунизации 2-х кроликов по схеме: 2 внутримышечные инъекции (с интервалом 14 дней) по 1 мл раствора, содержащего 2 мг конъюгата по содержанию белка. Для сравнения кроликов иммунизируют конъюгатом декстран-овальбумин, полученным по методу (4). Через три недели после второй иммунизации у кроликов определяют антитела к овальбумину в реакции иммунодиффузии. Получают результаты (табл. 6), из которых следует, что предлагаемый способ существенно повышает иммуногенность овальбумина по сравнению с известным способом конъюгации. Этот факт подтверждают путем выделения анти-ОА-антител из объединенного образца сыворотки от кролика 1 и 2 аффинной хромотографией на CNBr сефарозе с иммобилизованным овальбумином. Из 1 мл сыворотки выделяют 583 мкг аффинно-очищенных антител к ОА, тогда как из объединенного образца сыворотки 3 и 4 выделяют 167 мкг антител к ОА. Приведенный пример демонстрирует преимущества предлагаемого способа при создании иммуногенных конъюгатов.
Пример 6.
Получают конъюгат белок А - декстран-пероксидаза, причем декстран активируют периодатным окислением. 4,4 мг декстрана (молекулярная масса 4400 KD) растворяют в 10 мл Н2О и добавляют 2 мг NalO4, смесь выдерживают на роторной мешалке (1 об/мин) 20 минут при 20±5oС, после чего диализуют 1 сутки против 200 объемов 0,001 М ацетатного буферного раствора рН 4,0±0,1. К диализованному раствору добавляют 20 мл 0,01 М корбанат-бикарбонатного буферного раствора рН 9,5±0,1, содержащего 200 мг белка А и 200 мг пероксидазы хрена. Смесь выдерживают на роторной мешалке при 20±5oС 2 часа. Затем добавляют 20 мг NaBH4 в 0,5 мл Н2О и выдерживают на роторной мешалке при 4±1oС 2 часа. Продукт реакции диализуют против 300 объемов ЗФР рН 7,2±0,1 в течение 20 часов и очищают на колонке с сефадексом G-200,как указано в примере 1. Получают 50 мл раствора конъюгата, который используют в ИФА в рабочей концентрации - 100 нг/мл по содержанию пероксидазы. Конъюгат испытывают, как указано в примере, при детекции сорбированных в лунках планшета IgG человека и альбумина человека. Получают результаты, представленные в табл.7. Из них следует, что способ воспроизводим в варианте конъюгации белков с периодатно-окисленным декстраном, т.е. при ином способе активации полисахарида, чем описано в примерах 1-5.
ЦИТИРОВАННАЯ ЛИТЕРАТУРА
1. Руослахти Е. (ред.) Иммуносорбенты в очистке белков. М., Медицина, 1979.
2. Туркова Я. Аффинная хроматография. М., Мир, 1980, 472 с.
3. Nacane Р. К., Kawaoi A. Peroxidase - labeled antibody a new methods of conjugation. J. Histochem. Cytochem., 1974, 22, 1084 -1091.
4. Richter W. , Kagedal L. Preparation of Dextran - Protein Conjugates and Studies of their Immunogenicity. Int. Arch. Allergy 1972, 42, 885 - 902.
5. Farr A.G., Nacane P.K., J.Immunol Meth, 1981, 47, р.129-144.
6. Стендифер Д. К. В кн.: Иммуноферментный анализ. М., Мир, 1988, стр. 172-192.
7. Фармакопейная статья ФС 42-3402-97.
8. Временная фармакопейная статья ВФС 42-34-80-99.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ СЕРОДИАГНОСТИКИ HELICOBACTER PYLORI-ИНФЕКЦИИ ИММУНОФЕРМЕНТНЫМ АНАЛИЗОМ | 2001 |
|
RU2196993C1 |
| СПОСОБ ПОЛУЧЕНИЯ ВАКЦИНЫ | 2000 |
|
RU2184566C1 |
| СПОСОБ ПОЛУЧЕНИЯ АФФИННОГО СОРБЕНТА ДЛЯ УДАЛЕНИЯ ФАКТОРА НЕКРОЗА ОПУХОЛИ ИЗ РАСТВОРОВ И БИОСУБСТРАТОВ | 2001 |
|
RU2184569C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ИСХОДОВ ОСТРОГО ВИРУСНОГО ГЕПАТИТА С | 2003 |
|
RU2269134C2 |
| ЛАКТОСЫВОРОТКА ИММУННАЯ СПЕЦИФИЧЕСКАЯ ПРОТИВ HELICOBACTER PYLORI И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2000 |
|
RU2201256C2 |
| ТЕСТ-СИСТЕМА ДЛЯ ОБНАРУЖЕНИЯ АНТИТЕЛ К ЯДЕРНОМУ БЕЛКУ ВИРУСА ГЕПАТИТА С КЛАССА IGM | 1997 |
|
RU2142134C1 |
| ИММУНОСОРБЕНТ ДЛЯ ОБНАРУЖЕНИЯ АНТИТЕЛ К ЯДЕРНОМУ БЕЛКУ ВИРУСА ГЕПАТИТА С В СЫВОРОТКЕ КРОВИ | 1997 |
|
RU2138286C1 |
| ВАКЦИННЫЙ ШТАММ ВИРУСА КРАСНУХИ "ОРЛОВ-Д" И СПОСОБ ПОЛУЧЕНИЯ ВАКЦИНЫ ПРОТИВ КРАСНУХИ | 1999 |
|
RU2173344C2 |
| СПОСОБ ОБНАРУЖЕНИЯ АНТИТЕЛ К ЯДЕРНОМУ БЕЛКУ ВИРУСА ГЕПАТИТА С | 1997 |
|
RU2133622C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ФУНКЦИОНАЛЬНОЙ АКТИВНОСТИ КОМПОНЕНТА C3 КОМПЛЕМЕНТА ЧЕЛОВЕКА | 2000 |
|
RU2195664C2 |

Изобретение относится к области биотехнологии, биохимии и медицины, а именно к способам синтеза веществ с бифункциональной и мультифункциональной биологической активностью. Сущностью изобретения является способ получения растворимых конъюгатов биологически активных веществ, предусматривающий соединение белка с полисахаридом - декстраном. В способе декстран использован в качестве носителя. К нему присоединяют белки с различной функциональной активностью. К декстрану можно присоединить фермент пероксидазу и детекторные белки для определения иммуноглобулинов, а в качестве детекторных белков для определения иммуноглобулинов IgG-фракции, или белок А золотистого стафилококка, или белок G стрептококка. Наилучшие результаты получают при молярном соотношении соединяемых компонентов декстран: детекторный белок: пероксидаза 1:5:5 - 1:5:10. Технический результат - расширение арсенала технологии иммунокомпетентных средств. 1 з.п. ф-лы, 7 табл.
| RICHTER W., RAGEDAL L | |||
| Preparation of Dextran-Protein Conjugates..., Jnt | |||
| Arh | |||
| Allergy, 1972, 42, 885-902 | |||
| ГИБРИДНОЕ МОНОКЛОНАЛЬНОЕ АНТИТЕЛО, ВЗАИМОДЕЙСТВУЮЩЕЕ С CD4-АНТИГЕНОМ Т-ХЕЛПЕРНЫХ КЛЕТОК ЧЕЛОВЕКА, И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1990 |
|
RU2112037C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПРЕДНАЗНАЧЕННАЯ ДЛЯ ТОРМОЖЕНИЯ ЗАВИСИМОЙ ОТ ИНТЕРЛЕЙКИНА-2 ПРОЛИФЕРАЦИИ ОПУХОЛЕВЫХ КЛЕТОК, УВЕЛИЧЕНИЯ СОДЕРЖАНИЯ ИНТЕРФЕРОНА, ЛЕЧЕНИЯ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ КИШЕЧНИКА, ПОТЕНЦИРОВАНИЯ ТОРМОЖЕНИЯ ПРОИЗВОДСТВА ЦИТОКИНА И ОГРАНИЧЕНИЯ ИЛИ ТОРМОЖЕНИЯ АЛЛЕРГИЧЕСКОЙ РЕАКЦИИ ЗАМЕДЛЕННОГО ТИПА | 1993 |
|
RU2120802C1 |
Авторы
Даты
2003-01-20—Публикация
2000-12-07—Подача