Изобретение относится к медицине и касается медико-биологических лекарственных препаратов, обладающих противовоспалительным и иммуномодулирующим действием, используемых для неинъекционного применения для профилактики и лечения любых заболеваний, обусловленных нарушениями иммунологических функций. Так как любая патология имеет в своей основе или связана с изменением реакций системы иммунитета, лекарственное средство согласно изобретению может быть применено во всех областях клинической медицины, наиболее важных из них: стоматология, ЛОР, дерматология, аллергология, иммунология, офтальмология и др.
Неинъекционное применение предполагает использование лекарственного препарата в любых случаях, за исключением введения в ткани и полости тела, изолированные от внешней среды. При этом лекарственный препарат изготавливается в любых возможных лекарственных формах: жидких (например, микстуры, капли, примочки, полоскания, ванны, впрыскивания, растворы и т. п. ), твердых (например, порошки, таблетки, пилюли, свечи, шарики, гранулы, микрогранулы, палочки, капсулы, суппозитории и т.п.), мягких (например, мази, пасты, гели, кремы, линименты, пластыри, аппликации и т.п.), газообразных (например, аэрозоли, газы, пары и т.п.).
В соответствии с классификацией лекарственных средств по фармакотерапевтическим группам лекарственное средство согласно изобретению относится к следующим фармакотерапевтическим группам:
13.5 - Стимуляторы гемопоэза (исключая препараты железа).
2 - Средства для лечения патологии кожи.
5 - Средства для лечения патологии органов респираторной системы.
6 - Средства для лечения патологии органов чувств.
8 - Средства иммуномодулирующие, иммуноглобулины, вакцины и фаги.
Способностью стимулировать иммунные реакции организма обладают производные нуклеиновой кислоты, а также ряд биогенных препаратов. Способность этих препаратов повышать общую резистентность организма, ускорять процессы регенерации послужила основанием для широкого их применения в комплексной терапии инфекционных и инфекционно-воспалительных заболеваний, при вяло текущих регенерационных процессах и ряде других заболеваний.
Особенно важным стало в последние годы изучение иммунологических свойств эндогенных соединений, образуемых самим организмом. Эти соединения мобилизуют иммунные силы организма на борьбу с патологическими процессами.
Одними из наиболее важных эндогенных иммуномодуляторов являются интерфероны.
Известен Интерферон лейкоцитарный человеческий (Справочник Видаль, М.: OVPEE-АстраФармСервис, 2000 г., с.Б-268). Состав: активное вещество - группа эндогенных белков, вырабатываемых лейкоцитами донорской крови человека под воздействием вирусов. Фармакологическое действие: противовирусное, иммуномодулирующее, антипролиферативное. Применяется для профилактики и лечения гриппа, ОРВИ, вирусных заболеваний глаз в виде водного раствора. Для лечения гриппа и ОРВИ интерферон закапывают в носовые ходы, кроме того, его можно применять в виде ингаляций.
Известен Интерферон человеческий лейкоцитарный в свечах. Активное вещество - группа эндогенных белков, вырабатываемых лейкоцитами донорской крови человека под воздействием вирусов. Фармакологическое действие: противовирусное, иммуномодулирующее. Применяется при лечении острого и хронического вирусного гепатита.
Недостатками чисто иммуномодулирующих препаратов является их тяжелая переносимость и наличие многих побочных эффектов, в частности: подавление кроветворения - Интерферон альфа N1 (Справочник Видаль, М.: OVPEE-АстраФармСервис, 2000 г., с. Е-178). Не являясь противовоспалительными, иммуномодуляторы лишь стимулируют выработку провоспалительных цитокинов. Препараты Интерферонов неэффективны при аллергии, аутоиммунитете, в качестве пртивовоспалительных средств.
Из средств иммуномодуляторов неинъекционного применения следует выделить препараты, созданные на основе экстрактов ромашки (Справочник Видаль, М.: OVPEE-АстраФармСервис, 2000 г., с. Б-123, Б-205): Камиллодерм (108 мг экстракта ромашки на 1 г мази) или Камиллозан (1%-ная мазь сухого экстракта цветков ромашки) или просто цветки ромашки. Как известно (Лесков В.П., Чередеев А.Н., Горлина Н.К., Новоженов В.Г. "Клиническая иммунология для врачей" М., 1997, с.128), экстракты ромашки обладают иммуномодулирующей активностью. Недостатком применения этих препаратов является их низкая иммуномодулирующая активность, трудность стандартизации оказываемого эффекта в связи с растительным происхождением сырья. Наконец, действие ромашки не является специфическим и направлено на различные звенья системы иммунитета, что не позволяет точно воздействовать на конкретные реакции системы иммунитета.
Известен иммуномодулятор Ликопид (Справочник Видаль, М.: OVPEE-АстраФармСервис, 2000 г., с. Б-290). Активное вещество данного препарата - глюкозаминилмурамилдипептид, представляющий основную структурную единицу клеточной стенки бактерий. Препарат используется для иммуномодуляций и имеет дозовозависимый эффект. В малых дозах он стимулирует провоспалительные реакции системы иммунитета (активация фагоцитоза, Т-и В-лимфоцитов, продукции провоспалительных цитокинов, например, фактора некроза опухолей). В больших дозах он используется для лечения кожных аутоиммунных заболеваний за счет ингибиции синтеза провоспалительных цитокинов. Недостатки препарата: противопоказан при беременности, имеются случаи непереносимости препарата; высокая вероятность аллергических реакций в связи с микробным происхождением препарата; возможность гипертермических реакций. Как известно (Лесков В.П., Чередеев А. Н. , Горлина Н.К., Новоженов В.Г. "Клиническая иммунология для врачей", М., 1997, с. 128), влияние препаратов бактериального происхождения происходит через макофогальную систему, когда вследствии активации антигенпрезентирующей макрофагальной клетки вырабатываются факторы, стимулирующие иммунный ответ. Ингибиция иммунного ответа под влиянием больших доз Ликопида обусловлена развитием "высокодозовой толерантности" (Петров Р.В. "Иммунология", "Медицина", 1982). При этом воздействии в системе иммунитета развивается состояние, похожее на "запредельное торможение", когда под влиянием высоких доз антигена идет патологическая реакция торможения. Несмотря на возможный клинический эффект, данное воздействие нельзя назвать физиологичным и, даже при получении положительного клинического эффекта, возможно развитие осложнений, связанных с разбалансировкой иммунологических функций.
Наиболее близким лекарственным препаратом того же назначения к заявленному изобретению по совокупности существенных признаков является известный иммуномодулирующий препарат - Преднизолон (М.Д. Машковский. Лекарственные средства. В двух томах.Т.2.-Изд. 13-е, новое. -Харьков: Торсинг, 1997, стр. 33). Преднизолон - глюкокортикостероид, гормон, обладающий выраженным противовоспалительным эффектом и иммуномодулирующим действием при использовании в малых дозах.
Показания: применяют при ревматизме, инфекционном неспецифическом полиартрите, бронхиальной астме, острой лимфатической и миелолидной лейкемии, инфекционном мононуклеозе, нейродермитах, экземе и других показаниях к применению глюкокортикостероидов. Применяется неинъекционно в виде мазей, кремов, таблеток.
Назначают Преднизолон внутрь в виде таблеток. Активное вещество - Преднизолон (0,005 г).
Для местного применения при кожных заболеваниях немикробной этиологии (экзема, зуд, дерматиды и т.п.) применяют 0,5%-ную преднизолоновую мазь, которую наносят тонким слоем на кожу. Активное вещество - Преднизолон (0,005 г).
В глазной практике (кератиты, конъюктивиты, ириты и др.) применяют глазные капли, содержащие 0,3%-ный раствор гидрохлорида 21-(дезокси-N-метил-N-пиперазинил)-преднизолона. Активное вещество - раствор гидрохлорида 21-(дезокси-М-метил-М-пиперазинил)-преднизолона.
В малых дозах (до 5 мг в сутки для среднего человека) преднизолон обладает иммуномодулирующим эффектом. Используемые концентрации в средствах для наружного применения (кремы, мази, капли) рассчитаны на иммуносупрессию (В. П.Лозовой, С.М.Шергин. Структурно-функциональная организация системы иммунитета. Новосибирск, Наука, 1981, 226 с.; Лесков В.П., Чередеев А.Н., Горлина Н. К. , Новоженов В.Г. Клиническая иммунология для практических врачей. М., 1997, 128 с.). Однако преднизолон является синтетическим аналогом природного гормона кортизола, поэтому его влияние на систему иммунитета имеет дозовозависимый эффект.
В стандартных применяемых схемах лечения преднизолон используется для подавления иммунологических реакций (в том числе воспаления и аллергии), так как является сильным иммунодепрессантом. В больших дозах преднизолон имеет побочные эффекты со стороны эндокринной системы, сердечно-сосудистой системы и гемостаза, со стороны ЖКТ, со стороны костной системы, со стороны глаз и, в том числе, со стороны иммунной системы: подавление защитных реакций с понижением сопротивляемости инфекциям, замедленное заживление ран. Иммунодепрессивные препараты могут быть весьма эффективны при применении с целью преодоления тканевой несовместимости и лечения иммунных заболеваний, однако данное свойство, характерное для всех глюкокортикостероидов, не позволяет использовать преднизолон при острых вирусных инфекциях, глаукоме, паразитарных заболеваниях, эрозивных и язвенных процессах слизистой верхних отделов желудочно-кишечного тракта (ЖКТ), лимфадените, системном микозе и т.п., то есть при заболеваниях, при которых требуется стимуляция иммунных процессов.
Недостатком преднизолона является также недопустимость длительного его применения и внезапного прекращения, в связи с привыканием к нему организма. Это связано с тем, что сам механизм действия преднизолона связан с ингибицией синтеза белка и деления клеток, причем данное свойство универсально по отношению ко всем клеткам. Отсюда и торможение регенерации, ранозаживления, повышение вероятности или стимуляция инфекционного процесса за счет ингибиции функции клеток системы иммунитета.
Предлагаемое изобретение решает задачу расширения арсенала эффективных противовоспалительных и иммуномодулирующих средств неинъекционного применения.
Поставленная задача решается созданием нового лекарственного средства, обладающего более эффективным противовоспалительным и иммуномодулирующим действием по сравнению с известными аналогами, не имеющего противопоказаний, а также в значительной степени обладающего узконаправленным специализированным действием, позволяющим со значительно большей вероятностью избегать побочных эффектов.
Указанный технический результат при осуществлении изобретения достигается тем, что в известном противовоспалительном и иммуномодулирующем средстве неинъекционного применения, содержащем активное вещество и целевую добавку, в качестве активного вещества применен эритропоэтин.
Эритропоэтин (ЭПО) - важный гормон организма млекопитающих, в том числе человека, продуцируемый интерстициальными клетками почек и регулирующий эритропоэз у млекопитающих. ЭПО может быть получен биотехнологическим путем - рекомбинантный РЭЧ (рекомбинантный эритропоэтин человека), путем химического синтеза или может быть выделен из тканей человека или животных.
Рекомбинантный эритропоэтин человека (РЭЧ) получают, например, методом введения клонированного гена эритропоэтина человека в составе плазмиды PSVdepoL Мо в клетки перевиваемой линии яичника китайского хомячка CHOtк (штамм ВСКК/П/637Д) (патент 2089611). Штамм депонирован в специализированной коллекции перевиваемых соматических клеток позвоночных Всесоюзной коллекции клеточных культур под номером ВСКК (п) 637Д от 36.04.94.
Установлено, что ЭПО обладает противовоспалительными и иммуномодулирующими свойствами (В.А. Козлов. Клиническая иммунология в клинике внутренних болезней. Новосибирск, 1997.- с. 20), оказывая влияние на процессы дифференцировки тучных клеток (Irani A.M., Schwartz L.B. Human mast cell heterogeneity // Allergy Proc. - 1994. - Vol. 15, N 6. - Р. 303-308), вызывая увеличение количества гранулоцитов и снижение Т-лимфоцитов в крови (Коуа Т., Narita J., Honda S. et al. Erythropoietin induces the expansion of c-kit+ progenitors for myeloid and erythroid cells, but not for lymphoid cells, in the bone marrow and liver // Eur. J. Haematol. - 1999. - Vol. 63, N 5. - P. 306-312), повышая чувствительность опухолевых клеток к действию NК-клеток (Miyajima J. , Imai Y., Nakao M. et al. Higher susceptibility of erythropoietin-producing renal cell carcinomas to lysis by lymphokine-activated killer cells // J. Immunother. Emphasis Tumor Immunol. - 1996. - Vol. 19, N 6. - P. 399-404), регулируя соотношение Тh1/Тh2-клеток (Matsumoto A., Seki Y. , Kubo M. et al. Suppression of STAT5 functions in liver, mammary glands, and Т cells in cytokine-inducible SН2-containing protein 1 transgenic mice // Mol. Cell Biol. - 1999. -Vol. 19, N 9. - P. 6396-6407), участвуя в регуляции ответа Т-лимфоцитов на интерлейкин-2 (Moriggl R., Topham D.J., Teglund S. et al. Stat5 is required for IL-2-induced cell cycle progression of peripheral Т cells // Immunity. - 1999. - Vol. 10, N 2. - P. 249-259) и чувствительности клеток к γ-интерферону (Taniguchi S., Dai C.H., Krantz S.B. Specific binding of interferon-gamma to high affinity receptors on human erythroid colony-forming cells // Exp. Hematol. - 1997. -Vol. 25, N 3. - P. 193-198). Противовоспалительное действие ЭПО объясняется его влиянием прямо на клетки-эффекторы иммунопатологических (провоспалительных и аллергических) реакций, поскольку он сам является противовоспалительным цитокином.
Достоинство ЭПО в его высокой иммуномодулирующей активности: его действующая доза от 1000 ME на человека в сутки (около 8-10 МЕ/кг веса) - это 0,5 мг (согласно технологическому регламенту 1 мг содержит 2000 ME активности), тогда как преднизолон используется в минимальной дозе 5 мг, а в обычной дозе - от 30 до 1000 мг.
ЭПО - легко переносится, по классу токсичности относится к нетоксичным веществам, не зависимо от дозы.
Побочные эффекты при неинъекционном применении нового лекарственного средства отсутствуют.
ЭПО стандартизирован по единицам активности (ME) и измеряется в ME и/или мг. Стандартизация согласно требованиям фарм. Статьи проводятся in viro путем электрофореза и изоэлектрофокусирования и in vivo на стандартных моделях у животных (линейные мыши).
ЭПО обладает высокоспецифическим эффектом. Он стимулирует дифференцировку и пролиферацию клеток гемопоэза в сторону эритроидного ростка, а в отношении клеток системы иммунитета - ингибирует активность клеток аутоиммунной и аллергических эффекторных реакций, не влияя на другие реакции системы иммунитета (например, противоопухолевый иммунитет или противоинфекционный иммунитет). Это позволяет точно определять показания для использования нового лекарственного средства и избежать нежелательных побочных эффектов.
Для получения лекарственного средства, отвечающего изобретению, активное вещество - ЭПО смешивают с целевой добавкой согласно принятым в фармацевтике способам компаундирования.
Целевая добавка - вещество или комплексы веществ, позволяющие получить необходимую лекарственную форму, не обладающие искомой биологической активностью.
Активность и эффективность препарата не зависит от вида целевой добавки, которая может иметь различные природные и синтетические формы, зависящие от лекарственной формы препарата, а определяется исключительно действием активного вещества - ЭПО.
Лекарственный препарат согласно изобретению можно применять детям и беременным женщинам, он не вызывает гипертермических реакций. Аллергические реакции отмечены лишь при длительном подкожном (парэнтеральном) применении лекарственного средства с ЭПО в качестве активного вещества. Поскольку ЭПО обладает прямым селективным влиянием на отдельные реакции системы иммунитета, использование нового лекарственного средства не вызывает осложнений со стороны иммунной системы и не способствует расбалансировке иммунологических функций.
Ниже приведены примеры сравнительных результатов лечения лекарственными препаратами с активным веществом - РЭЧ (рекомбинантный эритропоэтин) и лекарственными препаратами с другими активными веществами.
Пример 1.
Исследовалась эффективность лекарственного препарата с ЭПО в качестве активного вещества при экспериментальном аллергическом конъюктивите.
Методы: морские свинки (n = 68) были сенсибилизированы интраперитонеальной инъекцией овальбумина. Через 3 недели после сенсибилизации меньшая концентрация овальбумина (10 мкг/мл) вводилась ежедневно в течение 3 недель. Через 6 недель для провокации аллергического воспаления использовали 20 мг/мл овальбумина.
Всех животных разделили на 3 группы.
Группа А ( контроль 1, n = 30), животные которые в качестве протектора воспаления получали плацебо (0,9%-ный раствор натрия хлорида, активное вещество - натрий хлорид).
Группа В (контроль 2, n = 22), животные, которые получали капли ДЕКСАПОС (0,1%-ные глазные капли, содержащие 1 мг активного вещества - дексаметазона - 21 - сульфобензоата натрия).
Группа С (опыт, n = 16), животные, которые получали 0,1%-ный раствор ЭПО (лекарственный препарат с ЭПО в качестве активного вещества).
Препараты тестирования противоаллергического и противовоспалительного эффекта применяли за 30 мин до нанесения аллергена, через 30 мин, затем ежечасно в течение 7 ч.
Через 30 мин, 8 и 24 ч после нанесения аллергена в биоптатах конъюнктивы определяли уровень воспалительной реакции.
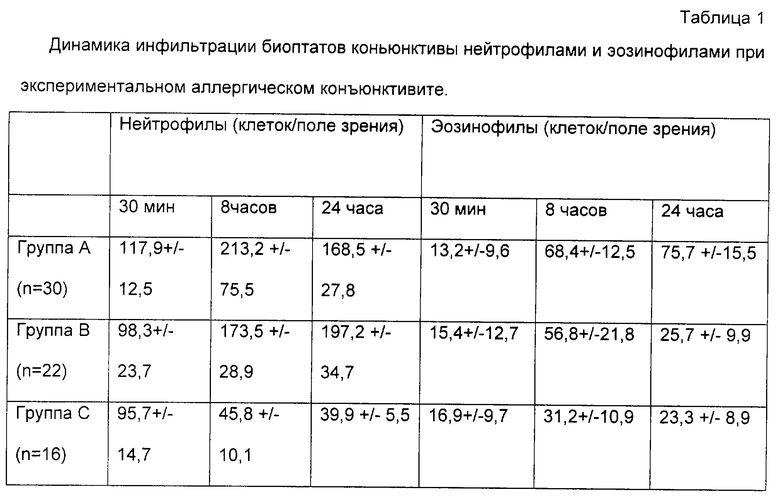
Полученные данные представлены в табл.1.
Установлено, что через 30 мин после нанесения аллергена на конъюнктиву уровень воспаления в контрольных группах и группе, предобработанной раствором с ЭПО не различался.
Через 8 ч после нанесения аллергена общее число клеток, характеризующих воспалительный процесс (нейтрофилы и эозинофилы), достоверно различалось во всех группах. В группе А этот показатель был 213,2 +/- 75,5 клеток в поле зрения. В группе В - 173,5 +/- 28,9, причем в инфильтрате в подавляющем большинстве преобладали нейтрофилы, В группе опыта (С) этот показатель был 45,8 +/-10,1 клеток в поле зрения.
Через 24 ч после введения аллергена уровень эозинофилов составил в группе контроля А 75,7 +/- 15,5, в группе контроля В - 25,7 +/- 9,9, а в группе опыта С - 23,3 +/-8,9 клеток/ поле зрения.
Уровень нейтрофилов: в группе А - 168,5 +/- 27,8; в группе В - 197,2 +/- 34,7; в группе С - 39,9 +/- 5,5.
Следует указать, что при объективном осмотре у животных обеих контрольных групп отмечены признаки гнойного конъюнктивита (повышенная экссудация, корки и др.).
Таким образом, при экспериментальном аллергическом конъюнктивите отмечен противовоспалительный и противоаллергический эффект как препаратов с ЭПО в качестве активного вещества, так и глюкокортикоидов (дексаметазона), однако действие глюкокортикоидов проявлялось в большей степени в отношении эозинофилов, но не нейтрофилов и суммарное влияние на инфильтрацию было ниже. Кроме того, выраженная инфильтрация нейтрофилами является одним из признаков нагноения, что и подтверждено объективными данными.
Таким образом, введение раствора с ЭПО в качестве активного вещества в значительной степени позволяет предупредить и ингибировать воспалительные явления, возникающие при экспериментальном аллергическом конъюнктивите, что подтверждает более эффективное его противовоспалительное действие.
Пример 2.
Обследовано 14 больных с хроническим атопическим дерматитом и явлениями экзематизации. Все больные были мужского пола в возрасте от 18 до 49 лет. Давность заболевания колебалась от 6 мес до 12 лет. Больные обследованы в фазе обострения заболевания. Все больные получали общепринятое лечение, включающее применение перорально антигастаминных препаратов, препаратов кальция, часть больных местно - 0,5%-ную преднизолоновую мазь, при выраженном зуде - транквилизаторы.
Всех больных разделили на 2 группы: А - группа контроля, получающее общепринятое лечение; группа В - группа опыта, которым вместо преднизолоновой мази назначали 0,1%-ный крем ЭПО (лекарственный препарат с активным веществом - ЭПО).
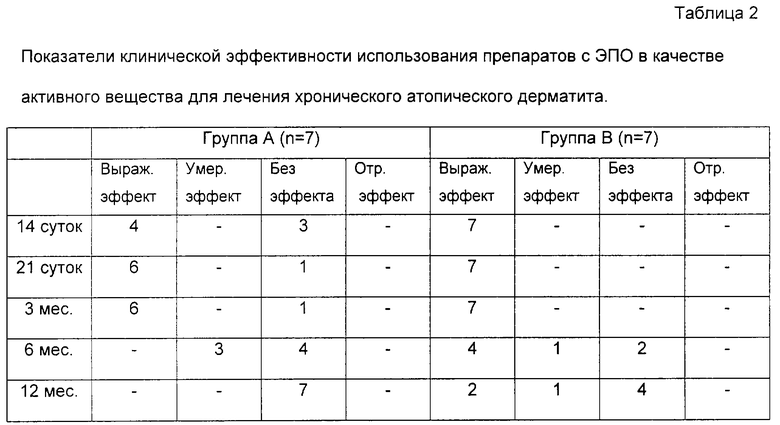
Контроль эффективности лечения осуществляли на основании данных субъективных ощущений больных и результатов осмотра через 14, 21 день от начала лечения, затем через 3, 6, 12 мес.
Установлено, что уже через 14 дней использования препарата ЭПО у больных группы В отмечены признаки исчезновения воспалительных проявлений. Это выражалось в уменьшении местной гиперемии, исчезновении зуда, в случае мокнущей экземы отмечено уменьшение экссудации. Положительная динамика отмечена у 7 больных. После проведения 3 недельного курса лечения ЭПО ремиссия составила: до 3 мес - у 3 больных; до 6 мес - у 1 больного; свыше года - у 3 больных.
В контрольной группе (группа А) через 14 дней лечения положительная динамика отмечена у 4 больных, через 21 день еще у 2 больных. У 1 больного эффекта от лечения не отмечено. После проведения 3 недельного лечения ремиссия составила: до 3 мес - у 6 больных. У 1 больного, как уже указывалось, эффекта от лечения достигнуто не было.
Таким образом, наружное использование лекарственного средства с ЭПО в качестве активного вещества обладает значительным клиническим эффектом при хроническом атопическом дерматите. Сравнительное изучение влияния препаратов преднизолона и лекарственного средства с ЭПО позволило сделать вывод о большей выраженности клинического эффекта лекарственного средства с ЭПО, что, очевидно, связано с его более специфичным влиянием на патологические реакции системы иммунитета.
Приведенный заявителем анализ уровня техники, включающий поиск по патентным и научно-техническим источникам информации, и выявление источников, содержащих сведения об аналогах заявленного изобретения. Позволил установить, что заявитель не обнаружил аналог, характеризующийся признаками, тождественными (идентичными) всем существенным признакам заявленного изобретения. Определение из перечня выявленных аналогов прототипа, как наиболее близкого по совокупности существенных признаков аналога, позволил выявить совокупность существенных по отношению к усматриваемому техническому результату отличительных признаков в заявленном лекарственном средстве, изложенных в формуле изобретения.
Следовательно, заявленное изобретение соответствует условию "новизна".
Противовоспалительное и иммуномодулирующее действие созданной фармацевтической композиции определяется исключительно новым активным веществом - ЭПО, а другие компоненты (целевая добавка) являются нейтральными носителями из круга традиционно применяющихся в композициях для создания различных лекарственных форм.
Эритропоэтин (ЭПО) - важный гормон организма млекопитающих, в том числе человека, продуцируемый интерстициальными клетками почек и регулирующий эритропоэз у млекопитающих. ЭПО может быть получен биотехнологическим путем - рекомбинантный ЭРО (рекомбинантный эритропоэтин человека), путем химического синтеза или может быть выделен из тканей человека или животных.
Для получения лекарственного средства, отвечающего изобретению активное вещество ЭПО смешивают с целевой добавкой согласно принятым в фармацевтике способам компаундирования.
Целевая добавка - вещество или комплексы веществ, позволяющие получить необходимую лекарственную форму, не обладающие искомой биологической активностью.
Активность и эффективность препарата не зависит от вида целевой добавки, который может иметь различные природные и синтетические формы, зависящие от лекарственной формы препарата (например, спиртовые, водные, жировые, гелевые и др.).
Ниже приведены примеры конкретных композиций с различными формами целевой добавки, где в качестве активного вещества применен РЭЧ (рекомбининтный Эритропоэтин).
Пример 3.
Фармацевтическая композиция, представляющая собой мазь с ЭПО в качестве активного вещества и с наполнителем на жировой основе, содержащая следующие ингредиенты при следующем их соотношении, мас.%:
РЭЧ - 0.5
Пчелиный воск - 4-8
Оливковое масло - 2-6
Ланолин - 10-20
Вазелин - До 100
Способ приготовления.
Активное вещество получают способом введения клонированного гена эритропоэтина человека в составе плазмиды PSVdepoL Mo в клетки перевиваемой линии яичника китайского хомячка СНОtk (штамм ВСКК/П/637Д). Компоненты в реактор подают через дозаторы. В реакторе (при t=70oC) расплавляют путем последовательного внесения компоненты, начиная с тугоплавких восков. Полученную смесь охлаждают до t=40oС. Затем в охлажденную смесь вносят, при активном перемешивании, рекомбинантный эритропоэтин человека. После чего производят фильтрование и расфасовку.
Пример 4.
Фармацевтическая композиция, представляющая собой суппозитории (ректальные, вагинальные), палочки уретральные, с РЭЧ в качестве активного вещества и с наполнителем на жировой основе, содержащая следующие ингредиенты при следующем их соотношении, мас.%:
РЭЧ - 0,5
Масло какао - 2-6
Твердая жировая основа - до 100
Средство готовят следующим образом. Активное вещество получают описанным выше способом. При этом компоненты в автомат для изготовления и упаковки суппозиториев подают через дозаторы и перемешивают. Однородная масса охлаждается при перемешивании до комнатной температуры. После чего производят фильтрование и расфасовку.
Пример 5.
Фармацевтическая композиция с РЭЧ в качестве активного вещества и с наполнителем на гелевой основе, содержащая следующие ингредиенты при следующем их соотношении, мас.%:
РЭЧ - 0,5
Сорбитанолетат - 2-5
Ланолиновый спирт - 1-3
Высокомолекулярные жирные спирты - 4-6
Оливковое масло - 15-20
Глицерин - 2-4
Вода - до 100
Средство готовят следующим образом. Активное вещество получают описанным выше способом. При этом компоненты в реактор подают через дозаторы. В реактор последовательно вносят компоненты и перемешивают. Гелеобразующие компоненты диспергируются в воде при t=50oC, после набухания и однородного распределения, т.е. образования дисперсии. Однородная масса нейтрализуется и охлаждается при перемешивании до комнатной температуры. Затем при перемешивании вносят активное вещество.
Пример 6.
Фармацевтическая композиция, представляющая собой раствор для ингаляций, с РЭЧ в качестве активного вещества и с наполнителем на водной основе, содержащая следующие ингредиенты при следующем их соотношении, мас.%:
РЭЧ - 0,5
Теофиллин - 2-4
Хлорид натрия - 2-5
Вода - до 100
Средство готовят следующим образом. Активное вещество получают описанным выше способом. Способ получения раствора для ингаляций включает следующую последовательность операций: растворение теофиллина в воде для инъекций с нагреванием раствора до t=50oC, растворение хлорида натрия, активного вещества, стерилизующая фильтрация полученного раствора, розлив раствора во флакон и его герметизация.
Пример 7.
Фармацевтическая композиция, представляющая собой глазные капли (капли в нос), с РЭЧ в качестве активного вещества и с наполнителем на водной основе, содержащая следующие ингредиенты при следующем их соотношении, мас.%:
РЭЧ - 0,01-0,5
Хлорид натрия - 0,9-1
Вода - до 100
Средство готовят следующим образом. Активное вещество получают описанным выше способом. Способ получения заявленной лекарственной формы включает следующую последовательность операций: растворение активного вещества и хлорида натрия в воде для инъекций с нагреванием раствора до t=50oС, стерилизующая фильтрация полученного раствора, разлив раствора во флакон и его герметизация.
Таким образом, вышеизложенные сведения свидетельствуют о выполнении при использовании заявленного изобретения следующей совокупности условий:
- фармацевтическая композиция, воплощающая заявленное изобретение (лекарственное средство) при его осуществлении, предназначено для использования в медицине, а именно, для неинъекционного применения для профилактики и лечения любых заболеваний, обусловленных нарушениями иммунологических функций;
- для заявленного лекарственного средства в том виде, как оно охарактеризовано в независимом пункте изложенной формулы изобретения, подтверждена возможность его осуществления с помощью описанных в заявке и известных до даты приоритета средств и методов;
- средство, воплощающее изобретение при его осуществлении, способно обеспечить достижение указанного технического результата: создание новой фармацевтической композиции, обладающей более эффективным противовоспалительным и иммуномодулирующим действием по сравнению с известными аналогами, не имеющей противопоказаний, а также в значительной степени обладающей узконаправленным специализированным действием, позволяющим со значительно большей вероятностью избегать побочных эффектов.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ЦИТОКИНОВОГО И ИММУНОМОДУЛИРУЮЩЕГО ДЕЙСТВИЯ | 2002 |
|
RU2222345C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ НЕВРОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2007 |
|
RU2335296C1 |
| Фармацевтическая композиция, стимулирующая иммунный ответ живого организма | 2021 |
|
RU2821633C1 |
| СПОСОБ ЛЕЧЕНИЯ АУТОИММУННЫХ СИСТЕМНЫХ ЗАБОЛЕВАНИЙ И ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2007 |
|
RU2361588C2 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО, ВКЛЮЧАЮЩЕЕ КОМБИНАЦИЮ АКТИВНЫХ ВЕЩЕСТВ, СОДЕРЖАЩУЮ ПАНТОТЕНОВУЮ КИСЛОТУ ИЛИ ЕЕ ПРОИЗВОДНЫЕ, ДЛЯ ЛЕЧЕНИЯ АЛЛЕРГИЧЕСКИХ СИМПТОМОВ | 2008 |
|
RU2472499C2 |
| ГИПОАЛЛЕРГЕННОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ИНФЕКЦИОННО-ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ РАЗЛИЧНОЙ ЭТИОЛОГИИ | 2007 |
|
RU2326688C1 |
| СПОСОБ СКРИНИНГА ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ | 1999 |
|
RU2150700C1 |
| ИММУНОМОДУЛИРУЮЩИЙ ПРЕПАРАТ | 2006 |
|
RU2294209C1 |
| СПОСОБ ЛЕЧЕНИЯ БОЛЬНЫХ ОСЛОЖНЕННЫХ ФОРМАМИ РОЖИСТОГО ВОСПАЛЕНИЯ | 2014 |
|
RU2546039C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ОСНОВЕ ТИЛОРОНА МЕСТНОГО И НАРУЖНОГО ПРИМЕНЕНИЯ ДЛЯ ЛЕЧЕНИЯ ГНОЙНО-ДЕСТРУКТИВНЫХ ПОРАЖЕНИЙ СЛИЗИСТОЙ И КОЖИ, ОБЩЕСИСТЕМНЫХ ЗАБОЛЕВАНИЙ ПРИ ИММУНОДЕФИЦИТНЫХ СОСТОЯНИЯХ | 2008 |
|
RU2401104C2 |
Изобретение относится к медицине и касается лекарственных средств, обладающих иммуномодулирующим действием, используемых для неинъекционного применения для профилактики и лечения заболеваний, обусловленных нарушениями иммунологических функций. В качестве указанного средства предлагается применение эритропоэтина. Лекарственное средство более эффективно по сравнению с известными аналогами, не имеет противопоказаний, а также в значительной степени обладает узконаправленным специализированным действием, позволяющим со значительно большей вероятностью избегать побочных эффектов. 2 табл.
Применение неинъекционной формы эритропоэтина в качестве иммуномодулятора.
| Приспособление в пере для письма с целью увеличения на нем запаса чернил и уменьшения скорости их высыхания | 1917 |
|
SU96A1 |
| ЕР 613683 А1, 07.03.1994 | |||
| ТАБЛЕТИРОВАННАЯ ФОРМА РЕКОМБИНАНТНОГО ЧЕЛОВЕЧЕСКОГО ЭРИТРОПОЭТИНА ДЛЯ ПЕРОРАЛЬНОГО ПРИМЕНЕНИЯ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 1997 |
|
RU2152206C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПРЕДСТАВЛЯЮЩАЯ МИКРОЭМУЛЬСИЮ С БИОЛОГИЧЕСКИ АКТИВНЫМ МАКРОМОЛЕКУЛЯРНЫМ МАТЕРИАЛОМ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 1989 |
|
RU2122403C1 |
Авторы
Даты
2003-02-10—Публикация
2001-03-23—Подача