Область техники, к которой относится изобретение
Изобретение относится к миелопептидам и их терапевтическому использованию.
Предпосылки изобретения
По сообщению Mikhailova с соавт., Immun. Lett. 47:199-203 (1995), и в WO-A-9618652, клетки костного мозга разных животных и человека продуцируют группу биорегуляторных пептидов, именуемых миелопептидами (MPs). MPs обладают широким спектром функциональных активностей: иммунорегуляторной, дифференцирующей и опиат-подобной. Они вызывают 2-3-кратную стимуляцию продукции антител на различные антигены и корректируют некоторые иммунные нарушения. MPs оказывают влияние на дифференциацию клеток костного мозга и периферической крови, получаемых от здоровых доноров и доноров, больных лейкозом. Они индуцируют терминальную дифференциацию в лейкозных клетках IL-60 человека и влияют на болевую чувствительность.
Если говорить точнее, Mikhailova с соавт. сообщила о двух специфических гексапептидах, т. е., FLGFPT (МР-1) и LVVYPW (МР-2), обладающих иммунорегуляторными свойствами. WO-А9618652 описывает гексапептиды, обладающие противоопухолевой активностью, формулы Y1-Y2-Y3-Tyr-Pro-Trp. Примером является МР-2.
Краткое изложение изобретения
С помощью твердофазной экстракции и HPLC из супернатанта, полученного из культуры клеток костного мозга свиньи, были выделены дополнительные пептиды. Эти новые пептиды представляют собой вид пептидов, включающих 4-10 аминокислот, в том числе Рrо-Х и/или Х-Рrо, где Х является гидрофильной аминокислотой, и которые, как правило, иным образом включают гидрофобные аминокислоты.
Эти новые пептиды обладают терапевтической применимостью. Например, они могут использоваться в тех случаях, когда необходима иммуностимуляция или противовирусная активность. В частности, они могут индуцировать производство интерферона(ов), подавлять репликацию вирусов, включая ВИЧ, создавая тем самым защитный эффект у животных, и повышают иммунную резистентность относительно бактериальной инфекции.
Описание настоящего изобретения
Как указано выше, из естественных источников были получены новые пептиды с использованием традиционных методик. Эти или другие пептиды настоящего изобретения могут быть также получены с помощью методов синтеза, которые известны рядовым специалистам в данной области, например с помощью хорошо известного твердофазного метода.
Ряд предпочтительных характеристик этих новых пептидов определены в формуле изобретения. Они могут являться тетра-, пента-, гекса-, гепта-, окта-, нона- или декапептидами. Конкретные примеры представляют собой LVCYPQ (здесь МР-3), FRPRIMTP (MP-4), VVYPD (МР-5) и VDPP (МР-6), а данные по этим пептидам приведены ниже. Как следует из результатов, эти пептиды не обладают одинаковыми характеристиками. Вместе с тем очевидно также, что можно осуществить соответствующие тесты, чтобы определить их наибольшую пригодность для какого-либо конкретного применения.
Пептиды настоящего изобретения могут быть изготовлены в виде фармацевтических композиций любого подходящего вида с использованием носителей или разбавителей, например в виде растворов или дисперсий для введения с или без адъюванта. Количество вводимого пептида можно подобрать с учетом таких факторов, как путь введения, тяжесть состояния, возраст и здоровье пациента и т. п. Квалифицированные врачи способны подобрать соответствующие количества, например, на основе эффективных доз, приведенных в нижеследующих результатах.
МР-3 стимулирует фагоцитоз макрофагов
Фагоцитоз опсонизированных эритроцитов барана (SRBC) мышиными перитонеальными макрофагами измеряли в NBT-тесте (восстановление нитросинего тетразолия супероксидными анионами, высвобождаемыми в течение окислительного всплеска). Перитонеальные клетки, полученные от мышей (CBAxC57BI)F1, помещали в лунку 96-луночного плоскодонного планшета (1•106 клеток/лунку) в среде 199. После 2 ч инкубации при 37oС в атмосфере воздуха с 5% СО2 неприлипшие клетки удаляли интенсивной промывкой теплым сбалансированным раствором Хэнкса (BSS). В каждую лунку вносили 100 мкл раствора NBT (1 мг/мл), 50 мкл 1% суспензии опсонизированных SRBC и МР-3, МР-1 или МР-2 в концентрации от 10-6 до 10-18 г/мл. Контрольные лунки не содержали MPs. Через 1 ч инкубации при 37oС клетки промывали с помощью BSS и фиксировали 10%-ным раствором формалина. Через 10 мин эти клетки промывали дистиллированной водой и сушили. Нерастворимый голубой формазан солюбилизировали добавлением вначале 60 мкл/лунку 2М КОН, а затем 70 мкл/лунку диметилсульфоксида (DMSO). Содержимое этих лунок перемешивали затем до полной солюбилизации. Полученный конечный раствор обладал интенсивной бирюзово-голубой окраской. OD620 считывали на спектрофотометре ELISA Multiskan MCC/340. Уровень фагоцитоза в каждой лунке, обработанной с помощью MPs, сравнивали с уровнем фагоцитоза контрольной лунки (100%).
В противоположность МР-1 и МР-2, МР-3 стимулирует фагоцитоз макрофагов дозозависимым образом. Полученная дозовая кривая имеет бимодальный характер. Максимальная стимуляция до 250% происходит при дозах 10-8 - 10-7 г/мл. Существует еще один пик макрофагальной стимуляции (при дозах 10-16 - 10-17 г/мл). Этот эффект менее выражен, но статистически значим (p <0,05).
Можно сделать вывод о том, что стимуляция фагоцитоза макрофагов с помощью МР-3 дает защитный эффект у инфицированных животных.
МР-3 повышает выживаемость мышей, инфицированных Salmonella typhimurium
МР-3 использовали для инокуляции мышей (CBAxC57BL)F1 1/p в дозах 0,5•10-4 г/мышь и 1•10-6 г/мышь. 24 часами позже эти мыши были заражены разными дозами Salmonella typhirium 415 (102, 103, 104 или 105 бактериальных клеток/мышь). Мышей контрольной группы инокулировали физиологическим раствором. Каждая группа содержала 10 мышей. Продолжительность жизни каждой мыши составляла в пределах 21 дня.
Выраженный защитный эффект МР-3 получили при использовании обеих доз. При уровне 100%-ной гибели в контроле (10-5 и 10-4 бактериальных клеток/мышь) выживаемость в группах, обработанных МР-3, составила 70 - 90%. При уровне 50%-ной гибели в контроле (102 бактериальных клеток/мышь) все мыши, обработанные МР-3, оставались в живых. Это дает основание полагать, что МР-3 защищает данных животных от бактериальной инфекции, обусловленной их способностью стимулировать макрофагальный фагоцитоз.
MPs индуцирует резистентность к летальной бактериальной инфекции
Острая бактериальная инфекция была индуцирована у лабораторных мышей, происходящих из (СВАхС57В1)F1 с использованием интраперитонеальной инъекции 100 LD50 Salmonella typhi, которая реально содержала 1000 микробных организмов. Данная инфекция вызывала быстро прогрессирующий сепсис и 100% гибель животных в течение 3-х дней при таком контрольном заражении.
Плацебным контрольным животным инъецировали интраперитонеально или подкожно с использованием 0,2 мл 0,85% раствора NaCl перед заражением. Затем этих животных подвергали той же процедуре инфицирования с использованием 100 LD50 S. typhi. Все контрольные животные погибли в течение 3-х дней, поскольку они были заражены сразу без предварительной обработки. Напротив, предварительная обработка мышей интраперитонеальной или подкожной инъекцией МР-3, МР-4, МР-5 или МР-6 за 24 ч до летального заражения с помощью 100 LD50 S. typhi спасла большинство животных. Защита MPs была дозозависимой.
MPs, при использовании 1 - 10 мкг доз на мышь, защищали 90 - 100% животных от последующего контрольного заражения летальной дозой Salmonella. Оба пути инъецирования, интраперитонеальное и подкожное, обнаружили полную эффективность при предварительной обработке с использованием MPs.
МР-4 индуцирует терминальную дифференциацию лейкозных клеток
Клеточная линия HL-60, полученная из клеток костного мозга пациентов с острым миелоидным лейкозом. Эти клетки представляют собой миеломонобласты, которые интенсивно пролиферируют. Они могут дифференцироваться по гранулоидному или моноцитному пути только в присутствии соответствующих стимуляторов.
Миелоидную линию HL-60 человека поддерживали в стандартной среде: среда RPMI-1640 с добавлением 15% (об./об.) инактивированной нагреванием околоплодной сыворотки теленка, 20 мМ HEPES, 2 мМ L-глутамина и 50 мкг/мл гентамицина. Начальная клеточная концентрация составила 2•105 клеток/мл. Эти клетки культивировали при 37oС в воздушной атмосфере с 5% CO2. МР-4 вносили в культуру в концентрации от 1•10-2 до 1•102 г/мл. После 3-х дней культивирования клетки промывали и повторно инкубировали в свежей культуральной среде. 3 днями позже каждую культуру метили 3H-тимидином и 14С-глицином за 4 часа до окончания культивирования. Эти клетки собирали на 6-й день культивирования и измеряли их радиоактивные ДНК (3Н) и белок (14С). В трех культуральных образцах данной культуры анализировали среднее число импульсов в мин (cpm).
Известно, что снижение синтеза хромосомной ДНК и повышение общего белкового синтеза без гистонов характерно для процесса дифференциации. По изменению соотношения включения 3H/14С можно видеть, что МР-4 индуцирует процесс дифференциации в клетках HL-60. МР-4 действует на бластоидные клетки HL-60 дозозависимо. Оптимальная доза равна 0,1 - 5,0 мкг/мл.
Морфологический анализ клеток HL-60, обработанных МР-4, подтверждает эти результаты. Среди бластоидных клеток найдено около 60% зрелых форм (моноциты-макрофаги). Дифференцирующее действие МР-4 сравнивали с действием известных дифференцирующих факторов - форбольным миристатацетатом и индуктором созревания (Т-лимфоцитный дифференцирующий фактор). Можно сделать вывод о том, что МР-4 индуцирует терминальную дифференциацию в лейкозных клетках HL-60 по моноцитному пути.
Повышение сывороточного интерферона у мышей, индуцированного с помощью MPs
Самцам неинбредных белых мышей в возрасте 1,5 - 2 месяцев, с весом тела 18 - 20 г, инъецировали в перитонеальную полость однократную дозу МР-3, МР-4, МР-5 или МР-6: 0,01, 0,1, 1 или 10 мкг (на мышь). Каждая экспериментальная группа животных была представлена 25 мышами, получивших одну и ту же дозу препарата. Через 4, 24, 48, 72 или 96 ч после инъекции, забивали 5 мышей из каждой экспериментальной группы, их сывороточные образцы объединяли и хранили замороженными при -60oС до измерения в данной объединенной сыворотке активности интерферона. Это последнее измерение осуществляли для тестирования сывороточной противовирусной активности в культурах клеток in vitro, инфицированных вирусом энцефаломиокардита (EMV).
Более подробно, клеточные культуры фибробластоидной клеточной линии L929 выращивали в культуральной среде альфа-МЕМ с добавлением 10% FBS. Культуры из 200000 клеток, суспендированные в 0,1 мл культуральной среде, помещали в лунки 96-луночного микропланшета и инкубировали в атмосфере с 5% СО2 при 37oС. Клеточные культуры L929 инфицировали с использованием 100 TCIC50-дозы адаптированного лабораторного штамма ЕМV. Цитопатологические нарушения клеточной морфологии регистрировали через 24 ч после инфекции.
Последовательное разведение фактора 2 в каждом сывороточном образце осуществляли с использованием культуральной среды альфа-МЕМ, содержащей FBS. 0,1 мл определенного разведения сывороточного образца вносили в каждую микролунку, содержащую клеточную культуру L929, в момент ее инфицирования с помощью EMV.
Зарегистрировано наибольшее разведение сыворотки, обеспечивающее 50%-ное подавление вирусной инфекции при наблюдении за нарушениями в клетках L929, вызванными в течение 24 ч EMV. Противоположное значение такого наибольшего разведения брали в качестве титра интерферона в сыворотке, представленного в единицах/мл.
В контрольных группах мышей использовали наиболее сильный из известных индукторов интерферона. А именно, вирус ньюкаслской болезни (NDS) и Ридостин использовали в качестве положительного контроля для сравнения с MPs по их повышающей активности интерферона в сыворотке.
При однократной инъекции 0,1 мкг МР-4 в мышиной сыворотке наблюдали две фазы явного повышения раннего (4 ч) и позднего (48 ч) интерферона, которые достигали уровней в 40 и 80 единиц/мл сывороточного интерферона.
Однократная инъекция 0,01 мкг МР-5 приводила к очень сильному повышению позднего (48 ч) сывороточного интерферона. Титры сывороточного интерферона достигали значения 320 единиц/мл, уровня, характерного для Ридостина, одного из известных сильнейших индукторов интерферона.
МР-3 и МР-6 слабо индуцировали поздний интерферон в мышиной сыворотке. Уровни в 20 и 40 единиц/мл достигали, соответственно, через 48 ч после однократной инъекции 1 - 10 мкг МР-3 и 0,1 - 1 мкг МР-6.
Противовирусная активность MPs in vitro
Обладая способностью индуцировать увеличение сывороточного интерферона in vivo, MPs, по всей видимости, индуцируют синтез интерферона в соответствующей клеточной культуре in vitro. Если это так, тогда можно проследить противовирусное действие этих соединений на клеточную культуру in vitro, которая инфицирована активно реплицирующимся вирусом.
In vitro культуру мышиных клеток L929, резко инфицированную вирусом энцефаломиокардита (EMV), использовали в качестве модели для установления активных концентраций МР-3, МР-4, МР-5 и МР-6, что касается их способности индуцировать синтез интерферона в клетках млекопитающих и, следовательно, блокировать вирусную инфекцию в этих клетках. Мышиную фибробластоидную клеточную линию L929 поддерживали in vitro, как описано выше. МР-3, МР-4, МР-5 и МР-6 вносили в тройные культуры с использованием следующих конечных концентраций: 500, 250, 125, 63, 31, 16, 8, 4, 2, 1, 0,5, 0/25 мкг на 1 мл культуры. Ридостин использовали в качестве контрольного индуктора интерферона.
Через 24 или 48 ч после инъекции культуры клеток L929 инфицировали с помощью 100 TCID50 EMV. В течение следующих 24 ч данная вирусная инфекция вызывала в клетках L929 резкие нарушения. Если данные культуры предварительно инкубировали в присутствии МР-3, он не защищал получаемые клеточные слои от обширного нарушения, обусловленного последующей вирусной инфекцией с использованием 100 TCID50 EMV. Напротив, МР-5, при добавлении в конечной концентрации 16 мкг/мл или больше, полностью аннулировал деструктивное влияние данного вируса на клетки L929. Так же действует и МР-6 при добавлении в концентрации 4 мкг/мл или больше. Противовирусный эффект МР-5 и МР-6 вполне сравним с действием Ридостина, добавляемого при 0,5 мкг/мл или больше. МР-4 также защищает клетки L929 от нарушений, индуцированных вирусом, через 48 ч выдерживания данных клеток в присутствии 32 мкг/мл (или более высокой концентрации) данного препарата перед их контрольным заражением данным вирусом.
Индукция интерферона в in vitro клетках человека с помощью MPs
Возможности MPs индуцировать интерферон исследовали на культурах клеточной линии L41 человека и клетках периферической крови (РВС) доноров. Клетки L-41 поддерживались в среде 199 с добавлением 10% FBS и антибиотиков. 200000 клеток на 1 мл культуральной среды помещали в лунки 24-луночных пластиковых культуральных планшетов и выращивали при 37oС в атмосфере с 5% СО2. После образования клеточного монослоя в эти культуры, желательно центрированные, интродуцировали контрольные и экспериментальные индукторы интерферона. Через 24 ч после индукции интерфероном собирали культуральные супернатанты и анализировали их на содержание интерферона.
РВС здоровых доноров инкубировали в лунках 96-луночных культуральных планшетов и культуральные супернатанты собирали через 24 часа после внесения в данную культуру испытуемого препарата.
Для измерения активности интерферона в собранных супернатантах готовили последовательные разведения полученных супернатантов и затем вносили их в свежие культуры L-41, инфицированные с использованием 100 TCID50 EMV. В этих супернатантах регистрировали титр интерферона, как описано выше для титрования интерферона мышиной сыворотки в культурах мышиных клеток L929.
1 мкг/мл МР-3 индуцировал интенсивное образование интерферона в человеческих клетках, как в L41, так и в донорных РВС. 0,01 мкг/мл МР-4 демонстрирует индукцию синтеза интерферона, сопоставимого с действием МР-3 в клетках L-41. МР-5 в небольших дозах (0,001 мкг/мл индуцирует образование интерферона в донорных РВС, а в больших дозах (1 мкг/мл) он активен в клетках L-41. MP-6 индуцирует относительно небольшие количества интерферона и в L-41 и в донорных РВС.
In vitro ингибирование ВИЧ с помощью Mps
Противовирусную активность МР-3, МР-4, МР-5 и MP-6 анализировали с использованием in vitro культуры клеток МТ4 лимфобластоидной Т-клеточной линии человека, инфицированной с помощью ВИЧ. В качестве источника инфицирующего вируса использовали лабораторный вирусный штамм НТ ВИЧ 27. Он обладает способностью вызывать хроническую ВИЧ-инфекцию с образованием неповрежденных инфекционных частиц ВИЧ-1 в in vitro клетках МТ4.
Интенсивность ВИЧ-инфекции и соответствующее противо-ВИЧ действие MPs оценивали в соответствии с нижеследующими критериями:
(a) изменения морфологии нормальных клеток МТ4, индуцированных ВИЧ (цитопатогенный эффект);
(b) обнаружение ВИЧ-антигенов в инфицированных клетках МТ4 с использованием люминесцентной микроскопии данных клеток, предварительно помеченных флуоресцентными антителами анти-ВИЧ;
(c) выявление белков ВИЧ в ВИЧ-инфицированных в культуральной среде клеток МТ4 с использованием иммунофлуоресценции.
Клетки МТ4, инфицированные ВИЧ, инкубировали в культуральной среде RPMI-1640 с добавлением 10% FBS и 2 мл L-глутамина. Клетки МТ4 (0,5 миллиона клеток на 1 мл культуральной среды) помещали в лунки 24-луночных пластиковых культуральных планшетов и держали 7 дней при 37oС в атмосфере с 4,5 СО2. Каждый из анализируемых MPs вносили в соответствующие лунки в конечной концентрации 0,1, 0,5, 1, 5, 10, 50 и 100 мкг на 1 мл используемой культуры. Азидотимидин (Sigma Chemical Co.) в конечной концентрации 0,1 мкг/мл использовали в качестве положительного противовирусного контроля в каждом эксперименте.
Тестирование на стандартную клеточную жизнеспособность осуществляли после 24 ч культивирования с МР-3, МР-4, МР-5 и МР-6, не вызывающих видимого повреждения клеток МТ4, выращиваемых in vitro. С этими четырьмя соединениями наиболее выраженную анти-ВИЧ активность наблюдали у МР-3. В присутствии 1 - 5 мкг/мл или более высокой концентрации МР-3 репликация HIV полностью прекращалась: в таких культурах цитопатогенный эффект или образование вирусного белка не регистрировались, 50%-ное подавление репликации ВИЧ наблюдали в присутствии 10 мкг/мл МР-4. МР-5 и МР-6 не оказывали влияния на репликацию ВИЧ в культурах клеток in vitro. Азидотимидин (0,1 мкг/мл) вызывает 100%-ное подавление репликации ВИЧ в инфицированных клетках МТ-4.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
(1) ОБЩИЕ СВЕДЕНИЯ:
(i) ЗАЯВИТЕЛЬ:
(A) ИМЯ: Primamedic Ltd.
(B) УЛИЦА: 66 Reagents Park Road
(C) ГОРОД: Лондон
(D) ШТАТ: N/A
(Е) СТРАНА: Соединенное Королевство
(F) ПОЧТОВЫЙ КОД (ZIP): NW1 7SX
(ii) НАЗВАНИЕ ИЗОБРЕТЕНИЯ: МИЕЛОПЕПТИДЫ И ИХ ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ
(iii) КОЛИЧЕСТВО ПОСЛЕДОВАТЕЛЬНОСТЕЙ: 6
(iv) ФОРМА КОМПЬЮТЕРНОГО ПРОЧТЕНИЯ:
(A) ТИП НОСИТЕЛЯ ДАННЫХ: Мягкий диск
(B) КОМПЬЮТЕР: совместимый с персональными компьютерами фирмы IBM
(C) ОПЕРАЦИОННАЯ СИСТЕМА: PS-DOS/MS-DOS
(D) ПРОГРАММНОЕ ОБЕСПЕЧЕНИЕ: Patentin Release #1.0, Version #1.30 (EPO)
(vi) ТЕКУЩИЕ ДАННЫЕ ПО ЗАЯВКЕ:
(А) НОМЕР ЗАЯВКИ: еще не известен WO
(2) СВЕДЕНИЯ О SEQ ID NO: 1:
(i) ХАРАКТЕРИСТИКИ ПОСЛЕДОВАТЕЛЬНОСТИ:
(A) ДЛИНА: 6 аминокислот
(B) ВИД: аминокислота
(C) СТРУКТУРА ЦЕПИ: одиночная
(D) ТОПОЛОГИЯ: линейная
(ii) ВИД МОЛЕКУЛЫ: пептид
(xi) ОПИСАНИЕ ПОСЛЕДОВАТЕЛЬНОСТИ: SEQ ID NO: 1: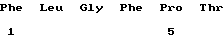
(2) СВЕДЕНИЯ О SEQ ID NO: 2:
(i) ХАРАКТЕРИСТИКИ ПОСЛЕДОВАТЕЛЬНОСТИ:
(A) ДЛИНА: 6 аминокислот
(B) ВИД: аминокислота
(C) СТРУКТУРА ЦЕПИ: одиночная
(D) ТОПОЛОГИЯ: линейная
(ii) ВИД МОЛЕКУЛЫ: пептид
(xi) ОПИСАНИЕ ПОСЛЕДОВАТЕЛЬНОСТИ: SEQ ID NO: 2: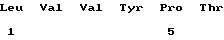
(2) СВЕДЕНИЯ О SEQ ID NO: 3:
(i) ХАРАКТЕРИСТИКИ ПОСЛЕДОВАТЕЛЬНОСТИ:
(A) ДЛИНА: 6 аминокислот
(B) ВИД: аминокислота
(C) СТРУКТУРА ЦЕПИ: одиночная
(D) ТОПОЛОГИЯ: линейная
(ii) ВИД МОЛЕКУЛЫ: пептид
(xi) ОПИСАНИЕ ПОСЛЕДОВАТЕЛЬНОСТИ: SEQ ID NO: 3: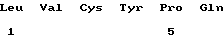
(2) СВЕДЕНИЯ О SEQ ID NO: 4:
(i) ХАРАКТЕРИСТИКИ ПОСЛЕДОВАТЕЛЬНОСТИ:
(A) ДЛИНА: 8 аминокислот
(B) ВИД: аминокислота
(C) СТРУКТУРА ЦЕПИ: одиночная
(D) ТОПОЛОГИЯ: линейная
(ii) ВИД МОЛЕКУЛЫ: пептид
(xi) ОПИСАНИЕ ПОСЛЕДОВАТЕЛЬНОСТИ: SEQ ID NO: 4: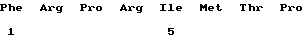
(2) СВЕДЕНИЯ О SEQ ID NO: 5:
(i) ХАРАКТЕРИСТИКИ ПОСЛЕДОВАТЕЛЬНОСТИ:
(A) ДЛИНА: 5 аминокислот
(B) ВИД: аминокислота
(C) СТРУКТУРА ЦЕПИ: одиночная
(D) ТОПОЛОГИЯ: линейная
(ii) ВИД МОЛЕКУЛЫ: пептид
(xi) ОПИСАНИЕ ПОСЛЕДОВАТЕЛЬНОСТИ: SEQ ID NO: 5:
(2) СВЕДЕНИЯ О SEQ ID NO: 6:
(i) ХАРАКТЕРИСТИКИ ПОСЛЕДОВАТЕЛЬНОСТИ:
(A) ДЛИНА: 4 аминокислот
(B) ВИД: аминокислота
(C) СТРУКТУРА ЦЕПИ: одиночная
(D) ТОПОЛОГИЯ: линейная
(ii) ВИД МОЛЕКУЛЫ: пептид
(xi) ОПИСАНИЕ ПОСЛЕДОВАТЕЛЬНОСТИ: SEQ ID NO: 6:
Val Asp Pro Pro
1
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛО, СПЕЦИФИЧНО СВЯЗЫВАЮЩЕЕСЯ С ИЗОЛИРОВАННЫМ ПЕПТИДОМ, ОБРАЗОВАННЫМ ИЗ ВИМЕНТИНА, ИЛИ СВЯЗЫВАЮЩИЙСЯ С ЭТИМ ПЕПТИДОМ ФРАГМЕНТ | 2016 |
|
RU2705899C2 |
| ПРОТИВООПУХОЛЕВЫЕ И АНТИВИРУСНЫЕ ПЕПТИДЫ | 2004 |
|
RU2267496C2 |
| СПОСОБ ИНГИБИРОВАНИЯ РЕПЛИКАЦИИ ВИЧ В КЛЕТКАХ МЛЕКОПИТАЮЩИХ И У ЛЮДЕЙ | 2011 |
|
RU2593948C2 |
| ИММУНОМОДУЛИРУЮЩИЕ И ПРОТИВООПУХОЛЕВЫЕ ПЕПТИДЫ | 2007 |
|
RU2430109C2 |
| ПЕПТИДЫ СО СПОСОБНОСТЬЮ СВЯЗЫВАТЬСЯ СО СКУРФИНОМ И ИХ ПРИМЕНЕНИЕ | 2008 |
|
RU2502741C2 |
| Иммуногенная композиция, включающая синтетические пептиды, повторяющие последовательности V3-петли оболочечного белка gp120 ВИЧ1 | 2017 |
|
RU2694576C2 |
| ИММУНОГЕНЫ ДЛЯ ВАКЦИНАЦИИ ПРОТИВ ВИЧ | 2013 |
|
RU2648791C2 |
| ПЕПТИД | 2014 |
|
RU2667428C2 |
| ПЕПТИДЫ | 2014 |
|
RU2676149C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ИСПОЛЬЗОВАНИЯ ПЕПТИДОВ НЕОГЕНЕЗА ОСТРОВКОВ И ИХ АНАЛОГОВ | 2014 |
|
RU2685958C2 |
Изобретение относится к пептидам-иммунорегуляторам и их терапевтическому использованию. Новые пептиды представляют собой вид пептидов, включающих 4-8 аминокислот. Пептиды настоящего изобретения могут быть изготовлены в виде фармацевтических композиций любого подходящего вида с использованием носителей или разбавителей. Лекарственное средство, содержащее новые пептиды, предназначено для лечения или профилактики вирусной или бактериальной инфекции или заболевания, нуждающегося в иммуностимуляции. Новое лекарственное средство расширяет арсенал средств аналогичного назначения. 7 с.п. ф-лы.
| US 5786334, 28.07.1998 | |||
| WO 9618652, 20.06.1996 | |||
| PETROV R, Myelopeptides: new immunoregulatory peptides, Allergy Proc, 1995 Jul-Aug; 16(4): 177-84 | |||
| SHANURIN SIu, BELEVSKAIA RG, MIKHAILOVA AA, SHANURIN MIu, The immunocorrective activity of myelopeptide1 and myelopeptide-2 in cyclophosphane-treated mice, Eksp Klin Farmakol, 1995, Sep-Oct; 58(5): 53-6 | |||
| MIKHAILOVA AA, SHANURIN SY, PETROV RV, Immunoregylatory effects of two bone-marrow hexapeptides (myelopeptides) in experimental modes of immunodeficiency, Immunol Lett, 1995, Sep; 47 (3): 199-203 | |||
| СРЕДСТВО ДЛЯ КОРРЕКЦИИ ДИСФУНКЦИЙ НЕЙТРОФИЛЬНЫХ ГРАНУЛОЦИТОВ | 1995 |
|
RU2112513C1 |
Авторы
Даты
2003-02-10—Публикация
1998-01-07—Подача