ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
[0001] Настоящее изобретение в целом относится к области медицины и фармацевтики и, более конкретно, к пептидной терапии для лечения диабета и других заболеваний.
[0002] От сахарного диабета (DM) страдает более 300 миллионов людей по всему миру. Существует два основных типа DM: DM 1-го типа (T1D) и DM 2-го типа (T2D). T1D является результатом неспособности организма продуцировать инсулин и требует, чтобы пациент вводил инсулин ежедневно. T2D является результатом резистентности к инсулину, состояния, при котором клетки не способны использовать инсулин должным образом. Существует множество одобренных способов неинсулиновой терапии для T2D. Однако большой части пациентов с T2D на поздней стадии требуется введение инсулина из-за утраты функции β-клетками по мере развития заболевания.
[0003] Развитие диабета связано с существенной потерей массы панкреатических островков. В момент диагностирования более 90% массы островков утрачено у пациентов с T1D и приблизительно 50% утрачено у пациентов с T2D. Предпринято множество попыток в поисках возможного стимула для неогенеза островков, который считают оптимальным лечением как для T1D, так и для T2D.
[0004] В последнее время исследователи показали, что островковый неогенез-ассоциированный белок (INGAP) хомяка, проостровковый пептид человека (HIP), глюкагоноподобный пептид-1 (GLP-1), островковый эндокринный нейропептид вазоактивный пептид кишечника (VIP), эпидермальный фактор роста и гастрин, а также другие, способны индуцировать панкреатические клетки-предшественники, расположенные в неэндокринной части поджелудочной железы, к дифференциации в полностью функциональные островки в различных животных моделях. Среди этих соединений для пептида INGAP (INGAP-PP), который представляет собой 15-членный пептид, полученный из аминокислот 104-118 последовательности INGAP, показано, что он индуцирует неогенез островков во многих животных моделях, обращает индуцированный стрептозотоцином (STZ) диабет у мышей, увеличивает секрецию C-пептида в пациентов с T1D и усовершенствует управление гликемией у пациентов с T2D. Сообщалось о дополнительных биологических эффектах INGAP-PP, которые включают дозозависимую стимуляцию роста β-клеточной массы, репликации β-клеток, сниженный апоптоз β-клеток и увеличенную секрецию инсулина. В исследованиях у человека имел место эффект усовершенствования гомеостаза глюкозы, который подтверждали снижением HbA1c за 90 суток у пациентов с T2D и значительным увеличением секреции C-пептида у пациентов с T1D. Однако короткое время полужизни INGAP-PP в плазме и необходимость вводить в больших дозах значительно ограничивает клиническое применение этого пептида.
[0005] HIP, биоактивный пептид, кодируемый частью гена регенерирующих островков 3α (REG3A) человека, представляет собой человеческий гомолог пептида INGAP. Предыдущие исследования показали, что лечение тканей протоков поджелудочной железы человека с использованием HIP стимулировало продукцию инсулина. Введение HIP усовершенствовало управление гликемией и увеличивало число островков у мышей с диабетом. Стабилизированную форму HIP тестировали в одном клиническом исследовании с возрастающей дозой с целью исследования переносимости, безопасности и фармакокинетики. Подобно INGAP-PP, необходима высокая доза HIP, что, таким образом, значительно ограничивает клиническое применение исходного пептида HIP.
[0006] Таким образом, существует необходимость создания дополнительных лекарственных средств для лечения диабета или других заболеваний, связанных с ослабленной функцией поджелудочной железы. Настоящее изобретение направлено на эту необходимость и также предусматривает связанные преимущества.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0007] Изобретение относится к пептидам и аналогам пептидов INGAP и HIP. Пептиды и аналоги можно использовать для лечения различных заболеваний и состояний, связанных с ослабленной функцией поджелудочной железы, лечения метаболических заболеваний, включая диабет, как 1-го типа, так и 2-го типа, преддиабет и метаболический синдром. Пептиды и аналоги также можно использовать для индукции островков, роста и пролиферации для трансплантации, содействия нейропротекции, содействия регенерации нервов, содействия регенерации печени и ингибирования воспаления.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
[0008] На фиг. 1 представлено сравнение пролиферации клеток ARIP (клеточная линия протоков поджелудочной железы крысы) в присутствии 100 нМ рандомизированного INGAP PP 1 (пептид 3), INGAP-PP (пептид 1) и выбранного пептидного аналога, пептида 7 (см. таблицу 2).
[0009] На фиг. 2 представлено сравнение стабильности в культуральной среде для INGAP-PP (пептид 1) и выбранных пептидных аналогов, пептида 7 и пептида 8 (см. таблицу 2).
[0010] На фиг. 3 представлено сравнение стабильности в плазме мыши для INGAP-PP (пептид 1) и выбранных пептидных аналогов, пептида 12, пептида 16 и пептида 29 (см. таблицу 2).
[0011] На фиг. 4 представлено сравнение стабильности в плазме человека для INGAP-PP (пептид 1) и выбранных пептидных аналогов, пептида 12 и пептида 16 (см. таблицу 2).
[0012] На фиг. 5 представлено сравнение стабильности в плазме мыши для HIP (пептид 2) и выбранных пептидных аналогов, пептида 52 и пептида 54 (см. таблицу 3).
[0013] На фиг. 6A-6C представлено сравнение эффективности для INGAP-PP (пептид 1), рандомизированного INGAP PP 1 (пептид 3) и выбранного пептидного аналога, пептида 7 (см. таблицу 2) в модели индуцированного STZ диабета на мышах. Фиг. 6 A: глюкоза крови (BG) после лечения в течение 21 суток; фиг. 6B: уровни инсулина натощак после лечения в течение 21 суток; фиг. 6C: площадь под кривой (AUC) для глюкозы, измеряемой в оральном тесте на толерантность к глюкозе (OGTT) после лечения в течение 21 суток.
[0014] На фиг. 7 представлено число островков, определяемое с помощью диапазонов площади (произвольные морфометрические единицы) для равный случайно выбранных полей (n>7) у животных, которых лечили интактным пептидом и пептидом 3, пептидом 1 или пептидом 7.
[0015] На фиг. 8 представлено увеличение стимулируемой глюкозой секреции инсулина островками с или без совместной инкубации с выбранными пептидами (10 мкг/мл), пептидом 12, пептидом 16 и пептидом 1 (см. таблицу 2). Совместную инкубацию с 100 мкМ глюкагоноподобного пептида-1 (GLP-1) включали в качестве положительного контроля.
[0016] На фиг. 9A-9C представлен биологический эффект введения INGAP-PP или аналогов INGAP-PP. На фиг. 9A представлено число дополнительных островковых кластеров (EIC) у самок мышей C57BL/6J после 10 суток лечения. На фиг. 9B представлена общая площадь EIC у самок мышей C57BL/6J после 10 суток лечения. На фиг. 9C представлен репрезентативный EIC, ассоциированный с протоком, в поджелудочной железе после введения пептида INGAP-PP или аналога INGAP-PP.
[0017] На фиг. 10 представлен эффект пептида INGAP-PP и аналогов INGAP-PP, оказываемый на неогенез островков, как отражено с помощью распределения размеров панкреатических островков.
[0018] На фиг. 11 представлена стабильность INGAP-PP и аналогов INGAP-PP в культуре.
[0019] На фиг. 12 представлена стабильность INGAP-PP и аналогов INGAP-PP в плазме крысы.
[0020] На фиг. 13 представлена стабильность HIP и аналогов HIP в плазме крысы.
[0021] На фиг. 14 представлена стабильность INGAP-PP и аналога INGAP-PP в плазме мыши.
[0022] На фиг. 15 представлена стабильность INGAP-PP и аналогов INGAP-PP в плазме человека.
[0023] На фиг. 16 представлена репрезентативная кривая высвобождения INGAP-PP (пептид 1) in vitro в гидрогеле, содержащем Pluronic F127.
[0024] На фиг. 17 представлена репрезентативная кривая высвобождения INGAP-PP (пептид 1) in vitro в гидрогеле, содержащем Jeffamine ED-2003.
[0025] На фиг. 18 представлена репрезентативная кривая высвобождения INGAP-PP (пептид 1) in vitro в гелевой системе SABER.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0026] Настоящее изобретение предусматривает соединения, в частности, пептид и пептидные аналоги, которые проявляют свойства, полезные для лечения различных заболеваний и состояний, в частности, заболеваний и состояний, связанных с диабетом. Пептиды и аналоги по изобретению дополнительно используют для лечения ослабленной функции поджелудочной железы, лечения метаболических заболеваний, индукции островков ex vivo, роста и пролиферации для трансплантации, увеличения выживаемости трансплантированных островков in vivo, содействия нейропротекции или регенерации нервов, содействия регенерации печени и ингибирования воспаления.
[0027] Как описано в настоящем документе, настоящее изобретение предусматривает ряд аналогов INGAP-PP и HIP со сравнимой или усовершенствованной стабильностью и активностями по сравнению пептидами с дикого типа (см. таблицы 2 и 3). Усовершенствованны фармацевтические свойства этих пептидных аналогов делают их особенно подходящими для клинических исследований. Настоящее изобретение также относится к фармацевтическим композициям, которые содержат соединение в соответствии с настоящим изобретением, и использованию соединений в соответствии с настоящим изобретением для получения лекарственных средств для лечения метаболических заболеваний, включая в качестве неограничивающих примеров диабет 1-го типа (TID) и диабет 2-го типа (T2D). Изобретение дополнительно предусматривает композиции по изобретению в подходящих составах, включая составы с замедленным высвобождением.
[0028] Как описано ранее, идентифицировали белок хомяка, который способствовал неогенезу панкреатических островков и который назван островковый неогенез-ассоциированный белок (INGAP) (см. патент США № 5834590). Описан пентадекапептидный фрагмент INGAP, обозначаемый в настоящем документе как INGAP-PP, у которого выявлена способность обращать диабет в модели на мышах (Rosenberg et al, Ann. Surg. 240:875-884 (2004); публикация США 2006/0009516; см. также публикацию США 2008/0171704; Kapur et al, Islets 4: 1-9 (2012); Chang et al, Mol. Cell. Endocrinol. 335: 104-109 (2011); Borelli et al, Regulatory Peptides 131:97-102 (2005); Dungan et al, Diabetes/Metabolism Res. Rev. 25:558-565 (2009); Zha et al, J. Endocrinol. Invest. 35:634-639 (2012); Wang et al, J. Cell. Physiol. 224:501-508 (2010); Petropavlovskaia et al, J. Endocrinol. 191:65-81 (2006); Taylor- Fishwick et al, Pancreas 39:64-70 (2010); Rosenberg, Diabetologia 39:256-262 (1996); Madrid et al, Regulatory Peptides 157:25-31 (2009); и Taylor-Fishwick et al, J. Endocrinol. 190:729-737 (2006)). Также описан пептид человека, называемый проостровковым пептидом человека (HIP), (Levetan et al, Endocrin. Pract. 14: 1075-1083 (2008); публикация США 2011/0280833). Настоящее изобретение предусматривает аналоги пептидов INGAP-PP и HIP, включая в качестве неограничивающих примеров те, которые перечислены в таблицах 2 и 3, или другие, описанные в настоящем документе, включая формулы, описанные в настоящем документе, которые не являются исходными пептидами INGAP-PP или HIP. Пептиды и аналоги по изобретению проявляются неожиданные и благоприятные свойства по отношению к исходным пептидам INGAP-PP или HIP.
[0029] Как используют в настоящем документе, термин «пептид» относится к полимеру из двух или более аминокислот. Пептид можно модифицировать, чтобы он содержал аналоги, производные, функциональные миметики, псевдопептиды и т.п., при условии, что пептид содержит полимер по меньшей мере из двух аминокислот. Значение термина «пептид» хорошо известно специалистам в данной области. В целом, пептид содержит две или более аминокислот, соединенных амидной связью между карбоксильной группой одного аминокислотного остатка и аминогруппой смежного аминокислотного остатка. Как описано в настоящем документе, пептид может содержать встречающиеся в природе аминокислоты или не встречающиеся в природе аминокислоты.
[0030] Как используют в настоящем документе, термин «аналог» относится к варианту исходной молекулы, например, исходного пептида. Например, аналог исходного пептида может включать вариант, где одну или несколько аминокислоты заменяют относительно исходного пептида. Аналог также может включать модификацию исходного пептида, включая в качестве неограничивающих примеров не встречающиеся в природе аминокислоты, D аминокислоты, модифицированные амино- и/или карбоксиконцевые (N- или C-концевые) аминокислоты, в частности, модификации аминогруппы на N-конце и/или модификации карбоксильной группы на C-конце, модификации жирных кислот, этерификация, пептидомиметики, псевдопептиды и т.п., как описано в настоящем документе. Образцовые модификации описаны более подробно далее.
[0031] Как используют в настоящем документе, фраза «ослабленная функция поджелудочной железы» относится к заболеванию или состоянию, связанному с поджелудочной железой, где поджелудочная железа проявляет пониженную функцию по сравнению с функцией у нормального или здорового индивидуума. Образцовые заболевания или состояния, связанные с ослабленной функцией поджелудочной железы включают, но не ограничиваясь этим, диабет 1-го типа, диабет 2-го типа, латентный аутоиммунный диабет у взрослых (LADA), пониженную глюкозу натощак, пониженную толерантность к глюкозе, дефицит инсулина, гиперинсулинемию натощак, резистентность к инсулину, пониженные уровни инсулина натощак, частичную панкреатомию из-за повреждения или воспаления или их сочетание. Такие заболевания и состояния рассмотрены более подробно далее.
[0032] Как описано в настоящем документе, изобретение относится к пептидным аналогам пептидов INGAP-PP и HIP. В таблице 1 представлены последовательности пептидов INGAP-PP и HIP, а также различных рандомизированных версий пептидов, которые используют в качестве отрицательных контролей в экспериментах, описанных в настоящем документе, или которые можно использовать в качестве отрицательных контролей в сравнительных исследованиях с использованием INGAP-PP, HIP или пептидных аналогов по изобретению.
Пептиды INGAP-PP и HIP и контрольные рандомизированные пептиды.
[0033] Как описано в настоящем документе, различные аналоги INGAP-PP предоставлены в качестве пептидов или аналогов по изобретению. Образцовые пептидные аналоги INGAP-PP по изобретению предусмотрены в таблице 2.
Образцовые аналоги INGAP-PP.
[0034] Как описано в настоящем документе, различные аналоги HIP предоставлены в качестве пептидов или аналогов по изобретению. Образцовые пептидные аналоги HIP по изобретению предоставлены в таблице 3.
Образцовые аналоги HIP.
[0035] Изобретение относится к пептидам или их аналогам, которые представляют собой аналоги INGAP-PP. В одном из вариантов осуществления изобретение относится к пептиду или его аналогу, который содержит последовательность, выбранную из группы, состоящей из IGLHDPSHGTLPAGS (SEQ ID № 7); и IGLHDPSHGTLPAG (SEQ ID № 73). Например, пептид или аналог может содержать пептид или аналог, выбранный из: IGLHDPSHGTLPAGS (SEQ ID № 7); IGLHDPSHGTLPAG (SEQ ID № 73); IGLHDPSHGTLPAGSK (SEQ ID № 9); IGLHDPSHGTLP(Aib)GS (SEQ ID № 10); IGLHDPSHGTLP(N-метил-L-Ala)GS (SEQ ID № 11); Ac-IGLHDPSHGTLPAGS (SEQ ID № 12); (D-Ile)GLHDPSHGTLPAGS (SEQ ID № 13); (L-NorVal)GLHDPSHGTLPAGS (SEQ ID № 14); (L-NorLeu)GLHDPSHGTLPAGS (SEQ ID № 15); IGLHDPSHGTLPAG-NH2 (SEQ ID № 28); Ac-IGLHDPSHGTLPAGS-NH2 (SEQ ID № 29); Ac-IGLHDPSHGTLPAG-NH2 (SEQ ID № 30); IGLHDPSHGTLPAGS-NH2 (SEQ ID № 41); IGLHDPSHGTLPAGSC (SEQ ID № 42); Ac-IGLHDPSHGTLPAGSC (SEQ ID № 43); IGLHDPSHGTLPAGSC-NH2 (SEQ ID № 44); Ac-IGLHDPSHGTLPAGSC-NH2 (SEQ ID № 45); IGLHDPSHGTLPAGC (SEQ ID № 46); Ac-IGLHDPSHGTLPAGC (SEQ ID № 47); IGLHDPSHGTLPAGC-NH2 (SEQ ID № 48); и Ac-IGLHDPSHGTLPAGC-NH2 (SEQ ID № 49).
[0036] В конкретном варианте осуществления изобретения, пептид или его аналог может состоять из: IGLHDPSHGTLPAGS (SEQ ID № 7); IGLHDPSHGTLPAG (SEQ ID № 73); IGLHDPSHGTLPAGSK (SEQ ID № 9); IGLHDPSHGTLP(Aib)GS (SEQ ID № 10); IGLHDPSHGTLP(N-метил-L-Ala)GS (SEQ ID № 11); Ac-IGLHDPSHGTLPAGS (SEQ ID № 12); (D-Ile)GLHDPSHGTLPAGS (SEQ ID № 13); (L-NorVal)GLHDPSHGTLPAGS (SEQ ID № 14); (L-NorLeu)GLHDPSHGTLPAGS (SEQ ID № 15); IGLHDPSHGTLPAG-NH2 (SEQ ID № 28); Ac-IGLHDPSHGTLPAGS-NH2 (SEQ ID № 29); Ac-IGLHDPSHGTLPAG-NH2 (SEQ ID № 30); IGLHDPSHGTLPAGS-NH2 (SEQ ID № 41); IGLHDPSHGTLPAGSC (SEQ ID № 42); Ac-IGLHDPSHGTLPAGSC (SEQ ID № 43); IGLHDPSHGTLPAGSC-NH2 (SEQ ID № 44); AC-IGLHDPSHGTLPAGSC-NH2 (SEQ ID № 45); IGLHDPSHGTLPAGC (SEQ ID № 46); Ac-IGLHDPSHGTLPAGC (SEQ ID № 47); IGLHDPSHGTLPAGC-NH2 (SEQ ID № 48); или Ac-IGLHDPSHGTLPAGC-NH2 (SEQ ID № 49).
[0037] В другом варианте осуществления изобретения предоставлены дополнительные аналоги INGAP-PP. Вариант осуществления изобретения, предусмотренный в настоящем документе, содержит пептид или его аналог, который содержит пептид или аналог, выбранный из группы, состоящей из: Ac-IGLHDPSHGTLPNGS (SEQ ID № 16); (D-Ile)GLHDPSHGTLPNGS (SEQ ID № 17); Ac-IGLHDPSHGTLPNGS-NH2 (SEQ ID № 31); IGLHDPSHGTLPNGS-NH2 (SEQ ID № 32); IGLHDPSHGTLPNGSC (SEQ ID № 33); Ac-IGLHDPSHGTLPNGSC (SEQ ID № 34); IGLHDPSHGTLPNGSC-NH2 (SEQ ID № 35); Ac-IGLHDPSHGTLPNGSC-NH2 (SEQ ID № 36); IGLHDPSHGTLPNGC (SEQ ID № 37); Ac-IGLHDPSHGTLPNGC (SEQ ID № 38); IGLHDPSHGTLPNGC-NH2 (SEQ ID № 39); Ac-IGLHDPSHGTLPNGC-NH2 (SEQ ID № 40); IGLHDPSHGTLPNG (SEQ ID № 74); Ac-IGLHDPSHGTLPNG (SEQ ID № 75); IGLHDPSHGTLPNG-NH2 (SEQ ID № 76); Ac-IGLHDPSHGTLPNG-NH2 (SEQ ID № 77); H-IGLHDPSHGTLPQGS-OH (SEQ ID № 78); H-IGLHDPSHGTLPDGS-OH (SEQ ID № 79); H-IGLHDPSHGTLPEGS-OH (SEQ ID № 80); H-IGLHEPSHGTLPNGS-OH (SEQ ID № 81); H-IGLHQPSHGTLPNGS-OH (SEQ ID № 82); H-IGLHNPSHGTLPNGS-OH (SEQ ID № 83); H-IGLHEPSHGTLPAGS-OH (SEQ ID № 84); H-IGLHQPSHGTLPAGS-OH (SEQ ID № 85); H-IGLHNPSHGTLPAGS-OH (SEQ ID № 86); H-IGLHDPSHGTLPQGSC-OH (SEQ ID № 87); H-IGLHDPSHGTLPDGSC-OH (SEQ ID № 88); H-IGLHDPSHGTLPEGSC-OH (SEQ ID № 89); H-IGLHEPSHGTLPNGSC-OH (SEQ ID № 90); H-IGLHQPSHGTLPNGSC-OH (SEQ ID № 91); H-IGLHNPSHGTLPNGSC-OH (SEQ ID № 92); H-IGLHDPSHGTLPQG-OH (SEQ ID № 93); H-IGLHDPSHGTLPDG-OH (SEQ ID № 94); H-IGLHDPSHGTLPEG-OH (SEQ ID № 95); H-IGLHEPSHGTLPNG-OH (SEQ ID № 96); H-IGLHQPSHGTLPNG-OH (SEQ ID № 97); H-IGLHNPSHGTLPNG-OH (SEQ ID № 98); H-IGLHEPSHGTLPAG-OH (SEQ ID № 99); H-IGLHQPSHGTLPAG-OH (SEQ ID № 100); H-IGLHNPSHGTLPAG-OH (SEQ ID № 101); H-IGLHDPSHGTLPQGE-OH (SEQ ID № 102); H-IGLHDPSHGTLPDGE-OH (SEQ ID № 103); H-IGLHDPSHGTLPEGE-OH (SEQ ID № 104); H-IGLHEPSHGTLPNGE-OH (SEQ ID № 105); H-IGLHQPSHGTLPNGE-OH (SEQ ID № 106); H-IGLHNPSHGTLPNGE-OH (SEQ ID № 107); H-IGLHEPSHGTLPAGE-OH (SEQ ID № 108); H-IGLHQPSHGTLPAGE-OH (SEQ ID № 109); и H-IGLHNPSHGTLPAGE-OH (SEQ ID № 110).
[0038] В конкретном варианте осуществления изобретения, пептид или его аналог состоит из: Ac-IGLHDPSHGTLPNGS (SEQ ID № 16); (D-Ile)GLHDPSHGTLPNGS (SEQ ID № 17); Ac-IGLHDPSHGTLPNGS-NH2 (SEQ ID № 31); IGLHDPSHGTLPNGS-NH2 (SEQ ID № 32); IGLHDPSHGTLPNGSC (SEQ ID № 33); Ac-IGLHDPSHGTLPNGSC (SEQ ID № 34); IGLHDPSHGTLPNGSC-NH2 (SEQ ID № 35); Ac-IGLHDPSHGTLPNGSC-NH2 (SEQ ID № 36); IGLHDPSHGTLPNGC (SEQ ID № 37); Ac-IGLHDPSHGTLPNGC (SEQ ID № 38); IGLHDPSHGTLPNGC-NH2 (SEQ ID № 39); Ac-IGLHDPSHGTLPNGC-NH2 (SEQ ID № 40); IGLHDPSHGTLPNG (SEQ ID № 74); Ac-IGLHDPSHGTLPNG (SEQ ID № 75); IGLHDPSHGTLPNG-NH2 (SEQ ID № 76); Ac-IGLHDPSHGTLPNG-NH2 (SEQ ID № 77); H-IGLHDPSHGTLPQGS-OH (SEQ ID № 78); H-IGLHDPSHGTLPDGS-OH (SEQ ID № 79); H-IGLHDPSHGTLPEGS-OH (SEQ ID № 80); H-IGLHEPSHGTLPNGS-OH (SEQ ID № 81); H-IGLHQPSHGTLPNGS-OH (SEQ ID № 82); H-IGLHNPSHGTLPNGS-OH (SEQ ID № 83); H-IGLHEPSHGTLPAGS-OH (SEQ ID № 84); H-IGLHQPSHGTLPAGS-OH (SEQ ID № 85); H-IGLHNPSHGTLPAGS-OH (SEQ ID № 86); H-IGLHDPSHGTLPQGSC-OH (SEQ ID № 87); H-IGLHDPSHGTLPDGSC-OH (SEQ ID № 88); H-IGLHDPSHGTLPEGSC-OH (SEQ ID № 89); H-IGLHEPSHGTLPNGSC-OH (SEQ ID № 90); H-IGLHQPSHGTLPNGSC-OH (SEQ ID № 91); H-IGLHNPSHGTLPNGSC-OH (SEQ ID № 92); H-IGLHDPSHGTLPQG-OH (SEQ ID № 93); H-IGLHDPSHGTLPDG-OH (SEQ ID № 94); H-IGLHDPSHGTLPEG-OH (SEQ ID № 95); H-IGLHEPSHGTLPNG-OH (SEQ ID № 96); H-IGLHQPSHGTLPNG-OH (SEQ ID № 97); H-IGLHNPSHGTLPNG-OH (SEQ ID № 98); H-IGLHEPSHGTLPAG-OH (SEQ ID № 99); H-IGLHQPSHGTLPAG-OH (SEQ ID № 100); H-IGLHNPSHGTLPAG-OH (SEQ ID № 101); H-IGLHDPSHGTLPQGE-OH (SEQ ID № 102); H-IGLHDPSHGTLPDGE-OH (SEQ ID № 103); H-IGLHDPSHGTLPEGE-OH (SEQ ID № 104); H-IGLHEPSHGTLPNGE-OH (SEQ ID № 105); H-IGLHQPSHGTLPNGE-OH (SEQ ID № 106); H-IGLHNPSHGTLPNGE-OH (SEQ ID № 107); H-IGLHEPSHGTLPAGE-OH (SEQ ID № 108); H-IGLHQPSHGTLPAGE-OH (SEQ ID № 109); или H-IGLHNPSHGTLPAGE-OH (SEQ ID № 110).
[0039] В настоящем документе предоставлены дополнительные пептидные аналоги INGAP-PP. В другом варианте осуществления изобретение относится к пептиду или его аналогу, который содержит последовательность, выбранную из группы, состоящей из: IGLHAPSHGTLPNGS (SEQ ID № 6); IGLHAPSHGTLPAGS (SEQ ID № 8); IGLHDPSHGTEPNGS (SEQ ID № 18); IGLHDPSQGTLPNGS (SEQ ID № 19); IGLHDPTHGTLPNGS (SEQ ID № 20); IGLHDPSHGTLPNGE (SEQ ID № 21); IGLHDPSHGTLPNGK (SEQ ID № 22); IGLHDPSHGTLPAGK (SEQ ID № 23); IGLHDPSHGTEPAGS (SEQ ID № 24); IGLHDPSQGTLPAGS (SEQ ID № 25); и IGLHDPTHGTLPAGS (SEQ ID № 26); IGLHDPSHGTLPAGE (SEQ ID № 27).
[0040] Например, изобретение относится к пептиду или его аналогу, который содержит пептид или аналог, выбранный из: IGLHAPSHGTLPNGS (SEQ ID № 6); IGLHAPSHGTLPAGS (SEQ ID № 8); IGLHDPSHGTEPNGS (SEQ ID № 18); IGLHDPSQGTLPNGS (SEQ ID № 19); IGLHDPTHGTLPNGS (SEQ ID № 20); IGLHDPSHGTLPNGE (SEQ ID № 21); IGLHDPSHGTLPNGK (SEQ ID № 22); IGLHDPSHGTLPAGK (SEQ ID № 23); IGLHDPSHGTEPAGS (SEQ ID № 24); IGLHDPSQGTLPAGS (SEQ ID № 25); IGLHDPTHGTLPAGS (SEQ ID № 26); и IGLHDPSHGTLPAGE (SEQ ID № 27). В другом варианте осуществления изобретение относится к пептиду или его аналогу, состоящему из: IGLHAPSHGTLPNGS (SEQ ID № 6); IGLHAPSHGTLPAGS (SEQ ID № 8); IGLHDPSHGTEPNGS (SEQ ID № 18); IGLHDPSQGTLPNGS (SEQ ID № 19); IGLHDPTHGTLPNGS (SEQ ID № 20); IGLHDPSHGTLPNGE (SEQ ID № 21); IGLHDPSHGTLPNGK (SEQ ID № 22); IGLHDPSHGTLPAGK (SEQ ID № 23); IGLHDPSHGTEPAGS (SEQ ID № 24); IGLHDPSQGTLPAGS (SEQ ID № 25); IGLHDPTHGTLPAGS (SEQ ID № 26); или IGLHDPSHGTLPAGE (SEQ ID № 27).
[0041] Изобретение дополнительно предусматривает аналоги HIP. В одном из вариантов осуществления изобретения изобретение относится к пептиду или его аналогу, который содержит последовательность IGLHDPTQGTEPAGE (SEQ ID № 50). В одном из вариантов осуществления изобретения пептид или аналог может содержать пептид или аналог, выбранный из: IGLHDPTQGTEPAGE (SEQ ID № 50); IGLHDPTQGTEP(Aib)GE (SEQ ID № 51); Ac-IGLHDPTQGTEPAGE (SEQ ID № 52); (D-Ile)GLHDPTQGTEPAGE (SEQ ID № 53); Ac-IGLHDPTQGTEPAG-NH2 (SEQ ID № 60); Ac-IGLHDPTQGTEPAGE-NH2 (SEQ ID № 62); IGLHDPTQGTEPAGE-NH2 (SEQ ID № 68); IGLHDPTQGTEPAGC (SEQ ID № 69); Ac-IGLHDPTQGTEPAGC (SEQ ID № 70); IGLHDPTQGTEPAGC-NH2 (SEQ ID № 71); и Ac-IGLHDPTQGTEPAGC-NH2 (SEQ ID № 72). В конкретном варианте осуществления пептид или его аналог состоит из: IGLHDPTQGTEPAGE (SEQ ID № 50); IGLHDPTQGTEP(Aib)GE (SEQ ID № 51); Ac-IGLHDPTQGTEPAGE (SEQ ID № 52); (D-Ile)GLHDPTQGTEPAGE (SEQ ID № 53); и Ac-IGLHDPTQGTEPAG-NH2 (SEQ ID № 60); Ac-IGLHDPTQGTEPAGE-NH2 (SEQ ID № 62); IGLHDPTQGTEPAGE-NH2 (SEQ ID № 68); IGLHDPTQGTEPAGC (SEQ ID № 69); Ac-IGLHDPTQGTEPAGC (SEQ ID № 70); IGLHDPTQGTEPAGC-NH2 (SEQ ID № 71); или Ac-IGLHDPTQGTEPAGC-NH2 (SEQ ID № 72).
[0042] В другом варианте осуществления изобретение относится к дополнительным пептидным аналогам HIP. Например, изобретение относится к пептиду или его аналогу, который содержит пептид или аналог, выбранный из группы, состоящей из: Ac-IGLHDPTQGTEPNGE (SEQ ID № 54); (D-Ile)GLHDPTQGTEPNGE (SEQ ID № 55); Ac-IGLHDPTQGTEPNGE-NH2 (SEQ ID № 61); IGLHDPTQGTEPNGE-NH2 (SEQ ID № 63); IGLHDPTQGTEPNGC (SEQ ID № 64); Ac-IGLHDPTQGTEPNGC (SEQ ID № 65); IGLHDPTQGTEPNGC-NH2 (SEQ ID № 66); и Ac-IGLHDPTQGTEPNGC-NH2 (SEQ ID № 67). В конкретном варианте осуществления пептид или его аналог может состоять из: Ac-IGLHDPTQGTEPNGE (SEQ ID № 54); (D-Ile)GLHDPTQGTEPNGE (SEQ ID № 55); Ac-IGLHDPTQGTEPNGE-NH2 (SEQ ID № 61); IGLHDPTQGTEPNGE-NH2 (SEQ ID № 63); IGLHDPTQGTEPNGC (SEQ ID № 64); Ac-IGLHDPTQGTEPNGC (SEQ ID № 65); IGLHDPTQGTEPNGC-NH2 (SEQ ID № 66); или Ac-IGLHDPTQGTEPNGC-NH2 (SEQ ID № 67).
[0043] В другом варианте осуществления изобретения, пептид или его аналог может содержать последовательность, выбранную из группы, состоящей из: IGLHDPTQGTEPNGS (SEQ ID № 56); IGLHDPTQGTEPAGS (SEQ ID № 57); IGLHDPTQGTLPNGE (SEQ ID № 58); и IGLHDPTQGTLPAGE (SEQ ID № 59). Например, пептид или его аналог может содержать пептид или аналог, выбранный из: IGLHDPTQGTEPNGS (SEQ ID № 56); IGLHDPTQGTEPAGS (SEQ ID № 57); IGLHDPTQGTLPNGE (SEQ ID № 58); и IGLHDPTQGTLPAGE (SEQ ID № 59). В конкретном варианте осуществления пептид или его аналог может состоять из: IGLHDPTQGTEPNGS (SEQ ID № 56); IGLHDPTQGTEPAGS (SEQ ID № 57); IGLHDPTQGTLPNGE (SEQ ID № 58); или IGLHDPTQGTLPAGE (SEQ ID № 59).
[0044] В конкретном варианте осуществления изобретение относится к пептиду или его аналогу, который содержит Ac-IGLHDPSHGTLPAGS (SEQ ID № 12). В другом конкретном варианте осуществления изобретение относится к пептиду или его аналогу, состоящему из Ac-IGLHDPSHGTLPAGS (SEQ ID № 12). В еще одном дополнительном варианте осуществления изобретение относится к пептиду или его аналогу, который содержит Ac-IGLHDPSHGTLPNGS-NH2 (SEQ ID № 31). В еще одном дополнительном варианте осуществления изобретение относится к пептиду или его аналогу, состоящему из Ac-IGLHDPSHGTLPNGS-NH2 (SEQ ID № 31). В сравнении с исходным пептидом INGAP-PP, пептиды SEQ ID № 12 и SEQ ID № 31 обладают значительно усовершенствованной стабильностью в плазме и среде для культивирования, значительно усовершенствованными фармакокинетическими свойствами, значительно более сильным эффектом, оказываемым на стимулируемую глюкозой секрецию инсулина, значительно более эффективной индукцией островковых клеток и значительно более сильным эффектом неогенеза островков. Как описано в настоящем документе, пептиды SEQ ID № 12 и SEQ ID № 31 демонстрировали более высокую эффективность относительно исходного пептида INGAP-PP (см. пример VIII). Сдвиг в направлении малого размера островков достигали при использовании пептидов SEQ ID № 12 и SEQ ID № 31 в 1/100 дозы исходного пептида INGAP-PP (см. пример IX). Пептиды SEQ ID № 12 и SEQ ID № 31 дополнительно проявляли усовершенствованные фармакокинетические свойства, о чем свидетельствовало значительное увеличение AUC и Cmax и увеличенная концентрация в плазме и поджелудочной железе относительно исходного пептида INGAP-PP (см. пример X). Пептиды SEQ ID № 12 и SEQ ID № 31 также демонстрировали увеличенную стабильность в культуральной среде и в плазме крысы, мыши и человека (см. пример XI). Следовательно, пептиды SEQ ID № 12 и SEQ ID № 31 обладают значительными преимуществами перед исходным пептидом INGAP-PP. Пептид или аналог по данному изобретению можно использовать в различных применениях, включая в качестве неограничивающих примеров стимуляцию роста клеток панкреатического островка, получение популяции клеток панкреатических островков ex vivo или in vivo, увеличение числа клеток панкреатических островков у человека и лечение заболеваний или состояний с ослабленной функцией поджелудочной железы, таких как сахарный диабет. Более конкретно, заболевания или состояния с ослабленной функцией поджелудочной железы включают, но не ограничиваясь этим, диабет 1-го типа, диабет 2-го типа, латентный аутоиммунный диабет у взрослых (LADA), сниженную глюкозу натощак, сниженную толерантность к глюкозе, дефицит инсулина, гиперинсулинемию натощак, резистентность к инсулину, сниженные уровни инсулина натощак и частичную панкреатомию из-за повреждения или воспаления. Пептид или аналог по данному изобретению можно вводить пациенту при значительно более низком уровне дозы, чем исходный пептид INGAP-PP, что ведет к усовершенствованной эффективности и/или сниженным побочным эффектам в ходе лечения. В предпочтительных вариантах осуществления каждый раз пациенту вводят пептид или аналог по данному изобретению не больше чем 10 мг/кг, не больше чем 5 мг/кг, не больше чем 1 мг/кг, не больше чем 0,5 мг/кг или не больше чем 0,1 мг/кг. В других предпочтительных вариантах осуществления пептид или аналог по данному изобретению вводят пациенту в диапазоне доз 0,1-100 мг в сутки, 1-50 мг в сутки, 5-100 мг в сутки, 5-50 мг в сутки, 0,1-10 мг в сутки или 0,1-1 мг в сутки.
[0045] В другом варианте осуществления изобретение относится к пептиду или аналогу, который имеет следующую формулу: X1GLHX2PX3X4GTX5PX6GS, где X1 выбран из изолейцина(I), D-изолейцина, L-норвалина или L-норлейцина; X2 выбран из аланина(A) или аспарагиновой кислоты(D); X3 выбран из серина(S) или треонина(T); X4 выбран из гистидина(H) или глутамина(Q); X5 выбран из лейцина(L) или глутаминовой кислоты(E); и когда X1 представляет собой изолейцин(I), X2 представляет собой аспарагиновую кислоту(D), X3 представляет собой серин(S), X4 представляет собой гистидин(H) и X5 представляет собой лейцин(L), X6 выбран из аланина(A), a-амино-изомасляной кислоты или N-метил-L-аланина; иначе X6 выбран из аланина(A), аспарагина(N), α-амино-изомасляной кислоты или N-метил-L-аланина. В конкретном варианте осуществления пептид или аналог этой формулы можно выбирать из H-IGLHAPSHGTLPNGS-OH( SEQ ID № 6), H-IGLHDPSHGTLP(Aib)GS-OH (SEQ ID № 10), H-IGLHDPSHGTLP(N-метил-L-аланин)GS-OH (SEQ ID № 11), H-(D-изолейцин)GLHDPSHGTLPNGS-OH (SEQ ID № 17), H-IGLHDPSHGTEPNGS-OH (SEQ ID № 18), H-IGLHDPSQGTLPNGS-OH (SEQ ID № 19) и H-IGLHDPTHGTLPNGS-OH (SEQ ID № 20). В другом конкретном варианте осуществления пептид или аналог этой формулы можно выбирать из H-IGLHDPSHGTLPAGS-OH (SEQ ID № 7), H-IGLHAPSHGTLPAGS-OH (SEQ ID № 8), H-(D-изолейцин)GLHDPSHGTLPAGS-OH (SEQ ID № 13), H-(L-норвалин)GLHDPSHGTLPAGS-OH (SEQ ID № 14), H-(L-норлейцин)GLHDPSHGTLPAGS-OH (SEQ ID № 15), H-IGLHDPSHGTEPAGS-OH (SEQ ID № 24), H-IGLHDPSQGTLPAGS-OH (SEQ ID № 25) и H-IGLHDPTHGTLPAGS-OH (SEQ ID № 26).
[0046] В еще одном другом варианте осуществления изобретение относится к пептиду или аналогу, который имеет следующую формулу: R1-IGLHDPSHGTLPNGX1(C)m-R2, где m равно 0 или 1; R1 выбран из -H или -Ac; R2 выбран из -OH или -NH2; и когда R1 представляет собой -H, R2 представляет собой -OH, и m равно 0, X1 выбран из глутаминовой кислоты(E), цистеина(C) или лизина(K); иначе X1 выбран из серина(S), глутаминовой кислоты(E), цистеина(C) или лизина(K). В конкретном варианте осуществления пептид или аналог этой формулы можно выбирать из H-IGLHDPSHGTLPNGE-OH (SEQ ID № 21) и H-IGLHDPSHGTLPNGK-OH (SEQ ID № 22). В другом конкретном варианте осуществления пептид или аналог этой формулы можно выбирать из Ac-IGLHDPSHGTLPNGS-NH2 (SEQ ID № 31), H-IGLHDPSHGTLPNGS-NH2 (SEQ ID № 32) и Ac-IGLHDPSHGTLPNGS-OH (SEQ ID № 16). В еще одном другом конкретном варианте осуществления пептид или аналог этой формулы можно выбирать из H-IGLHDPSHGTLPNGC-OH (SEQ ID № 37), Ac-IGLHDPSHGTLPNGC-OH (SEQ ID № 38), H-IGLHDPSHGTLPNGC-NH2 (SEQ ID № 39) и Ac-IGLHDPSHGTLPNGC-NH2 (SEQ ID № 40). В еще одном дополнительном конкретном варианте осуществления пептид или аналог этой формулы можно выбирать из H-IGLHDPSHGTLPNGSC-OH (SEQ ID № 33), Ac-IGLHDPSHGTLPNGSC-OH (SEQ ID № 34), H-IGLHDPSHGTLPNGSC-NH2 (SEQ ID № 35) и Ac-IGLHDPSHGTLPNGSC-NH2 (SEQ ID № 36). В еще одном другом конкретном варианте осуществления пептид или аналог этой формулы можно выбирать из H-IGLHDPSHGTLPNG-OH (SEQ ID № 74), Ac-IGLHDPSHGTLPNG-OH (SEQ ID № 75), H-IGLHDPSHGTLPNG-NH2 (SEQ ID № 76) и Ac-IGLHDPSHGTLPNG-NH2 (SEQ ID № 77).
[0047] В еще одном другом варианте осуществления изобретение относится к пептиду или аналогу, который имеет следующую формулу: R1-IGLHDPSHGTLPAG(X1)m-R2; где m равно 0 или 1; R1 выбран из -H или - Ac; R2 выбран из -OH или -NH2; когда R1 представляет собой -H, R2 представляет собой -OH и m равно 1, X1 выбран из глутаминовой кислоты(E), цистеина(C) или лизина(K); иначе X1 выбран из серина(S), глутаминовой кислоты(E), цистеина(C) или лизина(K). В конкретном варианте осуществления пептид или аналог этой формулы можно выбирать из H-IGLHDPSHGTLPAGE-OH (SEQ ID № 27) и H-IGLHDPSHGTLPAGK-OH (SEQ ID № 23). В другом конкретном варианте осуществления пептид или аналог этой формулы можно выбирать из Ac-IGLHDPSHGTLPAGS-NH2 (SEQ ID № 29), H-IGLHDPSHGTLPAGS-NH2 (SEQ ID № 41) и Ac-IGLHDPSHGTLPAGS-OH (SEQ ID № 12). В еще одном другом конкретном варианте осуществления пептид или аналог этой формулы можно выбирать из H-IGLHDPSHGTLPAGC-OH (SEQ ID № 46), Ac-IGLHDPSHGTLPAGC-OH (SEQ ID № 47), H-IGLHDPSHGTLPAGC-NH2 (SEQ ID № 48) и Ac-IGLHDPSHGTLPAGC-NH2 (SEQ ID № 49). В еще одном другом конкретном варианте осуществления пептид или аналог этой формулы можно выбирать из H-IGLHDPSHGTLPAG-OH (SEQ ID № 73), H-IGLHDPSHGTLPAG-NH2 (SEQ ID № 28) и Ac-IGLHDPSHGTLPAG-NH2 (SEQ ID № 30).
[0048] В другом варианте осуществления изобретение относится к пептиду или аналогу, который имеет следующую формулу: R1-IGLHDPSHGTLPAGSX2-R2, где X2 выбран из лизина(K) или цистеина(C), R1 выбран из -H или -Ac, R2 выбран из -OH или -NH2. В конкретном варианте осуществления пептид или аналог этой формулы можно выбирать из H-IGLHDPSHGTLPAGSK-OH (SEQ ID № 9), H-IGLHDPSHGTLPAGS C-OH (SEQ ID № 42), Ac-IGLHDPSHGTLPAGSC-OH (SEQ ID № 43), H-IGLHDPSHGTLPAGSC-NH2 (SEQ ID № 44) и Ac-IGLHDPSHGTLPAGSC-NH2 (SEQ ID № 45).
[0049] В другом варианте осуществления изобретение относится к пептиду или аналогу, который имеет следующую формулу: X1GLHDPTQGTX2PX3GE, X1 выбран из изолейцина(I) или D-изолейцина; X2 выбран из глутаминовой кислоты(E) или лейцина(L); и когда X1 представляет собой изолейцин(I) и X2 представляет собой глутаминовую кислота(E), X3 выбран из аланина(A) или α-амино-изомасляной кислоты; иначе X3 выбран из аланина(A), аспарагина(N) или α-амино-изомасляной кислоты. В конкретном варианте осуществления пептид или аналог этой формулы можно выбирать из H-IGLHDPTQGTEP(Aib)GE-OH (SEQ ID № 51), H-(D-изолейцин)GLHDPTQGTEPNGE-OH (SEQ ID № 55) и H-IGLHDPTQGTLPNGE-OH (SEQ ID № 58). В другом конкретном варианте осуществления пептид или аналог этой формулы можно выбирать из H-IGLHDPTQGTEPAGE-OH (SEQ ID № 50), H-(D-изолейцин)GLHDPTQGTEPAGE-OH (SEQ ID № 53) и H-IGLHDPTQGTLPAGE-OH (SEQ ID № 59).
[0050] В другом варианте осуществления изобретение относится к пептиду или аналогу, который имеет следующую формулу: R1-IGLHDPTQGTEPNGX1-R2, где R1 выбран из -H или -Ac; R2 выбран из -OH или -NH2; когда R1 представляет собой -H и R2 представляет собой -OH, X1 выбран из серина(S) или цистеина(C); иначе X1 выбран из серина(S), глутаминовой кислоты(E) или цистеина(C). В конкретном варианте осуществления пептид или аналог этой формулы можно выбирать из Ac-IGLHDPTQGTEPNGE-OH (SEQ ID № 54), Ac-IGLHDPTQGTEPNGE-NH2 (SEQ ID № 61) и H-IGLHDPTQGTEPNGE-NH2 (SEQ ID № 63). В другом конкретном варианте осуществления пептид или аналог этой формулы можно выбирать из H-IGLHDPTQGTEPNGS-OH (SEQ ID № 56), H-IGLHDPTQGTEPNGC-OH (SEQ ID № 64), Ac-IGLHDPTQGTEPNGC-OH(SEQ ID № 65), H-IGLHDPTQGTEPNGC-NH2 (SEQ ID № 66) и Ac-IGLHDPTQGTEPNGC-NH2 (SEQ ID № 67).
[0051] В другом варианте осуществления изобретение относится к пептиду или аналогу, который имеет следующую формулу: R1-IGLHDPTQGTEPAG(X1)n-R2, где, R1 выбран из -H или -Ac; R2 выбран из -OH или -NH2; n равно 0 или 1; X1 выбран из серина(S) или цистеина(C). В конкретном варианте осуществления пептид или аналог этой формулы можно выбирать из H-IGLHDPTQGTEPAGS-OH (SEQ ID № 57), Ac-IGLHDPTQGTEPAG-NH2 (SEQ ID № 60), H-IGLHDPTQGTEPAGC-OH (SEQ ID № 69), Ac-IGLHDPTQGTEPAGC-OH (SEQ ID № 70), H-IGLHDPTQGTEPAGC-NH2 (SEQ ID № 71) и Ac-IGLHDPTQGTEPAGC-NH2 (SEQ ID № 72). В другом конкретном варианте осуществления пептид или аналог этой формулы можно выбирать из Ac-IGLHDPTQGTEPAGE-OH (SEQ ID № 52), Ac-IGLHDPTQGTEPAGE-NH2 (SEQ ID № 62) и H-IGLHDPTQGTEPAGE-NH2 (SEQ ID № 68).
[0052] Как описано в настоящем документе, пептиды или аналоги по изобретению включают аналоги INGAP-PP и HIP, которые могут представлять собой пептиды, которые имеют 20 стандартных встречающихся в природе аминокислот, а также другие встречающиеся и/или не встречающиеся в природе аминокислоты. В пептидах, как описано в настоящем документе, в целом используют стандартную номенклатуру. Например, некоторые пептиды обозначают H-XXX-OH, и специалистам в данной области понятно, что это может обозначать не модифицированные амино- (H-) или карбоксиконцы (-OH). Аминокислотную последовательность также можно представлять без указания модификации на амино- или карбоксиконце. Специалистам в данной области понятно, что пептиды, описанные в настоящем документе, пока конкретная модификация не указана N- или C-конце, могут содержать немодифицированные и модифицированные амино- и/или карбоксиконцы на пептиде, который содержит точно определенную аминокислотную последовательность, или пептидном аналоге. Таким образом, пептид или аналог, который содержит обозначенную аминокислотную последовательность, может содержать дополнительные аминокислоты на N- и/или C-конца, а также модифицированные аминокислоты из обозначенной последовательности. Пептид или аналог, который содержит обозначенный пептид или аналог, аналогичным образом может содержать модифицированные аминокислоты и/или дополнительные аминокислоты, если N- и/или C-конец не содержит модификацию, которая препятствует добавлению аминокислоты, например, через пептидную связь. Такие модификации могут включать, например, ацетилированный N-конец и/или амидированный C-конец.
[0053] Как описано в настоящем документе, пептиды или аналоги по изобретению могут содержать модификацию. Специалистам в данной области понятно, что в пептиде или аналоге можно выполнять множество модификаций. Образцовые модификации включают, но не ограничиваясь этим, ацетилированный N-конец, амидированный C-конец, D-аминокислоты, модифицированные аминокислоты, модификации жирных кислот, этерификацию или их сочетание. Любая из множества хорошо известных модификаций пептида или аминокислоты может быть включена в пептид или аналог по изобретению. Например, производные могут содержать химические модификации полипептида, такие как этерификация, алкилирование, ацилирование, карбамилирование, иодирование или какую-либо модификацию, которая позволяет получать производное полипептида. Модификации пептида или аналога могут включать модифицированные аминокислоты, например, гидроксипролин или карбоксиглутамат, и могут включать аминокислоты, которые не соединены пептидными связями.
[0054] Специалистам в данной области понятно, что какой-либо из множества хорошо известных способов можно использовать для получения пептидов или аналогов по изобретению (см., например, Protein Engineering: A practical approach (IRL Press 1992); Bodanszky, Principles of Peptide Synthesis (Springer- Verlag 1984), Lloyd-Williams et al, Tetrahedron 49: 11065-11133 (1993); Kent, Ann. Rev. Biochem. 57:957-989 (1988); Merrifield, J. Am. Chem. Soc, 85:2149-2154 (1963); Merrifield, Methods Enzymol. 289:3-13 (1997)). Особенно эффективным способом получения пептидов или аналогов по изобретению является химический синтез с использованием хорошо известных способов синтеза пептидов. Химический синтез особенно эффективен для введения не встречающихся в природе аминокислот, модифицированных аминокислот и/или модифицированного N- и/или C-конца. Например, преимущество использования химического синтеза для того, чтобы получать пептид или аналог по изобретению, состоит в том, что, при желании, (D)-аминокислотами можно заменять (L)-аминокислоты. Встраивание одной или нескольких (D)-аминокислоты может придавать, например, дополнительную стабильность пептиду in vitro или, в частности, in vivo, поскольку эндогенные эндопротеазы в целом неэффективны против пептидов, содержащих (D)-аминокислоты. Пептиды, содержащие D-аминокислоты, также можно обозначать в настоящем документе с использованием хорошо известной номенклатуры со строчными буквами для соответствующего однобуквенного кода для аминокислот.
[0055] При желании, реакционноспособную боковую группу одной или нескольких аминокислот в пептиде или аналоге по изобретению можно модифицировать или производные аминокислот можно встраивать в пептид. Избирательная модификация реакционноспособной группы пептида или аналога может придавать желаемые характеристики пептиду или аналогу. Решение о включении такой модификации принимают, отчасти, исходя из требуемых характеристик пептида. Например, пептид или аналог может иметь свободный карбоксильный конец или его можно модифицировать с тем, чтобы амидировать C-конец (см. таблицы 2 и 3). Аналогичным образом, пептид или аналог может иметь свободный аминоконец или его можно модифицировать с тем, чтобы ацетилировать N-конец (таблицы 2 и 3). Кроме того, пептиды или аналоги по изобретению можно необязательно амидировать по C-концу и ацетилировать по N-концу. Другие модификации N- и/или C-конца пептида или аналога также могут быть включены в значение модификации.
[0056] Другие модификации пептида или аналог по изобретению могут включать, но не ограничиваясь этим, 2-аминоадипиновую кислоту (Aad); 3-аминоадипиновую кислоту (bAad); β-аланин, β-аминопропановую кислоту (bAla); 2-аминомасляную кислоту (Abu); 4-аминомасляную кислоту, пиперидиновую кислоту (4Abu); 6-аминокапроновую кислоту (Acp); 2-аминогептановую кислоту (Ahe); 2-аминоизомасляную кислоту (Aib); 3-аминоизомасляную кислоту (bAib); 2-аминопимелиновую кислоту (Apm); 2,4-диаминомасляную кислоту (Dbu); десмозин (Des); 2,2'-диаминопимелиновую кислоту (Dpm); 2,3-диаминопропановую кислоту (Dpr); N-этилглицин (EtGly); N-этиласпарагин (EtAsn); гидроксилизин (Hyl); алло-гидроксилизин (aHyl); 3-гидроксипролин (3Hyp); 4-гидроксипролин (4Hyp); изодесмозин (Ide); алло-изолейцин (alle); N-метилглицин (MeGly; саркозин); N-метилизолейцин (Melle); 6-N-метиллизин (MeLys); N-метилвалин (MeVal); норвалин (Nva); норлейцин (Nle); и орнитин (Orn). Понятно, что все модифицированные α-аминокислоты можно заменять соответствующими β-, γ- или ω-аминокислотами.
[0057] Другая модификация пептида или аналога по изобретению включает модификацию жирной кислоты. Таким образом, пептид или аналог по изобретению можно модифицировать посредством ацилирования алифатическими группами, включая C2, C4, C6, C8, C10, C12, C14, C16, C18, C20 или более длинные цепи. Пептид или аналог также можно модифицировать с помощью изопренилирования и/или фосфатидилинозитола (PI). Дополнительные модификации пептида или аналога по изобретению включают этерификацию. Например, карбоксильную группу можно модифицировать посредством этерификации с кислотным катализом или конденсации со спиртом. Наоборот, спиртовую группу можно модифицировать посредством конденсации с карбоновой кислотой или другой кислотой. Дополнительные модификации пептида или аналога по изобретению могут включать замыкание кольца. Например, посредством введения конформационного ограничения через замыканиие кольца «от головы к хвосту» повышает стабильность пептида относительно его линейных эквивалентов и, следовательно, увеличивает длительность действия пептида. Полагают, что посредством ограничения конформационной гибкости циклический пептид принимает конформацию, которая более точно имитирует ту активную последовательность, которая представлена в нативном белке (см., например, Dutta Chem. Br. 25: 159(1989); Kopple, J. Am. Chem. Soc. 94-973-981 (1972); Brugghe et al, Int. J. Peptide Protein Res. 43: 166-170 (1994)). Эти и другие модификации аминокислот, пептидов или белков хорошо известны специалистам в данной области (см., например, Glazer et al, Chemical modification of proteins: Selected methods and analytical procedures, Elsevier Biomedical Press, Amsterdam (1975)). Понятно, что такие модификации можно включать в пептид или аналог по изобретению в виде отдельных модификаций или комбинаций одной или нескольких модификаций в молекуле пептида или аналога.
[0058] Изобретение также включает миметики пептидов или аналогов, описанных в настоящем документе, также обозначаемых как пептидомиметики. Миметики включают химические соединения, содержащие химические фрагменты, которые имитируют функцию пептида. Например, если пептид содержит два заряженных химических фрагмента, которые обладают функциональной активностью, миметик помещает два заряженных химических фрагмента в пространственной ориентации и стерически ограниченной структуре с тем, чтобы заряженная химическая функция сохранялась в трехмерном пространстве. Таким образом, миметик ориентирует функциональные группы пептида или аналога по изобретению так, что функциональная активность пептида или аналога сохраняется.
[0059] Миметики или пептидомиметики могут содержать химически модифицированные пептиды, пептидоподобные молекулы, которые содержат не встречающиеся в природе аминокислоты, пептидоиды и т.п. и обладают функциональной активностью пептида или аналога, из которого получают пептидомиметик (см., например, Burger's Medicinal Chemistry and Drug Discovery, 5-е издание, тома с 1 по 3 (ред. M. E. Wolff; Wiley Interscience 1995)). Способы идентификации пептидомиметика хорошо известны в данной области и включают, например, скрининг баз данных, которые содержат библиотеки потенциальных пептидомиметиков (Allen et al, Acta Crystallogr. Section B, 35:2331 (1979)) или использование молекулярного моделирования (Rusinko et al, J. Chem. Inf. Comput. Sci. 29:251 (1989)). Миметики или пептидомиметики могут обеспечивать желаемые свойства, такие как более высокая стабильность, например, при введении субъекту, например, во время прохождения через пищеварительный тракт и, следовательно, их можно использовать для перорального введения.
[0060] Различные миметики или пептидомиметики известны в данной области, которые содержат в качестве неограничивающих примеров пептидоподобные молекулы, которые содержат стерически ограниченные аминокислоты, непептидные компоненты, которые имитируют вторичную структуру пептида, или изостеры с амидными связями. Миметик или пептидомиметик, который содержит стерически ограниченную, не встречающуюся в природе аминокислоту, может включать, без ограничения, α-метилированную аминокислоту; α,α-диалкилглицин или α-аминоциклоалкановую карбоновую кислоту; Nα-Cα-циклизованную аминокислоту; Nα-метилированную аминокислоту; β- или γ-аминоциклоалкановую карбоновую кислоту; α, β-ненасыщенную аминокислоту; β,β-диметил- или β-метиламинокислоту; β-замещенную-2,3-метаноаминокислоту; N-Cδ или Cα-Cδ циклизованную аминокислоту; замещенный пролин или другой миметик аминокислоты. Миметик или пептидомиметик, который имитирует вторичную структуру пептида, может содержать, без ограничения, непептидный миметик β-поворота; миметик γ-поворота; или миметик спиральной структуры, каждый из которых хорошо известен в данной области. В качестве неограничивающих примеров, пептидомиметик также может представлять собой пептидоподобную молекулу, которая содержит изостеру с амидной связью, такую как ретро-инвертированная модификация; восстановленную амидную связь; метиленовый тиоэфир или метиленсульфоксидную связь; метиленовую эфирную связь; этиленовую связь; тиоамидную связь; транс-олефиновую или фторолефиновую связь; 1,5-двузамещенное тетразоловое кольцо; кетометиленовую или фторкетометиленовую связь или другую амидную изостеру. Специалист в данной области понимает, что можно использовать эти и другие миметики или пептидомиметики пептида или аналога по изобретению.
[0061] Изобретение также относится к псевдопептидным производным пептидов или аналогов по изобретению. Псевдопептиды известны в данной области в качестве пептидов, в которых пептидную связь (амидную связь) в пептиде модифицируют до заменителя амидной связи (см., например, Cudic and Stawikowski, Mini-Rev Organic Chem. 4:268-280 (2007); Anderson, в Neuropeptide Protocols, ред. Brent и Carvell, 73:49-60 (1996)). Образцовый заменитель амидной связи включает, но не ограничиваясь этим, пептидосульфонамиды, фосфонопептиды, депсиды и депсипептиды, олигомочевины, азапептиды и пептидоиды (см. Cudic and Stawikowski, выше, 2007), а также, в качестве метиленамино, производные простых тиоэфирови гидроксиэтилена и т.п. (Anderson, выше, 1996).
[0062] Пептиды или аналоги по изобретению можно получать с использованием способов, хорошо известных специалистам в данной области, включая химический синтез пептидов или аналогов, используя хорошо известные способы синтеза пептидов, как описано в настоящем документе. Таким образом, когда пептиды или аналоги содержат одну или несколько нестандартных аминокислот, более вероятно, что их будут получать способом химического синтеза. В дополнение к использованию химического синтеза пептидов или аналогов, пептиды или аналоги можно получать посредством экспрессии кодирующих нуклеиновых кислот. В частности, это можно использовать для пептидов или аналогов, которые включают только встречающиеся в природе аминокислоты. В таком случае, нуклеиновую кислоту, кодирующую пептидную последовательность, можно получать с использованием хорошо известных способов (см. Sambrook et al, Molecular Cloning: A Laboratory Manual, 3-е издание, Cold Spring Harbor Laboratory, New York (2001); Ausubel et al, Current Protocols in Molecular Biology, John Wiley and Sons, Baltimore, MD (1999)). В целом, такую нуклеиновую кислоту будут экспрессировать рекомбинантным способом в подходящем организме-хозяине, таком как бактерия, дрожжи, клетка млекопитающего или насекомого и т.п. Получение в бактериях, в частности, можно использовать для крупномасштабного получения пептида или аналога по изобретению. Пептид можно экспрессировать в организме и очищать с использованием хорошо известных способов очистки.
[0063] Молекулу нуклеиновой кислоты, кодирующая пептид или аналог по изобретению, можно клонировать в подходящем векторе, в частности экспрессирующем векторе, и кодируемый пептид или аналог можно экспрессировать в клетке-хозяине или с использованием реакции транскрипции/трансляции in vitro, тем самым предоставляя средство для получения больших количеств пептида или аналога. Необязательно рекомбинантный пептид можно получать в виде слитой молекулы с меткой, такой как гистидиновая метка, чтобы содействовать идентификации и очистке. Подходящие векторы, клетки-хозяева, системы транскрипции/трансляции in vitro и последовательности меток хорошо известны в данной области и коммерчески доступны.
[0064] Пептид или аналог можно экспрессировать в виде одной копии, в полицистронном экспрессирующем векторе, или необязательно можно экспрессировать в виде одной открытой рамки считывания с множеством копий пептидной последовательности. В таком случае, пептид можно получать посредством экспрессии открытой рамки считывания, которая содержит множество копий пептидной последовательности, что ведет к экспрессии полипептида с множеством копий пептида. Полипептид можно подвергать посттрансляционной обработке для получения пептида или аналога по изобретению, например, посредством конструирования подходящих протеолитических сайтов расщепления между копиями пептида и расщепления полипептида на пептид или аналог по изобретению. Несмотря на то, что такой рекомбинантный способ в целом используют, когда пептид или аналог по изобретению представляет собой пептид, который содержит только встречающиеся в природе аминокислоты, также понятно, что такой способ можно использовать вместе с экспрессирующими организмами-хозяевами, которые соответственно сконструированы для того, чтобы экспрессировать не встречающиеся в природе аминокислоты. Дополнительно, понятно, что пептид или аналог, экспрессируемый рекомбинантно, необязательно можно химически модифицировать для того, чтобы вводить желаемую модификацию аминокислоты или N- и/или C-концевую модификацию с использованием хорошо известных способов химической модификации (см. Glazer et al, выше, 1975).
[0065] Таким образом, изобретение дополнительно предусматривает нуклеиновые кислоты, кодирующие пептиды или аналоги по изобретению. Такие нуклеиновые кислоты включают, например, нуклеиновые кислоты, которые кодируют какие-либо из аминокислотных последовательностей SEQ ID №№ 6-73. Таким образом, когда аналоги содержат только одну или несколько замен с использованием стандартных аминокислот, аналоги можно экспрессировать с экспрессирующего вектора с использованием хорошо известных способов, как описано в настоящем документе.
[0066] Пептиды или аналоги по изобретению могут содержать последовательность или пептид или аналог, как описано в настоящем документе. В случае пептида или аналога, который содержит аминокислотную последовательность или пептид, пептид в целом имеет длину в 20 аминокислот или меньше. Например, пептид или аналог может иметь длину в 19 аминокислот или меньше, 18 аминокислот или меньше, 17 аминокислот или меньше. Таким образом, пептид или аналог по изобретению, как описано в настоящем документе, может иметь длину 10 аминокислот, 11 аминокислот, 12 аминокислот, 13 аминокислот 14 аминокислот (см. Пептид 73, пептид 74), 15 аминокислот, 16 аминокислот, 17 аминокислот, 18 аминокислот, 19 аминокислот или 20 аминокислот. В случае более коротких пептидов специалистам в данной области понятно, что более короткий пептид содержит фрагмент раскрытого пептида или аналога, например, за счет делеции одной или нескольких аминокислот на N- и/или C-конце раскрытого пептида или аналога, который сохраняет функциональную активность, включая в качестве неограничивающих примеров одну или несколько из биологических активностей пептидов и аналогов по изобретению, как описано в настоящем документе. Тем не менее, понятно, что пептид также может содержать более длинные аминокислотные фрагменты, при условии, что функциональная активность пептида или аналога сохранена. Таким образом, пептид или аналог может иметь длину меньше чем 150 остатков, меньше чем 130 остатков, меньше чем 120 остатков, меньше чем 110 остатков, меньше чем 100 остатков, меньше чем 90 остатков, меньше чем 80 остатков, меньше чем 70 остатков, меньше чем 60 остатков, меньше чем 50 остатков, меньше чем 45 остатков, меньше чем 40 остатков, меньше чем 35 остатков, меньше чем 30 остатков, меньше чем 25 остатков, меньше чем 24 остатка, меньше чем 23 остатка, меньше чем 22 остатка, меньше чем 21 остаток, меньше чем 20 остатков, меньше чем 19 остатков, меньше чем 18 остатков или меньше чем 17 остатков. Специалистам в данной области понятно, что когда пептид или аналог по изобретению содержит последовательность, найденную в известной более длинной последовательности, такой как полноразмерный белок дикого типа, пептид или аналог по изобретению, в частности, не включает такую полноразмерную последовательность.
[0067] Изобретение также относится к пептидам и аналогам по изобретению в форме фармацевтически приемлемой соли, которая хорошо известна специалистам в данной области. Особенно эффективной солевой формой является форма ацетатной или гидрохлоридной соли. Тем не менее, специалистам в данной области понятно, что доступны любые из множества подходящих солевых форм. Когда пептид или аналог по изобретению содержит кислый или основной фрагмент, он может быть предусмотрен в виде фармацевтически приемлемой соли (см., например, Berge et al, J. Pharm. Sci. 1977, 66, 1-19; и Handbook of Pharmaceutical Salts, Properties, and Use; ред. Stahl and Wermuth; Wiley-VCH and VHCA: Zurich, Switzerland, 2002).
[0068] Подходящие кислоты для использования при получении фармацевтически приемлемых солей включают, но не ограничиваясь этим, уксусную кислоту, 2,2-дихлоруксусную кислоту, ацетилированные аминокислоты, адипиновую кислоту, альгиновую кислоту, аскорбиновую кислоту, L-аспарагиновую кислоту, бензолсульфоновую кислоту, бензойную кислоту, 4-ацетамидобензойную кислоту, борную кислоту, (+)-камфорную кислоту, камфоросульфоновую кислоту, (+)-(1S)-камфоро-10-сульфоновую кислоту, каприновую кислоту, капроновую кислоту, каприловую кислоту, коричную кислоту, лимонную кислоту, цикламовую кислоту, циклогексансульфаминовую кислоту, дезоксихолевую кислоту, додецилсерную кислоту, докозагексаеновую кислоту, эйкозапентаеновую кислоту, этан- 1,2-дисульфоновую кислоту, этансульфоновую кислоту, 2-гидрокси-этансульфоновую кислоту, муравьиную кислоту, фумаровую кислоту, галактаровую кислоту, гентизиновую кислоту, глюкогептоновую кислоту, D-глюконовую кислоту, D-глюкуроновую кислоту, L-глутаминовую кислоту, α-оксоглутаровую кислоту, гликолевую кислоту, гиппуровую кислоту, бромистоводородную кислоту, соляную кислоту, йодистоводородную кислоту, (+)-L-молочную кислоту, (±)-DL-молочную кислоту, лактобионовую кислоту, лауриновую кислоту, маллеиновую кислоту, (-)-L-яблочную кислоту, малоновую кислоту, (±)-DL-миндальную кислоту, метансульфоновую кислоту, нафталин-2-сульфоновую кислоту, нафталин-1,5-дисульфоновую кислоту, 1-гидрокси-2-нафтойную кислоту, никотиновую кислоту, азотную кислоту, олеиновую кислоту, оротовую кислоту, щавелевую кислоту, пальмитиновую кислоту, памовую кислоту, перхлорную кислоту, фосфорную кислоту, L-пироглутаминовую кислоту, сахарную кислоту, салициловую кислоту, 4-аминосалициловую кислоту, себациновую кислоту, стеариновую кислоту, янтарную кислоту, серную кислоту, дубильную кислоту, (+)-L-винную кислоту, тиоциановую кислоту, п-толуолсульфоновую кислоту, ундециленовую кислоту, урзоловую кислоту и валериановую кислоту.
[0069] Подходящие основания для использования при получении фармацевтически приемлемых солей включают в качестве неограничивающих примеров неорганические основания, такие как гидроксид магния, гидроксид кальция, гидроксид калия, гидроксида цинк или гидроксид натрия; и органические основания, такие как первичные, вторичные, третичные и четвертичные, алифатические и ароматические амины, включая L-аргинин, бенетамин, бензатин, холин, динол, диэтаноламин, диэтиламин, диметиламин, дипропиламин, диизопропиламин, 2-(диэтиламино)-этанол, этаноламин, этиламин, этилендиамин, изопропиламин, N-метилглюкамин, гидрабамин, 1H-имидазол, L-лизин, морфолин, 4-(2-гидроксиэтил)-морфолин, метиламин, пиперидин, пиперазин, пропиламин, пирролидин, 1-(2-гидроксиэтил)-пирролидин, пиридин, хинуклидин, хинолин, изохинолин, вторичные амины, триэтаноламин, триметиламин, триэтиламин, N-метил-D-глюкамин, 2-амино-2-(гидроксиметил)-1,3-пропандиол и трометамин.
[0070] Изобретение также относится к пептидам и аналогам по изобретению в композиции. Например, пептиды или аналоги из таблиц 2 или 3 или другие пептиды или аналоги, описанные в настоящем документе или формулах, описанных в настоящем документе, можно предоставлять в композиции, как описано в настоящем документе. В конкретном варианте осуществления композиция может содержать пептид или аналог SEQ ID № 12 или SEQ ID № 31. Композицию необязательно формулировать с использованием фармацевтически приемлемого носителя для того, чтобы получать фармацевтическую композицию, которую можно вводить индивидууму, которым может быть человек или другое млекопитающее. Фармацевтически приемлемый носитель может представлять собой, например, воду, натрий-фосфатный буфер, фосфатно-солевой буфер, нормальный физиологический раствор или раствор Рингера или другой физиологически забуференный физиологический раствор или другой растворитель или наполнитель, такой как гликоль, глицерин, масло, такое как оливковое масло, или инъецируемый сложный органический эфир.
[0071] Фармацевтически приемлемый носитель может содержать физиологически приемлемые соединения, которые действуют, например, для того, чтобы стабилизировать или увеличивать абсорбцию пептида или аналога по изобретению. Такие физиологически приемлемые соединения включают, например, углеводы, такие как глюкоза, сахароза или декстраны; антиоксиданты, такие как аскорбиновая кислота или глутатион; хелатирующие средства, такие как этилендиаминтетрауксусная кислота (ЭДТА), которые нарушают микробные мембраны; двухвалентные ионы металлов, таких как кальций или магний; низкомолекулярные белки; или другие стабилизаторы или эксципиенты. Специалисту в данной области известно, что выбор фармацевтически приемлемого носителя, включая физиологически приемлемое соединение, зависит, например, от пути введения композиции. Подходящие носители и их составы хорошо известны в данной области (см., например, Remington: The Science and Practice of Pharmacy, 19th ed., ed. A. R. Gennaro, Mack Publishing Company, Easton, PA (1995); и Remington's Pharmaceutical Sciences, 18th ed., Mack Publishing Company, Easton PA (1990)). Типично, подходящее количество фармацевтически приемлемой соли используют при формулировании для того, чтобы сделать состав изотоническим. pH раствора в целом составляет приблизительно от 4 приблизительно до 8,5, например, приблизительно от 4 приблизительно до 5, приблизительно от 5 приблизительно до 6, приблизительно от 6 приблизительно до 7, приблизительно от 4,5 приблизительно до 8, приблизительно от 5 приблизительно до 8, приблизительно от 5 приблизительно до 7,5, приблизительно от 5,5 приблизительно до 8, приблизительно от 5,5 приблизительно до 7,5, приблизительно от 6 приблизительно до 8, приблизительно от 6,5 приблизительно до 8, приблизительно от 7 приблизительно до 8, приблизительно от 7,5 приблизительно до 8 или приблизительно от 7 приблизительно до 7,5.
[0072] Фармацевтические носители известны специалистам в данной области. Наиболее типично они представляют собой стандартные носители для введения лекарственных средств человеку, в том числе растворы, такие как стерильная вода, физиологический раствор и буферные растворы с физиологическим pH, как описано выше. Фармацевтические композиции могут содержать носители, загустители, разбавители, буферы, консерванты, поверхностно-активные средства и т.п. в дополнение к предпочтительной молекуле, такой как пептиды или аналоги по изобретению. Фармацевтические композиции также могут содержать один или несколько активных ингредиентов, таких как противомикробные средства, противовоспалительные средства, анестетики и т.п.
[0073] Дополнительные носители включают препараты с замедленным или контролируемым высвобождением, такие как полупроницаемые матрицы из твердых гидрофобных полимеров, ковалентно или нековалентно связанные с пептидом или аналогом, эти матрицы имеют вид изделий определенной геометрической формы, например, пленок, липосом, нелипосомального липидного комплекса или микрочастиц и т.п., или других биологически совместимых полимеров, хорошо известных специалистам в данной области (см., например, патент США № 6824822 и 8329648). Липосомы, которые состоят из фосфолипидов или других липидов, являются нетоксичными, физиологически приемлемыми и метаболизируемыми носителями, которые можно относительно просто получать и вводить (Gregoriadis, Liposome Technology, том 1 (CRC Press, Boca Raton Fla., 1984). Различные способы доставки лекарственных средств хорошо известны специалистам в данной области (Langer, Nature 392(Suppl):5-10 (1998); Langer et al, Nature 428:487-492 (2004)). Специалистам в данной области будет понятно, что определенные носители можно выбирать в зависимости, например, от пути введения и концентрации композиции, подлежащей введению.
[0074] Как описано в настоящем документе, пептиды или аналоги по изобретению можно получать в виде составов с замедленным или контролируемым высвобождением. Как описано в примере XII, можно создавать различные композиции с замедленным высвобождением, которые демонстрировали выполнимость дозированных форм пептидов или аналогов по изобретению с высвобождением длительного действия. Образцовые составы содержат биологически совместимые полимеры, включая в качестве неограничивающих примеров полимеры, содержащие поли(этиленгликоль) (PEG), неионные поверхностно-активные вещества полиолы, также известные как полоксамеры, которые представляют собой сополимеры полиоксипропилена и полиоксиэтилена (поли(этиленоксида)), полиэфирамины, которые могут быть основаны на этиленоксиде (EO), пропиленоксиде (PO), смеси EO/PO или политетраметиленгликоле (PTMEG), полиэфирдиамины, основанные преимущественно на PEG остове, и т.п. Образцовые полоксамеры включают, но не ограничиваясь этим, Pluronic® F127, Pluronic® F38, Pluronic® F68, Pluronic® F87, Pluronic® F108, Pluronic® 10R5, Pluronic® 17R2, Pluronic® 17R4, Pluronic® 25R2, Pluronic® 25R4, Pluronic® 31R1, Pluronic® F108 Cast Solid Surfacta, Pluronic® F108 NF, Pluronic® F108 Pastille, Pluronic® F108NF Prill Poloxamer 338, Pluronic® F127 NF, Pluronic® F127 NF 500 BHT Prill, Pluronic® F127 NF Prill Poloxamer 407, Pluronic® F38 Pastille, Pluronic® F68 LF Pastille, Pluronic® F68 NF, Pluronic® F68 NF Prill Poloxamer 188, Pluronic® F68 Pastille, Pluronic® F77, Pluronic® F77 Micropastille, Pluronic® F87 NF, Pluronic® F87 NF Prill Poloxamer 237, Pluronic® F88, Pluronic® F88 Pastille, Pluronic® F98, Pluronic® FT L 61, Pluronic® L10, Pluronic® L101, Pluronic® L121, Pluronic® L31, Pluronic® L35, Pluronic® L43, Pluronic® L61, Pluronic® L62, Pluronic® L62 LF, Pluronic® L62D, Pluronic® L64, Pluronic® L81, Pluronic® L92, Pluronic® L44 NF INH Surfactant Poloxamer 124, Pluronic® N 3, Pluronic® P 103, Pluronic® P 104, Pluronic® P 105, Pluronic® P 123 Surfactant, Pluronic® P 65, Pluronic® P 84, Pluronic® P 85 и т.п. Образцовые полиэфирамины включают, но не ограничиваясь этим, Jeffamine® ED-2003, Jeffamine® D-2000 Jeffamine® D-230, Jeffamine® D-400, Jeffamine® EDR-176, Jeffamine® SD-2001, Jeffamine® T-403, Jeffamine® T-5000. Дополнительные компоненты могут включать, например, циклодекстрины, такие как α-, β- и γ-циклодекстрины. Способы, хорошо известные в данной области, можно использовать для того, чтобы генерировать составы с замедленным высвобождением. Компоненты можно формулировать в желаемой концентрации и соотношениях, включая в качестве неограничивающих примеров концентрацию от 0,1% до 30%, например, от 0,5% масс./масс. до 20%, 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19%, 20% и т.п. масс./масс. от конечной массы композиции. Другие системы доставки пептидов с замедленным высвобождением, известные в данной области, включают, например, состав наночастиц, который содержит поли(молочную-когликолевую кислоту) (PLGA), полилактид (PLA), PEG/PLGA и липосомы, которые также можно использовать для того, чтобы генерировать состав с замедленным высвобождением. Составы с замедленным высвобождением хорошо известны в данной области (см., например, Remington's Pharmaceutical Sciences, 18th ed., Mack Publishing Company, Easton PA (1990)). Составы с замедленным высвобождением можно использовать для предоставления стабильной и/или непрерывной дозы пептида или аналога по изобретению и/или для того, чтобы избегать повторного введения.
[0075] Фармацевтическую композицию можно вводить многими путями, в зависимости от того, желаемым является местное или системное лечение, и от области, подлежащей лечению. Понятно, что различные пути введения можно использовать для пептидов, аналогов и способов по изобретению. Такие пути охватывают системное и местное введение и включают, без ограничения, внутривенную инъекцию, интраперитонеальную инъекцию, внутримышечную инъекцию, подкожную инъекцию, трансдермальную доставку, трансдермальную диффузию или электрофорез, ингаляционное введение, пероральное введение, местную инъекцию, внутриполостное и устройства доставки с длительным высвобождением, включая локально имплантированные устройства с длительным высвобождением, такие как биоразрушаемые импланты или импланты, основанные на резервуарах. Введение может быть топическим (в том числе офтальмическим, вагинальным, ректальным, интраназальным), пероральным, посредством ингаляции или парентеральным, например, посредством внутривенного вливания, подкожной, интраперитонеальной или внутримышечной инъекции. Составы с замедленным высвобождением можно доставлять через формирование имплантов in situ. Кроме того, понятно, что пептиды или аналоги по изобретению можно вводить ежедневно за одно введение, за несколько ежедневных введений, в составах с замедленным высвобождением или с непрерывным или периодическим, не непрерывным введением, через промежутки в не следующие друг за другом дни и так далее с тем, чтобы достигать желаемого эффекта.
[0076] Препараты для парентерального введения включают стерильные водные или неводные растворы, суспензии и эмульсии. Примерами неводных растворителей являются пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло, и инъецируемые органические сложные эфиры, такие как этилолеат. Водные носители включают воду, спиртовые/водные растворы, эмульсии или суспензии, в том числе физиологический раствор и забуференные среды. Парентеральные наполнители включают раствор хлорида натрия, декстрозу Рингера, декстрозу и хлорид натрия, Рингер-лактат или жирные масла. Внутривенные наполнители включают текучие вещества и восполнители питательных веществ, восполнители электролитов (такие как те, что основаны на декстрозе Рингера) и т.п. Также могут присутствовать консерванты и другие добавки, такие как, например, антимикробные средства, антиокислители, хелатирующие средства и инертные газы, и т.п. Инсулин представляет собой хорошо известное пептидное терапевтическое средство, так что способы, используемые для доставки инсулина, в частности, пригодны в качестве способа доставки для пептидов или аналогов по изобретению, включая в качестве неограничивающих примеров шприцы, ручки, инфузионные насосы, ингаляторы, спреи для рта, пилюли и т.п.
[0077] Руководство с подходящими дозами пептидов или аналогов по изобретению предоставлено в Dungan et al, Diabetes Metab. Res. Rev., 25:558-565 (2009). В частности, клинические исследования у человека с использованием пептида INGAP предоставляют указание на подходящие возможные дозы для пептидов или аналогов по изобретению. Поскольку пептиды или аналоги по изобретению демонстрируют усовершенствованную эффективность относительно исходного пептида INGAP (см. примеры), пептиды или аналоги по изобретению можно вводить в эффективных дозах, которые ниже, чем те, которые используют для INGAP. Образцовые дозы пептидов или аналогов по изобретению включают, но не ограничиваясь этим, 0,01-1000 мг в сутки, например, 0,01, 0,02, 0,03, 0,04, 0,05, 0,06, 0,07, 0,08, 0,09, 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 210, 220, 230, 240, 250, 260, 270, 280, 290, 300, 310, 320, 330, 340, 350, 360, 370, 380, 390, 400, 410, 420, 430, 440, 450, 460, 470, 480, 490, 500, 510, 520, 530, 540, 550, 560, 570, 580, 590, 600, 610, 620, 630, 640, 650, 660, 670, 680, 690, 700, 710, 720, 730, 740, 750, 760, 770, 780, 790, 800, 810, 820, 830, 840, 850, 860, 870, 880, 890, 900, 910, 920, 930, 940, 950, 960, 970, 980, 990 или 1000 мг в сутки. В конкретном варианте осуществления дозы пептида составляют приблизительно 1-100 мг в сутки, например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100 мг в сутки. Образцовые диапазоны доз включают, но не ограничиваясь этим, 0,01-1000, 0,1-1000, 1-1000, 10-1000, 100-1000, 0,01-500, 0,1-500, 1-500, 10-500, 100-500, 0,01-400, 0,1-400, 1-400, 10-400, 100-400, 0,01-300, 0,1-300, 1-300, 10-300, 100-300, 0,01-200, 0,1-200, 1-200, 10-200, 100-200, 0,01-100, 0,1-100, 1-100, 10-100, 1-90, 1-80, 1-70, 1-60, 1-50, 1-40, 1-30, 1-20, 1-10, 5-100, 5-90, 5-80, 5-70, 5-60, 5-50, 5-40, 5-30, 5-20, 5-10, 10-100, 10-90, 10-80, 10-70, 10-60, 10-50, 10-40, 10-30, 10-20, 15-100, 15-90, 15-80, 15-70, 15-60, 15-50, 15-40, 15-30, 15-20, 20-100, 20-90, 20-80, 20-70, 20-60, 20-50, 20-40, 20-30, 25-100, 25-90, 25-80, 25-70, 25-60, 25-50, 25-40, 25-30, 30-100, 30-90, 30-80, 30-70, 30-60, 30-50, 30-40, 35-100, 35-90, 35-80, 35-70, 35-60, 35-50, 35-40, 35-30, 40-100, 40-90, 40-80, 40-70, 40-60, 40-50, 45-100, 45-90, 45-80, 45-70, 45-60, 45-50, 50-100, 50-90, 50-80, 50-70, 50-60, 55-100, 55-90, 55-80, 55-70, 55-60, 60-100, 60-90, 60-80, 60-70, 65-100, 65-90, 65-80, 65-70, 70-100, 70-90, 70-80, 75-100, 75-90, 75-80, 80-100, 80-90, 90-100 и т.п. или какие-либо приращения доз для доз, перечисленных выше. Специалистам в данной области понятно, что дозы пептидов и аналогов по изобретению в целом предоставляют в виде дозы, подлежащей введению субъекту в сутки. Кроме того, специалистам в данной области понятно, что дозу можно корректировать посредством увеличения или уменьшения дозы в зависимости от восприимчивости субъекта, массы, субъекта и так далее, как хорошо известно врачу или клиническому специалисту в данной области. Пептиды или аналоги в таблицах 2 или 3 или другие пептиды или аналоги, описанные в настоящем документе, или формулы, описанные в настоящем документе, можно предоставлять в композиции в указанных дозах, как описано в настоящем документе. В конкретном варианте осуществления композиция может содержать пептид или аналог SEQ ID № 12 или SEQ ID № 31 в указанных дозах.
[0078] Как описано в настоящем документе, пептиды и аналоги по изобретению в частности можно использовать для лечения определенных заболеваний и нарушений. Например, пептиды или аналоги по изобретению можно использовать для лечения ослабленной функции поджелудочной железы, лечения метаболического заболевания, содействия нейропротекции или регенерации нервов, содействия регенерации печени или ингибирования воспаления. Таким образом, изобретение дополнительно предусматривает композиции по изобретению для лечения ослабленной функции поджелудочной железы, лечения метаболического заболевания, содействия нейропротекции или регенерации нервов, содействия регенерации печени или ингибирования воспаления. Такие композиции могут содержать пептид или аналог, такой как те, которые описаны в настоящем документе в таблицах 2 или 3, или другие пептиды или аналоги, описанные в настоящем документе, или формулы, описанные в настоящем документе. В конкретном варианте осуществления композиция может содержать пептид или аналог SEQ ID № 12 или SEQ ID № 31. Использование пептидов и аналогов по изобретению в таких терапевтических применения описано далее более подробно.
[0079] При желании, пептиды или аналоги по изобретению можно вводить в комбинации. Например, комбинацию двух или более пептидов или аналогов по изобретению, включая те, которые описаны в настоящем документе и показаны в таблицах 2 и 3, или другие пептиды или аналоги, описанные в настоящем документе, или формулы, описанные в настоящем документе, например, пептид или аналог SEQ ID № 12 или SEQ ID № 31, можно вводить в способе лечения, как описано в настоящем документе. Такую комбинацию можно вводить параллельно или в отдельных составах или объединять в один и тот же состав, в зависимости от пептидов, подлежащих введению, и совместимости составов для пептидов или аналогов по изобретению. Альтернативно, два или более пептида или аналога по изобретению можно вводить последовательно, в том числе в те же сутки или поочередно в отдельные сутки.
[0080] Кроме того, специалистам в данной области понятно, что пептиды и аналоги по изобретению необязательно можно вводить с лекарственными средствами или терапевтическими средствами для лечения определенного состояния. Например, в случае лечения диабета или связанных состояний, другие лекарственные средства против диабета можно вводить с пептидами или аналогами по изобретению. Понятно, что такое совместное введение может происходить параллельно, или в отдельных составах или комбинированно в одном и том же составе, в зависимости от лекарственных средств, которые вводят, и совместимости составов для пептидов или аналогов по изобретению. Альтернативно, совместное введение может происходить последовательно, в том числе в одни и те же сутки или поочередно в отдельные сутки. Специалисту в данной области известные подходящие схемы введения, подходящие для эффективной доставки пептида или аналога по изобретению с другим лекарственным средством или терапевтическим средством. Кроме того, понятно, что введение пептида или аналога может быть периодическим.
[0081] В случае лечения инсулиновых или связанных нарушений, подходящие антидиабетические лекарственные средства включают, но не ограничиваясь этим, инсулин, прамлинтид, агонисты рецептора GLP-1, оральные антидиабетические средства и т.п. Образцовые антидиабетические лекарственные средства включают, но не ограничиваясь этим, инсулин, меглитиниды, например, репаглинид (Prandin™) и натеглинид (Starlix™); сульфонилмочевины, например, глипизид (Glucotrol™), глимепирид (Amaryl™) и глибурид (DiaBeta™, Glynase™); ингибиторы дипептидилпептидазы-4 (DPP-4), например, саксаглиптин (Onglyza™), ситаглиптин (Januvia™) и линаглиптин (Tradjenta™); бигуаниды, например, метформин (Fortamet™, Glucophage™); тиазолидиндионы, например, росиглитазон (Avandia™) и пиоглитазон (Actos™); ингибиторы α-глюкозидазы, например, акарбоза (Precose™) и миглитол (Glyset™); амилиновые миметики, например, прамлинтид (Symlin™); и инкретиновые миметики, например, эксенатид (Byetta™) и лираглутид (Victoza™). Таким образом, в способах и использованиях по изобретению для лечения диабета или связанных состояний антидиабетическое лекарственное средство можно вводить с пептидом или аналогом по изобретению. Для диабета 2-го типа средства для неогенеза островков, такие как пептиды или аналоги по изобретению, можно использовать у пациентов с хорошим уровнем управления глюкозой посредством изменения образа жизни или с использованием комбинации антидиабетических средств, таких как метформин, тиазолидиндионы, GLP-1, инсулин и т.п., как описано выше, чтобы сделать возможным созревание вновь сформированных островков.
[0082] Диабет 1-го типа и латентный аутоиммунный диабет у взрослых (LADA) являются аутоиммунными заболеваниями. Следовательно, в случае субъекта, который имеет диабет 1-го типа или LADA, другое терапевтическое средство, которое можно вводить с пептидом или аналогом по изобретению, может представлять собой, например, иммуномодулирующее средство. Иммуномодулирующее средство можно использовать для блокирования или уменьшения разрушения неогенного островка или β-клеток, связанного с аутоиммунной реакцией. Образцовые иммуномодулирующие средства включают, но не ограничиваясь этим, сиролимус (рапамицин, Рапамун™), такролимус (FK 506, Prograf™), лизофиллин, антитимоцитарный глобулин, базиликсимаб (Simulect™), DiaPep277™ и т.п. Известно, что островки подвержены глюкозной токсичности, липотоксичности и иммунной атаке (для T1D). Для диабета 1-го типа у пациентов с хорошим управлением гликемией можно использовать средства для неогенеза островков, такие как пептиды или аналоги по изобретению, и комбинацию иммуномодулирующих средств для того, чтобы защищать вновь образованные островки от иммунной атаки.
[0083] Как описано в настоящем документе, пептиды и аналоги по изобретению проявляют неожиданные свойства по сравнению с таковыми у исходных пептидов INGAP-PP и HIP, в том числе пептиды и аналоги из таблиц 2 и 3, которые не являются исходными пептидами INGAP-PP или HIP. Как описано в настоящем документе, пептиды и аналоги по изобретению проявляют усовершенствованную стабильность в культуральной среде и плазме относительно таковых у исходного пептида (см. пример III и XI). Пептидные аналоги по изобретению также эффективны в значительном улучшении глюкозы крови, инсулине натощак и оральной толерантности к глюкозе (см. пример IV). Пептидные аналоги по изобретению также проявляют значительно увеличенный эффект неогенеза островков относительно исходного пептида (см. пример V, пример VIII и пример IX). Кроме того, пептидные аналоги по изобретению проявляют значительно увеличенную способность стимулировать секрецию инсулина в основных клетках панкреатических островков (см. пример VI). Дополнительно, пептидные аналоги по изобретению демонстрировали превосходные фармакокинетические свойства (см. примеры VII и X). Многие неожиданные и превосходные свойства пептидов и аналогов по изобретению указывают на то, что пептиды и аналоги по изобретению, включая пептиды и аналоги из таблиц 2 и 3, в том числе другие пептиды или аналоги, описанные в настоящем документе, или формулы, описанные в настоящем документе, которые не являются исходными пептидами INGAP-PP или HΙΡ, например, SEQ ID № 12 или SEQ ID № 31, можно использовать для терапевтических применений.
[0084] Кроме того, обнаружено, что пептиды и аналоги по изобретению индуцируют дополнительные кластеры островковых инсулин-положительных β-клеток (см. пример VIII). Пептидные аналоги эффективны в 1/10 дозы исходного пептида INGAP-PP. Также эффекты неогенеза островков для пептидных аналогов определяли как отражено в распределении размеров панкреатических островков (см. пример IX). Пептидные аналоги эффективны в 1/100 дозы исходного пептида INGAP-PP. Таким образом, пептиды и аналоги по изобретению могут проявлять более высокую активность, чем исходный пептид INGAP-PP или HIP. В данной области известно, что неогенные островки можно получать из клеток протоков поджелудочной железы или ацинарных клеток (см. Yatoh et al, Diabetes 56: 1802-1809 (2007); Lipsett and Finegood, Diabetes 51: 1834-1841 (2002)). Таким образом, пептиды и аналоги по изобретению можно использовать для того, чтобы получать неогенные островки из клеток протоков поджелудочной железы и/или ацинарных клеток.
[0085] В дополнительном варианте осуществления изобретение относится к способу улучшения признака или симптома, связанного с ослабленной функцией поджелудочной железы, который включает введение пептида или аналога по изобретению. Такие пептиды или аналоги по изобретению могут представлять собой, например, пептид или аналог из таблиц 2 или 3, в том числе другие пептиды или аналоги, описанные в настоящем документе, или формулы, описанные в настоящем документе. В конкретном варианте осуществления изобретение относится к способу улучшения признака или симптома, связанного с ослабленной функцией поджелудочной железы, который включает введение пептида или аналога SEQ ID № 12 или SEQ ID № 31. Заболевание или состояние, связанное с ослабленной функцией поджелудочной железы, включает, но не ограничиваясь этим, диабет 1-го типа, диабет 2-го типа, латентный аутоиммунный диабет у взрослых (LADA), сниженную глюкозу натощак, сниженную толерантность к глюкозе, дефицит инсулина, гиперинсулинемию натощак, резистентность к инсулину или сниженные уровни инсулина натощак или их сочетание. Поджелудочная железа продуцирует инсулин для регулирования глюкозы крови. В состояниях, таких как диабет 1-го и 2-го типа и LADA, организм не может нормально отвечать на образование глюкозы, что ведет к множеству связанных состояний (см. Cecil Textbook of Medicine, Bennett and Plum, eds., 20th ed., W.B. Saunders, Philadelphia (1996); Harrison's Principles of Internal Medicine, Fauci et al, eds., 14th ed., McGraw-Hill, New York (1998)). Специалистам в данной области понятно, что такие состояния, которые коррелируют со сниженной функцией поджелудочной железы, включены в значение ослабленной функции поджелудочной железы.
[0086] Сахарный диабет представляет собой серьезное метаболическое заболевание, которое определяется присутствием хронически повышенных уровней глюкозы крови (гипергликемия). Это состояние гипергликемии представляет собой результат относительного или абсолютного недостатка активности пептидного гормона, инсулина. Инсулин продуцируют и секретируют β-клетки поджелудочной железы. Инсулин способствует утилизации глюкозы, синтезу белка и образованию и хранению энергии углеводов в виде гликогена. Глюкоза хранится в организме в виде гликогена, полимеризованной формы глюкозы, которую можно превращать обратно в глюкозу, чтобы отвечать требованиям метаболизма. В нормальных условиях секреция инсулина происходит как на базовой скорости, так и на повышенных скоростях после стимуляции глюкозой, предназначенных для того, чтобы поддерживать метаболический гомеостаз посредством превращения глюкозы в гликоген.
[0087] Термин сахарный диабет охватывает несколько различных гипергликемических состояний. Эти состояния включают диабет 1-го типа (инсулинозависимый сахарный диабет или IDDM) и 2-го типа (независимый от инсулина сахарный диабет или NIDDM). Гипергликемия, присутствующая у индивидуумов с диабетом 1-го типа, связана с недостаточными, сниженными или несуществующими уровнями инсулина, которые недостаточны для того, чтобы поддерживать уровни глюкозы в крови в физиологическом диапазоне. Лечение диабета 1-го типа включает введение замещающих доз инсулина, в целом, через парентеральный путь. Гипергликемия, присутствующая у индивидуумов с диабетом 2-го типа, изначально связана с нормальными или повышенными уровнями инсулина; однако, эти индивидуумы не способны поддерживать метаболический гомеостаз из-за состояния резистентности к инсулину в периферических тканях и печени и, по мере развития заболевания, из-за прогрессирующего повреждения панкреатических β-клеток, которые отвечают за секрецию инсулина. Таким образом, начальная терапия диабета 2-го типа может быть основана на диете и изменениях образа жизни, которые дополняет терапия оральными гипогликемическими средствами, такие как сульфонилмочевины. Инсулиновая терапия часто необходима, однако, в частности, на поздних стадиях заболевания, чтобы получать некоторый контроль над гипергликемией и минимизировать осложнения заболевания. Известно, что при диабете 2-го типа β-клетки подвержены глюкозной токсичности, липотоксичности, хроническому окислительному стрессу, и их сочетаниям; при диабете 1-го типа β-клетки в первую очередь подвержены иммунной атаке и глюкозной токсичности. относительно стабильная глюкоза крови и уровень липидов могут обеспечивать более здоровое окружение для неогенных островков для развития в зрелые и функциональные островки у пациентов с диабетом 2-го типа; для диабета 1-го типа дополнительные иммуномодулирующие средства могут обеспечивать желаемое физиологическое окружение для развития неогенных островков.
[0088] Изобретение дополнительно предусматривает способ улучшения признака или симптома, связанного с метаболическим заболеванием, у субъекта, который включает введение пептида или аналога по изобретению субъекту. Такое метаболическое заболевание включает, но не ограничиваясь этим, диабет, преддиабет или метаболический синдром. Такие пептиды или аналоги по изобретению могут представлять собой, например, пептид или аналог из таблиц 2 или 3, в том числе другие пептиды или аналоги, описанные в настоящем документе, или формулы, описанные в настоящем документе. В конкретном варианте осуществления изобретение относится к способу улучшения признака или симптома, связанного с метаболическим заболеванием у субъекта, который включает введение пептида или аналога SEQ ID № 12 или SEQ ID № 31.
[0089] Преддиабет представляет собой состояние, в котором уровень сахара в крови выше нормального, но все еще не достаточно высок для того, чтобы его классифицировать как диабет 2-го типа. Метаболический синдром является названием группы факторов риска, которые встречаются вместе и увеличивают риск болезни коронарных артерий, инсульта и диабета 2-го типа. Двумя наиболее важными факторами риска для метаболического синдрома являются избыточный вес в средней и верхней частях тела (центральное ожирение, так сказать «в форме яблока») и резистентность к инсулину, при которой организм использует инсулин менее эффективно, чем в норме. Инсулин необходим для того, чтобы помогать управлять количеством сахара в организме. В результате возрастают уровни сахара и жира в крови. Считают, что метаболический синдром присутствует, если субъект имеет ри или больше из следующих признаков: кровяное давление, равное или превышающее 130/85 мм рт. ст.; сахар (глюкоза) крови натощак, равная или превышающая 100 мг/дл; большая окружность талии (длина вокруг талии; у мужчин 40 дюймов или больше; у женщин 35 дюймов или больше); низких HDL холестерин (у мужчин ниже 40 мг/дл; у женщин ниже 50 мг/дл); триглицериды 150 мг/дл или выше.
[0090] Специалист в данной области легко поймет и сможет легко определить подходящие показатели эффективности пептидов или аналогов по изобретению при улучшении признака или симптома, связанного с состоянием или заболеванием, связанным с ослабленной функцией поджелудочной железы и/или метаболическим заболеванием. Например, диабет и 1-го типа и 2-го типа представляют собой хорошо описанные заболевания с множеством известных параметров для диагностирования и/или мониторинга прогрессирования заболевания и/или для осуществления мониторинга эффективности терапии. Такие параметры включают, но не ограничиваясь этим, уровни глюкозы в плазме, уровни глюкозы натощак, оральный тест на толерантность к глюкозе (OGTT), уровни инсулина, уровни инсулина натощак, уровни гликозилированного гемоглобина и т.п.
[0091] Пептиды или аналоги по изобретению, следовательно, можно использовать для улучшения какого-либо одного или нескольких признаков или симптомов, связанных с ослабленной функцией поджелудочной железы и/или метаболическим заболеванием. В случае диабета, такие признаки или симптомы включают, но не ограничиваясь этим, ослабленную толерантность к глюкозе, повышенную глюкозу крови (в частности, выше 200 мг/дл), повышенную глюкозу крови натощак (в частности, выше 140 мг/дл), повышенную глюкозу крови после приема пищи, дефицит инсулина, гиперинсулинемию натощак, резистентность к инсулину, сниженные уровни инсулина натощак, повышенный гликозилированный гемоглобин (HbA1c) и т.п. Такие признаки или симптомы хорошо известны специалистам в данной области, и их могут обычным образом определять специалисты в данной области, в том числе тестами, доступными в медицинских тестовых лабораториях. В одном из вариантов осуществления изобретения, изобретение относится к способу снижения признака или симптома, связанного с состоянием, таким как диабет, например, к способу снижения ослабленной толерантности к глюкозе, глюкозы крови, в частности, суточной средней концентрации глюкозы в крови, глюкозы крови натощак, глюкозы в крови после приема пищи, дефицита инсулина, гиперинсулинемии натощак, резистентности к инсулину, сниженных уровней инсулина натощак, гликозилированного гемоглобина (HbA1c), аргинин-стимулированного C-пептида, повышенного гликирования конечных продуктов (AGE) или их сочетания, посредством введения пептида или аналога по изобретению. В способе используют пептиды или аналоги по изобретению. Такие пептиды или аналоги по изобретению могут представлять собой, например, пептид или аналог из таблиц 2 или 3, в том числе другие пептиды или аналоги, описанные в настоящем документе, или формулы, описанные в настоящем документе. В конкретном варианте осуществления изобретение относится к способу снижения признака или симптома, связанного с состоянием, таким как диабет, например, способ снижения ослабленной толерантности к глюкозе, глюкозы крови, в частности, суточной средней концентрации глюкозы в крови, глюкозы крови натощак, глюкозы крови после приема пищи, дефицита инсулина, гиперинсулинемии натощак, резистентности к инсулину, ослабленных уровней инсулина натощак, гликозилированного гемоглобина (HbA1c), аргинин-стимулированного C-пептида, повышенного гликирования конечных продуктов (AGE) или их сочетания, посредством введения пептида или аналога SEQ ID № 12 или SEQ ID № 31. Способы мониторинга эффективности лекарственного средства для лечения диабета хорошо известны специалистам в данной области (см., например, Cecil Textbook of Medicine, выше; Harrison's Principles of Internal Medicine, выше, Dungan et al, Diabetes/Metabolism Res. Rev. 25:558-565 (2009); патент США № 8329648). Таким образом, изобретение относится к способу снижения у субъекта с диабетом ослабленной толерантности к глюкозе, глюкозы крови, глюкозы крови натощак, глюкозы крови после приема пищи, дефицита инсулина, гиперинсулинемии натощак, резистентности к инсулину, ослабленных уровней инсулина натощак, гликозилированного гемоглобина (HbA1c), аргинин-стимулированного C-пептида, повышенного гликирования конечных продуктов (AGE) или их сочетания, посредством введения пептида или аналога по изобретению субъекту. Такие пептиды или аналоги по изобретению могут представлять собой, например, пептид или аналог из таблиц 2 или 3, в том числе другие пептиды или аналоги, описанные в настоящем документе, или формулы, описанные в настоящем документе. В конкретном варианте осуществления изобретение относится к способу снижения у субъекта с диабетом ослабленной толерантности к глюкозе, глюкозы крови, глюкозы крови натощак, глюкозы крови после приема пищи, дефицита инсулина, гиперинсулинемии натощак, резистентности к инсулину, ослабленных уровней инсулина натощак, гликозилированного гемоглобина (HbA1c), аргинин-стимулированного C-пептида, повышенного гликирования конечных продуктов (AGE) или их сочетание посредством введения пептида или аналога SEQ ID № 12 или SEQ ID № 31.
[0092] Как описано в настоящем документе, пептиды и аналоги по изобретению, в частности, эффективны при стимуляции роста клеток панкреатического островка и индукции кластеров β-клеток (см. пример V, пример VIII и пример IX). Образцовые пептиды и аналоги по изобретению демонстрировали усовершенствованный эффект неогенеза островков относительно исходного пептида (пример V, пример VIII и пример IX).
[0093] Таким образом, изобретение дополнительно предусматривает способ стимуляции роста клеток панкреатического островка посредством контакта клеток панкреатического островка in vitro с пептидом или аналогом по изобретению, посредством чего стимулируют пролиферацию клеток панкреатического островка. Такие пептиды или аналоги по изобретению могут представлять собой, например, пептид или аналог из таблиц 2 или 3, в том числе другие пептиды или аналоги, описанные в настоящем документе, или формулы, описанные в настоящем документе. В конкретном варианте осуществления изобретение относится к способу стимуляции роста клеток панкреатического островка посредством контакта клеток панкреатического островка in vitro с пептидом или аналогом SEQ ID № 12 или SEQ ID № 31. В другом варианте осуществления изобретение относится к способу получения популяции клеток панкреатических островков, который включает контакт одной или нескольких клеток панкреатических островков in vitro с пептидом или аналогом по изобретению, посредством чего стимулируют пролиферацию одной или нескольких клеток панкреатических островков и получают популяцию клеток панкреатических островков. Такие пептиды или аналоги по изобретению могут представлять собой, например, пептид или аналог из таблиц 2 или 3, в том числе другие пептиды или аналоги, описанные в настоящем документе, или формулы, описанные в настоящем документе. В конкретном варианте осуществления изобретение относится к способу получения популяции клеток панкреатических островков, который включает контакт одной или нескольких клеток панкреатических островков in vitro с пептидом или аналогом SEQ ID № 12 или SEQ ID № 31. Способы по изобретению можно использовать для индукции островков, роста и пролиферации ex vivo для трансплантации и для увеличения выживаемости трансплантированных островков in vivo с использованием пептидов или аналогов по изобретению. Такие пептиды или аналоги по изобретению могут представлять собой, например, пептид или аналог из таблиц 2 или 3, в том числе другие пептиды или аналоги, описанные в настоящем документе, или формулы, описанные в настоящем документе. В конкретном варианте осуществления изобретение относится к способу индукции островков, роста и пролиферации ex vivo для трансплантации и для увеличения и улучшения выживаемости трансплантированных островков in vivo с использованием пептида или аналога SEQ ID № 12 или SEQ ID № 31.
[0094] Способы по изобретению дополнительно можно использовать для того, чтобы сохранять выделенные островковые клетки с использованием пептидов или аналогов по изобретению. Такие пептиды или аналоги по изобретению могут представлять собой, например, пептид или аналог из таблиц 2 или 3, в том числе другие пептиды или аналоги, описанные в настоящем документе, или формулы, описанные в настоящем документе. В конкретном варианте осуществления изобретение относится к способу сохранения выделенные островковых клеток с использованием пептида или аналога SEQ ID № 12 или SEQ ID № 31. Таким образом, изобретение относится к способам роста и пролиферации островков ex vivo для трансплантации с использованием пептидов или аналогов по изобретению посредством контакта островковых клеток in vitro, увеличения числа островковых клеток и необязательно использования клеток для трансплантации. Такие пептиды или аналоги по изобретению могут представлять собой, например, пептид или аналог из таблиц 2 или 3, в том числе другие пептиды или аналоги, описанные в настоящем документе, или формулы, описанные в настоящем документе. В конкретном варианте осуществления изобретение относится к способу роста и пролиферации островков ex vivo для трансплантации с использованием пептидов или аналогов по изобретению посредством контакта островковых клеток in vitro, увеличения числа островковых клеток и необязательно использования клеток для трансплантации посредством контакта клеток с пептидом или аналогом SEQ ID № 12 или SEQ ID № 31. Изобретение также относится к способу увеличения выживаемости трансплантированных островков in vivo посредством введения субъекту пептида или аналога по изобретению, где субъект является реципиентом трансплантированных островковых клеток. Такие пептиды или аналоги по изобретению могут представлять собой, например, пептид или аналог из таблиц 2 или 3, в том числе другие пептиды или аналоги, описанные в настоящем документе, или формулы, описанные в настоящем документе. В конкретном варианте осуществления изобретение относится к способу увеличения выживаемости трансплантированных островок in vivo посредством введения субъекту введения пептида или аналога SEQ ID № 12 или SEQ ID № 31. Пептиды или аналоги по изобретению, таким образом, можно использовать для того, чтобы создавать клетки для трансплантации, с использованием способов in vitro и ex vivo, а также для того, чтобы увеличивать выживаемость трансплантированных островковых клеток. Такие трансплантированные клетки можно получать способами in vitro с использованием пептидов или аналогов по изобретению или из традиционных источников для трансплантации островковых клеток, таких как трупы. Способы по изобретению дополнительно можно использовать для того, чтобы лечить пациента с утраченной или ослабленной функцией поджелудочной железы посредством введения пептида или аналога по изобретению. Такая утрата или ослабление функции поджелудочной железы может возникать, например, при частичной панкреатэктомии, например, из-за повреждения, воспаления, новообразований, гиперинсулинемической гипогликемии и т.п., или при состояниях, которые влияют на функцию поджелудочной железы, таких как кистозный фиброз. Такие пептиды или аналоги по изобретению могут представлять собой, например, пептид или аналог из таблиц 2 или 3, в том числе другие пептиды или аналоги, описанные в настоящем документе, или формулы, описанные в настоящем документе. В конкретном варианте осуществления изобретение относится к способу лечения пациента с утраченной или ослабленной функцией поджелудочной железы посредством введения пептида или аналога SEQ ID № 12 или SEQ ID № 31.
[0095] В конкретном варианте осуществления одну или несколько клеток панкреатических островков можно получать у субъекта. Популяцию клеток панкреатических островков, получаемую посредством стимулирования пролиферации клеток панкреатических островков, можно использовать, например, для трансплантации субъекту и восстановления функции клеток панкреатического островка. Таким образом, способ по изобретению дополнительно может включать стадию трансплантации популяции клеток панкреатических островков субъекту. В конкретном варианте осуществления одну или несколько клеток поджелудочной железы получают у субъекта, которому будут имплантировать популяцию клеток панкреатических островков. Альтернативно, клетки панкреатических островков, подлежащие трансплантации, получают у подходящего донора, который имеет совместимый тип крови.
[0096] Трансплантация панкреатических островков описана ранее (см., например, Shapiro et al, N. Engl. J. Med. 343:230-238 (2000)). Клетки панкреатических островков можно получать у субъекта или альтернативно у подходящего донора, включая островковые клетки, взятые у трупа. В целом, реципиенту трансплантата вводят иммуносупрессорные лекарственные средства для снижения отторжения островковых клеток (см., например, иммуносупрессорные лекарственные средства, описанные в настоящем документе). Использование подходящих иммуносупрессорных лекарственных средств хорошо известно в области трансплантации органов или клеток. Таким образом, в способах по изобретению, в которых клетки панкреатических островков стимулируют для пролиферации in vitro для того, чтобы получать популяцию клеток панкреатических островков, такую популяцию можно трансплантировать субъекту с использованием хорошо известных способов трансплантации клеток панкреатического островка. Кроме того, пептиды или аналоги по изобретению можно использовать для того, чтобы индуцировать дифференциацию клеток протоков поджелудочной железы в островковые клетки, в частности, β-клетки (см. Yatoh et al, Diabetes 56: 1802-1809 (2007)). Таким образом, изобретение дополнительно предусматривает способ дифференциации клеток протоков поджелудочной железы в островковых клетки посредством контакта клетки протоков поджелудочной железы с пептидом или аналогом по изобретению. Такие пептиды или аналоги по изобретению могут представлять собой, например, пептид или аналог из таблиц 2 или 3, в том числе другие пептиды или аналоги, описанные в настоящем документе, или формулы, описанные в настоящем документе. В конкретном варианте осуществления изобретение относится к способу дифференциации клеток протоков поджелудочной железы в островковые клетки посредством контакта клетки протоков поджелудочной железы с пептидом или аналогом SEQ ID № 12 или SEQ ID № 31. Когда осуществляют способ, в котором клетка протоков поджелудочной железы контактирует in vitro, популяцию дифференцированных клеток протоков поджелудочной железы можно генерировать и использовать для трансплантации, как описано в настоящем документе.
[0097] Изобретение дополнительно предусматривает способ увеличения числа клеток панкреатических островков у субъекта, который включает введение пептида или аналога по изобретению субъекту. Такие пептиды или аналоги по изобретению могут представлять собой, например, пептид или аналог из таблиц 2 или 3, в том числе другие пептиды или аналоги, описанные в настоящем документе, или формулы, описанные в настоящем документе. В конкретном варианте осуществления изобретение относится к способу увеличения числа клеток панкреатических островков у субъекта, который включает введение пептида или аналога SEQ ID № 12 или SEQ ID № 31. Такой способ терапевтического лечения с использованием пептидов или аналогов по изобретению можно использовать для того, чтобы увеличивать клетки панкреатических островков у индивидуума, без необходимости собирать клетки поджелудочной железы у индивидуума или идентифицировать подходящего донора и без необходимости подвергать субъекта сложным трансплантационным процедурам и необходимости часто использовать иммуносупрессорные средства при использовании клеток донора, полученных не от пациента.
[0098] Как описано ранее, показано, что пептид INGAP улучшает нервную функцию и усиливает регенерацию нервов в модели диабета на мышах (Tarn et al, FASEB J. 18: 1767-1769 (2004)). Также показано, что пептид INGAP увеличивает невритные отростки у нейронов дорсальных корешковых ганглиев (Tarn et al, Biochem. Biophys. Res. Communic. 291:649-654 (2002; Tarn et al, NeuroReport 17: 189-193 (2006)). Как описано в настоящем документе, пептиды и аналоги по изобретению значительно более активны, чем исходный пептид INGAP, и ожидают, что они имеют схожую, но более высокую активность, чем INGAP. Таким образом, изобретение относится к способу содействия нейропротекции или регенерации нервов посредством контакта нервной клетки с пептидом или аналогом по изобретению, тем самым содействуя нейропротекции и/или регенерации нервов. Такие пептиды или аналоги по изобретению могут представлять собой, например, пептид или аналог из таблиц 2 или 3, в том числе другие пептиды или аналоги, описанные в настоящем документе, или формулы, описанные в настоящем документе. В конкретном варианте осуществления изобретение относится к способу содействия нейропротекции или регенерации нервов посредством контакта нервной клетки с пептидом или аналогом SEQ ID № 12 или SEQ ID № 31. Контакт с нервной клеткой может происходить in vivo или in vitro. В случае, когда нервная клетка контактирует in vivo, пептид или аналог по изобретению вводят субъекту, как и в случае других терапевтических способов, описанных в настоящем документе. В случае, когда нервная клетка контактирует in vitro, нейропротектированную клетку можно использовать в применении ex vivo и вводить клетку субъекту. Такие способы введения нервных клеток посредством трансплантации хорошо известны специалистам в данной области (см., например, Dunnett et al, Brit. Med. Bulletin 53:757-776 (1997)). Такие трансплантации выполняли для того, чтобы лечить такие неврологические состояния, как болезнь Паркинсона и хорея Гентингтона.
[0099] Пептид HIP описан как ускоряющий регенерацию печени (Lieu et al, Hepatol. 42:618-626 (2005). Как описано в настоящем документе, пептиды и аналоги по изобретению значительно более активны, чем исходный пептид HIP, и ожидают, что они имеют схожую, но более высокую активность, чем HIP. Таким образом, изобретение также относится к способу содействия регенерации печени посредством контакта клетки печени с пептидом или аналогом по изобретению, тем самым содействия регенерации печени. Такие пептиды или аналоги по изобретению могут представлять собой, например, пептид или аналог из таблиц 2 или 3, в том числе другие пептиды или аналоги, описанные в настоящем документе, или формулы, описанные в настоящем документе. В конкретном варианте осуществления изобретение относится к способу содействия регенерации печени посредством контакта клетки печени с пептидом или аналогом SEQ ID № 12 или SEQ ID № 31. Контакт с клеткой печени может происходить in vivo или in vitro. В случае, когда клетка печени контактирует in vivo, пептид или аналог по изобретению вводят субъекту, как и в случае других терапевтических способов, описанных в настоящем документе. В случае, когда клетка печени контактирует in vitro, клетки печени можно индуцировать к пролиферации, например, чтобы получать популяцию клеток печени. Популяцию клеток печени можно использовать в применении ex vivo и вводить клетки субъекту. Способы трансплантации или пересадки клеток печени в печень субъекта хорошо известны специалистам в данной области. Трансплантированные клетки можно использовать для того, чтобы восстанавливать поврежденную или метаболически дефективную ткань печени. Клетки печени можно вливать в воротную вену или селезенку, откуда клетки мигрируют в печень, обретают постоянное местонахождение и выполняют нормальные метаболические функции печени (см., например, Khan et al, Cell Transplant. 19:409-418 (2010)).
[00100] Обнаружено, что белок HIP (также обозначаемый как панкреатит-ассоциированный белок (PAP)) проявляет противовоспалительную активность in vivo и in vitro (Closa et al, World J. Gastroenterol. 13: 170-174 (2007)). Следовательно, ожидают, что пептиды и аналоги по изобретению проявляют противовоспалительную активность. Следовательно, изобретение дополнительно предусматривает способ ингибирования воспаления посредством введения пептида или аналога по изобретению. Такие пептиды или аналоги по изобретению могут представлять собой, например, пептид или аналог из таблиц 2 или 3, в том числе другие пептиды или аналоги, описанные в настоящем документе, или формулы, описанные в настоящем документе. В конкретном варианте осуществления изобретение относится к способу для ингибирования воспаления посредством введения пептида или аналога SEQ ID № 12 или SEQ ID № 31.
[00101] Изобретение также относится к использованию пептида или аналога по изобретению для получения лекарственного средства для лечения ослабленной функции поджелудочной железы, лечения метаболического заболевания, содействия нейропротекции или регенерации нервов, содействия регенерации печени или ингибирования воспаления у субъекта. Такие пептиды или аналоги по изобретению могут представлять собой, например, пептид или аналог из таблиц 2 или 3, в том числе другие пептиды или аналоги, описанные в настоящем документе, или формулы, описанные в настоящем документе. В конкретном варианте осуществления изобретение относится к использованию пептида или аналога SEQ ID № 12 или SEQ ID № 31 для получения лекарственного средства для лечения ослабленной функции поджелудочной железы, лечения метаболического заболевания, содействия нейропротекции или регенерации нервов, содействия регенерации печени или ингибирования воспаления у субъекта.
[00102] Изобретение дополнительно предусматривает использование пептида или аналога по изобретению для получения лекарственного средства для лечения ослабленной функции поджелудочной железы, лечения метаболического заболевания, содействия нейропротекции или регенерации нервов, содействия регенерации печени или ингибирования воспаления у субъекта. Такие использования могут быть предназначены, например, для того, чтобы осуществлять способам по изобретению, описанным в настоящем документе. Такие пептиды или аналоги по изобретению могут представлять собой, например, пептид или аналог из таблиц 2 или 3, в том числе другие пептиды или аналоги, описанные в настоящем документе, или формулы, описанные в настоящем документе. В конкретном варианте осуществления изобретение относится к использованию пептида или аналога SEQ ID № 12 или SEQ ID № 31 для получения лекарственного средства для лечения ослабленной функции поджелудочной железы, лечения метаболического заболевания, содействия нейропротекции или регенерации нервов, содействия регенерации печени или ингибирования воспаления у субъекта.
[00103] Как описано в настоящем документе, пептиды и аналоги по изобретению можно использовать в различных способах. Такие способы включают, но не ограничиваясь этим, лечение ослабленной функции поджелудочной железы, лечение метаболического заболевания, содействие нейропротекции или регенерации нервов, содействие регенерации печени или ингибирование воспаления. Во многих применениях по изобретению для терапевтического применения вводят пептиды или аналоги по изобретению. Однако понятно, что альтернативный вариант состоит в использовании генной терапии для того, чтобы экспрессировать пептид по изобретению посредством введения субъекту подходящего геннотерапевтического вектора, который содержит нуклеиновую кислоту, кодирующую пептид. Такие способы генной терапии описаны ниже более подробно и хорошо известны специалистам в данной области (см., например, Anderson, Nature 392 (Supp.):25-30 (1998)).
[00104] Носитель для доставки гена относится к молекуле, которая может вносить вставленные полинуклеотиды в клетку-хозяина. Примеры носителей для доставки гена представляют собой липосомы, мицеллы, биологически совместимые полимеры, в том числе природные полимеры и синтетические полимеры; липопротеины; полипептиды; полисахариды; липополисахариды; искусственные вирусные оболочки; металлические частицы; и бактерии или вирусы, такие как бакуловирусы, аденовирусы и ретровирусы, бактериофаги, космиды, плазмиды, грибковые векторы и другие рекомбинантные носители, типично используемые в данной области, которые описаны для экспрессии в различных эукариотических и прокариотических организмах-хозяевах и которые можно использовать для генной терапии, а также простой экспрессии белка.
[00105] Пептид или аналог по изобретению можно доставлять в клетку или ткань с использованием носителя для доставки гена. Доставка гена, перенос гена, трансдукция и т.п., как используют в настоящем документе, представляют собой термины, относящиеся ко введению экзогенного полинуклеотида (иногда обозначаемого как трансген) в клетку-хозяина, независимо от способа, используемого для введения. Такие способы включают различные общеизвестные способы, такие как вектор-опосредованный перенос гена (например, посредством вирусной инфекции/трансфекции, или различные другие комплексы для доставки гена на основе белков или липидов), а также способы, облегчающие доставку «голых» полинуклеотидов (такие как электропорация, доставка «генной пушкой» и различные другие способы, используемые для введения полинуклеотидов). Введенный полинуклеотид может сохраняться в клетке-хозяине постоянно или временно. Постоянное сохранение типично требует, чтобы введенный полинуклеотид или содержал участок начала репликации, совместимый с клеткой-хозяином, или встраивался в репликон клетки-хозяина, такой как внехромосомный репликон (например, плазмида) или ядерная или митохондриальная хромосома. Известно, что множество векторов способно опосредовать перенос генов в клетки млекопитающих, как известно в данной области.
[00106] Вирусный вектор относится к рекомбинантно полученному вирус или вирусной частице, которая содержит полинуклеотид, подлежащий доставке в клетку-хозяина, in vivo, ex vivo или in vitro. Примеры вирусных векторов включают ретровирусные векторы, аденовирусные векторы, аденоассоциированные вирусные векторы, альфавирусные векторы и т.п. Для использования в генной терапии и иммунотерапии также разработаны альфавирусные векторы, такие как векторы на основе вируса лихорадки леса Семлики и векторы на основе вируса Синдбис (см. Schlesinger and Dubensky Curr. Opin. Biotechnol. 5:434-439 (1999) и Ying, et al. Nat. Med. 5(7):823-827 (1999)).
[00107] В аспектах, где перенос гена опосредован ретровирусным вектором, векторная конструкция относится к полинуклеотиду, который содержит ретровирусный геном или его часть и терапевтический ген. Как используют в настоящем документе, опосредованный ретровирусом перенос гена или ретровирусная трансдукция имеет то же значение и относится к процессу, посредством которого ген или последовательности нуклеиновой кислоты стабильно переносят в клетку-хозяина посредством вхождения вируса в клетку и встраивания его генома в геном клетки-хозяина. Вирус может входить в клетку-хозяина через его нормальный механизм инфекции или может быть модифицирован так, что он связывается с другим рецептором или лигандом поверхности клетки-хозяина для вхождения в клетку. Как используют в настоящем документе, ретровирусный вектор относится к вирусной частице, способной вводить экзогенную нуклеиновую кислоту в клетку через вирусный или вирусоподобный механизм входа. Ретровирусы несут свою генетическую информацию в форме РНК; однако, когда вирус инфицирует клетку, происходит обратная транскрипция РНК в ДНК-форму, которая встраивается в геномную ДНК инфицированной клетки. Встроенную ДНК-форму называют провирусом.
[00108] В аспектах, где перенос гена опосредован ДНК вирусным вектором, таким как аденовирус (Ad) или аденоассоциированный вирус (AAV), векторная конструкция относится к полинуклеотиду, который содержит вирусный геном или его часть и трансген. Аденовирусы (Ad) представляют собой относительно хорошо описанную гомогенную группу вирусов, включающую более 50 серотипов (см., например, WO 95/27071). Для Ad не нужно встраивание в геном клетки-хозяина. Также созданы рекомбинантные Ad векторы, в частности, те, которые снижают потенциал рекомбинации и генерации вируса дикого типа (см., например, WO 95/00655 и WO 95/11984). AAV дикого типа обладают высокой инфекционностью и специфичностью встраивания в геном клетки-хозяина (см., например, Hermonat and Muzyczka, Proc. Natl. Acad. Sci. USA 81:6466-6470 (1984) и Lebkowski et al, Mol. Cell. Biol. 8:3988-3996 (1988)).
[00109] Векторы, которые содержат и промотор и сайт клонирования, с которым полинуклеотид может быть функционально связан, хорошо известны в данной области. Такие векторы способны к транскрипции РНК in vitro или in vivo и коммерчески доступны в таких источниках, как Stratagene (La Jolla, CA) и Promega Biotech (Madison, WI). Для того чтобы оптимизировать экспрессию и/или транскрипцию in vitro, может быть необходимо удалять, добавлять или изменять 5'- и/или 3'-нетранслируемые части клонов для того, чтобы удалять лишние, потенциально неподходящие альтернативные кодоны инициации трансляции или другие последовательности, которые могут препятствовать экспрессии или снижать ее, на уровне или транскрипции или трансляции. Альтернативно, консенсусные участки связывания рибосомы можно вставлять непосредственно 5' от инициирующего кодона для усиления экспрессии.
[00110] Носитель для доставки гена также включает комплексы ДНК/липосом, мицеллы и нацеленные комплексы вирусных белков-ДНК. Липосомы, которые также содержат нацеленное антитело или его фрагмент, можно использовать в способах по данному изобретению. Для улучшения доставки в клетку нуклеиновую кислоту или белки по данному изобретению можно конъюгировать с антителами или их связывающими фрагментами, которые связывают антигены клеточной поверхности, например, поверхностный клеточный маркер, найденный на клетках панкреатических островков.
[00111] В еще одном другом варианте осуществления изобретение относится к способу введения пептида или аналога по изобретению субъекту посредством контакта клетки с нуклеиновой кислотой, кодирующей пептид или аналог по изобретению. Контактирование клетки с нуклеиновой кислотой может происходить in vitro, для применений ex vivo, или in vivo. Такие способы часто обозначают как способы генной терапии. Когда клетка контактирует in vitro, клетки, экспрессирующие полинуклеотид, можно вводить субъекту. Такие способы делают возможной экспрессию терапевтического белка или пептида, такого как пептиды или аналоги по изобретению, для терапевтических применений. Такие терапевтические применения можно использовать для лечения различных заболеваний и состояний, включая в качестве неограничивающих примеров лечение ослабленной функции поджелудочной железы, лечение метаболического заболевания, содействие нейропротекции или регенерации нервов, содействие регенерации печени или ингибирование воспаления, как описано в настоящем документе.
[00112] Понятно, что модификации, которые по существу не влияют на активность различных вариантов осуществления по данному изобретению, также предусмотрены в рамках определения по изобретению, приведенного в настоящем документе. Соответственно, следующие примеры предназначены для того, чтобы иллюстрировать, но не ограничивать настоящее изобретение.
ПРИМЕР I
Получение пептидов и пептидных аналогов
[00113] Этот пример описывает получение пептидов и пептидных аналогов.
[00114] Все пептиды, используемые в этих исследованиях, синтезировали посредством твердофазного синтеза пептидов с использованием реакций с 9-флуоренилметоксикарбонилом (Fmoc). Вкратце, предварительно взвешенное количество 2-хлортритилхлоридной смолы (1,6 ммоль/г) размачивали в дихлорметане (DCM). Для пептидов с амидированным C-концом, амидную смолу Rink использовали вместо 2-хлортритилхлоридной смолы. Fmoc-предактивированные аминокислоты использовали для реакций сочетания в присутствии гидроксибензотриазола (Sigma Chemical Co., St. Louis, MO, USA) в диметилформамиде (DMF). Избыток аминокислот использовали на всем протяжении синтеза. Осуществляли реакцию удлинения цепи, после чего следовало снятие защитных групп Fmoc в 20% пиперидине в DMF. После завершения реакции удлинения цепи, защитные группы Fmoc удаляли с N-конца пептидов с помощью 25% пиперидина в DMF, после чего следовало промывание в DMF четыре раза. Для пептидов с ацетилированным N-концом, перед расщеплением трифторуксусной кислотой (TFA), раствор 20% уксусного ангидрида, разведенного в DMF, добавляли в соотношении 7 мл/г смолы, проводили реакцию в течение 30 мин, после чего следовало промывание 4 раза в DMF и DCM. После промывания четыре раза в DMF и DCM смолу сушили в вакууме. Впоследствии, полученные пептиды отщепляли от смолы с использованием стандартных процедур отщепления с TFA в TFA с 5% H2O, после чего следовало множество экстрагирований простым эфиром. Все синтетические пептиды очищали до >95% посредством жидкостной хроматографии высокого давления с обращенной фазой, которую осуществляли с использованием жидкостного хроматографа. Пептиды анализировали посредством масс-спектрометрии для того, чтобы подтверждать идентичность и чистоту.
[00115] Для исследований in vitro и ex vivo, полученные выше пептиды растворяли в дважды дистиллированной воде для получения стокового раствора, и в исследовании эффективности in vivo их восстанавливали в стерильном нормальном физиологическом растворе для достижения желаемой концентрации. Конечный раствор пептидов фильтровали через 0,22 мкм мембрану, чтобы делать его стерильным.
[00116] Пептиды и аналоги также можно получать с использованием других хорошо известных способов, включая изготовление пептидов с использованием способа синтеза пептидов или экспрессии нуклеиновых кислот, которые кодируют желаемые пептиды или пептидные аналоги. Таким образом, когда аналоги содержат одну или несколько нестандартных аминокислот, более вероятно их получают способом химического синтеза. Когда пептиды содержат только одну или несколько замен на стандартные аминокислоты, пептиды можно экспрессировать из экспрессирующего вектора с использованием хорошо известных способов экспрессии.
[00117] Конкретные пептиды, используемые далее в экспериментах, можно найти в таблицах 1-3.
ПРИМЕР II
Стимулирующий эффект пептидов, оказываемый на клеточную пролиферацию
[00118] В этом примере описан эффект пептидов и аналогов, оказываемый на панкреатический клеточный рост.
[00119] Для того чтобы измерять клеточную пролиферацию, осуществляли тест ELISA с бромдезоксиуридином (BrdU). В кратком изложении, клетки ARIP (ATCC (American Type Culture Collection), Manassas VA USA), клеточную линию протоков поджелудочной железы крысы, культивировали в среде F-12K (Gibco-BRL, Gaithersburg, MD, USA), содержащей 10% эмбриональной телячьей сыворотки (FBS; HyClone, Thermo Fisher Scientific Inc.; Waltham MA USA), 100 мкг/мл стрептомицина и 100 мкг/мл пенициллина в клеточном инкубаторе. Клетки ARIP высевали в 96-луночные культуральные планшеты по 8000 или 0 (в качестве пустого контроля) клеток/лунка в объеме 50 мкл клеточной культуральной среды и инкубировали в течение ночи для последующих экспериментов. На вторые стуки, после замены среды на среду без сыворотки, 50 мкл бессывороточной клеточной культуральной среды, содержащей тестовые пептиды в ряде концентраций (конечные концентрации 10 мкМ, 5 мкМ, 1 мкМ, 500 нМ, 100 нМ, 50 нМ, 10 нМ и 1 нМ) добавляли в высеянные клетки. Среду без соединения добавляли в лунки с отрицательным контролем и фоновым контролем. Среду заменяли в 24 ч и 48 ч, соответственно, на свежую среду. В 69 часов в среду добавляли 10 мкл метящего раствора бромдезоксиуридина (BrdU) (за исключением лунок с фоновым контролем) из набора ELISA для клеточной пролиферации с BrdU (Roche Applied Science; Indianapolis IN USA), и инкубировали в течение дополнительных 3 часов. В 72 часа метящую среду удаляли и добавляли 200 мкл/лунка раствора FixDenat. После времени инкубации 30 минут тщательно удаляли раствор FixDenat и добавляли 100 мкл/лунка рабочего раствора антитела против BrdU и инкубировали при комнатной температуре (RT) в течение 90 минут. Конъюгат антитела удаляли и лунки споласкивали три раза 250 мкл/лунка промывающего раствора (1× PBS). После удаления промывающего раствора, добавляли 100 мкл/лунка раствора субстрата и инкубировали при RT в течение 15 мин, затем добавляли 25 мкл/лунка 1M H2SO4, и планшет инкубировали в течение приблизительно 1 мин на встряхивателе для тщательного перемешивания. Измеряли поглощение при 450 нм (эталонная длина волны 690 нм) на считывателе планшетов En Vision™ (Perkin Elmer, Boston MA) в течение 5 мин после добавления останавливающего раствора.
[00120] Для того чтобы тестировать жизнеспособность клеток, осуществляли анализ CellTiter-Glo™ (CTG) (Promega, Madison WI). В кратком изложении, клетки ARIP (ATCC, № по каталогу CRL-1674) культивировали в среде F-12K (Gibco-BRL), содержащей 10% эмбриональную телячью сыворотку (FBS; HyClone), 100 мкг/мл стрептомицина и 100 мкг/мл пенициллина, в клеточном инкубаторе. Клетки ARIP высевали в 96-луночные культуральные планшеты по 8000 и 0 (в качестве пустого контроля) клеток/лунка в объеме 50 мкл клеточной культуральной среды и инкубировали в течение ночи для последующих экспериментов. На вторые стуки, после замены среды на среду без сыворотки, 50 мкл клеточной культуральной среды без сыворотки, содержащей тестовые пептиды в ряде концентраций (конечные концентрации составляли 10 мкМ, 5 мкМ, 1 мкМ, 500 нМ, 100 нМ, 50 нМ, 10 нМ и 1 нМ), добавляли в высеянные клетки. Среду без соединения добавляли в лунки с отрицательным контролем и фоновым контролем. Среду заменяли в 24 ч и 48 ч соответственно на свежую среду. В 72 часа 25 мкл реактива CellTiter-Glo® добавляли в каждую лунку и смешивали на орбитальном встряхивателе в течение 2 мин. Сигнал люминесценции количественно определяли на считывателе планшетов En Vision™ после 10 минут инкубации при комнатной температуре.
[00121] На фиг. 1 представлено сравнение клеточной пролиферации ARIP в присутствии 100 нМ рандомизированного INGAP PP 1 (пептид 3), INGAP-PP (пептид 1) и пептида 7 (пептиды, показанные в таблице 2). На фиг. 1 показано, что имело место увеличение числа клеток при концентрации пептида 100 нМ. Пептид 7 демонстрировал значительно более высокое процентное увеличение числа клеток по сравнению с рандомизированным пептидом INGAP, отрицательным контролем и пептидом INGAP-PP.
ПРИМЕР III
Исследования стабильности пептида
[00122] В этом примере описаны исследования стабильности пептидов в различных условиях.
[00123] Для того чтобы определять стабильность пептидов в культуральной среде, определенное количество выбранных пептидов точно взвешивали и растворяли в дистиллированной воде до 5 мг/мл в качестве стокового раствора. Стоковый раствор разводили до 0,25 мг/мл в среде F-12K (Gibco-BRL, Gaithersburg, MD, USA) в качестве рабочего раствора. Объем 100 мкл каждого рабочего раствора переносили в отдельные сосуды для образцов. Сосуды для образцов инкубировали при 37°C в инкубаторе в течение 0, 24, 48 и 72 час перед анализом и количественным определением с помощью ВЭЖХ.
[00124] На фиг. 2 представлена стабильность соединений в культуральной среде. В частности, на фиг. 2 представлено сравнение стабильности в культуральной среде INGAP-PP (пептид 1) и выбранных пептидных аналогов, пептида 7 и пептида 8 (см. таблицу 2). Как показано на фиг. 2, пептидные аналоги пептид 7 и пептид 8 значительно более стабильны, чем пептид INGAP-PP, в культуральной среде.
[00125] Стабильность пептидов также тестировали в плазме мыши и человека. В кратком изложении, определенное количество пептидов и порошка эукатропина (положительный контроль) точно взвешивали. Тестируемые соединения растворяли в 50% растворе метанол-вода и разбавляли до 20 мг/мл, а эукатропин растворяли в диметилсульфоксиде (DMSO) и разводили до 10 мМ, в качестве стокового раствора. Стоковый раствор эукатропина разводили до 0,2 мМ в DMSO в качестве рабочего раствора. Получали останавливающий реактив, содержащий 200 нг/мл мидазолама и толбутамида в ацетонитриле. Объем 300 мкл останавливающего раствора добавляли в каждую лунку 96-луночного планшета с глубокими лунками, предварительно помещенного на лед.
[00126] Для исследований стабильности пептиды и эукатропин соответственно вносили в плазму, хорошо перемешивали и затем 100 мкл каждого смешанного раствора переносили в предварительно охлажденный останавливающий реактив в образец в момент времени 0. Остающиеся смеси инкубировали при 37°C в водяной бане со встряхиванием на 100 об./мин (n=2). Конечная концентрация при инкубации составляла 1 мкМ для эукатропина и 100 мкг/мл для всех тестируемых соединений.
[00127] В желаемые моменты времени 100 мкл инкубационной смеси переносили в останавливающий реактив для того, чтобы преципитировать белки. Образцы энергично перемешивали и центрифугировали на RCF 5000×g в течение 10 минут и переносили супернатант в тестовый планшет. Образцы анализировали посредством LC-MS/MS.
[00128] Наклон вычисляли посредством построения графика натурального логарифма процентной доли остающегося количества тестируемых соединений и времени и вычисляли T1/2 в соответствии со следующей формулой.
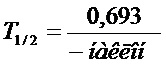
[00129] Для стабильности в плазме мыши время инкубации составляло 0, 5, 15, 30 и 60 мин для пептида 1 и эукатропина; 0, 15, 30, 60, 120, 240 и 480 мин для пептида 12, пептида 16 и пептида 29. На фиг. 3 представлена стабильность соединений в плазме мыши. В частности, на фиг. 3 представлено сравнение стабильности в плазме мыши INGAP-PP (пептид 1) и выбранных пептидных аналогов, пептида 12, пептида 16 и пептида 29 (см. таблицу 2). Как показано на фиг. 3, пептидные аналоги пептид 12, пептид 16 и пептид 29 демонстрировали хорошую стабильность в плазме мыши и более стабильны, чем INGAP-PP (пептид 1).
[00130] В другом исследовании стабильности в плазме мыши время инкубации составляло 0, 30, 60 и 120 мин для пептида 2 и эукатропина; 0, 30, 60, 120, 240 и 960 мин для пептида 52 и пептида 54. На фиг. 5 представлена стабильность соединений в плазме мыши. В частности, на фиг. 5 представлено сравнение стабильности в плазме мыши HIP (пептид 2) и выбранных пептидных аналогов, пептида 52 и пептида 54 (см. таблицу 3). Как показано на фиг. 5, пептидные аналоги пептид 52 и пептид 54 демонстрировали хорошую стабильность в плазме мыши и значительно более стабильны, чем HIP (пептид 2).
[00131] Для стабильности в плазме человека время инкубации составляло 0, 30, 60 и 120 мин для пептида 1, пептида 12, пептида 16 и эукатропина. На фиг. 4 представлена стабильность соединений в плазме человека. В частности, на фиг. 4 представлено сравнение стабильности в плазме человека INGAP-PP (пептида 1) и выбранных пептидных аналогов, пептида 12 и пептида 16 (см. таблицу 2). Как показано на фиг. 4, пептидные аналоги пептид 12 и пептид 16 демонстрировали хорошую стабильность в плазме человека и значительно более стабильны, чем INGAP-PP (пептид 1).
[00132] Эти результаты демонстрируют, что различные пептидные аналоги проявляют хорошую стабильность при различных условиях, включая среду для культивирования и плазму мыши и человека, и демонстрируют превосходную стабильность по сравнению с пептидами INGAP-PP и HIP.
ПРИМЕР IV
Эффективность пептидных аналогов в модели диабета на мышах
[00133] В этом примере описано исследование эффективности in vivo с использованием модели индуцированного стрептозотоцином (STZ) диабета на мышах.
[00134] После акклиматизации в виварии в течение одной недели, мышам C57BL/6J в возрасте 6-8 недель вводили низкую дозу STZ 40 мг/кг в цитратном буфере в течение 5 последовательных суток, чтобы создать животную модель T1D. Мышей с глюкозой крови больше 16,7 ммоль/л на 5 сутки после последней инъекции STZ включали в исследование. Затем мышей лечили с использованием INGAP-PP (пептид 1) или пептида 7 в дозах 5 мг/кг (2,5 мг/кг, два раза в сутки) или 25 мг/кг (12,5 мг/кг, два раза в сутки) в течение 20 суток перед умерщвлением. Двум дополнительным группам мышей с диабетом вводили или физиологический раствор или пептид (пептид 3), состоящий из рандомизированной последовательности аминокислот из пептида 1, в качестве контрольных групп. Измеряли глюкозу крови и уровни инсулина, и через 20 суток после последнего дозирования тестовых средств осуществляли оральный тест на толерантность к глюкозе (OGTT) у голодавших 6 часов животных для того, чтобы определять эффект пептида 1 и пептида 7. Образцы крови, полученные из надреза хвоста для определения глюкозы, анализировали с использованием глюкометра ACCU-CHEK™ (Roche, ACCU-CHEK® Active), и уровни инсулина определяли с использованием набора Rat/Mouse Insulin Elisa (Millipore, Billerica, MA USA). Для OGTT, после измерения базовой концентрации глюкозы (T=-30 мин), мыши получали оральный стимул глюкозой по 2 г/кг, и значения глюкозы определяли посредством глюкометра в 0, 15, 30, 60, 90 и 120 мин.
[00135] На фиг. 6 представлено сравнение эффективности INGAP-PP (пептид 1), рандомизированного INGAP PP 1 (пептид 3) и пептида 7 в модели индуцированного STZ диабета на мышах. На фиг. 6A представлена глюкоза крови (BG, мМ) на 21 сутки лечения. На фиг. 6B представлены уровни инсулина натощак (нг/мл) на 21 сутки лечения. На фиг. 6C представлена площадь под кривой (AUC) глюкозы (T0~120 мин), измеряемая в оральном тесте на толерантность к глюкозе (OGTT) на 21 сутки лечения.
[00136] Введение пептида 1 и пептида 7 (или 5 мг/кг или 25 мг/кг) в течение 20 суток не влияло на массу тела или массу поджелудочной железы. Значительные различия в уровнях глюкозы в крови продемонстрированы между группой мышей, которой вводили пептид 7, и контрольной группой физиологического раствора (фиг. 6A). Кроме того, один из наиболее потрясающих результатов состоял в том, что уровни инсулина в плазме у животных, которых лечили пептидом 7 (группа дозы 25 мг/кг), в конце периода в 20 суток значительно отличались от контролей с физиологическим раствором и почти восстанавливались до уровня интактной группы (фиг. 6B). Кроме того, группы лечения пептидом 7 также демонстрировали усовершенствованную толерантность к глюкозе (фиг. 6C).
[00137] Эти результаты демонстрируют, что репрезентативный пептидный аналог, пептид 7, эффективен при улучшении признаков и симптомов диабета в модели диабета на мышах.
ПРИМЕР V
Эффект пептидов, оказываемый на индукцию мелких β-клеточных кластеров
[00138] В этом примере описаны эффекты пептидов, оказываемые на индукцию мелких β-клеточных кластеров у нормальных мышей C57BL/6J.
[00139] После недельной акклиматизации самок мышей C57BL/6J случайным образом делили на 4 группы. Две контрольные группы получали или 10 мл/кг стерильного нормального физиологического раствора (n=4) или рандомизированный пептид (пептид 3, 25 мг/кг) (n=5) через подкожную инъекцию в течение 10 суток. Другие две группы получали INGAP-PP (пептид 1) или аналог INGAP-PP пептид 7 в дозе 25 мг/кг в сутки, соответственно (n=7 на группу) в течение того же периода. Массу тела и глюкозу крови после 6 часов голодания измеряли перед лечением и после последнего дозирования лечения. Плазму и панкреатический инсулин также измеряли в конце исследования. На 11 сутки у каждого животного удаляли поджелудочную железу, очищали от жира и лимфатических узлов, взвешивали и фиксировали в 10% нейтральном забуференном формалине (NBF) в течение не более чем 24 часов перед обработкой для морфометрического анализа.
[00140] По сравнению с группой физиологического раствора, введение пептида 3, пептида 1 или пептида 7 нормальным мышам в течение 10 суток не влияло на массу тела, глюкозу крови, инсулин плазмы, инсулин поджелудочной железы или массу поджелудочной железы. Иммуногистохимический анализ использовали для того, чтобы определять распределение размеров панкреатических островков. На фиг. 7 представлено распределение размеров панкреатических островков у самок мышей C57BL/6J на 10 сутки лечения пептидом. Для размера островков (выраженного в виде Log[мкм]2) в диапазоне от 4,9 до 2,3 не было отличий ни для одной группы, тогда как для размера островков в диапазоне от 2,1 до 0,7 число значительно возрастало у мышей, которых лечили пептидом 7 (p<0,05 или 0,01 в сравнении с интактной/контрольной группой) (фиг. 7). Увеличение у мышей, которых лечили пептидом 1, наблюдали только для размера островков 2,1 (p<0,05 в сравнении с интактной/контрольной группой).
[00141] Эти результаты указывают на усовершенствованный эффект неогенеза островков у разработанных аналогов INGAP-PP. Следует отметить, что среди всех измеряемых параметров не было различий для мышей, которых лечили нормальным физиологическим раствором или рандомизированным пептидом.
ПРИМЕР VI
Эффект пептидов, оказываемый на стимулируемую глюкозой секрецию инсулина
[00142] В этом примере описан эффект пептидов, оказываемый на стимулируемую глюкозой секрецию инсулина (GSIS).
[00143] Поджелудочные железы получали у взрослых самцов крыс Sprague-Dawley (SD). После 7 суток акклиматизации животных умерщвляли посредством смещения шейных позвонков и всю поджелудочную железу удаляли и расщепляли коллагеназой для того, чтобы выделять островки. После расщепления островки содержали в 37°C в RPMI 1640 (Carlsbad CA, USA) pH 7,4, содержащей 10% (об./об.) эмбриональной телячьей сыворотки, 1% пенициллина/стрептомицина и 10 мМ глюкозы во влажной атмосфере (5% CO2/95% O2) без добавления какого-либо соединения (контроль) или с добавлением 100 нМ глюкагоноподобного пептида-1 (GLP-1); или 10 мкг/мл пептида 1, пептида 12 или пептида 16, как кратко изложено далее в таблице 4.
Параметры для различных групп, тестированных на стимулируемую глюкозой секрецию инсулина (GSIS)
Глюкоза
10 мкг/мл пептид 1
10 мкг/мл пептид 12
10 мкг/мл пептид 16
Глюкоза
10 мкг/мл пептид 1
10 мкг/мл пептид 12
10 мкг/мл пептид 16
Глюкоза
10 мкг/мл пептид 1
10 мкг/мл пептид 12
10 мкг/мл пептид 16
Глюкоза
10 мкг/мл пептид 1
10 мкг/мл пептид 12
10 мкг/мл пептид 16
[00144] Культивированные островки промывали в бикарбонатном буфере КРЕБСА-Рингера (KRB), pH 7,4, предварительно газированном смесью CO2/O2 (5/95%), и предварительно инкубировали в 1,0 мл KRB, содержащем 0,5% (масс./об.) BSA и 1,5 мМ глюкозы при 37°C в течение 45 мин. После этого периода группы из 5 островков инкубировали в 0,6 мл KRB с добавлением 1,5 или 12,0 мМ глюкозы, с добавлением пептидов или без них в течение 60 мин. В конце периода инкубации аликвоты среды собирали для количественного определения инсулина.
[00145] Результаты количественного определения инсулина представлены на фиг. 8. На фиг. 8 представлено увеличение стимулируемой глюкозой секреции инсулина в островках с или без совместной инкубации выбранных пептидов (10 мкг/мл), пептида 12, пептида 16 и пептида 1. Совместная инкубация с 100 нМ глюкагоноподобного пептида-1 (GLP-1) была включена в качестве положительного контроля. При концентрации глюкозы 12,0 мМ панкреатические островки, которые культивировали с пептидами GLP-1, пептидом 12 и пептидом 16, высвобождали значительно больше инсулина, чем те, которые культивировали без добавления пептидов. В частности, аналоги INGAP-PP пептид 12 и пептид 16 демонстрировали в 2-3 раза более сильную стимуляцию секреции инсулина, чем GLP-1. В отличие от этого, стимуляцию не наблюдали с добавлением INGAP-PP (пептид 1) (фиг. 8).
[00146] Эти результаты демонстрируют, что аналоги INGAP-PP стимулировали секрецию инсулина клетками панкреатических островков.
ПРИМЕР VII
Фармакокинетические свойства пептидов у крыс и мышей
[00147] В этом примере описаны фармакокинетические (PK) свойства пептидов in vivo у крыс и мышей.
[00148] После 7 суток акклиматизации самцов крыс Sprague-Dawley (SD) весом 210-250 г или самцов мышей C57BL/6 весом 19-24 г, с хорошим состоянием здоровья, использовали в исследовании. Пептид 1, пептид 12 и пептид 16 растворяли в стерильном нормальном физиологическом растворе и затем их инъецировали в виде подкожного (sc) болюса или внутривенного (iv) болюса при уровне дозы 25 мг/кг. Три животных из каждой группы использовали для взятия крови в момент времени 5 мин, 15 мин, 30 мин, 1 ч, 2 ч, 4 ч, 6 ч, 8 ч и 24 ч после дозы. Образцы крови (приблизительно 400 мкл) брали и помещали и в пробирки, содержащие ЭДТА-K2, и центрифугировали 8000 об./мин в течение 6 минут при 4°C для отделения плазмы от образцов. Получаемую плазму хранили замороженной при -80°C до анализа.
[00149] Концентрации пептидов в плазме определяли с использованием тандемного масс-спектрометрического (LC-MS/MS) анализа. Некомпартментный модуль WinNonlin® Professional 5.2 (Pharsight; St. Louis MO), использовали для того, чтобы вычислять параметры фармакокинетики. Выбранные параметры фармакокинетики представлены далее в таблице 5. Сокращение AUC(o-t) представляет площадь под кривой от момент дозирования до времени последнего наблюдения, AUC(0-∞) представляет площадь под кривой от времени дозирования до бесконечности, а Cmax представляет максимальную обнаруженную концентрацию.
Фармакокинетические параметры у мышей и крыс, получавших лечение
мкг/л
мкг/л
мкг/л
[00150] По сравнению с INGAP-PP (пептид 1), пептидные аналоги пептид 12 и пептид 16 демонстрировали заметно усовершенствованные фармакокинетические свойства, о чем свидетельствовало значительное увеличение площади под кривыми концентрация в плазме-время (AUC) и максимальной концентрации (Cmax) у мышей и крыс.
[00151] Эти результаты демонстрируют, что пептидные аналоги INGAP-PP демонстрировали значительно усовершенствованные фармакокинетические свойства по сравнению с INGAP-PP.
Пример VIII
Эффект пептидов, оказываемый на индукцию инсулин-положительных β-клеточных кластеров дополнительных островков
[00152] В этом примере описаны эффекты пептидов, оказываемые на индукцию инсулин-положительных β-клеточных кластеров дополнительных островков у нормальных мышей C57BL/6J.
[00153] После недельной акклиматизации самок мышей C57BL/6J случайным образом делили на 6 групп (n=5 на группу). Контрольная группа получала 10 мкл/кг стерильного нормального физиологического раствора через подкожную инъекцию в течение 10 последовательных суток. Другие пять групп получали INGAP-PP (пептид 1) или аналоги INGAP-PP пептид 12, пептид 16, пептид 29 или пептид 31 в дозе 50 мг/кг или 5 мг/кг в сутки, соответственно, в течение того же периода. На 11 сутки у каждого животного поджелудочную железу удаляли, очищали от жира и лимфатических узлов, взвешивали и фиксировали в 10% нейтральном забуференном формалине (NBF) в течение не более чем 24 часов перед обработкой для морфометрического анализа.
[00154] Иммуногистохимический анализ использовали для того, чтобы оценивать активность неогенеза островков у пептидов посредством измерения числа и площади дополнительных инсулин-положительных β-клеточных кластеров островков (EIC) в панкреатических тканях, полученных из каждой группы индивидуумом после 10 суток лечения. EIC отражает неогенез островков, как описано ранее Lipsett and Finegood (Diabetes 51: 1834-1841 (2002)).
[00155] По сравнению с группой лечения физиологическим раствором, имело место значительное увеличение числа и площади EIC в группах лечения пептидами. На фиг. 9A показано число EIC у самок мышей C57BL/6J после 10 суток лечения. На фиг. 9B показана общая площадь EIC у самок мышей C57BL/6J после 10 суток лечения. На фиг. 9C показаны репрезентативные EIC, связанные с протоками, в поджелудочной железе после введения пептида INGAP-PP или аналога INGAP-PP. Группы лечения INGAP-PP или аналог INGAP-PP демонстрировали значительное увеличение числа EIC и площади EIC по сравнению с группой лечения физиологическим раствором. Примечательно, что число и площадь EIC в группе лечения пептидом 31 (5мг/кг) статистически выше, чем таковые в группе лечения INGAP-PP (пептид 1) (50 мг/кг) (p<0,05).
[00156] Результаты демонстрировали биологические активности INGAP-PP и его аналогов при стимуляции неогенеза островков у нормальных мышей после 10 суток лечения. Важно, что для групп лечения пептидом 12 или пептидом 31 сравнимой или усовершенствованной эффективности достигали при дозе в одну десятую от INGAP-PP, что указывает на усовершенствованную активность аналогов INGAP-PP.
Пример IX
Эффект пептидов, оказываемый на неогенез островков, отражаемый в распределении размеров панкреатических островков
[00157] В этом примере описаны эффекты неогенеза островков для пептидов, которые отражены в распределении размеров панкреатических островков у нормальных мышей C57BL/6J.
[00158] После недельной акклиматизации, самок мышей C57BL/6J случайным образом делили на 4 группы (n=6 на группу). Контрольная группа получала 10 мл/кг стерильного нормального физиологического раствора через подкожную инъекцию в течение 10 последовательных дней. Другие три группы получали INGAP-PP (пептид 1) в дозе 25 мг/кг/сутки или аналог INGAP-PP пептид 12 или пептид 31 в дозе 0,25 мг/кг/сутки, соответственно, в течение того же периода. Различные дозы INGAP-PP или аналогов INGAP-PP использовали в исследовании на основании эффективной дозы INGAP-PP, известной в данной области, и фармакокинетических свойств, характеризующих аналоги INGAP-PP. На 11 сутки поджелудочную железу удаляли у каждого животного, очищали от жира и лимфатических узлов и фиксировали в 10% нейтральном забуференном формалине (NBF) в течение не более чем 24 часов перед обработкой для иммуногистохимического анализа. Проводили трассировку и количественное определение для позитивных срезов с окрашиванием инсулина, используя программное обеспечение для анализа изображений (микроскоп Olympus DP70, соединений посредством видеокамеры с компьютером, оборудованным программным обеспечением with Image-Pro Plus версии 6.0), и осуществляли анализ распределения размеров островков.
[00159] По сравнению с группами лечения физиологическим раствором, мыши, которых лечили INGAP-PP или аналогами INGAP-PP в течение 10 суток, демонстрировали сдвиг в направлении малого размера островков, показанного на фиг. 10. В частности, имеет место приблизительно 50% увеличение для размера островков меньше 1000 мкм2 в группах лечения пептидами (60% популяции островков в группе лечения пептидом против 40% в группе физиологического раствора), при этом отсутствовали различия для размера островков между 1000 и 5000 мкм2, и имело место приблизительно 50% снижение для размера островков больше 5000 мкм2 (приблизительно 10% популяции островков в группе лечения пептидом против 20% в группе физиологического раствора).
[00160] Эти результаты показывают, что INGAP-PP и аналоги INGAP-PP демонстрировали сдвиг в направлении малого размера островков. Кроме того, протестированные аналоги INGAP-PP демонстрировали активность при 1/100 дозы INGAP-PP.
ПРИМЕР X
Фармакокинетические свойства пептидов у крыс SD
[00161] В этом примере описаны фармакокинетические (PK) свойства in vivo для пептидов после одного подкожного (sc) введения крысам SD.
[00162] После 7 суток акклиматизации всего 15 самцов крыс Sprague-Dawley (SD) (масса тела: от 230 до 270 г) с хорошим состоянием здоровья из Sino-British SIPPR/BK Lab Animal Ltd, Shanghai, использовали в исследовании. Все пептиды, пептид 1, пептид 12, пептид 16, пептид 29 или пептид 31, растворяли в стерильном нормальном физиологическом растворе, соответственно, чтобы получать желаемые конечные концентрации, и вводили в виде одной подкожной (sc) дозы. Детализированная информация для фармакокинетических исследований представлена в таблице 6.
Информация о группах и дозировании для фармакокинетических (PK) исследований
[00163] Три животных в каждой группе использовали для взятия крови в момент времени 5 мин, 15 мин, 30 мин, 1 ч, 2 ч, 4 ч, 6 ч, 8 ч и 24 ч после дозирования. Образцы крови (приблизительно 400 мкл) собирали и помещали в пробирки, содержащие ЭДТА-K2 (этилендиаминтетраацетат дикалия), и центрифугировали 8000 об./мин в течение 6 минут при 4°C, чтобы отделять плазму от образцов. Получаемую плазму хранили замороженной при -80°C до анализа.
[00164] Концентрации пептидов в плазме определяли с использованием тандемного масс-спектрометрического (LC-MS/MS) анализа. Некомпартментный модуль WinNonlin® Professional 5.2 (Pharsight; St. Louis MO) использовали для того, чтобы вычислять PK параметры. Отобранные PK параметры представлены далее в таблице 7. AUQ(0-t) представляет площадь под кривой от времени дозирования до времени последнего наблюдения, AUC(0-∞) представляет площадь под кривой от времени дозирования до бесконечности, а Cmax представляет максимальную обнаруженную концентрацию.
Отобранные фармакокинетические параметры у крыс Sprague-Dawley после подкожного введения
[00165] По сравнению с INGAP-PP (пептид 1), аналоги пептид 12, пептид 16, пептид 29 и пептид 31 демонстрировали усовершенствованные PK свойства, о чем свидетельствует значительно увеличение AUC и Cmax у крыс SD одного и того же пола и при одном и том же уровне дозы.
[00166] Чтобы дополнительно охарактеризовать фармакокинетические (PK) свойства пептидов, определяли концентрацию пептида в поджелудочной железе - целевом органе, через 30 мин после дозы. В кратком изложении, INGAP-PP (пептид 1), пептид 12 или пептид 31 растворяли в стерильном нормальном физиологическом растворн и затем вводили через подкожный (sc) болюс при уровне дозы 25 мг/кг самцам крыс Sprague-Dawley (SD). Пять животных в каждой группе использовали для взятия крови и поджелудочной железы в момент времени 30 мин после дозы. Образцы крови (приблизительно 400 мкл) собирали и помещали в пробирки, содержащие ЭДТА-K2, и центрифугировали 8000 об./мин в течение 6 минут при 4°C для того, чтобы отделять плазму от образцов. После получения крови и умерщвления животных, у каждого животного незамедлительно поджелудочную железу удаляли, очищали от жира и лимфатических узлов, взвешивали и помещали в 5-кратный объем ледяного стерильного нормального физиологического раствора с коктейлем ингибиторов протеаз (Merck Millipore, № по каталогу 539137) для того, чтобы гомогенизировать с использованием гомогенизатора.
[00167] Концентрацию пептида в плазме и панкреатическом гомогенате определяли незамедлительно с использованием тандемного масс-спектрометрического (LC-MS/MS) анализа, а результаты представлены в таблице 8.
Концентрация пептида в плазме и поджелудочной железе
[00168] По сравнению с INGAP-PP (пептид 1), пептидные аналоги пептид 12 и пептид 31 демонстрировали усовершенствованные PK свойства, о чем свидетельствовало значительное увеличение концентрации в плазме и поджелудочной железе.
[00169] Эти результаты демонстрировали, что, по сравнению с INGAP-PP, пептидные аналоги INGAP-PP показывали значительно усовершенствованные фармакокинетические свойства in vivo.
ПРИМЕР XI
Исследования стабильности пептидов
[00170] В этом примере описаны исследования стабильности пептидов в различных условиях.
[00171] Для того чтобы определять стабильность пептидов в культуральной среде, определенное количество выбранных пептидов точно взвешивали и растворяли в дистиллированной воде до 5 мг/мл в качестве стокового раствора. Стоковый раствор разводили до 0,25 мг/мл в среде F-12K (Gibco-BRL, Gaithersburg, MD, USA) в качестве рабочего раствора. Объем 100 мкл каждого рабочего раствора переносили в отдельные сосуды для образцов. Сосуды для образцов инкубировали при 37°C в инкубаторе в течение 0, 24, 48 и 72 часов перед анализом и количественным определением с помощью ВЭЖХ.
[00172] На фиг. 11 представлена стабильность соединений в культуральной среде. В частности, на фиг. 11 представлено сравнение стабильности в культуральной среде INGAP-PP (пептид 1) и выбранных пептидных аналогов, пептида 12 и пептида 16. Как показано на фиг. 11, пептидные аналоги пептид 12 и пептид 16 значительно более стабильны, чем пептид INGAP-PP в культуральной среде.
[00173] Стабильность пептидов также тестировали в плазме крысы, мыши и человека. В кратком изложении, точно взвешивали определенное количество пептидов и порошка эукатропина (положительный контроль). Тестируемые соединения растворяли в 50% растворе метанол-вода и разводили до 20 мг/мл, а эукатропин растворяли в диметилсульфоксиде (DMSO) и разводили до 10 мМ, в качестве стокового раствора. Стоковый раствор эукатропина разводили до 0,2 мМ в DMSO в качестве рабочего раствора. Получали останавливающий реактив, содержащий 200 нг/мл мидазолама и толбутамида в ацетонитриле. Объем 300 мкл останавливающего раствора добавляли в каждую лунку 96-луночного планшета с глубокими лунками, который предварительно помещали на лед.
[00174] Для исследований стабильности пептиды и эукатропин вносили в плазму, соответственно, хорошо перемешивали и затем 100 мкл каждого смешанного раствора переносили в предварительно охлажденный останавливающий реактив в качестве образца в момент времени 0. Остальные смеси инкубировали при 37°C в водяной бане со встряхиванием 100 об./мин (n=2). Конечная концентрация при инкубации составляла 1 мкМ для эукатропина и 100 мкг/мл для всех тестируемых соединений.
[00175] В желаемые моменты времени 100 мкл инкубационной смеси переносили в останавливающий реактив для преципитации белков. Образцы энергично перемешивали и центрифугировали на RCF 5000×g в течение 10 минут и переносили супернатант в тестовый планшет. Образцы анализировали посредством LC-MS/MS.
[00176] Наклон вычисляли посредством построения графика натурального логарифма процентной доли остающегося количества тестируемых соединений и времени, и T1/2 вычисляли в соответствии со следующей формулой.
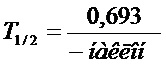
[00177] Для стабильности в плазме крысы время инкубации составляло 0, 15, 30, 60 и 120 мин для пептида 1 и эукатропина и 0, 15, 30, 60, 120 и 240 мин для пептида 12, пептида 16, пептида 29 и пептида 31. На фиг. 12 представлена стабильность соединений в плазме крысы. В частности, на фиг. 12 представлено сравнение стабильности в плазме крысы для INGAP-PP (пептид 1) и выбранных пептидных аналогов, пептида 12, пептида 16, пептида 29 и пептида 31. Как показано на фиг. 12, пептидные аналоги пептид 12, пептид 16, пептид 29 и пептид 31 демонстрировали хорошую стабильность в плазме крысы и более стабильны, чем INGAP-PP (пептид 1).
[00178] В другом исследовании стабильности в плазме крысы время инкубации составляло 0, 30, 60 120 и 240 мин для пептида 2, пептида 52, пептида 64 и эукатропина. На фиг. 13 представлена стабильность соединений в плазме крысы. В частности, на фиг. 13 представлено сравнение стабильности в плазме крысы для HIP (пептид 2) и выбранных пептидных аналогов, пептида 52 и пептида 62. Как показано на фиг. 13, пептидные аналоги пептид 52 и пептид 62 демонстрировали хорошую стабильность в плазме крысы и значительно более стабильны, чем HIP (пептид 2).
[00179] Для стабильности в плазме мыши время инкубации составляло 0, 15, 30, 60 и 120 мин для пептида 1 и эукатропина; 0, 15, 30, 60, 120 и 240 мин для пептида 31. На фиг. 14 представлена стабильность соединений в плазме мыши. В частности, на фиг. 14 представлено сравнение стабильности в плазме мыши для INGAP-PP (пептид 1) и пептида 31. Как показано на фиг. 14, пептид 31 демонстрировал более высокую стабильность в плазме мыши и более стабилен, чем INGAP-PP (пептид 1).
[00180] Для стабильности в плазме человека время инкубации составляло 0, 15, 30, 60, 120 и 240 мин для пептида 1, пептида 29, пептида 31 и эукатропина. На фиг. 15 представлена стабильность соединений в плазме человека. В частности, на фиг. 15 представлено сравнение стабильности в плазме человека для INGAP-PP (пептид 1) и выбранных пептидных аналогов, пептида 29 и пептида 31. Как показано на фиг. 15, пептидные аналоги пептид 29 и пептид 31 демонстрировали хорошую стабильность в плазме человека и значительно более стабильны, чем INGAP-PP (пептид 1).
[00181] Стабильность пептида в буферах тестировали для INGAP-PP и выбранных аналогов. 10 мг/мл пептида 1, пептида 12, пептида 16, пептида 29 или пептида 31 растворяли в изотонических буферах с pH в диапазоне от 4,0 до 8,0. Подобно пептиду 1, обнаружено, что пептид 16 и пептид 31 более стабильны в буферах с pH от 4,0 до 6,0, тогда как пептид 12 и пептид 29 более стабильны в буферах с pH от 6,0 до 8,0. Дополнительное исследование для оценки стабильности пептида в буферах обнаружило, что пептид 16 и пептид 31 стабильны в изотоническом ацетатном буфере (pH 5,0) вплоть до 90 суток при 4°C и меньше чем 7 суток при 25°C. Пептид 12 и пептид 29 стабильны в изотоническом фосфатном буфере (pH 7,4) в течение больше 90 суток при 4°C (признаки разложения в момент проверки на 90 сутки отсутствовали) и 60 суток при 25°C.
[00182] Эти результаты демонстрируют, что различные пептидные аналоги показывают хорошую стабильность при различных условиях, включая среду для культивирования, плазму крысы, мыши и человека, и показывают превосходную стабильность по сравнению с пептидами INGAP-PP и HIP.
ПРИМЕР XII
Системы с замедленным высвобождением для доставки с длительным действием
[00183] В этом примере описано использование разлиных биологически совместимых и биоразрушаемых материалов для разработки систем с замедленным высвобождением INGAP-PP и аналогов для клинических применений INGAP-PP и аналогов.
[00184] Оценивали биологически совместимый полимер, содержащий сегмент поли(этиленгликоля) (PEG) в концентрации от 0,5% масс./масс. до 20% масс./масс. конечной массы композиции, α-циклодекстрин в концентрации от 5% масс./масс. до 15% масс./масс. конечной массы композиции, INGAP-PP и/или его аналоги в концентрации от 0,1% масс./масс. до 20% масс./масс. конечной массы композиции и фосфатный буферный раствор (PBS). Биологически совместимый полимер, содержащий сегмент PEG, например, Pluronic F127, Pluronic F38, Pluronic F68, Pluronic F87, Pluronic F108, Jeffamine ED-2003 и аналог, также можно встраивать для того, чтобы формировать супрамолекулярную гидрогелевую систему. PEG, биологически совместимый полимер, содержащий сегмент PEG, и α-циклодекстрин можно растворять или отдельно или в предварительно смешанной форме, INGAP-PP и/или его аналоги можно диспергировать непосредственно в PBS, затем смешивать со смесью PEG. Смешанный раствор затем обрабатывают звуком для того, чтобы формировать гидрогель. На фиг. 16 представлена репрезентативная кривая высвобождения INGAP-PP (пептид 1) in vitro из гидрогеля, содержащего Pluronic F127. На фиг. 17 представлена репрезентативная кривая высвобождения INGAP-PP (пептид 1) in vitro из гидрогеля, содержащего Jeffamine ED-2003.
[00185] Также оценивали систему с замедленным высвобождением с композицией из сахарозы ацетата изобутирата (SAIB), INGAP-PP и/или его аналогов и растворителя. Эффективные составы содержат SAIB в концентрации от 45% масс./масс. до 85% масс./масс. конечной массы композиции, INGAP-PP и/или его аналоги в концентрации от 0,1% масс./масс. до 20% масс./масс. конечной массы композиции, а остальное является растворителем. Растворитель можно выбирать из этанола, ацетона, этилацетата или каких-либо других растворителей, которые могут растворять SAIB. На фиг. 18 представлена репрезентативная кривая высвобождения INGAP-PP (пептид 1) in vitro из гелевой системы SABER.
[00186] Системы с замедленным высвобождением, описанные выше, демонстрировали возможность дозированных форм с высвобождением с длительным действием для INGAP-PP или его аналогов.
[00187] На всем протяжении этой заявки упомянуты различные публикации. Раскрытия этих публикаций их содержания включены, таким образом, посредством ссылки в эту заявку для того, чтобы более полно описать существующий уровень техники, к которой относится это изобретение. Несмотря на то, что изобретение описано со ссылкой на примеры, приведенные выше, следует понимать, что различные модификации можно выполнять, не отступая от сущности изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СТИМУЛЯТОР РЕГЕНЕРАЦИИ ПАНКРЕАТИЧЕСКИХ БЕТА-КЛЕТОК И ПРОДУЦИРОВАНИЯ ИНСУЛИНА В ПАНКРЕАТИЧЕСКИХ БЕТА-КЛЕТКАХ | 2006 |
|
RU2403058C2 |
| ДВОЙНЫЕ АГОНИСТЫ GLP1/GIP ИЛИ ТРОЙНЫЕ АГОНИСТЫ GLP1/GIP/ГЛЮКАГОНА | 2013 |
|
RU2652783C2 |
| ПЕПТИДНЫЕ КОМПОЗИЦИИ | 2014 |
|
RU2725150C2 |
| АГОНИСТЫ РЕЦЕПТОРА-3(R3) ПЕПТИДА-АКТИВАТОРА ГИПОФИЗАРНОЙ АДЕНИЛАТЦИКЛАЗЫ(РАСАР) И СПОСОБЫ ИХ ФАРМАКОЛОГИЧЕСКОГО ПРИМЕНЕНИЯ | 2000 |
|
RU2269354C2 |
| МУЛЬТИАГОНИСТЫ И ИХ ПРИМЕНЕНИЕ | 2022 |
|
RU2833609C2 |
| ПЕПТИДНЫЕ ПРОЛЕКАРСТВА, ПРИНАДЛЕЖАЩИЕ К СУПЕРСЕМЕЙСТВУ АМИД-СОДЕРЖАЩИХ ГЛЮКАГОНОВ | 2011 |
|
RU2580317C2 |
| ПОЛИПЕПТИДЫ, СЕЛЕКТИВНЫЕ К РЕЦЕПТОРАМ ГЛЮКАГОНА, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2760007C2 |
| НОВЫЙ ПЕПТИД И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2783776C1 |
| ПРОИЗВОДНОЕ АНАЛОГА GLP-1 ИЛИ ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ И ИХ ПРИМЕНЕНИЕ | 2010 |
|
RU2565536C2 |
| СПОСОБ ЛЕЧЕНИЯ АУТОИММУННОГО ЗАБОЛЕВАНИЯ С ИСПОЛЬЗОВАНИЕМ БИОСОВМЕСТИМЫХ БИОАБСОРБИРУЕМЫХ НАНОСФЕР | 2011 |
|
RU2635537C2 |



































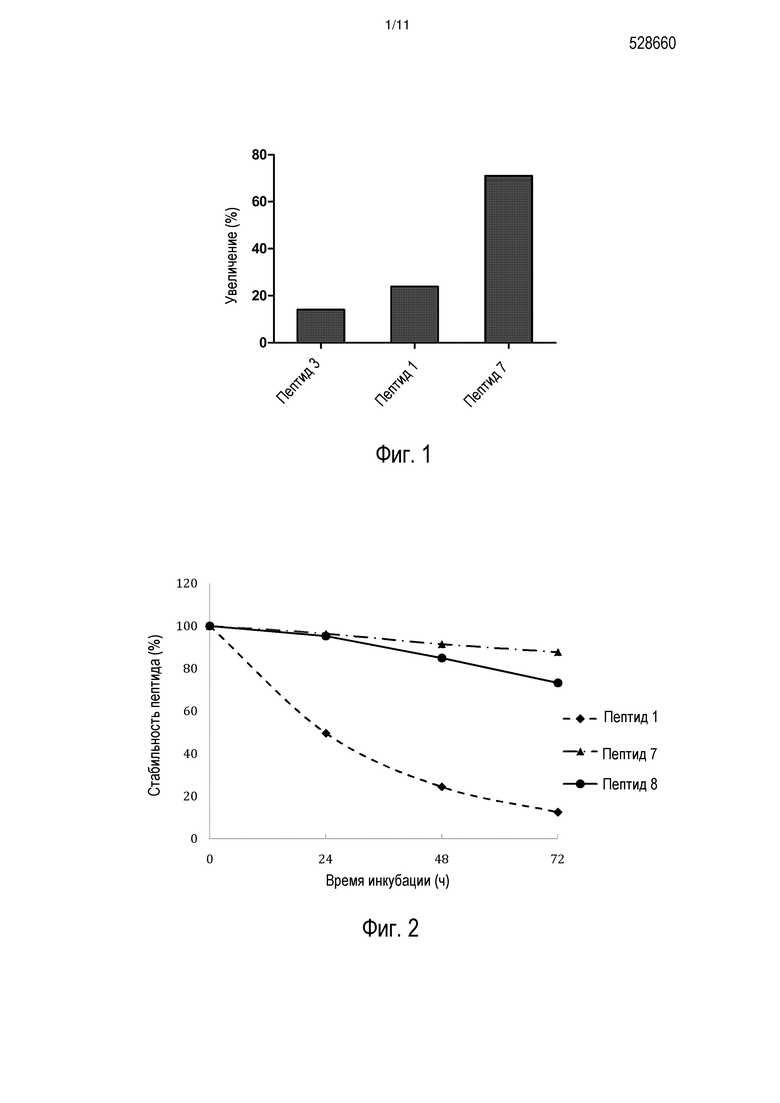
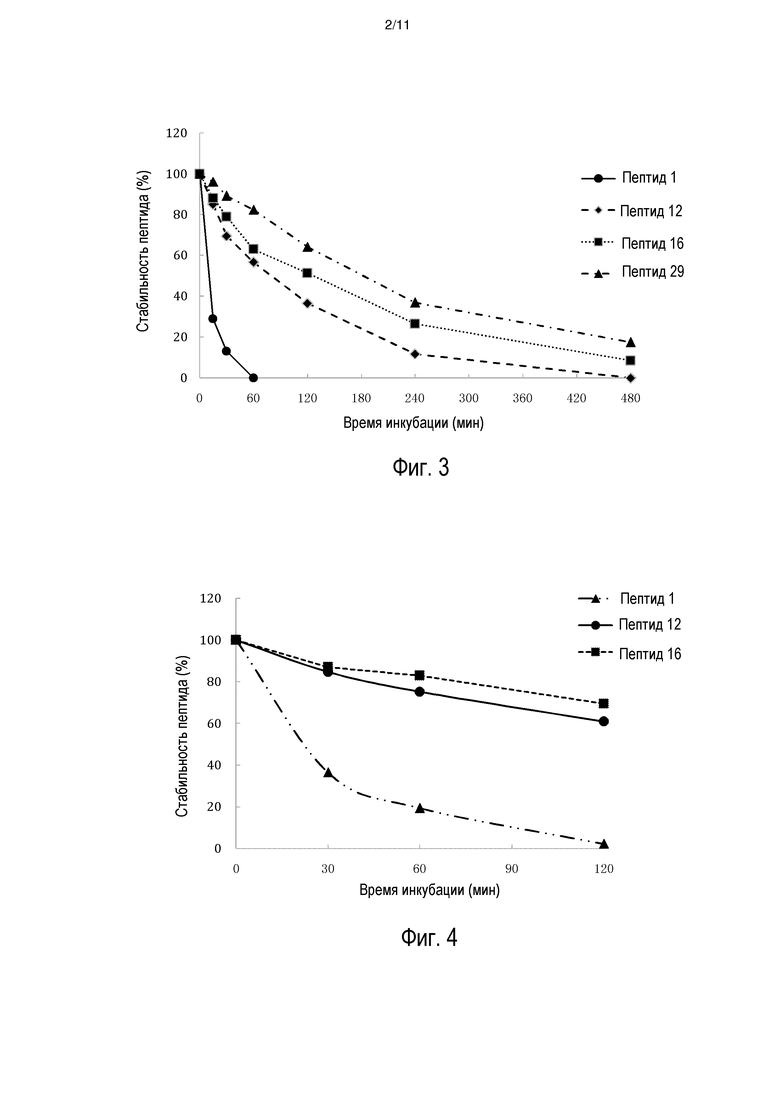
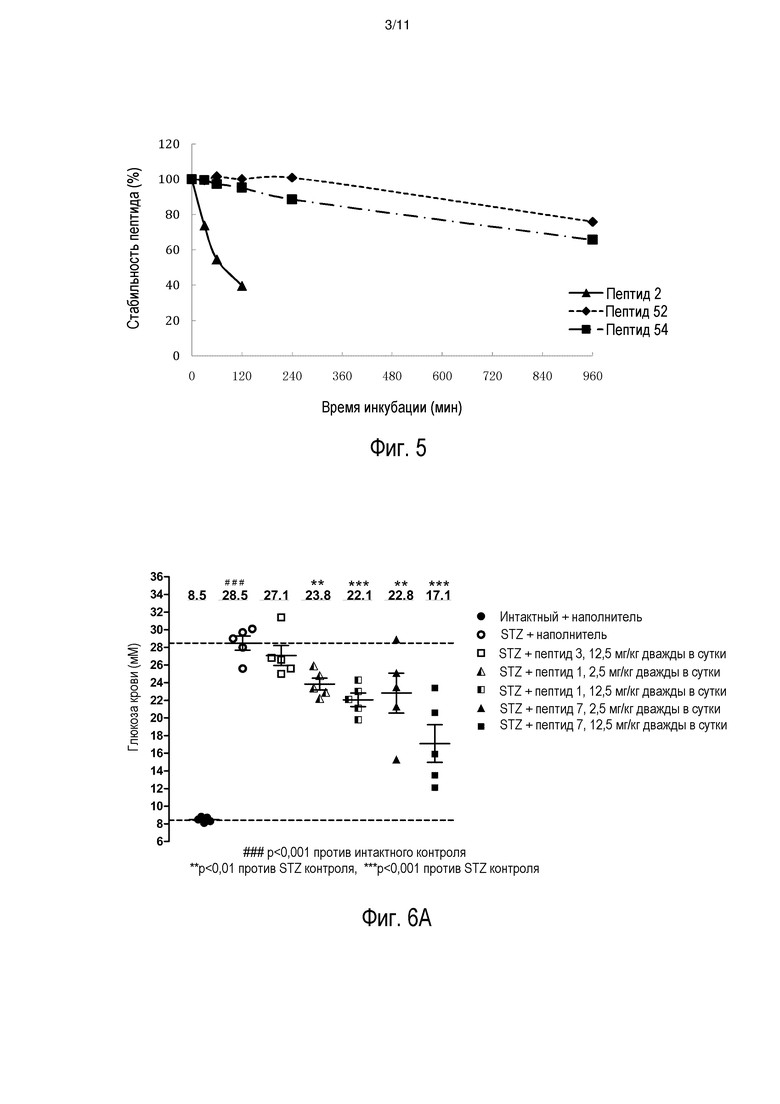
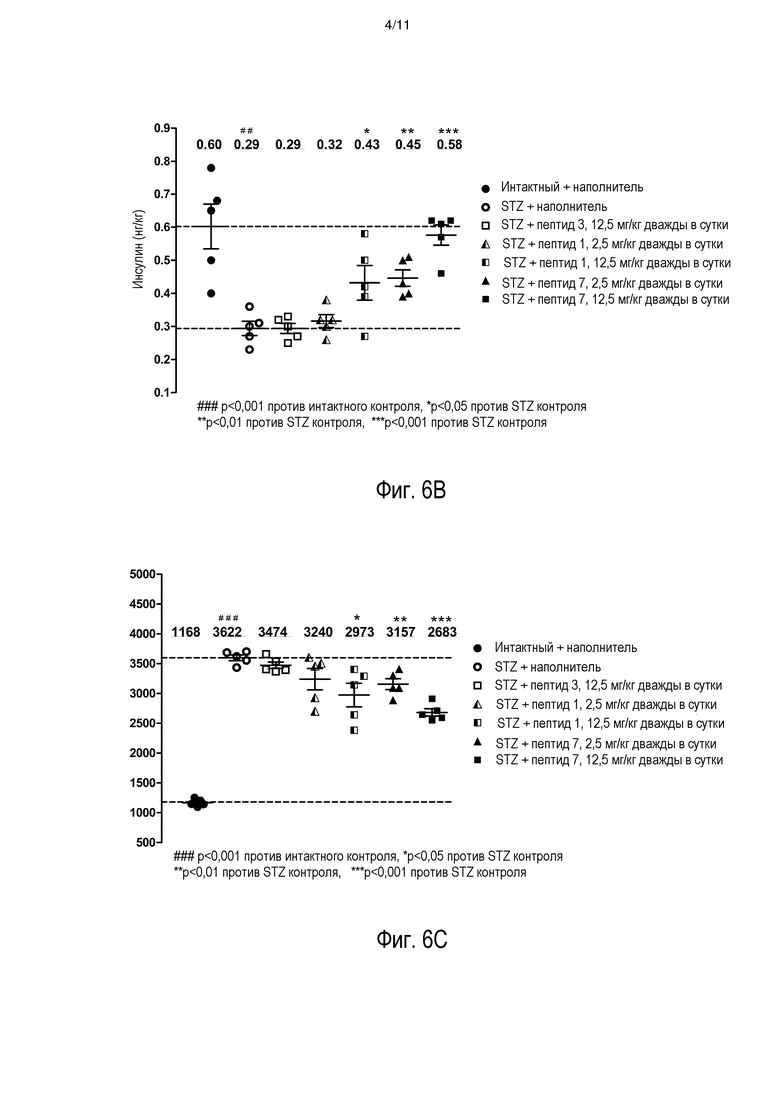
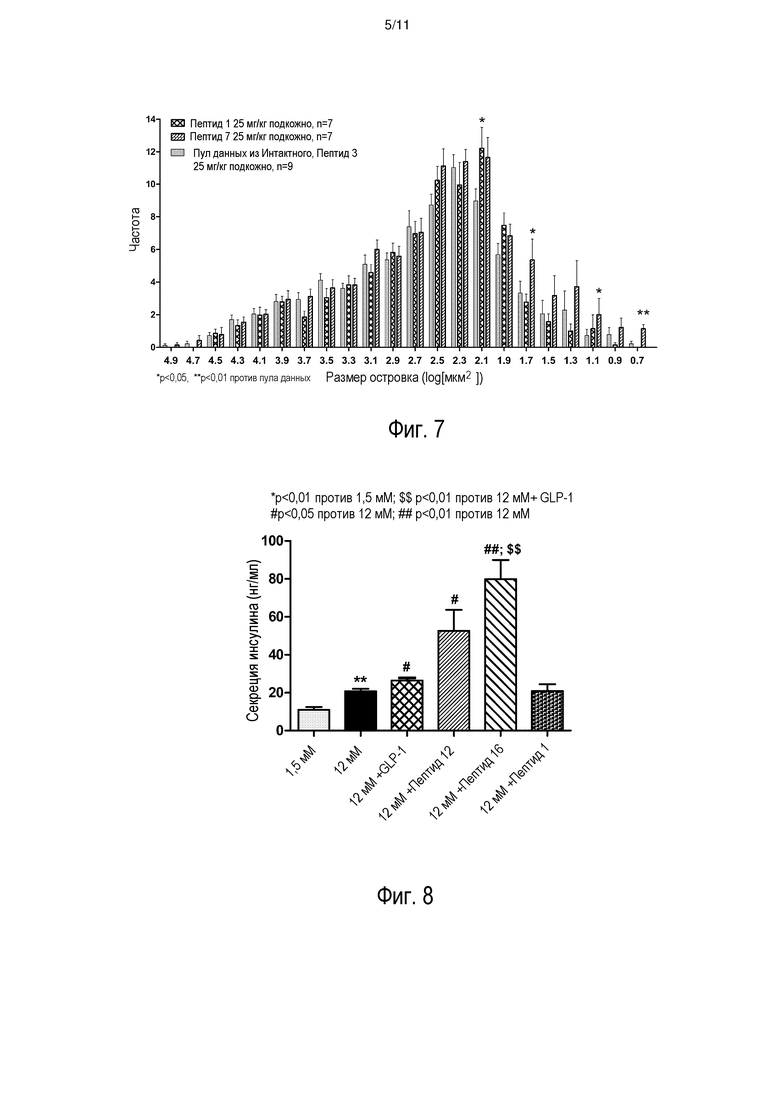
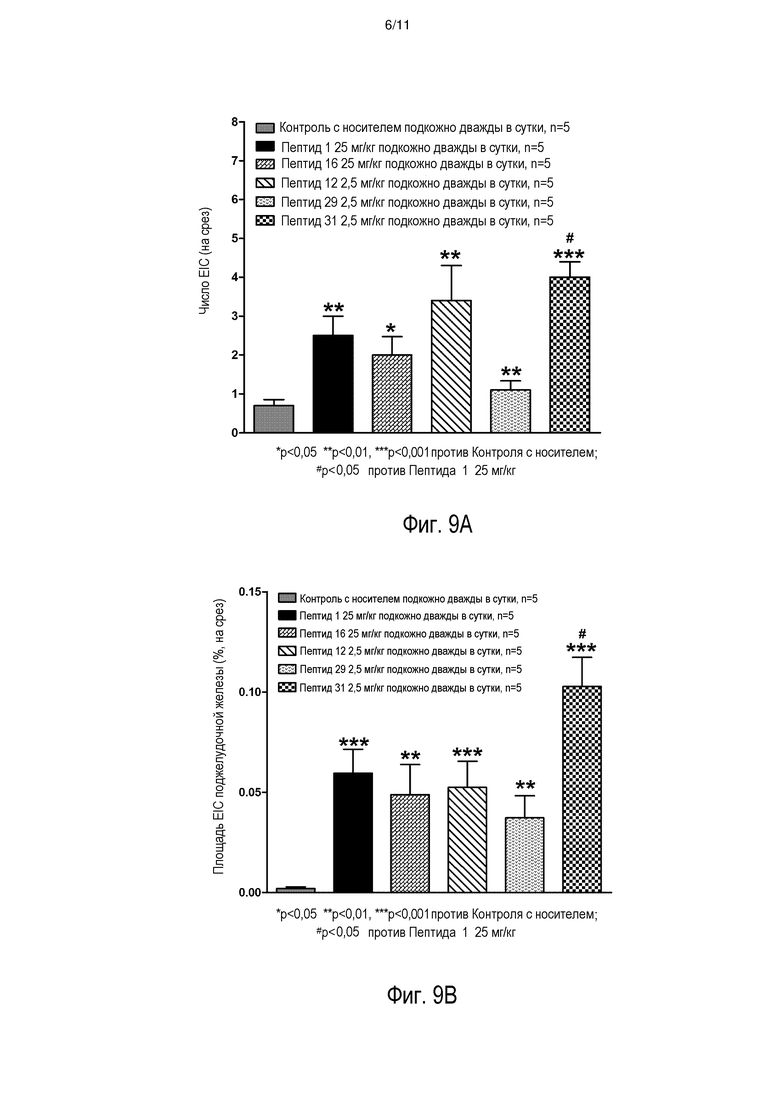
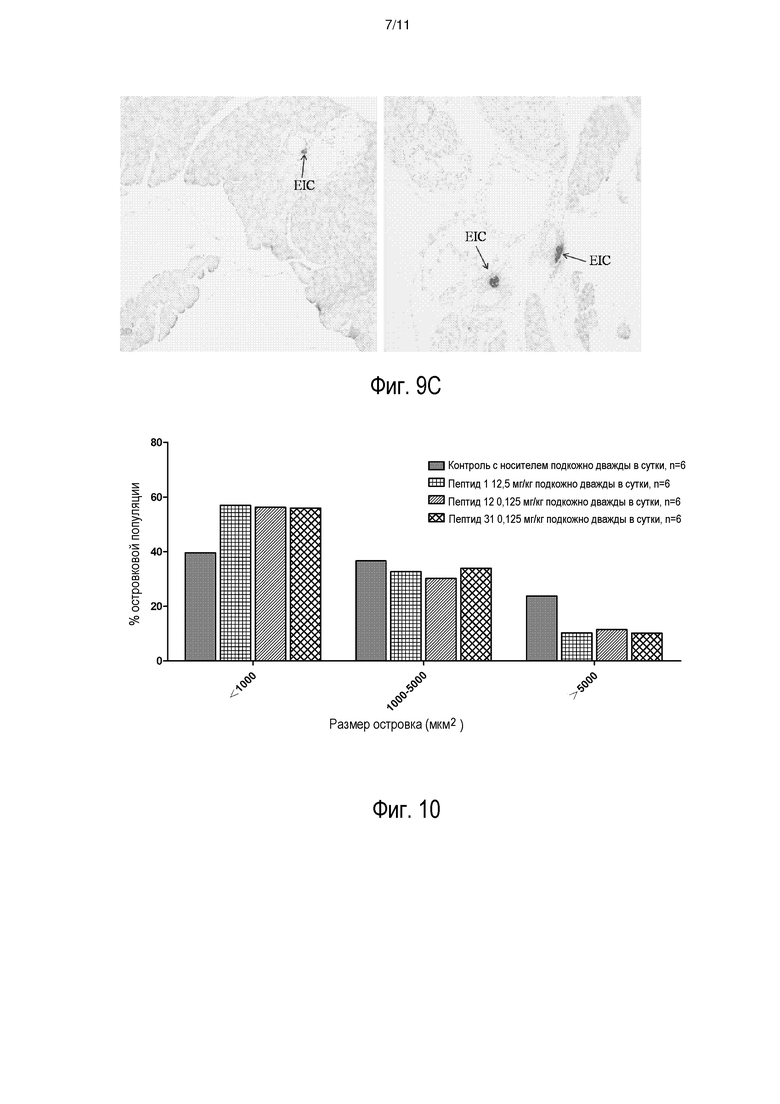
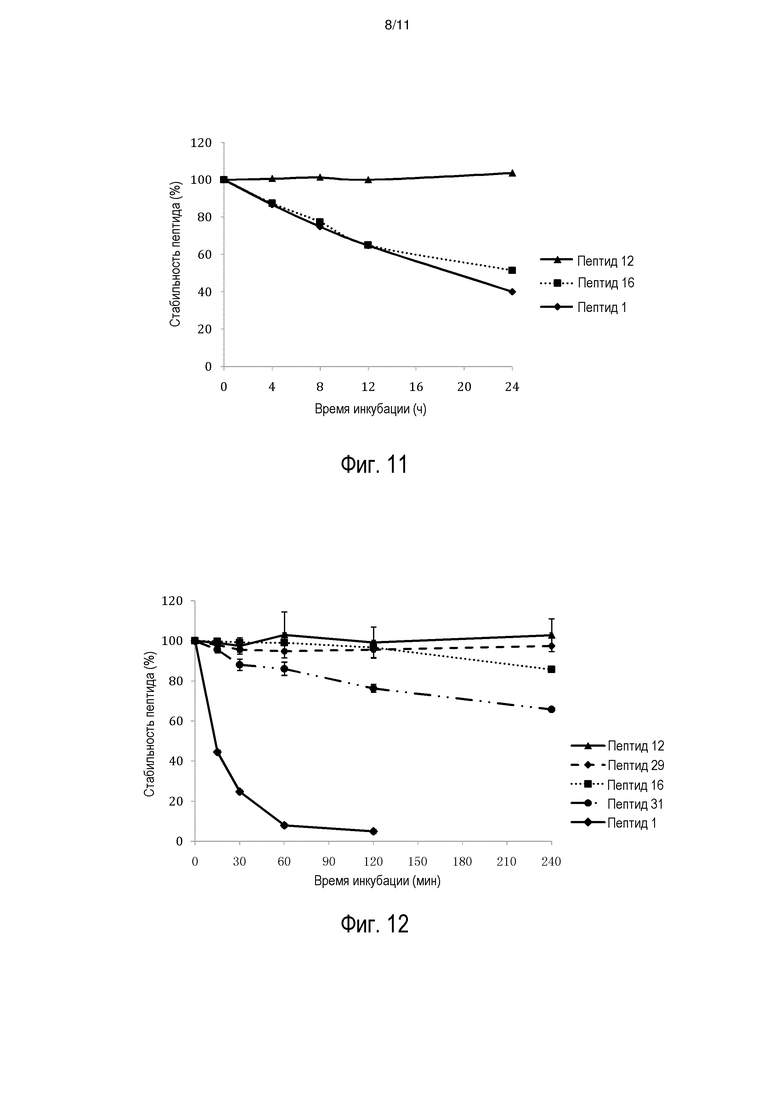
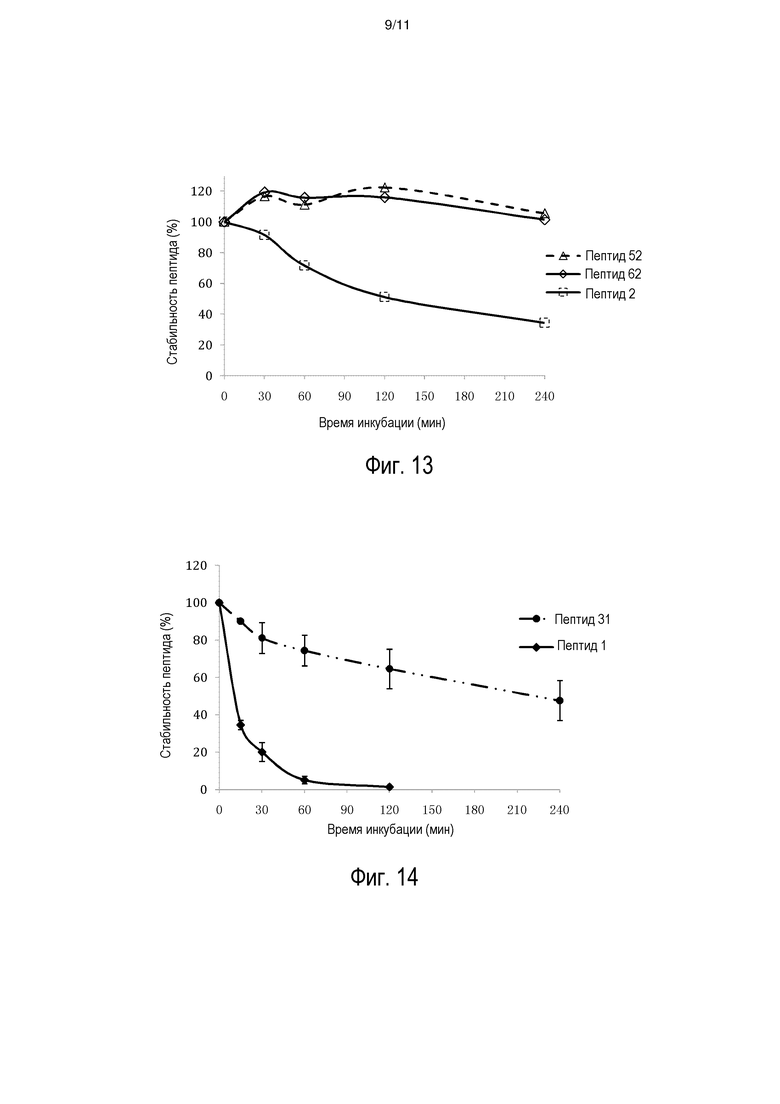
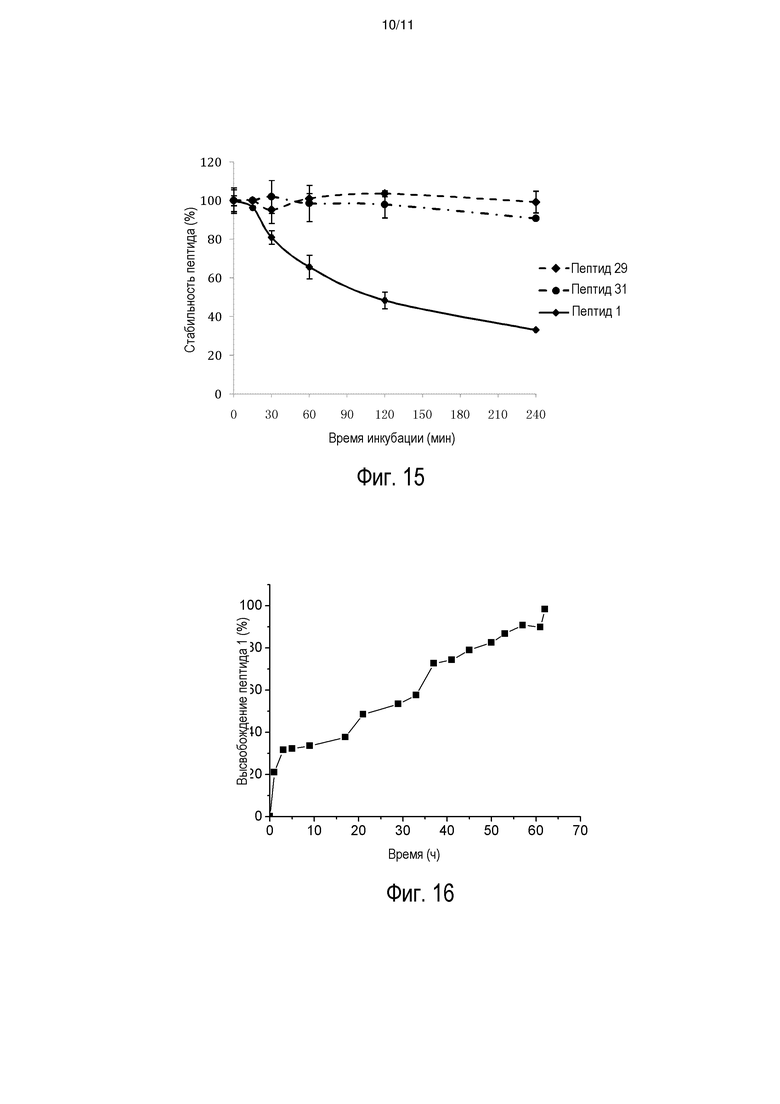
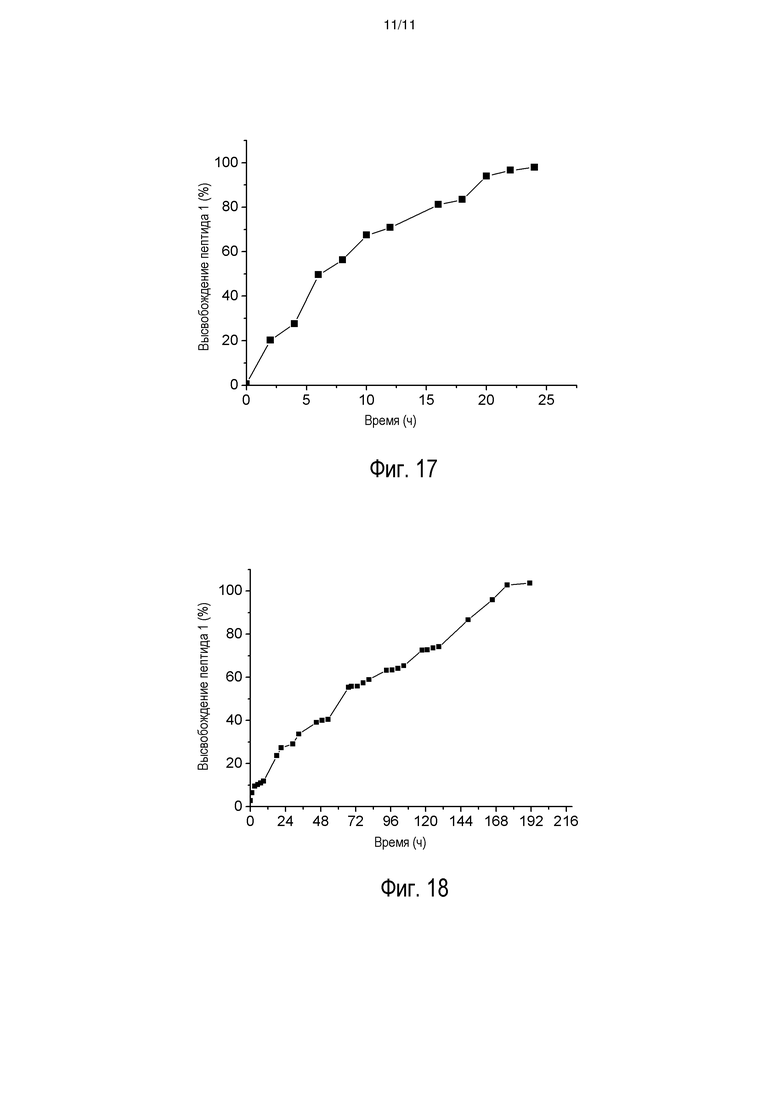
Изобретение относится к области биотехнологии, конкретно к аналогам пептида INGAP-PP, и может быть использовано в медицине для лечения ослабленной функции поджелудочной железы, метаболического заболевания, для содействия нейропротекции и регенерации нервов, для стимуляции регенерации печени и для ингибирования воспаления. Изобретение позволяет получить пептид IGLHDPSHGTLPAG или IGLHDPTQGTEPAG или аналог пептида, выбранный из SEQ ID NO: 7, 9-15, 23, 27-30, 41-53, 60, 62, 68-72, проявляющий повышенную активность по сравнению с родительским пептидом INGAP-PP. Повышенная активность полученного пептида заключается в активности поддержания своей стабильности в культуральной среде и плазме; активности повышения сниженных уровней глюкозы крови, сниженных уровней инсулина натощак и сниженной оральной толерантности к глюкозе, активности индукции эффекта неогенеза, стимуляции размножения и пролиферации панкреатических островков, активности повышения выживания трансплантированных островков in vivo, активности стимуляции секреции инсулина в основных клетках панкреатических островков, активности содействия нейропротекции или регенерации нервов, активности содействия регенерации печени и/или активности ингибирования воспаления. 31 н. и 12 з.п. ф-лы, 18 ил., 8 табл., 12 пр.
1. Пептид, имеющий аминокислотную последовательность, выбранную из группы, состоящей из:
IGLHDPSHGTLPAG (SEQ ID NO: 73) и IGLHDPTQGTEPAG (SEQ ID NO: 118), или
аналог пептида, выбранный из группы, состоящей из SEQ ID NO: 7, 9-15, 23, 27-30, 41-53, 60, 62, 68-72, где пептид или аналог пептида проявляет повышенную активность по сравнению с родительским пептидом INGAP-PP (SEQ ID NO: 1), где активностью является по крайней мере одна активность, выбранная из группы, состоящей из:
активности поддержания своей стабильности в культуральной среде и плазме;
активности повышения одного из сниженных уровней глюкозы крови, сниженных уровней инсулина натощак и сниженной оральной толерантности к глюкозе,
активности индукции эффекта неогенеза панкреатических островков и стимуляции размножения и пролиферации панкреатических островков,
активности повышения выживания трансплантированных островков in vivo,
активности стимуляции секреции инсулина в основных клетках панкреатических островков,
активности содействия нейропротекции или регенерации нервов,
активности содействия регенерации печени и
активности ингибирования воспаления.
2. Пептид или аналог пептида по п. 1, где пептид или аналог пептида выбирают из:
Ac-IGLHDPSHGTLPAGS (SEQ ID NO: 12);
IGLHDPSHGTLPAGS (SEQ ID NO: 7);
IGLHDPSHGTLPAG (SEQ ID NO: 73);
IGLHDPSHGTLPAGSK (SEQ ID NO: 9);
IGLHDPSHGTLP(Aib)GS (SEQ ID NO: 10);
IGLHDPSHGTLP(N-метил-L-Ala)GS (SEQ ID NO: 11);
(D-Ile)GLHDPSHGTLPAGS (SEQ ID NO: 13);
(L-NorVal)GLHDPSHGTLPAGS (SEQ ID NO: 14);
(L-NorLeu)GLHDPSHGTLPAGS (SEQ ID NO: 15);
IGLHDPSHGTLPAGK (SEQ ID NO: 23);
IGLHDPSHGTLPAGE (SEQ ID NO: 27);
IGLHDPSHGTLPAG-NH2 (SEQ ID NO: 28);
AC-IGLHDPSHGTLPAGS-NH2 (SEQ ID NO: 29);
Ac-IGLHDPSHGTLPAG-NH2 (SEQ ID NO: 30);
IGLHDPSHGTLPAGS-NH2 (SEQ ID NO: 41);
IGLHDPSHGTLPAGSC (SEQ ID NO: 42);
Ac-IGLHDPSHGTLPAGSC (SEQ ID NO: 43);
IGLHDPSHGTLPAGS C-NH2 (SEQ ID NO: 44);
Ac-IGLHDPSHGTLPAGSC-NH2 (SEQ ID NO: 45);
IGLHDPSHGTLPAGC (SEQ ID NO: 46);
Ac-IGLHDPSHGTLPAGC (SEQ ID NO: 47);
IGLHDPSHGTLPAGC-NH2 (SEQ ID NO: 48) и
Ac-IGLHDPSHGTLPAGC-NH2 (SEQ ID NO: 49).
3. Пептид или аналог пептида по п. 1, где пептид или аналог пептида состоит из:
Ac-IGLHDPSHGTLPAGS (SEQ ID NO: 12);
IGLHDPSHGTLPAGS (SEQ ID NO: 7);
IGLHDPSHGTLPAG (SEQ ID NO: 73);
IGLHDPSHGTLPAGSK (SEQ ID NO: 9);
IGLHDPSHGTLP(Aib)GS (SEQ ID NO: 10);
IGLHDPSHGTLP(N-метил-L-Ala)GS (SEQ ID NO: 11);
(D-Ile)GLHDPSHGTLPAGS (SEQ ID NO: 13);
(L-NorVal)GLHDPSHGTLPAGS (SEQ ID NO: 14);
(L-NorLeu)GLHDPSHGTLPAGS (SEQ ID NO: 15);
IGLHDPSHGTLPAGK (SEQ ID NO: 23);
IGLHDPSHGTLPAGE (SEQ ID NO: 27);
IGLHDPSHGTLPAG-NH2 (SEQ ID NO: 28);
AC-IGLHDPSHGTLPAGS-NH2 (SEQ ID NO: 29);
Ac-IGLHDPSHGTLPAG-NH2 (SEQ ID NO: 30);
IGLHDPSHGTLPAGS-NH2 (SEQ ID NO: 41);
IGLHDPSHGTLPAGSC (SEQ ID NO: 42);
Ac-IGLHDPSHGTLPAGSC (SEQ ID NO: 43);
IGLHDPSHGTLPAGSC-NH2 (SEQ ID NO: 44);
Ac-IGLHDPSHGTLPAGSC-NH2 (SEQ ID NO: 45);
IGLHDPSHGTLPAGC (SEQ ID NO: 46);
Ac-IGLHDPSHGTLPAGC (SEQ ID NO: 47);
IGLHDPSHGTLPAGC-NH2 (SEQ ID NO: 48) или
Ac-IGLHDPSHGTLPAGC-NH2 (SEQ ID NO: 49).
4. Пептид или аналог пептида по п. 1, где пептид или аналог пептида выбирают из:
IGLHDPTQGTEPAG (SEQ ID NO: 118);
IGLHDPTQGTEPAGE (SEQ ID NO: 50);
IGLHDPTQGTEP(Aib)GE (SEQ ID NO: 51);
Ac-IGLHDPTQGTEPAGE (SEQ ID NO: 52);
(D-Ile)GLHDPTQGTEPAGE (SEQ ID NO: 53);
AC-IGLHDPTQGTEPAG-NH2 (SEQ ID NO: 60);
Ac-IGLHDPTQGTEPAGE-NH2 (SEQ ID NO: 62);
IGLHDPTQGTEPAGE-NH2 (SEQ ID NO: 68);
IGLHDPTQGTEPAGC (SEQ ID NO: 69);
Ac-IGLHDPTQGTEPAGC (SEQ ID NO: 70);
IGLHDPTQGTEPAGC-NH2 (SEQ ID NO: 71) и
Ac-IGLHDPTQGTEPAGC-NH2 (SEQ ID NO: 72).
5. Пептид или аналог пептида по п. 1, где пептид или пептид аналог состоит из:
IGLHDPTQGTEPAG (SEQ ID NO: 118);
IGLHDPTQGTEPAGE (SEQ ID NO: 50);
IGLHDPTQGTEP(Aib)GE (SEQ ID NO: 51);
Ac-IGLHDPTQGTEPAGE (SEQ ID NO: 52);
(D-Ile)GLHDPTQGTEPAGE (SEQ ID NO: 53);
AC-IGLHDPTQGTEPAG-NH2 (SEQ ID NO: 60);
Ac-IGLHDPTQGTEPAGE-NH2 (SEQ ID NO: 62);
IGLHDPTQGTEPAGE-NH2 (SEQ ID NO: 68);
IGLHDPTQGTEPAGC (SEQ ID NO: 69);
Ac-IGLHDPTQGTEPAGC (SEQ ID NO: 70);
IGLHDPTQGTEPAGC-NH2 (SEQ ID NO: 71) или
Ac-IGLHDPTQGTEPAGC-NH2 (SEQ ID NO: 72).
6. Пептид, имеющий аминокислотную последовательность, выбранную из группы, состоящей из:
IGLHDPSHGTLPAG (SEQ ID NO: 73) и IGLHDPTQGTEPAG (SEQ ID NO: 118), или
аналог пептида, выбранный из группы, состоящей из SEQ ID NO: 7, 9-15, 23, 27-30, 41-53, 60, 62, 68-72, где пептид или аналог пептида проявляет повышенную активность по сравнению с родительским пептидом INGAP-PP (SEQ ID NO: 1), где активностью является по крайней мере одна активность, выбранная из группы, состоящей из:
активности поддержания своей стабильности в культуральной среде и плазме;
активности повышения одного из сниженных уровней глюкозы крови, сниженных уровней инсулина натощак и сниженной оральной толерантности к глюкозе,
активности индукции эффекта неогенеза панкреатических островков и стимуляции размножения и пролиферации панкреатических островков,
активности повышения выживания трансплантированных островков in vivo,
активности стимуляции секреции инсулина в основных клетках панкреатических островков,
активности содействия нейропротекции или регенерации нервов,
активности содействия регенерации печени и
активности ингибирования воспаления;
где пептид или аналог пептида имеет модификацию, выбранную из группы, состоящей из ацетилированного N-конца, амидированного C-конца, D аминокислоты, модифицированной аминокислоты, добавления жирной кислоты, эстерификации карбоксильной группы спиртом, эстерификации спирта кислотой или их комбинаций.
7. Композиция для лечения ослабленной функции поджелудочной железы, содержащая терапевтически эффективное количество пептида или аналога пептида по любому из пп. 1-6 и фармацевтически приемлемый носитель.
8. Композиция для лечения метаболического заболевания, содержащая терапевтически эффективное количество пептида или аналога пептида по любому из пп. 1-6 и фармацевтически приемлемый носитель.
9. Композиция для содействия нейропротекции, содержащая терапевтически эффективное количество пептида или аналога пептида по любому из пп. 1-6 и фармацевтически приемлемый носитель.
10. Композиция для содействия регенерации нервов, содержащая терапевтически эффективное количество пептида или аналога пептида по любому из пп. 1-6 и фармацевтически приемлемый носитель.
11. Композиция для стимуляции регенерации печени, содержащая терапевтически эффективное количество пептида или аналога пептида по любому из пп. 1-6 и фармацевтически приемлемый носитель.
12. Композиция для ингибирования воспаления, содержащая терапевтически эффективное количество пептида или аналога пептида по любому из пп. 1-6 и фармацевтически приемлемый носитель.
13. Способ лечения ослабленной функции поджелудочной железы, который включает стадию введения терапевтически эффективного количества пептида или аналога пептида по любому одному из пп. 1-6.
14. Способ по п. 13, где ослабленная функция поджелудочной железы представляет собой диабет 1-го типа, диабет 2-го типа, латентный аутоиммунный диабет у взрослых (LADA), сниженную глюкозу натощак, сниженную толерантность к глюкозе, дефицит инсулина, гиперинсулинемию натощак, резистентность к инсулину или сниженный уровень инсулина натощак или их сочетание.
15. Способ лечения ослабленной функции поджелудочной железы, который включает стадию введения пептида или аналога пептида по любому одному из пп. 1-6 и антидиабетического лекарственного средства.
16. Способ стимуляции роста β-клеток панкреатического островка in vitro, который включает стадию контакта β-клетки панкреатического островка с пептидом или аналогом пептида по любому одному из пп. 1-6, посредством чего стимулируют рост β-клетки панкреатического островка.
17. Способ стимуляции роста β-клеток панкреатического островка in vivo, который включает стадию контакта β-клетки панкреатического островка с терапевтически эффективным количеством пептида или аналога пептида по любому одному из пп. 1-6, посредством чего стимулируют пролиферацию β-клетки панкреатического островка.
18. Способ получения популяции β-клеток панкреатических островков, который включает стадию контакта одной или нескольких β-клеток панкреатических островков in vitro с пептидом или аналогом пептида по любому одному из пп. 1-6, посредством чего стимулируют пролиферацию одной или нескольких β-клеток панкреатических островков и получают популяцию β-клеток панкреатических островков.
19. Способ по п. 18, где одну или несколько β-клеток панкреатических островков получают у субъекта.
20. Способ трансплантации популяции β-клеток панкреатических островков субъекту, который включает стадию контакта одной или нескольких β-клеток панкреатических островков in vitro с пептидом или аналогом пептида по любому одному из пп. 1-6, посредством чего стимулируют пролиферацию одной или нескольких β-клеток панкреатических островков и получают популяцию β-клеток панкреатических островков, и осуществляют трансплантацию популяции β-клеток панкреатических островков субъекту, где одну или несколько β-клеток поджелудочной железы получают у субъекта, которому трансплантируют популяцию β-клеток панкреатических островков.
21. Способ увеличения числа β-клеток панкреатических островков у субъекта, который включает стадию введения терапевтически эффективного количества пептида или аналога пептида по любому одному из пп. 1-6 субъекту.
22. Способ лечения метаболического заболевания у субъекта, который включает стадию введения терапевтического эффективного количества пептида или аналога пептида по любому одному из пп. 1-6 субъекту.
23. Способ по п. 22, где метаболическим заболеванием является диабет, предиабет или метаболический синдром.
24. Способ лечения состояния, связанного с диабетом, выбранного из группы, состоящей из: ослабленной толерантности к глюкозе, глюкозы крови, глюкозы крови натощак, глюкозы крови после приема пищи, дефицита инсулина, гиперинсулинемии натощак, резистентности к инсулину, ослабленных уровней инсулина натощак, гликозилированного гемоглобина (HbA1c) или их сочетания, посредством введения терапевтически эффективного количества пептида или аналога пептида по любому одному из пп. 1-6 субъекту.
25. Способ содействия нейропротекции, который включает стадию контакта нервной клетки in vivo или in vitro с пептидом или аналогом пептида по любому одному из пп. 1-6.
26. Способ содействия регенерации нервов, который включает стадию контакта нервной клетки in vivo или in vitro с пептидом или аналогом пептида по любому одному из пп. 1-6.
27. Способ содействия регенерации печени, который включает стадию контакта клетки печени in vivo или in vitro с пептидом или аналогом пептида по любому одному из пп. 1-6.
28. Способ по любому из пп. 25-27, где контакт происходит in vitro.
29. Способ по любому из пп. 25-27, где контакт происходит in vivo.
30. Способ ингибирования воспаления у субъекта, который включает стадию введения терапевтически эффективного количества пептида или аналога пептида по любому одному из пп. 1-6 субъекту.
31. Применение пептида или аналога пептида по любому одному из пп. 1-6 для получения лекарственного средства для лечения пациента-человека, имеющего ослабленную функцию поджелудочной железы.
32. Применение пептида или аналога пептида по п. 31, где пациент-человек, имеющий ослабленную функцию поджелудочной железы, имеет заболевание или состояние, выбранное из группы, состоящей из: диабета 1-го типа, диабета 2-го типа, латентного аутоиммунного диабета у взрослых (LADA), сниженной глюкозы натощак, сниженной толерантности к глюкозе, дефицита инсулина, гиперинсулинемии натощак, резистентности к инсулину, сниженного уровня инсулина натощак или их сочетание.
33. Применение пептида или аналога пептида по любому одному из пп. 1-6 для получения лекарственного средства для стимуляции роста β-клеток панкреатического островка.
34. Применение пептида или аналога пептида по любому одному из пп. 1-6 для получения лекарственного средства для получения популяции β-клеток панкреатических островков.
35. Применение пептида или аналога пептида по любому одному из пп. 1-6 для получения лекарственного средства для увеличения числа β-клеток панкреатических островков у человека.
36. Применение пептида или аналога пептида по любому одному из пп. 1-6 для получения лекарственного средства для лечения пациента-человека, имеющего метаболическое заболевание.
37. Применение пептида или аналога по п. 36, где метаболическим заболеванием является диабет, преддиабет или метаболический синдром.
38. Применение пептида или аналога пептида по любому одному из пп. 1-6 для получения лекарственного средства для лечения состояния у субъекта с диабетом, где состояние выбирают из группы, состоящей из:
сниженной толерантности к глюкозе, повышенной глюкозы крови, повышенной глюкозы крови натощак, повышенной глюкозы крови после приема пищи, дефицита инсулина, гиперинсулинемии натощак, резистентности к инсулину, сниженных уровней инсулина натощак, гликозилированного гемоглобина (HbA1c), аргинин-стимулированного C-пептида (AUC) или их сочетание.
39. Применение пептида или аналога пептида по любому одному из пп. 1-6 для получения лекарственного средства для содействия нейропротекции.
40. Применение пептида или аналога пептида по любому одному из пп. 1-6 для получения лекарственного средства для содействия регенерации нервов.
41. Применение пептида или аналога пептида по любому одному из пп. 1-6 для получения лекарственного средства для содействия регенерации печени.
42. Применение пептида или аналога пептида по любому одному из пп. 1-6 для получения лекарственного средства для ингибирования воспаления.
43. Применение по п. 31 для лечения пациента-человека, имеющего частичную панкреатомию.
| WO 2009049222, 16.04.2009 | |||
| WO 2009029847, 05.03.2009 | |||
| WO 03033808, 24.04.2003 | |||
| Прибор для измерения энергии лучеиспускания | 1929 |
|
SU13821A1 |
| FRANKEL A.E | |||
| et al | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Насос | 1917 |
|
SU13A1 |
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
| ПОДОГРЕВАТЕЛЬ ДЛЯ ИСПОЛЬЗОВАНИЯ ТЕПЛОТЫ ВЫХЛОПНЫХ ГАЗОВ ДЛЯ НАГРЕВА ВОДЫ | 1924 |
|
SU575A1 |
| РОЙТ А | |||
| и др | |||
| Иммунология, пер | |||
| с анг | |||
| - М.: Мир, 2000. | |||
Авторы
Даты
2019-04-23—Публикация
2014-03-14—Подача