Данная заявка является составной частью заявки на патент США 08/779768, поданной 7 января 1997 года, которая в настоящее время находится на стадии ожидания решения.
Предпосылки изобретения
Паращитовидный гормон (РТН) является полипептидом, вырабатываемым паращитовидными железами. Зрелая циркулирующая форма данного гормона состоит из 84 аминокислотных остатков. Биологическая активность РТН может быть воспроизведена пептидным фрагментом, включающим N-концевую часть (например, аминокислотные остатки 1-34). Белок, родственный паращитовидному гормону (обозначаемый "PTHrP") - это белок, состоящий из 139-173 аминокислот, по N-концевой части гомологичный РТН. РТНrР проявляет многие общие с РТН биологические функции, включая связывание на общем рецепторе PTH/PTHrP (Tregear et al. , 1983, Endocrinology, 93, 1349). Были описаны пептиды РТН, происходящие от большого числа организмов, например, человека, быка, крысы, домашней курицы (Nissenson et al., 1993, Receptor, 3: 993).
Для РТН была продемонстрирована активность по улучшению и массы, и качества костей (Dempster et al., 1993, Endocrine Rev., 14: 690; Riggs, 1991, Amer. J. Med., 91 [suppl. 5B]: 37S). Был продемонстрирован анаболический эффект перемежающегося введения РТН у мужчин и женщин с диагнозом остеопороза как при наличии, так и при отсутствии конкурирующего противорезорбционного лечения (Slovik et al. , 1986, J. Bone Miner, Res., 1: 377; Reeve et al., 1990, Brit. Med. J., 301: 314; Hesch et al., 1989, Calcif. Tissue Intern., 44: 176).
Резюме изобретения (см. в конце описания).
За исключением N-концевой аминокислоты, все сокращенные обозначения (например, А1а или A1) аминокислот в настоящем изобретении соответствуют структуре -NH-CH(R)-СО-, при том, что R - это боковая цепь аминокислоты (например, СН3 для аланина). Для N-концевой аминокислоты сокращение обозначает структуру ==N-CH(R)-СО-, при том, что R - это боковая цепь аминокислоты. Сокращения β-Nal, Nle, Dap, Cha, Nva, Amp, Pal, Ahc и Aib обозначают следующие α-аминокислоты: β-(2-нафтил)аланин, норлейцин, α,β-диаминопропионовая кислота, циклогексилаланин, норвалин, 4-аминофенилаланин, β-(3-пиридинил)аланин, 1-амино-1-циклогексанкарбоновая кислота и α-аминоизобутановая кислота, соответственно. Под аббревиатурой Асс понимается аминокислота, выбираемая из группы, которая включает 1-амино-1-циклопропанкарбоновую кислоту, 1-амино-1-циклобутанкарбоновую кислоту, 1-амино-1-циклопентанкарбоновую кислоту, 1-амино-1-циклогексанкарбоновую кислоту, 1-амино-1-циклогептанкарбоновую кислоту, 1-амино-1-циклооктанкарбоновую кислоту и 1-амино-1-циклононанкарбоновую кислоту. В приведенной выше формуле гидроксиалкил, гидроксифенилалкил и гидроксинафтилалкил могут включать от 1 до 4 гидроксикомпонентов. Также COE1 обозначает -C=О-E1. Примеры -C=О-E1 включают ацетил и фенилпропионил, но не ограничиваются ими.
Пептид по настоящему изобретению обозначается в данном тексте также и в другом формате, например, [Ahc7,11] hPTH (1-34)NH2, при том, что замещенные аминокислоты из естественной последовательности обозначены в квадратных скобках (например, Ahc7 вместо Leu7 и Ahc11 вместо Leu11 в составе hPTH). Сокращение hPTH обозначает РТН человека, hPTHrP обозначает РТНrР человека, rРТН обозначает РТН крысы и bРТН обозначает РТН быка. Цифры в круглых скобках обозначают число аминокислот, входящих в состав данного пептида: например, hPTH(1-34) ообозначает аминокислоты от 1-й до 34-й в последовательности пептида РТН человека. Последовательности hPTH(1-34), hPTHrP(1-34), bРТН(1-34) и rРТН(1-34) приведены у Nissenson et al., 1993, Receptor, 3: 1993. Обозначение "NH2" в формуле РТН(1-34)NH2 определяет то, что С-конец данного пептида амидирован. С другой стороны, РТН(1-34) обозначает наличие на С-конце свободной аминокислоты.
Каждый из пептидов по настоящему изобретению способен стимулировать рост костей у подопытного субъекта (т.е. у млекопитающего, например, у человека-пациента). Таким образом, они применимы для лечения остеопороза и ломкости костей при введении отдельно или наряду с проведением антирезорбционного лечения, например, с применением бифосфонатов и кальцитонина.
Пептиды по настоящему изобретению могут быть представлены в форме фармацевтически приемлемых солей. Примеры таких солей включают, при этом данным перечнем не ограничиваясь, те соли, которые образуют органические кислоты (например, уксусная, молочная, малеиновая, лимонная, яблочная, аскорбиновая, янтарная, бензойная, метансульфоновая, толуолсульфоновая или памоевая кислоты), неорганические кислоты (соляная кислота, серная кислота или фосфорная кислота) или полимерные кислоты (например, танниновая кислота, карбоксиметилцеллюлозная, полиактовая, полигликолевая или сополимеры полиактогликолевых кислот).
Терапевтически эффективное количество пептида по настоящему изобретению и фармацевтически пригодный носитель (например, карбонат магния, лактоза или фосфолипид, с которым лекарственное соединение может образовывать мицеллу) вместе образуют терапевтическую композицию (например, пилюлю, таблетку, капсулу или жидкий препарат) для введения (например, перорально, внутривенно, трансдермально, через легкие, вагинально, подкожно, назально, с помощью лекарственного электрофореза или внутритрахейно) пациенту. Пилюля, таблетка или капсула, предназначенная для перорального введения, может быть покрыта веществом, защищающим активное начало композиции от действия желудочной кислоты или кишечных ферментов в желудке в течение времени, достаточного для перемещения в нерасщепленном виде из желудка в тонкий кишечник. Терапевтическая композиция также может быть в биодеградируемой или небиодеградируемой форме, предназначенной для постепенного выделения препарата, вводимого подкожно или внутримышечно. См., например, патенты США 3773919 и 4767628 и заявку РСТ WO 94/15587. Непрерывное введение также может быть обеспечено путем использования имплантируемого или внешнего насоса (например, насоса INFUSAIDТМ). Введение также может осуществляться прерывисто, например, путем инъекций раз в день или непрерывно низшими дозами, например, в виде композиции с отсроченным выделением.
Доза пептида по настоящему изобретению для лечения перечисленных выше заболеваний или расстройств варьируется в зависимости от способа введения, возраста и веса тела пациента и от состояния подвергаемого лечению пациента и в конечном счете выбирается по решению лечащего врача или ветеринара.
Также в объеме настоящего изобретения представляется пептид, описываемый вышеприведенной генетической формулой, предназначенный для использования в лечении заболеваний, связанных с дефицитом роста костей или подобного, например, при остеопорозе и ломкости костей.
Другие параметры и достоинства настоящего изобретения будут ясны из подробного описания и из формулы изобретения.
Подробное описание изобретения
Основываясь на приведенном здесь описании, настоящее изобретение может быть использовано в полном своем объеме. Следующие специфические примеры приведены как исключительно иллюстративные и не органичивающие остальные аспекты изобретения в любом направлении его использования. Далее все цитируемые в данном тексте публикации включены в виде библиографических ссылок.
Структура
Для РТН(1-34) и РТНrР(1-34) было описано наличие двух амфофильных α-спиральных доменов: см., например, Barden et al. (1992), Biochemistry, 32; 7126. Первая α-спираль образуется между аминокислотными остатками 4 и 13, в то время как вторая α-спираль образуется на участке между аминокислотами 21 и 29. Некоторые пептиды по настоящему изобретению включают замены одного или большего числа аминокислотных остатков на Асс в пределах этих сегментов РТН(1-34) и РТНrР(1-34) или рядом с ними, например, Ahc7 и Ahc11 в пределах первой α-спирали или Ahc27 и Ahc28 в пределах второй α-спирали.
Синтез
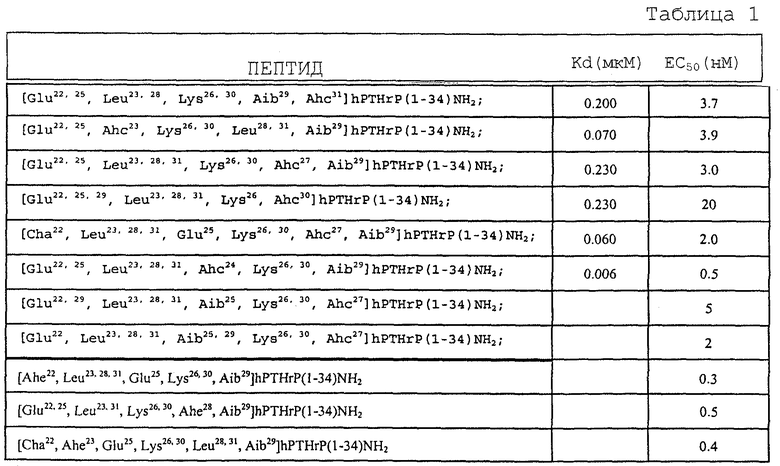
Пептиды по настоящему изобретению могут быть получены с помощью стандартного синтеза в твердой фазе: см., например, Stewart et al., 1984, Solid Phase Synthesis (Pierce Chemical Co., 2d ed.). Далее следует описание того, как был получен пептид [Glu22,25, Leu23,28, Lys26,30, Aib29, Ahc31] hPTH (1-34) NH2. Другие пептиды по настоящему изобретению могут быть получены аналогичным путем рядовым специалистом в данной области техники.
1-[N-трет-бутоксикарбониламино]-1-циклогексанкарбоновая кислота (Вос-Аhс-ОН) была синтезирована следующим образом:
19,1 г (0,133 моль) 1-амино-1-циклогексанкарбоновой кислоты (Acros Organics, Fisher Scientific, Питтсбург, Пенсильвания, США) растворяли в 200 мл диоксана и 100 мл воды. К ним добавляли 67 мг 2N NaOH. Раствор охлаждали на бане с ледяной водой. 32,0 г (0,147 моль) ди-трет-бутилдикарбоната добавляли к этому раствору. Реакционную смесь перемешивали в течение ночи при комнатной температуре. Затем удаляли диоксан при пониженном давлении. К оставшемуся водному раствору добавляли 200 мл этилацетата. Смесь охлаждали на бане с ледяной водой. Значение рН водного слоя доводили примерно до 3 путем добавления 4N НС1. Органический слой отделяли. Водный слой экстрагировали этилацетатом (1х100 мл). Объединяли два органических слоя и промывали водой (2х150 мл), высушивали с использованием безводного МgSO4, отфильтровывали и концентрировали досуха в условиях пониженного давления. Остаток перекристаллизовали из смеси этилацетата и гексана. Было получено 9,2 г чистого продукта, выход составил 29%. Другие защищенные аминокислоты Асс могут быть получены аналогичным способом рядовым специалистом в данной области техники.
Пептид был синтезирован с использованием пептидного синтезатора Applied Biosystems (Foster City, CA), модель 430А, который был модифицирован для условий ускоренного Вос-химического твердофазного синтеза пептидов: см. Schnoize et al., 1992, Int. J. Peptide Protein Res., 90: 180. Использовали 4-метилбензгидриламиновую смолу (МВНА) (Peninsula, Belmont, CA) с замещением 0,93 ммоль/г. Вос-аминокислоты (Bachem, Torrance, CA; Nova Biochem., La Jolla, CA) были использованы со следующей защитой боковых цепей: Boc-Ala-OH, Boc-Arg(Tos)-OH, Boc-Asp (OcHex) -ОН, Вос-Glu(OcHex)-OH, Boc-His(DNP)-OH, Boc-Val-OH, Boc-Leu-OH, Boc-Gly-OH, Boc-Gln-OH, Boc-Ile-OH, Boc-Lys(2C1Z)-OH, Boc-Ahc-OH, Boc-Thr(Bzl)-OH, Boc-Ser(Bzl)-OH и Boc-Aib-OH. Синтез осуществляли в масштабе 0,14 ммоль. Группы Вос удаляли с помощью обработки 100%-ной TFA дважды по 1 минуте. Вос-аминокислоты (2,5 ммоль) были предварительно активированы HBTU (2,0 ммоль) и DIEA (1,0 мл) в 4 мл DMF и объединялись без предварительной нейтрализации пептидно-смоляной TFA-соли. Время соединения составляло 5 минут, за исключением Boc-Aib-OH и ее следующего остатка Boc-Leu-OH, а также Вос-Аhс-ОН и ее следующего остатка Boc-Lys(2Clz)-ОН, при том, что время соединения для этих четырех остатков составляло 2 часа.
По окончании сборки пептидной цепи смолу обрабатывали раствором 20% меркаптоэтанола и 10% DIEA в DMF в течение 2х30 минут с целью удаления группы DNP в боковой цепи гистидина. Затем N-концевую группу Вос удаляли путем обработки 100%-ной TFA в течение 2х2 минуты. Частично освобожденная от защиты смесь пептида и смолы промывали с использованием DMF и DCM и высушивали в условиях пониженного давления. Окончательное расщепление выполняли путем перемешивания пептида-смолы в 10 мл HF, содержащей 1 мл анизола и 24 мг дитиотреитола при 0oС в течение 75 минут. HF удаляли потоком азота. Остаток промывали эфиром (6х10 мл) и экстрагировали 4N НОАс (6х10 мл).
Смесь пептидов в водном экстракте очищали с помощью высокоэффективной жидкостной хроматографии с обращенной фазой (ВЭЖХ) с использованием обратно-фазной колонки VydacTM C18 (Nest Group, Southborough, MA). Колонку элюировали в линейном градиенте (10-45% раствора В в течение более 130 минут) при скорости потока 10 мл/мин (раствор А - 0,1%-ная водная TFA; раствор В - ацетонитрил, содержащий 0,1% TFA). Фракции отбирали и тестировали методом аналитической ВЭЖХ. Те фракции, которые содержали чистый продукт, объединяли и лиофилизировали до высыхания. Было получено 85 мг белого твердого вещества. По данным аналитической ВЭЖХ чистота продукта превысила 99%. Анализ на масс-спектрометре с электрораспылением позволил определить молекулярную массу 3972,4 (что соответствует расчетной молекулярной массе 3972,7).
Синтез и очистка [Cha22, Leu23,28,31, Glu25, Lys26,30, Ahc27, Aib29] hPTHrP(1-34)NH2 были проведены тем же способом, что и описанный выше синтез пептида [Glu22,25, Leu23,28, Lys26,30, Aib29, Ahc31]hPTHrP(1-34)NH2. Защищенная аминокислота Boc-Cha-OH была закуплена у Bachem (СА). Чистота конечного продукта превысила 99%, по данным масс-спектрометрии с электронным распылением молекулярная масса составила 3997,2 (расчетная молекулярная масса составляет 3996,8).
Полные названия соединений, упомянутых выше в виде сокращений, следующие: Вос - трет-бутилоксикарбонил, HF - фтористоводородная кислота, Fm - формил, Хал - ксантил, Bzl - бензил, Tos - тозил, DNP - 2,4-динитрофенил, DMF - диметилформамид, DCM - дихлорметан, HBTU - 2-(1H-бензтриазол-1-ил)-1,1,3,3-тетраметил-уроний -гексафторфосфат, DIEA - диизопропилэтиламин, НОАс - уксусная кислота, TFA - трифторуксусная кислота, 2Clz - 2-хлорбензил-оксикарбонил и OcHex - О-циклогексил.
Радикалы R1 и R2 в приведенной выше общей формуле могут быть присоединены к свободному амину N-концевой аминокислоты с использованием стандартных методов, известных в данной области техники. Например, алкильные группы, такие как C1-12-алкил, могут быть присоединены с использованием реакции алкилирования. Гидроксиалкильные группы, например, C1-12-гидроксиалкил, также могут быть присоединены с применением восстановительного алкилирования, при том, что свободная гидроксильная группа защищена трет-бутиловым эфиром. Ацильные группы, например, COE1, могут быть присоединены путем присоединения свободной кислоты, например, E1COOH, к свободному амину N-концевой аминокислоты путем смешения полной смолы с тремя молярными эквивалентами свободной кислоты и диизопропилкарбодиимида в метиленхлориде на 1 час и включения полученной смолы в этапы (a)-(f) описанной выше программы промывки. Если свободная кислота включает свободную гидроксильную группу, например, п-гидроксифенилпропионовая кислота, то соединение должно быть проведено с дополнительным добавлением 3 молярных эквивалентов НОВТ.
Другие пептиды по настоящему изобретению могут быть получены аналогичным способом рядовым специалистом в данной области техники.
Функциональные тесты
А. Связывание на рецепторе РТН
Пептиды по настоящему изобретению были протестированы по их способности связываться рецепторами РТН, имеющимися на остеосаркомных клетках SaOS-2 человека. Клетки SaOS-2 (Американская коллекция типовых культур, Роквилль, Мэриленд: АТСС НТВ-85) поддерживали в среде RPMI-1640 (Sigma, St. Louis, МО) с добавлением 10% фетальной телячьей сыворотки (FBS) и 2 мМ глутамина при 37oС во влажной атмосфере при содержании 5% СO2 в воздухе. Культуральную среду заменяли каждые три-четыре дня, а клетки пересевали каждую неделю с использованием обработки трипсином.
Клетки SaOS-2 поддерживали в течение четырех дней до того момента, когда они достигали стадии слияния. Культуральную среду замещали средой RPMT-1640 с добавлением 5% FBS и инкубировали в течение 2 часов при комнатной температуре с 10х104 спМ моно-125I-[Nie8,18, Туr34 (3-125I)] bРТН (1-34) NH2 в присутствии конкурирующего пептида по настоящему изобретению при различных его концентрациях в диапазоне от 10-11 М до 10-4 М. Клетки промывали четырежды охлажденным на льду фосфатным буфером и лизировали 0,1 М NaOH, а радиоктивность, связанную с данными клетками, определяли с помощью сцинтилляционного счетчика. Синтез моно-125I- [Nle8,18, Туг34 (3-125I)] bРТН (1-34) NH2 был осуществлен так, как это было описано у Goldman et al., 1988, Endoсrinology, 123: 1468.
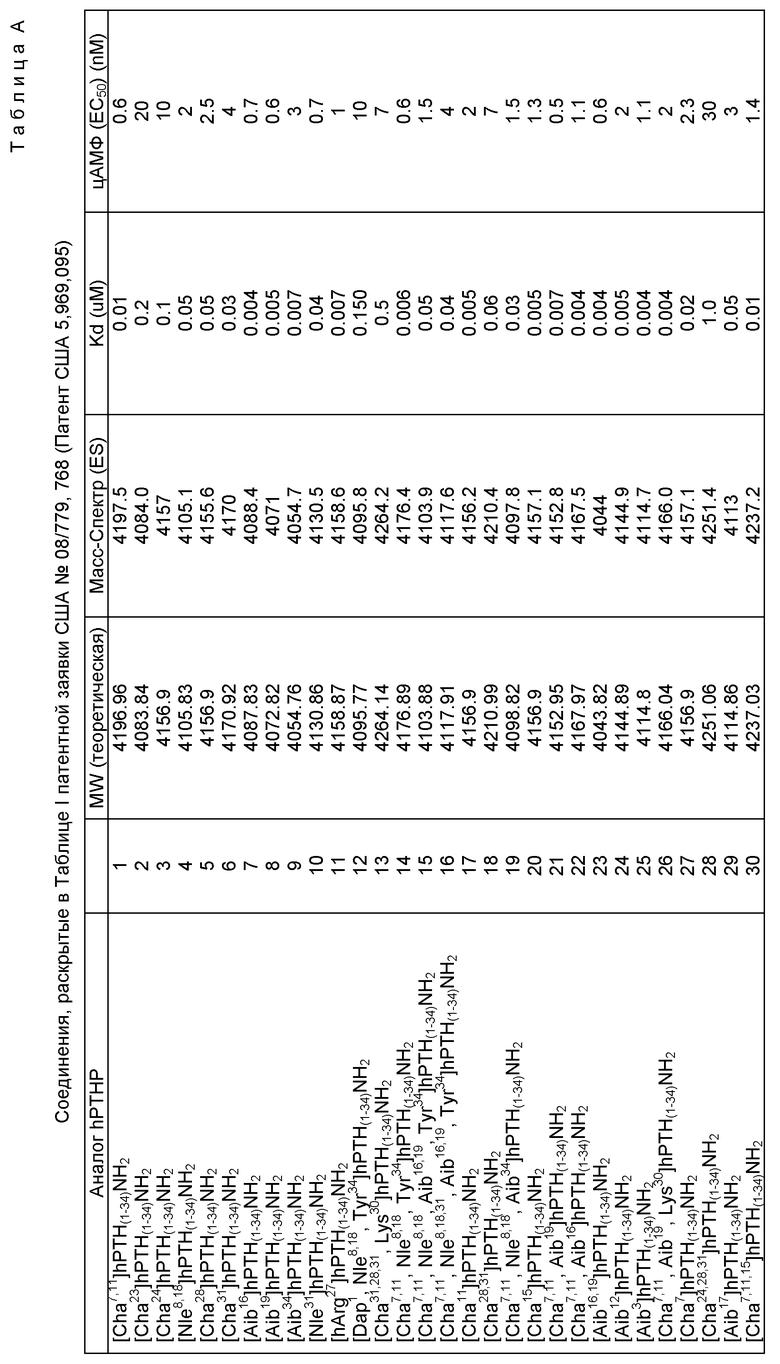
Тест на связывание был осуществлен с различными пептидами по настоящему изобртенеию, и для каждого пептида был определен показатель Kd (50% максимального подавления связывания моно-125I- [Nle8,18, Туг34 (3-125I)] bРТН (1-34) NH2).
Как показано в табл. 1, все тестированные пептиды обладали высокой аффинностью связывания на рецепторе РТН клеток SaOS-2.
В. Стимуляция активности аденилатциклазы
Была измерена способность пептидов по настоящему изобретению индуцировать биологический ответ в клетках SaOS-2. Более подробно, любую стимуляцию аденилатциклазной активности определяли путем измерения интенсивности синтеза цАМФ (аденозин-3',5'-монофосфата), так, как это ранее было описано у Rodan et al., 1983, J. Clin. Invest., 72: 1511 и у Goldman et al., 1988, Endocrinology, 123, 1468. Слившиеся клетки SaOS-2 на 24-луночных планшетах инкубировали с 3H-аденином, 0,5 микрокюри (26,9 Kи/ммоль, New England Nuclear, Boston, MA), в свежей культуральной среде при 37oС в течение 2 часов и дважды промывали сбалансированным солевым раствором Хенкса (Gibco, Gaithersburg, MD). Клетки обрабатывали 1 мМ изобутилметилксантином (IBMX; Sigma, St. Louis, МО) в свежей культуральной среде в течение 15 минут, а пептиды по настоящему изобретению добавляли в эту среду для 5-минутной инкубации. Реакцию останавливали путем добавления 1,2 М трихлоруксусной кислоты (ТСА) (Sigma, St. Louis, МО) с последующей нейтрализацией пробы 4N едкого кали. цАМФ выделяли с использованием метода двухколоночной хроматографии (Salmon et al., 1974, Anal. Biochem., 58, 541). Радиоактивность определяли с помощью сцинтилляционного счетчика (жидкостный сцинтилляционный счетчик 2200СА, PACKARD, Downers Grove, IL).
Соответствующие значения EC50 (50% максимального уровня стимуляции аденилатциклазной активности) были определены для тестированных пептидов: они показаны в табл. 1. Для всех тестированных пептидов продемонстрирован потенциал по стимуляции аденилатциклазной активности, которая соответствует биохимическому пути, индикаторному по проксимальному сигналу пролиферации остеобластов (т.е. роста костей).
Другие варианты
Должно быть понятно, что, хотя изобретение описано в связи с конкретными подробностями, такие описания предназначены для иллюстрирования изобретения и при этом никак не ограничивают объем изобретения, который определяется объемом прилагаемой формулы изобретения. Другие аспекты, преимущества и модификации включены в формулу изобретения.
Результаты приведены в табл. А, В, С.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПЕПТИДЫ, ОБЛАДАЮЩИЕ СРОДСТВОМ К РЕЦЕПТОРУ ПАРАТГОРМОНА (РТН) И СТИМУЛИРУЮЩИЕ АКТИВНОСТЬ АДЕНИЛАТЦИКЛАЗЫ | 1996 |
|
RU2157699C2 |
| АНАЛОГИ ГПП-1 | 1999 |
|
RU2208015C2 |
| АНАЛОГИ ПАРАТИРЕОИДНОГО ГОРМОНА И ИХ ПРИМЕНЕНИЕ | 2011 |
|
RU2604809C2 |
| АНАЛОГИ ГРЕЛИНА | 2003 |
|
RU2315059C2 |
| АНАЛОГИ GLP-1 | 1999 |
|
RU2288232C9 |
| АНАЛОГИ ПАРАТИРЕОИДНОГО ГОРМОНА ДЛЯ ЛЕЧЕНИЯ ОСТЕОПОРОЗА | 1997 |
|
RU2203286C2 |
| АНАЛОГИ ГРЕЛИНА | 2003 |
|
RU2373220C2 |
| ПТГ-СОЕДИНЕНИЯ И СПОСОБ ИХ ПОЛУЧЕНИЯ, СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ФРАГМЕНТ ДНК И СЛИТЫЙ БЕЛОК | 1993 |
|
RU2130945C1 |
| ЛИГАНДЫ РЕЦЕПТОРОВ МЕЛАНОКОРТИНОВ | 2006 |
|
RU2439079C2 |
| ЛИГАНДЫ РЕЦЕПТОРОВ МЕЛАНОКОРТИНОВ | 2006 |
|
RU2380372C2 |








Изобретение относится к пептиду формулы (R1)(R2)A1 - Val - A3 - Glu - A5 - Gln - A7 - A8 - His - Asn - A11 - A12 - Lys - His - A15 - A16 - A17 - A18 - A19 - Arg -A21 - A22 - A23 - A24 - Arg - Lys - A27 - A28 - A29 - A30 - A31 - A32 - A33 - A34 - R3, где A1 - это Ser; A3 - это Ser или Aib; A5 - это Ile; A7 - это Leu или Сha; A8 - это Мet или Nle; A11 - это Leu или Cha; A12 - это Gly или Aib; A15 - это Leu или Cha; A16 - это Asn или Aib; A17 - это Ser или Aib; A18 - это Met, Nle или Aсс; A19 - это Glu или Aib; A21 - это Val; A22 это Aсс, Glu или Сha; A23 - это Тrp, Aсс, Cha или Leu; A24 - это Leu, Acc или Cha; A27 - это Lys, Leu, hArg, Aсс или Cha; A28 - это Leu, Aсс или Cha; A29 - это Glu, Gln или Aib; A30 - это Asp, Lys, Nle или Aсс; A31 - это Val, Leu, Nle, Aсс или Сha; A32 - это His; A33 - это Asn; A34 - это Phe, Tyr или Aib; каждый из радикалов R1 и R2, независимо друг от друга, - Н; и R3 - NH2, при условии, что по крайней мере одна из аминокислот A5, A7, А8, А11, А12, А15, А18, А21, А22, А23, А24, А27, А28, А29 и А31 есть Aсс, или его фармацевтически приемлемой соли, которые являются аналогами гормона паращитовидной железы. Соединения обладают высокой степенью связывания рецепторами РТН и стимулируют активность аденилатциклазы. 3 с. и 12 з.п. ф-лы, 4 табл.

где А1 - это Ser;
А3 - это Ser или Aib;
А5 - это Ile;
А7 - это Leu или Сha;
А8 - это Мet или Nle;
А11 - это Leu или Cha;
А12 - это Gly или Aib;
А15 - это Leu или Cha;
А16 - это Аsn или Аib;
А17 - это Ser или Aib;
А18 - это Met, Nle или Асс;
А19 - это Glu или Aib;
А21 - это Val;
А22 - это Асс, Glu или Сha;
А23 - это Тrp, Асс, Cha или Leu;
А24 - это Leu, Acc, или Cha;
А27 - это Lys, Leu, hArg, Асс или Cha;
А28 - это Leu, Асс или Cha;
А29 - это Glu, Gln или Aib;
А30 - это Аsp, Lys, Nle или Асс;
А31 - это Val, Leu, Nle, Асс или Сha;
А32 - это His;
А33 - это Asn;
А34 - это Phe, Tyr или Aib;
каждый из радикалов R1 и R2, независимо друг от друга, -Н;
R3 - NH2,
при условии, что по крайней мере одна из аминокислот А5, А7, А8, А11, А12, А15, А18, А21, А22, А23, А24, А27, А28, А29 и А31 есть Асс,
или его фармацевтически приемлемая соль.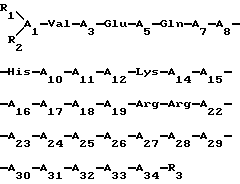
при том, что А1 - это Ala или Ser;
А3 - это Ser или Aib;
А5 - это His;
А7 - это Leu или Сha;
А8 - это Leu;
А10 - это Аsp;
А11 - это Lys или Cha;
А12 - это Gly или Aib;
А14 - это Ser;
А15 - это Ile или Cha;
А16 - это Gln или Аib;
А17 - это Asp или Aib;
А18 - это Leu или Асс;
А19 - это Arg или Aib;
А22 - это Phe, Glu, Асс или Сha;
А23 - это Phe, Leu, Асс или Сha;
А24 - это Leu, Acc или Cha;
А25 - это His, Lys, Aib или Glu;
А26 - это His или Lys;
А27 - это Leu, Lys, Асс или Cha;
А28 - это Ile, Leu, Асс или Cha;
А29 - это Ala, Glu или Aib;
А30 - это Glu, Nle, Асс или Lys;
А31 - это Ile, Leu, Cha или Асс;
А32 - это His;
А33 - это Thr;
А34 - это Ala;
каждый из радикалов R1 и R2, независимо друг от друга, -Н;
R3 - NH2;
при условии, что по крайней мере одна из аминокислот А18, А22, А23, А24, А27, А28, А30 и А31 - это Асс,
или его фармацевтически приемлемая соль.
Приоритет по пунктам:
07.01.1997 по пп.1-15;
07.03.1997 по пп.1-15 (уточнение радикалов).
| ЭЛЕКТРИЧЕСКИЙ РЕАКТОР | 2004 |
|
RU2269176C1 |
| RU 94027680 А1, 10.11.1996 | |||
| Емкостной накопитель энергии | 1978 |
|
SU748817A1 |
| Прибор для очистки паром от сажи дымогарных трубок в паровозных котлах | 1913 |
|
SU95A1 |
| US 5589452 А, 31.12.1996. | |||
Авторы
Даты
2003-02-10—Публикация
1997-12-08—Подача