Изобретение относится к рекомбинантному вирусу коровьей оспы, происходящему от модифицированного вируса коровьей оспы Анкара (MVA), а также содержащему и способному экспрессировать чужеродные гены, встроенные в сайт природной делеции в геноме MVA; к использованию таких рекомбинантных вирусов MVA для продуцирования полипептидов, например антигенов или терапевтических агентов, или вирусных векторов для генной терапии; и к использованию указанных рекомбинантных вирусов MVA, кодирующих антигены, в качестве вакцин.
Цели изобретения
Целью настоящего изобретения является получение рекомбинантного вируса MVA, который может быть использован в качестве эффективного и абсолютно безопасного экспрессионного вектора.
Другой целью настоящего изобретения является разработка простого, эффективного и безопасного способа продуцирования полипептидов, например, антигенов или терапевтических агентов, а также получение рекомбинатных вирусов для изготовления вакцин и вирусных векторов для использования в генной терапии.
Еще одной целью настоящего изобретения является получение экспрессионной системы на основе рекомбинантного вируса MVA, экспрессирующего РНК-полимеразу Т7, и разработка способов продуцирования полипептидов, например, антигенов или терапевтических агенов, или генерирования вирусных векторов для использования в генной терапии, или изготовления вакцин на основе указанной экспрессионной системы.
Предпосылки создания изобретения
Вирус коровьей оспы, принадлежащий к роду Ортопоксвирусов семейства Поксвирусов, был использован в качестве живой вакцины для иммунизации человека в целях продуцирования у него иммунитета против натуральной оспы. (The global eradication of smallpox. Final report of the global commission for the certification of smallpox eradication. History of Public Health, 4, Geneva: World Health Organisation, 1980). Co времени подписания декларации ВОЗ (Всемирная организация здравоохранения, WHO) всеобщая вакцинация была прекращена, за исключением людей с высоким риском заражения поксовирусом (например, лаборантов).
Позже вирусы коровьей оспы были также использованы для конструирования вирусных векторов, предназначавшихся для экспрессии рекомбинантных генов и для возможного их применения в качестве живых вакцин (Mackett, М., Smith, G. L. , Moss, В., 1982, P.N.A.S., USA 79, 7415-7419; Smith, G.L., Macket, M.& Moss, В. , 1984, Biotechnology & Genetic Engineering Reviews, 2, 383-407). Это дает возможность получить ДНК-последовательности (гены), кодирующие чужеродные антигены и встроенные, с помощью техники рекомбинантных ДНК, в геном вируса коровьей оспы. Если ген интегрируется в сайт вирусной ДНК, который не имеет решающего значения для жизненного цикла вируса, то вновь продуцируемый рекомбинантный вирус коровьей оспы может быть инфекционным, то есть, он может инфицировать чужеродные клетки, в результате чего будет экспрессироваться интегрированная ДНК-последовательность (Европейские патентные заявки 83286 и 110385). Полученные таким образом рекомбинантные вирусы коровьей оспы могут быть использованы, с одной стороны, в качестве живых вакцин для профилактики инфекционных заболеваний и, с другой стороны, в качестве материала для продуцирования гетерологичных белков в эукариотических клетках.
Продуцирование рекомбинантного вируса коровьей оспы, экспрессирующего ген РНК-полимеразы бактериофага Т7, позволяет получить экспрессионную систему, которая может широко использоваться для синтеза рекомбинантных белков в клетках млекопитающих (Moss, В., Erloy-Stein, О., Mizukami, Т., Alexander,. W. А. , Fuerst, Т.R., 1990, Nature 348, 91-92). Все методы экспрессии рекомбинантного гена предусматривают синтез РНК-полимеразы Т7 в цитоплазме эукариотических клеток. При этом, наиболее часто используется схема временной экспрессии (Fuerst, T.R., Niles, E.G., Studier, F.W & Moss, В., [1986] Proc. Natl. Acad.Sci. USA, 83, 8122-8126, и заявка на патент США 7648971). Сначала нужный чужеродный ген встраивают в плазмиду под контроль промотора гена РНК-полимеразы Т7. Затем, используя стандартную технику трансфекции, эту плазмиду вводят в цитоплазму клеток, инфицированных рекомбинантным вирусом коровьей оспы, продуцирующим РНК-полимеразу Т7.
Эта схема трансфекции является довольно простой, поскольку она не требует создания новых рекомбинантных вирусов, и к тому же очень эффективной, поскольку она позволяет получить более 80% клеток, экспрессирующих нужный ген (Elroy-Stein, О. & Moss, В. [1990] Proc. Natl. Acad. Sci. USA, 87, 6743-6747). Преимущество "вирус коровьей оспы/Т7-РНК-полимераза"-гибридной системы, по сравнению с другими системами с временной экспрессией, заключается, вероятно, в ее независимости от транспорта плазмид в ядро клетки. Ранее эту систему использовали исключительно в аналитических целях в вирусологии и микробиологии (Buonocore,.L. and Rose, J.К. [1990] Nature 345, 625-628, Pattnaik, A. K. and Wertz, G.W. [1991] Proc. Natl. Acad. Sci. USA, 88, 1379-1383, Karschin, A. , Aiyar, J., Gouin, A., Davidson, N. and Lester, H.A. [1991] FEBS Lett. , 278, 229-233, Но, B. Y., Karshin, A., Raymond, J., Branchek, Т., Lester, H.A. and Davidson, N. [1992] FEBS Lett., 301, 303-306, Buchholz, C.J., Retzler C., Homann, H.E. and Neubert, W.J. [1994] Virology, 204, 770-776). Однако в будущем возможные важные применения гибридной системы "вирус коровьей оспы/РНК-полимераза Т7", например для продуцирования рекомбинантных белков или рекомбинантных вирусных частиц в целях разработки новых терапевтических или профилактических методов в медицине, могут столкнуться с определенными трудностями, обусловленными продуктивной репликацией рекомбинантного вектора, полученного на основе вируса коровьей оспы.
Вирус коровьей оспы является инфекционным для человека, и иногда, после вакцинации, проводимой в качестве профилактической меры по борьбе с натуральной оспой, у вакцинированных людей наблюдались серьезные осложнения. Наиболее полное описание случаев осложнений после вакцинации людей приводится в Национальном отчете США, освещающем наблюдения за вакцинацией около 12 миллионов человек, проведенной с использованием вакцины, полученной на основе штамма Нью-Йоркского городского департамента здравоохранения (New York City Board of Health) вируса коровьей оспы (Lane, J., Ruben, F., Neff, J and Millar, J. [1969] New Engl.J.Med., 281, 1201-1208). Поэтому, многообещающая возможность использования вируса коровьей оспы в качестве вектора для изготовления живых вакцин сталкивается с проблемой безопасности и регламентации применения этого вируса. Кроме того, большинство рекомбинантных вирусов коровьей оспы, описанных в литературе, было получено на основе штамма Western Reserve вируса коровьей оспы. С другой стороны, известно, что этот штамм обладает высокой степенью нейровирулентности, а поэтому, он является малопригодным для введения человеку и животным (Morita et al., Vaccine 5, 65-70 [1987]).
Риск для здоровья человека или животных, связанный с применением указанного вируса в качестве вектора, может быть снижен путем использования в высокой степени аттенюированного (ослабленного) штамма вируса коровьей оспы. Несколько таких штаммов вируса коровьей оспы были специально разработаны для устранения нежелательных побочных эффектов, возникающих в результате противооспенной вакцинации. Так, например, модифицированный вирус коровьей оспы Анкара (MVA) был получен путем длительного серийного пассирования штамма Анкара вируса коровьей оспы (CVA) на фибробластах куриных эмбрионов (см. обзор Mayr, A. , Hochstein-Mintzel, V. and Stickl, H. [1975] Infection 3, 6-14; патент Швейцарии 568392). Вирус MVA был депонирован, в соответствии с требованиями Будапештского договора, в CNCM (Институт Пастера, Национальная коллекция микроорганизмов, 25 rue du Docteur Roux, 75724 Paris Cedex 15) 15 декабря 1987 г. под номером допуска 1-721. Модифицированный вирус MVA отличается своей высокой степенью ослабленности, то есть он обладает пониженной вирулентностью или инфекционностью, сохраняя при этом хорошую иммуногенность. Вирус MVA был проанализирован для того, чтобы определить, какие именно изменения имеются в его геноме по сравнению с вирусом дикого типа CVA. В результате этого анализа были идентифицированы шесть главных делеций в геномной ДНК (делеций I, II, III, IV, V и VI), всего 31000 пар оснований (Meyer, H. , Sutter, G. and Mayr A. [1991] J.Gen. Virol., 72, 1031-1038). По своему кругу хозяев полученный вирус MVA был строго ограничен лишь клетками птиц. Кроме того, MVA отличается своей крайней ослабленностью. Испытания на различных животных показали, что вирус MVA является авирулентным даже у животных с ослабленным иммунитетом. И что особенно важно, что штамм MVA обладает прекрасными свойствами, которые были продемонстрированы в широкомасштабных клинических испытаниях (Mayr et al., Zbl. Bakt. Hyg. I., Abt. Org., В 167, 375-390 [1987] , Stickl et al., Dtsch. med. Wschr., 99, 2386-2392 [1974]). Обследования свыше 120000 человек, вакцинированных вирусом MVA, показали, что у этих пациентов, включая пациентов с повышенным риском заражения, отсутствовали какие-либо побочные эффекты.
Было обнаружено, что репликация MVA в клетках человека блокируется на поздней стадии инфицирования, что способствует предупреждению сборки зрелых инфекционных вирионов. Тем не менее, MVA способен экспрессировать вирусные и рекомбинантные гены на высоком уровне даже в непермессивных клетках, в результате чего было высказано предположение, что вирус MVA может служить в качестве эффективного и безопасного вектора экспрессии генов (Sutter, G. and Moss, В. [1992] Proc.Natl.Acad.Sci. USA, 89, 10847-10851). Недавно были разработаны новые системы векторов на основе вируса MVA, имеющего чужеродные ДНК-последовательности, встроенные в сайт делеции в геноме MVA или в гене ТК (Sutter, G. и Moss, В [1995] Dev.Biol.Stand.Basell, Karger, 84, 195-200 и патент США 5185146).
Для дальнейшего более перспективного использования MVA, были проведены исследования по разработке новых возможных путей введения чужеродных генов в штамм MVA вируса коровьей оспы с использованием техники рекомбинантных ДНК. Поскольку изменение генома вируса MVA не являлось целью этих исследований, то необходимо было использовать такой метод, который соответствовал бы этим целям. В соответствии с настоящим изобретением, была осуществлена рекомбинация путем встраивания чужеродной ДНК-последовательности в вирусную ДНК точно в сайт натуральной делеции, имеющейся в геноме MVA.
Краткое описание изобретения
Настоящее изобретение включает, inter alia, в свой объем (отдельно или в комбинации):
рекомбинантный вирус MVA, содержащий и способный экспрессировать, по крайней мере, один чужеродный ген, встроенный в сайт природной делеции в геноме MVA;
вышеуказанный рекомбинантный вирус MVA, содержащий и способный экспрессировать, по крайней мере, один чужеродный ген, встроенный в сайт делеции II в геноме MVA;
вышеуказанный рекомбинантный вирус MVA, в котором чужеродный ген кодирует маркер, терапевтический агент или антигенную детерминанту;
вышеуказанный рекомбинантный вирус MVA, в котором чужеродный ген кодирует антигенную детерминанту патогенного вируса, бактерии или другого микроорганизма, паразита или опухолевой клетки;
вышеуказанный рекомбинантный вирус MVA, в котором чужеродный ген кодирует антигенную детерминанту Plasmodium Falciparum, микробактерий, вируса герпеса, вируса гриппа, вируса гепатита, или вируса иммунодефицита человека;
вышеуказанный рекомбинантный вирус MVA, в котором антитигенной детерминантой является nef ВИЧ или тирозиназа человека;
вышеуказанный рекомбинантный вирус MVA, которым является MVA-lAInef или MVA-hTYR;
вышеуказанный рекомбинантный вирус MVA, в котором чужеродный ген кодирует РНК-полимеразу Т7;
вышеуказанный рекомбинантный вирус MVA, которым является MVA-poI T7;
вышеуказанный рекомбинантный вирус MVA, в котором чужеродный ген находится под транскрипционным контролем раннего/позднего промотора Р7.5 вируса коровьей оспы;
вышеуказанные рекомбинантные вирусы MVA, которые, в основном, не способны реплицироваться в клетках человека;
использование вышеуказанного рекомбинантного вируса MVA для транскрипции ДНК-последовательностей под транскрипционным контролем промотора РНК-полимеразы T7;
эукариотическая клетка, инфицированная любым из вышеуказанных рекомбинантных вирусов MVA;
клетка, инфицированная вышеуказанным рекомбинантным вирусом MVA, в котором чужеродный ген кодирует РНК-полимеразу T7;
клетка, инфицированная вышеуказанным рекомбинантным вирусом MVA, в котором чужеродный ген кодирует РНК-полимеразу T7, и содержащая, кроме того, один или несколько экспрессирующих векторов, несущих один или несколько чужеродных генов под транскрипционным контролем промотора РНК-полимеразы Т7;
использование вышеуказанных клеток для продуцирования полипептидов, кодируемых указанными чужеродными генами, предусматривающее:
a) культивирование указанных клеток в подходящих условиях и
b) выделение полипептидов, кодированных указанными чужеродными генами;
клетка, инфицированная вышеуказанным рекомбинантным вирусом MVA, в котором чужеродный ген кодирует РНК-полимеразу Т7, и кроме того, содержащая экспрессионные векторы, несущие вирусные гены, и/или вирусную векторную конструкцию, кодирующую геном вирусного вектора под контролем транскрипционного промотора РНК-полимеразы Т7;
использование вышеуказанных клеток для продуцирования вирусных частиц, предусматривающее:
a) культивирование указанных клеток в подходящих условиях и
b) выделение вирусных частиц;
клетка, инфицированная вышеуказанным рекомбинантным вирусом MVA, в котором чужеродный ген кодирует РНК-полимеразу Т7, и, кроме того, содержащая:
а) экспрессионный вектор, несущий ретровирусную конструкцию, способную инфицировать клетки-мишени и регулировать в этих клетках-мишенях экспрессию одного или нескольких чужеродных генов, присутствующих в указанной ретровирусной векторной конструкции и
b) один или несколько экспрессионных векторов, несущих гены, кодирующие полипептиды, необходимые для генома указанной ретровирусной векторной конструкции, подвергаемой упаковке под транскрипционный контроль промотора РНК-полимеразы Т7;
использование вышеуказанных клеток для продуцирования ретровирусных частиц, предусматривающее:
a) культивирование указанных клеток в подходящих условиях и
b) выделение ретровирусных частиц;
вакцина, содержащая вышеуказанный рекомбинантный вирус MVA, в котором чужеродный ген кодирует антигенную детерминанту, в физиологически приемлемом носителе;
использование вышеуказанного рекомбинантного вируса MVA, в котором чужеродный ген кодирует антигенную детерминанту для получения вакцины;
использование вышеуказанной вакцины для иммунизации живого организма животного, включая человека;
использование вышеуказанной вакцины, содержащей MVA-LAInef, для предупреждения или лечения ВИЧ-инфекции или СПИД'а;
использование вышеуказанной вакцины, содержащей MVA-hTYR, для предупреждения или лечения меланомы;
вакцина, содержащая в качестве первого компонента вышеуказанный рекомбинантный вирус MVA, в котором чужеродный ген кодирует РНК-полимеразу Т7, в физиологически приемлемом носителе; и в качестве второго компонента - ДНК-последовательность, несущую антигенную детерминанту под транскрипционным контролем промотора РНК-полимеразы Т7, в физиологически приемлемом носителе; при этом, два указанные компонента присутствуют вместе или отдельно;
использование вышеуказанной вакцины для иммунизации живого организма животного, включая человека, предусматривающее инокуляцию указанного живого организма животного, включая человека, первым и вторым компонентом вакцины либо одновременно, либо с определенным интервалом времени, с использованием одного и того же сайта инокуляции.
Термин "ген" означает ДНК-последовательность, которая кодирует белок или пептид.
Термин "чужеродный ген" означает ген, встроенный в ДНК-последовательность, в которой этот ген обычно отсутствует.
Чужеродным геном может быть, например, маркерный ген; терапевтический ген; ген, кодирующий антигенную детерминанту; или вирусный ген. Эти гены хорошо известны специалистам.
Описание изобретения
Модифицированный вирус коровьей оспы Анкара (MVA), имеющий ограниченный круг хозяев и являющийся в высокой степени аттенюированным штаммом вируса коровьей оспы, не способен размножаться в клетках человека и в исследованных клеточных линиях большинства других млекопитающих. Однако поскольку экспрессия вирусного гена не нарушается в непермиссивных клетках, то, в соответствии с настоящим изобретением, рекомбинантные вирусы MVA могут быть использованы в качестве абсолютно безопасных и эффективных экспрессионных векторов.
Рекомбинантные вирусы MVA, кодирующие антигенную детерминанту
В одном из вариантов своего осуществления настоящее изобретение относится к рекомбинантному вирусу MVA коровьей оспы, содержащему ген, который кодирует чужеродный антиген, предпочтительно патогенный агент; и к вакцинам, содержащим указанный вирус в физиологически приемлемой форме. Настоящее изобретение также относится к способам получения указанного рекомбинантного вируса коровьей оспы MVA или вакцин на основе этого вируса и к использованию этих вакцин для профилактики инфекционных заболеваний, вызываемых указанными патогенными агентами.
В предпочтительном варианте настоящего изобретения, чужеродным геном, встроенным в вирус MVA, является ген, кодирующий nef ВИЧ.
Авторами настоящей заявки были сконструированы рекомбинантные вирусы MVA, которые позволяют осуществлять экспрессию гена nef ВИЧ-1 под контролем раннего/позднего промотора Р7.5 вируса коровьей оспы. Регуляторный белок Nef лентивирусов приматов синтезируется на ранней стадии репликативного цикла вируса; при этом было показано, что этот белок играет важную роль в репликации вируса с высоким титром и индуцировании заболеваний in vivo. Это позволяет предположить, что nef ВИЧ может играть решающую роль в патогенезе СПИД'а. Молекулярные механизмы, благодаря которым nef способствует увеличению инфекционности и патогенности вируса ВИЧ, нуждаются в дополнительном исследовании. Однако, очевидно, что nef является иммуногенным, и nef-специфический антиген может быть использован в качестве вакцины против ВИЧ-инфекции и СПИД'а.
В соответствии с этим очевидно, что, с одной стороны, рекомбинантный вирус MVA, экспрессирующий ген nef ВИЧ, может быть использован в качестве профилактической вакцины против ВИЧ для иммунизации человека, а с другой стороны, он может быть использован для иммунотерапии ВИЧ-инфицированных пациентов или больных СПИД'ом. Кроме того, рекомбинантный вирус MVA, экспрессирующий ген nef ВИЧ, может быть использован для продуцирования рекомбинантного белка ВИЧ.
В другом предпочтительном варианте осуществления настоящего изобретения чужеродным геном, встроенным в вирус MVA, является ген, кодирующий трозиназу человека.
Авторами настоящей заявки были сконструированы рекомбинантные вирусы MVA, которые позволяют осуществлять экспрессию гена тирозиназы человека под контролем раннего/позднего промотора Р7.5 вируса коровьей оспы. Недавно тирозиназа человека идентифицирована как меланома-специфический опухолевый антиген, который способствует генерированию противоопухолевых цитолитических Т-лимфоцитов (Brichard, V., et al., [1993] J.Exp.Med., 178, 489-495). Поскольку, среди нормальных клеток, вероятно, лишь меланоциты экспрессируют ген тирозиназы, то очевидно, что тирозиназа является ценным антигеном-мишенью для иммунотерапии меланомы. Поэтому, рекомбинантный вирус MVA, экспрессирующий ген тирозиназы человека, может быть использован для продуцирования у пациентов, страдающих меланомой, иммунного ответа, стимулирующего отторжение опухоли или предупреждающего возникновение метастазов. Рекомбинантный вирус MVA, экспрессирующий ген тирозиназы человека, может быть использован непосредственно в качестве вакцины против меланомы, либо этот вирус может быть использован для получения вакцины против меланомы. В одном примере, рекомбинантный вирус MVA, экспрессирующий ген тирозиназы человека, может быть использован для продуцирования рекомбинантного белка тирозиназы, который может служить в качестве антигена в вакцинных препаратах. В другом примере, клетки, взятые из опухоли пациента, могут быть модифицированы in vitro с использованием в качестве вектора рекомбинантного вируса MVA, экспрессирующего ген тирозиназы человека, а затем, модифицированные клетки, экспрессирующие тирозиназу, переносят обратно в организм пациента для индуцирования у него противоопухолевого иммунного ответа. Вакцина, полученная на основе рекомбинантного MVA, экспрессирующего ген тирозиназы человека, может быть использована либо парентерально, либо местно путем введения непосредственно в область опухоли. Для предупреждения возникновения метастазов или для фенотипического изменения опухоли, например изменения ее размеров, формы, консистенции, васкуляризации или других признаков, вакцина, полученная на основе рекомбинантного вируса MVA, экспрессирующего ген тирозиназы человека, может быть введена до, во время или после хирургического удаления опухоли.
Для изготовления вакцин в соответствии с настоящим изобретением вирусы коровьей оспы MVA приготавливают в соответствующей физиологически приемлемой форме. Это может быть сделано, исходя из опыта получения MVA-вакцин, предназначенных для противооспенной вакцинации (как описано Stickl, Н. et al., [1974] Dtsch. med. Wschr. , 99, 2386-2392). Для этого около 106-108 частиц рекомбинантного MVA лиофилизуют в 100 мл забуференного фосфатом физиологического раствора (PBS) в присутствии 2% пептона и 1% альбумина человека в ампуле, предпочтительно в стеклянной ампуле. Лиофилизат может содержать наполнители (такие как маннит, декстран, сахар, глицин, лактоза или поливинилпирролидон) или другие добавки (такие, как антиоксиданты, стабилизаторы и т. п. ), подходящие для парентерального введения. Затем стеклянную ампулу герметично запаивают, и эта ампула может быть оставлена на хранение в течение нескольких месяцев при температуре предпочтительно ниже -20oС.
Для вакцинации или терапии, лиофилизат может быть растворен в 0,1-0,5 мл водного раствора, предпочтительно физиологического раствора, и введен либо парентерально, например, путем внутримышечной инокуляции или локально, например, путем инокуляции в саму опухоль или в область локализации опухоли. Вакцины или терапевтические средства настоящего изобретения предпочтительно вводят путем внутримышечной инъекции (Mayr, A. et al., [1978] Zbl.Bakt.Hyg., I. Abt. Orig. В, 167, 375-390). Способ, доза и схема введения могут быть оптимизированы самим специалистом известными способами. Для того чтобы получить соответствующий иммунный ответ против чужеродного антигена, желательно вводить вакцину несколько раз в течение длительного периода времени.
Использование вирусов MVA для продуцирования гетерологичных полипептидов
В соответствии с настоящим изобретением, рекомбинантные вирусы коровьей оспы MVA могут быть также использованы для продуцирования гетерологичных полипептидов в эукариотических клетках. Для этого, клетки инфицируют рекомбинантными вирусами коровьей оспы. В инфицированных клетках экспрессируются гены, кодирующие чужеродный полипептид, в результате чего продуцируется гетерологичный полипептид, который затем выделяют. Методы, используемые для продуцирования таких гетерологичных полипептидов, хорошо известны специалистам (ЕР-А-206920 и ЕР-А-205939), Полипептиды, продуцированные с помощью рекомбинантных вирусов MVA, являются более подходящими исходя из конкретных свойств вирусов MVA, для использования в качестве лекарственных средств для введения человеку и животным.
Рекомбинантные вирусы MVA, кодирующие РНК-полимеразу T7, их использование для экспрессии ДНК-последовательностей под контролем промотора РНК-полимеразы Т7
В другом варианте осуществления настоящего изобретения авторами изобретения были сконструированы рекомбинантные вирусы MVA, которые позволяют экспрессировать ген РНК-полимеразы бактериофага Т7 под контролем раннего/позднего промотора Р7.5 вируса коровьей оспы. Эффективность рекомбинантных вирусов MVA-pol T7 в качестве экспрессирующих систем оценивали с помощью анализа методом кратковременной трансфекции для индуцирования экспрессии рекомбинантных генов под контролем промотора РНК-полимеразы T7. Используя в качестве гена-репортера ген хлорамфениколацетилтрансферазы (CAT) E.coli, авторы обнаружили, что MVA-pol T7-индуцированная экспрессия гена CAT является такой же эффективной, как и экспрессия, индуцированная вирусом коровьей оспы/pol T7, происходящим от компетентного в отношении репликации штамма WR вируса коровьей оспы.
Таким образом, гибридная система MVA/pol T7 настоящего изобретения может быть использована в качестве простой, эффективной и безопасной экспрессионной системы для продуцирования полипептидов в клетках млекопитающих при отсутствии вируса коровьей оспы.
Эта экспрессионная система может быть также использована в целях генерирования рекомбинантных вирусных частиц для вакцинации или генной терапии путем трансформации клеточных линий, инфицированных рекомбинантным вирусом MVA, экспрессирующим РНК-полимеразу Т7, то есть инфицированных ДНК-конструкцией, содержащей все или некоторые гены, и геном или рекомбинантный геном, необходимые для генерирования вирусных частиц, например, MVA-частиц или ретровирусных частиц под транскрипционным контролем промотора РНК-полимеразы Т7.
Векторные системы на основе ретровирусов состоят из двух компонентов:
1) первым компонентом является сам ретровирусный вектор, представляющий собой модифицированный ретровирус (векторную плазмиду), в котором гены, кодирующие вирусные белки, были заменены терапевтическими генами и маркерными генами, необходимыми для введения в клетку-мишень. Поскольку такая замена генов, кодирующих вирусные белки, приводит к значительному повреждению вируса, то этот вирус может быть "спасен" с помощью второго компонента в системе, который восполняет отсутствие вирусных белков в модифицированном ретровирусе;
2) вторым компонентом является клеточная линия, которая продуцирует большие количества вирусных белков, но, при этом, не обладает способностью продуцировать компетентный по репликации вирус. Такая клеточная линия известна как линия клеток с дефектом упаковки и представляет собой клеточную линию, трансфецированную одной или несколькими плазмидами, несущими гены (гены gag, pol и env, кодирующие полипептиды), обеспечивающие упаковку модифицированного ретровирусного вектора.
Для генерирования упакованного вектора, векторную плазмиду трансфецируют в линию клеток с дефектом упаковки. В этих условиях модифицированный ретровирусный геном, включающий встроенные терапевтические и маркерные гены, транскрибируется с векторной плазмиды и упаковывается в модифицированные ретровирусные частицы (рекомбинантные вирусные частицы). Затем этот рекомбинантный вирус используют для инфицирования клеток-мишеней, в ДНК которых могут интегрироваться геном вектора и любые присутствующие в нем маркерные или терапевтические гены. Клетка, инфицированная такой рекомбинатной вирусной частицей, не может продуцировать новый векторный вирус, поскольку в этих клетках отсутствуют вирусные белки. Однако ДНК вектора, несущего терапевтические и маркерные гены, интегрируется в ДНК клетки и может экспрессироваться в инфицированных клетках.
В соответствии с настоящим изобретением, рекомбинантный вирус MVA, экспрессирующий РНК-полимеразу Т7, может быть использован для продуцирования белков, необходимых для упаковки ретровирусных векторов. Для этого, гены gag, pol и env ретровируса (например, вирус лейкоза мышей (MLV)) помещают в один или несколько экспрессионных векторов (например, плазмид) под транскрипционный контроль промотора РНК-полимеразы Т7. Затем экспрессионный вектор вводят в клетку, инфицированную рекомбинантным вирусом MVA, экспрессирующим РНК-полимеразу Т7, вместе с экспрессионным вектором, несущим ретровирусную векторную конструкцию, возможно под транскрипционным контролем промотора РНК-полимеразы Т7.
В WO 94/29437, WO 89/11539 и WO 96/07748 описаны различные типы ретровирусных векторных конструкций, которые могут быть упакованы с использованием системы для упаковки, описанной выше.
Кроме того, рекомбинантный вирус MVA, экспрессирующий РНК-полимеразу Т7, может быть использован для продуцирования рекомбинантных белков, неинфицированных вирусных частиц или инфекционных мутантных вирусных частиц в целях изготовления вакцин или терапевтических средств (Buchholz et al., Virology, 204, 770-776 [1994] и ЕР-ВI-356695). Для этого, вирусные гены (например, гены gag-pol и env вируса ВИЧ-1) помещали под транскрипционный контроль промотора Т7 в экспрессионный вектор (например, в плазмиду или другой рекомбинантный вирус MVA). Затем, эту конструкцию вводили в клетки, инфицированные рекомбинантным вирусом MVA, экспрессирующим РНК-полимеразу Т7. Гены рекомбинантного вируса транскрибируются с высокой степенью эффективности, в результате чего могут быть получены и очищены белки в больших количествах. Кроме того, экспрессированные рекомбинантные вирусные белки (например, env, gag ВИЧ-1) могут собираться в вирусные псевдочастицы, которые реплицируются и отделяются от клетки, после чего они могут быть выделены из среды с тканевой культурой. В другом варианте осуществления изобретения вирусные белки (например, вирусов ВИЧ, SIV и вируса кори), экспрессируемые MVA-pol Т7-системой, могут "спасать" дополнительно введенный мутантный вирус (происходящий, например, от ВИЧ, SIV, вируса кори) посредством преодоления дефекта интеграции; и инфицирование, декапсидация, репликация нуклеиновой кислоты, экспрессия вирусного гена, сборка, баддинг или другая стадия размножения вируса позволяют осуществлять продуцирование и очистку вышеупомянутого мутантного вируса.
Вирус MVA-pol T7 может быть также использован вместе с ДНК-последовательностями, несущими ген нужного антигена (например, ген ВИЧ, nef, tat, pol, gag, env или другие гены), необходимого для иммунизации. Сначала кодирующую последовательность данного антигена (например, ВИЧ, HCV, HPV, HSV, вируса кори, вируса гриппа или др.) клонируют под контролем промотора РНК-полимеразы T7 предпочтительно в плазмидный вектор, а полученную ДНК-конструкцию амплифицируют и очищают с использованием стандартных лабораторных процедур. Затем,
векторную ДНК инокулируют одновременно или с некоторым интервалом времени вместе с MVA-pol T7. В месте инокуляции нужный рекомбинантный ген подвергается временной экспрессии в клетках, содержащих векторную ДНК и MVA-pol T7, и соответствующий антиген презентируется иммунной системе хозяина, стимулируя антиген-специфический иммунный ответ. Эта схема, предусматривающая использование нереплицирующегося вектора MVA-pol T7 на основе вируса коровьей оспы, является многообещающим новым способом вакцинации нуклеиновой кислотой, обеспечивающим эффективную временную экспрессию данного антигена, но, при этом, позволяющим избежать потенциального риска конститутивной экспрессии гена.
Рекомбинантные вирусы MVA, происходящие от вируса коровьей оспы, могут быть получены, как описано ниже.
ДНК-конструкцию, которая содержит ДНК-последовательность, кодирующую чужеродный полипептид и фланкированную MVA-ДНК-последовательностями, смежными с природной делецией, например, делецией II в геноме MVA, вводят в клетки, инфицированные вирусом MVA, в результате чего происходит гомологичная рекомбинация.
После введения ДНК-конструкции в эукариотические клетки и после рекомбинации с заменой вирусной ДНК на чужеродную ДНК, рекомбинантный вирус коровьей оспы может быть выделен известными способами, предпочтительно с помощью маркера (ср. Nakano et al., Proc.Natl.Acaq.Sci. USA, 79, 1593-1596 [1982], Franke et al., Mol.Cell.Biol., 1918-1924 [1985], Chakrabarti et al., Mol.Cell.Biol., 3403-3409 [1985], Fatchi et al., Virology 97-105 [1986]).
Вводимая ДНК-конструкция может быть линейной или кольцевой. Предпочтительной является кольцевая ДНК, а в частности - плазмида. ДНК-конструкция содержит последовательности, фланкирующие левый и правый края природной делеции, например, делеции II, в геноме MVA (Altenburger, W., Suter, С.Р. and Altenburger J. [1989] Arch.Virol., 105, 15-27). Чужеродную ДНК-последовательность встраивают между последовательностями, фланкирующими природную делецию. Такой чужеродной ДНК-последовательностью может быть ген, кодирующий терапевтический полипептид, например, t-PA или интерферон, или антигенную детерминанту патогенного агента. Такими патогенными агентами могут быть вирусы, бактерии и паразиты, которые могут вызывать заболевания, а также опухолевые клетки, которые бесконтрольно размножаются в организме и могут приводить к образованию и росту опухоли. Примеры таких патогенных агентов описаны Davis, B.D. и др. (Microbiology, 3rd ed., Harper International Edition). Предпочтительными антигенами патогенных агентов являются вирусы иммунодефицита человека (например, ВИЧ-1 и ВИЧ-2), микобактерии, вызывающие туберкулез, паразит Plasmodium falciparum и клетки меланомы.
Для экспрессии ДНК-последовательности или гена требуется присутствие регуляторных последовательностей, которые необходимы для транскрипции генов, присутствующих на ДНК-последовательности. Такие регуляторные последовательности (называемые промоторами) хорошо известны специалистам, и примером таких последовательностей может служить промотор гена вируса коровьей оспы, кодирующего полипептид 11 кДа, описанный в ЕР-А-198328, и промотор гена, кодирующего полипептид 7,5 кДА, описанный в ЕР-А-110385.
ДНК-конструкция может быть введена в MVA-инфицированные клетки путем трансфекции, например путем преципитации фосфатом кальция (Graham et al., Virol., 52, 456-467 [1973]; Wigler et al., Cell, 777-785 [1979]); путем электропорации (Neumann et al. , EMBO J., 1, 841-845 [1982]); путем микроинъекции (Graesmann et al. , Meth. Enzymology, 101, 482-492 [1983]); посредством использования липосом (Straubinger et al., Methods in Enzymology 101, 512-527 [1983]); с помощью сферопластов (Schaffner, Proc.Natl.Acad.Sci. USA, 77, 2163-2167 [1980]), или какими-либо другими известными методами. При этом, предпочтительным методом трансфекции является осаждение фосфатом кальция.
Для лучшего понимания сущности настоящего изобретения ниже приводятся подробные примеры его осуществления. Однако эти примеры не должны рассматриваться как некое ограничение объема изобретения.
Описание чертежей
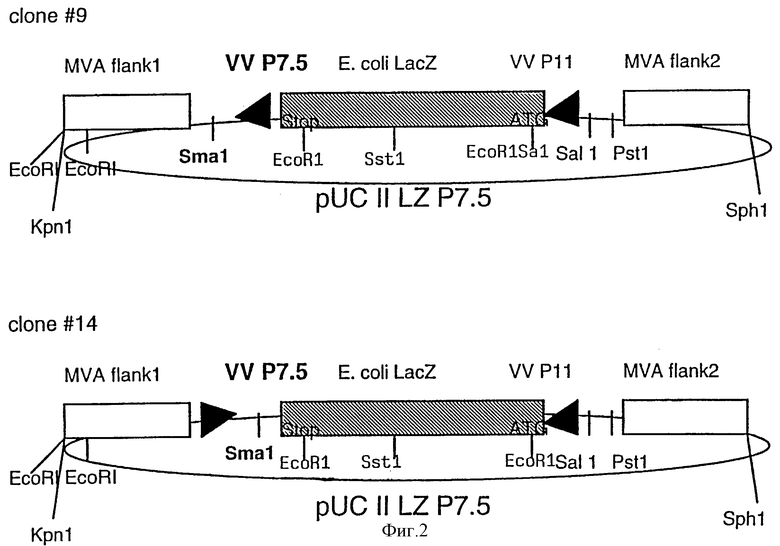
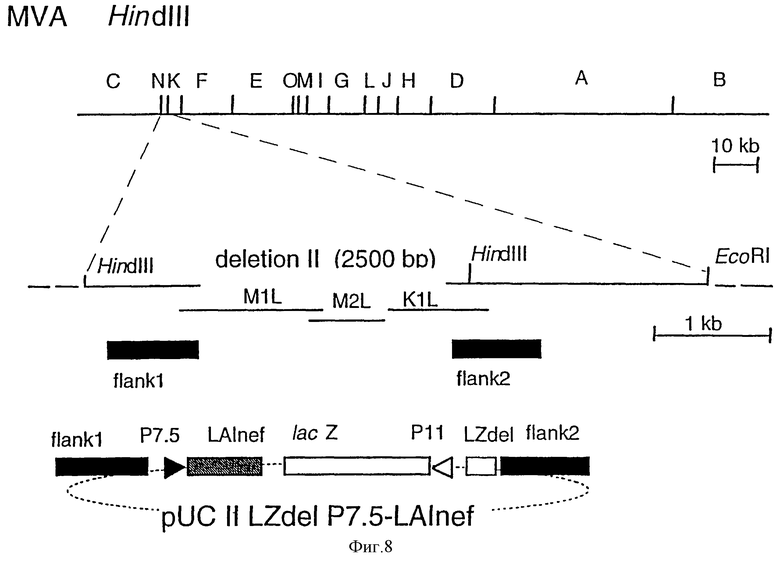
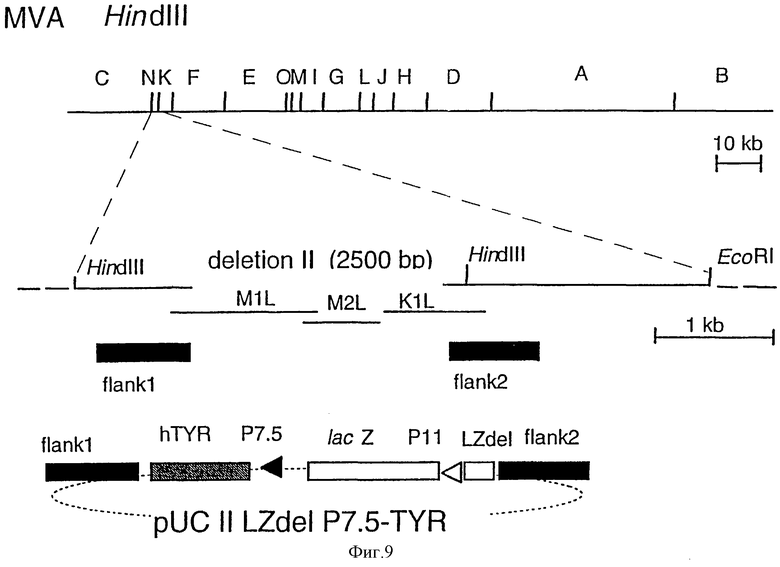
Фиг.1: Схематическая карта генома MVA и плазмиды для инсерции чужеродной ДНК путем гомологичной рекомбинации: HindIII-рестрикционные сайты в геноме MVA указаны сверху. Показан также HindIII-NindIII N-фрагмент (900 п.о.), который перекрывает область делеции II в геноме MVA. ДНК-последовательности MVA, примыкающие к делеции II (край 1 (flank 1) и край 2 (flank 2) были амплифицированы с помощью полимеразной цепной реакции (PCR) и использованы для конструирования инсерционной плазмиды pUC II LZ.
Фиг. 2: pUC II LZ P7.5: плазмидный вектор MVA, предназначенный для инсерции в делецию II и содержащий экспрессирующий PII-LacZ-кластер и ранний/поздний промотор P7.5 вируса коровьей оспы, для экспрессии нужных генов, которые могут быть клонированы в Smal-сайт плазмиды.
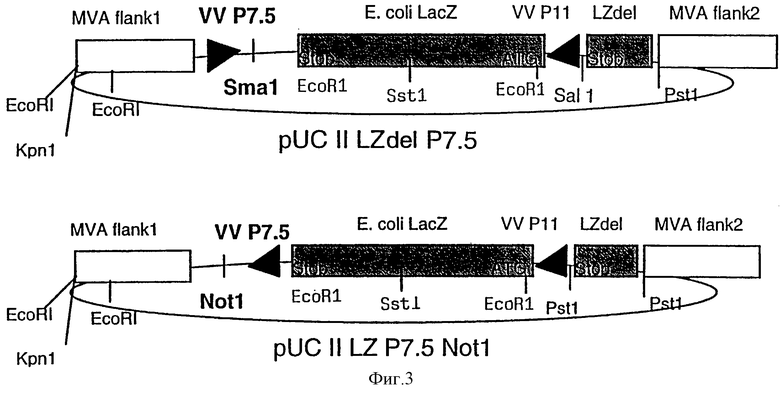
Фиг. 3: pUC II Lzdel P7.5: MVA-плазмидный вектор для инсерции чужеродных генов в сайт делеции II в геноме MVA, содержащий самоделетирующийся экспрессионный PII-LacZ-кластер и ранний/поздний промотор P7.5 вируса коровьей оспы для экспрессии нужных генов, которые могут быть клонированы в Sma1/Not1-сайт клонирования плазмиды.
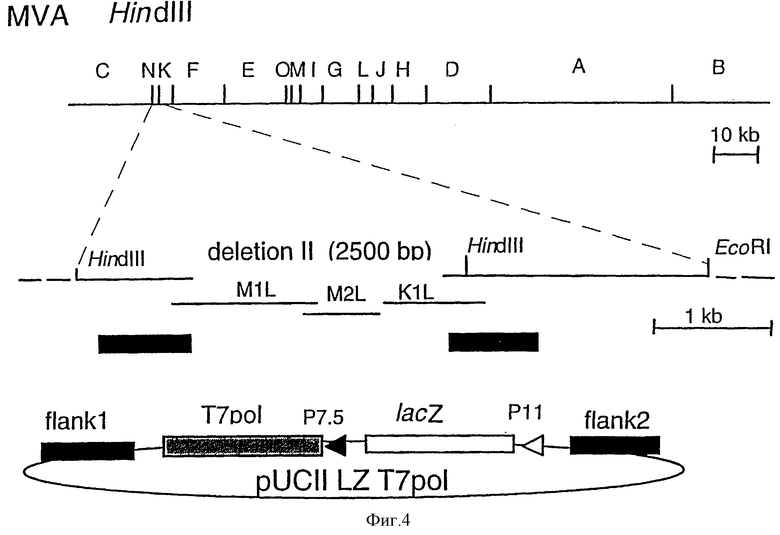
Фиг. 4: Конструирование рекомбинантного вируса MVA-pol Т7: схематические карты генома MVA (рестрикционные HindIII-сайты эндонуклеазы) и векторная плазмида pUC II LZ T7pol, с помощью которой осуществляют инсерцию ген РНК-полимеразы Т7 в сайт делеции II в HindIII-фрагменте N генома MVA.
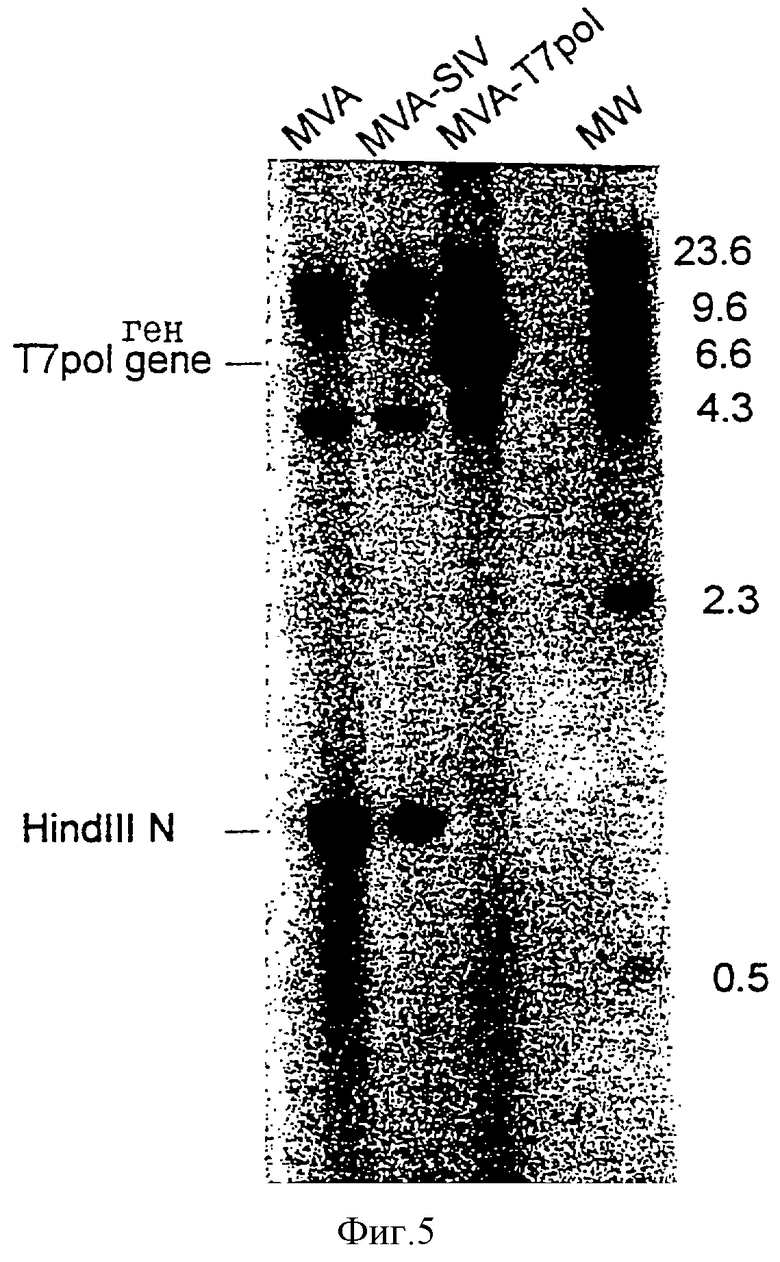
Фиг.5: Саузерн-блот-анализ ДНК вируса MVA-pol T7.
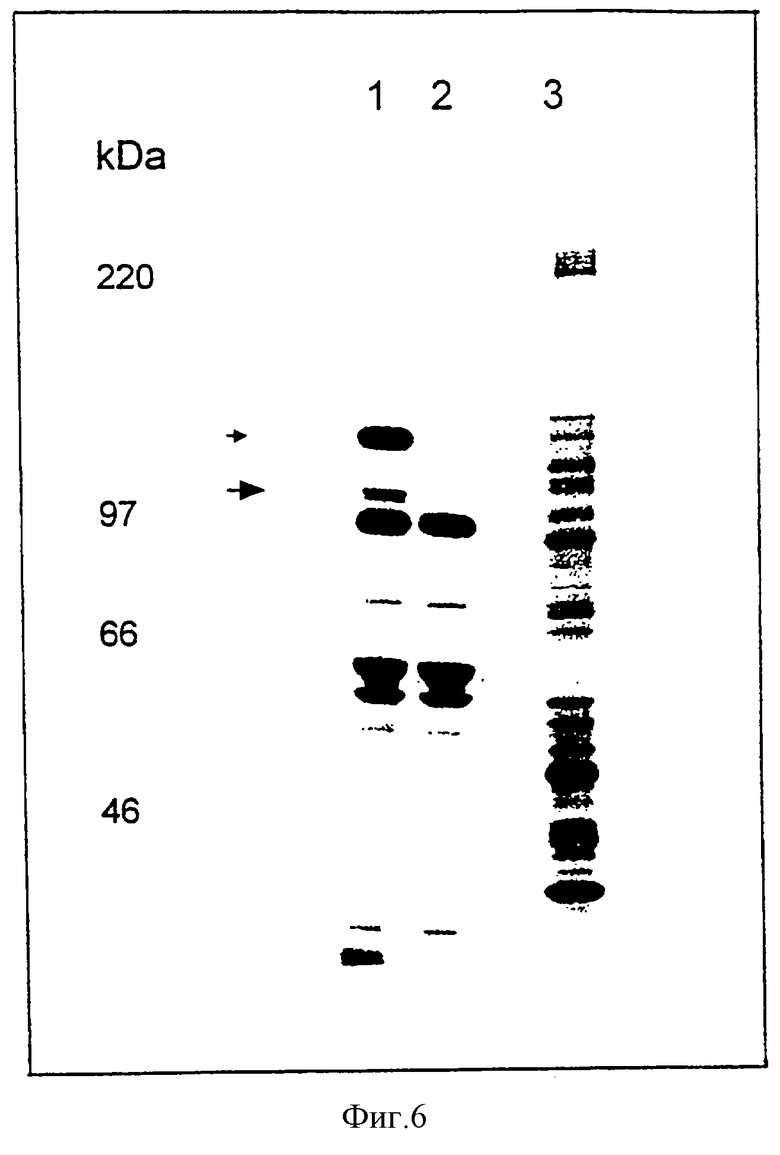
Фиг. 6: Метаболическое мечение белков с использованием [35S]метионина. Анализ с помощью электрофореза в ПААГ с ДСН. Дорожка 1: MVA-pol T7; дорожка 2: MVA; дорожка 3: клетки CV-1.
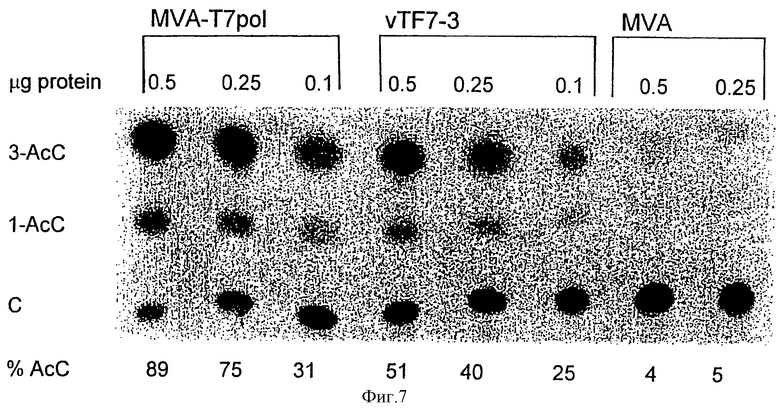
Фиг.7: САТ-анализ: клетки CV-1 трансфецировали плазмидой, содержащей ген CAT под контролем промотора РНК-полимеразы T7, и инфицировали вирусом MVA-T/pol или WR-polT7. Лизаты тестировали на САТ-активность. "С" означает хлорамфеникол, и 1-АсС и 3-АсС означают моно- и триацетилированные формы хлорамфеникола. САТ-активность выражали как процент ацетилированного продукта, образованного за 60 минут.
Фиг. 8: Конструирование MVA-LAlnef: схематические карты генома MVA (рестрикционные HindIII-сайты эндонуклеазы) и векторной плазмиды pUC II LZdel p7.5-LAlnef, с помощью которой осуществляют инсерцию гена nef ВИЧ-1 LAl в сайт делеции II в HindIII-фрагмент N генома MVA.
Фиг. 9: Конструирование MVA-hTYR: схематические карты генома MVA (рестрикционные HindIII-сайты эндонуклеазы) и векторной плазмиды pUC II Lzdel P7.5-TYR, с помощью которой осуществляют инсерцию гена тирозинкиназы в сайт делеции II в HindIII-фрагменте N генома MVA.
Примеры
1.Культивирование и очистка вирусов
1.1. Культивирование вируса MVA
Вирус MVA является в высокой степени ослабленным вирусом коровьей оспы, полученным от штамма вируса коровьей оспы Анкара (CVA) в результате длительного серийного пассирования на культуре первичных фибропластов куриного эмбриона (CEF). С общим обзором истории продуцирования, свойств и использования штамма MVA можно ознакомиться в кратких публикациях Mayr et al., in Infection, 3, 6-14 [1975] . Благодаря аттенюации в CEF, в этой птичьей клетке-хозяине вирус MVA реплицируется с высоким титром. Однако в клетках млекопитающего рост MVA сильно ограничен, и обычное образование бляшек под действием вируса не обнаруживается. Поэтому, вирус MVA был культивирован на клетках CEF. В целях получения клеток CEF 11-дневные эмбрионы выделяли из инкубированных куриных яиц, конечности удаляли, и эмбрионы измельчали и диссоциировали в растворе, содержащем 0,25% трипсина, при температуре 37oС в течение 20 минут. Полученную клеточную суспензию фильтровали и клетки осаждали путем центрифугирования при 2000 об/мин в центрифуге Sorvall RC-3B при комнатной температуре в течение 5 минут, а затем ресуспендировали в 10 объемах среды А (среда Игла (DMEM), получаемая, например, от Life Technologies GmbH, Eggenstein, Germany), после чего снова осаждали путем центрифугирования при 2000 об/мин в центрифуге Sorvall RC-3B при комнатной температуре в течение 5 минут. После центрифугирования клеточный осадок переносили в среду А, содержащую 10% фетальную сыворотку теленка (FCS), пенициллин (100 единиц/мл), стрептомицин (100 мг/мл) и 2 мМ глутамин, в результате чего получали клеточную суспензию, содержащую 500000 клеток/мл. Клетки CEF, полученные тем же самым способом, наносили путем распыления на чашки для культивирования клеток. Эти клетки культивировали в среде А в инкубаторе с СO2 при 37oС в течение 1-2 дней в зависимости от нужной плотности клеток и использовали для инфицирования либо сразу, либо после одного клеточного пересева. Подробное описание получения первичных культур может быть найдено в работе R. I. Freshney, "Culture of animal cell", Alan R.Liss Verlag New York 1983, Chapter II, стр.99.
Вирусы MVA инфицировали следующим образом. Клетки CEF культивировали в 175 см2 флаконах для культивирования клеток. При 90-100% сплошности среду удаляли, и клетки инкубировали в течение одного часа с суспензией вируса MVA (0,01 единиц инфекции (ME) на клетку, 0,02 мл/см2) в среде А. Затем добавляли дополнительное количество среды А (0,2 мл/см2) и флаконы инкубировали при температуре 37oС в течение 2-3 дней (до тех пор, пока 90% клеток не начинали проявлять цитопатогенный эффект). Неочищенный вирусный исходный материал был получен путем соскабливания клеточных монослоев в среду и осаждения клеточного материала путем центрифугирования при 3000 об/мин в центрифуге Sorvall RC-3B при температуре 4oС в течение пяти минут. Неочищенный вирусный препарат хранили при температуре -20oС перед дальнейшей обработкой (например, очисткой вируса).
1.2. Очистка вирусов
Для того чтобы получить, по возможности, чистый вирусный препарат, который не содержит компонентов, специфичных для этой хозяйской клетки, проводили стадии очистки способом, аналогичным описанному Joklik (Virology, 18, 9-18 [1962]). Неочищенный вирусный исходный материал выдерживали при температуре -20oС, а затем оттаивали и один раз суспендировали в PBS (10-20-кратный объем осадка), после чего суспензию центрифугировали, как описано выше. Только что полученный осадок суспендировали в десяти объемах буфера Трис 1 (10 мМ Трис-HCl, рН 9,0), и суспензию быстро обрабатывали ультразвуком (Labsonic L., B.Braun Biotech International, Melsungen, Germany; 2•10 с при 60 Вт и при комнатной температуре) в целях последующего дезинтегрирования клеточного дебриса и высвобождения вирусных частиц из клеточного материала. Ядра клеток и большую часть клеточного дебриса удаляли путем быстрого центрифугирования суспензии (роторная центрифуга Sorvall GSA от DuPont. Co. , D-6353 Bad Nauheim, FRG; 3 мин при 3000 об/мин и т-ре 10oС). Осадок снова один раз суспендировали в буфере Трис 1, обрабатывали ультразвуком и центфугировали, как описано выше. Собранные супернатанты, содержащие свободные вирусные частицы, объединяли и покрывали градиентом 10 мл 36% сахарозы в 10 мМ Трис-НСl с рН 9,0, а затем центрифугировали в центрифуге Beckman SW 27/SW 28 при 13500 об/мин в течение 80 минут при температуре 4oС. Затем супернатант отбрасывали, а осадок, содержащий вирусные частицы, растворяли в 10 мл 1 мМ Трис-НСl с рН 9,0, гомогенизировали путем быстрой обработки ультразвуком (2•10 с при комнатной температуре с использованием устройства, описанного выше) и наносили на градиент 20-40% сахарозы (сахароза в 1 мМ Трис-HCl, рН 9,0) для последующей очистки. Градиент центрифугировали в роторной центрифуге Beckmann SW41 при 13000 об/мин в течение 50 минут при температуре 4oС. После центрифугирования дискретные полосы, содержащие вирусные частицы, собирали путем пипетирования после уменьшения объема вышеуказанной полосы. Полученный раствор сахарозы разводили тремя объемами PBS и вирусные частицы снова осаждали путем центрифугирования (Beckmann SW27/28, 60 минут при 13500 об/мин, температура 4oС). Осадок, который состоял, главным образом, из чистых вирусных частиц, ресуспендировали в PBS и уравновешивали до средних концентраций вируса, составляющих в среднем 1-5•109 МЕ/мл. Раствор очищенного вирусного исходного материала хранили при -80oС и использовали либо сразу, либо разводили фосфатно-буферным физиологическим раствором для проведения последующих экспериментов.
1.3. Клонирование вируса MVA
Для генерирования гомогенных исходных вирусных препаратов вирус MVA, полученный от Prof. Anton Mayr, клонировали путем лимитирующего разведения в течение трех последовательных пересевов в клетки CEF, культивированные на 96-луночных планшетах для культивирования ткани. Клон F6 MVA отбирали и амплифицировали в CEF с получением маточных растворов вируса, которые служат в качестве исходного материала для генерирования рекомбинантных вирусов MVA, описанных в данной патентной заявке, а также для генерирования рекомбинантных вирусов MVA, описанных ранее (Sutter, G. и Moss, В., [1992] Proc.Natl. Acacd.Sci. USA 89, 10847-10851; Sutter, G., Wyatt, L., Foley, P., Bennink, J. и Moss, В., [1994], Vaccine 12, 1032-1040; Hirsch, V., Fuerst, Т., Sutter, G. , Carroll, M., Yang, L., Golgstein, S., Piatak, M., Elkins, W., Alvord, G. , Montefiori, D., Moss, B. and Lifson, J., [1986] J.Virol., 70, 3741-3752).
2. Конструирование и характеризация рекомбинантных вирусов MVA
2.1. Конструирование векторных плазмид
В целях генерирования рекомбинантных вирусов MVA были сконструированы новые векторные плазмиды. Встраивание чужеродных генов в геном MVA осуществляли точно в сайт природной делеции II в геноме MVA. Последовательности MVA-ДНК, фланкирующие сайт 2500 п.о.-делеции во HindIII-фрагменте N генома MVA (Altenburger, W. Suter.C.P. к Altenburger, J. [1989], J. Arch.Virol., 105, 15-27), были амплифицированы с помощью полимеразной цепной реакции и клонированы в сайт множественного клонирования плазмиды pUC18. Праймерами для левого 600 п.о.-ДНК-края являются:
5'-CAG CAG GGT ACC CTC ATC GTA CAG GAC GTT CTC-3' и 5'-CAG CAG CCC GGG TAT TCG ATG ATT ATT TTT AAC AAA ATA ACA-3' (сайты для рестриктирующих ферментов KpnI и SmaI подчеркнуты). Праймерами для правого 550 п.о.-ДНК-края являются: 5'-CAG CAG CTG CAG GAA ТСА ТСС ATT ССА CTG ААТ AGC-3' и 5'-CAG CAG GCA TGC CGA CGA АСА AGG AAC TGT AGC AGA-3' (сайты для рестриктирующих ферментов PstI и SphI подчеркнуты). Между этими краями MVA ДНК, вставленной в pUC18, встраивали ген lacZ Escherichia coli под контролем позднего промотора Р11 вируса коровьей оспы (полученного путем гидролиза ферментом pIII LZ, Sutter, С. and Moss, В. [1992] PNAS USA 89, 10847-10851) с использованием BamHI-сайта, в результате чего получали инсерционный MVA-вектор pUCII LZ (фиг. 1). После этого, 289 п.о.-фрагмент, содержащий ранний/поздний промотор Р7.5 вируса коровьей оспы вместе с SmaI-сайтом для клонирования (полученным путем рестрикции ферментами EcoRI и XbaI из плазмидного вектора pUCII [Chakrabarti и др. , 1985, Molecular и Cellular Biology 5, 3403-3409]), вставляли SmaI-сайт pUCII с получением MVA-вектора pUCII LZ P7.5 (фиг.2). Для конструирования векторной плазмиды, которая позволяет выделять рекомбинантные вирусы MVA посредством временного синтеза репортерного фермента β-галактозидазы, 330 п.о.-ДНК-фрагмент от 3'-конца открытой рамки считывания LacZ. E.coli амплифицировали с помощью PCR (праймеры 5'-CAG CAG GTC GAC CCC GAC CGC CTT ACT GCC GCC-3' и 5'-GGG GGG CTG CAG ATG GTA GCG ACC GGC GCT CAG-3') и клонировали в SalI- и PstI-сайты pCU II LZ P7.5 с получением MVA-вектора pUC II LZdel P7.5 (фиг.3). С использованием SmaI-сайта, эта векторная плазмида может быть использована для вставки ДНК-последовательностей, кодирующих чужеродный ген под транскрипционным контролем промотора P7.5 вируса коровьей оспы, в геном MVA. После этого нужный рекомбинантный вирус выделяли посредством скрининга на экспрессию β-галактозидазной активности и последующее его культивирование приводило к самоделеции вновь сконструированного P11-LacZ-экспрессирующего кластера в результате гомологичной рекомбинации.
2.2. Конструирование и характеризация рекомбинантного вируса MVA-polТ7
3,1 kbp-ДНК-фрагмент, содержащий полный ген РНК-полимеразы бактериофага Т7 под контролем раннего/позднего промотора P7.5 вируса коровьей оспы, вырезали ферментом EcoRI из плазмиды pTF7-3 (Fruest, Т.Р., Niles, E.G., Studier, F. W. and Moss, В., [1986], P.N.A.S. USA, 83, 8122-8126), модифицировали путем инкубирования ДНК-полимеразы фрагментом Кленова для продуцирования тупых концов и клонировали в уникальный SmaI-сайт рестрикции LZ pUCII с образованием плазмидного вектора переноса pUCII-LZ-pol T7 (фиг.4). В качестве транскрипционного регулятора для экспрессии гена РНК-полимеразы Т7 был выбран ранний/поздний промотор Р7.5 вируса коровьей оспы. В противоположность более сильному позднему промотору вируса коровьей оспы (например, Р11) эта промоторная система позволяет экспрессировать рекомбинантные гены непосредственно после инфицирования клеток-мишеней. LZ-pol Т7-плазмида pUCII, которая обеспечивает введение чужеродных генов в сайт делеции II генома MVA, была использована для генерирования рекомбинантного вируса MVA-pol T7.
Клетки CEF инфицировали вирусом MVA при множественности инфекции TCID50= 0,05 на клетку и трансфецировали ДНК плазLZ-pol Т7-плазмиды pUCII, как описано ранее (Sutter, G., Myatt, L., Foley, P., Bennink, J. и Moss, В., [1994] , Vaccine 12, 1032-1040). Рекомбинантный вирус MVA, экспрессирующий РНК-полимеразу T7 и совместно экспрессирущий β-D-галактозидазу (Р7.5-pol T7 MVA), отбирали в результате проведения пяти последовательных циклов очистки методом бляшек в клетках CEF, окрашенных 5-бром-4-хлор-3-индолил-β-D-галактозидом (300 мкг/мл). Рекомбинантные вирусы амплифицировали путем инфицирования монослоев CEF, и ДНК анализировали с помощью PCR для подтверждения генетической однородности вирусного штамма. Саузерн-блот-анализ вирусной ДНК MVA-pol T7 продемонстрировал стабильную интеграцию рекомбинантных генов в сайте делеции II в геноме MVA (фиг.5). Для наблюдения за экспрессией РНК-полимеразы T7 посредством рекомбинантного MVA-pol T7 были проанализированы меченые [5S] метионином полипептиды от вирус-инфицированной культуры ткани. Монослои клеточной линии почек обезьяны CV-1, культивированные в 12-луночных планшетах, инифицировали вирусом при множественности инфекции TCID50=20 на клетку. Через 3-5 часов после инфицирования среду удаляли, и культуры один раз промывали 1 мл среды, не содержащей метионина. В каждую лунку добавляли 0,2 мл среды, не содержащей метионина, вместе с 50 мкКи [35S]метионином и среду инкубировали в течение 30 минут при 37oС. Цитоплазматические экстракты инфицированных клеток получали путем инкубирования каждой лунки в 0,2 мл 0,5% буфера для лизиса Nonidet P-40 в течение 10 минут при 37oС, и образцы анализировали путем электрофореза в ПААГ с ДСН. Метаболическое мечение клеток CV-1 вирусом MVA-pol T7 выявило синтез двух дополнительных полипептидов (i) белка размером около 116000 Да, представляющего собой совместно экспрессированную β-галактозидазу E.coli, которая позволяет проводить скрининг на рекомбинантный вирус; и (ii) белка с ожидаемым размером 98000 Да, соответствующим РНК-полимеразе бактериофага T7 (фиг.6). При этом, было отмечено, что MVA-T7pol продуцирует большое количество β-галактозидазы. Эксперименты с in vivo-мечением продемонстрировали очень высокий уровень экспрессии Р11-LacZ-ген-содержащей конструкции, введенной в геном MVA в сайт делеции 11, что свидетельствовало о том, что рекомбинантные гены в векторном вирусе MVA могут быть экспрессированы с большей эффективностью в том случае, если они встроены именно в этот локус генома MVA.
Эффективность рекомбинантных вирусов MVA-polT7 как экспрессирующих систем по сравнению с рекомбинантным WR-T7pol вирусом vTF7-3 (Fuerst и др., 1986) оценивали путем котрансфекции ДНК плазмидного вектора, происходящего от pTM1 (Moss, В., Erloy-Stein, О., Mizukami, Т., Alexander, W.A., & Fuerst T.R. [1990] Nature, 348, 91-92), и содержащего ген (клонированный в NcoI - и BamHI-сайты множественного клонирования pTMl) хлорамфениколацетилтрансферазы (CAT) E. coli под контролем промотора РНК-полимеразы Т7 (РТ7). Трансфецированные и инфицированные клетки CV-1 суспендировали в 0,2 мл 0,25М Трис-НСl (рН 7,5). После трех циклов замораживания-оттаивания, лизаты осветляли путем центрифугирования, а затем определяли содержание белка в супернатантах, и образцы, содержащие 0,5; 0,25; 0,1 мкг полного белка, анализировали на ферментную активность методом, описанным Mackett, М., Smith, G.L. & Moss, В. , [1984] , J.Virol., 49, 857-864. После авторадиографии количество меченых пятен оценивали с использованием визуализирующей аналитической системы Fuji. Полученные результаты проиллюстрировали, что путем использования в высокой степени аттенюированного вектора MVA на основе вируса коровьей оспы может быть получена система "вирус коровьей оспы-РНК-полимераза Т7", которая является такой же эффективной, как и при использовании вполне компетентного по репликации рекомбинанта на основе вируса коровьей оспы (фиг.7).
2.3. Конструирование и характеризация рекомбинантного вируса MVA-LAlnef
648 п. о.-ДНК-фрагмент, содержащий полный ген nef LAl ВИЧ-1, получали с помощью PCR из плазмидной ДНК (pTG1166, любезно предоставленной М.-Р. Kieny, Transgene S.A., Strasbourg; для PCR использовали следующие праймеры: 5'-CAG CAG GGA TCC ATG GGT GGC AAG TGG TCA AAA AGT AGT-3' и 5'-CAG CAG GGA TCC ATG TCA GCA GTT CTT GAA GTA CTC CGG -3'), гидролизовали рестриктирующей эндонуклеазой BamHI, модифицировали путем инкубирования с ДНК-полимеразой Кленова для "затупления концов" и клонировали в SmaI-сайт pUC II LZ-delP7.5, в результате чего получали вектор pUC II LZdel p7.5-LAlnef (фиг.8). Эта плазмида может быть использована для конструирования рекомбинантного вируса MVA, который экспрессирует ген nef ВИЧ-1-LAI под контролем раннего/позднего промотора Р7.5 вируса коровьей оспы.
Клетки CEF, инфицированные вирусом MVA при множественности заражения TCID50= 0,05 (TCID - средняя цитопатогенная доза) на клетку, трансфецировали ДНК плазмиды pUC II Lzdel-P7,5-LAInef, как описано ранее (Sutter, G., Wyatt, L., Foley, P., Bennink, J., & Moss, B. [1994] Vaccine, 12, 1032-1040). Рекомбинантные вирусы MVA, содержащие ген nef, и совместно экспрессирующийся с временной регуляцией маркерный ген LacZ E.coli, отбирали путем проведения последовательных циклов очистки методом бляшек в клетках CEF, окрашенных 5-бром-4-хлор-3-индолил-β-D-галактозидом (300 мкг/мл). После этого, рекомбинантные вирусы, содержащие ген nef и имеющие делетированный маркерный ген LacZ, выделяли путем проведения еще трех дополнительных последовательных циклов очистки методом бляшек, осуществляя скрининг на неокрашенные фокусы вируса в клетках CEF в присутствии 5-бром-4-хлор-3-индолил-β-D-галактозида (300 мкг/мл). Затем рекомбинантные вирусы амплифицировали путем инфицирования монослоев, и MVA-LAInef-вирусную ДНК анализировали с помощью PCR для того, чтобы убедиться в генетической гомогенности вирусного штамма. Саузерн-блот-анализ вирусной ДНК подтвердил генетическую стабильность MVA-LAInef и явно продемонстрировал интеграцию гена nef и делецию маркерного гена LacZ E. coli в сайте делеции 11 в вирусном геноме.
Эффективная экспрессия рекомбинантного белка Nef была подтверждена с помощью Вестерн-блот-анализа белок-продуцирующих лизатов клеток CEF, инфицированных вирусом MVA-LAInef с использованием мышиных mАВ против Nef ВИЧ-1 (любезно предоставленных K.Krohn и использованных как описано Ovod, V., Lagerstedt, A. , Ranki, A., Gombert, F., Spohn, R., Tahtinen, M., Jung, G., & Krohn, K. [1992] AIDS, 6, 25-34).
2.4. Конструирование и характеризация рекомбинантного вируса MVA-hTYR
1,9 п. о. -ДНК-фрагмент, содержащий полный ген, кодирующий тирозиназу человека (кДНК-клон тирозиназы 123.В2 выделяли из клеточной линии меланомы SK29-MEL пациента SK29 (AV), GenBank допуска U01873; Brichard, V., Van Pel, A. , Wolfel, Т., Wolfel, С., De Plae, E., Lethe, В., Coulie, P. и Boon, В. [1993] , j. exp. Мed., 178, 489-495), получали из плазмиды pcDNAI/Amp-Tyr (Wolfel, Т. , Van Pel, A., Brichard, V., Schneiders, J., Seliger, В., Meyer zum Buschenfelde, K., и Boon, T. (1994) Eur.J.Immunol., 24, 759-764) путем гидролиза ферментом EcoRI, а затем модифицировали путем инкубирования с ДНК-полимеразой Кленова для "затупления концов" и клонировали в SmaI-сайт pUC II LZdel P7.5, в результате чего получали вектор pUC 11 LZdel P7.5-TYR (фиг. 9). Эта плазмида может быть использована для конструирования рекомбинантного вируса MVA, который экспрессирует ген тирозиназы человека под контролем раннего/позднего промотора P7.5 вируса коровьей оспы.
Клетки CEF, инфицированные вирусом MVA при множественности заражения TCID50= 0,5 на клетку, трансфецировали ДНК плазмиды pUC II LZdel P7.5-TYR, как описано в литературе (Sutter, G., Wyatt, L., Foley, P., Bennink, J., & Moss, В., [1994] Vaccine 12, 1032-1040). Рекомбинантный вирус MVA, стабильно экспрессирующий ген тирозиназы человека и коэкспрессирующий, с временной регуляцией, ген LacZ Е. coli, отбирали путем проведения последовательных циклов очистки методом бляшек в клетках CEF, окрашенных 5-бром-4-хлор-3-индолил-β-D-галактозидом (300 мкг/мл). После этого, рекомбинантные вирусы, экспрессирующие ген, кодирующий тирозиназу человека и имеющий делетированный маркерный ген LacZ, выделяли путем проведения еще трех дополнительных последовательных циклов очистки методом бляшек, осуществляя скрининг на неокрашенные фокусы вируса в клетках CEF в присутствии 5-бром-4-хлор-3-индолил-β-D-галактозида (300 мкг/мл). Затем рекомбинантные вирусы амплифицировали путем инфицирования монослоев CEF, и MVA-hTYR-вирусную ДНК анализировали с помощью PCR для того, чтобы убедиться в генетической гомогенности вирусного штамма. Саузерн-блот-анализ вирусной ДНК подтвердил генетическую стабильность MVA-hTYR и явно продемонстрировал интеграцию рекомбинантного гена тирозиназы и делецию маркерного гена LacZ, E.coli в сайте делеции 11 в вирусном геноме.
Эффективная экспрессия рекомбинантной тирозиназы человека была подтверждена с помощью Вестерн-блот-анализа белок-продуцирующих лизатов клеток CEF, инфицированных вирусом MVA-hTYR с использованием кроличьих поликлональных антител (любезно предоставленных V. Hearing и использованных, как описано Jimenez., М., Kameyama, К., Maloy, L., Tomita, Y., & Hearing, V. [1988] P.N. A. S. USA 85, 3830-3834), или мышиных моноклональных антител (любезно предоставленных L. Old и использованных, как описано Chen, Y., Stockert, E., Tsang, S., Coplan, К. & Old, L. [1995] P.N.A.S. USA 92, 8125-8129), направленных против тирозиназы.




Изобретение относится к биотехнологии, в частности иммунобиотехнологии, и касается создания рекомбинантного модифицированного вируса осповакцины Ankara (MVA), способного реплицироваться в клетках человека. Вирус MVA используют для получения вакцины, которая предназначена для иммунизации животного и человека. Линии клеток, инфицированные вектором MVA-hTYP и MVA-LAInef, соответственно, продуцируют рекомбинантную тирозиназу человека и вирусные частицы MVA-hTYP и рекомбинантный белок Nef и вирусные частицы MVA-LAInef. Полученный рекомбинантный вирус MVA является эффективным и абсолютно безопасным экспрессионным вектором, что обеспечивает безопасность вакцин и производство полипептидов. 7 с. и 16 з.п. ф-лы, 9 ил.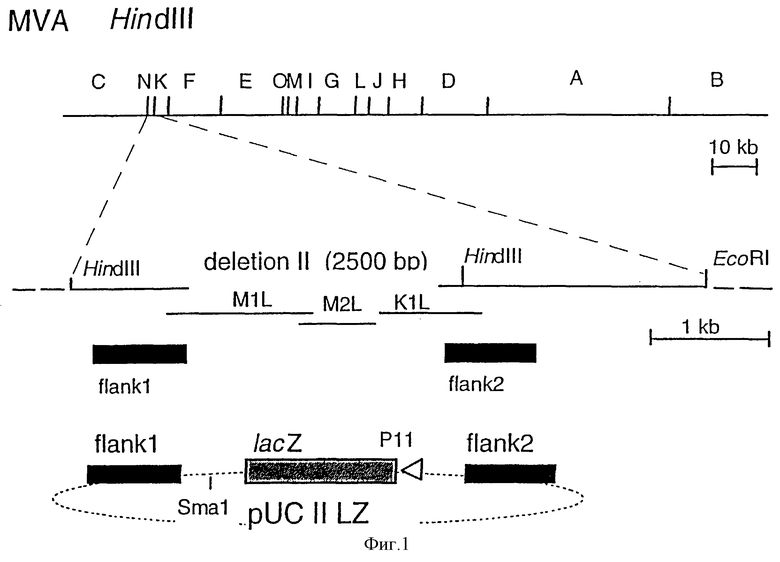
| US 5185146 А, 09.02.1993 | |||
| УНИВЕРСАЛЬНАЯ УСТАНОВКА ДЛЯ РАЗВЕДЕНИЯ ГИДРОБИОНТОВ (ВАРИАНТЫ) | 1998 |
|
RU2145477C1 |
| ВСЕСОЮЗНАЯ I111^:шт-'1тт:ш^!^ИБ.ЛНО7';;;; оД | 0 |
|
SU356695A1 |
Авторы
Даты
2003-02-10—Публикация
1996-07-03—Подача