Данная заявка претендует на приоритет на основании Шведской патентной заявки N 9601245-5, которая была зарегистрирована 29 марта 1996 года, и на основании заявки США 08/695692, которая была зарегистрирована 12 августа 1996 года, которые включены в качестве ссылки.
Область изобретения
Данное изобретение относится к функционально активным модифицированным суперантигенам, которые являются суперантигенами дикого типа (SA I), в которых один или несколько аминокислотных остатков заменены с сохранением при этом функции суперантигена. В случае, когда один или несколько замененных остатков (или их консервативный остаток) встречаются в соответствующих положениях в другом суперантигене дикого типа (SA II), модифицированный суперантиген называют химерой (иногда гибридом). Таким образом, химерные суперантигены будут содержать частичные последовательности/районы, происходящие по меньшей мере из двух различных суперантигенов дикого типа.
Под термином "соответствующие" имеют в виду, что остатки, частичные последовательности и районы, заменяющие друг друга, имеют функционально одно и то же положение в суперантигенах I и II, так что замена приводит к химерной форме, которая способна функционировать как суперантиген.
Терминологию "привитый/прививка/привитая часть/ (трансплантат)" используют в связи с частями полной последовательности суперантигена II, которые заменяют соответствующие части суперантигена I, даже если заменена только одна единственная аминокислота.
К модифицированным/химерным суператигенам относятся также функциональные суперантигены, модифицированные другими путями, например модифицированные заменой аминокислот в участках, иных, чем относящиеся к данному изобретению, конъюгированные с отыскивающей мишень частью молекулы, в том числе также слитые формы, когда эта часть молекулы является полипептидом/белком. Порядок проведения этих модификаций может вариировать (см. ниже).
Суперантигены
Согласно самому первому определению (приблизительно 1988-1993), суперантигены представляют собой бактериальные или вирусные белки, способные связываться с антигенами главного комплекса гистосовместимости класса II (МНС class II) без предварительного внутриклеточного процессинга и активировать Т-клетки путем связывания с вариабельной областью β-цепи (Vβ) Т-клеточного рецептора (TCR). Это связывание приводит к рестриктрованной семейством Vβ активации относительно большой части/субпопуляции Т-клеток к лизису экспрессирующих МНС II клеток (суперантиген-зависимому клеточно-опосредованному цитолизу =SDCC).
Хорошо известными суперантигенами дикого типа, согласно этому определению, являются стафилоккоковые энтеротоксины (SEA SEB, SEC1, SEC2, SED, SEE, SEH. Дальнейшими примерами являются Токсин 1 Синдрома Токсического Шока (TSST-1, также стафилококкового происхождения), Токсины Эксфолиации (Exft), Стрептококковые Пирогенные Экзотоксины А, В и С (SPE А, В, и С), белки мышиного вируса молочной железы (MMTV), Стрептококковые белки М, Энтеротоксин Clostridial perfringens (CPET), суперантигены Mycoplasma arthritis и т.д. Обзор суперантигенов и их свойств дан Kotzin et al., 1993.
В самом начале 90-х годов было обнаружено, что активация и последующий лизис клеток могут происходить независимым от МНС класса II образом в случае, когда суперантиген конъюгирован с узнающей мишень частью молекулы, способной связываться со структурой клеточной поверхности (Dohlsten et al., WO9201470 и Abrahmsen et al., WO9601650). При инкубировании клеток-мишеней (несущей структуру-мишень для отыскивающей мишень части молекулы) и эффекторных клеток (Т-клеток) с конъюгатами, клетки-мишени становятся лизированными (суперантиген-антитело-зависимый клеточно-опосредованный цитолиз = SADCC) без необходимости экспрессии класса II. Поэтому концепция суперантигена наших дней, используемая в контексте данного изобретения, если нет иных указаний, включает в себя любое соединение (предпочтительно полипептидной структуры), которое способно связываться со структурой клеточной поверхности (структурой-мишенью) и с одной или несколькими цепями полиморфных TCR, в частности с цепью Vβ, с активированием тем самым субпопуляции Т-клеток, экспрессирующих специфическую цепь TCR, участвующую в этом связывании. Затем Т-клетки становятся цитотоксичными в отношении клеток, несущих эту клеточную структуру (структуру-мишень, клеток-мишеней). Обычно активированная субпопуляция Т-клеток составляет приблизительно 1-20% от общего числа Т-клеток индивидуума.
Предпосылки изобретения - Структурные и функциональные исследования, использующие мутированные и химерные суперантигены
Ранее были описаны химерные суперантигены, в том числе формы с точковыми мутациями (Kappler et al., WO 9314364, Kappler et al., 1992; Grossman et al. , 1991; Hufnagle et al., 1991; Hartwig et al., 1993; Fraser et al., 1993; Mollick et al., 1993; Irwin et al., 1992; Hudson et al., 1993; и Blanco et al. , 1990). Mollick et al. и Hudson et al. показывают на основании исследований химер, что Vβ-специфичность SEA и SEE основана на определенных аминокислотных последовательностях, присутствующих в карбоксиконцевом районе (т. е. аминокислотных остатках 200, 206 и 207). Кроме Vβ-специфичности, в основном зависящий от этого района, Mollick et al. смогли также показать, что для полного воспроизведения SEE-подобной активности SEA, содержащего SEE-прививки, в отношении Vβ8 был необходим фрагмент, содержащий 70 N-концевых аминокислотных остатков из SEE. Этот фрагмент содержит части SEE-подобного сайта связывания α-цепи МНС класса II, и химерные молекулы SEA/SEE, содержащие эту часть из SEE, ингибировали связывание SEA с DR1 МНС класса II SEE-подобным образом.
Недавно были описаны химеры SEA/SEE, образованные обменом районов, принимающих участие в связывании TCR Vβ (Lamphaer et al., J. Immunol. 156 (March 15, 1996) 2178-2185). Слитый белок суперантиген SEE/Fab-антитело, в котором домены SEE, участвующие во взаимодействии с Т-клетками, были заменены соответствующими негомологичными доменами SEA, обсуждались на ABRF'96:Biomolecular Techniques, Holyday Inn Golden Gateway, San Francisco, California March 30 - April 2, 1996(Bjork et al., M45).
Предпосылки изобретения - Терапевтическое использование суперантигенов
Для терапии предлагались неконъюгированные суперантигены с лечебным действием, предпочтительно осуществляемым через общую активацию иммунной системы (Kalland et al., WO9104053; Terman et al., WO9110680 и WO9324136; Newall et al., 1991).
Также предлагалось использование модифицированных суперантигенов, конъюгированных с отыскивающими мишень частями молекулы (Dohl sten et al., WO9201470; Abrahmsen et al., WO9601650, включенные здесь в качестве ссылок). Это делало возможным более широкое терапевтическое использование активации Т-клеток через Vβ. Исследованные до сих пор конъюгаты имели пониженное сродство с классом II, что в свою очередь приводило к снижению тяжелой системной токсичности, обычно связанной с суперантигенами дикого типа.
Terman et al. (WO9110680 и WO9324136) в дополнительных рекомендациях предлагал терапию рака с применением модифицированных суперантигенов и фрагментов суперантигенов.
Kappler et al. (WO 9314634) предложили использовать неконъюгированные суперантигены (SEB), мутированные для элиминации их способности Vβ-связывания или связывания МНС класса II (в контексте вакцин и для нейтрализации токсических эффектов суперантигенов. Abrahmsen et al. (WO9601650) предложили терапию рака конъюгированными суперантигенами, обладающими модифицированной, предпочтительно уменьшенной, способностью связываться с антигенами класса II. Модификации включали одиночные мутации, а также конструкцию химер между различными суперантигенами.
Проблемы, которые должны были быть решены данным изобретением
Сыворотки популяций человека обычно содержат высокие титры антител против суперантигенов. Например, для стафилококковых суперантигенов относительные титры:
TSST-1>SEB>SEC1>SE3>SEC2>SEA>SED>SEE. Эти относительные титры свидетельствуют о проблемах иммуногенности и проблемах с нейтрализующими антителами в случае, когда SE вводятся парентерально. На основании лишь этих проблем SEE должен был бы быть предпочтительным стафилококковым суперантигеном. Однако в ходе исследований со слитыми белками мы обнаружили, что способность Т-клеточной независимой от МНСС класса II цитотоксичности, суперантиген-антитело-зависимой цитотоксичности (SADCC) конъюгатов SEE является слабой. Титры антител к SE (антител-SE) также указывают на то, что может быть выгодно модифицировать суперантиген "высокого титра", чтобы он был более подобен суперантигену "низкого титра".
Цели данного изобретения
Первой целью является улучшение ранее известных суперантигенов в отношении снижения их иммуногенности и реакции с нейтрализующими антителами.
Второй целью является обеспечение суперантигенов с меньшими побочными действиями при использовании их в качестве лекарственного средства.
Третьей целью является обеспечение улучшенных суперантигенов, которые могут быть использованы в качестве активного начала в лечение млекопитающих, страдающих от раковых опухолей, аутоиммунных заболеваний, инвазий паразитами, вирусных инфекций или других заболеваний, связанных с клетками, которые экспрессируют на их поверхности антигены МНС класса II и/или структуры, которые являются специфическими для соответствующего заболевания и связываются с узнающей мишень частью, включенных в суперантиген.
Открытие, которое привело к данному изобретению
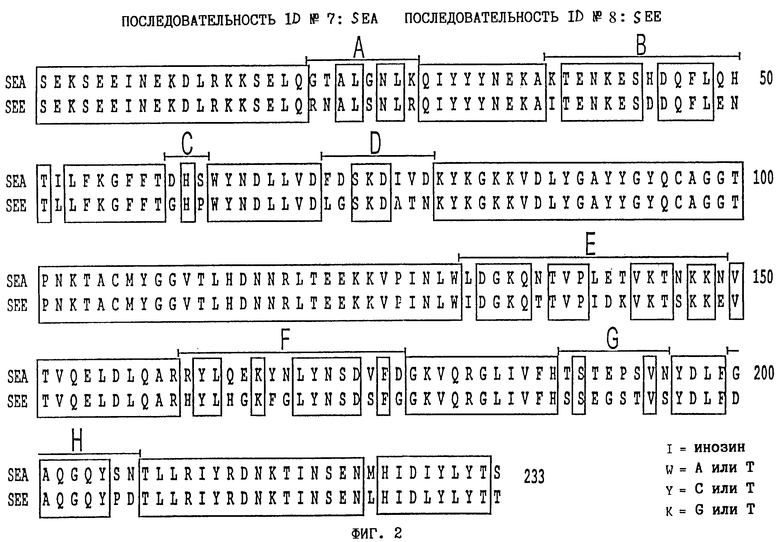
Анализ гомологии последовательностей SEA и SEE (фиг.2) обнаружил, что неидентичные аминокислотные остатки сконцентрированы в 8 различных районах. Вне этих 8 районов, составляющих до 34%последовательности, идентичность двух SE равна 97%, причем замены консервативных аминокислот ответственны за остальные различия. Четыре из этих районов структурно близки к двум сайтам связывания МНС класса II (В: АА 37-50, D: 71-78, Е: 136-149 и G: 189-195) и, по-видимому, не взаимодействует с TCR. Дополнительные четыре района (А: АА 20-27, С: 60-62, F: 161-176 и Н: 200-207) расположены на конце молекулы, вблизи возможного сайта связывания TCR, который, как считают, находится в канавке между двумя субдоменами. Путем прививки индивидуальных районов (замены аминокислотных остатков, которые отличаются) мы теперь нашли, что свойство SEA-конъюгатов индуцировать цитотоксическую ответную реакцию, а также усиливать пролиферативную ответную реакцию в отсутствие МНС класса II, обусловлено одним районом в домене связывания TCR SEA. Этот район (А) может переноситься в SEE и оказывать сильное влияние на активность в отсутствие класса II, хотя имеет ограниченное влияние на Vβ-специфичность суперантигена (фиг. 6, таблица 2). По-видимому, все районы (А, С, F и Н) участвуют, прямо или косвенно, во взаимодействии с TCR, проявляющемся в измененном стимулирующем действии на мышиные Т-клеточные гибридомы (таблица 2).
Вследствие аналогичного способа действия понятно, что подобное структурное разделение этих TCR Vβ-связывающих свойств относится также к суперантигенам, аналогичным SEA и SEE. To же самое можно сказать и в отношении других типов суперантигенов, в которых связывающие структуры организованы по-иному. Наше открытие позволило нам наметить в общих чертах конструирование химерных суперантигенов, потенциально очень ценных в качестве терапевтических средств.
Изобретение
Первый аспект данного изобретения представляет собой способ лечения заболевания млекопитающего путем активации его иммунной системы посредством введения терапевтически эффективного (иммуноактивирующего) количества модифицированного, предпочтительно химерного, суперантигена. Предпочтительным млекопитающим является человек. Заболевания, о которых идет речь, в основном связаны с клетками, экспрессирующими на их поверхности структуру-мишень, связывающуюся с суперантигеном. В большинстве случаев эта структура-мишень отличается от эпитопа TCR, обычно связывающегося с суперантигенами. Связывание со структурой-мишенью делает возможными также связывание с TCR и активацию Т-клеток. Иллюстративными примерами являются антигены МНС класса II и другие структуры клеточной поверхности, которые могут экспрессироваться на клетках, связанных с ходом заболеваний. Иллюстративными заболеваниями являются злокачественные опухоли, включающие раковые опухоли любого типа (такие как карцинома, саркома, меланома, лимфома и т. д.), вирусные инфекции, паразитарные инвазии и аутоиммунные заболевания. Рак, который может быть подвергнут лечению, может быть локализован в ободочной кишке, молочной железе, шейке матки, почке, желудке, тонкой кишке, двенадцатиперстной кишке, простате, яичке, коже, легком, печени, поджелудочной железе, скелете и т.д., в том числе также метастазирование в различных местоположениях. Активный ингредиент данного изобретения применим также для форм раковых заболеваний, резистентных ко множеству лекарственных средств. Клетки, экспрессирующие структуру-мишень, могут также быть клетками, которые некоторым образом контролируют или регулируют развитие подвергаемого лечению заболевания.
Характерной особенностью этого способа является то, что в нем используют модифицированный суперантиген, в которых один или несколько аминокислотных остатков в районе (районе I), обеспечивающем связывание с субпопуляцией Т-клеток через полиморфную цепь TCR, в частности TCRVβ, в суперантигене дикого типа (SA I), замены соответствующим аминокислотным остатком, сохраняющим активность модифицированного таким образом суперантигена. Предпочтительные в настоящее время варианты относятся к химерному суперантигену, в котором один или несколько аминокислотных остатков в районе (районе I) первого суперантигена дикого типа были заменены соответствующими одним или несколькими аминокислотными остатками в соответствующем районе (районе II) второго суперантигена дикого типа (SA II). Районы I и II различаются по аминокислотным последовательностям. Суперантигены I и II были выбраны таким образом, что районы I и II могут заменять друг друга без уничтожения функции суперантигенов. В этой связи следует считать фактом, что некоторый район I может быть в отдельности неспособным к замене на соответствующий район другого суперантигена дикого типа, хотя при замене вместе с другими районами, определяющими связывание TCR и активацию Т-клеток, результатом является функционально активный суперантиген. Рассматриваемые районы обычно содержат менее 20 остатков, в частности, для суперантигенов, аналогичных SEA. Таким образом, заменяющий аминокислотный остаток отличается от заменяемого остатка и, как должно быть понятно, включает также консервативные замены и замены других аминокислот, приводящие к функционально активным модифицированным суперантигенам, делающим возможными связывание с TCRVβ и активацию субпопуляции Т-клеток. Это означает, что модифицированные в соответствии с данным изобретением суперантигены в широком смысле включают любой модифицированный суперантиген, в котором одна или несколько аминокислот в вышеупомянутых районах были функционально заменены.
Термин "консервативная замена" относится к замене аминокислотного остатка химически подобным остатком, например гидрофобного остатка другим гидрофобным остатком, заряженного остатка другим, но одинаково заряженным остатком и т.д.
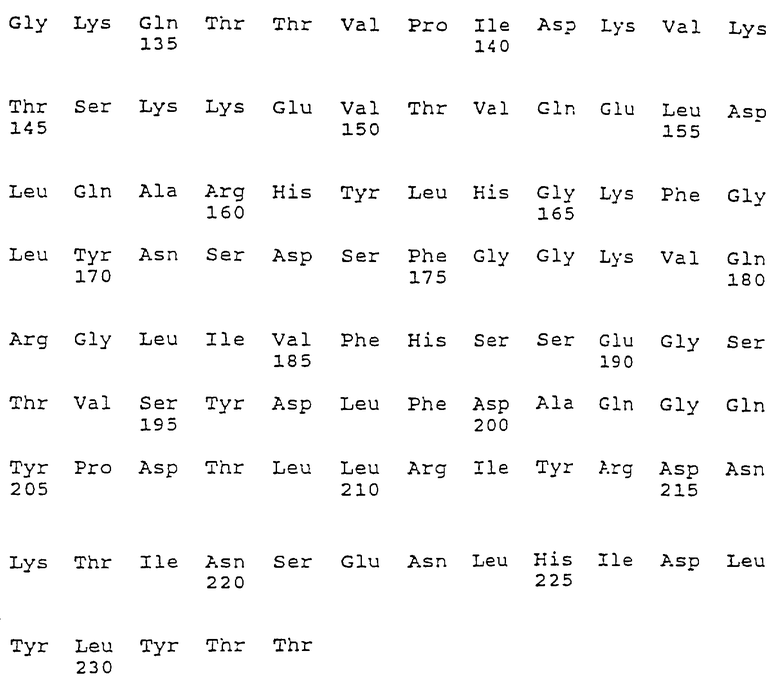
В качестве суперантигенов I, II и т.д. к моменту заявления о приоритете предпочтительными были стафилококковые энтеротоксины, в частности энтеротоксины, которые координируют цинк, т.е. SEA, SEE, SED и, возможно, также SEH.
Рассматриваемые районы могут иметь любую из вышеупомянутых функций (см. раздел с заголовком "Открытие, которое привело к данному изобретению" и Экспериментальную часть):
1. Сильное влияние на активность суперантигена как таковую и ограниченное действие на TCR-специфичность, в частности, на Vβ-специфичность. Для суперантигенов SEA-типа это означает район А (положения аминокислот 20-27).
2. Глубокое влияние на специфичность в отношении связывания с полиморфными цепями TCR, такими как Vβ-цепь. Для суперантигенов SEA-типа это означает район С (положения аминокислот 60-62), F (положения аминокислот 110-126) и Н (положения аминокислот 200-207).
Для SEA-подобных суперантигенов это означает одну или несколько замен (применительно к прививке из SEA в SEE; SEE/A-химерам)
Район A:R20G, N21T, S24G, R27K
Район C:G60D, P62S
Район F:H111R, HI 14Q, G115Y, F117Y, G118N, S124V, G126D
Район H:D200G, P206S, D207N
В момент заявления приоритета было предпочтительно проводить все замены для каждого района. Для других суперантигенов могли бы также проводиться аналогичные замены между соответствующими положениями/районами.
В типичном случае можно было бы начинать с одного первого суперантигена, подобного SEE и SED, и затем заменять один или несколько его уникальных Vβ-связывающих районов соответствующим районом (районами) второго суперантигена (например, SEA), причем первый и второй суперантигены предпочтительно выбирают таким образом, что титр антител в нормальных сыворотках человека для первого суперантигена ниже, чем для второго суперантигена. Для химер SEA и SEE наилучшие способы соответствуют химерам SEE/A-А, SEE/A-AH, SEA/E-BDEG с абсолютной предпочтительностью для SEE/A-A. См. Экспериментальную часть и фигуры.
Вместе с районами F, С, F и Н могут быть также заменены аминокислотные остатки в других частях. Одним типом обмена является обмен для уменьшения способности связывания класса II, так как это свойство связано с обычными побочными эффектами, встречающимися при терапии с использованием суперантигенов (общей иммунной активацией с сопутствующим системным высвобождением фактора некроза опухолей (TNF) и интерферона-γ). Для таких суперантигенов, как SEA, SED и SEE, положения, которые важны для способности координировать ионы цинка, могут быть предпочтительно изменены, т.е., например, положения 225 и 227 в мутации Н225A SEA и, особенно, D227A, имеют положительное влияние на уменьшение токсичных побочных эффектов (см. Abrahmsen et al., WO09601650 и Fraser et al., 1993).
Другие замены могут быть выполнены по всей молекуле, если они не нарушают функции суперантигена, например, консервативные замены, в частности, вне районов, участвующих в связывании с классом II и TCR. Изменение в последовательности ДНК для изменения связывания МНС класса II или любое другое изменение на уровне ДНК может быть выполнено либо перед изменением в районах обеспечения связывания с TCR, либо после изменения. Эти другие типы модификации могут быть с тем же успехом введены перед заменой аминокислот в районе I. Таким образом, в контексте данного изобретения концепция использования "суперантигена дикого типа" в начале модификации согласно формуле изобретения первично относится к аминокислотной последовательности дикого типа в районе I, вне которого могут иметь место предыдущие модификации.
Конструирование химерных и мутированных суперантигенов можно проводить в соответствии со способами, хорошо известными в этой области. Переключение от района, специфического для одного суперантигена, к соответствующему району в другом суперантигене производят на геномном уровне, и оно может выполняться заменой всей последовательности или точковыми мутациями тех специфических оснований, которые требуются для получения в результате желательной аминокислотной последовательности. См., например, экспериментальную часть и также цитированные выше ссылки предшествующего уровня знаний. Термин "мутация" включает замену, встраивание или удаление одного или нескольких аминокислотных остатков путем модификации последовательности ДНК, кодирующей белок, который должен быть мутирован.
Суперантиген для использования в способе данного изобретения может быть неконъюгированным суперантигеном, модифицированным, как описано выше, т.е. модифицированным суперантигеном, не имеющим специфически присоединенной узнающей мишень части молекулы, но имеющим явную способность связываться как с антигенами МНС класса II, так и с субпопуляцией Т-клеток через TCR. Более предпочтительно модифицированный суперантиген, предпочтительно, химерный суперантиген, конъюгирован с узнающей мишень частью молекулы. В последнем случае предпочтительными вариантами являются "гибриды" (слияния) между узнающей мишень частью и модифицированным суперантигеном. Эти конъюгаты как таковые являются новыми и представляют собой отдельный аспект данного изобретения.
Структуры конъюгатов данного изобретения аналогичны известным ранее конъюгатам антитело/суперантиген (Dohlsten et al., WO9201470;.Abrahmsen et al. , WO09601650, обе публикации включены в качестве ссылки), т.е. конъюгаты часто подчиняются формуле
T-B-SA(m)
где Т обозначает отыскивающую мишень часть молекулы, SA(m) является модифицированным, предпочтительно химерным, суперантигеном, описанным выше, и В является ковалентной мостиковой связью, соединяющей Т и SA(m) вместе. Т может в принципе содержать дополнительные суперантигенные части молекулы (SA(m), a SA(m) дополнительные узнающие мишень части молекулы, хотя в предпочтительных конъюгатах имеются только одна узнающая мишень часть и одна часть, являющаяся модифицированным антигеном, как описано выше.
Т может быть в принципе любой структурой, которая способна связываться со структурой поверхности клетки, предпочтительно специфической для заболевания структурой. Структура, против которой направлен Т, обычно отличается от (а) эпитопа Vβ-цепи, с которым связывается SA(m), и (б) эпитопов МНС класса II, с которыми связываются суперантигены. Узнающую мишень часть первично выбирают среди интерлейкинов (например, интерлейкин-2), гормонов, антител, в том числе антигенсвязывающих фрагментов антител, факторов роста и т. д. См. , например, Woodworth, Preclinical and Clinical development of Cytokine toxins, presented at the conference "Molecular approaches to cancer Immunotherapy", Ashville, North Carolina, November 7-11, 1993).
К моменту заявления приоритета было предпочтительно, чтобы Т был антителом (полноразмерным антителом, Fab, F(ab)2, Fv, одноцепочечным антителом и любым другим антигенсвязывающим фрагментом антитела), с особым предпочтением активных фрагментов антител (таких как Fab), направленных на так называемый эпитоп С242 (Lindholm et al., WO9301303), или более предпочтительно на связывающий эпитоп для антитела 5Т4, специфического для рака легких (Stem et al. , WO8907947). Однако это не исключает того, что другие специфические для рака антитела могут функционировать также хорошо или даже лучше. Термин "антитело" включает как моноклональные, так и поликлональные варианты, предпочтительно моноклональные препараты.
Т может быть также направлен на уникальные структуры на более или менее здоровых клетках, которые регулируют или контролируют развитие заболевания.
Мостиковая связь В может быть выбрана, как описано ранее (Dohlsten et al. , WO9201470; и Abrahmsen et al., WO9601650), т.е. В предпочтительно является гидрофильным и обнаруживает одну или несколько структур, выбранных из амида, тиоэфира, дисульфида и т. д. Наиболее известными мостиковыми связями являются связи, полученные рекомбинантными способами, т.е. конъюгирование в этом случае имеет место на геномном уровне. В таких случаях предпочтительны олигопептидные мостики, содержащие гидрофильные аминокислотные остатки, такие как Gln, Ser, Gly, Glu, Pro, His и Arg. Особенно предпочтительными В являются пептидные мостики, состоящие из 1-10 аминокислотных остатков, с абсолютной предпочтительностью для 3-7 аминокислотных остатков. Типичным мостиком является трипептид GlyGlyPro, SEQ ID N1.
Получение новых конъюгатов данного изобретения может проводиться в принципе в соответствии с двумя основными путями реакций: 1. Рекомбинантные способы и 2. Химическое связывание узнающей мишень части Т с модифицированным, предпочтительно химерным, суперантигеном (SA(m)), описанным выше. Эти способы хорошо известны исследователям с обычной квалификацией и включают в себя большое количество вариантов.
Химическое связывание модифицированного неконъюгированного суперантигена с отыскивающей мишень частью Т часто используют функциональные группы (например, первичные аминогруппы или карбоксигруппы), которые присутствуют во многих положениях в этих соединениях. Из этого следует, что конечный продукт будет содержать смесь молекул конъюгата, отличающихся по положениям связывания, а также гетеро- и гомоконъюгататы.
Для рекомбинантных конъюгатов (слитых белков) полученный материал конъюгата будет однородным в отношении положения связывания. Либо аминоконец химерного суперантигена будет связан с карбоксиконцом узнающей мишень части, либо наоборот, для антител, таких как интактные антитела и антигенсвязывающие фрагменты (Fab, Fv, одноцепочечные антитела и т.д.), для слияния могут быть использованы либо легкая цепь, либо тяжелая цепь. В настоящее время предпочтительны рекомбинантные конъюгаты, наиболее предпочтительно Fab-фрагменты, и связывание аминоконца химерного суперантигена с первым константным доменом тяжелой цепи антитела (СН1), без исключения аналогичного связывания с легкой цепью или с доменами VH и VL, которое также может дать вполне хорошие результаты.
Основная клетка-хозяин для широкомасштабного рекомбинантного получения модифицированных суперантигенов данного изобретения (как слитных форм, так и не-конъюгированных форм) является E.coli. Этот хозяин обеспечивает в принципе два пути: внутриклеточное продуцирование и секрецию. Последний вариант является предпочтительным, так как он обеспечивает очистку правильно уложенных белков из периплазмы и из культурной среды. Вышесказанное не исключает того, что можно получать активные конъюгаты также и в других клетках-хозяевах, например в эукариотических клетках, таких как дрожжи или клетки млекопитающих.
Фармацевтические композиции, доза и пути введения
Третьим аспектом данного изобретения являются фармацевтические композиции, содержащие модифицированные, предпочтительно химерные, суперантигены данного изобретения, описанные выше (как конъюгированные, так и неконъюгированные формы). Рассматриваемые композиции известны в данной области, за исключением того, что теперь они содержат суперантиген данного изобретения. Так, эти композиции могут быть в форме лиофилизированного состоящего из частиц материала, стерильного асептически приготовленного раствора, таблетки, ампулы и т.д. Могут присутствовать носители, такие как вода (предпочтительно забуференная до физиологически приемлемой величины рН, например, при помощи PBS (забуференного фосфатом физиологического раствора, ЗФР)) или другой твердый или жидкий материал. В общих чертах, эти композиции готовят с использованием конъюгата, смешанного, связанного или иным образом комбинированного с одним или несколькими водорастворимыми или нерастворимыми в воде водными или неводными носителями (или растворенного в них), если необходимо, вместе с подходящими добавками и адъювантами. Обязательным является то, что носители и условия не должны оказывать неблагоприятного действия на активность модифицированного суперантигена.
Обычно суперантиген данного изобретения должен продаваться и вводиться в заранее распределенных дозах, каждая из которых содержит эффективное количество конъюгата, которое на основании представленного здесь результата должно находиться в диапазоне 10 нг - 50 мг, например, в диапазоне 10 нг - 1 мг или в диапазоне 10 мкг - 50 мг. Точная доза будет вариировать от случая к случаю в зависимости от веса и возраста пациента, пути введения, типа заболевания, отыскивающей мишень части молекулы, суперантигена, связи (-В-) и т. д.
Пути введения являются обычно применяемыми в данной области путями, т.е. убивающее клетки-мишени эффективное
количество или терапевтически активное количество суперантигена, модифицированного в соответствии с изобретением, приводят в контакт с клетками-мишенями. Для описанных выше показаний это большей частью означает парентеральное введение, такое как инъекция или инфузия (подкожная, внутривенная, внутриартериальная, внутримышечная, внутрибрюшинная) млекопитающему, например человеку. Рассматриваемые модифицированные, предпочтительно химерные, суперантигены могут вводиться местно или системно.
Под термином "убивающее мишень эффективное количество" подразумевают, что это количество является эффективным в активации и нацеливании Т-клеток для разрушения клеток-мишеней.
Предпочтительный путь введения в момент заявления приоритета соответствует пути введения, обсуждаемому для конъюгатов суперантигенов согласно Dohlsten et al., WO9201470 и Abrahmsen et al., WO9601650. Это означает 1-5-часовую внутривенную инфузию (предпочтительно 4-часовую) в день вместе с жаропонижающим средством (парацетамолом). Введение должно повторяться в течение нескольких дней, например, в течение 4 дней, с соблюдением осторожности в отношении риска усиления образования антител, направленных против конъюгата.
Суперантигены данного изобретения могут вводиться либо в качестве основной терапии, либо, в предпочтительных схемах, в качестве адъювантной (дополнительной) терапии в соединении с хирургией или другими лекарственными средствами.
В контексте терапии мы обнаружили, что препараты антител, которые являются чистыми в отношении нековалентно связанных тяжелых и легких цепей антител, обеспечивают преимущества в сравнении с препаратами, содержащими антитела, в которых эти цепи связаны вместе через цистиновые связи. Четвертым аспектом данного изобретения является терапевтическое использование препарата антител, в частности препарата Fab, в котором цистеиновые остатки, связывающие цепи вместе, были заменены аминокислотой, не позволяющей образование дисульфидных связей, например серином. Наиболее предпочтительными специфическими антителами для этого аспекта изобретения были в момент заявления приоритета С 242 mab (Lindholm et al., WO9301302) и 5Т4 mab, как описано в цитированных выше ссылках. В предпочтительных вариантах одна из цепей антитела слита с суперантигеном, который способен активировать субпопуляцию Т-клеток Vβ-специфическим образом, как описано выше. Суперантиген может быть антигеном дикого типа, химерой или вариантом с точковой мутацией (и их комбинациями), описанными выше или Dohlsten et al., WO9201470 и Abrahmsen et al. , WO9601650. Этот аспект изобретения включает также фармацевтические композиции, описанные выше, но содержащие препарат антител, описанных в данном аспекте изобретения, вместо химерного суперантигена.
В момент заявления приоритета было предпочтительно использовать фрагмент Fab антитела 5Т4 (Stem et al., WO8907947) в сочетании с химерой SEE/A-A с мутацией D227A. Предпочтительный фрагмент Fab был мутирован в обеих цепях в положении, обеспечивающем межцепочечные дисульфидные связи (Ser вместо Cys). Для увеличения выхода слитого с антителом белка при продуцировании его в Е. coli. мутации также проводили в Vk-цепи при определенных положениях. См. экспериментальную часть.
МАТЕРИАЛЫ И СПОСОБЫ
Конструирование химерных генов SEA/SEE
Конструирование химер SEA/SEE выполняли с использованием способа на основе полимеразной цепной реакции (ПЦР), перекрывающегося удлинения последовательности (Horton et al.). ПЦР проводили cU1Tma (Perkin-Elmer) в соответствии с рекомендациями изготовителей. Продуцируемые ПЦР фрагменты клонировали в PCR-script (Stratagene, USA) и секвенировали для проверки правильности последовательности. Затем химерные гены суперантигенов субклонировали в экспрессирующий вектор рКР889 (Abrahmsen et al., 1995), соединяя эти конструкции SE с частью тяжелой цепи с фрагментом Fab мышиного моноклонального антитела С215. Рекомбинантные слитые белки SEA и SEE получали в виде полноразмерных полипептидов в соответствии с консенсусной последовательностью для отщепления сигнального пептида (von Heijne 1986).
Экспрессия и очистка белка
Штамм UL635 Escherichia coli К 12 использовали для экспрессии слитых белков Fab-SE и мутантов SEA, описанных ранее (Abrahmsen et al., 1995). Слитые белки Fab-SE собирали центрифугированием при 5000 g и фракции супернатанта подвергали очистке на Протеин G-Сефарозе (Phamacia Biotech AB, Uppsala, Sweden), как описано ранее (Abrahmsen et al., 1995). Чистота аффинно очищенных вариантов Fab-SE была >90% при анализе с применением электрофореза в ДСН-ПААГ.
Клетки
Линию клеток В-клеточной лимфомы человека Raji и карциномы ободочной кишки человека Colo 205 культивировали в полной R-среде (среде RPMI-1640 с добавлением 10% фетальной телячьей сыворотки (Gibco BRL, Life Technologies, Ltd. Paisley Scotland), 1 мМ глутамина; HyClone Europe, Ltd. Cramlington, 5•50-5 M β-меркаптоэтанола; ICN Biomedicals INC. Costa Mesa CA, 0,1 M NaHCO3; Seromed Biochrome, 1•10-2 M Hepes-буфера; HyClone Europe, Ltd. Cramlington, 0,1 мг/мл гентамицина; Biological Industries Kibbutz Beit Haemek Izrael, 1•10-3 M пирувата натрия; HyClone Europe, Ltd. Cramlington). Клетки СНО, трансфицированные молекулами С215 и CD80 человека, культивировали в полной R-среде с добавлением 0,5 мг/мл Геницитина (G418) Gibco BRL, Life Technologies, Ltd. Paisley Scotland). Мононуклеарные клетки периферической крови (РВМ) получали из гепаринизированной крови здоровых доноров. Клетки выделяли центрифугированием в градиенте плотности через Ficoll-Paque, как описано ранее (Dohlsten et al., 1991). Т-лимфоциты человека очищали до гомогенности положительной селекцией с использованием колонок MiniMACS в сочетании с магнитными гранулами, покрытыми моноклональными антителами, специфическими для CD4 и CD8 человека (Miltenyl Biotec GmbH, Germany), в соответствии с инструкциями изготовителей. Реагирующие с SEA и SEE (SEA- и SEE-реактивные) клеточные линии человека получали, как описано ранее (Dohlsten et al., 1994). Экспрессирующую TCR Vβ22 клеточную линию человека получали из первично стимулированной реагирующей с SEA клеточной линии при помощи положительного отбора с магнитными гранулами (Dynabeads, Dynal A.S., Norway), покрытыми моноклональными антителами, специфическими для TCR Vβ22 (Immunotech, France). Обогащенные клетки содержали >95% TCR Vβ22+ Т-клеток, как определено проточной цитометрией (данные не показаны). Мышиные Т-клеточные гибридомы (I1B3, 2В4 и 11.40) получали, как описано (Fleury et al., 1991).
Тест на цитотоксичность
Цитотоксичность измеряли в стандартном тесте высвобождения 51Cr после 4 или 6 часов, как описано ранее (Dohlsten et al., 1991). Клетки Colo205 или Raji человека использовали в качестве клеток-мишеней. Эффекторные клетки, SEA- или SEE- реактивные линии Т-клеток человека или линии TCR Vβ22+-клеток человека добавляли при отношении эффектора к мишени 30:1. 51Cr-меченные клетки-мишени использовали в тестах на цитотоксичность при 2500 клеток/200 мл полной среды в лунках микротитрационного планшета с V-дном. Гибриды C215Fab-SEA/E добавляли при различных концентрациях, как указано, и высвобождение 51Cr измеряли в счетчике Гейгера. Удельную цитотоксичность в процентах рассчитывали как 100х[(экспериментальное высвобождение в имп/мин-фоновое высвобождение в имп/мин)/(общее высвобождение в имп/мин-фоновое высвобождение в имп/мин)].
Тесты пролиферации лимфоцитов
Для измерения пролиферации 105 Т-клеток-респондеров человека инкубировали при 37oС с 104 облученными (20000 рад) стимулирующими клетками в 200 мл полной среды в 96-луночном микротитрационном планшете с U-дном с различными количествами гибридов C215Fab-SEA/E в течение 72 часов. Пролиферацию оценивали по включению [3H]-тимидина, как описано (Dohlsten et al., 1988).
Анализ индуцированного Fab-SAg продуцирования ИЛ-2
Клетки мышиной гибридомы Т-Т (105) инкубировали в 200 мл полной среды R-среды с химерными белками C215Fab-SEA/E в присутствии 2•104 стимулирующих клеток Raji. После 48 часов супернатанта собирали и анализировали на присутствие мышиного ИЛ-2. Вкратце, содержание цитокина анализировали с использованием крысиных mAb против мышиного цитокина в качестве связывающих антител. Очищенные крысиные антитела против мышиного ИЛ-2, крысиный ИЛ-" были приобретены из PharMingen (San Diego, CA). Меченные биотином mAb против цитокина, набор Vectastain ABC (Vector Laboratories, CA) использовали для обнаружения цитокинов. Поглощение определяли в Иммуноридере (ImmunoReader NJ2000, InterMed Roskilde, Denmark) при 405 или 450 нм.
Мутирование 5T4Fab
Конструирование вектора для экспрессии 5T4Fab-SEA в Е. coli
Кодирующие Fv части 5Т4 клонировали из гибридомы 5Т4, полученной от доктора Петера Стерна (Stern et al., WO8907947). Более подробно: кДНК получали из мРНК, районы целых вариабельных доменов и части сигнальных последовательностей, а также первый константный домен тяжелой цепи и константный домен легкой цепи амплифицировали при помощи ПЦР. Олигонуклеотиды 5'-CAATTTTCTTGTCCACCTTGGTGC-3' (SEQ ID N 2) и 5'-ACTAGTCGACATGGATGGAGCTITATCATIyTCTT-3' (SEQ ID N 3) использовали для тяжелой цепи с получением фрагмента 553 п. н. , тогда как олигонуклеотиды 5'-ACTAGTCGACATGGGCITCAAGATGGAGTCACAkwyyCwGG-3' (SEQ ID N 4) и 5'-GCGCCGTCTAGAATTAACACTCATTCCTGTTGAA-3' (SEQ ID N 5) использовали для легкой цепи с получением фрагмента 724 п.н. для каждой цепи секвенировали три различных клона и нашли, что они были идентичными. Фрагменты ДНК, пригодные для встраивания в экспрессирующий вектор (ref), получали во второй стадии ПЦР. Для сборки Fab-экспрессионной плазмиды вариабельные области 5Т4 сливали с последовательностями, кодирующими константные области, из мышиного IgG1/k антитела С242 mab (Lindholm et al., WO9301302). Район, кодирующий суперантиген, произведенный из стафилококкового энтеротоксина A(SEA), присоединяли после тяжелой цепи. Подтвержденная последовательность для Vk-цепи каркаса антитела 5Т4 представлена в результатах.
Мутагенез 5Т4
Семь аминокислотных замен вводили в районы, кодирующие каркас антител. Это были Phe10Ser, Thr45Lys, Ile63Ser, Tyr67Ser, Phe73Leu, Thr77Ser и Leu78Val. Подобным образом, остатки Cys в каждой цепи, участвующие в образовании междоменной дисульфидной связи, были заменены остатками серина, что приводило к мутации Cys458Ser в тяжелой цепи и Cys214Ser в легкой цепи. Эти мутации вводили при помощи мутагенеза на основе ПЦР и полученную последовательность ДНК подтверждали секвенированием.
Экспрессия в ферменте и очистка 5T4Fab-SEA
Экспрессионная плазмида содержит ген устойчивости к канамицину и lacUV5-промотор, который может индуцироваться IPTG. Слитые белки очищали из осветленной культуральной среды с использованием Протеин G-Сефарозы и SP-Сефарозы (Pharmacia Biotec, Uppsala, Sweden) и переводили в цитратный буфер при помощи Сефадекса G-25 в основном, как описано. Характеристика при помощи электрофореза в ДСН-ПААГ, обратнофазовой ВЖХ (ВЖХ в обращенной фазе) и масс-спектрометрии показала, что очищенный слитый белок имел чистоту 95% и имел правильную молекулярную массу.
РЕЗУЛЬТАТЫ: Модификации суперантигена
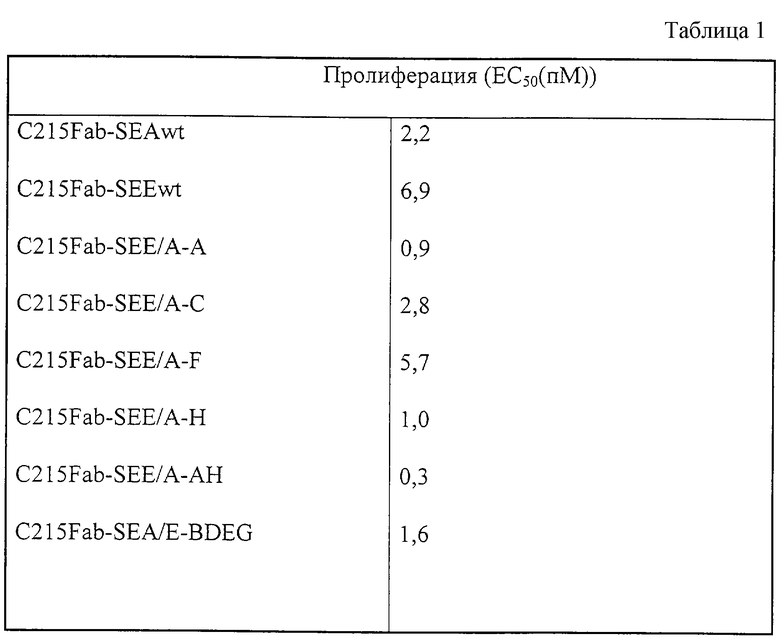
Суперантиген-зависимую клеточную цитотоксичность (SDCC) C215Fab/SEA и C215Fab-SEE против МНС класса II+-клеток Raji анализировали с применением SEA- и SEE-реактивных Т-клеток человека в качестве эффекторных клеточных линий. Несмотря на различие в Vβ-специфичности между SEA и SEE оба суперантигена обнаруживали индукцию сравнимой степени цитотоксичности с обеими эффекторными клеточными линиями (фиг. 1). Для различения между эффектами предоставления МНС класса II и прямыми действиями SEA и SEE в узнавании TCR их исследовали в тесте суперантиген-антитело-зависимой клеточной цитотоксичности (SADCC) против экспрессирующих С215 клеток Colo205. В этом тесте Fab-часть направляет слитый белок к экспрессирующим С215 клеткам-мишеням и приводит к предоставлению слитых молекул SE цитотоксическим Т-клеткам (CTL) независимо от молекул МНС класса II (Dohlsten et al., 1994). Несмотря на > 80% идентичность аминокислотной последовательности между SEA и SEE, взаимодействие с TCR SEA и SEE обнаруживает качественные различия в этом типе теста. Слитый белок C215Fab-SEA сохраняет его способность направлять SEA- и SEE-реактивные CTL против МНС класса II--клеток-мишеней (фиг.1), тогда как C215Fab-SEE не может индуцировать цитотоксичность в отношении МНС класса II--клеток-мишеней ни с SEA-, ни с SEE-реактивными CTL (фиг.1).
Ранее сообщалось другими исследователями, что различие в Vβ-специфичности между SEA и SEE первично связано с различиями в трех аминокислотах в петле, предшествующей спирали а5, и в спирали а5 (Irwin et al., 1992, Hudson et al., 1993, Fraser et al., 1993 и Mollick et al., 1993). Различие в отношении взаимодействия с TCR, сообщенное в этом исследовании, не связано с измененной TCR Vβ-специфичностью, поскольку способность C215Fab-SEA индуцировать МНС класса II-независимую цитотоксичность не ограничивается SEA-реактивными CTL, но также наблюдается с SEE-реактивными CTL.
Анализ гомологии последовательности SEA и SEE (фиг.2) обнаруживает, что неидентичные аминокислотные остатки сконцентрированы в восьми различных районах. Вне этих восьми районов, составляющих до 34% последовательности, идентичность двух SE равна 97%, причем за остальные различия ответственны консервативные аминокислотные замены. Четыре из негомологичных районов структурно близки к двум сайтам связывания МНС класса II (В, D, Е и G) и они, по-видимому, не взаимодействуют с TCR (фиг.3). Дополнительные четыре района (А: АА 20-27, С: 60-62, F: 161-176 и Н: 200-207) локализованы на конце молекулы (фиг. 3), вблизи сайта связывания TCR, расположенного в канавке между двумя субдоменами (Kappler et al., 1992). Для исследования качественного различия в узнавании TCR между SEA и SEE мы изготовили гибридные белки прививкой районов из SEA и SEE в виде химер одного района (SEE/A-А, -С, -F, Н) в виде гибридов двух районов (SEE/a-AH) и прививкой районов, локализованных вблизи сайтов связывания МНС класса II на SEE в SEA (SEA/E-BDEG) (фиг.4). Все эти химерные SE экспрессировались в виде слитых белков с C215Fab для обнаружения различий в отношении их активности в отсутствие МНС класса II.
Гибридные белки SEA/E, слитые с С215Fab-частью, обнаруживают различие в Fab-нацеленных тестах цитотоксичности
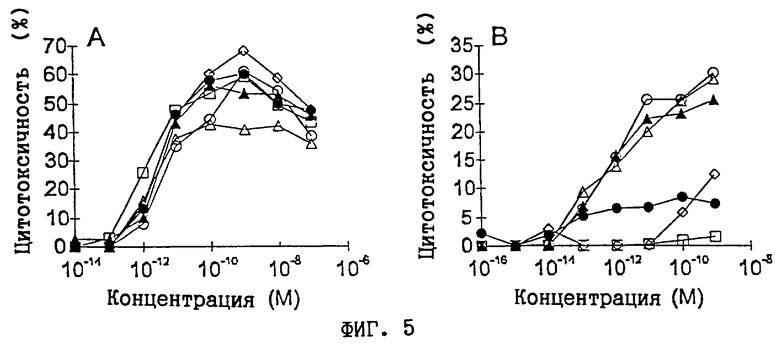
SDCC-активность гибридных белков C215Fab-SEE/A против МНС класса II+-клеток Raji анализировали с использованием SEA-реактивных Т-клеток человека в качестве эффекторов. Величины ЕС50 всех гибридов C215Fab-SE, а также C215Fab-SEAwt и -SEEwt (wt=дикого типа) находятся в пределах ошибок (например, 10-12-10-11 М, фиг.5). Единственным детектируемым различием является слегка пониженное плато для гибрида C215Fab-SEE/A-AH, указывающее на потерю Т-клеток. С другой стороны, в SADCC-эксперименте, где цитотоксичность направлена на линию МНС класса II-/С215+-клеток Colo 205, только гибриды C215Fab-SEE/A-A, C215Fab-SEE/A-AH и C215Fab-SEE/E-BDEG индуцировали цитотоксичность, сравнимую с цитотоксичностью C215Fab-SEAwt (фиг.5). Гибрид C215Fab-SEE/A-F способен индуцировать С215-направленную цитотоксичность при более высоких концентрациях (EC50>10-10 M). Хотя гибрид C215Fab-SEE/A-AH способен индуцировать С215-направленную цитотоксичность с такой же ЕС50, что и C215Fab-SEAwt (например, ЕС50 10-13 M), абсолютный уровень цитотоксичности значительно уменьшается (фиг.5). Это различие могло бы быть следствием ограниченной Vβ-специфичности C215Fab-SEE/A-AH, хотя способность индуцировать С215-направленную цитотоксичность преобладает в отвечающей субпопуляции Т-клеток. Для дальнейшего исследования этой идеи мы приготовили Vβ22-олигоклональную линию CTL человека. Vβ22 человека аналогичны Vβ3 мышей в том отношении, что они представляют собой семейство Vβ, специфическое для SEA и неспецифическое для SEE. Ранее было показано (Mollick et al., 1993), что основной вклад Vβ SEA и SEE первично связан с различием в трех аминокислотах между SEA и SEE в районе Н (АА 200-207). В SDCC-тестах против МНС класса II+-клеток Raji (мишеней) с использованием Vβ22-олигоклональной линии CTL в качестве эффекторов только гибриды, содержащие район SEA-H, способны давать С215Fab-SEAwt-подобную ответную реакцию (например, C215Fab-SEE/A-H, C215Fab-SEE/-AH и C215Fab-SEA/E-BDEG, фиг.6). Гибрид C215Fab-SEA/A-A, который способен индуцировать полный SDCC-ответ со всеми популяциями CTL в качестве эффекторов, в этом тесте сильно понижен как в отношении полумаксимальной концентрации, так и в отношении плато (фиг.6). Когда цитотоксичность Vβ22 CTL направлена на линию МНС класса II-/C215+-клеток Colo 205, только гибриды, содержащие как SEA-A, так и SEA-Н (например, C215Fab-SEE/A-AH и C215Fab-SEE/E-BDEG) районы, способны индуцировать цитотоксический ответ, сравнимый с ответом, индуцируемым C215Fab-SEAwt (фиг.6). Гибрид, содержащий только район A SEA (C215 Fab-SEE/A-A), индуцирует более низкий уровень цитотоксичности со сравнимой величиной ЕС50. Это указывает на то, что остальная активность, наблюдаемая с гибридом C215Fab-SEE/A-AH, в тесте SADCC с популяцией целых Т-клеток в качестве эффекторов не является следствием индуцированного гибридом ответа в рестриктированной популяции Т-клеток. Более вероятным объяснением этого наблюдения является то, что способность индуцировать SADCC-ответ гибридных белков C215Fab SE первично связана с районом SEA-A и с меньшим вкладом со стороны районов SEA-H и -F. Нет доказательства, что это качество ограничивается только какой-либо субпопуляцией Т-клеток в объединенной SEA-SEE-отвечающей популяции Т-клеток, так как гибрид C215Fab-SEA способен индуцировать тот же самый ответ с SEE-реактивными CTL, и гибрид C215Fab-SEE/A-A способен полностью воспроизводить ответ, наблюдаемый с C215Fab-SEA.
Гибридные белки SEA/E, слитые с С215Fab-частью, обнаруживают различие в Fab-нацеленных тестах пролиферации
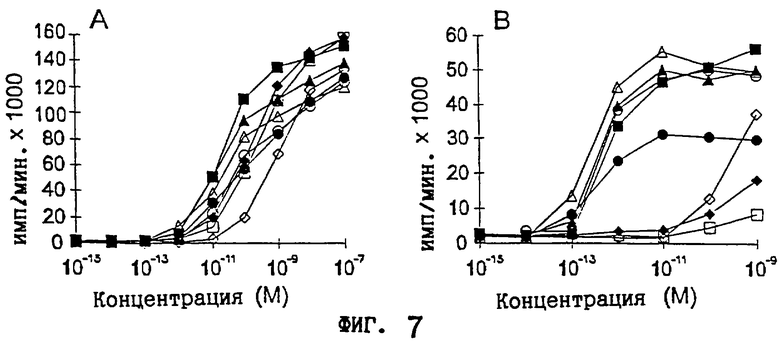
Ранее было показано, что очищенные покоящиеся Т-клетки человека индуцируются в отношении пролиферации при предоставлении C215Fab-SEA на линии МНС класса II-/C215-/CD80+-клеток (Lando et al. , 1993). Однако способность C215Fab-SEA индуцировать МНС II--независимую пролиферацию заметно уменьшается с C215FabSEE (Таблица 1). Для исследования, связано ли это различие в качестве также с районом A SEA, как это наблюдали в SADCC-тестах, мы исследовали пролиферативную активность гибридов C215Fab-SE, предоставляемых либо CHO-DR1+/CD80+, либо CHO-C215+/CB80+ трансфицированными клеточными линиями, на очищенных покоящихся Т-клетках человека. При предоставлении конъюгатов Fab-SE на CHO-DR1+/CD80+ не было различий между различными белками SE (данные не показаны). Однако прививки районов А, С и Н SEA в SEE усиливает пролиферативную активность по сравнению с C215Fab-SEE. Наилучшие результаты были получены путем прививки районов А и Н SEA, что указывает на важную роль района А, как это наблюдали для МНС класса II-независимой цитотоксичности. Возможно, что при применении негативной селекции различия между Fab-SEA и -SEE были более значительными.
Vβ-специфичность SE-гибридов
Для дальнейшего исследования, связаны ли гибридные слитые белки C215Fab-SEA/SEE с определенной Vβ-специфичностью, мы использовали SEA-реактивные мышиные Т-клеточные гибридомы, экспрессирующие Vβ1, Vβ3 и Vβ11. Из полученных данных очевидно, что все исследованные районы, прямо или опосредованно, влияют на взаимодействие с TCR. При прививке районов С и F SEA в C215Fab-SEE активность в отношении SEA- и SEE-перекрестно реактивной Vβ1-гибридомы I1B3 уничтожается. Те же самые химеры, по-видимому, не влияют или оказывают небольшое влияние на активность Vβ3- и Vβ11-гибридом (2.В4 и 11.40) по сравнению с C215Fab-SEE. При прививке района A SEA в C215Fab-SEE активность в отношении Vβ3 (2.В4) увеличивается по меньшей мере в 10 раз в сравнении с C215Fab-SEE. Более заметно выраженные эффекты наблюдаются с той же клеточной линией при прививке района Н SEA в C215Fab-SEE. Этот более сильный эффект в отношении влияния района Н SEA на Vβ3-специфичность отмечался также в более ранних исследованиях (Mollick et al., 1993). Однако та же самая химера (C215Fab-SEE/A-H), по-видимому, уменьшает активность в отношении SEA/SEE-перекрестно реактивных Vβ1- и Vβ11-гибридом (I1B3 и 11.40) в 10 раз. В заключение можно отметить, что взаимодействие с SEA с TCR, по-видимому, включает в себя все вариабельные районы А, С, F и Н SEA-SEE.
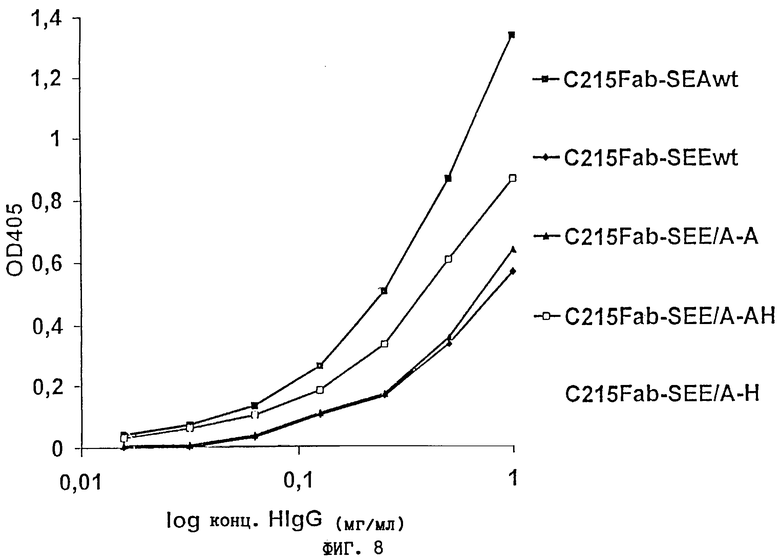
Серореактивность
Серореактивность в пробах сывороток человека в отношении химерных SE исследовали как в объединенных пробах из различных частей света, так и в индивидуальных пробах сывороток. Путем прививки обоих районов А и Н SEA в SEE мы получили промежуточную серореактивность (фиг.8). Сходную серореактивность наблюдали также против химеры C215Fab-SEE/A. Однако отдельные прививки района A SEA (C215Fab-SEE/A-A) дали С215Fab-SЕЕ-подобную серореактивность, что свидельствует о том, что за остальную серореактивность против C215Fab-SEE/A-AH ответственен район Н SEA. Это указывает на то, что район Н SEA является доминирующим антигенным эпитопом в SEA. Серореактивность объединенных проб сывороток из других частей света (Японии и США), а также 14 отдельных проб из Швеции подтверждает один и тот же общий характер результатов (не показано).
РЕЗУЛЬТАТЫ: Мутации Fab-части слитых белков
Экспрессия конструкций 5Т4FabSEA
Было обнаружено, что уровень продуцирования 5T4Fab-SEA в Е. coli в ферменте значительно ниже, чем в других конструкций Fab-суперантиген, исследованных в нашей лаборатории. Поэтому были введены два типа модификаций для увеличения уровня продуцирования. Во-первых, были введены семь различных точковых мутаций в каркасную область легкой цепи. Это были Phe10Ser, Thr45Lys, Ile63Ser, Tyr67Ser, Phe73Leu, Thr77Ser и Leu78Val. Во-вторых, остатки цистеина, образующие дисульфидную связь, соединяющую тяжелую и легкую цепи, были заменены остатками серина. Последняя модификация привела к трехкратному увеличению, а 7 точковых мутаций привели к дополнительному 12-кратному увеличению уровня продуцирования. Кроме значительно увеличенного уровня продуцирования, удаление дисульфидной связи также привело к получению более гомогенного продукта, поскольку исключена возможность реакции реакционноспособных тиоловых групп с другими содержащими тиол агентами.
Модифицированную молекулу 5Т4 проверяли на сродство с ее антигеном, а также на биологическую активность в SADCC-тестах. В этих тестах не смогли обнаружить различий между мутантной формой и формой дикого типа.
Мутацию Cys/Ser получали также в тяжелых и легких цепях фрагментов Fab нескольких других моноклональных антител. Продукты становились гомогенными и полностью сохраняли их способность связывания антигена.
Последовательность района каркасной области антитела для Vk-цепи 5Т4:
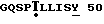
 100 GTKLEIK (SEQ ID N6)
100 GTKLEIK (SEQ ID N6)
Подчеркнутые последовательности являются CDR. Положения, выделенные точкой, были мутированы: Phe10Ser, Thr45Lys, Ile63Ser, Ile63Thr, Tyr67Ser, Phe73Leu, Thr77Ser и Leu78Val.
Таблица 1. (см. в конце текста).
Подписи к фигурам
Фиг. 1. МНС класса II-зависимая и -независимая цитотоксичность с SEE- и SEA-CTL человека
МНС класса II-зависимая клеточная цитотоксичность (А и В) и С215-зависимая клеточная цитотоксичность (С и D) с молекулами C215Fab-SEA (▪) и C215Fab-SEE  в качестве эффекторных молекул. Цитотоксичность анализировали в стандартном 4-часовом тесте высвобождения 51Cr с использованием SEE-реактивной линии Т-клеток человека (А и С) и SEA- реактивной линии Т-клеток человека (В и D). Клеточными линиями-мишенями были МНС класса II+-клеток Raji (А и В) и МНС класса II-/С215+-клеток Colo 205 (С и D). Представлены данные из отдельных тестов, которые представляют два (А и С) - пять (В и D) независимых экспериментов.
в качестве эффекторных молекул. Цитотоксичность анализировали в стандартном 4-часовом тесте высвобождения 51Cr с использованием SEE-реактивной линии Т-клеток человека (А и С) и SEA- реактивной линии Т-клеток человека (В и D). Клеточными линиями-мишенями были МНС класса II+-клеток Raji (А и В) и МНС класса II-/С215+-клеток Colo 205 (С и D). Представлены данные из отдельных тестов, которые представляют два (А и С) - пять (В и D) независимых экспериментов.
Фиг.2. Анализ гомологии первичной структуры SEA и SEE
Вариабельные районы SEA/SEE вблизи сайта связывания TCR (А, С, F и Н) и вариабельные районы вблизи двух сайтов связывания МНС класса II.
Фиг.3. Эскиз модели SEA
Модель (Molscript model, Kraulis, 1991) кристалла SEA (Schad et al., 1995). Вариабельные районы SEA/SEE вблизи сайта связывания TCR (А, С, F и Н) и вариабельные районы вблизи двух сайтов связывания МНС класса II. Ион цинка в виде круглого шарика.
Фиг.4. Схематическое представление химерных молекул SE
Отрезки последовательности SEA понижены. Вариабельные районы SEA/SEE обозначены А, В, С, D, F, G и Н.
Фиг. 5. МНС класса II-зависимая и -независимая цитотоксичность с SEA-CTL человека
(А) МНС класса II-зависимая клеточная цитотоксичность и (В) С215-зависимая клеточная цитотоксичность C215Fab-SEE/A-A  , C215Fab-SEE/A-C (□), C215Fab-SEE/A-F
, C215Fab-SEE/A-C (□), C215Fab-SEE/A-F  , C215Fab-SEE/A-H (•), C215Fab-SEE/A-AH (Δ) и C215Fab-SEA/E-BDEG (O). Цитотоксичность анализировали в стандартном 4-часовом тесте высвобождения 51Cr с использованием SEA- реактивной линии Т-клеток человека. Клеточными линиями-мишенями были МНС класса II+-клеток Raji (A) и МНС класса II-/С215+-клеток Colo 205 (В). Представлены данные из отдельных тестов, которые представляют пять независимых экспериментов.
, C215Fab-SEE/A-H (•), C215Fab-SEE/A-AH (Δ) и C215Fab-SEA/E-BDEG (O). Цитотоксичность анализировали в стандартном 4-часовом тесте высвобождения 51Cr с использованием SEA- реактивной линии Т-клеток человека. Клеточными линиями-мишенями были МНС класса II+-клеток Raji (A) и МНС класса II-/С215+-клеток Colo 205 (В). Представлены данные из отдельных тестов, которые представляют пять независимых экспериментов.
Фиг. 6. МНС класса II-зависимая и -независимая цитотоксичность с Vβ+CTL человека
(А) МНС класса II-зависимая клеточная цитотоксичность и (В) С215-зависимая клеточная цитотоксичность C215Fab-SEA (▪), C215Fab-SEE  , C215Fab-SEE/A-A
, C215Fab-SEE/A-A  , C215Fab-SEE/A-C (□), C215Fab-SEE/A-F
, C215Fab-SEE/A-C (□), C215Fab-SEE/A-F  , C215Fab-SEE/A-H (•), C215Fab-SEE/A-AH (Δ) и C215Fab-SEA/E-BDEG (О) в качестве эффекторных молекул. Цитотоксичность анализировали в стандартном 4-часовом тесте высвобождения 51Cr с использованием Vβ22-отобранной SEA- реактивной линии Т-клеток человека. Клеточными линиями-мишенями были МНС класса II+-клеток Raji (А) и МНС класса II-/С215+-клeтoк Colo 205 (В). Представлены данные из отдельных тестов, которые представляют два независимых эксперимента.
, C215Fab-SEE/A-H (•), C215Fab-SEE/A-AH (Δ) и C215Fab-SEA/E-BDEG (О) в качестве эффекторных молекул. Цитотоксичность анализировали в стандартном 4-часовом тесте высвобождения 51Cr с использованием Vβ22-отобранной SEA- реактивной линии Т-клеток человека. Клеточными линиями-мишенями были МНС класса II+-клеток Raji (А) и МНС класса II-/С215+-клeтoк Colo 205 (В). Представлены данные из отдельных тестов, которые представляют два независимых эксперимента.
Фиг. 7. МНС класса II-зависимая и -независимая пролиферация (не представленная в приоритетных заявках)
Действие гибридов Fab-SE на МНС класса II-зависимую (А) и -независимую (В) пролиферацию Т-клеток. Очищенные Т-клетки человека стимулировали в течение 96 часов C215Fab-SEA (▪), C215Fab-SEE  , C215Fab-SEE/A-A
, C215Fab-SEE/A-A  , C215Fab-SEE/A-C (□), C215Fab-SEE/A-F
, C215Fab-SEE/A-C (□), C215Fab-SEE/A-F  , C215Fab-SEE/A-H (•), C215Fab-SEE/A-AH (Δ) и C215Fab-SEA/E-BDEG (O) представленными на МНС класса II+/С215-CHO-DR4/C215- трансфектантах (А) и МНС класса II-/C215+-СНО-CD80/C215- трансфектантах (В). После 72 часов клетки импульсно-метили [3Н] -тимидином в течение 24 часов и включенную метку измеряли и представляли в виде полумаксимальной концентрации (ЕС50). Представлены данные из отдельных тестов, которые представляют два независимых эксперимента.
, C215Fab-SEE/A-H (•), C215Fab-SEE/A-AH (Δ) и C215Fab-SEA/E-BDEG (O) представленными на МНС класса II+/С215-CHO-DR4/C215- трансфектантах (А) и МНС класса II-/C215+-СНО-CD80/C215- трансфектантах (В). После 72 часов клетки импульсно-метили [3Н] -тимидином в течение 24 часов и включенную метку измеряли и представляли в виде полумаксимальной концентрации (ЕС50). Представлены данные из отдельных тестов, которые представляют два независимых эксперимента.
Фиг.8. Серореактивность в пуле Ig человека
Пул из >5000 сывороток из здоровых доноров в Южной Европе против слитых белков. Серийно разведенному Ig человека давали взаимодействовать в течение 1 часа при комнатной температуре с C215Fab-SEAwt, C215Fab-SEEwt, C215Fab-SEE/A-A, C215Fab-SEE/A-H и C215Fab-SEE/A-AH, иммобилизованными на микротитрационных планшетах при концентрации 1 нг/лунку. Коррекцию на связывание с сывороточными белками делали вычитанием OD-величины для C215Fab в каждой точке. Каждая точка представляет собой среднее из двух повторностей (двух проб). Дальнейшие детали см. в Материалах и способах.
Таблица 1. Очищенные Т-клетки человека стимулировали в течение 96 часов соответствующими C242Fab-SE, представленными на МНС класса II-негативных СНО-СD80/С215-трансфектантах. После 72 часов клетки импульсно-метили 3H-тимидином в течение 24 часов и включенную метку измеряли и представляли в виде полумаксимальной концентрации (ЕС50).
Таблица 2. Мышиные Т-клеточные гибридомы стимулировали в течение 48 часов или химерным Fab-конъюгированным суперантигеном. Активность измеряли в виде продуцирования ИЛ-2 и представляли в виде полумаксимальной концентрации (ЕС50).
Работа в течение года приоритета
В попытке сведения к минимуму токсичности слитого белка (суперантиген-антитело) C215Fab-SEE/A-A химеру SEE/A-A мутировали в сайтах связывания Класса II, как описано в WO9601650 и сливали с C215Fab. Были получены конструкции C215Fab-SEE/A-A-D227A, C215Fab-SEE/A-A-F47A/D227A, C215Fab-SEE/A-A-H187A/D227A, C215Fab-SEE/A-A-W130A/D227A, C215Fab-SEE/A-A-D70A/D227A, C215Fab-SEE/A-A-N50S/D227A, C215Fab-SEE/A-A-N50S/D70A/D227A, C215Fab-SEE/A-A F47Y/D227A och C215Fab-SEE/A-A-D70R/D227A. Все слитые белки испытывали на способность индуцировать пролиферацию РВМС человека для индентификации мутантов, имеющих пониженную активность по сравнению с C215Fab-SEE/A-A-D227A. Пониженную пролиферативную активность наблюдали для C215Fab-SEE/A-A-F47A/D227A, C215Fab-SEE/A-A-F47Y/D227A, och C215Fab-SEE/A-A-D70R/D227A. Некоторые из химерных слитых белков испытывали также на титр антител в нормальной сыворотке человека (C215Fab-SEE/A-A-D227A, C215Fab-SEE/A-A-D70A/D227A и C215Fab-SEE/A-A-D70R/D227A). Проводили сравнение с C215Fab-SEA-D227A и C215Fab-SEE-D227A. Относительно C215Fab-SEA-D227A титр был гораздо ниже для каждой испытанной химеры. Относительно C215Fab-SEE-D227A титр был слегка выше для каждой химеры.
Это означает замены в положениях, соответствующих одной или нескольким, предпочтительно двум, из положений 47, 50, 70, 130, 187, 227, согласно нумерации в SEQ ID N 7 и 8 на фиг.2.
Поскольку многие различные варианты и изменения могут быть сделаны в объеме описанной здесь концепции изобретения и поскольку могут быть сделаны модификации в описанных здесь подробно вариантах в соответствии с предусмотренными требованиями закона к формуле изобретения, должно быть понятно, что описанные здесь детали должны интерпретироваться как иллюстративные, а не как ограничительные.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОНЪЮГАТ ДЛЯ СТИМУЛИРОВАНИЯ ИММУННОЙ РЕАКЦИИ ПРОТИВ КЛЕТКИ-МИШЕНИ, СПОСОБ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ У МЛЕКОПИТАЮЩЕГО | 1995 |
|
RU2183215C2 |
| НОВЫЙ БИОТЕХНОЛОГИЧЕСКИ СОЗДАННЫЙ СУПЕРАНТИГЕН ДЛЯ ЛЕЧЕНИЯ ЧЕЛОВЕКА | 2002 |
|
RU2307837C2 |
| АНТИТЕЛА К АНТИГЕНУ ЭПИТЕЛИАЛЬНЫХ ОПУХОЛЕЙ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА ЧЕЛОВЕКА, РОДСТВЕННОМУ АЛЬФА 6 БЕТА 4 ИНТЕГРИНУ | 2000 |
|
RU2266298C2 |
| РАСТВОРИМЫЙ КОНЪЮГАТ АНТИТЕЛА, СПОСОБ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКОГО ЗАБОЛЕВАНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1991 |
|
RU2125889C1 |
| НОВОЕ АНТИТЕЛО СО СПЕЦИФИЧНОСТЬЮ К ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ ТОЛСТОЙ КИШКИ | 2001 |
|
RU2268068C2 |
| КОНЪЮГАТЫ АФФИННАЯ МОЛЕКУЛА-ОЛИГОНУКЛЕОТИД И ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2763554C2 |
| КОНЪЮГАТЫ АФФИННАЯ ЧАСТЬ-ОЛИГОНУКЛЕОТИД И ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2778754C2 |
| ОДНОЦЕПОЧЕЧНЫЕ РЕКОМБИНАНТНЫЕ Т-КЛЕТОЧНЫЕ РЕЦЕПТОРЫ | 2003 |
|
RU2355703C2 |
| ПОЛИМЕРНЫЙ КОНЪЮГАТ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1993 |
|
RU2130462C1 |
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА И ИХ ИСПОЛЬЗОВАНИЕ | 1994 |
|
RU2139934C1 |















Изобретение относится к функционально активным модифицированным суперантигенам. Представлены конъюгат, обладающий способностью активировать иммунную систему, и фармацевтическая композиция, включающая указанный конъюгат. Конъюгат имеет следующую формулу: T-B-SA(m), где Т представляет собой Fab-фрагмент антитела, направленного на специфический раковый антиген; В представляет собой ковалентную мостиковую связь и SA(m) представляет собой мутированный стафилококковый энтеротоксин E(SEE), в котором в регионе А заменен, по крайней мере, один аминокислотный остаток в положении 20, 21, 24 и 27 на аминокислотный остаток в соответствующем положении стафилококкового энтеротоксина A(SEA). Предлагаемый конъюгат может быть использован в качестве активного начала при лечении различных заболеваний без побочных эффектов. 2 с. и 3 з.п. ф-лы, 2 табл., 14 ил.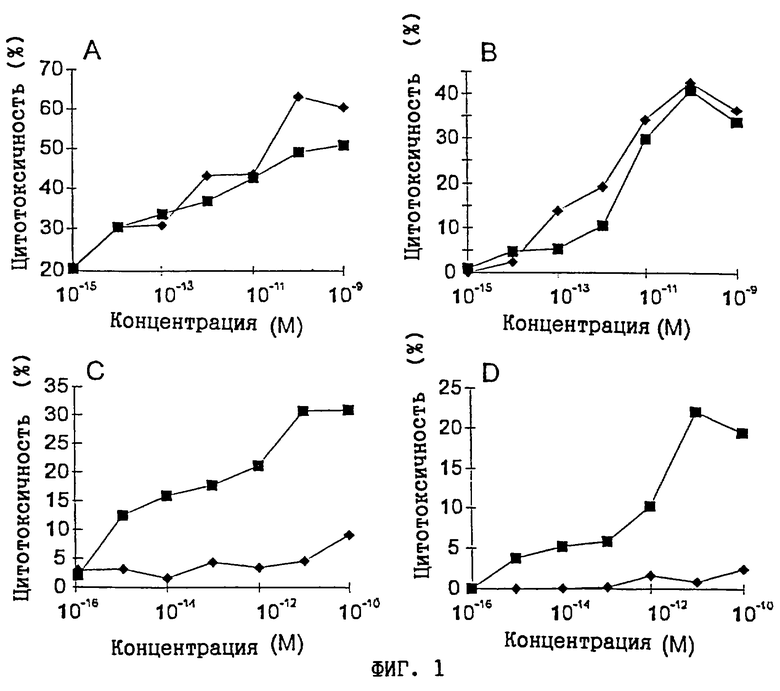
T-B-SA(m),
где Т представляет собой Fab-фрагмент антитела, направленного на специфический раковый антиген;
В представляет собой ковалентную мостиковую связь;
SA(m) представляет собой мутированный стафилококковый энтеротоксин E(SEE), в котором в регионе А заменен, по крайней мере, один аминокислотный остаток в положении 20, 21, 24 и 27 на аминокислотный остаток в соответствующем положении стафилококкового энтеротоксина A(SEA), как указано на фиг. 2.
| Приспособление в пере для письма с целью увеличения на нем запаса чернил и уменьшения скорости их высыхания | 1917 |
|
SU96A1 |
| MARC BETTER et al., "Potent anti-CD5 ricin A chain immunoconjugates from bacterially produced Fab and F(ab')", Proc | |||
| Natl | |||
| Acad | |||
| Sci, January 1993, vl.90, p.457-461 | |||
| EP 0682039 A1, 15.11.1995 | |||
| РАСТВОРИМЫЙ КОНЪЮГАТ АНТИТЕЛА, СПОСОБ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКОГО ЗАБОЛЕВАНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1991 |
|
RU2125889C1 |
Авторы
Даты
2003-02-20—Публикация
1997-03-26—Подача