Суперантигены в основном являются белками вирусной или бактериальной природы и способны к одновременному связыванию с антигенами МНС класса II клеток млекопитающего и Vβ цепью рецептора Т клетки. Связывание приводит к активации Т-лимфоцитов и лизису клеток, проявляющих МНС класса II. Умеренная степень полиморфизма связывающей части Vβ цепи приводит к активации относительно большой части Т-лимфоцитов при контакте с суперантигеном (по сравнению с активацией посредством обычного процессинга антигена).
Первоначально понятие суперантигена было связано с различными стафилококковыми энтеротоксинами (SEA, SЕВ, SEC1, SEC2 и SEE. Недавно был открыт новый стафилококковый энтеротоксин, названный SЕН (Keyong et al., J. Exp. Med. 180 (1994) 1675-1683). С ростом интереса были открыты дальнейшие суперантигены. Среди прочих, примерами являются Токсин 1 синдрома токсического шока (ТСТШ-1-ТSSТ-1), отслаивающие (экзофолиирующие) токсины (Exft), которые связаны с синдромом шелушения кожи, стрептококковый пирогенный экзотоксин А, В и С (СПЭ А, В и С), белки вируса опухоли молочной железы мыши (ВОМЖМ-MMTV), М белки стрептококков, энтеротоксин Клостридиума перфрингенс (Clostridia perfringens) (КПЭТ-СРЕТ). В качестве обзора по суперантигенам и их свойствам см. Kotzin et al. (Adv. Immunol. 54 (1993) 99-166).
В качестве функционального суперантигена рассматривался экзотоксин A Pseudomonas, поскольку имеются данные, свидетельствующие, что данный токсин может быть подвержен внутриклеточной процессии под действием вспомогательных клеток на фрагменты, которые экспрессируются на клеточной поверхности, обладающие способностью связываться с Vβ цепью, с последующей активацией Т клеток. (Pseudomonas exotoxin A. Legaard et al., Cell Immunol 135 (1991) 372-382).
Для терапии различных заболеваний были предложены такие суперантигены с лечебным действием, которое сопровождается активацией иммунной системы (Kalland et al. , WO 9104053; Jerman et al., WO 9110680; Jerman et al., WO 9324136; Newell et al., Proc. Natl. Acad. Sci. USA 88 (191) 1074-1078).
Совместно с вакцинами было предложено использовать суперантигены, которые мутировали таким образом, чтобы потерять свою ТСR. связывающую активность (Kappler & Marrack, WO 9314634).
Мутации суперантигенов были описаны ранее (Kappler & Marrack, WO 9314634; Kappler et al., J. Exp. Med. 175 (1992) 387-396; Grossman et al., J. Immunol. 147 (1991) 3274-3281; Hufnagle et al., Infect. Immun. 59 (1991) 2126-2134).
Ранее нами было предположено использовать для терапии конъюгаты между суперантигеном и антителом для того, чтобы лизировать клетки, которые экспрессируют структуры, относительно которых направлены антитела (Dohlsten et al. , WO 9201470; Lando et al., Cancer Immunol. Immunother. 36 (1993) 223-228; Kalland et al., Med. Oncol. Jumor Pharmacother. 10 (1993) 37-47; Lando et al., J. Immunol. 150 (8, часть 2) (1993) 114A (Joint Meeting of the American Association of Immunologists and clinical Immunology Society, Denver, Colorado, USA, May 21-25 (1993)); Lando et al., Proc. Am. Assоc. Cancer Res, Annu. Meet. 33 (0) (1992) 339 (Annual Meeting of the American Association for Cancer ReSEArch, San Diego, California, USA, May 20-23 (1992)); Dohlsten et al., Proc. Natl. Acad. Sci. USA 88 (1991) 9287-9291).
Предположительными заболеваниями, предназначенными для лечения являются рак, вирусные инфекции, паразитарные инвазии, аутоиммунные заболевания и другие заболевания, связанные с экспрессией структур на поверхности клеток, специфических для заболевания. Ранее проведенные экспериментальные работы были направлены на конъюгаты, содержащие рекомбинантные SЕА и различные противораковые антитела. Подобные конъюгаты имели несколько сниженную способность связываться с антигеном МНС класса II, сравнимую с таковой у неконъюгированной формы суперантигена. Является ли пониженная способность связывания антигена МНС класса II для достижения оптимального лизиса и оптимального терапевтического эффекта полезной или нет, определено не было.
Эксперименты по иммунной терапии с применением SЕВ: химически конъюгированным с опухолевоспецифическим антиидиотипическим антителом были ранее описаны Ochi et at., (J. Immunol. 151 (1993) 3180-3186).
В период проведения расследования приоритета заявки в Шведском патентном бюро, был дополнительно цитирован Buelow et al., (J. Immunol, 148 (1992) (1-6), который описывает слияния между белком А и фрагментами SEB, без усиления связывания МНС класса II, или использования слияния для уничтожения клеток; и Hartwig et al., (Int. Immunol. 5 (1993) 869-875), который описывает мутацию, влияющую на связывание МНС класса II неслитой формы суперантигена стрептококового эритрогенного токсина А.
Объекты изобретения
Первым объектом изобретения является усовершенствование ранее известных конъюгатов суперантиген-антитело в отношении к общей иммунной стимуляции по сравнению с направленной цитотоксичностью. Стимуляция приводит к активации Т-лимфоцитов и зависит от способности суперантигена связываться и с рецептором Т клетки, и с антигеном МНС класса II.
Вторым объектом изобретения является получение конъюгатов между дубликатами с биоспецифическим сродством (например, антителами) и суперантигенами с модифицированным сродством к антигенам МНК класса II. Это, как было теперь показано, улучшает селективность по отношению к суперантиген антитело зависимому цитолизу клетки (SADCC) в клетках, проявляющих антиген (по отношению к которому направлен конъюгат антитела/дубликата биоспецифического сродства) по сравнению с другими клетками, проявляющими антигены МНС класса II.
Третьим объектом изобретения является получение конъюгатов, которые могли бы быть использованы в качестве активного начала при лечении млекопитающих, болеющих раком, аутоиммунными заболеваниями, паразитарными инвазиями, вирусными инфекциями или другими заболеваниями, связанными с клетками, которые экспрессируют на своей поверхности структуры, которые являются специфическими для соответствующего заболевания.
Описание изобретения
Главным аспектом изобретения является конъюгат, включающий
а) дубликат с биоспецифическим сродством, который направлен по отношению к структуре, с которой он предназначен связываться в конъюгате,
б) пептид, который
i) является производным суперантигена,
ii) обладает способностью связываться с Vβ цепью рецептора Т клетки, и
iii) обладает модифицированной способностью связываться с антигенами МНС класса II, по сравнению с суперантигеном, производным которого является пептид (дикий тип суперантигена=SA(wt)).
Пептид и дубликат по сродству являются ковалентно связанными друг с другом через мостик (В).
Предпочтительные конъюгаты имеют способность активировать и направлять Т-лимфоциты к избирательному лизису клеток, которые на своей поверхности проявляют структуру, по отношению к которой направлен дубликат по сродству. Это означает, что конъюгаты будут вызывать цитолиз в способе, опосредованном SADCC (суперантиген антитело зависимая клеточная цитотоксичность). См. экспериментальную часть ниже и наши предыдущие публикации, относящиеся к конъюгатам между суперантигенами и антителами (например, Dohlsten et al., WO 9201470).
Конъюгаты по изобретению имеют структуру, которая является аналогичной к конъюгату суперантигена-антитела, описанной в предшествующей области техники (Dolsten et al., WO 9201470, которая здесь включена в качестве ссылки), т.е. , конъюгат соответствует формуле:
Т-В-SА (m)
где, Т представляет дубликат по биоспецифическому сродству, SА (m) представляет модифицированный суперантиген (вышеупомянутый пептид) и В представляет ковалентный мостик, связывающий Т и SА(m) вместе.
Т, в принципе, может быть любой структурой, которая связывается посредством биоспецифического сродства. В большинстве важных случаев, Т способен к связыванию с поверхностной структурой клетки, предпочтительно, специфической для заболевания структурой, как дано выше. Структура, относительно которой направлен Т, обычно является отличной от (а) эпитопа Vβ цепи, с которым связывается пептид, производный от суперантигена (SА(m) и (б) эпитопа антигена МНС класса II, с которым связывается немодифицированный суперантиген. Дубликат Т по биоспецифическому сродству может первично быть отобран из интерлейкинов (например, интерлейкин-2), гормонов, антител и фрагментов антител, связывающих антиген, факторов роста и т.п. См., например, Woodworth, Preclinical and Clinical Development of Cytokine Toxines (доклиническая и клиническая разработка цитокинных токсинов), представленная на конференции " Molecular Approaches to Cancer Immunotherapy; Ashvill, North Carolina, ноябрь 7-11, 1993. Связывание полипептидов с константным доменом иммуноглобулинов (например, протеины А, G и L), пектинами, стрептавидином, биотином и т.п., находилось в порядке очередности, представляющем меньшее значение.
В порядке очередности, было предпочтительным, чтобы Т являлся антителом или фрагментом антитела, связывающим антиген (включая Fab, F(ab)2, Fv, антитело с одной цепью и т.п.), с конкретным усилением активного фрагмента антитела (такого как Fab) у антител, направленных относительно так называемых С242 эпитопов (Lindholm et al., WO 9301303) или по отношению к другим раковоспецифическим эпитопам.
В случае, когда Т является антителом, это первично моноклональное или смесь определенного количества моноклональных (например, 2, 3, 4, 5 или больше) антител. Т может быть поликлональным антителом, в случае, если использование является нетерапевтическим.
Необязательно, для Т иметь полипептидную структуру.
Модифицированный суперантиген SА(m) является первично мутированным антигеном, но может также потенциально быть химически модифицированным суперантигеном, включая фрагменты суперантигенов, сохраняющих способность связываться с Vβ цепью рецептора Т клетки.
Выражение "мутированный суперантиген" означает, что природная способность суперантигена связываться с антигенами МНС класса II была модифицирована на геномном уровне путем замены, вставки или удаления одной или нескольких аминокислот из природного суперантигена.
Фрагменты суперантигена, полученные путем мутаций по удалению части полной аминокислотной последовательности, и фрагменты, полученные путем ферментативного или химического расщепления суперантигена, могут быть использованы эквивалентно в химических конъюгатах по изобретению.
Модифицированный суперантиген SА(m) может включать одну или несколько аминокислотных последовательностей, которые являются производными от различных суперантигенов и, которые могли быть мутированными, например, комбинации предпочтительных суперантигенов, упомянутых выше.
Модифицированный суперантиген SА(m) как таковой может проявлять пониженную иммуногенность и токсичность, по сравнению с нативным суперантигеном.
Другие группы/соединения, которые способны к перекрестной реакции с Vβ-цепью рецептора Т клетки, могут также потенциально быть использованы эквивалентно с мутированным суперантигеном (SА(m)), как дано выше. Подобные группы/соединения могут быть не полипептидной структуры.
В конце года приоритета большинство интересующих продуктов-кандидатов по изобретению, включали мутированные формы суперантигенов, имеющих множественные участки связывания МНС класса II, и/или способность к координатной связи с Zn2+, например, SEA, SED, SEE и SЕН.
Т, так же как и SА(m), может быть получен при помощи рекомбинантного способа.
Мостик В может быть выбран, как ранее было описано (Dohlsten et al., WO 9201470), а именно, будет предпочтительно гидрофильным и проявлять одну или несколько структур(у), выбранных из амида, тиоэфира, эфира, дисульфида и т. п. В случае, если мостик имеет незамещенные неразорванные углеводородные цепи, они предпочтительно не имеют ароматических колец, таких как фенил. Наиболее важными мостиками являются те, которые получены при помощи рекомбинантного способа, т.е., когда конъюгация имеет место на геномном уровне. В подобных случаях являются предпочтительными олигопептидные мостики, содержащие остатки гидрофильных аминокислот, такие как Gln, Ser, Gly, Glu и Arg. Могут быть включены также Pro и His. В течение года приоритета было решено, что предпочтительным мостиком является пептид, включающий три аминокислотных остатка (GlyGlyPro).
Конъюгат по изобретению может включать один или несколько модифицированных суперантигенов на дубликат по биоспецифическому сродству, и наоборот. Это означает, что Т в вышеуказанной формуле, может содержать один или несколько модифицированных суперантигенов в добавление к биоспецифическому дубликату. По аналогии, SА(m) может содержать один или несколько Т дубликатов по биоспецифическому сродству. Дубликат по сродству Т и SA(m) может также с включать другие структуры. Количество модифицированных суперантигенов на дубликат по сродству составляет предпочтительно один или два.
Синтез новых конъюгатов по изобретению может быть проведен в принципе согласно двум главным путям: 1) рекомбинантным способом и 2) химическим присоединением Т к SА(m). Способы хорошо известны для обычного, квалифицированного в данной области работника и включают большое количество вариантов. Из этого следует, что изобретение относится первично к искусственным конъюгатам, то есть, конъюгатам, которые не обнаруживаются в природе.
Химическое сшивание модифицированного суперантигена с дубликатом Т биоспецифического сродства часто применяет функциональные группы (например, первичные аминогруппы или карбоксигруппы), которые имеются во многих положениях каждого соединения. Из этого следует, что конечный продукт будет содержать смесь конъюгатов молекул, различающихся по отношению к положению, по которому произошло сшивание.
Для рекомбинантных конъюгатов (слитых белков), полученные конъюгированные субстанции будут единообразными по отношению к положению сшивания. Или концевой амин модифицированного суперантигена пришивается к карбокси концу дубликата по биоспецифическому сродству, или наборот. Для подобного слияния для антител, таких как интактные антитела и фрагменты связывания антигена (Fab, FV и т.п.), может быть использована либо легкая, либо тяжелая цепь. В настоящее время предпочтительны рекомбинантные конъюгаты, с предпочтением для Fab фрагментов и пришиванием амино конца модифицированного суперантигена к первому константному домену тяжелой цепи антитела (СНl), без включения аналогов, сшивающихся с легкой цепью или с VH, VL доменами, которые также могут дать достаточно хорошие результаты.
Существует два различных способа получения больших количеств суперантигенов (включая модифицированные и слитые формы) на E. coli: внутриклеточная продукция и секреция. Последний способ предпочтителен для конъюгатов по изобретению, поскольку он предполагает очистку правильно уложенного белка из периплазмы и из культуральной среды. Внутриклеточная продукция приводит к сложному способу очистки и часто требует повторное укладывание белка in vitro (для того, чтобы получать белок с правильной третичной структурой). Вышеуказанное не исключает, что возможно получить активные конъюгаты также и в других клетках хозяевах, например, эукариотических клетках, таких как дрожжи или клетки млекопитающих.
Получение мутированных суперантигенов и отбор мутантов, имеющих модифицированную способность связываться (сродство) к антигену МНС класса II, может быть проведено в соответствии с известными способами (см. Kappler et al., J. Exp. Med. 165 (1992) 387-396). См. также нашу экспериментальную часть.
Способность конъюгата связываться с Vβ цепью рецептора Т клетки, со структурой-мишенью и вызывать лизис клетки-мишени зависит, в частности, от пептида (SА)m)), который является производным от суперантигена, дубликата (Т) по биоспецифическому сродству и структуры и длины мостика (В). Квалифицированный работник способен оптимизировать конъюгаты по изобретению в отношении способности связываться и способности вызывать лизис путем изучения взаимоотношения между структурой и эффектом с помощью той модели, которая описана в соответствии с предыдущим знанием по конъюгатам суперантигена и антитела (см. вышеприведенные публикации). См. также экспериментальную часть ниже.
Первоначально предполагалось, что путем модификации способности связывать антиген МНС класса II, соотношение IC50 (SA(wt): IC50(SA(m)) составляет <0,9 (90%), такое как <0,5 (<50%) и возможно также <0,01 (<1%). В альтернативе, модифицированная способность связывания конъюгатов по изобретению может быть измерена в виде отношения констант диссоциации Kd (SA(wt): Кd (SA((m)), при Kd, измеренной в нМ и в том же пределе, как для соотношения IС50(SA(wt): IC50(SА(m)). Для определения IC50 (SA(wt)), IC50(SA(m)), Kd(SA(wt) и Кd(SА((m)) см. экспериментальную часть ниже.
Ранее было известно, что некоторые суперантигены могут иметь два или более участков, которые связывают антиген МНС класса 11 (Fraser et al., In: Superantigen: A patogens view on the immun system. bds. Huber & Palmer, Current Communications in Cell Molecular Biology
7 (1993) 7-29). Для этого типа суперантигенов способность связывания была бы модифицирована по крайней мере по одному из связывающих участков, например, в виде снижения вышеупомянутой способности. Вместе с модификацией суперантигена, это возможно достаточно, чтобы создать изменения в разнице в сродстве для двух участков связывания МНС класса II, экспериментально >10%, и предпочтительно путем снижения сродства по крайней мере одного участка.
Суперантигены связываются с Vβ цепями TCR различных подгрупп с различным сродством. В белках слияния/конъюгатах по изобретению, использованный суперантиген может быть модифицированным таким образом, чтобы проявить измененную специфичность подгруппы, или измененное сродство к одному или нескольким членам подгруппы. Имеются серьезные причины полагать, что существует параболическое взаимоотношение между сродством к Vβ ТСR и стимуляцией, посредством TCR, то есть умеренное сродство будет давать максимальную стимуляцию. Соответственно, подходящее сродство модифицированного суперантигена к Vβ ТСR, может быть близким, в такой же мере, как у сплавления белка/конъюгата, включающего модифицированный суперантиген, способное значительно стимулировать к делению покоящуюся популяцию Т клеток, представляющих, по существу, распределение всех подгрупп Vβ человека. Популяция Т клетки может быть накопленной из Т клеток от случайно выбранных человеческих индивидуумов. Это существенно означало, что стимуляцию возможно измерить. Результаты, представленные в Таблице II (правая колонка), в экспериментальной части отмечают, что способность вызывать SADCC у белков конъюгатов/слияния по изобретению часто, по существу, та же, что для слияния, включающего дикий тип суперантигена.
Основное использование белков конъюгатов/слияния по изобретению.
Конъюгаты согласно изобретению первоначально предназначались для лечения тех же заболеваний, что и конъюгаты между обычными суперантигенами и антителами. См. вышеупомянутые публикации. Таким образом, конъюгаты по изобретению могут быть введены либо в качестве основной терапии, либо в качестве адъювантной терапии при хирургическом вмешательстве, или совместно с другими препаратами.
Фармацевтическая композиция по изобретению включает составы, которые подобны известным в данной области, но теперь содержат наши новые конъюгаты. Таким образом, композиции могут быть в виде материала из лиофилизированных частичек, стерильного или асептического производственного раствора, таблеток, ампул и т.п. Могут присутствовать наполнители, такие как вода (предпочтительно, подведенная буфером до физиологического значения рН при помощи, например, РВS) или другой инертный твердый или жидкий материал. В целом, термины композиции представляют, полученные путем смешивания конъюгата с, растворения в, привязывания к, или составленные другим образом с одним или несколькими водорастворимыми или нерастворимыми в воде водными или неводными наполнителями, если необходимо, вместе с подходящими добавками и адъювантами. Обязательно необходимо, чтобы наполнители и кондиционеры не проявляли неблагоприятного воздействия на активность конъюгата. Вода, как и подобное, включается в понятие наполнитель.
Обычно, конъюгаты будут продаваться и вводиться в предварительно приготовленных дозировках, содержащих каждая эффективное количество конъюгата, которое основано на результатах, представленных в настоящее время, предположительно, в интервале 10-50 мкг. Точная доза варьируется от случая к случаю и зависит от веса пациента и возраста, пути введения, типа заболевания, антитела, суперантигена, пришивания (-В-) и т.п.
Пути введения являются широко известными в данной области, то есть, эффективное количество, лизирующее клетку-мишень, или терапевтически эффективное количество конъюгата по изобретению, контактирует с клетками-мишенями. Для назначений, отмеченных выше, это главным образом представляет парентеральное введение, такое как инъекция или инфузия (подкожно, внутривенно, внутриартериально внутримышечно) животному, такому как человек. Конъюгат может быть введен локально или системно.
Предполагается, что "эффективное количество, лизирующее клетку-мишень", является эффективным количеством для активации и направления Т-лимфоцитов на разрушение клетки-мишени.
В конце года приоритета было решено, что предпочтительным путем введения для белка конъюгата/слияния, содержащего немодифицированные суперантигены, является 3-часовая внутривенная инфузия в день, комбинированная с жаропонижающим агентом (парацетомол). Введение повторяется в течение 4 дней и прекращается перед появлением у пациента второго антитела к слитому белку/конъюгату. Данная схема дозировки, по-видимому, будет применима также для белков конъюгатов/слияния по настоящему изобретению.
Альтернативные области использования
Конъюгаты по изобретению могут также применяться для количественного и качественного определения структур, по отношению к которым направлены отыскивающие мишень группы (Т). В целом, данные способы являются хорошо известными для специалистов в данной области. Таким образом, модифицированный суперантиген может функционировать в качестве маркерной группы в иммуноопределениях, включая иммуногистохимические определения, поскольку маркерная группа, в свою очередь определяется, например, при помощи антитела, которое направлено по отношению к пептиду (SA(m)) и мечено ферментативно, изотопом, флуорофором или другими известными маркерными группами. Другой метод иммуноопределения определяет в клеточной популяции клетки, которые на своей поверхности экспрессируют структуру, способную связываться с группой, отыскивающей мишень (Т). Данное применение означает, что образец из клеточной популяции инкубируется вместе с Т-лимфоцитами и конъюгатами по настоящему изобретению, так же как и в SADСС определении. В случае, если инкубация приводит к лизису клеток, это показывает, что популяция содержит клетки, которые на своей поверхности экспрессируют структуру.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Получение рекомбинантных белков
Антитела
Экспериментальная работа вместе с изобретением первоначально была выполнена с моноклональным антителом С215 в качестве модельной субстанции. Данное антитело направлено против антигена из семейства GA-733 (см., например, ЕП 376746), цитируемые здесь ссылки и Larsson et al., Int. J. Canc. 32 (1988) 877-82). Эпитоп С215 оценивается как не достаточно специфический для лечения рака у человека. На дату приоритета, по экспериментальной оценке, mab C242 (Lindholm et al., WO 9301303) вместе со своим продуктом слияния с диким типом SЕА, по-видимому, был лучшим кандидатом.
Бактериальные штаммы и плазмиды
Для экспрессии и клонирования были использованы штаммы E. coli UL 635 (xyl-7, аrа-14, Т4R, ΔompT) и НВ101 (Boyer and Roulland-Dessoix, J. Mol. Biol. 41 (1969) 459-472) соответственно. Для экспрессии Fab-SEA белков слияния (производных от антитела мыши С215) был использован вектор рКР889 и для секреции SЕА (фиг.1) векторы рКР943 и рКР1055. Вектор рКР889 экспрессии Fab-SЕА идентичен рКР865 (Dohlsten et al., Proc. Natl. Acad. Sci. USA (1994) in press), за исключением того, что спейсером между СH 1 и SЕА является GIyGlyAlaAlaHis TyrGly. Экспрессия из рКР943 дает выход SЕА с природными аминокислотными остатками. Использование рКР1055 дает SЕА, обладающее добавленным Gly к аминоконцу. У обеих векторов для транскрипции и трансляции используют сигналы из стафилококкового белка А (Uhlen et al., J. Biol. Chem. 259 (1984) 1695-1702) и синтетический сигнальный пептид для секреции (L. Abrahmsen,, неопубликовано).
Мутагенез
Мутации, полученные при помощи реакции полимеразной цепи, проанализировали на Perkin Elmer Thermocycler. Реакционная смесь (100 мкл) содержала: 1•буфера РПЦ от Perkin Elmer Cetus (10 мМ Трис/HCl рН 8,3; 1,5 мМ MgCl2, 0,001% (вес/объем) желатин; и дополнительные 2 мМ МgСl2; 0,4 мМ dNТРS (Perkin Elmer Cetus): 2,5 единицы Ampli Tag ДНК полимеразы (Perkin Elmer Cetus, США) и 100 нг матрицы ДНК. Праймеры добавляли в конечной концентрации 0,8 мкМ. Оригинальная матрица представляла плазмиду, содержащую ген энтеротоксина А Staphylococcus aureus, идентичный к опубликованному Betley et al., (J. Bacteriol. 170 (1988) 34-41), за исключением того, что первый кодон (кодирующий Ser) заменен на ТСС для обставления сайта Ваm HI на 5' конце гена. Далее было использовано производное, содержащее несколько уникальных участков рестрикции ферментами, введенных путем покоящейся мутации. Мутации, введенные в окружение участков рестрикции, были получены путем одного набора праймеров, один из них охватывает мутацию и участок рестрикции. Для большинства мутаций должны были использовать два набора праймеров, и проводить реакцию полимеразной цепи в два последовательных этапа. Новый участок рестрикции ферментом был введен вместе с каждой мутацией для возможности легкой идентификации. Олигонуклеотиды, использованные в качестве праймеров, были синтезированы на Gene Assemble (Pharmacia Biotech AB, Sweden). Для подтверждения каждой мутации определяли родственную часть нуклеотидной последовательности на Applied Biosystems DNA-Sequenser, используя набор Taq Dye Deoxy Termination Sequencing Kit.
Получение белков и анализ
Клетки E. coli, содержащие конструкции различных генов, выращивали в течение ночи при комнатной температуре (Fab-SEA векторы) и при 34oС (векторы секреции, оптимум зависит от мутации). Питательная среда содержала 2•УТ (16 г Бакто триптона, 10 г/л дрожжевого Бакто экстракта, 5 г/л NаСl), дополненного канамицином (50 мг/л). Слияние белков индуцировали путем добавления изопропил-β-D-тиогалактозида в конечной концентрации 100 мкМ. (Промотор белка А, использованный в экспрессии не слитого SЕА являлся конституитивным). Клетки осаждали при 5000•g и содержимое периплазмы отделяли путем осторожного размораживания, ранее замороженного осадка клеток в Трис-НСl (рН 7,5), на льду при потряхивании в течение 1 часа. Экстракт периплазмы просветляли путем центрифугирования при 9500•g в течение 15 минут. Fab-SEA белки использовали без дальнейшей очистки. SEA и Glу-SЕА далее очищали путем аффинной хроматографии на колонке с анти-SЕА. Поликлональные анти-SЕА антитела кролика были ранее получены от кроликов, предварительно иммунизированных SЕА и очищали путем аффинной хроматографии на протеин GСефарозе® (Pharmacia Biotech).
Анализ белков
Белки разделяли на предварительно залитых полиакриламидных SDS Трис-Глицин гелях Novex (градиент 4-20%, или гомогенном 12%, новая экспериментальная технология Novex) и, либо прокрашивали Кумасси бриллиантовым синим, либо использовали в Western блоте. Поликолональные анти-SЕА антитела кролика (выше) использовали для определения SЕА в Western блот анализе после обработки антителами свиньи против Ig кролика и антителами кролика против пероксидазы хрена, и пероксидазой. Вместе с белками слияния Fab-SEA, использовали также конъюгированные при помощи пероксидазы хрена антитела крысы, распознающие каппа цепи (AAC 08P, Serotech Ltd, England). Для визуализации пероксидазы использовали 3,3-диаминобензидин (Sigma).
Спектры кругового дихроизма (КД) получали на J-720 спектрополяриметре (JASCO, Япония) при комнатной температуре (22-25oС) в 10 мМ фосфатном буфере, рН 8,2, в присутствтии 0,02 мМ ZnSO4 и 0,005% (объем/объем) Tween® 20. Скорость сканирования составляла 10 нм/мин, и каждый спектр представлял среднее из пяти последовательных сканирований. Длина пути ячейки составляла 1 мм и концентрация белка от 0,2 до 0,5 мг/мл. Денатурацию при равновесии гуанидин гидрохлоридом (Gdn-HCl) определяли при 23oС путем КД при 222 нм при концентрации белка 0,3 мг/мл и длине пути ячейки 1 мм. Эти данные использовали для расчета кажущейся Фракции развернутого белка (Fарр). Параметры равновесия развертывания выводили путем подбора данных для двухсайтового процесса складывания (Hurle et al., Biochemistry 29 (1990) 4410-4419.
СВЯЗЫВАНИЕ И ФУНКЦИОНАЛЬНЫЕ ИССЛЕДОВАНИЯ IN VITRO
Материалы
Реактивы: Использовали среду RPMI 1640, полученную от (Gibco, Middlesex, Англия. Среда имела рН 7,4 и содержала 2 мМ L-глютамина (Gibco, Middlesex, Англия), 0,01 М НЕРЕS (Biological Industries, Израиль), 1 мМ NаНСО3 (Biochrom AG, Германия), 0,1 мг/мл Гентамицин сульфата (Biological Industries Израиль), 1 мМ Nа-перувата (JRH Bioscences Industries, США), 0,05 мМ меркаптоэтанола (Sigma Co. , США), эссенциальные аминокислоты, концентрированные в 100 раз (Flow Laboratories, Шотландия), дополненные 10%-ной бычьей эмбриональной сывороткой (Gibco, Middlesex, Англия). Рекомбинантный SEA(wt), SEA(m) и продукты слияния С21Fаb-SEA(wt) и C21Fab-SЕА(m) получили как описано выше. Рекомбинантный IL-2 человека получен от Cetus Corp., США. Митомицин С получен от Sigma Co., США. Na2 51CrO4 получен от Merck, Германия. Физраствор на буфере (РВS) без магния и кальция получили от Imperial Англия.
Клетки: Линия клеток карциномы толстой кишки Соlо205 и клетки В лимфомы клеточной линии Raji получены от American Type Cell Culture Collection (Rockvill, MD, США ) (экспрессирующие HLA-DR23/w/10, -DР7, -Dqw1/w2). Лимфобластоидные В клетки линии ВSМ, трансформированные EBV представляли любезный дар Др. van Dе Griend, Dept, of Immunology, Dr. Daniel den Ноеd Cancer Centre, Leiden. Нидерланды. Клетки неоднократно проверяли на загрязнение микоплазмой при помощи Gen-Probe Mycoplasma Т. С. теста. Gen-Probe Inc., San Diego, США.
Линии Т клеток, активированных SEA, были получены путем активации моноядерных клеток из периферической крови. Кровь получали в виде кожистого слоя от доноров крови из Госпиталя Университета Лунда. Клетки РВМ стимулировали при концентрации 2•106 клеток/мл, обработанными митомицином С, покрытыми SЕА клетками ВSМ (проинкубированными с 100 нг/мл SЕА) в среде с 10% FСS. Линию Т клеток стимулировали повторно с двухнедельным интервалом рекомбинантным IL-2 человека 20 U/мл и еженедельно, обработанными митомицином С, покрытыми SEA клетками BSM. Линии клеток культивировали в течение 4-12 недель перед использованием в определении.
Жизнеспособность эффекторных клеток, согласно определению включения трипанового синего, превышало 50%.
Определение характеристик связывания МНС класса II дикого типа и мутанта SЕА.
Способы радиоактивного иодирования. Подходящие количества дикого типа или мутанта SЕА метили радиоактивностью от 10 до 25 мСi Nа125I, используя способ с лактопероксидазой и ферментом на подложке (NEN, Boston, MА). Реакцию останавливали при помощи гашения азидом натрия, и связанную с белком радиоактивность отделяли от свободного иода путем фильтрации через колонку РD-10 (Pharmacia Biotech АВ, Швеция) в среде R10 в качестве буфера элюции. Условия выбирали, чтобы получить стехиометрическое соотношение между иодом-125 и белком ≤2:1. Радиохимическую чистоту подтверждали путем эксклюзионной ЖХВР хроматографии по размеру на колонке ТSК SW 3000. Влияние радиоиодирования на связывающую активность тестировали только для дикого типа SЕА и изменения не обнаружили (данные не представлены).
Прямое определение связывания. Клетки Raji. 6•104/100 мкл, предварительно культивированные в среде R10, добавляли в конические полипропиленовые пробирки и инкубировали (22oС/45 мин) в трипликатах со 100 мкл/на пробирку, серийно разбавленного меченного 125I дикого типа или мутанта SЕА. Клетки промывали 2 мл 1% (вес/объем) бычьим сывороточным альбумином (ВSА) в 10 мМ физрастворе на фосфатном буфере (РВS), рН 7,4, центрифугировали при 300•g в течение 5 минут и аспирировали. Данную процедуру повторяли дважды. В конце клетки анализировали на связанную с клетками радиоактивность в гамма счетчике (Packard Instruments Co., Downers Grove, IL, США). Кажущуюся константу диссоциации, kd, и количество участков связывания, N, при насыщении определяли по Скэтчарду (Scatchard, Ann. N.Y. Acad. Sci. (1949) 660-72), после вычитания неспецифического связывания (т.е. связывания после инкубации только в среде R10).
Определение ингибирования (ингибирование связывания 125I-меченного дикого типа SEA мутантами SEA). Данные эксперименты по ингибированию проводили как описано для определения прямого связывания с небольшими модификациями. В кратком виде, 50 мкл 125I-меченного дикого типа SЕА оставляли конкурировать с избытком немеченного дикого типа или мутанта SЕА (50 мкл/пробирку) для связывания с 6•104/100 мкл клеток Raji. Для получения максимальной чувствительности в исследовании ингибирования использовали следовые концентрации, дающие ≈40% связавшейся радиоактивности от прямого определения. Эффективность вытеснения конкурента выражали в виде концентрации, дающей 50%-ное ингибирование (IС50) связавшейся радиоактивности. Сродство связывания мутантов по отношению к дикому типу SЕА рассчитывали, используя уравнение
IC50(SEA(wt)):IС50(SЕА(m))
Для того, чтобы проанализировать, действительно ли мутанты конкурируют за связывание с тем же участком на клетках Raji, как и дикий тип SЕА, данные по связыванию, полученные с мутантами SЕА, выражали графически в виде двойной логарифмической функции и исследовали на параллельность с соответствующими данными для дикого типа SEA.
Определение ингибирования (ингибирование связывания меченного флуоресцентной меткой SЕА дикого типа под действием немеченного SЕА дикого типа и мутантов SЕА). Клетки Raji. (2.5•105) инкубировали с ингибитором (диким типом или мутантом SEA; 0-6000 нМ), разведенным в 50 мкл СО2-независимой среды (Gibco) дополненной 10% FСS, глютамином и гентамицином при 37oС в течение 30 минут. Добавляли флуоресцеин, конъюгированный с диким типом SЕА в конечной концентрации 30 нМ и образцы инкубировали дополнительные полчаса при 37oС. Образцы промывали три раза ледяным РВS, дополненным 1% ВSА (РВS-ВSА) и окончательно выдерживали в 0,4 мл РВS-ВSА во льду до анализа. Из каждого образца анализировали 10 000 живых клеток по зеленой флуоресценции на FACStar (Becton Dickinson) проточном цитометре и рассчитывали среднее значение флуоресценции, используя программу LYSIS II.
Определение SDCC и SADCC SЕА(wt), SЕА(m) и их белков слияния при помощи С21Fаb.
Определение SDСС. Анализировали цитотоксичность SEA (wt), SЕА(m) и их белков слияния при помощи С21Fаb по отношению МНС класса II+ клеток Raji в обычном исследовании высвобождения 51Сr3+, используя стимулированную in vitro SEA-специфическую линию Т клеток в качестве эффекторных клеток. В кратком виде, клетки Raji, меченные 51Сr, инкубировали в количестве 2,5•103 клеток на 0,2 мл среды (RPMI, 10% FCS) в микротитровальных ячейках при определенном соотношении эффектора для клетки-мишени, в присутствии или отсутствии (контроль) добавок. Рассчитывали процент специфической цитотоксичности в виде 100•([счет в мин, высвобождение в эксперименте - счет в мин, фоновое высвобождение] /[счет в мин, общее высвобождение - счет в мин, фоновое высвобождение] ). Соотношение эффекторов к клеткам составляло 30:1 для неслитых белков и 40:1 для белков слияния.
SАDСС против клеток рака толстой кишки человека
Анализировали цитотоксичность C21Fab-SEA(wt), С21Fаb-SЕА(m), SЕА(wt) и мутантов SЕА по отношению к С215+ МНС класса II клеток карциномы толстой кишки SW 620 в обычных условиях в течение 4 часов по определению выхода 51Сr3+, используя стимулированную in vitro под действием SEA, линию Т клеток в качестве эффекторных клеток. В кратком виде, клетки, SW 620, меченные 51Сr3+, инкубировали в количестве 2,5•103 клеток на 0,2 мл среды (RPMI, 10% FCS) в микротитровальных ячейках при соотношении эффектора к клеткам-мишеням 30: 1 в присутствии или отсутствие (контроль) добавок. Процент специфической цитотоксичности рассчитывали так же, как и для определения SD СС.
ФУНКЦИОНАЛЬНЫЕ ЭКСПЕРИМЕНТЫ IN VIV0
Опухолевые клетки. Клетки меланомы B16-F10, трансфецированные кДНК, кодирующей ассоциированный антиген рака человека С215 (В16-С215) (Dohlsten et al., Monoclonal antibody - Superantigen fusion proteins: Tumor specific agents for T cell based tumor therapy; Proc. Natl. Acad. Sci. USA, In press, 1994), выращивали в виде налипших клеток до субконфлуентности. Культуральная среда состояла из RPMI 1640 (GIBCO, Middlesex, UK), дополненной 5•10-5 М β-меркаптоэтанолом (Sigma, St Louis, MO США), 2 мМ L-глютамина (GlBCO), 0,01 Нереs (Biological Industries, Израиль) и 10% эмбриональной сывороткой теленка (GlBCO). Клетки снимали путем быстрой инкубации в 0,02% ЭДТА и суспендировали в ледяном физрастворе на фосфатном буфере с 1% сывороткой сингенных мышей (наполнитель) в концентрации 4•105 клеток/мл.
Животные и лечение животных. Мыши, возрастом 12-19 недель, являлись трансгенными мышами С57В1/6 по Vβ 3 цепи рецептора Т клеток (Dohlsten et al. , Immunology 79 (1993) 520-527). Внутривенно в хвостовую вену инъецировали сто тысяч опухолевых клеток В16-С215 в 0,2 мл наполнителя. На 1, 2 и 3 дни мыши получали при внутривенной инъекции C215Fab-SEA(wt) или C215Fab-SЕА (D 227А) в 0,2 мл наполнителя в дозах, отмеченных на фиг. 5. Контрольные мыши получали только наполнитель согласно той же схеме. На 21 день после инъекции опухолевых клеток, мышей забивали путем смещения шейных позвонков, извлекали легкие и фиксировали в растворе Bouin, подсчитывали количество метастазов в легких.
РЕЗУЛЬТАТЫ
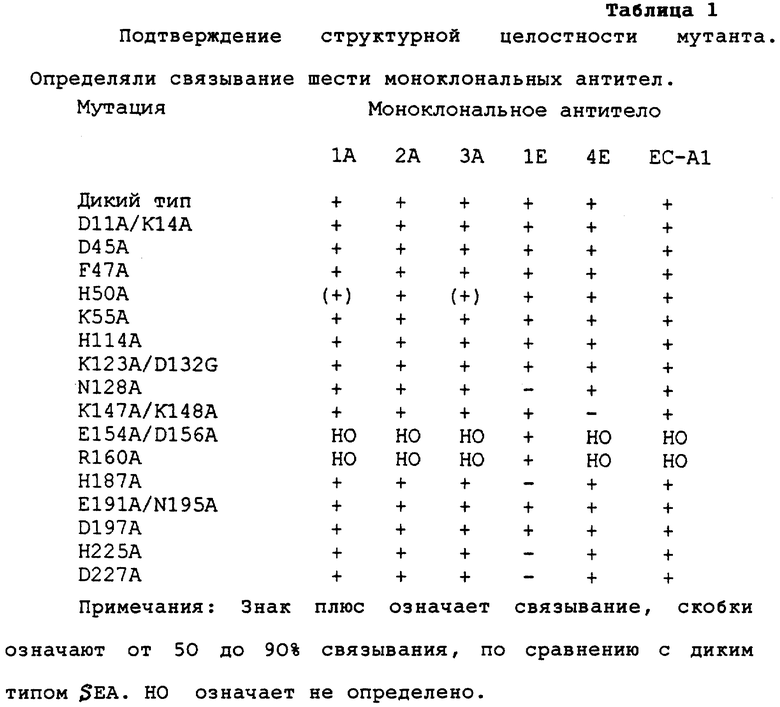
"Сканирование аланина" в стафилококковом энтеротоксине А.
Первоначально структура SЕА была неизвестна и можно было только делать спекуляции в том, какие боковые цепи доступны на поверхности. Следовательно, большинство мутантов, выбрали из линейно расположенных гомологичных суперантигенов (Marrack and Kappler, Science 248 (1990) 705-711). Чтобы некоторые из тех суперантигенов предположительно связывались с HLA-DR консервативным образом, по традиции выбирали консервативные (в основном полярные) остатки, (Chitagumpala et al., J. Immunol. 147 (1991) 3876-3881). Замещения на аланин использовали в соответствии с опубликованной стратегией (Cunnigham and Wells, Science 244 (1988) 1081-1085). В процессе выполнения настоящей работы появилась доступная информация:
i) было показано, что ион Zn2+ является важным для взаимодействия между SEА и МНС классом II (HLA-DR) (Fraser et al., Proc. Natl. Acad. Sci. USA 89 (1991) 5507-5511),
ii) был представлен множественный анализ энтеротоксина В стафилококка (SЕВ) (Kappler et al., J. Exp. Med. 175 (1992) 387-396),
iii) представлена структура SЕВ (Swaminathan et al., Nature 359 (1992) 801-806).
Было обнаружено, что наш первый мутант, проявляющий серьезно пониженное сродство к HLA-DR, D227A очень плохо образует координатную связь с Zn2+ (данные не представлены). Учитывая полную укладку SЕА и, SЕВ, новые данные предполагают две области связывания МНС класса II; одна включает ион Zn2+, и одна соответствует участку, определенному у SЕВ. На основе данного предположения был получен второй набор мутантов. Этот второй набор мутантов экспрессировали в виде SEA, несущего глицин, добавленный к амино концу. Сначала было показано, что расширение не имеет влияния на связывающие свойства дикого типа SEA (следующий раздел).
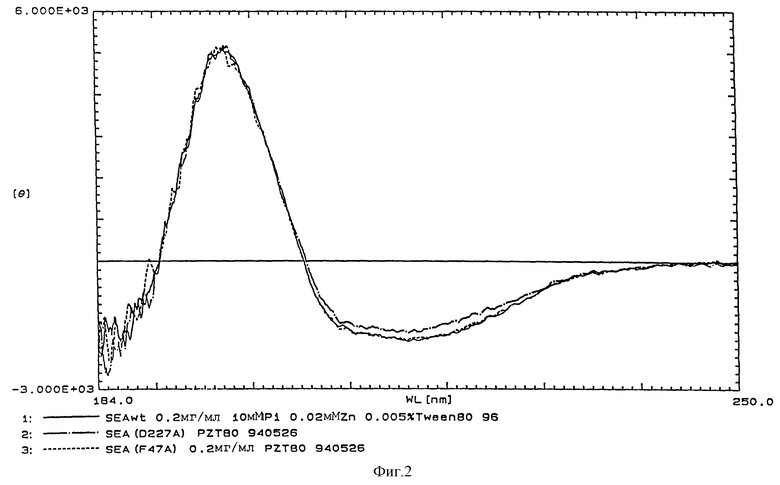
Большинство мутантов экспрессировались и секретировались E. coli в функциональном виде, что определяли по данным анализа связывания моноклональных антител (Таблица I). Были получены очень небольшие количества мутантов Е154А/ D156А и R160A. Они были последовательно исключены из исследования. Мутанты, обладающие замещением на Ала по остаткам 128, 187, 225 или 227 не различались моноклональным антителом 1Е. Последние два мутанта, проявляющие пониженный уровень экспрессии (более выраженный при 34oС, чем при 24oС) мигрировали быстрее при SDS-PAGE электрофорезе в денатурирующих, но не восстанавливающих условиях (все другие мутанты мигрировали как дикий тип SЕА, данные не представлены). При оценке анализа КД спектра, структура D227А могла немного отличаться от нативного SЕА (фиг.2), но стабильность была очень близка к дикому типу SEA (определяли по устойчивости к денатурации гуанидинхлоридом). Рассчитанная ΔΔG между мутантом и нативным SЕА (SЕА(wt)) составляла 0,16 ккал/моль, что составляет только около 4% от значений ΔG° (данные не представлены). В целом, все сигналы при КД анализе были очень низкими, как ожидается, преимущественно, от β-складчатой структуры. Недавно было доложено, что His 225 координирует Zn2+ (неопубликованные данные в работе Fraser et al., (Proc. Natl. Acad. Sci. USA 89 (1991) 5507-5511).
Поскольку Asp 227 участвует в координатной связи Zn2+ (выше) и предположительно расположен в той же β-складчатой структуре, как и His 225, это предполагает, что данных два остатка составляют цинк-связывающие ядра, обнаруженные в белках с цинк-координирующими структурами (Vallee and Alud, Biochemistry, 29 (1990) 5647-5659).
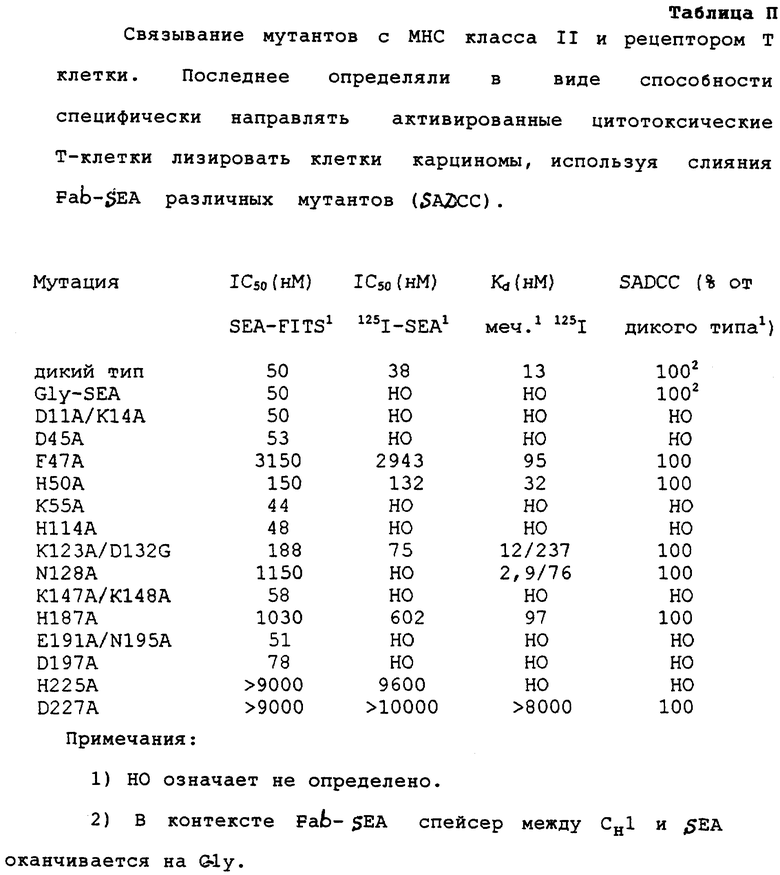
Связывание с МНС классом II и рецептором Т клетки
Сродство МНС класса II рассчитывали из количества, требующегося для конкуренции с меченным флуоресцеином SЕА дикого типа для клетки Raji, проявляющей большое количество МНС класса II. Способность вытеснения для мутанта рассчитывали из концентрации, дающей 50% ингибирования (IС50), связанной флуоресцентной метки, по сравнению с концентрацией, требующейся для, SEA дикого типа, в качестве конкурента. Для SЕА дикого типа и некоторых мутантов сравнивали результаты данного анализа с результатами, где использовали меченный 125I SЕА дикого типа, в качестве следового количества. Как можно видеть из Таблицы II, значения, полученные из этих двух анализов ингибирования, хорошо коррелируют.
Было определено прямое связывание МНС класса II для шести выбранных мутантов, используя 125I-меченный мутант SЕА (Таблица II). Для мутанта Н50А значения, полученные из прямого определения связывания и определения ингибирования коррелируют хорошо, однако с мутантом F47А было обнаружено большое расхождение: непосредственное связывание показывает только в 7 раз более слабое связывание, чем для дикого типа SЕА, но оба конкурентных анализа показывают, около, в 70 раз пониженное связывание. Данные двух из других мутантов показывают два различных типа взаимодействий при связывании. Для мутантов Н225А и Д227А в тех же определениях сродство было ниже, чем предел определения.
Ранее мы показали, что белки слияния, состоящие из Fab фрагмента реактивного к карциноме антитела и SЕА, могут быть использованы для направления цитотоксического действия Т клеток на специфический лизис раковых клеток, несмотря на то, что взаимодействие между SEA и рецептором Т клетки (TCR) являлось слишком слабым, чтобы быть зарегистрированным само по себе (Dohlsten et al. , Proc. Natl. Acad. Sci. USA в печати). Таким образом, в противоположность к анализам, включающим контекст выделенного суперантигена слияния Fab, позволяет проводить функциональное определение для взаимоедйствия между SЕА и TCR, независимо от связывания МНС класса II. Соответственно, эффективность различных конъюгатов непосредственно направлять Т клетки на лизис клеток, распознаваемых по Fab остатку, определяли по выходу хрома. Данный анализ подтверждает, что мутации, проявляющие воздействие на связывание МНС класса II, не влияют на связывание TCR (Таблица II).
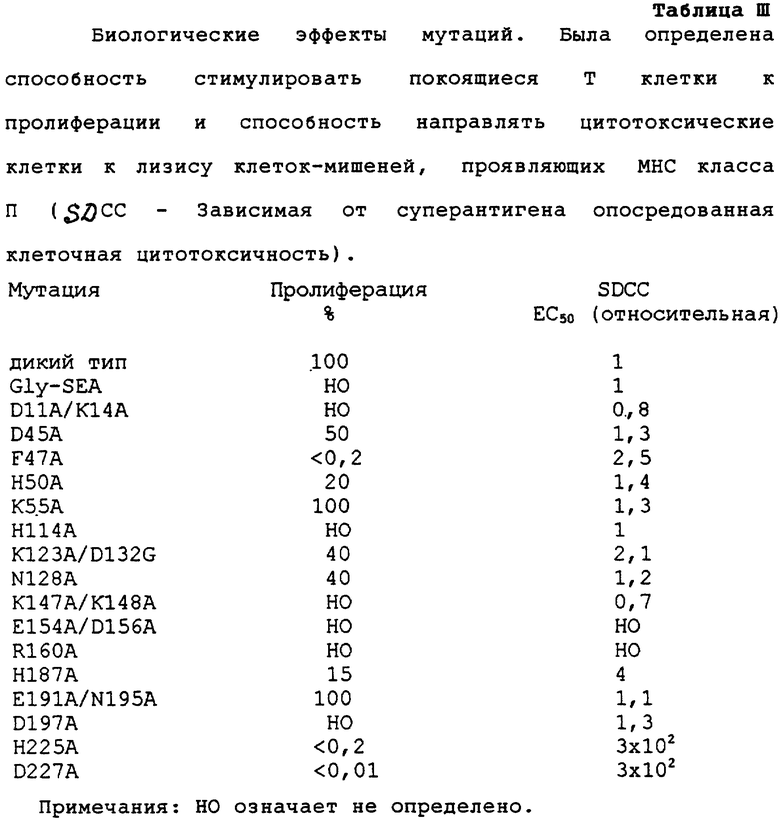
Биологические эффекты мутаций
Пролиферативное действие было определено в виде способности стимулировать периферические лимфоциты к делению. Все три мутанта, которые очень слабо конкурировали за МНС класс II, индуцировали слабую пролиферацию, или не вызывали ее, а промежуточный мутант Н187А проявлял некоторую пролиферативную способность, тогда как другие исследованные мутанты были неразличимы от дикого типа (Tаблица III). Harris et al. (Infect. Immun. 61 (1993) 3175-3183) недавно доложил о сходной сильной редукции стимуляторной активности Т клетки для мутантов SЕА F47G и L48G. Очевидно, сильная редукция в любой из двух предполагаемых областей связывания приводит к сильному воздействию на способность индуцировать пролиферацию. Это предполагает, что SЕА перекрестно сшивает две молекулы МНС класса II, приводя к димеризации ТСД, и что это является необходимым для получения сигнала трансдукции.
В отличие от эффективности различных мутантов по направлению, стимулированных in vitro под действием SEA Т клеток, к лизису клеток-мишеней, обладающих МНС класса II, скорее наблюдается корреляция со сродством связывания, чем со способностью конкурировать (Таблица III). Например, эффективности F47A и D48А являются пониженными только в 2,5 раза и 300 раз соответственно. Таким образом, здесь, очевидно, также нет неотъемлемого требования для двухвалентности.
Увеличение в мультивалентности, являющееся результатом значительно большего количества ТSR на поверхности активированной Т клетки, возможно, частично экранирует эффект низкой способности взаимодействия SЕА/МНС класса II. Путем использования специфических бифункциональных антител карциномы, содержащих один анти-СD3 остаток и один антикарциномный остаток, ранее было показано, что данная димеризация не является необходимой для непосредственной цитотоксичности Т клетки (Renner et al., Science 264 (1994) 833-35).
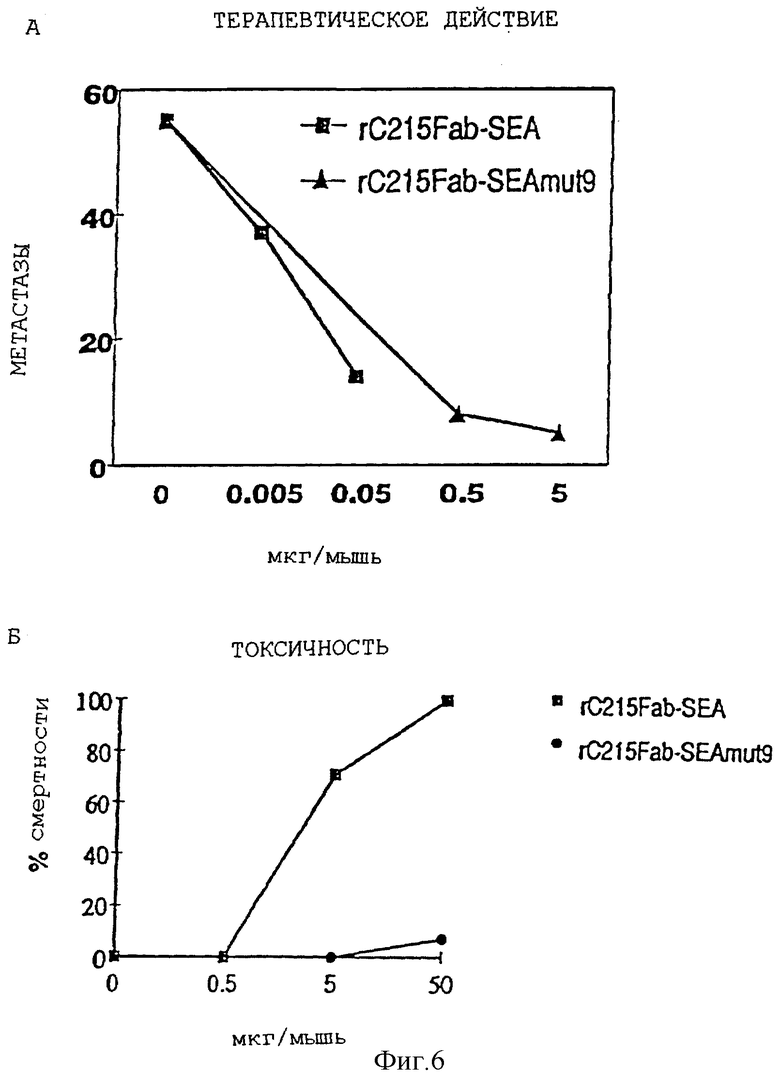
Функциональные эксперименты in vivo: Результаты представлены на фиг. 6А и 6Б. Лечение мышей C21Fab-SEA(wt) и C21Fab- SEA (D227А) по понижению количества метастазов в легких клеток В16-С215 меланомы являлось высокоэффективным. Терапевтическое действие, по существу, было идентичным для двух вариантов целевых суперантигенов. Лечение С21Fаb-SЕА(wt) приводило к 70% летальности в дозах 5 мкг/инъекцию. В противоположность этому, смертность мышей в тех же дозах при применении C21Fab-SEA (D5227А) не было. Рассматривая вместе, SЕА(D227А) является примером мутанта с пониженной токсичностью и сохраненной терапевтической эффективностью при включении в Fаb-SEA белок слияния.
ДИСКУССИЯ
Недавно была доложена структура комплекса между SЕВ и HLA-DR (Jardetzky et al., Nature 368 (1994) 711-718). Большинство идентифицированных остатков SЕВ, участвующих в данном взаимодействии являются консервативными в SЕА. Наши данные по мутанту D227А показывают слабое сродство взаимодействия между данным участком в SЕА (амино концевой участок) и МНС классом II, имеющим значение kd выше 8 мкМ. Недавно было доложено, что kd взаимодействия между SЕВ и HLA-DR. составляет 1,7 мкМ (Seth et al., Nature (1994) 324-27). Были исследованы различия во взаимодействии между SЕВ, TCR и HLA-DR и было показано, что комплекс между SEB и HLA-DR, не являлся стабильно поддерживаемым в отсутствие ТСR. Эксперименты по плазмоновому (рентгеновскому) резонансу показывают, что это происходило из-за очень быстрой скорости распада. Полученные эффекты захвата, если SЕА перекрестно пришивает две молекулы МНС класса II, вслед за последовательной полимеризацией TCR, могли бы объяснить, каким образом SЕА может индуцировать пролиферативное действие при концентрациях, много ниже kd. Учитывая, что мутация F47A снижает сродство амино концевого участка ниже значимого, Кd участка с Zn2+ составляет около 95 нМ. Данная гипотеза недавно была подтверждена наблюдением, что мутанты F47R, F47R/H50A и F47R/L48A/H50D проявляют идентичное сродство к МНС класса II, так же как и F47A (неопубликовано).
Основываясь на структуре SEB (Kappler et al., J. Exp. Med. 175 (1992) 387-396) и на линейной гомологии (Marrack and Kappler, Science 248 (1990) 705-711), строго подтверждается, что Нis 225 и Аsр227 расположены в той же β-складке и, таким образом, цепи должны быть проксимальными. Следовательно, наиболее вероятно, что эти два остатка составляют цинк-связывающее ядро, обнаруженное в цинк-координирующих белках (Vallee and Auld, Biochemistry, 29 (1990) 5647-5659). Подобно данным мутантам, мутанты с заменами по остаткам 128 и 187 также являются распознаваемыми всеми моноклонами, за исключением 1Е. Fraser et al., (Proc. Natl. Acad. Sci. USA 89 (1991) 5507-5511) показали, что Zn2+ связывается с SЕА и требуется для высокоаффинного взаимодействия с МНС класса II. Сродство для цинка не изменяется путем добавления HLA-DR. Основываясь на данном наблюдении и высоком сродстве к Zn2+ (Kd около 1 мкМ) было предположено, что координатная связь обеспечивается исключительно SЕА и включает 4 координатных складки. Наши данные отмечают участие четырех остатков N128, Н187, Н225 и D227. Функции двух бывших остатков не ясны; за исключением обеспечения возможной помощи лиганда N128 в депротонировании D227. Одним из аргументов в пользу этого является то, что влияние замены D227 более серьезное, чем замены Н225.
Ранее было доложено, что корреляция между сродством различных суперантигенов к МНС класса II и способностью стимулировать Т клетки к пролиферации отсутствует (Chintagumpala et al., J. Immunol. 147 (1991) 3876-3881). Эти данные возможно частично объясняются различным сродством суперантигенов по отношению к различным Vβ-цепям TCR. Здесь нами обнаружено такое же отсутствие корреляции, но в отличие от отдельных суперантигенов, мутанты проявляют идентичное сродство к ТСR, как показано в контексте Fab-SЕА (определяемого в виде SАDСС). Наиболее вероятным объяснением отсутствия корреляции является то, что две связывающие области, идентифицированные в данном анализе, представляют два различных участка связывания, которые обеспечивают не только кооперативное связывание, но которые приводят к перекрестному сшиванию двух молекул МНС класса II, который, в свою очередь, обеспечивает димеризацию двух молекул рецептора Т клетки. Это означало бы, что сродство обеих участков является важным для получения пролиферативного эффекта. Взаимодействия внутри гексамерного комплекса, включающего две молекулы SЕА, TCR и МНС класса II, приводят к высокой захватываемости. Таким образом, сильное средство/захватываемость SEA по отношению к МНС класса II, дает возможность взаимодействия SЕА с ТСR, несмотря на низкое непосредственное сродство.
Другие дубликаты биоспецифического сродства: Белок слияния SЕА(D227А) и IgG-связывающего домена белка А стафилококка был получен путем рекомбинантной технологии и экспрессируется в E. coli. Данный реактив успешно применяли для нацеливания Т-лимфоцитов на клетки Моt 4 и CCRF-CEM (полученные из АТСС), которые являются CD7 и СD38 позитивными, но HLA-DP, -DQ и -DR негативными. Клетки Моt 4 и CCRF-CEM преинкубировали с анти-СD7 или анти-СD38 моноклонами мыши (Dianova, Hamburg Германия). Для того чтобы усилить связывание между моноклонами мыши и IgG-связывающей частью белка слияния, было также добавлено антитело кролика против Ig мыши.
По сравнению с белком А-SЕА(wt), белок А-SЕА(D 227А) имеет пониженную способность связываться с клетками Daudi, экспрессирующими антиген МНС класса II.
Общее к чертежам : Мутант SЕА(D227А) (=SЕА(m9), или мутант m 9) ко времени даты приоритета был наиболее многообещающим вариантом SЕА. Таким образом, мы отбирали для представления результаты in vitro и in vivo с данным вариантом (фиг. 3-6).
Фиг. 1 представляет схематическое изображение плазмиды, используемой для экспрессии SЕА и C21Fab-SEA. Кодирующие области и два транскрипционных терминатора, следующие за продуктами генов, отмечены прямоугольниками. Ген, кодирующий белок устойчивости к канамицину, отмечен Кm. lacI представляет репрессор гена lac. VH и СH1 отмечают гены, кодирующие Fd фрагмент тяжелой цепи антигена мыши С215. Подобно Vк и Ск отмечают гены, кодирующие каппа цепь. Rop представляет ген, кодирующий белок контроля репликации из рВ322. Промотеры, направляющие транскрипцию продукта генов показаны стрелками, в рК889 промотор trc и в других двух векторах промотор белка A стафилококка (sра). Область, содержащая природу репликации, отмечена ori. Различием между SЕА, кодирующим рКР943 и рКР1055, является только глициновый остаток, добавленный к Н-концу последнего. Ген SЕА, содержащий последний вектор, также содержит несколько уникальных участков для рестрикционных ферментов, введенных путем молчащих мутаций.
Фиг. 2 представляет спектр кругового дихроизма SЕА дикого типа и мутантов F47A и D227А, представляющих мутации с наиболее серьезными редукциями в области связывания каждого МНС класса II. Сплошная линия представляет кривую для дикого типа SЕА. Кривые для мутантов представлены пунктирной или штрихпунктирной линиями для Р47А и D227А соответственно.
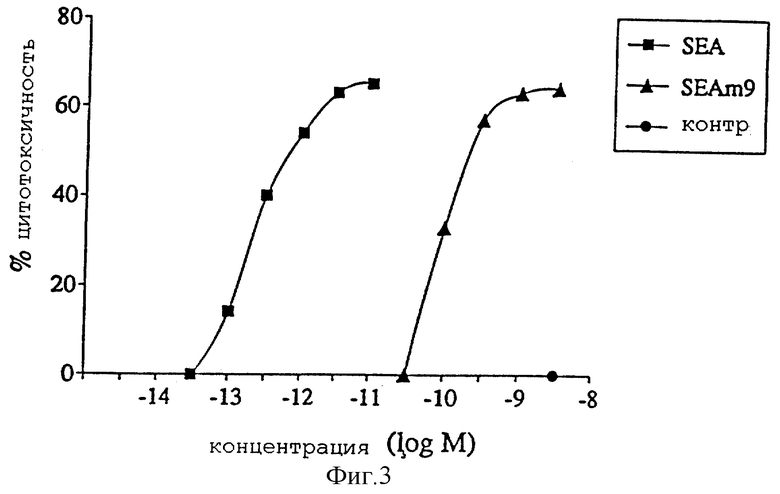
Фиг. 3 представляет концентрационную зависимость суперантиген-зависимой опосредованной клеточной цитотоксичности (SDСС) для SЕА(wt) и SEA(D227A).
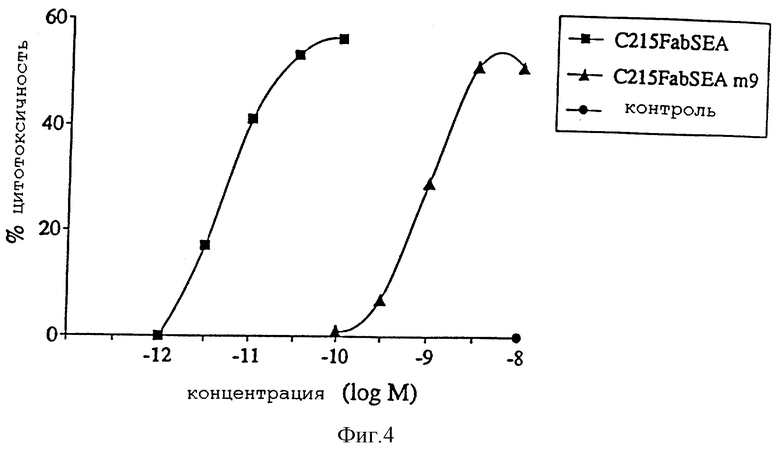
Фиг. 4 представляет концентрационную зависимость суперантиген-зависимой опосредованной клеточной цитотоксичности (SDСС) для C21Fab-SEA(wt) и C21Fab-SEA (D 227А).
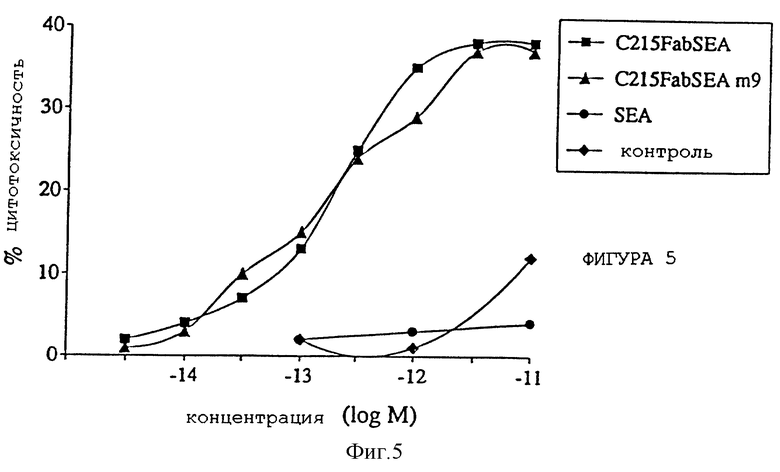
Фиг. 5 представляет концентрационную зависимость суперантиген mab-зависимой опосредованной клеточной цитотоксичности (SADCC) для C215Fab-SEA(wt) и С215Fаb-SЕА(D227А).
Фиг. 6А представляет сравнение терапевтического действия, полученного на С57В1/6 мышах, несущих легочные метастазы клеток меланомы В16-С215 при лечении с C215Fab-SEA(wt) и С215Fаb-SЕА(D227А).
Фиг. 6Б представляет токсическое действие С215-SEA(wt) и С215-SЕА(D227А) при лечении, как представлено на фиг. 6А.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОНЪЮГАТ, ОБЛАДАЮЩИЙ СПОСОБНОСТЬЮ АКТИВИРОВАТЬ ИММУННУЮ СИСТЕМУ, И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ВКЛЮЧАЮЩАЯ УКАЗАННЫЙ КОНЪЮГАТ | 1997 |
|
RU2198895C2 |
| НОВЫЙ БИОТЕХНОЛОГИЧЕСКИ СОЗДАННЫЙ СУПЕРАНТИГЕН ДЛЯ ЛЕЧЕНИЯ ЧЕЛОВЕКА | 2002 |
|
RU2307837C2 |
| РАСТВОРИМЫЙ КОНЪЮГАТ АНТИТЕЛА, СПОСОБ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКОГО ЗАБОЛЕВАНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1991 |
|
RU2125889C1 |
| АНТИТЕЛА К АНТИГЕНУ ЭПИТЕЛИАЛЬНЫХ ОПУХОЛЕЙ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА ЧЕЛОВЕКА, РОДСТВЕННОМУ АЛЬФА 6 БЕТА 4 ИНТЕГРИНУ | 2000 |
|
RU2266298C2 |
| ПЕПТИДЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 1994 |
|
RU2146262C1 |
| НОВОЕ АНТИТЕЛО СО СПЕЦИФИЧНОСТЬЮ К ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ ТОЛСТОЙ КИШКИ | 2001 |
|
RU2268068C2 |
| ПРИМЕНЕНИЕ α-МЕТИЛ-п-ТИРОЗИНА ДЛЯ ИНГИБИРОВАНИЯ ПРОДУЦИРОВАНИЯ МЕЛАНИНА В МЕЛАНОЦИТАХ РАДУЖНОЙ ОБОЛОЧКИ | 1998 |
|
RU2218159C2 |
| КОНЪЮГАТЫ АФФИННАЯ МОЛЕКУЛА-ОЛИГОНУКЛЕОТИД И ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2763554C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА И ИХ ИСПОЛЬЗОВАНИЕ | 1994 |
|
RU2139934C1 |
| Fc-ВАРИАНТЫ С ИЗМЕНЕННЫМ СВЯЗЫВАНИЕМ С FcRn | 2005 |
|
RU2412200C2 |
Конъюгат для стимулирования иммунной реакции против клетки-мишени содержит моноклональное антитело С215, моноклональное антитело С242 или их антиген - связывающие фрагменты и стафилококковый энтеротоксин А (SEA). Последний содержит мутацию D 227 A, проявляет пониженную способность к связыванию с антигенами МНС класса II по сравнению с нативным SEA, сохраняет способность к связыванию с Vβ Т-клеточного рецептора. Коньюгат получен с помощью рекомбинантных методик. Лечение злокачественных опухолей у млекопитающего проводится за счет введения терапевтически эффективного количества конъюгата. Изобретение позволяет повысить способность связываться с антигенами МНС класса II клеток млекопитающих. 2 c.п.ф-лы, 6 ил., 3 табл.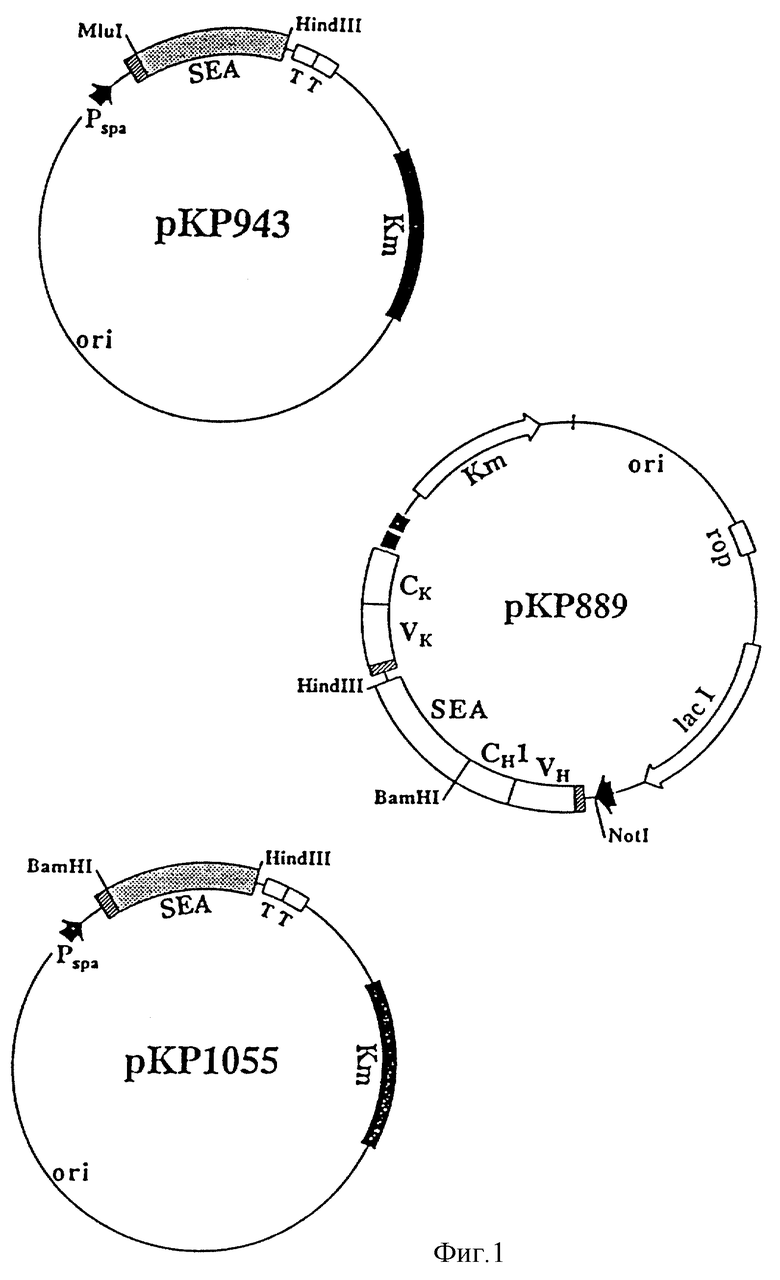
| WO 9201470 A1, 06.02.1992 | |||
| WO 9324136 A1, 09.12.1993 | |||
| Способ получения противоопухолевого средства | 1981 |
|
SU1304736A3 |
Авторы
Даты
2002-06-10—Публикация
1995-06-07—Подача