Изобретение относится к области биотехнологии, а именно к получению биологически активных веществ из микроорганизмов.
Уже более ста лет ведутся работы по поиску эффективных средств профилактики, лечения и выявления бруцеллезной инфекции, однако до сих пор нет надежных профилактических и диагностических средств при бруцеллезе.
Применяемые в настоящее время живые аттенуированные вакцины или инактивированные вызывают развитие патологических симптомов, весьма похожих на клинику заболевания. Тоже относится и к выделяемым в настоящее время антигенам.
Известны методы получения бруцеллезных антигенов путем экстракции их из бактериальной массы химическими реагентами фенолом [1, 2], эфиром [3, 4], трихлоруксусной кислотой [5] . Эти антигены наряду с невысокой иммуногенностью вызывают ряд нежелательных явлений, таких как индукция S-антител и сенсибилизация организма.
Наиболее близким методом получения антигена, который следует взять за ближайший аналог, является метод получения бруцеллезного антигена, включающий накопление бактериальной массы, получение из нее ацетонового порошка, уксуснокислый гидролиз этого порошка при 100oС, отделение гидролизованной бакмассы от супернатанта и высаживание антигена этиловым спиртом на холоду [6] . Получаемый антиген представляет собой комплекс веществ поверхностного слоя клеточной стенки и содержит в своем составе сахара, белок, липиды, нуклеиновые кислоты и фосфаты [7]. Однако данный антиген обладает способностью вызывать синтез S-антител и сенсибилизацию организма.
Технический результат изобретения заключается в получении протективного внеклеточного антигена бруцелл, не вызывающего реакции гиперчувствительности замедленного типа и синтез антител к S- и R-антигенам бруцелл и способного провоцировать скрытые формы бруцеллеза.
Предлагаемый способ заключается в том, что бруцелл культивируют в жидкой питательной среде. Культивирование ведут в течение 6-8 часов на стационарной фазе роста при перемешивании и аэрации. рН среды в процессе культивирования может колебаться в пределах от 5,0-7,0. После окончания культивирования бактериальную массу отделяют, а из культуральной жидкости получают после очистки целевой продукт, представляющий собой вещество, в котором определяются сахара до 60% (определяемые по Дюбуа [8]), белки до 20% (определяемые по Лоури [9] ) и нуклеотиды до 10% (определяемые спектрофотометрическим методом [10] ) с молекулярной массой менее 30 кД, содержащий в своем составе аминогруппы (определяемые тринитробензолсульфокислотным методом [11]). Полученный антиген в диапазоне волн от 250-265 имеет максимальный пик поглощения.
Патент иллюстрируется следующими примерами:
Пример 1. Двухсуточную матричную культуру вакцинного штамма Вr. abortus 19, смытую с 2 матр, помещают в реактор с 1000 мл мясопептонно-печоночного-глюкозо-глицеринового бульона с рН 7,0 и культивируют в течение 18 часов при постоянном перемешивании и аэрации. Через 8 часов после достижения стационарной фазы роста и концентрации 40-50 млрд микробных клеток в одном мл бактериальную массу отделяют центрифугированием. Полученный супернатант дополнительно подвергают фильтрации через бактериальный фильтр. Обеззараженный супернатант лиофилизируют при общепринятых режимах. Высушенный препарат растворяют в 50 мл дистиллированной воды и в него вливают 150 мл охлажденного до 4oС этанола. Смесь культуральной жидкости и этанола выдерживают в течение 16 часов при температуре 4oС. Выпавший осадок отделяют от жидкой фазы центрифугированием при 5 тыс. g в течение 20 минут. Полученный осадок растворяют в дистиллированной воде. Из полученного раствора методом гель-фильтрации выделяют целевой продукт.
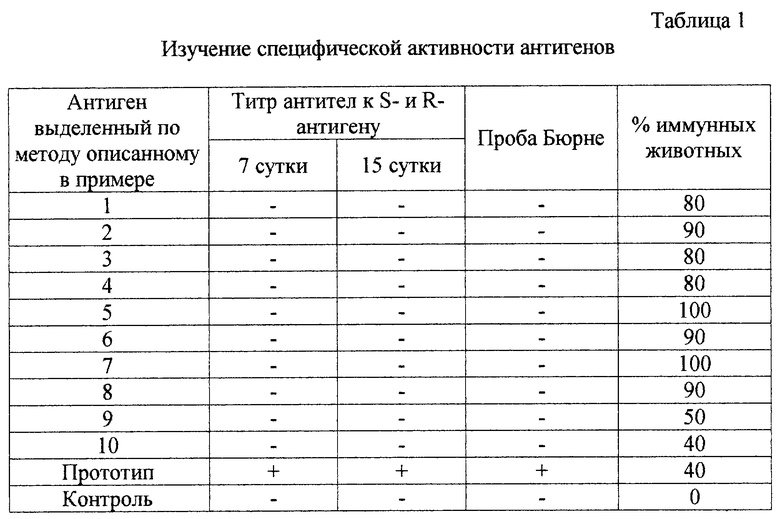
Хроматографическую очистку антигена проводят на колонке (1000•75), заполненой Сефадексом G-75 и уравновешенной дистиллированной водой, рН 6,2-6,4 при длине волны 254 нм. На колонку наносят раствор антигена в количестве 100-150 мл. В качестве элюента используют дистиллированную воду, рН 6,2-6,4. Скорость подачи элюента 1-1,5 мл/мин. Первый пик, выходящий в свободном объеме, удаляют. Собирают второй пик, выходящий в объеме колонки, и подвергают лиофильному высушиванию. Полученный антиген представляет собой вещество, в котором определяются сахара 60% (определяемые по Дюбуа), белки 20% (определяемые по Лоури) и нуклеотиды 5% (определяемые спектрофотометрическим методом) с молекулярной массой менее 30 кД, содержащее в своем составе аминогруппы (определяемые тринитробензолсульфокислотым методом). Результаты биологической активности антигена представлены в таблице 1.
Пример 2. Антиген получают аналогично методу, описанному в примере 1, но вместо вакцинного штамма используют вирулентный штамм Вг. abortus 54, рН среды 6,0. После окончания культивирования и отделения культуральной жидкости от бакмассы культуральную жидкость подвергают ультрафильтрации через фильтр с полыми волокнами, которые пропускают вещества с молекулярной массой ниже 30 тысяч. Полученный антиген содержит в своем составе 28% сахаров, 1% белков и 1% нуклеотидов, молекулярная масса менее 30 кД. Полученный антигенсодержащий фильтрат подвергают лиофилизации. Результаты биологической активности антигена представлены в таблице 1.
Пример 3. Антиген получают методом, описанным в примере 1, но в качестве штамма продуцента используют вирулентный штамм Br. melitensis 16 М, рН среды доводят 40% молочной кислотой до 5,0. Удаление из антигенсодержащей культуральной среды высокомолекулярных примесей осуществляют путем кислотного гидролиза. Для этого в культуральную антигенсодержащую среду добавляют соляную кислоту до конечной концентрации 1% и проводят гидролиз при температуре 85-95oС в течение часа. В результате гидролиза разрушаются все высокомолекулярные примеси. После гидролиза антигенсодержащую жидкость нейтрализуют 0,1 н. раствором NaOH до рН 6,5-7,0. Антиген выделяют спиртовым осаждением с последующей гель-хроматографией, описанным в примере 1. Полученный антиген содержит в своем составе 48% сахаров, 16% белков и 5% нуклеотидов, молекулярная масса менее 30 кД. Результаты биологической активности антигена представлены в таблице 1.
Пример 4. Антиген получают методом, описанным в примере 1, но в качестве штамма продуцента используют вирулентный штамм Br. melitensis 16 М, рН среды доводят 40% молочной кислотой до 5,0. Удаление из антигенсодержащей культуральной среды высокомолекулярных примесей осуществляют путем щелочного гидролиза. Для этого в культуральную антигенсодержащую среду добавляют раствор NaOH до 1% конечной концентрации и проводят гидролиз при температуре 85-95oС в течение часа. В результате гидролиза разрушаются все высокомолекулярные примеси. После гидролиза антигенсодержащую жидкость нейтрализуют до рН 6,5-7,0 0,1 н. соляной кислотой. Антиген выделяют спиртовым осаждением с последующей гель-хроматографией, описанным в примере 1. Полученный антиген содержит в своем составе 58% сахаров, 14% белков и 2% нуклеотидов, молекулярная масса менее 30 кД. Результаты биологической активности антигена представлены в таблице 1.
Пример 5. Антиген получают методом, описанным в примере 1, но в качестве питательной среды используют среду Вейбриджа. Полученный антиген содержит в своем составе 48% сахаров, 20% белков и 5% нуклеотидов, молекулярная масса менее 30 кД. Результаты биологической активности антигена представлены в таблице 1.
Пример 6. Антиген получают методом, описанным в примере 1, но в качестве среды используют бульон на переваре Хоттингера. Полученный антиген содержит в своем составе 30% сахаров, 12% белков и 3% нуклеотидов. Результаты биологической активности антигена представлены в таблице 1.
Пример 7. В синтетическую питательную среду 199 вносят предварительно выращенную двухсуточную культуру штамма Br. abortus 54. Конечная концентрация засевной культуры в 199 среде составляет 60 млрд микробных клеток в мл, рН среды доводят 0,1 н. раствором соляной кислоты до 7,0 единиц. Питательную среду инкубируют при 37oС в течение 4 часов при перемешивании. Через 6 часов бактериальную массу отделяют центрифугированием. Полученный супернатант дополнительно подвергают фильтрации через бактериальный фильтр Зейца. Обеззараженный супернатант лиофилизируют при общепринятых режимах. Высушенный препарат растворяют в 50 мл дистиллированной воды и в него вливают 150 мл охлажденного до 4oС этанола. Смесь культуральной жидкости и этанола выдерживают в течение 16 часов при температуре 4oС. Выпавший осадок отделяют от жидкой фазы центрифугированием при 5 тыс. g в течение 20 минут. Полученный осадок растворяют в дистиллированной воде. Из полученного раствора методом гель-фильтрации выделяют целевой продукт.
Хроматографическую очистку антигена проводят на колонке (1000•75), заполненой Сефадексом G-75 и уравновешенной дистиллированной водой, рН 6,2-6,4 при длине волны 254 нм. На колонку наносят раствор антигена в количестве 100-150 мл. В качестве элюента используют дистиллированную воду, рН 6,2-6,4. Скорость подачи элюента 1-1,5 мл/мин. Первый пик, выходящий в свободном объеме, удаляют. Собирают второй пик, выходящий в объеме колонки, и подвергают лиофильному высушиванию. Полученный антиген содержит в своем составе 30% сахаров, 5% белков и 1% нуклеотидов, молекулярная масса менее 30 кД. Результаты биологической активности антигена представлены в таблице 1.
Пример 8. Антиген получают методом, описанным в примере 7, но в качестве среды культивирования используют солевой раствор Хенкса. Концентрацию клеток бруцелл в нем доводят до 100 млрд/мл, а время инкубации увеличивают до 16 часов. Очистку антигена от высокомолекулярных примесей проводят путем гидролиза в 1 н. уксусной кислоте. Антиген из гидролизованной питательной среды выделяют путем осаждения этиловым спиртом с последующей гель-фильтрацией на колонках с Сефадексом. Полученный антиген содержит в своем составе 30% сахаров, 2% белка и 5% нуклеотидов, молекулярная масса менее 30 кД. Результаты биологической активности антигена представлены в таблице 1.
Пример 9. Антиген получают методом, описанным в примере 1, но рН среды устанавливают равным 4,5. Результаты биологической активности антигена представлены в таблице 1.
Пример 10. Антиген получают методом, описанным в примере 1, но рН среды устанавливают равным 7,5. Результаты биологической активности антигена представлены в таблице 1. Полученный антиген содержит в своем составе 48% сахаров, 9% белков и 5% нуклеотидов, молекулярная масса менее 30 кД.
Пример 11. Биологические свойства полученных антигенов в сравнении с прототипом проверяют на морских свинках. Антиген вводят внутримышечно в дозе 0,2 мг. На 7 и 15 день у животных берут кровь и исследуют ее на предмет обнаружения антител к S- и R-антигенам бруцелл. На 30 день проводят внутрикожную пробу Бюрне. Через 35 дней животных опытных и контрольных групп заражают 2 ИД100. И через месяц после заражения проводят убой и бактериологическое исследование лимфатических узлов и паренхиматозных органов. Животное считается заразившимся, если удается выделить культуру из какого-либо объекта.
Пример 12. Изучение способности бруцеллезного внеклеточного антигена выявлять скрытые формы бруцеллеза.
Для определения способности бруцеллезного антигена выявлять скрытые формы бруцеллеза тридцати морским свинкам вводят вакцинный штамм Br. abortus 19 в дозе 15 тыс. микробных клеток. Всех животных разделяют на 6 групп. Через 45 дней после иммунизации морским свинкам 5 групп вводят антиген, полученный по методам, описанным в примерах 1, 3, 6, 7 и 9 в дозе 0,2 мг, а пять животных оставляют в качестве контроля. Через 15 дней у всех животных берут кровь и исследуют на наличие S-агглютининов в реакции агглютинации (РА), начиная с разведения 1:10. Результаты исследований приведены в таблице 2.
Таким образом, полученный внеклеточный протективный антиген бруцелл обладает выраженной протективной активностью, не вызывает сенсибилизации организма и синтеза антител к S- и R-антигенам и способен провоцировать синтез антител при скрыто протекающих формах бруцеллеза.
Список литературы
1. Proc. Soc. Exp. Biol. 1961, - v.106, - N4, - р.748-752.
2. International symposium on Brucellosis. Develop. Biol. Standart - Rabat, - 1975, - v.31, - p.68-91.
3. Jornal Bactereology. - 1962, - v.94, - N 2, - p.256-268.
4. Вершилова П.А., Чернышева М.И., Князева Э.Н. Патогенез и иммунология бруцеллеза - Медгиз - 1974 - с.178-179.
5. Jornal Bacteriology - 1965, - v.90, - p. 895-902.
6. Авторское свидетельство СССР 467933 от 1972 г.
7. Гадельшин И.А. Определение реактогенности, безвредности и антигенной активности бруцеллезной химической вакцины. Автореферат дисс. кан. мед. наук. - Алма-Ата - 1986 г., - с.20.
8. Dubois М, Gilles К.A., Hamilton J.К. Colorimetric method of determination of sugar and related substances. //Anal. Chem. 1956. - v.28., - P. 350-356.
9. Protein measurement with the Folin phenol reagent. /Lowry O.H., Resenbrough N.J., Farr A.L, Randalle R.J. // J. Biol. Chem. - 1951. - v.193. - P.265-275.
10. World Health Organization Expert Commitee on Biological Standartion 1977, Technical Report Series 610. World Health Organization, Geneva.
11. Snyder S.L., Sobocinsky P.Z. Improved 2,4,6-trinitrobenzenesolfonic acid metod for the determination of amine. // Analit. Biochem. - 1975. - v. 64., - N 1. - P.284-288.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения антигена для определения противобруцеллезного иммунитета | 2016 |
|
RU2627897C1 |
| СПОСОБ ПОСТАНОВКИ ДИАГНОСТИЧЕСКОЙ РЕАКЦИИ ПРИ БРУЦЕЛЛЕЗЕ | 2001 |
|
RU2203499C1 |
| СПОСОБ ЛЕЧЕНИЯ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ | 1993 |
|
RU2092184C1 |
| СПОСОБ ПОЛУЧЕНИЯ БРУЦЕЛЛЁЗНОГО АНТИГЕНА ДЛЯ КЛЕТОЧНЫХ ТЕСТОВ IN VITRO | 2019 |
|
RU2708561C1 |
| СПОСОБ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ БРУЦЕЛЛЕЗА | 2002 |
|
RU2230572C1 |
| СПОСОБ ЛЕЧЕНИЯ ИНФЕКЦИОННЫХ ЭНЦЕФАЛИТОВ И ЭНЦЕФАЛОМИЕЛИТОВ | 1994 |
|
RU2098126C1 |
| Способ получения аллергена для диагностики бруцеллеза у сельскохозяйственных животных | 2022 |
|
RU2792814C1 |
| СПОСОБ ПОЛУЧЕНИЯ БРУЦЕЛЛЕЗНОГО АНТИГЕНА ИЗ ШТАММА BRUCELLA ABORTUS 19 ДЛЯ ИЗГОТОВЛЕНИЯ ЕДИНОГО БРУЦЕЛЛЕЗНОГО АНТИГЕНА ДЛЯ РА, РСК И РДСК, БРУЦЕЛЛЕЗНОГО АНТИГЕНА ДЛЯ РОЗ-БЕНГАЛ ПРОБЫ (РБП) И БРУЦЕЛЛЕЗНОГО АНТИГЕНА ДЛЯ КОЛЬЦЕВОЙ РЕАКЦИИ (КР) С МОЛОКОМ, СПОСОБ ИЗГОТОВЛЕНИЯ БРУЦЕЛЛЕЗНОЙ ДИАГНОСТИЧЕСКОЙ СЫВОРОТКИ И ДИАГНОСТИЧЕСКИЕ НАБОРЫ | 2008 |
|
RU2361610C1 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ БРУЦЕЛЛЕЗА КРУПНОГО РОГАТОГО СКОТА И СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2005 |
|
RU2300107C2 |
| СПОСОБ ПОЛУЧЕНИЯ КОНЦЕНТРАТА КУЛЬТУРЫ КЛЕТОК БРУЦЕЛЛ ИЗ ШТАММА Brucella abortus 19 ДЛЯ ПРИГОТОВЛЕНИЯ БРУЦЕЛЛЕЗНЫХ АНТИГЕНОВ, БРУЦЕЛЛЕЗНЫЕ АНТИГЕНЫ (ТРИ ВАРИАНТА), СПОСОБ ИЗГОТОВЛЕНИЯ БРУЦЕЛЛЕЗНОЙ ДИАГНОСТИЧЕСКОЙ СЫВОРОТКИ И ТЕСТ-СИСТЕМЫ ДЛЯ ДИАГНОСТИКИ БРУЦЕЛЛЕЗА ЖИВОТНЫХ (ТРИ ВАРИАНТА) | 2014 |
|
RU2593712C2 |
Изобретение относится к медицине и ветеринарии и касается получения бруцеллезного антигена для выявления хронической формы бруцеллеза. Протективный антиген характеризуется содержанием сахаров до 60%, белков до 20%, нуклеотидов до 5%, имеет мол.м. менее 30 кД и максимум поглощения в диапазоне волн 250-265 нм. Получают антиген в процессе культивирования бруцелл в питательной среде при рН 5,5-7,0. Антиген выделяют из жидкой фракции культуральной жидкости, предварительно подвергнутой кислотному или щелочному гидролизу, и очищают путем ультрафильтрации или жидкостной хроматографии. Способ обеспечивает получение антигена, не вызывающего реакции ГЗТ, и синтез антител к S- и R-антигенам бруцелл, способного провоцировать скрытые формы бруцеллеза. 3 з.п.ф-лы, 2 табл.
| GB 1056839 А, 01.02.1967 | |||
| GB 890618 А, 07.03.1962 | |||
| СПОСОБ ПОЛУЧЕНИЯ ВАКЦИНЫ ПРОТИВ БРУЦЕЛЛЕЗА | 1991 |
|
RU2054293C1 |
Авторы
Даты
2003-02-27—Публикация
2001-09-12—Подача