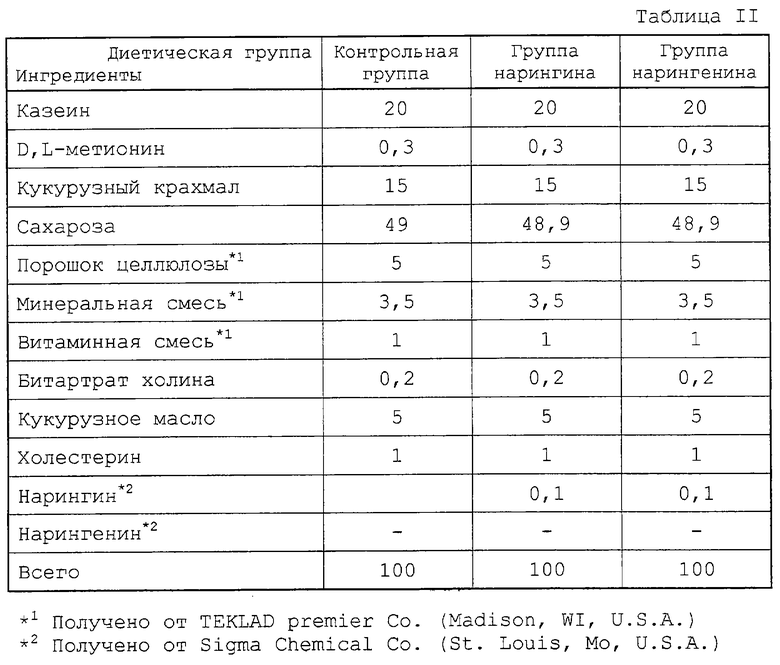
Область изобретения
Настоящее изобретение относится к применению нарингина или нарингенина для ингибирования активности ацил СоА-холестерин-о-ацилтрансферазы (АСАТ), ингибирования накопления комплексов макрофаг-липид на эндотелии артерий и для профилактики или лечения заболеваний печени у млекопитающих.
Предпосылки изобретения
В последние годы коронарные кардио-циркуляторные заболевания, например атеросклероз и гиперхолестеринемия, все чаще становятся основной причиной смертности. Сообщалось, что повышенные уровни содержания холестерина в плазме вызывают отложение жира, макрофагов и пенистых клеток на стенках кровеносных сосудов и что такие отложения приводят к образованию бляшек, а затем к атеросклерозу (Ross, R. , Nature, 362, 801-809, 1993). Одним из способов снижения уровней холестерина в плазме является алиментотерапия для уменьшения поглощения холестерина и липидов. Другим способом является ингибирование абсорбции холестерина путем ингибирования участвующих ферментов.
Ацил СоА-холестерин-о-ацилтрансфераза (АСАТ) промотирует образование сложных эфиров холестерина в крови. Пенистые клетки образуются в результате действия АСАТ и содержат большое количество сложного эфира холестерина, который переносят липопротеины низкой плотности (ЛНП). Образование пенистых клеток на стенках артерии растет с повышением АСАТ активности, и соответственно ингибитор АСАТ может также служить средством для профилактики атеросклероза. Далее сообщалось, что уровень содержания в крови ЛНП-холестерина можно понизить, ингибируя АСАТ активность (Witiak, D.Т. and D.R. Feller (eds. ), Anti-Lipidemic Drugs: Medicinal, Chemical and Biochemical Aspects, Elsevier, pp. 159-195, 1991).
С другой стороны, ухудшение функций печени может происходить из-за избыточного потребления алкоголя или пищи с высоким содержанием липидов, или в результате инфицирования вирусами гепатитов В или С, и это может развиться в гепатиты, привести к циррозу печени или к раку печени. В частности, избыточное потребление пищи с высоким содержанием жиров и спиртных напитков вызывает ожирение печени, когда большое количество липидов отлагается в тканях печени, и повышаются уровни сывороточной GOT (глутамат-оксалоацетат трансаминазы), GPT (глутамат-пируват трансаминазы) и γ-GTP (γ-глутамил транспептидазы) (Т. Banciu et al., Med. In-terne., 20, 69-71, 1982; и A. Par et al., Acta. Med. Acad. Sci. Hung., 33, 309-319, 1976).
Были предприняты многочисленные попытки разработать лекарства, которые ингибируют АСАТ активность; и в результате появились сообщения о выделении нескольких соединений из культур различных микроорганизмов. Примеры таких соединений включают пирипиропены, выделенные из культуры Aspergillus fumigatus (S. Omura et al., J. Antibiotics, 46, 1168-1169, (993) и акатерин, выделенный из Pseudomonas sp. (S. Nagamura et al., J. Antibiotics, 45, 1216-1221, 1992).
Далее в качестве средства для лечения гиперхолестеринемии был разработан ингибитор HMG-CoA редуктазы, названный ловастатином (Lovastatin®), который поставляется на рынок Merck Co., U.S.A.
Однако известно, что это лекарство вызывает вредный побочный эффект - повышает содержание креатин-киназы в печени.
Соответственно продолжает существовать необходимость в создании нетоксичных ингибиторов АСАТ и ингибиторов накопления комплексов макрофаг-липид на эпителии артерий и средств для профилактики или лечения заболеваний печени.
Авторы настоящего изобретения предприняли попытки разработать новый и эффективный ингибитор АСАТ, ингибитор накопления комплексов макрофаглипид и средство для профилактики и лечения заболеваний печени из природных материалов, и в результате обнаружили, что нарингин или нарингенин обладают потенциальной ингибирующей АСАТ активностью, ингибирующей накопление комплексов макрофаг-липид, и активностью в отношении профилактики или лечения заболеваний печени.
Нарингин (С27Н32О14, М. В. : 580,53) и агликон нарингина, нарингенин (C15H12O5, М. В. : 272,25), являются флавоноидами, находящимися в лимонах, грейпфрутах, мандаринах, цитронах и апельсинах (Citrus sinensis) (Horowitz, Gentili, Tetrahedron, 19, 773, 1963).
Сообщалось, что нарингин или нарингенин обладают противораковой, противовирусной активностями, а также активностью в отношении снижения уровней холестерина (Monforte, М. Т., et al., Farmaco., 50 (9), 595-599, 1995, Sep.; JP 95-86929; JP 95-86930; Felica, V., et al., J. Med. Virol., 15, 71-79, 1985; ЕР 0352147 А2, 1990.1.24 и Martin M.J., et al., Pharmacal., 49, 144-150, 1994).
Далее нарингин был использован в качестве придающего горечь агента, подсластителя или в качестве основания жевательной резинки.
Однако до сих пор не сообщалось ни о АСАТ ингибирующей активности, ни о ингибирующей активности в отношении накопления комплекса макрофаг-липид, ни о профилактической или терапевтической активности нарингина или нарингенина.
Краткое содержание изобретения.
Соответственно основной целью настоящего изобретения является новое применение нарингина или нарингенина для ингибирования АСАТ активности у млекопитающих.
Другой целью настоящего изобретения является новое применение нарингина или нарингенина для ингибирования накопления комплексов макрофаг-липид на эндотелиальных стенках артерий у млекопитающих.
Следующей целью настоящего изобретения является новое применение нарингина или нарингенина для профилактики или лечения заболеваний печени у млекопитающих.
Краткое описание чертежей.
Вышеуказанные и другие цели и признаки настоящего изобретения станут яснее из следующего описания изобретения вместе с прилагаемыми чертежами, где:
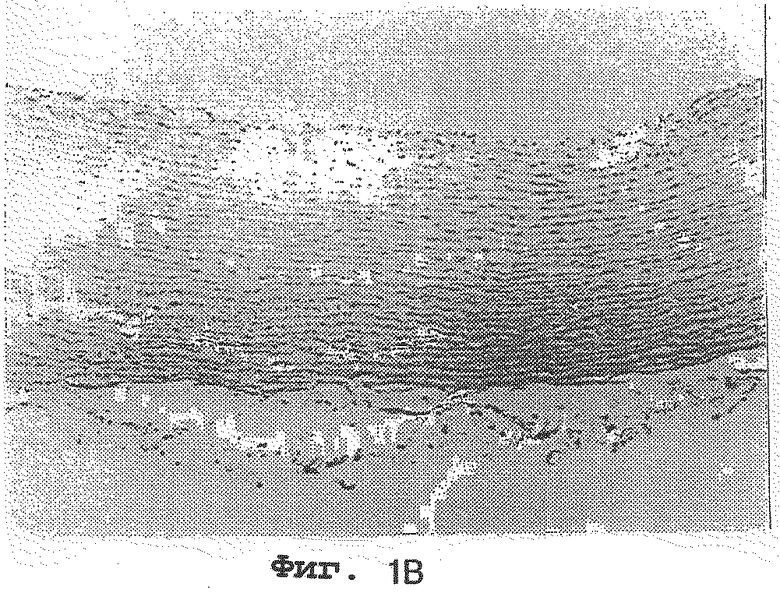
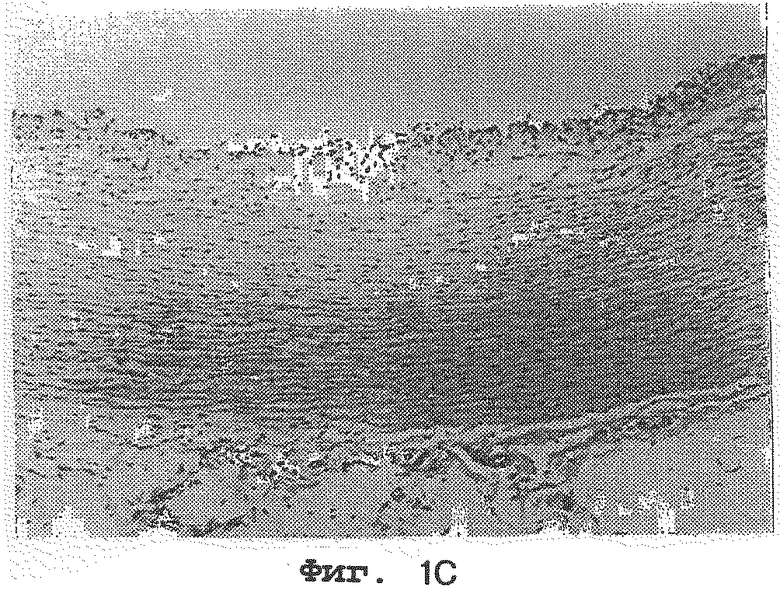
на фиг.1А, 1В и 1С представлены артерии кроликов, которым вводили 1% холестерина; 1% холестерина плюс 1 мг/кг Lovastatin® и 1% холестерина плюс 0,1% нарингина соответственно и
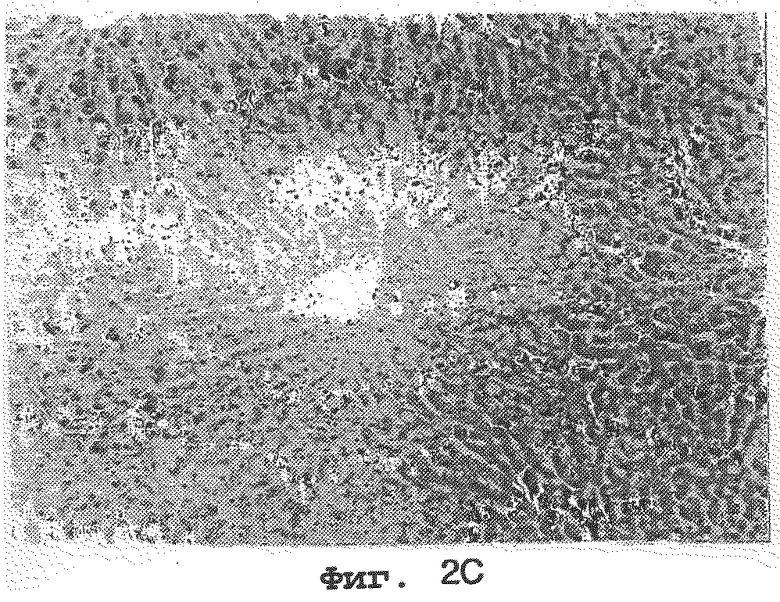
на Ффг. 2А, 2В и 2С представлены микроскопические особенности печеней кроликов, которым вводили 1% холестерина; 1% холестерина плюс 1 мг/кг Lovastatin® и 1% холестерина плюс 0,1% нарингина соответственно.
Подробное описание изобретения
В соответствии с одним аспектом настоящего изобретения предложено применение нарингина или нарингенина для ингибирования активности ацил СоА-холестерин-о-ацилтрансферазы (АСАТ) у млекопитающих.
В соответствии с другим аспектом настоящего изобретения предложено применение нарингина или нарингенина для ингибирования накопления комплексов макрофаг-липид на эндотелиальных стенках артерий у млекопитающих.
В соответствии со следующим аспектом настоящего изобретения предложено применение нарингина или нарингенина для профилактики или лечения заболеваний печени у млекопитающих.
Нарингин или нарингенин можно экстрагировать из кожуры цитрусовых или синтезировать по способу, раскрытому Zemplen, Bognar, Ber., 75, 1043, 1943, и Seka, Prosche, Monatsh., 69, 284, 1936. Далее нарингенин можно получить в результате гидролиза нарингина.
Нарингин или нарингенин демонстрируют ингибирующее действие на АСАТ активность и ингибирующее накопление комплексов макрофаг-липид на эндотелиальных стенках артерий, а также профилактическое или терапевтическое действие в отношении заболеваний печени в дозах 0,1 мг/кг/день или более, причем ингибирующее действие усиливается с увеличением дозы.
Более того, несмотря на потенциальную эффективность нарингина или нарингенина, они демонстрируют низкую токсичность или митогенность в тестах на мышах. Более конкретно, нарингин или нарингенин вообще нетоксичны при пероральном введении мышам в дозе 1000 мг/кг, что соответствует дозе при пероральном введении от 50 до 100 г/кг веса тела нарингина или нарингенина для пациентов весом 50 кг. Кроме того, нарингин и нарингенин не оказывают вредного действия на функции печени.
В настоящем изобретении предложена также фармацевтическая композиция для ингибирования АСАТ активности и ингибирования накопления комплексов макрофаг-липид на эндотелиальных стенках артерий и для профилактики или лечения заболеваний печени, которая включает нарингин или нарингенин в качестве активного ингредиента и фармацевтически приемлемые эксципиенты, носители или разбавители.
Фармацевтическую композицию можно приготовить в соответствии с любой из обычных процедур. При приготовлении композиции активный ингредиент предпочтительно смешивают с носителем, или разбавляют носителем, или заключают в носитель, который может быть в форме капсулы, облатки или в виде какого-либо другого контейнера. Если носитель служит разбавителем, он может быть твердым, полутвердым или жидким материалом и функционирует как носитель, эксципиент или среда для активного ингредиента. Так, композиция может быть в форме таблеток, пилюль, порошков, облаток, эликсиров, суспензий, эмульсий, растворов, сиропов, аэрозолей, мягких или твердых желатиновых капсул, стерильных растворов для инъекций, порошков в стерильной упаковке и т.п.
Примерами подходящих носителей, эксципиентов и разбавителей являются лактоза, декстроза, сахароза, сорбит, маннит, крахмалы, смола акации, альгинаты, желатин, фосфат кальция, силикат кальция, целлюлоза, метилцеллюлоза, микрокристаллическая целлюлоза, поливинилпирролидон, вода, метилгидроксибензоаты, пропилгидроксибензоаты, тальк, стеарат магния и минеральное масло. Композиции могут дополнительно включать наполнители, антиагглютинационные агенты, смазывающие агенты, смачивающие агенты, ароматизаторы, эмульгаторы, консерванты и т.п. Композиции настоящего изобретения можно приготовить так, чтобы обеспечить быстрое, замедленное или с задержкой выделение активного ингредиента после их введения млекопитающим, с использованием любого известного специалистам способа.
Фармацевтические композиции настоящего изобретения можно вводить различными способами, включая пероральное, чрескожное, подкожное, внутривенное и внутримышечное введение. Для людей типичная дневная доза нарингина или нарингенина может быть в интервале от около 0,1 до 100 мг/кг веса тела, предпочтительно от 3 до 10 мг/кг веса тела, и ее можно вводить в виде единичной дозы или в виде разделенных доз.
Однако следует понимать, что количество активного ингредиента, которое вводят реально, следует определять с учетом различных факторов, включая подлежащее лечению состояние, выбранный способ введения, возраст, пол и вес пациента, и тяжесть симптомов; и поэтому вышеуказанные дозы ни коим образом не должны ограничивать объем изобретения.
Более того, нарингин или нарингенин можно включать в продукты или напитки в качестве дополнений или диетических добавок для ингибирования АСАТ активности, ингибирования накопления комплексов макрофаг-липид на эндотелиальных стенках артерий и/или для профилактики или лечения заболеваний печени. Продукты питания или напитки могут включать различные сорта мяса; соки, такие как овощные соки (например, морковный сок и томатный сок) и фруктовые соки (например, апельсиновый сок, виноградный сок, ананасный сок, яблочный сок и банановый сок); шоколады; закуски; конфеты; пиццу; продукты, приготовленные из муки зерновых, такие как хлеб, кексы, крекеры, печенье, бисквиты, лапшу и т. д. ; жевательные резинки; молочные продукты, такие как молоко, сыры, йогурт и мороженое; супы; бульоны; пасты; кетчупы и соусы; чаи; алкогольные напитки; газированные напитки, такие как Кока-Кола и Пепси-Кола; комплексы витаминов и различную здоровую пищу.
В этом случае содержание нарингина или нарингенина в продуктах питания или напитках может быть в интервале от 0,01 до 5 вес.%. В частности, напиток в соответствии с настоящим изобретением может содержать от 200 до 10000 мг нарингина или нарингенина на 1000 мл напитка.
Как было указано выше, нарингин или нарингенин можно использовать в качестве эффективного нетоксичного фармацевтического агента для ингибирования АСАТ активности, ингибирования накопления комплексов макрофаг-липид на эндотелии артерий и/или для профилактики или лечения заболеваний печени.
Приводимые далее примеры предназначены для дальнейшей иллюстрации настоящего изобретения без ограничения его объема.
Далее приводимые ниже проценты для смесей твердое в твердом, жидкое в жидком и твердое в жидком даны в расчете на вес/вес, объем/объем и вес/объем, соответственно; а все реакции ведут при комнатной температуре, если нет других указаний.
Пример 1. Экстрагирование нарингина из кожуры цитрусовых.
Кожуру мандаринов (Cheju Island, Korea), цитронов (Jeollanamdo, Korea) и апельсинов, грейпфрутов и лимонов (California, CA, U.S.A.) сушат при комнатной температуре и измельчают в порошок с размером частиц от 100 до 200 мкм. 50 мл метанола добавляют к 500 мг каждого из порошков кожуры цитрусовых и экстрагируют в водяной бане при 50oС в течение 6 ч. Полученный таким образом экстракт охлаждают и фильтруют, а затем метанол добавляют к фильтрату до объема 50 мл.
Для определения содержания нарингина в полученных экстрактах, 5,0 мкл полученного экстракта обрабатывают с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ), используя колонку Lichrosorb RP-8 (5 мкм, 4х250 мм), которую предварительно уравновешивают 37% метанолом и поддерживают при температуре 30oС. Экстракт элюируют 37% метанолом при скорости потока 1,0 мл/мин. Стандартные растворы приготавливают, растворяя нарингин (Sigma Chemical Co. U.S.A.) в метаноле до конечных концентраций 0,1, 0,2, 0,3, 0,4 и 0,5 мг/мл и обрабатывая с помощью ВЭЖХ в таких же условиях, что указаны выше. Элюаты детектируют при 280 нм с помощью спектрофотометра, работающего в УФ-видимом диапазоне, и содержание нарингина рассчитывают, сравнивая площади под кривыми ВЭЖХ экстрактов кожуры цитрусовых и стандартного раствора. Содержание (%) нарингина в различных экстрактах кожуры цитрусовых представлено в табл. I.
Пример 2. Токсичность при пероральном введении нарингина или нарингенина.
7-8 недельных специфических без патогенных ICR самок мышей (6 штук), каждая весом от около 25 до 29 г, и самцов мышей (6 штук), каждый весом от около 34 до 38 г, выращивают в условиях температуры 22±1oС, влажности 55±5% и фотопериода 12 ч свет/12 ч темнота. Корм (Cheiljedang Co., корм для мышей и крыс) и воду стерилизуют и дают мышам.
Нарингин и нарингенин растворяют в 0,5% Твин 80 до концентрации 100 мг/мл, и этот раствор вводят перорально мышам в количестве 0,2 мл на 20 г веса тел мышей. Раствор вводят один раз, и за мышами ведут наблюдение в течение 10 дней в отношении признаков вредного действия или гибели в соответствии со следующей схемой: через 1, 4, 8 и 12 ч после введения и каждые 12 ч после этого. Изменения веса мышей регистрируют каждый день для определения влияния нарингина или нарингенина. Далее на 10 день мышей умерщвляют, и визуально исследуют внутренние органы.
Через 10 дней все мыши были живы, и нарингин или нарингенин не продемонстрировали никакой токсичности в дозе 1000 мг/кг. Аутопсия показала, что у мышей не развилось каких-либо патологических отклонений, и за 10 дней тестового периода не наблюдалось потерь веса. Соответственно было сделано заключение, что нарингин или нарингенин нетоксичен при пероральном введении животным.
Пример 3. Введение нарингина или нарингенина животным.
30 четырехнедельных крыс штамма Sprague-Dawley (Tainan laboratory animal center, Korea), каждая весом от 90 до 110 г, равномерно произвольно разделяют на три диетические группы. Крысам в этих трех группах дают три различных корма с высоким содержанием холестерина, то есть AIN-76 лабораторный корм для животных (ICN, Biochemicals, Cleveland, ОН, U.S.A.), содержащий 1% холестерина (контрольная группа), и 1% холестерина плюс 0,1% нарингина или нарингенина соответственно. Состав кормов, которые давали этим трем группам, представлен в табл. II.
Крысы питались по желанию специальным кормом вместе с водой в течение 6 недель, поглощенное количество регистрировалось ежедневно, и крыс взвешивали каждые 7 дней, а затем анализировали результаты. Все крысы продемонстрировали нормальную скорость роста и никаких заметных различий между тремя группами с точки зрения потребляемого количества корма и привеса не наблюдалось.
Пример 4. Определение содержания полного холестерина, ЛВП-холестерина и нейтральных липидов в плазме.
Влияние введения крысам нарингина или нарингенина на содержание в плазме холестерина и нейтральных липидов определяют следующим образом.
Образцы крови отбирают у крыс трех различных диетических групп, и выделяют из них фракции плазменных ЛВП, используя ЛВП-холестериновый реагент (Sigma Chemical Co., Cat. 352-3), содержащий декстран-сульфат. Уровни содержания полного холестерина и ЛВП-холестерина определяют, используя Sigma Diagnostic Kit Cat. 352-100 (Sigma Chemical Co., U.S.A.) (Allain et al., Clin. Chem., 20, 470-475, 1974). Уровень содержания нейтральных липидов определяют, используя Sigma Diagnostic Kit Cat. 339-50 (Bucolo G. and David H. , Clin. Chem., 19, 476-482, 1973). Полученные результаты представлены в табл. III, где уровни полного плазменного холестерина в группах крыс, в корме которых был нарингин или нарингенин, снижены на 32% и 18% соответственно по сравнению с контрольной группой.
Пример 5. Активность нарингина и нарингенина в отношении ингибирования АСАТ.
(Стадия 1) Получение микросом.
Для определения действия на крыс корма с нарингином или нарингенином на активность АСАТ микросомы выделяют из тканей печени, чтобы использовать в качестве источника ферментов.
Вначале крыс трех групп, полученных в примере 3, умерщвляют, отсекая голову, и вырезают печени. По 1 г из каждой печени гомогенизируют в 5 мл гомогенизационной среды (0,1 М КН2РО4, рН 7,4, 0,1 мМ EDTA и 10 мМ β-меркаптоэтанола). Гомогенат центрифугируют при 3000 g в течение 10 мин при 4oС и таким образом полученную надосадочную жидкость цетрифугируют при 15000 g в течение 15 мин при 4oС для получения надосадочной жидкости. Эту надосадочную жидкость помещают в ультрацентрифужную ампулу (Beckman) и центрифугируют при 100000 g в течение 1 ч при 4oС, получая осадок микросом, который затем суспендируют в 3 мл гомогенизационной среды, и центрифугируют при 100000 g в течение 1 ч при 4oС. Полученный таким образом осадок суспендируют в 1 мл гомогенизационной среды. Концентрацию протеинов в полученной суспензии определяют методом Lowry, а затем доводят до величины от 4 до 8 мг/мл. Полученную суспензию хранят при очень низкой температуре (Biofreezer, Forma Scientific Inc.).
(Стадия 2) АСАТ анализ.
6,67 мкл 1 мг/мл раствора холестерина в ацетоне смешивают с 6 мкл 10% Triton WR-1339 (Sigma Co.) в ацетоне, и затем ацетон удаляют из смеси выпариванием, используя газообразный азот. К полученной смеси добавляют дистиллированную воду в таком количестве, чтобы довести концентрацию холестерина до 30 мг/мл.
К 10 мкл полученного водного раствора холестерина добавляют 10 мкл 1 М КН2PО4 (рН 7,4), 5 мкл 0,6 мМ альбумина бычьей сыворотки (BSA), 10 мкл раствора микросом, полученного на стадии 1, и 55 мкл дистиллированной воды (всего 90 мкл). Две смеси предварительно инкубируют в водяной бане при 37oС в течение 30 мин.
10 мкл раствора (l-14C) олеоил-СоА (0,05 мкКюри, конечная концентрация: 10 мкМ) добавляют к предварительно инкубированной смеси, и полученную смесь инкубируют в водяной бане при 37oС в течение 30 мин. К этой смеси добавляют 500 мкл смеси изопропанол: гептан (4:1 (об./об.)), 300 мкл гептана и 200 мкл 0,1 М КН2РO4 (рН 7,4), и полученную смесь интенсивно перемешивают, используя центрифугу, а затем оставляют выстаиваться при комнатной температуре в течение 2 мин.
200 мкл полученной надосадочной жидкости помещают в сцинтилляционную ампулу, и к этому добавляют 4 мл сцинтилляционной жидкости (Lumac). Полученную смесь анализируют на радиоактивность с помощью сцинтилляционного счетчика 1450 Microbeta (Wallacoy, Finland). АСАТ активность рассчитывают как пикомоли холестеринолеата, синтезируемые в минуту на мг протеина (пмоль/мин/мг протеина). Полученные результаты представлены в табл. IV.
Как видно из данных табл. IV, АСАТ активности, наблюдаемые для групп крыс, в корм которых был добавлен нарингин или нарингенин, ниже, нежели для контрольной группы на 20,2% и 17,4% соответственно.
Пример 6. Ингибирование образования бляшек, вызываемое комплексами макрофаг-липид, у животных, в корм которым добавлен нарингин или нарингенин.
(Стадия 1). Введение животным нарингина или нарингенина.
24 трехмесячных Новозеландских белых кролика (Yeonam Horticulture and Animal Husbandry College, Korea), каждый весом от около 2,5 до 2,6 кг, выращивают в условиях 20±2oС и относительной влажности 55±5%, и фотопериоде 12 ч свет/12 ч темнота. Кроликов делят на группы по 6 кроликов, и кроликов четырех групп кормят четырьмя различными по составу кормами, т.е. RC4 корм (Oriental Yeast Co., Japan), содержащий 1% холестерина (контрольная группа); 1% холестерина плюс 1 мг/кг Lovastatin® (Merck, U.S.A.) (сравнительная группа); 1% холестерина плюс 0,1% нарингина и 1% холестерина плюс 0,1% нарингенина соответственно. Корм RC4 содержит 7,6% влаги, 22/8% сырого протеина, 2,8% сырого жира, 8,8% неочищенной золы, 14,4% сырой целлюлозы и 43,6% растворимых веществ, не содержащих азота. Кроликов кормят таким образом в течение 6 недель при свободном доступе к корму и воде.
(Стадия 2). Анализ полосок жира в главной артерии.
Кроликов, которых кормили по схеме стадии 1, умерщвляют и вырезают грудную клетку. Из нее вырезают главную артерию примерно на 5 см в прямом направлении от точки, расположенной на 1 см над клапаном аорты, и жир, окружающий главную артерию, удаляют. Главную артерию разрезают посередине вдоль длинной оси и помещают в чашку. Главную артерию фотографируют, а затем производят окрашивание полосок жира по способу Esper, E., et al., (J. Lab. Clin. Med., 121, 103-110, 1993) следующим образом.
Часть иссеченной главной артерии трижды промывают по 2 мин безводным пропиленгликолем и окрашивают в течение 30 мин насыщенным раствором Oil Red О (ORO, Sigma Co.) в пропиленгликоле. После этого артерию дважды промывают по 3 мин 85% пропиленгликолем для удаления остатков красящего раствора, а затем промывают физиологическим раствором. Артерию фотографируют, и фотографию исследуют. Площадь окрашенного участка (участок с полосками жира) определяют с помощью анализатора изображений (LEICA, Q-600, Germany) и рассчитывают его долю (%) от полной площади артерии.
С другой стороны, другую часть главной артерии окрашивают в соответствии со способом гематоксилин-эозин (Н& Е) и способом трехцветного окрашивания Masson и наблюдают под микроскопом для подтверждения того факта, что комплексы макрофаг-липид накапливаются в во внутренней оболочке, In-ternus, эластичной мембране и среде.
Далее у кроликов отбирают образцы крови и определяют уровни содержания полного холестерина и триглицеридов по способу примера 4.
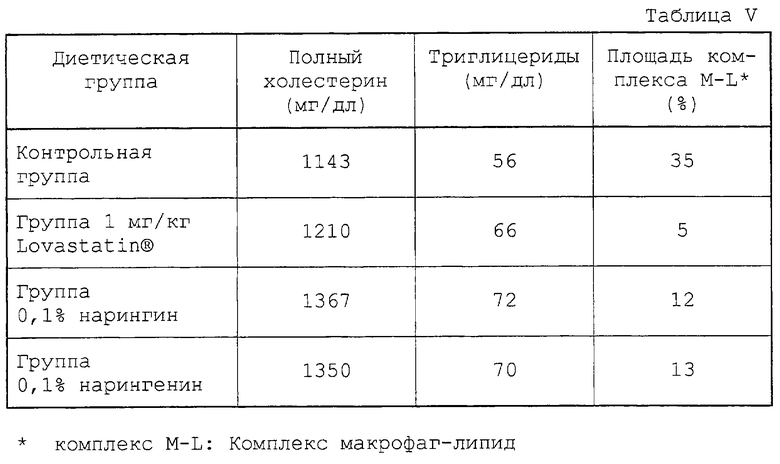
Полученные результаты представлены в табл. V.
Как видно из результатов табл. V, площадь накопления комплекса макрофаг-липид на эндотелии артерий значительно снижается для групп с 1 мг/кг Lovastatin®, 0,1% нарингина и 0,1% нарингенина по сравнению с контрольной группой. Соответственно было подтверждено, что нарингин и нарингенин ингибируют накопление комплексов макрофаг-липид на эндотелии артерий. В частности, примечательно, что активность нарингина или нарингенина в отношении ингибирования накопления комплексов макрофаг-липид проявляется при уровнях холестерина в крови более 1100 мг/дл, что гораздо выше, нежели у здоровых кроликов, т.е. около 50 мг/дл. Этот результат позволяет предположить возможность нового механизма профилактики наступления атеросклероза, который отличается от блокирования синтеза холестерина за счет ингибитора HMG-CoA редуктазы, блокирования абсорбции холестерина за счет АСАТ ингибитора или блокирования переноса холестерина за счет СЕТР ингибитора.
На фиг. 1А, 1В и 1С представлены артерии кроликов, которым вводили 1% холестерина (контрольная группа); 1% холестерина плюс 1 мг/кг Lovastatine® сравнительная группа); 1% холестерина плюс 0,1% нарингина соответственно. Как видно на Фиг.1А, 1В и 1С, наблюдается толстый слой комплекса макрофаг-липид на эндотелии артерий кроликов, которым вводили 1% холестерина, тогда как очень тонкие слои или вовсе отсутствие комплексов макрофаг-липид наблюдается на эндотелии артерий кроликов, которым вводили 1% холестерина плюс 1 мг/кг Lovastatine® и 1% холестерина плюс 0,1% нарингина соответственно.
Соответственно был сделан вывод, что нарингин или нарингенин сильно ингибируют накопление комплексов макрофаг-липид на эндотелии артерий.
Пример 7. Профилактика болезней печени с помощью нарингина.
(Стадия 1). Введение крысам нарингина.
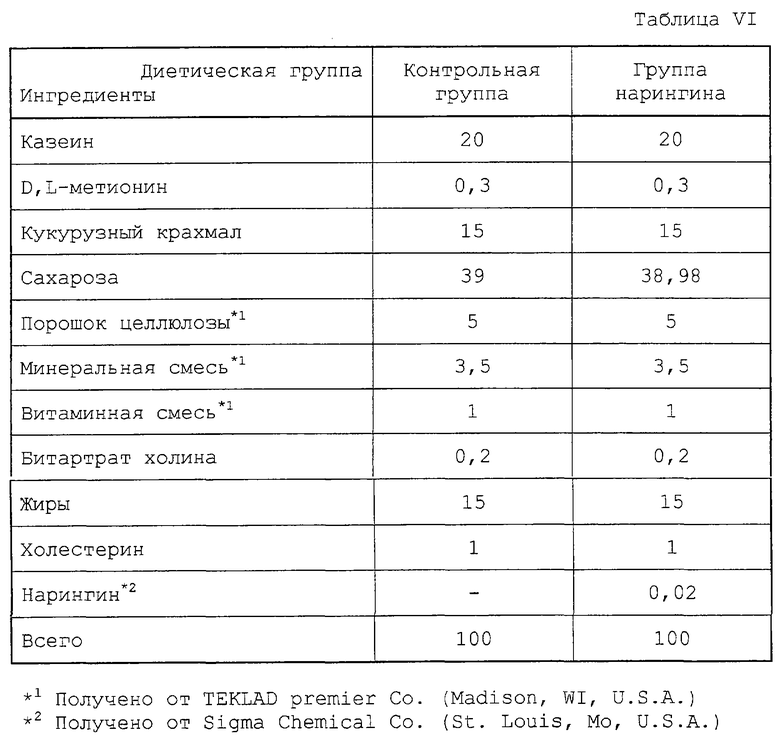
20 четырехнедельных крыс штамма Sprague-Dawley (Taihan laboratory animal center, Korea), каждая весом от 90 до 110 г, равномерно произвольно разделяют на две диетические группы. Крысам в этих двух группах дают два различные корма с высоким содержанием холестерина, то есть, AIN-76 лабораторный корм для животных (ICN, Biochemicals, Cleveland, ОН, U.S.A.), содержащий 1% холестерина (контрольная группа), и 1% холестерина плюс 0,02% нарингина соответственно. Состав кормов, которые давали этим двум группам, представлен в табл. VI.
Крысы питались по желанию специальным кормом вместе с водой в течение 6 недель, поглощенное количество регистрировалось ежедневно, и крыс взвешивали каждые 7 дней, а затем анализировали результаты. Все крысы продемонстрировали нормальную скорость роста, и никаких заметных различий между двумя группами с точки зрения потребляемого количества корма и привеса не наблюдалось.
(Стадия 2). Определение уровней содержания GOT и GPT в сыворотке.
Влияние введения крысам нарингина на функции печени исследуют следующим образом.
Образцы крови отбирают у крыс двух диетических групп, и определяют уровни содержания в сыворотке GOT (глутамат-оксалоацетат трансаминаза) и GPT (глутамат-пируват трансаминаза) по способу Reitman и Frankel (Reitman, S. and J.S. Frankel, Am.J. Clin. Pathol., 28, 56, 1956). GOT и GPT синтезируются в печени и сердце, и выделяются в поток крови при повреждении этих органов. Соответственно, GOT и GPT являются представительными маркерами функций печени, и высокие уровни содержания GOT и GPT в сыворотке свидетельствуют о серьезном поражении печени.
Полученные результаты показывают, что GOT и GPT уровни для группы нарингина были ниже уровней для контрольной группы примерно на 30 и 10% соответственно.
(Стадия 3). Эксперимент на кроликах.
Повторяют процедуру стадии 1, за исключением того, что вместо крыс используют 30 трехмесячных Новозеландских белых кроликов (Yeonam Horticulture and Animal Husbandry College, Korea), каждый весом от около 2,5 до 2,6 кг, и кроликов кормят в течение шести недель тремя различными по составу кормами, т. е. RC4 корм, содержащий 1% холестерина (контрольная группа); 1% холестерина плюс 1 мг/кг Lovastatine® (сравнительная группа) и 1% холестерина плюс 0,1% нарингина соответственно.
После этого у кроликов извлекают печень и проводят гистопатологические наблюдения следующим образом.
Кроликов анестезируют внутримышечной инъекцией кетамина (75 мг/кг) и разрезают брюшную полость. Цвет и степень склерозирования печени определяют на глаз, и печень, удаленную из кролика, фиксируют в 10% нейтрально буферированном формалине более чем на 24 ч. Отфиксированную печень промывают достаточным количеством воды, поэтапно обезвоживают 70, 80, 90 и 100% этанолом, а затем заключают в парафин. Заключенную в парафин печень нарезают на слои толщиной 4 мкм с помощью микротома и окрашивают гематоксицилином и эозином. Окрашенные образцы печени делают прозрачными ксилолом, помещают with permount и наблюдают под микроскопом для подтверждения присутствия поражений.
На фиг. 2А, 2В и 2С представлены микроскопические особенности печеней кроликов, которым вводили 1% холестерина (контрольная группа); 1% холестерина плюс 1 мг/кг Lovastatine® (сравнительная группа) и 1% холестерина плюс 0,1% нарингина соответственно. Как видно на фиг.2А и 2В, клетки печени контрольной группы и сравнительной группы нерегулярны и увеличены, и на них отложилось большое количество жира. Напротив, как видно на фиг.2С, клетки печени нарингиновой группы остались нормальными, и на них не наблюдается отложения жира. Этот результат показывает, что нарингин сильно ингибирует ожирение печени без каких-либо вредных воздействий на клетки печени.
(Стадия 4). Эксперимент на человеке.
Нарингин перорально вводят 55-летнему человеку в дневной дозе 10 мк/кг в течение 68 дней и определяют уровни GOT, GPT и γGTP непосредственно перед введением (день 0) и через 45 и 68 дней после введения (дни 45 и 68) соответственно. Уровни GOT в сыворотке на 45 и 68 день снизились на 17% соответственно по сравнению с днем 0. Уровни GPT в сыворотке на 45 и 68 день снизились на 15 и 19% соответственно по сравнению с днем 0. Далее, уровни γGTP в сыворотке на 45 и 68 день снизились на 25 и 51% соответственно по сравнению с днем 0. Неожиданно снижение уровня γGTP в сыворотке оказалось более чем на 50%, и этот результат позволяет предположить, что нарингин или нарингенин обладает высокой защищающей печень активностью, а также профилактической активностью в отношении заболеваний печени, таких как гепатиты, ожирение печени и алкогольное ожирение печени.
В другом случае, нарингин перорально вводили 56-летнему мужчине, который постоянно употреблял алкогольные напитки в количестве 100 см3 в день, в дневной дозе 6 мг/кг в течение 30 дней, и уровень γGTP в сыворотке определяли непосредственно перед введением (день 0) и через 30 дней после введения (день 30). Соответственно начальный уровень γGTP в сыворотке в день 0 был 129 междунар. ед/л, тогда как на 30 день он снизился до 69 междунар. ед/л, что соответствует нормальному значению. Этот результат показывает, что нарингин или нарингенин обладает высокой активностью в профилактике алкогольного ожирения печени и гепатоцирроза.
Пример 9. Продукты, содержащие нарингин или нарингенин.
Продукты, содержащие нарингин или нарингенин, приготавливают следующим образом.
(1). Приготовление томатного кетчупа и соуса.
Нарингин или нарингенин добавляют к томатному кетчупу или соусу в количестве в интервале от 0,01 до 5 вес.% для получения улучшающего здоровье томатного кетчупа или соуса.
(2). Приготовление продуктов из пшеничной муки.
Нарингин или нарингенин добавляют к пшеничной муке в количестве в интервале от 0,01 до 5 вес.%, и приготавливают хлеб, кексы, печенье, крекеры и лапшу, используя эту смесь для получения улучшающих здоровье продуктов.
(3). Приготовление супов и подливок.
Нарингин или нарингенин добавляют к супам и подливкам в количестве в интервале от 0,01 до 5 вес. % для получения улучшающих здоровье супов и подливок.
(4). Приготовление говяжьего фарша.
Нарингин или нарингенин добавляют к говяжьему фаршу в количестве в интервале от 0,01 до 5 вес.% для получения улучшающего здоровье говяжьего фарша.
(5). Приготовление молочных продуктов.
Нарингин или нарингенин добавляют к молоку в количестве в интервале от 0,01 до 5 вес.%, и из этого молока приготавливают различные молочные продукты, такие как масло и мороженное.
Однако при приготовлении сыров нарингин или нарингенин добавляют к коагулированному молочному белку; а в случае приготовления йогурта, нарингин или нарингенин добавляют к коагулированному молочному белку после ферментации.
Пример 10. Напитки, содержащие нарингин или нарингенин.
(1). Приготовление овощного сока.
От 200 до 10000 мг нарингина или нарингенина добавляют к 1000 мл томатного или морковного сока для получения улучшающих здоровье овощных соков.
(2). Приготовление фруктового сока.
От 200 до 10000 мг нарингина или нарингенина добавляют к 1000 мл яблочного или виноградного сока для получения улучшающих здоровье фруктовых соков.
(3). Приготовление газированных напитков.
От 200 до 10000 мг нарингина или нарингенина добавляют к 1000 мл Кока-колы или Пепси-колы для получения улучшающих здоровье газированных напитков.
Хотя настоящее изобретение было описано в отношении к вышеприведенным примерам, следует понимать, что специалисты могут осуществить различные модификации и изменения изобретения, которые попадают в объем изобретения и определяются прилагаемой формулой изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ГЕСПЕРИДИН И ГЕСПЕРЕТИН В КАЧЕСТВЕ ИНГИБИТОРА АЦИЛ СОА-ХОЛЕСТЕРИН-О-АЦИЛТРАНСФЕРАЗЫ, ИНГИБИТОРОВ НАКОПЛЕНИЯ КОМПЛЕКСОВ МАКРОФАГ-ЛИПИД НА СТЕНКАХ АРТЕРИЙ, И В КАЧЕСТВЕ СРЕДСТВА ДЛЯ ПРОФИЛАКТИКИ ИЛИ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ ПЕЧЕНИ | 1998 |
|
RU2197239C2 |
| НАРИНГИН И НАРИНГЕНИН В КАЧЕСТВЕ ИНГИБИТОРА 3-ГИДРОКСИ-3-МЕТИЛГЛУТАРИЛ КОА (HMG-COА) РЕДУКТАЗЫ | 1997 |
|
RU2174393C2 |
| ЭКСТРАКТ ИЗ КОЖУРЫ ПЛОДОВ ЦИТРУСОВЫХ В КАЧЕСТВЕ ИНГИБИТОРА 3-ГИДРОКСИ-3-МЕТИЛГЛУТАРИЛ-СoА (ГМГ - СoА) -РЕДУКТАЗЫ | 1997 |
|
RU2173164C2 |
| ГЕСПЕРИДИН И ГЕСПЕРЕТИН В КАЧЕСТВЕ ИНГИБИТОРОВ 3-ГИДРОКСИ-3-МЕТИЛГЛУТАРИЛ-КОА (ГМГ-КОА)-РЕДУКТАЗЫ | 1997 |
|
RU2174392C2 |
| БИОФЛАВОНОИДЫ В КАЧЕСТВЕ АГЕНТА, СНИЖАЮЩЕГО УРОВЕНЬ ГЛЮКОЗЫ В КРОВИ | 1998 |
|
RU2203050C2 |
| ИНСЕКТИЦИДНЫЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ СОЕДИНЕНИЯ, ОБЛАДАЮЩИЕ ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ ПРОТИВ АЦИЛ СоА: ХОЛЕСТЕРИНАЦИЛТРАНСФЕРАЗЫ, ИЛИ ИХ СОЛИ В КАЧЕСТВЕ ЭФФЕКТИВНЫХ ИНГРЕДИЕНТОВ | 2003 |
|
RU2305403C2 |
| КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ЭКСТРАКТ ТРАВЫ ВЕРБЕЙНИКА СЕННОГО, ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ ОБМЕНА ВЕЩЕСТВ | 2008 |
|
RU2481851C2 |
| СПОСОБ ИНГИБИРОВАНИЯ ВСАСЫВАНИЯ И/ИЛИ ПОВЫШЕНИЯ ВЫВЕДЕНИЯ ЛИПИДОВ С ИСПОЛЬЗОВАНИЕМ D-ПСИКОЗЫ | 2016 |
|
RU2725145C2 |
| МАКРОПОРИСТЫЕ ХИТОЗАНОВЫЕ ГРАНУЛЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ, СПОСОБ КУЛЬТИВИРОВАНИЯ КЛЕТОК | 2000 |
|
RU2234514C2 |
| КОМПОЗИЦИЯ ДЛЯ ПРЕДОТВРАЩЕНИЯ, УЛУЧШЕНИЯ ТЕЧЕНИЯ ИЛИ ЛЕЧЕНИЯ ОЖИРЕНИЯ ИЛИ ЖИРОВОЙ БОЛЕЗНИ ПЕЧЕНИ, СОДЕРЖАЩАЯ LEUCONOSTOC CITREUM WIKIM0104 | 2020 |
|
RU2816754C2 |





Предложен новый активный ингредиент фармацевтической композиции, пищевой композиции или напитка для профилактики или лечения липодистрофии печени или цирроза печени у млекопитающих, в том числе человека. В качестве такого ингредиента служат известные флавоноиды нарингин или нарингенин. Изобретение расширяет арсенал средств заявленного назначения. 8 з.п.ф-лы, 6 табл., 6 ил.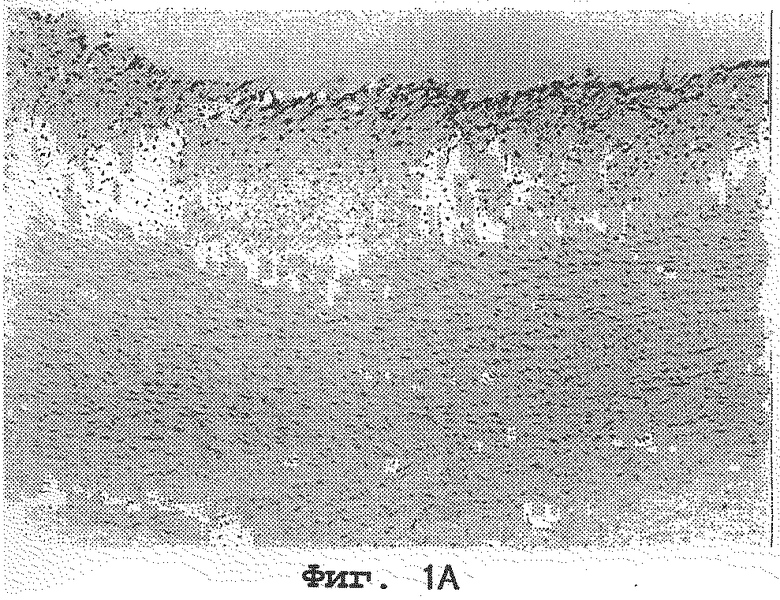
| Мосейчук И.П | |||
| Гепатотропные средства и эффективность растительных флавоноидов при остром и хроническом поражении печени | |||
| Автореферат диссертации на соискание ученой степени кандидата медицинских наук | |||
| - Киев, 1988, с.21-24 | |||
| СПОСОБ ПОЛУЧЕНИЯ БЕЗАЛКОГОЛЬНОГО ЖАЖДОУТОЛЯЮЩЕГО ТОНИЗИРУЮЩЕГО НАПИТКА ИЗ ПЛОДОВ ГРЕЙПФРУТА | 1994 |
|
RU2073987C1 |
| БЕЗАЛКОГОЛЬНЫЙ ЖАЖДОУТОЛЯЮЩИЙ ГАЗИРОВАННЫЙ ТОНИЗИРУЮЩИЙ НАПИТОК "ТОНУС-1" | 1994 |
|
RU2076615C1 |
| JP 8280358, 29.10.1996 | |||
| JP 8283154, 29.10.1996. | |||
Авторы
Даты
2003-03-27—Публикация
1998-10-20—Подача