Изобретение относится к фармацевтической и пищевой промышленности и касается стандартизации пектинов и альгинатов, используемых в качестве детоксикантов тяжелых металлов.
Полиурониды (пектины, альгиновая кислота), имеющие функциональные группы: -СООН, -СООСН3, -ОН, -OCOCH3, обладают сорбционными свойствами и могут выполнять роль ионообменников. Эти свойства полисахаридов обусловлены наличием в них уроновых кислот: полигалактуроновой в пектине, полигулуроновой и полиманнуроновой в альгиновой кислоте. В значительной степени ионообменные свойства полиуронидов связаны с содержанием в них перечисленных выше функциональных групп: чем выше содержание свободных карбоксильных и гидроксильных групп, тем выше сорбционные свойства полисахаридов. И, напротив, высокое количественное содержание этерифицированных метанолом карбоксильных групп и уксусной кислотой гидроксильных групп обусловливает выраженные студнеобразующие свойства полимеров.
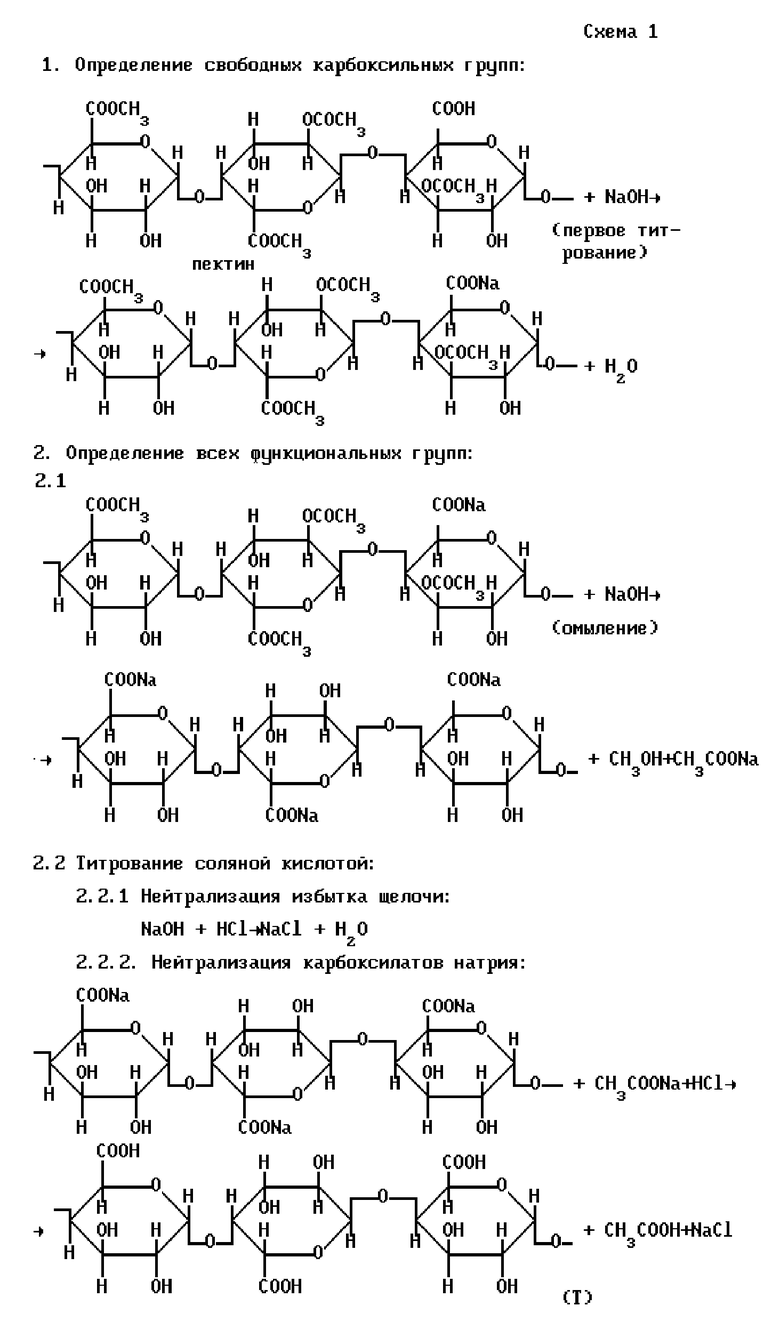
Описаны методики определения содержания свободных карбоксильных групп полиуронидов путем титрования их растворами гидроксида натрия в присутствии индикатора фенолфталеина (в точке эквивалентности наблюдается переход от бесцветной окраски раствора до слабо-розовой). Содержание этерифицированных карбоксильных групп определяют после омыления полисахаридов избытком раствора гидроксида натрия в течение 2 ч при комнатной температуре с последующим прибавлением к реакционной смеси равного объема соляной кислоты и титрованием избытка кислоты щелочью (индикатор - фенолфталеин). Содержание ацетильных групп определяют после омыления полиуронидов 0,6% раствором гидроксида натрия путем отгонки образовавшейся уксусной кислоты и титрования ее щелочью (индикатор-фенолфталеин). (Шелухина Н. П. , Абаева Р.Ш., Аймухамедова Г.Б. Пектин и параметры его получения. - Фрунзе: Илим, 1987. - С.87-88, 91-92).
Недостатками описанного способа являются: а) трудоемкость определения содержания ацетильных групп, связанная с отгонкой образующейся уксусной кислоты, б) невозможность количественного определения уксусной кислоты, т.к. после омыления щелочью преимущественно образуется ацетат натрия, который не будет в дальнейшем титроваться щелочью; в) определение содержания свободных и этерифицированных карбоксильных групп и содержания ацетильных групп ведется в различных навесках препарата, что увеличивает погрешность определения, г) точка эквивалентности при определении всех функциональных групп устанавливается визуально с помощью фенолфталеина, что также увеличивает погрешность определения из-за нечеткого перехода окраски; д) завышены объемы титрантов - раствора гидроксида натрия - вследствие того, что вода, насыщенная карбонатами и гидрокарбонатами (рН 5-6,5), также частично титруется щелочью.
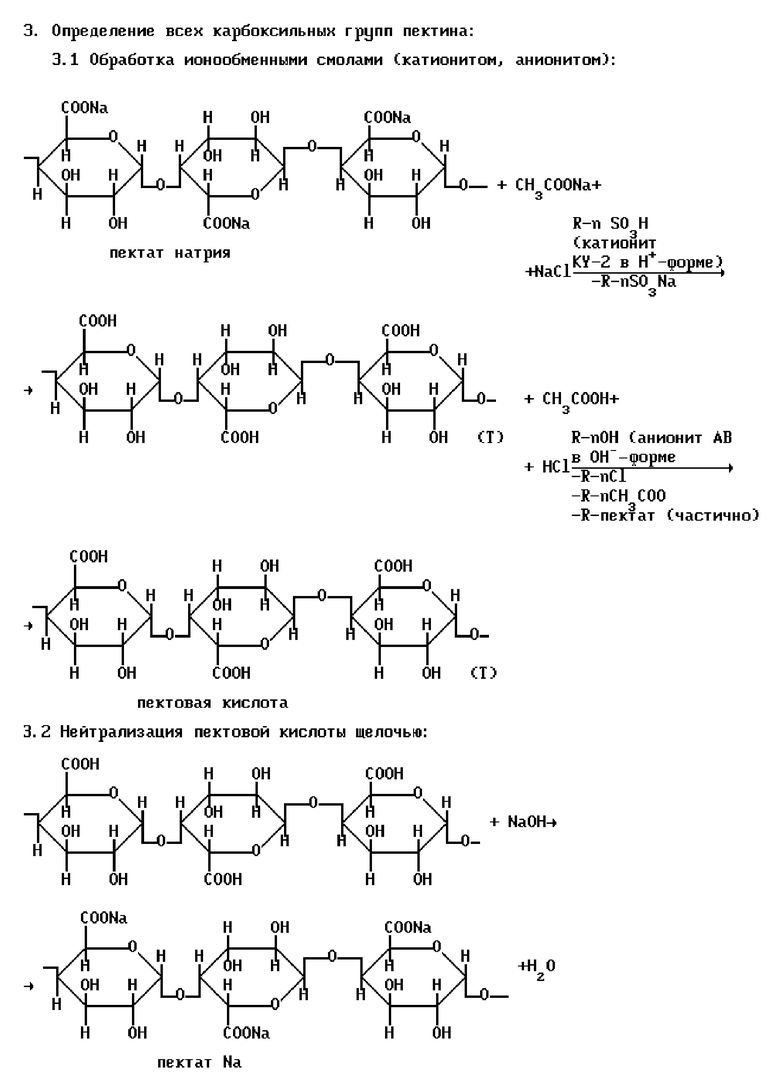
Описано определение содержания функциональных групп полисахаридов путем кондуктометрического титрования 0,1-0,2% раствора пектина 0,1 моль/л раствором гидроксида натрия; при титровании определяют величину сопротивления растворов (R, Ом) и рассчитывают электропроводность растворов (I/R, Ом-1), затем графически I/R=f(VNaOH) определяют точку эквивалентности, которая соответствует нейтрализации свободных карбоксильных групп. Затем к оттитрованному растору полиуронида добавляют 10 мл 0,1 моль/л раствора гидроксида натрия (избыток щелочи) для омыления этерифицированных карбоксильных и гидроксильных групп (омыление проводится 30-40 мин при комнатной температуре), после чего аликвотную часть омыленного раствора полисахарида титруют раствором 0,1 моль/л соляной кислоты. В системе координат: I/R-VNaOH графически определяют две точки эквивалентности: первая точка характеризует нейтрализацию гидроксида натрия, не вступившего в реакцию взаимодействия при омылении, а участок кривой между первой и второй точками эквивалентности соответствует титрованию всех карбоксильных групп (до и после омыления полиуронида, а также ацетата натрия). Другую аликвотную часть омыленного раствора полисахарида последовательно в статических условиях обрабатывают катионитом в Н+-форме (для удаления ионов натрия) и анионитом в ОН--форме (для удаления хлорид- и ацетат-ионов), затем раствор фильтруют и фильтрат снова кондуктометрически титруют 0,1 моль/л раствором гидроксида натрия. Графически определяют точку эквивалентности, которая соответствует нейтрализации всех карбоксильных групп. (Голубев В.Н., Шелухина Н.П. Пектин: химия, технология, применение. - М., 1995. - С.105-110).
Схематически определение функциональных групп в пектине по указанному способу можно представить в виде уравнений, показанных на схеме 1 (см. в конце описания).
Недостатками указанного способа являются: 1) невозможность количественного определения пектовой кислоты, т.к. а) после обработки анионитом пектовая кислота как малорастворимое соединение частично диссоциирует на пектат ион и ион водорода (Кдис•10-4 ), при этом пектат ион обменивается на ОH- группы анионита, осаждаясь на анионите; б) элюирование пектовой кислоты с катионита и анионита водой не может быть количественным, т.к. возможна адсорбция пектовой кислоты на смолах; в) после обработки ионитами образующаяся пектовая кислота (осадок) фильтруется и остается на фильтре, что не учитывается в описанной методике, поскольку определение пектовой кислоты, согласно методике, проводится не в нерастворимой части, а в фильтрате; 2) трудоемкость и длительность процесса, связанные с необходимостью регенерации катионитов и анионитов; 3) т.к. вода имеет слабокислую реакцию за счет образования карбонатов и гидрокарбонатов (рН 5-6,5), то при титровании полиуронидов щелочью часть последней расходуется на титрование воды, поэтому расход щелочи при анализе несколько завышен.
Известен способ определения содержания функциональных групп полисахаридов, заключающийся в следующем: раствор пектина титруют 0,1 моль/л раствором гидроксида натрия в присутствии фенолфталеина (определение свободных карбоксильных групп), затем добавляют еще 10 мл щелочи и оставляют при комнатной температуре на 30 мин. Избыток щелочи оттитровывают 0,1 моль/л раствором соляной кислоты в присутствии фенолфталеина (определение всех функциональных групп) и прибавляют еще 50 мл 0,1 моль/л раствора соляной кислоты, помещают в кипящую водяную баню на 10 мин, охлаждают, доводят до определенного объема, фильтруют. Отмеренное количество фильтрата титруют 0,1 моль/л раствором гидроксида натрия в присутствии фенолфталеина (определение всех карбоксильных групп пектина или пектовой кислоты). Аналогично проводят контрольный опыт. (Арасимович В.В., Балтага С.В., Пономарева Н.П. Методы анализа пектиновых веществ, гемицеллюлоз и пектолитических ферментов в плодах.- Кишинев: Редакционно-издательский отдел АН Молд. ССР, 1970. - С.38). Данный способ определения массовой доли функциональных групп полиуронидов наиболее близок к предлагаемому и выбран за прототип.
Недостатками указанного способа являются: а) невозможность количественного определения пектовой кислоты, т.к. пектовая кислота как малорастворимое соединение выпадает в осадок (после обработки соляной кислотой и нагревания), который фильтруется, поэтому определение пектовой кислоты необходимо вести в осадке, а не в фильтрате; б) невозможность количественного определения всех сложноэфирных групп, т.к. омыление с помощью 10 мл щелочи и в течение 30 мин недостаточно, в) установление точек эквивалентности визуальным способом с помощью фенолфталеина из-за нечеткого перехода окраски растворов способствует высокой погрешности определений.
Цель изобретения - количественное определение различных функциональных групп полиуроновых кислот, повышение точности анализа.
Поставленная цель достигается тем, что к навеске полисахаридов около 0,1 г (точная навеска) приливают 50 мл воды и перемешивают на магнитной мешалке с нагревом до получения раствора. Полученный раствор титруют потенциометрически на иономере И-135 (индикаторный электрод - стеклянный, электрод сравнения - хлорсеребряный) или кондуктометрически на кондуктометре КП (платиновые электроды) 0,1 моль/л раствором гидроксида натрия. К оттитрованному раствору полисахарида приливают 50 мл 0,1 моль/л раствора гидроксида натрия и оставляют раствор на 24 ч при комнатной температуре для полного омыления сложноэфирных групп. Затем весь раствор потенциометрически или кондуктометрически титруют 0,1 моль/л раствором соляной кислоты. При этом первая точка эквивалентности характеризует нейтрализацию гидроксида натрия, не вступившего в реакцию омыления, а участок кривой между первой и второй точками эквивалентности соответствует титрованию всех карбоксильных групп (до и после омыления полиуронидов, а также ацетата натрия). Далее для осаждения пектовой или альгиновой кислот приливают еще 50 мл 0,1 моль/л раствора соляной кислоты, стакан с раствором помещают в кипящую водяную баню на 10 мин, охлаждают, фильтруют через плотный бумажный фильтр ("синяя лента"), промывают осадок на фильтре водой до отрицательной реакции промывных вод на уксусную и соляную кислоты по универсальному индикатору. Затем осадок (пектовая или альгиновая кислоты) с фильтра количественно переносят в стакан с помощью 50 мл 0,1 моль/л раствора гидроксида натрия и оставляют на 30 мин при периодическом перемешивании для полного растворения, после чего потенциометрически или кондуктометрически титруют раствор пектата натрия или альгината натрия 0,1 моль/л раствором соляной кислоты: первая точка эквивалентности соответствует нейтрализации избытка гидроксида натрия, не вступившего в реакцию, а участок кривой между первой и второй точками эквивалентности соответствует титрованию карбоксильных групп полиуронида. Параллельно проводят контрольный опыт (без полиуронида).
При применении потенциометрического титрования для надежного определения точки эквивалентности строят график зависимости в системе координат
При использовании кондуктометрического титрования точку эквивалентности определяют графически в системе координат I/R-Vтитранта, где I/R - электропроводность растворов (Ом-1).
В результате исследований подобраны следующие оптимальные условия определения массовой доли функциональных групп полиуронидов (таблицы 1-4).
Из таблицы 1 следует, что потенциометрическое и кондуктометрическое титрования обусловливают хорошую воспроизводимость полученных результатов на всех этапах определения функциональных групп. Визуальная фиксация точки эквивалентности дает иные результаты при анализе различных функциональных групп возможно из-за "размытого" перехода окраски растворов в точке эквивалентности, неполного омыления полисахаридов, а также из-за отсутствия контрольного опыта, предусматривающего титрование воды с рН<7. При визуальной фиксации невозможно определить две точки эквивалентности, характерные для титрования избытка щелочи, не вступившей в реакцию, и прореагировавшей щелочи. При определении карбоксильных групп полиуроновых кислот (3-е титрование) по способу-прототипу определяется также только одна точка эквивалентности, соответствующая титрованию воды раствором гидроксида натрия; второй точки эквивалентности нет из-за потери полиуроновых кислот в результате фильтрации (кислоты остаются в виде осадков на фильтре).
Из таблицы 2 следует, что оптимальный объем щелочи для полного омыления этерифицированных групп составляет 50,0 мл. При меньших объемах щелочи рН растворов ≤7, т.е. щелочи недостаточно для практически полного омыления.
Из таблицы 3 видно, что наиболее оптимальная продолжительность омыления составляет 24 ч, при большей продолжительности реакции рH растворов полиуронидов не меняется.
Как следует из таблицы 4, в течение 30 мин осадки пектовой и альгиновой кислот растворяются в растворе гидроксида натрия, образуя истинные растворы.
Статистически обработанные результаты определений содержания функциональных групп приведены в таблице 5 (при п=6, Р=0,95).
Как следует из таблицы 5, погрешность определений предлагаемым способом в среднем в 2,3 раза меньше погрешности анализа по способу, принятому за прототип. При этом потенциометрический и кондуктометрический способы определения дают сопоставимые результаты, в то время как по способу-прототипу содержание свободных -СООН и суммы всех карбоксильных групп отличается, по-видимому, из-за перетитровывания анализируемых растворов и недостаточно полного омыления полисахаридов. При анализе карбоксильных групп полиуроновых кислот способ-прототип позволяет получить заниженные результаты в связи с потерями полиуроновых кислот при фильтрации.
Предлагаемый способ определения массовой доли функциональных групп полиуронидов поясняется следующими примерами конкретного выполнения.
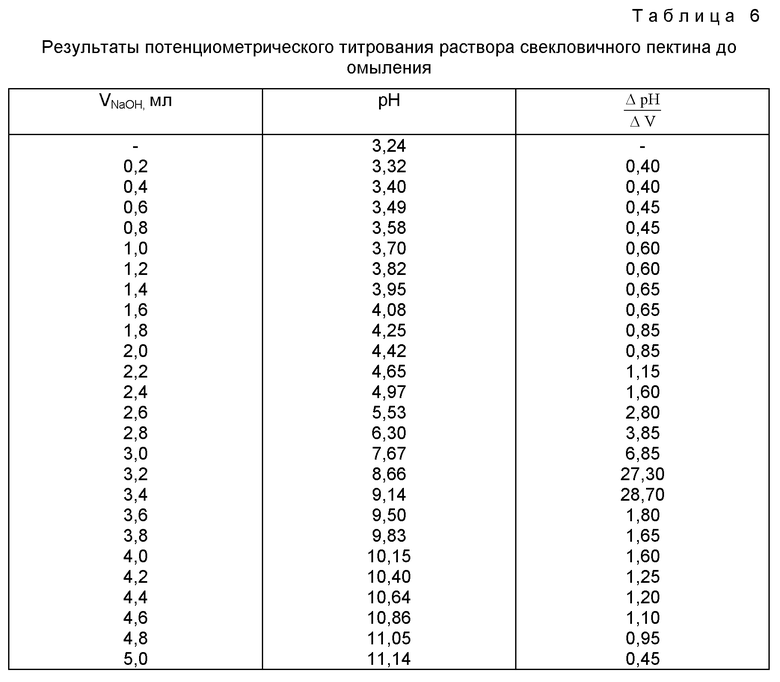
ПРИМЕР 1. К 0,1 г (точная навеска) свекловичного пектина приливают 50 мл воды очищенной и перемешивают на магнитной мешалке с нагревом до растворения пектина. Полученный раствор титруют 0,086 моль/л раствором гидроксида натрия потенциометрически на иономере И-135. В качестве индикаторного электрода используют стеклянный электрод, а в качестве электрода сравнения - хлорсеребряный. По полученным результатам - величине рН и объему титранта (VТ, мл) - определяют дифференциальным методом (Пономарев В.Д. Аналитическая химия. - М.: ВШ. 1982. - ч.2. - С.219-228) отношение 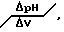 затем строят график зависимости в системе координат
затем строят график зависимости в системе координат
и определяют объем титранта в точке эквивалентности (таблица 6, фиг.1).
Как видно из фиг.1, объем титранта - 0,086 моль/л раствора гидроксида натрия - в точке эквивалентности составляет 3,4 мл.
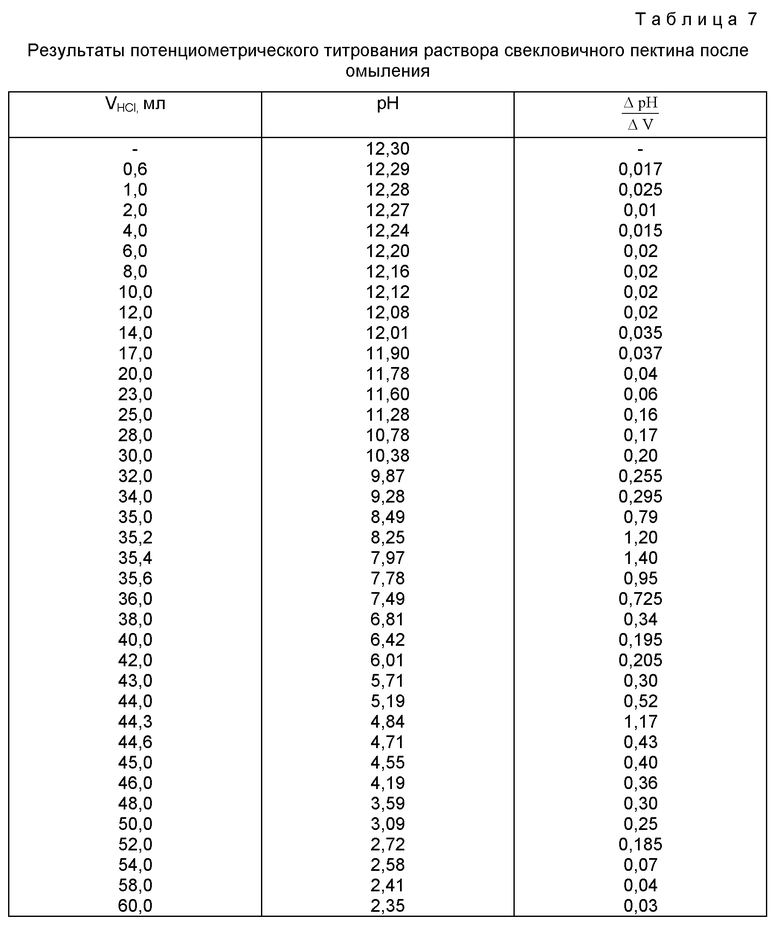
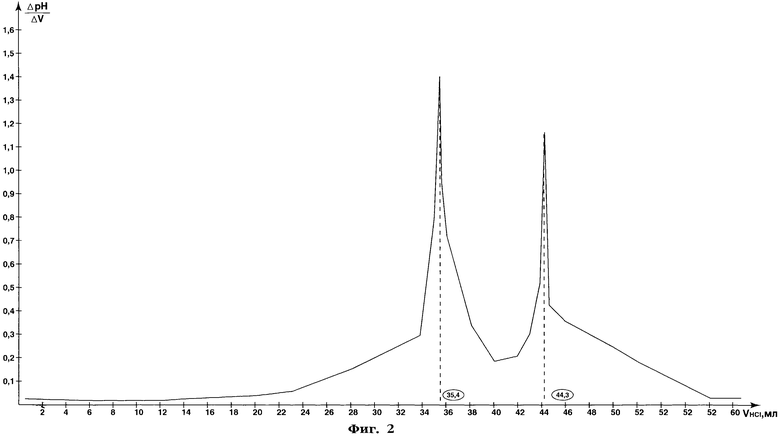
После титрования электроды промывают небольшим количеством воды (~5 мл), промывные воды сливают в стакан с оттитрованным раствором пектина. Затем к этому раствору приливают 50 мл 0,086 моль/л раствора гидроксида натрия и оставляют раствор на 24 ч при комнатной температуре для полного омыления сложноэфирных групп. Далее весь раствор потенциометрически титруют 0,1 моль/л раствором соляной кислоты. Результаты титрования приведены в таблице 7 и на фиг.2.
Как видно из фиг.2, объем титранта - 0,1 моль/л раствора соляной кислоты - в первой точке эквивалентности составляет 35,4 мл, во второй точке эквивалентности - 44,3 мл.
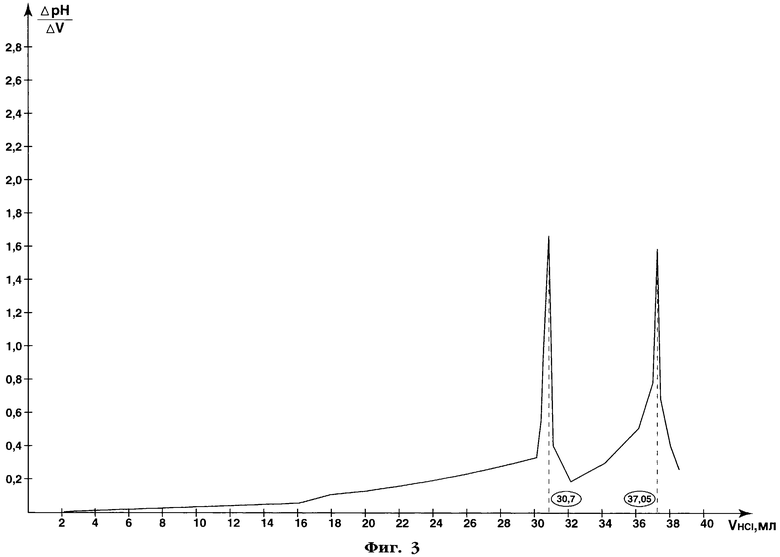
После титрования электроды промывают небольшим количеством воды (~5 мл), промывные воды сливают в стакан с оттитрованным раствором пектина. Затем к этому раствору приливают 50 мл 0,1 моль/л раствора соляной кислоты, стакан с раствором помещают в кипящую водяную баню на 10 мин, охлаждают, фильтруют через плотный бумажный фильтр ("синяя лента"). Осадок (пектовая кислота) на фильтре промывают водой до отрицательной реакции промывных вод на уксусную и соляную кислоты по универсальному индикатору. Затем осадок с фильтра количественно переносят в стакан с помощью 50 мл 0,086 моль/л раствора гидроксида натрия и оставляют на 30 мин при периодическом перемешивании для полного растворения, после чего потенциометрически титруют раствор пектата натрия 0,1 моль/л раствором соляной кислоты. Результаты потенциометрического титрования пектата натрия представлены в таблице 8 и на фиг.3.
Как видно из фиг.3, объем титранта - 0,1 моль/л раствора соляной кислоты - в первой точке эквивалентности составляет 30,7 мл, во второй точке эквивалентности - 37,05 мл. Параллельно титрованию анализируемых растворов пектина проводят контрольные опыты (без добавления пектина). При этом объемы титрантов в контрольных опытах составляют 0,2 мл, поэтому для точного определения объемов титрантов в точках эквивалентности в опытных растворах вычитают объем титранта в контрольных опытах. Таким образом, при первом титровании пектина объем 0,086 моль/л раствора гидроксида натрия составляет 3,4-0,2=3,2 мл; при втором титровании - 35,2 мл и 44,1 мл 0,1 моль/л раствора соляной кислоты; при третьем титровании - 30,5 мл и 36,85 мл 0,1 моль/л раствора соляной кислоты.
Массовую долю свободных карбоксильных групп (ω1,%) пектина определяют по формуле:
где СТ - концентрация титранта - гидроксида натрия, моль/л.
VТ - объем титранта, мл,
ЭCOOH - эквивалент карбоксильной группы (45 г/моль),
а - навеска пектина, г.
 ,
,
Содержание суммы карбоксильных групп пектина и уксусной кислоты (ω2, %, 2-е титрование) определяют по формуле:
где СТ ', СТ '' - концентрации титранта - 0,1 моль/л раствора соляной кислоты;
VТ ', VТ '' - объемы титранта соответственно в первой и второй точках эквивалентности, мл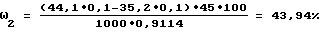
Содержание всех карбоксильных групп пектина (ω3, %; 3-е титрование) определяют аналогично ω2:
Содержание ацетилированных групп (ω4, %) определяют по формуле:
ω4 = ω2-ω3 = 43,94-31,35 = 12,59%
Количество ацетилированных групп (п) равно количеству гидроксильных групп: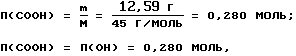
тогда содержание гидроксильных групп (ω5, %) составляет: ω5=п•М(ОН)= 0,280•17=4,76%
Содержание этерифицированных карбоксильных групп (ω6, %):
ω6 = ω3-ω1 = 31,35-13,59 = 17,76%
Количество этерифицированных карбоксильных групп равно количеству метанола: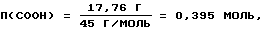
п(СООН)=п(СН3ОН)=0,395 моль,
тогда массовая доля метанола (ω7, %) составляет:
ω7=0,395•32=12,64%
Степень этерификации карбоксильных групп (ω8, % определяют по формуле: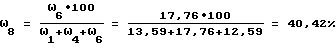
ПРИМЕР 2. К 0,02 г (точная навеска) альгиновой кислоты приливают 50 мл воды очищенной и перемешивают на магнитной мешалке с нагревом до растворения кислоты. Определение функциональных групп альгиновой кислоты проводят потенциометрически аналогично примеру 1.
С учетом контрольных опытов при первом титровании альгиновой кислоты объем 0,086 моль/л раствора гидроксида натрия составил 0,60 мл; при втором титровании 41,10 мл и 43,80 мл 0,1 моль/л раствора соляной кислоты; при третьем титровании - 36,20 мл и 38,45 мл 0,1 моль/л раствора соляной кислоты.
Аналогично примеру 1 рассчитывают содержание функциональных групп альгиновой кислоты: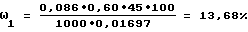
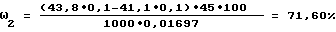

ω4=71,60-59,66=11,94%,
ω5=0,265•17=4,51%,
ω6=59,66-13,68=45,98%,
ω7=1,022•32=32,70%,
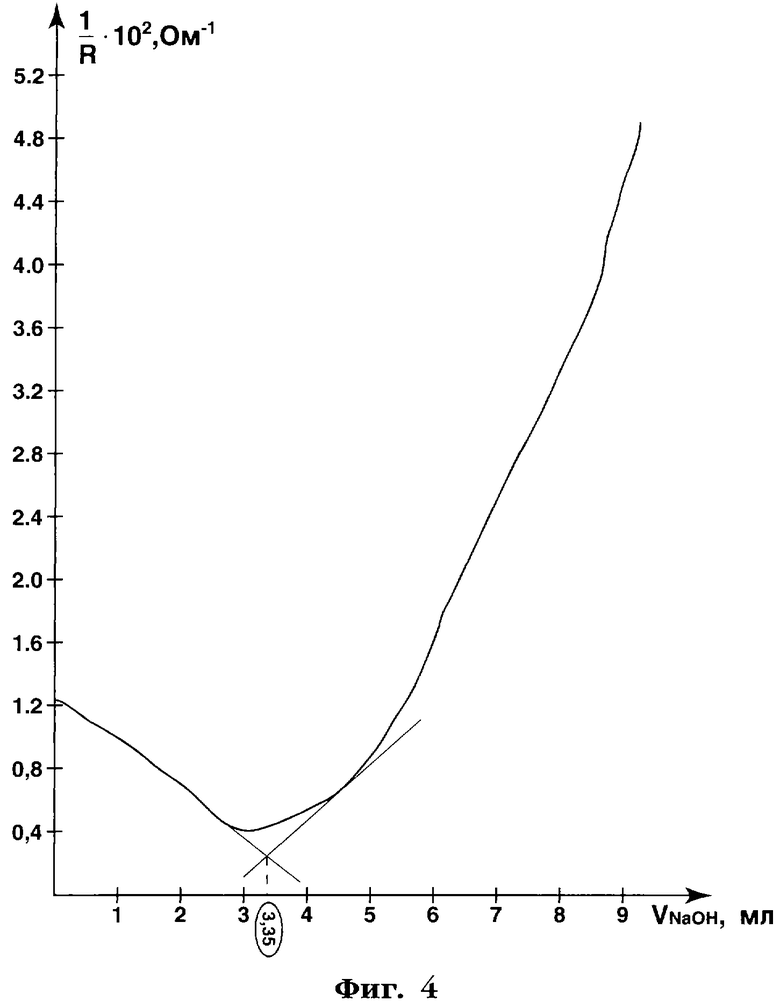
ПРИМЕР 3. К навеске свекловичного пектина около 0,1 г (точная навеска) приливают 50 мл воды очищенной и перемешивают на магнитной мешалке с нагревом до растворения пектина. Полученный раствор титруют 0,086 моль/л раствором гидроксида натрия кондуктометрически на кондуктометре КП. По полученным результатам - величинам сопротивления раствора (R, Ом) и вычисленным по ним значениям электропроводности растворов (I/R, Ом-1) и объему титранта (VТ, мл) графически определяют объем титранта в точке эквивалентности. Результаты кондуктометрического титрования свекловичного пектина приведены в таблице 9 и на фиг.4.
Как видно из фиг.4, объем титранта - 0,086 моль/л раствора гидроксида натрия - в точке эквивалентности составляет 3,35 мл.
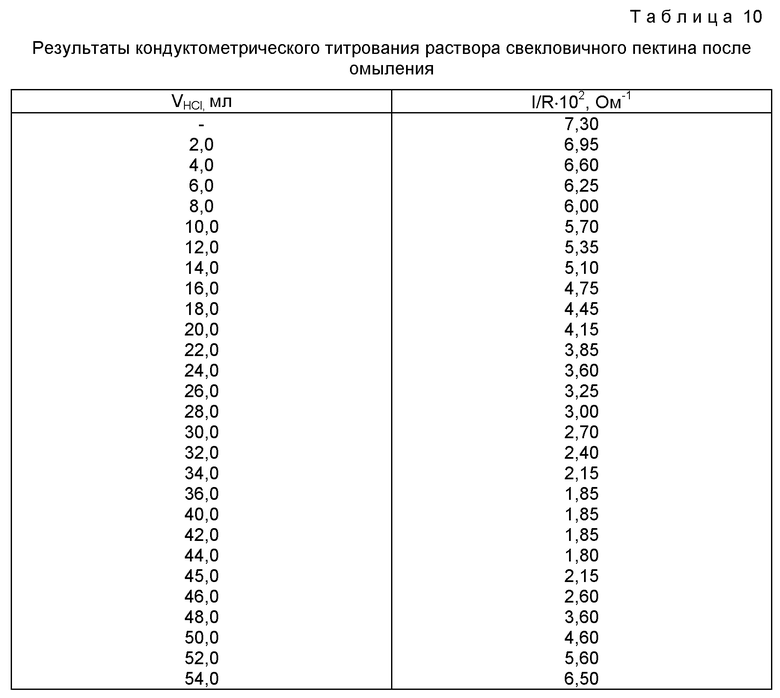
После титрования электроды промывают примерно 5 мл воды, промывные воды сливают в ячейку кондуктометра с оттитрованным раствором пектина. Затем к этому раствору приливают 50 мл 0,086 моль/л раствора гидроксида натрия и оставляют раствор на 24 ч при комнатной температуре для полного омыления сложноэфирных групп. Далее весь раствор кондуктометрически титруют 0,1 моль/л раствором соляной кислоты. Результаты титрования приведены в таблице 10 и на фиг.5.
Как видно из фиг.5, объем титранта - 0,1 моль/л раствора соляной кислоты - в первой точке эквивалентности составляет 35,45 мл, во второй точке эквивалентности - 44,35 мл.
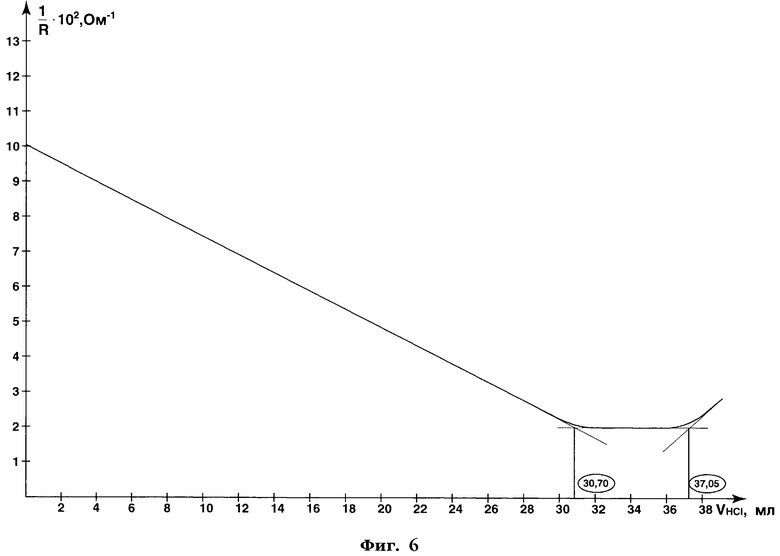
После титрования электроды промывают примерно 5 мл воды, промывные воды сливают в стакан с оттитрованным раствором пектина. Затем к этому раствору приливают 50 мл 0,1 моль/л раствора соляной кислоты, стакан с раствором помещают в кипящую водяную баню на 10 мин, охлаждают, фильтруют через бумажный фильтр "синяя лента". Осадок (пектовая кислота) на фильтре промывают водой до отрицательной реакции промывных вод на уксусную и соляную кислоты по универсальному индикатору. Затем осадок с фильтра количественно переносят в стакан с помощью 50 мл 0,086 моль/л раствора гидроксида натрия и оставляют на 30 мин при периодическом перемешивании до полного растворения, после чего кондуктометрически титруют раствор пектата натрия 0,1 моль/л раствором соляной кислоты. Результаты кондуктометрического титрования пектата натрия приведены в таблице 11 и на фиг.6.
Как видно из фиг.6, объем титранта - 0,1 моль/л раствора соляной кислоты - в первой точке эквивалентности составил 30,70 мл, во второй точке - 37,05 мл.
С учетом контрольных опытов при первом титровании пектина объем 0,086 моль/л раствора гидроксида натрия составил 3,15 мл; при втором титровании 35,25 мл и 44,15 мл 0,1 моль/л раствора соляной кислоты, при третьем титровании - 30,50 мл и 36,85 мл 0,1 моль/л раствора соляной кислоты.
Массовую долю функциональных групп пектина вычисляют по формулам, приведенным в примере 1.



ω4=43,96-31,37=12,59%,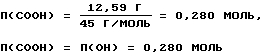
ω5=0,280•17=4,76%,
ω6=31,37-13,38=17,99%,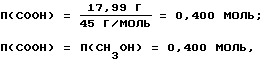
ω7=0,400•32=12,80%,
ПРИМЕР 4. К навеске альгиновой кислоты около 0,02 г (точная навеска) приливают 50 мл вода очищенной и перемешивают на магнитной мешалке с нагревом до растворения кислоты. Определение функциональных групп альгиновой кислоты проводят кондуктометрически аналогично примеру 3.
С учетом контрольных опытов при первом титровании альгиновой кислоты объем 0,086 моль/л раствора гидроксида натрия составил 0,60 мл; при втором титровании 41,10 мл и 43,80 мл 0,1 моль/л раствора соляной кислоты; при третьем титровании - 36,15 мл и 38,45 0,1 моль/л раствора соляной кислоты.
Массовую долю функциональных групп альгиновой кислоты рассчитывают по формулам, приведенным в примере 1.

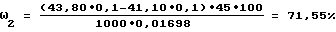
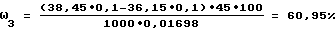
ω4=71,55-60,95=10,60%,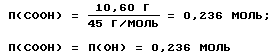
ω5=0,236•17=4,01%,
ω6=60,95-13,67=47,28%,
ω7=1,051•32=33,63%,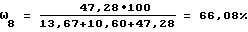
Таким образом, предлагаемый способ определения массовой доли функциональных групп полиуронидов обеспечивает следующий положительный эффект:
1) количественное определение полиуроновых кислот: в предлагаемом способе после нагревания, осаждения и фильтрации полиуроновых кислот анализ этих кислот проводят не в фильтрате, как предусмотрено по способу, принятому за прототип, а в нерастворимой части путем переведения осадков с помощью гидроксида натрия в раствор и последующего титрования соляной кислотой пектатов или альгинатов натрия. Данные таблицы 5 свидетельствуют о том, что при определении полиуроновых кислот по способу-прототипу при третьем титровании в фильтрате практически нет этих кислот, в то время как при анализе предлагаемым способом (анализ осадков) наблюдается высокое содержание этих кислот;
2) практически полное определение всех функциональных групп полиуроновых кислот при втором титровании, т.к. обеспечивается полное омыление сложноэфирных групп за счет увеличения объема щелочи (до 50 мл) и продолжительности омыления (24 ч), о чем свидетельствуют данные таблицы 5;
3) повышение точности анализа, или понижение погрешности определений в среднем в 2,3 раза за счет использования физико-химических методов анализа (потенциометрия, кондуктометрия) для фиксации точек эквивалентности.




Изобретение относится к фармацевтической и пищевой промышленности и касается стандартизации пектинов и альгинатов, используемых в качестве детоксикантов тяжелых металлов. Водный раствор полисахарида потенциометрически или кондуктометрически титруют 0,1 моль/л раствором гидроксида натрия (определение свободных карбоксильных групп). К оттитрованному раствору полисахарида приливают 0,1 моль/л раствора гидроксида натрия и оставляют раствор на 24 ч при комнатной температуре для полного омыления сложноэфирных групп, после чего раствор титруют 0,1 моль/л раствором соляной кислоты. Затем к оттитрованному раствору полисахарида приливают 0,1 моль/л раствора соляной кислоты, нагревают 10 мин на кипящей водяной бане, охлаждают, фильтруют, промывают осадок на фильтре водой до отрицательной реакции промывных вод на кислоты, после чего осадок полиуроновой кислоты количественно переносят в стакан с помощью 0,1 моль/л раствора гидроксида натрия и в течение 30 мин при периодическом перемешивании растворяют. Затем полученный раствор титруют 0,1 моль/л раствором соляной кислоты. Параллельно проводят контрольный опыт. Достигается повышение точности и информативности анализа. 6 ил., 11 табл.
Способ определения массовой доли функциональных групп полиуронидов, включающий растворение пробы в воде, титрование полученного раствора 0,1 молярным раствором гидроксида натрия и фиксирование объема титранта, омыление сложноэфирных групп при добавлении к оттитрованному раствору 0,1 молярного раствора гидроксида натрия и последующей выдержке при комнатной температуре, титрование избытка щелочи 0,1 молярным раствором соляной кислоты и фиксирование объема титранта, добавление к оттитрованному раствору 0,1 молярного раствора соляной кислоты, помещение полученного раствора в кипящую водяную баню на 10 мин с последующим охлаждением и фильтрованием, расчет содержания функциональных групп, исходя из зафиксированных объемов титранта, отличающийся тем, что выдержку раствора при омылении осуществляют в течение 24 ч, после фильтрования осадок промывают до отрицательной реакции промывных вод на уксусную и соляную кислоты по универсальному индикатору с последующим растворением в 0,1 молярном растворе гидроксида натрия в течение 30 мин при периодическом перемешивании и титрованием полученного раствора 0,1 молярным раствором соляной кислоты при фиксировании объема титранта, титрование осуществляют потенциометрически или кондуктометрически с фиксированием объемов титранта по точкам эквивалентности.
| АБРАСИМОВИЧ В.В., БАЛТАГА С.В., ПОНОМАРЕВА Н.П | |||
| Методы анализа пектиновых веществ, гемицеллюлоз и пектолитических ферментов в плодах | |||
| - Кишинев: Редакционно-издательский отдел АН Молдавской ССР, 1970, с.38 | |||
| RU 2064178 C1, 20.07.1996 | |||
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ ПЕКТИНОВЫХ ВЕЩЕСТВ | 1991 |
|
RU2010801C1 |
| Способ количественного определения трудногидролизуемых полисахаридов в растительном сырье | 1987 |
|
SU1525573A1 |
| ГОЛУБЕВ В.Н., ШЕЛУХИНА Н.П | |||
| Пектин: химия, технология, применение | |||
| - М., 1995, с.105-110 | |||
| КАРАКОЛЕВ Г., ОГНЯНОВ И., МАРИНОВ М | |||
| Пектиновые вещества | |||
| Химия, производство, приложение | |||
| - София: Державно издательство "Наука и искусство", 1956, 154 с. | |||
Авторы
Даты
2003-06-10—Публикация
2001-12-13—Подача