Изобретение относится к области санитарно-гигиенической оценки пищевых продуктов и касается определения микроколичеств соединений авермектинового ряда в продуктах растительного и животного происхождения после применения препаратов, содержащих авермектииовый комплекс - аверсектин С, таких как аверсект-2, универм, фитоверм и др., и используемых для защиты животных и растений от экто- и эндопаразитов.
Предшествующий уровень техники
Авермектины - соединения, обладающие широким спектром инсектоакаронематоцидного действия, широко используются для профилактики и лечения паразитарных заболеваний животных и для защиты сельскохозяйственных культур от вредителей (В.А.Дриняев и др., Аверсектин С: физико-химические и биологические свойства. Прикладная биохимия и микробиология, 1999, том 35, 2, с.199-205). По характеру воздействия авермектины относятся к нейротоксинам и используются в практике в микродозах. Содержание авермектинов в продуктах питания строго ограничено соответствующими нормативными документами и не должно превышать 0,005 мг на кг продукта, в связи с чем необходимы высокочувствительные методы определения.
По своему химическому строению все авермектины являются 16-членными макролидными лактонами, содержащими по два остатка олеандрозы. Основные авермектины имеют обозначения A1 A2; В1 и В2.
Авермектины группы А и группы В отличаются между собой заместителем у 5-го углеродного атома макролидного кольца.
Известен высокочувствительный способ определения микроколичеств авермектина B1 - абамектина и его дигидропроизводного ивермектина, основанный на получении их флуоресцирующих производных при воздействии трифторуксусным ангидридом в присутствии N-метилимидазола в ацетонитриле с последующим определением методом флуоресцентной жидкостной хроматографии: детектирование ведут при длинах волн возбуждения и эмиссии 365 и 470 нм соответственно. Чувствительность метода составляет 0,004-0,005 мг в кг продукции. Описанный метод рекомендован для определения абамектина и ивермектина в продуктах питания как растительного, так и животного происхождения после применения таких препаратов, как вертимек, ивомек и др. (Sunil V. Prabhu et al. Rapid and Sensitive High-Performance Liquid Chromatographic Method for the Quantitation of Abamectin and Its Delta 8,9-Isomer, J. Agric. Food Chem. 1992, 40, 622-625). Описан также способ получения флуоресцирующего производного авермектина B2 с использованием трифторуксусного ангидрида в присутствии N-метилимидазола (А. В.Викторов и др., ВЭЖХ-флуоресцентный метод определения микроколичеств аверсектина С в растительных объектах. Биотехнология, 1996, 6, с.55-62).
Недостаток известных способов состоит в том, что он дает возможность получать производные только авермектинов группы В, имеющих в своей молекуле гидроксильную группу у пятого углеродного атома. Авермектины группы А в этом положении имеют группу ОСН3. Метальный радикал в С5 положении препятствует получению флуоресцентных производных авермектинов группы А.
Другим недостатком известных способов является высокая лабильность получаемых производных. Они сохраняют флуоресценцию в течение всего нескольких часов при хранении их при пониженной температуре, что ограничивает возможности анализа.
Сущность изобретения
Для получения возможности определять все авермектины, входящие в состав аверсектина С, разработан прием предварительного деметилирования метальных групп, в том числе в положении С5-ОСН3 сайта в структуре авермектинов группы А, что обеспечивает дальнейшее получение флуоресцирующих производных. Авермектины группы В при этом также образуют флуоресцирующие производные.
Способ определения микроколичеств авермектинов в продуктах животного и растительного происхождения включает отбор пробы, ее гомогенизацию, экстракцию из пробы авермектинов, их очистку, получение флуоресцирующих производных авермектинов и последующее их определение ВЭЖХ-флуоресцентным методом (ВЭЖХ - высокоэффективная жидкостная хроматография).
Экстрагентами авермектинов могут служить изооктан, этилацетат, метанол и др.
Очистку авермектинов проводят методом скоростной хроматографии сначала на катионообменном, а затем на анионообменном сорбенте. В качестве катионообменного сорбента преимущественно используют модифицированный силикагель с привитыми октальными группами (патрон С-8 с обращенной фазой), а в качестве анионообменного сорбента - модифицированный силикагель с привитыми NH2- группами (патрон с прямой фазой).
Получение флуоресцирующих производных проводят в уксусном ангидриде в присутствии N-метилимидазола при нагревании. Оптимальное соотношение уксусного ангидрида и N-метилимидазола составляет 2:1. При получении флуоресцирующих производных реакционную смесь обычно выдерживают на кипящей водяной бане в течение часа. Возможно также перед выдержкой на водяной бане озвучить реакционную смесь в течение 20-40 секунд в ультразвуковой бане.
Хроматографический анализ производных на колонке диасорб С-16 в изократическом режиме в системе метиловый спирт:вода в соотношении 98:2 показал, что все они могут быть обнаружены с помощью флуоресцентного детектора при длинах волн возбуждения и эмиссии 370 и 465 нм соответственно. При этом производное авермектина А1 элюируется с временем удерживания между 9 и 10 мин, что совпадает с временем удерживания производного авермектина B1. Производное авермектина А2 элюируется с временем удерживания между 7-й и 8-й мин, что совпадает с временем удерживания производного авермектина В2.
На хроматограмме производного, полученного для комплексного авермектинового препарата - аверсектина С - обнаруживаются два основных пика, соответствующих авермектинам серии 1 и 2 (фиг.1).
На всех хроматограммах обнаруживается пик со временем удерживания между 6-й и 7-й минутами, относящийся к продукту взаимодействия уксусного ангидрида и N-метилимидазола (контрольная проба: уксусный ангидрид + N-метилимидазол - условия реакции те же).
Отклонение от оптимального соотношения уксусного ангидрида и N-метилимидазола (2:1) приводит к снижению выхода реакции деметилирования. Реактивы - уксусный ангидрид и N-метилимидазол берут в избыточном количестве, достаточном для определения 4 мкг авермектинов, что значительно превышает содержание остаточных количеств авермектинов в исследуемых объектах. Подобранный объем реакционной смеси для проведения дериватизации - 15 мкл является оптимальным. Его увеличение приводит к снижению выхода производных и резкому увеличению образования побочных продуктов. Уменьшение выхода продуктов дериватизации наблюдается при снижении температуры проведения процесса.
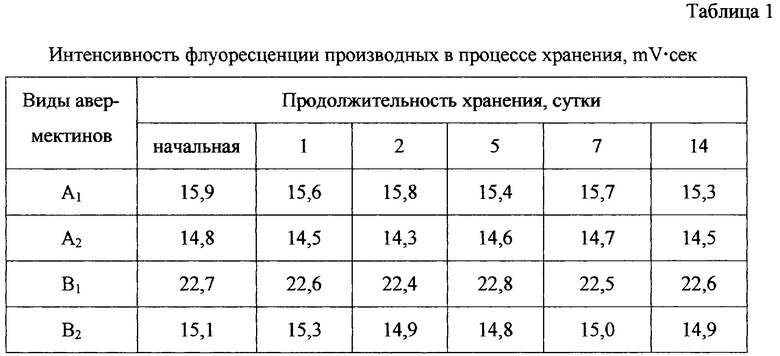
Установлена корреляционная зависимость интенсивности флуоресценции от количества авермектинов, участвующих в реакции.
Производные авермектинов, получаемые предлагаемым методом, устойчивы.
Уровень флуоресценции продуктов реакции сохраняется в течение длительного времени (сроки наблюдения - 14 дней), хранение при -20o и +20oС, что облегчает проведение серийных анализов при осуществлении контроля за содержанием авермектинов в исследуемых объектах.
Примеры осуществления предлагаемого изобретения
Пример 1. Установление зависимости интенсивности флуоресценции от концентрации авермектина A1.
Проведение реакции дериватизации. В стеклянные пробирки внесли по 10, 20, 30, 40, 50, 60, 70 и 80 нг авермектина A1 в метанольном растворе. Растворы упарили в вакуум-сушильном шкафу досуха. В каждую пробирку внесли по 10 мкл свежеперегнанного уксусного ангидрида и по 5 мкл N-метилимидазола. Пробирки плотно закрыли и поместили в кипящую баню на 1 час, после чего образцы охладили и довели объем каждой пробы до 500 мкл ацетонитрилом.
Проведение хроматографического анализа. На хроматографическую колонку, заполненную обращенной фазой Диасорб С-16, нанесли 50 мкл подготовленного образца. В качестве подвижной системы использовали смесь метилового спирта с водой в соотношении 98:2 соответственно. Скорость потока 0,8 мл/мин. Давление 120-160 атм. Детектирование вели при длинах волн возбуждения и эмиссии 365 и 470 нм. На хроматограммах отмечали время удерживания производного. Интенсивность флуоресценции характеризовали площадью пика, выраженной в виде сигнала mV•с.
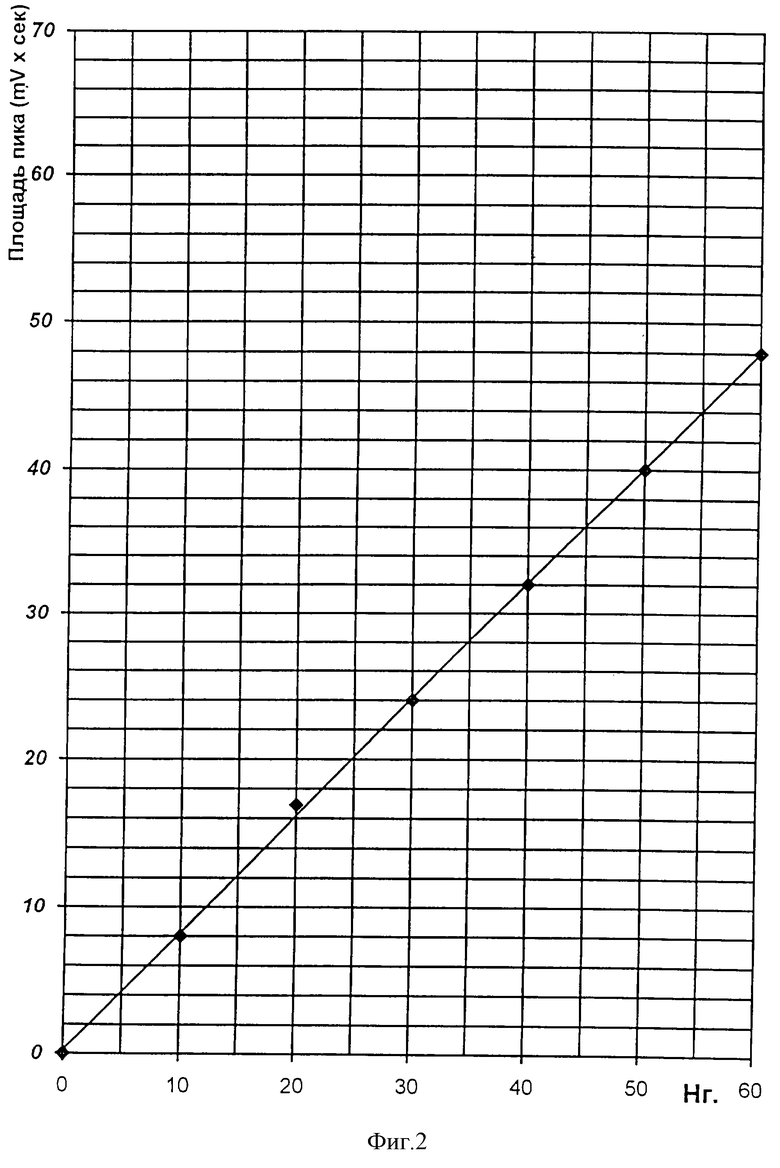
Время удерживания производного авермектина А1 составило 10 мин. Зависимость площади хроматографического пика от количества авермектина A1, внесенного в колонку, представлена на фиг.2.
Пример 2. Установление зависимости интенсивности флуоресценции от концентрации авермектина А2.
Для проведения реакции взяли те же количества авермектина A2, что и в примере 1. Условия проведения реакции и анализа такие же, как и в примере 1.
Время удерживания производного А2 составило 6,5 мин. Зависимость площади хроматографического пика от количества авермектина Аз, внесенного в колонку, представлена на фиг.3.
Пример 3. Установление зависимости интенсивности флуоресценции от концентрации авермектина B1.
Для проведения реакции взяли такие же концентрации, какие указаны в примере 1. Условия проведения реакции и анализа такие же, как в примере 1.
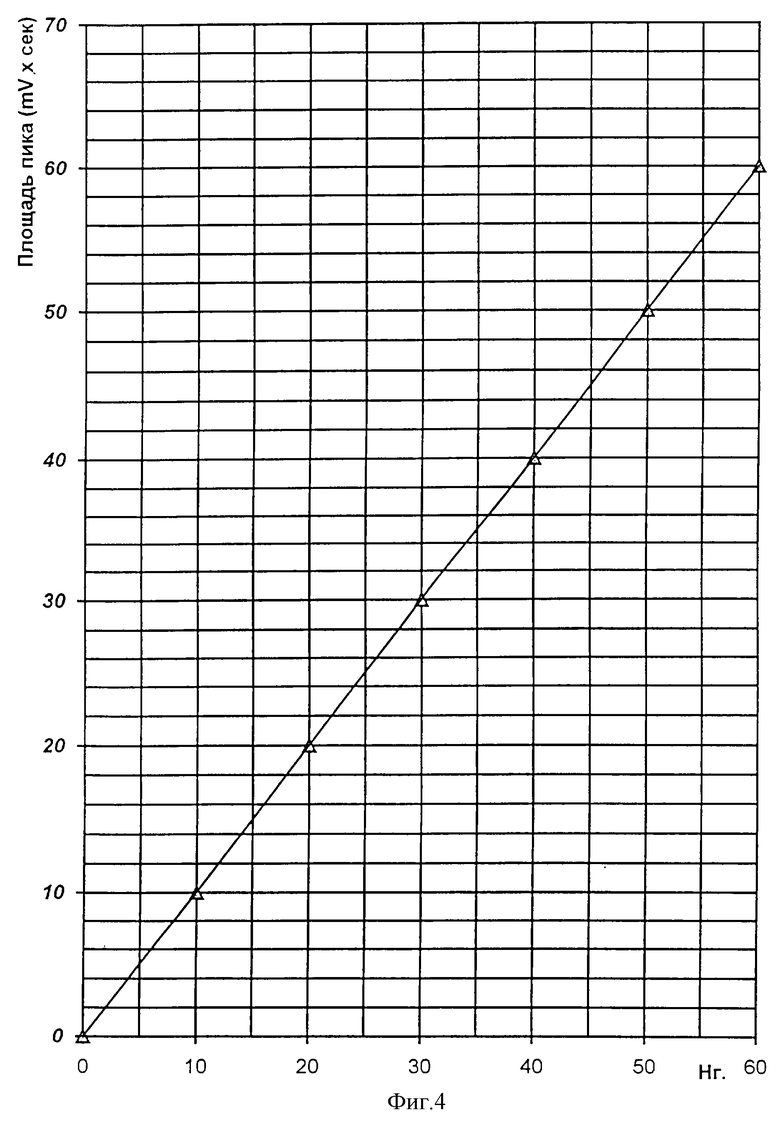
Время удерживания производного B1 10 мин, что совпадает с временем удерживания авермектина A1. Зависимость площади хроматографического пика от количества авермектина B1 внесенного в реакцию, представлена на фиг.4.
Пример 4. Установление зависимости интенсивности флуоресценции от концентрации авермектина В2.
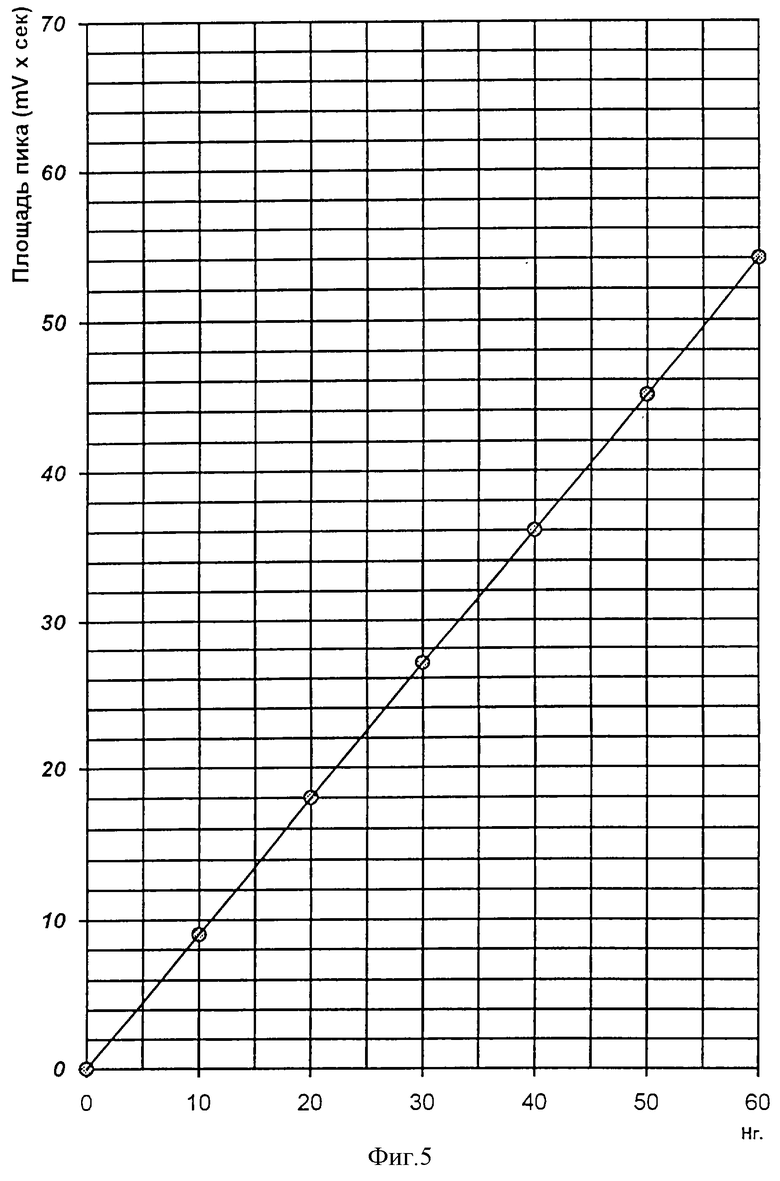
Для проведения реакции взяли такие же концентрации авермектина B2, как и для других авермектинов (примеры 1-3). Условия проведения реакции такие же, как в предыдущих примерах. Зависимость площади хроматографического пика от концентрации авермектина В2, внесенного в реакцию, представлена на фиг.5.
Пример 5. Установление зависимости интенсивности флуоресценции от концентрации аверсектина С.
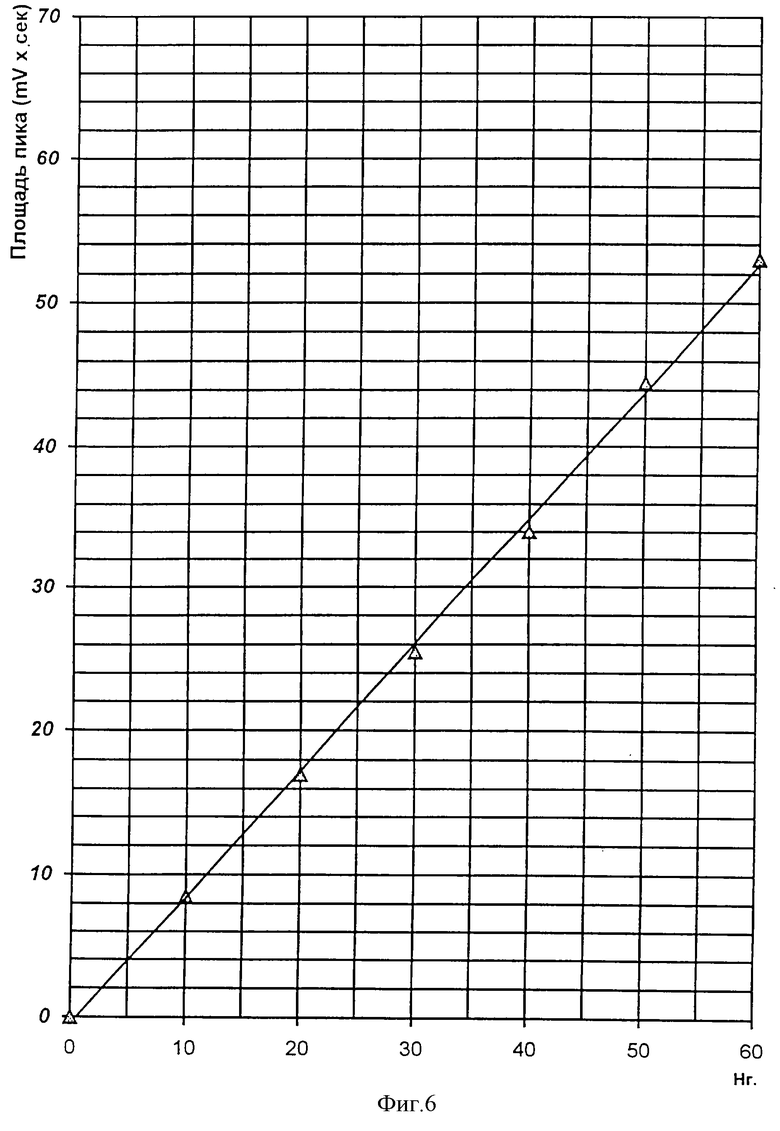
Для проведения реакции брали такие же концентрации, как и для индивидуальных авермектинов. Условия проведения реакции такие же, как в предыдущих примерах. При хроматографировании продуктов реакции на хроматограмме обнаруживаются два пика (кроме побочного), соответствующие по времени удерживания производным авермектинов А1 и B1 и А2 и В2. Сумма площадей двух пиков находилась в прямой зависимости от концентрации аверсектина С, взятого в реакцию (фиг.6).
Пример 6. Описанным в примере 1 способом получили производные для каждого из 4-х авермектинов. После проведения реакции измерили интенсивность флуоресценции. Реакционные смеси заложили на хранение при комнатной температуре и периодически отбирали пробы для хроматографического анализа.
В табл. 1 приведены данные по интенсивности флуоресценции производных (площади пиков mV•с) в процессе хранения.
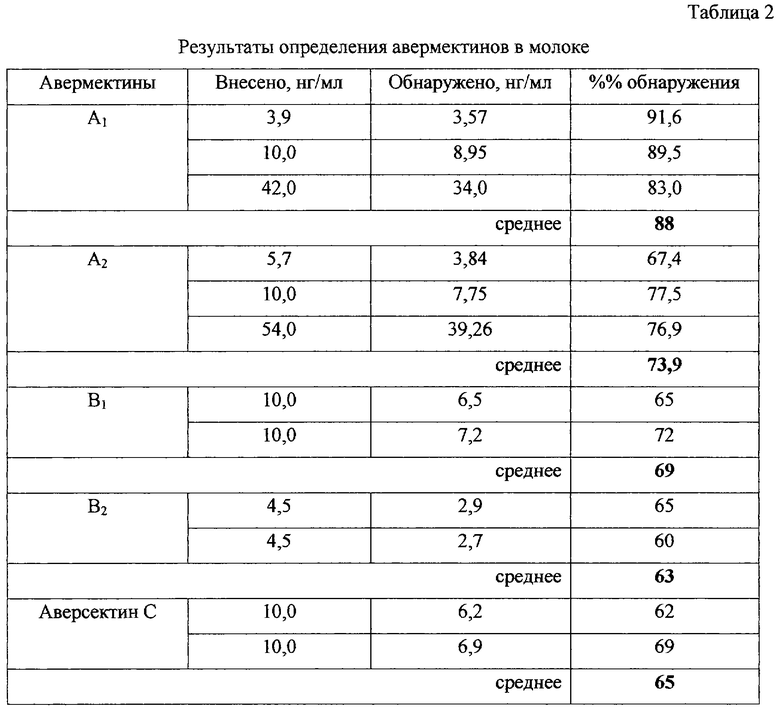
Пример 7. Определение авермектинов A1, A2, В1 и В2 и аверсектина С в молоке (модельные опыты).
Индивидуальные авермектины и аверсектин С внесли в молоко в количествах, указанных в таблице 2. Для анализа 1 мл молока каждого образца добавили 5 мл смеси ацетон:вода (1:1) и перемешали в течение 5 минут. Из полученной эмульсии авермектины экстрагировали дважды 5 мл изооктана. Экстракцию вели при встряхивании с последующим центрифугированием. Изооктановые экстракты упарили, остаток растворили в 4 мл ацетонитрила. Ацетонитрильный раствор 5 раз промыли гексаном, а затем поместили в стеклянные пробирки и упарили досуха. Получение флуоресцирующих производных и хроматографический анализ вели так, как в примере 1.
Результаты определения авермектинов представлены в табл. 2.
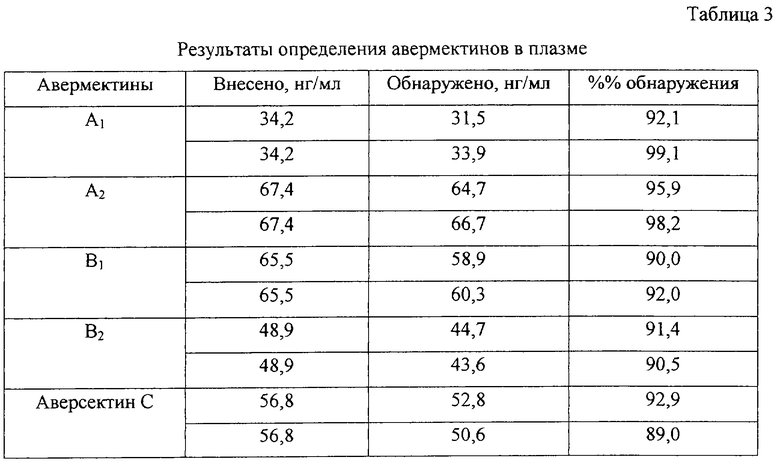
Пример 8. Определение авермектинов А1, A2, B1 и В2 и аверсектина С в плазме (модельный опыт).
Индивидуальные авермектины и аверсектин С внесли в плазму, полученную из крови телят в количествах, указанных в таблице 3. Далее вели подготовку образцов к анализу. 1,0 мл Плазмы крови поместили в гомогенизатор, туда же добавили 3 мл смеси этиловый спирт:вода (1:1). Обработку вели при 4500 об/мин в течение 10 минут. Из полученной эмульсии авермектины экстрагировали этилацетатом 3 раза порциями по 8 мл. Экстракцию вели при встряхивании с последующим центрифугированием. Этилацетатные экстракты отобрали и упарили в вакууме досуха. Остаток растворили в 4 мл ацетонитрила. Ацетонитрильный раствор 3 раза промыли гексаном, далее упарили досуха. Получение флуоресцирующих производных и проведение хроматографического анализа вели, как указано в примере 1. Результаты определения авермектинов в плазме представлены в табл 3.
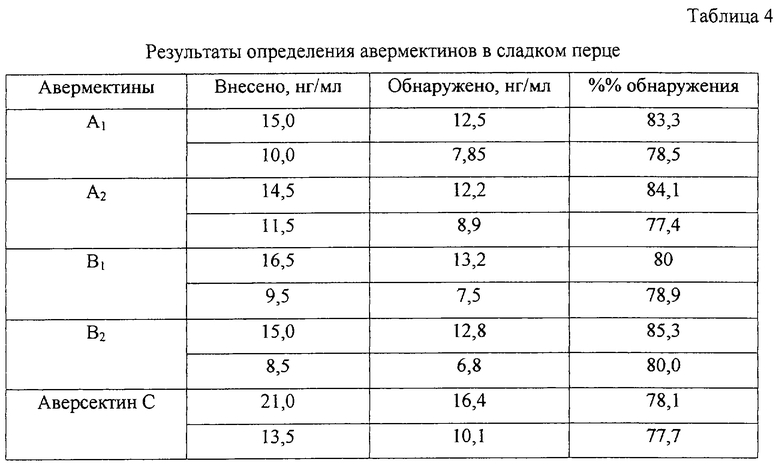
Пример 9. Определение авермектинов A1, A2, В1 и В2 и аверсектина С в сладком перце.
К образцам гомогенизированной массы сладкого перца, взятым в количестве по 5 г, добавили авермектины и аверсектин С в количествах, указанных в табл. 4. Далее вели подготовку образцов к анализу. Навеску гомогенизированной массы с внесенными авермектинами поместили в центрифужный стакан емкостью 50 мл, добавили 10 мл метилового спирта. Суспензию тщательно перемешали, после чего центрифугировали. Экстракцию метиловым спиртом повторили дважды. Экстракты объединили и разбавили дистиллированной водой до 100 мл. Водно-метановый раствор очистили с помощью твердофазной экстракции патронами диапак-8 и диапак амина. Очищенный раствор упарили досуха. Получение флуоресцирующих производных и хроматографического анализа вели, как указано в примере 1. Результаты определения авермектинов в сладком перце представлены в табл. 4.
Предлагаемое изобретение дает возможность определять в микроколичествах все компоненты авермектинового комплекса в продуктах питания животного и растительного происхождения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ВЫДЕЛЕНИЯ АВЕРМЕКТИНОВЫХ КОМПЛЕКСОВ | 2000 |
|
RU2182174C2 |
| ПРОТИВОПАРАЗИТАРНЫЙ ВЕТЕРИНАРНЫЙ ИНЪЕКЦИОННЫЙ ПРЕПАРАТ | 2000 |
|
RU2201243C2 |
| ПРЕПАРАТ ДЛЯ ЗАЩИТЫ ЖИВОТНЫХ И РАСТЕНИЙ | 2000 |
|
RU2201244C2 |
| ПРОТИВОПАРАЗИТАРНЫЙ ПРЕПАРАТ ДЛЯ ЛЕЧЕНИЯ СОБАК И КОШЕК | 2006 |
|
RU2356562C2 |
| СРЕДСТВО ДЛЯ БОРЬБЫ С СИНАНТРОПНЫМИ НАСЕКОМЫМИ | 1999 |
|
RU2159040C1 |
| ПРОТИВОПАРАЗИТАРНОЕ СРЕДСТВО | 1999 |
|
RU2160536C1 |
| ШТАММ АКТИНОМИЦЕТА STREPTOMYCES AVERMITILIS ССМ 4697 - ПРОДУЦЕНТ АВЕРМЕКТИНОВ | 1998 |
|
RU2156301C2 |
| ПРОТИВОПАРАЗИТАРНЫЙ ПРЕПАРАТ ДЛЯ БЕЗЫГОЛЬНОГО ВВЕДЕНИЯ | 2003 |
|
RU2251421C2 |
| КОМПОЗИЦИЯ ДЛЯ БОРЬБЫ С ВРЕДИТЕЛЯМИ РАСТЕНИЙ | 2000 |
|
RU2181244C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ МИКРОКОЛИЧЕСТВ КЛОЗАНТЕЛА В ПЛАЗМЕ, МОЛОКЕ, ТКАНЯХ | 2007 |
|
RU2366950C2 |

Изобретение предназначено для использования в области санитарно-гигиенической оценки пищевых продуктов и касается определения микроколичеств соединений авермектинового ряда в продуктах растительного и животного происхождения, после применения препаратов, содержащих авермектины и используемых для защиты животных и растений от экто- и эндопаразитов. Способ определения микроколичеств авермектинов в продуктах животного и растительного происхождения включает отбор пробы, ее гомогенизацию, экстракцию из пробы авермектинов, их очистку, получение флуоресцирующих производных авермектинов и последующее их определение ВЭЖХ-флуоресцентным методом. Получение флуоресцирующих производных проводят в уксусном ангидриде в присутствии N-метилимидазола при нагревании. Очистку авермектинов проводят методом скоростной хроматографии сначала на катионообменном, а затем на анионообменном сорбенте. В качестве катионообменного сорбента используют модифицированный силикагель с привитыми октильными группами, а в качестве анионообменного сорбента используют модифицированный силикагель с привитыми NH-группами. При получении флуоресцирующих производных реакционную смесь выдерживают на кипящей водяной бане в течение часа. Перед выдержкой на водяной бане реакционную смесь в течение 20-40 с можно обработать ультразвуком. Изобретение позволяет определить в микроколичествах все компоненты авермектинового комплекса. 5 з.п. ф-лы, 6 ил., 4 табл.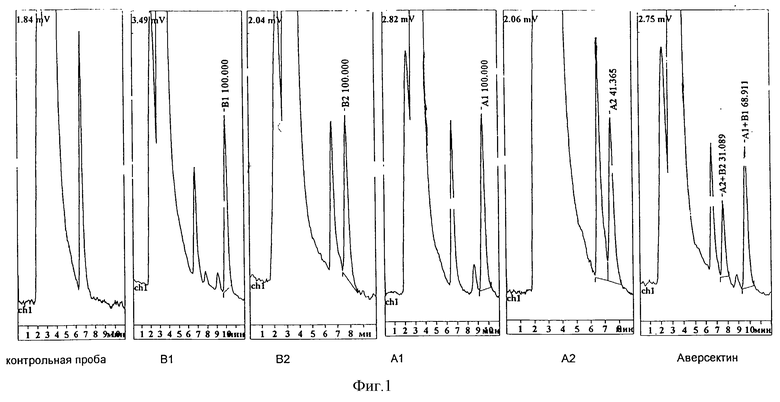
| ВИКТОРОВ А.В | |||
| и др | |||
| ВЭЖХ-флуоресцентный метод определения микроколичеств аверсектина С в растительных объектах | |||
| -Биотехнология, 1996, №6, с.55-62 | |||
| PRABHU S.V | |||
| et al | |||
| J | |||
| Agric | |||
| Food Chem | |||
| Пуговица для прикрепления ее к материи без пришивки | 1921 |
|
SU1992A1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АВЕРМЕКТИНОВ | 1995 |
|
RU2083970C1 |
Авторы
Даты
2003-06-27—Публикация
2001-11-01—Подача