Изобретение относится к биохимии, физиологии и фармакологии, в частности к применению известного 3,6-бис(4-аминофуразан-3-ил)-1,4,2,5-диоксадиазина (БАФДОД) формулы I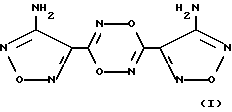
в качестве донора оксида азота, активирующего растворимую форму гуанилатциклазы (рГЦ), ингибирующего агрегацию тромбоцитов и обладающего спазмолитическим и сосудорасширяющим действием.
Данное изобретение может быть использовано в биохимии, физиологии и медицине.
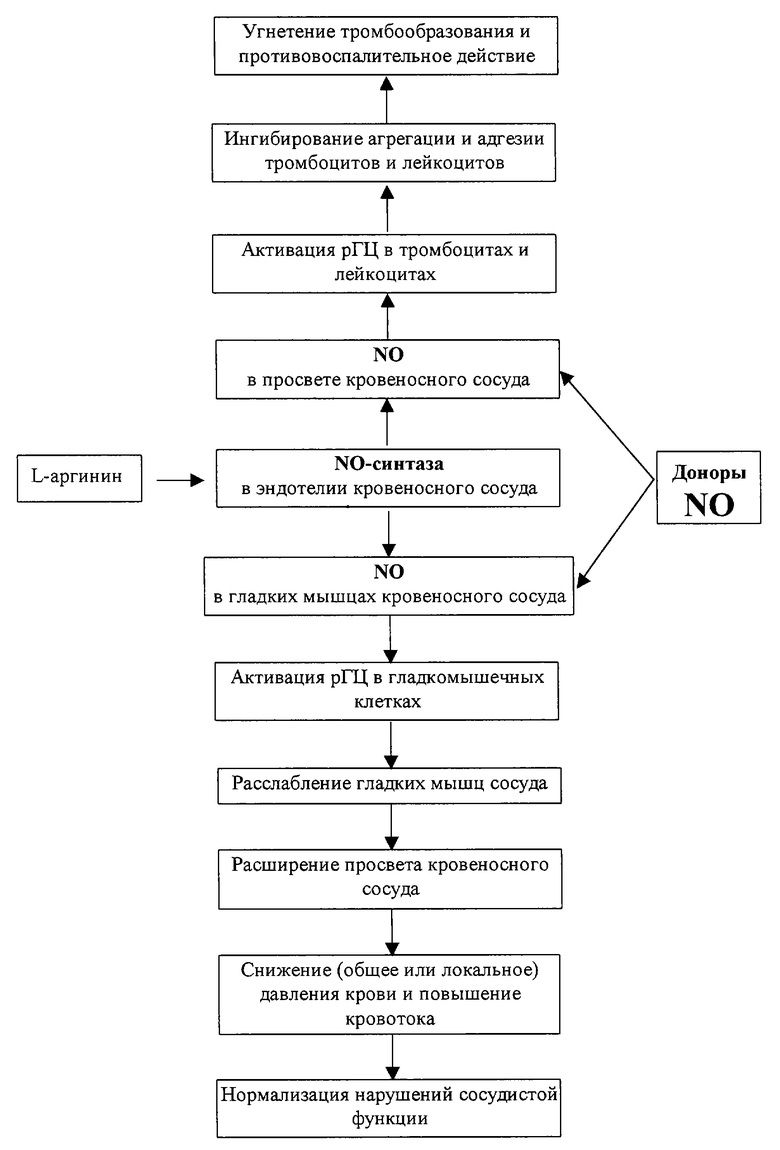
Оксид азота (NO), синтезируемый эндотелиальными клетками и другими типами клеток и тканей, играет одну из ключевых ролей в поддержании нормального тонуса гладких мышц сосудов, влияющего на системное давление крови. Кроме того, NO оказывает спазмолитическое действие на мышцы желудочно-кишечного тракта, желчных путей, мочеточников, матки, бронхов и других органов, а также ингибирует процессы агрегации и адгезии тромбоцитов и нейтрофилов (М.Д. Машковский "Лекарственные средства", т.1, "Торсинг", Харьков, 1998 г., стр. 385 [1] ). Механизм молекулярного действия эндогенного оксида азота, синтезируемого из аминокислоты L-аргинина, включает его диффузию через плазматические мембраны и связывание с гемовой группой рГЦ. Гуанилатциклаза /КФ 4.6.1.2; гуанозин-5'-трифосфат-пирофосфатлиаза (циклизующая)/ является ферментом, катализирующим биосинтез гуанозин-3',5'-циклофосфата (цГМФ) - вторичного мессенджера, выполняющего роль универсального регулятора внутриклеточного метаболизма (F. Murad "Regulation of cytosolic guanylyl cyclase by nitric oxide: The NO-cGMP signal transduction system" Adv. Pharmacol. 1994, v. 26, p. 19-33). ГЦ существует в двух формах - мембранной и растворимой. В настоящее время установлено, что в результате взаимодействия NO с атомом железа гема, входящего в состав фермента, и образования комплекса нитрозил-гем возникают конформационные изменения активного центра фермента, которые приводят к активации рГЦ и повышению синтеза цГМФ (см. чертеж).
К настоящему времени доказано образование оксида азота в результате энзиматической биотрансформации тринитроглицерина и других нитратов, которые используются для лечения сердечно-сосудистых заболеваний в качестве антиишемических и антиангинальных препаратов ([1], стр. 385 - 392). Однако их существенным недостатком является слабая антиагрегантная активность, а также возникновение толерантности и других побочных эффектов при длительном применении. Кроме того, данные органические нитраты в составе различных лекарственных форм эффективно снижают артериальное давление, что существенно затрудняет их локальное применение (например, в случаях церебрального вазоспазма, легочной гипертонии, рестеноза после ангиографии и т.д.).
Известны различные гетероциклические соединения, обладающие способностью генерировать NO, активировать рГЦ и проявляющие антиагрегантные, спазмолитические и/или сосудорасширяющие свойства.
Так, известны производные 1,2,4-оксадиазол-5-она общей формулы II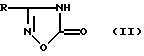
где R - фенил, 4-хлорфенил или стирил, которые рассматривались в качестве предшественников (депо-форм) NO-генерирующих соединений (амидоксимов). Данные производные не обладали гипотензивным действием, но ингибировали агрегацию тромбоцитов под действием коллагена в моделях ex vivo и in vivo (K. Rehse, F.Brehme "New NO-donors with antithrombotic and vasodilating activities. Part 26: Amidoximes and their prodrugs" Arch. Pharm. Pharm. Med. Chem. 1998, v. 331, p. 375-379).
Способность данных соединений генерировать NO в условиях in vivo не была установлена, их влияние на активность рГЦ, а также спазмолитические и сосудорасширяющие свойства не исследовались.
Известны различные 3,4-дизамещенные фуроксаны (1,2,5-оксадиазол-2-оксиды) общей формулы III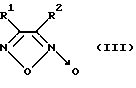
где R1 и R2 - метил, фенил, фенилсульфонильная, нитрильная, метокси-, нитро- или аминогруппа, генерирующие NO, активирующие рГЦ, проявляющие антиагрегантные свойства и обладающие выраженным вазорелаксантным действием на изолированных кольцах торакальной аорты кролика, сокращенных под действием норадреналина (R. Ferioli, G.C. Folco et al. "A new class of furoxan derivatives as NO-donors: mechanism of action and biological activity" Brit. J. Pharmacol. 1995, v. 144, 3, p. 816-820; заявка РСТ 94/01422, C 07 D 271/08, А 61 К 31/41, 1993 г.).
Способность производных фуроксанов, как и органических нитратов, эффективно снижать системное давление крови (на 25-85 мм рт. ст. при внутривенном введении животным в дозах 0,05-0,1 мг/кг) (например, европейские патенты 0054872, C 07 D 271/08, А 61 К 31/41, 1984 г.; 0054873, C 07 D 271/08, А 61 К 31/41, 1984 г.) существенно затрудняет их направленное локальное применение.
Известен 3,6-бис(4-аминофуразан-3-ил)-1,4,2,5-диоксадиазин вышеуказанной формулы I в качестве продукта химического синтеза (В.Г. Андрианов, В.Г. Семенихина, А.В. Еремеев "Галогенангидриды 4-аминофуразан-3-карбогидроксимовой кислоты" Химия гетероцикл. соед. 1992, 5, с. 687-691 [12]). Биохимические, физиологические и фармакологические свойства данного соединения не изучены.
Наиболее близким к соединению настоящего изобретения является 4,4'-дифенил-3,3',4',3''-трифуразан-2,2',2''-триоксид формулы III, где R1=R2=4-фенилфуроксанил-3(2-оксидо-4-фенил-1,2,5-оксадиазол-3-ил), являющийся донором NO, ингибирующий агрегацию тромбоцитов под действием коллагена и вызывающий вазодилятацию на изолированных кольцах торакальной аорты кролика, сокращенных под действием норадреналина (A.M.Gasco, A.Di Stilo et al. "Synthesis and structure of a trimer of the furoxan system with high vasodilator and platelet antiaggregatory activity" Liebigs Ann. Chem. 1993, p. 441-444 - прототип).
Влияние данного соединения на активность рГЦ и его гипотензивная активность не изучены. Кроме того, оно обладало недостаточно эффективным спазмолитическим и сосудорасширяющим действием в условиях эксперимента.
Целью изобретения является поиск в ряду производных 1,2,5-оксадиазола нового донора оксида азота и активатора рГЦ, обладающего улучшенным спазмолитическим и сосудорасширяющим действием.
Указанная цель достигается применением известного химического соединения -3,6-бис(4-аминофуразан-3-ил)-1,4,2,5-диоксадиазина вышеуказанной формулы I в качестве донора NO, активирующего рГЦ, ингибирующего агрегацию тромбоцитов и обладающего спазмолитическим и сосудорасширяющим действием.
БАФДОД был синтезирован известным способом, основанным на реакции стереоселективной димеризации нитрилоксидов и заключающимся во взаимодействии хлорангидрида (4-аминофуразан-3-ил)гидроксамовой кислоты с триэтиламином в инертном органическом растворителе (ацетонитриле) при температуре 0-5oС [12] .
Описание данного изобретения содержит 9 примеров, иллюстрирующих экспериментальный материал.
Примеры 1-4 показывают химические основы молекулярного механизма действия 3,6-бис(4-аминофуразан-3-ил)-1,4,2,5-диоксадиазина, преимущественно заключающиеся в селективной генерации NO.
Пример 5 иллюстрирует биохимический эффект БАФДОД, опосредованный генерацией оксида азота, - активацию частично очищенной рГЦ из легких быка.
Примеры 6 и 7 иллюстрируют фармакологические свойства БАФДОД - способность ингибировать агрегацию тромбоцитов, а также спазмолитическую и сосудорасширяющую активность в условиях in vitro.
Пример 8 демонстрирует отсутствие у БАФДОД при внутривенном введении в дозе 0,5 мг/кг гипотензивной активности в условиях in vivo.
Пример 9 описывает изучение острой токсичности БАФДОД.
Пример 1. Образование оксида азота из 3,6-бис(4-аминофуразан-3-ил)-1,4,2,5-диоксадиазина.
Для определения оксида азота использовали известный способ, основанный на реакции оксида азота с кислородом воздуха в водной среде с образованием нитрита, количество которого измеряли по интенсивности окрашивания пробы продуктом реакции азосочетания с помощью спектрофотометра. В качестве доказательства того, что данный способ дает возможность измерить именно оксид азота, выделяющийся из соединения в результате химической реакции, а не нитрит, реакцию проводят в присутствии оксигемоглобина, который количественно реагирует с оксидом азота (но не нитритом), образуя нитрат, который не вступает в реакцию азосочетания.
Проба конечным объемом 1 мл содержала 50 мМ калий-фосфатный буфер (рН 7,4) или 20 мМ калий-цитратный буфер (рН 5,0), 0,5 мМ цистеин или глутатион, изучаемое соединение в концентрации 0,1 мМ и 0,2% диметилсульфоксид (ДМСО), а при инкубации с оксигемоглобином его концентрация составляла 0,1 мМ. В качестве отрицательного контроля использовали водный раствор ДМСО в концентрации 0,2%, а в качестве положительного контроля 0,1 мМ нитрит натрия, содержащий 0,2% ДМСО. Пробы инкубировали 60 мин при 37oС и добавляли последовательно 100 мкл 3 М ацетата натрия, 400 мкл 0,92% раствора сульфаниловой кислоты в 30% уксусной кислоте и 400 мкл 0,05% N-нафтилэтилендиамина. Пробы инкубировали 10 мин и измеряли оптическую плотность при длине волны 554 нм на спектрофотометре.
В вышеуказанных условиях при рН 7,4 не наблюдалось образование заметного количества нитрита (<0,01 моль нитрита/моль исходного соединения (исх. соед. ) в отсутствие тиолов. В присутствии тиолов БАФДОД генерировал 0,182 моль нитрита на моль исх. соед. в присутствии цистеина и 0,154 моль нитрита на моль исх. соед. в присутствии глутатиона. Дальнейшая инкубация не приводила к дополнительному образованию нитрита.
При инкубации БАФДОД в вышеуказанных условиях в присутствии оксигемоглобина и цистеина или глутатиона наблюдалось образование метгемоглобина (см. пример 4).
Согласно известным данным NО-генерирующие свойства наиболее близкого известного аналога в условиях, близких к описанным (в присутствии тиолов), изучить не удалось вследствие его крайне низкой растворимости в условиях эксперимента.
Пример 2. Образование S-нитрозотиолов (S-нитрозоглутатиона) 3,6-бис(4-аминофуразан-3-ил)-1,4,2,5-диоксадиазином.
Для определения S-нитрозотиолов использовали известный способ, основанный на реакции с хлоридом ртути (II), в ходе которой происходит образование нитрита. Для учета образования нитрита в ходе реакции соединения настоящего изобретения с глутатионом реакцию проводили, как описано в примере 8, а затем определяли нитрит по способу, описанному в примере 8, в отсутствие и в присутствии хлорида ртути (II) в концентрации 0,1%. Разность полученных значений соответствует количеству S-нитрозоглутатиона.
В вышеуказанных условиях не происходит образования S-нитрозоглутатиона из соединения формулы I. Возможность генерации известным аналогом S-нитрозотиолов не исследовалась.
Пример 3. Образование восстановленной формы оксида азота из 3,6-бис(4-аминофуразан-3-ил)-1,4,2,5-диоксадиазина.
Для определения восстановленной формы оксида азота (NO-/HNO) использовали известный способ, основанный на том, что образовавшийся в ходе реакции нитроксил реагирует с тиолами с образованием гидроксиламина (или происходит конкурентное образование N2O), который после окисления ионами I3 - дает нитрит, определяемый по реакции азосочетания (см. пример 8). Поскольку изучаемые соединения также генерируют и нитрит, который аналогичным образом вступает в реакцию азосочетания на заключительном этапе, в качестве положительного контроля использовали гидроксиламина гидрохлорид и нитрит натрия в концентрации 0,1 мМ, а инкубацию проводили так же, как описано в примере 1, при рН 7,4. После инкубации в пробы добавляли 100 мкл 3 М ацетата натрия, 400 мкл 0,92% раствора сульфаниловой кислоты в 30% уксусной кислоте, 100 мкл 1,25% I2 в 2% KI, 30 мкл 0,5 М 2-меркаптоэтанола и 400 мкл 0,05% N-нафтилэтилендиамина. Пробы инкубировали 15 мин и измеряли оптическую плотность при длине волны 554 нм на спектрофотометре. Параллельно с этим опытом проводили измерения образования нитрита, как описано в примере 1. Содержание гидроксиламина рассчитывали по формуле: Х=(А-Y•N)/H, где Х соответствует концентрации гидроксиламина, мкМ; А - оптическая плотность пробы, содержащей исследуемое соединение, Y - концентрация образовавшегося нитрита натрия, определенная как описано в примере 1, мкМ; N - оптическая плотность положительного контроля, содержащего нитрит натрия, мкМ-1; и Н - оптическая плотность положительного контроля, содержащего гидроксиламина гидрохлорид, мкМ-1.
В вышеуказанных условиях не наблюдалось образования гидроксиламина из соединений данного изобретения в присутствии цистеина или глутатиона. Возможность генерации известным аналогом восстановленной формы оксида азота не исследована.
Таким образом, БАФДОД является селективным донором NO.
Пример 4. Образование метгемоглобина из оксигемоглобина под действием 3,6-бис(4-аминофуразан-3-ил)-1,4,2,5-диоксадиазина.
Определение генерации NO в присутствии оксигемоглобина, сопровождающееся образованием метгемоглобина, изучали известным способом в спектрофотометрической кювете конечным объемом 1 мл при 25oС. Пробы содержали 25 мМ калий-фосфатный буфер (рН 7,4), 3 мкМ оксигемоглобин, 0,5 мМ цистеин или глутатион и БАФДОД в концентрации 0,1 мМ. Определяли скорость возрастания оптической плотности при 401 нм, и по линейному начальному участку рассчитывали скорость образования оксида азота (коэффициент молярного поглощения метгемоглобина принимали равным 39,9 ммоль-1•см-1). В отсутствие тиолов заметного прироста оптической плотности при 401 нм не наблюдалось. Кажущуюся константу скорости реакции первого порядка выражали в мин-1. Из данных литературы известно, что процесс превращения оксигемоглобина в метгемоглобин может сопровождаться образованием гемихрома или холеглобина, поэтому в отдельных экспериментах проверяли отсутствие этих форм гемоглобина. Для этого пробы инкубировали в калий-фосфатном буфере рН 7,4 в присутствии 25 мкМ оксигемоглобина, 0,2 мМ цистеина или глутатиона и 20 мкМ соединений. Измеряли оптическую плотность при 560, 577, 630 и 700 нм и рассчитывали концентрации оксигемоглобина, гемихрома, метгемоглобина и холеглобина. Эти эксперименты показали, что при инкубации исследуемых соединений с оксигемоглобином в отсутствие тиолов или в присутствии цистеина или глутатиона не наблюдается образования холеглобина или гемихрома, а происходит исключительно превращение оксигемоглобина в метгемоглобин.
В вышеуказанных условиях БАФДОД вызывал образование метгемоглобина из оксигемоглобина, причем данный эффект усиливался в присутствии цистеина и глутатиона. Константа скорости реакции (NO+Гм-О2-->NO3 -+метГм) в присутствии цистеина имела значение 0,0348 мин-1, в присутствии глутатиона - 0,0341 мин-1. Соединение не реагировало в аналогичных условиях с метгемоглобином.
Пример 5. Активация растворимой формы гуанилатциклазы 3,6-бис(4-аминофуразан-3-ил)-1,4,2,5-диоксадиазином.
Активность рГЦ измеряли в препаратах из легких быка, полученных известным способом.
Для получения препарата рГЦ из легких быка ткань гомогенизировали в 5 объемах 50 мМ трис-HCl-буфера (рН 7,6), содержащего 10 мМ MgCl2, с помощью гомогенизатора "стекло-стекло". Гомогенат центрифугировали в течение 30 мин при 30000 g, супернатант отбирали и определяли активность фермента по количеству [32P] цГMФ, образовавшегося из [α-32P]ГТФ, известным способом. Белок (около 0,2-0,5 мкг белка частично очищенного препарата из легких быка) на льду добавляли в инкубационную смесь (конечный объем проб 100 мкл), содержащую (конечные концентрации) 50 мМ трис-НСl рН 7,6, 1 мМ 3-изобутил-1-метилксантин, 5 мМ MgCl2, 0,4 мг/мл креатинфосфокиназы, 5 мМ креатинфосфат, 2 мМ цГМФ, 0,2 мМ ГТФ, 10000-20000 имп/мин/пмоль [α-32P]ГТФ (ГНЦ ФЭИ, Обнинск), а также 10 мМ ДТТ. При определении активирующего действия в среду инкубации вносили изучаемое соединение в концентрации 10 мкМ в виде раствора в водном ДМСО, а в контрольные пробы добавляли ДМСО до концентрации 0,02%. Контрольная проба показала отсутствие влияния ДМСО в указанной концентрации на базальную активность рГЦ. Пробы инкубировали при 37oС в течение 15 мин. Реакцию останавливали кипячением проб в течение 2 мин. После охлаждения до комнатной температуры в пробы добавляли 0,5 мл 30 мМ Na2CO3 и 0,6 мл 36 мМ Zn(СН3СОО)2, инкубировали при 4oС в течение 10 мин и центрифугировали при 15000 g в течение 5 мин. Супернатант наносили на хроматографические колонки с окисью алюминия, уравновешенные 1 М хлорной кислотой, которые затем промывали водой. Элюцию [32Р]цГМф проводили 0,2 М формиатом аммония во флаконы для сцинтилляционного счета, радиоактивность измеряли с помощью жидкостного сцинтилляционного счетчика известным способом.
Соединение настоящего изобретения в зависимости от концентрации в 11,0 (10 и 50 мкМ)-16,6 раз (100 мкМ) повышало активность рГЦ из легких крысы. Влияние известного структурного аналога на активность рГЦ не изучено.
Пример 6. Ингибирование агрегации тромбоцитов человека, вызываемое 3,6-бис(4-аминофуразан-3-ил)-1,4,2,5-диоксадиазином.
Влияние соединения настоящего изобретения на агрегацию тромбоцитов человека изучали известным турбидиметрическим способом Борна. Для этого венозную кровь, взятую в 8 часов утра у здоровых доноров, центрифугировали при 450 g при комнатной температуре в пластиковой посуде в течение 10 мин, используя в качестве антикоагулянта цитрат натрия. Супернатант, то есть богатую тромбоцитами плазму, отбирали и центрифугировали при 650 g в течение 30 мин, получая бедную тромбоцитами плазму. Концентрацию тромбоцитов доводили в богатой тромбоцитами плазме до 2,5•108 клеток/мл с помощью разведения бедной тромбоцитами плазмой и приливали полученную суспензию в кювету объемом 0,5 мл. Агрегацию индуцировали добавлением АДФ до концентрации 2-5 мкМ. Концентрацию АДФ подбирали в каждом эксперименте так, чтобы агрегация была обратимой и максимум приходился на 2 мин после добавления АДФ, не превышая 50%. Светорассеяние суспензии тромбоцитов измеряли с помощью агрегометра, разработанного в лаборатории биоорганической химии биологического факультета МГУ им. М.В. Ломоносова (Россия). Изучаемое соединение добавляли в пробу до АДФ.
Полученные результаты показывают, что БАФДОД в описанных условиях ингибировал агрегацию тромбоцитов. Значение концентрации, при которой достигалось полумаксимальное ингибирование (IС50), для данного соединения составило 2,2 мкМ. Известный аналог, согласно данным прототипа, в близких условиях имел значение IС50, равное 1,8 мкМ.
Пример 7. Сосудорасширяющая и спазмолитическая активности 3,6-бис(4-аминофуразан-3-ил)-1,4,2,5-диоксадиазина.
Сосудорасширяющую и спазмолитическую активности БАФДОД изучали на модели изометрического сокращения гладких мышц изолированного сегмента аорты крысы под действием вазоконстриктора (спазмогена) - фенилэфрина. Активность БАФДОД определяли в условиях in vitro на кольцах торакальной аорты крыс-самцов линии Вистар средней массой 280 г (210-330 г) известным способом. Крыс декапитировали, вырезали торакальную аорту и очищали от жировой ткани. Затем вырезали кольца шириной 2,5 мм, которые подвешивали на двух параллельных крючках из нержавеющей стали. Один из крючков закрепляли на стенке камеры, а другой соединяли с изометрическим датчиком DY1, соединенным с восьмиканальным самописцем (фирмы Beckman, США). Камера содержала 30 мл раствора Кребса (130 мМ NaCl, 4,7 мМ КСl, 2,5 мМ СаСl2, 1,18 мМ КН2РO4, 14,9 мМ NаНСО3, 1,2 мМ MgSO4, 11 мМ глюкоза) при 37oС, который находился в условиях постоянной аэрации 95% O2/5% СО2 для поддержания рН 7,4. В раствор Кребса добавляли индометацин до концентрации 1 мкМ. При необходимости эндотелий удаляли механическим способом. Кольца перед опытом уравновешивали в течение часа под нагрузкой 2,5 г. Перед началом эксперимента кольца предсокращали 10 нМ норадреналином, а через 20 мин вызывали сокращение препарата добавлением фенилэфрина в концентрации 0,3 мкМ. После стабилизации состояния мышцы сосуда регистрировали ее расслабление в ответ на кумулятивные дозы соединений в диапазоне концентраций от 0,003 нМ до 50000 нМ. Затем изучаемое соединение отмывали 6-7 сменами среды инкубации в течение 1 часа и контролировали интактное состояние гладкой мышцы сосуда с использованием 0,5 мкМ нитропруссида натрия. В связи с невысокой растворимостью соединений в воде влияние растворителя (ДМСО) на изометрическое сокращение сосуда определяли в отдельных экспериментах. Было установлено, что ДМСО в концентрации до 0,1-0,2% практически не оказывает влияния на сосудистый тонус, что позволяет тестировать вазорелаксантную активность соединения в концентрации до 100 мкМ. Все эксперименты повторяли не менее 3 раз. Величину концентрации исследуемого соединения, соответствующую 50%-ной релаксации сосуда (IС50), рассчитывали с применением программы SigmaPlot версии 2,0 по стандартному уравнению для сигмоидных зависимостей вида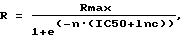
где R соответствует релаксации сосуда при концентрации соединения с, Rmax соответствует максимальной релаксации под действием этого же соединения, а n представляет собой виртуальный коэффициент кооперативности, варьировавший в пределах от 1,1 до 1,8. Достоверность подбора параметров (n и IC50), которую контролировали по методу наименьших квадратов, составляла не менее 95-97%. Статистическую обработку результатов проводили по тесту Стьюдента (t).
В вышеописанных условиях БАФДОД вызывал уменьшение изометрического сокращения сосуда с интактным эндотелием в присутствии фенилэфрина (IC50=22 нМ).
Согласно данным прототипа, известное соединение в условиях in vitro, близких к вышеописанным, обладало спазмолитическим и сосудорасширяющим действием; при этом значение IC50 составляло 120 нМ. Для базового фармпрепарата (глицерилтринитрата), использованного в качестве эталона сравнения в вышеописанных условиях, данный параметр имел значение, равное 5,3 нМ.
Пример 8. Гипотензивная активность 3,6-бис(4-аминофуразан-3-ил)-1,4,2,5-диоксадиазина.
Гипотензивную активность соединений настоящего изобретения общей формулы I определяли в условиях in vivo у бодрствующих крыс линии Вистар средней массой 280 г известным способом. Для измерения среднего артериального давления и частоты сердечных сокращений и для введения препарата в кровоток за сутки до эксперимента животным имплантировали полиэтиленовые катетеры (марки РЕ-10, РЕ-50) в бедренную артерию и бедренную вену. Свободные концы катетеров выводили и закрепляли на голове. Операция проводилась под гексеналовым наркозом (150 мг/кг). Через сутки крысу брали в опыт. В ходе эксперимента регистрировали артериальное давление датчиком фирмы Stadham (США) с последующей регистрацией данных с помощью компьютера (программа Bioshell, Факультет Фундаментальной Медицины, МГУ им. Ломоносова, Россия). Соединения вводили болюсно внутривенно в дозе 2,5 мг/кг в объеме 0,2 мл в 5% ДМСО. Во время всего эксперимента животные находились в состоянии бодрствования и могли свободно перемещаться по клетке. В течение часа животные свободно адаптировались к условиям эксперимента, а затем начинали регистрацию гемодинамических показателей, которая велась непрерывно в течение всего опыта. Исходные значения среднего артериального давления и частоты сердечных сокращений составляли 98,3 мм рт. ст. и 315,6 ударов/мин соответственно.
Болюсное введение БАФДОД в дозе 0,5 мг/кг не влияло на артериальное давление в течение 5 мин. При этом наблюдалось кратковременное незначительное повышение частоты сердечных сокращений с последующим снижением до исходного уровня. Таким образом, БАФДОД не проявляет гипотензивного действия при внутривенном введении крысам в дозах до 0,5 мг/кг. Влияние известного аналога на артериальное давление в условиях in vivo не изучалось.
Пример 9. Острая токсичность 3,6-бис(4-аминофуразан-3-ил)-1,4,2,5-диоксадиазина.
Острую токсичность соединения настоящего изобретения определяли известным способом по ЛД50 с использованием беспородных мышей обоего пола средней массой 21 г при комнатной температуре; стандартное питание и воду давали ad libitum в течение всего эксперимента; подвижность животных не ограничивали. Растворы соединений в ДМСО вводили с помощью стерильного шприца внутрибрюшинно. После инъекции за животными вели наблюдение в течение 48 часов; по истечении этого времени за мышами наблюдали дополнительно в течение 72 часов (ни одно из животных не погибло в течение дополнительного промежутка времени). Полученные результаты свидетельствуют о том, что значение ЛД50 для 3,6-бис(4-аминофуразан-3-ил)-1,4,2,5-диоксадиазина составляет ~ 150-300 мг/кг. Острая токсичность известного аналога не изучена.
Согласно известным данным, аналогичный показатель для базового фармпрепарата - глицерилтринитрата в близких условиях соответствует 7-9 мг/кг (патент РФ 2086534 (С 07 С 203/04) 1994 г., табл.2).
Вышеприведенные примеры 1 - 5 показывают, что 3,6-бис(4-аминофуразан-3-ил)-1,4,2,5-диоксадиазин является эффективным донором оксида азота и активатором рГЦ. Из примера 7 следует вывод о том, что данное соединение обладает выраженным спазмолитическим и сосудорасширяющим действием, превосходящим соответствующий фармакологический эффект в условиях in vitro известного структурного аналога. При этом, в отличие от известных производных фуроксана, БАФДОД не оказывал заметного влияния на артериальное давление при внутривенном введении в дозе 0,5 мг/кг, что предполагает возможность его направленного локального применения.
Таким образом, 3,6-бис(4-аминофуразан-3-ил)-1,4,2,5-диоксадиазин вышеуказанной формулы I является представителем нового класса доноров NO, активаторов рГЦ, ингибиторов агрегации тромбоцитов, спазмолитических и сосудорасширяющих средств.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ 1,2,5-ОКСАДИАЗОЛО-[3,4-D]-ПИРИДАЗИН-5,6-ДИОКСИДА В КАЧЕСТВЕ АКТИВАТОРОВ РАСТВОРИМОЙ ФОРМЫ ГУАНИЛАТЦИКЛАЗЫ И СРЕДСТВ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ | 1997 |
|
RU2165256C2 |
| КОМПЛЕКСЫ ВКЛЮЧЕНИЯ ПРОИЗВОДНЫХ 1,2,5-ОКСАДИАЗОЛ-2-ОКСИДА С ПОЛИЦИКЛИЧЕСКИМИ ПРОИЗВОДНЫМИ ГЛЮКОПИРАНОЗЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2001 |
|
RU2186782C1 |
| ПРОИЗВОДНЫЕ 1,4,2,5-ДИОКСАДИАЗИНА | 2001 |
|
RU2212409C1 |
| СПЕЦИФИЧЕСКИЙ РЕГУЛЯТОР АКТИВНОСТИ НУКЛЕОТИД-ЗАВИСИМЫХ ФЕРМЕНТОВ | 1997 |
|
RU2130490C1 |
| ИНГИБИТОР NO-ЗАВИСИМОЙ АКТИВАЦИИ РАСТВОРИМОЙ ФОРМЫ ГУАНИЛАТЦИКЛАЗЫ | 2001 |
|
RU2189392C1 |
| ДОНОР ОКСИДА АЗОТА И АКТИВАТОР РАСТВОРИМОЙ ФОРМЫ ГУАНИЛАТЦИКЛАЗЫ | 1998 |
|
RU2139932C1 |
| ПРОИЗВОДНЫЕ 3,4-БИС(ФУРАЗАН-3-ИЛ)ФУРОКСАНА, ГЕНЕРИРУЮЩИЕ ОКСИД АЗОТА, АКТИВИРУЮЩИЕ РАСТВОРИМУЮ ФОРМУ ГУАНИЛАТЦИКЛАЗЫ, ИНГИБИРУЮЩИЕ АГРЕГАЦИЮ ТРОМБОЦИТОВ И ОБЛАДАЮЩИЕ СПАЗМОЛИТИЧЕСКИМ, СОСУДОРАСШИРЯЮЩИМ, ГИПОТЕНЗИВНЫМ ДЕЙСТВИЕМ, И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2002 |
|
RU2240321C2 |
| ИНГИБИТОР NO-ЗАВИСИМОЙ АКТИВАЦИИ РАСТВОРИМОЙ ФОРМЫ ГУАНИЛАТЦИКЛАЗЫ | 2001 |
|
RU2188865C1 |
| ДОНОР ОКСИДА АЗОТА И АКТИВАТОР РАСТВОРИМОЙ ФОРМЫ ГУАНИЛАТЦИКЛАЗЫ | 1997 |
|
RU2123046C1 |
| СПОСОБ ИНГИБИРОВАНИЯ АГРЕГАЦИИ ТРОМБОЦИТОВ | 2002 |
|
RU2226392C1 |
Предложено: средство-донор оксида азота, активирующий растворимую форму гуанилатциклазы. Указанное средство ингибирует агрегацию тромбоцитов, также обладает спазмолитическим, сосудорасширяющим действием и представляет собой 3,6-бис(4-аминофуразан-3-ил)-1,4,2,5-диоксадиазин (БАФДОД) формулы (1). Изобретение может быть использовано в клинике в качестве средства со спазмолитическим и сосудорасширяющим действием и, в отличие от производных фуроксана, не оказывает заметного влияния на артериальное давление, что предполагает возможность его направленного локального применения. 1 ил.
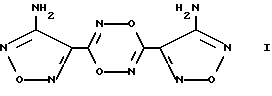
Применение 3,6-бис(4-аминофуразан-3-ил)1,4,2,5-диоксадиазина формулы I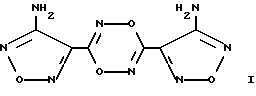
в качестве донора оксида азота, активирующего растворимую форму гуанилатциклазы, ингибирующего агрегацию тромбоцитов и обладающего спазмолитическим и сосудорасширяющим действием.
| Ванин А.Ф | |||
| Оксид азота в биологии: история, состояние и перспективы исследований | |||
| - Биохимия, 1998, т.63, вып.7 с.867-869 | |||
| ПРОИЗВОДНЫЕ ТЕТРАФУРАЗАНО[3,4-b:3',4'-f:3",4"-j:3'",4'"-N][1,4,5,8,9,12,13,16]ОКТААЗАБ ИЦИКЛО[14.2.2]ЭЙКОЗА-4,8,12-ТРИЕНА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2000 |
|
RU2167161C1 |
| US 5811416, 22.09.1998 | |||
| Прибор, замыкающий сигнальную цепь при повышении температуры | 1918 |
|
SU99A1 |
Авторы
Даты
2003-07-20—Публикация
2001-12-24—Подача