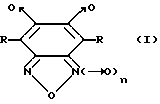
Изобретение относится к биохимии и фармакологии, в частности к применению известных производных 1,2,5-оксадиазоло[3,4-d]пиридазин-5,6-диоксида общей формулы I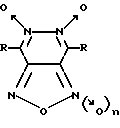 (I)
(I)
где R = CH3 или C6H5 и n = 0 или 1, для специфической активации растворимой формы гуанилатциклазы (рГЦ) и лечения заболеваний сердечно-сосудистой системы и фармацевтическим композициям на их основе.
Гуанилатциклаза/КФ 4.6.1.2; гуанозин-5'-трифосфат-пирофосфатлиаза (циклизующая)/является ферментом, катализирующим биосинтез гуанозин-3',5'-циклофосфата (цГМФ) - универсального регулятора внутриклеточного метаболизма [1].
ГЦ существует в двух формах - мембранной и растворимой. В настоящее время установлено, что рГЦ является основной мишенью фармакологического действия наиболее распространенных нитровазодилятаторов (нитроглицерина, нитросорбида, нитропруссида натрия) и играет ключевую роль в регуляции таких физиологических процессов, как сокращение и расслабление гладких мышц кровеносных сосудов и агрегация тромбоцитов. Показано, что лечебный эффект вышеуказанных фармпрепаратов связан со стимуляцией активности рГЦ в результате взаимодействия оксида азота, образующегося при их биотрансформации, с атомом железа гема, входящего в состав фермента, и образования комплекса нитрозил-гем.
Существенным недостатком известных вазодилятаторов на основе органических нитратов является возникновение толерантности при их длительном применении. В связи с этим изучение механизма действия новых соединений, способных генерировать NO в живом организме и/или вызывать активацию фермента NO-независимым путем, является перспективным подходом для поиска и создания новых более эффективных антигипертензивных и антиагрегантных фармпрепаратов.
Известен фармпрепарат "миноксидил" - 6-(1-пиперидинил)пирролидин-2,4,-диамин-3-оксид формулы II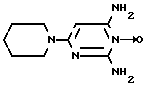 (II)
(II)
являющийся периферическим вазодилятатором [2] и повышающий уровень цГМФ в клетках гладких мышц кровеносных сосудов [3].
Известны различные N-оксиды и близкие к ним по строению соединения, являющиеся донорами оксида азота и/или его биологически активных форм (восстановленной формы - NO-/HNO, нитрозотиолов) и активаторами рГЦ и оказывающими фармакологическое действие на сердечно-сосудистую систему [4].
Так, известны 3,4-дизамещенные фурокcаны, в частности 1,2,5-оксадиазол-3,4-динитрил-2-оксид, 3-фенил-1,2,5-оксадиазол-4-нитрил-2-оксид и его изомер общей формулы III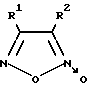 (III)
(III)
где R1 = CN и R2 = CN или C6H5 или R1 = C6H5 и R2 = CN, являющиеся донорами оксида азота и активаторами рГЦ из легких крысы (в 12-37 раз), а также обладающие выраженным вазорелаксантным действием на кольцах аорты кролика, сокращенных под действием фенилэфрина (IC50 = 0,005-0,016 мкМ) и ингибирующих агрегацию тромбоцитов, вызванную под действием коллагена (IC50 = 0,24-0,84 мкМ) [5].
Однако данные соединения обладают повышенной токсичностью (см. пример 12), а их синтез достаточно сложен.
Известны соли N-нитрозо-N-замещенных производных гидроксиламина общей формулы IV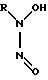 (IV)
(IV)
где R = O-, SO3-, C6H5 и др., являющиеся донорами NO в условиях in vitro и обладающие антигипертензивным действием [6].
Согласно приведенным данным, наибольшей активностью в условиях in vivo обладала соль Анжели/K2(O3SN2O2)/, которая в дозе 9 мг/кг понижала артериальное давление у нормотензивных крыс на 84 мм рт. ст. В условиях in vitro на изолированных кольцах аорты крысы, сокращенных под действием фенилэфрина, величина IC50 для данного соединения составила 3,16·10-7 М [7].
Недостатками данного соединения являются его неустойчивость в результате быстрого гидролиза при физиологических значениях pH и сравнительно невысокая антигипертензивная активность.
Известны соли диазенийдиолатов(NONOаты) общей формулы V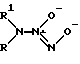 (V)
(V)
где R и R1> - алкил, замещенный алкил, представляющие собой димерные аддукты NO с азотсодержащими нуклеофилами [4]. Данные соединения являются спонтанными донорами NO или NO-, повышают уровень цГМФ в клетке и обладают вазорелаксантным действием.
Их недостатками являются относительная сложность синтеза (автоклавирование под давлением в атмосфере NO в течение 1-3 дней), сравнительная неустойчивость в водной среде при физиологических значениях pH, а также возможность образования канцерогенных N-нитрозодиалкиламинов при их разложении в аэробных условиях [4].
Известны замещенные 1,2-диазетин-1,2-диоксиды общей формулы VI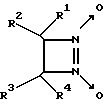 (VI)
(VI)
где R1 - H или Br, R2 - алкил или фенил, R3 - алкил и R4 - H или алкил, генерирующие оксид азота при нагревании (80oC), активирующие рГЦ из тромбоцитов человека, обладающие спазмолитическим и гипотензивным действием [8, 9] и ингибирующие агрегацию тромбоцитов под действием АДФ [10]. Наиболее активное соединение, 1-бром-6-метил-7,8-диазабицикло[4,2,0]октен-7,8- диоксид, в условиях in vitro на изолированных кольцах аорты крысы, сокращенных под действием норадреналина, имело IC50, в 2 раза превышавшее IC50 для нитроглицерина.
В целом данные соединения проявляют недостаточно высокую спазмолитическую и антиагрегантную активность, а также обладают пониженной устойчивостью при хранении при комнатной температуре, что связано с их способностью спонтанно генерировать оксид азота.
Известны 3,6-дизамещенные пиридазин-1,2-диоксиды общей формулы VII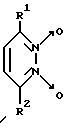 (VII)
(VII)
где R1 и R2 - CH3 или C6H5 [II].
Однако биохимические свойства и фармакологическое действие данных соединений не изучены.
Запатентованы замещенные пирроло[2,3-d] пиридазин-5,6- диоксиды в ряду других аналогов общей формулы VIII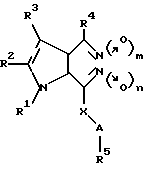 (VIII)
(VIII)
где A, R1 - R5, X имеют указанные в патенте значения, m = 0 или 1 и n = 0 или 1, в качестве средств для лечения язвы желудка, вызванной Helicobacter pylori [12].
Влияние данных соединений на активность рГЦ и возможность применения для лечения заболеваний сердечно-сосудистой системы не изучены.
Известен 4,4,7,7- гетраметил-4,7-дигидро-1,2,5-оксадиазоло[3,4-d]пиридазин-1,5,6- триоксид формулы IX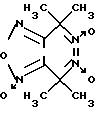 (IX)
(IX)
в качестве фотоактивируемого донора оксида азота [13].
Однако биохимические свойства и фармакологическое действие данного соединения не изучены.
Наиболее близкими к производным 1,2,5-оксадиазоло[3,4-d]пиридазин-5,6-диоксида вышеуказанной общей формулы I являются 3,5-дизамещенные пиразол-3-он-1,2-диоксиды общей формулы X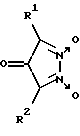 (X)
(X)
где R1 - алкил (CH3), арил (C6H5), замещенный арил и др., R2 - арил (C6H5), замещенный арил и др., являющиеся тиол-зависимыми донорами NO, активаторами рГЦ и средствами для лечения заболеваний сердечно-сосудистой системы [14].
Недостатками данных соединений, в частности 3,5-дифенилпиразол-3-он-1,2-диоксида (соединение 5), являются невысокая степень активации рГЦ (в 2,5 раза в концентрации 10 мкМ, см. пример 6), ингибирование агрегации тромбоцитов человека при использовании относительно высоких концентраций (IC50 = 1,5 мкМ в модели с коллагеном в качестве индуктора агрегации [15]), а также низкая эффективность сосудорасширяющего действия в условиях in vitro на изолированных кольцах аорты крысы, сокращенных под действием фенилэфрина (IC50 = 1,5 мкМ).
Известны производные 1,2,5-оксадиазоло[3,4-d] пиридазин- 5,6-диоксида общей формулы I в качестве продуктов химического синтеза [16-20]. Биохимические и фармакологические свойства данных соединений не изучены.
Целью изобретения является поиск новых активаторов рГЦ и средств для лечения заболеваний сердечно-сосудистой системы, обладающих более выраженными биохимическими и фармакологическими свойствами.
Указанная цель достигается применением известных производных 1,2,5-оксадиазоло[3,4-d] пиридазин-5,6-диоксида вышеуказанной общей формулы I в качестве активаторов рГЦ и лекарственных средств для лечения заболеваний сердечно- сосудистой системы.
Конкретными соединениями согласно общей формуле I являются 4,7-диметил-1,2,5-оксадиазоло[3,4-d] пиридазин-1,5,6-триоксид (4,7-диметилфуразано[3,4-d] пиридазин-1,5,6-триоксид; соединение 1); 4,7-диметил-1,2,5-оксадиазоло[3,4-d] пиридазин-5,6-диоксид (4,7-диметилфуразано[3,4-d]пиридазин-5,6-диоксид; соединение 2); 4,7-дифенил-1,2,5-оксадиазоло[3,4-d]пиридазин-1,5,6-триоксид (4,7-дифенилфуразано[3,4-d]пиридазин-1,5,6-триоксид; соединение 3); 4,7-дифенил-1,2,5-оксадиазоло[3,4-d]пиридазин- 5,6-диоксид(4,7-дифенилфуразано[3,4-d]пиридазин-5,6-диоксид; соединение 4).
Предпочтительно, производными 1,2,5-оксадиазоло[3,4-d] пиридазин-5,6-диоксида вышеуказанной общей формулы I являются 4,7-диметил-1,2,5-оксадиазоло[3,4-d] пиридазин-1,5,6- триоксид (соединение 1) и 4,7-диметил-1,2,5-оксадиазоло[3,4-d]пиридазин-5,6-диоксид (соединение 2).
Данное изобретение относится к применению производных 1,2,5- -оксадиазоло[3,4-d] пиридазин-5,6-диоксида общей формулы I для лечения заболеваний сердечно-сосудистой системы, включая лечение артериальной гипертонии, застойной сердечной недостаточности при инфаркте миокарда, гипертонических кризов, рефрактерной сердечной недостаточности, инфаркта миокарда и острого инфаркта миокарда, стенокардии, ишемической болезни сердца, хронической сердечной недостаточности, легочной гипертонии, острой недостаточности левого желудочка, легочного сердца, отека легких, периферической артериальной эмболии, токсикогенных спазмов сосудов, для профилактики и купирования приступов стенокардии и спазмов коронарных артерий при использовании сердечных катетеров, ангиографии и ангиопластике, а также других заболеваний сердечно-сосудистой системы, при которых положительный лечебный эффект достигается при снижении кровяного давления, нормализации сократительной способности миокарда и/или ингибировании активности тромбоцитов, за исключением тех заболеваний, при которых противопоказано снижение кровяного давления и/или ингибирование агрегации тромбоцитов (например, артериальной гипотонии, кардиогенного шока, острого инфаркта миокарда с пониженным давлением наполнения левого желудочка, общего снижения функции левого желудочка с низким давлением наполнения, гипертрофической обструктивной кардиомиопатии, сосудистого коллапса, токсического отека легких, геморрагического инсульта, гемофилии, геморрагического диатеза, гипопротромбинемии).
Данное изобретение также относится к применению 4,7-диметил-1,2,5-оксадиазоло[3,4-d] пиридазин-1,5,6-триоксида для профилактики и купирования приступов стенокардии и для лечения острого инфаркта миокарда.
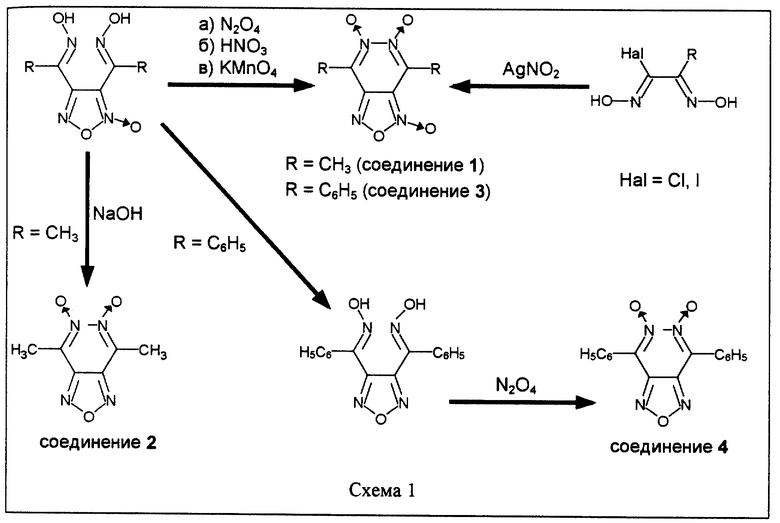
Соединения 1, 3, 4 были синтезированы в 1925-1927 гг. [16, 17] (соединение 2 в 1899 г. [18]), однако их химическая структура была однозначно установлена значительно позднее [19, 20].
В общем случае соединения 1, 3, 4 получают окислением диоксимов соответствующих 3,4-диацилпроизводных фуроксана или фуразана (схема 1). В зависимости от строения исходного диоксима в качестве окислителя используют четырехокись азота, азотную кислоту или разбавленный раствор перманганата калия.
Другой способ синтеза соединений 1 и 3 основан на реакции 2-замещенных 1-галогенглиоксимов с нитритом серебра в среде эфира [21, 22].
Соединение 2 было получено обработкой диоксима 3,4- диацетилфуроксана водным раствором гидроокиси натрия [16, 20] (схема 1).
Исходные диоксимы 3,4-диацилфуроксанов синтезируют из гидроксиламина и соответствующих диацилфуроксанов, которые, в свою очередь, получают с высоким выходом обработкой ацетона четырехокисью азота или при взаимодействии ацетофенона с азотной кислотой.
Данное изобретение также относится к фармацевтическим композициям, включающим в качестве активного компонента производные 1,2,5-оксадиазоло[3,4-d] пиридазин-5,6-диоксида общей формулы I вместе с соответствующими добавками. В качестве добавок используются компоненты, общепринятые для приготовления лекарственных форм для лечения заболеваний сердечно-сосудистой системы.
В зависимости от вида введения препарата и цели его применения лекарственные формы могут быть выполнены в виде таблеток, капсул, гранул, драже, пилюль для постепенного дозирования (при необходимости из полимерного материала, например из ацетилфталоилцеллюлозы, или другого пригодного для данной цели материала, например желатина), а также в качестве порошков, растворов, суспензий или эмульсий.
Твердая форма для приема внутрь может содержать в качестве добавок инертный наполнитель (например, лактозу, сахарозу, сорбит, крахмал, маннит), поверхностно-активные вещества (например, стеарат магния или кальция, поливинилпирролидон, полиэтиленгликоль, полипропиленгликоль) и фармакологически приемлемые неорганические соли (например, хлорид натрия).
Жидкие композиции могут быть получены при растворении или диспергировании активного компонента в водном или неводном растворителе (например, этаноле, растительном масле) в присутствии стабилизирующих добавок (например, компонентов буферных смесей, поверхностно-активных веществ, пищевых углеводов), консервантов, пищевых красителей. Жидкие композиции могут быть использованы для различных способов введения, в частности, в форме капель или аэрозолей, а также в ампульной форме для внутривенного или внутримышечного введения.
Другой возможной формой применения производных 1,2,5-оксадиазоло[3,4-d] пиридазин-5,6-диоксида общей формулы I являются трансдермальные терапевтические композиции в виде мазей и пластырей, в том числе обеспечивающие дозированное чрескожное поступление активных компонентов в организм.
Вышеуказанные фармацевтические композиции на основе производных 1,2,5-оксадиазоло[3,4-d] пиридазин-5,6-диоксида общей формулы I могут быть получены комбинированием соединений 1-4 с активными компонентами других известных фармпрепаратов для лечения заболеваний сердечно-сосудистой системы. В частности, с этой целью можно использовать блокаторы α1-адренергических рецепторов (празозин), агонисты центральных α2- адренергических и I1 имидазолиновых рецепторов (клофелин, моксонидин), блокаторы β-(β1-) адренергических рецепторов (пропранолол, атенолол, метопролол), блокаторы кальциевых каналов (нифедипин, дилтиазем), ингибиторы ангиотензин-превращающего фермента (лизиноприл), коронарорасширяющие препараты (карбокромен), диуретики (дихлортиазид), сердечные гликозиды (дигитоксин), антигипертензивные средства (безафибрат, гемфиброзил).
Описание данного изобретения содержит 16 примеров и фиг. 1-4, иллюстрирующих экспериментальный материал.
Примеры 1-5 отражают химические основы молекулярного механизма действия производных 1,2,5-оксадиазоло[3,4-d]пиридазин-5,6-диоксида общей формулы I, преимущественно заключающиеся в генерации оксида азота и его активных форм (восстановленной формы и S-нитрозотиолов), модификации сульфгидрильных групп и взаимодействии с атомом железа гемовой группы белков.
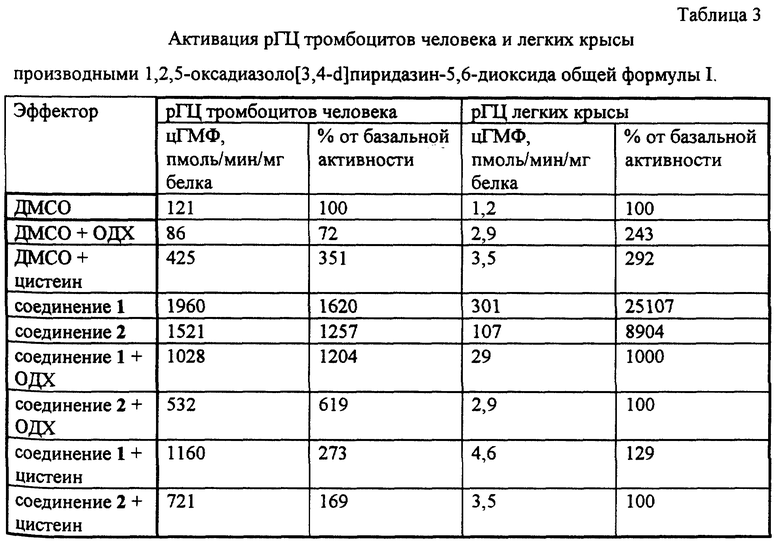
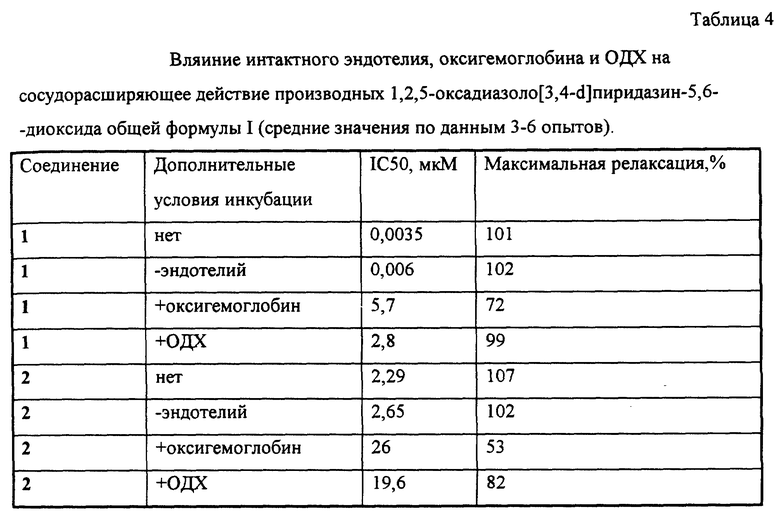
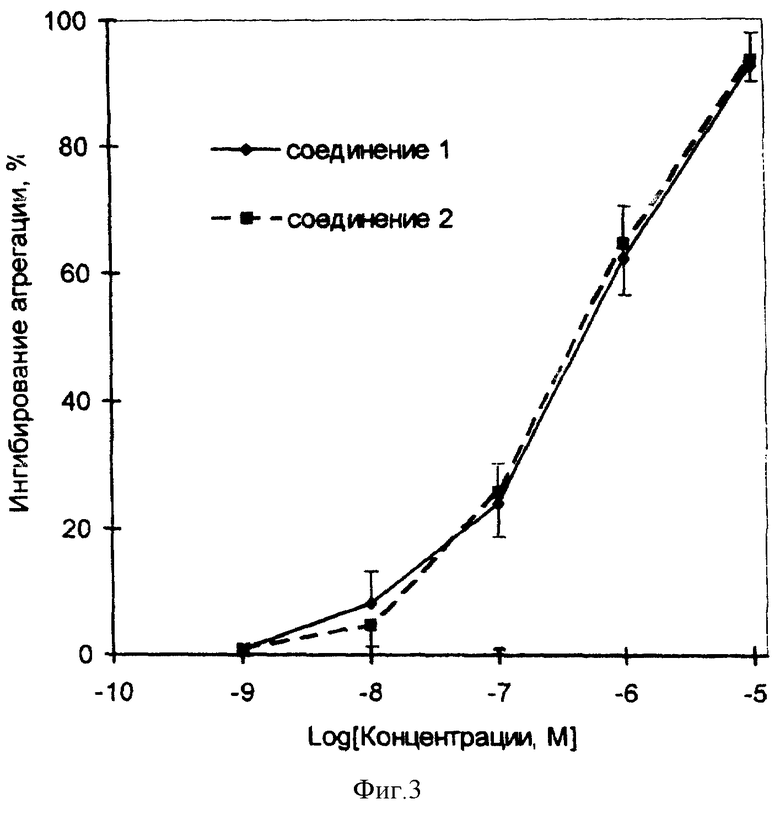
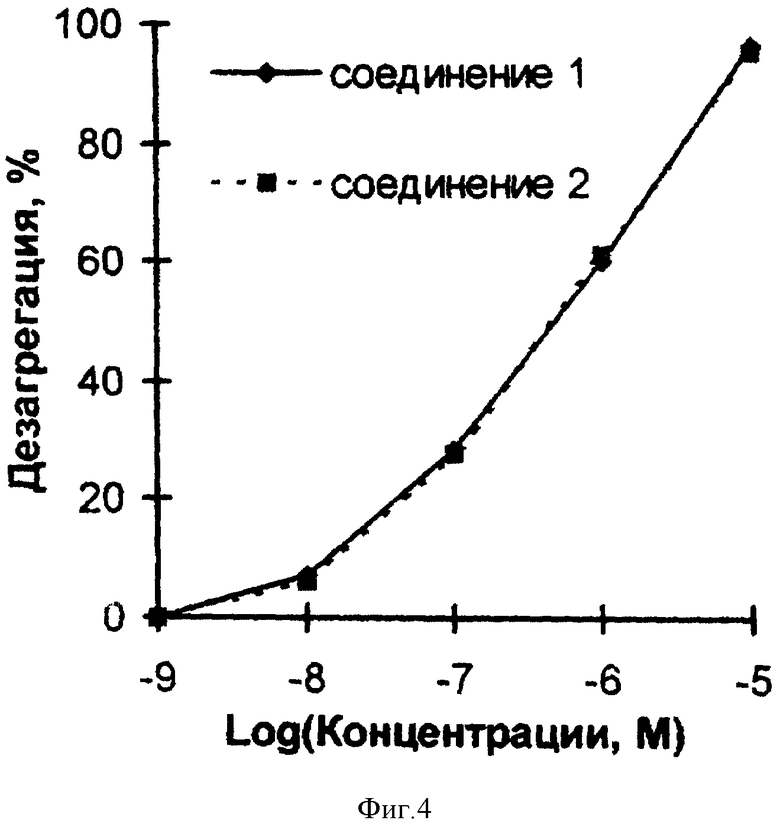
Примеры 6 и 7 показывают биохимические эффекты производных 1,2,5-оксадиазоло[3,4-D] пиридазин-5,6- диоксида общей формулы I, опосредованные генерацией оксида азота и его активных форм, - активацию рГЦ и повышение уровня цГМФ в тромбоцитах человека. Примеры 8-11 и фиг. 1-4 иллюстрируют фармакологические свойства производных 1,2,5-оксадиазоло[3,4- d]пиридазин-5,6-диоксида общей формулы I - сосудорасширяющую и гипотензивную активности, - в условиях in vitro и in vivo, а также ингибирование агрегации тромбоцитов, вызванной - под действием АДФ, и дезагрегацию агрегированных тромбоцитов, то есть способность одновременно как снижать кровяное давление, так и ингибировать активность тромбоцитов.
Пример 12 включает изучение острой токсичности производных 1,2,5-оксадиазоло[3,4-d]пиридазин-5,6-диоксида общей формулы I.
Пример 13 содержит описание некоторых, ранее не изученных физико-химических свойств производных 1,2,5-оксадиазоло[3,4-d]пиридазин-5,6-диоксида общей формулы I (растворимость, стабильность водных растворов и др.).
Примеры 14-16 описывают состав различных фармацевтических композиций на основе производных 1,2,5-оксадиазоло[3,4-d]пиридазин-5,6- диоксида общей формулы I.
Пример 1. Образование оксида азота из производных 1,2,5-оксадиазоло[3,4-d]пиридазин-5,6-диоксида.
Для определения оксида азота использовали известный способ, основанный на реакции оксида азота с кислородом воздуха в водной среде с образованием нитрита, количество которого измеряли по интенсивности окрашивания пробы продуктом реакции азосочетания с помощью спектрофотометра. В качестве доказательства того, что данный способ дает возможность измерить именно оксид азота, выделяющийся из соединения в результате химической реакции, а не нитрит, реакцию проводят в присутствии оксигемоглобина, который количественно реагирует с оксидом азота (но не нитритом), образуя нитрат, который не вступает в реакцию азосочетания.
Проба конечным объемом 1 мл содержала 50 мМ калий-фосфатный буфер (pH 7,4) или 20 мМ калий-цитратный буфер (pH 5,0), 0,5 мМ цистеин или глутатион, изучаемое соединение в концентрации 0,1 мМ и 0,2% диметилсульфоксид (ДМСО), а при инкубации с оксигемоглобином его концентрация составляла 0,1 мМ. В качестве отрицательного контроля использовали водный раствор ДМСО в концентрации 0,2%, а в качестве положительного контроля 0,1 мМ нитрит натрия, содержащий 0,2% ДМСО. Пробы инкубировали 30 мин при 37oC и добавляли последовательно 100 мкл 3 М ацетата натрия, 400 мкл 0,92% раствора сульфаниловой кислоты в 30% уксусной кислоте и 400 мкл 0,05% N-нафтилэтилендиамина. Пробы инкубировали 10 мин и измеряли оптическую плотность при длине волны 554 нм на спектрофотометре.
В вышеуказанных условиях при pH 7,4 не наблюдалось образование заметного количества нитрита (< 0,01 моль нитрита/моль исходного соединения (исх.с.)) в отсутствие тиолов. В присутствии тиолов соединение 1 генерировало 0,32 моль нитрита на моль исх.с. в присутствии цистеина и 0,43 моль нитрита на моль исх. с. в присутствии глутатиона; соединение 2 генерировало 0,02 моль нитрита на моль исх.с. в присутствии цистеина и 0,01 моль нитрита на моль исх.с. в присутствии глутатиона. В тех же условиях, но при pH 5,0 происходило образование из соединения 1 0,72 моль нитрита на моль исх.с. в присутствии цистеина и 0,75 моль нитрита на моль исх.с. в присутствии глутатиона; в случае соединения 2 соответствующие значения составляли 0,13 и 0,14 моль нитрита на моль исх.с. Дальнейшая инкубация не приводила к дополнительному образованию нитрита. При инкубации в вышеуказанных условиях при pH 7,4 в присутствии оксигемоглобина соединение 1 генерировало 0,04 и 0,05 моль нитрита на моль исх.с. в присутствии цистеина и глутатиона соответственно, а оптическая плотность положительной контрольной пробы не изменялась. Это свидетельствует о том, что до 90% нитрита, определяемого по этому способу, является продуктом окисления оксида азота при pH 7,4. При pH 5,0 нитрит реагирует с оксигемоглобином, что затрудняет однозначное определение образования оксида азота при этом значении pH. Известный аналог (соединение 5) в указанных условиях в присутствии тиолов генерировал 0,08 моль нитрита на моль исх.с.
Пример 2. Образование S-нитрозотиолов (S-нитрозоглутатиона) производными 1,2,5-оксадиазоло[3,4-d]пиридазин-5,6-диоксида.
Для определения S-нитрозотиолов использовали известный способ, основанный на реакции с хлоридом ртути (II), в ходе которой происходит образование нитрита. Для учета образования нитрита в ходе реакции соединения 1 с глутатионом реакцию проводили, как описано в примере 1, а затем определяли нитрит по способу, описанному в примере 1, в отсутствие и в присутствии хлорида ртути (II) в концентрации 0,1%. Разность полученных значений соответствует количеству S-нитрозоглутатиона.
В вышеуказанных условиях происходит образование 0,17 моль S-нитрозоглутатиона на моль соединения 1. Образование S-нитрозотиолов известным аналогом (соединением 5) не исследовано.
Пример 3. Образование восстановленной формы оксида азота производными 1,2,5- оксадиазоло[3,4-d]пиридазин-5,6-диоксида.
Для определения восстановленной формы оксида азота (NO-/HNO) использовали известный способ, основанный на том, что образовавшийся в ходе реакции нитроксил реагирует с тиолами с образованием гидроксиламина (или происходит конкурентное образование N2O), который после окисления ионами I3- дает нитрит, определяемый по реакции азосочетания (см. пример 1). Поскольку соединения 1 и 2 также генерируют и нитрит, который также вступает в реакцию азосочетания на заключительном этапе, в качестве положительного контроля использовали гидроксиламина гидрохлорид и нитрит натрия в концентрации 0,1 мМ, а инкубацию проводили так же, как описано в примере 1, при pH 7,4. После инкубации в пробы добавляли 100 мкл 3 М ацетата натрия, 400 мкл 0,92% раствора сульфаниловой кислоты в 30% уксусной кислоте, 100 мкл 1,25% I2 в 2% KI, 30 мкл 0,5 М 2-меркаптоэтанола и 400 мкл 0,05% N-нафтилэтилендиамина. Пробы инкубировали 15 мин и измеряли оптическую плотность при длине волны 554 нм на спектрофотометре. Параллельно с этим опытом проводили измерения образования нитрита, как описано в примере 1. Содержание гидроксиламина рассчитывали по формуле X = (A- Y·N)/H, где X соответствует концентрации гидроксиламина, мкМ; A - оптическая плотность пробы, содержащей исследуемое соединение, Y - концентрация образовавшегося нитрита натрия, определенная, как описано в примере 1, мкМ; N - оптическая плотность положительного контроля, содержащего нитрит натрия, мкМ-1; и H - оптическая плотность положительного контроля, содержащего гидроксиламина гидрохлорид, мкМ-1.
В вышеуказанных условиях происходит образование 0,18 моль гидроксиламина на моль соединения 1 в присутствии цистеина и 0,34 моль гидроксиламина на моль соединения 1 в присутствии глутатиона. В данных условиях из соединения 2 в присутствии или в отсутствие тиолов не происходит образования гидроксиламина. Возможность генерации известным аналогом (соединением 5) восстановленной формы оксида азота не исследована.
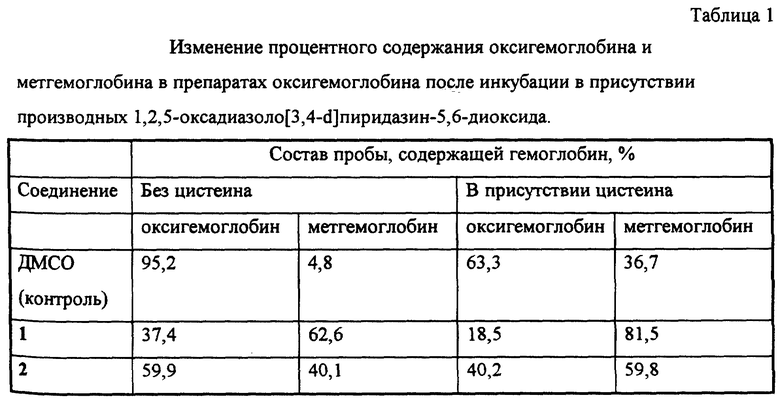
Пример 4. Образование метгемоглобина из оксигемоглобина под действием производных 1,2,5-оксадиазоло[3,4-d]пиридазин-5,6- диоксида.
Образование метгемоглобина из оксигемоглобина изучали известным способом с помощью спектрофотометра.
Пробы конечным объемом 1 мл содержали 50 мМ калий-фосфатный буфер (pH 7,4), 40 мкМ оксигемоглобин, 50 мкМ соединения 1 или 2 (в контрольные пробы добавляли ДМСО до концентрации 0,2%) и 0,25 мМ цистеин или воду. Пробы инкубировали 60 мин при 37oC и измеряли оптическую плотность при длинах волн 577, 630 и 700 нм, рассчитывая концентрации оксигемоглобина, метгемоглобина и холеглобина (см. табл. 1).
В вышеуказанных условиях соединения 1 и 2 вызывали образование метгемоглобина из оксигемоглобина, причем данный эффект усиливался в присутствии цистеина. Это свидетельствует о способности указанных соединений взаимодействовать с атомом железа гемовой группы белков. Аналогичный эффект известного аналога (соединения 5) не исследовался.
Пример 5. Модификация сульфгидрильных групп низкомолекулярных тиолов под действием производных 1,2,5-оксадиазоло[3,4-d]пиридазин-5,6-диоксида. Концентрацию SH-групп определяли известным способом Эллмана. Пробы конечным объемом 0,2 мл содержали 50 мМ калий-фосфатный буфер (pH 7,4), тиолы в концентрации 0,5 мМ и соединения 1 или 2 в концентрации 0,05 мМ. Контрольные пробы содержали соответствующее количество ДМСО (0,2%). Инкубацию проводили в течение 20 мин при 37oC и добавляли 1,8 мл 0,5 мМ раствора 5,5'-дитиобис(2-нитробензойной) кислоты в 50 мМ калий-фосфатном буфере (pH 7,4). Через 5 мин измеряли оптическую плотность при длине волны 412 ими рассчитывали концентрацию SH-групп (см. табл. 2)
Взаимодействие известного аналога (соединения 5) с низкомолекулярным тиолами не исследовано.
Пример 6. Активация растворимой формы гуанилатциклазы производными 1,2,5- оксадиазоло[3,4-d]пиридазин-5,6-диоксида общей формулы I.
Активность рГЦ измеряли в препаратах цитозоля тромбоцитов человека и легких крысы известными способами.
В первом случае для получения препарата рГЦ выделяли тромбоциты из венозной крови здоровых доноров известным способом с применением разделения форменных элементов крови в градиенте плотности фиколла. Тромбоциты промывали 3 раза 20 мМ трис-HCl-буфером (pH 7,5), содержащим 150 мМ NaCl и 5 мМ ЭДТА, центрифугируя при 1 000 g в течение 15 мин, а затем суспендировали в 50 мМ трис-HCl-буфере (pH 7,6), содержащем 0,2 мМ дитиотреитол, и озвучивали ультразвуком с помощью ультразвукового генератора MSE 7-78 (Великобритания) в течение 20 сек при 4oC. Суспензию разрушенных клеток центрифугировали при 100 000 g в течение 1 ч, супернатант разводили до концентрации белка 1 мг/мл, добавляли дитиотреитол до концентрации 0,2 мМ и определяли активность фермента по количеству цГМФ, образовавшегося из гуанозин-5'-трифосфата (ГТФ), иммуноферментным способом с использованием наборов реактивов для количественного определения цГМФ (АО "Биоген", Россия). Инкубационная смесь для определения активности конечным объемом 0,15 мл готовилась при 4oC и содержала 50 мМ трис-HCl (pH 7,6), 1 мМ ГТФ, 4 мМ MgCl2, 4 мМ креатинфосфат, 100 мкг (50 ед/мг) креатинфосфокиназы, 10 мМ теофиллин и ферментный препарат (10-20 мкг белка супернатанта). При определении активирующего действия в среду инкубации вносили изучаемое соединение в концентрации 10 мкМ в виде раствора в водном ДМСО и, при необходимости, другие соединения, например 0,3 мкМ 1H-[1,2,4]оксадиазол[4,3-a]хиноксалин-1-он (ОДХ; специфический ингибитор гем-зависимой активации рГЦ) или 1 мМ цистеин, а в контрольные пробы добавляли ДМСО до концентрации 0,02%. Контрольная проба показала отсутствие влияния ДМСО в указанной концентрации на базальную активность рГЦ. Пробы инкубировали при 37oC в течение 15 мин. Реакцию останавливали кипячением проб в течение 2 мин с последующим охлаждением в ледяной бане. После отделения денатурировавшего белка при центрифугировании (10 мин при 1 500 g) в супернатанте определяли количество образовавшегося цГМФ вышеуказанным способом.
Для получения препарата рГЦ из легких крысы ткань гомогенизировали в 5 объемах 50 мМ трис-HCl-буфера (pH 7,6), содержащего 10 мМ MgCl2, с помощью гомогенизатора "стекло-стекло". Гомогенат центрифугировали в течение 30 мин при 30 000 g, супернатант отбирали и определяли активность фермента по количеству [32P]цГМФ, образовавшегося из [α-32P]ГТФ известным способом. Инкубационная смесь конечным объемом 100 мкл содержала 50 мМ трис-HCl-буфер (pH 7,6), 5 мМ MgCl2, 5 мМ креатинфосфат, 0,4 мг/мг креатинфосфокиназы, 1 мМ 3-изобутил-1-метилксантин, 2 мМ цГМФ, 0,2 мМ ГТФ (около 200 000 имп/мин на пробу) и ферментный препарат (40-50 мкг белка). При определении активирующего действия в среду инкубации вносили изучаемое соединение в концентрации 10 мкМ в виде раствора в водном ДМСО и, при необходимости, другие соединения, например 3 мкМ ОДХ или 5 мМ цистеин, а в контрольные пробы добавляли ДМСО до концентрации 0,02%. Контрольная проба показала отсутствие влияния ДМСО в указанной концентрации на базальную активность рГЦ. Пробы инкубировали при 37oC в течение 15 мин. Реакцию останавливали кипячением проб в течение 2 мин. После охлаждения до комнатной температуры в пробы добавляли 0,5 мл 30 мМ Na2CO3 и 0,6 мл 36 мМ Zn(CH3COO)2, перемешивали, инкубировали при 4oC в течение 10 мин и центрифугировали при 15000 g в течение 5 мин. Супернатант наносили на колонки с подкисленной известным способом окисью алюминия, которые промывали водой. Элюцию [32P]цГМФ проводили 0,2 М формиатом аммония во флаконы для сцинтилляционного счета и радиоактивность измеряли с помощью жидкостного сцинтилляционного счетчика известным способом Черенкова.
Определение белка проводили по известному способу Лоури с использованием бычьего сывороточного альбумина в качестве стандарта.
Соединения 1 и 2 активировали рГЦ из тромбоцитов человека и легких крысы. Активация снижалась в присутствии ОДХ, что указывает на гем-зависимую природу эффекта. Активация практически полностью ингибировалась в присутствии цистеина, что указывает на предпочтительное действие указанных производных 1,2,5-оксадиазоло[3,4-d] пиридазин-5,6-диоксида общей формулы I на рГЦ в клетках с пониженным содержанием свободных тиолов. В вышеописанных условиях известный аналог (соединение 5) активировал рГЦ тромбоцитов человека в 2,5 раза (250%).
Пример 7. Повышение содержания цГМФ в тромбоцитах человека производными 1,2,5-оксадиазоло[3,4-d]пиридазин-5,6-диоксида общей формулы I.
Определение цГМФ в тромбоцитах человека проводили известным способом. Обогащенную тромбоцитами плазму разводили обедненной тромбоцитами плазмой до концентрации 109 клеток/мл. Пробы конечным объемом 4 мл содержали 1 мл суспензии тромбоцитов (2,5·108 клеток/мл), 3 мл обедненной тромбоцитами плазмы, соединения 1 или 2 в концентрации 10 мкМ или 0,02% ДМСО. Пробы инкубировали 10 мин при 37oC, центрифугировали 5 мин при 1 500 g, осадок суспендировали в 100 мМ трис-HCl-буфере (pH 7,6), содержащем 8 мМ ЭДТА, озвучивали ультразвуком в течение 20 сек при 4oC, кипятили 2 мин и снова центрифугировали при 2 000 g в течение 10 мин. Концентрацию цГМФ определяли в супернатанте иммуноферментным способом с использованием наборов реактивов для количественного определения цГМФ (АО "Биоген", Россия).
В контрольной пробе, содержащей 0,02% ДМСО, содержание цГМФ составляло 10,2 пмоль/109 тромбоцитов. В пробах, содержащих соединения 1 и 2, содержание цГМФ составляло 15,4 и 13,6 пмоль/109 тромбоцитов (151% и 133%) соответственно. Таким образом, соединения 1 и 2 повышают содержание цГМФ в интактных тромбоцитах человека. Аналогичный эффект соединения 5 не изучен.
Пример 8. Сосудорасширяющее действие производных 1,2,5- оксадиазоло[3,4-d]пиридазин-5,6-диоксида общей формулы I.
Под сосудорасширяющим действием здесь и далее понимали уменьшение изометрического сокращения гладких мышц изолированного сегмента оарты крысы. Активность производных 1,2,5-оксадиазоло [3,4-d]пиридазин-5,6-диоксида общей формулы I определяли в условиях in vitro на кольцах торакальной аорты крыс-самцов линии Вистар средней массой 280 г (210-330 г) известным способом. Крыс декапитировали, вырезали торакальную аорту и очищали от жировой ткани. Затем вырезали кольца толщиной 3,5 мм, которые подвешивали на двух параллельных крючках из нержавеющей стали. Один из крючков закрепляли на стенке камеры, а другой соединяли с изометрическим датчиком DY1, соединенным с двухканальным самописцем Gemini (фирмы Ugo Basile, Италия). Камера содержала 30 мл раствора Кребса (130 мМ NaCl, 4,7 мМ KCl, 2,5 мМ CaCl2, 1,18 мМ KH2PO4, 14,9 мМ NaHCO3, 1,2 мМ MgSO4, 11 мМ глюкоза) при 37oC, который находился в условиях постоянной аэрации 95% O2/5% CO2 для поддержания pH 7,4. В раствор Кребса добавляли индометацин до концентрации 1 мкМ. При необходимости эндотелий удаляли механическим способом. Кольца перед опытом уравновешивали в течение часа под нагрузкой 1,2 г. Сокращение препарата вызывали добавлением норадреналина в концентрации 0,5 мкМ, добавляли 0,1 мМ N-G-нитро-L-аргинин(L-NNA; ингибитор эндотелий-зависимого образования оксида азота), и после стабилизации состояния мышцы сосуда регистрировали ее расслабление в ответ на кумулятивные дозы соединений в диапазоне концентраций от 0,003 нМ до 50 000 нМ. В отдельных экспериментах для установления роли NO или рГЦ в механизмах действия соединений добавляли 0,01 мМ оксигемоглобин (ловушка оксида азота) или 3 мкМ 1H-[1,2,4]оксадиазол[4,3-a]хиноксалин-1-он (ОДХ; специфический ингибитор гем-зависимой активации растворимой гуанилатциклазы; смотри Пример 6). Наличие или отсутствие эндотелия контролировали расширением изолированных сегментов в ответ на 1 мкМ ацетилхолин, а интактное состояние гладкой мышцы сосуда контролировали с использованием 0,5 мкМ нитропруссида натрия.
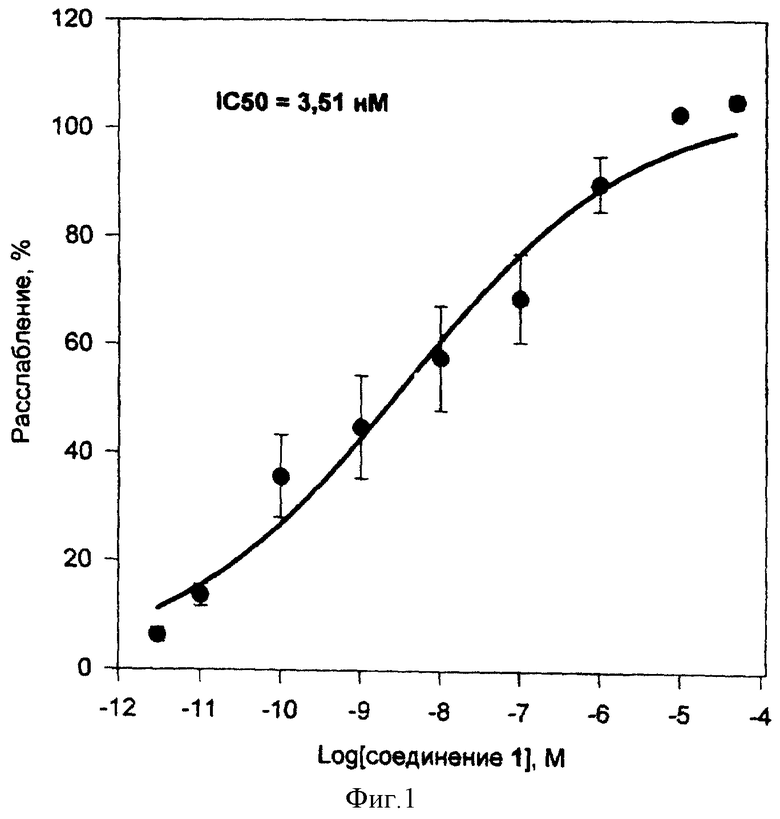
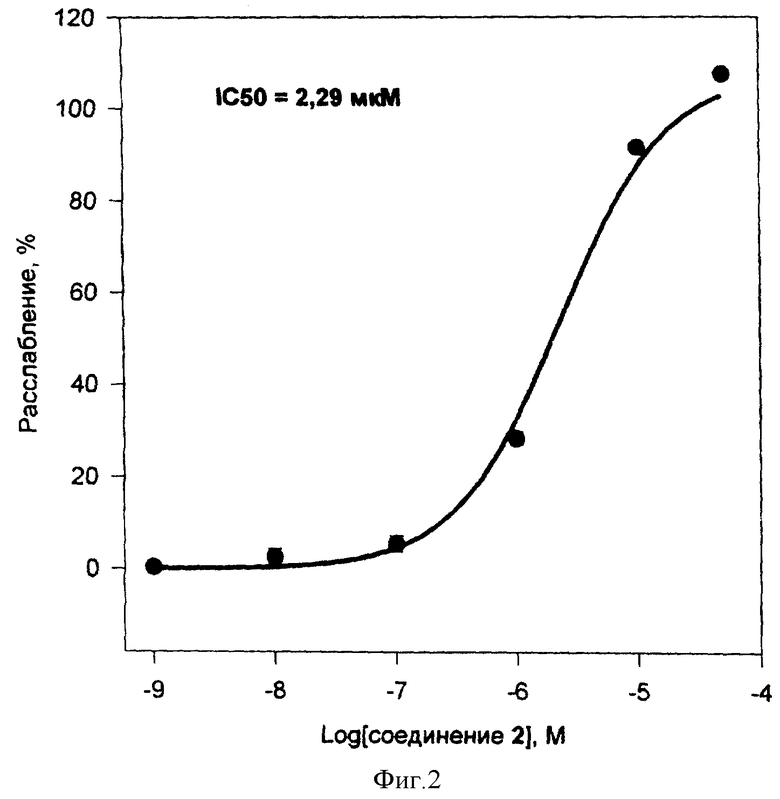
Соединения 1 и 2 вызывали уменьшение изометрического сокращения сосуда с интакным эндотелием в присутствии норадреналина и L-NNA (фиг. 1 и 2). При этом концентрация соединения 1, соответствующая 50%-ному снижению исходного сосудистого тонуса (IC50), составляла 3,51±0,5 нМ (средняя величина ± среднеквадратичное отклонение по данным трек экспериментов), а максимальное расслабление на 100% наблюдалось при концентрации 10 мкМ. Соединение 2 в тех же условиях имело IC50 = 2,29 мкМ, а расслабление на 100% наблюдалось при концентрации 50 мкМ. Данные о влиянии интактного эндотелия, оксигемоглобина и ОДХ на IC50 и максимальное расслабление при действии соединений 1 и 2 представлено в таблице 4. Полученные данные указывают на то, что соединения 1 и 2 являются эндотелий-независимыми релаксантами, действуют непосредственно на гладкомышечные клетки аорты, а механизм их действия обусловлен образованием оксида азота (ингибирование оксигемоглобином) и активацией растворимой формы гуанилатциклазы (ингибирование ОДХ).
Согласно данным прототипа, соединение 5 в условиях in vitro, близких к вышеописанным, при использовании в качестве вазоконстриктора фенилэфрина обладало сосудорасширяющим действием; при этом значение IC50 составляло 1,5 мкМ. Влияние дополнительных факторов на активность соединения 5 не исследовалось.
Пример 9. Гипотензивная активность производных 1,2,5-оксадиазоло [3,4-d] пиридазин-5,6-диоксида общей формулы I.
Активность производных 1,2,5-оксадиазоло[3,4-d]пиридазин-5,6- диоксида общей формулы I определяли в условиях in vivo нa самцах крыс линии Вистар средней массой 320 г известным способом. Для измерения среднего артериального давления и частоты сердечных сокращений и для введения препарата в кровоток за сутки до эксперимента животным имплантировали полиэтиленовые катетеры (марки РЕ-10, РЕ -50) в бедренную артерию и бедренную вену. Свободные концы катетеров выводили и закрепляли на голове. Операция проводилась под гексеналовым наркозом (150 мг/кг).
Через сутки крысу брали в опыт. В ходе эксперимента регистрировали артериальное давление датчиком фирмы Stadham (США) с последующей регистрацией данных с помощью компьютера (программа Bioshell, Факультет Фундаментальной Медицины, МГУ им. Ломоносова, Россия). Соединение 1 вводили болюсно внутривенно в дозе 2,5 мг/кг в объеме 0,2 мл в 5% ДМСО. Во время всего эксперимента животные находились в состоянии бодрствования и могли свободно перемещаться по клетке. В течение часа животные свободно адаптировались к условиям эксперимента, а затем начинали регистрацию гемодинамических показателей, которая велась непрерывно в течение всего опыта. Исходные значения среднего артериального давления и частоты сердечных сокращений составляли 98,3 мм рт. ст. и 315,6 ударов/мин соответственно.
Болюсное введение соединения 1 в дозе 2,5 мг/кг вызывало двухфазный ответ среднего артериального давления: быстрое понижение до 16,1 мм рт. ст., которое сменялось компенсаторным повышением артериального давления до 121,4 мм рт. ст. через 2,5 мин после введения соединения 1. Частота сердечных сокращений изменялась разнонаправленно по отношению к артериальному давлению, повышаясь до 663,6 ударов/мин через 10 сек после инъекции, а затем снижаясь до 205,7 уд/мин через 3 мин после инъекции. Таким образом, очевидна высокая эффективность и отсутствие временной задержки сосудорасширяющего действия соединения 1 при внутривенном введении. Действие известного аналога (соединения 5) на артериальное давление in vivo не изучалось.
Пример 10. Ингибирование агрегации тромбоцитов человека под действием производных 1,2,5-оксадиазоло[3,4-d]пиридазин-5,6-диоксида общей формулы I.
Влияние производных 1,2,5-оксадиазоло[3,4-d] пиридазин- 5,6-диоксида общей формулы I на агрегацию тромбоцитов человека изучали известным турбидиметрическим способом Борна. Для этого венозную кровь, взятую в 8 ч утра у здоровых доноров, центрифугировали при 450 g при комнатной температуре в пластиковой посуде в течение 10 мин, используя в качестве антикоагулянта цитрат натрия. Супернатант, то есть богатую тромбоцитами плазму, отбирали и центрифугировали при 650 g в течение 30 мин, получая бедную тромбоцитами плазму. Концентрацию тромбоцитов доводили в богатой тромбоцитами плазме до 2,5·108 клеток/мл с помощью разведения бедной тромбоцитами плазмой и приливали полученную суспензию в кювету объемом 0,5 мл. Агрегацию индуцировали добавлением АДФ до концентрации 2-5 мкМ. Концентрацию АДФ подбирали в каждом эксперименте так, чтобы агрегация была обратимой, и максимум приходился на 2 мин после добавления АДФ, не превышая 50%. Светорассеяние суспензии тромбоцитов измеряли с помощью агрегометра, разработанного в Лаборатории Биоорганической Химии, Биологического Факультета МГУ им. М.В. Ломоносова (Россия). Соединения 1, 2 и их известный аналог (соединение 5) добавляли до АДФ.
Соединения 1 и 2 ингибировали агрегацию тромбоцитов, как показано на фиг. 3. Соответствующие значения концентраций, при которых достигается полумаксимальное ингибирование (IC50), составляли 0,43 и 0,49 мкМ соответственно. Максимальное ингибирование на 100% наблюдалось при концентрации обоих соединений, равной 10 мкМ. Известный аналог (соединение 5) в вышеописанных условиях имел значение IC20 = 10 мкМ. Согласно опубликованным данным, в модели агрегации тромбоцитов, вызванной под действием коллагена, значение IC50 для соединения 5 составляло 1,5 мкМ.
Пример 11. Дезагрегация агрегированных тромбоцитов под действием производных 1,2,5-оксадиазоло[3,4-d]пиридазин-5,6- диоксида общей формулы I.
Влияние производных 1,2,5- оксадиазоло[3,4-d]пиридазин-5,6-диоксида общей формулы I на дезагрегацию агрегированных тромбоцитов изучали в условиях, описанных в примере 10, за исключением того, что указанные соединения добавляли после АДФ на максимуме обратимой агрегации.
Соединения 1 и 2 вызывали дезагрегацию агрегированных тромбоцитов, как показано на фиг. 4. Соответствующие значения концентраций, при которых достигается полумаксимальная дезагрегация, составляли 1,4 и 1,2 мкМ, и максимальная (полная) дезагрегация наблюдалась при концентрации обоих соединений, равной 10 мкМ. Аналогичный эффект известного аналога (соединения 5) не исследован.
Пример 12. Определение острой токсичности производных 1,2,5-оксадиазоло[3,4-d]пиридазин-5,6-диоксида общей формулы I.
Острую токсичность определяли известным способом по ЛД50 с использованием беспородных мышей обоего пола средней массой 21 г при комнатной температуре; стандартное питание и воду давали ad libitum в течение всего эксперимента; подвижность животных не ограничивали. Растворы соединений в ДМСО вводили с помощью стерильного шприца внутрибрюшинно. После инъекции за животными вели наблюдение в течение 48 ч; по истечении этого времени за мышами наблюдали дополнительно в течение 72 ч (ни одно из животных не погибло в течение дополнительного промежутка времени).
Данные указывают на то, что ЛД50 для соединения 1 составляет 100 мг/кг, для соединения 2 - от 200 до 250 мг/кг. Острая токсичность известного аналога (соединения 5) не изучена. Для известного фармпрепарата - тринитроглицерина - значение ЛД50 при внутрибрюшинном введении мышам обоего пола составляла 104-110 мг/кг [23]. Один из наиболее активных вазодилятаторов в ряду фуроксанов - 1,2,5-оксадиазол-3,4-динитрил-2-оксид(дицианофуроксан) [5] в вышеуказанных условиях имел ЛД50 < 50 мг/кг. Сравнение физиологической активности и токсичности соединений 1 и 2 показывает, что терапевтические концентрации этих соединений значительно ниже, чем ЛД50.
Пример 13. Растворимость производных 1,2,5-оксадиазоло[3,4-d]пиридазин-5,6-диоксида общей формулы I и стабильность водных растворов и растворов, приготовленных с использованием различных органических растворителей.
Растворимость производных 1,2,5-оксадиазоло[3,4-d]пиридазин-5,6- диоксида общей формулы I и известного аналога (соединения 5) определяли путем внесения аликвоты концентрированного 50 мМ раствора в смешивающемся с водой органическом растворителе (ДМСО, диметилформамиде, диоксане, ацетоне, метаноле) в воду до той конечной концентрации, при которой происходило образование нерастворившихся частиц и хлопьев.
Установлено, что в указанных условиях растворимость в воде соединения 1 составляет 250 мкмоль/л, соединения 2 - 1000 мкмоль/л, известного аналога (соединения 5) - 50 мкмоль/л.
Стабильность в растворах органических растворителей изучалась на примере 50 мМ раствора соединения 1 в ДМСО и 0,25 мМ раствора в воде, содержащей 0,5% ДМСО. Снижение концентрации соединения оценивали с помощью спектроскопии, используя величины молярного коэффициента поглощения при 353 нм (ε = 5 320 М-1·см-1) в воде.
Раствор соединения 1 в ДМСО был стабилен в течение 1 месяца при комнатной температуре при хранении в защищенном от света месте и в замороженном виде при -20oC до 6 месяцев. Водный раствор соединения 1 достаточно стабилен при комнатной температуре при хранении в защищенном от света месте при нейтральных или слабокислых значениях pH (τ 1/2 > 4,2 мес). Водный раствор соединения 1 нестабилен при слабощелочных и щелочных значениях pH (pH > 9), на ярком свету и в присутствии тиолов. В сухом виде соединение 1 устойчиво при комнатной температуре при хранении в защищенном от света месте в течение как минимум двух лет.
Пример 14. Раствор соединений 1-4 для сублингвальных инъекций.
Компоненты - мас.%
Активный компонент - 1
Этиловый спирт - 99
Пример 15. Таблетки соединений 1-4 для приема внутрь.
Компоненты - мг/1 таблетку
Активный компонент - 0,5
Лактоза - 50
Микрокристаллическая целлюлоза - 50
Стеарат магния - 0,5
Поливинилпирролидон - 10
Общая масса - 111
Пример 16. Раствор соединений 1-4 в рафинированном подсолнечном масле в желатиновых капсулах по 0,001 и 0,0005 г.
Компоненты - мас.%/капсулу
Активный компонент - 1
Рафинированное подсолнечное масло - 99
Из вышеприведенных примеров 1-5 следует вывод о том, что соединения 1 и 2 являются значительно более эффективными донорами оксида азота, чем известный аналог (соединение 5). Кроме того, соединение 1 генерирует биологически активные формы оксида азота, включая восстановленную форму NO и нитрозотиолы, а так же, как и соединение 2, является модификатором SH-групп и атома железа гемовой группы белков. Из примеров 6 и 7 следует, что производные 1,2,5-оксадиазоло[3,4-d]пиридазин-5,6-диоксида общей формулы I гем-зависимо активируют рГЦ значительно эффективнее, чем их известный аналог (соединение 5), и повышают уровень цГМФ в тромбоцитах. Из примеров 8 и 9 следует вывод о том, что производные 1,2,5-оксадиазоло[3,4-d]пиридазин-5,6-диоксида общей формулы I обладают выраженным сосудорасширяющим и гипотензивным действием, причем соединение 1 in vitro превосходит аналогичное действие известного аналога (соединения 5) и известного фармпрепарата - тринитроглицерина (ср. IC50 = 3,5 нМ для соединения 1, 1500 нМ для соединения 5 и 11,3 нМ для тринитроглицерина). Сосудорасширяющий эффект соединения 2 в вышеуказанных условиях был сравним с аналогичным эффектом соединения 5 (ср. IC50 = 2,3 и 1,5 мкМ соответственно).
Из примеров 10 и 11 следует, что производные 1,2,5-оксадиазоло[3,4-d] пиридазин-5,6-диоксида общей формулы I превосходят по антиагрегантной активности аналогичный эффект соединения 5 (ср. IC50 = 0,43, 0,49 и > 10 мкМ соответственно), а также обладают дезагрегантным действием на агрегированные тромбоциты.
Пример 12 показывает, что острая токсичность соединений общей формулы I сравнима или ниже токсичности известного фармпрепарата - тринитроглицерина.
Соединения общей формулы I получают из доступных исходных продуктов - ацетона и ацетофенона.
Таким образом, применение производных 1,2,5-оксадиазоло[3,4-d]пиридазин- -5,6-диоксида общей формулы I может расширить спектр эффективных активаторов рГЦ и лекарственных средств для лечения заболеваний сердечно-сосудистой системы.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПЕЦИФИЧЕСКИЙ РЕГУЛЯТОР АКТИВНОСТИ НУКЛЕОТИД-ЗАВИСИМЫХ ФЕРМЕНТОВ | 1997 |
|
RU2130490C1 |
| КОМПЛЕКСЫ ВКЛЮЧЕНИЯ ПРОИЗВОДНЫХ 1,2,5-ОКСАДИАЗОЛ-2-ОКСИДА С ПОЛИЦИКЛИЧЕСКИМИ ПРОИЗВОДНЫМИ ГЛЮКОПИРАНОЗЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2001 |
|
RU2186782C1 |
| ПРОИЗВОДНЫЕ 1,4,2,5-ДИОКСАДИАЗИНА | 2001 |
|
RU2212409C1 |
| ДОНОР ОКСИДА АЗОТА, АКТИВИРУЮЩИЙ РАСТВОРИМУЮ ФОРМУ ГУАНИЛАТЦИКЛАЗЫ, ИНГИБИРУЮЩИЙ АГРЕГАЦИЮ ТРОМБОЦИТОВ И ОБЛАДАЮЩИЙ СПАЗМОЛИТИЧЕСКИМ И СОСУДОРАСШИРЯЮЩИМ ДЕЙСТВИЕМ | 2001 |
|
RU2208438C1 |
| ДОНОР ОКСИДА АЗОТА И АКТИВАТОР РАСТВОРИМОЙ ФОРМЫ ГУАНИЛАТЦИКЛАЗЫ | 1998 |
|
RU2139932C1 |
| ИНГИБИТОР NO-ЗАВИСИМОЙ АКТИВАЦИИ РАСТВОРИМОЙ ФОРМЫ ГУАНИЛАТЦИКЛАЗЫ | 2001 |
|
RU2189392C1 |
| ДОНОР ОКСИДА АЗОТА И АКТИВАТОР РАСТВОРИМОЙ ФОРМЫ ГУАНИЛАТЦИКЛАЗЫ | 1997 |
|
RU2123046C1 |
| ИНГИБИТОР NO-ЗАВИСИМОЙ АКТИВАЦИИ РАСТВОРИМОЙ ФОРМЫ ГУАНИЛАТЦИКЛАЗЫ | 2001 |
|
RU2188865C1 |
| АКТИВАТОР РАСТВОРИМОЙ ФОРМЫ ГУАНИЛАТЦИКЛАЗЫ | 1997 |
|
RU2122582C1 |
| ИНГИБИТОР РАСТВОРИМОЙ ФОРМЫ ГУАНИЛАТЦИКЛАЗЫ | 1999 |
|
RU2151799C1 |

Изобретение относится к медицине, в частности предложено использовать производные формулы I, где R = СН3 или С6Н5 и n = 0 или 1, в качестве сосудорасширяющих, гипотензивных, спазмолитических, антиангинальных средств и ингибиторов агрегации тромбоцитов и фармацевтическая композиция на их основе. Соединения реализуют указанную активность благодаря активации растворимой формы гуанилатциклазы. 2 с. и 1 з.п. ф-лы, 4 табл, 4 ил.
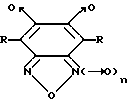
где R = CH3 или C6H5 и n = 0 или 1,
в качестве сосудорасширяющих, гипотензивных, спазмолитических, антиангинальных средств и ингибиторов агрегации тромбоцитов.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Устройство для автоматической расцепки железнодорожного подвижного состава | 1978 |
|
SU742218A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| DE 4322545, 12.01.1995. | |||
Авторы
Даты
2001-04-20—Публикация
1997-12-26—Подача