Изобретение относится к офтальмологии, а именно к офтальмоонкологии, и предназначено для прогнозирования клинического течения увеальной меланомы с целью увеличения продолжительности и улучшения качества жизни этого тяжелого контингента больных.
Увеальная меланома (УМ) является чрезвычайно злокачественной опухолью органа зрения, представляющей угрозу не только зрительным функциям, но и жизни пациента. Частота заболеваемости УМ по данным различных авторов колеблется от 2,3 до 7 человек на 1 млн. населения.
Частота метастазирования после энуклеации достигает 80% при 10-летнем сроке наблюдения [Opthalmic Pathology and Intraocular Tumors. - 1996 -1997. - p.186-190. - American Academy of Ophthalmology. San-Francisco].
Вопросы прогнозирования УМ занимали умы офтальмологов еще на рубеже 18-19 веков. Справедливости ради следует отметить, что многие из прогностических критериев, найденных более сотни лет назад эмпирическим путем, с успехом используются в клинической практике и поныне. Так, в руководстве по офтальмологии проф. А. Фоссиуса (Руководство по офтальмологии. / Под ред. проф. А. Fossius. - С.-Петербург, 1903) написано, что прогноз заболевания зависит скорее от возраста пациента, нежели от стадии заболевания, на которой оно диагностировано и удален больной глаз. При этом Фоссиус обращает внимание на тот факт, что наличие признаков экстраокулярного роста УМ резко сокращает шансы больного на выживание.
На сегодняшний день официально признаны 16 клинико-морфологических критериев прогноза УМ. Основными являются: размеры, локализация, тип гистологического строения опухоли, степень склеральной инвазии, наличие или отсутствие очагов эпибульбарного роста, факт соприкосновения края опухоли с ДЗН или факт распространения переднего края опухоли кпереди за экватор, присутствие субретинальной жидкости, характер или тип ангиогенеза, показатели клеточной пролиферации (например, митотический индекс), возраст пациента, количество и состав тумор-инфильтрирующих лимфоцитов в строме УМ, присутствие генетических аберраций; характер и спектр экспрессии меланома-ассоциированных антигенов, уровень экспрессии активаторов и ингибиторов плазминогена и уровень их рецепции [Мооу С.М. De Yong PTVM. Prognostic parameters in uveal melanoma: a review. Surv. Opthalmol, 1996, 41:215-228]. Чувствительность и специфичность каждого из прогностических критериев и их различных комбинаций колеблется от 40% до 76%. Это означает, что при отборе пациентов с УМ в группу высокого риска развития метастазов по указанным критериям последние разовьются практически только у каждого второго.
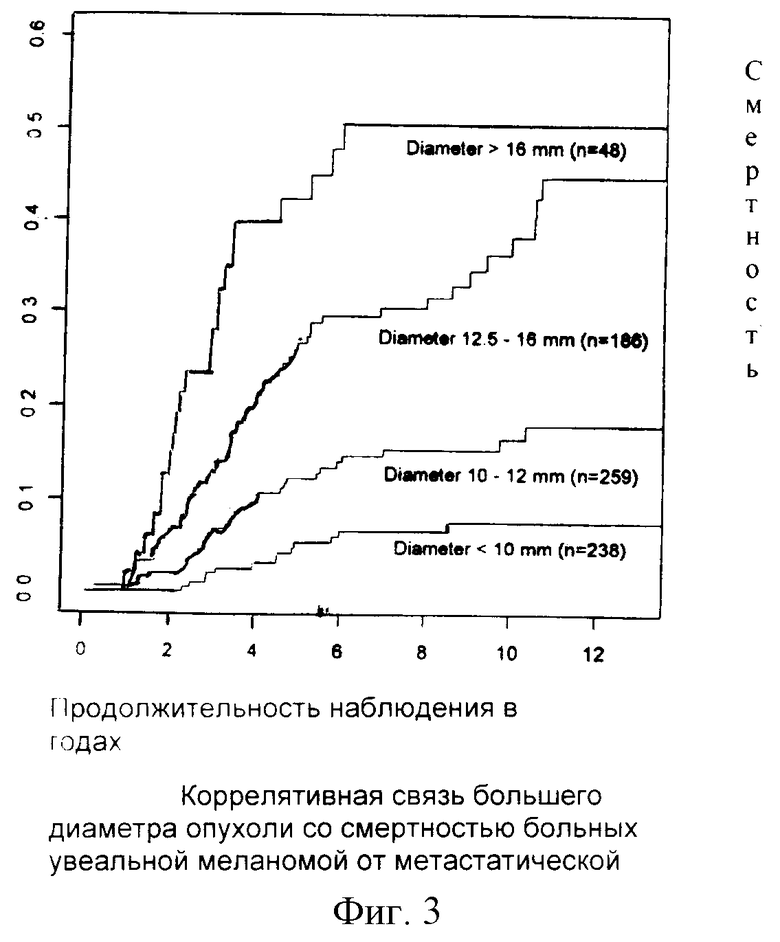
К наиболее информативным и достоверным параметрам относят диаметр опухоли. По данным различных авторов смертность при маленьких меланомах (не более 10 мм в диаметре) составляет 3-16%, при средних (от 10,1 до 15 мм) - 12-32 %, а при больших - 21-53% при 5-летнем сроке наблюдения [Center for Disease Control. Death from melanoma. - United States. - 1973-1994. - JAMA. - 1995. - vol.274. - 1. - р.20].
На рис.3, представленном проф. D. Char, отчетливо прослеживается высоко достоверная связь между большим диаметром опухоли и вероятностью смерти от метастатической болезни. При построении графических кривых использован большой клинический материал, прослеженный в динамике до 12 лет.
Высота опухоли - второй параметр опухоли, отражающий ее размер. Однако этот показатель менее информативен и достоверен при прогнозировании исхода заболевания, нежели диаметр узла.
Тип клеточного строения УМ высоко коррелирует с прогнозом заболевания. Увеличение количества эпителиоидных клеток в строме смешанно-клеточных меланом значительно ухудшает их прогноз [Hungerford J. Prognosis in ocular melanoma // Br. J. Opthalm. - 1989. - Sept.73(9). - p.689-690. Мооу С.М. De Yong PTVM. Prognostic parameters in uveal melanoma: a review. Surv. Opthalmol, 1996, 41:215-228].
Что касается фактора локализации, то здесь связь с прогнозом скорее опосредованная и определяется, на наш взгляд, степенью вовлечения в опухолевой процесс цилиарного тела. Меланомы, распространяющиеся на цилиарное тело, быстро строят сосудистую сеть, соответственно при этом повышается риск развития метастазов. Изолированные меланомы радужки редко метастазируют (3-5%) по сравнению с меланомами хориоидеи преэкваториальной зоны (до 44-76% случаев, по данным различных авторов) [Hungerford J. Prognosis in ocular melanoma // Br. J. Opthalm. - 1989. - Sept.73(9). - p.689-690]. Столь выраженные различия в биологическом поведении опухолей этих локализаций некоторые авторы объясняют особенностями эмбриогенеза пигментных систем радужки и хориоидеи [Пачес А. И., Бровкина А.Ф., Зиангирова Г.Г. Клиническая онкология органа зрения. - М.:Медицина, 1980, c. 316].
Учитывая, что самую высокую информативность и достоверность в прогнозе среди упомянутых маркеров несет диаметр опухоли, мы взяли способ определения диаметра опухоли (ультразвуковым исследованием) за ближайший аналог предлагаемого изобретения.
Выбранный нами ближайший аналог имеет свои преимущества и недостатки. Во-первых, он легок и доступен. Необходимо лишь иметь под рукой УЗ-оборудование, позволяющее производить замеры опухоли.
Вместе с тем, оказалось, что он имеет ряд недостатков. Так, представляет научный интерес следующий выявленный нами факт. На первый взгляд, казалось бы, что наличие трех и более неблагоприятных клинико-морфологических показателей у одного больного должно существенно ухудшить прогноз и повысить степень надежности и информативности каждого из маркеров. Однако на практике этого не случилось. Мы проверили это эмпирическим путем, отобрав однородную клиническую группу, состоящую из 81 пожилого пациента (медиана возраста на момент заболевания составила 61 год) с УМ, преимущественно смешанно-клеточного и эпителиоидного строения. Диаметр их опухоли превышал 15 мм (медиана большего диаметра опухоли 15,6 мм), а высота - 5,0 мм. Анализ выживаемости в этой группе, проведенный по Каплан-Мейеру, показал, что роль диаметра опухоли на фоне двух других неблагоприятных маркеров стала менее значимой в прогнозе безрецидивной и общей выживаемости больных УМ, чем в качестве самостоятельного и единственного маркера прогноза (фиг.1).
Как видно из представленного графика (см. фиг.3), разница в показателях выживаемости в группах пациентов со средним и большим диаметром опухоли практически стала недостоверной. Причин для объяснения этого феномена может быть несколько. Во-первых, непрезентативностью групп сравнения или, проще говоря, малочисленностью анализируемых групп. Во-вторых, какими-либо скрытыми закономерностями опухолевого процесса, о которых мы не знаем и благодаря которым сочетание трех неблагоприятных маркеров меняет информативность и надежность каждого из параметров. Как бы то ни было на самом деле, но прогноз в однородных по клинико-морфологическим признакам группах риска развития метастазов традиционными способами - дело чрезвычайно трудное, а порой невозможное.
Таким образом, в целом, достоверность и информативность признанных прогностических тестов оставляет желать лучшего. В целом проблема прогноза УМ далека от разрешения.
Между тем, современными достижениями молекулярной биологии и генетики были открыты более точные и информативные показатели прогноза - биологические молекулярные и генные маркеры. Они не только позволяли осуществить прогноз заболевания, но и раскрыть этапы канцерогенеза на молекулярном и генном уровне, а также наметить пути к патогенетически ориентированной терапии.
Известно, что биологическое поведение опухоли определяется балансом двух диаметрально противоположных по смыслу процессов - пролиферации и апоптоза.
Апоптоз - генетически программированный клеточный суицид. Апоптоз - физиологический механизм регуляции клеточного гомеостаза тканей и органов в процессе эмбриогенеза, постнатального развития, инволюции. Ежедневно в организме человека через апоптоз умирает около 100 миллиардов клеток, что за 1,5-2 года приравнивается в общей массе к весу взрослого человека.
Апоптоз и его нарушения лежат в основе развития многих патологических процессов, в том числе злокачественных опухолей. В запуске апоптоза участвуют биохимические, морфологические, иммунологические и функциональные сигналы-индукторы. Их комбинации варьируют в различных клетках, органах и тканях в разных физиологических и патологических условиях.
B опухолях человека апоптоз может быть спонтанный или индуцированный (лекарственный, лучевой, гормональный и т.д.).
Необходимо иметь четкие представления о том, что физиологический апоптоз, то есть протекающий в нормальных клетках, имеет принципиальные отличия от аноптоза опухолевых клеток. В последнем случае меняются не только его функции, но и механизмы регуляции. Если физиологический апоптоз - это механизм поддержания гомеостаза (объема органа, ткани и т.д.), а также генетического постоянства, то апоптоз в опухоли - один из способов иммортализации (закрепления) и усиления злокачественного фенотипа опухолевой клетки, его агрессивности, метастатического потенциала, а также - регулятор скорости прогрессирования [Лушников Е.Ф., Абросимов А.Ю. Гибель клетки. - М.: Медицина, 2001, с.189].
Спонтанный апоптоз изучен во многих типах опухолей человека. Его интенсивность зависит от гистогенеза опухоли, ее локализации, гистологического типа, стадии, гормонального статуса и ряда других факторов, каждый из которых или их комбинации оказывают различное влияние на развитие апоптоза (Программированная клеточная гибель / Под редакцией Новикова В.С. - СПб.: Наука, с.30].
В большинстве опухолей отмечена прямая корреляция между интенсивностью спонтанного апоптоза и активностью пролиферации. Опухоли с высокой пролиферативной активностью обладают более высокой способностью к апоптозу. Это объясняется тем, что клетки, находящиеся в 0-фазе и не входящие в цикл, то есть не пролиферирующие, не апоптируют. Апоптоз развивается только в клетках, находящихся в цикле пролиферации. При этом имеет значение не индекс митоза или индекс апоптоза как самостоятельный показатель, а баланс этих двух диаметрально направленных процессов: с одной стороны - пролиферации (увеличение клеточной популяции), с другой - апоптоза (гибель опухолевых клеток). Именно баланс этих двух механизмов гомеостаза клеточной популяции в итоге определяет скорость роста опухоли.
На широком спектре опухолей человека доказано, что интенсивность апоптоза прямо ассоциируется с прогрессированием, снижением степени зрелости и типом. Многие авторы пришли к выводу, что интенсивность апоптоза является надежным прогностическим маркером. Чем он выше, тем выше злокачественный потенциал и хуже прогноз.
Апоптоз включается действием множества внутренних и внешних факторов. Решение о запуске программы клеточной смерти определяется балансом про- и антиапоптических сигналов. Сигналы, помогающие клетке выжить, запускаются контактами клетка-клетка, клетка-экстрацеллюлярный матрикс, растворимыми ростовыми факторами [Bock E. Cell-cell adhesion molecules // Biochem. Soc. Trans. - 1991. - vоl.19. - 2. - р.1076-1080. Bosman F.T. Integrins: cell adhesives and modulators of cell function // Histochem.J. - 1993. - vol.25. - 2. - p.469-477]. В качестве примера растворимых внешних проапоптических сигналов могут служить CD95L [Griffith T. S., Brunner Т., Fletcher S.M. Fas-Ligand-induced apoptosis as a mechanism of immune privilege // Science. - 1995. - vol.270. - 7. - p.1189-1192. Griffith T.S., Herndon J.M., Green D. R. Ferguson Т.A. CD95 induced apoptosis in lymphocytes in an immune privileged site induces immunological tolerance // Immunity. - 1996. - vol.5. - 1. - p. 7-16] . Внутри клетки решение о смерти определяется балансом между проапоптическими молекулами, подобными Bax, и антиапоптическими пептидами, например, Всl-2. Способностью подавлять апоптоз при повреждениях ДНК обладает белок р53 [Papas R.J. Spontaneous regression оf cancer: possible mechanisms. // In vivo. - 1998. - vol.12. - 6. - p.571-579].
Диагностика апоптоза, идентификация и количественное определение пептидов, непосредственно регулирующих важнейшие этапы его развития (р53, Всl-2, Bax, Fas-рецепторы и др.), дает ценную информацию об особенностях клинического течения, скорости роста, лекарственной чувствительности, эффективности лечения, выживаемости и о других свойствах опухолей различного генеза.
Для оценки апоптоза и основных механизмов, ответственных за его развитие, в практическом плане широко используются маркеры ключевых точек генетической программы клеточной смерти: протеинов р53, Bcl-2, Bax, Fas (APO-1/CD-95). Из этого числа можно исследовать отдельные показатели, некоторые их сочетания или весь комплекс в зависимости от поставленных задач.
Ключевую роль в развитии апоптоза играет так называемый "дикий" тип генаонкосупрессора wt p53 и кодируемый им белок р53. Как видно из представленной схемы, при случайном, не смертельном для клетки, повреждении ДНК (например, точковой мутации) происходит экспрессия гена wt p53 и белка, синтез которого этот ген контролирует. p53 блокирует клеточный цикл в фазе G1-S (то есть при переходе из фазы покоя к подготовительному этапу митоза) и тем самым ингибирует дальнейшую репликацию поврежденной ДНК, синтез которой происходит именно в фазе S. При этом создаются все условия для репарации поврежденного участка ДНК. В случае удачно завершенной репарации клетка продолжает делиться и давать потомство здоровых клеток. При неудачной попытке устранения повреждений ДНК включаются механизмы, обеспечивающие уничтожение клетки с поврежденной (мутантной) ДНК, то есть запускается программа клеточного суицида или так называемый апоптоз. Если по каким-либо причинам апоптоз не наступает, то клетка гибнет через некроз. Блокировка одновременно двух механизмов клеточной гибели приводит к безудержному делению клетки-мутанта и селекции клона малигнизированных клеток с нарушениями механизмов генетического контроля клеточного цикла (пролиферации) [Imesch P.D., Albert D. M. Apoptosis in uveal and skin melanomas // Invest. Ophthalmol. Vis. Sci. - 1997. - vol. 38. - 2. - S.803-808. Imesch P.D., Lovitt B.T., Kummer J., Albert D. M. Apoptosis in intraocular and metastatic melanomas // Abstracts book of XIII ICER-1998-abstract 402. - p.121].
Ген-онкосупрессор wt (wild type) p53, а также ассоциированные с ним другие гены и кодируемые ими белки осуществляют постоянный мониторинг состояния ДНК в каждой отдельной клетке организма, обеспечивая, таким образом, генетическую стабильность. В норме wt p53 функционирует как "молекулярный полицейский", осуществляющий защиту генома. Дикий тип wt p53 - короткоживущий тип белка. Его период полураспада не превышает более 20 мин. Поэтому его очень мало (не более нескольких тысяч молекул в клетке). Низкий уровень лежит за пределом чувствительности иммуногистохимических методов. Это означает, что в норме он не выявляется или обнаруживаются его "следы". При мутации гена wt p53 с образованием мутантного типа (mutant type) mt p53 или блокаде wt p53 определенными протеинами этот ключевой ген апоптоза теряет свою первоначальную функцию, но обретает другие. mt p53 - долгоживущий белок, его период полураспада увеличивается до 24 ч, и он успевает накапливаться в количествах, вполне доступных для индентификации. Таким образом, положительная реакция в опухолевой клетке полностью зависит от присутствия мутантного типа p53 [Лушников Е.Ф., Абросимов А.Ю. Гибель клетки. - М.: Медицина, 2001, с.189].
Превращение нормальной клетки в опухолевую происходит в результате последовательного накопления ряда точковых мутаций в генетическом аппарате, ведущих к нарушению механизмов контроля клеточного размножения и роста. Инактивация онкосупрессорной функции гена wt p53 - первый универсальный шаг в развитии опухолей у человека. Мутации wt p53 с образованием mt p53 и/или функциональная блокада wt p53 - наиболее частые генетические нарушения, обнаруживаемые в раковых опухолях. При исследовании рака толстой кишки в 80% тестируемых опухолей обнаруживается мутация p53 (mt p53), причем амплитуда этих нарушений прямо коррелирует со степенью морфологической атипии и злокачественностью опухолевых клеток. Так, в маленьких (до 5 мм в диаметре) поверхностных формах рака толстой кишки mt p53 выявлялся редко и только в единичных клетках, в опухолях 6-20 мм диаметра с выраженной клеточной атипией и инфильтрацией кишки практически все - 100% - клетки в поле зрения содержали mt p53 [там же].
Известно, что мутация p53 - позднее событие в прогрессировании меланомы кожи, оно предшествует развитию метастазов. Статус p53 при УМ все еще дискутируется. Отдельные авторы считают, что этот белок в опухолевой ткани не синтезируется [Chana J.S., Wilson G.D., Cree I.A., Alexander R.A., Foss A.J. C-myc, p53 and Bcl-2 expression and clinical outcome in uveal melanoma // Br. J. Ophthalmol. - 1999. - vоl.83. - 1. - р.110-114]. По другим данным экспрессия р53 встречается в 50-70% [Tobal К., Warren W., Zielenska M. Increased expression and mutation of P53 in choroidal melanoma // Br. J. Cancer. - 1992. - vol.66. - 4. - p.900-904]. Возможно, подобные разногласия связаны с использованием различных методик.
Мы решили составить собственное представление о роли этого белка. С целью углубления понимания аспектов онкогенеза УМ в ходе научно-исследовательской работы мы провели иммуногистохимические исследования с количественным определением синтеза mt p53 на различных стадиях роста УМ и попытались определить роль этого белка в патогенезе и прогнозе заболевания.
При проведении иммуногистохимических исследований были использованы материалы из архивов МНИИ глазных болезней имени Гельмгольца и МОКБ в виде парафиновых блоков энуклеированных глаз (n=97) с УМ, принадлежавших пациентам-москвичам, сроки наблюдения за которыми составили от 1 года до 25 лет. За время наблюдения от генерализации УМ умерло 48 человек. Продолжительность их жизни, точная дата смерти установлена, а причины подтверждены результатами аутопсии. Продолжительность жизни оставшихся в живых 49 пациентов составляла не менее 5 лет. Они были отобраны из 934 пациентов, находящихся на диспансерном учете в Московской глазной больнице. Контрольный осмотр и обследование их проводили не позднее чем за 2 месяца до момента настоящего исследования.
В целом тридцать семь тестируемых образцов УМ (46, 3%) из 97 имели р53-положительные клетки. Нормальные внутриглазные структуры, такие как хориоидея и сетчатка, были негативными (не фиксировались маркером) по p53. Количество положительных клеток варьировало от 0,5% до 100%. Интенсивность ядерного окрашивания в большинстве случаев была слабой (1,6±0,7) (фото). Опухоли были оценены как положительные по p53 (более 25% позитивных клеток) в 23 (28%) случаях УМ.
Во всех случаях окрашивание маркером p53 наблюдалось в ядрах опухолевых клеток, поскольку p53 - белок ядерного происхождения. В среднем практически половина (50%) опухолевых клеток на срезах УМ оказались положительными по p53.
Мы обнаружили экспрессию р53 (более 25% окрашенных клеток) в 29% исследуемых опухолей. Наиболее интенсивно синтез р53 наблюдался в начальных и поздних стадиях опухолевого роста.
Установлена обратная корреляционная связь между продолжительностью жизни пациентов с УМ и показателями продукции р53, например коэффициент корреляции по интенсивности продукции р53 k=-0,18097 (р=0,009), а по проценту р53-позитивных клеток - k=-0,20000 (p=0,008). Чем больше в УМ содержится р53-позитивных клеток, тем быстрее протекает метастазирование и короче период с момента выявления метастазов до смерти (k-0,35046, p=0,006).
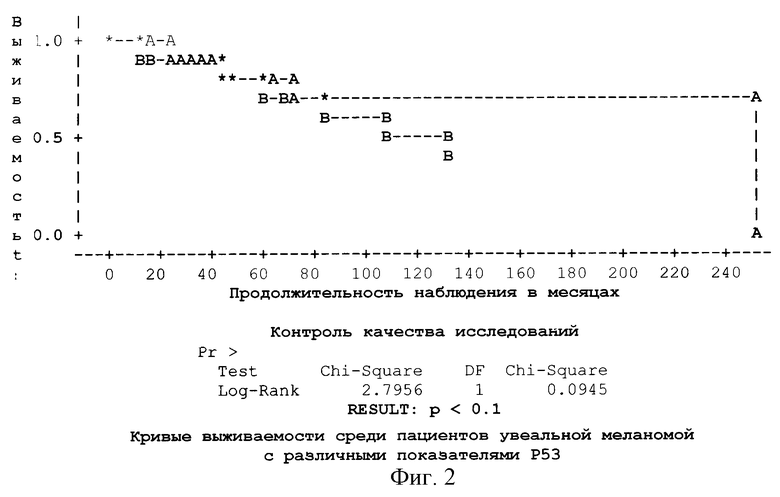
Для понимания роли р53 в прогнозе УМ и подтверждения взаимосвязи между количественными показателями продукции р53 и временными характеристиками заболевания, в частности выживаемостью, мы провели анализ кривых выживаемости по Каплан-Мейеру. Отрезная точка для р53 была 20%. Пациенты, у которых в УМ р53 был ≤20%, составили группу А - 65 человек, из которых за время наблюдения (197,0±13,7 месяцев) умерло от генерализации 14 (21,5%). Группу В образовали 30 человек, у которых р53 был >20%, из них умерло 10 (33,3%) за средний срок наблюдения 94,6±10,1 месяцев. График кривых выживаемости (фиг. 2) констатирует, что при сроке наблюдения 140 месяцев в группе А (р53≤20%) смертность была в 3 раза реже (20%), чем в группе В (65%). Разница между показателями статистически достоверна (р<0,1). Результаты полностью согласовываются с представленными ранее данными кореляционного анализа.
Результаты позволяли прийти к выводу, что УМ относится к категории опухолей, в патогенезе которых апоптоз играет важное значение. Практическая значимость исследований определялась возможностями прогнозирования вероятности развития метастазов, продолжительности жизни больных УМ на основе показателей продукции р53.
Задачей предлагаемого изобретения является разработка способа прогнозирования клинического течения увеальной меланомы, в частности вероятность развития метастазов у каждого конкретного больного.
Техническим результатом является объективизация и повышение точности прогнозирования.
Технический результат достигается за счет иммуногистохимического анализа удаленной опухоли с точным определением количественных показателей экспрессии р53 опухолевых клеток.
Предлагаемый нами способ прогнозирования осуществляют следующим образом.
1. После энуклеации глаза с увеальной меланомой готовят парафиновый блок по стандартной технологии, а затем парафиновые срезы толщиной 3-5 мкм. Последние депарафинируют в ксилоле и регидратируют в батарее спиртов.
3. Для "демаскировки" антигенов проводят прогревание срезов на водяной бане и предварительно нагретом до 95-99oС цитратном буфере [DAKO, Копенгаген. Линия] в течение 30 мин. Затем стекла охлаждают при комнатной температуре в течение 15-20 мин и переносят в фосфатный буфер.
4. Для блокирования эндогенной пероксидазы срезы инкубируют 20 мин в темноте с 3% перекисью водорода, приготовленной на дистилированной воде, а затем промывают 5 мин в фосфатном буфере.
5. Для блокирования неспецифического связывания антител срезы инкубируют 15 мин с 1% раствором бычьего сывороточного альбумина. Инкубация с первичными антителами проводится при 4oС в течение ночи. После первичных антител стекла промывают 2 раза по 5 мин в фосфатном буфере. Инкубацию со вторыми антителами, меченными биотином [LSAB+kit, DAKO, Копенгаген, Дания] проводят при комнатной температуре в течение 20 мин, и затем срезы промываются 2х5 мин. Инкубацию с антителами, меченными стрептавидином [LSAB+kit, DAKO, Копенгаген, Дания], проводят при комнатной температуре в течение 20 мин, и затем срезы промывают 3х5 мин.
6. Для визуализации иммуногистохимической реакции используют систему [DAKO, Копенгаген, Дания] . Срезы докрашивают гематоксилином и заключают в бальзам. В качестве первичных антител использовали: антитела к р53 (моноклональные антитела; клон D07, разведение 1:200; DAKO, Копенгаген, Дания).
7. Реакцию оценивают с применением светового микроскопа (увеличение х40) по следующим критериям. Количество положительных клеток оценивают в зонах, содержащих их максимальное количество.
8. Количественную оценку экспрессии маркера по срезу определяют как долю иммунопозитивных клеток от общего числа клеток в поле зрения микроскопа при увеличении х40. В случае, где процент позитивных не превышал 20%, реакция расценивается как слабая. Если процент позитивных клеток был больше 20%, реакция считается выраженной.
9. При выявлении более 20% позитивных клеток в УМ считают прогноз для конкретного пациента с таким показателем в плане клинического течения увеальной меланомы неблагоприятным с короткой продолжительностью жизни и вероятностью метастазирования 65%. Пациента выделяют в группу риска.
Пример 1. Пациент 65 лет. Диагноз УМ в стадии T3NoMo. Размеры опухоли не позволяют провести органосохранное лечение. Безальтернативным методом является энуклеация. Иммуногистохимические исследования парафинового среза опухоли по указанному способу выявили 55% позитивных клеток на срезе УМ при увеличении 40. Больной отнесен в группу высокого риска развития метастазов. Назначены укороченные интервалы между визитами врача. Незадолго до окончания года наблюдения после энуклеации у больного выявлены микрометастазы в печени. Назначена иммунотерапия с целью замедления скорости метастазирования.
Пример 2. Пациентка 73 лет. Перенесла энуклеацию по поводу УМ значительных размеров. Размеры, локализация, возраст - являлись факторами высокого риска развития метастазов. Однако проведенные исследования по определению уровня р53 показали, что белок синтезируется лишь в 5% опухолевых клеток. Учитывая это, больному предложены визиты не чаще 1 раза в год. Наблюдение на протяжении 8 лет не выявило вторичных очагов УМ.
Таким образом, предлагаемый способ позволяет с достоверной степенью точности прогнозировать течение увеальной меланомы после энуклеации и своевременно назначать адекватное лечение.
Изобретение относится к области медицины, в частности к офтальмологии. Способ позволяет повысить точность и объективизацию прогнозирования клинического течения увеальной меланомы. С помощью иммуногистохимического анализа клеток удаленной опухоли определяют процент клеток, экспрессирующих р53, по отношению к общему количеству опухолевых клеток в поле зрения, и при их наличии 20% и более вероятность мстастазирования в 65% случаев. 3 ил.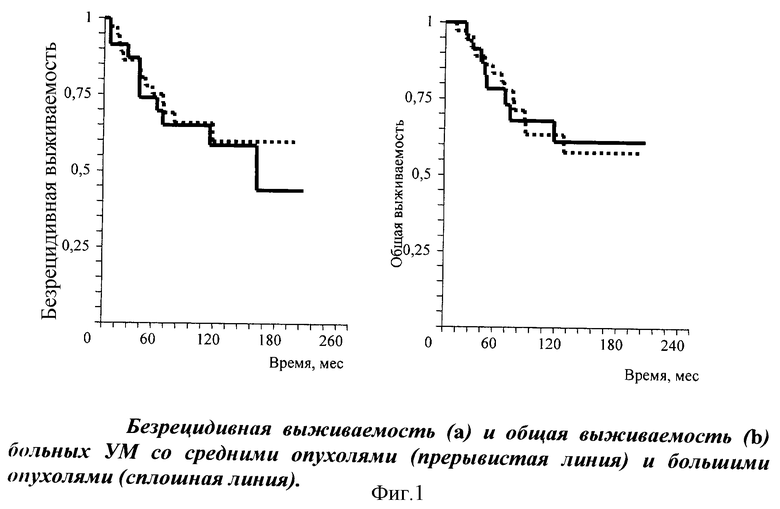
Способ прогнозирования клинического течения увеальной меланомы, отличающийся тем, что с помощью иммуногистохимического анализа клеток удаленной опухоли определяют процент клеток, экспрессирующих р53, по отношению к общему количеству опухолевых клеток в поле зрения, и при их наличии 20% и более прогнозируют вероятность метастазирования в 65% случаев.
| HUNGERFORD J | |||
| Prognosis in ocular melanome | |||
| Br.j | |||
| Opthalmol., 1989, Sept., 73(9), pр.689-690 | |||
| СПОСОБ ПРОГНОЗИРОВАНИЯ КЛИНИЧЕСКОГО ТЕЧЕНИЯ УВЕАЛЬНОЙ МЕЛАНОМЫ | 1998 |
|
RU2146823C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ КЛИНИЧЕСКОГО ТЕЧЕНИЯ УВЕАЛЬНОЙ МЕЛАНОМЫ | 1999 |
|
RU2157998C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ КЛИНИЧЕСКОГО ТЕЧЕНИЯ УВЕАЛЬНОЙ МЕЛАНОМЫ | 1999 |
|
RU2149404C1 |
| US 4507391 A, 26.03.1985 | |||
| JP 59090052 A, 25.07.1984. | |||
Авторы
Даты
2003-07-20—Публикация
2002-10-28—Подача