Область техники
Настоящее изобретение относится к способу получения и очистки рекомбинантного эритропоэтина (ЕРО) человека посредством применения половолоконной культуры и очистки с использованием хелатной хроматографии. Более конкретно, изобретение относится к способу получения чистой молекулы с соответствующим типом гликозилирования, связанным с его биологической активностью; биохимической характеристике и фармакокинетическому профилю, обеспечивающим возможность его применения при лечении различных заболеваний, связанных с эритропоэзом.
Предшествующий уровень техники
Эритропоэтин (ЕРО) представляет собой гликопротеид, который стимулирует эритропоэз в костном мозге и вырабатывается в почках естественным путем. Он главным образом показан для терапевтического применения в качестве средства лечения анемии, и было установлено, что он может очень успешно использоваться при лечении различных заболеваний, таких как конечная стадия почечных заболеваний, онкологические заболевания у больных, получающих химиотерапию, и СПИД. Его лечебное действие заключается в стимуляции деления и дифференцировки скомпрометированных эритроидных предшественников в костном мозге.
До недавнего времени доступность продукта была ограничена ввиду естественных источников и способов экстракции молекулы. Miyake et al. (J. BIO Chem. , N 252, page 5558, 1977) описали способ экстракции ЕРО из мочи больного, страдающего апластической анемией, получив очень хорошие результаты, но недостаточные количества для его клинического применения.
Ранее был описан рекомбинантный эритропоэтин человека, полученный с помощью методов генной инженерии посредством идентификации, клонирования и экспрессии в различных клеточных линиях (патент США 4703008), и было возможно его промышленное производство с использованием технологии рекомбинантной ДНК.
Эритропоэтин считался одним из наиболее подходящих продуктов в биотехнологической промышленности. Эта молекула представляет собой гликопротеид, состоящий из 165 аминокислот, который имеет молекулярный вес от 32.000 до 40.000 дальтон и вырабатывается клетками млекопитающих, в которые был трансфектирован ген эритропоэтина человека. Продукт содержит идентичную аминокислотную последовательность выделенного естественного эритропоэтина (Davis et al. [Biochem. 26, рад. 2633, 1987]), которая была выявлена посредством исследований кругового дихроизма и спектрофлюориметрии.
Imai et al. (J Biochem, N 107, page 352, 1990) сравнили физико-химические и биологические свойства обеих молекул; рекомбинантной, в надосадочной жидкости клеток яичников китайского хомячка (СНО), и естественной, полученной из мочи пациента, и пришли к выводу, что они обе имеют одинаковые свойства.
На клеточном уровне этот белок действует на рецепторы эритроидных клеток-предшественников как полипептидный гормон, который может также иметь более одного рецепторного участка с различным сродством. С другой стороны, Sawada et al. (J Cell Physiology, N 142, page 219, 1990) исследовали взаимодействие рекомбинантного эритропоэтина, меченного I125, в клетках-предшественниках и зрелых эритроцитах. Эти исследования показали его предпочтение первых из них перед последними и отсутствие соединения (менее чем 15%) с последними. Он может также действовать через второй мессенджер или, альтернативно, посредством интернализации молекулы, которая происходит при инкубации при высокой температуре. Другие исследования, связанные с интернализацией (Spivak, Int J Cell Cloning, N 4, page 39, 1986), доказали, что интернализация имела место, используя с этой целью полученный биосинтетическим способом эритропоэтин, меченный S35/цистеином.
Биологическая активность белков, а также другие родственные свойства зависят от их структуры (аминокислотная последовательность и посттрансляционные модификации), и именно в этой молекуле было обнаружено, что устранение углеводов (N-гликозилирование), присутствующих в положениях Asn 28, Asn 38 и Asn 83, полностью устраняет биологическую активность in vivo, но не биологическую активность in vitro. Это можно объяснить тем обстоятельством, что дегликозилированная молекула быстро выводится организмом через рецепторы, присутствующие в печени.
Этот феномен можно воспроизвести, если молекула обработана специфичными экзогликозидазами сиаловой кислоты, что свидетельствует об основной роли, которую играют эти углеводы. С другой стороны, наблюдалось, что углеводы, присутствующие в положении Ser 128 (0-гликозилирование), не имеют отношения к поддержанию биологической активности молекулы in vivo. Препараты высоко очищенного ЕРО составлены из смеси различных гликоформ, которые могут разделяться с помощью изоэлектрического фокусирования и хроматографического фокусирования (WO N 91-05867).
В отношении способов очистки, разработанных для нативных гормонов, а также для рекомбинантных гормонов, предшествующий уровень техники показывает, что было описано несколько способов. Среди них один относится к жидкостной хроматографии с обращенной фазой (патент США 1577195), недостатком которого является дороговизна и возможность использования только в лабораторном масштабе.
Другие описанные способы очистки включают смолы, связанные с лектинами, для связывания молекулы ЕРО (заявка на патент ЕР 359463; Rudzki et al., Hematologica, vol. 63, page 4, 1978) и даже несмотря на то, что уровень полученной специфической активности молекулы был очень высоким, он определялся только с помощью методик in vitro, и поэтому нельзя установить, может ли этот способ использоваться для отделения активных изоформ от неактивных изоформ для биологической активности in vivo.
Несколько исследований, проведенных McDougall et al. (Contrib Nephrol, N 76, page 112, 1991), подтвердили, что после внутривенного введения объем распределения эритропоэтина приблизительно соответствует объему плазмы. Концентрация в плазме проявляет моноэкспотенциальное снижение с периодом полувыведения, составляющим 4,5 ч.
Доступность эритропоэтина в диализной жидкости при внутрибрюшинном введении составила 3/8%, но при инъекции препарата в "сухую" брюшную полость наблюдалась тенденция к ее увеличению. При подкожной инъекции максимальная сывороточная концентрация через 18 ч составляла 5-10% такой же дозировки, введенной внутривенно. Тем не менее, аналогичные результаты получены при увеличении концентрации гематокрита 0,2х106 клеток/мл.
Различные фармакокинетические исследования, проведенные с эритропоэтином, показали следующую характерную особенность: фармакокинетические свойства ЕРО у различных групп (здоровые добровольцы, пациенты с хроническими почечными заболеваниями и новорожденные) одинаковы.
При различных способах введения ЕРО: внутривенном (в/в), подкожном (п/к) и внутрибрюшинном (в/б) и у здоровых лиц, и у больных, были выявлены различия исследуемых показателей. После в/в введения наблюдается значительное возрастание концентрации в плазме, однако в течение следующих 48 ч она снижается ниже исходных величин концентрации эндогенного ЕРО. После п/к введения, ввиду более медленного всасывания и выведения, сначала уровень в плазме низкий, однако через 24 ч величины выше, чем после в/в введения (Diana, F. Drugs, N 38, page 863, 1989; Jensen, J.D. Drug. Invest. N 8, page 278, 1994).
Эритропоэтин быстро распределяется по плазматическим компартментам, и средний объем распределения составляет от 3,3 до 5,5% веса тела. Основная часть молекул захватывается печенью и почками, хотя специфический захват происходит главным образом на уровне костного мозга. Кривая выведения из плазмы имеет двухфазный характер, но при высоких дозах кривая оказывается монофазной, вероятно, потому, что при высоких дозах имеет место феномен маскировки фазы распределения. Период полувыведения (T-1/2 Бета) составляет от 2 до 11 ч (Hans, N. Contrib. Nephrol./N 76, page 108, 1989).
Эритропоэтин был впервые очищен из мочи пациентов с апластической анемией, но выделение с мочой представляет лишь небольшую часть общего выведения. Менее 10% эритропоэтина выделяется в неизмененном виде, и сниженная почечная функция лишь в небольшой степени воздействует на скорость выведения.
Фармакокинетические исследования показали очень значительное возрастание скорости клиренса десиалированной формы. При удалении терминальных остатков сиаловой кислоты гликопротеиды с галактозным терминальным концом распознаются в гепатоцитах. После интернализации эндоцитозом десиалированная форма гликопротеида переваривается лизосомами. Тем не менее, имеется часть десиалированного эритропоэтина, которая уклоняется от печеночного клиренса, вероятно, ввиду отложения углеводных групп.
Сиалированная форма молекулы покидает сосудистый компартмент без взаимодействия с эндотелиальными клетками, и этот факт еще не получил объяснения. Эта ситуация предполагала две альтернативы: содержание сиаловой кислоты синтезируемого in vivo гормона слишком мало или недостаточно время экспозиции рецептора, причем обе ситуации способствуют транспорту к клеткам-мишеням (Leonard I.Z,., Ed. Marcel Dekker, NY, USA, 1990).
Новизна настоящего изобретения состоит в предоставлении способа получения и очистки рекомбинантного эритропоэтина человека (ЕРО) с помощью методик половолоконной культуры и хелатной хроматографии. Молекула, полученная в результате этого способа, характеризуется высокой специфической активностью, а также биологическими и фармакокинетическими свойствами, которые делают эту молекулу терапевтическим средством, отличающимся более высоким выведением из крови, объемом распределения, а также временем пребывания в периферическом компартменте, чем любые другие молекулы, описанные ранее, и поэтому она очень эффективна для терапевтического применения.
а) Клеточная культура и ферментация для получения ЕРО
Рекомбинантый ЕРО получен методом генной инженерии и экспрессирован в клетках яичника китайских хомячков (СНО). Его получают с помощью трансформации плазмидами pKG-Xho-EPO-HIND, содержащими ген эритропоэтина человека, и pSV2 DHFR, клонированными в клетках CHO-DHFR.
Конечным продуктом является линия клеток, которая вырабатывает 107 единиц ЕРО на 1 л культуры за 24 ч. Клетки растут в среде DMEM-F12 с добавлением 5% бычьей эмбриональной сыворотки, 26 мМ бикарбоната натрия, 15 мМ Hepes, 6 мМ глутамина, 1 мМ пирувата натрия и 10-5 М 2-меркаптоэтанола.
При наличии в культуре якорной подложки клетки этой линии морфологически удлинены, достигая своей максимальной длины после достижения слияния. В свою очередь, в суспензии они морфологически закруглены.
Инокуляция в колбы производится в концентрации, которая обеспечивает хорошее прикрепление и пролиферацию клеток. Время удвоения составляет приблизительно 16 ч. Культуру получают в Т-образных колбах или во вращающихся колбах.
Концентрация экспрессируемой молекулы в стационарной культуре
По данным определения с помощью набора для иммуноферментного анализа, на 7-й день линия в стационарной культуре вырабатывала ЕРО в концентрации от 12 мкг/мл до 15 мкг/мл.
Получение инокулята
Питательной средой, используемой для получения инокулята, может быть DMEM-F12 или другая эквивалентная среда, содержащая 5% бычью эмбриональную сыворотку с добавлением 26 мМ бикарбоната натрия, 15 мМ Hepes, 6 мМ глутамина, 1 мМ пирувата натрия и 10-5 М 2-меркаптоэтанола.
Для получения инокулята размораживают ампулу из WCB, которая содержит от 8 до 10х106 клеток. Проводят инокуляцию колб размером 175 см2 при концентрации приблизительно 0,2х106 клеток/мл, а также 4 ячейки в качестве контролей размороженного инокулята в концентрации 2х105 клеток/мл в 1 мл конечного объема, затем определяют жизнеспособность, которая должна быть выше 80%.
На 7-й день удаляют надосадочную жидкость и с помощью иммуноферментного анализа определяют концентрацию ЕРО.
Инокулят для ферментера составляет приблизительно 1000-1500х106 клеток, которые получают из колб, инокулированных после размораживания. Проводят пересев в колбы размером 175 см2, а затем переносят во вращающиеся колбы. Кроме того, в момент инокуляции клетки из одного и того же размороженного инокулята повторно высевают для получения повторной инокуляции тем же количеством клеток через 7 дней после проведения первой инокуляции. Это дает всего от 2000 до 3000х106 клеток на 1 ферментер.
Время удвоения количества клеток составляет приблизительно 16 ч, и культуры достигают нормальной плотности в экспоненциальной фазе, составляющей 2х106 клеток на 1 мл в стационарной стадии.
Процесс ферментации
Культивирование можно проводить в биореакторах Acusyst-Jr или Р3Х. В случае Р3Х он состоит из картриджей полых волокон, расположенных рядами, в которые по их экстракапиллярному пространству подается среда DMEM-F12, содержащая 5% бычью эмбриональную сыворотку, а через внутрикапиллярное пространство подается основная среда без сыворотки.
Клетки инокулируют в экстракапиллярном пространстве картриджа, где создаются условия для роста. После повторной инокуляции через день проводят сбор среды из экстракапиллярного пространства, обогащенной ЕРО.
Для обеспечения качества молекулы выращивание культур завершали в период от 45 до 60 дней после цикла.
Для того, чтобы знать характер цикла и подобрать показатели, следует проводить определения, которые должны сохранять соответствие со следующими величинами:
Аммоний - <2 мМ
Глутамин - >2 мМ
Лактат - <3 мМ
Глюкоза - >5 мМ
Во время цикла берут образцы для выявления микробного загрязнения собранных из культуры клеток. Для оценки концентрации ЕРО методом ELISA из каждой культуры клеток берут образцы.
b) Очистка эритропоэтина
Этот способ позволяет производить очистку ЕРО в основном в два хроматографических этапа из высококомплексного материала при наличии большого количества белковых примесей ввиду того, что надосадочная жидкость клеточной культуры содержит 5% бычью эмбриональную сыворотку. Для выделения соответствующих изоформ проводится дополнительный этап.
I этап: Аффинная хроматография в синей сефарозе
Предварительно колонку синей сефарозы уравновешивают связывающим буфером; 20 мМ Tris-HCl, 1% Tween-20 при рН 7,3-7,5. Надосадочную жидкость наносят непосредственно на колонку синей сефарозы в концентрации 0,2-0,3 мг/мл ЕРО/1 мл геля. Затем проводят этап промывания 20 мМ Tris-HCl, 1% Tween-20, 400 мМ NaCl, pH 7,3-7,5, и ЕРО элюируют с помощью промывания 20 мМ Tris-HCl, 2,5 М NaCl, pH 7,5.
Этот этап позволяет удалить бычью эмбриональную сыворотку, присутствующую в надосадочной жидкости, а также другие белковые примеси, которые содержатся в более низкой пропорции. Бычий сывороточный альбумин не удерживается в колонке и вымывается в не связывающейся фракции, тогда как этап промывания способствует выведению других примесей. Фракция, не обладающая биологической активностью, удаляется посредством количественного определения in vivo, которое позволяет сделать вывод, что изоформы, присутствующие в этой фракции, имеют низкое содержание сиаловой кислоты и поэтому низкий уровень биологической активности in vivo.
II этап: Хроматография по сродству с металлом
Хроматография по сродству с металлом обычно включает модификацию первичной последовательности подвергаемого очистке белка путем вставки последовательности полинуклеотидов, которая кодирует аминокислоту гистидин (полигистидин). Эта последовательность ответственна за взаимодействие с иммобилизованным металлическим комплексом на колонке. Эта процедура проводится для получения достаточного разделения между интересующим белком (который обладает возросшим сродством к гелю ввиду модификации) и примесями. В настоящем изобретении этап модификации белка устраняется, поскольку в этом конкретном образце и в особых используемых хроматографических условиях достигается дифференциальное элюирование между интересующей молекулой и примесями.
Этот хроматографический этап выполняют с Cu2+ в качестве иона металла. Колонку загружают этим ионом в присутствии дистиллированной воды в соответствии со следующей процедурой: промывание геля тремя-четырьмя объемами колонки дистиллированной воды; этап активации колонки выполняют двумя-тремя объемами колонки 0,1 М раствора CuSО4; и гель снова промывают пятью объемами колонки дистиллированной воды. Колонку считают активированной, когда проводимость сигнала достигает высокой величины и остается стабильной. Ни при каких условиях используемый объем дистиллированной воды не должен быть меньше 5 объемов колонки.
После этого этапа колонку уравновешивают 20 мМ Na2HPO4, 500 мМ NaCl при рН 7,1-7,3. Образец наносят со скоростью 30 см/ч-60 см/ч. После окончания нанесения колонку промывают 20 мМ Na2HPО4, 500 мМ NaCl при рН 7,1-7,3. ЕРО окончательно элюируют 20 мМ Na2HPO4, 500 мМ NaCl при рН 3,8-4,2. Металл удаляют из колонки с помощью промывания 50 мМ этилендиаминтетрауксусной кислоты, 500 мМ NaCl, а затем 500 мМ NaCl.
Этим этапом достигается удаление примеси белков, еще присутствующей после первого хроматографического этапа. Даже если все белки, присутствующие в образце, очевидно связаны с колонкой, между ЕРО и примесью белков достигается дифференциальное избирательное элюирование, поскольку примеси удерживаются больше, чем ЕРО.
На этом хроматографическом этапе ЕРО свободен от посторонних примесей и представляет собой смесь гликоформ с различным содержанием сиаловой кислоты.
III этап: Ионообменная хроматография на SP-Сефарозе
На этом этапе достигается разделение изоформ, присутствующих в образце, на две фракции. Не связывающаяся фракция состоит из кислых изоформ с более высоким содержанием сиаловой кислоты, а другая фракция состоит из основных изоформ с более низким содержанием сиаловой кислоты.
Образец наносят на колонку, предварительно уравновешенную в связывающем буфере 20 мМ Tris-HCl при рН 6,35-6,5. Не связывающуюся фракцию собирают как только начинает возрастать сигнал оптической плотности. Эта фракция содержит более кислые изоформы ЕРО, которые представляют собой подходящие виды. Основную фракцию элюируют с помощью регенерации 3М NaCl.
Проведенный процесс очистки показан ниже:
Этап Твердый хроматографический носитель
Очистка Быстрый поток через синюю сефарозу 6
Очистка Быстрый поток через хелатобразующую сефарозу
Захват ионов Быстрый поток через хелатобразующую сефарозу
Очистка Быстрый поток через сефарозу SP
Примеры:
Пример 1. Культура клеток и ферментация для получения ЕРО
Рекомбинантный ЕРО получают с использованием методов генной инженерии, и он экспрессируется в клетках яичников китайского хомячка (СНО) путем трансформации плазмидами pKG-Xho-EPO-Hind, содержащими ген эритропоэтина человека, и pSV2 DHFR, клонированными в клетках CHO-DHFR.
Конечный продукт представлял собой клеточную линию, которая вырабатывала 107 единиц ЕРО на 1 л культуры за 24 ч. Клетки растут в среде DMEM-F12 с добавлением 5% бычьей эмбриональной сыворотки, 26 мМ бикарбоната натрия, 15 мМ Hepes, 6 мМ глутамина, 1 мМ пирувата натрия и 10-5 М 2-меркаптоэтанола.
Для обеспечения достаточного прикрепления и пролиферации клеток готовят культуру в колбе в соответствующей концентрации. Время удвоения составило 16 ч. Культуру получают в Т-образных колбах, затем во вращающихся колбах. На 7-й день линия в стационарной культуре вырабатывала эритропоэтин в концентрации 20 мкг/мл.
Получение инокулята
Питательной средой, используемой для получения инокулята, была DMEM-F12, содержащая 5% бычью эмбриональную сыворотку с добавлением 26 мМ бикарбоната натрия, 15 мМ Hepes, 6 мМ глутамина, 1 мМ пирувата натрия и 10-5 М 2-меркаптоэтанола.
Для получения инокулята размораживают ампулу, содержащую 10х106 клеток. Проводят посев в колбы размером 175 см2 при концентрации 0,2х106 клеток/мл. В качестве контролей засевают 4 ячейки в концентрации 2х105 клеток/мл в 1 мл конечного объема; в результате жизнеспособность превысила 80%.
На 7-й день из этих ячеек собирают надосадочную жидкость. Концентрацию ЕРО определяют методом ELISA, и она в результате превысила 70% величины исходного раствора, содержащего размороженное содержимое ампулы.
Количество клеток, полученных из засеянных колб и использованное для инокуляции ферментера, при размораживании составило 1500х106. Их сначала пересевают в колбы размером 175 см2, а затем переносят во вращающиеся колбы. Кроме того, в момент инокуляции клетки из одного и того же размороженного инокулята повторно высевают для получения повторной инокуляции тем же количеством клеток через 7 дней после проведения первой инокуляции. Это дает всего 3000х106 клеток на 1 ферментер.
Процесс ферментации
Ферментацию проводят в биореакторе Acusyst-Jr., в который по его экстракапиллярному пространству подается среда DMEM-F12, содержащая 5% бычью эмбриональную сыворотку, и через внутрикапиллярное пространство подается основная среда без сыворотки. Клетки инокулируют в экстракапиллярном пространстве картриджа, где создаются условия для роста. После повторной инокуляции через день проводят сбор среды из экстракапиллярного пространства, обогащенной эритропоэтином.
Циклы в целом составляли 45 дней.
Пример 2. Очистка эритропоэтина
I этап: Аффинная хроматография в синей сефарозе
Предварительно колонку синей сефарозы уравновешивают связывающим буфером: 20 мМ Tris-HCl, 1% Tween-20 при рН 7,5. Надосадочную жидкость наносят непосредственно на колонку синей сефарозы в концентрации 0,2 мг/мл ЕРО/1 мл геля. Затем проводят этап промывания 20 мМ Tris-HCl, 1% Tween-20, 400 мМ NaCl, рН 7,5, и ЕРО элюируют в объеме 10 мл со временем удерживания 20 мин путем промывания 20 мМ Tris-HCl, 1% Tween-20 2,5 М NaCl, pH 7,5. Использовали скорость 60 см/ч, и элюируемую фракцию собирают до тех пор, пока величина оптической плотности не достигнет исходного уровня, и проводят дальнейшую обработку.
Полученные на этой стадии результаты представлены на фиг.1.
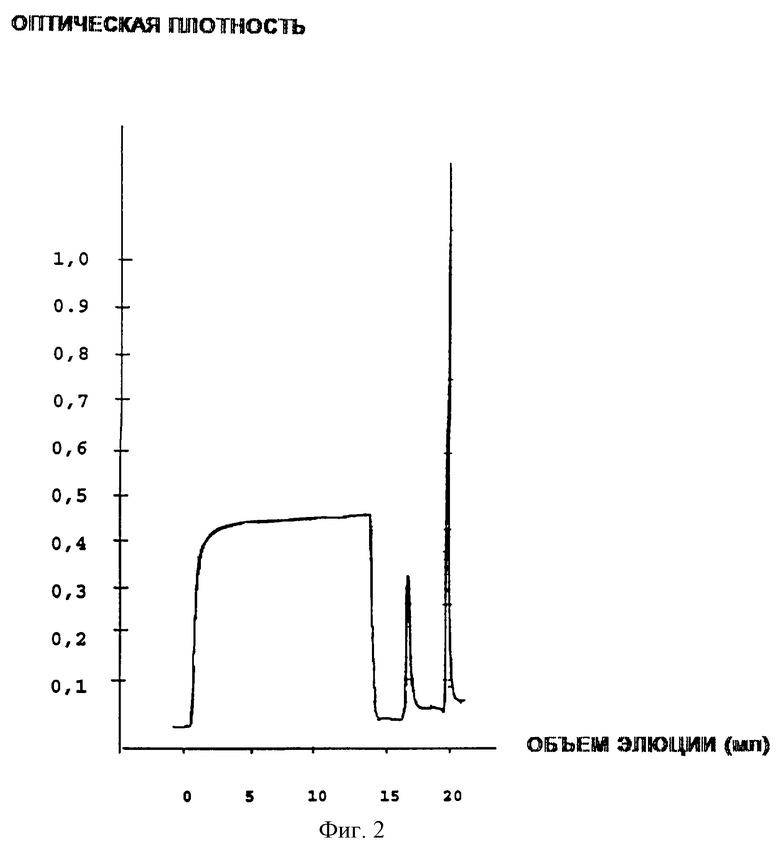
II этап: Хроматография по сродству с металлом
Колонку загружают ионом Сu2+ в присутствии дистиллированной воды в соответствии со следующей процедурой: гель промывают тремя объемами колонки дистиллированной воды; затем колонку загружают двумя объемами колонки 0,1 М раствора CuSO4 и снова промывают пятью объемами колонки дистиллированной воды.
После этого этапа колонку уравновешивают 20 мМ NazHPO4, 500 мМ NaCl при pH 7,2. После предварительного уравновешивания образец наносят в тот же буфер. ЕРО окончательно элюируют со временем удерживания 20 мин с помощью 20 мМ Na2HPO4, 500 мМ NaCl при pH 3,5 в объеме 10 мл.
Полученные на этом этапе результаты показаны на фиг.2.
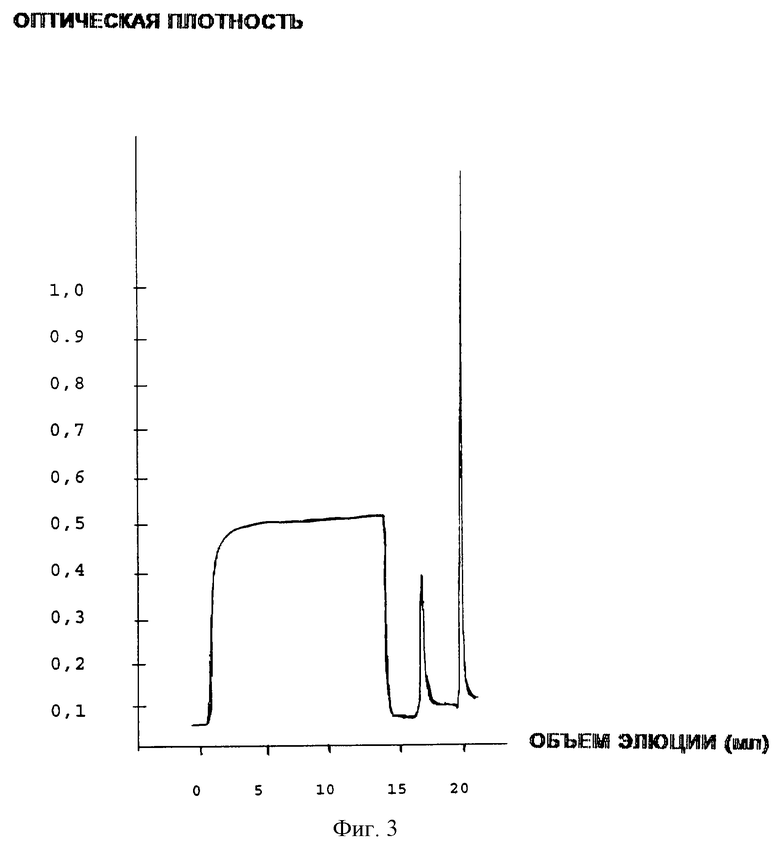
III этап: ионообменная хроматография на SP-Сефарозе
На этом этапе достигается разделение изоформ, присутствующих в образце, на две фракции: щелочную и кислую.
Образец наносят на колонку, предварительно уравновешенную связывающим буфером 20 мМ Tris-HCl при pH 6,35. Пик поглощения не связывающейся фракции собирают, элюируя объемом 5 мл со временем удерживания 10 мин. Таким образом собирают кислую фракцию, которая содержит активные изоформы ЕРО.
Пример 3. Характеристика молекулы эритропоэтина, полученной описанным способом
a) Биологическая активность, или сила, ЕРО
Использованный метод (Cotes et al., Nature 191, 1961) позволяет оценить активность препарата путем определения включения радиоактивного железа (Fe59) в клетки крови трансформированных мышей с полицитемией в условиях воздействия сниженного атмосферного давления.
Эта методика обеспечивает возможность оценки активности эритропоэтина, полученного с помощью ранее описанной системы очистки.
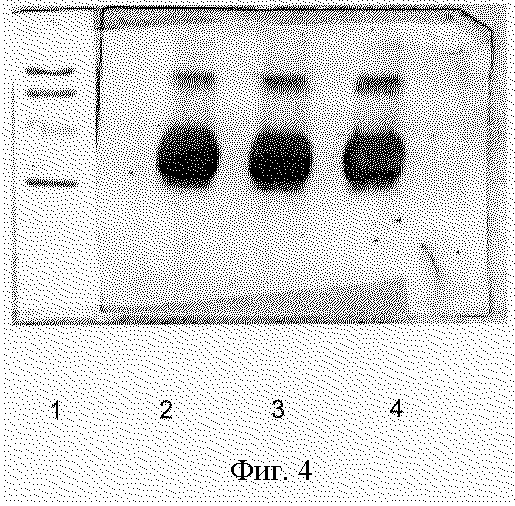
b) Анализ R-HuEPO с помощью вестерн-блоттинга
Препарат ЕРО идентифицировали как положительный с помощью методики вестерн-блоттинга, когда его получали в результате положительной реакции, при молекулярном весе 34 кДа, с помощью специфического моноклонального антитела против ЕРО.
Полученные на этом этапе результаты показаны на фиг.4.
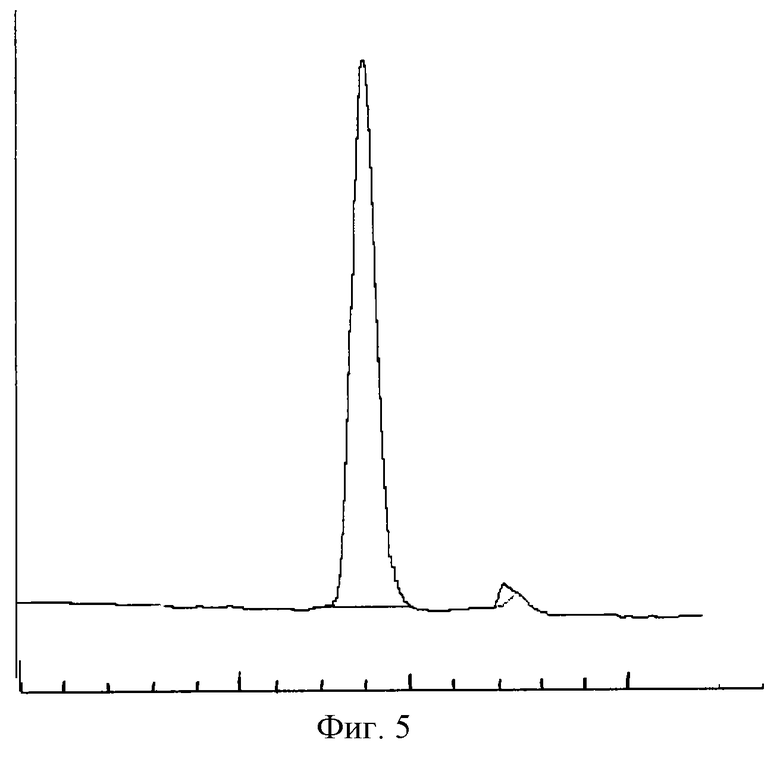
с) Анализ чистоты с помощью жидкостной хроматографии быстрого разрешения или с обращенной фазой
В трех препаратах, полученных с помощью описанного способа, чистота молекулы составила 99,9%. На фиг. 5 хроматографический профиль показывает степень чистоты ЕРО, полученного с помощью обоих способов.
d) Определение типа изоформы с помощью изоэлектрического фокусирования
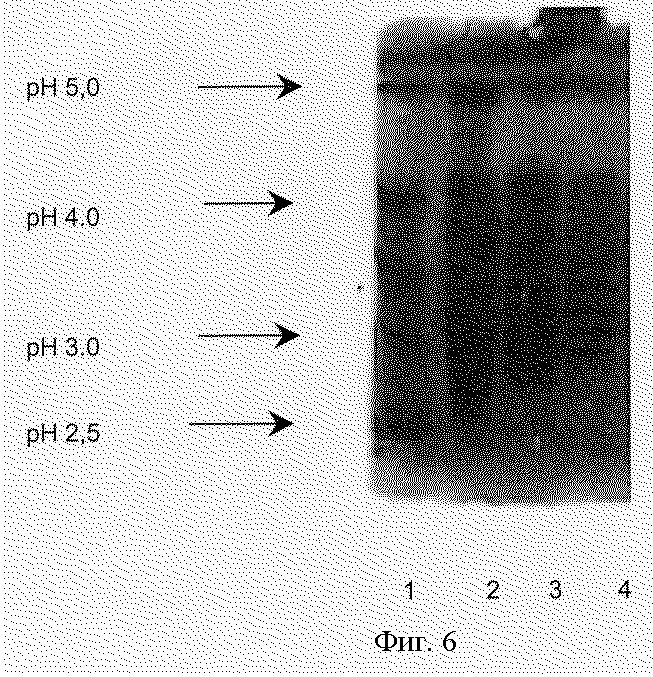
Эти данные подтверждают способность описанного способа разделять неактивные и активные изоформы в щелочной фракции и в кислой фракции. Тип изоэлектрического фокусирования показан на фиг.6.
e) Содержание сиаловой кислоты.
Содержание сиаловой кислоты в полученных препаратах выражено следующим образом в молях сиаловой кислоты на моль белка: 13,40 молей/моль, 13,42 моля/моль, 15,30 молей/моль.
Пример 4. Фармакокинетическая характеристика эритропоэтина
Фармакокинетическое поведение рекомбинантного эритропоэтина человека изучают у пациентов с хронической почечной недостаточностью. Оценивают сывороточную концентрацию молекулы в следующие периоды времени: 0, 0,25, 0,75, 1, 2, 3, 4, 6, 8, 12, 16 и 24 ч. При использовании анализа компартментализации экспоненциальная модель соответствовала фармакокинетическому профилю каждого индивидуума.
Получают двухкомпартментную модель и определяют следующие фармакокинетические показатели: период полужизни альфа и бета (t1/2α, t1/2β), площадь под кривой (AUC), площадь под кривой в первый момент против кривой динамики (AUMC), клиренс (Сl), объем распределения центрального компартмента (Vc), стационарный объем распределения (Vss) и среднюю продолжительность присутствия (MRT).
Средние величины фармакокинетических показателей были следующие:
t1/2α: - 1,87 ч
t1/2β - 15,4 ч
AUC: - 8262/82 мкг•ч/л
AUMC: - 146953,2 мкг•ч/л
Cl: - 0,36 л/ч
Vc: - 3,05 л
Vss: - 6,45 л
MRT: - 9/37 ч
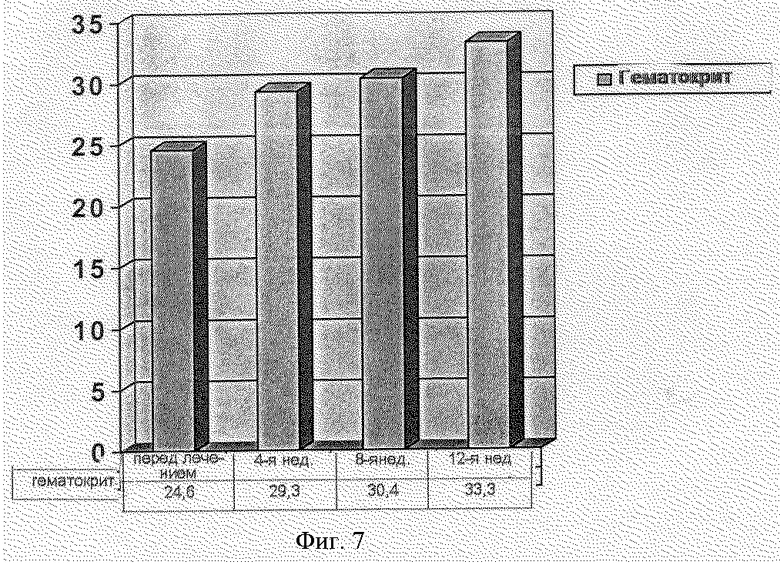
На фиг.7 показан пример фармакокинетического профиля.
Пример 5. Фармацевтическая композиция, содержащая эритропоэтин
Была получена фармацевтическая композиция для лечения анемии, которая содержит рекомбинантный эритропоэтин человека в количестве 4000 ME на 1 мл и в качестве наполнителя 2,5 мг альбумина человека, 5,8 мг цитрата натрия, 0,069 мг лимонной кислоты и 1 мл воды для инъекций.
Пример 6. Оценка терапевтической эффективности композиции, содержащей эритропоэтин
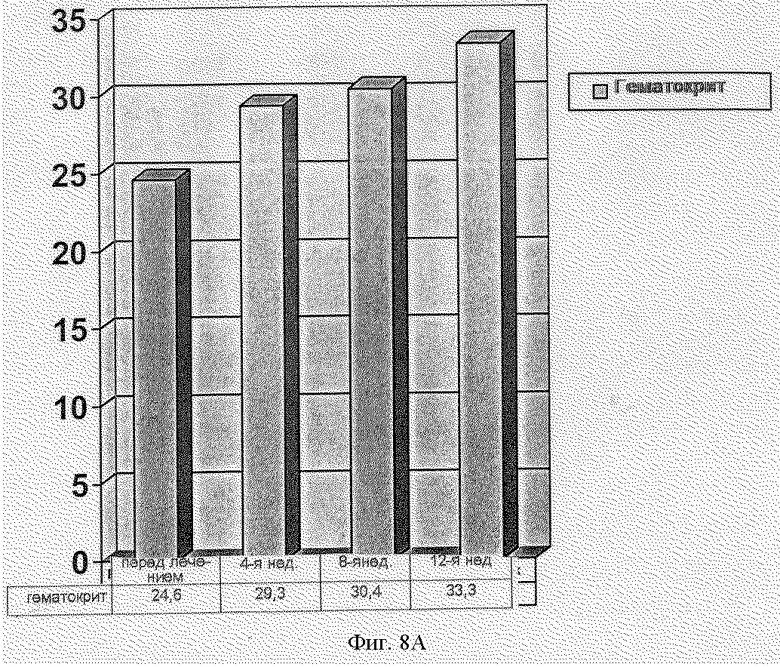
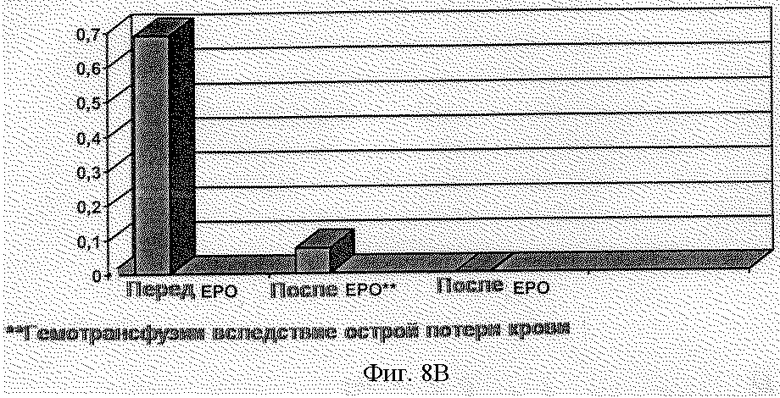
Эффективность рекомбинантного эритропоэтина человека оценивали у 23 пациентов, и в пределах 13 нед. лечения получили возрастание величин гематокрита с 24 до 33%. Во время клинического испытания у 100% пациентов анемия была устранена без гемотрансфузии (фиг.8а и 8b). Средняя использованная доза составила 60,8 МЕ/кг.
Краткое описание чертежей
Фиг.1 - Профиль аффинной хроматографии рекомбинантного эритропоэтина человека в сефарозе Cibacron Blue.
Фиг.2 - Профиль аффинной хроматографии эритропоэтина в хелатах металлов.
Фиг.3 - Профиль ионообменной хроматографии эритропоэтина в сефарозе SP.
Фиг. 4 - Образец иммунологического распознавания рекомбинантного эритропоэтина человека с помощью вестерн-блоттинга.
Фиг.5 - Хроматограмма определения чистоты.
Фиг.6 - Образец изоэлектрического фокусирования.
Фиг.7 - Фармакокинетический профиль пациента.
Фиг.8 - Клинические результаты терапевтического действия эритропоэтина:
a) возрастание величин гематокрита;
b) показатель трансфузий до и после лечения эритропоэтином.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНАЛОГ ЭРИТРОПОЭТИНА | 1994 |
|
RU2159814C2 |
| МОДИФИЦИРОВАННЫЙ ЭРИТРОПОЭТИН ЧЕЛОВЕКА | 2019 |
|
RU2827791C2 |
| ГИБРИДНЫЙ БЕЛОК НА ОСНОВЕ РЕКОМБИНАНТНОГО ЭРИТРОПОЭТИНА ЧЕЛОВЕКА, ОБЛАДАЮЩИЙ ПРОЛОНГИРОВАННЫМ ДЕЙСТВИЕМ (ВАРИАНТЫ), И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2013 |
|
RU2515914C1 |
| ШТАММ КЛЕТОК ЯИЧНИКОВ КИТАЙСКОГО ХОМЯЧКА СНО-ЕРО 4А9 - ПРОДУЦЕНТ ВЫСОКОСИАЛИРОВАННОГО ЭРИТРОПОЭТИНА | 2016 |
|
RU2652884C1 |
| КОНЪЮГАТЫ ЭРИТРОПОЭТИНА И ПОЛИЭТИЛЕНГЛИКОЛЯ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ (ВАРИАНТЫ), СПОСОБ ПРОФИЛАКТИЧЕСКОГО И/ИЛИ ТЕРАПЕВТИЧЕСКОГО ЛЕЧЕНИЯ НАРУШЕНИЙ И СПОСОБ ПОЛУЧЕНИЯ КОНЬЮГАТА ИЛИ КОМПОЗИЦИИ | 2000 |
|
RU2232163C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПОВЕРХНОСТНОГО АНТИГЕНА ВИРУСА ГЕПАТИТА В (HBS AG), МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА СВ-HEPI, ПОВЕРХНОСТНЫЙ АНТИГЕН ВИРУСА ГЕПАТИТА В (HBS AG) И СПОСОБ ПОЛУЧЕНИЯ ГИБРИДНОГО КЛОНА 48/1/574, ПРОДУЦИРУЮЩЕГО МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА СВ-HEPI | 1992 |
|
RU2128707C1 |
| ПОЛИПЕПТИДЫ, ОБРАБОТАННЫЕ HAS, ОСОБЕННО ЭРИТРОПОЭТИН, ОБРАБОТАННЫЙ HAS | 2003 |
|
RU2328505C2 |
| СПОСОБ ОЧИСТКИ РЕКОМБИНАНТНОГО ЭРИТРОПОЭТИНА ЧЕЛОВЕКА | 1998 |
|
RU2145610C1 |
| СИНТЕТИЧЕСКАЯ ДНК, КОДИРУЮЩАЯ ЭРИТРОПОЭТИН ЧЕЛОВЕКА, СОДЕРЖАЩИЙ ЕЁ ВЕКТОР, СПОСОБ ПОЛУЧЕНИЯ ШТАММА-ПРОДУЦЕНТА ЭРИТРОПОЭТИНА, ШТАММ-ПРОДУЦЕНТ ЭРИТРОПОЭТИНА | 2014 |
|
RU2548806C1 |
| СПОСОБ ОЧИСТКИ ПЕГИЛИРОВАННОГО ЭРИТРОПОЭТИНА | 2011 |
|
RU2566267C2 |
Изобретение относится к биотехнологии и используется для получения рекомбинантного эритропоэтина человека (ЭПО). Рекомбинатный эритропоэтин человека получают путем культивирования трансформированных клеток СНО, вырабатывающих рекомбинантный ЭПО в половолоконных биореакторах, повторной инокуляции биореакторов через 7 дней, инкубации клеточной культуры в течение 16 ч до достижения плотности 2•106 клеток/мл и началом процесса ферментации путем непрерывной перфузии до 60 дней, сбора надосадочной жидкости обогащенной рекомбинантным ЭПО и центрифугированием культуральной среды. Очистку супернатанта и фракции проводят с помощью аффинной и ионообменной хроматографии. Рекомбинантный ЭПО имеет 98%-ую степень чистоты, биологическую активность 160 МЕ/мг и используется в фармацевтической композиции для лечения анемии. Изобретение позволяет получить рекомбинантный эритропоэтин человека с высокой специфической активностью и выведением из крови, высокоэффективный для терапевтического применения. 3 с.п. ф-лы, 8 ил.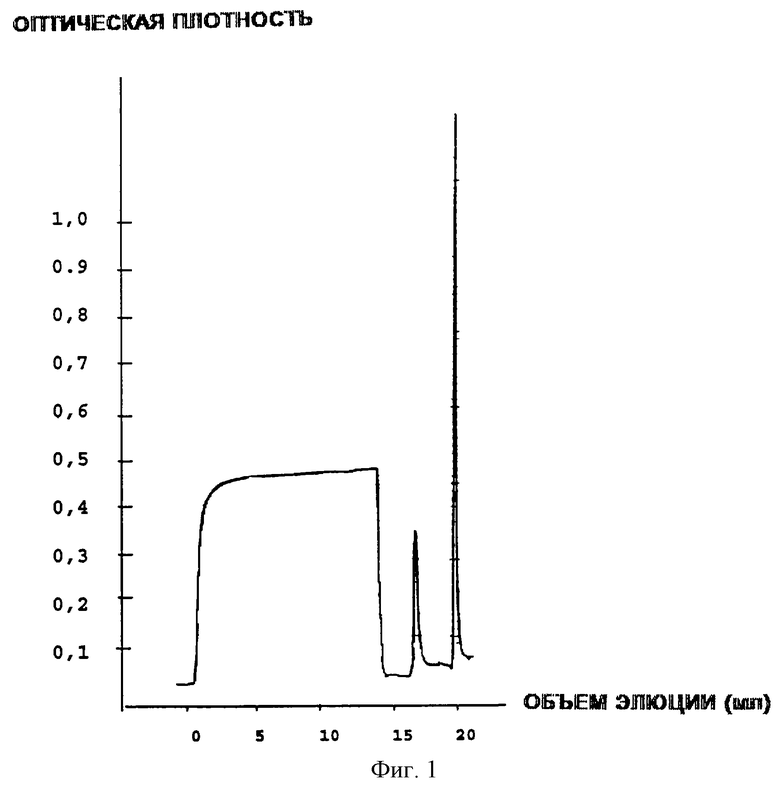
| СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО ЧЕЛОВЕЧЕСКОГО ЭРИТРОПОЭТИНА, ШТАММ КУЛЬТИВИРУЕМЫХ КЛЕТОК ЯИЧНИКА КИТАЙСКОГО ХОМЯКА - ПРОДУЦЕНТ ЭРИТРОПОЭТИНА | 1998 |
|
RU2125093C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК рКЕР-9, КОДИРУЮЩАЯ ЭРИТРОПОЭТИН ЧЕЛОВЕКА, ШТАММ КУЛЬТИВИРУЕМЫХ КЛЕТОК ЯИЧНИКА КИТАЙСКОГО ХОМЯЧКА СНОрЕ-9 - ПРОДУЦЕНТ ЭРИТРОПОЭТИНА ЧЕЛОВЕКА | 1997 |
|
RU2118662C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЭРИТРОПОЭТИНА ЧЕЛОВЕКА | 1996 |
|
RU2129613C1 |
| RU 95111858 A1, 20.06.1997 | |||
| US 5856298, 05.01.1999 | |||
| JP 62036400, 17.02.1987 | |||
| JP 60041614, 05.03.1985. | |||
Авторы
Даты
2003-11-10—Публикация
1999-04-09—Подача