Изобретение относится к биотехнологии, в частности к сохранению генетических ресурсов вегетативно размножаемых растений, и может использоваться в садоводстве для длительного криогенного хранения оздоровленных клонов ценных сортов земляники садовой (Fragaria L.).
В настоящее время криобанк - наиболее компактная и экономичная форма сохранения генетических ресурсов сельскохозяйственных и дикорастущих растений, необходимых человечеству как в настоящее время, так и в будущем. Долговременное криогенное хранение изолированных меристем является одним из перспективных методов сохранения генетических ресурсов вегетативно размножаемых растений, в частности оздоровленных клонов ценных сортов ягодных и плодовых культур, поэтому надежный способ криосохранения меристем земляники может стать основой для создания криобанка ценных отечественных и районированных в России иностранных сортов земляники садовой.
Известен способ криосохранения меристем земляники садовой: K.K.Kartha, N.L.Leung, K.Pahl "Cryopreservation of Strawberry Meristems and Mass Propagation of Plantlets" // J. Amer.Soc. Hort.Sci., 1980, 105 (4), 481-484.
В этом способе авторы культивировали in vitro растения земляники и выделяли из них меристематические верхушки (апексы).
После 2 дней подготовки изолированных апексов к замораживанию на питательной среде Мурасиге и Скуга (МС) (Murashige Т., F.Skoog A revised medium for rapid growth and bio-assays with tobacco tissue culture // Physiol. Plantarum. - 1962. - 15. - P.473-497), дополненной 5% диметилсульфоксида (ДМСО), их переносили в криоампулы на жидкую среду МС, куда при 0oС по каплям добавляли криопротекторы.
Затем изолированные апексы в криоампулах охлаждали медленно со скоростью 0,5-1,0oС/мин до - 40oС и погружали в жидкий азот (-196oС) на срок не менее 1 ч.
Стадию посткриогенного восстановления растений из меристем проводили на питательной среде МС, дополненной бензиламинопурином, индолил-масляной кислотой и гибберелловой кислотой при 26oС, 16-часовом дне и освещенности 4 клк.
В результате из криосохраненных меристем земляники сорта Redcoat, авторы (K.K.Kartha, N.L.Leung, K.Pahl), получали в среднем 55% регенерантов.
Однако воспроизведение указанного способа, по описанию, приведенному в статье, на других сортах земляники (Гренада - 0-10%, Эльвира - 0%, Зенга-Тигайга - 0% посткриогенной регенерации), в наших условиях не позволило получить ожидаемого эффекта.
С нашей точки зрения недостатком этого способа является отсутствие в процессе подготовки растительного материала к криосохранению стадии закаливания растений-доноров меристем и отсутствие льда в ампулах при их криогенном охлаждении.
Наиболее близким технологическим решением из известных нам является способ криосохранения генофонда растений земляники, принадлежащий американским ученым Б. Рид и К.Хаммеру (Reed B.M., Hummer K.E. "Conservation of Germplasm of Strawberry (Fragaria species)" // Biotechnology in Agriculture and Forestry: V.32.Cryopreservation of Plant Gemplasm 1 / Ed. Bajaj Y.P.S. Berlin; Heidelberg: Springer, 1995. P.354-370).
В этом способе маточные растения земляники, размноженные in vitro, закаливали в течение 1 недели на модифицированной питательной среде.
Изолированные из них меристематические верхушки (0,8 мм длиной) 48 ч культивировали на агаризованной (0,8%) питательной среде в условиях закаливания с 5% диметилсульфоксида (ДМСО), а затем переносили в расположенные на льду пластиковые криоампулы, куда добавляли по каплям в течение 30 мин смесь криопротекторов (PGD) из 10% полиэтиленгликоля (М.В.=8000), 10% глюкозы и 10% диметилсульфоксида.
После этого меристематические верхушки, обработанные PGD, избавляли от его избытка и в криоампулах с раствором криопротекторов, с помощью программируемого замораживателя охлаждали со скоростью 0,8oС/мин до - 40oС с последующим погружением в жидкий азот на 1 ч.
Ампулы с меристемами, извлеченные из жидкого азота, оттаивали в водяной бане при +40oС и переносили в воду (+23oС). Затем криопротекторы в ампулах заменяли на жидкую среду, меристематические верхушки вынимали из ампул и помещали сначала на стерильную фильтровальную бумагу, а потом на ростовую среду.
В результате этот способ позволил авторам (Б.Рид и К.Хаммеру) получить после замораживания из меристем 56 генотипов - регенеранты 48 генотипов, причем не было получено регенерантов сорта Tribute, а процент посткриогенного восстановления растений колебался от 0 до 100% (57,6±15,6).
Недостатками этого способа мы считаем непродолжительный период закаливания растений-доноров меристем и отсутствие льда в криоампулах перед началом их программного охлаждения, что приводит, по нашему мнению, к нестабильности результатов и отсутствию посткриогенной регенерации у восьми из 56 генотипов, включая и сорт Трибьют.
Задачей, на решение которой направлено настоящее изобретение, является стабильное получение после жидкого азота растений - регенерантов земляники садовой различных сортов из каждой криоампулы, содержащей не менее 20 апикальных верхушек.
Поставленная задача решается тем, что в способе криосохранения меристематических апексов, изолированных из закаленных in vitro растений земляники садовой (Fragaria L.), заключающемся в подготовке растений - доноров меристем к замораживанию, выделении апексов и их обработке криопротекторами, охлаждении апексов в криоампулах до сверхнизких температур, хранении ампул с меристемами в жидком азоте, и посткриогенной регенерации растений из меристем, проводят последовательно:
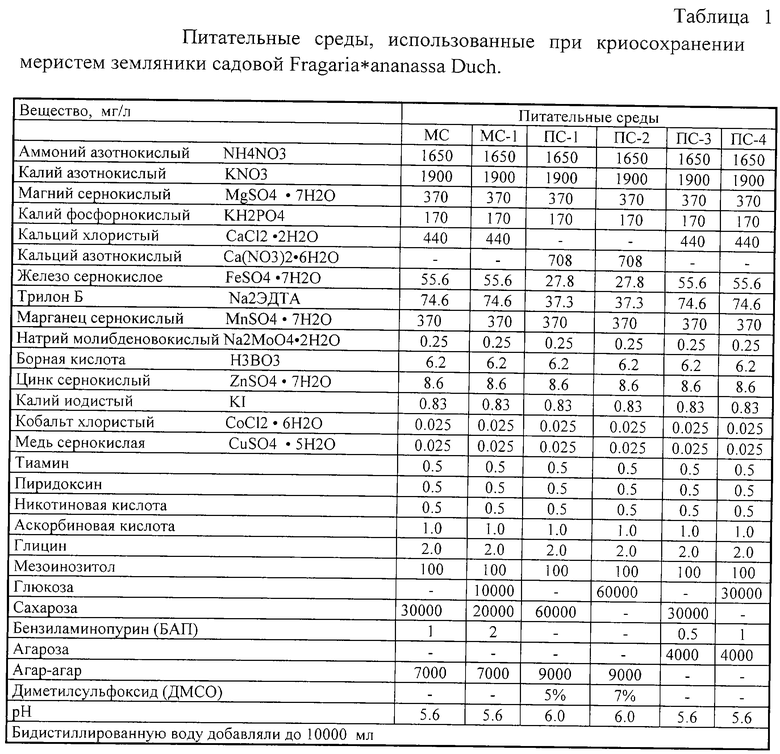
закаливание растений-доноров 1-2 месяца на твердой агаризованной питательной среде, дополненной 6% сахарозой или глюкозой,
обработку изолированных меристем перед замораживанием - 18-19 ч на жидкой питательной среде с криопротекторами 6% сахарозы или глюкозы и 5-7% ДМСО,
охлаждение апексов в криоампулах, заполненных раствором 6% сахарозы или глюкозы и 7-9% ДМСО, содержащим лед, в программном замораживателе по оригинальной программе со скоростью 0,3-0,33oС/мин до -38-40oС, затем со скоростью 9-11oС/мин до -75oС с погружением в жидкий азот (-196oС) на срок не менее часа;
посткриогенное восстановление растений из оттаявших меристем, освобожденных от избытка криопротекторов, первый этап которого проходит на модифицированной питательной среде с 0,5-1 мг/л бензиламинопурина и 3%-ными глюкозой или сахарозой при 19-20oС, 16-часовом дне и освещенности 0,5-1 клк.
На чертеже представлена принципиальная схема криосохранения меристем, изолированных из растений культивированных и закаленных in vitro, включающая в себя не только этапы подготовки растительного материала к замораживанию, его хранения в жидком азоте и восстановления из криогенного сна, но и все традиционные процедуры культивирования растений при клональном размножении in vitro. Эта схема представляет собой полный цикл преобразований растительного материала от обычного растения до растения восстановленного после хранения в жидком азоте, способного нормально размножаться и плодоносить в грунте.
Суть настоящего изобретения в том, что предлагаемый способ криосохранения меристем земляники садовой представляет собой совокупность модифицированных этапов известных методов замораживания живых объектов и эффективно обеспечивает получение после процедуры криосохранения растений-регенерантов всех испытанных нами сортов земляники из каждой криосохраненной ампулы, содержащей не менее 20 меристем.
Заявленный способ отличается от прототипа тем, что растения-доноры меристем закаливают в течение 1-2 месяцев в присутствии 6% сахарозы или глюкозы, а замораживание проводят в ампулах, содержащих не только криопротекторы, но и лед.
Изобретение иллюстрируется следующими примерами:
Пример 1
Растения земляники садовой сортов Трибьют и Джеско размножают in vitro на агаризованной питательной среде МС (таблица 1), дополненной 3% сахарозой и 1 мг/л бензиламинопурина. Маточные растения земляники, полученные в результате размножения, закаливают на модифицированной питательной среде (ПС-1) с 6% сахарозой и в течение 2 месяцев в темноте при температуре 4±4oС (таблица 1). Затем изолированные из них меристематические верхушки 18 ч культивируют на жидкой питательной среде (ПС-1), дополненной 6% сахарозой и 5% ДМСО (таблица 1) при 4±4oС в темноте и переносят в криоампулы с 6% сахарозы и 7% ДМСО. Криоампулы с меристематическими верхушками, содержащие лед, охлаждают в программном замораживателе ЗРК-1 со скоростью 0,3oС/мин до -40oС, а затем со скоростью 9oС/мин до -75oС, и помещают на хранение в жидкий азот (-196oС). После криогенного хранения не менее часа ампулы с меристемами оттаивают в водяной бане при 38oС. Размороженные меристемы извлекают из ампул и освобождают от криопротекторов последовательным перемещением сначала на сухую стерильную фильтровальную бумагу, затем дважды на свежую полужидкую питательную среду с агарозой (ПС-3), дополненную 3% сахарозы и 0,5 мг/л бензиламинопурина (таблица 1). После процедуры освобождения от криопротекторов меристемы помещают на среду ПС-3 для рекультивирования при 18oС 16-часовом дне и освещенности 0,5-1 клк. После месяца культивирования из 37-100% меристем были восстановлены растения с листьями и корнями, минуя стадию каллусообразования.
Пример 2
Растения земляники садовой сорта Кокинская поздняя, принадлежащие к одному мериклону, размножают in vitro на агаризованной питательной среде МС-1 (таблица 1), дополненной 2% сахарозой, 1% глюкозой и 2 мг/л бензиламинопурина. Маточные растения земляники, полученные в результате размножения, переносят на модифицированную питательную среду (ПС-1) с 6% глюкозой и закаливают их в течение 1 месяца в темноте при температуре 4±4oС (таблица1). Затем изолированные из них меристематические верхушки 19 часов культивируют на жидкой питательной среде (ПС-2), дополненной 6% глюкозой и 7% ДМСО (таблица 1) при 4±4oС в темноте и переносят в криоампулы с 6% глюкозы и 9% ДМСО. Криоампулы с меристематическими верхушками, содержащие лед, охлаждают в программном замораживателе ЗРК-1 со скоростью 0,33oС/мин до -40oС, а затем со скоростью 11oС/мин до -75oС и помещают на хранение в жидкий азот (-196oС). После криогенного хранения не менее часа ампулы с меристемами оттаивают в водяной бане при +40oС. Размороженные меристемы извлекают из ампул и освобождают от криопротекторов последовательным перемещением сначала на сухую стерильную фильтровальную бумагу, затем дважды на свежую полужидкую питательную среду с агарозой (ПС-4), дополненную 3% глюкозы и 1,0 мг/л бензиламинопурина (таблица 1). После процедуры освобождения от криопротекторов меристемы помещают на среду ПС-4 для рекультивирования при 20oС 16-часовом дне и освещенности 0,5-1,0 клк. После месяца культивирования из 70-100% меристем были восстановлены растения с листьями и корнями, минуя стадию каллусообразования.
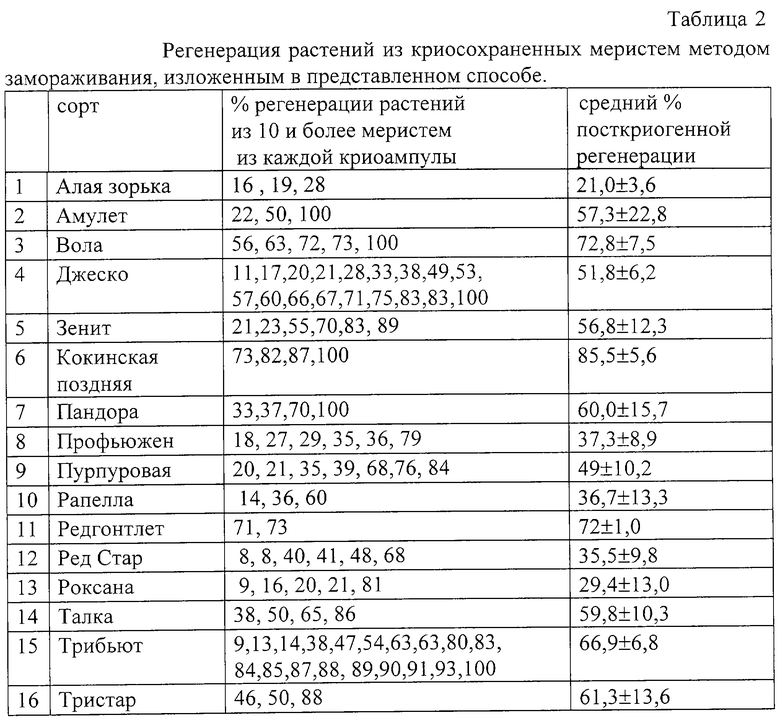
Пример 3
Изолированные апексы земляники садовой различных сортов (таблица 2) замораживают до -196oС в соответствии со схемами, представленными в примерах 1 и 2.
Из результатов таблицы 2 следует, что предлагаемый способ криосохранения позволяет после криогенного хранения (не менее 20 меристем в каждой ампуле) восстанавливать растения 16 различных сортов из 62,5±9,0% криосохраненных меристем, причем у сорта Трибьют посткриогенная регенерация достигала - 66,9±6,8%, а у сорта Кокинская поздняя - 85,5±5,6%.
Изобретение относится к биотехнологии, в частности к способу криосохранения меристематических апексов, изолированных из закаленных in vitro растений земляники садовой (Fragaria L.). Данный способ заключается в подготовке растений-доноров меристем к замораживанию, выделении апексов и их обработке криопротекторами, охлаждении апексов в криоампулах до сверхнизких температур, хранении ампул с меристемами в жидком азоте и посткриогенной регенерации растений из меристем. Причем растения-доноры меристем закаливают на твердой агаровой питательной среде, дополненной 6% сахарозы или глюкозы в течение 1-2 месяцев, а криогенное охлаждение апексов проводят со скоростью 0,30-0,33oС/мин в криоампулах, заполненных раствором криопротекторов со льдом. Предлагаемый способ позволяет эффективно восстанавливать растения различных сортов земляники садовой из криосохраненных меристем после криогенного хранения. 1 ил., 2 табл.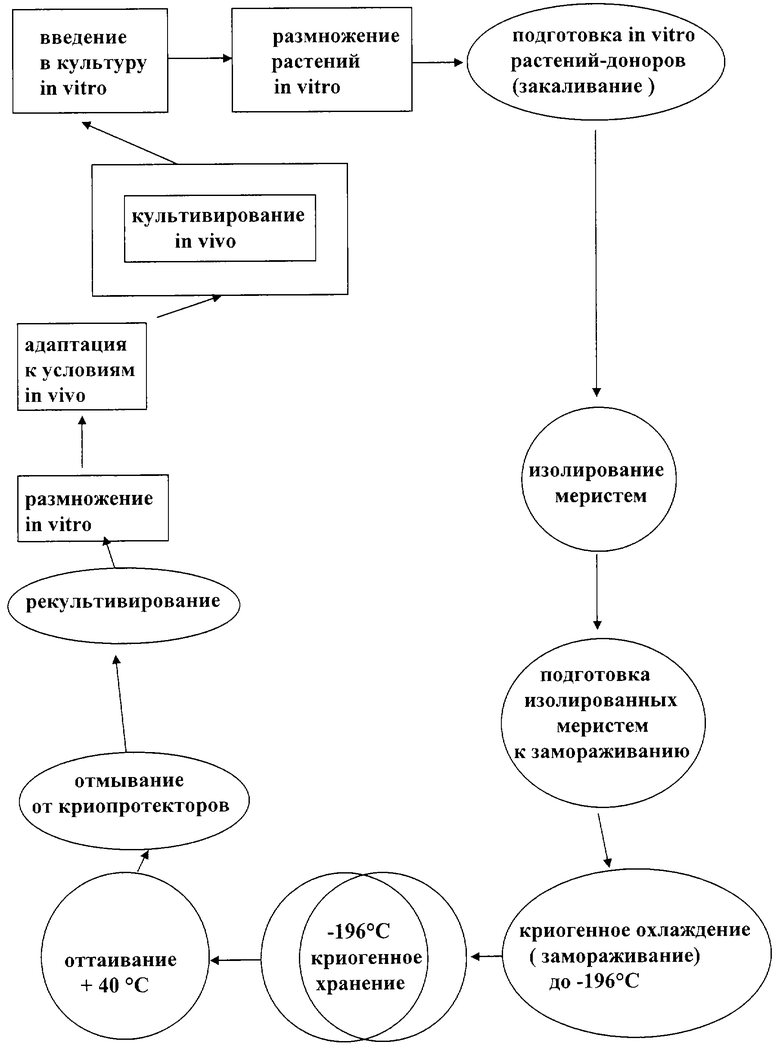
Способ криосохранения меристем, изолированных из растений земляники садовой (Fragaria L.) in vitro, заключающийся в подготовке растений-доноров меристем к замораживанию, выделении апексов и их обработке криопротекторами, охлаждении апексов в криоампулах до сверхнизких температур, криосохранении ампул с меристемами, посткриогенной регенерации растений из криосохраненных меристем, отличающийся тем, что растения-доноры меристем закаливают на твердой агаровой питательной среде, дополненной 6% сахарозы или глюкозы в течение 1-2 месяцев, а криогенное охлаждение апексов, со скоростью 0,30-0,33°С/мин, проводят в криоампулах, заполненных раствором криопротекторов со льдом.
| REED В.М | |||
| et | |||
| al | |||
| Conservation of Germplasm of Strawberry (Fragaria species | |||
| Способ образования коричневых окрасок на волокне из кашу кубической и подобных производных кашевого ряда | 1922 |
|
SU32A1 |
| Cryopreservation of Plant Germplasm | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Ed | |||
| Bajaj Y.P.S | |||
| Berlin; Heidelberg: Springer, 1995, р.354-370 | |||
| УИЗЕРЕ Л.А | |||
| Криосохранение и хранение генофонда | |||
| Биотехнология растений: культура клеток | |||
| Механизм для сообщения поршню рабочего цилиндра возвратно-поступательного движения | 1918 |
|
SU1989A1 |
| Ротационный фильтр-пресс для отжатия торфяной массы, подвергшейся коагулированию, и т.п. работ | 1924 |
|
SU204A1 |
| ЧУЛАФИЧ Л | |||
| и др | |||
| Соматический эмбриогенез in vitro диоскореи кавказской и балканской и криосохранение их органогенных каллусных тканей | |||
| Физиология растений, 1994, т.41, № 6, с | |||
| Автоматический огнетушитель | 0 |
|
SU92A1 |
Авторы
Даты
2004-01-10—Публикация
2002-05-24—Подача