Изобретение относится к биотехнологии, в частности к генетической инженерии, и представляет собой сконструированную in vitro гибридную плазмиду pZZSA, содержащую синтетический ген ангиогенина, слитый с геном IgG-связывающего домена белка А стафилококка, и штамм Escherichia coli BL21(DE3) pZZSA - продуцент рекомбинантного химерного белка ангиогенина человека.
Ангиогенин представляет собой катионный полипептид, состоящий из 123 аминокислот с молекулярной массой 14 кДa и являющийся белковым фактором ангиогенеза. Он стимулирует функции эндотелиальных клеток, важных для развития кровеносных сосудов. Этим объясняется интерес к ангиогенину, как к перспективному средству для лечения ран, ожогов, язв и сердечно-сосудистой патологии.
Известен способ выделения ангиогенина из культуральной среды клеток НТ-29 (патент США 4229531, МПК С 12 Р 1/00, опубл. 21.10.80).
Однако выход ангиогенина составляет 0,5 мкг/л, поэтому для получения ангиогенина данный источник является неэффективным.
Известен способ выделения ангиогенина из плазмы или сыворотки крови (Bond M. D. , Vallee B.L. Isolation of bovine angiogenin using a placental ribonuclease inhibitor binding ussag. Biochemistry, v.27, 17, p.6282-6287, 1988). Выход ангиогенина составляет 30-80 мг из 1 литра плазмы или сыворотки крови.
Известен способ выделения ангиогенина из коровьего или козьего молока (патент РФ 2109748, МПК С 07 К 14/515, опубл. 27.04.98). Выход ангиогенина составляет от 0,27 до 3,27 мг/л.
Однако вышеуказанные способы используют дорогостоящее сырье, количество которого ограничено, а технология очистки длительна, многоэтапна, осуществляется с использованием дорогостоящего оборудования (HPLC).
Известен структурный ген ангиогенина человека, синтезированный химико-ферментативным методом. Проведено клонирование этого гена в нескольких экспрессирующих векторных системах, в частности в генетической конструкции pRITA16, и сконструирован ряд бактериальных штаммов-продуцентов ангиогенина [1, 2, 3] . В частности, получены штаммы Е. coli JM103 - продуценты гибридов ангиогенина с бета-галактозидазой [3] и с доменами белка А стафилококка [1], а также сконструирован бактериальный штамм-продуцент Е. coli VL1222p R AngT (депонирован в ГНИИ генетика, ВКПМ В-6895), продуцирующий свободный ангиогенин [4, 5].
Однако недостатком указанных генетических конструкций и бактериальных штаммов является низкий уровень экспрессии синтетического гена, составляющий 2 мг белка на литр культуральной среды, что эквивалентно всего лишь 0,02% суммарного клеточного белка [6, 7].
Техническим результатом предлагаемых изобретений является создание такой векторной системы биосинтеза белков в виде гибридов (с новым промотором и иным механизмом индукции) и такого рекомбинантного штамма-продуцента Е.соli, которые позволили бы повысить эффективность экспрессии гибридного гена и стабильность белка ангиогенина, а также обеспечили бы возможность аффинной очистки химерного белка на IgG-сорбентах. При этом сами химерные белки такого рода при сохранении специфической биологической активности могут использоваться как активное начало наружных форм медицинских препаратов.
Указанный результат достигается путем клонирования синтетического гена ангиогенина человека, слитого с геном IgG-связывающего домена белка А стафилококка в новую векторную систему рЕТ-21 a-d(+) Vectors [8] no участкам рестриктаз Hind III и Xba I. В результате получена плазмида pZZSA, в которой гибридный ген находится под контролем раннего промотора фага Т7. Полученная плазмида pZZSA введена в клетки E.coli BL21 (DE3) (из коллекции ВНИИ генетики). Полученный рекомбинантный штамм E.coli BL21 (DE3) pZZSA депонирован в Коллекции микроорганизмов Межрегионального центра коррекции микроценоза человека под номером МЦКМ В-127. Синтез белка в полученном штамме осуществляется после индукции 1 мМ изопропил β-D-тиогалактозидом (IРТG). Штамм не имеет протеиназы оmр Т внешней мембраны клетки [8], что исключает деградацию белка в процессе очистки целевого продукта.
Химерная плазмида pZZSA для экспрессии химерного белка ангиогенина, имеющая размер 6192 п.о. и молекулярную массу 3814 кДа и характеризующаяся тем, что состоит из
- Hind III/XbaI фрагмента плазмиды рЕТ-21 a-d(+) и
- синтетического химерного гена, представляющего собой ген ангиогенина (Ang), слитый с нуклеотидной последовательностью, кодирующей IgG-связывающий домен белка А стафиллококка (Spa), и включает
- ранний промотор фага Т7,
- ген бета-лактамазы (bla), определяющий устойчивость к ампициллину,
- ген lacI, репрессирующий экспрессию до индукции IPTG,
- уникальные сайты рестрикции: EcoRI-192 п.о., XbaI-276 п.о., BglII-342 п.о., Sph-539 п.o., EcoNI-599 п.о.
Существенным отличием предложенной плазмидной конструкции является то, что гибридный (синтетический) ген ангиогенина находится под контролем раннего промотора фага Т7, что обеспечивает специфическую индукцию продукта (химерного ангиогенина) изопропилтиогалактозидом и дает высокий выход целевого белка по сравнению со штаммами, сконструированными нами ранее - E.Coli JM103 pRITA16 и E.Coli VL1222 pRAngT [1].
Для получения штамма-продуцента рекомбинантного химерного белка ангиогенина человека трансформируют компетентные клетки Escherichia coli BL21 (DE3) рекомбинантной гибридной плазмидой pZZSA.
Полученный штамм Escherichia coli BL21(DE3) pZZSA характеризуется следующими признаками:
Морфологические признаки. Клетки мелкие размером 1мкм х 3-5 мкм палочковидной формы, грамотрицательные, неспороносные, подвижные.
Культуральные признаки. При росте на плотной среде LA колонии круглые, гладкие, полупрозрачные, блестящие, серые, края ровные; диаметр колоний 1-3 мм; консистенция пастообразная. Рост в жидких средах (LB, минимальная среда с глюкозой) характеризуется ровным помутнением с образованием легкого осадка.
Физико-биохимические признаки. Клетки растут при температуре от +4 до +42oС при оптимуме рН от 6,8 до 7,2. В качестве источника азота используют как минеральные соли в аммонийной форме, так и органические соединения в виде пептона, триптона, дрожжевого экстракта, аминокислот. В качестве источника углерода используют аминокислоты, глицерин, углеводы.
Устойчивость к антибиотикам. Клетки проявляют устойчивость к ампициллину (до 300 мкг/мл), обусловленную наличием в плазмиде гена β-лактамазы, и устойчивость к тетрациклину (до 50 мкг/мл), связанную с наличием транспозона.
Полученный штамм Escherichia coli BL21(DE3) pZZSA обеспечивает индуцируемый IPTG (изопропил-β-D-тиогалактозид) синтез химерного белка ангиогенина человека не ниже 5% от суммарного клеточного белка, что в 10 раз выше, чем в прототипе.
Перечень графических материалов
Фиг.1 - физическая карта сконструированной рекомбинантной плазмиды pZZSA с гибридным геном ангиогенина. Полный перечень условных обозначений:
MCS-полилинкер;
Lac-I-ген, репрессирующий экспрессию до индукции IPTG;
Bla-ген, кодирующий β-лактамазу (селективный маркер);
Lac 0-оператор;
Т7- промотор;
Ang - встроенный химерный ген ангиогенина, слитый с Spa.
Фиг.2 - нуклеотидная последовательность гена ангиогенина в составе плазмиды pZZSA. Перечень условных обозначений:
EcoRI, XhoI, NcoI, BamHI, SalGI, PstI - эндонуклеазы рестрикции.
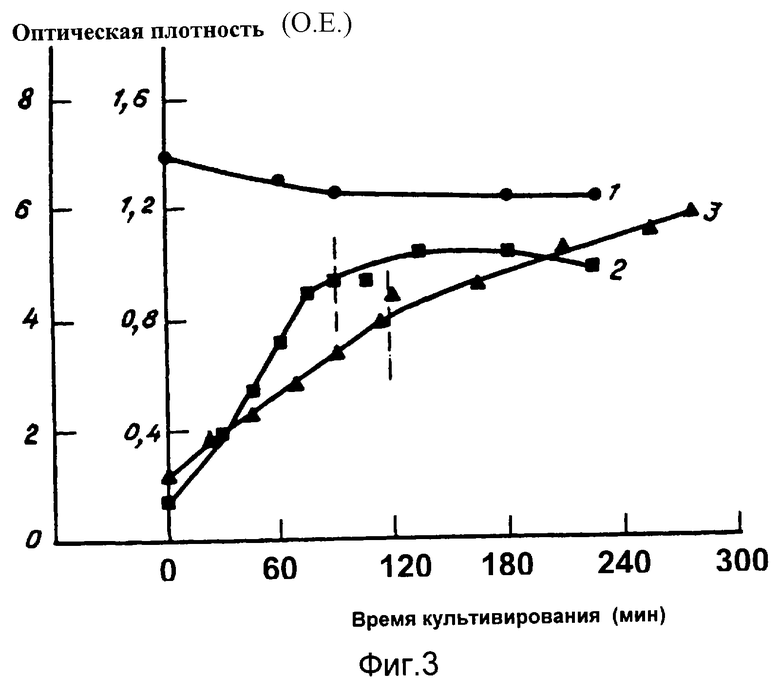
Фиг. 3 - представлена динамика роста биомассы продуцента E.coli BL 21 (DЕ3) pZZSA в процессе культивирования, где: 1- рН среды; 2.3 - ОП культуры при 590 нм; 2 - объем питательной среды в биореакторе 3,5 л; 3 - 2,7 л. Пунктирными линиями обозначен момент внесения индуктора IPTG.
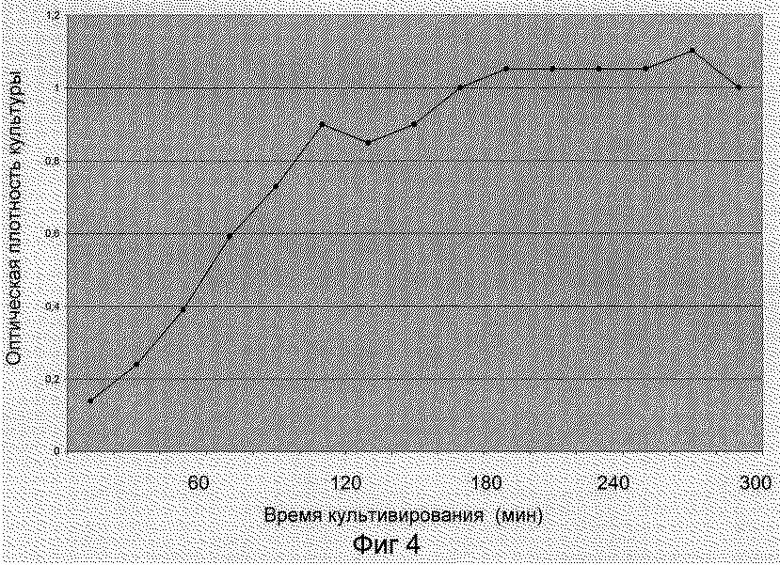
На фиг. 4 приведена кривая роста штамма E.coli BL 21 (DE3) pZZSA в вихревом ферментере типа "БИОК".
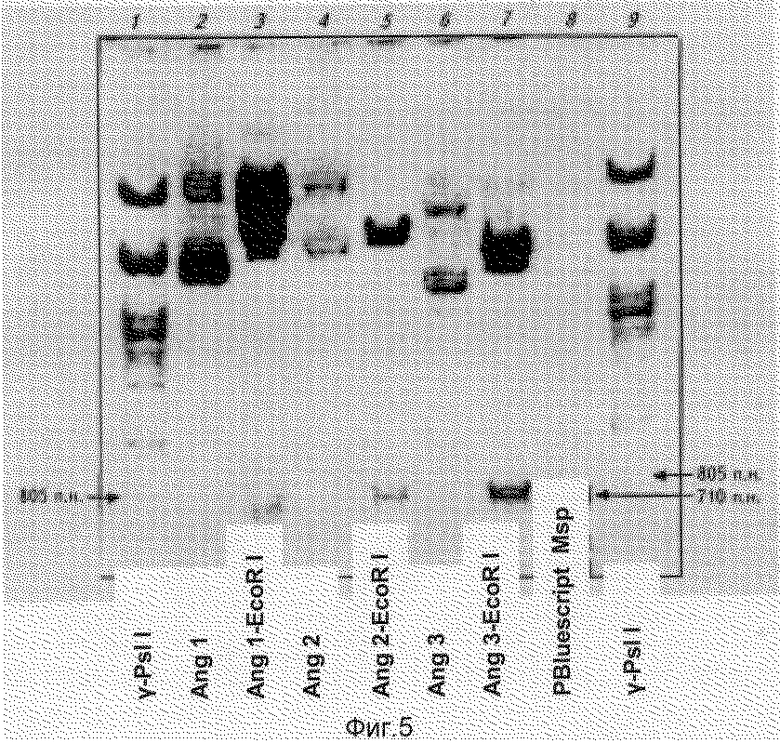
На фиг.5 представлены данные (электрофореграмма: разделение в 12% ПААГ) рестрикционного анализа рекомбинантных плазмидных ДНК - pAngI, pAng2 и pAng3, наработанных в вихревом биореакторе "БИОК": 1, 9 - PstI-гидролизат ДНК фага λ; 2 - ДНК плазмиды pAng1; 3 - EcoRI-гидролизат ДНК плазмиды pAng1; 4 - ДНК плазмиды pAng2; 5 - EcoRI-гидролизат ДНК плазмиды pAng2; 6 - ДНК плазмиды pAng3; 7 - EcoRI-гидролизат ДНК плазмиды pAng3; 8 - MspI-гидролизат ДНК плазмиды pBluescript.
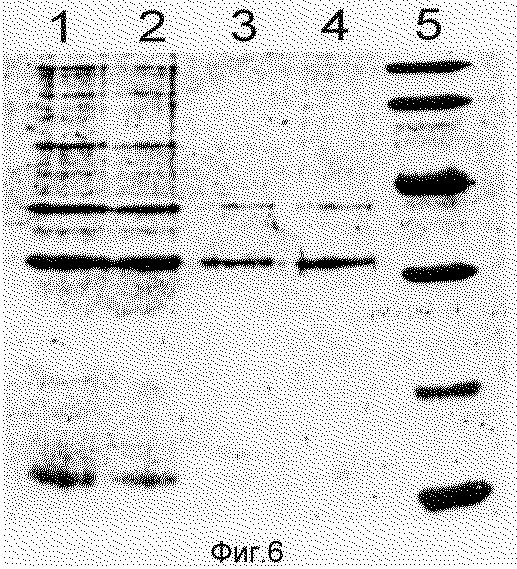
На фиг.6 приведены данные (электрофорез в 15% денатурирующем ПААГ) анализа химерного белка в процессе отмывания телец включения: 1,2 - обработанный ультразвуком лизат после удаления растворимых клеточных белков; 3,4 - растворимые белки в 6М гуанидинхлориде; 5 - маркер молекулярной массы: 14,2 кДа; 20,0; 24,0; 36,0; 45,0; 66,0 кДа.
Изобретение иллюстрируется следующими примерами.
Пример 1. Способ конструирования плазмиды pZZSA.
10 мкг плазмидной ДНК рЕТ 21 a-d (+) обрабатывают последовательно рестриктазами Hind III и Xba I в соответствии с методикой, описанной в работе (Sambrook V. , Fritsch E. E., Maniatis T. Molecular Clonind. A Laboratory Manual 2 bd ed Cold Spring Harbor, NY, 1989) и из полученного гидролизата выделяют в 1% геле легкоплавкой агарозы вектор рЕТ21 a-d (+). Синтетический ген ангиогенина (с нуклеотидной последовательностью, представленной на фиг. 2), слитый с геном IgG-связывающего домена белка А стафилококка, и векторную часть плазмиды pET21a-d(+) сшивают при помощи лигазной реакции в 50 мкл буфера для лигирования (Sambrook V.). 10 мкг реакционной смеси используют для трансформации компетентных клеток Е-coli с 600 (Hanahan J. //J-Mol. Biol, 1983, V 166, No 4, p.557-580).
Трансформанты высевают на LB - агар, содержащий 100 мкг/мл ампициллина. Из выросших клонов выделяют плазмидную ДНК и анализируют рестрикционным анализом. Отбирают ДНК, содержащую нужный набор рестрикционных фрагментов. Плазмида pZZSA содержит ранний промотор фага Т7, вслед за ним XhoI - сайт, EcoRI - сайт, далее идет синтетический Xho(!) усилитель трансляции и синтетический ген ангиогенина, слитого с геном IgG -связывающего домена белка А стафилоккока, фланкированный сайтами Hind III, XbaI. Физическая карта сконструированной рекомбинантной плазмиды pZZSA с гибридным геном ангиогенина представлена на фиг.1.
Клетки E. coli BL21(DE3), трансформированные плазмидой pZZSA, способны синтезировать полипептид Ang - домен белка А при индукции промотора изопропилтиогалактозидом (IPTG).
Структурно-функциональный анализ рекомбинантной ДНК. Химерный полипептид и векторную ДНК соединяют при помощи лигазной реакции в 50 мкл буфера для лигирования. 5 мкг реакционной смеси используют для трансформации компетентных клеток Е coli BL21 (DE3).
Трансформанты высевают на LB - агар, содержащий 100 мкг/мл ампициллина. Из выросших клонов выделяют плазмидную ДНК pZZSA и анализируют ее путем обработки набором эндонуклеаз рестрикции Hind III, EcoRI, XbaI с последующим электрофоретическим анализом длин рестрикционных фрагментов в 1,8% агарозном геле.
Из 10 проанализированных клонов 5 показали нужный набор рестрикционных фрагментов. Целевая рекомбинантная плазмида pZZSA содержит уникальные сайты узнавания рестрикционными эндонуклеазами, имеющие следующие координаты: EcoRI-192 п. о.,Xba I -276 п.о., Bgl II - 342 п.о., Sph 539 п.о., EcoN I - 599 п.о.
Окончательную структуру рекомбинантной ДНК pZZSA подтверждают определением нуклеотидной последовательности в районе встроенного фрагмента, содержащего синтетический ген ангиогенина человека.
Пример 2. Получение штамма E.coli BL 21 (DЕ3) pZZSA - продуцента рекомбинантного химерного белка ангиогенина человека
Рекомбинантной плазмидой pZZSA трансформируют компетентные клетки E.coli BL 21 (DE3) и получают штамм E.coli BL 21 (DЕ3) pZZSA - продуцент рекомбинантного химерного белка ангиогенина человека. Методика транформации.
Трансформацию проводили с применением хлористого кальция. 1 мл ночной культуры бактерий вносили в 100 мл бульона L. Выращивали клетки при 37oС 4 часа с интенсивным перемешиванием до плотности 5•107 клеток/мл. Охлаждали культуру во льду (10 мин), центрифугировали клетки при 4000g в течение 5 минут при 4oС. Удаляли надосадочную жидкость. Ресуспендировали клетки в половине начального объема охлажденного во льду стерильного раствора 50 mM СаСl2 + 10 mМ трис-HCl, рН 8.0. Суспензию клеток помещали в ледяную баню на 15 минут, центрифугировали, удаляли надосадочную жидкость. Ресуспендировали клетки в 1/15 начального объема охлажденного во льду стерильного раствора 50 mМ СаСl2+10 mМ трис-HCl, рН 8.0.
Аликвоты объемом 0.2 мл разливали в охлажденные пробирки. Добавляли 40 нг ДНК в 100 мл лигазного буфера, размешивали и инкубировали смесь во льду 30 мин. Переносили пробы в водяную баню 42oС на 2 мин. Добавляли в каждую пробирку по 1 мл бульона L и инкубировали 60 минут при 37oС. Высевали клетки на 1,5% агар, инкубировали их при 37oС, 16 часов. Селекцию вели на устойчивость к ампициллину.
Пример 3. Методика культивирования штамма E.coli BL 21 (DE3) pZZSA и индукции белка ангиогенина человека
Ночную культуру штамма E.coli BL 21 (DE3) pZZSA разводят в 50 раз в среде LB с добавлением ампициллина до концентрации 0,1 мг/мл и культивируют с аэрацией в вихревом ферментере типа "БИОК" (Патент РФ 2135579, МПК С 12 М 1/04, опубл. 27.08.99) в объеме от 2,5 до 5,0 л при 37oС до завершения логарифмической фазы роста, т.е. до достижения оптической плотности 1 о.е. при длине волны 600 нм. Далее в суспензию добавляют IPTG до концентрации 1 мМ и инкубируют для экспрессии рекомбинантного гена ангиогенина в течение 3,5 часов. Динамика роста культуры бактериальных клеток отражена на диаграмме (фиг. 4). По окончании инкубации клетки бактерий осаждают центрифугированием при 5000 об/мин и далее хранят при -20oС до момента лизиса. Результаты культивирования представлены на фиг.3 и 4.
Пример 4. Методика выделения телец включения и получение химерного белка ангиогенина человека
Клетки суспендируют в буфере "А" (0,1 М трис-HCl; рН 7,2; 0,1 М NaCl; 10 мМ бета-меркаптоэтанол, 10% сахароза), озвучивают в генераторе ультразвука УЗДН2Т и центрифугируют 15 мин при 5000 об/мин. Осадок 5 раз отмывают буфером "А" с добавлением 1% тритона Х-100, 2 М мочевины с обязательной гомогенизацией и последующим центрифугированием в течение 15 мин. После удаления супернатанта осадок растворяют в 50 мл 7М гуанидин хлорида.
Далее для выделения химерного белка ангиогенина к 50 мл солюбилизированного белка добавляют 2,5 мл 1М трис-НСl рН 8,0; 0,5 г тетратионата Na, 1 г сульфита Na и выдерживают 20 часов при 22 oС. После диализа в 1 л фосфатного буфера, рН 8,0 раствор разбавляют в 10 раз тем же буфером с добавлением 1 мМ глутатиона восстановленного и 0,1 мМ глутатиона окисленного и инкубируют 17 часов при +4 oС. Далее проводят хроматографию на целлюлозе DE-52, выполняя ступенчатую элюцию белка раствором NaCl. Концентрация элюента при выходе белка с колонки составляла 0,5 М NaCL Выход белка составляет 40 мг на 5 г биомассы.
Пример 5. Электрофоретический анализ белков и анализ специфической активности химерного белка ангиогенина
Электрофоретический анализ белков проводят в 15% полиакриламидном геле (ПААГ) в буферной системе Лэммли [10]. О степени чистоты препарата химерного белка ангиогенина после очистки судят на основе анализа электрофореграммы (денситометрии).
Аналогичным образом анализируют содержание химерного белка в клетке в процессе культивирования.
Проведенные эксперименты показали, что полученная гибридная плазмида pZZSA действительно обеспечивает экспрессию химерного гена ангиогенина в клетках E. coli. По данным электрофореза в ПААГ молекулярная масса рекомбинантного белка составляет 28,8 кДа (фиг.5 и 6), из которых на ангиогенин приходится 14,1 кДа [1].
Динамику индуцированного IPTG синтеза ангиогенина, слитого с IgG-связывающим доменом белка А стафилококка, определяют электрофоретическим методом. По данным денситометрии полос рекомбинантного белка его выход составляет 20-30%. Электрофоретическая чистота белка составляет около 95%.
Анализ специфической активности рекомбинантного белка проводят на хориоаллантоисной оболочке (ХАО) куриного эмбриона [11, 12] по нижеследующей методике с использованием 7-9-суточных куриных эмбрионов с нормальным развитием плода.
В опыт берут не менее 7 куриных эмбрионов на точку. Исследуют параллельно не менее двух разведений препарата рекомбинантного ангиогенина и два контроля. В условиях соблюдения стерильности исследуемые образцы по 10 мкл наносят на фильтры Миллипор (диаметр диска 10 мм). Диски подсушивают под лампой в ламинаре. В стерильных условиях фильтры с импрегнированными образцами исследуемых препаратов апплицируют на ХАО. Все яйца, используемые в опыте, подписывают и помещают в термостат с температурой 37oС для дальнейшего инкубирования.
Результаты учитывают через 72-80 часов после имплантации фильтра с нанесенным образцом препарата рекомбинантного ангиогенина на ХАО. Предварительно яйца с куриными эмбрионами анализируют в овоскопе, отбраковывая погибшие. Яйца с живыми куриными эмбрионами вскрывают и производят визуальное исследование сосудистой сети хориоаллантоисной оболочки как к прилежащей к имплантированному диску фильтра, так и пристеночной (прилегающей к скорлупе). Затем извлекают участок хориоаллантоисной оболочки из-под диска фильтра и помещают для фиксации в раствор формалина на 5-7 минут. Фиксированные участки ХАО помещают под лупу (или микроскоп) и производят подсчет сосудов. Берут среднюю величину от результатов измерения плотности сосудов на 7 эмбрионах для каждого образца и сравнивают со степенью васкуляризации хориоаллантоисной оболочки в контрольных образцах. Положительным считают результат, при котором средняя величина плотности сосудов в опыте превышает таковую в контроле в 2 и более раза.
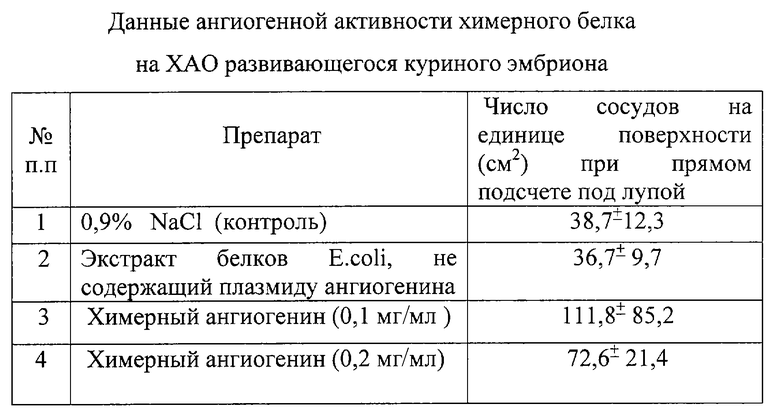
В таблице приведены результаты анализа ангиогенной активности химерного белка на ХАО развивающегося куриного эмбриона.
Анализ таблицы показывает, что специфическая активность исследуемых образцов положительна, поскольку средняя величина плотности сосудов в опыте превышают таковую в контроле в 2 и более раза [13].
Пример 6. Данные по применению химерного белка ангиогенина в медицине
Химерный белок ангиогенина, полученный из клеточной биомассы E.coli BL 21 (DE3) pZZSA в соответствии с примером 4, используют, например, в мазевой форме на основе геля полиэтиленоксида.
Выявленные показания к применению заболеваний и повреждений кожи различной этиологии:
- при ожогах (отморожениях) различной степени тяжести гель с ангиогенином эффективен как средство первой помощи, а также в процессе лечения и реабилитации;
- при травматических повреждениях кожного покрова в виде порезов, ссадин, трещин, пролежней;
- при заболеваниях, связанных с нарушением кровообращения, трофических язвах, при варикозном расширении вен, облитерирующем эндартериите сосудов нижних конечностей;
- при кожных болезнях (склеродермия, псориаз, неинфекционные дерматиты, алопеция).
Гель с использованием аппликатора наносят тонким слоем на поврежденную поверхность через 6-12 часов и далее по мере заживления раны раз в сутки до полного восстановления дефекта кожи.
Длительные экспериментальные исследования показывают, что мазь обладает специфическим заживляющим действием, способствующим быстрому восстановлению эпителиального покрова без образования рубцов, улучшает кровообращение в области повреждения тканей за счет восстановления капиллярной сети и стимулирует местный иммунитет. Гель образует защитную пленку на ожоговой, либо раневой поверхности, что значительно снижает вероятность инфекционных осложнений, снижает отечность и болевые ощущения.
Источники информации
1. Мертвецов Н.П.//Известия Академии наук. Сер. химическая, - 1996, т. 21, 12, с.2837-2846.
2. Мертвецов Н.П., Стефанович Л.Е. //Ангиогенин и механизм ангиогенеза. - Новосибирск: Наука, Сибирское предприятие, РАН, 1997.
3. Коваленко С.П., Лисняк И.А., Мертвецов Н.П.//Биоорган. химия. - 1989, т. 15, с.492-498.
4. Нетесова Н.А., Петров B.C., Чешенко Н.В., Чикаев Н.А., Малыгин Э.Г., Мертвецов Н.П.//Биоорган. химия. - 1995, т.21, - с.608-611.
5. Никонова А.А., Серегин С.В., Чикаев Н.А., Мишин В.П., Бабкина И.Н., Мертвецов Н.П.//Биоорган. химия. - 1996, т.22, - с.891-893.
6. Shapiro R. , Harper J.W., Fox E.A., Jasen H.W., Hein F. Uhlman E. //Anal. Biochem. - 1988, v. 175, - p.450-451.
7. Hsiung H.M. Maune N.A., Becker G.W. //Biotechnol. - 1986, v.4, - p. 991-995.
8. Studier et al. //Meth. Enzimol. - 1990, v.185, - p.60-89.
9. Кислых В. И. , Рамазанов Ю.А., Майстренко В.Ф., Мертвецов Н.П. Биотехнология, 2000, 4, с.72-79.
10. Маниатис Т. , Фрич Э., Сэмбрук Дж. //Методы генетической инженерии. Молекулярное клонирование. Пер. с англ., М., 1984.
11. Laemmly U.K. //Nature. 1970. - v. 227, - р.680-685.
12. Klasburn M., Knighton D., Folkman J.//Cancer Research. - 1976, v.36, - p.110-114.
13. Fett J.W., Strudom D.J., Lobb R.R., Alderman E.M.// Biochemistry. - 1985, v. 24, p.5480-5486.
14. Shapiro R., Strudom D.J., Olson K.A., Vallee B.L.//Biochemistry. - 1987, v.26, - p.5141-5146.
15. Шестенко О.И., Никонов С.Д., Мертвецов Н.П. Ангиогенин и его роль в ангиогенезе //Молек. биология, 2001, т.35, 3, с.1-23 (349-371).

Изобретение относится к области биотехнологии и может быть использовано в медико-биологической промышленности с целью получения белкового фактора ангиогенеза (химерного белка ангиогенина человека). На основе плазмидного вектора рЕТ-21а-d(+) сконструирована рекомбинантная плазмида pZZSA, содержащая синтетический химерный ген, в котором нуклеотидная последовательность, кодирующая ангиогенин человека, слита с нуклеотитдной последовательностью, кодирующей IgG - связывающий домен белка А стафилококка. Экспрессия химерного гена находится под контролем раннего промотора фага Т7 и индуцируется изопропилтиогалактозидом (ИПТГ). В результате трансформации полученной плазмидой компетентных клеток Е.coli BL21(DE3) и отбора трансформантов по признаку устойчивости к ампициллину получен рекомбинантный штамм Е. coli BL21(DE3) рZZSA - продуцент химерного белка ангиогенина человека, который депонирован в Коллекции микроорганизмов Межрегионального центра коррекции микроценоза человека под номером МЦКМ В-127. Новый штамм обеспечивает высокий уровень экспрессии отличающегося повышенной стабильностью химерного белка ангиогенина. 2 с.п. ф-лы, 6 ил., 1 табл.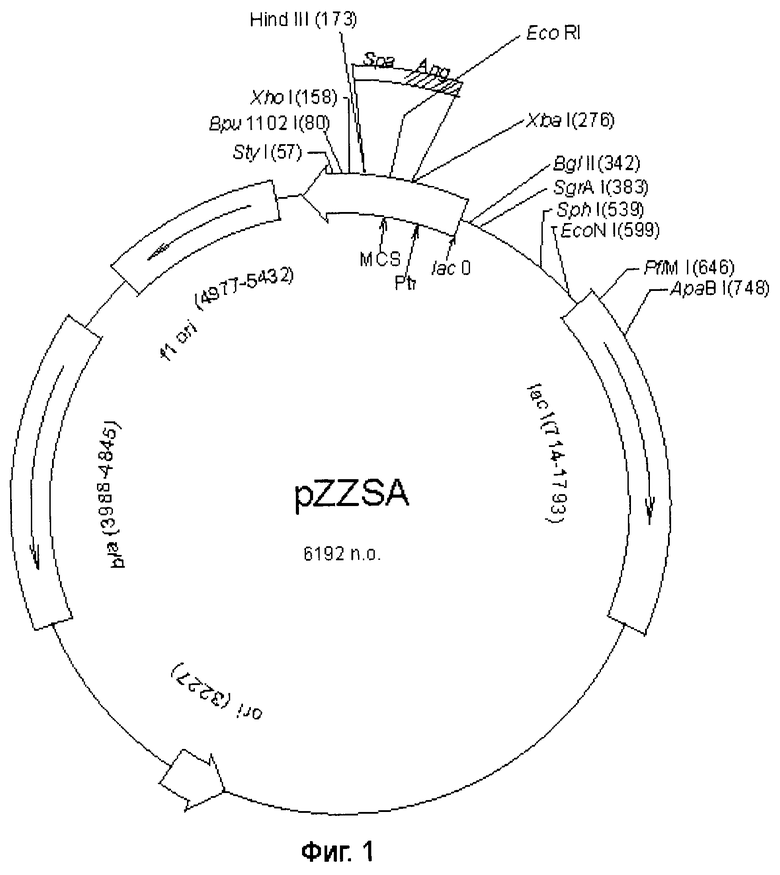
Штамм Escherichia coli BL21(DE3)/pZZSA (Коллекция микроорганизмов Межрегионального центра коррекции микроценоза человека, коллекционный номер МЦКМ В-127) - продуцент рекомбинантного химерного белка ангиогенина человека.
| МЕРТВЕЦОВ Н.П | |||
| Известия Академии наук | |||
| Серия химическая | |||
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
| ПРИБОР ДЛЯ ОПРЕДЕЛЕНИЯ ТВЕРДОСТИ МЕТАЛЛОВ | 1925 |
|
SU2837A1 |
| HUHN M | |||
| et | |||
| al | |||
| Cancer Res | |||
| Устройство для сортировки каменного угля | 1921 |
|
SU61A1 |
| US 4721672, 20.09.1985. | |||
Авторы
Даты
2004-01-10—Публикация
2002-01-31—Подача